pms
nòm ant ël fil


Former breeder? and winter visitor?
El pigargo européu[2] (Haliaeetus albicilla) ye una especie d'ave accipitriforme de la familia Accipitridae. Nun se reconocen subespecies.[3]
Ye una ave de gran tamañu, algama un llargor de 69 a 92 cm y un valumbu de nales de 200 a 245 cm.[4] Les femes son de mayor tamañu que los machos.[5] Tien nales amplies, una cabeza grande y un gruesu picu "carniceru". Los adultos son principalmente de color marrón sacante pela so cabeza y cogote más pálidu, tienen una distintiva cola blanca, el so picu y pates son mariellos. La cola y el picu nel so estadiu xuvenil son más escuros, nos subadultos la cola tórnase blanca con una franxa escura na so terminación.
Nidifica nel norte d'Eurasia. Foi introducida con ésitu na Isla de Rum, nel archipiélagu de les islles Small n'Escocia, en 1975 y agora la so área de reproducción toma les Islles Occidentales y les islles Small, según les islles de Mull, Skye, Lewis, Canna y la mariña de Wester Ross. La so población ye escasa en Gran Bretaña por causa de la so estinción y posterior repoblación. La mayor población n'Europa atopar a lo llargo de la mariña de Noruega.
El 22 de mayu de 2006 anuncióse qu'una pareya taba añerando na reserva natural d'Oostvaardersplassen n'Holanda. Esta ye la primer vegada en tiempos modernos qu'esta ave añeró n'Holanda.
Ye un ave principalmente residente, solo les aves qu'habiten nes rexones del estremu norte, tales como la población de Siberia, migren escontra'l sur pel hibiernu.
Esiste una pequeña población nel estremu suroeste de Groenlandia y l'oeste d'Islandia. Por cuenta del so mayor tamañu propúnxose que les aves de Groenlandia formen una subespecie groenlandicus, pero considérase esta especie como monotípica y la variación de tamañu ye clinal d'alcuerdu a la regla de Bergmann.
Conforma una especie par xuntu col pigargo americanu (Haliaeetus leucocephalus). Estes especies diverxeron d'otros pigargos al empiezu del Miocenu tempranu (c. 10 mya) a más tardar, y posiblemente - si los rexistros fósiles más antiguos tán correchamente asignaos a esti xéneru - enantes nel Oligocenu ceo, unos 28 mya (Wink et al. 1996[6]).
En forma similar a otros pares d'especies de pigargos, esti componer d'una especie con cabeza blanca (el pigargo americanu) y otra con cabeza color turráu. Probablemente dixebráronse nel Pacíficu norte, esvalixándose escontra l'oeste en Eurasia y escontra l'este en América del Norte. Al igual que la otra especie nórdica, el pigargo xigante (Haliaeetus pelagicus), los adultos tienen güeyos, pates y picos mariellos.
 Esta páxina forma parte del wikiproyeutu Aves, un esfuerciu collaborativu col fin d'ameyorar y organizar tolos conteníos rellacionaos con esti tema. Visita la páxina d'alderique del proyeutu pa collaborar y facer entrugues o suxerencies.
Esta páxina forma parte del wikiproyeutu Aves, un esfuerciu collaborativu col fin d'ameyorar y organizar tolos conteníos rellacionaos con esti tema. Visita la páxina d'alderique del proyeutu pa collaborar y facer entrugues o suxerencies. El pigargo européu (Haliaeetus albicilla) ye una especie d'ave accipitriforme de la familia Accipitridae. Nun se reconocen subespecies.
Ağquyruq dəniz qartalı (lat. Haliaeetus albicilla) - Haliaeetus cinsinə aid quş növü. Azərbaycanda təhlükədə olan quşlar siyahısına daxil edilmişdir.[1]
|description= ignored (kömək) (rus.)
Ağquyruq dəniz qartalı (lat. Haliaeetus albicilla) - Haliaeetus cinsinə aid quş növü. Azərbaycanda təhlükədə olan quşlar siyahısına daxil edilmişdir.
Status. Nadir, sayı tez azalan növdür. Yayılması. Düzənlik və dağətəyi rayonları. Adətən Xəzər sahillərində və Kür-Araz boyu rast gəlinir. Dəniz qartalına Abşeron sahillərində bütün il boyu təsadüf etmək olar. Balıqların kürü tökmə zamanı daha tez-tez təsadüf edilir. Onu dəniz sahillərinə yaxın yerlərdə, Astara və Kürün mənsəbi arasında müşahidə etmək olar. Yaşayış yeri. Qışda qida axtarmaq üçün çayların, göllərin və dənizlərin sahillərinə gəlirlər. Ağaclarda və kolluqlarda gecələyir. Təbiətdə sayı. Qızılağac qoruğu ərazisində 20-25-ə qədər ağquyruq dəniz qartalı qışlayır. Lənkəran düzənliyində 10-15, Ağ-göldə 8-10, Abşeron sahillərində və Bəndovanda 5-6, Mingəçevir su anbarında 3-4, Kür-Araz sahillərində 8-10 fərd qeydə alınmışdır. Çoxalması. Ağaclarda, nadir hallarda kollarda yuvalayır. Yuvaya 2 yumurta qoyur. Sayının dəyişilmə səbəbləri. Ağquyruq dəniz qartalının yuvaları, xüsusilə alçaqda yerləşənləri, insan tərəfindən dağıdılır. Qorunması üçün zəruri tədbirlər. Qorunmasına riayət etmək üçün nəzarəti gücləndirmək.Ar morerer lost gwenn (Haliaeetus albicilla) a zo un evn-preizh eus ar Bed Kozh.
Diouzh an evnoniourien e vez renket ar morerer lost gwenn en urzhiad Falconiformes pe Accipitriformes.
Bevañ a ra al labous en Eurazia[1].
a vo kavet e Wikimedia Commons.
Ar morerer lost gwenn (Haliaeetus albicilla) a zo un evn-preizh eus ar Bed Kozh.
L'àguila marina o pigarg cuablanc (Haliaeetus albicilla), també coneguda com a pigarg europeu, àguila de cua blanca, àguila de mar, àguila marina de cua blanca o àguila pescatera[1] és una espècie d'ocell falconiforme de la família Accipitridae.[2] No se'n coneixen subespècies.[3] Únic membre europeu del gènere Haliaeetus, el nom comú es fa extensiu a la resta de les espècies del gènere.
L'àguila de cua blanca és un ocell gros, abasta una llargada de 76 a 92 cm i una envergadura d'ales de 200 a 250 cm. Les femelles són significativament més grosses que els mascles. L'àguila de cua blanca té ales amples, un cap gros i un gruixut bec «carnisser». L'adult és principalment de color marró excepte pel seu cap i clatell més pàl·lid, té una distintiva cua blanca, el bec i les potes són grocs. La cua i el bec de l'àguila pescatera al seu estadi juvenil són més foscos, en els subadults la cua torna blanca amb una franja fosca en el seu acabament. És un animal molt emblemàtic i majestuós, raó per la qual és protegit.
Aquesta és una àguila molt grossa que es reprodueix al nord d'Eurasia. Se la va reintroduir amb èxit a l'Illa De Rum, a l'arxipèlag de les Small Isles a Escòcia, el 1975 i ara la seva àrea de reproducció inclou les Hèbrides Exteriors i les Small Isles, com també les illes Mull, Skye, Lewis, Canna i la costa de Wester Ross. La població de l'àguila de cua blanca és escassa a la Gran Bretanya a causa de la seva extinció. La repoblació és recent. La major població a Europa es troba al llarg de la costa de Noruega.
El 22 de maig,del 2006 es va anunciar que una parella d'àguiles de cua blanca estava niant en la reserva natural d'Oostvaardersplassen als Països Baixos. Aquesta és la primera vegada en temps moderns que aquesta au ha tornat a niar en aquest País.
L'àguila de cua blanca és una au principalment resident, sol les aus que habiten a les regions de l'extrem nord tals com la població de Sibèria migren cap al Sud a l'hivern. Hi ha una petita població a l'extrem sud-oest de Groenlàndia i l'oest d'Islàndia. A causa de la seva major mida s'ha proposat que les aus de Groenlàndia formen una subespècie groenlandicus, però es considera aquesta espècie és monotip i la variació de mida és clinal d'acord a la regla de Bergmann.
L'àguila de cua blanca conforma una espècie parella junt amb l'àguila calba. Aquestes espècies van divergir d'altres àguiles marines al començament del Miocè primerenc (c. 10 mya) a tot tardar, i possiblement - si els registres fòssils més antics estan correctament assignats a aquest genus - abans en l'Oligocè primerenc, uns 28 mya (Wink et al. 1996[4]).
En forma similar a altres parells d'espècies d'àguiles marines, aquest es compon d'una espècie amb cap blanc (l'àguila calba) i una altra amb cap color torrat. Probablement es van separar al Pacífic nord, dispersant-se cap a l'oest a Eurasia i cap a l'est a Amèrica del Nord. Igual com l'altra espècie nòrdica, l'àguila marina de Steller, els adults tenen ulls, potes i becs grocs.
L'àguila marina o pigarg cuablanc (Haliaeetus albicilla), també coneguda com a pigarg europeu, àguila de cua blanca, àguila de mar, àguila marina de cua blanca o àguila pescatera és una espècie d'ocell falconiforme de la família Accipitridae. No se'n coneixen subespècies. Únic membre europeu del gènere Haliaeetus, el nom comú es fa extensiu a la resta de les espècies del gènere.
Eryr yn perthyn i'r genws Haliaeetus a'r teulu Accipitridae yw Eryr y Môr (Haliaeetus albicilla). Mae'n perthyn yn agos i'r Eryr Moel.
Mae Eryr y Môr yn aderyn mawr, 69 – 91 cm (27 – 36 modfedd) o hyd a 182 – 238 cm (72 – 94 modfedd) ar draws yr adenydd. Pwysa'r ieir 4 – 6.9 kg (8.8–15.2 pwys), tra mae'r ceiliogod yn llai, 3 – 5.4 kg (6.6–12 pwys). Saif yn bedwerydd ymhlith eryrod y byd o ran maint.
Mae'n nythu ar draws gogledd Ewrop a gogledd Asia. Ceir poblogaeth fwyaf Ewrop o gwmpas arfordir Norwy. Pysgod ac adar yw eu prif fwyd, ond gall mamaliaid bychain fod yn bwysig hefyd.
Diflannodd y rhywogaeth o'r Alban yn y 19g, ond yn 1975, gollyngwyd nifer o adar ar ynys Rùm i geisio ei adfer. Mae'r eryr yma yn awr yn nythu ar draws Ynysoedd Heledd a rhai ar dir mawr yr Alban. Mae rhaglen i geisio adfer y rhywogaeth i Iwerddon, a bu awgrym y gellid gwneud yr un peth yng Nghymru. Nid oes sicrwydd a fu'r rhywogaeth yn nythu yng Nghymru yn y gorffennol ai peidio, ond mae'n bosibl fod rhai o'r cyfeiriadau at "eryr" yn cyfeirio at y rhywogaeth yma yn hytrach na'r Eryr Euraid.
Orel mořský (Haliaeetus albicilla) je velký druh dravce z čeledi jestřábovitých, patřící k největším žijícím orlům vůbec. Žije v blízkosti vod na rozsáhlém území Evropy a Asie a živí se převážně rybami a ptáky. V minulosti z mnoha oblastí Evropy zvláště v důsledku lidského pronásledování zcela vymizel, od 80. let 20. století však začala jeho početnost opět stoupat a postupně obsadil řadu původních hnízdišť.
Monotypický druh. Izolovaná populace orlů mořských v Grónsku, která dosahuje v rámci druhu i největších rozměrů, bývá některými autory označována za poddruh H. a. groencaldicus.[2]
Orel mořský je největší evropský orel a největší dravec vyskytující se v Česku.[3] Délka jeho těla dosahuje 76–92 cm a v rozpětí křídel měří 190–240 cm. Hmotnost u samce je cca 4 kg, u samice 7 kg.[3][4] Zbarvení tmavohnědé, jen ocas bílý, případně i jiné světlejší oblasti na hlavě a krku. Za letu se snadno pozná podle charakteristického vzhledu dlouhých širokých křídel s dlouhými ručními letkami. Ocas je klínovitý, jeho zbarvení se v průběhu života výrazně mění. Přechází od hnědé mladých ptáků, přes hnědobíle mramorovanou k bílé barvě s hnědými okraji rýdovacích per u pohlavně dospělých jedinců. Podobně postupně světlá starším ptákům nejen hlava a hruď, kde může původní hnědá (bíle kropenatá) barva přejít až do hnědožluté, ale i zobák, který z hnědé přechází v jasně žlutou. Neopeřené nohy jsou žluté. Samec a samice se navzájem liší pouze velikostí.
Hlasem je zdaleka slyšitelné „kjikjikjiklieklikklik“; samec má vyšší hlas, než samice.
Orel mořský je rozšířen v Evropě a Asii mimo tropické oblasti (palearktický typ rozšíření). Na severu tvoří hranici výskytu lesotundra, na jihu hranice probíhá od Balkánu přes Turecko k jižnímu pobřeží Kaspického moře. Jako okrajové oblasti výskytu lze označit i některé středomořské ostrovy, Island, Kamčatka, a ostrovy podél severovýchodního pobřeží Asie.[5]
Dospělí ptáci jsou převážně stálí a zimu tráví obvykle v okolí hnízdišť, ptáci z nejsevernějších populací však táhnou do jižnějších oblastí, kde vyhledávají nezamrzající vodní plochy. Někdy zaletují i mnohem dále na jih, například do oblasti Perského zálivu nebo severní Indie. Mladí ptáci jsou potulní až tažní a mohou podnikat přesuny nejen na jih, ale i na sever (z Balkánu do střední Evropy apod.).
Orel mořský byl ve velké části původního areálu vyhuben, nebo zde byly výrazně sníženy jeho početní stavy. Začátkem 20. století vymizel z Irska, roku 1916 naposledy zahnízdil ve Skotsku, v roce 1980 v Dánsku, v roce 1964 na Slovensku, roku 1946 v Rakousku. V posledních letech se však situace zlepšuje a znovu se šíří zpět do původních lokalit; od roku 1983 hnízdí opět ve Skotsku, od roku 1987 v Litvě, od roku 1984 i v ČR.[2] Celková početnost v Evropě je odhadována na 5 000 párů.[5]
Až do 19. století hnízdil na území ČR poměrně běžně, ale poté jako hnízdič postupně vymizel. Ve druhé polovině 19. století zanikla poslední hnízdiště v Čechách a ve 20. letech 20. století i na Moravě. Dlouhá desetiletí se zde objevoval pouze v zimě, přičemž největším zimovištěm bylo pravidelně Třeboňsko. To se také díky příhodným podmínkám k hnízdění a dostatečné potravní nabídce stalo oblastí, kam byla zacílena snaha ornitologů a orgánů ochrany přírody o obnovení původních hnízdišť, jejíž součástí bylo intenzivní přikrmování zimujících ptáků, postavení několika umělých hnízd a vypouštění v zajetí odchovaných mladých orlů zpět do volné přírody (v letech 1978–89 bylo vypuštěno celkem 9 jedinců). První, avšak neúspěšné zahnízdění bylo v lokalitě zaznamenáno v roce 1984, kdy hnízdící pár tvořili jedinci vypuštění ze zajetí. První mláďata byla úspěšně vyvedena až v roce 1986, je však pravděpodobné, že k zahnízdění došlo nejméně na 2 lokalitách již v letech 1981–82, a to u ptáků z divoké, původně jen zimující populace. V roce 1984 byl první pokus o zahnízdění zaznamenán i na jižní Moravě a v roce 1988 i na další zdejší lokalitě, první mláďata zde však byla vyvedena až v roce 2004. V následujících letech se orel mořský jako hnízdící druh rozšířil i do Českobudějovicka, Jindřichohradecka a Českolipska.[2][5]
Celková početnost byla v letech 1985–89 odhadnuta na 8–10 párů a v roce 1994 na 10–15 párů. V roce 2000 bylo prokázáno 17 hnízdění a u dalších 4–8 bylo považováno za možné až pravděpodobné,[2] v roce 2006 byla velikost hnízdící populace odhadnuta na 25–30 párů, v roce 2013 na 100 párů. Stoupající tendenci má i počet zimujících ptáků; největšími zimovišti jsou Třeboňsko, kde pravidelně zimuje 40–50 jedinců, a jižní Morava (Novomlýnské nádrže), kde lze pozorovat až 60 ptáků. V menším počtu zimuje i na mnoha dalších lokalitách.[5]
Potrava orla mořského je tvořena téměř výhradně rybami, ptáky a savci, zcela výjimečně se v ní mohou objevit i jiní živočichové, včetně plazů a obojživelníků. Její složení se liší v závislosti na místě výskytu a ročním období; v Grónsku v ní převažují ryby (93 %), v Polsku ptáci (90,7 %) a v ruské části Laponska savci (40,7 %).[2] Z ryb bývají nejčastěji chytány exempláře o délce 10–15 cm a hmotnosti 1–2 kg (štika, okoun, kapr, plotice, cejn), dokáže ale ulovit i kořist těžkou 5–6 kg. Z ptáků v potravě převládají vodní ptáci, jako lysky, kachny, racci či potápky. Zbytky po větších savcích (srnec obecný, prase divoké) pocházejí nepochybně z padlých nebo silně oslabených kusů, přímý útok nebyl nikdy pozorován. Denní spotřeba je zhruba 700 g, což je průměrně 500 g čisté svaloviny. Potravu vyhlíží za letu nebo vsedě z vyvýšeného místa, a ačkoli dokáže ulovit i zcela zdravou kořist, zaměřuje se především na uhynulé nebo oslabené kusy, čímž v přírodě vykonává sanitární funkci. Známý je také občasný tzv. kleptoparasitismus.[2][5]
Hnízdí jednotlivě na okrajích zatopených území, v jezernatých, rybničnatých a pobřežních oblastech. Zásnubní lety za mírného počasí probíhají již v druhé polovině prosince, obvykle však během ledna až března. Oba ptáci při nich vystoupají za hlasitého volání do výše, kde se samec spouští střemhlav na samici, která se na poslední chvíli převrátí na záda a proti samci nastaví pařáty.
Hnízdo je obrovská stavba ze silných větví, vystlaná tenkými větvičkami, trávou nebo drny, umístěná na stromech, skalách, v rákosinách a v tundře i na zemi (v ČR výhradně na stromech, nejčastěji na borovicích). Na jeho stavbě, která trvá asi 2,5 týdne, se podílejí oba ptáci. Párem je za příhodných podmínek využíváno opakovaně, i když může v různých letech střídat více hnízd. Průměr hnízda dosahuje 100–160 cm, výška nového hnízda 60 cm. Každý rok však hnízdo trochu dostavuje, takže po několika letech může dosáhnout výšky i dvou metrů a hmotnosti několika set kilogramů.
Hnízdí 1× ročně, náhradní snůšku klade jen v případě brzkého zničení vajec. Ve střední Evropě začíná hnízdit zpravidla v únoru, kdy do hnízda klade 1–2 bílá vejce o rozměrech 74,7 × 57,9 mm a hmotnosti 141–145 g. Snášena jsou v intervalu 2–5 dnů a na jejich inkubaci se podílejí oba ptáci po dobu cca 38 dnů. Mláďata zpočátku krmí jen samice, která jim trhá veškerou potravu, po 5–6 týdnech si s kořistí již poradí sama a předkládá jim ji i samec. Doba krmení na hnízdě je asi 70–75 dnů. I po opuštění hnízda se mláďata zprvu zdržují poblíž a rodiče je krmí ještě aspoň 1 měsíc. Pohlavní dospělosti dosahují ve věku 5–6 let. Ve volné přírodě je nejvyšší zaznamenaný věk 34 let.[2]
Dospělí ptáci nemají v přírodě žádného přirozeného predátora, největší hrozbu pro ně tak představuje lidská činnost. V časných fázích hnízdění jsou citliví na vyrušování, takže přítomnost lidí v blízkosti hnízda může vést až k jeho opuštění. Při těžbě dřeva pak může dojít ke zničení hnízdiště.[5]
Mnohem závažnější je ale ilegální pokládání otrávených návnad, které se u nás velmi rozšířilo v posledních letech. Jen v roce 2006 na něj doplatilo 9 jedinců, desátý byl postřelen. Jedem, který bývá nejčastěji používán, je insekticid karbofuran. Přestože je jakékoli pokládání otrávených návnad nelegální již více než 40 let, dochází k němu v současnosti v takovém rozsahu, že může během několika málo let způsobit vymizení orlů mořských z České republiky.[5]
V Německu, kde bylo v letech 1990–2000 zkoumáno 120 kadáverů orlů mořských, byly nejčastějšími příčinami úhynu srážka s vlaky (14 %), otrava olovem (12 %) a infekční onemocnění (11 %). K dalším příčinám, kterým podlehl větší počet ptáků, patřil například zásah elektrickým proudem (9 %) nebo zranění způsobené během vnitrodruhových konfliktů (5 %). Otrava chlorovanými uhlovodíky byla potvrzena u 3 jedinců, otrava karbofuranem u 1.[6]
V ČR je dle vyhlášky č. 395/1992 Sb. kriticky ohroženým druhem a je zařazen též v Příloze I. Směrnice o ptácích.[5]
Zoo Ostrava Zoo Jihlava
Orel mořský je významným heraldickým zvířetem, které se objevuje ve znaku i na vlajce Polska.
Orel mořský (Haliaeetus albicilla) je velký druh dravce z čeledi jestřábovitých, patřící k největším žijícím orlům vůbec. Žije v blízkosti vod na rozsáhlém území Evropy a Asie a živí se převážně rybami a ptáky. V minulosti z mnoha oblastí Evropy zvláště v důsledku lidského pronásledování zcela vymizel, od 80. let 20. století však začala jeho početnost opět stoupat a postupně obsadil řadu původních hnízdišť.
Havørnen (Haliaeetus albicilla) er Nordeuropas største rovfugl med et vingefang på op til 244 cm. Arten er udbredt over store dele af Europa og Asien og yngler desuden i Grønland, mens dens nære slægtning hvidhovedet havørn findes i resten af Nordamerika. Havørnen vendte i 1995 tilbage som dansk ynglefugl efter mange års fravær.
Havørnen er 78-102 cm med et vingefang på 180-244 cm. Forkrop og hoved er i lysegule eller gråbrune farver, mens undersiden er ensartet mørk. Halen er hos adulte fugle karakteristisk hvid og der findes hvide dækfjer på vingerne.
Havørnen er en forholdsvis sjælden fugl i Danmark, idet den oprindelige bestand blev udryddet herhjemme i 1917, men den genindvandrede i 1995 og bestanden er nu jævnt stigende. I 2012 registrerede Dansk Ornitologisk Forening således 48 havørnepar med rede, hvilket var 11 par flere end det foregående år [2]. I 2013 var tallet steget til 54 registrerede par, [3] og i 2015 var antallet af registrerede ynglepar yderligere steget til 72 par [4].
Den er udbredt over det meste af landet, men de fleste ynglepar findes i Sønderjylland og i østersøområdet, bl.a. på det sydlige Sjælland og Lolland-Falster. Fuglen ses bedst om vinteren, hvor endnu flere ørne opholder sig i Danmark, især i de sydøstlige egne. På Ørnens Dag den 16. februar 2014 blev der talt 344 havørne,[3] hvilket er en lille nedgang ift. året før (374 havørne og 11 kongeørne.[5]), hvilket kan skyldes den milde vinter.[3] Ved tælling i januar 2017 blev det største antal ørne i Danmark registreret. Således var der optalt et minimum på 395 havørne. Særligt omkring Limfjorden synes koncentrationen at være høj. Samtidig blev et minimum på 14 kongeørne optalt, hvilket får det samlede antal op over 400 individer. Mange er optalt langt fra kendte redesteder.
Havørnens rede bygges ofte højt til vejrs i ældre træer samt på klippehylder (Bornholm). Den yngler første gang når den er 5-7 år gammel og holder sig gerne til den samme mage hele livet igennem. I begyndelsen af marts lægges 1-3 æg, der udruges i løbet af 38 dage. Efter yderligere 70 dage er ungerne flyvefærdige, men mades alligevel af forældrene i to måneder mere. Herefter har forældre og unger ingen faste bånd mere.
Havørnens primære bytte er fisk og i mindre grad fugle der opholder sig ved vandet. En sjælden gang tager den også pattedyr, der som oftest er ådsler som den finder i vinterperioden.
Havørnen (Haliaeetus albicilla) er Nordeuropas største rovfugl med et vingefang på op til 244 cm. Arten er udbredt over store dele af Europa og Asien og yngler desuden i Grønland, mens dens nære slægtning hvidhovedet havørn findes i resten af Nordamerika. Havørnen vendte i 1995 tilbage som dansk ynglefugl efter mange års fravær.
Der Seeadler (Haliaeetus albicilla) ist ein Greifvogel aus der Familie der Habichtartigen (Accipitridae). Seeadler bewohnen gewässerreiche Landschaften Eurasiens von Grönland bis zum Pazifik. Sie ernähren sich überwiegend von Fischen, Wasservögeln und Aas. Die Art wurde in Mittel- und Westeuropa durch menschliche Verfolgung und die Vergiftung durch das Insektizid DDT fast ausgerottet. Seit Mitte der 1980er Jahre nimmt der Bestand in weiten Teilen Europas wieder stark zu.
Seeadler gehören zu den größten Greifvögeln Mitteleuropas, im Westen der Paläarktis sind nur Mönchsgeier (Aegypius monachus), Bartgeier (Gypaetus barbatus) und Gänsegeier (Gyps fulvus) größer.
Im Sitzen sind Seeadler selbst auf große Entfernung meist durch ihre Größe, den etwas eckig wirkenden, sehr kräftigen und fast bulligen Körper, den sehr kräftigen und langen Hals, den großen Fang und die sehr kräftigen Beine erkennbar. Das Gefieder erwachsener Seeadler ist überwiegend braun. Kopf, Hals, obere Brust und oberer Rücken sind gelblich-ockerfarben aufgehellt. Der weiße Stoß ist kurz und keilförmig. Der Fang ist im Vergleich zu anderen Greifvögeln sehr groß und kräftig und wie die Wachshaut hellgelb. Die Iris der Augen ist ebenfalls hellgelb. Die Beine sind anders als beim Steinadler (Aquila chrysaetos) nicht bis zu den Zehen befiedert.
Im Flug sind Seeadler in Mitteleuropa kaum verwechselbar. Neben der bedeutenden Größe sind der weit vorgestreckte, lange und kräftige Hals und die breiten, brettförmigen und im Segelflug horizontal gehaltenen Schwingen gute Unterscheidungsmerkmale. In größerer Höhe ist der weiße Stoß oft kaum sichtbar, das Flugbild wird dann oft mit „fliegendem Gerüstbrett“ umschrieben. Im aktiven Flug werden die riesigen Schwingen weit nach unten und nach oben durchgeschlagen.
Junge Seeadler sind dunkelbraun, der Fang und die Wachshaut sind dunkelgrau. Mit jeder Mauser werden sie den adulten Tieren ähnlicher, mit fünf Jahren zeigen sie das vollständige Adultkleid. Immature Seeadler werden wegen der häufig gut ausgebildeten dunklen Stoßendbinde gelegentlich mit jungen Steinadlern verwechselt. Anhand der sehr unterschiedlichen Körperproportionen und den bei Seeadlern fehlenden hellen Flügelfeldern sind die Arten jedoch gut zu unterscheiden.
Seeadler erreichen eine Körperlänge von 74 bis 92 Zentimetern und eine Flügelspannweite von 193 bis 244 Zentimetern. Die Weibchen sind mit einem Gewicht von 3,7 bis 6,9 Kilogramm und einer Flügellänge von 621 bis 717 Millimetern im Mittel deutlich größer und schwerer als die Männchen mit 3,1 bis 5,4 Kilogramm und einer Flügellänge von 552 bis 652 Millimetern.[1]
Für den Seeadler werden heute keine Unterarten beschrieben. Früher wurden die Seeadler auf Grönland als eigene Unterart von der Nominatform abgetrennt, auch diese Trennung wird jedoch heute nicht mehr aufrechterhalten. Genetische Studien haben die relativ enge Verwandtschaft der grönländischen Seeadler mit Seeadlern aus Westeuropa bestätigt. Vermutlich geht der grönländische Bestand auf eine Besiedlung durch europäische Seeadler nach der Klimaerwärmung seit der letzten Eiszeit ([2] Allerdings scheinen die Seeadler auf Island und Grönland heutzutage nicht durch Genfluss mit europäischen Seeadlern verbunden zu sein.
In Aussehen, Verhalten und Ökologie ähnelt der Seeadler sehr dem amerikanischen Weißkopfseeadler. Einige Autoren vereinigen diese beiden Arten daher zu einer Superspezies.
Der Balz-„Gesang“ des Seeadlers ist eine relativ hohe und etwas heisere, oft im Duett geäußerte Rufreihe wie „klü, klü, klü, klü, klü“ oder „rick, rick rick“, die zum Ende hin höher wird; dabei wird der Kopf nach oben geworfen. Die Rufreihe ähnelt auf größere Entfernung dem Ruf des Schwarzspechtes. Der Ruf wird fast nur in Horstnähe und dort vor allem in der Morgen- und Abenddämmerung geäußert. Bei Störungen am Horst rufen die Altvögel anhaltend heiser und abgehackt „ak, ak, ak, ak, ak“, denselben Ruf äußern die Jungvögel im Horst bei Annäherung.
Die Verbreitung des Seeadlers erstreckt sich in einem breiten Streifen über die gemäßigten, borealen und arktischen Zonen Europas und Asiens von Island über Irland[3] bis Kamtschatka und Japan. Außerdem ist Grönland von der Art besiedelt. In Europa reicht das Brutgebiet in Nord-Süd-Richtung von der Nordspitze Norwegens bis in den Norden Griechenlands. In Mittelasien folgt die Nordgrenze der Verbreitung etwa der nördlichen Grenze der Taiga, im Süden liegt die Verbreitungsgrenze in Israel, der Türkei, dem Irak, Iran und Kasachstan.
Der Seeadler ist an große Gewässer, also Küsten, große Seen und Flüsse gebunden. Im Binnenland Mitteleuropas sind Seeadler vor allem Bewohner der „Wald-Seen-Landschaften“. In Deutschland werden die höchsten Siedlungsdichten im Bereich der Müritz in Mecklenburg-Vorpommern sowie in der Oberlausitz Sachsens erreicht.
Adulte Seeadler sind in fast ganz Europa Standvögel und bleiben ganzjährig in ihrem Revier. Junge und immature Seeadler streifen ebenso wie adulte revierlose Vögel auf der Suche nach günstigen Ernährungsmöglichkeiten weiträumig in Europa umher. Die Seeadler im Norden Russlands und Sibiriens sind Zugvögel. Sie überwintern auf Hokkaidō und in Korea, in Süd-China und im Norden Indiens, in Pakistan und weiter westlich häufig am Kaspischen Meer, selten in Arabien, der Türkei und auf Zypern.
In Österreich gab es im Winter 2011/2012 fünf Hauptüberwinterungsgebiete. Diese waren die March-Thaya-Auen im Grenzgebiet zur Slowakei und Tschechien, die Parndorfer Platte im Norden des Burgenlandes, der burgenländische Seewinkel inkl. des Grenzgebietes zu Ungarn (Hanság), die Donau-Auen bei Wien und das nordöstliche Waldviertel. Im Februar 2012 zählte der WWF in Österreich 159 überwinternde Seeadler.[4]
Der Seeadler ernährt sich während der Brutzeit vor allem von Fischen und Wasservögeln, auch Aas wird gern genommen, lebende Säuger spielen meist nur eine untergeordnete Rolle. Fische werden häufig selbst erbeutet, Seeadler fressen jedoch auch tote und halb verweste Fische. Die im jeweiligen Lebensraum häufigsten Arten dominieren meist auch im Nahrungsspektrum des Seeadlers.
In Schleswig-Holstein bilden Fische 73 % und Wasservögel 24 % der Beute. Die übrigen 3 % sind Säuger, vor allem Kaninchen und Feldhasen. Unter den Fischen sind Bleie mit 24 %, Karpfen mit 23 % und unbestimmte Karpfenfische (Cyprinidae) mit 29 % dominierend. Die am häufigsten erbeuteten Wasservögel sind Blässhuhn (56 %), Graugans (10 %) und Stockente (6 %).[5]
Im Winterhalbjahr steigt der Anteil der Wasservögel beträchtlich an und macht im mitteleuropäischen Binnenland etwa 80 % der Beute aus. Insbesondere im Winter spielt auch Aas eine bedeutende Rolle.
Die Fischbeute der an der finnischen Ostseeküste lebenden Seeadler besteht zur Brutzeit vor allem aus Hecht und Aland, unter den Vögeln dominieren hier Eiderente und verschiedene Säger (Mergus sp.), wobei die Anteile regional stark variieren. Auf den Åland-Inseln im Südwesten Finnlands waren Eiderenten mit 19,4 % die häufigste Beute, gefolgt von Hecht (15,5 %), verschiedenen Sägern (11,1 %), Aland (6,4 %) und Reiherente (4,4 %). In der Umgebung der Stadt Vaasa an der Westküste Finnlands dominierten Hechte mit 31,7 % die Beuteliste, gefolgt von Sägern (10,7 %), der Eiderente (10,5 %) und der Reiherente (8,7 %).[6]
Auf der nordrussischen Kola-Halbinsel leben Seeadler zur Brutzeit vor allem von Alanden (49,1 %), gefolgt von Hechten (16,7 %). Wasservögel machten hier 20,3 % der Beuteliste aus, Säuger 4,9 %.
Auch im äußersten Osten des Verbreitungsgebietes dominieren Fische in der Nahrung. Am unteren Amur machten 4 Fischarten (Giebel, Amur-Hecht (Esox reicherti), Amur-Wels (Parasilurus asotus) und Amur-Stachelwels (Pelteobagrus fulvidraco)) zur Brutzeit 93,8 % der Beute aus.[7]
Die Methoden des Seeadlers beim Beuteerwerb sind sehr vielfältig. Seeadler nutzen zur Nahrungssuche an Gewässern bevorzugt störungsarme Sitzwarten, von denen aus sie stundenlang auf eine Gelegenheit zum Beuteerwerb warten. Die einfachste „Jagdmethode“ ist das Absammeln halbtoter oder toter Fische von der Wasseroberfläche. Ebenso wie lebende Fische werden diese vom niedrig über dem Wasser fliegenden Adler im Vorbeiflug aus dem Wasser gegriffen. Große Fische mit einem Gewicht von mehr als 2 Kilogramm werden in Ufernähe im Wasser gegriffen und festgehalten. Dabei kann der Adler in tieferem Wasser einige Minuten mit ausgebreiteten Flügeln auf dem Wasser liegen. Wenn der Fisch sich müde gekämpft hat, schwimmt der Adler mit seiner Beute an Land.
Gesunde Enten und Gänse fliegen beim Angriffsflug eines Seeadlers sofort auf und werden dann nicht weiter verfolgt. Die Adler nutzen dabei jedoch günstige Gelegenheiten, beispielsweise angeschossene oder kranke Vögel, im Sommer vor allem noch nicht flügge Jungvögel und flugunfähige Vögel in Vollmauser, im Winter zum Beispiel im Eis festgefrorene Vögel. Blässhühner fliegen beim Angriff eines Seeadlers nicht auf, sondern schließen sich dicht zusammen und laufen als geschlossene Gruppe flügelschlagend über das Wasser. Das dabei entstehende Rauschen ist weit zu hören. Winterliche Ansammlungen von Wasservögeln in Eislöchern ziehen oft größere Zahlen von Seeadlern an. Die Adler rütteln dann schwerfällig über dem Eisloch und erbeuten die Wasservögel durch gezielte Stoßflüge.
Einzelne Tauchenten, Lappentaucher oder Blässhühner, die sich Angriffen durch Abtauchen entziehen, werden durch den immer wieder angreifenden Adler so lange zum Tauchen gezwungen, bis sie erschöpft sind, und dann gegriffen. Diese Jagdmethode ist besonders effizient, wenn beide Partner eines Paares abwechselnd angreifen.
Zur Brutzeit werden Kolonien von Kormoranen und Graureihern, in Nordeuropa auch von Lummen und anderen Seevögeln, von Seeadlern regelmäßig aufgesucht und Jungvögel aus den Nestern erbeutet. In Kormorankolonien sammeln Seeadler auch auf dem Boden die von den Kormoranen ausgewürgten Fische ein. Erst in den letzten Jahren wurde bekannt, dass Seeadler auch regelmäßig Greifvogelnester ausnehmen. Mehrfach wurden in Seeadlernestern zum Beispiel tote oder sogar noch lebende nestjunge Mäusebussarde gefunden.[8]
Vor allem im Winter suchen Seeadler systematisch nach Aas. Dabei werden auch große Säuger wie Rothirsche und Wildschweine genutzt. Die Adler beobachten unter anderem Kolkraben und Krähen, die sich an solchen Kadavern oft in großen Schwärmen sammeln. An Bahnlinien fressen Seeadler regelmäßig überfahrene Tiere, in Gebieten mit regelmäßigen Jagden suchen Seeadler oft nach liegengelassenen Organen der erlegten Tiere, dem Aufbruch. Beides ist für die Adler jedoch nicht ungefährlich (siehe Abschnitt Mortalität).
Seeadler versuchen also meist mit möglichst wenig Aufwand Nahrung zu erlangen und wirken dabei oft plump und träge, andererseits werden die Geschwindigkeit und die Wendigkeit, die dieser Adler entwickeln kann, oft unterschätzt. Im normalen Schlagflug fliegen Seeadler mit rund 60 km/h und sind ohne weiteres in der Lage, beispielsweise Kolkraben einzuholen. Die Erbeutung von Graureihern und Gänsen im freien Luftraum ist mehrfach beobachtet worden. Seeadler parasitieren auch sehr geschickt bei anderen Arten, vor allem Fischadlern (Pandion haliaetus) wird regelmäßig die Beute abgejagt. Funde von kleineren Vögeln wie adulten Eichelhähern, Elstern oder Waldschnepfen in Seeadlerhorsten haben gezeigt, dass offensichtlich auch mittelgroße Greifvogelarten wie Habicht oder Wanderfalke von Seeadlern parasitiert werden.
Alte Seeadlerpaare leben in Dauerehe zusammen und zeigen vor allem im Winter beeindruckende Balzflüge. Bei den Balzflügen wechseln Synchronflüge, gemeinsames Kreisen und spielerisches Aufeinanderstoßen einander ab. An sonnigen Tagen mit starkem Wind ist die Flugaktivität besonders groß.
Junge und noch nicht ausgefärbte Artgenossen werden von territorialen Altvögeln meist ignoriert und im Revier geduldet. Ausgefärbte Fremdadler werden jedoch sofort heftig angegriffen und aus dem Revier vertrieben. Der angegriffene Fremdadler verlässt im Normalfall so schnell wie möglich das Revier des Paares. Regelmäßig werden in Brutrevieren jedoch Seeadler gefunden, die bei innerartlichen Beschädigungskämpfen schwer verletzt oder getötet wurden. Vermutlich kommt es zu solchen Kämpfen, wenn der revierbesitzende Vogel durch hohes Alter, kleine Verletzungen oder Ähnliches geschwächt ist und der eindringende Vogel eine Chance auf die Übernahme des Revieres sieht.
Junge und immature Adler schließen sich insbesondere an nahrungsreichen Stellen zu größeren Gruppen zusammen und nutzen gemeinsame Schlafplätze. An Stellen mit hohem Nahrungsangebot, wie zum Beispiel beim Abfischen in Teichanlagen oder an großen Kadavern, finden sich daher oft 20 und mehr Seeadler ein. Innerhalb dieser Gruppen sind spielerische Balgereien um Beute oder die besten Ruheplätze häufig.
Seeadler errichten gewaltige Horste aus Ästen. Die Nestmulde wird mit Gras und Moos ausgekleidet. In Mitteleuropa werden zur Horstanlage alte Bäume benutzt, in Norddeutschland vor allem Rotbuchen, in Ostdeutschland neben der Rotbuche vor allem Waldkiefern. Neue Horste haben einen Durchmesser von etwa 1,2 bis 1,5 Metern und eine Höhe von 50 bis 80 Zentimetern, alte und über Jahrzehnte genutzte Horste können einen Durchmesser von zwei Metern, eine Höhe von drei bis fünf Metern und ein Gewicht von 600 Kilogramm erreichen. An den Küsten Nordeuropas, zum Beispiel in Norwegen, brüten viele Seeadler in Felswänden, auf abgelegenen und baumlosen Inseln auch auf dem Boden. Viele Reviere weisen einen oder mehrere Wechselhorste auf, die abwechselnd oft über Jahrzehnte genutzt werden.
In Mitteleuropa beginnt die Brut zwischen Mitte Februar und Mitte März. Das Gelege besteht aus ein bis drei weißen Eiern, die Brutzeit beläuft sich auf ca. 38 Tage. Die Jungvögel erreichen nach rund 75 Tagen das Ästlingsstadium und nach 80 bis 90 Tagen können sie schon kurze Strecken fliegen.
Die Sterblichkeit in den ersten Lebensjahren ist verglichen mit kleineren Greifvogelarten sehr gering. Bei einer Studie in Norwegen wurden nestjunge Seeadler mit Satellitensendern versehen, mindestens 86 % aller Jungvögel überlebten die ersten zwei Lebensjahre.[9] In Finnland wurde die Sterblichkeit anhand von Ablesungen beringter Vögel an Fütterungsstellen berechnet, sie betrug bis zum ersten Winter (also von der Beringung bis zum Winter im Jahr der Beringung) 14 %, vom ersten bis zum zweiten Winter 7 % und vom zweiten bis zum dritten Winter 4 %.[10] Vergleichbare Untersuchungen liegen aus Mitteleuropa bisher nicht vor.
Angaben zum durchschnittlichen Alter von Brutvögeln liegen bisher aus Schleswig-Holstein vor. Im Jahr 2006 wurden 35 beringte Brutvögel identifiziert, diese hatten ein Alter von 4–20 Jahren, im Mittel 10,3 Jahre. Der überwiegende Teil der Vögel (80 %) war zwischen 6 und 14 Jahre alt.[11]
Die wichtigste natürliche Verlustursache sind Verletzungen bei Revierkämpfen.
Die Mortalität in Mitteleuropa ist aktuell überwiegend auf menschliche Einflüsse zurückzuführen. Hierzu gehören insbesondere Todesfälle infolge von Bleivergiftungen durch die Aufnahme von Bleipartikeln aus Jagdgeschossen welche sich durch die starke Magensäure auflösen und in die Blutbahn gelangen, Kollisionen mit Eisenbahnen, Oberleitungen und Windrädern sowie Stromschläge an Hochspannungsleitungen. Die Häufigkeiten solcher Todesfälle können regional sehr unterschiedlich sein. So ist in Schleswig-Holstein, einem Bundesland mit hohem Anteil an Windkraftanlagen, die Kollision mit Windrädern die mit Abstand häufigste aufgeklärte Todesursache.[12]
Von 87 zwischen 1998 und 2006 verletzt oder geschwächt gefundenen Seeadlern aus Deutschland hatten 33 % eine Bleivergiftung, 12 % waren mit technischen Anlagen kollidiert, 5 % waren Opfer von Stromschlägen. Weitere 22 % wiesen ebenfalls Anflugverletzungen wie Knochenbrüche und Ähnliches auf, ohne dass die Ursachen ermittelt werden konnten, da viele dieser Vögel offenbar schon tage- oder wochenlang flugunfähig gewesen waren und weite Strecken zu Fuß zurückgelegt hatten. Verletzungen durch innerartliche Revierkämpfe wurden bei 9 % der Fundtiere festgestellt, diese traten nur bei adulten und immaturen Adlern auf. Im Unterschied zu kleineren Greifvogelarten, bei denen die größte Sterblichkeit bei Jungvögeln im ersten Lebensjahr auftritt, waren hier 43 % der gefundenen Vögel adult, weitere 18 % waren immatur und nur 39 % waren im Nestlingsalter oder im Jugendkleid. Von den 23 in dieser Studie erfassten nestjungen und eben flüggen Seeadlern hatten zudem 11 das Pinching-Off-Syndrom, eine vermutlich genetisch bedingte schwere Befiederungsstörung. Ohne diese bisher nur in Mittel- und Westeuropa auftretende Erkrankung wäre der Anteil der Jungvögel noch deutlich geringer gewesen.[13]
Bleivergiftungen sind zum einen auf Bleischrot zurückzuführen, wie er für die Jagd auf Wasservögel, Tauben, Fasane, Füchse verwendet wird, aber vor allem auf bleihaltige Kugelmunition, mit der Paarhufer (u. a. Rehe, Hirsche und Wildschweine) erlegt werden. Diese Projektile zersplittern beim Aufprall und kontaminieren große Teile des Tierkörpers mit Bleisplittern.[14] Seeadler suchen insbesondere im Winter systematisch nach Aas und nutzen dann die am Ort der Erlegung vom Jäger zurückgelassenen Innereien sowie Tiere, die beschossen und trotz Nachsuche nicht gefunden wurden. Die sauren Magensäfte des Seeadlers lösen Blei sehr schnell auf, es gelangt in die Blutbahn. Das toxische Schwermetall schädigt unter anderem das Zentralnervensystem und die Blutbildung der Adler. Dies führt häufig zu zentralnervösen Ausfallerscheinungen bis zur völligen Blindheit. Die Störung der Blutbildung führt zu Sauerstoffmangel, viele der Adler ersticken daher.[15] Wissenschaftler gehen davon aus, dass auch ein Teil der Kollisionen mit anthropogenen Strukturen wie Zügen oder Windrädern auf durch Bleivergiftungen ausgelöste Verhaltensstörungen zurückzuführen ist.[16] Bleifreie Alternativmunition ist seit längerem verfügbar. Erste Schritte zum Verbot bleihaltiger Kugelmunition haben bisher die Landesforstverwaltungen der Länder Berlin und Brandenburg unternommen.
Im Winter 2016/2017 kam es in Mecklenburg-Vorpommern, Schleswig-Holstein, Niedersachsen und Hamburg zu mindestens 17 gesicherten Todesfällen infolge einer Infektion mit dem Influenzavirus H5N8.[17]
Im Rahmen der allgemein praktizierten Verfolgung aller Greifvögel etwa ab Mitte des 17. Jahrhunderts wurden auch Seeadler in weiten Teilen ihres Verbreitungsgebietes intensiv verfolgt. Bis Anfang des 20. Jahrhunderts waren sie in ganz Westeuropa ausgerottet, die westlichsten Vorkommen gab es in Mitteleuropa zu dieser Zeit in den heutigen Bundesländern Mecklenburg-Vorpommern und Brandenburg. Auch die Vorkommen in Skandinavien und Finnland waren bis auf kleine Reste verschwunden. Ab Anfang des 20. Jahrhunderts gab es erste Schutzbemühungen, die in den 1920er Jahren vor allem durch ein Buch von Bengt Berg, Die letzten Adler, in ganz Europa erheblich verstärkt wurden. Die Bestände zeigten durch die Jagdverschonung deutliche Zuwächse. In dieser Zeit wurde unter anderem Schleswig-Holstein (1947) und Dänemark (1952) wieder besiedelt.
In den 1950er und 1960er Jahren kam es wieder zu einer rapiden Abnahme der Bestände, da die Vögel kaum noch Nachwuchs bekamen. Dies lag an den Folgen der Verwendung von DDT. Das nach 1945 weltweit häufig eingesetzte Insektizid DDT und dessen Metabolit DDE reicherte sich über die Nahrungskette besonders in aquatischen Lebensräumen stark an und führte beim Seeadler und anderen Greifvögeln zu dünnen Eierschalen. Die Eier zerbrachen während der Brut oder starben ab. Mit dem Verbot von DDT ab Anfang der 1970er Jahre erholten sich die Bestände wieder, seit 1990 zeigen viele Populationen, darunter auch die deutsche, ein starkes Wachstum und eine deutliche Ausbreitungstendenz. So stieg die Zahl der Brutpaare in Deutschland von 185 im Jahr 1990 auf 470 im Jahr 2004, 2007 wurden 575 Brutpaare in Deutschland gezählt. 2018 wurden in Deutschland 700 Brutpaare gezählt, davon 391 in Mecklenburg-Vorpommern. Das entspricht einem jährlichen Zuwachs um 20 %. Ähnliche Entwicklungen fanden in Polen, Finnland und Schweden statt. Wieder besiedelt wurden unter anderem Tschechien (1984), Niedersachsen (1987), Dänemark (1995), Österreich (2001), Bayern (2006) und die Niederlande (2006). Bestandsschätzungen gehen derzeit weltweit von bis zu 12.000 Brutpaaren aus.
Genetische Studien haben gezeigt, dass der lokale Schutz von Seeadlern ein großer Erfolg für den Naturschutz war.[18] Verbot der DDT-Nutzung, lokaler Nestplatzschutz, Winterfütterung und die unzähligen weiteren Schutzmaßnahmen in vielen Ländern führten insgesamt dazu, dass sich die Seeadlerbestände regional erholten. Dies führte dazu, dass trotz der massiven Bestandsrückgänge während des 19. und 20. Jahrhunderts viel genetische Variation erhalten blieb. Diese Tatsache sehen Naturschutzbiologen als wichtigen Faktor für das langfristige Überleben der Art an.
Die IUCN hat den Seeadler bis 1993 als „gefährdet“ geführt, 1994 wurde die Art wegen der Bestandszunahmen auf „gering gefährdet“ und 2005 auf „nicht gefährdet“ heruntergestuft. In einigen Bundesländern ist der Seeadler seit 2015 allerdings als "stark gefährdet" eingestuft worden.[19]
Eine erste in neun Ländern koordinierte Zählung durch 300 Menschen entlang der gesamten Donau am Sonntag, 12. Januar 2014, ergab, dass 3000 Fluss-Kilometer winters von 750 Exemplaren dieser Art bevölkert werden. Auf etwa 400 km Fließstrecke in (oder an) Österreich wurden 35 Stück seines Wappenvogels gezählt, der hier seit 1946 nach gezielter Verfolgung als ausgestorben galt, doch nach Schutzmaßnahmen seit 2001 wieder brütet.[20]
Der Seeadler (Haliaeetus albicilla) ist ein Greifvogel aus der Familie der Habichtartigen (Accipitridae). Seeadler bewohnen gewässerreiche Landschaften Eurasiens von Grönland bis zum Pazifik. Sie ernähren sich überwiegend von Fischen, Wasservögeln und Aas. Die Art wurde in Mittel- und Westeuropa durch menschliche Verfolgung und die Vergiftung durch das Insektizid DDT fast ausgerottet. Seit Mitte der 1980er Jahre nimmt der Bestand in weiten Teilen Europas wieder stark zu.
L' Acula codibianca (Haliaeetus albicilla) hè un rapaci chì faci parti di a famiglia di l'Accipitridae. Hè un aceddu maiori è alilargu. A coda hè corta. L'impiumatura hè bruna bughja, fora di u capu è a parti suttana di u coddu chì sò più chjari. A coda hè bianca ind'è l'adultu. L'aculi codibianchi annosi t'ani a testa è u coddu bianchi. A testa hè larga è u bizzicu hè forti. I patti è u bizzicu sò giaddi. U ghjovanu hè più scuru, incù a coda è u bizzicu più bughji.
L'acula codibianca stà accantu à l'acqua, in i grandi fiumi, i lava o ancu in i facciati maritimi. Stà piuttostu à u cantu di u mari, ma accadi ch'edda stessi in piaghja, o in i furesti. L'acula codibianca si scontra in Siberia (Russia), in u nordu di l'Auropa, in u nordu di a China, in u Giapponu. Ci sò i pupulazioni impurtanti in i paesi di l'exi-URSS, in Nurveghja, in Pulogna è in Alimagna (in particulari in l'exi-Alimagna di l'Estu).
Ci hè una piccula crescita di l'effettivi di l'acula codibianca, incausata da a so prutizzioni. Ma a pupulazioni in Auropa hè di circa 600 coppii. I minacci pà l'acula codibianca so l'usu di u vilenu, a sparizioni di u so ambienti naturali, a caccia illegali, l'arrubecciu di l'ovi è di i piulacona.
L'acula codibianca si nutrisci pà u più di pesci (95%). Ma accadi ch'edda chjappessi calchì aceddu o picculi mammiferi com'è u topu o ancu a volpi. Caccighjeghja sola o in coppiu.
L'acula codibianca era prisenti in Corsica in i tempi, ma hè sparita, dipoi 1939. Ci hè pochi rinsignamenti annantu à prisenza di l'acula codibianca in Corsica, ma pari ch'edda fussi piuttostu arrighjunata in a costa uriintali, in u stagnu di Palu, o in u stagnu di Chjurlinu (Thibault 1983). Duranti u seculu XIX, l'aculi codibianchi pudiani stà dinò in Bonifaziu è versu Aiacciu. Ci hè parechji ussirvazioni chì facini pinsà ch'eddi si tramutavani di tantu in tantu in muntagna. Dopu à a sparizioni di l'acula codibianca di Corsica, ci hè statu calchì ussirvazioni, par asempiu in a bocca di Verdi in 1966, è da un piscadori in u stagnu di Chjurlinu di frivaghju 1968 (Thibault 1983). L'acula codibianca pudaria essa introdutta torra in a Riserva di Scandula. Ma ci hè quantunqua u pinseri di a prisenza di l'alpana in a riserva.
Com'è tutti i rapaci, l'acula codibianca hè prutetta da:
L' Acula codibianca (Haliaeetus albicilla) hè un rapaci chì faci parti di a famiglia di l'Accipitridae. Hè un aceddu maiori è alilargu. A coda hè corta. L'impiumatura hè bruna bughja, fora di u capu è a parti suttana di u coddu chì sò più chjari. A coda hè bianca ind'è l'adultu. L'aculi codibianchi annosi t'ani a testa è u coddu bianchi. A testa hè larga è u bizzicu hè forti. I patti è u bizzicu sò giaddi. U ghjovanu hè più scuru, incù a coda è u bizzicu più bughji.
L'acula codibianca stà accantu à l'acqua, in i grandi fiumi, i lava o ancu in i facciati maritimi. Stà piuttostu à u cantu di u mari, ma accadi ch'edda stessi in piaghja, o in i furesti. L'acula codibianca si scontra in Siberia (Russia), in u nordu di l'Auropa, in u nordu di a China, in u Giapponu. Ci sò i pupulazioni impurtanti in i paesi di l'exi-URSS, in Nurveghja, in Pulogna è in Alimagna (in particulari in l'exi-Alimagna di l'Estu).
Ci hè una piccula crescita di l'effettivi di l'acula codibianca, incausata da a so prutizzioni. Ma a pupulazioni in Auropa hè di circa 600 coppii. I minacci pà l'acula codibianca so l'usu di u vilenu, a sparizioni di u so ambienti naturali, a caccia illegali, l'arrubecciu di l'ovi è di i piulacona.
L'acula codibianca si nutrisci pà u più di pesci (95%). Ma accadi ch'edda chjappessi calchì aceddu o picculi mammiferi com'è u topu o ancu a volpi. Caccighjeghja sola o in coppiu.
De goesearn, see-earn of guozze-earn (Haliaeetus albicilla) is in grutte rôffûgel út de famylje fan de haukfûgels.
De goesearn is ien fan de grutste rôffûgels yn Jeropa. De goesearn falt ek op troch syn giele snaffel dy't yn ferhâlding mei oare rôffûgels hiel grut is. De fearren fan de goesearn binne foar it grutste part brún. Op de kop, rêch en boarst binne de fearren wat ljochter. De folwoeksen goesearn hat in koarte wite sturt.
In jonge goesearn is folle donkerder. De fearren binne donkerder, de sturt is ek noch brún ynstee fan wyt en ek de snaffel is noch donker.
In goesearn is tusken de 74 en 92 sm. grut en de wjukspanwiidte leit tusken de 193 en 244 sm. De wyfkes binne mei in gewicht tusken de 3,7 en 6,9 kilogram wat swierder as de mantsjes dy't tusken de 3,1 oant 5,4 kilogram wage.
De goesearn komt foar yn gebieten mei in protte wetter, fan Grienlân, oer hiel Jeraazje oant de Kust fan de Stille Oseaan.
Yn West-Jeropa wie de soarte troch it jachtsjen fan de minsken en troch fergiftigjen mei it lânbougif DDT hast hielendal ferdwûn. Mar sûnt it midden fan de jierren '80 wreidet de fûgel syn gebiet yn grutte parten fan Jeropa wer út.
Yn Nederlân is de see-earn ek geregeld te sjen. Foaral yn de Oostvaardersplassen yn Flevolân. Dêr briedt al sûnt 2006 in pearke see-earnen.
It earste besykjen fan de fûgel om yn Fryslân te brieden datearret fan 2009. Dat wie yn it Lauwersmargebiet. Yn 2010 hie it pear súkses en fleach in jonge earn út. De goesearn briedt tsjintwurdich (2017) ek yn de Alde Feanen by Earnewâld en yn de Súdwesthoeke by Koudum.[1].
De goesearn yt it meast fisk, wetterfûgels en ies. De fisken wurde it meast sels fong troch de earnen, mar se ite ek wol deade as heal fergiene fisken. Fan de wetterfûgels binne de eiders en de seachbekken populêr as proai.
Goesearnen bouwe grutte nêsten, faak yn âlde beammen. De nêstkûle wurdt mei gers en mos oanklaaid. In nije nêst hat in trochsnee fan 1,2 oant 1,5 meter in is sa'n heale meter heech. Alde nêsten kinne wol in trochsnee fan 2 meter hawwe en wol 3 oant 5 meter heech wurde. Oan de kusten wêr't net in protte beammen binne briede de earnen ek wol op de rotswanden as op de grûn.
It wyfke begjint yn Jeropa meast tusken mids febrewaris en mids maart te brieden. Sy leit dan ien oant trije wite aaien dy't yn likernôch 38 dagen útbret wurde. It duorret sa'n 80 oant 90 dagen foar de jongen fleane kinne.
De goesearn, see-earn of guozze-earn (Haliaeetus albicilla) is in grutte rôffûgel út de famylje fan de haukfûgels.
A gusiarn (gusiar, guuseniarn, (mo.) gooseoodler, goosejarn) (Haliaeetus albicilla) as en fögel ütj at famile faan a hanjügern (Accipitridae).
Haliaeetus albicilla es un specie de Haliaeetus.
Havørn (frøðiheiti - Haliaeetus albicilla) hevur nakað minni kropp enn svanur, men nógv longri flog, hálvan triðja metur. Hon er mest brún — tær gomlu hava hvítt vel; føturnir eru sólgulir. Hon eigur í fjallalondum, Noregi og Svøríki, ikki sørt á Íslandi — altíð nær við sjógv ella vøtn ella stórar áir. Sum allur rovfuglur heldur hon seg mest einsamøll ella saman í pørum. Føðin er mest fiskur og fuglur. Høgt í lofti sveimar hon spakuliga um og skimast; sær hon tá fisk uppi undir vatnskorpuni, stoytir hon sær niður og tekur hann í klørnar. Tey fuglasløg, sum fara á flog, letur hon vera í frið; men teir, ið kava, eygleiðir hon, til teir koma upp; eru teir knappir undir aftur, kunna teir sleppa einar tvær ferðir; men eina ferð mugu teir steðga til at anda, og tá hevur hon klørnar í teimum, og flýgur so burt at eta teir. Á landi drepur hon ikki nógv annað enn harur og rýpur. Deyðseyða og onnur ræ á sjógv ella landi dámar henni væl. Har sum hon eigur, hevur tað hent seg, at hon hevur tikið lítil børn, so søgnin um ørnina í Tindhólmi er væl trúlig.
Reiðrið er oftast í høgum homrum, óføra stórt, sum favn breitt og hálvan favn høgt; tilfarið er mest viðagreinar, í neðra tjúkkar sum armar, sum upp kemur, klænir. Sum aðrir rovfuglar verpur hon tíðliga á vári — longu í mars. Eggini eru 2; 6 vikur tekur at klekja tey. Ungarnir elta tær gomlu til út á heystið. Í árunum, áðrenn teir setast í búgv, strúka teir víða um lond. Nú og tá kemur onkur til Føroyar. Tá væntaðu teir gomlu Føroyingarnir stórt herverk í haganum; ein maður, sum skeyt eina ørn, varð fríur bæði fyri nevtoll og skjútsflutning, so leingi hann livdi. Enn koma ørnir higar av og á, men einki hoyrist um, at tær gera nakað ilt.
Havørn (frøðiheiti - Haliaeetus albicilla) hevur nakað minni kropp enn svanur, men nógv longri flog, hálvan triðja metur. Hon er mest brún — tær gomlu hava hvítt vel; føturnir eru sólgulir. Hon eigur í fjallalondum, Noregi og Svøríki, ikki sørt á Íslandi — altíð nær við sjógv ella vøtn ella stórar áir. Sum allur rovfuglur heldur hon seg mest einsamøll ella saman í pørum. Føðin er mest fiskur og fuglur. Høgt í lofti sveimar hon spakuliga um og skimast; sær hon tá fisk uppi undir vatnskorpuni, stoytir hon sær niður og tekur hann í klørnar. Tey fuglasløg, sum fara á flog, letur hon vera í frið; men teir, ið kava, eygleiðir hon, til teir koma upp; eru teir knappir undir aftur, kunna teir sleppa einar tvær ferðir; men eina ferð mugu teir steðga til at anda, og tá hevur hon klørnar í teimum, og flýgur so burt at eta teir. Á landi drepur hon ikki nógv annað enn harur og rýpur. Deyðseyða og onnur ræ á sjógv ella landi dámar henni væl. Har sum hon eigur, hevur tað hent seg, at hon hevur tikið lítil børn, so søgnin um ørnina í Tindhólmi er væl trúlig.
Reiðrið er oftast í høgum homrum, óføra stórt, sum favn breitt og hálvan favn høgt; tilfarið er mest viðagreinar, í neðra tjúkkar sum armar, sum upp kemur, klænir. Sum aðrir rovfuglar verpur hon tíðliga á vári — longu í mars. Eggini eru 2; 6 vikur tekur at klekja tey. Ungarnir elta tær gomlu til út á heystið. Í árunum, áðrenn teir setast í búgv, strúka teir víða um lond. Nú og tá kemur onkur til Føroyar. Tá væntaðu teir gomlu Føroyingarnir stórt herverk í haganum; ein maður, sum skeyt eina ørn, varð fríur bæði fyri nevtoll og skjútsflutning, so leingi hann livdi. Enn koma ørnir higar av og á, men einki hoyrist um, at tær gera nakað ilt.
The White-tailed eagle (Haliaeetus albicilla[2]) — an aa cried the Sea eagle, Erne (sometimes Ern), an White-tailed Sea-eagle — is a lairge bird o prey in the faimily Accipitridae which includes ither raptors such as hawks, kites, an harriers.
The White-tailed eagle (Haliaeetus albicilla) — an aa cried the Sea eagle, Erne (sometimes Ern), an White-tailed Sea-eagle — is a lairge bird o prey in the faimily Accipitridae which includes ither raptors such as hawks, kites, an harriers.
Ο Θαλασσαετός είναι ημερόβιο αρπακτικό πτηνό, ένας από τους αετούς που απαντούν και στον ελλαδικό χώρο. Η επιστημονική ονομασία του είδους είναι Haliaeetus albicilla και περιλαμβάνει 2 υποείδη. [2][3]
Στην Ελλάδα, όπως σε όλη την Ευρώπη, απαντά το υποείδος H. a. albicilla (Linnaeus, 1758). [4]
Η επιστημονική ονομασία του γένους, Haliaeetus, είναι εκλατινισμένη απόδοση της ελληνικής λέξης Αλιαετός, εκ του αλς, -αλός «θάλασσα» + αετός, που παραπέμπει στα ενδιαιτήματα του πτηνού. Ωστόσο, παρά την ονομασία, αυτά τα ενδιαιτήματα περιλαμβάνουν κυρίως εκείνα με γλυκά και υφάλμυρα, παρά αλμυρά ύδατα.
Ο όρος albicilla στην επιστημονική ονομασία του είδους είναι λατινικός, αποτελούμενος από τα συνθετικά albus «λευκός» + cilla «έσχατος, σπάνιος, τελευταίος» και σημαίνει «αυτός που έχει λευκό το έσχατο σημείο του», κατ’επέκτασιν και εν προκειμένω, «την ουρά» του. [7]
Η ίδια αναφορά γίνεται και στην αγγλική ονομασία του είδους (White-tailed Eagle).
Το είδος περιγράφηκε από τον Λινναίο, ως Falco Albicilla (Σουηδία, 1758). Η μεταφορά του στο γένος Haliaeetus, έγινε το 1809 από τον Γάλλο ζωολόγο Μ. Σαβινί (Marie Jules César Lelorgne de Savigny 1777 – 1851). [8]
Ο θαλασσαετός αποτελεί συγγενικό είδος του λευκοκέφαλου θαλασσαετού. Το ζεύγος αυτό, καλύπτει τον ίδιο οικολογικό θώκο και φαίνεται να απέκλινε από τα υπόλοιπα είδη αετών στην αρχή του Μειοκαίνου (περίπου 10 εκατομμύρια χρόνια πριν), ίσως και πρωτύτερα (αν το αρχαιότερο απολίθωμα που βρέθηκε, σωστά αποδίδεται σε αυτό το γένος), από το πρώιμο ή μέσο Ολιγόκαινο, περίπου 28 εκ. χρόνια πριν. [9] Όπως και σε άλλα «ζεύγη» ειδών θαλασσαετών, αποτελείται από ένα (1) είδος με λευκό κεφάλι και ένα (1) με σκουρόχρωμο. Πιθανώς διαχωρίστηκαν στην περιοχή του βορείου Ειρηνικού, με ανατολική εξάπλωση για το ένα είδος και δυτική για το άλλο. Μερικοί ερευνητές κατατάσσουν τα δύο αυτά είδη, σε ένα υπερείδος (superspecies).
Το υποείδος H. a. groenlandicus έχει τραβήξει το ενδιαφέρον των ορνιθολόγων στα τελευταία χρόνια. Μικροί, αποκομμένοι μεταξύ τους, πληθυσμοί κατοικούν στη ΝΔ. Γροιλανδία και την Δ. Ισλανδία. Για τη συστηματική του υπάρχουν, ακόμη και σήμερα, δύο αντίθετες απόψεις: Σύμφωνα με την πρώτη, έχει προταθεί ως διακριτό υποείδος, με στοιχεία που βασίζονται στο πολύ μεγάλο μέγεθος και τις αναλογίες σώματος.
Σύμφωνα με τη δεύτερη άποψη, αυτή η διακύμανση μεγέθους κατά τον Κανόνα του Μπέργκμαν (Bergmann’s Rule), αποτελεί, οικολογικά, φυσιολογική κλιμακωτή (clinal) προσαρμογή, οπότε το taxon δεν μπορεί να θεωρηθεί διακριτό υποείδος. Πρόσφατη γενετική μελέτη μιτοχονδριακού DNA είναι συναφής με αυτή την άποψη. [10]. Με άλλα λόγια, ο γροιλανδικός πληθυσμός που, σε εξελικτική κλίμακα γεωλογικού χρόνου, είναι σχετικά πρόσφατος, δεν έχει ακόμη συσσωρεύσει πολλά μοναδικά γενετικά χαρακτηριστικά. [11] Παρόλ’ αυτά, σημαντικοί ταξινομικοί φορείς (ITIS, Howard and Moore) εξακολουθoύν να θεωρούν ότι υπάρχουν δύο διακριτά υποείδη, ασπαζόμενοι την πρώτη άποψη.
Στην σύγχρονη εποχή, θαλασσαετοί εμφανίζονται στα νησιά της Χαβάης, ως τυχαίοι επισκέπτες, αλλά οστά Haliaeetus από το Τεταρτογενές έχουν βρεθεί σε τρία από τα μεγάλα νησιά. Μελέτη που δημοσιεύθηκε το 2015, χαρακτήρισε ως ταχέως εξελισσόμενη την μιτοχονδριακή περιοχή ελέγχου ενός από τα δείγματα αυτά. [12] Οι ερευνητές ανέλυσαν το DNA από έναν σκελετό «θαλασσαετού» 3.500 ετών, που βρέθηκε σε μια σπηλιά λάβας, στο νησί Μάουι. Οι φυλογενετικές αναλύσεις πρότειναν ότι, ο συκεκριμένος «αετός της Χαβάης» αποτελεί διακριτή (> 3% αποκλίνουσα) mtDNA εξελικτική γραμμή, πιο στενά συνδεδεμένη με τους αρτίγονους θαλασσαετούς, που απέκλινε στο Μέσο Πλειστόκαινο, περίπου. Έτσι, αν και δεν διαφοροποιείται σαφώς στην μορφολογία από τους συγγενείς του, ο «αετός της Χαβάης», πιθανόν, αντιπροσώπευε έναν απομονωμένο, ενδημικό πληθυσμό στο αρχιπέλαγος της Χαβάης για περισσότερα από 100.000 χρόνια, όπου και υπήρξε το μεγαλύτερο χερσαίο αρπακτικό. Οι λόγοι για την εξαφάνισή του είναι άγνωστοι μέχρι σήμερα.
Ο θαλασσαετός απαντά στην Ευρασία και ένα τμήμα της Γροιλανδίας, είτε ως επιδημητικό πτηνό, είτε ως καλοκαιρινός ή χειμερινός επισκέπτης. Η ολική επικράτειά του περιλαμβάνει και τις τρεις προαναφερθείσες κατηγορίες μετακίνησης σε ευρεία ζώνη που εκτείνεται από την Ισλανδία μέχρι την Ιαπωνία.
Στην Ευρώπη, η εξάπλωση είναι περιορισμένη από την Σκανδιναβία στα βόρεια μέχρι την Ν. Ιταλία και την Β. Ελλάδα στα νότια και από την Γαλλία στα δυτικά, μέχρι την Ευρωπαϊκή Ρωσία στα ανατολικά, αλλά εξαιρετικά διάσπαρτη και διακεκομμένη. Στην ήπειρο, το είδος απαντά κυρίως ως επιδημητικό ή διαχειμάζον.
Η Ασία αποτελεί την κύρια αναπαραγωγική επικράτεια του θαλασσαετού, σε συμπαγή ζώνη που εκτείνεται μεταξύ των υποαρκτικών περιοχών της τάιγκας στα βόρεια, και της Τουρκίας, του Ισραήλ, του Ιράκ, του Ιράν, του Καζακστάν, της Ινδίας και της ΝΑ. Κίνας στα νότια. Οι περιοχές διαχείμασης βρίσκονται στην Αραβική Θάλασσα, στον ΒΔ. Ινδικό Ωκεανό και φθάνουν μέχρι τις ακτές της Α. Κίνας, της Κορέας και της Ιαπωνίας.
(σημ. με έντονα γράμματα το υποείδος που απαντά στον ελλαδικό χώρο)
Οι μεγαλύτεροι αναπαραγωγικοί πληθυσμοί του θαλασσαετού απαντούν στη Β. Ευρώπη και την Β. Ασία, ενώ ο μεγαλύτερος πληθυσμός στην Ευρώπη βρίσκεται κατά μήκος των ακτών της Νορβηγίας και της Ρωσίας. Είναι ως επί το πλείστον μόνιμοι (επιδημητικοί) και, μόνον οι πολύ βόρειοι πληθυσμοί, όπως εκείνοι στην Β. Σκανδιναβία και την Α. Σιβηρία, μεταναστεύουν προς το νότο το χειμώνα. Τα άτομα από την Α. Ρωσία, σπάνια, φθάνουν μέχρι την Αλάσκα, ως τυχαίοι επισκέπτες. Γενικά, θεωρείται πλήρως μεταναστευτικό πτηνό, σε γεωγραφικό πλάτος μεγαλύτερο των 60°, όπου υπάρχει η πήξη των γλυκών υδάτων και απουσία υδρόβιων θηραμάτων, κατά την διάρκεια του χειμώνα. Ακόμη και στους μόνιμους πληθυσμούς της Δ. Ευρασίας, τα νεαρά και τα ανώριμα άτομα περιπλανώνται σε μεγάλο βαθμό, κυρίως νότια/νοτιοδυτικά.
Τυχαίοι, περιπλανώμενοι επισκέπτες έχουν αναφερθεί μεταξύ άλλων από τα Σβάλμπαρντ, την Ιρλανδία, το Βέλγιο και την Μάλτα, την Τυνησία και την Αίγυπτο, το Μπουτάν και την Ταϊλάνδη, καθώς και από τις ΗΠΑ. [19]
Ο θαλασσαετός είναι αρπακτικό πτηνό άρρηκτα συνδεδεμένο με το υδάτινο στοιχείο και, έτσι, μπορεί να βρεθεί σε πολλούς και ποικίλους υγροτόπους, κυρίως σε μεγάλες λίμνες και ποτάμια στα πεδινά, αλλά μπορεί να φθάσει έως τα 5.000 μ. Στις ακτές, απαντά στις κάθετες ορθοπλαγιές αλλά και στα παράκτια νησιά και, ειδικά τον χειμώνα, στις εκβολές ποταμών και πεδινούς βάλτους. Επίσης, σε περιοχές με έντονη αλιευτική δραστηριότητα εκ μέρους του ανθρώπου (π.χ. στην Ιαπωνία), αλλά και ιχθυοκαλλιέργειες ή σχετικές εγκαταστάσεις, όπου υπάρχει προσβασιμότητα σε «εύκολη» τροφή. [26]
Φωλιάζει σε δέντρα γενικά κοντά σε νερό, αλλά και σε ορεινές περιοχές στα βράχια. Στο ευρύ φάσμα κατανομής του, μπορεί να βρεθεί, από τα άδενδρα θαλάσσια φιόρδ στη Γροιλανδία και στην εξωτερική ακτή της Νορβηγίας μέχρι τις υφάλμυρες, δασώδεις ακτές της Βαλτικής, και από τις βόρειες λίμνες της τάιγκας και τα ποτάμια της Φινοσκανδιναβίας και της Ρωσίας στα προσχωσιγενή δάση και τις πλημμυρικές περιοχές στην κεντρική και νότια Ευρώπη. Βέβαια, μια επαρκής βάση θηραμάτων είναι ζωτικής σημασίας για την αναπαραγωγή του είδους. Τα ρηχά νερά με υψηλή παραγωγικότητα είναι απαραίτητα στις περισσότερες περιοχές. Στις δασικές περιοχές, οι φωλιές κατασκευάζονται αποκλειστικά στα δένδρα. [27]
Ο θαλασσαετός είναι ο μεγαλύτερος ευρωπαϊκός αετός, μεγαλύτερος και βαρύτερος από τον χρυσαετό. Μόνον ο ασιατικός θαλασσαετός του Στέλερ, είναι μεγαλύτερος και ογκωδέστερος από αυτόν. [30][31] Ο λευκοκέφαλος θαλασσαετός της Αμερικής έχει ανάλογες διαστάσεις, αλλά ελαφρά μικρότερο ανάπτυγμα πτερύγων και, ελαφρά μεγαλύτερο μήκος λόγω της μακρύτερης ουράς του. Πέρα από τις εντυπωσιακές του διαστάσεις, ένα ακόμη σημαντικό διαγνωστικό στοιχείο αποτελεί το ογκώδες του ράμφος, δυσανάλογα μεγάλο σε σχέση με το σώμα του.
Οι πληθυσμοί της Γροιλανδίας έχουν, κατά μέσον όρο, μεγαλύτερες διαστάσεις και αυτός είναι και ένας από τους λόγους για να υποστηριχθεί η άποψη του ξεχωριστού υποείδους (βλ. Συστηματική ταξινομική). Ο θαλασσαετός θεωρείται ο 8ος μεγαλύτερος και ο 4ος βαρύτερος αετός στον κόσμο. [32][33]
Κατά την πτήση και σε κοιλιακή όψη ξεχωρίζουν η, ανοικτή σε σχήμα βεντάλιας, σχετικά κοντή και λευκή ουρά, οι πολύ πλατιές πτέρυγες σε σχήμα παραλληλογράμμου και ο μακρύς λαιμός, ενώ σε μετωπική όψη (ανφάς), οι πτέρυγες διατηρούνται σχεδόν παράλληλες με το έδαφος ή πολύ λίγο προς τα κάτω. Τουλάχιστον 6 πρωτεύοντα ερετικά φτερά ξεχωρίζουν στην άκρη κάθε πτέρυγας, εν είδει «δακτύλων». [34]
Οι ενήλικες έχουν, γενικά, χρώμα σκούρο γκρι-καφέ, το κεφάλι και ο λαιμός είναι ελαφρά πιο ανοικτόχρωμα, το ράμφος είναι ογκώδες, «βαρύ» και με έντονα αγκιστρωτή ρινοθήκη, ενώ ξεχωρίζουν τα μαυριδερά πρωτεύοντα ερετικά φτερά και τα λευκά κάτω πηδαλιώδη της ουράς. Όλα τα γυμνά μέρη (πόδια, κήρωμα, ράμφος), όπως και η ίριδα είναι κίτρινου χρώματος.
Στα νεαρά πουλιά, η ίριδα είναι καφέ, η ουρά και το ράμφος είναι σκούρα γκρι, ενώ με το πέρασμα της ηλικίας, η ουρά γίνεται όλο και πιο λευκή, με χαρακτηριστική μαυριδερή ταινία στην άκρη της. [35] Τα φτερά που καλύπτουν το λαιμό και τους ώμους, με το πέρασμα των χρόνων, λευκαίνουν ολοένα και περισσότερο. [36] Αποκτούν το τελικό πτέρωμα των ενηλίκων στα 5 χρόνια, περίπου.
Τα φύλα είναι όμοια στη μορφολογία, αλλά τα θηλυκά είναι λίγο βαρύτερα από τα αρσενικά.
(Πηγές: [37][38][39][40][41][42][43][44][45][46][47][48][49][50])
Οι θαλασσαετοί έχουν ποικίλη διατροφή, ευκαιριακή και εποχική, δίνοντάς τους τον χαρακτηρισμό του «διατροφικού οπορτουνιστή». Δείγματα από την τροφή τους περιλαμβάνουν συχνά ψάρια, αλλά και πουλιά ή θηλαστικά. Πολλά πουλιά ζουν σε μεγάλο βαθμό ως «καθαριστές» ή «πειρατές», κλέβοντας τακτικά τη λεία από βίδρες και άλλα πουλιά όπως κορμοράνους, γλάρους, ψαραετούς και από διάφορα άλλα αρπακτικά. [51] Γενικά, τα είδη που απαντούν περισσότερο στην περιοχή του θαλασσαετού, αποτελούν και τα κυριότερα θηράματά του για την συγκεκριμένη περιοχή.
Τα θνησιμαία είναι, συχνά, η κύρια πηγή τροφής για τους δύσκολους μήνες του χειμώνα, με τα ψάρια και τα οπληφόρα (ελάφια, αγριογούρουνα) θηλαστικά να προτιμώνται, αλλά τα πάντα, από κητοειδή μέχρι και ανθρώπινοι σωροί να τρώγονται όταν υπάρχει έλλειψη τροφής. [52][53] Πολλές φορές έχουν παρατηρηθεί, να επιτηρούν τις περιοχές με σδηροδρομικές γραμμές, όπου υπάρχει μεγάλη πιθανότητα να βρεθούν νεκρά ή τραυματισμένα θηράματα.
Η καθημερινή απαίτηση τροφής είναι της τάξης των 500-600 γραμμαρίων. Φαίνεται ότι, λόγω του μακρύτερου εντέρου τους και του πιο αποτελεσματικού πεπτικού τους συστήματος, οι θαλασσαετοί είναι σε θέση να ζήσουν ομαλά με λιγότερο φαγητό. Σχεδόν κάθε ψάρι, που μπορεί να βρεθεί κοντά στην επιφάνεια, αποτελεί λεία για τον θαλασσαετό, ενώ και οι υπαίθριες ιχθυαγορές και τα ιχθυοτροφεία, εύκολα γίνονται αντικείμενο εκμετάλλευσης από τους αετούς όταν είναι διαθέσιμα. [54] Παρόλο που, μόνο περιστασιακά, θανατώνουν ή παρενοχλούν πουλιά της ξηράς, αντίθετα, όταν τους δίνεται η ευκαιρία επιτίθενται σε καλοβατικά πτηνά ή γενικότερα σε πουλιά που έχουν ως βάση το νερό. Έτσι, στην Βαλτική, η διατροφή του θαλασσαετού αποτελείται κυρίως από θαλάσσια πτηνά, ενώ πρόσφατα έχει αναφερθεί να έχουν επιτεθεί και να τρώνε κορμοράνους και, σε ορισμένες περιπτώσεις, να καταστρέφουν ολόκληρες αποικίες τους. [55] Στο νησί της Εσθονίας Hiiumaa, τουλάχιστον 25 ζεύγη θaλασσαετών και έως 26 μεμονωμένα άτομα έχουν παρατηρηθεί να λυμαίνονται ολόκληρη αποικία κορμοράνων. [56] Στην Γερμανία, το 73% της λείας είναι ψάρια και το 24% υδρόβια πουλιά (φαλαρίδες, χήνες και πάπιες), ενώ το υπόλοιπο 3% είναι θηλαστικά, κυρίως κουνέλια, λαγοί και βίδρες. [57]. Ακόμη και στα απώτατα ανατολικά όρια της επικράτειάς του, ο θαλασσαετός έχει ως βασικό στοιχείο της δίαιτάς του τα ψάρια. [58]
Επιπλέον, βουτηχτάρια, πάπιες, φαλαρίδες, γλάροι, χήνες και κύκνοι έχουν καταγραφεί στη λεία τους. [59] Νεοσσοί και αυγά άλλων πουλιών, επίσης καταναλώνονται τακτικά. Τα θηλαστικά που θηρεύονται κυμαίνονται σε μέγεθος, από χωραφοποντικούς, μέχρι μικρά αρνιά και ελάφια, με τα τελευταία, πιθανόν να έχουν το ίδιο μέγεθος με εκείνα που θηρεύονται στην Βόρεια Αμερική από τον Λευκοκέφαλο θαλασσαετό. [60]
Ο θαλασσαετός θεωρείται, γενικά, ένας «βαρύς» κυνηγός, σχετικά «άτσαλος» που προτιμάει να περιμένει για τη λεία του, παρά να επιτίθεται. Αυτό, όμως, είναι η μισή αλήθεια διότι, όταν υπάρξει ανάγκη μετατρέπεται σε έναν επιθετικό αετό που στρέφεται σε διαφόρων ειδών θηράματα.
Οι κυνηγετικές μέθοδοι του θαλασαετού είναι πολύ διαφορετικές. Στις περισσότερες περιπτώσεις χρησιμοποιεί κάποια χαμηλή θέση κοντά στην επιφάνεια του νερού, από όπου περιμένει ακόμη και ώρες για μια ευκαιρία. Ο ευκολότερος τρόπος είναι να συλλαμβάνει τα μισοπεθαμένα ή νεκρά ψάρια από την επιφάνεια του νερού. Όμως, και τα ζωντανά ψάρια συλλαμβάνονται με χαμηλές πτήσεις πάνω από το νερό, [62] μέχρι 30 εκατοστά βάθος, [63] ενώ εκείνα που ζυγίζουν περισσότερο από 2 κιλά, μεταφέρονται στην ακτή όπου και σταθεροποιούνται με τους γαμψώνυχες μέχρι να εξαντληθούν.
Όταν συνυπάρχουν άλλα σαρκοβόρα στο πεδίο τροφής, τότε η παρουσία των θαλασσαετών συχνά είναι κυρίαρχη, ακόμη και έναντι μεγάλων θηρευτών (λύκων κ.α.). Στην Σκωτία, ανταγωνίζεται σκληρά με τον χρυσαετό για τα κουνέλια και τους λαγούς, ενώ στη Νορβηγία, όπου αυτοί οι δύο μεγάλοι αετοί συνυπάρχουν, τέτοιος ανταγωνισμός δεν φαίνεται να υπάρχει. [64] Αν και, γενικά, είναι λιγότερο δραστήριος κυνηγός από τον χρυσαετό, ο ανταγωνισμός για την τροφή μπορεί να καταλήξει υπέρ του ενός ή του άλλου, ανάλογα με την ισχύ τού εκάστοτε ατόμου. Μπορεί ακόμη, να βρίσκονται σε υψηλότερες πυκνότητες πληθυσμού και να υπερτερούν αριθμητικά των χρυσαετών.
Κατά την επίθεση σε υδροβατικά πουλιά που δεν φωλιάζουν, πετούν κατ' επανάληψη εναντίον τους, αναγκάζοντάς τα να καταδύονται ξανά και ξανά, μέχρι που εξαντλούνται και πιάνονται εύκολα. Η μέθοδος αυτή είναι ιδιαίτερα αποδοτική, όταν παίρνουν μέρος τόσο το αρσενικό όσο και το θηλυκό, που εναλλάσσονται στις επιθέσεις. [65] Όταν το θήραμα που θανατώνεται είναι πολύ μεγάλο, όπως οι κύκνοι, μπορεί να συρθεί από την επιφάνεια του νερού στην ακτή για να καταναλωθεί.
Στην ενήλικη ζωή του, η θαλασσαετός δεν έχει φυσικούς εχθρούς και, ως εκ τούτου, βρίσκεται στην κορυφή της τροφικής αλυσίδας των ενδιαιτημάτων του.
Γενικά, οι θαλασσαετοι είναι μοναχικά πτηνά ή σχηματίζουν ζευγάρια ή τριάδες όταν βρίσκονται στον ζωτικό τους χώρο. Ωστόσο, είναι αγελαία πτηνά στις χειμερινές θέσεις κουρνιάσματος, όπου μπορούν να συναθροίζονται σε ομάδες δεκάδων ατόμων. [66]
Ο θαλασσαετός παρουσιάζεται «βαρύς» και αργός στην πτήση του, θυμίζοντας τους γύπες, [67] ωστόσο –στοιχείο συνηθισμένο στα πολύ μεγάλα αρπακτικά-, μπορεί να εμφανίσει ασυνήθιστη επιδεξιότητα, ιδιαίτερα κατά τις εναέριες επιδείξεις ερωτοτροπίας. Η πτήση γίνεται με αργά, χαλαρά και σχετικά «ρηχά» φτεροκοπήματα, ενώ χαρακτηριστικές είναι η απότομη άνοδος και κάθοδος, κατά την πορεία της. [68] Η εικόνα που δίνουν οι πτέρυγες είναι 2,5 φορές το μήκος του σώματος, περίπου. Η αερολίσθηση (glide) πραγματοποιείται με τις πτέρυγες επίπεδες ή με την άκρη τους ελαφρά κεκλιμένη προς τα κάτω. Το αντίθετο συμβαίνει κατά το γυροπέταγμα (soaring), όπου οι πτέρυγες εμφανίζονται με την άκρη τους ελαφρά κεκλιμένη προς τα πάνω. [69]
Τα ζευγάρια που σχηματίζουν οι θαλασσαετοί ζουν μαζί σε μόνιμη βάση και, πολλές φορές, επιδεικνύουν εντυπωσιακά «παιχνίδια» στον αέρα ιδιαίτερα στις ηλιόλουστες χειμωνιάτικες ημέρες με ισχυρούς ανέμους, οπότε η πτητική δραστηριότητα είναι ιδιαίτερα υψηλή. Τα νεαρά και μη-πλήρως χρωματισμένα άτομα της εδαφικής επικράτειας, συνήθως αγνοούνται και γίνονται ανεκτά από τα ενήλικα πουλιά, αντίθετα από τα πουλιά με πλήρες πτέρωμα, που αναγνωρίζονται αμέσως και οδηγούνται βίαια έξω από την περιοχή. Μερικές φορές οι επιθέσεις αυτές οδηγούν στο σοβαρό τραυματισμό των γηραιότερων και πιο αδύναμων αετών.
Από την άλλη πλευρά, τα νεαρά και ανώριμα άτομα είναι ιδιαίτερα κοντά μεταξύ τους σε περιοχές πλούσιες σε τροφή και, μοιράζονται ανά ομάδες κοινές θέσεις ύπνου. Για παράδειγμα, σε περιοχές με υψηλή προμήθεια τροφίμων, όπως στα ιχθυοτροφεία ή σφαγεία βρίσκονται συχνά 20 ή περισσότεροι αετοί. Το έδαφος που υπερασπίζονται οι θαλασσαετοί όταν φωλιάζουν, κυμαίνεται μεταξύ 30 και 70 χμ², συνήθως σε προφυλαγμένα παράκτια σημεία. Μερικές φορές βρίσκονται στην ενδοχώρα κοντά σε λίμνες ή κατά μήκος ποταμών. Η αναπαραγωγική επικράτειά τους, μπορεί να συμπίπτει με εκείνη των χρυσαετών, αλλά ο ανταγωνισμός μεταξύ των δύο ειδών είναι περιορισμένος διότι ο χρυσαετός προτιμάει τα βουνά και τις βαλτώδεις περιοχές, ενώ ο θαλασσαετός την ακτή και τους υγροτόπους.
Οι θαλασσαετοί γίνονται σεξουαλικά ώριμα στα τέσσερα ή πέντε χρόνια της ηλικίας τους. Ζευγαρώνουν εφ’όρου ζωής, αλλά αν κάποιος από το ζευγάρι χαθεί, τότε μπορεί γρήγορα να υπάρξει αντικατάστασή του. Ο δεσμός οριστικοποιείται όταν επιλεγεί η μόνιμη «κατοικία» του ζεύγους και, τότε αρχίζουν οι ερωτοτροπίες που περιλαμβάνουν χαρακτηριστικές εναέριες επιδείξεις, οι οποίες κορυφώνονται με κλείδωμα των νυχιών στον αέρα, στροβιλισμούς και κραυγές. [70]
Όντας ευαίσθητος σε οχλήσεις στην φωλιά του, ο θαλασσαετός απαιτεί θέσεις αναπαραγωγής με χαμηλή ανθρώπινη δραστηριότητα. Η πλησιέστερη απόσταση από τις πιθανές πηγές όχλησης που μπορεί να γίνει ανεκτή, ποικίλλει σε μεγάλο βαθμό μεταξύ των περιοχών, όντας μεγαλύτερη σε ανοικτούς οικοτόπους, με τις φωλιές εκτεθειμένες, από ό, τι σε πιο απομονωμένες τοποθεσίες. Η σταδιακή χαλάρωση στην ευαισθησία στην ανθρώπινη ενόχληση έχει παρατηρηθεί πρόσφατα σε ορισμένες περιοχές, πιθανώς ως αποτέλεσμα της μικρότερης δίωξης.
Η φωλιά (eyrie) είναι ένα τεράστιο οικοδόμημα από χοντρά ξερόκλαδα πάνω σε ένα ψηλό δένδρο, ή αν δεν υπάρχει, σε χαμηλά δένδρα ή σε ψηλούς θάμνους, πιο σπάνια σε ένα παράκτιο βράχο. Όπως συμβαίνει και με άλλους αετούς, η φωλιά κτίζεται σιγά-σιγά και, κερδίζει όγκο και ύψος με τα χρόνια. Το υλικό επίστρωσης είναι φυλλοφόρα κλαδιά, γρασίδι και, ενίοτε, μαλλί από θηράματα. Η κατασκευή γίνεται και από τους δύο εταίρους, με το αρσενικό να προμηθεύει το περισσότερο υλικό και το θηλυκό να αναλαμβάνει την τακτοποίησή του. [71] Όντας πιστός στην αναπαραγωγική του επικράτεια, ο θαλασσαετός κατασκευάζει περισσότερες από μία, φωλιές, που συχνά επαναχρησιμοποιούνται, μερικές φορές επί δεκαετίες από διαδοχικές επιτυχημένες αναπαραγωγικά γενιές. Μία (1) φωλιά στην Ισλανδία ήταν σε χρήση για πάνω από 150 χρόνια, [72] ενώ στην Σκανδιναβία, πολλά δένδρα είναι γνωστό ότι έχουν καταρρεύσει υπό το βάρος των τεράστιων, από καιρό επαναχρησιμοποιημένων, φωλιών.
Η γέννα αποτελείται από (1-) 2 (-3, 4) μεγάλα, ελαφρώς υποελλειπτικά ή ελλειπτικά, ελαφρώς γυαλιστερά αβγά, διαστάσεων 75,8 Χ 58,7 χιλιοστών [73] και βάρους 142 γραμμαρίων, εκ των οποίων ποσοστό 10% είναι κέλυφος. [74] Eναποτίθενται σε διάστημα δύο έως πέντε ημερών, μεταξύ τους, τον Μάρτιο ή τον Απρίλιο. Η επώαση αρχίζει μετά την εναπόθεση του 1ου αβγού, πραγματοποιείται και από τους δύο γονείς, ή μόνο από το θηλυκό, και διαρκεί 35 ημέρες περίπου. Μόλις εκκολαφθούν, οι νεοσσοί είναι αρκετά ανεκτικοί ο ένας με τον άλλο, αν και ο πρώτος νεοσσός είναι πιο μεγάλος και κυρίαρχος στη σίτιση. Το θηλυκό αναλαμβάνει το μεγαλύτερο μέρος του ταΐσματος, με το αρσενικό να αναλαμβάνει πού και πού. Οι νεοσσοί είναι σε θέση να τραφούν μόνοι τους στις 35-40 ημέρες, ενώ μετακινούνται έξω από τη φωλιά στις 56 ημέρες, περίπου. Πτερώνονται στις 70 ημέρες, παραμένουν όμως στην περιοχή της φωλιάς, εξαρτημένοι από τους γονείς τους για, περαιτέρω 35-40 ημέρες. [75]
Η θνησιμότητα των θαλασσαετών κατά τα πρώτα χρόνια της ζωής τους, είναι χαμηλή σε σχέση με άλλα αρπακτικά πτηνά. Σε έρευνα στη Νορβηγία, με χρήση δορυφορικών αναμεταδοτών, τουλάχιστον το 86% των νεοσσών έφθασε τα δύο χρόνια ζωής. [77] Επίσης, όπως φαίνεται από έρευνα στη Φινλανδία, βασισμένη σε μέτρηση δακτυλιωμένων πουλιών στις περιοχές σίτισής τους, η θνησιμότητα από τη γέννηση μέχρι τον 1ο χειμώνα ήταν 14%, από τον 1ο στον 2ο χειμώνα ήταν 7% και, από τον 2ο στον τρίτο, 4%. [78] Η μέση διάρκεια ζωής του θαλασσαετού είναι 21 χρόνια. [79]
Η σημερινή θνησιμότητα του θαλασσαετού στην Κ. Ευρώπη οφείλεται σε μεγάλο βαθμό στον ανθρώπινο παράγοντα. Οι πιο σημαντικές αιτίες είναι η δηλητηρίαση από την κατάποση κυνηγετικών σκαγίων που φέρουν μόλυβδο και οι συγκρούσεις με τεχνητές δομές όπως οι σιδηρόδρομοι, τα ηλεκτροφόρα καλώδια και οι ανεμογεννήτριες.
Ο πρώτος όμως, χρονολογικά, μεγάλος κίνδυνος για τον θαλασσαετό προήλθε στη δεκαετία ’50 και ’60, από την εκτεταμένη χρήση DDT, που οδήγησε στην παραγωγή αβγών με λεπτό κέλυφος, με αποτέλεσμα να μην επωάζονται με φυσιολογικό τρόπο. Μετά την απαγόρευση της χημικής ουσίας, οι πληθυσμοί άρχισαν να ανακάμπτουν. Έτσι, στην Γερμανία, τα ζευγάρια αναπαραγωγής, από 185 το 1990, αυξήθηκαν σε 470 το 2004 και 575 το 2007, ενώ παρόμοιες αυξήσεις είχαν και η Τσεχία, η Δανία και η Αυστρία.
Κατά την περίοδο 1998 – 2006, από τα 87 πτηνά που βρέθηκαν νεκρά ή τραυματισμένα στην Γερμανία, το 33% είχε δηλητηρίαση από μόλυβδο, το 12% είχε σύγκρουση με ανθρωπογενείς δομές, ενώ 5% ήταν θύματα ηλεκτροπληξίας. Ένα άλλο 22% παρουσίασε τραυματισμούς, -όπως σπασμένα κόκαλα- χωρίς να μπορεί να προσδιοριστεί η αιτία, διότι πολλά από αυτά τα πουλιά για μέρες ή εβδομάδες, δεν μπορούσαν να πετάξουν και, μεγάλες αποστάσεις καλύφθηκαν με τα πόδια.
Ειδικά, η δηλητηρίαση από μόλυβδο αποτελεί πολύ σοβαρό πρόβλημα, διότι η βρώση των πυροβολημένων πουλιών από τους θαλασσαετούς, δεν έχει πάντοτε ως αποτέλεσμα τον άμεσο θάνατο του αρπακτικού, αλλά η μόλυνση είναι σταδιακή και βασανιστική. Τα όξινα γαστρικά υγρά διαλύουν σταδιακά το μέταλλο, τα τοξικά προϊόντα περνάνε στην κυκλοφορία του αίματος και βλάπτεται το κεντρικό νευρικό σύστημα που, στις περισσότερες των περιπτώσεων, οδηγεί σε ολική τύφλωση. Επίσης η αλλαγμένη δομή των συστατικών του αίματος οδηγεί σε έλλειψη οξυγόνου, με αποτάλεσμα πολλοί από τους αετός να πεθαίνουν βασανιστικά από ασφυξία. [80] Μάλιστα, δεν είναι λίγοι εκείνοι οι ερευνητές που πιστεύουν ότι, οι συγκρούσεις με τεχνητές δομές, όπως τα τρένα ή ανεμογεννήτριες προκαλούνται από τη δηλητηρίαση από μόλυβδο και τις επακόλουθες διαταραχές στη συμπεριφορά των πτηνών. [81]
Κατά τη διάρκεια της περιόδου 1800-1970 οι θαλασσαετοί, στο μεγαλύτερο μέρος της Ευρώπης υπέστησαν δραματική μείωση και εξαφανίστηκαν σε πολλές περιοχές της , ενώ η Νορβηγία, η Γερμανία, η Πολωνία και η Ισλανδία κατάφεραν να διατηρήσουν κάποιους πληθυσμούς. [82] Έντονες δράσεις διατήρησης του είδους (νομική προστασία για να μειωθεί το κυνήγι, προστασία των τόπων αναπαραγωγής, σίτιση κατά το χειμώνα), οδήγησαν στην ανάκαμψη πολλών τοπικών πληθυσμών. Από το 1980, ο θαλασσαετός έχει ανακάμψει σταθερά, και εξαπλώνεται προς τα δυτικά. Έχει επαναποικήσει αρκετές παραδοσιακές περιοχές αναπαραγωγής στην Ευρώπη και η ανάκαμψη είναι ακόμη σε εξέλιξη. Μάλιστα, μελέτες μιτοχονδριακού DNA από την Β. και Κ. Ευρώπη έχουν δείξει ότι, η ανάκτηση του ευρωπαϊκού πληθυσμού έχει διατηρήσει σημαντικές ποσότητες της γενετικής ποικιλότητας, γεγονός που συνεπάγεται χαμηλό κίνδυνο ενδογαμίας (μια σοβαρή επιπλοκή σε είδη με χαμηλή πυκνότητα πληθυσμού). Ως εκ τούτου, η επιστροφή τού εν λόγω, πρώην απειλουμένου, είδους αποτελεί αληθινή επιτυχία στην προσπάθεια διατήρησης της Φύσης. Η ιστορία δείχνει επίσης, με ποιόν τρόπο, οι τοπικές προσπάθειες για την προστασία ενός είδους μπορεί να είναι επιτυχείς και σημαντικές για τη διατήρηση της εξελικτικής δυνατότητας. [83][84][85]
Στην Ελλάδα, αντιθέτως, η κατάσταση παραμένει πολύ κακή. Είναι το σπανιότερο αρπακτικό πτηνό στη χώρα, που βρίσκεται στα όρια της εξαφάνισης. [86] Και όμως, στα μέσα του περασμένου αιώνα, οι θαλασσαετοί φώλιαζαν σε πολλές περιοχές στα ηπειρωτικά, καθώς και σε αρκετά νησιά. Είναι χαρακτηριστικό ότι, μέχρι το 1940, υπήρχαν αναπαραγόμενα ζευγάρια στην ευρύτερη περιοχή της Θεσσαλονίκης. Ωστόσο, στις αρχές της δεκαετίας του ’60 υπήρχαν 10-12 ζευγάρια στον Έβρο [87] και το 1994, μόλις 1-4 ζευγάρια (!) υπήρχαν σε όλη την επικράτεια, [88] σε θέσεις που παρέμεναν μυστικές. Η καταστροφή των βιοτόπων του (αποξηράνσεις, δασική εκμετάλλευση κ.ο.κ.), τα δηλητηριασμένα δολώματα, η λαθροθηρία και η συλλογή αβγών, αποτελούσαν τα βασικά αίτια. [89]
Κατά την διάρκεια του χειμώνα εμφανίζονται περισσότερα άτομα, κυρίως νεαρά και μη-ώριμα, αλλά και πάλι σε πολύ περιορισμένους αριθμούς στην Μακεδονία και την Θράκη. Όσες, σπανιότατες, καταγραφές έχουν γίνει στα νησιά της Ν. Ελλάδας οφείλονται, πιθανότατα, σε παραστρατημένα άτομα που ακολουθούν τον μεταναστευτικό διάδρομο των ακτών της Τουρκίας. [90][91]
Παρά τις συνεχιζόμενες προσπάθειες, ειδικά στην Ελλάδα, το είδος εξακολουθεί να κατατάσσεται ως Κρισίμως Κινδυνεύον CR [D]. [92]
Το είδος είναι προστατευόμενο, για ολόκληρο τον αναπαραγόμενο και διαχειμάζοντα πληθυσμό της χώρας (περιοχές του δικτύου ΖΕΠ/Natura 2000). Τοπικά, όπως στην Δαδιά, επωφελείται στην διατροφή του από την ταΐστρα για τους γύπες. Ωστόσο, απαιτείται αυστηρή προστασία των εναπομεινάντων ζευγαριών και των θέσεων φωλιάσματος, καθώς και των περιοχών διαχείμασης και τροφοληψίας του είδους, ιδιαίτερα όσον αφορά στην λαθροθηρία και την χρήση κυνηγετικών σκαγιών (που περιέχουν Pb) στους υγρότοπους. Χρειάζεται επίσης διερεύνηση των απειλών που αντιμετωπίζει το είδος, όπως η επίδραση των βαρέων μετάλλων, καθώς και μελέτη της αναπαραγωγικής του βιολογίας και οικολογίας. Θα πρέπει επίσης να διερευνηθεί και η παροχή συμπληρωματικής τροφής (ταΐστρες), τουλάχιστον σε κάποια ζευγάρια, κατά την θερινή περίοδο. [93]
Ο Θαλασσαετός απαντά στον ελλαδικό χώρο και με τις ονομασίες Πύγαργος, Ασπροκέφαλος και Ασπρονούρης (Ικαρία). [94]
Ο Θαλασσαετός είναι ημερόβιο αρπακτικό πτηνό, ένας από τους αετούς που απαντούν και στον ελλαδικό χώρο. Η επιστημονική ονομασία του είδους είναι Haliaeetus albicilla και περιλαμβάνει 2 υποείδη.
Στην Ελλάδα, όπως σε όλη την Ευρώπη, απαντά το υποείδος H. a. albicilla (Linnaeus, 1758).
Ο θαλασσαετός είναι το σπανιότερο επιδημητικό αρπακτικό πτηνό της Ελλάδας και κινδυνεύει με άμεση εξαφάνιση (βλ. Κατάσταση στην Ελλάδα).Ак куйруктуу суу бүркүт (Haliaeetus albicilla), (Linnaeus, 1758):
Түндүккө карай Колңск жарым аралга чейин, Евразиянын жарымынан түштүктү көздөй Орто Азия жана Монголияга чейин жетет . Кыргызстанда Чүй өрөөнү менен Ысыккөлдө жана Түштүк Кыргызстандын сууларында кездешет .
Балыктарга жана сууда сүзүүчү куштарга бай, уя салууга ыңгайлуу, бийик бак-дарактары же жарлары бар көлдөрдүн, дарыялардын жана деңиздердин жээктери .
Республика боюнча болгону 25-30 особго чейин кыштайт . ==Жашоо тиричилиги (жашоо циклдары)==Кышташ үчүн гана учуп келет. Уясында 1ден 4кө чейин жумуртка, аны 35-40 суткада басып чыгарат.
Көлмөлөрдүн жээктерин чарбага пайдалануу, азыгынын жетишпестиги, түздөн-түз кырып жоготуу.
Колго багып көбөйтөт .
Кыргызстанда алынган аңчылыктын эрежесине ылайык атууга тыюу салынган. «Жапайы фаунанын жана флоранын жоголуп бара жаткан түрлөрдү соода-сатык кылуу боюнча эларалык конвенциясынын» 1-тиркемесине киргизилген .
Кыштоочу жерлерин сактоо, коргоо. Массалык маалымат каражаттары аркылуу түрдү коргоо боюнча пропаганда жүргүзүү. Колго багып көбөйтүү боюнча питомникти уюштуруу.Кыштоочу жерлеринде чыныгы санын аныктоо жана жем берүүнү уюштуруу. Чектөөчү факторлорду изилдөө.
VI категория, Nearly Threatened, NT. Саны азайып бара жаткан сейрек кездешчү куш. Дүйнөлүк фаунанын суубүркүттөрүнүн 8 түрдөн бир түрү жана Кыргызстандын фаунасынан 2 түрдүн бирөө. Номинативдүү түрчөсү кыштайт.

Ак куйруктуу суу бүркүт (Haliaeetus albicilla), (Linnaeus, 1758):
Арлан-белахвост (па-лацінску: Haliaeetus albicilla) — драпежная птушка з атраду сокалападобных (Falconiformes), сямейства ястрабіных (Accipitridae). Занесены ў Чырвоную кнігу Беларусі[1].
Даўжыня цела арлана-белахвоста — ад 70 да 100 сантымэтраў, размах крылаў — ад 200 да 250 сантымэтраў[2], маса — ад 4 да 7 кіляграм. Хвост кароткі, клінавіднай формы. Пер’е дарослай птушкі бурага колеру, галава й шыя з жаўтаватым, колеру вохры асьвятленьнем, хвост белы, што дало назву ўсяму віду. Дзюба ў параўнаньні да іншых драпежных птушак вельмі вялікая й моцная, сьветла-жоўтага колеру, таксама як і васкавая скура. Ірыс вока таксама сьветла-жоўты. У адрозьненьне ад беркута (Aquila chrysaetos) лапы арлана-белахвоста не пакрытыя пер’ем да самых пальцаў. Маладыя птушкі цёмна-бурага колеру, дзюба і васкавая скура цёмна-шэрыя. З кожнай лінькай маладыя арланы-белахвосты станавяцца ўсё больш падобнымі на дарослых жывёл, а ў пяцігадовым узросьце птушка носіць цалкам дарослую вопратку. Самкі арлана-белахвоста значна большыя па памерах і маюць большую масу за самцоў. У планірумым палёце птушка трымае шырокія, дошкападобныя крылы гарызантальна. Пасьля чорнага грыфа (Aegypius monachus), барадача (Gypaetus barbatus) і белагаловага сіпа (Gyps fulvus) арлан-белахвост зьяўляецца чацьвертай па велічыні птушкай Эўропы. Гнёзды масіўныя, на верхавінах высокіх (15-30 м) дрэў[2][3]. Утварае верныя пары. Прылятае ў сакавіку-красавіку. Нясе звычайна 2 (радзей 1, 3) белыя яйкі. Птушаныяты вылятаюць напрыканцы чэрвеня - у пачатку жніўня[2].
Падвіды арлана-белахвоста на сёньняшні час невядомы. Раней арланаў-белахвостаў Грэнляндыі адрозьнівалі ад намінатнай формы як асобны падвід, але сёньня гэты падзел не вытрымлівае крытыкі. Па сваім зьнешнім выглядзе, паводзінах і экалёгіі арлан-белахвост вельмі падобны на амэрыканскага белагаловага арла (Haliaeetus leucocephalus), што для некаторых аўтараў стала падставай дзеля аб’яднаньня двух відаў у супэрвід.
Такавальная «песьня» арлана-белахвоста мае аднасна высокія й крыху хрыплаватыя ноткі, якія напрыканцы становяцца ўсё вышэй, пераважна дуэтам і нагадваючы «клю, клю, клю, клю, клю»; пры гэтым птушка закідвае галаву ўверх. З адносна вялікай адлегласьці крык арлана-белахвоста чымсьці нагадвае голас чорнага дзятла (Dryocopus martius). Птушка падае голас амаль што выключна каля непасрэднай блізасьці гнязда, пераважна на досьвітку альбо з надыходам цемнаты. Калі нешта здараецца з гняздом, дарослыя птушкі несупыньна выкрыкваюць хрыплае й абрубленае «ак, ак, ак, ак, ак», такі ж голас падаюць маладыя арланы-белахвосты ў гняздзе пры набліжэньні.
Жыцьцёвы арэал арлана-белахвоста цягнецца доўгай паласой па ўмераных, таежных і арктычных зонах Эўропы і Азіі ад Ісьляндыі да Камчаткі. Распаўсюджаны таксама й у Грэнляндыі. У Эўропе тэрыторыі гнездаваньня арлана-белахвоста распрасьціраюцца з поўначы на поўдзень ад крайняга поўдня Нарвэгіі да поўдня Грэцыі. У Сярэдняй Азіі паўдневая мяжа гнездаваньня праходзіць прыкладна па паўднёвай мяжы тайгі, на поўначы мяжа жыцьцёвага арэалу праходзіць па Ізраілі, Турэччыне, Іране, Іраку й Казахстане. Селіцца арлан-белахвост каля вялікіх водных масіваў — на ўзьбярэжжах, непадалёку ад вялікіх азёраў, рэк, на вялікіх балотах[2]. У Цэнтральнай Эўропе арлан-белахвост засяляе ў першую чаргу «леса-азёрныя ландшафты». У Нямеччыне, напрыклад, самыя высокая шчыльнасьць засяленьня тэрыторыяў арланам-белахвостам у асяродзьдзі Мюрытца на зямлі Мэкленбург — Пярэдняя Памяранія, а таксама ў рэгіёне Обэрлаўзіц у Саксоніі. Таксама пашыраны ў Паўночнай Афрыцы[2]. Занесены ў чырвоную кнігу Беларусі (у 1978 годзе) і Расеі[4]. На тэрыторыі Беларусі сустракаецца у ляндшафтным заказьніку «Стронга», батанічным заказьніку рэспубліканскага значэньня «Баранавіцкі»[5]. Большая частка гнездаваньняў знаходзіцца ў Віцебскай вобласьці[2]. У 2014 годзе колькасьць пар арлана-белахвоста ў Беларусі ацэньвалася ў 85-105 пар і працягвае павялічвацца[6]. Паводле дасьледаваньня, праведзенага ў 2011-2013 гадах, колькасьць пар арлана-белахвоста ў Палескім дзяржаўным радыяцыйна-экалягічным запаведніку ацэньвалася ў 15-20 пар[7]. У Белавескай пушчы і Дзікім балоце жылі па 1-2 пары[8]. Упершыню арлан-белахвост быў заўважаны на тэрыторыі беларускай часткі Белавескай пушчы ў 1975 годзе (на возеры Ляцкія)[9]. У 2002-2003 годах арлан-белахвост быў заўважаны каля возера Хмялеўскае. Пасьля 2004 году пара дарослых і малады арлан назіраліся на азёрах Ляцкія і Перароўскае. У 2017 годзе арлан-белахвост назіраўся паміж вадасховішчам Ляцкае і сажалкай Прамежная. Ад 1993 да 2006 году іншая пара птушак назіралася каля вадасховішча Сіпурка. У 2007 годзе было выяўленае гняздо ў Хвойніцкім лясьніцтве[3].
У час вывядзеньня птушанят арлан-белахвост корміцца пераважна рыбай і вадаплаўнымі птушкамі, млекакормчыя маюць у яго рацыёне адносна невялікую ролю. Рыбу арлан-белахвост звычайна здабывае сам, але не брыдзіцца таксама мёртвай і напалову стухленай рыбай. Віды, якія насяляюць жыцьцёвы арэал арлана-белахвоста, дамінуюць пераважна таксама й у харчавальным спэктруме птушкі.
У зямлі Шлезьвіг-Гальштайн, напрыклад, працэнтныя суадносіны рыбы й вадаплаўчых птушак у рацыёне арлана-белахвоста складаюць адпаведна 73% і 24%. Астатнія 3% прыходзяцца на млекакормчых, у першую чаргу на трусоў і палявых зайцаў. У межах Палескага дзяржаўнага радыяцыйна-экалягічнага запаведніка доля рыбы ў рацыёне складае 48,1%, доля птушак - 41,7%[10].
Лічыцца, што выява на польскім гербе — стылізаваны арлан-белахвост.
Дарослы арлан-белахвост — асёдлая птушка на тэрыторыі амаль што ўсёй Эўропы й застаецца ў сваіх рэўерах круглы год.
![]() — сховішча мультымэдыйных матэрыялаў
— сховішча мультымэдыйных матэрыялаў
Арлан-белахвост (па-лацінску: Haliaeetus albicilla) — драпежная птушка з атраду сокалападобных (Falconiformes), сямейства ястрабіных (Accipitridae). Занесены ў Чырвоную кнігу Беларусі.
БгъащхъуэкӀэху (лат-бз. Haliaeetus albicilla) — къашыргъэ лъэпкъым щыщщ.
ПӀащэщ, и кӀыхьагъыр см. 77-100-м нос, и зы дамэр см. 57-69-рэ, къешэч ч. 6-м щӀигъу, теплъэкӀэ бгъащхъуэм ещхьщ, кӀэр тэхуфэщ.
Хамэ къэрал бжыгъэм щыӀэщ. Абгъуэ щещӀ лъагэу Ӏэтауэ жыгыщхьэм, къырым. Нэхъыбэу уащыпэщӀохуэ хы Ӏуфэхэм, хыкъумхэм, псыежэххэм я гъунэгъуу.
Ӏусыр икъукӀэ зэщымыщщ, нэхъыбэу — бдзэжьей, псыбабыщ, къазхэкӀ.
БгъащхъуэкӀэху (лат-бз. Haliaeetus albicilla) — къашыргъэ лъэпкъым щыщщ.
Белоопашести орел или морски орел (науч. Haliaeetus albicilla) — голема граблива птица од фамилијата на јастребите. Оваа птица ја имаме и во Македонија.
Белоопашестиот орел се размножува во северна Европа и северна Азија. Најголема популација од овој орел има на крајбрежјето на Норвешка. Во 2008 година популацијата изнесуваше 9.000 до 11.000 двојки. Птицата е претежно резидентна (постојан жител), освен оние кои живеат многу на север, во источна Скандинавија и Сибир. Се селат на југ зимно време. Птиците од источна Русија ретко мигираат во Алјаска.
Мала издвоена популација се постојани жители на југозападен Гренланд и западен Исланд. Порано бил предложен да се издвои како посебен подвид groenlandicus заради големината и пропорциите на телото. Сега, овој вид се смета за монотипичен. Гренландскиот белоопашест орел е релативно нова популација која нема акумулирано многу уникатни карактеристики. Тие се демографски изолирани и заслужуваат специјална заштита.
Белоопашестиот орел е криптичен пар со белоглавиот орел.
Белоопашестиот орел е многу голема птица, со должина од 66 до 94 см и распон на крилјата од 1.78 до 2.45 метри, што во просек е најголемиот од сите видови.[2][3] Женките тежат од 4 до 6.9 кг, и се малку поголеми од мажјаците, кои тежат од 3.1 до 5.4 кг.[2] Најтежок орел од овој вид е забележан во Шкотска со 7.5 кг, а неодамна е регистрирана огромна женка во Гренланд со распон на крилјата од 2.53 метри.[4][5] Овој вид има широки крилја, голема глава и голем дебел клун. Возрасните се главно сивкавокафеави, освен што им се малку посветли во главата и вратот, имаат црни летачки пердуви и препознатливата бела опашка. Сите голи делови им се жолти, вклучувајќи ги и клунот и нозете. Кај младенчињата опашка и клунот се потемни, а опашката станува бела со темна црна лента кога птицата е речиси возрасна. Комбинацијата на сивкавокафеавата боја, широките, рамномерни крилја, белата опашка, силниот жолт клун и големите димензии го прават белоопашестиоѕ орел непогрешно препознатлив меѓу орлите.[2]
Утврдено е дека некои индивидуи живеат над 25 години, [6] но 21 година им е просечен животен век.[7]
Исхраната на белоопашестиот орел е променлива, опортунистичка и сезонска. Грабливците вклучуваат риби, птици и цицачи во својот лов, а многу индивидуи живеат крадејќи ја храната од други животни и птици, како корморани, галеби и други грабливи птици.[2] Мршата е често основна храна за време на зимата, особено рибите и копитарите, но и сите други животни, вклучувајќи го и човекот.[2][8] Но, орлите се и моќни ловци, исто така. Секоја риба што ќе се доближи до површината е потенцијален улов за белоопашестиот орел.[2] Рибниците и езерцата со крапови, ако е возможно, често ги експлоатираат.[2] Иако понекогаш убиваат копнени птици, сепак, нивна мета се водните птици.[2]На Балтикот, тие се хранат претежно со морски птици, а неодамна е регистрирано дека нападнеале и изеле голем корморан, а во одредени ситуации знаат да уништат и цели колонии.[9] Во Естонија, 25 двојки морски орли биле набљудувани како симултано убиваат колонија корморани.[10] Сепак, најчест плен на белоопашестиот орел се: морските нуркачи, нуркачите, патките, гуските, па дури и лебедите; а од цицачите, сите животни од големина на глушец па до јагне.[2]
Белоопашестиот орел сексуално созрева на возраст од четири до пет години. Се спарува за цел живот, но ако едниот умре, се заменува со друг партнер. Врската се создава кога ќе се одбере местото за гнездење. Тие имаат карактеристично воздушно додворување кое кулминира со фаќање за канџите и заедничко спуштање кон земјата правејќи разни пируети. За тоа време се огласуваат, за разлика од златниот орел. Огласувањето понекогаш може да биде дует. Гнездото е огромна градба од гранки, сместена на дрво или на крајбрежни гребени. Тие се територијални, па гнездото често го користат со години, па дури и со децении. Се случува гнездото да го користат и следните генерации, па така, во Исланд едно гнездо било користено над 150 години.[11] Територијата на белоопашестиот орел е меѓу 30 и 70 км², на крајбрежните локации. На копно, се среќава крај езера и реки. Територијата на овој орел може да се преклопи со територијата на златниот орел, а конкуренцијата меѓу нив не е голема. Златниот орел повеќе сака планински предели и пусти рамнини, а белоопашестиот, пак, сака крајбрежја и море. Спарените двојки несат едно до три јајца годишно. Ги квачат двата родитела 38 дена. Откако ќе се испилат, пилињата се релативно толерантни едно кон друго, иако првоиспиленото е секогаш поголемо и подоминантно за време на хранењето. Претежно женката е таа што ги одгледува и ги храни младенчињата, а мажјакот е во близина и ја презема грижата одвреме-навреме. Младите се способни да се хранат за пет-шест недели, а се оперјуваат за 11-12 недели, останувајќи во близина на гнездото и зависејќи од родителите уште 6 до 10 недели.
Вишокот пилња понекогаш се земани од гнездото за да се искористат во програмата за обновување на видот во подрачјата каде изумреле. Ако останат во гнездото, тие ќе бидат убиени од првороденото, порано или подоцна, како кај повеќето орли. Во ваквите програми птиците се одгледувани на тој начин што нема да го гледаат човекот што ги храни, сè додека не пораснат доволно за да се хранат самостојно.
Белоопашестиот орел е алфа-предатор. Тие ја доживуваат биоакумулацијата од загадената животна средина присутна во нивниот плен, а исто така страдаат од овчарите и ловците на дивеч кои сметаат дека орлите се закана за овците и дивечот. Во периодот 1800-1970, белоопашестиот орел претрпе драматичен пад во популацијата и стана исчезнат вид во многу региони на западна, централна и јужна Европа. Интензивната конзервација, забраната за лов, заштита на местата за размножување, зимската исхрана, доведе до обновување на многу локални популации.
Белоопашестиот орел е национална птица на Германија и го има на војничките амблеми. Се верува дека на војничките амблеми на Полска и Србија е белиот орел.[12] Морскиот орел обично е претставуван со риба во клунот за да се разликува од обичниот.
Во Оркни, (Шкотска) коски од морски орел се пронајдени во гробници стари 6000 години, што сугерира дека птиците биле одгледувани од тогашните луѓе, а тврдењето се поткрепува и со цртежи на орлите во пештерите во таа област.[7]
На Шетландските Острови, рибарите веруваат дека штом ќе се појави орелот, рибите испловуваат на површина со стомакот нагоре, па затоа некои рибари користат маст од орел да го зголемат својот улов.[7]
Live view of a nest with 2 eglets is transmitted since April 10, 2012 from Poland at http://www.lasy.gov.pl/bielik
Белоопашести орел или морски орел (науч. Haliaeetus albicilla) — голема граблива птица од фамилијата на јастребите. Оваа птица ја имаме и во Македонија.
Боруллуо эбэтэр ала тойон, (лат. Haliaeetus albicilla, нууч. орлан-белохвост) — Кыырдар кэргэннэригэр (Accipitridae) киирэр бөдөҥ тыҥырахтаах көтөр.
Этин-сиинин устата 70 - 90 см, кынаттарын далааһына — 200 - 230 см, ыйааһына — 4 - 7 киилэ. Кутуруга кылгас, үрүҥ өҥнөөх. Тумса атын тыҥырахтаах көтөрдөртөн бөдөҥ, сырдык араҕас өҥнөөх.
Евразия хоту өттүгэр уонна орто балаһатыгар, ол иһигэр Саха сиригэр, уйаланар. Кыстыыр сирдэрэ: Кэриэй тумул арыыта, Кытай, Япония, Индия.
2013 сылы Арассыыйа көтөрдөрү көмүскүүр Сойууһа Боруллуо сылынан биллэрбитэ.

Боруллуо эбэтэр ала тойон, (лат. Haliaeetus albicilla, нууч. орлан-белохвост) — Кыырдар кэргэннэригэр (Accipitridae) киирэр бөдөҥ тыҥырахтаах көтөр.
Этин-сиинин устата 70 - 90 см, кынаттарын далааһына — 200 - 230 см, ыйааһына — 4 - 7 киилэ. Кутуруга кылгас, үрүҥ өҥнөөх. Тумса атын тыҥырахтаах көтөрдөртөн бөдөҥ, сырдык араҕас өҥнөөх.
Евразия хоту өттүгэр уонна орто балаһатыгар, ол иһигэр Саха сиригэр, уйаланар. Кыстыыр сирдэрэ: Кэриэй тумул арыыта, Кытай, Япония, Индия.
2013 сылы Арассыыйа көтөрдөрү көмүскүүр Сойууһа Боруллуо сылынан биллэрбитэ.
Диңгеҙ бөркөтө, балыҡ бөркөтө, аҡҡойроҡ бөркөт, аҡкүт (рус. Орлан-белохвост , лат. Haliaeetus albicilla)— ҡарсығалар ырыуынан булған йыртҡыс ҡош. Башҡортостан Республикаһының Ҡыҙыл Китабына индерелгән.
Ҡаҙҙан ҙурыраҡ. Осҡанда ҡанат осондағы ҡауырһындары бармаҡ һымаҡ күренә. Дөйөм төҫө һорғолт көрән, башы һәм муйыны һарғылт аҡ, ҡойроғо ап-аҡ. Беҙҙәге башҡа ҙур йыртҡыс ҡоштарҙан аҡ төҫтәге ҡойроғо менән айырыла.
Тауышы яңғырауыҡлы: «ҡыййй-ҡыййй-ҡыййй» йәки ҡалын һәм тоноҡ: «ҡроҡ-ҡроҡ».
Ҙур күл һәм йылға буйҙарында йәшәй Төп аҙығы — балыҡ. Ваҡ йәнлек һәм ҡоштарҙы ла аулай. Күсмә ҡош. Һирәк осрай. Ояһы ағас баштарында була. Ерәнһыу таплы 1—3 (күберәк 2) бөртөк аҡ йомортҡа һала.
Диңгеҙ бөркөтө, балыҡ бөркөтө, аҡҡойроҡ бөркөт, аҡкүт (рус. Орлан-белохвост , лат. Haliaeetus albicilla)— ҡарсығалар ырыуынан булған йыртҡыс ҡош. Башҡортостан Республикаһының Ҡыҙыл Китабына индерелгән.
Елга́ каракошы́ (аккойрык бөркет, Haliaeetus albicilla) - карчыга кошлар гаиләлегеннән ерткыч кош.
Евразиянең урман һәм урман-дала зоналарының зур сулык ярлары буенда тереклек итә. ТРда, башлыча, Идел һәм Кама елгалары үзәннәрендә очрый. Куйбышев һәм Түбән Кама сусаклагычлары төзелгәч, елга каракошының саны шактый кими, хәзерге вакытта 30 пардан күбрәк исәпләнә. Оя коручы күчмә төр, кайберләре кышлый.
5-6 яшьтә җитлегәләр, гадәттә ике йомыркага утырып бала чыгаралар. Гәүдә озынлыгы 1 м га кадәр. Канат колачы 2,5 м га җитә. Олы бөркетнең авырлыгы 3 тән 6,5 кг га кадәр, ана затлар аталардан эрерәк. 2009 елда Иж елгасы буенда балыкчылар куйган ятьмәләргә уралып, табигать инспекторлары кулына 9,7 кг авырлыгындагы кош эләккән.[15]
Төсе көрән, башы һәм гәүдәнең түбәнге өлеше аксылрак. Канатлары киң, озын. Койрыгы кыска, чөйсыман, ак төстә. Акларының түбәнге ягы каурыйланмаган. Томшыгы зур, ыргаксыман, сары төстә. Елга каракошы биек кәүсәле карт урманнарда оялый. Ояны февраль-апрельдә ясый башлый. Биек агачларга зур оя ясап, аны күп еллар рәттән куллана. Соргылт төстә 1-3 йомырка сала, ояда ана һәм ата кошлар чиратлашып утыра. Балыклар, имезүчеләр (куян, ондатра, йомран), кошлар (үрдәк, акчарлак, кыр тавыклары), үләксәләр белән туклана.
Елга каракошы Татарстан Республикасы һәм Русиянең Кызыл Китапларына кертелгән һәм аны саклау чаралыры каралган күп кенә бөтендөнья документларына кертелгән. Татарстанның зур сусаклагычлар һәм елгалар янына урнашкан районнарында күренәләр алар. Март урталарында кайталар, октябрь азагында җылы якларга очып китәләр, сирәк кенә кышлаган экземплярлар да күзәтелә.[15]
Елга́ каракошы́ (аккойрык бөркет, Haliaeetus albicilla) - карчыга кошлар гаиләлегеннән ерткыч кош.
Евразиянең урман һәм урман-дала зоналарының зур сулык ярлары буенда тереклек итә. ТРда, башлыча, Идел һәм Кама елгалары үзәннәрендә очрый. Куйбышев һәм Түбән Кама сусаклагычлары төзелгәч, елга каракошының саны шактый кими, хәзерге вакытта 30 пардан күбрәк исәпләнә. Оя коручы күчмә төр, кайберләре кышлый.
5-6 яшьтә җитлегәләр, гадәттә ике йомыркага утырып бала чыгаралар. Гәүдә озынлыгы 1 м га кадәр. Канат колачы 2,5 м га җитә. Олы бөркетнең авырлыгы 3 тән 6,5 кг га кадәр, ана затлар аталардан эрерәк. 2009 елда Иж елгасы буенда балыкчылар куйган ятьмәләргә уралып, табигать инспекторлары кулына 9,7 кг авырлыгындагы кош эләккән.
Төсе көрән, башы һәм гәүдәнең түбәнге өлеше аксылрак. Канатлары киң, озын. Койрыгы кыска, чөйсыман, ак төстә. Акларының түбәнге ягы каурыйланмаган. Томшыгы зур, ыргаксыман, сары төстә. Елга каракошы биек кәүсәле карт урманнарда оялый. Ояны февраль-апрельдә ясый башлый. Биек агачларга зур оя ясап, аны күп еллар рәттән куллана. Соргылт төстә 1-3 йомырка сала, ояда ана һәм ата кошлар чиратлашып утыра. Балыклар, имезүчеләр (куян, ондатра, йомран), кошлар (үрдәк, акчарлак, кыр тавыклары), үләксәләр белән туклана.
Елга каракошы Татарстан Республикасы һәм Русиянең Кызыл Китапларына кертелгән һәм аны саклау чаралыры каралган күп кенә бөтендөнья документларына кертелгән. Татарстанның зур сусаклагычлар һәм елгалар янына урнашкан районнарында күренәләр алар. Март урталарында кайталар, октябрь азагында җылы якларга очып китәләр, сирәк кенә кышлаган экземплярлар да күзәтелә.
Усны цагаан сүүлт бүргэд (мөн Цагаансүүл нөмрөгбүргэд) нь махчин шувуу юм. Биеийн урт 69-92 см, далавчаа дэлгэсэн урт нь 182-244 см байдаг. Эм бүргэд нь 4-6.9 кг жинтэй ба эр нь арай хөнгөн 3.1-5.4 кг байна. Дундажаар 21 наслах ба 25 хүртэл насалсан тохиолдол бий. Усны шувууд өндөглөдөг, гуужин зусдаг, загасаар баян, орчиндоо өндөр мод, хадан цохио, бүхий томоохон нуур, гол мөрний дагуу амьдардаг. Манай орны томоохон нуур, гол мөрөн ихтэй нутагт голдуу дулааны улиралд, заримдаа өвөл ч тааралддаг. Усны цагаан бүргэд нь загас, шувуу, улай сэг мөн зарим жижиг хөхтөн гээд олон төрлийн зүйлээр хооллоно. Нэг өдөрт 500-600 гр хоол тэжээл иддэг.
Холзан білохвіст (Haliaeetus albicilla) є найвекшый хищ і разом і найвекшый евроорел, роспятя крыл досягує аж 2,5 м. Лїтать з натягнутыма лїтовыма пірками. Стары птахы мають жовтый гаковый дзёбак і куртый білый хвіст. Молоды екземплары мають тмаво зафарбленый дзёбак і тмавшый хвіст. Неопірены ногы суть жовты. Самець і саміця ся взаємно одрізняють лем розмірами.
Довжка тїла холзана білохвоста є до 69-92 cm, вага у самця коло 4 кґ, у саміцї 7 кґ. Роспятя крыл може досягнути аж 2,5 м. Фарба тмавобура лем хвіст білый, припадно і іншы світлїшы области на голові і шыї. При лїтаню ся легко познать, подля характерістічного взгляду шырокых крыл з ростягнутыма пірками. Хвіст є клиновый, ёго фарба за през жывот мінить. Переходить од бурой о молодых птахів, через буробілу марморовану до білой з бурыма краями у поглавно дорослых екземпларів.
Холзан білохвіст (Haliaeetus albicilla) є найвекшый хищ і разом і найвекшый евроорел, роспятя крыл досягує аж 2,5 м. Лїтать з натягнутыма лїтовыма пірками. Стары птахы мають жовтый гаковый дзёбак і куртый білый хвіст. Молоды екземплары мають тмаво зафарбленый дзёбак і тмавшый хвіст. Неопірены ногы суть жовты. Самець і саміця ся взаємно одрізняють лем розмірами.
Шур хӳреллĕ ăмăрткайăк (е тинĕс ăмăрткайăкĕ) - кĕлеткипе хуртан пысăкрах. Çăмартисем (1-3) шурă, тутăх тĕслĕ пăнчăсемлĕ. Ку кайăк мăшăрĕсем пĕрре пĕрлешсен мĕн виличчен те уйрăлмаççĕ. Ами пĕр улшăнмасăр 40 кун таран пусра ларать. Чĕпписене икĕ уйăх хушши тăрантарса ӳстереççĕ. Çурла уйăхĕнче чĕпписем хăйсем тĕллĕн пурăнма пуçлаççĕ. Апачĕ вĕсен пуян. Пулăсене - çăрттан, çупах, шампа - тытать, шăшисемпе йĕкехӳресене тапăнать, кăвакалсене, чарлăксене, шыв чăххисене тытса çиет. Тĕрлĕ кайăк çăмартисене шăтарса ĕçет, кукшаксемпе йытă çурисем çине те тапăнни пулкалать. Ытларах вĕсем чирлĕ, вăйсăр чĕрчунсене тытаççĕ. Пирĕн пата ака уйăхĕнче вĕçсе килеççĕ. Авăн уйăхĕнче кăнтăралла вĕçеççĕ. Хальхи вăхăтра вĕсен хисепĕ пур çĕрте те пĕчĕкленсе юлнă, ку ăмăрткайăка Хĕрлĕ кĕнекене кĕртнĕ.
कङ्कम चील नेपालमा पाइने एक प्रकारको चराको नाम हो । यसलाई अङ्ग्रेजीमा ह्वाइट-टेल्ड इगल (White-tailed Eagle) भनिन्छ ।
पांढऱ्या शेपटीचा गरुड (शास्त्रीय नाव: हॅलिएईटस ॲल्बिसिला) हा एक मोठा पक्षी आहे. हा घार, ससाणे आणि गरुड कुळात मोडतो.
पांढऱ्या शेपटीचा गरुड (शास्त्रीय नाव: हॅलिएईटस ॲल्बिसिला) हा एक मोठा पक्षी आहे. हा घार, ससाणे आणि गरुड कुळात मोडतो.
Garaguş (Akguýruk) – (haliaeetus albicilla). Türkmenistanyň Milli tebigat hazynasyna girýän bu haýwan Türkmenistan üçin goramaga iň kritik bir sürüsidir.
Ol uly yrtyjy guş. Ýetişen uly guşlaryň gyska ak guýrugyndan başka erleriniň eleginiň renki goňurdur.[1]
Türkmenistanda onuň höwürtgelýändigi barada ähtibarly maglumat ýok, ýöne Türkmenistanyň serhedine golaý demirgazyl Eýranda akguýruk garaguşlar höwürtgelýärler. Türkmenistanda tomsuna olar ýeke-täklikde gelýär.[1]
Garaguş (Akguýruk) – (haliaeetus albicilla). Türkmenistanyň Milli tebigat hazynasyna girýän bu haýwan Türkmenistan üçin goramaga iň kritik bir sürüsidir.
Гьуьлуьн лекь гьакIни Лацу тум галай лекь (лат. Haliaeetus albicilla) — чинеругрин сихилдик акатзавай луван ничхир , йашамиш жезвай Евразида ва Гренландида. Вичин йаргъивал — 70-90 см (лувар ахъаяла: 200—230 см), заланвал — 3.1-5.4 (итим) — 4-6.9 (дишиди) кг.
КIайн цIога долу аьрзу — (en. White-tailed Eagle), (оьрсаша "Орлан-белохвост" олу). КIайн цIога долу аьрзу яккхийрчех аьрзу ю. Цуьнан цIога дечиг йоькъачу зайлан кепехь ду. Бос мокха бу, кортий, лахара деггIий жимма сирло ду цуьнан. ЦIога кIайн ду, зIок можа ю.
КIайн цIога долу аьрзу — (en. White-tailed Eagle), (оьрсаша "Орлан-белохвост" олу). КIайн цIога долу аьрзу яккхийрчех аьрзу ю. Цуьнан цIога дечиг йоькъачу зайлан кепехь ду. Бос мокха бу, кортий, лахара деггIий жимма сирло ду цуьнан. ЦIога кIайн ду, зIок можа ю.
Тундрера дуьйна есачу аренашка, лаьмнашка кхаччалц массо а мехкашкахь ю и тайпа аьрзунаш. Церан дахар хIурдан йистошкахь, хин бердашкахь, тогIешкахь, ламанийн даккъашкахь ду. Iа доьлчи къилбаседехьара йовхачу метте охьайогIу уьш. Иштта ду церан дIай-схьай кхалхар. Яккхийра шелонаш йоцчохь цхьана меттехь ду церан дахар. Диттийн генех, синтарех боккха бен бо оцу аьрзуна доккхачу диттан боьххьехь. Дуккху а шерашкахь оцу цхьана бенахь йоху цо кIорнеш. Бен атта дIа ца тосу цо шена адамаша новкъарло ца йичи. Бен бар доладо март-апрель баттахь. ХIоа 2-3 до. КIайн хуьлу уьш. Ларлуш ю иза. Адама герга ца кхочуьйту. Дукъа лекха хьалайолий дац цуьнан хIаваэхь хьийзар. Лахахула хIаваэхь го туьйсуш лоху цо ижо: моьлкъарчий, дехкий, чIерий, пхьагалаш, акха бедаш, кхин долу олхазарш. Ламанан чхар тIехь, я дечиган юьхка тIехь хохий а Iа иза ижо ларош. Вукху аьрзунийчул ядар хала ду цуьнан. Екаран аз иштта ду "кра-кра-кра!" я "кий-кий-кий!". ЗIок йоккха хиларна а цIога кIай хиларна а, кхоьчу аьрзонех къаьсташ ю иза.Сагаан hүүлтэ бүргэд - Haliaeetus albicilla захын тундра, Хойто мүльhэн далайн эрьеhээ бэшэ тээгүүр Россин дэбисхэр дээрэ хаа яагүй ушардаг. Кольско хахад арал ба Анадырь багаар үсөөхэн тэды дайралдадаг. Уурхайлдаг газарнуудынь далайн, ехэ мүрэнүүдэй, нуур сөөрэмүүдэй эрьенүүдээр, олтирогууд дээгүүр, уурхай түхеэржэ боломоор бүдүүн томо модонуудтай газараар. Амидардаг газарайнь арга нүхэсэлнүүдэй хоёрдохи заатагүй эрилтэ гэхэдэ тэдээнэй тэжээл, хоол элбэгтэй ехэ уhанууд. Ойгүй газарнуудта уурхайгаа хабсагайнуудаар түхеэрдэг. 5-6 наhатайhаа үндэгэлжэ захалдаг, хоёр бүргэд нэгэтэ бүлэ байгуулбал, тэрэнь хори гаран жэлнүүдэй туршада hаладаггүй юм. Агнууриин тогтонижонги газартай.
The white-tailed eagle (Haliaeetus albicilla) is a very large species of sea eagle widely distributed across temperate Eurasia. Like all eagles, it is a member of the family Accipitridae (or accipitrids) which includes other diurnal raptors such as hawks, kites, and harriers. One of up to eleven members in the genus Haliaeetus, which are commonly called sea eagles, it is also referred to as the white-tailed sea-eagle.[4] Sometimes, it is known as the ern or erne (depending on spelling by sources),[5] gray sea eagle[6] and Eurasian sea eagle.[7]
While found across a very wide range, today breeding as far west as Greenland and Iceland across to as far east as Hokkaido, Japan, they are often scarce and very spottily distributed as a nesting species, mainly due to human activities. These have included habitat alterations and destruction of wetlands, about a hundred years of systematic persecution by humans (from the early 1800s to around World War II) followed by inadvertent poisonings and epidemics of nesting failures due to various manmade chemical pesticides and organic compounds, which have threatened eagles since roughly the 1950s and continue to be a potential concern. Due to this, the white-tailed eagle was considered endangered or extinct in several countries.[5][8][9][10] However, some populations have recovered well due to some governmental protections and dedicated conservationists and naturalists protecting habitats and nesting sites and partially regulating poaching and pesticide usage, as well as careful reintroductions into parts of their former range.[11][12][13]
White-tailed eagles usually live most of the year near large bodies of open water, including coastal saltwater areas and inland freshwater lakes, wetlands, bogs and rivers. It requires old-growth trees or ample sea cliffs for nesting,[5][11] and an abundant food supply of fish and birds (largely water birds) amongst nearly any other available prey.[5][11] Both a powerful apex predator and an opportunistic scavenger, it is considered a close cousin of the bald eagle (Haliaeetus leucocephalus), which occupies a similar niche in North America.[14]
The first formal description of the white-tailed eagle was by the Swedish naturalist Carl Linnaeus in 1758 in the tenth edition of his Systema Naturae under the binomial name Falco albicilla.[15][16] The genus Haliaeetus was introduced in 1809 by the French naturalist Marie Jules César Savigny in the Description de l'Égypte.[17] The name Haliaeetus is Neo-Latin for "sea-eagle", from Ancient Greek hali-, "sea-" and aetos, "eagle". The specific albicilla, "white-tailed", is from Neo-Latin albi-, "white" and cilla, "tail".[18] The Anglo-Saxon name erne means "soarer", and it is cognate to Swedish örn and Finnish aarni.[5] It has many Gaelic names, including iolar sùil na grèine or 'eagle of the sun's eye.'[19]
The white-tailed eagle is a member of the genus Haliaeetus, a monophylic group comprising 11 living species, including the closely related Ichthyophaga fish eagles which may or may not be part of a separate genus. The latter group, comprised by the lesser (Haliaeetus humilis) and the grey-headed fish eagle (Haliaeetus ichthyaetus), differ mostly in life history, being more fully devoted to fish eating and habituating wooded areas, especially in mountainous areas. In appearance the two Ichthyaetus are slenderer, longer tailed and more uniform and grey in colour than typical sea eagles. This species pair may not be genetically distinct enough to warrant division into separate genera.[20][21] Other than these Ichthyophaga-type species found farther north in Asia, Sanford's sea eagle (Haliaeetus sanfordi) of the Solomon Islands is the most atypical Haliaeetus, retaining rufous-brown plumage into adulthood (this particularly resembling the white-bellied sea eagle juvenile, likely a closely related species) more typical of juveniles in other species and it also dwells more so in dense, coastal forests where it feeds mostly on birds and mammals rather than fish and water birds.[5][22]
Outside of the genus Haliaeetus, among other extant forms, they appear to be most closely related to milvine kites and Old World vultures, based on modern forms from these subfamilies that broadly share morphological and life history traits with sea eagles: the Brahminy kite (Haliastur indus) (historically sometimes referred to as the "red-backed sea eagle") and the palm-nut vulture (Gypohierax angolensis) (which was once widely referred to as the "vulturine fish eagle"). The relation of these species to the sea eagles is partially borne out by their genetic sequencing.[5][23][24] Other groups, beyond milvine kites and Old World vulture, of modern accipitrid that are seemingly in some way related, albeit very distantly, to the sea eagles include Accipiters, harriers, chanting-goshawks and buteonines. Notably excluded from their relations are most other species referred to as "eagles", including booted eagles and snake and serpent eagles.[11][14][24][25]
The white-tailed eagle itself forms a species pair with the bald eagle. These diverged from other sea eagles at the beginning of the early Miocene (c. 10 mya) at the latest, possibly (if the most ancient fossil record is correctly assigned to this genus) as early as the early or middle Oligocene, about 28 mya.[14] A recent genetic study of mitochondrial DNA[26] is consistent with this idea. Greenlandic white-tailed eagles (proposed as H. a. groenlandicus) form, on evolutionary time scales, a relatively recently founded population that has not yet accumulated many unique genetic characteristics and may not strictly fulfill the distinction of a subspecies. However, the population appears to be demographically isolated and deserves special protection. At one time an eastern subspecies (H. a. brooksi) was proposed as well but there is little evidence supporting this as more than a case of clinal variation in coloring and size (i.e. the eastern average slightly darker and smaller than more westerly ones).[27] As in other sea-eagle species pairs, this one consists of a white-headed (the bald eagle) and a tan-headed species. They probably diverged in the North Pacific, spreading westwards into Eurasia and eastwards into North America. Like the third large northern species, Steller's sea eagle (Haliaeetus pelagicus), adults have yellow feet, beaks and eyes. Another species, likely intermediate between the white-tailed, bald and Steller's sea eagles and the Ichthyophaga type fish eagles, is the Pallas's fish eagle (Haliaeetus leucoryphus), which in life history seems to range farther from water and to higher elevations than the three northern species normally do. Due to the similar dietary and nesting habits of sea eagles, they are mostly allopatric in distribution as competition can be considerable between these eagles.[5][20]
Currently, eagles occur in the Hawaiian Islands only as vagrants, but Quaternary bones of Haliaeetus have been found on three of the major islands. An ancient DNA study published in 2015 characterized the rapidly evolving mitochondrial control region of one of these specimens.[28] DNA from a ∼3,500-year-old sea eagle skeleton found in a lava cave on Maui was sequenced. Phylogenetic analyses suggested that the Hawaiian eagle represents a distinct (>3% divergent) mtDNA lineage that is most closely related to extant white-tailed eagles. Based on fossil calibration, the Hawaiian mtDNA lineage probably diverged around the Middle Pleistocene. Thus, although not clearly differentiated in morphology from its relatives, the Hawaiian eagle likely represented an isolated, resident population in the Hawaiian archipelago for more than 100,000 years, where it was the largest terrestrial predator. The reasons for its extinction are unknown.[29]
The white-tailed eagle is one of the largest living birds of prey. It is the largest of the dozen species of eagle found in Europe and the largest eagle across its distribution, excluding the Russian Far East and (during the winter) Hokkaido, Japan, where it co-exists with its larger cousin, Steller's sea eagle. The white-tailed eagle is sometimes considered the fourth largest eagle in the world[19] and is, on average, the fourth heaviest eagle in the world. The only extant eagle species known to be more massive in mean bulk are the Steller's sea eagle (Haliaeetus pelagicus), the harpy eagle (Harpia harpyja) and the Philippine eagle (Pithecophaga jefferyi).[11][30] The white-tailed eagle measures anywhere from 66 to 94 cm (26 to 37 in) in total length with a typical wingspan of 1.78 to 2.45 m (5 ft 10 in to 8 ft 0 in).[11][31] This species may have the largest wingspan of any living eagle.[11][30] The Steller's sea eagle, which is larger in weight, total length and non-wing standard measurements, may be the closest rival for median wingspan amongst living eagles.[11] The white-tailed eagle does appear to outsize the average wingspan of the wedge-tailed eagle (Aquila audax), which is sometimes also titled the largest winged extant eagle due to an exceptionally large individual shot in 1931,[32] although the Steller's sea eagle may rival it in that respect.
In one sample from Norway, five male white-tailed eagles were found to average 2.26 m (7 ft 5 in) and eight females were found to average 2.37 m (7 ft 9 in).[33] In another sample of wild birds of unspecified origin, five males were found to average 2.1 m (6 ft 11 in) and seven females averaged 2.3 m (7 ft 7 in).[34] Record wingspans have included a specimen from Greenland which measured 2.53 m (8 ft 4 in) while another specimen apparently spanned 2.6 m (8 ft 6 in).[35][36] The bald eagle broadly overlaps in size with the white-tailed eagle. In direct comparison, the white-tailed eagle averages somewhat larger in body mass than the bald eagle and may be marginally larger in bill and talon size, although these linear aspects can be quite similar between the two species. The white-tailed eagle does have a significantly larger wing chord and average wingspan than the bald eagle, but the latter usually possesses a longer tail, resulting in a larger total length than the white-tailed eagle and a larger mean tarsal length.[5][11][37][38]
Size variation is generally a clinal trend and is normally quantified using standard measurements such as wing, tail and tarsal length, or body mass, rather than wingspan or total length. As expected for many widely distributed animals of varied lineages, the white-tailed eagle conforms to Bergmann's rule in that more northerly birds tend to outsize those found relatively closer to the Equator. Average size also decreases from west to east across its distribution.[5][26][39] The largest white-tailed eagles appear to be found in Greenland, these being slightly larger than those from Ireland, Scotland and Scandinavia and notably larger than eagles from central Europe, especially in proportions of the wing area. Those from the southerly portions of the breeding range, such as Asia Minor (principally Turkey), southern Kazakhstan, and Korea Bay, appear to be the smallest-bodied population but there have been limited measurements and published weights known for these extremely sporadic and rare Asian populations of eagle. Furthermore, weights of fully grown eagles from Greenland are not known.[5][11][34] Unlike many accipitrids, juvenile white-tailed eagles (and seemingly other sea eagles as well) are often of similar weight to the adults, although the juveniles typically have a somewhat larger average wing and tail length than the adults.[5][40] In the white-tailed eagle, body mass can typically range from 4 to 6.9 kg (8.8 to 15.2 lb) in females. The slightly smaller male may typically weigh from 3.1 to 5.4 kg (6.8 to 11.9 lb).[11]
Average weights in European white-tailed eagles can range from 4.02 kg (8.9 lb) in five males and 5.11 kg (11.3 lb) in nine females to (from the reintroduced birds of Scotland of Norwegian stock) 4.98 kg (11.0 lb) in 39 males and 6.06 kg (13.4 lb) in 43 females.[13][34] In comparison, the weight ranges for white-tailed eagles from Northeast China were claimed to be only 2.8 to 3.78 kg (6.2 to 8.3 lb) in males and 3.75 to 4.6 kg (8.3 to 10.1 lb) in females.[39] The heaviest female white-tailed eagles can apparently weigh as much as 7.5 to 8 kg (17 to 18 lb) and even males can sometimes weigh up to 6.5 kg (14 lb), which would make the largest males perhaps the heaviest recorded modern male eagle, as male harpy and Philippine eagles (being more sexually dimorphic in favor of the female) are not known to exceed 5 kg (11 lb) (the highest weights for male Steller's sea eagle are not known).[5][32][41][42] The global mean body mass of white-tailed eagles is estimated at approximately 5 kg (11 lb).[41][43][44] The average female Steller's sea eagle may weigh just under 25% more than the average female white-tailed eagle (the average weight of male Steller's is not known) while the average European golden eagle may weigh about 11–12% less than the average European white-tailed eagle and the bald eagle species as a whole about 10% less than the white-tailed eagle species.[41][45][46]
The most reliable method to sex birds is by tarsus width and depth and bill depth but these are infrequently measured.[5][47][48] In some cases females are as much as 25% heavier and 15% greater in linear dimensions, though the sexes are rarely this discrepant in standard measurements.[11] Among standard measurements, the wing chord is 552 to 695 mm (21.7 to 27.4 in) in males, averaging 606 and 645 mm (23.9 and 25.4 in) in European adults and juveniles, respectively, and 646.5 mm (25.45 in) in Greenland males.[34][40] In females, the wing chord may measure 605 to 740 mm (23.8 to 29.1 in), averaging 668 and 685 mm (26.3 and 27.0 in) in European adults and juveniles, respectively, and 691.3 mm (27.22 in) in Greenland females.[34][40] Adult tail length is 250 to 331 mm (9.8 to 13.0 in) in males, averaging 280 mm (11 in), and 276 to 330 mm (10.9 to 13.0 in) in females, averaging 305 mm (12.0 in). Juvenile tail lengths can reach roughly 380 mm (15 in) in both sexes, however.[40] The tarsus is 90 to 101 mm (3.5 to 4.0 in), averaging 95.5 mm (3.76 in).[39][40]
In terms of their killing apparatuses, their hallux claw, the largest talon on all accipitrids, is 37 to 46 mm (1.5 to 1.8 in) in length, averaging 40.9 mm (1.61 in).[40] The hallux claw averages about a centimeter less than that of a golden eagle and is more sharply curved, an adaptation to prevent escape of slippery prey such as fish, while that of a bald eagle is similarly about 40.4 mm (1.59 in) and of similar curvature.[49][50] The exposed culmen is typically large as in all Haliaeetus, ranging from 45 to 65 mm (1.8 to 2.6 in), with an average of 56.1 mm (2.21 in).[5][11][39][40][51] The average culmen length of the bald eagle is 54.3 mm (2.14 in), thus averaging slightly smaller. However, the average culmen length in the large bald eagles of Alaska is considerably larger than other bald eagles as well as most white-tailed eagles at up to 75 mm (3.0 in) and can even rival the length (but perhaps not the girth) of the truly massive bill of the Steller's sea eagle.[37][38][50]
The adult white-tailed eagle is a greyish mid-brown color overall. The plumage is fairly uniform over most of the body and wings, but the upper wing coverts are typically somewhat paler. In the adult, the head, neck and upper breast have a distinctly paler appearance than the rest of the plumage and most often have a buff coloration. In worn or bleached plumages these light areas can be even paler at times, ranging to almost whitish, which can render a resemblance in such eagles to a washed-out bald eagle. Some of the palest birds can appear anywhere from cream-tawny to light grayish. It is thought that in some populations perhaps paleness increases with age, although it is possible that there is an historical genetic factor to these pale variations. In contrast, some adults can also be a richer, more deeply dark brown (or somewhat rufescent) than average with perhaps a mild increase in average darkness of hue to the east of the species' range.[5][11][26] When many of the feathers are freshly molted, they can take on a slight purplish gloss.[34] The brownish hue of the adult overall makes the somewhat wedge-shaped white tail stand out in contrast.[11] All the bare parts of the adult's body are yellow in color, including the bill, cere, feet and eyes.[5] Juvenile and immature white-tailed eagles are a much darker brown than the adults and are more unevenly marked, with whitish feather edgings variably showing, mostly manifesting in some small areas of the underside and under-wing, with a narrow white axillary strip usually apparent.
The upperside is usually similarly darkish brown but variable based on extent of blackish-brown tip to otherwise buff-brown feathers of the mantle, back and upper wing. The head of the juvenile is normally a blackish-brown hue, somewhat darker and always more uniform than most of the other feathers. The juvenile's tail tends to be a washed out greyish-cream color with messy blackish color on the feather edges and on the tips. Some individual juveniles may exhibit some faint barring on the tail while others may appear largely dirty whitish on the tail. The bill of juveniles is usually almost half dark brown from the tip and half dirty, dull yellowish or gray to the base, while the feet are usually a dirty yellow and the eyes are a darkish brown. Juvenile males may average a slightly darker brown plumage with less speckling on the upper body than like-age females; their head and neck plumes may also appear shorter, which can accentuate the slighter, more angular skull possessed by males. In disposition, the male juveniles are said to be more highly strung and higher voiced than their female counterparts.[5][11][34]
The head gradually grows paler over several years. The whitish mottling may increase on the upperparts, belly and especially on the underwing area later into their third year (considered the first subadult plumage) and subadult birds can appear fairly blotched with white but much individual variation in coloring is known at this age. However, this white mottling then fades late into the fourth year and the plumage becomes less contrasting.[5][11] Although sexual maturity is considered to be attained at between five and six years of age, usually the fully white tail and the uniform pale head and neck are not obtained until the eighth year.[5][11][34] Juveniles first molt in May/June until October/November at just over one year of age. Their second molt is the following year in March or April, with two more subsequent molts usually beginning around this time for the next couple of years. Like other large raptors, feathers are molted at slow intervals so as not to inhibit food capture. Only relatively small proportions of the flight feathers are molted each year. Molting occurs more or less continuously, although it may pause in winter if food is in short supply.[52]
White-tailed eagles of all ages typically perch in quite upright positions on exposed branch, rock or other vantage point, but tend to sit more horizontally on the ground or other level surfaces. They have an ample bill with a relatively high culmen, helping to impart a rather narrow and high crowned facial look, especially compared to Aquila eagles.[11][53] The neck is at times unusually long-looking, more so than in the bald eagle, which can give the upper body a vulturine appearance. The tail is relatively short, and in some adults it can appear disproportionately stubby in relation to the massive body, and slightly wedge-shaped. All ages have a well-feathered tibia but bare tarsi. In flight, the wings are extremely broad and deeply fingered, with the usual tendency for at least six fingers to be visible. Juveniles are longer tailed than adults, which is usually more evident in flying than perched birds, with sometimes a slightly bulging section of feathers manifesting on the wing secondaries. The species tends to fly with shallow wing beats; at times the wing beats can be fairly fast for a bird of this size, but interspersed at times with gliding. At a great distance, this flight style may be suggestive of a large brown heron. The wings are held flat or slightly upraised at the tip in flight and the white-tailed eagle is well known to soar extensively. This species can be surprisingly maneuverable on the wing, usually during aerial displays or dogfights with other birds. These eagles may also maneuver by half-closing both wings or fully closing one wing.[5][11][54]
The white-tailed eagle is considered a very vocal bird of prey during the breeding season, although some authors consider their voice "not loud or impressive for the size of the bird".[11][34] The male call is oft transcribed as gri-gri-gri or krick-krick-krick, while the female is a deeper gra-gra-gra-gra or krau-krau-krau-krau. These will increase in tempo and pitch, with about 15–30 calls in a sequence. Often pairs will duet during early spring, in flight or from a perch. When perched, the male calls kyi-kyi-kyi-kli-kliek-yak with the head thrown back and upwards in the last call ended with a lower ko-ko-ko, the perched call of females is similar but deeper, a krau-krau-krau-uik-ik. Typically, the perched version of their calls tend to be shriller and higher than those issued in flight.[11][34]
In courtship display, male calls krau-krau-krau-uik-ik-ik answered by females with a lower ra-rack-rack-rack-rack. Young in nest call a shrilly piieh-piieh, while the female when receiving food from male calls out with tschie-tschie or vueee-vueee. Single or repeated krlee or similar component of calls used in other circumstances, but this can be very variable. Alarm calls tend to be 3–4 short, loud klee or klek notes. Sometimes a different call of alarm or anger, a deep gah-gah-gah or jok-jok-jok, similar to alarm calls of a large gull, is also uttered when a nest is approached (usually recorded while directed towards humans). The young let out a monotonous veee-veee when hungry (or "bored") which intensifies if the eaglets are not fed or brooded immediately.[5][11][34][55]
Given reasonable view, adult white-tailed eagles are difficult to mistake for any other bird. There are no other eagles with fully white tails in their range except for in the easternmost limits of their range, their cousins the bald eagle and Steller's sea eagle, which in adults are obviously very different in all other respects of plumage.[11] Even in poor light, the bald species shows a sharp demarcation from white to dark brown whereas the color contrast is far subtler in white-tailed eagles between their brown body (of a paler hue than that of a bald eagle) and buff-colored head. At a great distance, the adult may be potentially confusable with the Griffon vulture (Gys fulvus), as the coloring of the two species is vaguely similar and they can overlap somewhat in size although the vulture can average rather heavier and longer winged. However even at long range, the relatively tiny head, distinctly curved trailing wing-edges and more raised wings make the vulture distinctive from the white-tailed eagle.[11][54]
Juveniles may be harder to distinguish, mainly from other sea eagles in few areas of overlap. In northern Mongolia (perhaps spilling over into southern Siberia), the northern part of the Caspian Sea and some central and southern parts of Kazakhstan, the white-tailed eagle may (or may not) live alongside the rarer, relatively poorly-known Pallas's fish eagle.[5][56][57] The Pallas's juveniles are more distinctively whitish marked on the underwing. In flight or perched, the Pallas's fish eagle are usually markedly smaller and slighter than white-tailed eagles with a longer and differently marked tail. At all ages, the white-tailed eagle averages a duller, slightly darker and browner colour overall than the Pallas's fish eagle. Pallas's fish eagles are mid-brown on the body in juvenile plumage with no paler feather edging as seen in juveniles and especially subadults of the larger species. Adult Pallas's fish eagles are immediately distinctive rufous hue with a more restricted but more sharply demarked paler buffy head.[11][58] Bald eagle juveniles may be found together with white-tailed eagles in the Aleutian islands (where the white-tailed eagle formerly bred until about 30 years ago) and when vagrants of white-tails occur in Alaska. Juveniles of bald and white-tailed eagles often strongly resemble each other but the bald eagles have a shorter neck, a relatively longer and squarer tail, and somewhat less broad wings. In the coloring, the bald juvenile is similarly as dark or even darker brown above as white-tailed eagle juveniles but on the underside often has more extensive whitish mottling, especially on the underwing.[11][59]
Steller's sea eagles are usually distinctly larger and longer tailed, with a taller, bulkier look in eagles standing on the ground or perched. Steller's juveniles have a different wing shape (roughly paddle-shaped) and a considerably more massive and paler bill, which is yellow even in juveniles unlike in bald and white-tailed eagles. Juvenile Steller's sea eagles are a distinctly darker soot colour than juvenile white-tailed eagles with even less whitish showing on the body than the latter species but, on the other hand, the underwing often as white marked as juvenile bald eagles (dissimilarly from juvenile white-tailed eagles), albeit in different pattern. In all three large northern sea eagles, the tail color is similar at the various stages of development but the shape is more distinctive, especially the bolder wedge shape of the Steller's.[11][59]
The cinereous vulture (Aegypius monachus) may too be considered superficially similar to the juvenile white-tailed eagle, but it is considerably larger and longer-winged and possesses a more uniform and darker hue with conspicuous paler legs and a relatively smaller head. Young white-tailed eagles are also potentially confusable with any Aquila, but should be obvious even as a silhouette in its huge wings, relatively truncated and slightly wedge-shaped tail and obvious projection of the neck and head. All Aquila lack pale the axillary band often visible on juvenile and subadult white-tailed eagles. Some greater spotted eagles (Clanga clanga) can suggest the wing shape of a white-tailed eagle but are far smaller and shorter winged and never bear a protruding head.[11][53] Similarly, the eastern imperial eagle (Aquila heliaca) may suggest a white-tailed eagle in its flat wing profile and relatively large head and neck but is also visibly smaller with far less broad wings and a relatively longer tail. Like all Clanga and Aquila, both greater spotted and eastern imperial eagles should be obviously distinct from white-tailed eagles by plumage characteristics.[53][60][61] The golden eagle usually appears slightly smaller than the white-tailed eagle and tends to be more dashing in flight, which is usually done with a distinct dihedral. When perched, the golden eagle looks more sleek and compact than the rangier white-tailed eagle and tends to be a darker, richer hue of brown. Golden eagles have a much shorter neck, with a smaller head and bill and a longer, squarer tail. White wing patches of juveniles are also differently distributed in golden than juvenile white-tailed eagles.[5]


This eagle breeds in northern Europe and northern Asia. Their range extends to as far west as southern Greenland (prevented from breeding further north due to the short summers[62]), northern and western Iceland, and the reintroduced populations in some areas of England (re-established in 2019[63]), Ireland and Scotland, particularly conserved coastal spots. In mainland Europe the range is expanding, with Europe's largest population breeding in coastal Norway (broadly),[64] northern and southwestern Finland,[65] eastern Sweden, broadly in Denmark,[66][67] islands of the Baltic Sea, western Austria, northeastern Germany, northern and eastern Poland,[68] the Czech Republic, much of the east Baltic countries, the non-montane areas of Ukraine, eastern Slovenia, central and southern Hungary (and adjacent northeastern Croatia), very sporadically in Greece,[69] the Danube sections of Romania and Bulgaria to the Black Sea[70] and western and eastern Moldova.[1][11][4][71] The bird returned to the Netherlands in 2006 and in 2020 the number of breeding pairs had increased to 20.[72]
In Anatolia, it only remains as a breeder in very sparse and small pockets of Turkey and Georgia, taken as a region there are likely to be fewer than 30 breeding pairs in this region.[1][11] In the Middle East, the white-tailed eagle may still be found breeding only along the southern coast of the Caspian Sea in northern Iran and southwestern Turkmenistan.[1][73] Discontinuously, they are found as residents in Kazakhstan where they live in a long strip of the southern part of the country starting at the Aral Sea and the northwestern portion (but not, as far as is known, breeding in the Kazakh part of the Caspian Sea coast).[1][11] The only country in which the white-tailed eagle is found over a continuous and extremely large area is Russia. The species is found very broadly everywhere in Russia from European Russia in the west to the Bering Sea in the east, only being fully absent as a nester as far as is known from the high Arctic regions and a section bordering westernmost Kazakhstan, although it breeds to south of this in the Russian coastal part of the Caspian Sea.[1][11][74] Their northern limits occur in Russia to the Ob river to 70 degrees north at the mouth of the Yenisei River and on the Gyda and Yamal Peninsulas, to the Kolyma, Indigirka and Lena rivers to above 72 degrees north, even to 75 degrees north on the Taymyr Peninsula. They are said to be common around the White Sea, reportedly even the most abundant bird of prey locally and found both on coasts and inland lakes, although breeding rates are low due to the frigid weather.[5][74][75] From Russia, breeding populations spill somewhat into northernmost Mongolia, extreme northwestern China and northern North Korea. The white-tailed eagle also breeds on Sakhalin Island, the Kuril Islands and Hokkaido, the northernmost island of Japan.[1][11]
The wintering range is less well understood for the white-tailed eagle given the extreme reductions and fluctuations of northern breeding populations over the last few centuries, so that the delineation of regular wintering areas versus areas of mere vagrancy is difficult to ascertain. It is known that a small number winter on Etang de Lindre of Lorraine, France as well as an area on the border of France to Germany around Strasbourg, with vagrants to elsewhere in France, as well as to Spain, Portugal and Malta.[5][71][4][76] A well-defined wintering population may occur in much of the Netherlands, even with infrequent modern breeding in the northern coastal areas.[77] A non-breeding population is known in western Germany from North Rhine-Westphalia to Bonn, as well as far northern Germany into southwestern Denmark.[1][4] Other established wintering areas are known in Europe in west-central Italy, northern Austria, fairly broadly in southern Slovakia and northern Hungary and a few protected pockets of Southeast Europe apart from the portions in the north and east where they still breed.[1][4]
Intermittent forms of vagrancy and migration (most from eagles that breed in or disperse from Russia) are known to occur in several areas of Turkey, the Levant countries, Azerbaijan and Iran down to even the Persian Gulf, albeit seldom is the species to be found commonly or reliably anywhere in these regions. Further east, rare wintering areas are known in a few small, scarce pockets of Turkmenistan, Afghanistan, Uzbekistan, Tajikistan and Pakistan.[1][11][73] It is a very rare winter visitor to India, namely the extreme northwest and along the border of Nepal to Bhutan and extreme northern Bangladesh.[78][79] Scattered pockets of wintering birds are known to occur too in central and southern China, into northeastern Myanmar, and more broadly and regularly in much of Northeast China.[80][81] Good numbers winter too in much of South Korea and Japan down to as far as Honshu.[1][81] White-tailed eagles dispersing from their breeding grounds or natal sites in the Russian Far East are known to occasionally disperse across the Bering Sea to North America in several parts of the Aleutian Islands, the Pribilof Islands and some of mainland coastal Alaska down to Kodiak Island.[59][82] Some white-tailed eagles even bred in Alaska on Attu Island in the late 1970s to the early 1980s (until 1984 when the last attempts were recorded) but it was not clear whether young were ever successfully fledged.[83]
White-tailed eagles may be found in varied habitat but usually are closely associated with water and generally occurs in lowland areas.[11] Although mainly a lowland species, the species is known to live at elevations of 1,500 to 2,300 m (4,900 to 7,500 ft) so long as there is water access in some parts of Central Asia and Siberia.[34] In coastal areas, the species may range from high sea cliffs down to low-lying islands and archipelagos. Especially in winter, many white-tailed eagles often frequent low coastal spots, estuaries and coastal marshes. Several studies have supported that coastal areas are preferred when available during winter.[11][4][84] In many areas, white-tailed eagles can seem to switch freely between usually cliff habitat and wooded spots for nesting sites and the center of their home range habitat.[85] In some areas, such as Japan, this species may occur in regions with intensive human fishing activity and they may become unusually partially habituated to this human presence.[11][86] Inland, white-tailed eagles usually require secluded woods, forested areas or groups of trees with tall mature trees and access to freshwater wetlands such as lakes, river systems, marshes or extensive, low-disturbance farmland.[11] In the alluvial wetlands of Croatia, 95% of nests were found within 4 km (2.5 mi) of deep freshwater.[87]
In some areas, white-tailed eagles readily visit commercial fish farms, carp ponds and similar areas with easily accessible food but they will usually avoid areas where human disturbances (especially noisy varieties such as construction, water sporting and heavy boating activities and hunting) commonly occur.[5][11][4] However, forestry activity and resulting lessened numbers of tall mature trees and large tree stands in Estonia was found to affect breeding white-tailed eagles less so than it seemed to affect breeding black storks (Ciconia nigra).[88] On the other hand, from studying wintering white-tailed eagles in partially or heavily disturbed wetlands in parts of the Netherlands shows that such areas cannot support the eagles for any long-term period and may only be visited for a day or two by individual eagles.[77] Conversely, reviews of the rapidly increasing Danish population have found that when well-protected, they may regularly forage in habitats near significant humans populations, even in the outskirts of cities,[89] and they can also successfully breed in such locations.[90][91]
White-tailed eagles spend much of their day perched on trees or crags, and may often not move for hours. Perhaps up to 90% of a day may be spent perched, especially if weather is poor.[5][34] Also, they will alternate periods of soaring with perching, especially flying over water or well-watered areas, but do considerably less soaring on average than do golden eagles. Pairs regularly roost together, often near to their nest, either on a crag or tree or crevices, overhung ledges or small isolated trees on a crag.[34]
The white-tailed eagle may be considered a rather inconsistent and partial migrant.[5][92] The species seldom migrates in the western part of its range, with eagles even breeding as far north as Greenland, Iceland and coastal Norway not moving at all for winter, but for some southward juvenile movements following dispersal. Juveniles overall are more migratory and dispersive and leave natal areas sooner, which is by August–September in northwestern Europe and return later, by March/April, than adults do.[11][34] Few Norwegian juveniles, per banding studies, were recorded to travel any considerable distance. Extreme cases include one that was found 720 km (450 mi) south of its nest near Karlstad, Sweden, another set of four color-marked first-year juveniles were also recorded to turn up in southern Sweden but one was found down to the Wadden Sea in the Netherlands and it is likely that trickling down numbers of Norwegian post-dispersal juveniles have gone onto form much of the known Dutch white-tailed eagle population.[77][93] In contrast, young from Finland and Sweden tend to distribute to the southwesterly direction to the shores of the Baltic Sea. One from Finland was recovered 520 km (320 mi) west in northern Norway and another was found as far south as Bulgaria.[94][65] In more southerly areas, winter movements are drawn-out and irregular, with most mature pairs probably never leaving their nesting haunts year-around.[34] Those that breed on inland waterways may migrate to sea coast.[34] German juveniles usually do not travel far, with most recorded to travel less than 50 km (31 mi) from their nests and a majority staying near the Baltic coast. However, some eagles that hatched from nests in Germany have been found as far south as in Italy, 1,030 km (640 mi) away to the southeast, or to Gironde, France, 1,520 km (940 mi) to the southwest.[95] In several parts of Russia, quite unlike many European populations, the white-tailed eagle seems to be largely migratory.[11]
In the far east, the species appear to take different migratory routes in fall and spring, traveling from north-central Kamchatka thru the Kurile islands to Hokkaido in fall, while in spring these eagles travel north through Sakhalin and the Okhotsk Coast.[96] In the White Sea area, southward moments begin in September with most white-tailed eagles being gone by November but in mild winters some adults may remain behind. Some white-tailed eagles from the White Sea were found well over 2,000 km (1,200 mi) away to the west, in countries such as Hungary and Italy. Return spring migration to the White Sea is by February–March.[75] During winter, whether long-distance migrants or short-distance dispersers, white-tailed eagles tend to become gregarious, especially younger juvenile birds. Many such groups can contain up to 10 and, in areas near large breeding populations such as in Norway, at least 30–40 individuals.[5][33] Wintering congregations at the Baltic coast and on the River Elbe from 37 winters show that arrivals begin in November, with numbers peaking in January and then declining during March and early April.[95] Although juveniles usually return to their natal area some apparently overshoot these areas, such as those returning to Romania or on the Black Sea which have been recorded 330 km (210 mi) north of their natal site and 510 km (320 mi) northeast of their natal site.[95]
Territory size in white-tailed eagles may vary from 52 to 415 km2 (20 to 160 sq mi), usually less than 130 km2 (50 sq mi), per one estimate.[34] However, home ranges in northeastern Germany were much smaller than this, at 2.25 to 19.16 km2 (0.87 to 7.40 sq mi).[97] While territorial behavior is known in well more than half of all modern birds, essentially all predatory birds of different lineages are particularly strongly territorial because the live prey necessary to feed a family, including the female of the pair (which must remain near the young for them to survive) and the young themselves, tends to be sparser. Furthermore, appropriate habitat is needed in which to execute this hunting and also, of course, to build a nest with some security.[98] Although a relatively gregarious raptor, especially among wintering birds and juveniles and immature birds, they are territorial and intrusion by a male in adult plumage often provokes vigorous fighting, in which either combatant can even die. In some cases, these vicious fights can cause damage to the nest as the two fighting eagles plummet down trying to slash at each other.[5][34]

The white-tailed eagle's diet is varied, opportunistic and seasonal. Prey specimens can often include fish, birds and, mostly in a secondary capacity, mammals.[5][11] White-tailed eagles are powerful predators and capable of attacking large prey of considerable sizes but, like most predators, prefer prey that is vulnerable and easy for them to capture.[5][99] Especially during the winter (and opportunistically in all seasons), many birds of the species live largely as scavengers, usually by coming across available carrion or watching for the activity of corvids, vultures or other raptors.[5] White-tailed eagles in northeastern Germany were shown to hunt mostly from perches, in a "sit-and-wait" style, usually from a prominent tree perch. Like other sea eagles, they can only capture fish normally in the littoral zone, seldom hunting fish when they exceed a water depth of 1.5 to 2 m (4.9 to 6.6 ft).[99][100] In addition to trees, they may also use crags, hillocks or high grassy tussocks as hunting perches so long as the perch provides a good overall view of the environment.[5][33] Fish tend to be grabbed in a shallow dive after a short distance flight from a perch, usually with the eagles only getting their feet wet.[5][11] Occasionally, though, white-tailed eagles have been recorded plunging right into water, usually while hunting on the wing at a height of at least 200 m (660 ft). In Norway, plunge-diving is considered rare.[33][95] At times they will also fish by wading into shallows, often from shores or gravel islands.[5]
The species will at times variously follow fishing boats, readily exploits commercial fisheries, stocked lakes, carp ponds and the like, and scavenges dead fish or fish-offal in a wide range of situations.[11] When it comes to non-fish prey, it has been said that white-tailed eagles often hunt by flying low over sea coast or lakeshore and attempt to surprise victims.[34] However, the hunting success rates on healthy birds can be low as revealed in studying wintering eagles in Sweden attempting to hunt mallards (Anas platyrhynchos).[101] White-tailed eagles also regularly pirate food from otters and other birds including cormorants, gulls, ospreys, corvids and various other raptors.[5][95] Carrion is often the primary food source during lean winter months, with fish and ungulates preferred but everything from cetaceans to livestock to even humans being eaten after death.[11][102] From studies of captive white-tailed eagles, daily food requirements were estimated at 500 to 600 g (1.1 to 1.3 lb), which is equivalent to about 10% of the birds' body weight, with crop contents commonly of 190–560 g (0.42–1.23 lb).[34][103] Some semi-captive juveniles on the isle of Rùm, Scotland could eat up to 1.4 kg (3.1 lb) in one sitting.[5][13] However, in Norway, it was estimated that a family of wild white-tailed eagles including each adult and three fledglings were consuming on average up to 625 g (1.378 lb) per bird each day. Furthermore, one male consumed an estimated 2 kg (4.4 lb) in a single meal upon capturing a large fish. The crop can bulge to the size of a small grapefruit after they've consumed a large meal.[5][33]
Many studies have reflected that the primary foods of white-tailed eagles are fish and water birds. These are the primary food as well for other sea eagle species. However, unlike most Haliaeetus, including the bald eagle and Steller's sea eagle, the water birds tend to take the primary position in the diet.[5][11][104] From 26 accumulated food studies for this species, prey remains and pellets show that about 48.5% of the diet is made up of birds, 39.95% by fish, 9.95% by mammals and 1.6% by other foods. In total, more than 300 prey species are known throughout the bird's range.[5][105] However, based on studies of prey remains and pellets in laboratories from Greenland white-tailed eagles, birds were shown to be biased in both kinds of remains (pellets and prey remains) whereas in situ study and direct nest observation favor fish. Going on pellet/remains alone here in Greenland from 557 items in the 1979 study, 68% of the diet would’ve been represented by birds and only 20% by fish but comprehensive observation shifted it to show fish were the primary food at 58% and birds were secondary at 30%. This study claimed this is often because the bones of fish are dissolved by the large digestive tract of the eagles upon consumption and may thus leave almost nothing in remains and to some extent in pellets. Subsequent studies here showed a much stronger preference for fish in Greenland by 1983, as fish comprised an extreme 91.8% of 660 items.[106][107] However, this kind of direct continuous observation of food deliveries to nests is not always possible.[5] Furthermore, despite similar bias for prey that is large and leaves conspicuous remains (including any larger fish, bird or mammal), in the bald eagle it was found that fish were usually detectable and dominant in remains and pellets. Most modern biologists may need to leave some fish unidentified but will account for different methodologies of prey study to get the most complete picture attainable.[99][108]
During winter, mammal prey can become more important in foods locally, as indicated in Scotland and shown in Norway and eastern Germany.[5] As much as 41% of the diet can be made up of mammals, as was the case on the Kola Peninsula.[75] There is evidence of strong seasonal shifts in food habits in several parts of the range, usually the largest portions of fish are caught during warmer months while birds and mammals are more important in the colder months, especially in coastal areas such as Norway when preferred fish prey often move to deeper water during winter.[33][109] Among both fish and bird prey, it is thought that a majority that are caught weigh between 0.5 and 3 kg (1.1 and 6.6 lb).[5] At times it has been said that "most" prey of white-tailed eagles will weigh only 0.5 to 1 kg (1.1 to 2.2 lb).[110] However, the mean prey sizes caught can show greater variability. Three studies showed that mean prey size varied from 578 g (1.274 lb) in the Wigry National Park, Poland,1,062.1 g (2.342 lb) in the Rybinsk Reservoir, Russia and 1.72 kg (3.8 lb) in the Volga-Kama Nature Reserve, Russia.[111][112][113] Thus, the mean prey size falls just slightly short of the mean prey mass of the golden eagle, which globally averages about 1.35 to 1.63 kg (3.0 to 3.6 lb).[45]
Overall, nearly 70 species of fish are known to be taken from throughout the white-tailed eagle's range.[5][105] White-tailed eagles can hunt fish in fresh or saltwater as well as those that prefer brackish water areas. However, they are basically restricted to taking fish in extremely shallow water, often by preference in water less than 1 m (3.3 ft) deep.[5] Ideal fishing areas can be found in areas such as the Baltic Sea, where low coasts and archipelagos often have relatively shallow water.[114] While healthy, large fish are often taken as well, white-tailed eagles often take out sickly, injured, or already dead fish. In some cases, the fish prey will float to the surface when infected by fish tapeworm, as is often the case with some fish families such as carp.[5][115] Fish are also caught after being battered, injured, and killed at power plants, from large-scale fishing nets, or are taken directly from human fishermen.[5] Benthic fish which tend to cling to rocks or sandy soil in shallows may be more vulnerable since they tend to look downward rather than upward and are less competent at escaping predators coming from above the water's surface. Therefore, lurking benthic fish such as lumpsuckers are more vulnerable than many.[33]
Besides vulnerability, habitat, and prey behavior, fish body size may be a driver in the piscivore's dietary preferences. White-tailed eagles usually can take various fish from 0.1 to 8 kg (0.22 to 17.64 lb), but fish ranging 0.5 to 3 kg (1.1 to 6.6 lb) typically preferred.[5][116] Similarly, studies have indicated that fish less than 20 cm (7.9 in) are taken infrequently, since they have a lower yield, fish of up to 30 cm (12 in) are taken secondarily and fish between 30 and 60 cm (0.98 and 1.97 ft) are preferred since they have the highest nutritional benefit. Fish taken can exceed 0.9 to 1 m (3.0 to 3.3 ft) but since they can start to considerably exceed the weight of the eagle itself, they may prove too heavy to carry.[5][99][100] One large Atlantic halibut (Hippoglossus hippoglossus) was found with the disembodied feet of a white-tailed eagle still embedded in its back, presumed the eagle drowned after being overpowered and drug under only to rot off, leaving only feet.[117] Since they do not have the waterproofing oils on the plumage of the more accomplished raptorial diver, the osprey (Pandion haliaetus), white-tailed eagles prefer not to get their feathers wet as it can take a long time for them to dry. This may also make them vulnerable to losing their catch to other white-tailed eagles since their flight may be impaired until the wings are dried. Therefore, when hunting fish, they will fly to a feeding perch or nest as soon as possible most of the time.[5][100] Another option when taking particularly large fish is for the eagle to stay in the water and row, swimming using their wings, across the water to the nearest bank or shore. While this would leave them waterlogged, of course, the food yield from such a catch, weighing up to around 10 kg (22 lb) is obviously attractive. White-tailed eagles have been photographed doing this with a large fish successfully in Greenland and 35 such cases were reported in Norway alone.[33][118][119]
The most frequently recorded prey species in 18 food studies from across the range is the northern pike (Esox lucius), present in at least 16 of those studies. Pike was found to be the main prey species in both the Baltic Sea and Lapland in Sweden, at three breeding locations in Finland, in two studies from Germany, and in Belarus. The maximum representation of pike known was in Lapland, where they comprised 38.2% of 809 food items.[105][110][120][121] While an average mature weight for a pike is around 1.4 kg (3.1 lb), white-tailed eagles often attack larger-sized pike, with an estimated average weight range of 2 to 5 kg (4.4 to 11.0 lb).[5][75][122] Some pike taken by white-tailed eagles were even estimated to weigh around 12 kg (26 lb).[123] The next most widely reported fish prey species is the common bream (Abramis brama). This bream was reported in 10 of 18 dietary studies and was the main prey in the Polesie State Radioecological Reserve, Belarus, in the Ural mountains region of Russia, and in the Kostomuksha Nature Reserve, Russia.[123][124][125]
Many varieties of fish are taken opportunistically and randomly, as opposed to pike and bream, which can locally appear to be selected out of proportion to their regional population.[99][100] Particularly diverse in the white-tailed eagle's prey spectrum are the family Cyprinidae, of which more than 20 species are known to be predated including the common bream.[5][105] Others taken with some preference may include salmonids and cod and their allies, both families known to obtain relatively large body sizes and occasional habituate shallow water, as well as lumpsuckers because they are benthic.[5] In Greenland, the leading prey species is the salmonid, the Arctic char (Salvelinus alpinus), which comprised 27.2% of 660 prey items. The secondary prey in Greenland was recorded as two species of cod. While the Arctic char can average up to 2.53 kg (5.6 lb) and cod can sometimes grow considerably larger than that, the average weight of cod taken here was estimated at only 420 to 640 g (0.93 to 1.41 lb) and the average char at 660 to 740 g (1.46 to 1.63 lb). The largest cods and chars taken during the study were 2.2 kg (4.9 lb) and 3.2 kg (7.1 lb) respectively.[106][126] In Norway, of 524 fish prey items, the common lumpsucker (Cyclopterus lumpus), which averages up to 1.43 kg (3.2 lb) but is usually smaller, made up 24% of fish taken and the 2.13 kg (4.7 lb) Atlantic wolffish (Anarhichas lupus) made up 17% of fish taken.[33][127][128] However, fish were secondary to birds overall in Norway.[33] Per two studies from Sweden, fish were usually the main food unlike in Norway and Finland, and could comprise 51–60% of the diet.[105][110][121] Fish were also somewhat dominant in the foods from two studies in Belarus, making up 48.1–53.7% of the diet.[124][129] Fish similarly were important to nesting eagles in Hokkaido, Japan where 54% of 533 prey items were fish, led by the 800 g (1.8 lb) Alaska pollock (Gadus chalcogrammus) at 18.4%.[130][131] In different studies of the Danube Delta of Romania, from 44.6% to 79% of the diet was comprised by fish, led by the common carp (Cyprinus carpio) and Prussian carp (Carassius gibelio).[5][132][133] In the Kostomuksha Nature Reserve of Russia, fish were strongly dominant in food remains, making 80% of the known diet.[123]

White-tailed eagles are known to prey on about 170 species of bird, the most diverse group in their prey spectrum.[5][33][105] While hunting birds, this massive, relatively slow-flying eagle requires an element of surprise, with often a tactful use of cover or bright sunlight upon the approach from a nearby perch.[5][100] For example, grey herons (Ardea cinerea) have been caught after an eagle used a low flight over turbulent water to ambush them.[33] However, even with a stealthy attack, the waterfowl favored in the avian diet tend to be highly wary and will more often than not escape.[101] The white-tailed eagles must then attack birds at times of vulnerability or injury, or will often utilize the prey's escape tactics against them.[5] Diving ducks and other diving water birds will be taken preferentially where they are available. In hunting diving birds, they utilize a technique of forcing the birds to dive repeatedly to avoid attacks, until the victim is exhausted from the efforts and can then be caught. Usually while hunting like this, the white-tailed eagle tends to circle low to stay close to the intended victim, with birds diving in shallower water being preferred. Ducks with conspicuous plumage, such as male common eiders (Somateria mollissima), with their pale plumage, may be easier to see under water and so may be taken somewhat more via this hunting method.[5][33] Beyond waterfowl, both loons and grebes have been seen to be successfully hunted in this way.[5]
Eagles were recorded doing up to 12 attacks on eiders in Russia and were usually successful in procuring prey. Even as many as 65 passes have recorded in less than 45 minutes but more than a few attacks also start to exhaust the eagle, as one immature gave up after 15–28 attempts at a little grebe (Tachybaptus ruficollis).[95][75] While bald eagles may attack diving ducks in the same way, they appear to do so somewhat less regularly and successfully.[134][135] White-tailed eagles usually have less success hunting dabbling ducks because their normal predator response behavior is to take flight. In one instance, a mallard was caught while flying in mid-air, but usually the much larger eagle is unable to capture ducks in flight. While somewhat less swift in flight, healthy geese can usually outpace a heavier eagle as well and one bean goose (Anser fabalis) was even recorded to have defended itself successfully against an eagle's attack even though this goose was injured.[101] White-tailed eagles often hunt dabbling ducks and geese most successfully when they are molted into their eclipse plumage which renders them temporarily flightless.[5] Swans during winter may find themselves forced to land due to their bulk on a sheet of ice over water if they can find no open water, which can make their feet stuck to the ice. White-tailed eagles have been recorded utilizing this disability to attack and kill swans.[136] They've also been seen to attack numerous waterfowl when the birds are injured by buckshot from duck hunters.[136] Due to their status as enemy of other large birds, they are frequently mobbed by them and white-tailed eagles have been recorded utilizing violent mobbings to suddenly turn over in flight and predaceously grab one of the birds mobbing them, including large gulls and even a northern goshawk (Accipiter gentilis).[5][137] As an opportunistic predator, it often takes young birds freely as well as adult and fledged juvenile birds. In general, due to different nesting situations, white-tailed eagles instead of dabbling or diving water birds usually attack the more conspicuous or open nests of gulls, those of several other types of seabird, large corvids or other accipitrids.[103] In Germany and Scotland, up to 86% of gulls taken were nestlings and juveniles.[120][138] Cases of white-tailed eagles eating eggs, instead of nestlings or older birds, is considered rare. Nonetheless, they have been recorded eating a few eggs, which they may carry in their beaks rather in their feet, of some seabirds such as kittiwakes, eiders, cormorants and gulls.[95][136]
The most widely recorded avian prey species and, second most widely recorded prey species behind the pike, is the 1.14 kg (2.5 lb) mallard, due to its circumpolar range and commonality in many wetlands areas.[5][41][105] However, as aforementioned, healthy mallards are difficult for white-tailed eagles due to their tendency to fly at first sign of danger. However, exploiting the mallard's flightlessness during eclipse plumage may result in eagles hunting them intensely only in late summer.[5][101] Due to this mallards are usually a secondary prey species year around. The largest known representation of mallards in the diet were from Müritz National Park in Germany, where mallards were the third best represented prey species at 10.1% of 247 items and from Augustów Primeval Forest in Poland, where mallards were the second most numerous prey and made up 9.84% of 803 items.[105][120] Taken more preferentially where they occur are common eiders. When hunting eiders, perhaps the largest of diving ducks at a mean weight of 2.06 kg (4.5 lb), white-tailed eagles frequently force the eider to dive repeatedly until it is exhausted and can be captured.[33][41][75] When sitting on the nest, the female common eider will try to escape in flight but is a relatively weak and ponderous flier and so too may be often victimized by the eagles.[95][139] Otherwise the pale plumage of adult male common eiders while they're diving is reported to make them more vulnerable to eagle attacks.[5][33] Eiders were the leading prey species in Norway making 18.8% of 1612 prey items, as well as in Åland, Finland where the eider comprised 18.63% of 5161 prey items (thus nearly a thousand eiders were taken here).[33][105][121] Eiders also appeared to be the main prey species in Iceland.[140] There is evidence that a growing white-tailed eagle population is having a net negative effect on eider numbers in some areas, and locally eiders have altered to partial nocturnal foraging apparently to avoid hunting eagles.[141][142] In inland regions, an avian prey species preferred by white-tailed eagles is the 836 g (1.843 lb) Eurasian coot (Fulica atra). The coot is the second most widely represented bird prey species (and fourth species of any class known overall) in 18 dietary studies.[5][41][105] Coots bunch together in marshy spots when approached by a flying eagle and as many as five eagles at once have been recorded attacking large flocks on the water.[5] Coots behaviour often endangers them to large raptors: they seldom dive, are weaker and slower fliers than most water birds and are collectively often less wary and more approachable than most waterfowl are.[101][99][100] Coot were strongly the dominant food in Wigry National Park, Poland where they made up 44.1% of 299 items, and were also the leading prey in Augustów Primeval Forest (Poland) where they made up 11.59% of the foods. Overall at Wigry and Augustów, birds altogether made up 66.2% and 47.83% of the diets, respectively.[105][111] In the Danube Delta, Romania, birds climbed in importance of the diet from 21% in 1970 to 50% by 2015, thanks largely to increased numbers of coots.[136][132]

In total, about 38 species of waterfowl are known to be hunted, as well as all available species of loons and grebes, several types of rails, tubenoses as well as herons, storks and other assorted large waders. White-tailed eagles also are known to hunt some 42 species of shorebird, most significantly gulls and alcids.[5][105][121] Even shorebirds as small as 21.1 g (0.74 oz) little stint (Calidris minuta), 62.6 g (2.21 oz) wood sandpiper (Tringa glareola) and 64 g (2.3 oz) common ringed plover (Charadrius hiaticula) are known to be preyed upon, albeit quite rarely.[41][110][143] More than a dozen gulls are known in the prey spectrum from the smallest to all four largest extant species.[106][110][104][144] In the United Kingdom, northern fulmar (Fulmarus glacialis) are noted as a common prey species and as such may contribute to locally high levels of DDT and PCB chemicals in nesting eagles.[102] However, fulmars defend themselves by regurgitating a smelly, tar-like oily substance that can impair the flight of predators and may even kill some intended predators when it is in large quantity, and young juvenile eagles, being less cautious and experienced, are most prone to being severely "oiled".[5][145] Alcids such as murres tend to become especially important in the diet of eagles in coastal Norway during winter, especially near offshore islands, when coastal fish tend to move to deeper waters.[33][142] At least eight species of dabbling duck are known in the prey spectrum. Due to the social inclination of dabbling ducks, they perhaps have the most success hunting isolated birds but they've also been taken from panic-stricken flocks as well.[5][136] Despite the difficulty of taking them, dabbling ducks of unidentified species were found to be the main food of white-tailed eagles in Lake Baikal, where they comprised 51.8% of 199 prey items.[104][146] In Fennoscandia, they are attracted to coastal waters during winter to attack large numbers of diving ducks including eiders, common goldeneye (Bucephala clangula), common (Mergus merganser) and red-breasted mergansers (Mergus serrator), tufted ducks (Aythya fuligula) and scoters. Year around in Åland, 66.2% of 5161 food items were birds, while in the three sites in different parts of Finland birds made up 51.1% of 3152 food items.[110][114][121] In Germany, 52.4% of 1637 prey items were birds, mostly coots and unidentified waterfowl. More locally in Germany, in Müritz National Park the percentage of birds in the diet climbs to 65.73%[120][105] Birds were strongly dominant in food records from Scotland, making up 73.53% of 1930 prey items, and in Kandalaksha Nature Reserve, where they comprised 75% of 523 prey items.[5][75]

While most of the aforementioned water birds are modest of size and taken largely due to ease (diving water birds, whether healthy or infirm, and usually infirm or molting dabbling water birds), white-tailed eagles routinely attack larger water birds as well. In many areas, large numbers of 3.31 kg (7.3 lb) graylag geese (Anser anser), Europe's largest native wild goose, are taken. For example, they were the main prey, making up 28.2% of 192 prey items, for wintering eagles in Oostvaardersplassen, Netherlands, and the second most often recorded prey species in both Müritz National Park (Germany), where they made up 16.42% of 247 prey items, and in Austria, where they made up 9.5% of 349 items.[41][77][105][147] White-tailed eagles are known to prey on at least 10 species of geese, ranging in size from the 1.23 kg (2.7 lb) red-breasted goose (Branta ruficollis) to the non-native 3.69 kg (8.1 lb) Canada goose (Branta canadensis).[41][148][149] They will take many goslings during summer, as greylag goslings alone can comprise up 23% of the seasonal bird prey, and fully-grown geese in other seasons.[5][136] Large waders are taken when possible, including a half dozen heron species, and, larger still, both the young and adults of 5.5 kg (12 lb) common cranes (Grus grus) and both the 2.93 kg (6.5 lb) black and the 3.44 kg (7.6 lb) white stork (Ciconia ciconia). Black and white storks are primary prey species in the Polesie State Radioecological Reserve, Belarus, where they comprised 12.6% (second most regular prey species) and 6.3% (fourth most regular) of the diet, respectively. Large numbers of black stork were also taken in Augustów Primeval Forest where nearly 50 were found around eagle nests.[5][105][110][124] They are reported to have attacked and eaten the largest seabirds they encounter, such as great cormorants (Phalacrocorax carbo) and in some cases, such as in the Baltic Sea, have nearly destroyed whole colonies, from the eggs to the adults which average about 2.57 kg (5.7 lb).[41][150] In the Estonian island of Hiiumaa, home to at least 25 pairs of sea eagles, as many as 26 individuals have been observed simultaneously culling a single cormorant colony.[151] Similarly large numbers were taken of the 2.82 kg (6.2 lb) Japanese cormorant (Phalacrocorax capillatus), which was the second most numerous prey species, making up 11.63% of 533 prey items in Hokkaido, and opportunistically, when their north Atlantic colonies are accessed, great numbers of 3 kg (6.6 lb) northern gannets (Morus bassanus).[41][130][152] Vagrant white-tailed eagles in Hawaii were recorded to prey on several Laysan albatross (Phoebastria immutabilis) and were suspected to prey on black-footed albatross (Phoebastria nigripes), both weighing about 3.17 kg (7.0 lb).[41][153] Another large water bird taken as adults are 4.98 kg (11.0 lb) common loons (Gavia immer).[5][41] However, the largest water birds they are known to kill are adult swans, including mute (Cygnus olor), whooper (Cygnus cygnus) and Bewick's swans (Cygnus columbianus bewickii). While cygnets and disabled birds (either by natural conditions such as ice or by human hunters) are at the greatest risk for eagle predation, white-tailed eagles have prey upon even healthy adult swans weighing at least 10 kg (22 lb).[5][105][111][154][155]
While land birds are a more infrequently part of the diet, at least 60 species have been recorded in the white-tailed eagles prey spectrum.[5][105] For the most part, land birds are taken so infrequently as to not warrant much mention. However, variable numbers of gamebirds are taken opportunistically, and in Belarus and Russia, especially around the White Sea where ptarmigan are not infrequent prey, they will take a few grouse. White-tailed eagles are known to prey on some numbers of ring-necked pheasant (Phasianus colchicus) in Austria.[75][129][147] They will at times attack adult male western capercaillie (Tetrao urogallus), of note for their large size at 4.2 kg (9.3 lb).[123] However, this is dwarfed by the largest avian prey credited to a white-tailed eagle, an adult male great bustard (Otis tarda), which weighed an estimated 15 kg (33 lb) (which, much like exceptionally large fish taken, must have been consumed in the killing spot or subsequently dismantled as too large to fly with).[5] Among the land birds taken, more than 20 passerines are included in the prey spectrum but most are obviously too small and swift to be anything but incidental prey.[5] The smallest avian prey known for white-tailed eagles was a great tit (Parus major), a species which weighs 16.4 g (0.58 oz) on average.[41][156] On one hand, small bird prey may be under-recorded since they leave few conspicuous remains but, on the other, are unlikely worthy of much pursuit as they have little food value. However, in one case, a white-tailed eagle was seen to fly into a murmuration of Eurasian starlings (Sturnus vulgaris) and come away with a starling in hand.[5][33] The only passerine family taken in numbers would be the larger corvids, of which eight species are known in the prey spectrum.[110][132][125] In Hokkaido, Japan, two species of corvid were well-represented in the diet, the 519.5 g (1.145 lb) large-billed crow (Corvus macrorhynchos) and the 570 g (1.26 lb) carrion crow (Corvus corone), which together comprised 14.8% of 533 prey items.[41][130]

Mammals are usually a quite secondary component of the diet. Although usually better represented than other non-fish and birds prey, their regional importance is variable.[5] In known dietary studies, the mammalian contribution can vary from 0.49% to 41% of prey by number.[5][75][105] When mammals are most significant to the diet, it usually due to local white-tailed eagles preying on rabbits and hares with some regularity. In some studies from Scotland, the European rabbit (Oryctolagus cuniculus) and mountain hare (Lepus timidus) were found to contribute as much as nearly 25% of the diet.[152][157][158][159][160] A similar contribution of European hares (Lepus europaeus) was found in the diet of Austria, where hares were the leading prey species making up 24.35% of 349 prey items (with mammals making up 34.67% of the overall diet).[147] In studies from Germany, European hares were taken fairly often but were numerically secondary prey.[105][120] Given that these rabbits and hares have average mature weights from 1.8 kg (4.0 lb) in rabbits to 3.8 and 4.2 kg (8.4 and 9.3 lb) in European and Arctic hares (Lepus arcticus), they can make a hearty contribution to the prey biomass when available (although certainly juveniles are attacked as much if not more so than adult rabbits and hares).[5][152][157][161][162][163]
The most widely reported mammalian prey known usually as a supplemental prey species are rodents, especially the non-native muskrat (Ondatra zibethicus), which averages about 1.1 kg (2.4 lb), and may be taken from "muskrat farms" or feral wetland populations. While largely a supplemental prey item, a respectable number of 137 were recorded in the diet from Finland.[5][110][164] Also, a study on the Ili delta in Kazakhstan has shown up to 30–43% of prey remains at eyries to consist of muskrat in spring and fall but only 14% in summer (for unknown reasons).[95] In total, about 20 rodent species are known in the white-tailed eagle's prey spectrum. In some of the coldest climes of Russia, such as in the Ural mountains or the Kola peninsula, white-tailed eagles have been recorded to live on surprisingly high numbers of small rodents, comprising 13.8% and more than 21% of all prey remains, respectively.[75][125] Even agile red squirrels (Sciurus vulgaris) may be caught from trees in some cases.[165] The smallest rodents known in the prey spectrum are the 27.4 g (0.97 oz) common vole (Microtus arvalis) and the 23.4 g (0.83 oz) wood mouse (Apodemus sylvaticus) but mammalian prey down to the size of 8.1 g (0.29 oz) common shrews (Sorex araneus), indeed the smallest vertebrate known to have been preyed upon, has been recorded.[5][125][166] By contrast, kits of larger rodents such as Eurasian (Castor fiber) and North American beavers (Castor canadensis) (introduced) have been found as prey.[124][167]
Other mammals are also taken infrequently, usually canids and mustelid. At least seven species of mustelid have been recorded in the white-tailed eagle's diet, from the smallest weasel to polecats, martens, sables, and rarely, even adult European otters (Lutra lutra).[5][168][169][170][171] Another mustelid, the American mink (Neogale vison) was introduced as a furbearer to Finland but then became an invasive pest, as a fast-breeding killer that threatens many native species. In turn, Finnish white-tailed eagles have become the main natural control and may inhibit the mink from breeding via heavy predation. Conversely, the white-tailed eagle has not been known to prey on the critically endangered, native European mink (Mustela lutreola) (perhaps due to its shier habits) which the American mink are known to have been outcompeting in some areas (but the European has mainly declined due to massive overhunting by humans as a furbearer).[172][173] Among canids, pups of Arctic foxes (Vulpes lagopus) are the sixth most regular prey species in Greenland,[106] While adult corsac foxes (Vulpes corsac) are occasionally taken in Russia.[174] Several red foxes (Vulpes vulpes) was taken or scavenged in Norway and Finland, and successful predatory attacks on red fox have been reported in Belarus and Slovenia.[33][175][169][176] White-tailed eagles are often considered potential predators of raccoon dogs, and several predations has been reported in Poland and Belarus.[170][177][169] Additionally, a white-tailed eagle was once observed to kill and feed on a live adult golden jackal (Canis aureus) that was trapped in a furbearer's trap.[178] White-tailed eagles are known to prey on seal pups but most are likely sickly and perhaps both adult and pup seals are most likely to be eaten as carrion. Four Baikal seal (Pusa sibirica) pups were taken in Lake Baikal.[104] They are considered a predator even for live grey seal (Halichoerus grypus) pups that weigh 11.75 kg (25.9 lb) at birth.[179] Successful attacks on young harbor seal (Phoca vitulina) weighing up to 18–20 kg (40–44 lb) have been observed.[116] In one instance, a white-tailed eagle reportedly tried to attack an adult harbor seal but was immediately dragged into the water and soon surfaced dying with a broken wing.[178] Similarly, in one anecdote, an eagle drowned while apparently attacking an adult harbor porpoise (Phocoena phocoena).[33]
More than a dozen ungulate species have been found in the foods of white-tailed eagles, but a very large proportion of this is likely from carrion found already dead.[110] Very large food sources such as horses (Equus ferus caballus), moose (Alces alces), cattle (Bos taurus) and European bison (Bison bonasus) are certainly visited as carrion always.[5][77][110][180] Wild ungulate species known to have their young attacked by white-tailed eagles in variable numbers may include deer such as reindeer (Rangifer tarandus), red deer (Cervus elaphus) and European roe deer (Capreolus capreolus) and wild boar (Sus scrofa). Boar made up 7.1% of the prey remains at Polesski Reserve, Belarus.[5][33][124] At least two successful attacks on adult roe deer have been reported, which could potentially weigh around 25.4 kg (56 lb) (their average mature weight), in addition to several cases of predation on young roe deer.[33][181][182][183] A yearling juvenile male eagle scaling 5 kg (11 lb), newly reintroduced into the wild on the isle of Rùm killed a healthy, 7 kg (15 lb) red deer calf within a couple of days.[5] One of the primary causes of the white-tailed eagles persecution by humans is that white-tailed eagles often feed on domestic sheep (Ovis aries) and goats (Capra aegagrus hircus), especially lambs and kids. However, they do not necessarily take healthy specimens and often feed on them after death, instead. Of 36 cases of feeding on lambs and kids by white-tailed eagles in Norway, only 12 could be proven to have been taken alive by the eagles.[33][184][185]
Prey of other animal classes is rarely taken by white-tailed eagles. Particularly, the diversity of reptiles known in the prey spectrum, at only six species, is quite paltry when compared to the many species known to be hunted by the bald eagle. Further among amphibians only two species of toad are known to be taken.[5][130][125][186] The Ural mountains is the only region where some diversity of reptile and amphibian species have been reported in their diet.[125] In only the white-tailed eagles nesting in Hokkaido, they've been known to hunt large cephalopods such as robust clubhook squid (Onykia robusta) and giant Pacific octopus (Enteroctopus dofleini), though likely mainly younger specimens and those collected and perhaps injured by large-scale fishing operations.[130] White-tailed eagle juveniles have been seen rarely foraging for unidentified clams and mussels on the Rhine.[187] However, the miscellaneous shells of marine mussels and snails found in Norway are probably usually consumed secondarily from the stomachs of eiders.[33] An exceptional number of insects, amounting to 24% of food items by number, were found in the foods of white-tailed eagles in Augustów Primeval Forest, almost entirely Odonata. The source of this food is not clear as the white-tailed eagle is far too large and bulky a raptor to invest much time in pursuit of insects.[105]
As the largest eagle in the majority of its distribution, the white-tailed eagle is an apex predator in its range.[5][172] In some areas it may compete with other large raptors, especially golden eagles. Relations between these two species are complex and variable.[152][157][45] In Scotland, where both eagles have been reintroduced or re-established, competition is considerable. This is, in part, due to their diets being more similar here than elsewhere in their range, with both species preying heavily on rabbits and hares and being reliant on carrion all year round, whereas in most other areas both favor carrion mostly only in winter. As much as 90% of their diets in Scotland can overlap. The white-tailed eagle elsewhere usually prefers fish and water birds.[157][45] Another factor is the reintroduction of white-tailed eagles occurred after golden eagles had been re-established in Scotland and that some of the golden eagles began to nest beyond their usually rocky, mountainous habitats, in or near trees in coastal or near lowland wet areas historically occupied by white-tailed eagles. More territorial conflicts between the species have been recorded in the last few decades.[5][157] Given appropriate healthy populations and ample habitat, as in Norway, the golden and white-tailed eagles are considerably segregated in nesting regions and direct competition is much milder. In spite of a size advantage for the white-tailed eagle, the golden eagle is reportedly "strongly dominant" over the white-tailed in food conflicts and, perhaps, in direct nesting competition. This is in part because of the swifter, more agile flight of golden eagles, as well as their greater overall aggression towards other raptors and perhaps due to their somewhat longer toes and larger talons, although there is little evidence that the golden and white-tailed eagles are notably different in strength.[5][157][188]
In many intraguild diurnal raptor assemblages, a slightly smaller, swifter-flying species often dominate their heavier competitors unless size differences become extreme,[189][190] to the contrary of owls and several other predators which often adhere fairly strictly to a size-based dominance hierarchy.[191][192] Golden eagles won all food conflicts over carrion observed by one author over the course of two winters in Norway, with the white-tailed eagles only displacing goldens after the golden eagles had already fed for some time.[157][188] However, cases of white-tailed eagles winning food conflicts have been reported as well and perhaps more assured mature white-tailed eagles may fare better in such conflicts.[193][194][195] Some territorial conflicts in Scotland have escalated, albeit rarely, to both eagle species killing the other.[45] White-tailed eagles are said to be "dominant", however, in population ecology as they can exist at higher population densities and typically outnumber golden eagles because of their longer gut and more efficient digestive system, being able to live better with less food.[152][157][188] Notably, in competition in North America, neither the golden or bald eagle are said to be dominant and either species may win conflicts. Furthermore, bald eagles may succeed in procuring up to 25% of fresh golden eagle kills in winter and golden eagles are reported to decidedly avoid active nesting areas of bald eagles.[135][196][197][198]

Beyond golden eagles, white-tailed eagles may live alongside a wide range of other large raptors, but other eagles are considerably different in dietary and habitat preferences, so there is almost no competitive effect.[5] For example, in Kazakhstan, white-tailed eagles were recorded to nest in proximity to golden eagles, eastern imperial eagles (Aquila heliaca) and steppe eagles (Aquila nipalensis) and all four eagles appear almost entirely indifferent to the presence of the other species, given their considerable partitioning in diet and habitat preferences. More significantly than the Aquila species, the white-tailed eagle seemed to have no issue nesting within a few hundred metres of the other eagles.[199] A more direct effect may be detected on other fish-eating birds, for example recovering numbers of white-tailed eagles in Lithuania was thought to limit local osprey populations. However, in similar habitats, white storks and lesser spotted eagles (Clanga pomarina) appeared to not be competitively effected.[200] Besides competitive effects, white-tailed eagles may adversely effect ospreys by habitually robbing them of their catches.[33] Besides the poorly studied relations between the Pallas's fish eagle and white-tailed eagle in the southern limits of the latter's Asian distribution, the only other Haliaeetus to live broadly alongside white-tailed eagles are Steller's sea eagles. Being larger and heavier, the Steller's is often characterized as a more powerful predator.[5][34] Nonetheless, studies of the species ecologies show that the Steller's is a more restricted feeder on salmonids and that the Steller's tended to defend a smaller home range area than white-tailed eagles do in the Russian Far East. However, the Steller's appeared to be more flexible in readily switching nest sites between trees and rocky areas, whereas white-tailed eagles of this area exclusively nested in trees. Both species seemed to avoid active territories of the other but little direct conflict during breeding was detected.[201][202] Although the Steller's sea eagle may be somewhat favored in wintertime food conflicts given its sometimes considerably larger size, both it and the white-tailed eagles have been observed to win conflicts over fish, with golden eagles sometimes entering the fray and sometimes losing or winning conflicts.[203][204][205] Given their larger population and farther current range into warmer areas (whereas the modern white-tailed eagle is only common in cold, northern climes), bald eagles (the ecological equivalent of the white-tailed eagle in North America) have a considerably broader prey spectrum than white-tailed eagles that ranges well over 400 species, with more species recorded from nearly all animal taxon. Although about 56% of the bald eagle's diet is comprised by fish, bald eagles often take a higher diversity and numbers of alternate prey such as mammals, reptiles and amphibians than do white-tailed eagles.[186][206][207]
Although other birds of prey are seldom caught, given that they are wary, fast and can defend themselves well, the white-tailed eagle can be characterized as an opportunistic predator of such birds.[5] Indicating that they are regarded as a threat to raptors is that they are frequently mobbed by a wide range of raptor species when displaying active flights, to a similar regard that the perhaps more aggressively predatory golden eagle is.[5][208][209] Given the difficulty of this prey type, white-tailed eagles are likely to attack other birds of prey when the victims are distracted, whether by migration on windy days, nesting duties or when trying to capture their own prey, are previously injured or they may even capture one while the raptor tries to mob the eagle. Certainly, nestlings and fledglings can certainly comprise a large fraction of the birds of prey caught as well as adult ones.[5][137][200] Other accipitrids they are known to have preyed upon, in increasing order of size are the Eurasian sparrowhawk (Accipiter nisus),[110] western marsh harrier (Circus aeruginosus),[147] black kite (Milvus migrans),[130] European honey-buzzard (Pernis apivorus),[110] common buzzard (Buteo buteo), northern goshawk,[110] red kite (Milvus milvus),[210] lesser spotted eagle (Clanga pomarina)[211] and eastern imperial eagle,[210] in addition to osprey.[110] Non-accipitrid raptorial birds, these more likely restricted to fully independent birds due to their less conspicuous nests, known to fall prey to white-tailed eagles include Eurasian pygmy owl (Glaucidium passerinum),[191] boreal owl (Aegolius funereus),[110] Eurasian hobby (Falco subbuteo),[168] long-eared owl (Asio otus),[129] northern hawk owl (Surnia ulula),[110] short-eared owl (Asio flammeus),[110] peregrine falcon (Falco peregrinus),[110] snowy owl (Bubo scandiacus)[212] and Eurasian eagle owl (Bubo bubo).[192] Accipitrid prey size ranges by body mass ranges from 237 g (8.4 oz) for a sparrowhawk to 3.13 kg (6.9 lb) in the imperial eagle and that of non-accipitrid raptors ranges from 58.5 g (2.06 oz) for the pygmy owl to 2.68 kg (5.9 lb) for the eagle owl and apparently both imperial eagles and eagle owls that were caught were adults.[41][210][191][213] As true apex predators, healthy adult white-tailed eagles have no known natural predators.[5][200]
The breeding season is from January to July in the south of the white-tailed eagles range, and from April to September in the northern part of their range.[11] They pair for life, though if one dies replacement can occur quickly. A bond is formed when a permanent home range is chosen. White-tailed eagles frequently engage during early spring variously in soaring, sky-dancing and other aerial displays, all with much loud calling, often performed by pair members together, including spectacular mutual cartwheel downwards where talons touch or interlock.[11][214] Nuptial displays may occur almost year-around in some parts of the range, increasing after young disperse in autumn, thence at rare intervals until spring when such behavior, of course, peaks.[34] Courtship often begins with a bird, often the male, "sky pointing" or "long calling" by throwing their head back. Soaring by pairs follows, with either partner leading by 1 to 6 m (3.3 to 19.7 ft) or soaring opposite directions. One may swoop upon the other who responds by tilting to one side or may roll over to touch talons momentarily before separating. This may be repeated or gain intensity until they are talon-grappling or "mutual cartwheeling", consisting of the pair locking talons mid-air and whirling earthwards in series of spectacular cartwheels. When doing this, the pair may stop only a few feet above the ground.[5][95][214]
Talon grappling is usually associated with territorial clashes in most accipitrids, especially between males, but in Haliaeetus such behaviour also seems to be related to courtship and is engaged by pairs as well as males attacking intruding males.[5][215][216] When locally common, 2–3 pairs can be seen displaying in the sky quite near each other but each pair in fact are within a border of a well-defined territory.[34] In Greenland, recorded pair densities were 0.3–0.6 occupied territories per 100 km2 (39 sq mi).[217] In eastern Germany, densities were reported as 1.6–2 pairs per 100 km2 (39 sq mi). Norwegian nests appear at no closer than 1–2 km (0.62–1.24 mi); territory size on Norwegian coasts were reported as roughly 6 to 9 km2 (2.3 to 3.5 sq mi).[33] Fischer noted 8–9 pairs on the small faroese island of Fugloy due to its huge seabird colonies, with late summer numbers boosting to 75 eagles, all within an area of only 22 km2 (8.5 sq mi).[136] Five occupied nests were noted on an 80 km (50 mi) stretch of the Russian Yenisei River.[136] Mating chiefly occurs between mid-March and mid-April in most parts of the range. The pair may copulate be about once every 20 minutes for several hours. Prior to mating, a more skilled and graceful flying than usual may be undertaken by the male as the final stage of courtship.[34] After his final display, the female crouches low, almost flat, with her head and neck outstretched, wings half open, and tail held level with the rest of the body. Mating has been recorded in white-tailed eagles to occur almost anywhere including a low perch, on the nest, on the ground or even on frozen lake surfaces, usually close to the nest at least but also at as far away from the nest as 3 km (1.9 mi) in Norway. Sometimes both members of the pair will assume the female's typical mating position simultaneously side-by-side until he jumps on her back. Once the male mounts he often calls loudly and flaps both wings to maintain his balance. After about 12 seconds he dismounts and sits quietly, ultimately will do so about 5 to 6 in 1.5 hours and at nearly any time of the day.[5][33][95]

White-tailed eagles most often nest in large trees, with perhaps coniferous trees preferred and nests may be in a high main fork, on the canopy or a large side branch.[34] Access to food is a key consideration in the nest's location in white-tailed eagles. In Germany, 75% of eyries were within 3 km (1.9 mi) of a lake, although one was 11 km (6.8 mi) away from any lake though was somewhat closer to the Baltic Sea.[218] 80% of German nests were described as being in forests but eagles exhibited preferences for wooded islands or promontories and most nests were usually towards edge of open space: a clearing, marshy ground or even agricultural land. Among the few eyries in open land were never more than 150 m (490 ft) away from woods. Only one cliff nest was recorded in Germany, on the Baltic island of Rugen. Older records indicated ground nests also recorded in the German Baltic region. Most German nests were at heights from 2 to 10 m (6.6 to 32.8 ft) off ground in the main fork of trees, rarely on ample horizontal tree branches.[136][218]
Tree nest height is partially based on tree species, i.e. in Romania, on black poplars (Populus nigra) and willows nest height would was recorded at 15 to 25 m (49 to 82 ft) of the ground but one was on a broken tree at only 7 m (23 ft) from the ground. There in the lower Danube of Romania beyond the mainly utilized black poplars and willows, one was on "a weak oak sapling", six on high, thick oaks, five in white poplars (Populus alba), two in beeches and one in a wild pear tree.[178] Another quote on eyrie height along the Danube was at 19 to 33 m (62 to 108 ft) above the ground.[95] Trees used for nests in Hokkaido were often the tallest in a stand, averaging 2.8 m (9.2 ft) higher than the average tree height in their stand. Tree species preferred here were Picea glehnii and Alnus japonica.[219] Nest height in Hokkaido was similar to that in Europe at 16.5 to 25 m (54 to 82 ft) above the ground.[130] In eastern Germany, among 177 nests, 65% were in mature pines, 22% in copper beeches (Fagus sylvatica), 8% in oak with the remainder in alder, elm, poplar and birch. The German eyries ranged in height from 8 to 30 m (26 to 98 ft), averaging 20 m (66 ft), usually in tallest trees available.[218] Nests can be on crags, whether or not trees may be available, depending on regional habitat.[34] In 98 Norwegian eyries, only eight were in trees, the rest were on cliffs. In comparison, against the 86% nests that were on cliffs in Norway, 79% known in Scotland were too, 77% in Iceland and all known Greenlandic nests were in cliffs or other rocky spots.[5][33][140][220] Nest height on cliffs can be over 75 m (246 ft) above the nearest flat ground.[11] Rarely, they may nest on the ground or a low hummock, as well as smaller trees, low bushes, on sand banks or among reed beds.[34] Showing their adaptability, one pair even nested on a buoy on a Norwegian shipping route.[33]
Nests are usually huge, constructed of sticks and branches, averaging roughly 1 m (3.3 ft) across and up to 2 m (6.6 ft) deep, but can be several metres in width & depth, lined variously with moss, greenery, seaweed or wool.[11] The nest must have easy access for the eagles with a clear view of the surrounding environment, shelter from the elements and protection from nest predators. In forest of Finland, it has been estimated that perhaps only one in a thousand trees will prove attractive to white-tailed eagles.[5] Cliff nests often include lesser materials, some may be only a scooped shallow depression of soil, or pile of heather or juniper stems with stipes of dried Laminaria, but also sticks up to 1.5 m (4.9 ft) and several cm thick may be incorporated; almost any material available may line the nests such as seaweed, driftwood, even glass or metal floats and, in one to two cases, the dried skeleton a sheep.[33] In tree nests, the average nest diameter is about 1.5 m (4.9 ft), with nests in trees tending to be larger, more rigid and stronger. A relatively new four-year-old nest weighed 240 kg (530 lb) and one about twice that age can exceed 600 kg (1,300 lb) in mass. Some tree nests may range easily up to 2 m (6.6 ft) in diameter and 3 m (9.8 ft) deep after many repairs over years, with extreme sizes of perhaps another metre in diameter and depth, or "twice the height of a man".[34][33][95][221] Tree nests may be lined with lichen, moss, seaweed, ferns, grass, woodrush, heather or Empetrum; many tree nests may be lined with sheep's wool.[5][33][220]
The male of the pair more often brings nesting branches, while the female takes the primary role in construction.[5] A nest may be added to by the resident pair at as early as December onwards, but usually do so starting in March at high latitudes. A new nest may take several months to construct, but if an old nest is lost in late winter, pairs have been known to build a new nest faster than average in less than a month, however egg laying may be inhibited in such cases.[34] Repair to an existing nest can take about 18 days.[5] White-tailed eagles have also used nests built by other species: black kite, common buzzard, common raven (Corvus corax) and, subsequent to the eagles evicting them, ospreys and red kites. Eastern imperial eagles, saker (Falco cherrug) and peregrine falcons have used old white-tailed eagles nests, in the two swift falcon species they've been recorded in evicting pairs of white-tailed eagles from their eyries with persistent dive-bombing.[120][95] In one case, after having been displaced by humans from an eyrie that had seen 30 years of white-tailed eagle use, an eagle pair returned to find the nest occupied by peregrine falcons. Despite many dogfights, the eagles constructed a nest higher up in the same tree. Although fighting continued, both species succeeded in raising one fledgling each.[222] In Norway, pairs of ravens, peregrines and white-tailed eagles have been known to successfully nest on the same cliff face.[33] Many small species of bird may nest in the immediate area of white-tailed eagle eyries, presumably due to incidental protection: Eurasian tree sparrow (Passer montanus), white wagtail (Motacilla alba), Eurasian treecreepers (Certhia familiaris), common redstarts (Phoenicurus phoenicurus), European crested tits (Lophophanes cristatus), Eurasian starlings and stock doves (Columba oenas).[120][136] Like in the golden eagle, pairs of white-tailed eagles often build multiple nests on their home range over time and use them randomly over different years (sometimes using one for several consecutive years or changing nests every year over several years). The species may build from 1 to 11 nests, averaging 2.5 in Norway with pairs with up to five nests being not uncommon in that country.[34][33]


Individual white-tailed eagles tend to be remarkably consistent on egg-laying times from year to year, seemingly regardless of surrounding weather conditions.[5][33] Egg laying does vary of course by latitude. Historic breeders from Israel and Iran (where they still usually breed) were reported to lay eggs in January, while in Greece and the lower Volga river it is during February, in Germany mostly during March and in the subarctic of Lapland, Finland and northern Russia, to as late as late April to early May.[76][75][140] White-tailed eagles in Scotland seem to have average egg laying about three weeks later, late March to early April, than those in coastal Norway.[5][33][178] Even near Arctic in Finland, eggs were found as early as 5 March despite ranging often to as late as May.[5] Younger pairs may nest later on average than older ones.[34] In white-tailed eagles, many (perhaps a majority) of clutches consist of two eggs, especially in Irish and Scottish nests, with three egg clutches being considered uncommon to rare there. Four egg clutches have been recorded on the Isle of Skye, as well as in at least Poland, Romania and Norway.[33][136][223] Clutch size in Scotland averages 1.56, while in Norway it is 2.16.[5][33] The eggs are a broad oval shape and dull white in colour, sometimes with a glossy sheen and are usually unmarked but for occasional yellowish stain.[34] Fresh egg weigh from 120 to 148 g (4.2 to 5.2 oz), with an average of approximately 135 g (4.8 oz) for the first egg and 124 g (4.4 oz) for the second. If replacement clutch is laid, usually a single egg is laid which may weigh as little as 112 g (4.0 oz).[95][178][224]
Average egg dimension seem to keep in accordance with the female body size, smallest mean size known were from Turkey where the average dimensions were 71.8 mm × 56.2 mm (2.83 in × 2.21 in) to the largest in three surveys from Greenland, where they were 78 mm × 59.3 mm (3.07 in × 2.33 in). In 54 eggs from Scotland they ranged from 67.5 to 84.2 mm (2.66 to 3.31 in), averaging 75.8 mm (2.98 in), in height by 53.4 to 64 mm (2.10 to 2.52 in), averaging 58.7 mm (2.31 in), in width.[120][76] In comparison, 90 eggs from mainland Europe ranged from 66 to 88.2 mm (2.60 to 3.47 in), averaging 73.4 mm (2.89 in), by 54 to 63.5 mm (2.13 to 2.50 in), averaging 57.6 mm (2.27 in).[34] Eggs may be compromised quickly by frost and snow in relatively early clutches.[34] Incubation starts as soon as the first egg is laid. In the species, a 2–3 day interval between the first and second egg being laid (as well as hatching) is recorded.[5][34] The female does up to 80–90% of incubation and all known nighttime incubating.[34] However, in Norway, the male of a pair could contribute up to about 27% of incubation to daylight hours. There may be as many as 11 changes of the incubating individual within a day. The longest period recorded the clutch was unguarded was 20 minutes, although one pair perched nearby the nest without incubating for 48 minutes. The clutches in Norway left alone only 2–4% of the time.[33] In some cases female may do all the incubation alone, however.[34] When the female is off the nest, she sometimes kills prey and returns with a full crop, but prey capture during incubation is often up to the male. Late into incubation, shift changes decreases and the female will sit tight and will crouch down at the approach of a human rather than leave the nest. Calling and displaying are reduced during incubation, but occasionally both may leave the clutch and display still.[34] The time range for incubation can vary from 34 to 46 days, but usually are between 38 and 42 days. A calculated mean time range for incubation of 38.3 days.[120][136]
In 1983, it was listed that brood size is one 56.5% of the time and two 40.8% of the time in eight studies from different parts of the range; only 2.5% of these studies had a brood size of three and only one from Norway was a brood size of four recorded. From 14 studies, the mean number of chicks in a brood may range from 1.1 in western Germany to 1.9 in southern Kazakhstan, with average overall brood size of 1.52. However, these datasets may be skewered lower than natural brood size as a majority these are from the mid to late 20th century when pesticide use considerably lowered the mean number of hatchlings in many parts of the range.[5][4][33][95] New hatchlings will weigh about 90 to 100 g (3.2 to 3.5 oz) but in Hokkaido new hatchlings were surprisingly notably heavier at 110 to 115 g (3.9 to 4.1 oz).[34][130] The sex of nestlings can be identified using field methods, or using DNA.[47] Initially, the hatchlings have a creamy white down which is longest and whitest on the head and often dirty grayish on wings and rump. Before they start walking about the nest, their underside may have several bare patches.[5]
The nestlings first become audible at around 2–3 days and have become active enough to move around the nest and excrete over the nest edge by 10 days old.[34] The initial down is replaced by a thick woolly coat of longer, coarser grayish down, which is usually darker on the crown, underparts and flanks. The legs and cere at this young nestling age can range from pinkish to pale yellow.[5] By about 30 days the first feathers poke through the down.[5] The eaglets can feed themselves starting at 35–40 days.[34] At six weeks (40 days) they are more firm on their feet and between this and the following week feathers take over the down, with patches of down remaining but usually gone by the seventh week.[5] Wing flapping begins only when the wings are partially feathered at 42 days.[34] Around seven weeks of age, the eaglet is more alert and stronger and frequently manipulates sticks and walks more so.[5] At eight weeks, only the long feathers of the wing and tail have yet to develop fully and eaglets tend to start exploring the surrounding branches.[5][34] The eaglets will attempt their first flight at about 70 days and will usually be flying well by about 90 days of age.[34][130] Fledgling occurs around mid- to late July in Norway, and about 3–4 weeks later in Russian White Sea.[33][75]
The female of the white-tailed eagle pair seems to do all the brooding early on and will be especially reluctant to leave the nest as well.[33][136] Thereafter, at 14 to 28 days, brooding behaviour by the female gradually declines.[34] The male may start to brood occasionally around this time period but will not do so at night.[33][136] Females may sit on the nest or shelter the fledglings from rain even 28 days after fledging but usually such behavior is much reduced.[34] Chicks may be fed as many as 11 times in 24 hours by the female who usually dismantles prey brought by the male.[5][33] To 28 days, male continues to do most of the prey capture but thereafter female does much of it and both parents begin to leave kills on the nest for the eaglets to consume.[34] As the chicks grow older, favored food often switches from fish to birds to meet their increasing food requirements as well as prey behavior as waterfowl may be flightless during eclipse.[5][33] Caches are often depleted quickly late into nestling development.[33] At start of fledgling, 4–5 carcasses may be brought in a week but by the end of fledgling, only one or two are usually brought, probably to encourage the young to start their own prey captures.[34] After leaving the nest, the young usually stay nearby for another 35–40 days and may still be largely fed by their parents but gradually learn to take their own prey.[34][130] In continental Europe, the young eagles are gone from the nest as early as the beginning of July to about 10 August and fully independent by late August. In this late summer stage, they may learn quickly to feed on stranded fish or to capture ducks flightless in eclipse. Juvenile eagles may remain for a long time on their parents range and apparently are not resented or repelled even to the ages of 1–3 years. However, usually by their first winter they will have congregated with other unrelated juveniles.[5][34] Communal juvenile roosts in Norway can maintain 30–40 white-tailed eagles usually in trees or steep slopes of offshore islands.[33] Sexual maturity is reached at 5–6 years of age.[5][33]
Normally, white-tailed eagles succeed in raising one or two young from a clutch of two, and two from a clutch of three.[34] The average breeding success seems to be about 1.1–1.6 young per annum (i.e. 45–48 young from 40 observed cases, with 16 failures) (1.6 young per pair in 93 recorded Norwegian nests).[34][33] About 33% of nesting attempts will fail to produce any young, and this is sometimes as many as 75% (at times of heavy persecution or pesticide use).[5] Beyond manmade threats to white-tailed eagle nestlings, starvation and nest collapse are considerable causes of nestling deaths.[5][34] Natural threats in the nest may also include siblicide (or "cainism") wherein the largest nestling behave aggressively and gradually kill their smaller sibling, which is often consumed.[225] Despite claims to contrary,[34] siblicide in white-tailed eagle does occur with some regularity in some parts of the range, from Germany to Hokkaido although is certainly less frequent than in some eagle species, including the golden eagle.[5][130][226] Single cases were reported in the White Sea and Iceland, and it may occur situationally as in many birds of prey when prey populations are low or prey capture is inhibited by poor weather.[75][227] Siblicide can be avoided in white-tailed eagles with manipulative techniques, which may include taking out and hand-rearing the runt, put a chick into a nest with slightly younger brood which it is about the same size as, or taking the first egg out and putting it back in later so it develops evenly with its younger sibling. Surplus chicks are sometimes removed from nests to use in reintroduction programs in areas where the species has died out. If left in the nest, they often die sooner or later, as with most large eagles. In such programs the birds are raised in boxes on platforms in the tree canopy and fed in such a way that they cannot see the human supplying their food, until they are old enough to fly and thus find their own food.[214][228]
Known natural predators of white-tailed eagle eggs and nestlings include red foxes, martens and bears, especially if nesting in overly accessible rock formations, while wild boars have been recorded eating eggs and nestlings that’ve fallen out of the nest too early. Avian predation, overall a seemingly rare occurrence, of white-tailed eagle eggs and nestlings have been reported as crows, common ravens and western marsh harriers, which are likely to succeed in cases where nest attendance is low or if successful in driving away the parents via fierce mobbing.[5][75][136] Furthermore, Eurasian eagle owls have been reported to prey upon "fairly large" nestlings of white-tailed eagle in nighttime ambushes.[192] Many juveniles do not survive their first year post-independence. In the 1970s, an average of 56% banded first-year white-tailed eagles in Norway, Sweden and Greenland were found dead, most often having been shot.[93][229][230] In eastern Germany, of 194 white-tailed eagles found dead between 1946 and 1972, of those where cause of death could be determined, 39% had been shot, accidents (especially powerlines) accounted for 6%, territorial disputes 7.5% and conservatively 13% were from poisoning.[218] It is estimated that the survival of those that reach adulthood at 70%.[40] Another estimate of average lifespan for those who reach adulthood is just over 12 years.[34] Widely reported individuals have been found to live for 25 years or more,[231] Another estimate of mean lifespan (presumably without persecution) is 21 years.[19] At one point, the oldest banded white-tailed eagle known in the wild known lived for 27 years. However, a wild eagle of the species was subsequently recorded to life for 33.1 years. White-tailed eagles in captivity have lived for more than 40 years, though their exactly captive longevity record is not known.[5][229][232] A male white-tailed eagle that was ringed as a chick on the Isle of Skye in 1994, was recorded on the Isle of Mull in early 2022 at the advanced age of 28 years old.[233] His mate, a female white-tailed eagle that hatched in 1992 on Mull, will now be 30 years old although her identity has not been confirmed.[234]
The white-tailed eagle formerly bred over much wider area, extending west to much of western Europe and perhaps south almost continuously in that region to the Mediterranean. From the 19th century, the species underwent a huge, well-documented decline. Ultimately the white-tailed eagle was almost extinct in Europe, extirpated from all but Fennoscandia (mainly remaining in Norway) and some sparse patches of eastern Europe. They were extinct in the entire British Isles by the early 1900s.[5] At one time, the white-tailed eagle bred down to Egypt in Africa, particularly around Lake Manzala with individuals wandering rarely to Algeria and Tunisia. It is likely that habitat degradation and drying conditions caused the extirpation of the species as all but a vagrant in Egypt.[235] Two pairs that nested in the Jordan Valley ceased to breed, apparently due to agricultural chemicals, in the early 1950s.[5] The species also once bred in northern Syria but is not found reliably there even in winter in modern times.[40]
In Britain, the opinion towards white-tailed eagles became negative in sync with the creation of farmland and commercial fishing, as it was quickly perceived that they were competitors for resources and could deplete the livelihood of flocks for shepherds (despite this being largely untrue) and game animals for gamekeepers. Therefore, laws were passed to facilitate their destruction.[5][236] Already by the end of the 18th century, down from breeding in all appropriate habitat, the English population was down to only localized breeding, namely in the Isle of Wight, Lundy, Isle of Man and (probably) near Plymouth; within a couple of decades the species only remained in the Lake District.[178] Before the advent of firearms, few people in England and Scotland were highly motivated to kill eagles since this could be time-consuming and hazardous process, therefore the British government rose the bounty on eagles to a very high 5 shillings a head by the turn of the 18th century.[5] Unfortunately, eyries in many coastal sites were found to be easily accessible so that destroying or selling eggs was common. Subsequent to systematic persecution, in Greenland 62% of eyries found to be "easily accessible" and only 13% foiled all attempts to reach them. Similar findings were found in sea cliff nests in Iceland, Norway and Scotland.[5][33][220]
White-tailed eagles are more vulnerable to direct persecution than golden eagles since most nests are highly accessible for white-tailed eagle but not for golden eagles which usually nest in mountainous, precipitously rocky terrain, in contrast to sea cliff nests of which 67–87% were found to be accessible.[5][140][220] Before firearms were widely available in Scotland and Norway automatic traps were utilized wherein carrion was laid out to entice an eagle with a person hiding in a near subterranean trap waited until the eagle was distracted, at that point grabbing the eagle by the leg. Petrified by the darkness once dragged below, white-tailed eagles apparently offer no resistance once caught. However, habitat had to be favorable and even when conditions were correct, success at capture as such was low.[5][33][178] The main driver of declines before firearms and industrialized poisons was habitat alterations.[5] After about the 1840s, firearms became available and declines accelerated considerably, by 1916 the last nesting pair in all of Britain attempted to raise a brood on the isle of Skye. While other ecological factors have been considered in this decline, stringent research has shown the extirpation here was fully correlated to intentional, rapacious predation by man.[5][178] Many gamekeepers poisoned and shot eagles and destroyed nearly any nest they encountered. A few more enlightened landowners forbade the killing of eagles but there's evidence that the gamekeepers sometimes chose to destroy eagles regardless of the rule of law. On deer forest, eagles were tolerated later than in other British areas, but destructions accelerated there by the late 1800s.[5] Also many white-tailed eagles were poisoned by shepherds who considered it enemy of the flock.[237] Elsewhere in Europe, persecution rates in the 19th and 20th century were just as drastic. In Romania, more than 400 white-tailed eagles were killed in two decades by a single hunter.[71] In Norway between 1959 and 1968, an average of 169 eagles were killed annually; with a maximum of 221 in 1961.[33] Around the year 1860, an author estimated that about 400 were being killed annually throughout Germany.[71] Between 1946 and 1972 in eastern Germany, a total of 194 dead white-tailed eagles were found, about half of them shot, after governmental protection of the species had been instituted there.[218]
Top predators, especially those that are aquatic and coastal, are almost immediately vulnerable upon exposure to DDT. Therefore, white-tailed eagles are highly susceptible to this pesticide, as are similar fish eaters, such as otters, and bird eaters, such as peregrine falcons. Distributed by man nearly across the developed world as an insecticide in the 1950s, by the early 1970s, authors found many species of bird experienced reduced egg shell thickness. Thus the incubating parents inadvertently crushed their normally hardy eggs and, in turn, many water birds and raptors had their nesting success dropped precipitously.[238] In fact, the species was found to have the highest concentration of DDT of any European raptor.[239] Egg shell thickness was found down from 0.62 mm (0.024 in) prior to 1935 from 1969 to 1975 down to only 0.52 mm (0.020 in), a 16% reduction.[240] In Sweden, coastal birds were considerably more effected by DDT than the inland birds of Lapland, Sweden.[229] In eastern Germany, where pesticide use was heavy, only 1 out of 28 nesting attempts were known to succeed in 1976.[5] Overall, about 75% nesting attempts failed in western Germany, Finland and the Swedish Baltic area.[5] Other environmental pollutants affecting the species include heavy metals which affect individuals through bioaccumulation. The amount of white-tailed eagles killed by mercury poisoning rose from 6.4% during 1946–1957 to 24.6% in 1958–1965 in Germany.[241][242] It was estimated that pesticides and metal contaminations reduced the white-tailed eagle population in Hungary from 1957 to 1967 by about 50–60%.[71] Lead poisoning, caused by lead bullets left in carcasses that the white-tailed eagles will eat in winter, is also another issue faced by the species. Fatal and near fatal levels of lead exposure continues to be a major issue in the 21st century in many parts of the range, at least from Poland to Hokkaido.[243][244][245] Despite regulations on their usage, lead and mercury poisonings were found to be the cause of death of 61 white-tailed eagles found in Germany from 1993 to 2000.[246]

In order to offset the numerous chemical and metal based poisoning that humans were inadvertently exposing the species to, a widespread operation was undertaken to feed white-tailed eagles uncontaminated foods in Sweden. Here, carcasses from slaughterhouses placed in areas free of human disturbance, usually fields, bogs, marshes or frozen lakes, from October to March (after these months, the eagles will ignore carrion in favor of capture of live prey). Apparently, breeding success improved from 29% to 44% when the program began. In southern Sweden subsequent to the feedings, 5 of 11 breeding pairs were successful and two previously unoccupied territories were taken over by new pairs, thus winter feeding was seemingly highly beneficial to local eagles.[229][247] Similar winter feeding stations set up in Finland from 1972 to 1978.[248] In Sweden, brood size has varied from 1.3 per nest prior to 1950, down to 0.3 in 1965–1985. Now the brood sizes have increased, at somewhat less than one brood size on average, but still somewhat less productivity than historical numbers.[249]
In several parts of the European range, especially southern Scandinavia and central Europe, protections have allowed white-tailed eagles to recolonize former parts of their range.[5] Since recolonizing Schleswig-Holstein, Germany in 1947, numbers have increased slowly; from 1975–2008, increases were recorded at 6.7% in population per annum and enjoyed much higher productivity.[12] Perhaps particularly key has been conserving white-tailed eagle habitats. In the 1970s, 75% of the potential and current white-tailed eagle territories became protected in Schleswig-Holstein.[71] In Poland, 78% of forests are state owned and clusters of 10 or more trees are preserved around each white-tailed eagle eyrie.[68] The Swedish Forest Service limits logging activities to within 200 m (660 ft) of a nest tree which expands to within 1,000 m (3,300 ft) during breeding season; however this acts not as a law but only as an advisory where the eyries are located on private land.[229] Limits on recreational activity were established as these can disturb white-tailed eagle nests especially in well-trodden countries such as Germany and Sweden, but even in the remote Russian Kandalaksha.[5][75] In northern Finland, artificial eyries were constructed for their use. Out of 19, 14 were visited by white-tailed eagle, eggs laid in at least nine, and two ultimately fledged young.[65] Regulations have been established on direct use of pesticides that harm white-tailed eagles such as DDT, however because of political variances, despite widespread monitoring, not at all areas are strictly protected.[250][251] Similarly, regulations on lead usage in hunting has been inconsistent in comparison with the stronger efforts to ban lead bullet fragments in North America.[252] The residuals of mercury from various fungicides (now banned), air particles and pollution run-off water have caused huge concentrations in fish of many different areas, which continues to effect humans as well as entire ecosystems of wildlife. Unfortunately, methylmercury is still difficult to manage in Europe as it is elsewhere.[238][250][253]

The first attempts at reintroduction in Scotland were in 1959 in Glen Etive, Argyll abortively, followed by a better informed but also ultimately unsuccessful attempt on Fair Isle in 1968.[5] Successful reintroduction into Scotland did not occur until the 1970s, with the isle of Rùm in the inner Hebrides being chosen because of its large size (10,600 ha (26,000 acres)) with access to the Isle of Skye (where last native pair known in Britain last bred in 1916) and it is only 24 km (15 mi) from the mainland. Also Rùm hosts large seabird colonies that make for viable prey, including eider (Somateria mollissima), shag (Phalacrocorax aristotelis), auks and gulls; as well as one of the few in Britain of manx shearwater (Puffinus puffinus). Furthermore, mainly as a source of carrion, were a population of around 1500 red deer and 200 feral goats; otters and gulls were also numerous and available to kleptoparasitize.[5][13] The birds to be used for reintroduction were gathered as nestlings from western Norway, as this is the nearest native breeding population. The young eagles were either kept in high grade fowl cages or tethered all within reach of an artificial eyrie, cover and feeding stations. Direct human contact, which the naturally wild young eagles tended to shun anyway, is minimal short of veterinary care. Releases were carried by taking bird out tethered, wearing a leather hood to prevent imprinting and then releasing with a radio-monitor. Most of the eagles, despite no direct parenting, turned out to be competent hunters within a couple of weeks or do well at stealing meals, including from other released eagles. Despite some dying before release due to illness and some found dead subsequent to release, most survived. A total of 95 birds were received for the Rùm reintroductions and 82 were successfully released between 1975 and 1987.[5][13] The white-tailed eagle now breeds throughout the Western Isles and the mainland coast of Wester Ross. However, a low reproductive output of reintroduced Scottish eagles was recorded in 1996, and it was advocated that additional releases were needed.[254] In August 2008, an additional fifteen chicks raised in Norway were released at a secret location in Fife, in expectation of reintroducing the species to the east coast of Scotland as well.[255] Breeding success of reintroduced birds in Scotland (from 1975–1985 & 1993–1998) is moderate compared overall in species, in 1982–1992: productivity was 0.38, with a mean fledgling number 1.61. In comparison, for the years 1993 to 2000, productivity was 0.61 and fledgling number was 1.48, while in 2000–2007, productivity was 0.7 and mean fledgling number 1.44.[256] Overall in Britain, there are estimated 36 breeding pairs in 2006 and 40 in 2008.[19][257][258] Juvenile survival rates are somewhat low overall compared to other areas.[256] Reintroduction efforts succeeded in the Bohemia area of the Czech Republic as well, where the biologists similarly followed the guidelines of guarding of occupied eyries and provision of safe foods.[11][259][260]
The white-tailed eagle is also being reintroduced to Ireland, where its Irish name of Iolar Mara (sea eagle) reflects its historic association with the island's long coast. The Irish program was begun in the summer of 2007. Fifteen to twenty young eagles from Norway are being released each spring into the Killarney National Park in the south-west of Ireland. This comprehensive project will last a number of years, with many more eagles being released. The species has a rich history on the island but became extinct in Ireland in the 1900s due to persecution from landowners.[261] The last pair bred on the coast of Mayo in 1912.[262] In 2007, a hundred local sheep farmers gathered at Kerry airport to protest the eagles' arrival. Irish Farming Association Hill Committee chairman Mr O'Leary said he had no doubt the eagles would take lambs.[263] Since their reintroduction seven eagles have been confirmed poisoned in County Kerry, two suspected of having been poisoned, and one shot. A 13th eagle released in Kerry was shot in Northern Ireland. Twenty more eagles were due for release in 2010. However, Dr Allan Mee, in charge of the sea eagle project, stated "the continuing loss of eagles to poisoning had cast a shadow over the future of the ambitious programme."[264] The first white-tailed eagle breeding pair since 1912 nested one hundred years later on Lough Derg (Loch Deirgeirt), marking a great success for the Irish reintroduction programme.[265] In early May 2013, the first eaglets were born in Ireland since the re-introduction programme began; one in the Killarney National Park and two in County Clare.[266] In Spring 2015, five nests hatched chicks in four counties in Ireland – Clare, Cork, Galway and Kerry.[267]

In 2019, a reintroduction project on the Isle of Wight was approved by the British government. It is hoped that establishing a breeding population in the coastal county will lead to the species re-colonising the South Coast.[269] Following the release of six juveniles on the island in 2019,[63] individuals were sighted across Southern England, and one of the six, a male named Culver (after Culver Down, a local landmark on the Isle of Wight near the town of Sandown) embarked on a tour of South-East England shortly after being released, and was sighted over Central London after ranging through Hampshire, East Sussex and Surrey, continuing through Essex, Kent and West Sussex.[270]
In May 2021, the group leading the Isle of Wight reintroduction project, the Roy Dennis Wildlife Foundation, were given permission by Natural England to start a second reintroduction project, this time in Norfolk, thus reintroducing the white-tailed eagle to East Anglia. Up to 60 birds are to be released over a span of 10 years at Wild Ken Hill in West Norfolk.[271]
Densities of white-tailed eagles have greatly increased in some parts of the range due to conservation efforts. Some threats still remain, notably illegal persecution by gamebird shooting and egg thieves in Scotland.[258] In prime habitat in north Europe, distance between breeding pairs can be only 4 km (2.5 mi) (even as little as 1–2 km [0.6–1.2 mi] locally) such as in Norway, density at one Polish forest were even reported at 6–7 in each square kilometer.[11] In the late 1990s, it was estimated that Russia held as many as 5,000 to 7,000 pairs, with around 175 pairs in Greenland and almost 3,500 pairs in Europe, led by Norway (1,500+ pairs), European Russia (900–1,100), Poland (180–240), Germany (140–150) and Sweden (100–150).[11] The largest population in Europe is found along the coast of Norway.[1][272] The Norwegian population in 2008 was claimed to have stood at 9,000–11,000 pairs, much larger than prior estimates, and indeed this may refer to the total number of individuals rather than total breeding pairs.[5][11][19] Even in the early 1980s, Norway maintained a population greater than all other European white-tailed eagle populations combined.[5] In isolation, Turkey holds merely 10–30 pairs.[11] Over 500 winter in Japan, mainly Hokkaido, but this island may have only 20 pairs breeding.[11] Strong increases were recorded in Croatia, with no less than 135 breeding pairs estimated in Croatia by 2009, up from only 25–30 in 2007.[87][273]
Beyond the threat of chemical poisonings, a new threat from wind turbines is emerging with significant mortality (considerably in excess of the area's population productivity) occurring at the Smøla Wind Farm in Norway.[274][275] From 2005 to 2010, 36 birds were killed by wind farm on the isle of Smøla, including four of the 45 recent radio-tagged fledglings. Breeding attempts within 500–1,000 m (1,600–3,300 ft) of the wind farm were considerably reduced in success. The white-tailed eagles of the region seem to have no behavioral avoidance capabilities, as in many raptors, since the blades are not visible at close range.[276][277][278] In a recovering population in north-east Germany, a trade-off between the distance to neighbouring breeding pairs and to the nearest water body (the birds' favoured foraging habitat) was found. This indicates that pairs may be increasingly selecting suboptimal habitats to reduce competition as the population increases, and has implications in the management of such populations.[279]
White-tailed eagles have apparently re-established themselves as a native breeding species in numerous countries: Austria (now breeding in extreme northwestern portions), Denmark (where broadly re-established as breeders), the Czech Republic and Slovakia (scattered pairs in both now with reintroductions factoring in the Czech Republic), Hungary, and Bulgaria.[1][5] In Denmark (excluding Greenland where the species never was extirpated as a breeder and there are 150–200 pairs in the south),[62][280] the breeding population increased from none in 1995 to at least 37 pairs by 2011.[66] In 2021, there were more than 150 breeding pairs in Denmark, far surpassing the initial goals of the species' recovery program in the country. From 1996 when the first pair bred to 2021, altogether more than 1,350 young have fledged.[89][67] In Hungary, re-establishment (starting from none in the 1970s) has also been a success, where 114 out of 166 breeding pairs by 2007 were successful producing altogether 182 fledged young. Wintering Hungarian population may now reach about a thousand eagles.[281] In Lithuania, back in 1985 no pairs were known to have bred but established pairs numbered 90 by 2007 and swelled to 120 by 2011.[282] On 22 May 2006, it was announced that a pair of white-tailed eagles breeding in the Oostvaardersplassen nature reserve in the Netherlands had arrived on their own, not as a reintroduction. This was the first time the bird has bred in the Netherlands in living memory. In 2007, 2008 and 2009 the eagles returned to their nest. The Dutch national forestry, which owns the reserve, installed a webcam trained on the nesting eagles.[283] In 2010, it turned out that the white-tailed eagle was also breeding in the Zwarte Meer nature district and in the Lauwersmeer area.[284] There is also a confirmed case of breeding white-tailed eagles in the Biesbosch. Currently (2023), there are over twenty pairs breeding in the Netherlands.
Studies of microsatellite and mitochondrial DNA in white-tailed eagles from north-central Europe have shown that the recovering European population has retained appreciable amounts of genetic diversity, implying low risk of inbreeding depression (a serious concern in species with low population density). Therefore, recovery of this formerly endangered species is a true success story for nature conservation. The story also shows how local protection of a species can be successful and important for preserving the species' evolutionary potential.[285][286][9] As of 2013, the IUCN estimated the total population of mature breeding white-tailed eagles at 20,000–49,999 individuals.[1]
White-tailed eagle are prominent in ancient Saxon folklore and artwork with many landmarks named after the species. It is believed to be the White eagle shown in the German Coat of arms, Polish coat of arms and in the Serbian coat of arms.[272] The sea eagle is often blazoned grasping a fish (usually a pike) in its talons, distinguishing it from an ordinary eagle.
On Orkney, Scotland, sea eagle bones have been found in 6,000-year-old burial mounds, among them the Tomb of the Eagles, suggesting that the birds were revered by the prehistoric people there, a belief strengthened by the Pictish stone carvings of sea eagles from Orkney.[19] Cut marks have been found in white-tailed eagle talons in Krapina, suggesting Neanderthals' use of jewellery.[287]
In the Shetland Isles, Scotland, fishermen believed that as soon as a sea eagle appeared fish would rise to the surface, belly up; this led to some fishermen using eagle fat, smeared on their bait, to increase their catch.[19]
The white-tailed eagle (Haliaeetus albicilla) is a very large species of sea eagle widely distributed across temperate Eurasia. Like all eagles, it is a member of the family Accipitridae (or accipitrids) which includes other diurnal raptors such as hawks, kites, and harriers. One of up to eleven members in the genus Haliaeetus, which are commonly called sea eagles, it is also referred to as the white-tailed sea-eagle. Sometimes, it is known as the ern or erne (depending on spelling by sources), gray sea eagle and Eurasian sea eagle.
While found across a very wide range, today breeding as far west as Greenland and Iceland across to as far east as Hokkaido, Japan, they are often scarce and very spottily distributed as a nesting species, mainly due to human activities. These have included habitat alterations and destruction of wetlands, about a hundred years of systematic persecution by humans (from the early 1800s to around World War II) followed by inadvertent poisonings and epidemics of nesting failures due to various manmade chemical pesticides and organic compounds, which have threatened eagles since roughly the 1950s and continue to be a potential concern. Due to this, the white-tailed eagle was considered endangered or extinct in several countries. However, some populations have recovered well due to some governmental protections and dedicated conservationists and naturalists protecting habitats and nesting sites and partially regulating poaching and pesticide usage, as well as careful reintroductions into parts of their former range.
White-tailed eagles usually live most of the year near large bodies of open water, including coastal saltwater areas and inland freshwater lakes, wetlands, bogs and rivers. It requires old-growth trees or ample sea cliffs for nesting, and an abundant food supply of fish and birds (largely water birds) amongst nearly any other available prey. Both a powerful apex predator and an opportunistic scavenger, it is considered a close cousin of the bald eagle (Haliaeetus leucocephalus), which occupies a similar niche in North America.
La Blankvosta maraglo (Haliaeetus albicilla[1]) estas birdo konata ankaŭ kiel simple Maraglo, tio estas rabobirdo el la ordo de falkoformaj birdoj de familio Akcipitredoj kiu inkludas aliajn rabobirdojn kiel buteoj, akcipitroj, milvoj, cirkuoj kaj veraj agloj.
Ĝi estas konsiderata proksima parenco de la Blankkapa maraglo kaj okupas la saman ekologian niĉon, sed en Eŭrazio.
Ĝi estas granda birdo, 76–92 cm longa kun enverguro de 190–250 cm. Inoj estas sufiĉe pli grandaj ol virbirdoj kaj pezas 4 ĝis 6,9 k; la viroj de 3,1 ĝis 5,4 k. Ĝi estas la kvara plej granda aglo en la mondo.[2]
La Blankvosta maraglo havas larĝegajn flugilojn, grandan kapon kaj maldikan bekon por tranĉi viandon. Plenkreskuloj estas ĉefe brunaj – ju pli brunaj dorse kaj ĉefe des pli sube – escepte pli palajn – helbrunaj – kapon kaj kolon, nigrecajn flugilplumojn kaj tre diferencigan voston – pure blanka (kio nomigas la specion)– kaj flavajn bekon kaj krurojn. Junaj birdoj havas pli malhelajn voston kaj bekon, kies vosto iĝas blanka kun malhela bordo ĉe nematuruloj.
Ne estas agnoskitaj subspecioj spite la ampleksan mondan disvastigon.
Kelkaj individuoj vivis pli da 25 jaroj,[3] sed ĝis 21 jaroj averaĝe.[2]
Ĝi estas granda precipe palearktisa birdo kiu reproduktiĝas en nordorienta Europo (Skandinavio, Islandio, Groenlando kaj oriente de linio el Pollando al Slovenio) kaj Azio (Turkio, tuta Siberio kaj norda Ĉinio). Ekzemple en Ĉinio ili vivas en la Nordoriento kaj la malsupra baseno de Jangzi-rivero.
Dum migrado ili videblas en ĉiuj apudmaraj provincoj de Ĉinio kaj travintras en la regiono sude de Jangzi-rivero. Ili estis sukcese reenmetitaj en okcidentaj insuloj de Skotio, kaj nun reproduktiĝas en insuloj Mull, Skye, Lewis kaj marbordo de Wester Ross. La plej granda birdaro troviĝas ĉe marbordo de Norvegio. En 2006 unuafoje paro da maragloj reproduktiĝis en Nederlando, nome en natura rezervejo Oostvaardersplassen.
La tutmonda populacio en 2008 estis nur de 9,000 - 11,000 paroj.[2]
Ili vivas ĉemare, sed ankaŭ proksime de iuj ajn lokoj, kie estas akvo, ĉu arbaro, ebenaĵo, terkulturejo, eĉ urbaj zonoj, kie ne longedaŭras. El altoj ĝis 2.000 m super marnivelo.
Malgrandaj disaj populacioj de loĝantaj birdoj estas en plej sudokcidenta Gronlando kaj okcidenta Islando. La unuaj estis proponitaj kiel diferenca subspecio groenlandicus baze sur ties tre grandaj grando kaj korpoproporcioj. Tamen, la specio estas nune konsiderata monotipa kaj la grandovario estas klina laŭ la Regulo de Bergmann. Ĵusa genetika studo de DNA kongruas kun tiu ideo. Gronlandaj blankavostaj maragloj estas, laŭ temposkaloj de evoluo, relative ĵusfondita populacio kiu ankoraŭ ne akumulis multajn unikajn genetikajn karakterojn. Tamen, la populacio ŝajne estas demografie izolata kaj meritas specialan protekton.
La Blankavosta maraglo formas kriptan specikomplekson aŭ pli precize speciparon kun la Blankakapa maraglo. Tiuj diverĝis el la aliaj maragloj komence de la Mioceno (antaŭ ĉ. 10 mj) plej malfrue, eble (se la plej antikva fosilio estas ĝuste atribuata al tiu genro) tiom frue kiom je komenca aŭ meza Oligoceno, antaŭ ĉirkaŭ 28 milionoj da jaroj.
Kiel ĉe aliaj paroj de maragloj, ankaŭ tiu konsistas el blankakapa (la Blankakapa maraglo) kaj flaveckapa specio (tiu ĉi). Ili probable diverĝis en Norda Pacifiko, kaj etendiĝis okcidenten al Eŭrazio kaj orienten al Nordameriko. Kiel ĉe la tria norda specio, la Granda maraglo, ili havas flavajn kalkanumojn, bekojn kaj okulojn ĉe plenkreskuloj.
Birdoj estas plejparte specio de loĝantaj birdoj, nur la plej nordaj – ĉefe en Rusio kaj Azio – migras suden vintre. Junuloj povas elflugi 1.000 km disde sia regiono, do ili estas videblaj sufiĉe for de ties nestolokoj. La birdoj vivas en la marĉoj apud maro aŭ rivero. Escepte de la pariĝa tempo, ili foje loĝas malproksime de akvo, sur stepo aŭ monto ĝis 1.400–1.500 super la marnivelo. Ili kutime agas solaj, sed post la genera tempo ili ofte vivas kun siaj idoj. Ili flugas rektalinie kaj malrapide. Ripozante, ili sidas sur roko aŭ tero, aŭ staras sur arbo longtempe. Temas pri tre socia specio, ĉefe inter junuloj kiuj foje ripozas samloke. Plenkreskuloj plej ofte estas solaj aŭ poparaj, sed ili povas manĝi kune.
La Blankvosta maraglo manĝas diverse, inkludante fiŝojn – grandajn ĝis salmo –, birdojn – ĉefe anasojn –, kiujn prenas perkrife aŭ forrabas de aliaj rabobirdoj, kadavraĵojn -kaze de malabundo aŭ rubaĵo de fiŝkaptistoj- kaj foje eĉ ronĝulojn, kiel leporon, raton, kaj birdojn kiel tetraon kaj otidon. La maskla birdo manĝas tre rapide, dum la femala subtile. Ili povas manĝi multe en unu fojo, tamen. Ili ankaŭ povas resti longe sen manĝi. Oni konstatis post observado, ke ili povas vivi ĝis 45 tagojn sen manĝi.
Tiu maraglo povas esti povega ĉasisto. Loke ĝi povas konkurenci fiere kun la Reĝa aglo pri kunikloj kaj leporoj kaptataj. La ĉiutaga postulo estas de 500-600 g. Kvankam malplej aktiva ĉasisto ol la Reĝa aglo, kaj kutime malvenkinta en rekta konkurenco por manĝero, ili povas ekzisti je pli altaj populacidensoj kaj eĉ konkurenci kun la Reĝa aglo pro siaj pli longaj intestoj kaj pli efika digestosistemo, kiu permesas ĝin vivi pli bone kun malpli da manĝo.
En Baltio, la dieto de la maraglo konsistas ĉefe de marbirdoj (el la Malgranda ŝterno al la Granda rabmevo) kaj ezokoj. Ĵuse oni informis, ke ĝi atakis kaj manĝis ekzemplerojn de granda kormorano.[4] La kormorano estas invada specio en Baltio, kaj la maraglo povus esti valora selektokontrolilo de la kormorana populacio.
La Blankvosta maraglo estas sekse matura post 4 aŭ 5 jaroj. Ili pariĝas porvive, kvankam se unu membro de la paro mortiĝas, anstataŭo povas okazi rapide: parligo estas formata kiam oni elektas daŭran hejmoteritorion. Ili havas karakteran aeran pariĝan ceremonian memmontradon kiu finas per paro kroĉita ĉe kalkanumoj mezaere kaj ruligante teren per serio de spektaklaj turniĝoj. La Blankavosta maraglo estas multe pli voĉema ol la Reĝa aglo, ĉefe dum la reprodukta sezono kaj ĉefe la masklo kiam estas ĉe la maraglejo. Alvokoj povas foje preni formon de dueto inter la paro.
La nesto estas granda konstruaĵo el bastonetoj en arbo aŭ marborda klifo; malofte surgrunde. Nestoj estas ofte reuzataj kaj oni aldonas ĉiujare pli da bastonetoj. La Blankvostaj halietoj konstruas neston sur krutaĵo ĉe maro aŭ sur pinoj, kverkoj, ulmoj kaj alispecaj arboj. Ilia nesto estas 6–25 metrojn supergrunde. La nesto estas farita el branĉoj, en formo de dika telero, kun sternitaj branĉetoj, arboŝeloj, plumoj, musko kaj herboj ene. Ĉiujare dum pariĝo ili plej ofte uzas sian malnovan neston, kiu pligrandiĝas jaron post jaro. Ĝi havas diametron de 1,5–2 m. kaj altecon de 1–1,5 m., sed la nove konstruita nesto estas unu metron larĝa. Reuzado foje okazas dum jardekoj fare de sinsekvaj generacioj de birdoj; unu nesto en Islando estis uzata dum ĉirkaŭ 150 jaroj. En Skandinavio, oni konas arbojn kiuj falis pro la pezo de enormaj, delonge setlitaj nestoj.
La teritorio de la Blankavosta maraglo havas gamon el 30 al 70 km², kutime en ŝirmitaj marbordaj lokoj. Foje ili troviĝas interne ĉe lagoj kaj laŭlonge de riveroj. La teritorio de la Blankavosta maraglo povas koincidi kun la teritorio de la Reĝa aglo, sed la konkurenco inter ambaŭ specioj estas limigita. La Reĝa aglo preferas montojn kaj marĉojn, dum la Blankavosta maraglo preferas marbordon kaj maron.
Paroj produktas unu ĝis tri blankajn – iam kun malhelokraj makuloj – ovalajn ovojn ĉiujare dum 2 al 5 tagoj marte aŭ aprile. Kovado kaj idomanĝigado – farata ĉefe de ino sed fakte de ambaŭ gepatroj – daŭras el 35 ĝis 45 tagojn. Post eloviĝo, la idoj estas sufiĉe toleraj unu de alia, kvankam la unua eloviĝinta estas ofte pli granda kaj domina ĉe manĝado. Idoj elflugas post du aŭ tri monatoj kaj estas zorgataj dum unu aŭ du pliaj monatoj.
Idoj verŝajne nezorgotaj aŭ endanĝerita antaŭ pli aĝa frato aŭ pli granda aglo estas prenataj de konservistoj por reenmeto en regionoj, kie la specio malaperis. Tiuj idoj estas bredataj tiel, ke ili ne vidas bredantojn, por ne alkutimiĝi al homa ĉeestado, ĝis kiam ili estas sufiĉe fortaj por elflugi kaj manĝi per si mem.
La Blankavostaj maragloj estas pintopredantoj. Tiele ili suferas bioakumuladon el mediaj poluantoj kiuj estas en ties predo, kaj suferas ankaŭ intensan persekutadon fare de ŝafistoj kaj ĉasgardistoj kiuj konsideris ilin (kutime malprave) kiel minaco al ties brutaro kaj ĉasbirdoj. Dum la periodo de 1800-1970, la Blankavostaj maragloj en plej parto de Eŭropo suferis grandegajn malpliiĝojn, kaj formortis en multaj regionoj de okcidenta, centra, kaj suda Eŭropo. Dum Norvegio, Germanio, Pollando, kaj Islando hejmis la plej grandajn survivantajn populaciojn, nur malmultaj reproduktantaj paroj restis en kelkaj aliaj landoj. Intensa konservado ĉe multe de la restanta eŭropa distribuado (leĝa protektado por malpliigi ĉasadon, protektado de reproduktejoj kaj de vintra manĝado) kondukis al rekupero de multaj lokaj populacioj. El la 1980-aj jaroj, la populacio de Blankavostaj maragloj rekuperiĝis rapide kaj etendas okcidenten. Ĝi nune jam rekoloniigis kelkajn tradiciajn reproduktejajn areojn en Eŭropo kaj rekupero estas ankoraŭ pliiĝanta, helpata ekzemple en Irlando kaj Britio per reenmetaj skemoj.
Kelkaj minacoj ankoraŭ restas, ĉefe kontraŭleĝa persekutado fare de ĉasbirda pafinteresoj kaj ovorabado en Skotio,[5] kaj nova minaco el ventoturbinoj komencis per grava mortindico (ege konsiderinda por la populacia produktiveco de tiu areo) ekzemple ĉe Ventofarmo Smøla en Norvegio.[6][7]
La specio estis sukcese reenmetita en la Insulo de Rum, de la insularo Proksimaj Hebridoj de Skotio, en 1975 kaj nune reproduktiĝas en la Eksteraj Hebridoj kaj la kontinenta marbordo de Wester Ross. Unu el ties gaelaj nomoj estas 'iolaire sùil na grèine' aŭ 'aglo de la sunluma okulo.'[8] Aŭguste de 2008 dekkvin maraglidoj bredataj en Norvegio estis liberigitaj sekrete ĉe Fife, espere reenmeti la specion ankaŭ en la orienta marbordo de Skotio.[9] La Blankavosta maraglo estas ankoraŭ rara reproduktanto en Britio sekve de siaj malapero kaj reenmeto, el kiu estis 36 paroj en 2006 kaj 40 en 2008.[5][8]
La 22an de majo 2006 estis anoncita, ke paro de Blankavostaj maragloj estas reproduktante en la naturrezervejo Oostvaardersplassen en Nederlando. Ili alvenis per si mem, ne kiel reenmeto. Tiu estis la unua fojo ke tiu birdospecio reproduktas en Nederlando en moderna epoko. En 2007, 2008 kaj 2009 la maragloj revenis al sia nesto.[10] En 2010, rezultis, ke la Blankavosta maraglo estis reproduktantaj ankaŭ en la natura distrikto de Zwarte Meer kaj en la areo de Lauwersmeer.[11]
La Blankavosta maraglo estas reenmetata en Irlandon. La programo komenciĝis somere de 2007. El 15 al 20 junaj maragloj el Norvegio estis liberigitaj ĉiun printempon en la Nacia Parko Killarney sudokcidente de Irlando. Tiu kompleta projekto pluos nombrajn jarojn kun pli da maragloj liberigitaj. La specio havas riĉan historion en la insulo sed formortiĝis en Irlando en la 1800-aj jaroj pro persekutado fare de terposedantoj.[12]
En 2007, cento da lokaj ŝafistoj kunvenis en la flughaveno de Kerry por protesti kontraŭ la alveno de la maragloj. La voĉparolanto de bienposedanta asocio Irish Farming Association Hill Committee nome Sro O'Leary diris, ke li ne havas dubon ke la maragloj manĝas ŝafojn.[13]
El ties reenmeto oni konfirmis ke 7 maragloj estis venenitaj en la Graflando Kerry, 2 estas supozate venenitaj kaj unu estis pafita. Dektria maraglo liberigita en Kerry estis mortpafita en Norda Irlando.
Pliaj dudek Blankavostaj maragloj estis liberigotaj en 2010, tamen Dro Allan Mee, respondeculo de la maragla projekto, asertis, ke "la konstanta perdo de maragloj venenitaj malheligis la estonton de la ambicia programo."[14]
Studoj per mikrosatelitoj kaj DNA ĉe Blankavostaj maragloj el nord-centra Eŭropo montris, ke la rekuperata eŭropea populacio retenis gravan kvanton de genetika diverseco, kun sekva malalta risko de malpliiĝanta reproduktindico (grava temo ĉe specioj kun malalta loĝdenso). Tiele, la rekupero de tiu iam endanĝerita specio estas vera sukcesa historio por natura konservado. La historio montras ankaŭ kiel surloka protektado de specio povas esti sukcesa, kaj grava resurso por la konservado de la evolua eblo de iu specio.
La Blankvosta maraglo onidire estas la aglo videbla en la Blazono de Pollando, tio estas ties bestoblazono, sed ankaŭ en la Blazono de Serbio.[15] La maraglo estas ofte blazonata portanta fiŝon (kutime ezokon) en siaj ungoj, distingante ĝin el alia ordinara aglo.
En Orkney, oni trovis ostojn de maragloj en tombokuŝejo de antaŭ 4000 jaroj, sugeste ke tiu birdoj estis venerataj de prahistoria popolo tie, kredo konfirmata de surŝtonaj gravurpentraĵoj de maragloj el Orkney.[8]
Ĉe Ŝetlandoj fiŝkaptistoj kredis, ke tuj kiam aperas maraglo ankaŭ fiŝo aperos surface, kun ventro supren; tio kondukis kelkajn fiŝkaptistojn uzi maraglan grason, ŝmirita sur la logaĵo, por pligrandigi sian kapton.[8]
La Blankvosta maraglo (Haliaeetus albicilla) estas birdo konata ankaŭ kiel simple Maraglo, tio estas rabobirdo el la ordo de falkoformaj birdoj de familio Akcipitredoj kiu inkludas aliajn rabobirdojn kiel buteoj, akcipitroj, milvoj, cirkuoj kaj veraj agloj.
Ĝi estas konsiderata proksima parenco de la Blankkapa maraglo kaj okupas la saman ekologian niĉon, sed en Eŭrazio.
El pigargo europeo[2] (Haliaeetus albicilla) es una especie de ave accipitriforme de la familia Accipitridae. Anida en el norte de Eurasia. No se reconocen subespecies.[3]
Es un ave de gran tamaño, alcanza una longitud de 69 a 92 cm y una envergadura de alas de 200 a 245 cm.[4] Las hembras son de mayor tamaño que los machos.[5] Tiene alas amplias, una cabeza grande y un grueso pico "carnicero". Los adultos son principalmente de color marrón excepto por su cabeza y cogote más pálido, poseen una distintiva cola blanca, su pico y patas son amarillos. La cola y el pico en su estadio juvenil son más oscuros, en los subadultos la cola se torna blanca con una franja oscura en su terminación.
Nidifica en el norte de Eurasia. Ha sido introducida con éxito en la Isla de Rum, en el archipiélago de las islas Small en Escocia, en 1975 y ahora su área de reproducción abarca las Islas Occidentales y las islas Small, así como las islas de Mull, Skye, Lewis, Canna y la costa de Wester Ross. Su población es escasa en Gran Bretaña a causa de su extinción y posterior repoblación. La mayor población en Europa se encuentra a lo largo de la costa de Noruega.
El 22 de mayo de 2006 se anunció que una pareja estaba anidando en la reserva natural de Oostvaardersplassen en Holanda. Esta es la primera vez en tiempos modernos que esta ave ha anidado en Holanda.
Es un ave principalmente residente, solo las aves que habitan en las regiones del extremo norte, tales como la población de Siberia, migran hacia el sur en invierno.
Existe una pequeña población en el extremo suroeste de Groenlandia y el oeste de Islandia. Debido a su mayor tamaño se ha propuesto que las aves de Groenlandia forman una subespecie groenlandicus, pero se considera esta especie como monotípica y la variación de tamaño es clinal de acuerdo a la regla de Bergmann. En el verano de 2015 se observó en la baja Veronese en las orillas del Adige y en el invierno de 2017 ha vuelto a anidar en la laguna de Venecia.
Conforma una especie par junto con el pigargo americano (Haliaeetus leucocephalus). Estas especies divergieron de otros pigargos como muy tarde al comienzo del Mioceno inferior (hace unos 10 ma) y posiblemente -si los registros fósiles más antiguos están correctamente asignados a este género- antes en el Oligoceno inferior, hace unos 28 ma (Wink et al. 1996[6]).
En forma similar a otros pares de especies de pigargos, este se compone de una especie con cabeza blanca (el pigargo americano) y otra con cabeza color tostado. Probablemente se separaron en el Pacífico norte, dispersándose hacia el oeste en Eurasia y hacia el este en América del Norte. Al igual que la otra especie nórdica, el pigargo gigante (Haliaeetus pelagicus), los adultos poseen ojos, patas y picos amarillos.
Adulto en vuelo en Svolvær mostrando sus características alas anchas, pico fuerte y cola corta blanca.
Haliaeetus albicilla - MHNT.
Haliaeetus albicilla groenlandicus - MHNT.
El pigargo europeo (Haliaeetus albicilla) es una especie de ave accipitriforme de la familia Accipitridae. Anida en el norte de Eurasia. No se reconocen subespecies.
Merikotkas (Haliaeëtus albicilla) on haugaslaste sugukonda merikotka perekonda kuuluv röövlind.
Merikotkas elab Euraasias, põhja poole kuni tundrani, lõuna poole Jaapani, Hiina, Põhja-Iraani, Türgi, Balkani ja Hispaaniani. Ta elab ka Korsikal, Sardiinial, Hebriididel, Shetlandil, Islandil ja Gröönimaal. Talvel on osa isendeid, eriti noored, hulgulinnud ning on jõudnud Pakistani ja Põhja-Aafrikasse.[1]
Eestis elab ta peamiselt Saare- ja Hiiumaal ning Lääne-Eesti rannikul, kuid ka Peipsi rannikul[1]. Eestis pesitseb ligi 300 paari merikotkaid[2]. Merikotka talvist arvukust hinnatakse 600–900 isendile [3]. Merikotka arvukus Eestis kasvab.[4]
Merikotkaste arvukusele on halvasti mõjunud kloororgaanilised ühendid. Pärast nende keelustamist Läänemere ümbruses 1970. aastal püsis ühendite mõju veel mitu kümnendit ja liigi arvukus hakkas taas tõusma 1990. aastate alguses.[2]
Merikotkas on suur lind, Eesti suurim röövlind[4]. Tema üldpikkus on 77–100 cm, tiiva pikkus 57–69 cm ja mass 3–6,5 kg[1]. Emaslind on isasest tunduvalt suurem[1].
Täiskasvanud isendite sulestik on mitut värvi pruun, pea võib olla ookerjas või valkjas. Hoosuled on tumepruunid, saba koosneb 12 tüürsulest ja on valge. Noorlind, see tähendab alla 4 aasta vanune lind, on pruun mustja peaga, sulgede tüvikuosa on valkjas ja alapool valkjas pruunide tähnidega. Merikotka tiivad on pikad ja laiad, aga saba lühike ja kiiljas. Kukla- ja kaela suled on pikenenud ja terava tipuga. Noorlinnu sulestik läheb vanalinnu sulestikuks üle järk-järgult.[1]
Vikerkest on vanalinnul kahvatukollane, noorlinnul pruun. Nokk on vanalinnul kollakas, noorlinnul must. Vahanahk ja jalad on kollased ning küünised mustad. Jookse on sulistumata ja selle poolest eristuvad merikotkad teistest kotkastest.[1]
Noorlinde on lihtne segi ajada konnakotkastega, aga merikotkad lendavad rohmakamalt ja aeglasemate tiivalöökidega, meenutades lendavat vaipa.[4]
Merikotkas elutseb veekogude lähedal nii merede kui ka järvede ja jõgede ääres[1].
Merikotka paarid on väga püsivad.[1]
Pesa teeb ta vanadesse ranniku- ja rabametsadesse või nende serva, harilikult männi otsa, harvem kaljudele[1]. Merikotkas väldib pesitsemist lageraielankide säilikpuudel. Rannikust asub merekotka pesa 5 km kaugusel sisemaal. Merikotkas eelistab 90-aastaseid lehtmetsi ja 120-130-aastasi okasmetsi.[2] Pesa on jämedatest okstest koosnev hiigelkuhil, mida kasutatakse mitu aastat järjest[1]. Aastakümneid kasutusel olnud pesakuhil võib olla isegi tonniraskune[4].
Kurn on varajane. Levila lõunaosas munetakse juba veebruari lõpul või märtsi algul, Eestis märtsi teisel poolel[4], aga tundras alles aprilli lõpul. Kurnas on tavaliselt 2 muna, aga võib olla ka vähem või rohkem. Pole ime, kui sigimine ebaõnnestub ja mune ei tulegi. Munad on valged, mõnikord ookerjate laikudega. Hauvad mõlemad vanemad, aga peamiselt emaslind. Haudumine kestab nii suure linnu kohta vähe: 35–40 päeva. Pojad lennuvõimestuvad umbes 70 päeva vanuselt.[1]
Merikotkas ei ole toidu suhtes valiv. Palju sööb ta kalu. Ta laskub jalgupidi vette ja tõstab kala veest välja. Lisaks toitub ta veelindudest: ta heidutab linnu sukelduma ja napsab ta kinni, kui lind uuesti veepinnale ilmub. Ta sööb ka imetajaid, näiteks jäneselisi, ümisejaid ja suslikuid. Ta ei põlga ka väikest saaki ja püüab levila põhjaosas lemminguid. Merikotkas sööb ka raibet, eriti talvel.[1]
Saagi varitsemiseks kasutab merikotkas kindlaid istekohti, näiteks suuri kive ja vanu puid.
Merikotkaste arvukus Eestis hakkas langema 19. sajandil. Inimesed hävitasid neid, sest arvasid, et merikotkas hävitab kalavarusid ja jahiloomi. Kõige halvemas seisus olid Eesti merikotkad 1960. aastatel, kui mitmel aastal järjest ei olnud Eestis ainsatki õnnestunud pesitsemist.[5] 1980ndatel ja 1990ndatel anti Eestis elavatele merikotkastele talvel lisatoitu.[2]
Merikotkas kuulub looduskaitse alla ja on Eesti punases raamatus.
Merikotkal ei ole looduslikke vaenlasi (peale inimese). Teda ähvardab elukeskkonna kadumine. Kuna merikotkas on toitumispüramiidi tipus, ähvardavad teda teistest liikidest rohkem inimtegevuse tulemusel keskkonda sattuvad mürgid, mille suhtes merikotkas on suhteliselt tundlik. Maaülikooli uuring näitas, et ligi pooled merikotkaste korjustest sisaldavad pliid, mille allikas on pliid sisaldav laskemoon. 2016. aastal lasti Eestis maha üks satelliitsaatjaga varustatud merikotkas.[2]
Merikotkas (Haliaeëtus albicilla) on haugaslaste sugukonda merikotka perekonda kuuluv röövlind.
Itsas arrano buztanzuria (Haliaeetus albicilla) accipitridae azpifamiliako hegazti harraparia da.
Haliaeetus leucocephalus espezie amerikarraren lehengusua, Eurasian txoko ekologiko berean kokatuta daude[1]. Iparraldeko Europan eta iparraldeko Asian bizi dira, populazio handiena Norvegiako kostaldetan egonik. 2008an, guztira, 9.000 - 11.000 arteko bikote ziren.
Itsas arrano buztanzuria (Haliaeetus albicilla) accipitridae azpifamiliako hegazti harraparia da.
Haliaeetus leucocephalus espezie amerikarraren lehengusua, Eurasian txoko ekologiko berean kokatuta daude. Iparraldeko Europan eta iparraldeko Asian bizi dira, populazio handiena Norvegiako kostaldetan egonik. 2008an, guztira, 9.000 - 11.000 arteko bikote ziren.
Merikotka (Haliaeetus albicilla) on suurikokoinen päiväpetolintu, joka kuuluu merikotkien sukuun.
Merikotka on suuri päiväpetolintu, jonka siivet ovat pitkät ja leveät. Siipien kärjissä olevat sulat muodostavat pitkät harittajat, jotka voivat olla 60 cm pitkät[2]. Sen pyrstö on melko lyhyt ja on muodoltaan tylpän kolmiomainen. Melko varma keino erottaa merikotka ja Suomen toinen suuri petolintu, maakotka, toisistaan onkin juuri pyrstö. Maakotkan pyrstö on nimittäin huomattavasti pitempi kuin merikotkan. Lajityypillisen lentosiluetin merikotkalle antavat pitkä kaula ja voimakas nokka.[3]
Sen pituus on 69–91 cm ja siipien kärkiväli 190–240 cm.[3] Merikotka painaa 3–6 kg. Naaras on yleensä suurempi kuin koiras. Iso lintu on usein resuisen näköinen, lentäväksi räsymatoksi joskus pilkattu[2], sillä nuorilta linnuilta voi puuttua usein paljon sulkia. Linnun pää ja pyrstö ovat vaaleammat kuin muu höyhenpeite, pyrstö vaalenee linnun vanhetessa ja on lopulta täysin valkea. Yli kahdeksanvuotiailla linnuilla pää on lähes kermanvalkoinen. Nokka on nuorella linnulla tumma, vanhalla täysin keltainen.
Maailman vanhin löydetty luonnonvarainen merikotka on löydetty kuolleena Ahvenanmaan Föglöstä alkuvuodesta 2011. Se oli rengastettu Ruotsin itärannikolla 33 vuotta aiemmin, vuonna 1978.[4] Aiempi vanhin merikotka oli löytöhetkellään iältään 30 vuotta ja seitsemän kuukautta. Se rengastettiin heinäkuussa 1980 Sodankylässä ja löydettiin viimeksi 2011 tammikuussa haaskalta talvehtimisalueeltaan Ruotsin itärannikon Uumajasta. Suomen vanhin oli 27 vuotta ja kuusi kuukautta.[5]
Merikotkan lentäessä sen siivet ovat melko lailla vaakatasossa. Siivet ovat kuitenkin vähän kuperat ja kyynärsiipi koholla. Lennossa myös käsisiipi roikkuu hieman. Matkalennossa merikotka lyö rauhalliseen tapaan pitkiä, melko matalien, siiveniskujen sarjoja. Sarjojen väleissä se liitää lyhyesti (vertaa maakotkaan). Sillä on tapana silloin tällöin kaarrella pitkiäkin aikoja korkealla, minkä aikana se voi edetä useita kilometrejä.[3]
Vanha merikotka on väriltään ruskea ja sen pää ja kaula vaaleamman kellanruskeat. Sen siipien yläpeitinhöyhenien sekä etuselän ja hartioiden höyhenien kärjet ovat epäsäännöllisen vaaleankellertävät, mikä saa linnun näyttämään hieman siltä, kuin sillä olisi epätasaista suomukuviointia. Vanhan merikotkan nokka on keltainen. Sen pyrstö on kokonaan valkoinen tai mahdollisesti tyvestä ja kärjestä ruskeatäpläinen.[3]
Nuoren merikotkan puku on kokonaan yhtenäisen tuore tai kulunut. Sillä on pitemmät uloimmat kyynärsulat kuin vanhalla merikotkalla, minkä johdosta siiven takareuna on muodoltaan ulospäinkaartuva. Nuoren merikotkan pyrstö on vanhan pyrstöä pitempi, eikä yhtä terävän kiilamainen. Pää, kaula ja ruumis ovat nuorella merikotkalla tummanruskeat. Rinta, vatsa, selkä ja siipien yläpinta ovat puolestaan punaruskeat, ja höyhenissä on leveät mustat kärjet. Pienet peitinhöyhenet ovat tummimpia. Nuorten merikotkien värityksen tummuus vaihtelee kuitenkin yksilöllisesti: osa niistä on mustanruskeita, ja jotkut taas melko vaaleita. Siipien alapinta on tumma. Kainaloiden alueella on epäselvä vaalea alue ja keskimmäisissä peitinhöyhenissä kapea vaalea juova. Tummien pyrstösulkien keskusta on vaalea, mutta suppuun aseteltuna pyrstö näyttää monesti kokonaan tummalta. Levitettynä ja hyvässä valossa pyrstön alue näyttää kuitenkin selvästi vaalealta. Nuoren merikotkan nokka on tumma. Silmän etupuolen vaalea ohjas muodostaa pään etupuolelle melko selvän vaalean laikun.[3]
Merikotkan toinen nuoruuspuku ajoittuu ensimmäiselle ja toiselle kesälle. Puku ei tällöin ole enää yhtenäisen tuore tai kulunut kuten alun perin, ja höyhenys on alkanut vaihtua hitaasti. Nuoren merikotkan punaruskea sävy on haalistunut, ja osa rinnan ja etuselän höyhenistä on muuttunut vaaleatyviseksi. Jalkojen juurten housut ovat yksivärisen tummat. Nokka on vaaleamman harmaa kuin alun perin.[3]
Kolmas nuoruuspuku ajoittuu toisen ja kolmannen kesän välille. Sen olemus vaihtelee eri yksilöiden välillä, mutta on tavallisesti yhtenäisemmän tumma. Rinnan, etuselän ja siipien höyhenet ovat tasaisemman ruskeita. Joillakin selkä ja rinta saattavat olla edelleen valkoisenkirjavat. Kolmannen nuoruuspuvun aikana merikotkan nokka on väriltään harmaankeltainen.[3]
Neljännen nuoruuspuvun merikotka saa kolmannesta viidenteen kesään ajoittuvalle jaksolle. Puku eroaa selvästi edellisistä muistuttaen enemmän vanhan merikotkan pukua, vaikka vaaleita alueita onkin vielä jonkin verran jäljellä. Myös pään ja kaulan väritys eroaa vanhasta merikotkasta, sillä ne ovat vielä melko harmaanruskeat. Merikotkan nokka on tällöin vaaleankeltainen ja silmät vaaleanruskeat.[3]
Merikotka on pesimäajan ulkopuolella yleensä hiljainen. Erityisesti pesän lähellä tavallisin ääni on kimeä ja kaklattava kovien äänten sarja, "kli kli kli kli...", joka muistuttaa hieman palokärjen reviirihuutoa. Koiraat ovat kirkasäänisempiä kuin naaraat. Merikotkien varoitusääni on jonkin verran syvempi, melko kova ja naksahtava "klek".[3] Ääni on kimakka sarja haukkuvia, kaklattavia ääniä, joka läheltä kuultuna on vaikuttavan villin kuuloista. Pesän lähellä se varoittelee korkealla vihellyksellä tai matalalla ronkotuksella.
Merikotkan levinneisyysaluetta ovat Pohjois-Eurooppa ja Aasia. Skotlantiin se on istutettu uudestaan. Euroopassa niitä pesinee noin 4 000 paria, joista noin 1 500 Norjassa. Venäjällä on 900–1 000 ja Turkissa 10–30 paria.
Lapin linnut talvehtivat etelämpänä. Nuoria lintuja tavataan vaeltelevina melkein ympäri vuoden. Sydäntalvella nuoret linnut eivät vaella, vaan hyödyntävät usein haaskoja. Talvisilla haaskoilla vierailee runsaasti merikotkia myös Venäjän Karjalasta sekä Ruotsista.
Suomessa merikotka pesii yleensä vesistöjen äärellä, tavallisimmin meren tuntumassa mantereella tai saaressa. Se on levittäytymässä myös sisämaahan, ja pesä on järven tai suon rantametsässä. Pesä on yleensä hyvin ihmiseltä piilossa, esimerkiksi järeän petäjän latvuksessa. Se pesii joskus harvoin merenkulun linjatauluihin. Ulkosaaristossa se harvoin on pesinyt myös maahan, tavallisesti kallioluodon korkeimpaan osaan kun sopivaa pesäpuuta ei ollut tarjolla.
1900-luvun alussa merikotkan ampumisesta maksettiin tapporahaa palkkiona vahinkoeläimen hävittämisestä. Merikotka ehti kadota melkein kokonaan, ennen kuin se rauhoitettiin 1920-luvulla.[6] Niitä ammuttiin kuitenkin yleisesti vielä 1960-luvulla.[7] 1950-luvulta alkaen merikotka harvinaistui Itämeren alueella ympäristömyrkkyjen takia, etenkin hyönteismyrkky DDT:n, sen hajoamistuotteen DDE:n sekä PCB-yhdisteiden vuoksi[8], mutta myös dioksiinien ja metyylielohopean takia[6]. Myrkyt kasautuivat ravintoketjussa ja tekivät kotkista hedelmättömiä tai tappoivat niiden sikiöt.[8] Munankuoret muuttuivat niin ohuiksi, että hautominen epäonnistui.[9]
1970-luvun alkupuolella Suomessa arvioitiin olevan vain 40−50 merikotkaparia. Vuonna 1973 WWF aloitti merikotkien suojeluhankkeen, johon kuului tiedotuskampanja, puhdaan ravinnon (sianruhojen) tarjoaminen talvella, sekä tekopesien rakentaminen saaristoon, josta metsäteollisuus oli kaatanut pesäpuut.[8] Vuonna 1975 kuoriutui koko maassa vain neljä poikasta.[10] DDT:n käyttö kiellettiin Suomessa vuonna 1976 ja naapurimaissakin samoihin aikoihin, minkä jälkeen kanta alkoi toipua hitaasti. PCB:n käyttö kiellettiin Suomessa vuonna 1990, mutta sitä tulee edelleen luontoon kaukokulkeutumana. 1990-luvulla merikotkakanta alkoi kasvaa nopeammin.[8] Vuonna 1996 lyijyhaulien käyttö vesilintujen metsästyksessä kiellettiin muualla kuin Ahvenanmaalla. Merikotkat syövät myös vesilintuja.[11]
Vuonna 2014 on tähänastinen ennätysvuosi, silloin kuoriutui 459[10] poikasta. Vuonna 2016 kuoriutui 421 poikasta.[12] Vuonna 2016 merikotkat pesivät ensimmäistä kertaa Turussa, Helsingissä ja Päijät-Hämeessä, Artjärvellä. Kanta on vahvin Ahvenanmaalla, Varsinais-Suomessa ja Merenkurkussa.[9] Vuonna 2015 selvisi, että kolmasosa Suomen merikotkista kuolee lyijymyrkytykseen, joka aiheuttaa hitaan kuoleman. Ympäristömyrkky lyijy halvaannuttaa lihastoiminnan ja ruuansulatuskanavan, aiheuttaa anemiaa ja lopulta lentokyvyttömyyden. Myrkytykseen tarvittavan ison kerta-annoksen merikotkat saavat ilmeisesti riistalihaan jääneistä hauleista tai hajonneista ammuksista. Etenkin nuoret merikotkat ympäri Suomen talvehtivat Ahvenanmaalla, jossa vesilintujen haulikieltoa ei ole. Lyijyjäämiä voi kertyä myös haaskoista, pienriistasta tai metsään jätetyistä sisälmyksistä. Eviran tutkijan mukaan paras ratkaisu olisi kieltää muillekin eliöille vaaralliset lyijyammukset kokonaan.[11] Muita merikotkien uhkia ovat häirintä pesintäalueilla ja pesäpuiden puute.[13] Vainoa on yhä jonkin verran.[13]
Vuoden 2010 uhanalaisuustarkastelussa laji luokiteltiin vaarantuneeksi.[14] Vuonna 2011 Suomessa oli WWF:n tiedon mukaan 1 500 merikotkayksilöä nuoret pesimättömät linnut mukaan lukien. Maailman Luonnonsäätiö (WWF) määrittelee merikotkan uhanalaiseksi.[15] Lintudirektiivissä sen uhanalaisuusluokitus on VU.[13] IUCN:n Punaisella listalla sen uhanalaisuusluokitus on poistettu, ja se on määritelty vuonna 2006 elinvoimaiseksi[1]. Saaristomeren kansallispuistossa on erityisesti panostettu merikotkan suojeluun. Ympäristöministeriön päätöksellä (n:o 1209/95) lähes kaikille Suomen pesimälintulintulajeille on määritelty ohjeellinen arvo. Merikotkan ohjeellinen arvo on 7400€.
[16] 1970 1971 1972 1973 1974 1975 1976 1977 1978 1979 1980 1985 1990 1995 2000 2005 2010 2011 2012 2013 2014 2015 2016 Poikasmäärä 8 5 5 5 10 4 6 16 20 6 17 27 62 85 172 272 314 329 341 420[17] 459[10] 414[18] 421[12] Pesimäkanta (paria) 35[9] 346 451[9]Merikotka on sukukypsä 4–6 vuoden iässä. Linnut rakentavat suuren oksakasan pesäksi puuhun tai kallioluodolle ja käyttävät ja täydentävät edellisvuotista pesää. Merikotkaparilla on reviirillään käytössä muutama vaihtopesä ja vuosittain ne valitsevat niistä yhden, johon munivat. Muita pesiä käytetään levähdys- ja ruokailupaikkoina. Merikotkat ovat reviirilintuja ja tavallisesti kahden asutun pesän väli on yleensä muutama kilometri. Kannan kasvaessa reviiritkin pienentyvät, ja lyhin kahden asutun pesän väli on Suomessa ollut muutama sata metriä. Kun kaksi merikotkaa ovat muodostaneet parin, osa pysyy uskollisina toisilleen loppuelämänsä, osa eroaa. Jos toinen kotka kuolee, eloonjäänyt voi myös ottaa uuden puolison.
Merikotka munii yleensä kaksi tai kolme munaa, mutta lentokykyiseksi varttuu yleensä yksi tai kaksi poikasta, jokus myös kolme. Naaras hautoo munia pääasiassa yksin lähes puolitoista kuukautta. Poikasten kuoriuduttua koiras tuo ruokaa pesälle lähinnä poikasille. Poikasten kasvaessa molemmat vanhemmat ruokkivat niitä. Poikaset oppivat lentämään vasta noin 11 viikon ikäisinä.
Merikotka syö kalaa, esimerkiksi haukia, vesilintuja, esimerkiksi haahkoja ja pieniä veden lähellä viihtyviä nisäkkäitä, kuten vesipäästäisiä. Talvella merikotka myös raatoja, haaskoja ja jätteitä. Saalis on riippuvainen elinpiiristä.
Merikotkat ovat oppineet saalistamaan merimetsoja. Merikotkat ovat Turun ja Vaasan saaristoissa saalistaneet aikuisiakin merimetsoja. Ruotsissa merikotkakannat ovat voimistuneet ja merimetsoyhdyskunnat taantuneet viime vuosina. Merikotkasta saattaa tulevaisuudessa tulla merimetsokannan rajoittaja, aiemmin merimetsolla ei ole ollut luontaisia vihollisia.[19][20]
Merikotka (Haliaeetus albicilla) on suurikokoinen päiväpetolintu, joka kuuluu merikotkien sukuun.
Haliaeetus albicilla
Le Pygargue à queue blanche (Haliaeetus albicilla) appelé également grand aigle de mer, aigle barbu, huard, orfraie ou encore haliète albicille, est une espèce de rapaces de grande envergure de la famille des Accipitridae.
Ce pygargue est le parent existant le plus proche du pygargue à tête blanche ; les deux espèces sont sœurs dans un complexe d'espèces, mais le pygargue à queue blanche est plus grand et a une envergure beaucoup plus importante. Dans la nature, ils remplissent la même niche écologique : ce sont tous les deux des rapaces diurnes qui se nourrissent de poissons, de petits mammifères et de membres de la famille des anatidés. Les deux espèces ont divergé des autres pygargues au plus tard lors du Miocène, il y a environ dix millions d'années et auraient été définitivement séparées par la dernière période glaciaire[1]. Les ornithologues modernes croient que les deux ont divergé dans le Pacifique Nord, se propageant vers l'ouest en Eurasie et vers l'est en Amérique du Nord, comme en témoignent les résultats du génome mitochondrial (ADNmt).
Pygargue très corpulent et de grande taille, il a une silhouette massive caractérisée par une large envergure et une queue courte cunéiforme. L'ensemble du plumage est brun foncé sauf la tête et la base du cou légèrement plus clairs. Les oiseaux âgés ont la tête et le cou blancs. Les adultes ont la queue blanche. La moitié de la longueur des pattes est emplumée. La tête est large et le bec très massif. Les pattes et le bec sont jaunes.
Le juvénile est beaucoup plus foncé, gagnant progressivement le plumage adulte en cinq ou six ans. La queue et le bec sont foncés, et la queue présente une bande terminale foncée chez les subadultes, avant de blanchir.
Le pygargue à queue blanche se fait entendre surtout pendant la nidification, les parades et la défense du territoire. Le mâle émet des cris puissants à la manière rauque des mouettes. La femelle a une voix plus grave. Le cri de contact est une série de « krick-rick-rick-rick », dont la fréquence et la tonalité augmentent. Le cri d'alarme « kli-kli-kli » prévient de l'arrivée d'un intrus sur le territoire.
Sa taille varie de 72 à 94 cm, pour un poids de 5 à 7 kg. L'envergure de ce rapace peut atteindre 240 cm[2].
Le pygargue à queue blanche est une espèce liée aux milieux aquatiques (côtes maritimes, grandes rivières, lacs, etc.), soit à l'intérieur des terres, soit au bord de mer. Dans les terres, le pygargue à queue blanche se plaît au bord des lacs et des fleuves propices à la prédation, dans la toundra et dans la forêt. Sur les côtes, il fréquente les falaises rocheuses escarpées.
Son aire de répartition s'étend du Groenland au nord de l'Europe et à la Sibérie. Quelques pays européens accueillent une forte population de pygargues à queue blanche : la Norvège, le nord de l'Allemagne, les pays baltes, la Pologne et la Russie.
Cinq années lui sont nécessaires pour atteindre la maturité sexuelle. C'est un oiseau particulièrement discret en dehors de la période de reproduction. Il possède quasiment la même technique de chasse que les autres pygargues ou aigles pêcheurs, à la différence qu'il fait preuve d'endurance et est capable de poursuivre sa proie jusqu'à épuisement.
En Europe, les pygargues à queue blanche adultes sont en général sédentaires. Les oiseaux nordiques (nord de la Russie et Laponie) descendent vers le sud en hiver. Les oiseaux âgés vagabondent, mais les jeunes bougent davantage et sont presque migrateurs.
Les couples restent sur leur territoire à l'année. Ils sont unis pour la vie et se reproduisent dans le même territoire chaque année. Au printemps, les parades aériennes se déroulent au-dessus du territoire. Les deux partenaires volent à environ 200 mètres de hauteur, proches l'un de l'autre, et effectuent des figures, des piqués et simulent des attaques.
Le pygargue à queue blanche se nourrit d'oiseaux, de mammifères ou de poissons. Il apprécie le gibier d'eau (oies, foulques, canards, etc.) mais il est surtout friand de poissons. Il ne dédaigne pas les cadavres quand les temps sont durs et que la nécessité se fait sentir. Il chasse à l'affût, en volant assez bas ou en décrivant des cercles en hauteur afin de repérer ses proies.
Le pygargue à queue blanche tient ses ailes tendues à plat ou légèrement arquées quand il plane. Quand il glisse, elles sont serrées vers l'avant, et plutôt aplaties ou un peu arquées, souvent avec la main abaissée. Le vol est lourd, avec des séries de battements peu profonds, intercalés de courts glissés. En vol, le pygargue à queue blanche rappelle souvent le vautour.
Il pêche sur les eaux calmes qui lui permettent de voir les poissons. Quand une proie est repérée, il vole brièvement sur place, juste au-dessus, puis il la saisit au cours d'un vol rasant, en projetant rapidement ses serres dans l'eau. Il peut aussi rester immobile ou patauger sur le bord pour y trouver des poissons. Plus rarement, il pratiquera aussi le piqué. Lorsqu'un poisson est trop lourd, il le tire jusqu'à la rive en battant des ailes. Les oiseaux et les mammifères sont plutôt capturés par surprise. Il épuise les oiseaux aquatiques et leur chasse est plus longue. Sa victime plonge pour éviter l'attaque, et il choisit le moment où elle remonte pour se précipiter sur elle. C'est en répétant ces attaques qu'il parvient à capturer sa proie. Il capture aussi des oiseaux en vol, anatidés ou grands corbeaux. Il passe beaucoup de temps perché, sans bouger, sur un arbre, ou s'aventure en planant à travers son territoire.
Son nid, auquel il rajoute des branches chaque année, est particulièrement volumineux et construit soit au sommet d'un grand arbre soit à l'abri d'une falaise inaccessible. Chaque couple en a plusieurs qui sont utilisés à plusieurs reprises et pendant une période importante.
Le pygargue à queue blanche construit son nid à quelques kilomètres des lieux de gagnage, souvent en lisière de forêt ou à la campagne, à proximité de l'eau, dans de vieux arbres centenaires (pin sylvestre ou hêtre). Suivant la région, il peut aussi nicher sur des récifs ou des îles au large et sur les falaises.
La femelle dépose 2 à 3 œufs blancs, à intervalles de 2 à 5 jours, occasionnant ainsi des naissances échelonnées. L'incubation dure environ 35 à 45 jours, assurée par les deux parents, mais surtout par la femelle qui surveille les poussins en permanence pendant les premiers quinze jours qui suivent la naissance. À quatre semaines, ils restent seuls au nid, tandis que les adultes chassent. Ils commencent à voler à l'âge de deux mois et demi, et restent aux alentours du nid pendant deux à trois semaines. Il leur faudra encore deux mois ou plus pour devenir indépendants.
D'après Alan P. Peterson, cette espèce est constituée des deux sous-espèces suivantes :
Même si actuellement les effectifs du Pygargue à queue blanche sont en légère croissance, grâce à l'abandon des polluants les plus toxiques, et à sa protection dans toute l'Europe, la population en Europe ne dépasse pas les 2 500 couples (dont 700 couples en Pologne). La chasse, les empoisonnements, la pollution des eaux, les prélèvements d'œufs et de poussins ainsi que la destruction et la disparition des zones humides, sont les principaux dangers qui la menacent.
L'oiseau est officiellement déclaré disparu du territoire français depuis 1959.
En 2016, son statut IUCN en France est passé de RE (Espèce disparue de France métropolitaine) à CR (en danger critique d'extinction)[3],[4], à la suite notamment de la découverte d'un unique couple nicheur à proximité du Lac du Der, observé à partir de 2015[5].
Le Pygargue à queue blanche bénéficie d'une protection totale sur le territoire français depuis l'arrêté ministériel du 17 avril 1981 relatif aux oiseaux protégés sur l'ensemble du territoire. Il est inscrit à l'annexe I de la directive Oiseaux de l'Union européenne[6]. Il est donc interdit de le détruire, le mutiler, le capturer ou l'enlever, de le perturber intentionnellement ou de le naturaliser, ainsi que de détruire ou enlever les œufs et les nids et de détruire, altérer ou dégrader leur milieu. Qu'il soit vivant ou mort, il est aussi interdit de le transporter, colporter, de l'utiliser, de le détenir, de le vendre ou de l'acheter.
En France, on le retrouve occasionnellement en bordure de milieux humides. Il est présent majoritairement dans la moitié Nord de la France sur de rares sites (Jura, pays des étangs...)[7].
Haliaeetus albicilla
Le Pygargue à queue blanche (Haliaeetus albicilla) appelé également grand aigle de mer, aigle barbu, huard, orfraie ou encore haliète albicille, est une espèce de rapaces de grande envergure de la famille des Accipitridae.
Iolar a itheann éisc agus a fhaightear ar chóstaí is ea an t-iolar mara. Tá cineálacha eile iolar éisc a fhaightear gar d'uisce úr, ach itheann siad sin veirteabraigh eile chomh maith le héisc.
O pigargo,[2] (Haliaeetus albicilla) é unha ave rapaz da familia dos Accipítridos.
É unha aguia de gran tamaño cun enorme peteiro amarelo. A plumaxe é escura, agás a cola e a cabeza que van branquexando conforme ó envellecemento do individuo. A femia é lixeiramente meirande có macho.
A posta consiste en 2-3 ovos, sendo realizada en febreiro ou marzo. Os ovos son chocados por ambos proxenitores durante uns 40 días. As parellas son estables e en ocasións conviven no mesmo territorio varias familias; trátase dunha das aguias máis sociábeis.
Ecléctica, dende peixes ata limícolas e anátidos, chegando incluso a capturar cisnes ou grúas. Tamén mamíferos, dende roedores ata crías de cervos, focas ou raposos. É unha especie moi habilidosa na caza, chegando a cazar en grupo.
Dende o norte e leste de Europa, ata a península de Kamchatka, Anadyr, norte de China e sur de Groenlandia. Na Europa occidental foi exterminada, considerándose a especie extinta en Francia, Italia, na totalidade das Illas Británicas e nas illas do Mediterráneo. En Alemaña estivo a piques de seguir a mesma sorte. Así á comezos do século XX, só había parellas estables na Pomerania e en Mecklemburgo. Grazas as medidas de protección desenvolvidas ó longo de décadas, conseguiuse estabilizar unha pequena poboación en Schleswig-Holstein. Ademais no 1992 acadouse a primeira cría con éxito na Baixa Saxonia. A comezos do século XXI, estimouse unha poboación estable de preto de 200 parellas en Alemaña.
O pigargo, (Haliaeetus albicilla) é unha ave rapaz da familia dos Accipítridos.
Orao štekavac ili bjelorepan (lat. Haliaeetus albicilla) je jedina vrsta roda Haliaeetus koja živi u Europi.
Rasprostranjen je od sjeverne Europe (zapadna Irska, obala Norveške) prema istočnoj i južnoj Europi, preko zemalja bivšeg SSSR-a na istok do Kamčatke i Japana. Nije naseljen u Portugalu, Španjolskoj, Francuskoj, Švicarskoj i Italiji.
Ornitolozi razlikuju pet geografskih rasa od kojih je jedna dobro rasprostranjena u Sjevernoj Americi, tako da su ga Amerikanci stavili u svoj grb (bijela glava, bijeli rep).
Haförn (fræðiheiti: Haliaeetus albicilla) er mjög stórvaxinn ránfugl af haukaætt. Haförn verpir í norðurhluta Evrópu og Asíu. Haförnum var næstum útrýmt í Evrópu en með friðun og aðgerðum hefur tekist að endurreisa varp sums staðar. Hafernir eru alls staðar sjaldgæfir en ernir eru þó flestir við strendur Noregs. Hafernir eru oftast staðfuglar.
Haförn er um 70-90 sm langur og vænghaf hans er 200 -240 sm. Fuglinn vegur um 5 kg. Karlfuglar eru mun minni en kvenfuglar. Haförninn hefur breiða, ferhyrnda vængi og stórt höfuð. Fullorðinn örn er brúnn en höfuð og háls er ljósara, stélið hvítt og goggur og fætur gulir. Á ungum fuglum eru stél og goggur dökk en stélið verður hvítt með svartri rönd þegar fuglinn eldist. Ernir verða kynþroska fjögurra til fimm ára gamlir. Ernir parast fyrir lífstíð og falli annar fuglinn frá getur hinn verið mörg ár að finna nýjan maka. Ernir gera sér stundum hreiður í hrúgu af kvistum í tré eða á klettasyllum. Hreiður íslenskra arna eru stundum miklir birkilaupar en eru oftar hrúga eða dyngja úr þangi, hvannarnjólum og grasi. Hreiðurgerðin er viðaminni ef ernirnir hafa hreiðrað um sig í sjávarhólmum. Sömu hreiðrin eru oftast notuð ár eftir ár. Ernir verpa einu til þremur eggjum og líða nokkrir dagar á milli eggjanna. Ernir fara að liggja á þegar einu eggi er orpið og álegutíminn er 35 dagar. Ungarnir verða fleygir um 10 vikna gamlir. Foreldrarnir þurfa að mata ungana fyrstu 5-6 vikurnar en eftir það rífa þeir sjálfir í sig bráðina. Algengast er að aðeins einn ungi komist upp í arnarhreiðri, tveir ungar komast upp í þriðja hverju hreiðri.
Arnarstofninn á Íslandi telur 73-74 fullorðin pör (2014) og hefur rúmlega þrefaldast frá því að bannað var að eitra fyrir tófu árið 1964. Árið 2005 komust 36 arnarungar á legg og eru það fleiri en nokkru sinni frá því farið var að fylgjast með arnarvarpi árið 1959. Aðalheimkynni arnarins eru við Breiðafjörð en þar halda nú til rúmlega 40 pör eða 2/3 hlutar stofnsins. Fyrr á öldum verptu hafernir yfirleitt á óaðgengilegum stöðum, í ókleifum klettum eða hólmum í ám og vötnum. Sennilegt er að ernir kjósi að verpa á láglendi en hafi hrakist upp í hamra vegna ofsókna manna. Þegar ernir voru friðaðir og búseta í eyjum og nytjar af eyjum drógust saman um miðja 20. öld, fluttu ernir heimkynni sín að mestu leyti úr hömrum í landi út í tanga og hólma. Á Íslandi er haförninn oftast aðeins nefndur örn, en á þeim svæðum þar sem hann verpir er hann oft kvenkenndur af heimamönnum og orðið haft í kvenkyni (hún örnin), eða þá að fuglinn er nefndur assa (bæði kynin).
Haförn (fræðiheiti: Haliaeetus albicilla) er mjög stórvaxinn ránfugl af haukaætt. Haförn verpir í norðurhluta Evrópu og Asíu. Haförnum var næstum útrýmt í Evrópu en með friðun og aðgerðum hefur tekist að endurreisa varp sums staðar. Hafernir eru alls staðar sjaldgæfir en ernir eru þó flestir við strendur Noregs. Hafernir eru oftast staðfuglar.
Haförn er um 70-90 sm langur og vænghaf hans er 200 -240 sm. Fuglinn vegur um 5 kg. Karlfuglar eru mun minni en kvenfuglar. Haförninn hefur breiða, ferhyrnda vængi og stórt höfuð. Fullorðinn örn er brúnn en höfuð og háls er ljósara, stélið hvítt og goggur og fætur gulir. Á ungum fuglum eru stél og goggur dökk en stélið verður hvítt með svartri rönd þegar fuglinn eldist. Ernir verða kynþroska fjögurra til fimm ára gamlir. Ernir parast fyrir lífstíð og falli annar fuglinn frá getur hinn verið mörg ár að finna nýjan maka. Ernir gera sér stundum hreiður í hrúgu af kvistum í tré eða á klettasyllum. Hreiður íslenskra arna eru stundum miklir birkilaupar en eru oftar hrúga eða dyngja úr þangi, hvannarnjólum og grasi. Hreiðurgerðin er viðaminni ef ernirnir hafa hreiðrað um sig í sjávarhólmum. Sömu hreiðrin eru oftast notuð ár eftir ár. Ernir verpa einu til þremur eggjum og líða nokkrir dagar á milli eggjanna. Ernir fara að liggja á þegar einu eggi er orpið og álegutíminn er 35 dagar. Ungarnir verða fleygir um 10 vikna gamlir. Foreldrarnir þurfa að mata ungana fyrstu 5-6 vikurnar en eftir það rífa þeir sjálfir í sig bráðina. Algengast er að aðeins einn ungi komist upp í arnarhreiðri, tveir ungar komast upp í þriðja hverju hreiðri.
L'aquila di mare coda bianca o aquila grigia (Haliaeetus albicilla, Linnaeus, 1758) è un grande uccello rapace della famiglia degli Accipitridi, diffuso in Europa settentrionale, in Europa orientale e in Asia[2]
Haliaeetus albicilla raggiunge una lunghezza di 70–92 cm circa. Alcuni esemplari possono presentare capo, collo e coda più chiari. Solitamente ha cervice grigio e non dorata, grande apertura delle larghe ali, coda breve e cuneiforme di colore bianco.
Si ciba di pesci, di mammiferi e rettili di varie dimensioni, vola bassa sulle acque per catturare il pesce in superficie, talora si tuffa parzialmente.
Dispiega volo tardo e poco agile, con lente battute d'ala.
Una specie diffusa in Europa settentrionale, soprattutto in Norvegia e Russia, ove è presente oltre le metà dell'intera popolazione europea, ma anche in Groenlandia, Danimarca, Svezia, Polonia e Germania. Piccole popolazioni sono segnalate anche in Islanda, Gran Bretagna, Finlandia, Estonia, Lettonia, Lituania, Austria, Repubblica Ceca, Slovacchia, Slovenia, Croazia, Bulgaria, Romania, Ungheria, Moldavia e Grecia; il suo areale si estende in Asia, attraverso la Turchia e il Medio Oriente sino alla Mongolia, la Cina e il Giappone[1]. In Italia si riproduceva in Sardegna, dove si è estinta come nidificante nel 1956.
È specie rara, in diminuzione, che esige protezione assoluta. La popolazione mediterranea è quasi estinta. È specie protetta ai sensi della legge 157/92[3]. La sua conservazione è insidiata da molte cause avverse, tra cui bracconaggio, cattura dei nidiacei, azione degli insetticidi, bocconi avvelenati, ma soprattutto dalla perdita di coste marine selvagge, oggi occupate da numerosi villaggi turistici, dalla distruzione di boschi, paludi, foci dei fiumi e dalla contaminazione delle acque interne.
L'aquila di mare coda bianca o aquila grigia (Haliaeetus albicilla, Linnaeus, 1758) è un grande uccello rapace della famiglia degli Accipitridi, diffuso in Europa settentrionale, in Europa orientale e in Asia
Paprastasis jūrinis erelis (lot. Haliaeetus albicilla, angl. White tailed Sea Eagle, vok. Seeadler) – vanaginių paukščių (Accipitriformes) būrio, vanaginių (Accipitridae) šeimos plėšrusis paukštis.
Paprastasis jūrinis erelis labai stambus ir vienas didžiausių Lietuvos plėšriųjų paukščių atstovas, už kurį svoriu ir dydžiu stambesnis tik palšasis grifas, o kilnusis erelis labai nežymiai didesnis kūno ilgio išmatavimu. Paprastųjų jūrinių erelių patelės pastebimai didesnės už patinėlius. Paprastųjų jūrinių erelių kūno ilgis nuo 70 iki 92 cm ilgio. Išskėstų sparnų ilgis 193–245 cm. Patelių sparnų ilgis 621–717 mm, patinėlių 552–652 mm. Patinų svoris 3,1–5,4 kg, patelių 3,7–6,9 kg.
Suaugusio paprastojo jūrinio erelio snapas stambus, gelsvas. Pastaibis neplunksnotas. Kojos geltonos, tvirtos su šiurkščiu padu, pritaikytas slidžiai žuviai laikyti. Pilkai rudas kūnas, dalis nugaros ir sparnų viršaus plunksnų šviesiai pilkos, kiek šviesesnės nei plasnojamosios. Jų uodega balta po 5–6 metų, kada įgauna suaugusio plunksnų dangą, nors kai kurių jūrinių erelių uodegos galiukai išlieka tamsūs visą gyvenimą.
Paprastieji jūriniai ereliai gyvena iki 20 metų.
Paprastieji jūriniai ereliai paplitę nuo Atlanto vandenyno vakaruose – pietų Grenlandijoje, Islandijoje, Britų salynas iki pat Didžiojo vandenyno rytuose – Japonijos, Taivano, Rusijos, Tolimųjų rytų. Pietuose jų paplitimo arealas siekia Arabų jūrą, Pietų Kinijos jūrą. Gana retokas paukštis visoje Europoje (išskyrus Skandinavijos šalis), bet jų populiacija paskutiniu metu maždaug nuo 1985 metų daugelyje šalių atsistato, įskaitant ir Lietuvą. Norvegijoje randama iki 2000–2500 perinčių porų.
Paprastieji jūriniai ereliai gyvena uolėtose vietose prie jūrų pakrančių ar miškingose vietose prie didesnių vandens telkinių, ežerų, upių kur gausu žuvų ir vandens paukščių.
Paprastasis jūrinis erelis įrašytas į Lietuvos raudonosios knygos 3(R) kategoriją. Lietuvoje tai sėslūs ir perintys paukščiai, nors jų pagausėjimas reguliariai pastebimas per migracijas ir žiemojimo metu. Aptinkami visoje Lietuvoje, nors gausiausi Lietuvos vakaruose apie Nemuno deltą ir aplink Kuršių marias. Manoma kad XXI a. pirmame dešimtmetyje Lietuvoje kas metai perėjo apie 90 porų ir pastebimas jų plitimas.
Lietuvoje įsikuria įvairaus tipo ir dydžio miškuose šalia vandens telkinių. Daugiau juos traukia ramūs ir nuošalūs miško plotai šalia žuvingų ir gausiau vandens paukščių gyvenamų vandens telkinių, pastaruoju metu dažnai netoli žuvininkystės ūkių. Jų veisimosi metu plotas užima nuo 19 iki 115 km² teritoriją.
Paprastieji jūriniai ereliai monogamai – sudaro pastovias poras kol gyvi abu poros nariai. Žuvus, nusibaigus vienam jų, likęs gyvas poros narys susiranda sau porai kitą. Bet jeigu tas kitas dar nesubrendęs, krauna lizdus, bet neperi, o veistis pradeda tik partneriui sulaukus lytinės brandos. Lietuvoje paprastieji jūriniai ereliai lizdus taisyti ar krauti pradeda dar nepasibaigus žiemai sausio–vasario mėnesiais. Lizdavietei pasirenka įvairaus tipo mišką, ir Lietuvoje perinčių paprastųjų jūrinių erelių lizdas būna tik medžiuose maždaug 100–5000 m atstumu nuo vandens telkinio. Lietuvoje lizdą sukasi 11–28,5 m aukštyje, o jam susisukti dažniausiai pasirenka paprastąsias pušis (54 %), juodalksnius ir drebules po 16 % ir kiek rečiau pasirenka ąžuolus 8 %, beržus 3 %, paprastąsias egles 2 %, mažalapes liepas 1 % Medžiai turi būti stambūs, subrendę, kad išlaikytų didelį lizdą, o lizdui vieta įvairiose medžio dalyse – šoninėse šakose ar viršūnėje. Jie būna labai prisirišę prie savo lizdaviečių. Net ir aplinkai keičiantis, kertant miškus ir jeigu išlieka jų nepaliestas medis, kuriame yra lizdas, pora ir toliau tos vietos ir lizdo nepalieka. Pasitaikę atvejų, kada po kirtimų net aplinkui lizdą atsiradus plynei, pora toliau sėkmingai perėjo. Ne vieną dešimtmetį peri tame pačiame ar viename iš atsarginių jų gyvenamoje veisimosi teritorijoje esamų lizdų, todėl vidutiniškai lizdai būna apie 1,5 m skersmens ir 1 m aukščio. Nuo vėjų apsaugotose vietose sukrauti lizdai kartais pasiekia 3–5 m aukštį ir 2,5 m skersmenį bei gali sverti iki 600 kg ir daugiau. Tokie lizdai ilgaamžiai, juose šie paukščiai peri daugelį metų.
Kiaušinius ima dėti vasario pabaigoje – kovo mėnesiais. Jaunos poros perėti dažnai pradeda vėliau, bet dėl tam tikrų priežasčių taip gali elgtis ir senesni paukščiai. Deda 1–3, bet dažniausiai 2, kartais 4 kiaušinius 48–60, kartais 70 valandų intervalu. Dažnai dėtyje vienas kiaušinis būna nevaisingas. Peri pasikeisdami patelė (ji kur kas ilgiau) ir patinėlis 34–46 dienas.
Paprastieji jūriniai ereliai dažniausiai medžioja sklandydami virš vandens telkinių ir stebėdami vandens paviršiuje esančias žuvis, kuriomis daugiausiai ir minta. Pastebėję grobį, plasnoja vietoje, bet dažniausiai išskleidę sparnus sustoja, o grobį griebia kojomis krisdami žemyn.
Kartais pasigauna vandens ir kitų paukščių. Juos medžiodami nutūpia į medį netoli vandens telkinio ir laukia tinkamo momento. Taip jie kartais ištupi po kelias valandas. Vėliau, nusižiūrėję tinkamą auką, ereliai staiga puola.
Rečiau medžioja ore, kada užskridę virš ančių ar panašių paukščių būrio ima staiga kilti į viršų, verčiasi ir vejasi auką.
Paprastasis jūrinis erelis (lot. Haliaeetus albicilla, angl. White tailed Sea Eagle, vok. Seeadler) – vanaginių paukščių (Accipitriformes) būrio, vanaginių (Accipitridae) šeimos plėšrusis paukštis.
Jūras ērglis (Haliaeetus albicilla) ir liela izmēra vanagu dzimtas (Accipitridae) plēsīgais putns. Izdala divas pasugas.[1] Sastopams Eirāzijas ziemeļu daļā. Latvijā jūras ērglis ir samērā parasta plēsīgo putnu suga, kas sava lielā izmēra dēļ ir viegli pamanāma. Ligzdojošo putnu skaits pēdējās desmitgadēs pieaug un sasniedzis 100 — 150 pārus.[2] Samērā bieži novērojams arī migrācijas sezonā un ziemā, kad Latvijā ieceļo putni no iekšzemes populācijām.
Jūras ērglis ir Polijas nacionālais putns.
Sastopams Eirāzijas ziemeļu daļā. Areāla rietumu daļā (Eiropā) pārsvarā nometnieks, bet citur migrē uz ziemošanas vietām. Eiropā iekšzemes populācijas ziemā pārvietojas uz Ziemeļjūras un Baltijas jūras piekrastēm, Āzijas putni ziemo areālos ap Arābijas jūru un Ķīnas austrumu piekrastēm, arī Korejā un Japānā.
1955. gadā Latvijā jūras ērglis izzuda kā ligzdotājs,[3] bet kopš 1970. gadu sākuma, kad atrasta pirmā apdzīvotā ligzda, to skaits, pateicoties aizsardzības pasākumiem, ir ievērojami audzis. Ligzdojošo putnu skaits sasniedzis 100 — 150 pārus. Pēdējos desmit gados to skaits ir pieaudzis vairāk kā par 30%.[4]
2012. gadā Latvijas Ornitoloģijas biedrība jūras ērgli izraudzījās par Gada putnu Latvijā.[5]
Jūras ērglis ir liels putns (lielākais Latvijā ligzdojošais plēsīgais putns un ceturtais lielākais Eiropā). Ķermeņa garums 66—94 cm, spārnu plētums 178—245 cm, svars 3,1—6,9 kg.[6][7] Raksturīga pazīme ir īsā ķīļveida aste, kas pieaugušajiem putniem ir balta. Pārējais apspalvojums brūns, galva un kakls gaišāki, knābis spilgti dzeltens, masīvs. Jaunie putni tumšāki, tumšu knābi un asti. Līdzīgi kā citi lielie plēsīgie putni jūras ērgļi pieaug pamazām un tikai 5 gadu vecumā sasniedz pieauguša putna izskatu. Raksturīgs dzimumu dimorfisms — mātītes ievērojami lielākas par tēviņiem.
Jūras ērgļi ligzdo pie dažādiem ar zivīm un ūdensputniem bagātiem ūdeņiem, arī jūras piekrastē. Areāla daļā, kur ir meži, ligzdošanai izvēlas vecus kokus. Ligzdu būvē to galotnes daļā. Dējumā ir 1—3 olas, kuras pārmaiņus perē abi vecāki. Parasti izaudzina vienu vai divus mazuļus. Pēc izšķilšanās mazuļi savā starpā ir samērā toleranti, lai gan vecākais un lielākais putnēns barošanas reizēs dominē pār citiem. Pārtiek no zivīm, putniem, nelieliem zīdītājiem, ziemā labprāt barojas ar maitu.
Sugai ir plašs izplatības areāls, tādēļ globālā mērogā tā netiek uzskatīta par apdraudētu.[8] Arī Eiropā, kur ligzdo apmēram puse sugas populācijas, jūras ērgļi vairs netiek uzskatīti par apdraudētiem putniem. Būtiska sugas stāvokļa uzlabošanās ir panākta pateicoties lauksaimniecības pesticīda DDT lietošanas aizliegumam, ligzdošanas vietu aizsardzībai un putnu šaušanas pārtraukšanai. Lielākā Eiropas populācija ir Norvēģijā, kur ligzdo vairāk par 2000 jūras ērgļu pāru.
Jūras ērglim ir 2 pasugas:[1]
Jūras ērglis (Haliaeetus albicilla) ir liela izmēra vanagu dzimtas (Accipitridae) plēsīgais putns. Izdala divas pasugas. Sastopams Eirāzijas ziemeļu daļā. Latvijā jūras ērglis ir samērā parasta plēsīgo putnu suga, kas sava lielā izmēra dēļ ir viegli pamanāma. Ligzdojošo putnu skaits pēdējās desmitgadēs pieaug un sasniedzis 100 — 150 pārus. Samērā bieži novērojams arī migrācijas sezonā un ziemā, kad Latvijā ieceļo putni no iekšzemes populācijām.
Jūras ērglis ir Polijas nacionālais putns.
Burung Lang Ekor Putih adalah salah satu daripada haiwan yang boleh didapati di Malaysia. Nama sainsnya ialah Haliaeetus albicilla.
Burung Lang Ekor Putih ialah haiwan yang tergolong dalam golongan benda hidup, alam : haiwan, filum : kordata, sub-filum : bertulang belakang (vertebrata), kelas : burung. Burung Lang Ekor Putih adalah haiwan berdarah panas, mempunyai sayap dan tubuh yang diselubungi bulu pelepah. Paruh Burung Lang Ekor Putih tidak bergigi.
Burung Lang Ekor Putih membiak dengan bertelur. Telur Burung Lang Ekor Putih bercangkerang keras.
Burung Lang Ekor Putih adalah salah satu daripada haiwan yang boleh didapati di Malaysia. Nama sainsnya ialah Haliaeetus albicilla.
De zeearend (Haliaeetus albicilla), soms Europese zeearend of witstaartzeearend genoemd, is een roofvogel uit de familie der havikachtigen (Accipitridae). De wetenschappelijke naam van de soort werd als Falco albicilla in 1758 gepubliceerd door Carl Linnaeus.[2] Het is de grootste roofvogel van Noord-Europa.[3][4]
De lengte van een volwassen zeearend bedraagt 70 tot 92 cm, de vleugelspanwijdte is 200 tot 250 cm en het gewicht 3,1 tot 7,5 kg. Een zeearend kan tot 20 jaar oud worden.
Vanwege de grote spanwijdte wordt de zeearend ook wel de 'vliegende deur' genoemd. Buiten zijn enorme spanwijdte vallen zijn grote gele snavel, de diep gevingerde vleugels en zijn witte staart op. Jonge exemplaren hebben die witte staart overigens niet.
Het voedsel van de zeearend bestaat uit vis, (water)vogels, kleine zoogdieren en aas. Soms stelen ze voedsel van andere roofvogels.
Volwassen zeearenden hebben eigenlijk geen natuurlijke vijanden, afgezien van de mens. Eieren en kuikens lopen echter het risico door roofdieren te worden buitgemaakt.
Zeearenden zijn sociaal levende dieren zonder territorium. Ze kunnen rustig naast elkaar broeden. Eieren leggen ze in hoge nesten, meestal in bomen bij moerasgebieden of op een steile rotswand langs kustgebieden. Het legsel bestaat meestal uit twee of drie witte eieren.
Oorspronkelijk kwam de zeearend in geheel Europa voor, maar op veel plaatsen zijn de aantallen sterk terug gelopen of is de soort verdwenen, vooral in Midden- en Zuid-Europa. Wel nemen de laatste tijd de aantallen in veel landen weer sterk toe. Zo is in Denemarken het aantal broedparen toegenomen van één broedpaar 1995 tot 94 broedparen 2017. In Nederland waren er 10 broedparen in 2017. De zeearend komt voor in een band over Rusland naar Azië, waar hij van de Golf van Anadyr tot het noordoosten van China leeft.
Er worden twee ondersoorten onderscheiden:
Na een afwezigheid van verscheidene eeuwen in Nederland werd in 2006 weer een succesvolle broedpoging geconstateerd, in de Oostvaardersplassen.[5] Het zeearendenpaar lijkt zich blijvend in dit gebied te hebben gevestigd, en daarmee in Nederland; sinds 2006 wordt er ieder jaar succesvol gebroed.[6] Na mislukte broedpogingen elders in 2010, onder meer in het Lauwersmeergebied,[7] nam het aantal geslaagde broedpogingen toe en nestelden zeearenden op verschillende plaatsen in Noord-Nederland en de Zeeuws-Zuid-Hollandse delta, zoals in de Biesbosch, de Slikken van de Heen,[8][9][10][11] De Oude Venen[12] en het Zuidlaardermeer.[13][14] Daarnaast wordt de zeearend waargenomen op andere plaatsen, bijvoorbeeld in de Gelderse Poort.[15][16]
De zeearend is van voorjaar 2005 tot en met voorjaar 2017 niet nestelend aangetroffen in België.[17][18]

De zeearend (Haliaeetus albicilla), soms Europese zeearend of witstaartzeearend genoemd, is een roofvogel uit de familie der havikachtigen (Accipitridae). De wetenschappelijke naam van de soort werd als Falco albicilla in 1758 gepubliceerd door Carl Linnaeus. Het is de grootste roofvogel van Noord-Europa.
Havørn (Haliaeetus albicilla) er den største rovfuglen i Nord-Europa. Som andre ørnar høyrer ho til haukefamilien.
Ungfuglen har svart og brun stjert med noko lyst i og svart nebb. Vaksne fuglar har kvit stjert og gult nebb. Begge kjønn har same utsjånad.
Havørna blir mellom 87 og 100 cm lang. Den vaksne hofuglen kan ha eit vengespenn på opptil 240 cm, medan hannfuglen er noko mindre. Ein fugl kan bli opptil 50 år gammal, men det er sjeldan.
Havørna lever av fisk og sjøfugl, men tek òg åtsel.
Ho byggjer store reir av kvister og greiner som ho forer med lyng, tang, mose og gras. Ofte bruker ørna same reir i fleire år. Ho legg egg mellom slutten av mars og mai. Dei to–tre egga blir ruga på i 35 til 45 dagar av begge foreldra.
Eldre havørnar held seg som oftast på ein stad, medan yngre fuglar streifar rundt omkring og trekkjer til dels sør- og vestover om vinteren.
I Noreg finst ørnane langs kysten frå Finnmark til Vest-Agder. Dei hekkar på øyar og holmar langs heile kysten, men mest i Nord-Noreg. Ifølgje Norsk Raudliste har talet på dyr vore veksande dei siste tretti åra, og bestanden på 4000–6000 reproduserande individ er rekna som robust. Utbygginga av vindmøller i hekkeområda har likevel medført fleire dødsfall.[1]
I Sverige hekkar havørna først og fremst ved Austersjøkysten, ved sør- og mellomsvenska sjøar og i Lappland.[2] EIn kan sjå den i heile Sverige og har vore hekkfugl i alle svenske landskap utanom Dalsland, Härjedalen og Jämtland.[3] Svenske havørnar kan vinterstid flytte sørover så langt som til Mellom-Europa, men kan òg flytte kortare strekningar eller bli verande i hekkeområdet.
Havnørna er ein relativt sjeldsynt fugl i Danmark, idet den opphavlege bestanden vart utrydda i 1917, men den gjeninnvandra i 1995 og bestanden er no stigande. Den finst hovudsakleg i Sønderjylland og i Austersjøområdet m.a. på det sørlege Sjælland og Lolland-Falster. Den er lettast å sjå om vinteren.
Havørn (Haliaeetus albicilla) er den største rovfuglen i Nord-Europa. Som andre ørnar høyrer ho til haukefamilien.
Havørn (Haliaeetus albicilla) er Nord-Europas største rovfugl og den fjerde største ørnen i verden. Den er toppkonsument i sitt økosystem og lever primært av fisk og sjøfugler, som den fanger i overflaten. Arten regnes som monotypisk og inngår i underfamilien Buteoninae (glenter, havørner og våker) i haukefamilien (Accipitridae).[3] Arten hekker i Norge og er nært beslektet med hvithodehavørn (H. leucocephalus), som er USAs nasjonalfugl.[3]
Arten er ifølge IUCNs rødliste livskraftig.[2] Den står imidlertid oppført både på CITES liste I og II, samt på CMS liste I og II.[2] BirdLife International hevdet i 2004, at Norge og Russland tilsammen hospiterte cirka 55 prosent av totalbestanden.[4] I Europa anslo BirdLife populasjonen av hekkende par til cirka 9 000–12 300 i 2015, noe som utgjør cirka 17 900–24 500 voksne individer og omkring 50–74 prosent av den europeiske totalbestanden.[4]
Havørn blir omkring 74–92 cm lang, og hunnene blir cirka 15 prosent lengre og 25 prosent tyngre enn hannene.[3] Hannene veier typisk 3 100–5 400 g; hunnene 3 700–6 900 g.[3] Vingespennet ligger på cirka 193–244 cm, avhengig av kjønn.[3] Fra Norge er det kjent eksemplarer (hunnkjønn) med et vingespenn på opp mot 265 cm og en vekt opp til 6 850 g.[5]
Arten har en karakteristisk hvit stjert, et gult kraftig kroket nebb, og øyne med gul iris. Fjærdrakten er generelt lysere (gråbrun eller blekbrun) på hodet og gradvis nedover halsen og oversiden av ryggen, enn den ellers mer mørkebrune undersiden. Ekstremitetene er fjærkledde nesten ned til de kraftige gule føttene, med sine lange kraftfulle tær og lange dolkelignende klør.[3] Ungfuglene, som ofte betegnes som gleksa i Nord-Norge, har fullstendig brunsvart fjærdrakt med hvitaktige markeringer på undervingene (axilla). Også nebb, hode, stjert, og iris er mørk. Ungfuglene har svart og brun stjert med noe lyst i, og svart nebb.[3]
Havørn er utbredt på Sørvest- og Sør-Grønland, Vest-Island og østover i Eurasia via kysten av Skottland og Norge til kysten av Beringhavet og Okhotskhavet i Øst-Sibir og kysten av Japanhavet i Mandsjuria. Arten overvintrer lenger mot sør; i Midtøsten sør til Irak.[3]
Arten trives i akvatiske habitater, både ferskvann og saltvann. Dette utgjør typisk kyststrøk, med typiske kystklipper, øyer med fjellformasjoner, innsjøer, elver og større våtmarkssystemer. Biomet omhandler alt fra ørken til arktiske forhold. Reir og hjemmeområdet krever nærhet til kystklipper eller høye trær i områder nær kysten, normalt i lavlandet. I kyststrøk med kommersielt fiskeoppdrett kan konsentrasjonene av havørn være større enn ellers.[3]
Hekketiden varierer mye i forhold til høye og lave breddegrader. I sin sørlige utbredelse starter den alt i januar, mens den i arktiske strøk ikke begynner før i april–mai. Redet legges til naturlige avsatser i kystklipper eller i kronen i høye trær, men sjelden på bakken ellers. Hvert par har normalt 2–3 reder, som de bytter på om å bruke fra år til år. Redet er en enorm konstruksjon av kvister og greiner, som med tiden kan måle flere meter både i diameter og dybde. Det fôres innvendig med mose, gress, lav, bregner, tang og ull med mer. Hunnen legger normalt to (1–3) egg over en periode på 2–4 dager. Inkubasjonstiden tar cirka 38 dager per egg (totalt 34–46 dager), og begge foreldrene bidrar til både ruging og oppveksten etter klekking. Avkommets første dun er grå, mens den andre duna er gråbrun. Full fjærdrakt oppstår etter cirka 70–90 dager, men avkommet er avhengig av foreldrene i minst 30 dager til. Ungfuglene blir reproduktive etter cirka fem år, kanskje før. Normal levetid er cirka 27 år, men enkeltindivider har oppnådd en levetid på opp mot 42 år i fangenskap.[3]
Havørnen lever av fisk og sjøfugl (spesielt dykkende arter), men den tar også av og til mindre pattedyr (inkludert lam) og åtsler, og den kan i enkelte tilfeller ty til kannibalisme.[6]
Inndelingen av haukefamilien følger i hovedsak Taxonomy in Flux og er i henhold til Boyd (2017),[7] med unntak av underfamilien Aquilinae. Den følger den nye revisjonen til Lerner et al. (2017).[8] Inndelingen regnes imidlertid som omdiskutert og uavklart i øyeblikket. HBW Alive og BirdLife International følger en ganske annen inndeling.[3] Norske navn på artene følger Norsk navnekomité for fugl og er i henhold til Syvertsen et al. (2008).[1] Navn og beskrivelser i parentes er ikke offisielle.
Havørnen hekker langs kysten fra Finnmark til Vest-Agder,[9] men den er mest utbredt i Nord-Norge. I 2008 ble det registrert vellykket hekking av havørn ved Drøbak i Oslofjorden, og et havørnpar innledet hekking på samme sted i 2013. Trolig det samme paret hekket på en annen lokasjon like ved både i 2014 og 2015. Paret fikk to unger på vingene både i 2013 og 2014. I 2015 er det klekket en unge. Havørnens utbredelsesområde utvides stadig. Det er per 2015 etablert hekkende par ved Oslofjorden, i Aust-Agder og trolig ved Telemarkskysten.[10] Sør-Trøndelag har arten som sin fylkesfugl.
Eldre havørner holder seg ofte på ett sted, mens yngre ørner streifer omkring og trekker til dels sør- og vestover om vinteren.
Havørnen fra Salten har fått æren for å ha reddet den norske bestanden, etter at arten ble totalfredet i Norge i 1968.[11] Senere har også den norske bestanden blitt benyttet i et rewildingprosjekt av havørn på De britiske øyer. Fra 1975–1985, 1993–1998 og fra 2007 og fram til i dag. I de to første periodene var det ørn fra Salten som ble sendt over. I 2011 ble det sendt over 16 havørnunger til Skottland og 23 til Irland, fra bestandene på Trøndelagskysten og Vestlandet. Prosjektet se ut til å bli en suksess. I dag er omkring 60 hekkende par i Skottland, selv om noen ørner fikk tilpasningsproblemer og en fløy til og med tilbake over Nordsjøen.[11]
I Norge forulykker havørn tidvis i vindmølleparker, blant annet på Smøla.[12]
Duell mellom havørner over Litløy fyr i Vesterålen
En voksen ørn på Litløya advarer sin unge om å søke dekning (noe den gjorde)
Ørnunge over redet sitt nær Litløy fyr
Havørn (Haliaeetus albicilla) er Nord-Europas største rovfugl og den fjerde største ørnen i verden. Den er toppkonsument i sitt økosystem og lever primært av fisk og sjøfugler, som den fanger i overflaten. Arten regnes som monotypisk og inngår i underfamilien Buteoninae (glenter, havørner og våker) i haukefamilien (Accipitridae). Arten hekker i Norge og er nært beslektet med hvithodehavørn (H. leucocephalus), som er USAs nasjonalfugl.
Arten er ifølge IUCNs rødliste livskraftig. Den står imidlertid oppført både på CITES liste I og II, samt på CMS liste I og II. BirdLife International hevdet i 2004, at Norge og Russland tilsammen hospiterte cirka 55 prosent av totalbestanden. I Europa anslo BirdLife populasjonen av hekkende par til cirka 9 000–12 300 i 2015, noe som utgjør cirka 17 900–24 500 voksne individer og omkring 50–74 prosent av den europeiske totalbestanden.
Àutri nòm an piemontèis: ...
Costo artìcol a l'é mach në sboss. Da finì.
Da finì.
Da finì.
Haliaeetus albicilla
Bielik, orzeł bielik, bielik zwyczajny, birkut (Haliaeetus albicilla) – gatunek dużego ptaka drapieżnego z rodziny jastrzębiowatych (Accipitridae). Występuje w Palearktyce – od Grenlandii po Japonię. Zamieszkuje głównie obszary przylegające do zbiorników wodnych, wzdłuż wybrzeży morskich, w pobliżu rzek. Gatunek osiadły, częściowo wędrowny. Generalista pokarmowy, odżywia się głównie rybami, ptactwem wodnym, okazjonalnie także padliną. Gniazduje na wierzchołkach dużych drzew, na konarach przy pniu, także na półkach urwisk skalnych. Pary są monogamiczne, zajmują terytoria o różnej wielkości, zależnie od dostępności pokarmu, i wyprowadzają jeden lęg w sezonie. Młodymi opiekują się obydwoje rodzice. W związku z antropopresją i zanieczyszczeniem środowiska liczebność gatunku zmniejszyła się znacząco do lat 70. XX wieku. Dzięki zabiegom ochronnym liczebność niektórych populacji wzrosła i ustabilizowała się. Ze względu na duży zasięg i korzystne trendy zmian liczebności populacji w klasyfikacji IUCN gatunek ma status gatunku najmniejszej troski.
Bielik zaliczany jest do rodziny jastrzębiowatych. Przed rewolucją linneuszowską funkcjonował w nazewnictwie naukowym pod nazwami „Pygargus”, „Albicilla” i „Hinnularia”[3][4]. Linneusz przyporządkował ten gatunek, wraz ze wszystkimi innymi ptakami drapieżnymi, do rodzaju Falco, pod nazwą Falco albicilla. Nie zaznaczył przy tym miejsca pozyskania holotypu, wpisał natomiast jako miejsce występowania „Europa, America”[4]. Osobniki młodociane początkowo zaliczano do osobnego gatunku: Falco melanoetos[5]. W związku ze zmianami w systematyce ptaków, bielik jeszcze w XIX w. został przyporządkowany przez Savigny’ego do utworzonego przez tegoż autora rodzaju Haliaeetus[6]. W ramach rodziny jastrzębiowatych bielik jest wydzielany wraz z innymi 8 gatunkami z rodzaju oraz dwoma gatunkami z rodzaju Ichthyophaga jako podrodzina Haliaeetinae[7]. W obrębie rodzaju najbliżej spokrewniony z bielikiem jest bielik amerykański – na podstawie danych morfologicznych, allozymatycznych oraz analiz mtDNA ustalono, że te dwa gatunki tworzą grupę siostrzaną[8][9][10]. Nie stwierdzono jednak, by pomiędzy osobnikami tych gatunków dochodziło do hybrydyzacji międzygatunkowej[11].
W powszechnym mniemaniu bielik jest uważany za orła, jednak w rzeczywistości przedstawiciele rodzaju Haliaeetus są genetycznie bliżej spokrewnieni z rodzajami Ichthyophaga, Milvus i Haliastur niż z orłami właściwymi zgrupowanymi w rodzaju Aquila[12][10]. W związku z tym, niektórzy określają przedstawicieli tego rodzaju mianem orłanów, wskazując także, że od orłów właściwych różnią się niektórymi cechami morfologicznymi, m.in. nieopierzoną dolną częścią skoku[5]. Jednak inni ornitolodzy, nie negując odrębności genetycznej Haliaeetinae od Aquilinae, kwestionują poprawność nazwy „orłany”, zwracając uwagę na to, że jest to rusycyzm (w języku rosyjskim nazwa bielika to: orłan biełokchwost), i że w krajach Europy Zachodniej przedstawiciele tej podrodziny określani są mianem orłów morskich (niem. – Seeadler, ang. – sea-eagle)[13][5]. W rezultacie niektórzy ornitolodzy przyjmują bardzo szeroką definicję orła („duże ptaki drapieżne, które nie są kaniami, myszołowami, sępami, sokołami lub jastrzębiami”), dopuszczając możliwość określania mianem orła oprócz orłów właściwych także gadożerów, harpii i orłów morskich[14].
Na podstawie danych molekularnych szacuje się, że radiacja orłów morskich nastąpiła przynajmniej 5 mln lat temu. Najprawdopodobniej przodkiem grupy był wymarły Haliaeetus piscator, którego skamieniałości znane są z miocenu Francji. Był to gatunek podobny do bielika tylko mniejszy. Rozejście się linii bielika i najbliżej z nim spokrewnionego bielika amerykańskiego nastąpiło najprawdopodobniej ok. 1–2 mln lat temu, po kolonizacji kontynentu Ameryki Północnej przez te ptaki podczas plejstocenu[11].
Wyróżniane są dwa podgatunki H. albicilla[15]:
Przedstawiciele podgatunku nominatywnego są nieco mniejsi od pobratymców z podgatunku zasiedlającego Grenlandię i mają mniejsze kości miednicy oraz mostka. Różnice te jednak nie są duże, dlatego odrębność obydwu podgatunków bywa kwestionowana[17]. Bieliki z obecnie wymarłej egipskiej populacji, odizolowanej geograficznie, zostały opisane jako odrębne gatunki pod dwoma nazwami: Haliaeetus cinereus (von Heuglin, 1856) i Haliaeetus funereus (A. E. Brehm, 1856). Ojciec Brehma, Christian Ludwig Brehm, opublikował je wcześniej w 1855 jako nomina nuda. W 1874 Richard Bowdler Sharpe zsynonimizował te nazwy z Haliaeetus albicilla[18]. Na Hawajach znaleziono subfosylne szczątki bielika z rodzaju Haliaeetus. Analiza genetyczna tych szczątków wykazała, że reprezentują one odrębną linię genetyczną, bliską pod względem pokrewieństwa do gatunku Haliaeetus albicilla, jednak ze względu na ograniczenia metodyczne badacze nie byli w stanie stwierdzić, czy był to osobny, endemiczny dla Hawajów podgatunek[19][20].
Nazwa rodzaju oznacza morskiego orła i jest zlatynizowaną wersją zbitki dwóch greckich słów: hals – morze, słony i aetos – orzeł[6], epitet gatunkowy odnosi się do białej barwy ogona bielika (łac. albi-cilla – o białym ogonie[21][13]).
W literaturze polskojęzycznej gatunek funkcjonuje pod wieloma nazwami, jako: bielik[22][23][24][25][5], orzeł bielik[5][26], birkut łomignat[26], bielik zwyczajny[27], birkut, ostrzyż łomignat[28], orzeł morski, orzeł bielec, orzeł ślepy, orzeł białogłów, orzeł białogon, orzeł bosy[5]. Nazwa bielik odnosi się do białej barwy piór ogona[5], birkut zaś jest słowem pochodzenia tureckiego, oznaczającym strzałę opatrzoną orlimi piórami[29].
Bieliki występują w północnej i centralnej Palearktyce, od równoleżnika 72°N do 30°N[30]. Część populacji jest wędrowna. Według BirdLife International obszar, na którym występują przedstawiciele tego gatunku, z wyłączeniem zimowisk, ma powierzchnię 43,2 mln km²[31]. Południowa granica zasięgu przebiega przez Grecję, Turcję, okolice Morza Kaspijskiego, jeziora Bałchasz (Kazachstan) i północno-wschodnie Chiny[32]. W krainie orientalnej bieliki spotykane są wyłącznie zimą, spotkać je wówczas można nie dalej niż do równoleżnika 22°N. Status we wschodniej części zasięgu w dużej mierze nieznany, poza nią zmienny – zależnie od regionu: miejscami to gatunek zanikły lub rzadki, lecz na niektórych obszarach częsty, czy wręcz o wzrastającej liczebności. W Nearktyce gniazdowanie stwierdzono tylko na Aleutach[30].
Na Grenlandii bieliki występują w południowo-zachodniej części wyspy, na Islandii zaś w zachodniej[32]. W Europie większość zasięgu obejmuje północne i wschodnie części lądu: od Islandii, Szkocji (reintrodukowany), wybrzeży Norwegii i pozostałych części Półwyspu Fennoskandzkiego (północnej i południowo-zachodniej Finlandii, wschodniej Szwecji) przez Rosję, Ukrainę (poza terenami górskimi)[30], Białoruś[33][34], dalej wschodnie kraje bałtyckie, Polskę, północno-wschodnie Niemcy[30], północną i południową Danię[35], zachodnią Austrię, Słowenię, centralne i południowe Węgry oraz przyległą do nich część Chorwacji, sporadycznie również Grecję[36] po Bułgarię, Rumunię oraz wschodnią i zachodnią Mołdawię[37][2][34]. Nieregularny europejski zasięg bielików ciągnie się po Morze Czarne i Turcję[30]. Odizolowane stanowiska odnotowano także w Gruzji i Azji Mniejszej[2][30].
Azjatycka część areału obejmuje północne i centralne regiony kontynentu, na południu sięgając przynajmniej do kazachskiego jeziora Bałchasz i Morza Kaspijskiego. Wschodnie krańce zasięgu gatunku wyznaczają Kamczatka i Japonia (północne i wschodnie Hokkaido; rzadki), a dalej na południe Mandżuria. Dawniej wschodnia granica zasięgu przebiegała przez dolny bieg Jangcy[30]. Bieliki zamieszkują również północne krańce Mongolii, skrajnie północno-zachodnią część Chin i północną Koreę Północną[2][30]. Jedynym państwem, w którym zasięg bielików ma charakter ciągły i obejmuje duży teren, jest Rosja. Przedstawiciele H. albicilla występują tam od europejskiej części kraju na zachodzie do Morza Beringa na wschodzie. Nie gniazdują wyłącznie w dalekiej Arktyce i terenach przyległych do najbardziej zachodniej części Kazachstanu, jednak na podobnej szerokości geograficznej gniazdują w rosyjskiej części wybrzeża Morza Kaspijskiego[2][38][30]. Północną granicę zasięgu wyznaczają równoleżnik 70°N, przechodzący przez rzekę Ob, ujście Jenisej, Półwysep Gydański, Jamal, Kołymę, Indygirkę i Lenę do ponad 72°N, a nawet 75°N na półwyspie Tajmyr. Są najbardziej pospolitymi szponiastymi w rejonie Morza Białego (na wybrzeżu i jeziorach w interiorze), jednak niewiele bielików tam gniazduje ze względu na mroźny klimat[39][38][40].
Bieliki są ptakami osiadłymi, jednak część populacji jest wędrowna. W zachodniej części zasięgu większość bielików prowadzi osiadły tryb życia, nawet te zasiedlające Grenlandię[30]. Rozmieszczenie zimowisk jest słabo poznane z uwagi na zmiany liczebności i zasięgu. Trudno rozróżnić między obszarami, gdzie bieliki spędzają zimę a obszarami, gdzie pojawiają się zabłąkane osobniki. Wiadomo, że w niewielkiej liczbie bieliki zimują we Francji (w Lotaryngii i w okolicach Strasburga). Goszczą w Hiszpanii, Portugalii i na Malcie[39][41][34]. Być może w Holandii istnieje populacja zimujących ptaków, nawet pomimo nieczęstych współcześnie lęgów na północnych wybrzeżach kraju[42]. Poza sezonem lęgowym bieliki notowane są również w zachodnich Niemczech w Nadrenii Północnej-Westfalii, w północnych Niemczech, południowo-zachodniej Danii, zachodnio-centralnych Włoszech, północnej Austrii, południowej Słowacji i północnych Węgrzech. Zimują też w kilku miejscach w Europie Południowo-Wschodniej, z wyłączeniem jej północnych i wschodnich rejonów, gdzie gniazdują[2][34]. Okresowo migrujące lub włóczące się ptaki, w większości z populacji rosyjskiej, zalatują do Turcji, państw Lewantu, Azerbejdżanu i Iranu, dalej na południe po okolice Zatoki Perskiej. W żadnym z państw nie są częste i brakuje pewnych stwierdzeń. Dalej na wschód od wspomnianych terenów z rzadka obserwuje się je w Turkmenistanie, Afganistanie, Uzbekistanie, Tadżykistanie i Pakistanie[2][43]. Sporadycznie zimą pojawiają się w Indiach (w północno-zachodnich rejonach kraju i wzdłuż granicy z Nepalem), oraz w Bhutanie i najdalej wysuniętej na północ części Bangladeszu[44][45]. Zimujące ptaki przebywają także w północno-wschodniej Mjanmie, centralnych i południowych Chinach oraz, regularnie, w północno-wschodnich Chinach[46][47]. W znaczącej liczbie bieliki zimują w Korei Południowej i Japonii, na południe po Honsiu[2][47]. Osobniki, które wykluły się lub gniazdowały na Rosyjskim Dalekim Wschodzie rozprzestrzeniają się, m.in. przez Morze Beringa do Ameryki Północnej, gdzie stwierdzano ich obecność na Aleutach, Wyspach Pribiłowa, części kontynentalnej Alaski i Kodiak[48][49].
W wielu regionach stwierdza się pojedyncze, zabłąkane ptaki, jak w Wielkiej Brytanii – nie mniej w tym państwie ustalenie statusu obserwowanego ptaka utrudnia istnienie reintrodukowanej szkockiej populacji[43]. W Nepalu bieliki pojawiają się bardzo rzadko zimą i na przelotach[50]. W Bhutanie pojawiają się tylko zimą, wszystkie stwierdzenia pochodzą z doliny Mocz‘u (dystrykt Punakʽa). Według danych z lat 60. XX wieku zabłąkane ptaki notowano na Wyspach Komandorskich[51]. W listopadzie 2009 roku bielik po raz pierwszy pojawił się w Kuwejcie[52].
Bieliki sporadycznie obserwowano w Ameryce Północnej. Między 1977 i 1986 rokiem często obserwowano na Attu (Aleuty, Alaska) cztery osobniki, a w 1982 odkryto czynne gniazdo, w którym w kolejnym roku zaobserwowano pisklę[53][30]. W 1983 roku bielik pojawił się także u wybrzeża Massachusetts, w pobliżu latarniowca u południowych wybrzeży Nantucket[53]. Doniesień o gniazdowaniu na Ziemi Baffina nie potwierdzono[53]. W 2007 r. po raz pierwszy zaobserwowano bieliki na Hawajach, na Kauai – potwierdzono też gniazdowanie w Kilauea Point National Wildlife Refuge[54].
W XX wieku zasięg bielika skurczył się, w niektórych krajach bieliki wymarły[32]. Z doniesień historycznych wynika, że w przeszłości bieliki gniazdowały także w Afryce, w Algierii[31] (1975[34][51]) i Egipcie[18]. Na podstawie XIX-wiecznych zapisków i kilku okazów muzealnych ustalono, że wyprowadzały wówczas lęgi w Egipcie (współcześnie tylko nieregularnie pojawiają się tam zimą)[18]. Bieliki wymarły na Wyspach Owczych, gdzie gniazdowały do połowy XVIII wieku[55]. W Mołdawii bieliki przestały gniazdować w 1975 po wcześniejszym drastycznym spadku liczebności[56]. W 2013, podczas pierwszych od 1981 prac terenowych poświęconych tym ptakom, stwierdzono jednak gniazdowanie 4 par[57]. Na początku XX wieku nielicznie bieliki gniazdowały w Albanii. W 1963 roku liczebność populacji szacowano na 1–5 par[58]. Według informacji z 2015 w Albanii populacja lęgowa całkowicie zanikła[59]. W Macedonii bieliki mogły gniazdować jeszcze w latach 50. XX wieku, w okolicy jeziora Prespa przy granicy z Albanią[58], jednak później nie stwierdzono w tym kraju ich występowania[58][59].
Bieliki to duże ptaki o masywnej sylwetce. W locie zwracają uwagę długie, prostokątne skrzydła. W sylwetce ptaka szyja i mocny dziób wystają na podobną długość, co ogon[60]. Dziób jest duży: o ile całkowita długość czaszki wynosi 122–138 mm, to z tego 58–65 mm stanowi dziób[61]. Dziób w szacie ostatecznej ma, podobnie jak woskówka, intensywnie jasnożółty kolor[62]. Koniuszki skrzydeł u siedzącego ptaka równają się z koniuszkiem ogona[60]. Nogawice są dobrze widoczne, a skok nagi[63]. „Palce” dłoni długie, wyraźnie zaznaczone. Ogon jest stosunkowo krótki, tępo zakończony, o klinowatym kształcie[63].
Dymorfizm płciowy jest słabo zaznaczony. Wprawdzie samice są zazwyczaj większe niż samce, a w locie wyróżniają się szerszymi skrzydłami i ostrzej zakończonym ogonem[63], to wizualnie z dystansu trudno określić płeć ptaka. Określenie płci osobnika, tak dorosłego, jak i pisklęcia, możliwe jest na podstawie kombinacji danych: wysokości dzioba i wymiarów szponu, a także iloczynu grubości i szerokości skoku (samice cechuje wyższa wartość tego iloczynu, a samce niższa – przy przyjęciu wartości iloczynu wynoszącej 215 jako kryterium rozróżniającego, w 89–90% przypadków oznaczenie płci jest zgodne ze stanem faktycznym)[64]. Identyfikacja płci jest możliwa także z wykorzystaniem markerów genetycznych[65].
Długość ciała wynosi 74–92 cm, rozpiętość skrzydeł 193–244 cm[60]. Samice są przeciętnie większe od samców. Masa ciała samic mieści się w przedziale 4,1–6,9 kg, samców zaś 3,1–5,4 kg. Długość skrzydła u samic sięga 610–715 mm, u samców: 552–600 mm; długość ogona: 285–515 mm u samic, 280–375 mm u samców; wysokość dzioba: 35,1–47,7 mm u samic, 32,4–36,0 mm u samców[66]. W Europie jedynie orłosępy (Gypaetus barbatus) i sępy osiągają większe niż bieliki rozmiary ciała[66]. Bieliki występujące na Grenlandii są nieco większe niż ich pobratymcy z innych terenów[32][67]. Długość skrzydła zmierzona u tamtejszych ptaków wynosiła 624–652 mm u samców i 660–717 mm u samic[67]. Wymiary szczegółowe z różnych źródeł dla dorosłych osobników, zestawione przez Mizerę (1999), przedstawione są w poniższej tabeli[68].
Wymiary dorosłych bielików za: Mizera, 1999 Parametr SamceDorosłe osobniki mają upierzenie w większości brązowe, chociaż jasne krawędzie skrzydeł wierzchu ciała i pokryw skrzydłowych wizualnie rozjaśniają upierzenie. Głowa, szyja, pierś i pokrywy skrzydłowe mniejsze są wyraźnie jaśniejsze, nawet żółtawoszare. Pióra stopniowo ciemnieją w kierunku kupra, brzucha i nogawic. Lotki są już jednolicie ciemne[43], jaśniejsze w części proksymalnej[61]. Z resztą upierzenia kontrastują białe sterówki[43] z brązowo nakrapianymi nasadami[61], aczkolwiek często ogon przysłonięty jest przez skrzydła. W znoszonej lub wypłowiałej szacie mocniej podkreślone są jasne obszary, niekiedy niemalże białe. Niekiedy wiązane jest to z wiekiem, jednakże zależy od stopnia zużycia albo wyblaknięcia upierzenia[43]. Na podstawie różnic w wybarwieniu sterówek (charakterystycznego dla osobnika układu plamkowania na chorągiewkach) możliwe jest odróżnienie poszczególnych osobników[62].
Ptaki w szacie juwenalnej mają upierzenie głównie w kolorze ciemnobrązowym, przy czym nierzadko głowa jest najciemniej wybarwiona. Pierś, brzuch i grzbiet skrzydeł są rdzawobrązowe z czarniawymi krawędziami. W szacie juwenalnej jest ciemny, z jasną nasadę. Dostrzec można widoczne w locie jasne podbarkówki i jasny pas na spodzie skrzydła. Białe podbarkówki utrzymują się kilka lat. Wszystkie pióra są świeże lub tak samo znoszone, inaczej niż w pierwszej szacie młodocianej (1.–2. lato), gdzie zwraca uwagę nierównomierne zużycie piór. Miejsca uprzednio rdzawobrązowe są wyblakłe, niektóre z piór płaszcza i piersi mają białe nasady. W drugiej szacie młodocianej (2.–3. lato) kolorystyka upierzenia jest zmienna, generalnie jednak coraz ciemniejsza, brązowa. U części ptaków na piersi i grzbiecie wciąż utrzymuje się białe plamkowanie. W 3. szacie młodocianej (3.–5. lato) bieliki są już wyraźnie podobne do dorosłych, upstrzone pojedynczymi białymi piórami i z nadal szarobrązową głową i szyją. U młodych ptaków ogon w większości ciemny, potem w kolejnych szatach jaśnieje, by w szacie dorosłej stać się śnieżnobiałym. Jaśnieje także dziób, początkowo ciemnobrunatny, a u dorosłych żółty[69].
Pisklęta są pokryte brudnosiwym, gęstym puchem. W miejscach przyszłych piór występuje długi i rzadki biały puch. Zajady są żółtozielone, nogi jasnożółte, dziób i pazury ciemnorogowe[70].
Repertuar głosów, wydawanych przez bieliki, jest bogaty. Wokalizacje bielików, zwłaszcza w sezonie lęgowym, są głośne, choć niektórzy autorzy opisują dźwięki przez nie wydawane jako niezbyt głośne jak na tak duże ptaki[71][72]. Głos samca często bywa zapisywany jako gri-gri-gri lub krik-krik-krik, samice natomiast odzywają się głębszym gra-gra-gra-gra lub krau-krau-krau-krau. Głos ten stopniowo nabiera tempa i tonacji, cała sekwencja może zawierać 15–30 pojedynczych dźwięków. Dobrane w pary bieliki często odzywają się w duecie, w locie lub z gałęzi. Siedzący samiec odzywa się kyi-kyi-kyi-kli-kliek-yak (transkrypcja angielska) z głową odchyloną do tyłu lub w górę, samo zawołanie kończy się niższym ko-ko-ko. Samice odzywają się podobnym do samczego, ale głębszym krau-krau-krau-uik-ik. Przeważnie głosy wydawane przez siedzące ptaki są wyższe i bardziej przenikliwe, niż te które usłyszeć można od lecących ptaków[71][72]. W trakcie zalotów samiec nawołuje krau-krau-krau-uik-ik-ik, samica natomiast odpowiada mu niższym ra-rak-rak-rak-rak. Młode w gnieździe wołają przeszywającym piieh-piieh, samica podczas odbierania pokarmu od samca odpowiada mu tszie-tszie lub wueee-wueee. Pojedyncze lub powtarzane krlee bywa używane różnorodnych sytuacjach. Głos ostrzegawczy to przeważnie 3 lub 4 krótkie klee lub klek notes. Niekiedy bieliki alarmują lub wyrażają niezadowolenie głębokim gah-gah-gah lub jok-jok-jok, podobnym do głosu dużych mew. Głos ten używany jest również podczas zbliżania się zwierzęcia do gniazda, głównie człowieka. Młode, gdy są głodne, wydają z siebie monotonne weee-weee. Jeśli w porę nie otrzymają pokarmu lub opieki wołanie staje się intensywniejsze[71][39][72][73].
W locie bieliki wyróżniają szerokie, prostokątne skrzydła o palczasto rozcapierzonych końcach lotek I rzędu, widać też ich kontrastujące podbarkówki. Ptaki szybując trzymają skrzydła płasko lub nieco uniesione i lekko wygięte. Podczas lotu ślizgowego skrzydła są wysunięte do przodu, z wystającymi nadgarstkami i opuszczoną dłonią. Na lot aktywny składają się serie płytkich uderzeń skrzydeł, przedzielone krótkimi fazami lotu ślizgowego[74]. W trakcie godów bieliki często latają parami, dochodzi wówczas do akrobatycznych walk powietrznych na dużej wysokości, zwykle tuż pod pułapem chmur. Ptaki chwytają się szponami i koziołkując spadają z dużej wysokości, rozdzielając się tuż nad ziemią. Bywa że w takich akrobacjach bierze udział więcej niż jedna para[75][76].
Bieliki nie spędzają dużo czasu w powietrzu. Gdy już zajmą terytorium, na loty przeznaczają średnio 6,8%[77]–33,1%[78] czasu dziennie, jedynie zimą udział ten zwiększa się, co wynika z większej ilości czasu poświęcanej na poszukiwanie pokarmu. Na przemieszczanie się w obrębie terytorium składało się tylko 9,1% czasu spędzonego dziennie w powietrzu, zdecydowanie więcej czasu bieliki poświęcają na loty godowe i związane z ochroną terytorium (45,8%) oraz na loty w poszukiwaniu pożywienia (45,1%)[77]. Średni dystans, jaki dorosły ptak pokonuje dziennie to 124 km[79]. Młode poświęcają więcej czasu na loty pokarmowe niż stare, co wynika najprawdopodobniej z różnicy w doświadczeniu w poszukiwaniu i zdobywaniu pokarmu[77].
Bieliki przemieszczające się na nogach wydają się być ociężałe, poruszają się mniej zgrabnie od orłów przednich (Aquila chrysaetos)[63].
Diploidalna liczba chromosomów tego gatunku to 2n=66, w tym 6 mikrochromosomów. 9 par chromosomów jest akrocentrycznych, 1 – subtelocentryczna, 15 – metacentrycznych do submetacentrycznych. Chromosom Z jest submetacentryczny i jest największym chromosomem w całym garniturze. Kariotyp bielika jest podobny do kariotypów H. leucocephalus, H. vocifer i H. pelagicus[80].
W całym obszarze występowania populacje bielika wykazują małą zmienność genetyczną. Wyróżnić można dwie odmienne haplogrupy: jedną, grupującą genotypy z zachodniej części zasięgu, i drugą – ze wschodniej części zasięgu gatunku. W Europie współwystępują osobniki należące do obydwu haplogrup. Rozdział obydwu linii nastąpił w plejstocenie. Taki wzór zmienności wskazuje najprawdopodobniej na to, że w trakcie zlodowaceń populacje bielika przetrwały w izolowanych od siebie refugiach w centralnej (region pontokaspijski) i zachodniej (wybrzeża Atlantyku) Eurazji, a po ustąpieniu lądolodu nastąpiła ekspansja osobników ze wschodniego refugium, zwłaszcza w kierunku północnym, i mieszanie puli genowej obydwóch populacji. Ekspansji bielików sprzyjać mogły towarzyszące ustępowaniu lądolodu podnoszenie poziomu morza i związane z tym zwiększanie się długości linii brzegowej[81][82]. Największą różnorodność genetyczną udokumentowano w populacjach z rejonu Morza Bałtyckiego. Nie stwierdzono, by istniała korelacja pomiędzy wielkością populacji bielika a ich różnorodnością genetyczną – np. bardzo duża populacja norweska jest bardziej homogenna pod względem genetycznym niż sąsiednia, mała populacja z Półwyspu Kolskiego[81]. Ponadto analizy struktury genetycznej populacji wskazują na to, że populacje z Grenlandii i Islandii różnią się mniej od pozostałych populacji niż osobniki z Japonii i znad Amuru. Tym niemniej populacja grenlandzka wyróżnia się niską różnorodnością w badanym odcinku mtDNA, oraz obecnością unikalnego, niespotykanego w pozostałych populacjach, haplotypu A03, co świadczy o stopniowo postępującej izolacji tej populacji[81]. Drastyczne zmniejszenie liczebności gatunku w Europie, do którego doszło w XIX i na początku XX wieku, nie spowodowało jednak zmniejszenia różnorodności genetycznej (efektu wąskiego gardła) populacji europejskich. Przypuszcza się, że jest to wynikiem długowieczności bielików (ich długość życia dochodzi do 20–30 lat) i tego, że okres niskiej liczebności trwał stosunkowo krótko (przez czas odpowiadający długości trwania dwóch pokoleń bielików). Do zachowania różnorodności genetycznej przyczyniły się również działania na rzecz ochrony wielu małych, lokalnych populacji gatunku[83].
Bieliki zajmują siedliska położone w sąsiedztwie środowisk wodnych, bowiem w płytkim litoralu lub nad wodą zdobywają większość pokarmu. W pobliżu wód, zarówno śródlądowych, jak i u wybrzeży morskich, budują gniazda, koczują w okresie polęgowym i gromadzą się na noclegowiska[84] (np. w Chorwacji 95% gniazd znajdowało się nie dalej niż 4 km od dużych zbiorników śródlądowych[85]). Bieliki zasiedlają różne typy wybrzeży morskich: fiordowe, ze skalistymi, wysokimi klifami, szkierowe, ale również nizinne wybrzeża w pobliżu ujść rzek: estuaria i zalewy nadmorskie oraz jezior przymorskich. Na terenach w głębi lądu preferują siedliska w pobliżu rzek, jezior, stawów, także tych położonych na terenach górskich (do wysokości 4000 m n.p.m.). Zależnie od warunków, mogą to być siedliska bezdrzewne (np. skaliste na Grenlandii, stepowe i półpustynne w centralnej Azji), z nielicznymi, niskimi drzewami (np. w Norwegii), jednak najczęściej wybierane przez bieliki są siedliska leśne, zwłaszcza ze starodrzewami, w których można założyć gniazda[86]. Bieliki gnieździć się mogą w różnych typach lasów, od tajgi na północy kontynentu, po lasy bagienne i rosnące na równinach zalewowych na południu[34]. W Europie Środkowej są to przede wszystkim bory i buczyny, a także w grądy, łęgi, olsy[87]. Bieliki do gniazdowania wymagają siedlisk, w których aktywność ludzka utrzymuje się na niskim poziomie – niepokojone mają tendencję do porzucania gniazda. Minimalny tolerowany przez przedstawicieli gatunku dystans do potencjalnych źródeł zakłóceń (dróg, osiedli, źródeł hałasu) jest różny, zależnie od typu środowiska i rejonu geograficznego (np. w Chorwacji określono go na 1–2 km[85]), zwykle jest większy w środowiskach otwartych[34].
Choć większa część populacji bielików jest osiadła, to niektóre bieliki podejmują migracje. Migrują osobniki młodociane, a także osobniki z populacji na północnych i wschodnich krańcach zasięgu gatunku[39][88][89]. W zachodniej części zasięgu bieliki podejmują wędrówki nieczęsto, osiadły tryb życia prowadzą nawet te pochodzące z Grenlandii, Islandii czy wybrzeża Norwegii. W południowej części zasięgu zimowe wędrówki są rzadsze, większość par nie opuszcza swoich terytoriów cały rok. Osobniki z interioru mogą przemieszczać się na wybrzeża[72]. Populacje azjatyckie natomiast regularnie migrują pomiędzy lęgowiskami na północy i zimowiskami na południu. Przyczyną migracji jest surowy klimat i brak możliwości zdobywania pokarmu zimą[43][89]. Tamtejsze ptaki migrują na zimowiska położone pomiędzy Hokkaido a Zatoką Tonkińską, oddalone o 2–5 tys. km od ich lęgowisk. Trasę tę pokonują w 57–84 dni[89]. Na Dalekim Wschodzie bieliki zdają się wybierać odmienne trasy wędrówek jesienią i wiosną. Jesienią z północno-centralnej Kamczatki udają się na Hokkaido przez Wyspy Kurylskie, za to wiosną ich droga wiedzie na północ przez Sachalin i północno-zachodnie wybrzeża Morza Ochockiego[90]. Osobniki z okolic Morza Białego wyruszają na zimowiska od sierpnia do listopada, choć niektóre zostają dłużej podczas łagodnych zim. W okolice Morza Białego powracają w lutym albo marcu[40].
Młode bieliki chętniej niż dorosłe podejmują wędrówki, szybko opuszczając obszary, gdzie się wykluły. Jednak jeśli okolica obfituje w łatwo dostępny pokarm również one będą koczować w pobliżu miejsca urodzenia[89]. W północno-zachodniej Europie migracje młodocianych osobników rozpoczynają się od sierpnia do września, powroty zaś w kwietniu i marcu – później, niż w przypadku osobników dorosłych[72][43]. Młodociane, 2.–4. letnie ptaki zalatują nieraz daleko od miejsc rodzinnych. Spośród zaobrączkowanych młodocianych bielików w Norwegii niewiele podejmowało dalsze wędrówki, lecz jeden z nich został znaleziony 720 km na południe od swojego gniazda, w okolicy Karlstad (Szwecja), inny z kolei zapuścił się w okolice Morza Wattowego (Holandia). Możliwe, że większość holenderskiej populacji tworzą osobniki przybyłe z Norwegii[42][91]. Młodociane ptaki z Finlandii i Szwecji przemieszczają się w kierunku południowo-zachodnim, na wybrzeża Bałtyku. Jeden osobnik z Finlandii dotarł 520 km na zachód, do północnej Norwegii, inny pojawił się w Bułgarii[92][93]. Młode ptaki z Niemiec zwykle nie wędrują daleko, przeważająca część nie docierała dalej, niż 50 km od gniazda, przeważnie pozostawały u wybrzeża Bałtyku. Niektóre jednak rejestrowano we Włoszech, 1030 km od miejsca wyklucia, czy w Żyrondzie (Francja), 1520 km na południowy zachód od gniazda[94]. Osobnik zaobrączkowany nad Morzem Białym doleciał w trakcie wędrówki na Węgry (ponad 2600 km od miejsca urodzenia)[95].
Zimą migrujące bieliki – szczególnie młode – stają się towarzyskie i łączą się w grupy, niezależnie od długości i charakteru podejmowanej wędrówki. Formowane przez nie grupy liczą do 10 osobników, a w obszarach z liczniejszą populacją lęgową (na przykład w Norwegii) do 30–40[39][96]. Miejscami (np. w okolicach Zalewu Szczecińskiego i na Hokkaido) na zimowiskach mogą się zbierać grupy liczące nawet kilkaset osobników[95]. Monitorowanie przez 37 zim zbiorowisk zimujących osobników u wybrzeża Bałtyku i wzdłuż Łaby wykazało, że w podanych obszarach bieliki osiedlają się najpierw w listopadzie. W styczniu liczebność jest największa, zaczyna maleć w marcu i na początku kwietnia[94].
Bieliki to ptaki terytorialne. Terytorium potrzebne jest w celu zapewnienia wyłączności korzystania z zasobów środowiska, zwłaszcza miejsc gniazdowych, noclegowisk i pokarmu[97]. W przypadku bielików terytorializm nie jest mocno zaznaczony – ściśle bronionym jest tylko niewielki obszar w pobliżu gniazda (terytorium gniazdowe), pozostałą przestrzeń, wykorzystywaną przez parę bielików (lub pojedynczego osobnika) określa się jako rewir (areał osobniczy)[98]. Wielkość areałów osobniczych bielików jest zróżnicowana: od 2,3–19,2 km² w północnych Niemczech[99], 6–9 km² na wybrzeżach Norwegii[96] do 415[72]-600 km²[98][100]. Zazwyczaj powierzchnia areału osobniczego to nie więcej niż 130 km²[72]. Wielkość areału zależy od dostępności miejsc gniazdowych, obfitości pokarmu i stanu populacji bielików – jest większa gdy populacja jest daleko od poziomu pojemności środowiska[101]. W przypadku, gdy tereny łowieckie są bogate w pokarm, a brakuje odpowiednich miejsc gniazdowych, pary bielików mogą gniazdować w odległości kilkuset metrów od siebie co stwierdzono np. nad Zalewem Szczecińskim. W tej sytuacji, mimo iż ptaki utrzymywały kontakt wzrokowy, nie dochodziło między nimi do konfliktów[98]. Podobnie w Norwegii, pary gniazdujące nad morzem zajmują rewiry wzdłuż wybrzeża o szerokości zaledwie 3–4 km, a nawet 1–2 km. Na obszarach śródlądowych rewir zwykle rozciąga się w promieniu 4–6 km od gniazda (60–100 km²)[98]. Wzdłuż 80-kilometrowego odcinka rzeki Jenisej odnaleziono 5 gniazd[102]. Większe rewiry odnotowano u ptaków gnieżdżących się na Syberii oraz na obszarach, na których liczebność populacji bielika zmalała wskutek presji człowieka, a same ptaki aby przetrwać gniazdowały w rozproszeniu[98].
Choć bieliki nie wykazują dużej agresji wobec osobników własnego gatunku, zwłaszcza dużą tolerancję wykazują wobec młodych osobników, wtargnięcie na terytorium obcego samca w szacie dorosłej prowokuje właściciela terytorium do walki. Zdarzają się śmiertelne potyczki czy uszkodzenia gniazda podczas ataku[39][72]. Niski poziom agresji może wynikać z tego, że zagęszczenie populacji bielików jest zwykle niższe niż poziom pojemności środowiska[101].
Bieliki są drapieżnikami i padlinożercami. Są generalistami pokarmowymi[77][103]. Ich głównym źródłem pokarmu są ryby i ptactwo wodne, padlina zaś jest ważnym uzupełnieniem diety[77][13][103]. Ssaki chwytane są mniej często[32], choć okresowo na niektórych obszarach ich udział w diecie może się zwiększać[103]. Bieliki zdobywają pożywienie głównie w ekotonach, na granicy różnych typów siedlisk – najczęściej w litoralu. Skład diety bielików różni się w zależności od rejon geograficznego i siedliska, w którym bytują, wieku i preferencji osobniczych, dostępności pokarmu, pory roku i warunków pogodowych[104][105]. Na podstawie różnic w składzie izotopów trwałych stwierdzono, że np. bieliki w Niemczech bazują głównie na pokarmie ze zbiorników śródlądowych i rzek, te z Finlandii – na pokarmie zdobywanym w słonawych wodach Bałtyku, a te z Grenlandii – na pokarmie zdobywanym na wybrzeżu Atlantyku. Duża wariancja w populacji niemieckiej wskazuje na międzyosobnicze różnice w składzie diety[105]. Dieta osobników młodocianych w większym stopniu opiera się na padlinie oraz na ofiarach łatwych do schwytania, takich jak łyski, natomiast sygnatury izotopowe osobników dorosłych wskazują na większy udział rybożernych ptaków w pokarmie tej grupy wiekowej. Skład diety bielików zmienia się w zależności od pory roku. Jak wykazały badania populacji zasiedlającej Niemcy, zimą, niezależnie od wieku osobników, udział padliny w składzie pokarmu bielików wzrasta do 29,5%, co badacze tłumaczą większą podażą padliny związaną z zimowym sezonem polowań (bieliki korzystają z trupów zwierząt zmarłych wskutek postrzału)[105].
Bieliki optymalizują wybór pokarmu i sposób jego zdobywania w zależności od jego dostępności[32][77]. Jeżeli mają pod dostatkiem pokarmu, preferują większe ryby niż mniejsze, a także wolniejsze i mniej zwinne osobniki ptactwa wodnego (np. kaczki nurkujące) od tych szybszych i zwinniejszych (np. kaczek pływających). Osobniki dorosłe, prawdopodobnie ze względu na większe doświadczenie i lepsze rozeznanie w terenie, mają większą skuteczność w atakach na ofiary niż osobniki młodociane. Największą skuteczność wykazują w atakach na ryby. Wpływ na skuteczność ma także pora roku – największą skuteczność stwierdzono wiosną (co może wynikać z tego, że wówczas ma miejsce tarło preferowanych gatunków ryb i związane z tym gromadzenie się ryb na płyciznach), a najmniejszą zimą[77].

W skład diety bielików wchodzi wiele gatunków zwierząt, co jest pochodną szerokiego zasięgu geograficznego tego gatunku. Jednym z najważniejszych źródeł pokarmu bielików są ryby – np. w populacji grenlandzkiej stanowią one większość (93%) konsumowanego pokarmu, podobnie na Mazurach (74%)[104] i w północnych Niemczech (77%)[77]. Ogółem w diecie bielików odnotowano około 70 gatunków ryb słono- i słodkowodnych[39]. Spośród nich tymi, które stwierdzano najczęściej, są: dorsze, zębacze smugowe, tasze, łososie, golce, szczupaki, leszcze, płocie, wzdręgi, karpie, karasie, miętusy i sieje[104]. Bieliki wybierają osobniki pływające przy powierzchni wody (zwykle nie głębiej niż do 1m[39]) słabsze, chore, świeże lub śnięte[32][39]. Z badań nad bielikami żerującymi nad jeziorami w północnych Niemczech wynika, że skład gatunkowy ryb złowionych przez bieliki różni się od obsady gatunkowej ryb w jeziorach: bieliki unikają polowania na okonie, węgorze i płocie też są reprezentowane w diecie bielika rzadziej, niż by to wynikało z częstości ich występowania w środowisku[77]. Bieliki chwytają ryby o różnej wielkości: od 0,1 kg do 6–8 kg[106][39]. W literaturze są informacje o atakach na znacznie większe ryby, o masie nawet ok. 15 kg – niekiedy osobniki, które zaatakowały tak dużą rybę, nie były w stanie unieść jej w powietrze, i musiały holować ją w wodzie do brzegu. Atak na zbyt dużą rybę może skończyć się śmiercią ptaka wskutek utopienia – odnotowano fakt złapania dużego halibuta, w grzbiecie którego wbita szponami tkwiła nogą bielika[106]. Bieliki preferują chwytanie ryb o średniej wielkości ciała: o długości od 30 do 50 cm[77], i masie od ok. 0,5 kg do 3 kg (średnio około 0,94 kg)[106].

Ptaki są również ważnym elementem diety bielików. W niektórych populacjach to właśnie ptaki (przede wszystkim wodne ptaki nurkujące) dominują w pokarmie, co stwierdzono np. na obszarach Szlezwika-Holsztynu (ponad 50% udział ptactwa w diecie bielika), nad zatoką Kandałaksza (79,1% udział)[103] i w Szkocji (73,5% udział)[39]. Wśród ofiar bielików odnotowano 170 gatunków ptaków[39][96]. Bieliki atakują zarówno ptaki dorosłe, także te wysiadujące jaja, jak i młodociane, porywają też pisklęta i jaja[32][103]. Mogą rabować także gniazda innych ptaków drapieżnych (sokoła wędrownego, myszołowa, rybołowa, uszatki czy też puchacza)[103].
Zakres wielkości ptaków, na które polują bieliki, jest duży: od ptaków wielkości szpaka aż do tak dużych jak łabędzie krzykliwe. Najczęściej łupem bielików pada ptactwo wodne: głównie kaczki, gęsi, nurzyki, nurniki, perkozy, a także żurawie, kormorany, mewy i rybitwy[103]. Bieliki preferują łowy na nurkujące ptaki wodne, zwłaszcza na edredony[103][96] i łyski[39], udział tego ostatniego gatunku w pokarmie bielików stanowić może nawet 33–73%[77][103]. Kaczki pływające, będące sprawniejszymi lotnikami, są atakowane relatywnie rzadziej. Jedynie w trakcie pierzenia, gdy są nielotne, również one mogą stanowić znaczącą część diety. Spośród nich, ze względu na rozprzestrzenienie, najczęściej łupem bielików padają krzyżówki[39][103]. Stwierdzono też żerowanie bielików na około 60 gatunkach ptactwa lądowego[39]. Spośród nich wymienić można między innymi: pardwy, głuszce, cietrzewie, gawrony, wrony, bażanty i gołębie. Jednak znaczenie ptaków lądowych jako źródła pożywienia dla bielika jest niewielkie, jedynie krukowate mogą lokalnie stanowić większy udział w diecie bielików[103][39]. Ostatnio coraz częściej ofiarą bielików padają też bociany i ich pisklęta[13].
Ssaki mają niewielkie znaczenie jako źródło pokarmu bielików. Ich udział ilościowy w pokarmie stanowi od 1,9–6% do 12%[103][77], wyjątkowo tylko stwierdzano większy ich udział – np. w jednym z rezerwatów w Laponii, gdzie bieliki żywiły się piżmakami i lemingami, wynosił on 41%[103]. Oprócz dwóch wymienionych wyżej gatunków lokalnie również zającowate (króliki, zające i bielaki) mogą odgrywać istotna role jako pokarm bielika[39][107][103]. Spośród innych ssaków wśród upolowanych przez bieliki zwierząt stwierdzono – różne gatunki gryzoni (m.in. karczowniki, szczury i myszowate), a także młode saren, warchlaki dzików, lisy, kuny leśne, wydry[103] i norki[108]. Obserwowano także skuteczne ataki bielika na młode foki pospolite o masie do 18–20 kg[103]. Przez wiele lak wierzono, że bieliki polują na zwierzęta gospodarskie przebywające na pastwiskach – w rzeczywistości prawie wszystkie obserwacje ptaków, pożywiających się inwentarzem na pastwiskach, dotyczyły zwierząt żerujących na padlinie[109].
Inne zwierzęta są przez bieliki chwytane rzadko. O ile niektóre z bezkręgowców czasami pojawiają się w ich diecie, jak np. meduzy, głowonogi – w tym kałamarnice olbrzymie, kraby i raki, rozgwiazdy, jeżowce i małże, to gady i płazy są zjadane jedynie wyjątkowo[103].
Bardzo ważnym, szczególnie zimą i dla osobników młodocianych, źródłem pokarmu jest padlina[103]. Stanowić może ona około 29,5% diety bielików[105]. Przedstawiciele tego gatunku zjadają zarówno martwe ssaki (łosie, renifery, foki, wieloryby oraz zwierzęta domowe), ptaki i ryby, a także padłe bezkręgowce. Na tuszach martwych zwierząt, jeśli są one większych rozmiarów, gromadzić się może kilka-kilkanaście ptaków. Podobnie osuszane stawy rybne również przyciągają bieliki, szukające martwych ryb. Chętnie i często zjadane są zwierzęta postrzelone przez myśliwych oraz potrącone przez pojazdy[103].
Racja pokarmowa bielika zależy od jego wieku i składu diety. Pisklę, w okresie od wyklucia z jaja do opuszczenia gniazda, zjada przeciętnie ok. 50 kg pokarmu (przy diecie składającej się głównie z ryb), w ostatnich pięciu tygodniach pisklęta zjadają średnio 820 g ryb dziennie[110]. Dorosłe osobniki z populacji norweskiej konsumowały średnio 625 g pokarmu, na który w większości składały się ryby[96]. Bieliki hodowane w niewoli na diecie mieszanej konsumowały od 409 g do 618 g pokarmu dziennie, co stanowiło ok. 9,4% masy ich ciała. Dorosłe osobniki mogą skonsumować dziennie do 2 kg pokarmu[110].
Bieliki mają zróżnicowany repertuar strategii łowieckich. Wybór konkretnej zależy od czasu, miejsca, rodzaju ofiary, umiejętności osobnika oraz obecności innych bielików[77][111]. Bielik chwyta ofiary głównie przy pomocy szponów. Atakujący osobnik wysuwa w locie do przodu obydwie nogi i stara się wbić szpony w ofiarę. Łukowato zakrzywione i ostro zakończone szpony o długości ok. 5 cm oraz szorstkie opuszki palców powodują, że w sytuacji, gdy się mu to uda, chwyt jest pewny, a schwytane zwierzę ma niewielką szanse na uwolnienie się z uścisku[111]. Mocny chwyt może też przyczynić się do śmierci bielika w sytuacji, gdy zaatakuje zbyt dużą ofiarę, która będzie miała dość siły by wciągnąć go pod powierzchnię wody i utopić[112]. Szorstkie opuszki ułatwiają też transport innych rodzajów pokarmu, np. zrabowanych ptasich jaj. Dziób służy jedynie do rozrywania zdobyczy[111].
Bieliki preferują strategię polowania z zasadzki (ang. sit and wait). Stosujący ją osobnik zajmuje miejsce (czatownię), które zapewnia mu dobre pole obserwacji na łowisko. Czatownią może być samotne drzewo, słup, eksponowana skała, wzniesienie terenu[111]. Na wypatrywanie ofiar z czatowni bieliki poświęcają średnio 81,5%[77]–90%[111] czasu polowania. Ryby pływające przy powierzchni wody atakowane są z lotu ślizgowego, przy tym ptak nie przerywa lotu, a jego nogi tylko płytko zanurzają się w wodzie[32][111]. Ryby pływające na większej głębokości atakowane są z większej wysokości, pod większym kątem. Atakujący osobnik podgina skrzydła, wysuwa nogi do przodu i w głąb, w trakcie ataku nawet całkowicie zanurzając się w wodzie. Atak na ptactwo pływające na powierzchni wody przebiega według odmiennego schematu: atak na łyskę rozpoczyna się, gdy ofiara oddali się od trzcinowiska na ok. 200 m lub gdy pojedynczy osobnik oddali się od stada. Bielik nadlatuje nad ofiarę i odcina jej drogę ucieczki w trzciny. Łyska broni się nurkując, a bielik wielokrotnie ponawia ataki zawisając nad nurkującym ptakiem. Gdy zmęczona i podtopiona ofiara wypływa na powierzchnię i nie jest już w stanie więcej nurkować, bielik chwyta ją w szpony. Takie polowanie trwać może od 35 minut do 2–4 godzin, a ataki na wybrana ofiarę mogą być powtarzane nawet 65 razy[111]. Schwyciwszy ofiarę drapieżnik odlatuje z nią w bezpieczne miejsce, by ją spożyć. Jeśli masa ofiary jest za duża, by unieść się w powietrze, bieliki holują łup w wodzie do brzegu[112][96]
Modyfikacją wyżej opisanego sposobu jest polowanie w tandemie. Dwa lub więcej osobników współpracuje wówczas ze sobą podczas ataków. Współpraca polega na zespołowym ataku na stado łysek lub kaczek – jeden osobnik lata nad szuwarem, usiłując wypłoszyć kryjące się tam ofiary, podczas gdy drugi atakuje ofiarę wypędzoną na otwartą wodę. Współdziałanie to przejawiać się może także w postaci wzajemnego zastępowania się w ponawianych kolejno atakach na stada usiłujące uniknąć ataku przez synchroniczne nurkowanie – gdy ptaki wynurzają się po ataku pierwszego osobnika, są od razu atakowane przez kolejnego[111].
Kolejną ze strategii polowań, stosowaną przez bieliki, jest brodzenie w płytkiej wodzie. Stosowana jest w płytkich zbiornikach wodnych, głównie osuszanych stawach rybnych, i płytkich ciekach. Bieliki brodząc przeszukują miejsca, w których gromadzą się nieodłowione ryby, odizolowane przez opadający poziom wody. Strategia ta jest też skuteczna podczas migracji ryb łososiowatych na tarło. Bieliki mogą wówczas polować zarówno na tarlaki, jak i żerować na śniętych rybach po tarle[111].
Polowanie z dolotu polega natomiast na błyskawicznym ataku bielika, który z wysokości ok. 60–80 m pikuje na łowisko, składając do tyłu skrzydła, względnie opadając z rozpostartymi skrzydłami i wyciągniętymi nogami[111].
Polowanie w formie powtarzanych przelotów wzdłuż pasa trzcin stosowane jest przez osobnika, który zlokalizował obecność potencjalnych ofiar – ptactwa wodnego, kryjących się w szuwarach. Niskie przeloty tuż na granicy otwartej wody mają zaskoczyć ofiary, wypływające poza refugium, względnie przestraszyć i wypłoszyć ja na otwartą wodę, gdzie mogą być łatwo schwytane. Ten typ ataku obserwowany był często na Śniardwach, bieliki stosują go do podczas polowań na łyski, gęgawy i czaple siwe[111].
Bieliki rzadko atakują ofiary w powietrzu, tym niemniej również taką strategie ataków zaobserwowano[32]. Stosowana jest ona wobec stad ptaków, które na pojawienie się bielika reagują poderwaniem się do lotu (kaczki, gęsi), a także na lecące pojedyncze ptaki (czaple, żurawie, bociany, łabędzie i gęsi). Pomimo dużych rozmiarów ciała bielik jest ptakiem bardzo zwrotnym, odnotowano fakt pochwycenia w locie mew, nękających bieliki powracające z łupem trzymanym w jednej z nóg[111].
Duża zwrotność i siła pozwala także bielikom zabierać pokarm innym zwierzętom. Ofiarami kleptopasożytnictwa są w tym wypadku głównie rybołowy, które zwykle polują w podobnych co bieliki siedliskach. Bielik, wypatrzywszy udany atak rybołowa, udaje się za nim w pogoń. Rybołów, nękany przez większego bielika, po kilku atakach zwykle wypuszcza swoją zdobycz, którą bielik przechwytuje jeszcze w powietrzu lub podejmuje z powierzchni. Stwierdzono, że bieliki odbierają zdobycz nie tylko rybołowom, ale również sowom śnieżnym, kaniom czarnym i kaniom rudym, sokołom wędrownym, myszołowom, mewom siodłatym, krukom i wronom[111] oraz kormoranom[32].
Bieliki nauczyły się też korzystać z resztek spożywczych i przyłowu, wyrzucanego przez statki rybackie[32]. Podążają za kutrami rybackimi i, podobnie jak mewy, podejmują z powierzchni wyrzucane odpady, zbliżając się nawet na 5–15 metrów do kutrów. Inną strategią pozyskiwania pokarmu, stosowana przez bieliki przy żerowaniu na małżach, polega na chwytaniu małża, unoszeniu go na wysokość ok. 1 metra i upuszczaniu na kamień w celu rozbicia muszli[111][13].
Nie stwierdzono różnic w skuteczności ataków pomiędzy osobnikami różnej płci, natomiast osobniki młodociane wykazywały niemal o połowę mniejszą skuteczność niż osobniki dorosłe, co może wynikać z ich mniejszego doświadczenia. Jeżeli porównywać sukces ataków bielików na różne typy ofiar, to największy jest podczas polowań na ryby (ok. 60% udanych ataków), a istotnie mniejszy podczas polowań na ptaki i ssaki (udane ataki stanowiły mniej niż 20% wszystkich prób). Spośród różnych strategii polowań największy odsetek udanych ataków zaobserwowano dla polowań z zasadzki. Względny sukces ataku przy stosowaniu tej strategii był większy (ok. 60% udanych ataków) niż przy aktywnym polowaniu z lotu (ok. 42% udanych ataków)[77]. W połączeniu z obserwacją, że większość czasu bieliki poświęcają na tę właśnie formę polowań, świadczyć to może o optymalizacji wydatków energetycznych na polowania przez minimalizowanie nakładów na lot w poszukiwaniu pokarmu. Przeczy to hipotezie zakładającej, że ptaki drapieżne o małym współczynniku obciążenia skrzydeł powinny stosować aktywne strategie polowań[77]. Dodatkową korzyścią ze stosowania tej strategii jest również prawdopodobnie lepsza kontrola nad zajmowanym terytorium – bieliki siedzące na czatowni wypatrując zdobyczy jednocześnie mogą skanować przestrzeń w poszukiwaniu intruzów i, w razie ich wypatrzenia, odpędzać ich[77].
Wypluwki bielików są duże, do 90–110 mm długości, 35–40 mm średnicy[61], przeciętnie mają wymiary 60x30 mm a ich sucha masa wynosi, średnio, 5,5 g[113]. Mają zaokrąglone końce, niekiedy są bocznie spłaszczone. Uformowane są ze sklejonych ze sobą niestrawionych resztek sierści, piór, łusek i niewielkich fragmentów kości[61][113]. Analiza wypluwek bywa stosowana do ilościowej oceny składu diety bielików, jednak wyniki uzyskane na jej podstawie odbiegają od wyników uzyskanych innymi metodami. Wiąże się to z tym, że niektóre kategorie ofiar (np. ryby, zwłaszcza te mniejsze) są całkowicie trawione w przewodzie pokarmowym i nie zachowują się w wypluwkach – stąd wynikają znaczne niedoszacowania udziału ryb w diecie bielika[114].
Bielik jest drapieżnikiem szczytowym (top predator) w piramidzie troficznej ekosystemów, które zasiedla. Wywiera znaczący wpływ na populacje gatunków z niższych poziomów troficznych nie tylko bezpośrednio, przez eliminację upolowanych ofiar, ale również pośrednio, np. poprzez wpływ na ich zachowanie[39][108][115]. Wzrastająca liczebność bielików w rejonie Morza Bałtyckiego spowodowała, że zwiększyła się presja, jaką wywierają na gatunki ptactwa wodnego. W rezultacie migrujące ptaki (m.in. bernikle) zmieniły czas i trasy sezonowych migracji pomiędzy zimowiskami w krajach Europy Zachodniej a lęgowiskami w Arktyce: opuszczają zimowiska o miesiąc później i skracają czas pobytu na etapach pośrednich migracji w rejonie Bałtyku. Ten efekt przenosi się w dół łańcucha troficznego: dłuższy pobyt ptactwa na zimowiskach powoduje, że wywiera ono tam silniejszy wpływ na roślinność, będącą ich pożywieniem. W Holandii stwierdzono, że powoduje to większe straty w uprawach rolnych[115]. Podobnie norki amerykańskie, zasiedlające przybrzeżne wody Bałtyku, omijają obszary będące rewirami łowieckimi bielików i w obecności bielików w sąsiedztwie skracają czas i dystans pływania, ponieważ wówczas są szczególnie narażone na atak. Tym sposobem bieliki, jako drapieżniki szczytowe, mogą ograniczać rozprzestrzenianie się tego gatunku inwazyjnego[108].

Na niektórych obszarach bieliki współwystępują z innymi dużymi ptakami drapieżnymi, w rezultacie dochodzić może między nimi do interakcji o różnym charakterze[39]. Na Wyspach Brytyjskich i w krajach skandynawskich bieliki koegzystują z orłami przednimi (Aquila chrysaetos). W związku z tym, że nisze ekologiczne obydwóch gatunków w pewnym stopniu pokrywają się, może dochodzić do konkurencji między nimi. W przypadku populacji zamieszkujących środowisko w pełni zaspokajające potrzeby, jak to ma miejsce w Norwegii, konkurencja między bielikami a orłami przednimi jest ograniczona – nie stwierdzono by dochodziło do konkurencyjnego wyparcia jednego gatunku przez drugi, choć występują one sympatrycznie[107]. Odmiennie w Szkocji, gdzie po wytępieniu przez człowieka bielików w początkach XX w., ich siedliska zajęły orły przednie. Po reintrodukcji bielików zaobserwowano tam, że wypierają one orły przednie z tychże siedlisk[107][116]. Wprawdzie orły przednie wygrywają w rywalizacji o padlinę, są też lepszymi lotnikami, dlatego uzyskują przewagę w starciach w powietrzu[a], jednak, ze względu na szersze spektrum pokarmowe i mniejsze wymagania pokarmowe, w rejonach współwystępowania w Szkocji to bieliki osiągają większe tempo wzrostu populacji niż orły przednie. Najprawdopodobniej do nasilenia oddziaływań konkurencyjnych na tym obszarze przyczyniło się antropogeniczne przekształcenie i degradacja siedlisk[b], na które bieliki, jako generaliści pokarmowi i siedliskowi, są mniej wrażliwe[107].
W Kazachstanie, w rezerwacie Naurzum stwierdzono z kolei współwystępowanie bielików z orłami przednimi, orłami cesarskimi (A. heliaca) i orłami stepowymi (A. nipalensis). Przedstawiciele tych czterech gatunków wydawali się być obojętni na obecność osobników pozostałych trzech gatunków. Prawdopodobnie wynika to z międzygatunkowych różnic w wyborze miejsc gniazdowania oraz w preferencjach pokarmowych[118]. Nawet gdy spektra pokarmowe gatunków, jak np. w przypadku bielika i orła przedniego, pokrywają się, to udział poszczególnych typów pokarmu w diecie obydwu gatunków jest różny: bieliki w większym stopniu bazują na pokarmie pozyskiwanym ze środowiska wodnego, natomiast orły przednie – na pokarmie pochodzenia lądowego (ptactwo lądowe, zajęczaki). W rezultacie może to osłabiać konkurencyjne oddziaływania międzygatunkowe[119]. Bieliki na niektórych obszarach współwystępują też z bielikami wschodnimi (Haliaeetus leucoryphus) oraz bielikami olbrzymimi (H. pelagicus), jednak nie zbadano wzajemnych relacji pomiędzy tymi gatunkami[39][72].
Bieliki wchodzą często w interakcje z rybołowami (Pandion haliaetus). Wynika to z tego, ze obydwa gatunki występują w zbliżonych siedliskach i na podobnym obszarze. Interakcje te przejawiają się m.in. zajmowaniem gniazd, zbudowanych przez osobniki drugiego gatunku i odbieraniem przez bieliki pokarmu, upolowanego przez rybołowy[111]. Kleptopasożytnictwo bielików na rybołowach powoduje lokalnie, co stwierdzono na Litwie, zmniejszenie liczebności populacji rybołowa[120][96].
Bieliki są żywicielami wielu gatunków pasożytów. Jak stwierdzono, w niektórych przypadkach nawet połowa badanych ptaków bywa zarażona jednym lub więcej gatunkiem endopasożyta[121]. U ptaków tych udokumentowano występowanie przywr z gatunków: Strigea falconis, Neodiplostomum (Conodiplostomum) perlatum, Paracoenogonimus ovatus, Metorchis crassiusculus i Nematostrigea serpens[122][123]. Spośród nicieni stwierdzono występowanie Stegophorus stellaepolaris, natomiast kolcogłowy reprezentowane były przez Profiliocollis botulus i Corynosoma suduche. Ponadto w żołądkach stwierdzono też występowanie oocyst Sarcocystis/Frenkelia[121]. Bieliki są podatne na zarażenie wirusem ptasiej grypy. O ile przed rokiem 2016 nie stwierdzono, by odmiany tego wirusa wpływały na zwiększenie umieralności w populacjach bielików, to szczepy wirusa H5N8 kladu 2.3.4.4b powodowały u zarażonych bielików rozwój choroby z ciężkimi objawami neurologicznymi. Zanotowano też przypadki śmierci bielików zarażonych wirusem z tego kladu. Obecność wirusów H5N8 kladu 2.3.4.4b wykryto w odchodach bielików, a więc także w ten sposób bieliki mogą przyczyniać się do rozprzestrzeniania tego wirusa[124].
Opuszczone lub nieużytkowane gniazda bielików zasiedlane są przez inne gatunki ptaków. Stwierdzono, że na swoje potrzeby zaadaptować je mogą: orliki krzykliwe i orliki grubodziobe, kanie czarne i kanie rude, kobuzy, sokoły wędrowne, rybołowy, kruki, puchacze[125], orły cesarskie (A. heliaca) i rarogi (Falco cherrug)[126][94]. Puchacze[125] i sokoły wędrowne[126][94] mogą zająć użytkowane gniazdo bielika, zmuszając go do przenosin do gniazda zapasowego. Stwierdzono też przypadki jednoczesnego korzystania z czynnych gniazd bielika przez inne gatunki ptaków: pliszki siwe, mazurki, szpaki, pełzacze, uszatki i siniaki[125], a także pleszki zwyczajne, czubatki, szpaki zwyczajne[126][102]. Niewielkie ptaki wielu gatunków gniazdujące w gniazdach bielików lub w ich bezpośredniej bliskości czynią tak najprawdopodobniej ze względu na ochronę przed innymi drapieżnikami[126][102].
W gniazdach bielika na terenie Polski stwierdzono występowanie 86 gatunków roztoczy, z których najliczniej reprezentowane były Allipis halleri, Androlaelaps casalis, Parasitus fimetorum i Macrocheles merdarius. Gatunki roztoczy pasożytniczych występowały w nich bardzo rzadko i reprezentowane były przez pojedyncze osobniki[127].
Bieliki polują na inne ptaki szponiaste jedynie sporadycznie, wynika to z tego, że czujność, szybkość i zdolność do obrony tej kategorii ofiar obniża sukces ataku[39]. Ponadto ptaki szponiaste, zagrożone przez bieliki, często nękają swych potencjalnych prześladowców[39][128][129]. Wśród gatunków szponiastych, o których wiadomo, że bywały łupem bielików, są: krogulec zwyczajny (Accipiter nisus)[130], błotniak stawowy (Circus aeruginosus)[131], kania czarna (Milvus migrans)[132], trzmielojad zwyczajny (Pernis apivorus), myszołów zwyczajny (Buteo buteo), jastrząb zwyczajny (A. gentilis)[130], kania ruda (Milvus milvus)[133], orlik krzykliwy (Clanga pomarina)[134], orzeł cesarski (Aquila heliaca)[133] i rybołów zwyczajny (P. haliaetus)[130]. Stwierdzono również pożywianie się dorosłymi osobnikami sóweczki zwyczajnej (Glaucidium passerinum)[135], włochatki (Aegolius funereus)[130][136], kobuza (Falco subbuteo)[137], uszatki (Asio otus)[138], jarzębatki (Surnia ulula), uszatki błotnej (Asio flammeus), sokoła (Falco peregrinus)[130], puchacza śnieżnego (Bubo scandiacus)[139] i puchacza zwyczajnego (Bubo bubo)[136].
Pora lęgowa u bielików trwa od stycznia do lipca w południowej części zasięgu i od kwietnia do września w północnej części zasięgu[71]. Na Aleutach, poza rdzeniem zasięgu, obserwowano wysiadywanie pod koniec maja i opiekę nad puchowym pisklęciem od 31 maja do 4 czerwca[53]. Na Hawajach – gdzie bielik wymarł i w 2007 zaczął ponownie gniazdować – 8 marca obserwowano karmienie już 34-dniowego pisklęcia[54]. Bieliki dobierają się w pary na całe życie, niemniej w przypadku śmierci partnera mogą szybko znaleźć kolejnego. Ostateczne połączenie się w parę następuje, gdy ptaki ustalą już terytorium. Wczesną wiosną bieliki biorą udział w tokach, podczas których szybują, wykonują podniebne tańce godowe i inne powietrzne popisy. Wszystkiemu towarzyszą głośne okrzyki, nierzadko ze strony obydwu ptaków z pary. Niekiedy wykonują spektakularne obroty w powietrzu dotykając lub trzymając się łapami[140][71]. Popisy w niektórych częściach zasięgu odbywają się całorocznie, przybierając na sile jesienią po wylocie młodych, i trwają, słabnąc, aż do wiosny[72]. Często inicjowane są przez samca nawołującego przy jednoczesnym odrzucaniu głowy w tył. Później para zaczyna wspólnie szybować; przewodzi jeden osobnik lub szybują w odwrotnych kierunkach. Jeden z bielików może obniżać lot w kierunku partnera, który odpowiada przechyleniem się lub odwróceniem, by szybko dotknąć drugiego ptaka łapą i ponownie odwrócić się. Zachowanie to bywa powtarzane lub przybiera na intensywności póki para bielików nie zacznie chwytać się wzajemnie łapami w locie i, po uchwyceniu się, opadać wirując. Opadające ptaki rozłączają się nisko nad ziemią (nawet około 1–2 metrów nad ziemią[39][94][140]. O ile łapanie się stopami u szponiastych jest interpretowane jako wyraz konfliktu terytorialnego, szczególnie pomiędzy samcami, to u przedstawicieli Haliaeetus te zachowanie wydaje się być jednak związane z zalotami[39][141][142]. Jeśli bieliki są lokalnie pospolite, można zaobserwować w danej okolicy 2–3 tokujące pary, aczkolwiek każda z nich znajduje się w obrębie ściśle określonego terytorium[72].
Kopulacje odbywają się przeważnie od marca do kwietnia. Mogą się odbywać w odstępach dwudziestominutowych do kilku godzin. Przed kopulacją zaloty ze strony samca przybierają bardziej wyrafinowaną formę[72]. Po ostatnim z jego popisów samica przykuca, niemal płaszcząc się na podłożu, wyciąga głowę i szyję, lekko odchyla skrzydła i trzyma ogon na równi z resztą ciała. Kopulacje bielików odbywały się w różnych miejscach – na niskich gałęziach, na gnieździe, na ziemi, a nawet na zamarzniętej tafli jeziora. Zwykle mają miejsce w okolicy gniazda, w Norwegii obserwowano jednak kopulacje 3 km od gniazda. Kopulacje odbywają się o dowolnej porze dnia. Kopulacja trwa około 12 sekund, po zejściu z grzbietu samicy samic siada w spokoju. Niekiedy obydwa ptaki z pary przybierają na zmianę pozycję samicy, nim samiec pokryje partnerkę. W trakcie krycia samiec często nawołuje i łopocze skrzydłami by utrzymać równowagę[39][96][94].
Bieliki najczęściej zakładają gniazda na dużych drzewach. Umieszczają je na jednym z głównych rozwidleń gałęzi, w koronie drzewa lub na dużym bocznym konarze[72]. Podstawowym kryterium przy wyborze miejsca na gniazdo jest dostęp do pożywienia. Wśród niemieckich gniazd 75% znajdowało się najwyżej 3 km od jeziora; jedno leżało 11 km od jeziora, a nieco bliżej do Bałtyku[143]. 80% niemieckich gniazd miało znajdować się w lesie, jednak bieliki wolą izolowane zadrzewienia czy oddzielające się na wzór półwyspu połacie lasów i większość gniazd budowana jest w pobliżu otwartej przestrzeni: przecinki, mokradła, a nawet terenów uprawnych. Kilka par wyprowadzających lęgi na otwartej przestrzeni zakładało gniazda nie dalej, niż 150 m od lasu. W Niemczech zaobserwowano tylko jedno gniazdo na klifie, na wyspie Rugia. Starsze doniesienia wspominały o gniazdach na ziemi w nadbałtyckim regionie Niemiec. W tym państwie większość gniazd budowana była 2–10 m nad podłożem, zwykle w głównym rozwidleniu, rzadziej na masywnym bocznym konarze[102][143].
Na Hokkaido przeciętna wysokość gniazda nad podłożem była podobna jak w Europie – 16,5–25 m[132]. We wschodnich Niemczech gniazda umiejscowione były od 8 do 30 m nad podłożem, przeciętnie 20 m, na najwyższym dostępnym drzewie[143]. Gniazda na klifach mogą leżeć do 75 m nad ziemią[71]. Wysokość drzewa na gniazdo zależy od jego gatunku. W Rumunii gniazda na topolach czarnych (Populus nigra) i wierzbach (Salix) mieściły się od 15 do 25 m nad ziemią, chociaż jedno leżało na złamanym drzewie 7 m nad podłożem. W dolnym biegu Dunaju w Rumunii jedno gniazdo znaleziono na wątłym wzrastającym dopiero dębie, sześć na wysokich, masywnych dębach (Quercus), pięć na topolach białych (Populus alba), dwa na brzozach (Betula) i jedno na dzikiej gruszy (Pyrus)[144]. Inne źródło mówi o gniazdach bielika wzdłuż Dunaju leżących 19–33 m nad ziemią[94]. Bieliki monitorowane na Hokkaido nierzadko na gniazdo wybierało najwyższe drzewo w okolicy, przeciętnie 2,8 m wyższe od pozostałych. Najchętniej korzystały ze świerków sachalińskich (Picea glehnii) i olszy japońskich (Alnus japonica)[145]. We wschodnich Niemczech spośród 177 gniazd 65% znajdowało się na dojrzałych sosnach (Pinus), 22% na bukach zwyczajnych (Fagus sylvatica), 8% na dębach, pozostałe 5% na olszach (Alnus), wiązach (Ulmus), topolach (Populus) i brzozach[143]. Jeśli drzew jest zbyt mało, bieliki budują gniazda na urwiskach skalnych[72]. W Norwegii na 98 gniazd jedynie 8 znajdowało się na drzewach. W Szkocji 79% gniazd znajdowało się na klifach, na Islandii – 77%, natomiast na Grenlandii – 100%[39][96][146][147]. Rzadko jako miejsce na gniazdo bieliki wybierają niewielkie wzniesienie, niskie drzewo, krzew, piaszczysty brzeg lub trzcinowisko[72].
Zbudowane przeważnie z gałęzi gniazda są duże, osiągają zazwyczaj 2 m wysokości i 1 m średnicy, jednak poszczególne wymiary sięgają niekiedy kilku metrów. Na wyściółkę składać się mogą mchy, inna roślinność, wodorosty i wełna[71]. Gniazdo musi zapewniać bielikom widok na okolicę, osłonę od warunków atmosferycznych i drapieżników. Oszacowano, że jedynie promil fińskich drzew spełnia te kryteria[39]. Gniazda na klifach nierzadko mają uboższy budulec. Zdarza się, że mają formę zaledwie płytkich zagłębień w ziemi albo sterty łodyg wrzosów lub jałowców pokrytych dodatkowo listownicami (Laminaria), choć niekiedy bieliki wplatają w nie gałęzie do długości 1,5 m. Ptaki gniazdujące na klifach jako wyściółkę wykorzystują niemal każdy dostępny materiał – wodorosty, naniesione przez fale kawałki drewna, szkła i metalu, w jednym–dwóch przypadkach odnaleziono nawet szkielet owcy[96]. Gniazda nadrzewne zazwyczaj cechują się większymi rozmiarami, sztywniejszą i silniejszą konstrukcją. Ich przecięta średnica to 1,5 m. Jedno czteroletnie, a więc stosunkowo nowe, gniazdo miało masę 240 kg; gniazda blisko dwa razy od niego starsze mogą przekraczać masę 600 kg. Po licznych, corocznych naprawach nadrzewne gniazda są w stanie osiągnąć 2 m średnicy i 3 m wysokości[72][96][94]. Za wyściółkę służą porosty, mchy, wodorosty, paprocie, trawy, sity, wrzosy (Calluna) i bażyny (Empetrum), a nierzadko i wełna[39][96][147].
Przy budowie gniazda główną rolę odgrywa samica, samiec natomiast częściej znosi gałęzie do budowy[39]. Niekiedy nanoszenie poprawek w konstrukcji gniazda rozpoczyna się już w grudniu, aczkolwiek przeważnie na większych szerokościach geograficznych zaczyna się w marcu. Budowa od początku trwa kilka miesięcy, lecz w przypadku zniszczenia gniazda późną zimą jej czas może ulec skróceniu do niecałego miesiąca. Wówczas opóźnia się pora składania jaj[72]. Naprawa gniazda zajmuje do 18 dni[39].
Bieliki używają niekiedy gniazd ptaków innych gatunków: kani czarnych (M. migrans), myszołowów zwyczajnych (B. buteo), kruków (Corvus corax) i – po przegonieniu dotychczasowych lokatorów – kani rudych (M. milvus) i rybołowów (P. haliaetus)[126][94]. W jednym przypadku po 30 latach używania jednego gniazda bieliki zostały przepłoszone przez ludzi, ale wróciły i zastały gniazdo zajęte przez sokoły wędrowne. Mimo potyczek zbudowały kolejne gniazdo wyżej na tym samym drzewie i zarówno sokoły, jak i bieliki odchowały po jednym młodym[148]. W Norwegii były przypadki pomyślnego gniazdowania kruków, sokołów wędrownych i bielików na tej samej ścianie skalnej[96]. Bieliki mogą budować kilka gniazd na swoim terytorium i wybierać jedno z nich w kolejnych latach. Para buduje na swoim terytorium od 1 do 11 gniazd – w Norwegii średnio 2,5, lecz nierzadko do 5 gniazd[72][96].

Poszczególne bieliki cechuje nadzwyczaj powtarzalna pora corocznego składania jaj, która zdaje się nie zależeć od warunków pogodowych danego roku[39][96]. Okres składania jaj zależy od szerokości geograficznej. W czasach historycznych w Izraelu i Iranie, gdzie bieliki nadal się gnieżdżą, okres składania jaj przypadał na styczeń (z danych historycznych wynika, że również w styczniu rozpoczynały składanie jaj bieliki gniazdujące w Egipcie[18]), w Grecji i okolicy niższego biegu Wołgi jest to luty, w Niemczech – zazwyczaj marzec, a w subarktycznych rejonach Laponii i północnej Rosji – koniec kwietnia lub początek maja[41][40][146], niektórzy podają, że nawet marzec[39]. Bieliki ze Szkocji mają w porównaniu do bielików z wybrzeży Norwegii przeciętnie o trzy tygodnie późniejszą porę składania jaj, przypada ona na okres od końca marca do początku kwietnia[39][96][144]. Istnieje duża międzyosobnicza zmienność w terminie przystępowania do składania jaj – różnice w terminie składania jaj u par zasiedlających sąsiadujące rewiry mogą wynosić nawet ponad 4 tygodnie[149]. Młodsze pary mogą rozpoczynać gniazdowanie później[72].
Jaja bielików są białe, zwykle bez plam, czasami skąpo nakrapiane plamami w kolorze gliniastożółtym[22][72]. Skorupka świeżych jaj ma niebieskawe zabarwienie, które szybko blaknie[150]. Ich skorupka jest twarda, chropowata, czasami z wapiennymi wypukłościami (bruzdami). Jaja są różnobiegunowe jajowate, mało wydłużone, z tępym węższym biegunem. Ich średnie wymiary to 73 × 57 mm (zakres: 67–78 × 54–60 mm)[70]. Najmniejsze średnie wymiary jaj stwierdzono w Turcji – 71,8 × 56,2 mm – największe natomiast na Grenlandii – 78 × 59,3 mm. Świeżo zniesione jaja osiągają masę 120–148 g, średnio 135 g dla pierwszego jaja i 124 g dla drugiego jaja. W lęgu zastępczym jest zazwyczaj jedno jajo o niewielkiej masie, do 112 g[94][144][151]. W zniesieniu są zwykle 2 jaja, czasami 1, 3 lub, rzadko, 4 jaja[70][149].
Wysiadywanie rozpoczyna się po zniesieniu pierwszego jaja. U bielików jaja składane są w odstępie dwu- lub trzydniowym i w takim też klują się pisklęta[150]. We wczesnych lęgach zagrożeniem dla zniesień jest mróz i śnieg[72]. Samica wysiaduje przez 80–90% czasu; w nocy w ogóle nie zmienia się z samcem[72]. W Norwegii zaobserwowano jednak, że samiec może wysiadywać do 27% czasu w ciągu dnia. Zachodzi wówczas do 11 zmian dorosłych ptaków na gnieździe. Najdłuższym stwierdzonym okresem pozostawienia jaj bez opieki było 20 minut; jedna para nie wysiadywała przez 48 minut, jednak przebywała obok gniazda. W Norwegii jedynie przez 2–4% czasu lęg pozostawał niestrzeżony[96]. Zdarza się, że samica całkowicie przejmuje wysiadywanie. Jeśli opuszcza gniazdo może pożywić się i wrócić z pełnym wolem. Podczas wysiadywania samiec zapewnia jej pokarm. Wraz z postępem w wysiadywaniu coraz rzadziej ptaki wymieniają się, a samica zaniepokojona przez człowieka chętniej pozostanie przykucnięta na gnieździe, niż odleci. Nawoływanie i popisy w okresie inkubacji jaj zdarzają się nie tak często, jak przed nim[72]. Czas wysiadywania wynosi od 34 do 46 dni, zazwyczaj jednak 38–42 dni (średnio 38,3 dnia)[126][102].

W 1983 wyliczono na podstawie 8 badań prowadzonych w różnych częściach zasięgu bielika, że w 56,5% w lęgu znajduje się jedno pisklę, w 40,8% – dwa, w 2,5% – trzy; zaledwie w jednym, norweskim, lęgu odnotowano cztery pisklęta[39][34][96][94]. Świeżo wyklute bieliki mają masę około 90–100 g, aczkolwiek na Hokkaido stwierdzono znacząco wyższą masę piskląt – 110–115 g[72][132]. Proces klucia trwa około 28 godzin, przez kolejne 8 godzin pisklę śpi, po obudzeniu zaczyna żebrać o pokarm[152]. Pisklęta klują się pokryte kremowobiałym puchem, najdłuższym i najbielszym na głowie; puch na skrzydłach i kuprze ma szarawy odcień. Zanim jeszcze młode zaczną chodzić po gnieździe mogą mieć na spodzie ciała kilka łysych plam[39]. Pisklęta można usłyszeć po 2–3 dniach życia, a w wieku 10 dni są już wystarczająco żywotne, by chodzić po gnieździe i wydalać na jego skraju[72]. Puch pierwotny zastępowany jest gęstą, wełnistą pokrywą z dłuższego szarawego puchu. Przeważnie ciemniejszą barwą wyróżnia się ten na ciemieniu, spodzie ciała i jego bokach. Nogi i woskówka piskląt w tym wieku mają barwę od różowej po jasnożółtą. Do około 30. dnia życia przez puch przebijają się już pierwsze pióra konturowe[39]. Orlęta 6-tygodniowe pewniej stoją na nogach, a pióra konturowe niemal w całości przysłaniają puch, zwykle niewidoczny już w 7. tygodniu życia[39]. Próbują trzepotać skrzydłami po około 40 dniach życia, gdy skrzydła są jeszcze częściowo nieopierzone[72]. W wieku 7 tygodni orlęta zaczynają wykazywać większą czujność, siłę, często manipulują gałązkami i więcej chodzą[39]. W ósmym tygodniu życia jedynie lotki i sterówki muszą rozwinąć się do końca, młode bieliki próbują zaś poznawać okolicę gniazda[39][72]. 70-dniowe osobniki podejmują pierwsze próby latania i zwykle zyskują zdolność lotu do około 90. dnia życia[72][132].
Samice bielików zdają się w całości przejmować początkową opiekę nad młodymi i niechętnie opuszczają gniazdo[96][102]. Później, od 2–4 tygodnia samice zaczynają na krótko opuszczać gniazdo, rzadziej też ogrzewają pisklęta[72]. Wówczas do doglądania piskląt dołącza się samiec, jednak tylko za dnia[96][102]. Samica może przesiadywać w gnieździe lub chronić potomstwo przed deszczem nawet 28 dni po jego opierzeniu się[72]. Początkowo młode karmione są małymi kęskami pokarmu co godzinę, od 6. dnia podawane im kęsy pokarmu są większe, a odstępy pomiędzy karmieniem dłuższe[152]. W ciągu doby młode otrzymują pokarm do 11 razy. Pokarm dostarczany przez samca jest rozdrabniany przez samicę i podawany do dziobów piskląt, zazwyczaj do czasu gdy osiągną wiek 5–6 tygodni. Siedmiotygodniowe pisklęta są już w stanie samodzielnie rozrywać przynoszone im ofiary[152][72]. Starsze młode samodzielnie jedzą zdobycz, którą rodziców układają na krawędzi gniazda[72]. Na początku etapu opierzania się młode otrzymują 4–5 martwych zwierząt w tygodniu, następnie liczba ta spada do 1–2, co ma najpewniej zachęcić młode bieliki do samodzielnego zdobywania pożywienia[72]. Po opuszczeniu gniazda przeważnie zostają w jego okolicy kolejne 35–40 dni i stopniowo oduczają się pobierania pokarmu od rodziców na rzecz samodzielnego polowania[72][132]. W kontynentalnej części Europy bieliki opuszczają gniazda od początku czerwca do środka sierpnia, pod koniec sierpnia uzyskując całkowitą samodzielność. Szybko uczą się polować na ryby osiadłe na mieliznach czy nielotne podczas pierzenia kaczki. Młodociane bieliki długo mogą pozostawać na terytorium rodziców i nie wchodzą z nimi w konflikty ani też nie są wyganiane, nawet do osiągnięcia wieku 1–3 lat. Zazwyczaj już pierwszej zimy łączą się w grupy z niespokrewnionymi młodocianymi bielikami[39][72]. We wspólnych noclegowiskach na sąsiadujących drzewach lub stromych zboczach przybrzeżnych wysp może gromadzić się nawet 30–40 młodych bielików[96]. Dojrzałość płciową bieliki osiągają w wieku 5–6 lat[39][96].
Zazwyczaj w lęgu, w którym były 2 jaja udaje się bielikom odchować 1 lub 2 pisklęta, a w lęgach, gdzie były 3 jaja – 2 młode[72]. Średni sukces lęgowy wynosi około 1,1–1,6 młodego/rok (przykładowo: 45–48 młodych odchowanych u 40 obserwowanych par, przy 16 potwierdzonych niepowodzeniach w odchowaniu potomka). W Norwegii w 93 gniazdach pary wychowywały średnio 1,6 pisklęcia[72][96]. W około ⅓ prób gniazdowania nie udaje się odchować żadnego młodego, na niektórych terenach w okresie intensywnego używania pestycydów nawet ¾ par nie było w stanie odchować potomstwa[39]. Obok działań ludzi znaczącymi zagrożeniami dla piskląt jest głód i zawalenie się gniazda[39][72][34]. Zdarza się zabicie pisklęcia przez rodzeństwo – większe pisklę zachowuje się agresywnie i ostatecznie zabija młodsze, nierzadko zjadając je[153][154]. Pisklęta bielików rzadziej niż pisklęta orłów właściwych przejawiają względem siebie zachowania agresywne. Stosunkowo często z sukcesem odchowywane są bliźnięta i trojaczki, poświadczony jest przynajmniej jeden przypadek odchowania czworaczków. Tym niemniej szacuje się, że ok. 28% piskląt, które wykluło się, ginie wskutek dręczenia przez starsze rodzeństwo. Kainizm u bielików wiąże się z różnicami tempie rozwoju rodzeństwa: pisklę, które wykluło się z trzeciego jaja w lęgu (o 7 dni później niż to z pierwszego jaja), po 2 tygodniach może mieć masę ciała 10 razy mniejszą niż najstarsze z rodzeństwa[152]. Być może agresywne zachowania piskląt wobec siebie są konsekwencją niewystarczającej ilości pokarmu, dostarczanej przez rodziców[40][155]. W ochronie bielików można zapobiegać zabijaniu słabszych piskląt poprzez zabranie i wykarmienie w niewoli najsłabszego pisklęcia, przemieszczenie go do innego lęgu z młodymi o podobnych rozmiarach lub zabranie pierwszego jaja i późniejsze zwrócenie go, tak aby obydwa jaja (a następnie pisklęta) rozwijały się w podobnym tempie. Słabsze pisklęta bywają wykorzystywane w programach reintrodukcji. Pozostawione w rodzinnym gnieździe umarłyby, a w przypadku odchowania przez człowieka mogą później zostać wypuszczone na obszarach, gdzie gatunek zanikł. Umieszczone są w sztucznych gniazdach na platformach i karmione w sposób uniemożliwiający zobaczenia człowieka podczas podawania pokarmu dopóki nie uzyskają samodzielności[140][156].
Drapieżnictwo jest kolejnym czynnikiem obniżającym sukces lęgowy bielików. Jak stwierdzono, jaja i pisklęta bielików padają ofiarą lisów, kun i niedźwiedzi, przy czym szczególnie narażone są lęgi na łatwo dostępnych formacjach skalnych i nisko przy ziemi. Dziki zjadają jaja lub pisklęta, które wypadły z gniazda. Drapieżnictwo ze strony ptaków jest stosunkowo rzadkie, donoszono jednak o plądrowaniu gniazd bielików przez wrony, kruki i błotniaki stawowe. Wprawdzie rodzice bronią potomstwa przez intruzami, jednak ataki drapieżników mogą okazać się skuteczne, gdy gniazdo jest niewystarczająco pilnowane lub gdy dorosłe ptaki zostaną odstraszone bądź przegonione atakami z powietrza[39][40][102]. Zaobserwowano polowania puchaczy na „stosunkowo duże” pisklęta bielików nocą[136].
Wiele młodocianych bielików nie przeżywa pierwszego roku po uzyskaniu samodzielności. W pierwszej połowie XX wieku umieralność osobników młodocianych (do 4 roku życia) wynosiła 92%, a osobników dorosłych ok. 30% rocznie. Wysoka umieralność wśród młodocianych osobników wynikać może z trudności w zdobyciu pokarmu zimą. Po wprowadzeniu działań ochronnych parametry te uległy poprawie – np. w Szwecji przeżywalność młodych pierwszorocznych wzrosła do 85%, a u pozostałych grup wiekowych do 95%[157]. Według szacunków 70% bielików dożywa dorosłości[158].
Główną przyczyną umieralności bielików są czynniki antropogeniczne – np. w Polsce to zatrucia (ok. 50% przypadków), kolizje z infrastrukturą energetyczną (20%) i postrzały (17%)[159], podobnie we wschodnich Niemczech: spośród 194 nieżywych bielików znalezionych w latach 1946–1974 w 39% przypadków zidentyfikowaną przyczyną śmierci było postrzelenie, w 13% – zatrucie, w 6% – wypadek (zderzenie z linią energetyczną), tylko 7,5% bielików straciło życie w wyniku obrażeń odniesionych w rezultacie międzyosobniczego sporu o terytorium[143]. Również na terenach o małej antropopresji, jak na przykład na Grenlandii, umieralność w populacjach bielików jest głównie wynikiem działania czynników antropogenicznych: zatrucia ołowiem (pochodzącym z amunicji myśliwskiej i ciężarków rybackich), postrzałów przez myśliwych, zatrucia rtęcią i kadmem oraz PCB i pestycydami chloroorganicznymi, które kumulują się w ciele bielików wskutek spożywania skażonego pokarmu[121].
Bieliki są ptakami długowiecznymi. W naturze mogą dożywać 27 lat[39], a nawet 33–34 lat[157]. Przeciętna długość życia zaś szacowana jest na 12[72]–21 lat[160][c]. W niewoli bieliki dożywać mogą 42 lat, jednak dokładna długość ich życia poza naturalnym środowiskiem jest niewystarczająco zbadana[39][161].
IUCN uznaje bielika za gatunek najmniejszej troski (LC, Least Concern) nieprzerwanie od 2005 roku (stan w 2018). Wcześniej w latach 1994, 2000 i 2004 gatunek miał status gatunku bliskiego zagrożenia (NT, Near Threatened)[31].
Z danych archeozoologicznych wynika, że bielik niegdyś występował w całej Europie. W XIX wieku rozpoczął się jednak gwałtowny spadek liczebności gatunku, połączony ze zmniejszeniem zasięgu jego występowania, szczególnie w zachodnich i południowo-zachodnich częściach zasięgu[32][162]. Wymarł między innymi na Wyspach Owczych, w Szkocji, Irlandii i większości kontynentalnej Europy za wyjątkiem północnych i wschodnich rejonów. W drugiej połowie XX wieku w części zasięgu (w krajach bałtyckich i na Półwyspie Fennoskandzkim) liczebność populacji zaczęła wzrastać lub ustabilizowała się. W sumie liczebność bielików w Europie wzrosła od lat 60. XX wieku z ok. 650-900 par do ok. 5400–6600 par w 2004 roku[159]. W dalszym ciągu na początku XXI wieku bieliki były rzadkie we wschodnim regionie Morza Śródziemnego, ani nie zajęły ponownie terenów z zachodnich krańców zasięgu[71]. Wzrost liczebności populacji bielika nastąpił wskutek ustanowienia ochrony biernej gatunku oraz podjęcia ochrony czynnej, w tym doglądania gniazd, zapewniania nieskażonego pożywienia zimą oraz programów reintrodukcji[32]. Wedle szacunków BirdLife International z 2015 roku europejska populacja bielika liczyła 9–12,3 tys. par lęgowych, z czego najwięcej w Norwegii (2,8–4,2 tys.), Rosji (2–3 tys.), Polsce (1–1,4 tys.), Szwecji (550–700) i Niemczech (628–643)[59].
Występowanie bielików na terenie Polski poświadczone jest, na podstawie danych archeozoologicznych, od IX-XIII w. n.e. Szczątki ptaków tego gatunku znajdowano na obszarze zbliżonym do obecnego zasięgu, do początku XIX w. zbliżona do dzisiejszej była również jego liczebność. Intensywne tępienie spowodowało drastyczny spadek liczebności gatunku, tak że w latach 30. XX w. na terenie kraju notowano tylko kilkanaście lęgowych par bielika. Od roku 1945 do końca lat 60. XX w. odnotowano lekki wzrost liczebności. W latach 50. XX wieku gniazdowało 49 do 56 par, natomiast na przełomie lat 60. i 70. było już około 100 par[159][23]. W kolejnych latach, prawdopodobnie w związku z nasilonym stosowaniem chemicznych środków ochrony roślin (m.in. DDT) i skażeniem metalami ciężkimi, nastąpił spadek liczebności[23]. Jednak od lat 80. liczebność tego gatunku ponownie wzrosła, do 210–240 par pod koniec lat 80, 430–500 par pod koniec lat 90.[23], natomiast w roku 2008 stwierdzono już 767 par. W okresie pomiędzy 1994 rokiem a 2008 rokiem liczebność bielików Polsce zwiększała się średnio o 40 par rocznie. Największe tempo wzrostu liczebności odnotowano w 1998 roku (ponad 20%), do roku 2008 zmalało ono do 5–7% rocznie. Sukces lęgowy w tym okresie wynosił 68%, na parę lęgową przypadało średnio 0,97 odchowanych młodych[159]. Polska jest trzecim w Europie krajem pod względem ilości gniazdujących osobników tego gatunku (po Norwegii i Rosji)[163][59]. W pierwszej dekadzie XXI wieku w Polsce główne lęgowiska bielików znajdowały się na zachodzie kraju (głównie w dolinie Odry), na wybrzeżu, Mazurach oraz przy wschodnich granicach kraju[164].
Na spadek liczebności populacji bielika w XIX–XX wieku nałożyło się kilka przyczyn. Spośród nich główne to: polowania na bieliki i ich tępienie jako szkodników przez ludzi, zanieczyszczenie środowiska, zwłaszcza przez pestycydy chloroorganiczne, metale ciężkie i polichlorowane bifenyle, niszczenie siedlisk (melioracje, wycinka lasów), zatrucia trutkami wykładanymi w celu tępienia drapieżników oraz amunicją ołowianą, spożywaną w ciałach zwierząt postrzelonych przez myśliwych, a także kolizje z infrastrukturą techniczną[32][71][162].

Bielik, podobnie jak inne drapieżniki, postrzegany był przez ludzi w XIX i XX w. jako konkurent i szkodnik, ograniczający pogłowie zwierzyny łownej i zagrażający zwierzom hodowlanym. Dlatego był tępiony: ptaki zabijano, niszczono gniazda i jaja. W Anglii do 1835 roku wypłacano nagrody za zabicie bielika – 5 szylingów od głowy, w Norwegii system premiowy działał do 1932 roku – tam za zabitego bielika płacono 2 korony. W samej Norwegii w latach 1846–1869 wypłacono nagrody za zabicie 88467 orłów[162]. Strzelanie do orłów stało się źródłem utrzymania wielu ludzi, stanowiło też rozrywkę dla różnych grup społeczeństwa. Do tego pod koniec XIX wieku nastała moda na kolekcjonowanie jaj i skórek ptasich. W rezultacie w wielu krajach Europy Zachodniej, np. w Irlandii, Wielkiej Brytanii, bielik całkowicie wyginął, a na innych terenach stał się rzadki. Potrzeby kolekcjonerów zaspokajał import trofeów ze wschodniej Europy, skutkując wzrostem presji na tamtejsze populacje. Prześladowaniom i tępieniu bielików nie zapobiegło wprowadzenie prawnej ochrony bielika. W Polsce w latach 80. XX wieku przypadki zastrzelenia bielika notowano każdego roku, pomimo tego, że był wtedy gatunkiem rzadkim objętym ochroną gatunkową. Odstrzał był przyczyną śmierci 37% ptaków w Grenlandii[162]. Prześladowania ptaków przez ludzi w dalszym ciągu stanowi poważne zagrożenie dla bielików w niektórych rejonach centralnej i południowej Europy oraz Azji[34].
Poważnym zagrożeniem dla bielików jest zanieczyszczenie środowiska chemicznymi środkami ochrony roślin, metalami ciężkimi i innymi odpadami poprzemysłowymi. Bieliki są drapieżnikami szczytowymi w łańcuchach troficznych, odżywiają się głównie rybami, są ponadto organizmami długowiecznymi – te cechy powodują, że wskutek biomagnifikacji w ich ciałach mogą kumulować się bardzo duże ilości antropogenicznych toksyn[162]. Stwierdzono, że u bielików zamieszkujących regiony przybałtyckie stężenie chloroorganicznych pestycydów, takich jak DDT i jego pochodnych (DDE) oraz polichlorowanych bifenyli (PCB), było w latach 60.–80. XX w. jednym z największych notowanych u wszystkich organizmów naszego globu. Stężenie DDT w tłuszczu padłych bielików w Szwecji sięgało do 3,6% (36 mln ng/g), a stężenie PCB – 1,6% (16 mln ng/g). W latach, gdy DDT był powszechnie stosowany, bieliki z rejonu Bałtyku produkowały jaja o skorupkach cieńszych o 13–19,7% w stosunku do jaj sprzed okresu stosowania DDT. Jaja o cieńszych skorupkach łatwiej ulegały zgnieceniu pod ciężarem wysiadującego rodzica, ponadto zaburzeniu ulegała wymiana gazowa przez skorupkę. Towarzyszyło temu zmniejszenie liczby odchowywanych młodych, do zaledwie 0,15–0,3 na parę[162]. Wysokie stężenia DDE i PCB w jajach powodowały też podwyższoną śmiertelność zarodków bielików[34]. Analizy chemiczne padłych zwierząt wykazały, że częstą przyczyną śmierci dorosłych ptaków bywa zatrucie metalami ciężkimi, takimi jak rtęć i ołów. Zatrucia rtęcią są najprawdopodobniej konsekwencją spożywania skażonych ryb. Zatrucia ołowiem są konsekwencją spożywania zwierzyny łownej, postrzelonej śrutem ołowianym[162]. Sekcje padłych ptaków wykazały też, że przyczyną śmierci bielików bywały trucizny zawarte w trutkach, wykładanych w celu tępienia lisów, wilków i ptaków krukowatych[162].
Zagrożenie dla populacji bielika stanowić może utrata siedliska i odlesienie[32][34]. Bieliki preferują zakładanie gniazd na drzewach, dlatego wycinanie lasów, a zwłaszcza starych drzew położonych w pobliżu zbiorników wodnych, które mogą utrzymać gniazdo, może wpływać na stan populacji. Ponadto prace leśne związane są często z budową dróg, które ułatwiają dostęp ludzi na tereny uprzednio odludne, co może odstraszać bieliki od gniazdowania. Negatywne skutki dla bielików mogą wynikać z regulacji rzek i osuszania mokradeł, co ograniczać będzie bazę pokarmową[162][34]. Prognozuje się, że coraz większym zagrożeniem dla bielików może stać się zakłócanie przez aktywność ludzką spokoju gniazdujących par. Nasilony ruch turystyczny, rozbudowa infrastruktury technicznej oraz budownictwa mieszkalnego w strefach, w których występują bieliki (np. na atrakcyjnych z punktu widzenia człowieka terenach nad wybrzeżami morskimi i jeziorami) może odstręczać bieliki od gniazdowania w pobliżu lub przyczyniać się do porzucania lęgów[34][87]. W drugiej dekadzie XXI wieku spadek liczebności populacji w azjatyckiej części Rosji przypisywany jest wylesieniu i rozwojowi przemysłu petrochemicznego[31].
Kolizje z napowietrznymi liniami energetycznymi to istotne źródło śmiertelności w populacjach bielików. W Meklemburgii w latach 1946–1972 aż 20% przypadków śmierci bielików było rezultatem zderzenia z liniami przesyłowymi i porażenia prądem[162]. Rozwój sieci komunikacyjnych oraz nasilenie ruchu drogowego i kolejowego stanowi kolejny czynnik zagrażający bielikom[162][32][87]. W Szwecji w latach 2000–2009 zderzenie z pociągiem było najczęstszą przyczyną śmierci bielików[165]. Truchła zwierząt, leżące przy szlakach komunikacyjnych oraz pod stacjami elektrowni wiatrowych stanowią źródło pokarmu, z którego bieliki coraz częściej korzystają. Wiąże się to ze zwiększonym ryzykiem kolizji z pojazdami bądź łopatami śmigieł elektrowni[162][32][87]. Jak wynika z obserwacji bielików zamieszkujących norweską wyspę Smøla, po założeniu na niej wielkiej fermy wiatrowej liczba par tam gniazdujących zmniejszyła się z 13 przed budową fermy, do 5 po ośmiu latach od budowy. Ponadto te osobniki, które pozostały, nie zmniejszyły swej aktywności na terenie farmy, a częstość lotów w strefie zasięgu rotorów turbin nawet wzrosła[166].
Bielik jest gatunkiem prawnie chronionym we wszystkich państwach[167]. Bielik został wymieniony w załączniku I Dyrektywy Rady 79/409/EWG z dnia 2 kwietnia 1979 roku w sprawie ochrony dzikich ptaków (tzw. dyrektywa ptasia), stając się w krajach Unii Europejskiej przedmiotem ochrony w ramach sieci Natura 2000[168]. Jest też chroniony na mocy Konwencji berneńskiej[169]. Jako gatunek wędrowny chroniony jest na mocy postanowień Konwencji bońskiej[170]. Handel bielikami jest poddany ograniczeniom i ścisłej reglamentacji na mocy konwencji CITES[171].
Na terenie Polski prawną ochronę bielika wprowadzono w 1952 roku. Gatunek jest objęty ochroną ścisłą, nie dotyczą go zwolnienia od zakazów wynikające z wykonywania czynności związanych z prowadzeniem racjonalnej gospodarki rolnej, leśnej lub rybackiej, wymaga ustalenia stref ochrony ostoi, miejsc rozrodu lub regularnego przebywania[26][25]. Wokół gniazd bielików obowiązuje strefa ochronna: przez cały rok w promieniu do 200 m, a okresowo (od 1 stycznia do 31 lipca) – w promieniu do 500 m od gniazda[25]. Podobne regulacje istnieją w kilku innych krajach, mogą dotyczyć zarówno zakazu wycinki i prowadzenia innej aktywności leśniczej w pobliżu gniazd lub generalnie niepokojenia gniazdujących ptaków. Obowiązują w Niemczech, na Islandii (w okresie od 15 marca do 15 sierpnia), Węgrzech i Litwie, w Czechach, Finlandii i Grecji (niekiedy brak określonego dokładnie promienia strefy ochronnej)[34].
Reintrodukcja jest jednym ze sposobów na przywrócenie bielika na terenach, na których wymarł. Reintrodukcję prowadzi się przeważnie w oparciu o osobniki z hodowli. Po raz pierwszy bielika rozmnożono w niewoli w 1961 roku, w ogrodzie zoologicznym w Wiedniu. Następnie udawało się to w placówkach w Abu Kabir, Arnhem, Baton Rouge, Berlinie, Brnie, Le Vaud, Moskwie, Neumünster, Rostowie i Stuttgarcie, w których odchowano łącznie 35 młodych osobników. W 1994 kilkadziesiąt ośrodków przystąpiło do projektu hodowlanego EEP[172]. Jednym z nich został ogród zoologiczny w Poznaniu[173][174]. Bieliki z tej placówki przekazywano na początku XXI wieku do programów reintrodukcji w Izraelu[174].
Jednej z pierwszych skutecznych reintrodukcji dokonano w Szkocji, gdzie po 1916 roku nie odnotowywano lęgów bielika. W 1959 podjęto próbę wprowadzenia dwóch osobników, lecz bez powodzenia. W 1968 wsiedlono cztery bieliki, które nie przeżyły. W latach 1975–1985 rocznie sprowadzano z norweskiej populacji około 10 piskląt. Zabierane był z gniazd w wieku 5–6 tygodni. Po odchowie i wstępnej aklimatyzacji w stacji na wyspie Rum wypuszczano je u wybrzeża Szkocji. Łącznie w czasie trwania projektu uwolniono 82 bieliki. W 1983 roku pierwsze pary przystąpiły do lęgów, a pierwsze szkockie pisklę opuściło gniazdo w 1985 roku. Do roku 1997 w Szkocji do lęgów przystępowało 13–15 par, które odchowały 64 potomków[175].
Reintrodukcję na niewielką skalę prowadzono w Szlezwiku-Holsztynie od połowy lat 70. XX wieku do 1982. Bieliki w tym regionie nie zostały nigdy wytępione, jednak ich sukces lęgowy uległ znacznej redukcji. W czasie trwania projektu zasilono populację 41 młodymi osobnikami[176]. Pochodziły one z obcych populacji, co wzbudziło obawy związane z napływem potencjalnie niekorzystnych genów – bieliki z obcych populacji przystępowały do toków w innych porach roku, niż rodzime. Program ten nie zakończył się sukcesem, a większość sprowadzonych ptaków zginęła[177]. W Czechach program reintrodukcji prowadzono w latach 1978–1988. Wypuszczono wówczas w okolicy stawów w Trzeboniu 9 osobników wyhodowanych w Niemczech. Wprawdzie 2 z nich nie przeżyły, jednak pozostałe zasiedliły stawy w Trzeboniu, skutecznie wyprowadzając lęgi. Program reintrodukcji bielików na terenie Czech zbiegł się w czasie ze wzrostem liczebności populacji polskiej, niemieckiej i skandynawskiej, migranci z których pospołu z osobnikami reintrodukowanymi przyczyniły się do odbudowy populacji w Czechach[177]. W latach 90. XX wieku rozpoczęto reintrodukcję bielików Izraelu. Wcześniej ostatnie lęgi odnotowano w latach 50. XX wieku w dolinie Jordanu. W 1997 roku obserwowano budowanie gniazda przez parę bielików. Utworzyły ją osobniki wsiedlone w 1992 (samiec) i 1993 (samica). Przez dwa kolejne sezony lęgowe nie stwierdzono jednak zniesień[177].
W drugiej połowie lat 90. XX wieku planowano reintrodukcję bielików w Irlandii, Austrii (wówczas już po pierwszych wsiedleniach) i Holandii[177]. W Irlandii po wstępnych przygotowaniach w 2007 roku rozpoczęto program reintrodukcji i do 2011 w Killarney National Park wypuszczono 100 młodych osobników. Było to 51 samców i 49 samic pochodzących z Norwegii. W 2012 odbyły się pierwsze pomyślne lęgi, a w 2013 pochodzące z niego młode opierzyły się. Do 2016 łącznie opierzyło się 14 młodych[178]. W Austrii celem monitorowania populacji bielika WWF Österreich utworzyło oddzielny projekt. W 2001 po raz pierwszy od dziesięcioleci odbył się w Austrii pomyślny lęg bielika[131]. Również holenderski rząd w roku 1996 wyraził zgodę na podjęcie programu reintrodukcji bielika, który to gatunek zanikł z terenów Holandii przed połową XVII wieku. Jednak już w 2000 roku program reintrodukcji został zawieszony, ze względu na gwałtowną ekspansję niemieckiej populacji bielika, migranci z której osiedlali się w Holandii. W 2006 odbył się pierwszy od kilku stuleci lęg bielika w Holandii[179].
Celem zwiększenia przeżywalności młodych bielików w trakcie ich pierwszej zimy, krytycznej dla niewprawionych w polowaniu osobników, prowadzi się zimowe dokarmianie. Do lat 90. XX wieku najwięcej działań tego rodzaju podjęto w Szwecji. Wykładana padlina, pozyskiwana głównie ze zwierząt gospodarskich, wykazywała się niską zawartością DDT i PCB. Punkty dokarmiania rozmieszczano na zamarzniętych jeziorach i zatokach, na bagnach i u wybrzeży Bałtyku. Dokarmianie, prowadzone od października do marca, poskutkowało wzrostem przeżywalności młodych bielików do co najmniej 50%. Niezanieczyszczona padlina pozytywnie wpłynęła również na sukces rozrodczy dorosłych osobników[180]. Pod koniec lat 90. XX wieku dokarmiano bieliki również w Finlandii oraz, na mniejszą skalę, w Estonii, Niemczech i na Węgrzech[181]. W 1991 Duńskie Towarzystwo Ornitologiczne wdrożyło program dokarmiania bielików na wzór szwedzkiego. W 1912 bieliki zostały w Danii wytępione, zaś program miał na celu przywrócenie bielika jako gatunku lęgowego. Projekt został jednak zakończony w roku 2000, jako że bieliki wobec obfitej dostępności naturalnego pożywienia nie były zainteresowane wykładaną padliną. Pierwszy po blisko 80 latach pomyślny lęg w Danii odbył się w 1996[35]. W latach 90. XX wieku dokarmiano bieliki na Słowacji w dolinie Dunaju i w rejonie Jeziora Orawskiego[165].
Dostępność miejsc lęgowych może ograniczać występowanie bielików – jak wynika z szacunków, w starodrzewiu sosnowym na tysiąc drzew tylko jedno spełnia wymagania bielików, jeśli chodzi o miejsce do założenia gniazda. Od lat 70. do lat 90. XX wieku z powodzeniem budowę platform gniazdowych przeprowadzono na Litwie, Łotwie i Finlandii, co przyczyniło się do wzrostu liczebności bielików w tych krajach. W Polsce platformy gniazdowe dla ptaków drapieżnych rozpoczęto stawiać w roku 1981, głównie dla rybołowów, wówczas bardziej zagrożonych od bielików. Platformy dla bielików lokalizowane były w środkowej części koron, dla rybołowów – na ich szczytach. Większość z nich została wykorzystana przez bieliki do gniazdowania[182]. W 2011 roku budowę platform gniazdowych wskazano jako jedno z ważniejszych działań ochronnych dla przywrócenia gniazdowań bielika na Słowacji[165]. Lęgi bielików na przygotowanych przez człowieka platformach odnotowano również w Danii przed 2011 rokiem[35] oraz w Rumunii, w okresie 1992–2002[34]. Nie zawsze jednak budowa platform lęgowych przynosi skutki. W latach 2007–2009 przeprowadzono w obwodzie samarskim projekt budowy platform dla orłów cesarskich i bielików. Podczas inspekcji w 2011 roku ustalono, że żadna z platform nie została wykorzystana do gniazdowania, mimo że w tym czasie gniazda niektórych par uległy zniszczeniu z powodów naturalnych[183].
W celu zmniejszenia prawdopodobieństwa kolizji ptaków z infrastrukturą energetyczną na przewodach napowietrznych zawieszane są duże, jaskrawe kule lub spirale w kontrastowych barwach. Wizualizują one bielikom (i innym ptakom) istnienie napowietrznej przeszkody. Aby zabezpieczyć ptaki przed porażeniem prądem od niedawna stosuje się izolowane przewody, zaś na słupach energetycznych, wykorzystywanych przez bieliki jako czatownie, instalowane są specjalne siedziska[184].
Orły, jako największe ptaki drapieżne, od najdawniejszych czasów wzbudzały podziw ludzi, często połączony z przekonaniem o nadnaturalnym pochodzeniu tych ptaków. Uważano je za istoty zdolne do dotarcia do niebiańskich siedzib bogów. Symbolizowały siłę, wielkość i męstwo. To powodowało, że pełniły ważną rolę w kulturze i wierzeniach ludzi. Ze względu na podobieństwo bielika do orłów właściwych znaczenie tego gatunku dla kultury ludzkiej również jest istotne[d][186]. Szpony bielików były wykorzystywane jako ozdoby przez neandertalczyków[187]. Elementy szkieletu bielików znajdowano w grobach z okresu brązu na Orkadach, np. w słynnym grobie Tomb of the Eagles czaszki, skrzydła i pazury kilku bielików złożone były w wyeksponowanym miejscu w centralnej części komory grobowej[188]. W Szkocji odnaleziono nakamienne wizerunki przedstawicieli tego gatunku, datowane na epokę żelaza[189], na neolitycznych stanowiskach w dolnym biegu Renu znaleziono też przedmioty użytkowe (igły, szydła) wykonane z kości bielików[190].
Bieliki wykorzystywano w sokolnictwie do polowań, między innymi na żurawie, czaple, łabędzie, zające, lisy, a nawet wilki. Szczególnie popularne w sokolnictwie były w Azji Środkowej. Do polowań układano ptaki młode, wybrane jeszcze z gniazda, ze względu na to, że starsze osobniki mogły stanowić zagrożenie dla sokolnika i jego otoczenia[191].
W literaturze staroangielskiej częstym motywem było zestawienie trójki zwierząt: kruka, lisa i orła, najprawdopodobniej bielika. W poematach staroangielskich bielika określano słowem earn, blisko powiązanym z gaelickim erne, jakim określano bieliki w starszych opracowaniach ornitologicznych. Choć earn odnosiło się ogółem do orła, niekoniecznie bielika, najpewniej to właśnie tego ptaka wspomniano w poematach The Seafarer i Bitwa pod Brunanburh nieznanych autorów czy Elene Cynewulfa. W poezji staroskandynawskiej bielik był znany jako ørn. Zwrot „nakarmić orły” był metaforą zabicia wroga. Odnaleźć go można na przykład w poemacie o królu Olafie Skötkonungu, na którego ciele pożywia się bielik z wilczycą[192].
W wierzeniach Praindoeuropejczyków orła uważano za epifanię (objawienie się) najwyższego boga i za jego posłańca. Ponieważ wierzono, że orzeł ma moc odpędzania zła, już w starożytności jego wizerunki noszono przed władcami, by zapewnić im ochronę, i ozdabiano nimi insygnia wodzów i władców. Wizerunek srebrnego orła był od czasów Mariusza głównym znakiem każdego legionu rzymskiego. Orły od starożytności uważano za ptaki królów i władców, jako symbol władzy i państwowości przejęli je sukcesorzy Imperium Rzymskiego[193].
W rezultacie orzeł jest jednym z ptaków drapieżnych, który najczęściej pojawia się w heraldyce. Jego wizerunek znajduje się w godłach 25 krajów[194][e]. Czarny orzeł w herbie Niemiec uważany jest przez niektórych ornitologów za młodocianego (a więc ciemno upierzonego) bielika, o czym świadczyć miałby jego nieopierzony skok[195]. Biały orzeł jest z kolei godłem Polski. Przyjmuje się, że jest to wizerunek bielika[f][189][198][196].
Biały orzeł miał szczególne znaczenie w kulturze Słowian, ponieważ w ich wierzeniach kolor biały miał wyróżniać istoty pochodzenia boskiego. Białego orła uważano więc za króla wszystkich zwierząt[199], względnie za króla ptaków[196]. Wizerunek białego orła, według legendy podanej przez Marcina Bielskiego, miał być przyjęty przez Lecha, księcia Polan, jako godło państwa[200]. Na monetach z czasów Bolesława Chrobrego na skrzydłach ptaka w koronie znajdują się kropki, które mogą odnosić się do białych lotek na złożonych skrzydłach bielika. Długosz podaje, że orła białego nadał państwu Bolesława Chrobrego Otto III, co jednak uznawane jest za zmyślenie kronikarza. Za omawianym gatunkiem jako zwierzęciem herbowym opowiadają się również historycy, kojarząc jego wygląd z majestatem i wielkością. Biały ptak, przypominający orła, widniał w herbie księcia wielkopolskiego Przemysła II, który po jego koronacji w 1295 roku stał się herbem państwa polskiego[201]. Przyjęcie białego orła jako herbu królestwa, zjednoczonego po okresie rozbicia dzielnicowego, stanowiło odwołanie do tradycji wcześniejszych władców piastowskich, oraz do funkcjonującego w średniowieczu mitu o orle, który odradzał się po kąpieli w wodzie[200].
Wizerunek białego orła umieszczano na polskich medalach, odznakach i pieczęciach jako symbol narodowy i jako utożsamienie niepodległej ojczyzny[202][201][196]. Jednym z najwyższych i najstarszych odznaczeń państwa polskiego jest Order Orła Białego, ustanowiony w 1705 roku przez Augusta Mocnego. Jego nazwa pochodzi od jednej ze zwyczajowych nazw bielika. Na rewersie tego orderu, mającego kształt krzyża maltańskiego, umieszczono emaliowany wizerunek białego orła ze złotą koroną[202].
Nazwa zwyczajowa gatunku, tak w języku polskim, jak i w innych językach, jest też powszechnie wykorzystywana jako nazwa okrętów oraz statków wodnych i aparatów latających. W Marynarce Wojennej RP miano ORP Bielik nadano dwóm okrętom podwodnym, jednemu projektu 613 (ORP Bielik (1955)) oraz jednemu projektu 207 (ORP Bielik (1967))[203][204]. Spośród okrętów innych krajów, noszących nazwę zapożyczoną od tego gatunku, sławę podczas I wojny światowej uzyskał rajder SMS „Seeadler” pod dowództwem kpt. von Lucknera[205]. Zwyczajową nazwę tego gatunku wykorzystano także do nazwania skonstruowanego w Polsce typu samolotu odrzutowego: EM-10 Bielik[206], a za granicą – odrzutowych pocisków rakietowych „Sea Eagle”[207].
Wizerunek orła często wybijano na monetach. Tradycję tę zapoczątkował Ptolemeusz I Soter, umieszczając podobiznę orła w charakterze symbolu władzy królewskiej. Podobiznę ptaka, którego można identyfikować jako bielika, znaleźć można na monetach wybijanych przez polskich królów. Pierwszą monetą z takim wizerunkiem na awersie jest denar Bolesława Chrobrego[g]. Podobnie jak w czasach antycznych, wizerunek orła stosowano początkowo jako znak władzy królewskiej, z biegiem czasu stał się on stałym elementem zdobniczym polskich monet[208]. Narodowy Bank Polski emituje od 1995 roku serie monet bulionowych, początkowo pod nazwą „Orzeł bielik”[209], a obecnie „Bielik”[210], na rewersie których widnieje wizerunek bielika.
Przedstawienia bielika można znaleźć na znaczkach pocztowych. Poczta Polska w 1919 roku z okazji pierwszej sesji Sejmu wydała znaczek z „białym orłem”. Jest to najstarszy znaczek z ptakiem szponiastym wydany w Europie[195]. W roku 1960 wizerunek bielika ukazał się w serii „Ptaki chronione” autorstwa J. Desselbergera. W 1976 r. bielik pojawił się na znaczku poświęconym Wolińskiemu Parkowi Narodowemu w serii „Parki narodowe”. W 1993 r. podczas Światowej Wystawy Filatelistycznej wyemitowano blok „Legenda o orle białym” z przedstawieniem bielika siedzącego na gnieździe oraz, dla uczczenia 75. rocznicy odzyskania niepodległości przez Polskę, blok z dwoma sylwetkami bielika[195]. Przedstawienia bielika można też znaleźć na znaczkach pocztowych emitowanych w innych krajach (m.in. Ukrainie, Kazachstanie).
Obszar Wolińskiego Parku Narodowego był, w chwili tworzenia Parku w latach 60. XX w., jednym z nielicznych miejsc w Polsce, gdzie gniazdowały bieliki. W roku powołania Parku pod opiekę jego pracowników trafiło chrome pisklę bielika – ptak, któremu nadano imię „Kuba”, przez 34 lata mieszkał w wolierze przy siedzibie dyrekcji Parku. Stąd stylizowany wizerunek bielika stał się symbolem Parku[211]. Na obszarze Parku gniazdują corocznie 3–4 pary bielików[212].
Mięso bielików uchodziło w XVIII w. za przysmak na Kamczatce i Ukrainie, a w czasach wcześniejszych mięso młodych osobników stanowiło element kulinarny wesel w Anglii[190].
Bieliki hodowano w klatkach w celu pozyskania piór, zrzucanych w trakcie pierzenia. Pióra te wykorzystywano do opierzania strzał i dla ozdoby. Stanowiły też ważny element panoplii husarskiej[213] – używane były przy konstruowaniu skrzydeł husarskich, które stanowiły element zabezpieczający jeźdźca przed cięciami z tyłu i złapaniem na arkan. Widok skrzydlatych jeźdźców miał deprymować atakowanego przeciwnika, a szum piór płoszył wierzchowce[214].
Bielik, orzeł bielik, bielik zwyczajny, birkut (Haliaeetus albicilla) – gatunek dużego ptaka drapieżnego z rodziny jastrzębiowatych (Accipitridae). Występuje w Palearktyce – od Grenlandii po Japonię. Zamieszkuje głównie obszary przylegające do zbiorników wodnych, wzdłuż wybrzeży morskich, w pobliżu rzek. Gatunek osiadły, częściowo wędrowny. Generalista pokarmowy, odżywia się głównie rybami, ptactwem wodnym, okazjonalnie także padliną. Gniazduje na wierzchołkach dużych drzew, na konarach przy pniu, także na półkach urwisk skalnych. Pary są monogamiczne, zajmują terytoria o różnej wielkości, zależnie od dostępności pokarmu, i wyprowadzają jeden lęg w sezonie. Młodymi opiekują się obydwoje rodzice. W związku z antropopresją i zanieczyszczeniem środowiska liczebność gatunku zmniejszyła się znacząco do lat 70. XX wieku. Dzięki zabiegom ochronnym liczebność niektórych populacji wzrosła i ustabilizowała się. Ze względu na duży zasięg i korzystne trendy zmian liczebności populacji w klasyfikacji IUCN gatunek ma status gatunku najmniejszej troski.
A águia-rabalva ou simplesmente rabalva (Haliaeetus albicilla)[2] é uma espécie de águia que vive no norte da Europa e da Ásia. É uma ave marinha, que se alimenta principalmente de peixes, aves aquáticas e carniça e que substitui na maior parte da Eurásia a águia-de-cabeça-branca americana.
Como outras espécies de águias que têm as penas da cauda brancas, comparte os nomes de aurifrísio ou pigargo.
Tem cerca de 70–90 cm de comprimento, corpo castanho escuro e cauda branca. Cabeça grande e mais clara que o corpo, bico grande e amarelo. As asas são grandes e de forma rectangular. Podem confundir-se com a águia-real, especialmente os imaturos, mas a águia-real possui uma barra terminal preta na cauda branca.
Foi muito perseguida, assim como é ameaçada pela contaminação com poluentes do meio ambiente, e sua maior população remanescente na Europa encontra-se na região dos fiordes da Noruega. Foi com exemplares provenientes desta população que, a partir de 1975, a espécie foi re-introduzida nas Ilhas Britânicas, de onde tinha desaparecido no início do século XX e atualmente existe uma população auto-sustentável (em torno de trinta sítios de nidificação, isto é, trinta casais estabelecidos) na costa oeste da Escócia. A espécie recentemente recolonizou espontaneamente a Países Baixos, onde um casal nidificou em 2006. Com as restrições ao uso de inseticidas químicos, a espécie parece que começa a recuperar-se em toda a Europa.
A espécie é monotípica (não são reconhecidas subespécies).
A águia-rabalva ou simplesmente rabalva (Haliaeetus albicilla) é uma espécie de águia que vive no norte da Europa e da Ásia. É uma ave marinha, que se alimenta principalmente de peixes, aves aquáticas e carniça e que substitui na maior parte da Eurásia a águia-de-cabeça-branca americana.
Codalbul (Haliaeetus albicilla) este o pasăre răpitoare de zi, protejată, din ordinul falconiformelor (Falconiformes), familia Accipitridae. În România este pe cale de dispariție, fiind răspândită doar în regiunea Dunării și în Delta Dunării. Este de talie mare (80–100 cm, de mărimea unui curcan), cu corpul cafeniu, coada albă, ciocul galben puternic, lung, drept, încovoiat spre vârf și picioare galbene, la fel ca și degetele; unghii negre, mult curbate. Se hrănește cu pești, broaște, șerpi, rațe, iepuri, popândăi, hoituri. Cuibărește în arbori din vecinătatea apelor.
Codalbul este corpolent și cu o talie mare, are o silueta masivă caracterizată prin o anvergură mare și o coadă scurtă cuneiformă. Codalbul are o talie mare, 70–90 cm lungime (între curcă și curcan), cu o anvergură a aripilor de 200–250 cm. Femelele, cu o greutate de 4-6,9 kg, sunt mai mari decât masculii, care cântăresc 3-5,4 kg.
Penajul este de culoare brun închis (cafeniu), cu excepția capului și bazei gâtului care sunt mai deschise. Păsările bătrâne au capul și gâtul alb. Adulții au o coadă albă. Aripile sunt mari în formă de "ușă de hambar". Capul este mare și ciocul foarte masiv. Ciocul este brun-negricios la tineri, galben la adulți; puternic, lung, drept, încovoiat brusc spre vârf. Picioarele sunt galbene, la fel ca și degetele cu unghii negre, mult curbate. Jumătate din lungimea picioarelor sunt acoperite cu pene.
Puii au o culoare mai închisă (smântâniu până la maro-cenușiu), ajungând treptat la penajul adult în 5-6 ani. Ei au coada și ciocul întunecate, iar coada are o bandă terminală închisă la păsările subadulte înainte a se înălbi.
Specia este răspândită predominant în Norvegia și Rusia (mai ales în Siberia), care dețin împreună>55% din populația europeană, populații importante se află în sud-vestul Groenlandei, Danemarca, Suedia, Polonia și Germania. Un număr mic de exemplare se găsesc în Islanda, Marea Britanie, Finlanda, Estonia, Letonia, Lituania, Belarus, Austria, Republica Cehă, Slovacia, Slovenia, statele din fosta Iugoslavie, Bulgaria, România, Republica Moldova, Ungaria, Grecia, Turcia, Iran, Armenia, Georgia, Azerbaidjan, Ucraina, Kazahstan, Turkmenistan, Mongolia, China și Japonia.[2]. La nivelul mondial se estimează că există 5000-7000 de perechi de codalbi: 175 perechi în Groenlanda și aproape 3500 de perechi în Europa (în Islanda 35-40 perechi, Norvegia 1500, Rusia europeană 900-1100, Polonia 180-240, Germania 140 -150, Suedia 100-150).
În România au fost identificate 20-25 perechi cuibăritoare de codalb, întâlnite în regiunea Dunării și în Delta Dunării: în mai multe rezervații naturale (Arinișul Erenciuc, Pădurea Caraorman, Pădurea Letea, Lacul Potcoava) incluse în parcul național Delta Dunării. Acestea îi asigură vulturului condiții de cuibărire și hrană, începând cu luna martie, până în octombrie[3]. Prezența în România: tot timpul anului; iarna sosesc aici și unele exemplare nordice.
În Republica Moldova au fost găsite câteva exemplare în pădurile de luncă ale Nistrului și Prutului. Este o specie critic periclitată, inclusă în Cartea Roșie a Republicii Moldova.
Este o pasare legată de mediu acvatic (coaste maritime, râuri mari, lacuri), trăind pe uscat sau la marginea mării. Pe uscat, codalbul preferă marginea lacurilor și fluviilor aflate în tundră, păduri sau aproape de păduri, care sunt potrivite pentru găsirea prăzii. Pe coastă mării, el trăiește pe falezele stâncoase abrupte.
Este o pasăre de pradă puternică hrănindu-se cu diverse animale, un necrofag ocazional (se hrănește cu hoituri) și pirat, având o gamă largă de pradă în funcție de locație și de sezon. Hrana include pești, broaște, șerpi, păsări (rațe, lișițe etc.), ouăle și puii din cuib; mai puțin frecvent, mamifere (iepuri, popândăi etc); în multe regiuni peștele este probabil cea mai importantă hrană.
Hoiturile pot fi deosebit de importante în hrană pe timpul iernii, sau chiar pe tot parcursul anului în anumite regiuni, cum ar fi Scoția, unde lagomorfele sunt, de asemenea, o hrană importantă; în Scoția concurează direct cu acvila de munte (Aquila chrysaetos) pentru hoituri.
Se hrănește cu pești vii de apă dulce sau de mare, mai ales cu cei găsiți lângă suprafață.
Prada aviară include cufundarii (Gavia), corcodeii (Podicipedidae), rațele (Anatidae), lișițele (Fulica), pinguinii nordici (Alcidae), pescărușii (Laridae) și alte pasări cu o mărime până la dimensiunea gâștelor și lebedelor adulte.
Mamiferele care servesc ca pradă includ un spectru larg de la șoareci și lagomorfe (iepuri) până la animale de dimensiunea puilor de cerbi sau de oii, de cele mai multe ori se hrănesc cu hoiturile acestor mamifere; nu există o limită în mărimea hoiturilor, care au inclus chiar cadavre umane.
Cuibul este o construcție masivă situat în arbori din vecinătatea apelor; el este mărit mereu în decursul anilor și este format din bețe și crengi și este căptușit cu plante verzi, ramuri cu frunze, lână, cârpe etc. Cuibul este construit de ambele sexe: masculul aduce materialul, iar femela construiește cuibul.
Ponta. Femela depune la intervale de 2-5 zile 1-3 ouă. Ouăle sunt albe mat. Ponta începe de la sfârșitul lui februarie până la mijlocul lui aprilie.
Incubația durează 35-42 de zile. Clocitul începe de la depunerea primului ou și este asigurat de ambele sexe sau numai de femelă.
Puii sunt nidicoli. În primele două săptămâni puii sunt acoperiți și îngrijiți de către femelă; în următoarele două săptămâni, femela rămâne în apropierea cuibului alimentând puii; în acest timp, hrana este procurată numai de mascul. Prima îmbrăcăminte a puilor este formată de un puf subțire și lung, smântâniu până la maro-cenușiu, și este mai întunecat pe aripi și târtiță și mai deschis pe beregată. A doua haină este formată din puf mai lung și mai lânos. Primele pene apar la pui la aproximativ o lună. Puii părăsesc cuibul în circa 56 de zile și se hrănesc independent la 8 săptămâni. Ei zboară la 70 de zile, însă rămân totuși în apropierea cuibului, cerând hrană, încă timp de 35-40 de zile.
 Evoluție și dispariție Comportament Liste Clasificare
Evoluție și dispariție Comportament Liste ClasificareCodalbul (Haliaeetus albicilla) este o pasăre răpitoare de zi, protejată, din ordinul falconiformelor (Falconiformes), familia Accipitridae. În România este pe cale de dispariție, fiind răspândită doar în regiunea Dunării și în Delta Dunării. Este de talie mare (80–100 cm, de mărimea unui curcan), cu corpul cafeniu, coada albă, ciocul galben puternic, lung, drept, încovoiat spre vârf și picioare galbene, la fel ca și degetele; unghii negre, mult curbate. Se hrănește cu pești, broaște, șerpi, rațe, iepuri, popândăi, hoituri. Cuibărește în arbori din vecinătatea apelor.
Orliak morský alebo orol morský[3] (lat. Haliaeetus albicilla) je druh z čeľade jastrabovité. Obýva celú severnú Palearktídu. Na Slovensku žije pri veľkých riekach a vodných plochách.[4] Podľa Medzinárodnej únie na ochranu prírody a prírodných zdrojov orliak morský patrí medzi najmenej ohrozené druhy, trend celkovej populácie je stúpajúci, európska populácia má takisto stúpajúci trend.[1]
Orliak morský sa ozýva vysokým a rýchlym kli-klik-klik[5] alebo kyik, kyik, kyik..., pripomínajúcim hlas tesára čierneho [6] v čase toku. U samici znie zreteľne hlbšie ako u samca. Je to kontaktný hlas, séria 15 - 30 volaní stúpajúca čo do rýchlosti i výšky tónu. Týmto hlasom sa ozýva najmä v období hniezdenia[7]. Pri rušení na hniezde znie ako kli-kli-kli...[7]. Známy je aj hlboký štekavý hlas kru.[5]
Odhadovaný počet hniezdiacich párov je 0 - 5, zimujúcich jedincov 40 - 80. Veľkosť populácie vykazuje mierny nárast od 20 do 50%. Veľkosť územia na ktorom sa vyskytuje je stabilná, maximálna zmena do 20%. Ekosozologický status v roku 1995 Im - nezaradený migrant, resp. nehniezdič. V roku 1998 CR:B1, CR - kriticky ohrozený. V roku 2001 CR - kriticky ohrozený.[8] V roku 2014 VU* D - zraniteľný.[2] Dôvodom preradenia do nižšej kategórie môže byť niektorý z nasledujúcich dôvodov: zvýšenie počtu rozmnožujúcich sa jedincov, rastúci trend populácie, zväčšovanie areálu alebo aj možnosti pozitívneho ovplyvnenia populácií z okolitých krajín.[9][10] Európsky ochranársky status SPEC3 - druhy, ktorých globálne populácie nie sú koncentrované v Európe, ale majú tam nevhodný ochranársky status. Stupeň ohrozenia R - vzácny druh.[4]
Mláďa na hniezde
Orliak morský alebo orol morský (lat. Haliaeetus albicilla) je druh z čeľade jastrabovité. Obýva celú severnú Palearktídu. Na Slovensku žije pri veľkých riekach a vodných plochách. Podľa Medzinárodnej únie na ochranu prírody a prírodných zdrojov orliak morský patrí medzi najmenej ohrozené druhy, trend celkovej populácie je stúpajúci, európska populácia má takisto stúpajúci trend.
Falco albicilla Linnaeus, 1758
Haliaeetus albicilla albicilla
Haliaeetus albicilla groenlandicus
Belorèpec ali postójna (znanstveno ime Haliaeetus albicilla) je ujeda iz družine kraguljev (Accipitridae).[1]
Belorepec je velika, čokata ujeda, ki zraste od 69 do 91 cm in ima razpon peruti med 200 in 240 cm. Pri teh pticah, kot pri večini ujed, je samica večja od samca. Značilnost tega orla so široke peruti, zelo kratek klinast rep bele barve (pri odraslih pticah, medtem ko je rep pri mladih pticah enake barve kot telo) in močan rumen kljun. V letu je videti kot deska, saj so krila pa vsej dolžini enako široka, dlanska peresa pa ima, kot veliko orlov, široko razprta. Glavo drži iztegnjeno naprej, tako, da sta dolžina glave in repa približno enaki.
Oglaša se podobno kot sivi galeb, z lajajočim, hripavim »krau«.
Razširjen je od severne, vzhodne in južne Evrope proti vzhodu do Kamčatke in Japonske ter v Severni Ameriki. Njegovo življenjsko okolje so morske obale ter bregovi rek in jezer, kjer se hrani pretežno z ribami do teže 8 kg ter vodnimi pticami (race, gosi, labodi, ponirki, čaplje, štorklje, žerjavi, ...). Poleg tega so postojnina hrana tudi razni sesalci (zajci, lisice, ...). Pogosto se hrani tudi z mrhovino.
Gnezdi v gnezdih, ki jih zgradi na drevesih ali na tleh in sicer februarja in marca.
Belorepec naj bi bil, po splošnem prepričanju, ptica, upodobljena v grbu Poljske. Sinonim za belorepca, postojna, je stara slovenska beseda za orla, po kateri je dobilo ime mesto Postojna in se kot motiv pojavi v mestnem grbu.
Belorèpec ali postójna (znanstveno ime Haliaeetus albicilla) je ujeda iz družine kraguljev (Accipitridae).
Havsörn (Haliaeetus albicilla) är en mycket stor rovfågel (den största regelbundet förekommande i Nordeuropa) som häckar i norra Palearktis från Berings sund till Island, samt på Grönland.
Havsörnen är en mycket stor örn med ett vingspann på 190–240 cm[2], en längd på 76–94 cm[2] och en ungefärlig vikt på 3,5–7 kg (honor är i genomsnitt ett drygt kilo tyngre än hanar)[3]. Som hos de flesta rovfåglar är honan större än hanen. En vuxen havsörn kännetecknas av en jämnt brun grundfärg, huvudet är ljusbrunt och stjärten vit. Näbben är gul och mycket kraftig, även i jämförelse med kungsörnens. Vingarna har rak fram- och bakkant och vingspetsen är tvärt avskuren, med spretiga, mycket långa vingpennor. Stjärten är spetsig. I flykten skiljer den sig från kungsörnen genom sina breda vingar, sin korta stjärt och sitt utskjutande långa huvudparti som sticker ut nästan lika långt som stjärten. Juvenila fåglar saknar den vita stjärten. Stjärten blir successivt vitare med åldern för att bli helt vit när fågeln uppnår könsmognad.[2]
Havsörnen häckar på Grönland, Island, i Nederländerna (Oostvaardersplassen), norra Skottland, Norden, Baltikum, Östeuropa, på Balkan, i Turkiet, österut genom Ryssland och Sibirien, i Kazakstan, Azerbajdzjan, Iran, Mongoliet, Kina, Japan och österut till Berings sund.[källa behövs]
I Sverige häckar havsörnen främst utmed Östersjökusten, vid syd- och mellansvenska sjöar och i Lappland.[4] Den observeras dock i hela landet och har förekommit som häckfågel i alla landskap förutom Dalsland, Härjedalen och Jämtland.[5] Svenska havsörnar kan vintertid flytta söderut så långt som till Mellaneuropa, men kan också flytta kortare sträckor eller stanna kvar vid häckningsområdet.
Den europeiska havsörnen är närbesläktad med den amerikanska vithövdade havsörnen och de kategoriseras som ett artpar. H. albicilla är något ljusare i fjäderdräkten, och har i adult dräkt en mindre kontrasterande ljus huvudfärg. DNA-studier tyder på att artparet skiljde sig från övriga havsörnar för 10-28 miljoner år sedan,[6] och att de två arterna spreds åt var sitt håll från Stilla havet.[7]
Den lilla isolerade populationen av havsörn som förekommer på allra sydvästligaste Grönland och på västra Island har tidigare föreslagits som en underart, groenlandicus, baserat på dess stora storlek och proportioner. Arten kategoriseras dock som monotypisk och storleksvariationerna är klinala. Genetiska studier visar att populationen ur ett evolutionärt perspektiv är ung och skiljer sig genetiskt väldigt lite ifrån resten av populationen.[8]
Havsörnens bo är mycket stort och tungt och används år efter år av samma par. Det placeras ofta i träd men kan också byggas på en klippavsats. Det kräver lämpliga grova träd i häckningsområdet, endast tallar som är minst 100 år gamla är lämpliga. Ett bo väger ca 500 kg, det är svårt att tro men om man tittar närmare på vad de byggs av så är det inte alls så konstigt. Skogsavverkning kan därför vara ett hot mot havsörnens häckning och är direkt förbjuden i närheten av existerande bon. Generellt placeras boet högre upp i trädet än kungsörnens bo och havsörnsbon kan också vara byggda mitt på toppen av en hög tall. Redet byggs på en plattform av grova grenar och mot centrum inreds redet med färskt granris och torrt gräs, som successivt trampas ned i balen och ersätts med nytt. Med åren växer boet som kan bli upp emot två meter i diameter.
Havsörnen lägger oftast två-tre ägg som till storleken i genomsnitt mäter 75 x 57 mm och har en vikt på 120 gram och är därmed mindre än kungsörnens ägg. Paret ruvar i mellan 35 och 45 dygn och tar sedan gemensamt hand om ungarna som är flygfärdiga efter cirka 70 dygn.
Havsörnar kan leva runt 40 år, men blir oftast inte äldre än 15 i frihet.
Jakten är mångsidig. Havsörnen avsöker områden eller sitter still och spanar. Bytet är främst fisk som utgör cirka 90% av födan sommartid[9], ofta gädda och braxen, men även sjöfågel, mindre däggdjur och as.[10] Det är också vanligt att den stjäl föda från andra djur och fåglar. Den fiskar ibland efter till exempel makrill och öring men också större fiskar som lax, samt bläckfisk i grunt vatten. I det fall havsörnen råkar gripa tag i en för stor fisk, kan den simma i land med fångsten i klorna. Den paddlar då sig fram med vingarna tills den når stranden.[11]
Den äldsta kända vilda havsörnen blev över trettio år. En havsörn som ringmärktes på Sveriges ostkust 1978 hittades död på Föglö på Åland i februari 2011.[12]
Under första hälften av 1900-talet minskade världspopulationen av örnar och så även havsörnen. Men denna trend avstannade 1970-1990 och under perioden 1990-2000 har artantalet i de flesta europeiska länder ökat.[1] Exempelvis bedömdes arten som utdöd i Storbritannien år 1918, men efter en lyckad inplantering år 1975 finns det nu över 200 havsörnar i Skottland.[13] De två viktigaste populationerna i världen återfinns idag i Norge och Europeiska Ryssland och tillsammans omfattar de mer än 55 % av världspopulationen. Fortfarande minskar dock några populationer i allra sydöstligaste Europa. 2004 uppskattades den europeiska populationen uppgå till 5 000–6 600 par, vilket utgör ungefär 50–74 % av världspopulation.[1]
Efter att ha varit nära utrotning i Sverige uppskattade man att det år 2009 fanns cirka 500 revirhävdande par i Sverige och att det skulle innebära ett bestånd på cirka 2 500 individer.[14] Trots att beståndet för närvarande ökar med 8 % årligen är den fortfarande (2015) kategoriserad som nära hotad (NT) på artdatabankens röda lista.[15]
För cirka 200 år sedan häckade havsörn över hela Sverige om än ojämnt eftersom den är knuten till vatten för sitt födosökande med ett tätare bestånd vid kuster och större sjöar. Man uppskattar att populationens historiska storlek kan ha legat på cirka 500 häckande par.[16] Under 1800-talet påbörjades en kraftig jakt på havsörn. Denna jakt fortsatte in på 1900-talet. Ornitologen Bengt Bergs arbete för svenska fåglar ledde till att havsörnen fridlystes 1924 och kategoriserades som kungsvilt (ingår i Statens vilt). 1924 återstod bara 35–40 par vid ostkusten och ett 10-tal par i Lappland. Detta skydd ledde dock till en långsam återhämtning av beståndet på ostkusten och vid 1950-talet räknade man med att där fanns cirka 100 häckande par. Då kom nästa hårda slag mot havsörnspopulationen. På grund av stigande halter i Östersjön av miljögifter som PCB och DDT så minskade fortplantningsförmågan. 1973 räknade man bara sex ungar utmed hela ostkusten.
1971 startade Svenska Naturskyddsföreningen Projekt Havsörn vilket var det första artprojektet i Sverige. Detta arbete tillsammans med bland annat förbud mot metylkvicksilver, DDT och PCB har inneburit att den svenska havsörnspopulationen sedan 1970-talet återhämtat sig förvånansvärt väl och finns nu i stort sett längs hela Östersjökusten och sedan 1980-talet har den börjat återkolonisera gamla häckningsområden i övriga Sverige. Vid insjöar finns arten ojämnt spridd från de östra delarna av Syd- och Mellansverige till Vänern samt ett isolerat bestånd i Lappland. Beståndet i Lappland består 2006 av cirka 60 par.
Genom det ringmärkningsprojekt som genomförts sedan 1976 där flertalet havsörnsungar märks har man kunnat visa att de flesta havsörnar som återkoloniserar Sverige kommer från populationen i Östersjön. Denna ringmärkning har också visat att den lappländska populationen är helt avskild från den resterande svenska populationen.
Efter att inte ha häckat i Vänern på över hundra år genomfördes två lyckade häckningar kring sjön 2001 vilket resulterade i fyra ungar som blev flygfärdiga.
I mars 2012 rapporterade Hallands ornitologiska förening att havsörn, efter 120 års frånvaro, återigen häckar på västkusten.[17]
Ett av Bruno Liljefors mest betydande verk är målningen Havsörnar från 1897 som hänger på Nationalmuseum i Stockholm. Den 2,4 meter breda målningen föreställer två havsörnar som attackerar en storlom.[18]
Den är Upplands landskapsfågel och landskapsdjur och även Ålands landskapsfågel.
Havsörn (Haliaeetus albicilla) är en mycket stor rovfågel (den största regelbundet förekommande i Nordeuropa) som häckar i norra Palearktis från Berings sund till Island, samt på Grönland.
Bayağı deniz kartalı (Haliaeetus albicilla), atmacagiller (Accipitridae) familyasından orta büyüklükte bir kartal türü.
Latince isimlendirilmesinde geçen Haliaeetus, "deniz kartalı", albicilla, "beyaz kuyruk" anlamındadır.
Tür, çaylaklar ve doğanlar gibi gündüzcül bir kuştur.
Bayağı deniz kartalı , büyük bir kuştur, 10–90 cm boyunda ve 200–250 cm kanat açıklığındadır. Dişiler 4 ila 6,9 kg gelirken erkekler 3 ila 5,4 kg olabilirler. Kanatları geniş, kafası iri ve kalın gagalıdır. Yetişkinler genellikle boyun ve başlarında beyazlıklar hariç kahverengi, kanatlar siyahımsı, kuyruk beyazdır. Gaga ve bacaklar sarıdır. Genç kuşlarda kuyruk ve gaga daha koyu renkli, kuyrukta koyu bantlar vardır.
Besinleri çeşitlidir, balık, kuş, leş ve küçük memeliler olabilir. Bazıları tamamen leşcil olarak yaşarken, düzenli korsan olarak, sumruların ya da diğer kuşların yiyeceğini çalarak beslenenleri de vardır; yine de güçlü avcılardır. Bu tür, avlıyacakları tavşanlar konusunda altın kartallarla şiddetli rekabete girebilir. Günlük besin gereksinimleri 500-600 g kadardır.[1]
Bu iri kartal türü, Amerika kel kartallarının yakın akrabasıdır, aynı ekolojik nişte, Avrasya'da yayılım gösterirler. Kuzey Avrupa ve kuzey Asya'da bulunurlar.
Avrupa'daki en büyük populasyonu Norveç kıyılarında bulunur. Çoğunlukla yerleşiktirler, sadece Sibirya ve doğu İskandinavya'nın kuzeylerindekiler kışları daha güneylere göçer.
Bayağı deniz kartalı (Haliaeetus albicilla), atmacagiller (Accipitridae) familyasından orta büyüklükte bir kartal türü.
Latince isimlendirilmesinde geçen Haliaeetus, "deniz kartalı", albicilla, "beyaz kuyruk" anlamındadır.
Орлан-білохвіст за походженням дуже близький до білоголового орлана, поширеного в Північній Америці. Вони виникли внаслідок дивергенції не пізніше початку міоцену (близько 10 мільйонів років тому) але не раніше середнього олігоцену (близько 28 мільйонів років тому)[2].
До недавнього часу більшість авторів у межах виду орлан-білохвіст виділяла два підвиди: номінативний (Haliaeetus albicilla albicilla) та гренландський (Haliaeetus albicilla groenlandicus). Підстави для виділення базувалися на більших розмірах останнього та інших пропорціях тіла. Однак з початку XXI ст. вид розглядають як монотиповий, а відмінності у розмірах пояснюють правилом Бергмана[3]. Нещодавні дослідження мітохондріальної ДНК підтверджують цю гіпотезу. З точки зору еволюційного масштабу гренландські орлани від'єдналися відносно нещодавно і не накопичили достатньо великої кількості генетичних відмінностей[4].
Великий за розміром хижий птах (розмах крил досягає 2—2,5 м). У природі можна впізнати за довгими та широкими крилами (махові пера у польоті розставлені), хвіст короткий, клиноподібної форми. Дорослий птах темно-бурий, з більш світлою головою і шиєю, білим хвостом, жовтуватим дзьобом і ногами. Молодий птах — темно-бурий, низ із поздовжніми плямами, хвіст і дзьоб темні, ноги сірувато-жовті. У польоті довго ширяє. Від орлів, особливо в польоті, відрізняється клиноподібною формою хвоста, а дорослий птах — також білим забарвленням хвоста.
Статевий диморфізм виражений тільки у розмірах. Маса тіла (кг): 3,1—6,9 (самці — 3,1—5,4, у середньому — 4,0; самиці — 4,1—6,9, у середньому — 5,6). Довжина крила (см): 55,2—71,5 (самці — 55,2—64,0, у середньому — 60,6; самиці — 62,1—71,5, у середньому — 66,8). Довжина хвоста (см): 25,4—33 (самці — 25,4—33,1, у середньому — 28,0; самиці — 27,6—33,0, у середньому — 30,5)[5].
Перше пухове вбрання — із довгого розрідженого пуху сірувато-бурого кольору, на голові пух особливо довгий і чисто-білий, з темною плямою біля ока; лапи і восковиця рожеві; дзьоб чорний. Друге пухове вбрання розвивається у віці близько 3 тижнів — воно густе і коротке, темне буро-сіре, між пухом пробиваються білі пухнасті вершини пер; лапи і восковиця блідо-жовті, дзьоб чорний.
Після вильоту із гнізда мають перше річне вбрання, яке щороку змінюється і більш-менш остаточним стає після чотирьох років життя.
Перше річне вбрання з чорнувато-бурою головою, на спинному боці бурий зі світлим вохристим рисунком із плям і білих країв пер, прикритих основою пір'я; краї пер іноді білуваті; махові пера темно-бурі, стернові чорно-бурі з мармуровим рисунком, іноді брудно-білі з темною строкатістю, що утворюють краї пера; черевний бік світло-сірий з темно-бурими плямами і білими основами пер. Райдужка бура, дзьоб чорнуватий, восковиця і лапи блідо-жовті, кігті чорні.
Друге річне вбрання орлана подібне до першого, але голова більш світла, на спинному боці ще помітні білі основи пер, надхвістя із домішкою білого, хвіст білий з чорною строкатістю.
У третьому річному вбранні, четвертому та, частково, п'ятому голова забарвлена дещо темніше, ніж у дорослих, білі основи пер на грудях ще зберігаються у більшому чи меншому ступені, залишки темної строкатості наявні на бічних парах стернових пер.
Дорослі птахи (у четвертому і наступних річних вбраннях) одноманітно бурі, у свіжому оперенні темні з фіолетовим відблиском, у зношеному вигляді — сірувато-бурі; відтінки бурого кольору варіюють також індивідуально; шия і голова світлі, у зношеному оперенні брудно-вохристо-білі; пір'я спини, вола, черева і боків з нерізкими блідими краями; махові пера чорно-бурі; довгі пера надхвістя білі, зазвичай з чорними вершинними мітками; стернові білі. Райдужка від блідої горіхово-бурої до жовтої, дзьоб жовтий, лапи і восковиця яскраво-жовті, кігті чорні. Це вбрання з'являється після трьох річних линянь і пов'язане з першим річним проміжним.
Географічної мінливості забарвлення і розмірів не виявлено. Статевий диморфізм у забарвленні не проявляється[6].
Дорослі орлани подають голос переважно у гніздовий період на гніздовій території. Це гучний крик, який складається з низки 15—30 коротких пронизливих звуків у ростучому темпі та тоні, які можна передати як «кльо-кльо-кльо-кльо» або «кра-кра-кра-кра». Коли кричить сидячи, то дещо витягає шию вперед і піднімає голову вгору. Кричить і в повітрі, при ширянні на висоті. Біля гнізда з яйцями або пташенятами у тривозі може видавати писклявий на високих нотах короткий крик[7].
У північній частині ареалу перелітний, у південній — осілий або кочовий вид[6]. Ступінь осілості також залежить від віку — молоді птахи більш схильні до дальніх переміщень[5].
Поширений у північній Палеарктиці, пов'язаний з великими водоймами і деревною рослинністю вид.
Ареал протягом останніх двох століть зазнавав суттєвих змін. Протягом XIX — першої половини XX століття відбувалося помітне скорочення області поширення[5], з 1970—1980-х років на більшій частині відбувається відновлення ареалу та його розширення.
Поширений в Євразії від Скандинавії, Данії, долини Ельби, Словаччини, Угорщини, Балканського півострова на схід до басейна Анадиру, Камчатки, тихоокеанського узбережжя Східної Азії. На північ по узбережжю Норвегії до 70-ї паралелі, до північної частини Кольського півострова, південної частини Каніна, Тиманської тундри[ru], південної частини Ямалу, на Гиданському півострові до 70-ї паралелі, до гирла Єнісею, на Таймирі до гирла Пясіни, між долинами Хатанги і Лени до 73-ї паралелі, далі на схід на півночі до 70-ї паралелі та приблизно до південного схилу Чукотського хребта. У Північній Азії гніздиться вздовж північної межі зростання деревної рослинності[6][8][9].
На південь до Греції, Малої Азії, північного Іраку, пониззя Амудар'ї, нижньої течії Ілі, Алаколя, Зайсану, північної Монголії, північно-східного Китаю і Корейського півострова. Заселяє західне узбережжя Гренландії на північ до затоки Диско. Острови: Ісландія, Британські острови, Еланд, Сахалін, Курильські острови, Хоккайдо[8].
У період скорочення чисельності в XIX — першій половині XX століття зник на гніздуванні у районах західної межі ареалу: в Шотландії, Данії, Австрії, Албанії, Ізраїлі, Єгипті та ряді інших місць. Південна межа відступила на північ в Азії, на Кавказі[5][10].
Спеціальні заходи щодо реінтродукції виду були успішно здійснені у Великій Британії[11][12][13], Ізраїлі[14], окремих районах Німеччини[15], Данії[16].
Завдяки вжитим заходам щодо реінтродукції та загального збільшення чисельності на початку XXI століття відновив гніздування у більшій частині європейського ареалу, за виключенням острова Сардинія, Сирії та деяких інших районів. Ареал відновився також в більшій частині Азії та на Кавказі.
У минулому гніздився на Фарерських островах, Корсиці[5].
У більшості регіонів має нерівномірне поширення, гніздиться головним чином вздовж басейнів великих річок, морського узбережжя і берегів озер. Відсутній у гірських і безводних районах.
Зальоти нестатевозрілих і холостих птахів влітку і восени відмічали за межами ареалу — аж до полярного узбережжя, на півночі Ямалу, на острові Білий та Новосибірських островах[9][17].
В Україні мешкає практично на всій території, крім Карпат та гірського Криму, поблизу водойм (боліт, озер, річок). Гніздиться вздовж Дніпра та його головних приток, на річках Сіверський Донець, Дунай, а також поблизу великих ставкових господарств у інших регіонах. Під час кочівель трапляється по всій Україні. На зимівлі — переважно вздовж Дніпра, у західній частині Північного Причорномор'я, на Сиваші та спорадично в інших регіонах[18].
Сучасна популяція орлана-білохвоста у світі оцінюється в 5000—7000 пар, в тому числі в Європі гніздиться 4000—4700 пар. Протягом XIX — першої половини XX століття чисельність виду в Європі скорочувалася. З 1980-х років у більшій частині ареалу чисельність зростає[19].
В Україні протягом XIX — першої половини XX століття чисельність катастрофічно скорочувалася. У другій чверті XX століття гніздилося 100—150 пар. Мінімальна кількість зафіксована в 1960—1970-ті роки — 20—30 пар. Відновлення чисельності у заплаві Дніпра почалося з другої половини 1970-х років, в інших регіонах — з середини 1980-х. У 1989 гніздилося 30—40 пар. З початку 1990-х років чисельність зростає. У середині 1990-х років гніздилося 50—70 пар, станом на 2009 рік — 100—120 пар[20][21].
На території України щороку зимує 260—370 особин[18].
Однією з головних причин скорочення чисельності орлана-білохвоста було переслідування з боку людини. У Західній Європі кампанія щодо винищення «шкідливих» хижих птахів розпочалася ще в XVIII столітті[22][11]. У Російській імперії цей процес розпочався дещо пізніше — наприкінці XIX століття. З цією метою відстрілювали птахів, розоряли гнізда. У період після німецько-радянської війни у СРСР навіть виплачувалися премії за відстріл пернатих хижаків. У цілому в СРСР до середини 1960-х років щорічно знищували 100—150 тисяч хижих птахів[23]. В Україні виплата грошових премій була зупинена тільки в 1969 році.
Однією з головних причин скорочення чисельності хижих птахів в Європі та Північній Америці в 1950—1960-х роках на сьогодні більшість дослідників визнають широке застосування отрутохімікатів, у першу чергу хлорорганічних сполук[22]. Це призводило до зниження репродуктивних здібностей птахів та, як наслідок, до зниження їх чисельності. Дослідження продуктивності орлана в Швеції встановили суттєві її відмінності протягом XX століття, що корелювало із вмістом ДДТ в яйцях орланів[24], подібні результати були отримані в Німеччині[25] та інших країнах.
Протягом XIX століття та до 1970-х років головними причинами скорочення чисельності в Україні були винищення дорослих птахів, їхніх яєць, вирубування лісів в місцях гніздування, створення каскаду водосховищ на Дніпрі, що супроводжувалося вирубуванням заплавних лісів, затопленням долини річки, скороченням кормової бази[18][20][21].
Чинниками, які сприяли відновленню чисельності орланів в Європі починаючи з 1980-х років, називають покращення охорони, заборону застосування ДДТ, реінтродукція, пристосування орланів до гніздування поруч з людиною[26].
Осілий птах, частина популяції в осінньо-зимовий період кочує. Кочують поодинці або парами, у місцях концентрації здобичі утворюють скупчення. Осінні кочівлі спостерігають переважно в жовтні — листопаді; весняні — з початку лютого до середини березня.
Орлан-білохвіст на гніздуванні звичайно пов'язаний з морськими узбережжями, широкими річками, озерами та вологими місцями. В Україні пари білохвостів оселяються на відстані 0,5—6 км від найближчої кормової водойми (в середньому ця відстань становить 1,7 км)[18]. Для гніздування зазвичай обирає найбільш віддалені від антропогенної діяльності ділянки. Проте з кінця XX століття намітилася тенденція пристосування цього хижака до існування поруч з людиною. Нині окремі пари гніздяться неподалік від доріг, у лісосмугах серед полів тощо. Відмічено успішне гніздування в адміністративних межах Гамбурга та Берліна[27].
Гніздиться головним чином на деревах, місцями — на скелях та, як виняток, на землі[28][11][29]. Відзначали також гніздування білохвостів на металевій опорі лінії електропередачі[30], на надмогильних спорудах[31], на триангуляційній вежі[32] та інших місцях.
В Україні в наш час всі гнізда білохвостів розташовані на деревах. Найбільше гнізд (52,6 %) збудовані на соснах, дещо менше — на чорних тополях (15,8 %), вільхах (11,8 %), а також на білих тополях та вербах (по 6,6 %), черешчатих дубах (5,3 %) та осиках (1,3 %)[18]. До кінця XIX століття орлани також гніздилися на скелях південного узбережжя Криму[7].
На своїй гніздовій ділянці нерідко має декілька гнізд. У Норвегії із 48 ділянок на 10 знаходилося по 1 гнізду, на 21 — по 2 гнізда, на 11 — по 3 гнізда, на 4 — по 4 гнізда, на 1 — 5 гнізд, на 1 було 11 гнізд, всього 117 гнізд, в середньому 2,5 гнізда на пару[28]. У Німеччині середня кількість гнізд на пару становила 2,2[33], в різних регіонах Польщі — від 1,8 до 3,2[32]. В Україні 15 гніздових територій мали по 1 гнізду, 4 — по 2 гнізда, та 5 — по 3 гнізда; в середньому 1,58 гнізда на гніздову територію[18]. Одне гніздо птахи можуть займати багато років. Покинувши гніздо, як правило, будують нове і до старих не повертаються.
Гнізда орланів-білохвостів являють собою масивні споруди, побудовані з гілок дерев. Лоток влаштовується з тонших гілок і вистилається сухою травою[7]. Новозбудовані гнізда мають діаметр 145—170 см та висоту від 33 до 80 см. Багаторічні гнізда можуть досягати 175—180 см завширшки та до 1,5—3,1 м заввишки[18].
Орлан-білохвіст — моногам, пари постійні. Дорослі птахи протягом усього року тримаються парою.
На території України токування білохвостів починається вже з середини грудня, більшої активності воно набуває з середини січня, досягаючи піку перед відкладанням яєць. Шлюбна поведінка включає повітряні демонстрації і голосову активність. Один птах або пара високо кружляють над гніздовою територією на висоті 60—100 м, рідше до 200 м і вище. Нерідко під час таких кружлянь спостерігаються і повітряні ігри пари, а також сутички із сусідніми парами. Крики, пов'язані зі шлюбною поведінкою, в умовах Середнього Придніпров'я найчастіше можна почути з першої декади грудня до першої декади березня, тобто до початку насиджування[18].
Відкладання яєць білохвостами в різних частинах ареалу значно варіює: на півдні це відбувається наприкінці лютого — в березні, в середній смузі наприкінці березня — у квітні, у лісотундрі та тундрі наприкінці квітня — на початку травня[6][5][34].
У білохвостів в Україні відкладання яєць відбувається з кінця першої декади лютого до початку першої декади квітня, тобто може розтягуватися на два місяці. Найбільш звичайним є яйцевідкладання з кінця лютого до кінця другої декади березня, коли відкладається близько 86 % кладок[18].
Яйця орлана великі, білі, іноді з ледве помітним блакитним відтінком. Вони еліптичні з полюсами, які не дуже відрізняються один від одного, зрідка — короткоеліптичні. Яйця з чітко відмінними тупим і гострим полюсами, наприклад гостроовальні, трапляються рідко[7].
Розміри яєць орланів у Норвегії були такими: довжина 65—89, ширина 56—63 мм[28]. Оологічні показники орланів на території України: довжина 69,5—80,1 (75,89), ширина 53,5—62,0 (58,83) мм; вага 128,0—151,5 (139,3) г.
Орлани відкладають від одного до трьох яєць, найчастіше трапляються кладки з двох яєць. Середній розмір кладок становить: у Великій Британії — 1,64[11], у Швеції — 1,62[35], у Норвегії — 2,16[28], в Україні — 2,24[18] яйця. Відкладання яєць відбувається з інтервалом 2—5 діб. Насиджує переважно самиця, інкубаційний період становить 38 діб на одне яйце[5].
Вилуплення першого пташеняти у білохвостів в Україні відбувається звичайно з середини першої декади квітня до кінця другої декади цього місяця, найчастіше в середині другої декади квітня. Пташенята залишають гніздо найчастіше у третій декаді червня у віці 70—80 діб. Протягом 1—2 місяців батьки їх підгодовують.
В Україні успішність гніздування (відсоток пар, які успішно виростили пташенят до кількості пар, які приступали до розмноження) становить 73,5 %. Найчастіше гніздо залишає лише одне пташеня (близько ⅔ випадків), рідше — двоє пташенят (близько ⅓ випадків) та лише у 4 % випадків успішно виростає троє пташенят[36][18].
Статевозрілими стають у 4—6 років[5].
У залежності від географічної широти та віку орлан-білохвіт є осілим, кочовим або перелітним птахом. Сезонні переміщення мають досить складний характер. Вони розпочинаються у птахів усіх вікових категорій у серпні — на початку вересня у зв'язку із пошуком територій, багатих на здобич. У другій половині вересня розпочинається міграція молодих птахів із місцевостей, де орлани не залишаються зимувати. Згодом починається переліт або кочівля дорослих білохвостів, що пов'язано із замерзанням водойм.
Осіння міграція виду в Україні триває з початку вересня до кінця листопада. Найінтенсивніше скрізь вона проходить протягом жовтня. Строки міграції залежать від температурного режиму — у теплі осені міграція може розтягуватися до середини грудня[37]. Більшість перелітних птахів — це молоді особини[5]. У Західній Палеарктиці переміщення здійснюються переважно на південь та південний захід[5][28]. Білохвости мігрують поодиноко, рідко парами. Лише на місцях тимчасових зупинок спостерігаються скупчення, які нараховують десятки особин. Більша частина мігрує вздовж великих та середніх річок, що пояснюється трофічним характером міграцій. В Україні переміщення відбуваються переважно вздовж Дніпра та його приток, а також вздовж Сіверського Дінця[37]. Характерно, що міграція молодих птахів спостерігається на місяць раніше, ніж дорослих[5].
Взимку білохвости тримаються переважно біля незамерзаючих ділянок морів та річок. Частина птахів зимує на гніздових ділянках, які віддалені від незамерзаючих водойм, поблизу скотомогильників та в степу. В Європі найважливішим місцем зимівлі орланів є узбережжя Балтійського моря, де зимує близько 3600 птахів[19]. Найважливішими місцями зимівлі виду в Україні є узбережжя Чорного й Азовського морів, а також Дніпро. Чисельність зимуючих орланів в Україні становить 260—370 птахів, із них 140—160 зимує в Північно-Західному Причорномор'ї, Приазов'ї та на Сиваші та 100—150 особин — на Дніпрі[38].
Відліт птахів з місць зимівлі на півдні України відбувається з середини лютого до кінця квітня, найчастіше — з кінця лютого до початку третьої декади березня та збігається в цілому зі строками розпаду зимівель водоплавних. В інших регіонах країни міграція звичайно триває від середини березня до середини квітня, окремі особини мігрують до кінця квітня[37]. Характерно, що весняна міграція виду на території України проходить у строки, коли дорослі орлани в багатьох випадках уже мають кладки.
Широкий спектр об'єктів живлення, їх розмір та вага є відображенням різноманітних способів полювання білохвоста. У цілому, в залежності від наявної здобичі та ситуації, білохвіст є хижаком, падлоїдом або клептопаразитом, який здобуває рибу, водно-болотних птахів, ссавців, споживає також падло. У Середньому Придніпров'ї риба становить близько 80 % його здобичі. З риб найчастіше у раціоні білохвостів на Середньому Дніпрі трапляється лящ (25 %), на другому місці — судак (14 %), на третьому — короп (4 %). Серед птахів найчастішою здобиччю є крижні[18]. В інших частинах ареалу риба також зазвичай переважає в раціоні орлана[6][5].
Головними загрозами та обмежувальними факторами для виду сьогодні вважають лісогосподарську діяльність; використання земель для розвитку інфраструктури; зміну гідрологічного режиму річок і меліорацію; турбування біля гнізд через рекреаційне навантаження; скорочення кормової бази; браконьєрське полювання, вилучення з гнізд та нелегальна торгівля; отруєння від поїдання приманок для інших тварин; вторинне отруєння внаслідок накопичення свинцю в організмі; зниження плодючості; підвищену смертність; загибель на лініях електропостачання; зміну клімату[39].
У наш час головними чинниками загрози для орлана-білохвоста в Україні є лісогосподарська діяльність, браконьєрство, збільшення рекреаційного навантаження поблизу водойм, збіднення кормової бази, забруднення довкілля[40][18][20][21].
Орлана-білохвоста занесено до усіх трьох видань Червоної книги України (1980, 1994, 2009). В останньому виданні (2009) його віднесено до категорії «рідкісний». Вид занесено до Червоного списку МСОП (2000, статус — найменший ризик) та Європейського Червоного списку (статус — рідкісний). Включено до Додатка І Конвенції про міжнародну торгівлю видами дикої фауни і флори, що знаходяться під загрозою зникнення (Конвенція СІТЕС, 1973), Додатка II Конвенції про охорону дикої флори і фауни та природних середовищ існування в Європі (Берн, 1979), Додатків I і II Конвенції про збереження видів диких тварин, що мігрують (Бонн, 1979).
Взаємовідносини орлана-білохвоста з людиною різноманітні та мають давню історію. Кістки цього хижака знайдені в культурних шарах людських поселень. Їх появу у таких місцях пояснюють декількома причинами:
Вважають, що саме орлан-білохвіст був прообразом зображення «білого орла» на гербі Польщі — на ньому зображено великого хижого птаха з голою цівкою (у всіх орлів цівка оперена, на відміну від орланів)[42]. Оскільки орлан-білохвіст є рідкісним видом, у багатьох країнах його зображають на поштових марках.
Білий орел на гербі Польщі, його можливий прообраз — орлан-білохвіст
Німецький корабель під назвою нім. Seeadler (орлан-білохвіст)
Киргизстан, 1995 рік
Азербайджан, 1994 рік
Đại bàng đuôi trắng (tên khoa học Haliaeetus albicilla) là một loài chim săn mồi trong họ Accipitridae cũng bao gồm các loài chim ăn thịt khác như diều, ó. Nó được xem là loài gần gũi với đại bàng đầu trắng.
Đại bàng đuôi trắng là một loài chim rất lớn. Chúng dài 66–94 cm với sải cánh dài 1,78-2,45 m. Sải cánh dài, với một trung điểm dài 2,18 m, trung bình là mức lớn nhất trong các loài đại bàng. Đại bàng biển Steller lớn hơn cả trọng lượng và chiều dài, là đối thủ gần nhất với sải cánh trung bình trong số các loài đại bàng sống. Đại bàng đầu trắng có khoảng kích thước tương tự như loài đại bàng đuôi trắng, mặc dù có sải cánh trung bình ngắn hơn và thường tổng chiều dài dài hơn, do đuôi dài hơn. Chim mái, thường có trọng lượng 4-6,9 kg, hơi lớn hơn so với chim trống, có cân nặng 3,1-5,4 kg. Trọng lượng kỷ lục loài này là 7,5 kgcho một mẫu vật từ Scotland, trong khi một con chim mái gần đây hơn từ Greenland được ghi nhận dài 2,53 m trên cánh. Trong số đo tiêu chuẩn, cánh gập 90 độ dài 55,2-71,7 cm, đuôi dài 25–33 cm, các xương cổ chân dài 9,2-10,1 cm (3,6-4,0 in) và mỏ dài 6-6,5 cm. Thay đổi kích thước thường là một xu hướng tập hợp dị biệt. Kích thước của đại bàng từ Greenland là nói chung lớn hơn những cá thể trong các khu vực khác trong khi những cá thể đến từ (nay đã gián đoạn) Trung Đông, ở cực nam của phân loài này, là nhỏ nhất của loài này. Đại bàng đuôi trắng đôi khi được coi là đại bàng lớn thứ tư của thế giới và trung bình là loài đại bàng nặng thứ tư trên thế giới.
Loài này có cánh "cửa nhà kho" rộng, đầu to và một mỏ dày lớn. Chim trưởng thành chủ yếu có màu nâu xám trừ đầu và cổ hơi nhạt màu hơn, lông bay màu đen, và đuôi màu trắng nổi bật. Tất cả các phần không có long có màu vàng, bao gồm cả mỏ và chân. Ở những con chim chưa thành niên, đuôi và mỏ màu sậm hơn, với một dải cuối sẫm màu ở các cá thể chim gần trưởng thành. Sự kết hợp của màu nâu xám xịt, cánh đều và rộng, đuôi trắng, mỏ màu vàng mạnh mẽ và kích thước lớn tổng thể làm cho loài đại bàng đuôi trắng về cơ bản không thể gây nhầm lẫn trong phạm vi nguồn gốc của nó. [3]
Một số cá thể đã được ghi nhận sống hơn 25 năm, trung bình 21 năm tuổi.
Đại bàng đuôi trắng (tên khoa học Haliaeetus albicilla) là một loài chim săn mồi trong họ Accipitridae cũng bao gồm các loài chim ăn thịt khác như diều, ó. Nó được xem là loài gần gũi với đại bàng đầu trắng.
Haliaeetus albicilla (Linnaeus, 1758)
Ареал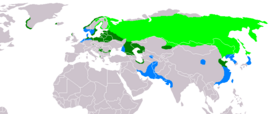
Районы гнездования
Районы зимовки
Круглогодичное присутствие
Орлан-белохвост[1] (лат. Haliaeetus albicilla) — хищная птица из семейства ястребиных (Accipitridae).
Длина тела орлана-белохвоста составляет от 70 до 90 сантиметров, размах крыльев — от 200 до 230 сантиметров, масса — от 4 до 7 килограммов. Хвост короткий, клиновидной формы. Оперение взрослой особи бурого цвета, голова и шея с желтоватым осветлением, хвост белый. Клюв светло-жёлтого цвета по сравнению с другими хищными птицами довольно большой и мощный. Радужная оболочка глаза также имеет светло-жёлтый цвет. В отличие от беркута (Aquila chrysaetos), лапы орлана-белохвоста не покрыты перьями до самых пальцев. Молодые особи тёмно-бурого цвета, клюв тёмно-серый. С каждой линькой молодые орланы-белохвосты становятся всё больше похожими на взрослых животных, а в пятилетнем возрасте орлан-белохвост полностью обретает взрослую внешность. Самки орлана-белохвоста значительно больше по размеру и весят больше, чем самцы. В полёте птица держит свои широкие крылья горизонтально. После чёрного грифа (Aegypius monachus), бородача (Gypaetus barbatus) и белоголового сипа (Gyps fulvus) орлан-белохвост является четвёртой по величине хищной птицей Европы.
Подвиды орлана-белохвоста на сегодняшний день неизвестны. Ранее орланов-белохвостов Гренландии отличали от номинантой формы как отдельный подвид, однако сегодня это деление не выдерживает критики. По своему внешнему виду, поведению и экологии орлан-белохвост весьма похож на американского белоголового орлана (Haliaeetus leucocephalus), что для некоторых орнитологов стало поводом объединения двух видов в надвид.
Союз охраны птиц России объявил орлана-белохвоста птицей 2013 года[2].
Орлан-белохвост на марке Азербайджана
Орлан-белохвост (лат. Haliaeetus albicilla) — хищная птица из семейства ястребиных (Accipitridae).

白尾海雕(學名:Haliaeetus albicilla[2])又稱白尾海鷲[3],是鷹科中一種非常大型的猛禽。很多人認為牠們是美國白頭海雕的近親,並深信牠們在舊大陸居住在同一個生態位。
白尾海雕是一種大型的鳥類,長76到100公分,翼展長200至250公分,體重介乎於3.5到7.5公斤之間。雌性的比雄性的大很多。白尾海雕的翅膀張開時非常闊,頭部很大,嘴部很厚,很輕易就能把肉切開。成年的白尾海雕除了較淺色的頭部和頸部、白色的尾部、黃色的嘴和腳外,基本上全身的主要顏色為棕色。幼體的嘴和腳較成體的深色,在半成年時,牠們的尾部才變為帶黑色條紋的白色。
白尾海雕在北歐亞大陸進行繁殖。1975年,白尾海雕被成功引入蘇格蘭小三島(Small Isles)的拉姆島(Isle of Rum),現時牠們在整個外赫布里底群島(Outer Hebrides)和韋斯特羅斯(Wester Ross)的海岸進行繁殖。而在英國,白尾海雕仍然鮮少到那裡進行繁殖。全歐洲最大的白尾海雕族群位於挪威海岸。
2006年5月22日,有消息指有一對白尾海雕在荷蘭Oostvaardersplassen自然保護區內進行繁殖。牠們是自行進入該自然保護區的,而不是由人類引入。這是首次有白尾海雕自行進入荷蘭進行繁殖。在2007年,這對白尾海雕回到自己的巢去了[4]。
2007年夏天,白尾海雕開始被引入愛爾蘭共和國。來自挪威的15隻年輕白尾海雕將被放於愛爾蘭西南部的凱里郡(County Kerry)基拉尼國家公園(Killarney National Park)。這個大型的項目將會持續數年,希望將更多的白尾海雕引至基拉尼國家公園。白尾海雕在愛爾蘭已有悠久的歷史,但在1800年代卻因為受到當地的人捕獵而逐漸消失了。在之後的5年都會每年有15隻小白尾海雕被放在基拉尼國家公園。[5]
白尾海雕大多並不會遷徙,只有最北部的白尾海雕族群,像是在西伯利亞的白尾海雕才會在每年的冬季遷至南方。
在格陵蘭的最西南端及冰島西部有一個不遷徙的小族群。這個白尾海雕族群的成員體型特別大,因此以前有人認為這小族群是另一亞種,稱之為「groenlandicus」,現時科學家認為這族群是單型種(monotypic species),而牠們的體型之所以如此大是因為牠們為漸變群(Cline),即如伯格曼氏法則(Bergmann's Rule)所述[6]。
白尾海雕與白頭海雕是一個複合種(species complex)。牠們從中新世早期開始出現差別。這個複合種由一個白頭的物種(白頭海雕)和一個黑頭的物種(白尾海雕)組成。像虎頭海雕(Steller's Sea-eagle)般,牠們都擁有黃色的爪和嘴,若是成體的話,牠們的眼睛亦然。
白尾海雕的食物很多,有魚類、鳥類和腐肉,有時牠們亦會捕獵一些小型的哺乳動物。很多鳥類只吃腐肉維生,有時去搶水獺和其他鳥類的食物,而白尾海雕亦是一個很強的獵手。有些白尾海雕會跟金鷹爭奪兔和野兔,因為牠們兩者都會吃捕食這些動物。在繁殖季節期間,若牠們有了胎兒,牠們每天需要500至600克的食物。在冬季的月份,牠們不大想活動,這時牠們的食量就會降至每天吃200到300克的食物。
白尾海雕在4或5歲時已性成熟。牠們找到配偶後就會跟對方共處一輩子,但若有其中一方死了,牠們仍舊會很快找到新的配偶。牠們會在空中示愛。白尾海雕發出的聲音要比金鷹多得多,特別是在繁殖季節期間,若雄性接近雛鳥時,雄性就會發出很多聲音。
白尾海雕的巢很大,一般是位於一棵樹上的樹枝或在海邊的懸崖構成的。牠們的巢通常會再使用,有時,一個巢甚至可用數十年。在斯堪地納維亞,不斷有很多樹木塌下來,就是因為長期負荷不住白尾海雕巨大的鳥巢。
一般而言,白尾海雕的巢穴位於隱蔽的懸崖上,但亦有時會在湖邊或河邊。白尾海雕的地盤可與金鷹的重疊,但是這兩個物種之間偶爾也會產生競爭。金鷹較喜歡山脈及荒野,而白尾海雕則較喜歡海岸和海洋。
一對白尾海雕每年可生出1到3隻蛋。雄性和雌性均會協助孵蛋的工作,而蛋一般會在離開母體後38天才孵化。在孵出後,幼鳥一般都很會互相遷就,但通常第一隻孵出的幼鳥體型都會較大,且在進食時佔有較大的優勢。雌性白尾海雕會完成大部分的孵蛋工作及較常餵幼鳥。在出生5到6個星期後,幼鳥一般就能自行進食,在出生11到12個星期後幼鳥才會長出羽毛,但牠們仍會一直留在巢中,依賴父母捕獵維生,再過6至7個星期牠們才開始懂得自立。
白尾海雕是頂級掠食者。在1959到60年代期間,白尾海雕在歐洲多處地方的數量急遽下跌,在一些地區甚至滅絕了。因此,很多地方都開始設立法律,希望能減少對白尾海雕的捕獵及保護繁殖區和冬季攝食區。後來,白尾海雕在歐洲的數量終於得以回升。因此,歐洲從前的白尾海雕繁殖區現時也重新引入了一些白尾海雕,但其數量直到今天仍在上升。
最近在歐洲中北部對白尾海雕進行的微隨體(microsatellite)粒線體DNA有關研究[7]顯示,白尾海雕的數量仍在上升,仍然保持著可觀的遺傳多樣性(genetic diversity)數量,這暗示著牠們的近親交配衰退(inbreeding depression)的風險很低[8],這一再證明了白尾海雕的數量在歐洲已成功復原。

 ワシントン条約附属書I 分類 界 : 動物界 Animalia 門 : 脊索動物門 Chordata 亜門 : 脊椎動物亜門 Vertebrata 綱 : 鳥綱 Aves 目 : タカ目 Accipitriformes 科 : タカ科 Accipitridae 属 : オジロワシ属 Haliaeetus 種 : オジロワシ H. albicilla 学名 Haliaeetus albicilla
ワシントン条約附属書I 分類 界 : 動物界 Animalia 門 : 脊索動物門 Chordata 亜門 : 脊椎動物亜門 Vertebrata 綱 : 鳥綱 Aves 目 : タカ目 Accipitriformes 科 : タカ科 Accipitridae 属 : オジロワシ属 Haliaeetus 種 : オジロワシ H. albicilla 学名 Haliaeetus albicilla
オジロワシ(尾白鷲、Haliaeetus albicilla)は、タカ目タカ科オジロワシ属に分類される鳥類。
ユーラシア大陸北部で繁殖し、冬季になると中華人民共和国東部、ペルシャ湾周辺に南下し越冬する。東ヨーロッパや西アジア、中華人民共和国北東部などでは周年生息する。日本では主に基亜種が冬季に北日本に飛来(冬鳥)するが、北海道北部および東部では周年生息する個体もいる(留鳥)。2010年1月に開催された環境省の保護増殖分科会では、北海道内で越冬する個体数は約1,700羽(うち、つがい約140組)という数を示している。また、かつては対馬に定期的に飛来する個体がいた。
全長70 - 98cm。翼開張180 - 240cm。体重3 - 7kg。全身は褐色の羽毛で覆われている。頭部は淡褐色や淡黄色の羽毛で被われる。尾羽は12枚で短く、やや楔形。尾羽の色彩は白い。種小名albicillaは「白い尾の」の意で、和名や英名(white-tailed)と同義。翼の後縁は直線的で飛翔時には長方形に見える。なお同属のオオワシの方が白い部分が多い。
虹彩は淡黄色。嘴や後肢の色彩は淡黄色。
幼鳥は全身が褐色や黒褐色の羽毛で被われ、上面や下雨覆に白い斑紋、尾羽に褐色の斑紋が入る。また虹彩が褐色で、嘴の色彩が黒い。成長に伴い全身の斑紋は消失し、虹彩や嘴の色彩は黄色みを帯びる。
以下の分類は2016年現在IOCで採用されている分類に従う[5]。一方で2016年現在Clements checklistでは亜種を認めていない[6]。
海岸、河川、湖沼などに生息する。単独もしくはペアで生活するが、冬季になると集団で休む事もある。
食性は動物食で、魚類、鳥類、哺乳類、動物の死骸などを食べる。ヒツジの幼獣、タンチョウの雛を襲い食べることもある。水面付近にいる獲物は急降下して捕らえる。
繁殖形態は卵生。高木の樹上や断崖に木の枝を組み合わせた巣を作り、3-4月に1回に2個の卵を産む。主にメスが抱卵し、抱卵期間は約38日。雛は孵化してから70-75日で飛翔できるようになり、さらに35-40日後に独立する。生後5-6年で性成熟し、生後6-7年で成鳥羽に生え換わる。ヨーロッパでの平均寿命は20年以上とされる[7]。
日本ではハリアエエトゥス・アルビキルラとして特定動物に指定されている[9]。
흰꼬리수리(영어: White-tailed Eagle)는 수리과에 속하며 학명은 Haliaeetus albicilla[1]이다. 몸길이는 69-94cm로 목이 황갈색이고, 꼬리는 흰색이며, 나머지는 갈색이다. 새끼는 몸이 갈색이고 부리와 발은 노랗다. 해안·습지·호수 및 큰 하천가에 서식하며 연어·송어 같은 어류, 토끼·쥐·오리·물떼새·도요새·까마귀 같은 포유류와 작은 조류를 먹는다. 암컷은 흰색 또는 회백색 알을 1-4개 낳는다. 혼자 생활하지만 번식이 끝난 뒤에는 어린 새와 같이 다니기도 한다. 유라시아대륙 전역에 걸쳐 폭넓게 분포하며 한국에서는 겨울에 볼 수 있으며 환경부 지정 멸종위기 1급인 동물이다.
흰꼬리수리는 매우 큰 대형 수리종이다. 전신은 약 66-94cm(26~37 인치)에 달하고 양 날개를 편 길이는 1.78-2.45미터에 이른다. 날개 중점이 2.18 미터 (7.2피트)에 이르는 만큼 평균적으로 어떠한 수리보다 가장 크다.[2][3] 몸무게와 총 길이 면에서 더 큰 참수리는 생존하는 수리종들 가운데 평균적인 날개 길이에서 가장 가까운 적수이다.[2] 흰머리수리는 흰꼬리수리와 크기가 거의 동일하지만 평균 날개 길이가 더 짧으며 더 긴 꼬리 때문에 일반적으로 총 길이는 더 크다.[2] 암컷은 일반적으로 4~6.9 킬로그램 (8.8~15 파운드)의 무게가 나가며 이는 3.1~5.4 킬로그램 (6.8~12 파운드)의 수컷보다 더 무거운 편이다.[2] 이 종의 최고 몸무게 기록은 스코틀랜드의 한 종인 7.5 킬로그램 (17 파운드)에 이르는 반면 그린란드계의 더 최근의 거대한 암컷은 날개 길이가 2.53미터 (0.3 피트)인 것으로 보고된다.[4][5] 표준 측정 기준으로 날개 길이는 55.2~71.1 센티미터 (21.7~28.2 인치), 꼬리는 25~33 센티미터 (9.8~13 인치), 발목뼈는 9.2~10.1 센티미터 (3.6~4.0 인치), 부리는 6~6.5 센티미터 (2.4~2.6 인치)에 이른다.[2][6] 그린란드계 수리종은 다른 개체수의 종들에 비해 일반적으로 더 큰 것으로 조사되었다.[2] 흰꼬리수리는 전 세계에서 4번째로 큰 수리종이자[7], 평균적으로 4번째로 무거운 수리종으로 간주된다.[2][8]
일부 종들은 25년 이상 생존하는 것으로 알려져 있으며[9] 평균적으로 21년 간 생존한다.[7]
이러한 대형 수리종은 북유럽과 북아시아에 서식한다. 유럽에서는 노르웨이 연안에 가장 많이 서식하고 있다. 2008년 개체 수 조사에서는 9,000~11,000 쌍의 개체가 살고 있다.[7] 일부 분리 거주하는 개체들은 남서쪽 끝의 그린란드와 아이슬란드 서부에서 발생한다. 전자는 커다란 크기의 신체 비율에 따라 groenlandicus라는 아종으로 제안되었다. 그러나 이 종들은 현재 단형으로 간주되며 베르그만의 법칙에 따라 크기의 다양성이 연속 변이적이다.[10] 최근의 미토콘드리아 DNA 연구가 이 개념을 견지하고 있다.[11]
흰꼬리수리의 먹이는 다양하고 기회주의적 먹이 습성을 보이며 계절성을 띈다. 먹이에는 물고기, 새, 포유동물이 포함된다. 많은 수가 청소동물로 살아가며 일상적으로 수달, 가마우지를 포함한 맹금류들이 잡은 먹이를 가로채 먹기도 한다.[2] 겨울 동안에는 물고기 및 조류, 포유류의 사체를 먹는데, 거기에다 고래부터 가축, 심지어는 사후의 인간까지도 무엇이든 선호한다.[2][12] 이들은 회색 늑대 따위의 가장 큰 육식 포유동물들은 제외하더라도 전반적으로 보면 지배적인 청소 동물이다.[2] 그러나 이 수리종은 강력한 사냥꾼이기도 하다. 스코틀랜드에서 이 종의 먹이는 동지역성의 검독수리의 먹이와 상당히 다르며 노르웨이의 사례에서도 마찬가지이다.[2] 흰꼬리수리가 날마다 먹어야 하는 음식의 양은 500~600그램이다.[13] 일반적으로 검독수리에 비해 덜 활발한 사냥꾼이긴 하지만 음식을 두고 싸우는 일은 개개의 수리마다 다르다. 개체 수가 많은 지역에 생존할 수 있으며 일반적으로 검독수리의 수를 초과하는데, 이는 창자가 더 길고 더 효율적인 소화 계통을 지니고 있어서 음식을 덜 먹어도 더 잘 살 수 있기 때문이다.[14]
흰꼬리수리는 4~5년이 되면 성적으로 성숙한 상태가 된다.
둥지는 커다란 조직의 나무 막대기들 안이나 해안 절벽 위에 위치한다. 이들의 세력권에 대한 믿음으로 말미암아 한번 둥지를 틀면 둥지는 종종 재사용되는데 , 이따금 여러 세대에 걸쳐 수십년 간 사용하고 아이슬란드의 한 둥지의 경우 150년 넘게 사용한 일이 있다.[15]
흰꼬리수리의 세력권은 30~70km² 범위이며 거의 바닷가를 끼고 살지만 가끔은 큰 호수나 강 가까이에도 볼 수 있다. 이들의 세력권은 검독수리의 세력권과 겹치기도 하지만 이 종들 간의 싸움은 제한적이다. 이는 검독수리는 산악과 황무지를 선호하는 반면 흰꼬리수리는 해안과 바다를 선호하기 때문이다. 다 큰 흰꼬리수리는 자연 상 천적은 없으므로 정점 포식자로 간주된다.
알은 해마다 1~3개를 낳는데 그 주기는 3~4월에 2~5일 간격이며, 또, 38일 간 양 부모가 알을 품는다. 한번 부화하면 새끼들은 다른 새끼들에게 매우 관대하지만, 첫 부화한 새끼는 종종 더 크며 먹이를 받아먹는 횟수가 더 많다. 암컷이 주로 알을 품고 직접 먹이를 먹이며 수컷이 간혹 그 일을 넘겨 받는다. 새끼들은 5~6주 간 성장한 뒤 먹이를 먹을 수 있으며 11~12 주 쯤 되어 날 수 있게 되어 둥지 가까운 곳에서 떠나지 않는다. 그 뒤 6~10주 간 더 부모들이 돌본다. 새끼새의 성별은 영역법이나 DNA를 사용하여 식별이 가능하다.[16]
오크니 제도(스코틀랜드)에서 흰꼬리수리의 뼈들이 6,000년 된 흙 무덤들에서 발견되었는데, 이는 새들이 그곳의 선사시대 사람들에게 숭배의 대상이 되었음을 의미한다.[7]
흰꼬리수리(영어: White-tailed Eagle)는 수리과에 속하며 학명은 Haliaeetus albicilla이다. 몸길이는 69-94cm로 목이 황갈색이고, 꼬리는 흰색이며, 나머지는 갈색이다. 새끼는 몸이 갈색이고 부리와 발은 노랗다. 해안·습지·호수 및 큰 하천가에 서식하며 연어·송어 같은 어류, 토끼·쥐·오리·물떼새·도요새·까마귀 같은 포유류와 작은 조류를 먹는다. 암컷은 흰색 또는 회백색 알을 1-4개 낳는다. 혼자 생활하지만 번식이 끝난 뒤에는 어린 새와 같이 다니기도 한다. 유라시아대륙 전역에 걸쳐 폭넓게 분포하며 한국에서는 겨울에 볼 수 있으며 환경부 지정 멸종위기 1급인 동물이다.