ar
الأسماء في صفحات التنقل

Els micobacteris (Mycobacterium) són l'únic gènere de la família eubacteriana de les micobacteriàcies (Mycobacteriaceae).
Els micobacteris (Mycobacterium) són l'únic gènere de la família eubacteriana de les micobacteriàcies (Mycobacteriaceae).
Mycobacterium (mykobakterie) je rod nepohyblivých a nesporulujících bakterií ze samostatné čeledi Mycobacteriaceae, řazené k aktinobakteriím. Jsou většinou považovány za grampozitivní. Mají však komplexní buněčnou stěnu, předpona myko- odkazuje na fakt, že jejich buněčná stěna obsahuje vosky. Mykobakterie rostou obecně poměrně pomalu, jsou acidorezistentní („acid fast“), tzn. zbarvení vyvolané činidly se nedá vymýt kyselinami. Používá se barvení podle Ziehl-Neelsena. Pěstují se často na Šulově půdě.
K rodu patří asi sto druhů, mnoho je medicínsky významných.[1] Rod totiž zahrnuje některé význačné patogeny, jako je např. M. tuberculosis (původce TBC) a M. leprae (původce lepry), dále však též M. avium complex, M. kansasii, M. abscessus a další.[1]
V tomto článku byl použit překlad textu z článku Mycobacterium na anglické Wikipedii.
Mycobacterium (mykobakterie) je rod nepohyblivých a nesporulujících bakterií ze samostatné čeledi Mycobacteriaceae, řazené k aktinobakteriím. Jsou většinou považovány za grampozitivní. Mají však komplexní buněčnou stěnu, předpona myko- odkazuje na fakt, že jejich buněčná stěna obsahuje vosky. Mykobakterie rostou obecně poměrně pomalu, jsou acidorezistentní („acid fast“), tzn. zbarvení vyvolané činidly se nedá vymýt kyselinami. Používá se barvení podle Ziehl-Neelsena. Pěstují se často na Šulově půdě.
K rodu patří asi sto druhů, mnoho je medicínsky významných. Rod totiž zahrnuje některé význačné patogeny, jako je např. M. tuberculosis (původce TBC) a M. leprae (původce lepry), dále však též M. avium complex, M. kansasii, M. abscessus a další.
Die Mykobakterien (Mycobacterium) bilden eine Gattung bestehend aus ca. 100 Arten. Sie sind die einzigen Vertreter der Familie Mycobacteriaceae. Zu ihnen gehören als Auslöser von Mykobakteriosen sowohl Krankheitserreger des Menschen wie Mycobacterium tuberculosis (Tuberkulose) und Mycobacterium leprae (Lepra) als auch Krankheitserreger von Tieren wie der Erreger der Rindertuberkulose (Mycobacterium bovis). Daneben gibt es aber auch freilebende Arten.
Mykobakterien sind mit der Gram-Färbung schlecht anzufärben, ihr Zellwandaufbau entspricht aber weitgehend dem Wandaufbau grampositiver Bakterien, d. h. die Zellwand besitzt keine äußere Membran und besteht aus einem mehrschichtigen Peptidoglykan (Murein). Die Einordnung zu den grampositiven Bakterien wurde auch durch RNA-Analysen bestätigt. Aufgrund des hohen GC-Gehaltes in ihrer DNA werden sie zu den Actinobacteria, einer Abteilung von grampositiven Bakterien, gestellt.
Mykobakterien sind immer auf Sauerstoff angewiesen (obligat aerob) und benötigen organische Stoffe zum Energiegewinn (chemoorganotroph). Sie sind meist stäbchenförmig und bilden nur selten in älteren Kulturen Verzweigungen, die dann oft wieder in Kokken (Kugelbakterien) oder Stäbchen zerfallen. Im Gegensatz hierzu bildet die Mehrzahl der Aktinomyzeten verzweigte Mycelien, die den von Pilzen gebildeten Mycelien gleichen, man spricht von den filamentösen Aktinomyzeten. Auf dieser Eigenschaft beruht auch der Name, Aktinomyzeten bedeutet soviel wie „Strahlenpilze“ (griechisch „aktis“ für Strahl und „mykes“ für Pilz).
Eines der Hauptmerkmale von Mykobakterien ist, dass ein Großteil der Zellwandbestandteile als Antigenkomponenten wirkt. Sie rufen in Wirtsorganismen eine Immunreaktion hervor und führen zu einer Allergie vom Spättyp (Typ IV). Die bekannteste Reaktion ist die Tuberkulinreaktion.
Charakteristisch sind der hohe Lipidgehalt der Zellwand, die Mykolsäuren, die Phthiocerol-Außenhülle und speziell bei Mycobacterium tuberculosis und Mycobacterium bovis der Cord-Faktor, die Verbindungen der Mykolsäuren mit dem Disaccharid Trehalose. Durch den Cord-Faktor kommt es zu dem schnur- oder zopfartigen Wachstum in älteren Kulturen.
Die sehr hohe Säurefestigkeit (engl.: acid-fast) kommt durch die langkettigen Mykolsäuren zustande. An jeder 10. N-Acetylmuraminsäure (welches zum Rückgrat des Peptidoglycan gehört) ist ein Arabinogalaktankomplex gebunden. Dieser besteht aus einem linearen Galaktose-Strang und ist verzweigt mit Arabinose-Ketten. An diese Komplexe sind wiederum Mykolsäuren gebunden. Nicht kovalent an die nach außen zeigenden Mycolsäuren geheftet ist schließlich die DIM/DIP-Schicht.[1]
Die Zellwand der Mykobakterien hat demnach so etwas wie einen weiteren äußeren Bilayer.
Aufgrund dieses Zellwandaufbaus besitzen Mykobakterien eine sehr hohe Widerstandsfähigkeit. Dies bewirkt, dass die obligat parasitären Mykobakterien auch in der freien Natur unter günstigen Bedingungen mehrere Monate infektionsfähig bleiben[2] und mit wenigen Ausnahmen (z. B. Streptomycin oder Kanamycin) gegen die meisten Antibiotika resistent sind. Auch gegen die meisten Laugen und Säuren sind sie widerstandsfähiger als andere Bakterien. Die Säurefestigkeit ist durch die Ziehl-Neelsen-Färbung nachweisbar. Die Bakterienzellen lassen sich nach Einfärbung mit Anilinfarbstoffen (z. B. Karbolfuchsin) mit Säure nicht mehr entfärben, ein Effekt, den Paul Ehrlich in Zusammenarbeit mit Robert Koch im Jahre 1882 erstmals bemerkte. Die Säurefestigkeit tritt nur bei wenigen Bakteriengattungen, wie Nocardia, Rhodococcus und Corynebacterium, auf.
Mykobakterien nutzen u. a. Triacylglycerine (Neutralfette, TAGs) als Reservestoffe.[3] Diese Neutralfette werden in Granula, so genannten „fat bodies“, innerhalb des Zellkörpers angehäuft.[4] Triacylglycerine als Speicherlipide sind bei Eukaryoten, wie Hefen oder Pilze, weit verbreitet, unter den Bakterien sind sie allerdings seltener anzutreffen. Vor allem bei den Actinomycetales, wie Mycobacterium, Streptomyces, Rhodococcus und Nocardia, ist die intrazelluläre Akkumulation von TAGs nachgewiesen.[5] Auch bestimmte Wachse, so genannte Wachsester, werden von einigen Vertretern der Actinomycetalen als Speicherstoffe genutzt.[5] Bei den Mykobakterien wurden sie z. B. bei Mycobacterium tuberculosis gefunden. Wachsester als Reservestoffe treten im Bakterienreich eher selten auf, außer bei den Actinomycetales wurden sie z. B. noch bei Moraxella und Alcanivorax, beides den Proteobakterien zugehörig, nachgewiesen.[5] Wachsester als Reservestoffe sind bei den Eukaryoten kaum anzutreffen, z. B. in Samen der Jojoba-Pflanze. Auch Glykogen und Trehalose werden als mögliche Speicherstoffe der Mykobakterien angesehen.[4]
Bei verschiedenen Mycobakterien (darunter auch Mycobacterium tuberculosis) ist der Citratzyklus verändert: die E1-Untereinheit der Ketoglutarat-Dehydrogenase ist durch eine Ketoglutarat-Decarboxylase ersetzt, die unabhängig von Coenzym A zunächst Succinat-Semialdehyd produziert, welches von einer NADP+-abhängigen Succinat-Semialdehyd-Dehydrogenase zu Succinat dehydriert wird.[6]
Nur wenige der rund 100 Arten sind als Parasiten auf einen Wirt als Lebensort angewiesen. Die Mehrzahl der Arten leben im Gegensatz zu dem meist auf die Wirte angewiesenen Mycobacterium tuberculosis-Komplex frei in der Umwelt und sind nicht krankheitserregend (apathogen). Diese Arten werden den nichttuberkulösen, apathogenen Mykobakterien zugerechnet. Man nimmt an, dass der größte Teil der Arten saprophytisch ist, d. h. von der Zersetzung toter organischer Stoffe lebt. Sie wurden in Böden und Grundwasser, Staub sowie Süß- und Meerwasser nachgewiesen.[7]
Beispiele für im Boden vorkommende Mykobakterien sind der Mycobacterium terrae-Komplex (M. terrae, M. triviale und M. nonchromogenicum) und M. fortuitum.[7] Letzteres wurde auch aus Meerwasser isoliert, weitere im Meer gefundene Arten sind Mycobacterium chelonae, M. marinum und M. gordonae. Einige Arten kommen in durch menschlichen Einfluss entstandenen künstlichen Umgebungen wie Abwasser, Klärschlamm oder Trinkwasser vor.[7] Im Trinkwasser wurden häufig Arten wie Mycobacterium gordonae, M. chelonae subsp. chelonae und M. flavescens nachgewiesen. Die im Englischen auch unter dem Namen „tap water bacillus“ bekannte Art M. gordonae ist im Trinkwasser das wohl häufigste Mykobakterium. Einige Arten, wie M. kansasii und M. avium, sind sogar in der Lage, sich in aufbereitetem (destilliertem) Trinkwasser zu vermehren, und lassen sich schlecht aus infizierten Leitungswassersystemen wieder entfernen, wodurch sie auch in Krankenhäusern eine erhebliche Gefahr darstellen.[7] Im Abwasser fand man ähnliche Artenzusammensetzungen wie in Böden und Süßwasser. Wie oben schon erwähnt, können die nur in den Wirtszellen Wachstum zeigenden, obligat pathogenen Arten des Mycobacterium tuberculosis-Komplexes außerhalb des Wirtes eine Zeitlang überleben. Im Kot von Rindern soll Mycobacterium bovis bis zu 13 Tage wachstumsfähig sein.[2]
Die meisten Vertreter des obligat pathogenen Mycobacterium tuberculosis-Komplexes (etwa Mycobacterium tuberculosis, Mycobacterium bovis, Mycobacterium africanum oder Mycobacterium microti) leben als obligat intrazelluläre Parasiten in Makrophagen. Virulenzfaktoren sind nicht bekannt, allerdings schützt ihr besonderer Wandaufbau, der wachsartige Substanzen und Mykolsäuren enthält, vor äußeren Einflüssen. Die Lipide der Zellwand sind auch Ursache der charakteristischen Säurefestigkeit. Der Wandaufbau verhindert einen schnellen Stoffaustausch mit der Umgebung und verursacht dadurch ein nur langsames Wachstum und langsame Vermehrung. Dieses im Vergleich zu anderen Bakterien äußerst langsame Wachstum ist charakteristisch für alle Mykobakterien.
Weiters ist für die Mitglieder des Mtb-Komplexes zwar kein Lebenszyklus als Bodenbakterium nachgewiesen, die Fähigkeit allerdings, in Amöben beziehungsweise ihnen anhängenden Zysten überleben zu können, haben sie nicht verloren. Vielmehr ist es diese Eigenschaft der Mykobakterien allgemein, die es den Mtb-complex-Mitgliedern erleichterte, in den (amöbenähnlichen) Fresszellen ihrer Wirte schlafend lange Zeit ohne Zellteilung zu überdauern (latente Infektion).[8]
In Bezug auf die Wachstumsgeschwindigkeit werden die Mykobakterien in zwei Gruppen unterteilt: Die langsamwachsenden („slow growers“) mit einer Generationszeit von 6–24 Stunden in Laborkulturen und die schnellwachsenden („rapid growers“) mit einer Generationszeit von 1–4 Stunden. Zum Vergleich: Die Generationszeit von Escherichia coli beträgt in Laborkulturen unter günstigen Bedingungen 20 Minuten. Schnell wachsende Mykobakterien bilden innerhalb einer Woche makroskopisch sichtbare Kolonien, langsam wachsende benötigen hierfür bis zu 8 Wochen. Unter den langsam wachsenden Mykobakterien sind die meisten (obligaten oder fakultativen) Krankheitserreger zu finden, viele der „rapid growers“ sind apathogen. Die Unterteilung in langsam und schnell wachsende Mykobakterien ist auch phylogenetisch relevant, sie spiegelt evolutionäre Verwandtschaftsverhältnisse wider.[4]
Die Mykobakterien zählen zu der Ordnung Actinomycetales. Ihrer Gestalt nach sind Mykobakterien zwischen den Corynebakterien und den Proactinomyceten (Aktinomyzeten die kein dauerhaftes Mycel bilden wie z. B. Nocardia) einzuordnen, enge Verwandtschaftsverhältnisse bestehen auch zu Rhodococcus und Caseobacter (jetzt zu Corynebacterium gestellt).[4]
Die Gattung wird taxonomisch in drei Gruppen unterteilt:
Nach Runyon erfolgt die Unterteilung der Mykobakterien nach Wachstumsgeschwindigkeit und Pigmentbildung bei Belichtung (sogenannte Photochromogenität). Das Pigmentverhalten ist allerdings phylogenetisch nicht relevant.
Der gesamte Mycobacterium tuberculosis-Komplex und Mycobacterium leprae zählen zu der Gruppe III. Apathogene, nicht krankheitserregende Mykobakterien wie M. moriokaense stammen überwiegend aus der Gruppe der schnellwachsenden, nichttuberkulösen Mykobakterien (Gruppe IV).[9]
Der Mycobacterium tuberculosis-Komplex:
Einige nichttuberkulöse Mykobakterien (NTM):
Folgende Arten gelten als apathogen, d. h. bis jetzt wurden sie noch nicht mit Krankheiten des Menschen in Verbindung gebracht. Alle hier aufgelisteten Arten zählen zu den schnellwachsenden Mykobakterien (Gruppe IV):[9]
Einige der normalerweise freilebenden Bakterien können unter Umständen bei Menschen mit geschwächtem Immunsystem Krankheiten verursachen (pathogene nichttuberkulöse Mykobakterien). Einige sind auch gefährliche Krankheitserreger bei Tieren und können in der Tierhaltung bzw. Landwirtschaft große Probleme verursachen.
Viele der um die 100 beschriebenen Arten sind für Menschen apathogen oder nur sehr selten krankheitserregend. Andere sind fakultativ pathogen, sie sind nur unter bestimmten Umständen, zum Beispiel bei geschwächtem Immunsystem, für den Menschen gefährlich. Keine der pathogenen Arten (außer M. tuberculosis) wird von Mensch zu Mensch übertragen. Viele Arten kommen in Böden vor und sind saprophytisch. Zu den nur sehr selten krankheitserregenden Mykobakterien zählen zum Beispiel Mycobacterium triviale, M. gordonae und M. nonchromogenicum.
In der Landwirtschaft beziehungsweise Tierhaltung hat Mycobacterium bovis die größte wirtschaftliche Bedeutung unter den Mykobakterien. Weitere in der Landwirtschaft wichtige Arten sind Mycobacterium avium, M. paratuberculosis (bzw. Mycobacterium avium subsp. paratuberculosis) und auch Mycobacterium tuberculosis. Mycobacterium avium kann die Geflügeltuberkulose bei Puten, Hühner, Tauben und anderen Vögeln auslösen, selten tritt das Bakterium auch bei Schweinen, Pferden und Rindern auf. Auch M. tuberculosis kann bei Hunden, Katzen, Schweinen und Rindern Tuberkulose auslösen. M. paratuberculosis, jetzt als Unterart von Mycobacterium avium geführt, ist der Erreger der Paratuberkulose (Johnsche Krankheit) der Rinder. Für den Menschen ist M. paratuberculosis ungefährlich, während M. avium und M. intracellulare auch pathogen für den Menschen sein können und beispielsweise Lungenkrankheiten verursachen. Mycobacterium avium und Mycobacterium avium ssp. paratuberculosis bilden mit M. intracellulare den „Mycobacterium avium complex“ (MAC).
Derzeit kennt man zwei Wege wie Mykobakterien Zellen infizieren können: Die lytische und die nicht-lytische Infektion von Zellen.
Bei der lytischen Infektion werden die Bakterien von Phagozyten in die Endosomen aufgenommen, um dort zu überdaueren oder sich zu vermehren. In letzterem Fall gelangen sie ins Zytosol und induzieren die Lyse der Wirtszellen, die hierbei zugrunde geht. Die freigesetzten Mykobakterien können anschließend weitere Zellen infizieren.
Neben dem bekannten Ablauf der lytischen Infektion wurde 2009 bei M. tuberculosis und M. marinum ein weiterer Infektionsweg, die nicht-lytische Infektion oder nicht-lytische Ausschleusung entdeckt.[13] Hierbei werden sogenannte Ejektosomen benutzt, mit Aktinfilamenten angereicherte Regionen der Membran: Durch diese Filamentkomplexe können die Bakterien die Wirtszelle verlassen, ohne dass ein für diese tödliches Leck in der Membran entsteht.
Beim lytischen Infektionsweg werden die Bakterien freigesetzt und können so mit Antibiotika erfolgreich bekämpft werden. Dagegen liegt die medizinische Bedeutung der nicht-lytischen Infektion darin, dass die Bakterien sich im Gewebe von Zelle zu Zelle verbreiten können, ohne dabei von den derzeit verfügbaren Arzneistoffen behelligt zu werden.
Zu dem aufgrund von rRNA-Analysen erstellten Mycobacterium tuberculosis (Mtu)-Komplex zählen Mycobacterium tuberculosis, M. africanum, M. bovis, M. microti und M. canettii. In den letzten Jahren wurden weiterhin die Arten M. caprae (früher als die Unterart Mycobacterium tuberculosis subsp. caprae geführt) und M. pinnipedii zu dieser Gruppe gestellt.[14] Auch der von M. bovis erzeugte Impfstamm Bacillus Calmette-Guérin (BCG) zählt zu dem Komplex.
Aufgrund der Untersuchung von VNTRs wird angenommen, dass sich die Stämme des Mtu-Komplexes frühestens vor etwa 40000 Jahren aus dem Urahn des Mtu-Komplexes entwickelt haben und mit dem Menschen in die unterschiedlichen Regionen verteilt wurden. Weiterhin ist daraus zu schließen, dass sich die die Tiere infizierenden Stämme aus Stämmen entwickelt haben, die den Menschen infizierten, die Übertragung also vom Menschen ausging.[14][15]
Die Übertragung von Mycobacterium tuberculosis erfolgt durch Tröpfcheninfektion. Mycobacterium tuberculosis kann auch von Menschen auf Tiere übertragen werden. Beim Menschen sind neben den von Mycobacteriumn tuberculosis verursachten Erkrankungen nur die von M. bovis und M. africanum verursachten von nennenswerter Häufigkeit, die anderen Vertreter des Mycobacterium tuberculosis-Komplexes lösen nur sehr selten Tuberkulosen beim Menschen aus.[16]
Der Mensch ist bei dem Komplex nur für Mycobacterium tuberculosis, M. africanum und M. canettii der primäre Hauptwirt.[17] Die anderen Bakterienarten des Komplexes sind primär für Tiere pathogen, können aber auch auf den Menschen übertragen werden und, vor allem wenn eine Immunschwäche vorliegt, humanpathogen wirken und eine Tuberkulose auslösen. Bei diesen Infektionen handelt es sich also um Zoonosen, auch eine sekundäre Übertragung von Menschen zu Tieren ist möglich. Mycobacterium africanum ist ein in Afrika häufig auftretender Tuberkuloseerreger, eventuell ist diese Art jedoch eine Variante von Mycobacterium tuberculosis. Mycobacterium bovis ist ein bei Rindern auftretender Parasit und Erreger der Rindertuberkulose, die aber auf Menschen übertragen werden kann, z. B. durch Aufnahme von nicht pasteurisierter Milch. Mycobacterium microti ist der Verursacher der Tuberkulose bei Wühlmäusen und kann von hier aus auf den Menschen als Tuberkuloseerreger übertragen werden. Mycobacterium pinnepedii ist pathogen für Robben (Robbentuberkulose) und Mycobacterium caprae für Ziegen, eine Übertragung auf den Menschen ist selten.[17]
Die nichttuberkulösen Mykobakterien (NTM) wirken nur selten (meist bei Menschen mit stark geschwächtem Immunsystem) krankheitserregend, sie gelten als fakultativ pathogen. Von einigen wurden bis jetzt noch keine durch sie ausgelöste Erkrankungen nachgewiesen, sie gelten als apathogen.
Den nichttuberkulösen Mykobakterien wurde erst lange Zeit nach der Beschreibung von Mycobacterium tuberculosis und M. leprae in der Medizin Beachtung geschenkt. Vor allem das in den letzten Jahren stark vermehrte Auftreten der Immunschwächekrankheit AIDS führte zu einer Häufung der durch nichttuberkulöse Mykobakterien verursachten Erkrankungen. Bei Infektionen erzeugen diese Arten zum größten Teil nicht-tuberkulöse Lungenentzündungen, Hauterkrankungen (z. B. Buruli-Ulkus durch die in den Tropen und Australien auftretende Art M. ulcerans) und Befall der Lymphknoten.
Weitere Bezeichnungen für diese Gruppe sind u. a. Mycobacteria other than tuberculosis (MOTT) und „atypische Mykobakterien“. Da sie frei in der Umwelt vorkommen, werden sie auch als „Potentiell pathogene Umwelt (environmental) -Mykobakterien“ (PPUM bzw. PPEM) bezeichnet.
Eine direkte Übertragung von Mensch zu Mensch ist in der Regel nicht möglich. Die Infektion erfolgt meist über infizierte Materialien oder aerogen (Tröpfcheninfektion). Die nichttuberkulösen Mykobakterien sind oft unempfindlich gegen Medikamente, mit denen man die Tuberkulose behandelt (Antituberkulotika) und weisen generell eine hohe Resistenz gegenüber Fremdeinflüssen auf.
Einige pathogene Arten der Gruppe I: Mycobacterium kansasii kann nicht-tuberkulöse Lungenkrankheiten hervorrufen, Humaninfektionen von Mycobacterium marinum können z. B. in Schwimmbädern erfolgen und verursachen Granulome (Schwimmbadgranulome). Zu den pathogenen Arten der Gruppe II zählt Mycobacterium scrofulaceum, der weltweit verbreitete Erreger der Lymphadenitis.
Arten der Gruppe III sind Mycobacterium malmoense (kann Erkrankungen der Lunge hervorrufen), Mycobacterium avium (Auslöser der Geflügeltuberkulose bei Hühnern, Puten, Tauben und anderen Vögeln, selten infiziert es auch Schweine, Rinder oder Pferde). Bei Menschen kann es Lungenerkrankungen und (bei Kindern) Lymphadenitis auslösen. Mycobacterium avium ist das am häufigsten auftretende pathogene Mykobakterium bei AIDS-Patienten und wird zusammen mit Mycobacterium intracellulare, dem aufgrund von genetischen Untersuchungen begründeten Mycobacterium avium-Komplex (MAC) zugeordnet. Bei dem Mycobacterium avium-intracellulare-scrofulaceum-Komplex (MAIS) wird zusätzlich die Art Mycobacterium scrofulaceum hinzugestellt. M. ulcerans ruft das Buruli-Ulkus aus, eine in den Tropen auftretende Hautkrankheit.
Pathogene Arten der Gruppe IV sind Mycobacterium chelonae, das Haut- oder Weichteilerkrankungen, Abszesse und auch Knochen- oder Gelenkerkrankungen hervorruft. Wie Mycobacterium fortuitum, ebenfalls zu der Gruppe IV zählend, besitzt es eine hohe Resistenz gegen Desinfektionslösungen und ist somit eine mögliche Infektionsgefahr in der Klinik beim Einsatz von Implantaten.
Die Mykobakterien (Mycobacterium) bilden eine Gattung bestehend aus ca. 100 Arten. Sie sind die einzigen Vertreter der Familie Mycobacteriaceae. Zu ihnen gehören als Auslöser von Mykobakteriosen sowohl Krankheitserreger des Menschen wie Mycobacterium tuberculosis (Tuberkulose) und Mycobacterium leprae (Lepra) als auch Krankheitserreger von Tieren wie der Erreger der Rindertuberkulose (Mycobacterium bovis). Daneben gibt es aber auch freilebende Arten.
Mykobakterien sind mit der Gram-Färbung schlecht anzufärben, ihr Zellwandaufbau entspricht aber weitgehend dem Wandaufbau grampositiver Bakterien, d. h. die Zellwand besitzt keine äußere Membran und besteht aus einem mehrschichtigen Peptidoglykan (Murein). Die Einordnung zu den grampositiven Bakterien wurde auch durch RNA-Analysen bestätigt. Aufgrund des hohen GC-Gehaltes in ihrer DNA werden sie zu den Actinobacteria, einer Abteilung von grampositiven Bakterien, gestellt.
Las micobacterias o micobactèris son un genre d'Actinobacteria, avent sa familha pròpria, las Mycobacteriaceae. Lo genre inclutz de bacterias patogènas conegudas per provocar de malautiás grèvas dins los mamifèrs, coma la tuberculòsi e la lèpra[1]. Lo prefixe grèc myco significa a l'encòp « campairòl » e « cera »; s'utiliza aici per caracterizar los compausats cerós de la paret cellulara.
Las micobacterias o micobactèris son un genre d'Actinobacteria, avent sa familha pròpria, las Mycobacteriaceae. Lo genre inclutz de bacterias patogènas conegudas per provocar de malautiás grèvas dins los mamifèrs, coma la tuberculòsi e la lèpra. Lo prefixe grèc myco significa a l'encòp « campairòl » e « cera »; s'utiliza aici per caracterizar los compausats cerós de la paret cellulara.
Микобактерии се голема група на грампозитивни еубактерии, од кои најпознати се Mycobacterium tuberculosis, причинител на инфективното заболување туберкулоза, потоа Mycobacterium leprae, предизвикувач на лепра, додека останатите припадници на овој род се именувани како нетуберкулозни, атипични или сапрофитни микобактерии. Основни одлики на микобактериските клетки се:
Микобактерии се голема група на грампозитивни еубактерии, од кои најпознати се Mycobacterium tuberculosis, причинител на инфективното заболување туберкулоза, потоа Mycobacterium leprae, предизвикувач на лепра, додека останатите припадници на овој род се именувани како нетуберкулозни, атипични или сапрофитни микобактерии. Основни одлики на микобактериските клетки се:
Специфична градба на клеточниот ѕид, односно присуство на миколински киселини. Посебна особина на задржување на кисел алкохол во клеточниот ѕид, врѕ основа на која се врши селективно боење по Цил-Нилсен. Висока процентуална ѕастапеност на G+C парот во нуклеинската киселина на истите (62-70 % mol).
माइकोबैक्टीरियम (Mycobacterium) ऐक्टीनोबैक्टीरिया का एक जीववैज्ञानिक वंश है जो माइकोबैक्टीरियेसी (Mycobacteriaceae) कुल का एकमात्र सदस्य है। इस वंश में 190 से अधिक ज्ञात जातियाँ सम्मिलित हैं।[1] कई जातियाँ स्तनधारियों में गम्भीर बीमारियों की रोगजनक हैं, मसलन मानवों में तपेदिक और कोढ़ करने वाले बैक्टीरिया इसी वंश के सदस्य हैं।[2]
"माइको" (myco) यूनानी भाषा में फफूंद (फ़ंगस) के लिए प्रयोगित शब्द है। माइकोबैक्टीरिया की कई जातियाँ प्रयोगशाला में फफूंद की तरह उगती हुई दिखती हैं, जिस से उनका नाम पड़ा।[3]
माइकोबैक्टीरियम (Mycobacterium) ऐक्टीनोबैक्टीरिया का एक जीववैज्ञानिक वंश है जो माइकोबैक्टीरियेसी (Mycobacteriaceae) कुल का एकमात्र सदस्य है। इस वंश में 190 से अधिक ज्ञात जातियाँ सम्मिलित हैं। कई जातियाँ स्तनधारियों में गम्भीर बीमारियों की रोगजनक हैं, मसलन मानवों में तपेदिक और कोढ़ करने वाले बैक्टीरिया इसी वंश के सदस्य हैं।
మైకోబాక్టీరియా (లాటిన్ Mycobacteria) ఒక రకమైన వ్యాధి కారకమైన బాక్టీరియా. ఇది మైకోబాక్టీరియేసి కుటుంబానికి చెందినది.
ఈ క్రిములు జంతువులలో క్షయ, కుష్టు వంటి ప్రమాదకరమైన వ్యాధులు కలిగిస్తాయి.[1] లాటిన్ లో "మైకో" అనగా శిలీంద్రం, మైనం; ఇది బాక్టీరియా కణత్వచంలో ఉండే మైనపు పొరను ఉద్దేశించినది.
మైకోబాక్టీరియా ఆమ్ల ద్రావణాల వలన ప్రభావం చెందవు (acid-fast or acid-resistant).[2] వీటిని గుర్తించడానికి ఉపయోగించే రంజనాలు: ఫైట్ రంజనం (Fite's stain), జీల్-నీల్సెన్ రంజనం (Ziehl-Neelsen stain) మొదలైనవి.
మైకోబాక్టీరియా (లాటిన్ Mycobacteria) ఒక రకమైన వ్యాధి కారకమైన బాక్టీరియా. ఇది మైకోబాక్టీరియేసి కుటుంబానికి చెందినది.
ఈ క్రిములు జంతువులలో క్షయ, కుష్టు వంటి ప్రమాదకరమైన వ్యాధులు కలిగిస్తాయి. లాటిన్ లో "మైకో" అనగా శిలీంద్రం, మైనం; ఇది బాక్టీరియా కణత్వచంలో ఉండే మైనపు పొరను ఉద్దేశించినది.
గుర్తించే విధానంమైకోబాక్టీరియా ఆమ్ల ద్రావణాల వలన ప్రభావం చెందవు (acid-fast or acid-resistant). వీటిని గుర్తించడానికి ఉపయోగించే రంజనాలు: ఫైట్ రంజనం (Fite's stain), జీల్-నీల్సెన్ రంజనం (Ziehl-Neelsen stain) మొదలైనవి.
Fûn-kî-hon-khiûn (Mycobacterium) su̍k Fong-sien Khiûn-mùn.
Mycobacterium is a genus of over 190 species in the phylum Actinomycetota, assigned its own family, Mycobacteriaceae. This genus includes pathogens known to cause serious diseases in mammals, including tuberculosis (M. tuberculosis) and leprosy (M. leprae) in humans. The Greek prefix myco- means 'fungus', alluding to this genus' mold-like colony surfaces.[3] Since this genus has cell walls with a waxy lipid-rich outer layer that contains high concentrations of mycolic acid,[4] acid-fast staining is used to emphasize their resistance to acids, compared to other cell types.[5]
Mycobacterial species are generally aerobic, non-motile, and capable of growing with minimal nutrients. The genus is divided based on each species' pigment production and growth rate.[6] While most Mycobacterium species are non-pathogenic, the genus' characteristic complex cell wall contributes to evasion from host defenses.[7]
Mycobacteria are aerobic with 0.2-0.6 µm wide and 1.0-10 µm long rod shapes. They are generally non-motile, except for the species Mycobacterium marinum, which has been shown to be motile within macrophages.[8] Mycobacteria possess capsules and most do not form endospores. M. marinum and perhaps M. bovis have been shown to sporulate;[9] however, this has been contested by further research.[10] The distinguishing characteristic of all Mycobacterium species is a thick, hydrophobic, and mycolic acid-rich cell wall made of peptidoglycan and arabinogalactan, with these unique components offering targets for new tuberculosis drugs.[11]
Many Mycobacterium species readily grow with minimal nutrients, using ammonia and/or amino acids as nitrogen sources and glycerol as a carbon source in the presence of mineral salts. Temperatures for optimal growth vary between species and media conditions, ranging from 25-45 °C.[6]
Most Mycobacterium species, including most clinically relevant species, can be cultured in blood agar.[12] However, some species grow very slowly due to extremely long reproductive cycles, such as M. leprae requiring 12 days per division cycle compared to 20 minutes for some E. coli strains.[13]
Whereas Mycobacterium tuberculosis and M. leprae are pathogenic, most mycobacteria do not cause disease unless they enter skin lesions of those with pulmonary and/or immune dysfunction, despite being widespread across aquatic and terrestrial environments. Through biofilm formation, cell wall resistance to chlorine, and association with amoebas, mycobacteria can survive a variety of environmental stressors. The agar media used for most water testing does not support the growth of mycobacteria, allowing it to go undetected in municipal and hospital systems.[14]
Hundreds of Mycobacterium genomes have been completely sequenced.[15]
The genome sizes of mycobacteria range from (e.g. in M. leprae) to quite large ones, such as that as M. vulneris, encoding 6,653 proteins, larger than the ~6000 proteins of eukaryotic yeast.[16]
Mycobacterium tuberculosis can remain latent in human hosts for decades after an initial infection, allowing it to continue infecting others. It has been estimated that a third of the world population has latent tuberculosis (TB).[22] M. tuberculosis has many virulence factors, which can be divided across lipid and fatty acid metabolism, cell envelope proteins, macrophage inhibitors, kinase proteins, proteases, metal-transporter proteins, and gene expression regulators.[23] Several lineages such as M. t. var. bovis (bovine TB) were considered separate species in the M, tuberculosis complex until they were finally merged into the main species in 2018.[24]
The development of Leprosy is caused by infection with either Mycobacterium leprae or Mycobacterium lepromatosis, two closely related bacteria. Roughly 200,000 new cases of infection are reported each year, and 80% of new cases are reported in Brazil, India, and Indonesia.[25] M. leprae infection localizes within the skin macrophages and Schwann cells found in peripheral nerve tissue.
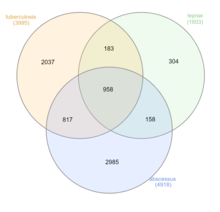
Nontuberculosis Mycobacteria (NTM), which exclude M. tuberculosis, M. leprae, and M. lepromatosis, can infect mammalian hosts. These bacteria are referred to as "atypical mycobacteria." Although person-to-person transmission is rare, transmission of M. abscessus has been observed between patients with cystic fibrosis.[26] The four primary diseases observed in humans are chronic pulmonary disease, disseminated disease in immunocompromised patients, skin and soft tissue infections, and superficial lymphadenitis. 80-90% of recorded NTM infections manifest as pulmonary diseases.[27]
M. abscessus is the most virulent rapidly-growing mycobacteria (RGM), as well as the leading cause of RGM based pulmonary infections. Although it has been traditionally viewed as an opportunistic pathogen like other NTMs, analysis of various virulence factors (VFs) have shifted this view to that of a true pathogen. This is due to the presence of known mycobacterial VFs and other non-mycobacterial VFs found in other prokaryotic pathogens.[27]
Mycobacteria have cell walls with peptidoglycan, arabinogalactan, and mycolic acid; a waxy outer mycomembrane of mycolic acid; and an outermost capsule of glucans and secreted proteins for virulence. It constantly remodels these layers to survive in stressful environments and avoid host immune defenses. This cell wall structure results in colony surfaces resembling fungi, leading to the genus' use of the Greek prefix myco-.[28] This unique structure makes penicillins ineffective, instead requiring a multi-drug antibiotic treatment of isoniazid to inhibit mycolic acid synthesis, rifampicin to interfere with transcription, ethambutol to hinder arabinogalactan synthesis, and pyrazinamide to impede Coenzyme A synthesis.[7]
Mycobacteria have historically been categorized through phenotypic testing, such as the Runyon classification of analyzing growth rate and production of yellow/orange carotenoid pigments. Group I contains photochromogens (pigment production induced by light), Group II comprises scotochromogens (constitutive pigment production), and the non-chromogens of Groups III and IV have a pale yellow/tan pigment, regardless of light exposure. Group IV species are "rapidly-growing" mycobacteria compared to the "slowly-growing" Group III species because samples grow into visible colonies in less than seven days.[6]
Because the International Code of Nomenclature of Prokaryotes (ICNP) currently recognizes 195 Mycobacterium species, classification and identification systems now rely on DNA sequencing and computational phylogenetics. The major disease-causing groups are the M. tuberculosis complex (tuberculosis), M. avium complex (mycobacterium avium-intracellulare infection), M. leprae and M. lepromatosis (leprosy), and M. abscessus (chronic lung infection).[3]
Microbiologist Enrico Tortoli has constructed a phylogentic tree of the genus' key species based on the earlier genetic sequencing of Rogall, et al. (1990), alongside new phylogentic trees based on Tortoli's 2017 sequencing of 148 Mycobacterium species:[38]

Gupta et al. have proposed dividing Mycobacterium into five genera, based on an analysis of 150 species in this genus. Due to controversy over complicating clinical diagnoses and treatment, all of the renamed species have retained their original identity in the Mycobacterium genus as a valid taxonomic synonym:[40][41]
The two most common methods for visualizing these acid-fast bacilli as bright red against a blue background are the Ziehl-Neelsen stain and modified Kinyoun stain. Fite's stain is used to color M. leprae cells as pink against a blue background. Rapid Modified Auramine O Fluorescent staining has specific binding to slowly-growing mycobacteria for yellow staining against a dark background. Newer methods include Gomori-Methenamine Silver staining and Perioidic Acid Schiff staining to color Mycobacterium avium complex (MAC) cells black and pink, respectively.[5]
While some mycobacteria can take up to eight weeks to grow visible colonies from a cultured sample, most clinically relevant species will grow within the first four weeks, allowing physicians to consider alternative causes if negative readings continue past the first month.[42]
Mycobacteria can be infected by mycobacteriophages, a class of viruses with high specificity for their targets. By hijacking the cellular machinery of mycobacteria to produce additional phages, such viruses can be used in phage therapy for eukaryotic hosts, as they would die alongside the mycobacteria. Since only some mycobacteriophages are capable of penetrating the M. tuberculosis membrane, the viral DNA may be delivered through artificial liposomes because bacteria uptake, transcribe, and translate foreign DNA into proteins.[43]
Mycosides are glycolipids isolated from Mycobacterium species with Mycoside A found in photochromogenic strains, Mycoside B in bovine strains, and Mycoside C in avian strains.[44] Different forms of Mycoside C have varying success as a receptor to inactivate mycobacteriophages.[45] Replacement of the gene encoding mycocerosic acid synthase in M. bovis prevents formation of mycosides.[46]
Mycobacterium is a genus of over 190 species in the phylum Actinomycetota, assigned its own family, Mycobacteriaceae. This genus includes pathogens known to cause serious diseases in mammals, including tuberculosis (M. tuberculosis) and leprosy (M. leprae) in humans. The Greek prefix myco- means 'fungus', alluding to this genus' mold-like colony surfaces. Since this genus has cell walls with a waxy lipid-rich outer layer that contains high concentrations of mycolic acid, acid-fast staining is used to emphasize their resistance to acids, compared to other cell types.
Mycobacterial species are generally aerobic, non-motile, and capable of growing with minimal nutrients. The genus is divided based on each species' pigment production and growth rate. While most Mycobacterium species are non-pathogenic, the genus' characteristic complex cell wall contributes to evasion from host defenses.
Mycobacterium es el único género de la familia de las bacterias Mycobacteriaceae. Por las características únicas entre otros géneros bacterianos y por la importancia médica de las mismas, se estudian en la subrama de la microbiología llamada micobacteriologia.
El género Mycobacterium está formado por bacilos aerobios inmóviles y no esporulados con un tamaño de 0,2 a 0,6 × 1 a 10 µm[1] algunos de los cuales son patógenos que causan graves enfermedades en los mamíferos, incluyendo tuberculosis y lepra.
El término MeSH para Mycobacterium lo define como:[2]
A genus of gram-positive, aerobic bacteria. Most species are free-living in soil and water, but the major habitat for some is the diseased tissue of warm-blooded hosts.Un género de bacterias aerobias grampositivas. La mayoría de las especies son de vida libre en la tierra y el agua pero el mayor hábitat para algunas es el tejido infectado de anfitriones de sangre caliente.
La palabra Mycobacterium deriva del prefijo griego "myces—" que significa tanto hongo como cera y "bakterium—" que significa pequeña varilla. Su significado literal es: Bacilo semejante a un hongo.[1]
Las bacterias se clasifican en el género Mycobacterium en función de:[1]
Las micobacterias son bacterias aerobias y no móviles (con excepción de la especie M. marinum, que ha mostrado ser móvil dentro de los macrófagos). Tienen ácido-alcohol resistencia,[3] no producen endosporas ni cápsulas y suelen considerarse grampositivas. En algunos casos, estos bacilos pueden formar filamentos ramificados; sin embargo, estos pueden romperse con facilidad.[1]
Se ha publicado un trabajo en PNAS que muestra esporulación en Mycobacterium marinum.[4]
Aunque las micobacterias no parecen encajar en la categoría Gram-positiva desde un punto de vista empírico (es decir, que no retienen el tinte violeta), se clasifican como bacterias ácido-resistentes Gram-positivas. Todas las especies de Mycobacterium comparten una característica; la pared celular más gruesa que la de muchas otras bacterias, hidrofóbica, cerosa, y rica en ácidos micólicos/micolatos. La pared celular es rica en lípidos, lo que hace que su superficie sea hidrófoba y confiere a las micobacterias resistencia frente a muchos desinfectantes y las tinciones de laboratorio. Esta pared celular proporciona una contribución sustancial a la resistencia de este género de bacterias.[3][1]
En la membrana plasmática se anclan proteínas, manósido de fosfatidil inositol y liporarabinomanano (LAM), que presenta una repación funcional con los liposacáridos O antigénicos presentes en otras bacterias. La capa de peptidoglucano forma el esqueleto básico al que se unen los arabiogalactanos, unos polisacáridos ramificados formados por D-arabinosa y D-galactosa. El residuo terminal de la D-arabinosa se esterifica para dar lugar a ácidos micólicos hidrofóbicos de alto peso molecular a los que se anclan moléculas de glucolípidos de superficie. Los componentes lipídicos abarcan el 60% del peso de la pared.[1]
A lo largo de las capas de la pared se intercalan proteínas transportadoras y porinas, las que constituyen el 15% del peso de la pared. Las proteínas constituyen antígenos importantes para estimular la respuesta del anfitrión a la infección y pueden usarse como prueba pronóstica.
Debido a que la pared celular de las micobacterias es compleja y a que este grupo de microorganismos es exigente desde el punto de vista nutricional, la mayoría crecen lentamente, se dividen cada 12 a 24 horas y se necesitan hasta 8 semanas antes de poder detectar el crecimiento en los cultivos de laboratorio. Además, algunas especies tienen también ciclos de reproducción muy largos. M. leprae puede tardar más de 20 días para completar un ciclo de división (por comparación, algunas cepas de E. coli toman sólo 20 minutos), aunque jamás se ha podido aislar de manera artificial a esta especie, haciendo que el cultivo en laboratorio sea un proceso lento. Algunas de las especies pueden ser extremadamente difíciles de cultivar y puede llevar más de dos años desarrollar su cultivo.[3]
Las micobacterias que forman colonias claramente visibles a simple vista en los cultivos en un plazo de 7 días se denominan de cultivo rápido, mientras que las que requieren períodos más largos se denominan de cultivo lento.[3] Muchas especies de Mycobacterium se adaptan fácilmente al crecimiento en sustratos muy simples, utilizando amoníaco o aminoácidos como fuentes de nitrógeno y glicerol como fuente de carbono en presencia de sales minerales. La temperatura óptima de crecimiento varía ampliamente según la especie desde 25 °C a más de 40 °C.[3]
Las micobacterias son microorganismos ampliamente distribuidos, típicamente se las encuentra en el agua (incluyendo el agua del grifo tratada con cloro) y en los alimentos. Algunas especies, sin embargo, son patógenos intracelulares obligados, tales como las causantes de tuberculosis y lepra y no se las encuentra viviendo en el agua.
Las micobacterias pueden clasificarse con base en sus características de crecimiento y pigmentación con objeto de diagnóstico y tratamiento. La clasificación de Runyon, primera en clasificar a las micobacterias con objeto diagnóstico, inicialmente incluyó 4 grupos:[1]
Con esta clasificación, una micobacteria pigmentada o de crecimiento lento nunca debería confundirse con M. tuberculosis.
Las micobacterias a veces colonizan a sus huéspedes sin que estos muestren signos de enfermedad. Por ejemplo en 2015, miles de millones de personas (cerca de un tercio de la población mundial) estarían infectadas por M. tuberculosis pero nunca lo supieron puesto que no desarrollaron síntomas; estimándose que solo 10 millones de personas se enfermaron .[5] Esto es debido a que en gran parte de los países la cepa de M. tuberculosis está circulando en el medio ambiente produciendo una primo infección, que permite desarrollar una respuesta inmune, pero sin presentar los síntomas específicos, creando así células de memoria que mantienen vigilancia específica en el organismo. Por ejemplo, al transitar por la calle el paciente está expuesto a una reinfección de M. tuberculosis, pero no desarrollará la infección porque al tener las células de memoria éstas se encargarán de neutralizar al patógeno. Esa también es la explicación de por qué algunos pacientes inmunocomprometidos (como los pacientes con VIH) tienden a desarrollar cuadros crónicos de tuberculosis.
Las infecciones micobacteriales son notoriamente difíciles de tratar. Su pared celular, que no es realmente ni Gram-negativa ni Gram-positiva, las hace muy resistentes. Como caso único en su grupo, son naturalmente resistentes a varios antibióticos que destruyen las paredes celulares, tales como la penicilina. También, gracias a esta pared celular, pueden sobrevivir a largas exposiciones a ácidos, bases, detergentes, ráfagas oxidativas, lisis por complemento y pueden desarrollar naturalmente resistencia a los antibióticos. La mayoría de las micobacterias son susceptibles a los antibióticos claritromicina y rifampicina, pero se conocen cepas resistentes a estos antibióticos.
Básicamente se consideran tres tipos de cuadros clínicos entre los que destacan la tuberculosis y la lepra. El tercer tipo de cuadro clínico son las micobacteriosis, término que se usa para encuadrar una serie de procesos de las enfermedades infecciosas humanas ocasionados por micobacterias diferentes a Mycobacterium tuberculosis y M. leprae.[6]
La denominación genérica de micobacteriosis por el territorio orgánico implicado con el proceso (broncopulmonar, ganglionar, cutánea, osteoarticular, diseminada, etc.) ha sido la forma natural de denominar a estas entidades.[6]
La prueba empleada normalmente para evaluar la respuesta del paciente a la exposición de la bacteria es mediante la prueba cutánea de al tuberculina. Usualmente la prueba de la tuberculina es positiva después de 3 a 4 semanas de la exposición. Esta prueba ha dejado de considerarse diagnóstica ya que indica el contacto previo del individuo con la bacteria pero no denota una infección activa, además de que la vacuna profiláctica con el bacilo de Calmette-Guérin (BCG) tienen resultados positivos a la prueba.[1]
La detección microscópica de los bacilos acidorresistentes en muestras clínicas (baciloscopia), es el método más rápido para confirmar una infección por micobacterias. La muestra clínica se tiñe con carbolfucsina (Ziehl-Neelsen y Kinyoun) o con colorantes fluorescentes de auramina y rodamina (Truant), se decolora con una solución de ácido alcohol y se aplica una tinción de contraste. Las muestras se examinan al microscopio de campo blanco, campo oscuro o fluoresencia (en caso de usar colorantes fluorescentes). La sensibilidad de la microscopía está entre 30 y 50% y la especificidad del 95%.[1]
Las sondas de ácidos nucleicos se emplean para identificar la especie implicada en la infección. esta puede usarse junto con la amplificación del genoma ya que en las muestras suele hallarse una cantidad baja de micobacterias. Estos tienen una baja especificidad.[1]
La proliferación in vitro de las micobacterias se ve dificultada por su velocidad de crecimiento. Las muestras que vayan a cultivarse deben de tratarse con reactivos descontaminantes —NaOH, por ejemplo— para evitar la confusión con otras bacterias de crecimiento rápido. Anteriormente, estas muestras se inoculaban en medios con huevo (Lowenstein-Jensen) y con agar (Middle-brook) pero esta prueba tomaba un tiempo prolongado; sin embargo, la introducción de los caldos de cultivo facilitan el crecimiento de la bacteria acortando el tiempo de crecimiento de 3 a 4 semanas a tan solo 10-14 días.[1]
En los cultivos de la especie M. tuberculosis cabe destacar la falta de color en la superficie, característica morfológica típica observada en el crecimiento de la misma. La identificación macroscópica con base en la morfología colonial continua como una de las maneras más frecuentes para identificarlo. (véase imagen).[1]
|mes= (ayuda) Mycobacterium es el único género de la familia de las bacterias Mycobacteriaceae. Por las características únicas entre otros géneros bacterianos y por la importancia médica de las mismas, se estudian en la subrama de la microbiología llamada micobacteriologia.
El género Mycobacterium está formado por bacilos aerobios inmóviles y no esporulados con un tamaño de 0,2 a 0,6 × 1 a 10 µm algunos de los cuales son patógenos que causan graves enfermedades en los mamíferos, incluyendo tuberculosis y lepra.
Mükobakter (Mycobacterium) on perekond happekindlaid grampositiivseid, eoseid mittemoodustavaid pulgakujulisi baktereid. Nad on looduses laialdaselt levinud ja võtavad osa mitmesuguste orgaaniliste ainete lõhustamisest.
Tuberkuloosi kirjeldas esimesena Hippokrates ning juba Aristoteles kahtlustas haiguse põhjusena halba nakkavat õhku. Esimese mükobakterite liigina avastas Norra arst Gerhard Armauer Hansen 1873. aastal Mycobacterium leprae ja ligi 10 aastat hiljem leidis saksa teadlane Robert Koch tuberkuloosi tekitaja Mycobacterium tuberculosis'e. Mycobacterium bovis'e avastas T. Smith 1896. aastal.
Looduses leidub ja teadlased on tuvastanud üle 100 mükobakteri liigi. Kuid nende süstemaatika pole päris selge.
Tundlikud UV-valgusele ja kõrgele temperatuurile. Efektiivseimad desinfektandid 70% alkohol ja 2–5% fenoolilahused.
Mükobakter (Mycobacterium) on perekond happekindlaid grampositiivseid, eoseid mittemoodustavaid pulgakujulisi baktereid. Nad on looduses laialdaselt levinud ja võtavad osa mitmesuguste orgaaniliste ainete lõhustamisest.
Tuberkuloosi kirjeldas esimesena Hippokrates ning juba Aristoteles kahtlustas haiguse põhjusena halba nakkavat õhku. Esimese mükobakterite liigina avastas Norra arst Gerhard Armauer Hansen 1873. aastal Mycobacterium leprae ja ligi 10 aastat hiljem leidis saksa teadlane Robert Koch tuberkuloosi tekitaja Mycobacterium tuberculosis'e. Mycobacterium bovis'e avastas T. Smith 1896. aastal.
Mycobacterium generoa bakterio Gram positiboz osatuta dago, bazilo itxura dutenak. Aerobioak dira eta hazkuntza oso motela dute, 16-24 orduoro ugaltzen baitira (Escherichia coli, aldiz, 20 minutuoro erdibidetzen da). Ez dira mugikorrak eta ez dute esporarik sortzen.
Genero honetako bakterioek berezko ezaugarria dute: zelula horma oso berezia. Izan ere, Mycobacterium guztiek zelula horma lodia daukate, lipido asko duena; lipido hauen artean azido mikolikoak eta argizariak nabarmentzen dira (azido mikolikoek izena ematen diote Mycobacterium-i). Osaketa berezi hori dela eta, bakterio hauek ez dira ongi tindatzen Gram tindaketarekin, eta tindaketa bereziak erabiltzen dira mikroskopioan ikusteko (Ziehl-Neelsen-ena, adibidez).
Genero honetako espezie gehienak saprofito ez-kaltegarriak dira, lur zoruan edo uretan bizi direnak. Patogenoen artean tuberkulosia eta legenarra eragiten dutenak besterik ez daude.
Mycobacterium patogenoek erresistentzia handia diote botika askori. Haien zelula horma hain lodia eta sendoa izanik, zelula horma desegiten duten antibiotikoak (penizilina edo zefalosporinak, kasu) ez dira erangikorrak bakterio hauen aurka.
Mykobakteerit ovat aktinobakteerien luokkaan kuuluvia bakteereja, jotka muodostavat Mycobacterium-suvun. Sukuun kuuluu monia patogeeneja, joiden tiedetään aiheuttavan ihmisessä ja muissa nisäkkäissä vakavia tauteja kuten tuberkuloosia ja lepraa. [1] Etuliite myko- ('vaha' tai 'sieni') tulee latinasta ja viittaa soluseinän vahamaisiin yhdisteisiin.
Mykobakteerit ovat aerobisia ja liikuntakyvyttömiä bakteereja (lukuun ottamatta lajia M. marinum, jonka on osoitettu pystyvän liikkumaan makrofagin sisällä) ja tyypillisesti vastustuskykyisiä happovärjäykselle[1]. Yleensä niissä ei myöskään ole endosporeja tai solukapselia. Vaikkakaan mykobakteerit eivät käytännön näkökulmasta (värjäytyminen) näytä luokittuvan gram-positiivisiin, ne luokitellaan haponkestäviksi gram-positiivisiksi bakteereiksi ulkokalvon puuttumisen takia. Kaikille mykobakteereille on yhteistä paksu soluseinä, joka on hydrofobinen, vahamainen ja runsaasti mykolaatteja sisältävä. Soluseinä suurelta osin tekee mykobakteereista kestäviä, sen rakenneosien biosynteesi taas on mahdollinen kohde uusille tuberkuloosilääkkeille. [2]
Monet mykobakteerilajit sopeutuvat helposti ravinneköyhäänkin ympäristöön – käyttävät ammoniakkia tai aminohappoja typen lähteenä ja glyserolia hiilen lähteenä – kun saatavilla vain on kivennäisaineita. Ihanteellinen kasvulämpötila vaihtelee suuresti lajista riippuen, 25:stä yli 50:een celsiusasteeseen. Osaa lajeista on vaikea viljellä ja osan lisääntyminen on erittäin hidasta. Esimerkiksi M. lepraen jakautuminen saattaa kestää kaksikymmentäkin vuorokautta.[1] Lisäksi käytettävissä olevat geenitekniset menetelmät eivät ole näiden lajien kohdalla yhtä runsaat. [3] Mykobakteerit jakautuvat selvästi nopea- ja hidaskasvuisiin lajeihin ja silmälle näkyviä yhdyskuntia seitsemässä päivässä kehittävät lajit voidaan luokitella nopeiksi. Muodoltaan ne ovat joko suoria, tai hieman kaarevia 1-10 mikrometrin pituisia ja 0,2-0,6 mikrometrin paksuisia sauvoja.
Jotkin lajit tuottavat karotenoidipigmenttejä ilman valoa, toiset vaativat fotoaktivaatiota pigmentin tuottamiseen. Fenotyypiltään mykobakteerit ovat lähimpänä Nocardia-, Rhodococcus- ja Corynebacterium- lajeja.
Mykobakteerit voivat levitä isäntäänsä tämän osoittamatta merkittäviä oireita. Esimerkiksi miljardit ihmiset kantavat oireettomana tuberkuloosibasillia (M. tuberculosis). Mykobakteeri-infektiot ovat huomattavan vaikeita hoidettavia, sillä bakteerit ovat vahvan soluseinänsä ansiosta luonnostaan vastustuskykyisiä monille antibiooteille kuten penisilliinille. Samasta syystä ne sietävät huomattavan hyvin happoja, emäksiä, puhdistusaineita ja eliöitten puolustustautumismiskeinoja. Klaritromysiini ja rifamysiini tehoavat useimpiin mykobakteereihin, mutta myös antibiooteille vastustuskykyisiä kantoja tunnetaan.
Muiden bakteeristen patogeenien lailla M. tuberculosiksen erittämillä proteiineilla ja pintaproteiineilla on merkittävä osuus bakteerin virulenssiin. Ekstrasytoplasmisia proteiineja, joiden tiedetään vaikuttavan tuberkuloosibakteerin virulenssiin, löydetään koko ajan lisää. [4]
Taudinmääritystä ja -hoitoa silmällä pitäen mykobakteerit luokitellaan useisiin pääryhmiin. M. tuberculosis -ryhmän bakteerit , jotka voivat aiheuttaa tuberkuloosia: M. tuberculosis, M. bovis, M. africanum, and M. microti, lepraa aiheuttava M. leprae ja NTM (engl. NonTuberculous Mycobacteria), johon kuuluvat kaikki muut mykobakteerit, jotka voivat aiheuttaa tuberkuloosia muistuttavaa keuhkotautia, lymfadeniittia, ihotauteja tai disseminoitunutta (levinnyttä) tautia.
Aiemmin mykobakteerit luokiteltiin ulkonäön ja lisääntymisnopeuden perusteella. Nykyisin käytetään kladistiikan mukaista luokitusta.
Ryhmän bakteerit aiheuttavat ihmisessä ja eläimissä tuberkuloosia. Ryhmään kuuluvia lajeja ovat:
Ryhmän bakteerit tapasivat olla yleis- mutta ei keuhkoinfektioissa AIDS-potilaiden merkittävä kuolinsyy.
Mykobakteerit ovat aktinobakteerien luokkaan kuuluvia bakteereja, jotka muodostavat Mycobacterium-suvun. Sukuun kuuluu monia patogeeneja, joiden tiedetään aiheuttavan ihmisessä ja muissa nisäkkäissä vakavia tauteja kuten tuberkuloosia ja lepraa. Etuliite myko- ('vaha' tai 'sieni') tulee latinasta ja viittaa soluseinän vahamaisiin yhdisteisiin.
Mycobacterium, la Mycobactérie, est un genre de bactéries de la famille des Mycobacteriaceae. Ce sont des bacilles aérobies assez longs et fins, asporulés et acapsulés.
Leur paroi présente une structure particulière, riche en cires (acides mycoliques) qui leur permet de retenir les colorants malgré l'action combinée d'acide dilué et d'alcool. Cette paroi leur confère une grande résistance aux antiseptiques, à certains antibiotiques, aux macrophages.
Ils sont dits « bacilles acido-alcoolo-résistants » ou BAAR.
Cette particularité de la paroi est utilisée pour les mettre en évidence lors d'examen microscopique par la coloration de Ziehl-Neelsen.
Leur temps de génération est extrêmement long (proche de 20 heures). Leur %GC est compris entre 61 et 71 %.
La taxonomie du genre Mycobacterium reposait sur la classification de Runyon (1954) fondée sur la vitesse de croissance et la pigmentation (4 groupes présentés dans le tableau suivant).
Mais dans la pratique courante, on distingue les mycobactéries tuberculeuses du complexe Mycobacterium tuberculosis comprenant les espèces déterminant la tuberculose humaine (M. tuberculosis), bovine (M. bovis) ou celle observée le plus souvent en Afrique noire (M. africanum).
En 2018 R.S. Gupta et al. ont proposé une importante refonte du genre Mycobacterium en s'appuyant sur des techniques de phylogénétique moléculaire[1]. En analysant le génome des 150 espèces de Mycobactéries séquencées au moment de l'étude, à travers la comparaison de trois séries de protéines conservées parmi elles et sur la base d'autres données concordantes, cette équipe a démontré l'hétérogénéité de l'ancien genre unique Mycobacterium. Un grand nombre d'espèces en ont été exclues et reclassées dans quatre nouveaux genres créés pour l'occasion : Mycolicibacter, Mycolicibacillus, Mycolicibacterium et Mycobacteroides. Le genre Mycobacterium a été conservé mais avec un nombre d'espèces plus restreint. En 2019, Gupta amende la description de l'ordre des Mycobactériales en y incluant la famille des Mycobacteriaceae[2],[3].
Le genre Mycobacterium conservé par Gupta en 2018 se limite désormais aux espèces suivantes[4] :
Mycobacterium, la Mycobactérie, est un genre de bactéries de la famille des Mycobacteriaceae. Ce sont des bacilles aérobies assez longs et fins, asporulés et acapsulés.
Leur paroi présente une structure particulière, riche en cires (acides mycoliques) qui leur permet de retenir les colorants malgré l'action combinée d'acide dilué et d'alcool. Cette paroi leur confère une grande résistance aux antiseptiques, à certains antibiotiques, aux macrophages.
Ils sont dits « bacilles acido-alcoolo-résistants » ou BAAR.
Cette particularité de la paroi est utilisée pour les mettre en évidence lors d'examen microscopique par la coloration de Ziehl-Neelsen.
Leur temps de génération est extrêmement long (proche de 20 heures). Leur %GC est compris entre 61 et 71 %.
Mycobacterium é un xénero de Actinobacteria, que é o único membro da familia Mycobacteriaceae (micobacteriáceas). A miúdo faise referencia a elas chamándolles micobacterias. O xénero inclúe patóxenos que orixinan graves enfermidades nos mamíferos, como a tuberculose (Mycobacterium tuberculosis) e a lepra (Mycobacterium leprae).[1] O prefixo myco que forma parte do seu nome procede do grego e significa “fungo”, facendo alusión ao modo similar ao dos fungos que ten a micobacteria de crecer na superficie dos líquidos cando se cultiva.[2]
As micobacterias son bacterias aeróbicas e inmóbiles (excepto a especie Mycobacterium marinum, que é móbil dentro de macrófagos) que son cracteristicamente ácido-alcohol resistentes (resisten a decoloración por ácidos durante a tinguidura).[1] En xeral, as micobacterias non conteñen endósporas e son consideradas xeralmente grampositivas. Porén, observouse esporulación en Mycobacterium marinum e talvez en M. bovis.[3], aínda que isto foi moi contestado por outros científicos.[4] Cómpre tamén facer algunhas precisións sobre a súa tinguidura de Gram, xa que desde un punto de vista empírico non parecen corresponder á categoría das grampositivas (é dicir, en xeral, non reteñen ben o colorante cristal violeta), e son clasificadas como bacterias ácido resistentes. Todas as especies de Mycobacterium comparten unha parede celular característica, de maior grosor ca a doutras bacterias, hidrofóbica, cerosa, e rica en ácido micólico/micolatos. A parede celular consta dunha capa de micolatos hidrofóbicos e unha capa de peptidoglicano unidas polo polisacárido, arabinogalactano. A parede celular fai unha contribución substancial á robustez das bacterias deste xénero. As rutas biosintéticas dos compoñentes da parede celular son dianas potenciais das novas drogas contra a tuberculose.[5] Moitas especies non parecen ter cápsula ou é moi difícil de ver coas técnicas de microscopía convencionais, pero nalgunhas, como M. tuberculosis está demostrada a presenza de cápsula.[6]
Moitas especies de Mycobacterium poden adaptarse rapidamente ao crecemento en substratos moi simples, utilizando amoníaco ou aminoácidos como fontes de nitróxeno, e glicerol como fonte de cabono en presenza de sales minerais. As súas temperaturas de crecemento óptimas varían amplamente segundo a especie e van desde 25 °C a algo máis de 50 °C.
Algunhas especies poden ser moi difíciles de cultivar e poden tardar moito tempo en desenvolverse en cultivo. Ademais, algunhas especies teñen ciclos reprodutivos extremadamente longos; por exemplo, M. leprae pode precisar máis de 20 días para completar un ciclo de división (por comparación, algunhas cepas de E. coli tardan só 20 minutos), facendo que o seu cultivo en laboratorio sexa un proceso lento.[1] Ademais, a facilidade para aplicarlles técnicas de manipulación xenética é moito menor ca noutras especies bacterianas.[7]
Existe unha división natural entre as especies de micobacterias de crecemento lento e de crecemento rápido. As micobacterias que forman colonias claramente visibles a simple vista en sete días en subcultivo denomínanse de crecemento rápido, e as que requiren períodos máis longos chámanse de crecemento lento. As células das micobacterias son bacilos rectos ou lixeiramente curvados de entre 0,2 e 0,6 µm de largo e de 1,0 a 10 µm de longo.
Algunhas micobacterias producen pigmentos carotenoides sen estaren expostas á luz. Outras requiren fotoactivación para a produción de pigmentos. Podemos distinguir os seguintes grupos:
As micobacterias son os organismos clásicos ácido resistentes (non se decoloran con ácidos na tinguidura).[8] As tinguiduras utilizadas para a avaliación de especimes de mostras de tecidos ou microbiolóxicos son: tinguidura de Fite, tinguidura de Ziehl-Neelsen, e tinguidura de Kinyoun.
As micobacterias parecen estar fenotipicamente máis relacionadas con membros de Nocardia, Rhodococcus e Corynebacterium.
As micobacterias son organismos ampliamente distribuídos na natureza, que viven tipicamente na auga (mesmo na auga da billa que foi tratada con cloro) e fontes alimenticias. Só algunhas, como os axentes da tuberculose e lepra, son parasitos obrigados e non son de vida libre.
As micobacterias poden colonizar os seus hóspedes sen que estes noten ningún síntoma adverso. Por exemplo, miles de millóns de persoas teñen infeccións asintomáticas de M. tuberculosis. A bacteria vive nos seus corpos con normalidade sen facer dano e só causa enfermidade en raros casos.
As infeccións por micobacterias son moi difíciles de tratar. Estes microorganismos son robustos debido á súa parede celular, que non é claramente gramnegativa nin grampositiva (ver máis arriba). Ademais, son resistentes de forma natural a varios antibióticos que interfiren coa biosíntese da parede celular, como a penicilina. Debido á súa peculiar parede celular, poden sobrevivir a unha longa exposición aos ácidos, alcalis, deterxentes, explosións oxidativas, lise polo sistema do complemento, e a moitos antibióticos. A maioría das micobacterias son susceptibles aos antibióticos claritromicina e rifamicina, pero apareceron xa cepas resistentes a eses antibióticos.
Como ocorre con outras bacterias patóxenas, as proteínas de superficie e as secretadas de M. tuberculosis contribúen significativamente á virulencia deste organismo. Hai unha lista crecente de proteínas extracitoplasmáticas das que se comprobou que teñen unha función na virulencia de M. tuberculosis.[9]
As micobacterias poden clasificarse en varios grupos principais a efectos de diagnose e tratamento:
Os micósidos son alcohois fenólicos (como o fenolftiocerol), que se comprobou é un dos compoñentes dos glicolípidos das micobacterias denominados glicósidos de fenolftiocerol dimicocerosato [10]. Os micósidos A e B teñen 18 e 20 átomos de carbono, respectivamente.[11][12][13]
Estudos xenómicos nos que se realizaron análises comparativas de xenomas micobacterianos identificaron varios indeis conservados e proteínas sinatura que se encontran unicamente en todas as especies secuenciadas do xénero Mycobacterium.[15][16] Ademais, encontráronse 14 proteínas só nas especies do xénero Mycobacterium e Nocardia, o que suxire que estes dous xéneros están estreitamente emparentados.[16]
Poden usarse probas fenotípicas para identificar e distinguir diferentes especies de micobacterias e cepas. Noutros sistemas vellos, as micobacterias agrúpanse segundo a súa aparencia e grao de crecemento. Porén, estes son simplesiomorfías (trazos ancestrais herdados por varios taxons), e as clasificacións máis recentes están baseadas na cladística.
O'Neill e colegas presentaron recentemente unha análise filoxenética completa baseada en aliñamentos dos xenomas esenciais de 57 cepas de bacterias, entre as que estaban incluídas todas as micobacterias de que se dispón.[17]
As micobacterias poden ser infectadas por micobacteriófagos, que son virus bacterianos que poderían usarse no futuro para tratar a tuberculose e enfermidades relacionadas por terapia de fagos.
Mycobacterium é un xénero de Actinobacteria, que é o único membro da familia Mycobacteriaceae (micobacteriáceas). A miúdo faise referencia a elas chamándolles micobacterias. O xénero inclúe patóxenos que orixinan graves enfermidades nos mamíferos, como a tuberculose (Mycobacterium tuberculosis) e a lepra (Mycobacterium leprae). O prefixo myco que forma parte do seu nome procede do grego e significa “fungo”, facendo alusión ao modo similar ao dos fungos que ten a micobacteria de crecer na superficie dos líquidos cando se cultiva.
Mycobacterium je rod bakterija Actinobacteria, koji ima vlastitu porodicu Mycobacteriaceae.
Međi mikobakterije ubrajuje se različiti patogene vrste koje kod čovjeka uzrokuju bolesti kao što su tuberkuloza ili lepra.
Mycobacterium je rod bakterija Actinobacteria, koji ima vlastitu porodicu Mycobacteriaceae.
Međi mikobakterije ubrajuje se različiti patogene vrste koje kod čovjeka uzrokuju bolesti kao što su tuberkuloza ili lepra.
Mikobakterium adalah genus Aktinobakteria. Genus termasuk pathogen diketahui menyebabkan penyakit serius pada mamalia, termasuk tuberkulosis dan leprosi.[1] Latin dari "miko—" berarti baik fungi dan lilin; lilin disini berhubungan dengan komponen "lilin" di diding sel.
Mikobakterium adalah genus Aktinobakteria. Genus termasuk pathogen diketahui menyebabkan penyakit serius pada mamalia, termasuk tuberkulosis dan leprosi. Latin dari "miko—" berarti baik fungi dan lilin; lilin disini berhubungan dengan komponen "lilin" di diding sel.
I micobatteri (Mycobacterium) sono un genere di bacilli Gram-variabili[1], unico genere della famiglia Mycobacteriaceae. Sono causa di diverse patologie nell'ospite umano. Il prefisso greco myco- significa "fungo", e allude al fatto che i micobatteri crescono in modo simile a una muffa sulla superficie delle colture.
I micobatteri sono caratterizzati dalla presenza di una parete cellulare (non si tratta di una vera e propria parete) insolitamente spessa e dalla struttura patogena insolita. Contrariamente a quelle degli altri batteri che sono formate di solo peptidoglicano (seppure disposto in più o meno strati nelle diverse specie), la parete dei micobatteri presenta uno strato relativamente sottile di peptidoglicano legato ad una serie di molecole composta rispettivamente da arabinogalattani, acidi micolici e glicolipidi fenolici.
Questa parete cellulare così complessa conferisce ai micobatteri il vantaggio di essere completamente impermeabili ad alcune delle sostanze più utilizzate nella terapia medica, compresi alcuni degli antibiotici più comuni: i micobatteri sono infatti sensibili solo alla rifampicina e ad alcuni derivati dell'isoniazide, come l'etambutolo. D'altro canto, la comprensibile lentezza negli scambi metabolici fra la cellula e l'ambiente esterno, giustificata dalla grande quantità di involucri che i metaboliti devono attraversare per raggiungere la membrana cellulare, dà una spiegazione della caratteristica lentezza di replicazione dei micobatteri nei terreni di coltura artificiali utilizzati in microbiologia.
I micobatteri in medicina vengono tradizionalmente suddivisi in diversi gruppi, a seconda del loro potere.
Un primo gruppo comprende i cosiddetti micobatteri tubercolari, ossia capaci di scatenare la tubercolosi nell'ospite animale. Questo gruppo è costituito dai tre batteri del cosiddetto Mycobacterium tuberculosis complex: Mycobacterium tuberculosis (responsabile della tubercolosi umana), Mycobacterium africanum (correlato alla stessa patologia del M. tuberculosis, seppure leggermente differente sotto il profilo biochimico ed isolato con maggiore frequenza in Africa) e Mycobacterium bovis (responsabile della tubercolosi bovina, zoonosi trasmissibile all'uomo per via alimentare).
Un altro gruppo, il più nutrito in assoluto, è costituito dai micobatteri non tubercolari, ossia da micobatteri che causano una serie di patologie diverse dalla tubercolosi nell'ospite umano, ma solo in concomitanza di particolari condizioni che abbassino le difese immunitarie dell'organismo colonizzato (si configurano perciò come parassiti opportunisti).
Una classificazione a parte viene fatta per il Mycobacterium leprae, agente eziologico della lebbra, il quale, pur essendo assimilabile al gruppo dei micobatteri non tubercolari, presenta caratteristiche cliniche e biologiche assolutamente peculiari.
Alcuni micobatteri si comportano infine come saprofiti, assolutamente innocui per gli altri organismi, che possono occasionalmente colonizzare l'ospite umano senza però dare luogo a patologie di alcun tipo: un esempio è il Mycobacterium smegmatis.
La particolare struttura della parete cellulare conferisce ai micobatteri anche una caratteristica importante per la loro identificazione in vitro, il cosiddetto fenomeno dell'acido-resistenza. I micobatteri infatti, pur se fissati (cioè uccisi) al calore, sono estremamente difficili da colorare, poiché i coloranti tradizionali non riescono ad oltrepassare la barriera impermeabile della loro parete cellulare; in compenso, se la cellula si imbibisce di un colorante, diventa ancor più resistente alla decolorazione.
Questa caratteristica spiega la particolare difficoltà di colorare i micobatteri con i normali coloranti di Gram: essi necessitano infatti di un procedimento particolare, la cosiddetta colorazione di Ziehl-Neelsen. Questa è una colorazione differenziale che prevede l'utilizzo in primo luogo di fucsina ed acido fenico, che vengono particolarmente ben assorbiti dai micobatteri; in seguito si procede con una decolorazione in HCl (che non ha effetto sui micobatteri, ma che decolora invece tutti gli altri batteri presenti sul vetrino), ed infine con l'aggiunta di blu di metilene (che a sua volta non viene assorbito dai micobatteri, ma solo dai batteri circostanti). Nel vetrino così colorato, i micobatteri appaiono come bastoncini rossi (perché NON hanno perso la colorazione iniziale della fucsina) sullo sfondo blu degli altri batteri eventualmente presenti nel materiale.
I micobatteri (Mycobacterium) sono un genere di bacilli Gram-variabili, unico genere della famiglia Mycobacteriaceae. Sono causa di diverse patologie nell'ospite umano. Il prefisso greco myco- significa "fungo", e allude al fatto che i micobatteri crescono in modo simile a una muffa sulla superficie delle colture.
Mycobacterium is een geslacht van bacteriën, dat vooral bekend is als verwekkers van de ziekten tuberculose en lepra, maar er zijn ook nuttige soorten aanwezig in de bodem, bijvoorbeeld die in symbiose leven met sommige planten. De meeste mycobacteriën zijn vrij ongevoelig voor de gebruikelijke antibiotica. Een van de eerste antibiotica die effectief was tegen deze bacteriën is streptomycine. Mycobacteriën delen zeer langzaam waardoor de behandeling ook lange tijd duurt: zo'n 6 tot 12 maanden.
Een aantal Mycobacteriumsoorten zijn:
Mycobacterium is een geslacht van bacteriën, dat vooral bekend is als verwekkers van de ziekten tuberculose en lepra, maar er zijn ook nuttige soorten aanwezig in de bodem, bijvoorbeeld die in symbiose leven met sommige planten. De meeste mycobacteriën zijn vrij ongevoelig voor de gebruikelijke antibiotica. Een van de eerste antibiotica die effectief was tegen deze bacteriën is streptomycine. Mycobacteriën delen zeer langzaam waardoor de behandeling ook lange tijd duurt: zo'n 6 tot 12 maanden.
Een aantal Mycobacteriumsoorten zijn:
M. tuberculosis M. bovis M. leprae M. intracellulare M. smegmatis M. ulceransMykobakterier, også kjent som Mycobacterium, er eneste slekt av bakteriefamilien Mycobacteriaceae. Mykobakterier kan gi alvorlige infeksjoner hos mennesker og dyr, for eksempel Mycobacterium tuberculosis som forårsaker tuberkulose og Mycobacterium leprae som forårsaker lepra. Mykobakterier er også vanlige hos mennesker og i menneskers omgivelser uten at de gir sykdom.[1]
Mykobakterier, også kjent som Mycobacterium, er eneste slekt av bakteriefamilien Mycobacteriaceae. Mykobakterier kan gi alvorlige infeksjoner hos mennesker og dyr, for eksempel Mycobacterium tuberculosis som forårsaker tuberkulose og Mycobacterium leprae som forårsaker lepra. Mykobakterier er også vanlige hos mennesker og i menneskers omgivelser uten at de gir sykdom.

Prątki (Mycobacterium) – drobnoustroje należące do rodziny Mycobacteriaceae, rząd Actinomycetales, klasa Schizomycetes.
Są to bakterie o tlenowym metabolizmie o kształcie pałeczkowatym (proste lub tylko nieznacznie zakrzywione) o średnicy 0,2 - 0,4 μm i długości 2 - 10 μm. Charakterystyczną cechą prątków jest specyficzna budowa ściany komórkowej, która nawet w ponad 60%[potrzebny przypis] zbudowana jest z lipidów. Dzięki temu ściana ma charakter hydrofobowy co sprawia, że jest ona nieprzepuszczalna dla stosowanych w wielu metodach barwienia anilinowych barwników zasadowych. Specyficzna budowa prątków daje im dużą kwasooporność oraz oporność na czynniki takie jak wysuszenie, niskie i wysokie pH, wysoką i niską temperaturę. W zaschniętej plwocinie prątki mogą przeżyć do trzech miesięcy. Wykazano obecność w ścianie komórkowej takich substancji o właściwościach antygenowych jak: lipoarabinomannan, peptydy muramylowe (np. adiuwant: dipeptyd muramylowy[1]), sulfatydy, czynnik wiązkowy (cord factor) i wiele innych. Za podstawową cechę umożliwiająca osiągnięcie gospodarza jako niszy życiowej uważa się umiejętność prątków do przeżywania wewnątrzkomórkowego. Mikobakterie są zdolne do przeżywania wewnątrz fagolizosomów - struktur pierwotnie zaangażowanych w zabijanie patogenów.
Rodzaj Mycobacterium należy do Promieniowców. Różnice między rodzajami sprowadzają się nie tylko do właściwości chorobotwórczych czy fizjologicznych, ale także do różnic w budowie ściany komórkowej, która u wszystkich drobnoustrojów należących do Actinomycetes zapewnia mniejszą lub większą kwasoodporność.
Prątki są hodowane na opartym na jajach podłożu Löwensteina-Jensena, agarowej pożywce Middlebrooka oraz na pożywce Ogawy, przy czym podłoże LJ jest podłożem z wyboru[2].
Ze względów praktycznych prątki dzieli się na:
Prątki (Mycobacterium) – drobnoustroje należące do rodziny Mycobacteriaceae, rząd Actinomycetales, klasa Schizomycetes.
Są to bakterie o tlenowym metabolizmie o kształcie pałeczkowatym (proste lub tylko nieznacznie zakrzywione) o średnicy 0,2 - 0,4 μm i długości 2 - 10 μm. Charakterystyczną cechą prątków jest specyficzna budowa ściany komórkowej, która nawet w ponad 60%[potrzebny przypis] zbudowana jest z lipidów. Dzięki temu ściana ma charakter hydrofobowy co sprawia, że jest ona nieprzepuszczalna dla stosowanych w wielu metodach barwienia anilinowych barwników zasadowych. Specyficzna budowa prątków daje im dużą kwasooporność oraz oporność na czynniki takie jak wysuszenie, niskie i wysokie pH, wysoką i niską temperaturę. W zaschniętej plwocinie prątki mogą przeżyć do trzech miesięcy. Wykazano obecność w ścianie komórkowej takich substancji o właściwościach antygenowych jak: lipoarabinomannan, peptydy muramylowe (np. adiuwant: dipeptyd muramylowy), sulfatydy, czynnik wiązkowy (cord factor) i wiele innych. Za podstawową cechę umożliwiająca osiągnięcie gospodarza jako niszy życiowej uważa się umiejętność prątków do przeżywania wewnątrzkomórkowego. Mikobakterie są zdolne do przeżywania wewnątrz fagolizosomów - struktur pierwotnie zaangażowanych w zabijanie patogenów.
Rodzaj Mycobacterium należy do Promieniowców. Różnice między rodzajami sprowadzają się nie tylko do właściwości chorobotwórczych czy fizjologicznych, ale także do różnic w budowie ściany komórkowej, która u wszystkich drobnoustrojów należących do Actinomycetes zapewnia mniejszą lub większą kwasoodporność.
Prątki są hodowane na opartym na jajach podłożu Löwensteina-Jensena, agarowej pożywce Middlebrooka oraz na pożywce Ogawy, przy czym podłoże LJ jest podłożem z wyboru.
Ze względów praktycznych prątki dzieli się na:
prątek gruźlicy (Mycobacterium tuberculosis) - wywołujące gruźlicę prątek trądu (Mycobacterium leprae) - wywołujące trąd (chorobę Hansena) prątki inne niż gruźlicze (MOTT) - w tym Mycobacterium avium complex (MAC)Mycobacterium ou micobactéria é um gênero de actinobactérias bacilares, aeróbicas obrigatórias, imóveis e altamente patogênicas, que causam diversas doenças, entre as quais lepra, tuberculose e infeções por micobactérias não tuberculosas. Possuem a forma de bacilos retos ou levemente curvado, sem a presença de flagelos ou de cápsula, além de não ter formação do endosporo. Apesar das micobactérias não possuírem membrana externa e, por isso, se assemelharem às gram-positivas, seu alto teor lipídico confere diferenças estruturais importantes na parede. A presença de ácidos graxos no envelope confere uma álcool-ácido resistência (AAR) - retendo fucsina básica pela parede mesmo na presença de álcool e ácido durante a coloração de Gram. Microorganismo intracelulares, que infectam e proliferam-se dentro de macrófagos.
As manifestações clínicas de infecções micobacterianas decorrem da resposta imunológica do hospedeiro à infecção e aos antígeos que portam. Possuem inúmeras resistências a antibióticos típicos e exigem tratamentos de muitas semanas, meses ou anos. Normalmente administrado mais de um antibiótico, já que algumas cepas já apresentam resistência antimicrobiana considerável. [1]
Diferente de outras bactérias gram-positivas ou gram-negativas, as micobactérias possuem peptideoglicano com ácido N-glicolilmurâmico em vez de ácido N-acetilmurâmico. A parede celular é constituída de cerca de 60% de ácidos micólicos (ácidos graxos de cadeia longa incomum), covalentemente ligados ao polissacarídeo que compõe a parede. A presença de alguns lipídeos livres com epítopos passiveis de reconhecimento pelo hospedeiro não estão covalentemente associados ao esqueleto basal. Possuem proteínas de membrana formadoras de canais catiônicos (porinas), que controlam a difusão de moléculas hidrofílicas. A Mycobacterium tuberculosis possui uma das paredes mais permeáveis a agentes antimicrobiano hidrofílicos. [1] A singularidade da parede permite que o microorganismo sobreviva dentro de macrófagos - que normalmente aniquilam patógenos fagocitados - facilitando a agregação bacteriana e tornando-as mais resistentes a muitos desinfetantes químicos, o que dificulta sua prevenção.
O alto teor lipídico das micobactérias confere à esta a álcool-ácido resistência, que impede a coloração das bactérias pela técnica de Gram, normalmente utilizada. Entretanto, se a porção lipídica for removida com etanol alcalino, a bactéria perde a característica de álcool-acido resistência, permitindo que sua coloração assemelhe-se às gram-positivas. A técnica de Ziehl-Neelsen é eficaz com essas bactérias, utilizando uma mistura de fucsina com fenol, envolvendo aquecimento na própria lâmina até que gere vapor. O diferencial dessa mistura é o fenol, que aumenta a absorção da fucsina nos lipídios (ocorrerá ligação do NH2+ da fucsina com o COO- do ácido micólico). Após essa aplicação, o esfregaço é lavado e tratado com álcool-ácido, sendo lavado mais uma vez para ser corado com azul de metileno, realizando o papel de contraste. O resultado é a coloração em vermelho aos acidorresistentes, e o restante em azul. [2]
Possui um meio desenvolvido especialmente para seu plaqueamento, o meio Löwenstein–Jensen (LJ), que é utilizado principalmente para o cultivo da Mycobacterium tuberculosis. Diferenças entre as espécies englobam mudanças na temperatura ótima de cultivo e tempo médio de crescimento.
COMPOSIÇÃO (g/L)
L-Asparagina: 3.60
Fosfato monopotássico: 2.40
Sulfato de magnésio: 0.24
Citrato de magnésio: 0.60
Amido de batata, solúvel: 30.00
Verde malaquita: 0.400
Essa é a composição basal, comprada em forma de um pó azul esverdeado. A ele, devem ser acrescentados 12mL de glicerol e 1000mL de emulsão de ovo. Nesse momento o meio adquire uma cor verde azulada pálida, e um pouco opaca.
A l-asparagina e o amido de batata são fontes de nitrogênio e vitaminas. Sulfato de magnésio e fosfato monopotássico agem como fatores de crescimento, e o glicerol e a emulsão de ovo fornecem ácidos graxos e aminoácidos e são fonte de carbono. O verde malaquita é composto que impede a contaminação a cultura por fungos e outros microrganismos, garantindo uma cultura pura.
Esse meio é muito importante para o diagnóstico precoce da tuberculose, mas seu grande problema se da pelo fato de que as colônias demoram para serem formadas devido ao crescimento lento da bactéria (colônias visíveis de 2 a 20 dias em temperatura ótima). Isso dificulta muito a rapidez de diagnóstico, e por isso técnicas alternativas são bastante pesquisadas e exploradas. Por não serem nem gram-positivas nem gram-negativas, podem ser cultivadas com antibióticos para esses dois tipos de bactérias, o que minimiza e evita contaminações.
A Mycobacterium leprae não é cultivada nesse meio ou em qualquer outro, sendo utilizado modelos experimentais para análise da hanseníase. O uso de tatu selvagem em laboratórios como modelo experimental ainda é o mais adequado. [3][4]
Devido à baixa velocidade de crescimento e a dificuldade de cultura dessas bactérias, o metabolismo dessas bactérias não é definido para todas as espécies. Suas necessidades nutricionais englobam:
Dentre as principais bactérias patogênicas, a Mycobacterium tuberculosis usa como principal fonte de carbono o colesterol e esteroides derivados de sua degradação como metabólitos adicionais. Uma via de regulação da ativação dos genes que participam do catabolismo do colesterol inicia-se com sua oxidação, até eventualmente alimentar o ciclo de Krebs (TCA Cicle) ou ser usado para o anabolismo da bactéria.[5]
A Mycobacterium leprae usa principalmente os lipídios como fonte de carbono. Eles também são oxidados e eventualmente servem de substrato para o ciclo de Krebs, que enfim fornece ATP para a bactéria.Como a M. leprae só cresce em hospedeiros específicos e não cresce em meios de culturas padrão para micobactérias, elas não produzem todos os metabólitos necessários ao seu crescimento. Entretanto, como seu crescimento ocorre em hospedeiros específicos, é de difícil determinação quais nutrientes ela precisa utilizar do meio em que se encontra, sendo os mecanismos gerais de seu metabolismo ainda nebulosos. [6]
As infecções por micobactérias geralmente só afetam imunocomprometidos, sendo assintomáticas na grande maioria da população:[7]
Algumas bactérias do gênero Mycobacterium são causadoras de doenças extremamente perigosas, como a hanseníase e a tuberculose. A manipulação desses patógenos requer laboratórios equipados de acordo com os Níveis de Biossegurança (NB), requisitos padronizados para a manipulação de microrganismos patógenos.
Esses níveis são definidos de acordo com a classe de risco desses microrganismos (determinada pelo risco potencial oferecido ao individuo, à comunidade e ao meio ambiente) e ao tipo de manipulação que será realizada. [8]
CLASSE DE RISCO 1: todas as Mycobacterium não incluídas em outras classes de risco.
CLASSE DE RISCO 2: M. leprae, M. asiaticum, M. avium, M. bovis BCG vacinal, M. intracellulare, M. chelonae, M. fortuitum, M. kansasii, M. malmoense, M.marinum, M. paratuberculosis, M. scrofulaceum, M. simiae, M. szulgai,M. xenopi
CLASSE DE RISCO 3:M. bovis (exceto a cepa BCG) e M. tuberculosis [9]
O número da classe de risco não corresponde ao NB necessariamente. Existem micobactérias,como a M.smegmatis, que são da classe de risco 1 e correspondem ao NB 1, e a M.leprae, que é da classe 2 e corresponde ao NB 2. Por outro lado, existem casos como a M.tuberculosis, que faz parte da classe de risco 3, mas pode corresponder ao NB 2 ou 3, dependendo do tipo de manuseio a ser realizado. [10]
Devido a característica de álcool-ácido resistência, as micobactérias possuem antimicrobianos específicos para o tratamento de enfermidades causadas pelas bactérias patogênicas. Os casos de resistência aos fármacos pela micobactéria ocorre devido às mutações espontâneas que ocorrem nas replicações dessas bactérias - não envolvendo plasmídeos e transposons (elementos móveis) como ocorre na maioria das bactérias resistentes a antibióticos.
A rifampicina é um importante antibiótico no tratamento da tuberculose, hanseníase e outras doenças causadas por micobactérias. É um composto semi-sintético produzido a partir da rifampicina B, que é obtida comercialmente pela fermentação a partir do Streptomyces mediterranei. Pertencente à família dos antibióticos ansamicinas, é um antibiótico bactericida que se liga a subunidade beta da RNA polimerase e inibe a transcrição gênica da micobactéria por bloqueio da RNA-polimeras dependente de DNA. Isso impede a síntese de RNA mensageiro (mRNA), produzindo morte celular. O mecanismo de resistência a esse fármaco resulta de mutações na região central do gen rpoB, que codifica a subunidade β da RNA-polimerase . As mutações modificam a estrutura desta enzima, fazendo com que a RMP perca a capacidade de bloqueá-la, liberando a síntese de mRNA.
Observação importante: A utilização da rifampicina em pacientes portadores de HIV pode promover interações farmacológicas do sistema hepático e intestinal com a maioria dos anti-retrovirais utilizados, o que pode provocar uma redução significativa dos níveis plasmáticos dos mesmos. Esse fato pode levar à diminuição da eficácia e ao aumento do risco de desenvolvimento de resistência do vírus HIV ao esquema de medicamentos anti-retrovirais. Assim, é necessário a utilização de processos alternativos, sem a presença da rifampicina.
A isoniazida, medicamento mais conhecido no tratamento da tuberculose devido a sua alta especificidade e também aquele com maior frequência de ocorrência de resistência, foi descoberto em 1952. O gene katG codifica a enzima catalase-peroxidase, importante no metabolismo do bacilo. Esta enzima ativa a isoniazida, produzindo radicais reativos de oxigênio e radicais orgânicos que inibem a formação de ácidos micólicos da parede bacilar e produzem dano no DNA.O gene inhA codifica a enzima carreadora de enoil (acil redutase) NADH dependente, que é importante na síntese de ácidos micólicos. Um dos produtos da isoniazida ativada (o radical acil isonicotínico) liga-se à NADH e impede a atividade da enzima, resultando na morte da bactéria por interferência na síntese do ácidos micólicos. As micobactérias que apresentam resistência à Isoniazida geralmente se livram dessa enzima que ativa o medicamento ou apresentam mutações, como no gene katG há diminuição da ação da catalase. A mutação estrutural do gene inhA faz com que a enzima modificada perca afinidade pela NADH. Ambas mutações resultam em resistência É bacteriostático e é utilizado ate hoje, embora algumas linhagens já apresentem resistência ao medicamento.
A Pirazinamida é um antibiótico muito utilizado no tratamento da Tuberculose. Não se sabe o exato mecanismo de ação pelo qual a pirazinamida inibe o crescimento da Mycobacterium tuberculosis (Mtb), porém sabe-se que ela tem atividade altamente específica contra essa micobactéria, não exercendo qualquer efeito sobre as outras. É provável que a quebra da molécula da pirazinamida através de sua enzima pirazinamidase-nicotinamidase nessas micobactérias produz ácido pirazinoico, a forma ativa da droga, em pH ácido. A atividade defeituosa da pirazinamidase, devido a mutações no pncA, é a principal causa de resistência a pirazinamida.
Etambutol é um tuberculostático sintético e micobacteriostático que não possui efeito sobre outras bactérias. O exato mecanismo não está totalmente conhecido, mas parece inibir a síntese de metabólitos, levando ao dano ao metabolismo celular, parada da multiplicação e morte celular. É ativo apenas quando a célula estiver em divisão.A resistência desenvolve-se in vivo, quando administrada na ausência de outra droga eficaz.
A Dapsona é um medicamento utilizado para diversos problemas que afetam a pele. Muito usado no tratamento da Hanseníase, ele age inibindo a síntese de ácido fólico, pela competição com o ácido para-amino-benzóico (PABA) na bactéria, devido a sua similaridade estrutural. Com isso há inibição na formação de DNA e RNA, impedindo a replicação e transcrição do mesmo, afinal o PABA é essencial na síntese de ácido fólico e consequentemente para a síntese de purinas, envolvidas diretamente na formação de DNA e RNA. A resistência à dapsona é associada às mutações nos códons 53 e 55 no gene folp1, gene relacionado à biossíntese de folato.
Clofazimina: Ela tem ação bacteriostática com relação ao bacilo de Hansen, ou seja inibe o crescimento micobacteriano, e, também segundo alguns, uma ação antinflamatória. Ainda não foi demonstrada resistência do Mycobacterium leprae à clofazimina e pouco se sabe sobre seu mecanismo de ação exato.
A associação da dapsona, rifampicina e clofazimina é eficaz no tratamento da hanseníase multibacilar, entretanto a dapsona é responsável por inúmeros efeitos colaterais, tais como anemia hemolítica, metahemoglobinemia, erupções cutâneas, neuropatias, agranulocitose, entre outras. Por isso tratamentos alternativos, como a substituição da dapsona pela ofloxacina, ou a utilização do sistema ROM (rifampicina, ofloxacina e minociclina) estão sendo aplicados atualmente.
A ofloxacina, uma droga do grupo das fluoroquinolonas, que possui grande espectro de ação, inibe a replicação do DNA devido à ligação com a subunidade A da DNA girase no gene gyrA. Mutações associadas com o gene gyrA são comumente relatadas em micobactérias. As mutações identificadas até o momento no gene gyrA encontram-se no códon 89 e no códon 91. Também substituições de aminoácidos nos códons 91 e 94 são associadas com resistência às quinolonas.
As fluoroquilonas demonstraram poderosa atividade tuberculocida. Seu uso no tratamento da doença aumentou pelos recentes surtos de tuberculose resistente à diversas drogas. Entretanto, a utilização frequente das fluoroquinolonas no tratamento de diversas outras doenças infecciosas está gerando bactérias resistentes à essas drogas. Esse antibiótico pode desencadear uma vasta onda de efeitos colaterais debilitantes e portanto não devem ser usadas como primeira linha de tratamento.
O tratamento das doenças é mais eficaz quando administrado combinações de antibióticos, diminuindo a quase 0% as chances da bactéria possuir resistência aos dois medicamentos utilizados.
Micobacteriófagos são um tipo de vírus bacteriófago que têm micobactérias como hospedeiras. Originalmente isolados de Mycobacterium smegmatis ,[11] hoje são conhecidos mais de 4,200 micobacteriófagos, sendo mais de 500 completamente sequenciados.[12] Todos os micobacteriófagos conhecidos apresentam DNA de fita dupla e são classificados nas famílias Siphoviridae e Myoviridae.[13] Devido a uma especificidade de hospedeiro relativamente alta, micobacteriófagos podem ser usados para identificar espécies e linhagens de micobactérias. [14] Nos anos 1980, micobacteriófagos foram descobertos como ferramentas para a manipulação genética de micobactérias,[15][16] apresentando possibilidade para, no futuro, serem usados para identificar resistência [17] ou tratar infecções.[18]
O uso de micobactérias para a biotecnologia se volta principalmente para a cura de suas principais doenças, a tuberculose e a hanseníase.[19] A dificuldade natural para o tratamento dessas doenças, aliadas ao surgimento de cepas resistentes, requer técnicas de tratamento mais eficazes. Descobertas como a formação de biofilme protetor [20] e a função de uma recém descoberta fosforibosiltransferase,[21] um tipo de transferase, apresentam novos alvos para drogas antimicrobacterianas. A popularização do sistema CRISPR também mostra uma possível nova abordagem para a identificação e eliminação de micobactérias, em especial Mycobacterium tuberculosis.[22][23]
|ano= (ajuda) |ano= (ajuda) Mycobacterium ou micobactéria é um gênero de actinobactérias bacilares, aeróbicas obrigatórias, imóveis e altamente patogênicas, que causam diversas doenças, entre as quais lepra, tuberculose e infeções por micobactérias não tuberculosas. Possuem a forma de bacilos retos ou levemente curvado, sem a presença de flagelos ou de cápsula, além de não ter formação do endosporo. Apesar das micobactérias não possuírem membrana externa e, por isso, se assemelharem às gram-positivas, seu alto teor lipídico confere diferenças estruturais importantes na parede. A presença de ácidos graxos no envelope confere uma álcool-ácido resistência (AAR) - retendo fucsina básica pela parede mesmo na presença de álcool e ácido durante a coloração de Gram. Microorganismo intracelulares, que infectam e proliferam-se dentro de macrófagos.
As manifestações clínicas de infecções micobacterianas decorrem da resposta imunológica do hospedeiro à infecção e aos antígeos que portam. Possuem inúmeras resistências a antibióticos típicos e exigem tratamentos de muitas semanas, meses ou anos. Normalmente administrado mais de um antibiótico, já que algumas cepas já apresentam resistência antimicrobiana considerável.
Micobacteriile (Mycobacterium) sunt bacterii în formă de bastonașe, uneori ramificate, sau de cocobacili. Sunt imobile, nu formează spori adevărați, unele specii sunt acidorezistente; unele micobacterii sunt saprofite, foarte răspândite în natură (în sol, în resturi vegetale etc.) iar altele sunt parazite, provocând boli la om, la animale sau la plante.
Printre cele mai cunoscute micobacterii se află: Mycobacterium tuberculosis (bacilul Koch), Mycobacterium leprae (agentul patogen al leprei).
Acest articol conține text din Dicționarul enciclopedic român (1962-1966), aflat acum în domeniul public.
Acest articol conține text din Dicționarul enciclopedic român (1962-1966), aflat acum în domeniul public.
Mykobakterier (Mycobacterium) är ett släkte bakterier i ordningen Actinomycetales och den enda systematiska gruppen i familjen Mycobacteriaceae.
Orörliga grampositiva, stavformade bakterier, som kan bilda trådar. Deras speciella cellvägg som har hög halt av mykocerosinsyror medför att bakterierna blir motståndskraftiga för kemisk påverkan. [1]
Olika arter:
Mykobakterier (Mycobacterium) är ett släkte bakterier i ordningen Actinomycetales och den enda systematiska gruppen i familjen Mycobacteriaceae.
Orörliga grampositiva, stavformade bakterier, som kan bilda trådar. Deras speciella cellvägg som har hög halt av mykocerosinsyror medför att bakterierna blir motståndskraftiga för kemisk påverkan.
Olika arter:
Mycobacterium tuberculosis orsakar tuberkulos. Mycobacterium ulcerans orsakar burulisårMycobacterium ya da Mycobacteriaceae; aside dirençli, uzun veya kısa çomaklar halinde, hareketsiz, sporsuz, kapsülsüz ve aerobik özelliğe sahip mikroorganizmalardır. Mikobakteriler standart hücre duvarı yapısına sahip değildirler ve gram pozitif veya gram negatif olarak sınıflandırılamazlar. Bilinen anlamda kapsül bulunmamasına rağmen hücre duvarlarında çok fazla lipid bulunur. Bu madde mikroorganizmayı hem çevresel koşulların etkisinden korur hem de normal boyalarla boyanamama özelliğini de meydana getirir. Bu nedenle mikobakterileri boyamak için alttan hafifçe ısıtılmaları gerekir.
Bu gruptaki önemli etkenler ve yaptıkları hastalıklar şunlardır:
Mycobacterium tuberculosis dışında kalan tüm mycobacter'ler tüberküloz dışı mycobacter'ler Nontuberculous mycobacteria (NTM) olarak da bilinir.[1]
Etkenler, Ziehl-Nielsen boyama yöntemiyle karbol-fuksin ve metilen mavisi kullanılarak boyanırlar. Karbol-fuksin preparatlara döküldükten sonra lam, alttan ısıtılır. Böylece hücre duvarı lipoidal madde biraz gevşemiş olur ve boya içeri girer. Sonra preparat asit alkol ile dekolere edilir. Bu işlem sırasında da bakteri içine giren boya çıkmaz. Arkasından preparat metilen mavisiyle boyanır. Mikroskopta tüberküloz etkenleri pembe renkte, ortam ve diğer etkenler mavi renkte görünürler.
Mycobacterium tuberculosis ve M. avium üremeleri sırasında gliserine ihtiyaç duyarlar ki bunlara eugonik etken denir. M. bovis ise gliserinli ortamda üremez ve buna da disgonik etken denir. Ürerken M. avium nemli, mucoid koloni; M. bovis kuru; M. tuberculosis ise kuru, granüllü, turuncu pigment yapar.
Laboratuvar hayvanlarından kobaylar M. tuberculosis’e ve bovis’e duyarlı, M. avium’a ise direnç gösterirler. Tavşanlar M. tuberculosis ve avium’a dirençli, M. bovis’e duyarlıdır. Kanatlılar M. avium’a duyarlı, diğerlerine dirençlidir.
Mycobacterium ya da Mycobacteriaceae; aside dirençli, uzun veya kısa çomaklar halinde, hareketsiz, sporsuz, kapsülsüz ve aerobik özelliğe sahip mikroorganizmalardır. Mikobakteriler standart hücre duvarı yapısına sahip değildirler ve gram pozitif veya gram negatif olarak sınıflandırılamazlar. Bilinen anlamda kapsül bulunmamasına rağmen hücre duvarlarında çok fazla lipid bulunur. Bu madde mikroorganizmayı hem çevresel koşulların etkisinden korur hem de normal boyalarla boyanamama özelliğini de meydana getirir. Bu nedenle mikobakterileri boyamak için alttan hafifçe ısıtılmaları gerekir.
Bu gruptaki önemli etkenler ve yaptıkları hastalıklar şunlardır:
Mycobacterium tuberculosis : İnsanlarda etkilidir. Köpek gibi bazı ev hayvanlarına da insanlardan geçebilen bu etken Verem hastalığına neden olur. Mycobacterium bovis : Sığırların tüberküloz etkenidir. İnsanlardaki tüberkülozun da 2. derecede sorumlusudur. Mycobacterium avium : Kanatlıların tüberküloz etkenidir. Yine madenocağı işçilerinde de akciğer tüberkülozu yaptığı bildirilmiştir. Mycobacterium avium subspecies paratuberculosis (Mycobacterium paratuberculosis): Sığırlarda paratüberküloz etkendir. Mycobacterium lepra : İnsanlarda cüzzam hastalığına neden olur. Mycobacterium marinum : Balıkların tüberküloz etkenidir. İnsanlara bulaşması halinde Tüberküloz'un deri formuna neden olur.Mycobacterium tuberculosis dışında kalan tüm mycobacter'ler tüberküloz dışı mycobacter'ler Nontuberculous mycobacteria (NTM) olarak da bilinir.
Виділяють 3 групи:
1. Патогенні
2. Умовно-патогенні (40 видів)
3. Сапрофіти
Представники роду Mycobacterium — це аеробні нерухомі бактерії (за виключенням Mycobacterium marinum, здатного рухатися всередині макрофагів), кислотостійкі[1]. Ці бактерії не утворюють спор і капсул та зазвичай розглядаються як грам-позитивні. Хоча вони і не забарвлюються за Грамом, їх класифікують як кислотостійкі грам-позитивні бактерії через відсутність у них зовнішньої мембрани.
Всі види роду характеризуються унікальною структурою клітинної стінки, товстішою за більшість бактерій, гідрофобною, восковистою, багатою на міколову кислоту та її солі. Головними шарами клітинної стінки є шари гідрофобних міколатів та шар пептидоглікану, зв'язаний з молекулами полісахариду-арабіногалактану. Клітинна стінка у великій мірі впливає на стійкість представників роду, в результаті її компоненти стають основними цілями для нових ліків проти хвороб, які спричинюють ці бактерії[2]
Клеточная стенка, помимо гидрофобных миколатов, в значительной степени состоит из сложных полисахаридов, некоторые из которых имеют для жизнедеятельности клетки особое значение. Терминальные фрагменты липоарабиноманнана, прежде всего его маннозные радикалы, неспецифически подавляют активацию Т-лимфоцитов и лейкоцитов периферической крови животных, что приводит к нарушению иммунного ответа на микобактерии[5]. В ходе эволюции микобактерии выработали различные механизмы преодоления или инактивации неблагоприятных факторов внешней среды. Во-первых, это особая клеточная стенка. Во-вторых, это обширные метаболические возможности. Они способны инактивировать многие клеточные токсины и вещества (различные перекиси, альдегиды и другие), разрушающие клеточную оболочку. В-третьих, это морфологическая пластичность, заключающаяся в трансформации микобактерий (образование L-форм, дормантных клеток). По своей устойчивости, после спорообразующих бактерий, они занимают лидирующее место в домене бактерий. Клетки сохраняют свою жизнеспособность в сухом состоянии до 3 лет. При нагревании некоторые виды микобактерий могут выдерживать температуру существенно выше 80 °С. Микобактерии туберкулёза устойчивы к органическим и неорганическим кислотам, щёлочам, многим окислителям, а также к ряду антисептических и дегидратирующих веществ, оказывающих губительное действие на другие патогенные микроорганизмы. Микобактерии проявляют устойчивость к воздействию спиртов и ацетона. Отмечено, что средства на основе четвертичного аммония не проявляют антимикобактериальной активности. В определённых условиях концентрации радикалов хлора и кислорода до 0,5 % также не оказывают губительного действия на микобактерии.
Микобактерии туберкулёза нечувствительны к рассеянному солнечному свету и могут более года существовать во внешней среде без потери жизнеспособности. Коротковолновое ультрафиолетовое излучение оказывает универсальное бактерицидное действие на все микроорганизмы. Однако в реальных условиях, когда микобактерии туберкулёза находятся во взвешенном состоянии в виде клеточных агломератов с пылевыми частицами, их устойчивость к ультрафиолетовому излучению возрастает[5].
Уникальность и ключевая роль миколовых кислот в структурной организации и физиологии микобактерий делают их отличной мишенью для этиотропной терапии[6].
Размножаются делением клеток. Широко распространены в почве. Сапрофитные формы участвуют в минерализации органических остатков, некоторые окисляют парафины и другие углеводороды. Могут использоваться для борьбы с загрязнением биосферы нефтью[7].
Согласно классификации Раньона нетуберкулёзных микобактерий на основе культуральных различий от 1959 года, по продукции пигмента колониями выделяют 4 группы микобактерий:
Патогенные виды вызывают болезни человека (туберкулёз, лепру, микобактериозы) и животных. Всего известно 74 вида таких микобактерий. Они широко распространены в почве, воде и среди людей.
Туберкулёз у человека вызывают виды Mycobacterium tuberculosis complex: Mycobacterium tuberculosistypus (человеческий вид), Mycobacterium bovis (бычий вид) и Mycobacterium africanum (промежуточный вид), у больных СПИД — также виды Mycobacterium avium complex. Эти виды способны проникать, жить и размножаться внутри человека.
Лепру (проказу) вызывает вид Mycobacterium leprae.
По старой системе микобактерии классифицировались, в зависимости от их свойств и скорости роста на питательных средах. Однако более новая номенклатура базируется на кладистике.
Mycobacterium avium complex (MAC) — часть большой группы нетуберкулёзных микобактерий (НТМБ), виды, составляющие данный комплекс, патогенны для человека и животных, чаще вызывают диссеминированные процессы внелёгочной локализации и являлись ранее одной из основных причин смерти больных СПИДом. Комплекс включает:
Клеточная стенка, помимо гидрофобных миколатов, в значительной степени состоит из сложных полисахаридов, некоторые из которых имеют для жизнедеятельности клетки особое значение. Терминальные фрагменты липоарабиноманнана, прежде всего его маннозные радикалы, неспецифически подавляют активацию Т-лимфоцитов и лейкоцитов периферической крови животных, что приводит к нарушению иммунного ответа на микобактерии. В ходе эволюции микобактерии выработали различные механизмы преодоления или инактивации неблагоприятных факторов внешней среды. Во-первых, это особая клеточная стенка. Во-вторых, это обширные метаболические возможности. Они способны инактивировать многие клеточные токсины и вещества (различные перекиси, альдегиды и другие), разрушающие клеточную оболочку. В-третьих, это морфологическая пластичность, заключающаяся в трансформации микобактерий (образование L-форм, дормантных клеток). По своей устойчивости, после спорообразующих бактерий, они занимают лидирующее место в домене бактерий. Клетки сохраняют свою жизнеспособность в сухом состоянии до 3 лет. При нагревании некоторые виды микобактерий могут выдерживать температуру существенно выше 80 °С. Микобактерии туберкулёза устойчивы к органическим и неорганическим кислотам, щёлочам, многим окислителям, а также к ряду антисептических и дегидратирующих веществ, оказывающих губительное действие на другие патогенные микроорганизмы. Микобактерии проявляют устойчивость к воздействию спиртов и ацетона. Отмечено, что средства на основе четвертичного аммония не проявляют антимикобактериальной активности. В определённых условиях концентрации радикалов хлора и кислорода до 0,5 % также не оказывают губительного действия на микобактерии.
Микобактерии туберкулёза нечувствительны к рассеянному солнечному свету и могут более года существовать во внешней среде без потери жизнеспособности. Коротковолновое ультрафиолетовое излучение оказывает универсальное бактерицидное действие на все микроорганизмы. Однако в реальных условиях, когда микобактерии туберкулёза находятся во взвешенном состоянии в виде клеточных агломератов с пылевыми частицами, их устойчивость к ультрафиолетовому излучению возрастает.
Уникальность и ключевая роль миколовых кислот в структурной организации и физиологии микобактерий делают их отличной мишенью для этиотропной терапии.
Размножаются делением клеток. Широко распространены в почве. Сапрофитные формы участвуют в минерализации органических остатков, некоторые окисляют парафины и другие углеводороды. Могут использоваться для борьбы с загрязнением биосферы нефтью.
Согласно классификации Раньона нетуберкулёзных микобактерий на основе культуральных различий от 1959 года, по продукции пигмента колониями выделяют 4 группы микобактерий:
Фотохромогенные (Группа I) Микобактерии, непигментированные при выращивании в темноте, но приобретающие ярко-жёлтую или жёлто-оранжевую пигментацию после выдерживания или реинкубации на свету. Ex: M. kansasii, M. marinum, M. simiae, M. asiaticum Скотохромогенные (Группа II) К этой группе относят микобактерии, образующие пигмент как в темноте, так и на свету. Скорость роста 30—60 дней. Ex: M. scrofulaceum, M. gordonae, M. xenopi, M. szulgai Нефотохромогенные микобактерии (Группа III) К этой группе относят микобактерии, не образующие пигмент или имеющие бледно-жёлтую окраску, которая не усиливается на свету. Растут в течение 2—3 или 5—6 недель. Ex: M. tuberculosis, M. avium, M.intra-cellulare, M. bovis, M. ulcerans Ex: M. chelonae Быстрорастущие микобактерии (Группа IV) Микобактерии, относящиеся к этой группе, характеризуются быстрым ростом (до 7—10 дней) в виде пигментных или беспигментных колоний, чаще R-формы. Ex: M. phlei, M. smegmatis, M. fortuitum{{Translated page}}标签。
本条目需要擴充。(2014年7月2日) 分枝杆菌屬(Mycobacterium)為放线菌门下的一個屬,且為分枝桿菌科唯一的屬。
该属细菌包括许多已知在哺乳類动物中造成严重疾病的病原菌,包括结核杆菌(Mycobacterium tuberculosis)和麻风杆菌(Mycobacterium leprae)[1]。
希臘語中的 myco 表示「真菌」,意思是說該屬的物種通常在液態培養基的表面,形成類似黴菌的菌落。[2]
本屬物種為好氧型細菌,且為不運動型細菌(海洋分枝桿菌除外,其可以在巨噬細胞內運動),為一種抗酸型細菌(英语:Acid-fast)[1]。分枝桿菌並不會形成内孢子或莢膜,因此常被認定為革蘭氏陰性菌。且分枝桿菌在革蘭氏染色上並無法染上結晶紫,因此無法被歸類於革蘭氏陽性菌或陰性菌。
雖然說本屬不產孢子,但有兩個物種似乎例外,那就是海洋分枝桿菌(Mycobacterium marinum)和牛分枝桿菌(M. bovis)[3]。但進一步的研究引發了爭論。[4]
分枝桿菌的特點就是其細胞壁較其他物種厚,且呈蠟狀疏水性,並含有大量的分枝菌酸(英语:mycolic acids)(mycolic acids)。多醣會將分枝菌酸層及肽聚糖層拉在一起,讓細胞壁變得十分堅韌。若可干擾其細胞壁的生物合成途徑,也許可以開發治療肺結核的藥物。[5]
Phenotypic tests(英语:Phenotypic testing of mycobacteria) can be used to identify and distinguish different Mycobacteria species and strains. In older systems, mycobacteria are grouped based upon their appearance and rate of growth. However, these are symplesiomorphies(英语:Symplesiomorphy), and more recent classification is based upon cladistics.
Mycobacteria can be infected by Mycobacteriophage(英语:Mycobacteriophage), bacterial viruses that may be used in the future to treat tuberculosis and related diseases by phage therapy(英语:phage therapy).
分枝杆菌屬(Mycobacterium)為放线菌门下的一個屬,且為分枝桿菌科唯一的屬。
该属细菌包括许多已知在哺乳類动物中造成严重疾病的病原菌,包括结核杆菌(Mycobacterium tuberculosis)和麻风杆菌(Mycobacterium leprae)。
希臘語中的 myco 表示「真菌」,意思是說該屬的物種通常在液態培養基的表面,形成類似黴菌的菌落。
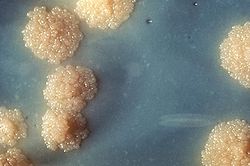
M. africanum
M. agri
M. aichiense
M. algericum
M. alvei
M. arabiense
M. aromaticivorans
M. arosiense
M. arupense
M. asiaticum
M. aubagnense
M. aurum
M. austroafricanum
M. avium
M. bacteremicum
M. boenickei
M. bohemicum
M. bolletii
M. botniense
M. bouchedurhonense
M. bourgelatii
M. bovis
M. branderi
M. brisbanense
M. brumae
M. canariasense
M. caprae
M. celatum
M. chelonae
M. chimaera
M. chitae
M. chlorophenolicum
M. chlorophenolicum
M. chubuense
M. colombiense
M. conceptionense
M. confluentis
M. conspicuum
M. cookii
M. cosmeticum
M. crocinum
M. diernhoferi
M. doricum
M. duvalii
M. elephantis
M. europaeum
M. fallax
M. farcinogenes
M. flavescens
M. florentinum
M. fluoranthenivorans
M. fortuitum
M. frederiksbergense
M. gadium
M. gastri
M. genavense
M. gilvum
M. goodii
M. gordonae
M. haemophilum
M. hassiacum
M. heckeshornense
M. heidelbergense
M. hiberniae
M. hippocampi
M. hodleri
M. holsaticum
M. houstonense
M. immunogenum
M. insubricum
M. interjectum
M. intermedium
M. intracellulare
M. iranicum
M. kansasii
M. komossense
M. koreense
M. kubicae
M. kumamotonense
M. kyorinense
M. lacus
M. lentiflavum
M. leprae
M. lepraemurium
M. litorale
M. llatzerense
M. madagascariense
M. mageritense
M. malmoense
M. mantenii
M. marinum
M. marseillense
M. massiliense
M. microti
M. minnesotense
M. monacense
M. montefiorense
M. moriokaense
M. mucogenicum
M. murale
M. neoaurum
M. nebraskense
M. neworleansense
M. nonchromogenicum
M. noviomagense
M. novocastrense
M. obuense
M. pallens
M. palustre
M. paraffinicum
M. parafortuitum
M. paragordonae
M. parakoreense
M. parascrofulaceum
M. paraseoulense
M. paratuberculosis
M. parmense
M. peregrinum
M. phlei
M. phocaicum
M. pinnipedii
M. porcinum
M. poriferae
M. pseudoshottsii
M. psychrotolerans
M. pulveris
M. pyrenivorans
M. rhodesiae
M. riyadhense
M. rufum
M. rutilum
M. salmoniphilum
M. saskatchewanense
M. scrofulaceum
M. sediminis
M. senegalense
M. senuense
M. seoulense
M. septicum
M. setense
M. sherrisii
M. shimoidei
M. shinjukuense
M. shottsii
M. simiae
M. smegmatis
M. sphagni
M. stomatepiae
M. szulgai
M. terrae
M. thermoresistibile
M. timonense
M. tokaiense
M. triplex
M. triviale
M. tuberculosis(ヒト型結核菌;タイプ種)
M. tusciae
M. ulcerans
M. vaccae
M. vanbaalenii
M. vulneris
M. wolinskyi
M. xenopi
M. yongonense
マイコバクテリウム属(マイコバクテリウムぞく、Mycobacterium、ミコバクテリウム属)はグラム陽性細菌に分類される真正細菌の一属。現在、170種と13亜種が登録されている(2015年4月28日現在)[1]。
マイコバクテリウム属(マイコバクテリウムぞく、Mycobacterium、ミコバクテリウム属)はグラム陽性細菌に分類される真正細菌の一属。現在、170種と13亜種が登録されている(2015年4月28日現在)。
ラテン語の接頭辞「myco-」はギリシア語「キノコ(μυκης)」の借用語で、「カビ(fungus)」「ロウ(wax)」の両方の意味をもつ。古典ラテン語だとミュコバクテーリウムと発音し、慣例ではミコバクテリウムとも表記される。 グラム陽性菌のグループに分類されているが、細胞壁にロウ質であるミコール酸を含むため染色されにくくグラム不定型である。一旦染色されると、酸アルコールによる脱色に抵抗性を示すため、抗酸菌(acid fast bacteria)とも呼ばれる。
미코박테륨(Mycobacterium)은 세균의 한 속인 미코박테륨속에 속하는 세균으로, 미코박테륨속은 홀로 미코박테륨과를 이루고 있다. 결핵이나 나병 등을 일으키는 여러 병원균을 포함한다.
라틴어 접두사 'myco-'는 '균'과 '밀랍'을 의미하는데, 세포벽 일부를 구성하는 밀랍 같은 부분을 반영한다.
그람 염색등 일반적인 염색에서 산(酸)에 저항성을 보이는 항산균으로, 그람 염색은 사용할 수 없고 질-닐슨 염색 등의 특수한 염색법을 사용해야 한다.
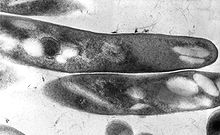
미코박테륨(Mycobacterium)은 세균의 한 속인 미코박테륨속에 속하는 세균으로, 미코박테륨속은 홀로 미코박테륨과를 이루고 있다. 결핵이나 나병 등을 일으키는 여러 병원균을 포함한다.
라틴어 접두사 'myco-'는 '균'과 '밀랍'을 의미하는데, 세포벽 일부를 구성하는 밀랍 같은 부분을 반영한다.
그람 염색등 일반적인 염색에서 산(酸)에 저항성을 보이는 항산균으로, 그람 염색은 사용할 수 없고 질-닐슨 염색 등의 특수한 염색법을 사용해야 한다.