tr
kırıntılardaki isimler


In die mediese vakterminologie verwys die begrip gonokokkus (Grieks “gone” saad; “kokkus” bessie) na 'n boonvormige mikro-organisme met die eienskappe van 'n slymvliesparasiet. Die mikro-organisme is die verwekker van gonorree.
El gonococ (Neisseria gonorrhoeae) és una[1] espècie bacteriana gram negativa que forma diplococs. És l'agent causant de la gonorrea, malaltia de transmissió sexual, també és responsable de l'oftalmia neonatal.[2] N. gonorrhoeae fou descrit per Albert Neisser el 1879. Es tracta d'un paràsit exclusiu dels humans, ja que no s'ha trobat en cap altra espècie. És un organisme molt sensible a la dessecació i a les radiacions UV, així doncs la seva transmissió es produeix per contacte íntim entre dues persones, generalment el coit.[3]
Com a paràsit estricte les mostres es recullen directament del possible punt d'infecció. Neisseria es desenvolupa sobre les mucoses especialment les de la uretra i del cèrvix uterí, però també sobre la mucosa anal i la conjuntiva. De forma secundària pot dispersar-se per via sanguínia a altres epitelis mucosos. La recollida de la mostra es pot fer mitjançant un frotis uretral o cervical amb un escovilló per tal d'absorbir aquest exsudat. També es pot recollir la primera micció matutina.[4]
Si l'observació microscòpica directa d'aquesta mostra després d'una tinció Gram revela la presència de diplococs s'ha de considerar un diagnòstic presumptiu que hauria de ser confirmat amb proves bioquímiques o moleculars, ja que altres diplococs gram negatius poden forma part de la flora del tracte genital.[4]
Totes les espècies del gènere Neisseria són de difícil cultiu, ja que requereixen la presència de nutrients específics per a ser cultivats. Per al seu aïllament en laboratori es fa servir comunament medis selectius que contenen, sang o hemoglobina escalfada, l'agar xocolata, i cultivats amb atmosferes enriquides amb 3-7% de diòxid de carboni. Neisseria també s'aïlla usant plaques d'agar Thayer-Martin amb tres antibiòtics diferents (Vancomicina, nistatina i colistina) i nutrients que faciliten la proliferació de d'espècies de Neisseria, i inhibeixen la proliferació de bacteris gram positius i la majoria dels bacils i fongs. La sembra es realitza per estria. La presència de colònies es confirma a les 24h i 48 h de cultiu. La presència de colònies de diplococs gram-negatius oxidasa positiu (tots els gonococs són oxidasa positius, és a dir que tenen citocrom c) és un altre diagnòstic presumptiu que s'ha d'acabar de confirmar amb la utilització de determinats monosacàrids per a la diagnosi definitiva del gonococ. Als darrers anys també existeixen proves de detecció basades en sondes d'ADN.[4]
La capacitat patogènica del gonococ ve determinada per una lipoproteïna que actua com una endotoxina.[5] També hi juga un paper important la pilina que permet l'adhesió del microorganisme a la mucosa. Posteriorment la porina, P. I (Por), permet la seva entrada a les cèl·lules de l'epiteli per endocitosi.[6] D'altra banda també produeix proteases, IgA1, que ataquen la cadena pesant de les immunoglobulines humanes permetent-li escapar al control per part del sistema immunitari[6]
Els símptomes de la infecció amb N. gonorrhoeae variar depenent del lloc d'infecció. La infecció del tracte genital pot resultar en una descàrrega purulenta de la uretra, tot i que alguns cops pot no arribar a produir-se. Aquesta descàrrega pot associar-se amb mala olor, inflamació, envermelliment, inflor, disúria i sensació d'ardor en orinar. N. gonorrhoeae també pot causar conjuntivitis, faringitis, proctitis o uretritis, prostatitis i orquitis.[6]
La conjuntivitis és la forma d'infecció més habitual en nadons i és un procediment generalitzat l'aplicació de nitrat de plata o antibiòtics si es sospita o se sap que la mare pateix gonocòccia genital per a prevenir-ne la infecció ocular durant el part. L'oftalmia neonatal, si no es tracta adequadament pot arribar a causar ceguesa o greus alteracions en la vista.
La disseminació de les infeccions pel gonococ poden comportar endocarditis, meningitis o síndrome gonocòccic dermatoartrític, aquest darrer es presenta amb artràlgia, tenosinovitis i dermatitis indolora no prurítica.
La infecció gonocòccica dels genitals en les dones pot resultar en la malaltia inflamatòria pelviana, si no es tracta, el que pot provocar infertilitat i embarassos ectòpics.
La resistència del gonococ a la penicil·lina és força freqüent i l'adquisició d'aquestes resistències per transformació està documentada experimentalment.[7] A principis de la dècada de 2000 la ceftriaxona (una cefalosporina de 3a generació) s'utilitzava sovint com a tractament d'elecció, en cas de soques resistents. També cal investigar la possible presència de coinfecció amb Chlamydia trachomatis.
La prevenció primària se centra principalment, segons la institució consultada, en l'abstinència sexual o l'ús de preservatius.
El gonococ (Neisseria gonorrhoeae) és una espècie bacteriana gram negativa que forma diplococs. És l'agent causant de la gonorrea, malaltia de transmissió sexual, també és responsable de l'oftalmia neonatal. N. gonorrhoeae fou descrit per Albert Neisser el 1879. Es tracta d'un paràsit exclusiu dels humans, ja que no s'ha trobat en cap altra espècie. És un organisme molt sensible a la dessecació i a les radiacions UV, així doncs la seva transmissió es produeix per contacte íntim entre dues persones, generalment el coit.
Neisseria gonorrhoeae je gramnegativní bakterie z kmene proteobakterií, která vyvolává pohlavně přenosnou chorobu kapavku. Jsou to velmi choulostivé a kultivačně náročné diplokoky. Jednotlivé koky mají tvar kávového zrna. Kapavka u muže probíhá obvykle jako hnisavá uretritida a u ženy jako cervicitida.
Při podezření na kapavku prokazujeme N. gonorrhoeae ve výtěru z pochvy, děložního hrdla a močové trubice, obvykle také z rekta; u muže pak z močové trubice a rekta.
Tento článek je příliš stručný nebo postrádá důležité informace.Neisseria gonorrhoeae je gramnegativní bakterie z kmene proteobakterií, která vyvolává pohlavně přenosnou chorobu kapavku. Jsou to velmi choulostivé a kultivačně náročné diplokoky. Jednotlivé koky mají tvar kávového zrna. Kapavka u muže probíhá obvykle jako hnisavá uretritida a u ženy jako cervicitida.
Neisseria gonorrhoeae (syn. Gonococcus neisseri, Micrococcus gonorrhoeae; Gonokokke) ist ein gramnegatives, unbewegliches Bakterium. Gonokokken sind die Auslöser der Gonorrhoe (syn. Tripper) und anderer Erkrankungen.
Gonokokken sind gramnegative, aerobe Diplokokken. Gonokokken sind gegenüber Umwelteinflüssen, insbesondere gegen Austrocknung, sehr empfindlich. Gonokokken sind Katalase- und Zytochromoxidase-positiv.
Gonokokken fehlt im Gegensatz zu Neisseria meningitidis eine echte Kapsel. Die Membran der Gonokokken enthält jedoch Lipooligosaccharide (LOS), von denen bestimmte Unterformen Sialinsäure binden können und damit eine kapselartige Struktur aufbauen, die Serumresistenz und extrazelluläres Überleben im Wirt ermöglicht. Gonokokken entziehen sich wirkungsvoll der humoralen Immunantwort des Wirtes. Der direkte Kontakt mit den Wirtszellen erfolgt über Typ IV Pili und sogenannte OPA-Proteine (OPA=opacity, da sie die Kolonien trübe erscheinen lassen). Gonokokken besitzen verschiedene OPA-Proteine im Genom. Diese werden meist nicht gleichzeitig exprimiert. Der Typ an exprimiertem OPA-Protein ist für den Organotropismus des Keimes ursächlich. Die Keime binden durch die OPA-Proteine an CD66, Heparansulfat-Proteoglykan-Rezeptoren und CGM1 auf Fibroblasten, Epithelzellen und Makrophagen. Außerdem induzieren diese Proteine die Phagozytose. Jedes OPA-Gen hat mehrere sich wiederholende Sequenzen (repeats) aus 5 Nucleotiden. Diese werden regelmäßig herausgeschnitten oder dupliziert, wodurch sich der reading-frame ändert und neue Varianten der OPA-Proteine entstehen. Dieser Mechanismus wird als antigene Variation bezeichnet. Da für Gonokokken die Eisenzufuhr essentiell ist, finden sich auf ihrer Oberfläche zudem Transporter für Transferrin und Laktoferrin.
Gonokokken besitzen aus Pilin aufgebaute Typ IV Pili. Diese Pili können zur Bewegung (Zuckbewegung, engl. twitching motility) über Oberflächen eingesetzt werden. Durch Zyklen von Verlängerung, Bindung des Pilus an die Oberfläche und Verkürzung des Pilus, wird der Zellkörper über das Substrat gezogen, es kommt zu einer zuckenden Bewegung.
Gonokokken-Stämme bilden z. T. Penicillinase und entgehen damit der früher üblichen Therapie mittels Penicillin. Die Penicillinase ist meist Plasmid-kodiert.
Außerdem bilden Gonokokken eine IgA1-Protease. Diese kann IgA-Antikörper spalten. Damit setzen Gonokokken einen wichtigen Abwehrmechanismus der Schleimhäute außer Kraft. Die IgA1-Protease spaltet den konstanten Teil, Fc-Fragment, des Antikörpers vom antigenbindenden Teil, Fab-Fragment, ab. Das Fc-Fragment dient der Bindung an den Fc-Rezeptor phagozytierender Zellen. Diese Bindung und somit die anschließende Phagozytose des Erregers bleibt durch die Spaltung des Antikörpers aus. Das Fab-Fragment erkennt trotzdem, spezifisch, die Epitope der Bakterien und bindet an diese. Die Folge ist, dass die Bakterien durch körpereigene Proteine (Fab-Fragmente) maskiert werden und von den Abwehrzellen nicht mehr als fremd erkannt werden. Das Bakterium entgeht somit den Abwehrzellen und es kommt zur Chronifizierung der Erkrankung.
Gonokokken haben eine weltweite Verbreitung. Das Reservoir ist ausschließlich der infizierte Mensch. Fraglich ist, ob es Übertragungsmöglichkeiten z. B. von oder zum Haustier gibt.
Die Gonorrhoe gilt als häufige Infektion. Ein Infektionsgipfel liegt im jungen Erwachsenenalter. Die Infektion kann insbesondere bei Frauen nur wenige oder uncharakteristische Symptome hervorrufen. Daher wird von einer hohen Dunkelziffer ausgegangen. In Ländern mit schlechter Gesundheitsversorgung findet sich eine hohe Infektionsrate. Die Gonorrhoe ist neben der Infektion durch Chlamydia trachomatis die weltweit häufigste Geschlechtskrankheit.
Gonorrhoe: Die Gonorrhoe verläuft beim Mann meist als schmerzhafte und eitrige Urethritis. Steigt die Erkrankung über die Harnröhre auf, so kann es zur gonorrhoischen Prostatitis und Epididymitis kommen. Harnröhrenstrikturen und Infertilität können die Folge sein. Die Symptome können nach Wochen wieder verschwinden.
Bei Frauen verläuft der Großteil der Infektionen ohne wesentliche Symptome. Bei den übrigen Patientinnen findet sich Ausfluss, schmerzhafte Miktionen und eitrige Sekretionen aus der Harnröhre. Steigt bei Frauen die Infektion auf, so kann sich eine Adnexitis bzw. Salpingitis und ein sogenanntes pelvic inflammatory disease (PID) (Unterleibsentzündung) entwickeln. Daraus kann Sterilität resultieren. Bei Schwangeren ist das Risiko hierfür erhöht. Außerdem kann es zur Infektion der Frucht und der Fruchtblase kommen (Chorionamnionitis) mit dem Risiko eines Abortes.
Gonoblennorrhoe: Dies ist eine eitrige Keratokonjunktivitis des Neugeborenen. Die Infektion der Augen entsteht beim Geburtsvorgang bei einer infizierten Mutter. Es besteht die Gefahr der Perforation und Erblindung. Daher wird seit dem 19. Jahrhundert die Credé-Prophylaxe mit Silbernitrat bzw. Penicillin durchgeführt.
Außerdem können Gonokokken Bindehäute (etwa als Konjunktivis), den Pharynx (vor allem den Oropharynx, den Mundrachen) und den Mastdarm infizieren. Des Weiteren gibt es eine disseminierte Infektion mit Befall z. B. von Gelenken, der Lunge und anderer Organe. Auch Endokarditis und Meningitis können Folge einer Infektion durch Gonokokken sein.[1]
Die Übertragung der Gonokokken erfolgt meist als Schmierinfektion beim Geschlechtsverkehr. Neugeborene infizieren sich durch vaginale Schmierinfektion bei der Geburt. Zur Prophylaxe wird (in Österreich und der Schweiz) Neugeborenen eine antibiotische Lösung mit Erythromycin (früher: Silbernitrat) in die Augen getropft.
Die Inkubationszeit liegt beim Mann zwischen zwei und fünf Tagen und bei der Frau bis zu drei Wochen.
Gonokokken heften sich über spezielle Pili an die Schleimhautzellen der Harnröhre bzw. des Gebärmutterhalses an. Dabei spielt das Adhäsin Pillin eine große Rolle. Einige Gonokokken induzieren durch die Opa-Proteine eine Endozytose an Schleimhautzellen und werden auf der Lumen-abgewandten Seite wieder ausgeworfen (sog. Transzytose). Gonokokken werden von Granulozyten phagozytiert und können meist auch abgetötet werden. Nur ein Teil der Gonokokken überlebt intrazellulär. Die Gewebsschädigung erfolgt durch Induktion einer eitrigen Entzündung und Komplementaktivierung und dadurch bedingter Zerstörung des befallenen Epithels. Dafür scheint v. a. das Lipopolysaccharid der Bakterienzellwand eine große Rolle zu spielen.
Die Therapie erfolgt heute wegen der zunehmenden Verbreitung penicillinasebildender Gonokokken mit Ceftriaxon bzw. einem Cephalosporin der dritten Generation, wobei in Japan mittlerweile gegen sämtliche Cephalosporine resistente Stämme gefunden werden.[2] Da sich häufig eine Doppelinfektion mit Chlamydien finden lässt, wird zusätzlich Azithromycin[3] oder Doxycyclin eingesetzt. Eine Coinfektion mit Syphilis sollte ausgeschlossen werden. Der Therapie-Erfolg wird nach einer Woche mittels Abstrich kontrolliert. Wichtig ist auch die Partner-Behandlung, um Kreuzinfektionen auszuschließen (sog. Ping-Pong-Gonorrhö). Die Credé-Prophylaxe ist die vorbeugende Behandlung von Neugeborenen mit 1%iger Silbernitratlösung oder Erythromycin. Ein Impfstoff ist wegen der hohen Variabilität der Opa- und Pillin-Proteine nicht verfügbar.
Der Nachweis einer Gonokokkeninfektion wird meist mikroskopisch gestellt. Dabei finden sich die typischen semmelförmigen Diplokokken meist im Inneren von Granulozyten. Zur Sicherung der Diagnose erfolgt eine Erreger-Anzucht z. B. auf Kochblut-Agar. Bei Frauen kann die Mikroskopie eines Zervix-Abstrichs negativ ausfallen, da sich die Erreger tief in den Krypten aufhalten können. Heute wird der Nachweis von Gonokokken häufig mit PCR durchgeführt.
In der Schweiz ist der positive laboranalytische Befund zu Neisseria gonorrhoeae für Laboratorien meldepflichtig und zwar nach dem Epidemiengesetz (EpG) in Verbindung mit der Epidemienverordnung und der Verordnung des EDI über die Meldung von Beobachtungen übertragbarer Krankheiten des Menschen.
Albert Neisser entdeckte die Gonokokken im Jahre 1879 im Urethralabstrich eines Patienten. Carl Siegmund Franz Credé führte 1881 die nach ihm benannte Prophylaxe ein. Ernst Bumm gelang 1885 erstmals die Anzucht von Gonokokken.
Neisseria gonorrhoeae (syn. Gonococcus neisseri, Micrococcus gonorrhoeae; Gonokokke) ist ein gramnegatives, unbewegliches Bakterium. Gonokokken sind die Auslöser der Gonorrhoe (syn. Tripper) und anderer Erkrankungen.
Gonokokk — kasallik qoʻzgʻatadigan mikrob; diplokokkparga mansub; nemis olimi A. Neysser topgan (1879). Organizmdan tashqarida uncha chidamli emas; yetarlicha nam joyda (mas, hoʻl lozim, choyshab, mochalkada) boʻlgandagina yuqadi; quritilganda bir necha minutda, 40—45° gacha qizdirilganda esa bir necha soatda halok boʻladi. Dezinfeksiyalovchi kimyoviy moddalar G.ni oʻldiradi. Odamda siydik-tanosil yoʻllari (soʻzakla) va koʻz (blennoreyatsya) shilliq qavatining yiringli kasalliklarini qoʻzgʻatadi.
Gonokokk — kasallik qoʻzgʻatadigan mikrob; diplokokkparga mansub; nemis olimi A. Neysser topgan (1879). Organizmdan tashqarida uncha chidamli emas; yetarlicha nam joyda (mas, hoʻl lozim, choyshab, mochalkada) boʻlgandagina yuqadi; quritilganda bir necha minutda, 40—45° gacha qizdirilganda esa bir necha soatda halok boʻladi. Dezinfeksiyalovchi kimyoviy moddalar G.ni oʻldiradi. Odamda siydik-tanosil yoʻllari (soʻzakla) va koʻz (blennoreyatsya) shilliq qavatining yiringli kasalliklarini qoʻzgʻatadi.
Neisseria gonorrhoeae, also known as gonococcus (singular), or gonococci (plural), is a species of Gram-negative diplococci bacteria isolated by Albert Neisser in 1879.[3] It causes the sexually transmitted genitourinary infection gonorrhea[4] as well as other forms of gonococcal disease including disseminated gonococcemia, septic arthritis, and gonococcal ophthalmia neonatorum.
It is oxidase positive and aerobic, and it survives phagocytosis and grows inside neutrophils.[4] Culturing it requires carbon dioxide supplementation and enriched agar (chocolate agar) with various antibiotics (Thayer–Martin). It exhibits antigenic variation through genetic recombination of its pili and surface proteins that interact with the immune system.[3]
Sexual transmission is through vaginal, anal, or oral sex.[5] Sexual transmission may be prevented through the use of barrier protection.[6] Perinatal transmission may occur during childbirth, and may be prevented by antibiotic treatment of the mother before birth and the application of antibiotic eye gel on the eyes of the newborn.[6] After an episode of gonococcal infection, infected persons do not develop immunity to future infections. Reinfection is possible due to N. gonorrhoeae's ability to evade the immune system by varying its surface proteins.[7]
N. gonorrhoeae can cause infection of the genitals, throat, and eyes.[8] Asymptomatic infection is common in males and females.[6][9] Untreated infection may spread to the rest of the body (disseminated gonorrhea infection), especially the joints (septic arthritis). Untreated infection in women may cause pelvic inflammatory disease and possible infertility due to the resulting scarring.[8] Diagnosis is through culture, Gram stain, or nucleic acid tests, such as polymerase chain reaction, of a urine sample, urethral swab, or cervical swab.[10][11] Chlamydia co-testing and testing for other STIs is recommended due to high rates of co-infection.[12]
Antibiotic resistance in N. gonorrhoeae is a growing public health concern, especially given its propensity to develop resistance easily. [13]
Neisseria species are fastidious, Gram-negative cocci that require nutrient supplementation to grow in laboratory cultures. Neisseria spp. are facultatively intracellular and typically appear in pairs (diplococci), resembling the shape of coffee beans. Neisseria is non-spore-forming, capable of moving using twitching motility, and an obligate aerobe (requires oxygen to grow). Of the 11 species of Neisseria that colonize humans, only two are pathogens. N. gonorrhoeae is the causative agent of gonorrhea and N. meningitidis is one cause of bacterial meningitis.[14]
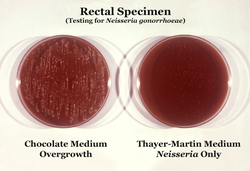
N. gonorrhoeae is usually isolated on Thayer–Martin agar (or VPN) agar in an atmosphere enriched with 3-7% carbon dioxide.[10] Thayer–Martin agar is a chocolate agar plate (heated blood agar) containing nutrients and antimicrobials (vancomycin, colistin, nystatin, and trimethoprim). This agar preparation facilitates the growth of Neisseria species while inhibiting the growth of contaminating bacteria and fungi. Martin Lewis and New York City agar are other types of selective chocolate agar commonly used for Neisseria growth.[10] N. gonorrhoeae is oxidase positive (possessing cytochrome c oxidase) and catalase positive (able to convert hydrogen peroxide to oxygen).[10] When incubated with the carbohydrates lactose, maltose, sucrose, and glucose, N. gonorrhoeae will oxidize only the glucose.[10]
On its surface, N. gonorrhoeae bears hair-like pili, surface proteins with various functions, and sugars called lipooligosaccharides. The pili mediate adherence, movement, and DNA exchange. The Opa proteins interact with the immune system, as do the porins. Lipooligosaccharide (LOS) is an endotoxin that provokes an immune response. All are antigenic and all exhibit antigenic variation (see below). The pili exhibit the most variation. The pili, Opa proteins, porins, and even the LOS have mechanisms to inhibit the immune response, making asymptomatic infection possible.[15]
Dynamic polymeric protein filaments called type IV pili allow N. gonorrhoeae to adhere to and move along surfaces. To enter the host the bacteria uses the pili to adhere to and penetrate mucosal surfaces.[4] The pili are a necessary virulence factor for N. gonorrhoeae; without them, the bacterium is unable to cause infection.[8] To move, individual bacteria use their pili like a grappling hook: first, they are extended from the cell surface and attach to a substrate. Subsequent pilus retraction drags the cell forward. The resulting movement is referred to as twitching motility.[16] N. gonorrhoeae is able to pull 100,000 times its own weight, and the pili used to do so are amongst the strongest biological motors known to date, exerting one nanonewton.[17] The PilF and PilT ATPase proteins are responsible for powering the extension and retraction of the type IV pilus, respectively.[18][19] The adhesive functions of the gonococcal pilus play a role in microcolony aggregation and biofilm formation.[20] Surface proteins called Opa proteins can be used to bind to receptors on immune cells and prevent an immune response. At least 12 Opa proteins are known and the many permutations of surface proteins make recognizing N. gonorrhoeae and mounting a defense by immune cells more difficult.[21]
Lipooligosaccharide (LOS) is a low-weight version of lipopolysaccharide present on the surfaces of most other Gram-negative bacteria. It is a sugar (saccharide) side chain attached to lipid A (thus "lipo-") in the outer membrane coating the cell wall of the bacteria. The root "oligo" refers to the fact that it is a few sugars shorter than the typical lipopolysaccharide.[4] As an endotoxin, LOS provokes inflammation. The shedding of LOS by the bacteria is responsible for local injury in, for example, pelvic inflammatory disease.[4] Although its main function is as an endotoxin, LOS may disguise itself with host sialic acid and block initiation of the complement cascade.[4]
N. gonorrhoeae evades the immune system through a process called antigenic variation.[22] This process allows N. gonorrhoeae to recombine its genes and alter the antigenic determinants (sites where antibodies bind), such as the Type IV pili,[23] that adorn its surface.[4] Simply stated, the chemical composition of molecules is changed due to changes at the genetic level.[7] N. gonorrhoeae is able to vary the composition of its pili, and LOS; of these, the pili exhibit the most antigenic variation due to chromosomal rearrangement.[8][4] The PilS gene is an example of this ability to rearrange as its combination with the PilE gene is estimated to produce over 100 variants of the PilE protein.[7] These changes allow for adjustment to the differences in the local environment at the site of infection, evasion of recognition by targeted antibodies, and contribute to the lack of an effective vaccine.[7]
In addition to the ability to rearrange the genes it already has, it is also naturally competent to acquire new DNA (via plasmids), via its type IV pilus, specifically proteins Pil Q and Pil T.[24] These processes allow N. gonorrhoeae to acquire/spread new genes, disguise itself with different surface proteins, and prevent the development of immunological memory – an ability which has led to antibiotic resistance and has also impeded vaccine development.[25]
Phase variation is similar to antigenic variation, but instead of changes at the genetic level altering the composition of molecules, these genetic changes result in the turning on or off of a gene.[7] Phase variation most often arises from a frameshift in the expressed gene.[7] The Opacity, or Opa, proteins of N. gonorrhoeae rely strictly on phase variation.[7] Every time the bacteria replicate, they may switch multiple Opa proteins on or off through slipped-strand mispairing. That is, the bacteria introduce frameshift mutations that bring genes in or out of frame. The result is that different Opa genes are translated every time.[4] Pili are varied by antigenic variation, but also phase variation.[7] Frameshifts occur in both the pilE and pilC genes, effectively turning off the expression of pili in situations when they are not needed, such as after colonization when N. gonorrhoeae survives within cells as opposed to on their surfaces.[7]
After gonococci invade and transcytose the host epithelial cells, they land in the submucosa, where neutrophils promptly consume them.[4] The pili and Opa proteins on the surface may interfere with phagocytosis,[8] but most gonococci end up in neutrophils. The exudates from infected individuals contain many neutrophils with ingested gonococci. Neutrophils release an oxidative burst of reactive oxygen species in their phagosomes to kill the gonococci.[26] However, a significant fraction of the gonococci can resist killing through the action of their catalase[4] which breaks down reactive oxygen species and is able to reproduce within the neutrophil phagosomes.[27]
Stohl and Seifert showed that the bacterial RecA protein, which mediates repair of DNA damage, plays an important role in gonococcal survival.[28] Michod et al. have suggested that N. gonorrhoeae may replace DNA damaged in neutrophil phagosomes with DNA from neighboring gonococci.[29] The process in which recipient gonococci integrate DNA from neighboring gonococci into their genome is called transformation.[30]
The genomes of several strains of N. gonorrhoeae have been sequenced. Most of them are about 2.1 Mb in size and encode 2,100 to 2,600 proteins (although most seem to be in the lower range).[31] For instance, strain NCCP11945 consists of one circular chromosome (2,232,025 bp) encoding 2,662 predicted open reading frames (ORFs) and one plasmid (4,153 bp) encoding 12 predicted ORFs. The estimated coding density over the entire genome is 87%, and the average G+C content is 52.4%, values that are similar to those of strain FA1090. The NCCP11945 genome encodes 54 tRNAs and four copies of 16S-23S-5S rRNA operons.[32]
In 2011, researchers at Northwestern University found evidence of a human DNA fragment in a N. gonorrhoeae genome, the first example of horizontal gene transfer from humans to a bacterial pathogen.[33][34]
Symptoms of infection with N. gonorrhoeae differ depending on the site of infection and many infections are asymptomatic independent of sex.[35][15][5] It is important to note that depending on the route of transmission, N. gonorrhoeae may cause infection of the throat (pharyngitis) or infection of the anus/rectum (proctitis).[36][8]
Disseminated gonococcal infections can occur when N. gonorrhoeae enters the bloodstream, often spreading to the joints and causing a rash (dermatitis-arthritis syndrome).[36] Dermatitis-arthritis syndrome results in joint pain (arthritis), tendon inflammation (tenosynovitis), and painless non-pruritic (non-itchy) dermatitis.[8] Disseminated infection and pelvic inflammatory disease in women tend to begin after menses due to reflux during menses, facilitating spread.[36] In rare cases, disseminated infection may cause infection of the meninges of the brain and spinal cord (meningitis) or infection of the heart valves (endocarditis).[36][37]
In symptomatic men, the primary symptom of genitourinary infection is urethritis – burning with urination (dysuria), increased urge to urinate, and a pus-like (purulent) discharge from the penis. The discharge may be foul smelling.[36] If untreated, scarring of the urethra may result in difficulty urinating. Infection may spread from the urethra in the penis to nearby structures, including the testicles (epididymitis/orchitis), or to the prostate (prostatitis).[36][8][38] Men who have had a gonorrhea infection have a significantly increased risk of having prostate cancer.[39]
In symptomatic women, the primary symptoms of genitourinary infection are increased vaginal discharge, burning with urination (dysuria), increased urge to urinate, pain with intercourse, or menstrual abnormalities. Pelvic inflammatory disease results if N. gonorrhoeae ascends into the pelvic peritoneum (via the cervix, endometrium, and fallopian tubes). The resulting inflammation and scarring of the fallopian tubes can lead to infertility and increased risk of ectopic pregnancy.[36] Pelvic inflammatory disease develops in 10 to 20% of the females infected with N. gonorrhoeae.[36]
In perinatal infection, the primary manifestation is infection of the eye (neonatal conjunctivitis or ophthalmia neonatorum) when the newborn is exposed to N. gonorrhoeae in the birth canal. The eye infection can lead to corneal scarring or perforation, ultimately resulting in blindness. If the newborn is exposed during birth, conjunctivitis occurs within 2–5 days after birth and is severe.[36][37] Gonococcal ophthalmia neonatorum, once common in newborns, is prevented by the application of erythromycin (antibiotic) gel to the eyes of babies at birth as a public health measure. Silver nitrate is no longer used in the United States.[37][36]
N. gonorrhoeae is transmitted through vaginal, oral, or anal sex; nonsexual transmission is unlikely in adult infection.[5] It can also be transmitted to the newborn during passage through the birth canal if the mother has untreated genitourinary infection. Given the high rate of asymptomatic infection, all pregnant women should be tested for gonorrhea infection.[5] However, communal baths, towels or fabric, rectal thermometers and caregivers hands have been implicated as means of transmission in the pediatric setting.[40] Kissing has also been implicated as a theoretical means of transmission in the gay male population, based on a newer study.[41]
Traditionally, the bacterium was thought to move attached to spermatozoa, but this hypothesis did not explain female to male transmission of the disease. A recent study suggests that rather than "surf" on wiggling sperm, N. gonorrhoeae bacteria use pili to anchor onto proteins in the sperm and move through coital liquid.[42]
For N. gonorrhoeae, the first step after successful transmission is adherence to the epithelial cells found at the mucosal site that is infected.[43] The bacterium relies on type IV pili that attach and retract, pulling N. gonorrhoeae toward the epithelial membrane where its surface proteins, such as opacity proteins, can interact directly.[43] After adherence, N. gonorrhoeae replicates itself and forms microcolonies.[44] While colonizing, N. gonorrhoeae has the potential to transcytose across the epithelial barrier and work its way in to the bloodstream.[45] During growth and colonization, N. gonorrhoeae stimulates the release of cytokines and chemokines from host immune cells that are pro-inflammatory.[45] These pro-inflammatory molecules result in the recruitment of macrophages and neutrophils.[7] These phagocytic cells typically take in foreign pathogens and destroy them, but N. gonorrhoeae has evolved many mechanisms that allow it to survive within these immune cells and thwart the attempts at elimination.[7]
Transmission is reduced by using latex barriers (e.g. condoms or dental dams) during sex and by limiting sexual partners.[6] Condoms and dental dams should be used during oral and anal sex, as well. Spermicides, vaginal foams, and douches are not effective for prevention of transmission.[4]
The current treatment recommended by the CDC is an injected single dose of ceftriaxone (a third-generation cephalosporin).[46] Sexual partners (defined by the CDC as sexual contact within the past 60 days)[11] should also be notified, tested, and treated.[6][46] It is important that if symptoms persist after receiving treatment of N. gonorrhoeae infection, a reevaluation should be pursued.[46]
Antibiotic resistance in gonorrhea has been noted beginning in the 1940s. Gonorrhea was treated with penicillin, but doses had to be progressively increased to remain effective. By the 1970s, penicillin- and tetracycline-resistant gonorrhea emerged in the Pacific Basin. These resistant strains then spread to Hawaii, California, the rest of the United States, Australia and Europe. Fluoroquinolones were the next line of defense, but soon resistance to this antibiotic emerged, as well. Since 2007, standard treatment has been third-generation cephalosporins, such as ceftriaxone, which are considered to be our "last line of defense".[47][48]Recently, a high-level ceftriaxone-resistant strain of gonorrhea called H041 was discovered in Japan. Lab tests found it to be resistant to high concentrations of ceftriaxone, as well as most of the other antibiotics tested. Within N. gonorrhoeae, genes exist that confer resistance to every single antibiotic used to cure gonorrhea, but thus far they do not coexist within a single gonococcus. However, because of N. gonorrhoeae's high affinity for horizontal gene transfer, antibiotic-resistant gonorrhea is seen as an emerging public health threat.[48]
As a Gram negative bacteria, N. gonorrhoeae requires defense mechanisms to protect itself against the complement system (or complement cascade), whose components are found with human serum.[15] There are three different pathways that activate this system however, they all result in the activation of complement protein 3 (C3).[49] A cleaved portion of this protein, C3b, is deposited on pathogenic surfaces and results in opsonization as well as the downstream activation of the membrane attack complex.[49] N. gonorrhoeae has several mechanisms to avoid this action.[45] As a whole, these mechanisms are referred to as serum resistance.[45]
Neisseria gonorrhoeae is named for Albert Neisser, who isolated it as the causative agent of the disease gonorrhea in 1878.[45][3] Galen (130 AD) coined the term "gonorrhea" from the Greek gonos which means "seed" and rhoe which means "flow".[50][7] Thus, gonorrhea means "flow of seed", a description referring to the white penile discharge, assumed to be semen, seen in male infection.[45]
In 1878, Albert Neisser isolated and visualized N. gonorrhoeae diplococci in samples of pus from 35 men and women with the classic symptoms of genitourinary infection with gonorrhea – two of whom also had infections of the eyes.[7] In 1882, Leistikow and Loeffler were able to grow the organism in culture.[45] Then in 1883, Max Bockhart proved conclusively that the bacterium isolated by Albert Neisser was the causative agent of the disease known as gonorrhea by inoculating the penis of a healthy man with the bacteria.[7] The man developed the classic symptoms of gonorrhea days after, satisfying the last of Koch's postulates. Until this point, researchers debated whether syphilis and gonorrhea were manifestations of the same disease or two distinct entities.[51][7] One such 18th-century researcher, John Hunter, tried to settle the debate in 1767[7] by inoculating a man with pus taken from a patient with gonorrhea. He erroneously concluded that both syphilis and gonorrhea were indeed the same disease when the man developed the copper-colored rash that is classic for syphilis.[49][51] Although many sources repeat that Hunter inoculated himself,[49][45] others have argued that it was in fact another man.[52] After Hunter's experiment other scientists sought to disprove his conclusions by inoculating other male physicians, medical students,[45] and incarcerated men with gonorrheal pus, who all developed the burning and discharge of gonorrhea. One researcher, Ricord, took the initiative to perform 667 inoculations of gonorrheal pus on patients of a mental hospital, with zero cases of syphilis.[7][45] Notably, the advent of penicillin in the 1940s made effective treatments for gonorrhea available.
Neisseria gonorrhoeae, also known as gonococcus (singular), or gonococci (plural), is a species of Gram-negative diplococci bacteria isolated by Albert Neisser in 1879. It causes the sexually transmitted genitourinary infection gonorrhea as well as other forms of gonococcal disease including disseminated gonococcemia, septic arthritis, and gonococcal ophthalmia neonatorum.
It is oxidase positive and aerobic, and it survives phagocytosis and grows inside neutrophils. Culturing it requires carbon dioxide supplementation and enriched agar (chocolate agar) with various antibiotics (Thayer–Martin). It exhibits antigenic variation through genetic recombination of its pili and surface proteins that interact with the immune system.
Sexual transmission is through vaginal, anal, or oral sex. Sexual transmission may be prevented through the use of barrier protection. Perinatal transmission may occur during childbirth, and may be prevented by antibiotic treatment of the mother before birth and the application of antibiotic eye gel on the eyes of the newborn. After an episode of gonococcal infection, infected persons do not develop immunity to future infections. Reinfection is possible due to N. gonorrhoeae's ability to evade the immune system by varying its surface proteins.
N. gonorrhoeae can cause infection of the genitals, throat, and eyes. Asymptomatic infection is common in males and females. Untreated infection may spread to the rest of the body (disseminated gonorrhea infection), especially the joints (septic arthritis). Untreated infection in women may cause pelvic inflammatory disease and possible infertility due to the resulting scarring. Diagnosis is through culture, Gram stain, or nucleic acid tests, such as polymerase chain reaction, of a urine sample, urethral swab, or cervical swab. Chlamydia co-testing and testing for other STIs is recommended due to high rates of co-infection.
Antibiotic resistance in N. gonorrhoeae is a growing public health concern, especially given its propensity to develop resistance easily.
Neisseria gonorrhoeae (gonococo) es un diplococo Gram negativo, oxidasa positivo, que causa la gonococia, una enfermedad de transmisión sexual que se presenta en los humanos.[1] Se diferencia de otros tipos de Neisseria por la prueba de la fermentación de carbohidratos, fermentando solamente a la glucosa. Se caracteriza por ser de difícil cultivo, siendo muy exigente a nivel nutricional y a la vez muy sensible a sustancias que se encuentran en los medios de cultivo corrientes. Suele utilizarse para este fin medios no selectivos enriquecidos con factores de crecimiento o selectivos, logrado con una mezcla de antibióticos, como el medio de Thayer-Martin (con vancomicina, nistatina, colistina y trimetoprim-sulfametoxazol). Requiere una atmósfera con 5-10 % de CO2.
Fue identificado por primera vez en 1879 por el médico alemán Albert Neisser a partir de exudados de pacientes con uretritis y oftalmia neonatal.[2] Cinco años después Hans Gram, bacteriólogo danés permitió la identificación del gonococo mediante el uso de las tinciones de Gram y en 1885 Ernest Bum aisló el microorganismo en un medio artificial. En 1959 se introduce el test de anticuerpos fluorescentes para la identificación de esta especie y en 1964, Thayer y Martin desarrollan un medio selectivo con antibióticos, exclusivo para el crecimiento de N. gonorrhoeae.
N. gonorrhoeae es un diplococo Gram negativo de tamaño que fluctúa entre 0,6 y 1 µm de diámetro, siendo el tamaño promedio de 0,8 µm de diámetro. Los microorganismos se visualizan al microscopio de luz como diplococos intracelulares, dentro de los neutrófilos. Esta apariencia contribuye a la identificación de la infección por gonococo.
Esta bacteria carece de cápsula, la superficie externa está compuesta por fimbrias, uno de los factores que contribuyen a su virulencia (capacidad de infectar).
Como todas las bacterias se reproduce asexualmente por división binaria, originándose dos células hijas aproximadamente del mismo tamaño a partir de una célula madre. Esta división no es completa, ya que no se separan los tabiques o septos de cada una de las células que se originan, y de allí que se dispongan en pares (diplococos). Este diplococo es inmóvil, aerobio facultativo y crece mejor a una temperatura que oscila entre 35 °C y 37 °C, en una atmósfera entre 3 y 5 % de CO2 y con un pH entre 7,2 y 7,6. Experimentan autólisis rápida cuando se exponen al aire del ambiente, a la desecación, luz ultravioleta, sales de plata, fenol y calor húmedo a 55 °C. Se diferencian de otras especies de Neisseria por su capacidad de transformar la glucosa, pero no la maltosa, sacarosa, lactosa, fructosa y manosa en ácido por medio de la prueba de agar con tripticasa de cistina (CTA) y por su respuesta positiva en las pruebas de oxidasa y catalasa.
Los gonococos son bacterias frágiles, de crecimiento lento y con requerimientos nutricionales estrictos. Dado que con frecuencia deben ser aislados de áreas que contienen un gran número de microorganismos de la flora normal como el tracto genital e incluso de localizaciones que pueden albergar otras especies de Neisseria como la orofaringe, se han desarrollado medios especiales para aislar N. gonorrhoeae.
Uno de los medios de cultivo empleado con mayor frecuencia es el Thayer Martin modificado, suplementado con agar chocolate y que contiene vancomicina (3 µg/ml), colistina (7,5 µg/ml), y nistatina (12,5 µg/ml) y lactato de trimetropima (5 µg/ml). Estas sustancias antimicrobianas fueron agregadas para inhibir aún más los microorganismos que pudiesen crecer como contaminantes del medio.
Los cultivos se incuban a 35 °C en una atmósfera de 3-5 % de CO2. El nivel de CO2 es importante porque concentraciones menores pueden no permitir el crecimiento del microorganismo, en tanto que concentraciones mayores inhiben el crecimiento de líneas de siembra, para de esta manera, facilitar la detección de colonias de N. gonorrhoeae y de Neisseria meningitidis. Las colonias pueden ser tipo transparentes o tipo opacas. Las neisserias que crecen en las transparentes son más virulentas. La virulncia parece variar según el día del ciclo menstrual en que se tome la muestra para investigar su presencia. Hacen colonias transparentes pre y transmenstrualmente y opacas entre el día 14 al 21. La facilidad de cazarlas para cultivo disminuye si aumenta la progesterona ( día 14 a 21 ) o si se ha administrado progesterona oral durante el embarazo.
Neisseria gonorrhoeae (gonococo) es un diplococo Gram negativo, oxidasa positivo, que causa la gonococia, una enfermedad de transmisión sexual que se presenta en los humanos. Se diferencia de otros tipos de Neisseria por la prueba de la fermentación de carbohidratos, fermentando solamente a la glucosa. Se caracteriza por ser de difícil cultivo, siendo muy exigente a nivel nutricional y a la vez muy sensible a sustancias que se encuentran en los medios de cultivo corrientes. Suele utilizarse para este fin medios no selectivos enriquecidos con factores de crecimiento o selectivos, logrado con una mezcla de antibióticos, como el medio de Thayer-Martin (con vancomicina, nistatina, colistina y trimetoprim-sulfametoxazol). Requiere una atmósfera con 5-10 % de CO2.
Neisseria gonorrhoeae, gonokoko ere deitua, Neisseria generoko bakterio patogenoa da, gonorrea eragiten duena.
Albert Neisser sendagile alemanak mikrobio hau isolatu zuen estreinakoz 1879an.
Neisseria gonorrhoeae koko itxurako bakterio Gram negatiboa da, gehienetan koko-bikoteak osatzen dituena (diplokokoak). Aerobioa edo anaerobio fakultatiboa da, eta katalasa eta oxidasa positiboa. Eskakizun nutritibo zorrotzak ditu, eta laborategian hazteko hazkuntza-inguru bereziak erabiltzen dira (eta baita CO2ko atmosfera berezia ere): txokolate-agarra eta Thayer-Martin agarra dira erabilienak.
Bere birulentzia areagotzen duten finbriak ditu: finbria horiei esker traktu urogenitaleko mukosen zelulei atxikitzen da [1]. Bestalde, bakterio hau oso sentikorra da lehortearen aurrean, eta bizkarroi-bizitzara moldatua da; horregatik, kontaktu zuzenaren bidez besterik ez da pertsonen artean transmititzen.
Neisseria gonorrhoeae gonorrea eragiten du, sexu-transmisiozko gaixotasun ohikoenetakoa. Gaitza sexu-harremanen bidez transmititzen da. Aipatu den bezala, mikrobio eragilea oso sentikorra da, eta ezin du gizakiarengandik kanpo bizi: gonorrearen kutsapen-bidea, beraz, pertsonen arteko kontaktu zuzena eta intimoa da beti.
Bakterioak endotoxina moduan jarduten duten zelula hormaren lipoproteinak ditu, ostalariaren ehunen zelulak kaltetzen dituztenak eta aparteko birulentzia ematen diotenak.
Gaitza traktu urogenitaleko eta inguruko ehunak eta organoak kaltetu ahal ditu: genitalak, prostata, umetokia, Fallopioren tronpak... Septizemia gertatzen denean, bakterioak gorputzeko beste organo batzuk ere erasaten ditu.
Neisseria gonorrhoeaek aniztasun antigeniko handia dauka: finbrien eta zelula hormaren lipoproteinen mota asko daude. Aniztasun handi horrek immunitate naturala murrizten du (pertsona batek gonorrea harrapa dezake behin baino gehiagotan) eta txerto baten eraginkortasuna zailtzen du [2]
Neisseria gonorrhoeae, gonokoko ere deitua, Neisseria generoko bakterio patogenoa da, gonorrea eragiten duena.
Albert Neisser sendagile alemanak mikrobio hau isolatu zuen estreinakoz 1879an.
Gonokokki (Neisseria gonorrhoeae) on gramnegatiivinen bakteeri, joka aiheuttaa tippuria.
Yli puolet gonokokkikannoista on resistenttejä penisilliinille. Näiden kantojen hoidossa käytetään siprofloksasiinia ja ofloksasiinia, jotka ovat fluorokinoloneita. On myös näille lääkkeille resistenttejä kantoja (erityisesti Filippiineillä), joita voidaan hoitaa tällä hetkellä keftriaksonilla, joka on 3. polven kefalosporiini.
Tippuri diagnosoidaan useimmiten osoittamalla gonokokki limakalvoeritteestä. Näyte otetaan virtsaputken suulta tai kohdunkaulan kanavasta. Gonokokki voidaan havaita myös geenimonistustestillä virtsanäytteestä.
Gonokokki (Neisseria gonorrhoeae) on gramnegatiivinen bakteeri, joka aiheuttaa tippuria.
Neisseria gonorrhoeae, également appelé gonocoque, est la bactérie gram négative responsable chez l'humain de la gonococcie (ou gonorrhée, ou encore blennorragie).
La bactérie Neisseria gonorrhoeae a été observée pour la première fois sous le microscope du scientifique allemand Albert Neisser en 1879.
Ce germe exclusivement humain est l'agent de la blennorragie. C'était, il y a quelques années[Quand ?], la plus fréquente des maladies vénériennes. Chlamydia trachomatis est aujourd'hui l'agent pathogène le plus fréquemment mis en évidence dans les infections sexuellement transmissibles (IST).
La très grande fragilité de ce germe vis-à-vis de la dessiccation, de l'oxydation et des rayons lumineux explique la transmission sexuelle exclusive par contact direct des muqueuses.
Chez l'homme, après une incubation de 3 à 5 jours, apparaît une urétrite aiguë, accompagnée d'un écoulement urétral purulent (« chaude-pisse »). En l'absence de traitement, l’urétrite devient chronique et peut se compliquer de prostatite, d'épididymite.
Chez la femme, l'infection est beaucoup plus discrète (75 % des cas passent inaperçus) : urétrite, vulvo-vaginite, cervicite, parfois rectite. Les complications possibles sont la bartholinite, pelvipéritonite, l'endométrite et la salpingite, susceptibles de conduire à la stérilité. La salpingite et l'endométrite sont favorisées par la multiplicité des partenaires sexuels (notamment rapports non protégés) ainsi que toute manœuvre endo-utérine (dont la pose de DIU / stérilet). Contrairement à ce qui a été précédemment diffusé, le port d'un stérilet en lui-même n'est pas associé à une fréquence plus élevée d'infection génitale haute (endométrite, salpingite)[1].
Environ 1 % des infections peuvent se compliquer d'une bactériémie dont la localisation secondaire la plus fréquente est l'arthrite (mono-arthrite).
Le nouveau-né peut se contaminer lors de l'accouchement lors du passage de la filière génitale. Une grave conjonctivite purulente bilatérale peut survenir entre le premier et le cinquième jour : l'atteinte ophtalmique entraîne rapidement des ulcérations de la cornée pouvant mener à la cécité.
La contamination a lieu le plus fréquemment par un rapport sexuel non protégé avec un sujet contaminé. L'atteinte oculaire est fréquente par auto-contamination (via des mains souillées).
Les caractéristiques sont identiques à celles du méningocoque, sauf :
a. Absence d'acidification du maltose.
b. Antigènes différents (il n'existe pas de typage sérologique des gonocoques).
L'examen permet généralement le diagnostic au stade aigu chez l'homme : l'examen de la « goutte matinale » prélevée avant miction révèle la présence des diplocoques en « grain de café », intracellulaires. Il faut les rechercher longtemps : au milieu d'une majorité de polynucléaires vides, quelques-uns seulement contiennent des gonocoques, souvent en grand nombre. Les formes extracellulaires ne donnent pas de certitude, vu l'existence de Neisseria non pathogènes. Lorsque le cas devient chronique, le gonocoque se raréfie et l'urètre est envahi de germes divers : la culture devient nécessaire. Chez la femme, la valeur de l'examen microscopique dépend de la méthode de prélèvement. Plusieurs lames doivent être préparées : à partir du méat urinaire, des sécrétions des glandes de Bartholin, de l'entrée du col de l'utérus. Malgré ces précautions, la culture est préférable.
Le germe étant très fragile, le prélèvement doit être ensemencé immédiatement. Il se cultive en milieu enrichi (gélose au sang cuit enrichi en facteurs vitaminiques) sous une atmosphère contenant 5 % à 10 % de CO2 à 37 °C.
Examen très rapide de plus en plus utilisé dans les milieux hospitaliers.
La réalisation d'un antibiogramme est systématique, à la recherche d'une souche résistante aux pénicillines par production de bêta-lactamases (cette résistance est de plus en plus fréquente, en particulier dans les pays développés).
Il n’existe pas de tests sérologiques. Pas d'immunité protectrice : réinfections possibles, aucun vaccin.
La blennorragie naturelle n'induisant guère d'immunité, il paraît peu probable qu'une vaccination préventive puisse être efficace.
La lutte contre le gonocoque est dès lors essentiellement basée sur le dépistage et le traitement. Chaque fois que l'on diagnostique un nouveau cas, il est nécessaire d'examiner tous les contacts sexuels qui ont eu lieu dans les dix jours précédents et de traiter les partenaires (si possible en même temps pour éviter les réinfections). Les patients doivent naturellement s'abstenir de relations sexuelles jusqu'à guérison contrôlée.
Une étude néo-zélandaise publiée en 2017[2] a montré l'efficacité d'un vaccin contre le méningocoque B, apparenté au gonocoque, dans la lutte contre celui-ci, avec une réduction d'environ 30 % du risque de contracter une gonorrhée par rapport au groupe témoin.
Les sensibilités évoluent rapidement, avec des résistances importantes aux pénicillines, aux fluoroquinolones (environ 40 % en France).
Les dernières recommandations concernant les urétrites et les cervicites, ont été émises par l'AFSSAPS (actuelle ANSM) en 2008 et préconisent les traitements suivants[3] :
Un traitement par azithromycine monodose ou par doxycycline ciblant Chlamydia trachomatis est systématiquement prescrit, la co-infection étant fréquente.
Comme toutes les IST, le dépistage et le traitement du ou des partenaires est indispensable.
Henri Michaux parle du gonocoque et de ses conséquences dans « Les petits soucis de chacun », treizième texte du recueil La nuit remue (1935) : « (…) même le damné gonocoque qui fait tellement pour compliquer les relations entre hommes et femmes, pris de désespoir abandonne, forcé, sa dure vie. »[4]
Neisseria gonorrhoeae, également appelé gonocoque, est la bactérie gram négative responsable chez l'humain de la gonococcie (ou gonorrhée, ou encore blennorragie).
Neisseria gonorrhoeae ou gonococo é unha especie de bacterias gramnegativas que aparece ao microscopio como un diplococo con forma de gran de café, causante das infeccións de transmisión sexual que orixinan a gonorrea.[1]
O seu tamaño varía entre 0,6 e 1 µm de diámetro (tamaño promedio 0,8 µm). Os microorganismos visualízanse ao microscopio de luz como diplococos intracelulares, dentro dos neutrófilos, o que serve para o diagnóstico.
N. gonorrhoea foi descrita por primeira vez por Albert Neisser en 1879 a partir de exsudados de pacientes con uretrite e oftalmia neonatal, e del procede o nome do xénero Neisseria.[2] Cinco anos despois os traballos do bacteriólogo danés Hans Gram permitiron a identificación do gonococo mediante a tinguidura de Gram, e en 1885 Ernest Bum illou o microorganismo nun medio artificial. En 1959 introdúcese a proba de anticorpos fluorescentes para a identificación desta especie, e en 1964, Thayer e Martin desenvolven un medio selectivo con antibióticos, exclusivo para o crecemento de N. gonorrhoeae, que é o que se emprega actualmente.
Os gonococos son bacterias fráxiles, de crecemento lento e con requirimentos nutricionais estritos. Dado que con frecuencia deben ser illados de áreas que conteñen un grande número de microorganismos da flora normal como o tracto xenital e mesmo de localizacións que poden acoller a outras especies de Neisseria como a orofarinxe, desenvolvéronse medios especiais para illar N. gonorrhoeae.
As Neisseria son cocos gramnegativos esixentes que requiren un suplemento de nutrientes para crecer nos cultivos de laboratorio. Especificamente crecen en ágar chocolate con dióxido de carbono. Estes cocos son intracelulares facultativos e tipicamente aparecen en pares formando diplococos con forma de grans de café.[3]
Para illar as Neisseria xeralmente se usa ágar Thayer-Martin (ou ágar VPN), unha placa de ágar que contén antibióticos (vancomicina, colistina, nistatina, e TMP-SMX) e nutrientes que facilitan o crecemento das especies de Neisseria á vez que inhiben o crecemento de bacterias contaminantes e fungos. Probas adicionais para distinguir as especies son a proba da oxidase (todas as Neisseria patóxenas dan positivo) e a proba dos carbohidratos maltosa, sacarosa, e glicosa nas cales N. gonorrhoeae só poderá oxidar (utilizar) a glicosa.
Como todas as bacterias, N. gonorrhoeae reprodúcese asexualmente por división binaria, orixinándose dúas células fillas aproximadamente do mesmo tamaño, pero esta división non é completa, xa que non se separan os tabiques ou septos de cada unha das células que se orixinan, e de alí que se dispoñan en pares (diplococos). Son aerobios e/ou anaerobios facultativos e crecen mellor a unha temperatura entre 35 °C e 37 °C, nunha atmosfera entre 3% e 5% de CO2 e cun pH entre 7,2 e 7,6. Experimentan autólise rápida cando se expoñen ao aire do ambiente, á desecación, luz ultravioleta, sales de prata, fenol e calor húmida a 55ª C. Como se dixo anteriormente, diferéncianse doutras especies de Neisseria pola súa capacidade de transformar a glicosa, pero non a maltosa, sacarosa, lactosa, frutosa e manosa en ácido por medio da proba de ágar CTA (tripticase cistina) e pola súa resposta positiva nas probas da oxidase e catalase.
As N. gonorrhoeae teñen motilidade por retorcemento e sacudidas (twitching motility) e posúen pili de tipo IV para adherirse a superficies. Os pili de tipo IV funcionan mecanicamente de xeito similar a un garfio de moitas puntas ou rizón. Estes pili esténdense e únense ao substrato, o que é o sinal para que o pilus se retraia, arrastrando a célula cara adiante. N. gonorrhoeae pode arrastrar así cen mil veces o seu propio peso e dise que estes pili son proporcionalmente os motores biolóxicos máis fortes coñecidos, que exercen unha forza de 1 nanonewton.[4]
N. gonorrhoeae ten proteínas de superficie chamadas proteínas Opa, que se unen a receptores das células inmunitarias, o que fai que a bacteria poida impedir a resposta inmunitaria. O hóspede non pode desenvolver unha memoria inmunolóxica contra N. gonorrhoeae, o cal quere dicir que é posible unha futura reinfección. N. gonorrhoeae pode tamén evadir o sistema inmunitario por medio dun proceso chamado variación antixénica, no cal a bacteria pode alterar os determinantes antixénicos (sitios aos que se unen os anticorpos) como son as proteínas Opa[5] e os pili de tipo IV[6] que inzan a súa superficie. As moitas permutacións que pode haber nas súas proteínas de superficie fai máis difícil que as células inmunitarias recoñezan a N. gonorrhoeae e organicen unha defensa.[7]
N. gonorrhoeae é naturalmente competente para a transformación do ADN e a conxugación. Estes procesos permiten que o ADN de N. gonorrhoeae sufra cambios. É especialmente perigoso sanitariamente a capacidade de conxugarse que ten, xa que orixina resistencia a antibióticos.
En 2011, investigadores da Northwestern University encontraron evidencias da existencia dun fragmento de ADN humano no xenoma de Neisseria gonorrhoeae, o cal é o primeiro exemplo de transferencia horizontal de xenes desde os humanos a un patóxeno bacteriano.[8][9]
Os síntomas da infección por N. gonorrhoeae dependen do lugar do corpo onde se produza. Algúns casos son asintomáticos, especialmente en mulleres.
A infección nos xenitais orixina descargas purulentas desde os xenitais, que poden feder, e hai tamén inflamación, inchamento, e disuria.
N. gonorrhoeae pode tamén causar conxuntivite, farinxite, proctite ou uretrite, prostatite e orquite.
A conxuntivite é común en neonatos, polo que a estes xeralmente se lles aplica nitrato de prata ou antibióticos nos ollos como medida preventiva. A conxuntivite por gonorrea neonatal contráese cando o neno se expón á N. gonorrhoeae no canal do parto e pode orixinar danos ou perforacións na córnea, que causen cegueira.
As infeccións diseminadas por N. gonorrhoeae poden orixinar endocardite, meninxite ou síndrome artrite-dermatite gonocócica. Esta última síndrome preséntase con dores articulares, tenosinovite e dermatite indolora que non proe.
A infección nos xenitais femininos por N. gonorrhoeae pode orixinar enfermidade inflamatoria pélvica se non se trata, que pode causar infertilidade. Esta doenza orixínase se N. gonorrhoeae chega ao peritoneo pélvico (a través do cérvix, endometrio e trompas de Falopio). A infertilidade débese á inflamación e cicatrización das trompas de Falopio. O risco de infertilidade considérase do 10 ao 20% nas mulleres infectadas con N. gonorrhoeae.
Antes, o tratamento inicial contra a N. gonorrhoeae era a penicilina, pero se é resistente aos antibióticos da familia da penicilina úsase xeralmente ceftriaxone (unha cefalosporina de terceira xeración). As parellas sexuais do paciente deberían ser tamén notificadas e tratadas.[10]
Os epidemiólogos detectaron ao longo das últimas décadas casos crecentes en número de gonorrea resistente a antibióticos. Na década de 1940 a gonorrea tratábase con penicilina, pero ao longo dos anos houbo que ir aumentando progresivamente a dose ata que chegou a ser ineficaz, e na década de 1970, a gonorrea resistente á penicilina e tetraciclina apareceu na Cunca do Pacífico. Estas cepas resistentes espalláronse despois por Hawai, California, resto de EEUU e Europa. As fluoroquinolonas foron a seguinte liña de defensa utilizada, pero axiña apareceu resistencia a elas. Desde 2007, o tratamento estándar son as cefalosporinas de terceira xeración, como ceftriaxone, que se considera que é a nosa “última liña de defensa.”[11]
Recentemente, descubriuse en Xapón unha cepa resistente a niveis altos de ceftriaxone, chamada H041. As probas de laboratorio mostraron que era resistente a altas concentracións de ceftriaxone, e á maioría dos outros antibióticos comprobados. N. gonorrhoeae ten xenes que lle confiren resistencia a todos os antibióticos usados para curar a gonorrea, pero ata agora eses xenes non están nunha mesma cepa da bacteria, senón en cepas distintas. Como N. gonorrhoeae ten unha alta afinidade pola transferencia horizontal de xenes, a resistencia aos antibióticos do gonococo considérase que é unha ameaza emerxente para a saúde pública.[11]
É frecuente que as infeccións por gonococo vaian acompañadas doutras infeccións de transmisión sexual, como as infeccións por Chlamydia. A transmisión redúcese co uso de condóns e limitando o número de parellas sexuais.
Debido á frecuencia relativa da infección e o desenvolvemento emerxente de resistencia aos antibióticos en cepas de N. gonorrhoeae, crese que a obtención dunha vacina debe ser un obxectivo importante para a prevención da infección. Porén, tense feito relativamente pouco énfase na investigación para obter esa vacina, como se observa examinando a literatura médica, e hai poucos ensaios clínicos para vacinas potenciais. A capacidade de desenvolver unha vacina efectiva está limitada pola falta de inmunidade adquirida xerada por esta infección e pola falta de compromiso e recursos na investigación para obtela.[12]
Os exsudados producidos polos individuos infectados conteñen moitos leucocitos polimorfonucleares (PMN) que levan no seu interior gonococos que foron fagocitados. Estes gonococos estimulan aos neutrófilos polimorfonucleares a liberar unha explosión oxidativa interna na que interveñen especies reactivas do oxíxeno para matar aos gonococos.[13] Porén, unha fracción significativa dos gonococos poden resistir este ataque e poden reproducirse dentro dos fagosomas dos neutrófilos polimorfonucleares.
Stohl e Seifert demostraron que a proteína bacteriana RecA, que media a reparación recombinatoria dos danos do ADN, xoga un importante papel na supervivencia dos gonococos.[14] A protección proporcionada pola proteína RecA pode estar ligada á transformación, o proceso polo cal un gonococo receptor capta ADN dos gonococs veciños e intégrao no seu propio xenoma por recombinación. Michod et al. suxeriron que un importante beneficio da transformación para N. gonorrhoeae pode ser a reparación recombinacional dos danos oxidativos no ADN causados polo ataque oxidativo das células fagocíticas do hóspede.[15]
Neisseria gonorrhoeae ou gonococo é unha especie de bacterias gramnegativas que aparece ao microscopio como un diplococo con forma de gran de café, causante das infeccións de transmisión sexual que orixinan a gonorrea.
O seu tamaño varía entre 0,6 e 1 µm de diámetro (tamaño promedio 0,8 µm). Os microorganismos visualízanse ao microscopio de luz como diplococos intracelulares, dentro dos neutrófilos, o que serve para o diagnóstico.
Neisseria gonorrhoeae merupakan bakteri gram negatif, nonmotil, tidak membentuk spora, berkembang berkoloni membentuk diplokokus, atau pun tunggal monokokus.[3] Bakteri ini ditemukan dan diisolasi oleh Albert Neisser pada tahun 1879.[4] Manusia merupakan satu-satunya inang alami bakteri ini. Untuk menginfeksi, bakteri membutuhkan kontak langsung dengan mukosa tubuh, bisa lewat hubungan seks, atau penggunaan kloset duduk. Bakteri ini menempel dengan pilinya.[5]
Neisseria gonorrhoeae merupakan bakteri gram negatif, nonmotil, tidak membentuk spora, berkembang berkoloni membentuk diplokokus, atau pun tunggal monokokus. Bakteri ini ditemukan dan diisolasi oleh Albert Neisser pada tahun 1879. Manusia merupakan satu-satunya inang alami bakteri ini. Untuk menginfeksi, bakteri membutuhkan kontak langsung dengan mukosa tubuh, bisa lewat hubungan seks, atau penggunaan kloset duduk. Bakteri ini menempel dengan pilinya.
Neisseria gonorrhoeae, o gonococco di Neisser, agente eziologico della gonorrea (o blenorragia) è un batterio Gram-negativo della famiglia delle neisserie, molto simile alla Neisseria meningitidis, con cui condivide anche la relativa fragilità al di fuori dell'organismo umano.
Il gonococco viene trasmesso generalmente per via sessuale (ove la popolazione femminile sviluppa molto spesso un'infezione asintomatica) e aderisce inizialmente in maniera aspecifica e debole con le adesine piliari all'epitelio non ciliato dell'uretra nel maschio e della cervice uterina nella donna; l'adesione è poi rinforzata dalle proteine OPA (proteine di opacità legate alla patogenesi) e successivamente con la porina PORB (espressa sulla membrana esterna) il gonococco viene internalizzato dalla cellula epiteliale.
A questo punto il patogeno per transcitosi raggiunge la lamina basale dell'epitelio ove si costruisce una capsula di acido sialico e produce il LOS (lipo- oligosaccaride con attività endotossinica) che favorisce la secrezione di citochine infiammatorie e chemio tattiche (dall'epitelio) che reclutano cellule fagocitiche e la creazione di un passaggio tra l'epitelio uretrale; a questo punto il gonococco (in forma libera, morto o fagocitato) ritorna nel lume dell'organo costituendo lo "scolo" di materiale purulento, tipico della gonorrea.
Si ricordi che proprio un tampone di questo materiale è adoperato dai microbiologi per una diagnosi di gonorrea usando un terreno agar- cioccolato incubato al 5% di anidride carbonica (si noti che se si usa un terreno poli microbico il terreno scelto è il Tayer-Marthin per le neisserie).
L'unico ospite naturale è l'uomo. Nell'uomo, N. gonorrhoeae entra attraverso l'epitelio stratificato colonnare dell'uretra anteriore, raggiungendo il connettivo subepiteliale. In questa sede, la risposta infiammatoria contro il batterio provoca un afflusso di neutrofili che fagocitano i batteri, e si portano poi nel lume uretrale, provocando la caratteristica fuoruscita di liquido purulento della malattia.
Questo microbo può essere facilmente identificato da un reperto prelevato da un essudato purulento di una forma infiammatoria acuta che si è sviluppata nelle tipiche sedi dell'infezione, ovvero i genitali maschili e femminili. Si trasmette quasi esclusivamente per via sessuale. Oltre al contagio sessuale, nel momento del parto può esserci anche il contagio verticale da madre a figlio. In questo caso, N. gonorrhoeae può infettare l'occhio dando luogo a una congiuntivite.
Uno striscio della secrezione uretrale, colorato con la colorazione di Gram, permette una rapida identificazione di N. gonorrhoeae nel 90% dei soggetti di sesso maschile. I prelievi delle secrezioni dalla cervice uterina sono positivi solo nel 60% dei casi. In caso di interessamento del retto, la rettoscopia può mostrare placche di mucopus sulle pareti.
A una visione microscopica, i gonococchi appaiono come piccoli chicchi di caffè. Inoltre è possibile identificarli se riscontrabili all'interno di leucociti polimorfonucleati neutrofili. La superficie esterna di N. gonorrhoeae non è ricoperta da una vera capsula glicidica, presente invece in Neisseria meningitidis.
Essenziale è la presenza di pili (composti da subunità proteiche ripetute note come piline) che si estendono dalla membrana citoplasmatica attraverso la membrana esterna: essi mediano l'attacco a cellule epiteliali non cigliate e conferiscono resistenza all'aggressione da parte di leucociti polimorfonucleati neutrofili. I pili sono inoltre correlati al mancato sviluppo di immunità; infatti, in caso di reinfezione, l'elevata variabilità antigenica di queste strutture permette a N. gonorrhoeae di infettare l'uomo senza una risposta immunitaria di tipo anticorpale.
In tutte le donne e negli uomini con striscio negativo o dubbio, è necessario identificare il germe mediante esame colturale. Nella raccolta del campione bisogna evitare la disidratazione e le basse temperature, poiché letali per il batterio. Inoltre è opportuno inoculare il campione subito dopo la raccolta su un terreno preriscaldato.
N. gonorrhoeae richiede particolari terreni colturali come il terreno selettivo di Thayer-Martin, oppure può crescere su terreno agar cioccolato (ovvero non selettivo, poiché alcuni ceppi di gonococchi possono essere inibiti dalla vancomicina, antibiotico usato in un terreno selettivo per uccidere altri microorganismi; questo terreno è appunto usato affinché non si escluda un contagio da N. gonorrhoeae se la coltura su terreno selettivo risultasse negativa). La coltura va incubata a 35-36 °C per 48 ore in un'atmosfera contenente il 3-10% di anidride carbonica.
È possibile anche eseguire test rapidi basati sulla ricerca dell'RNA gonococcico.
Uretrite gonococcica (entro 2-7 giorni), disuria, stranguria, arrossamento del meato uretrale esterno con fuoriuscita di materiale purulento. In caso di rapporti anali, l'infezione oltre che in uretra, può localizzarsi nella mucosa ano-rettale, nel canale anale e, per rapporti orali, nella faringe.
L'infezione in uretra è solo transitoria, il batterio si localizza a livello della cervice uterina, delle ghiandole di Skene e delle ghiandole di Bartolini. Anche in questo caso, l'infezione può localizzarsi alla mucosa anale e al faringe. L'infezione decorre anche a lungo in maniera asintomatica, passando inosservata. Spesso l'infezione nella donna viene pertanto rilevata solo in seguito alla diagnosi di uretrite gonococcica nel partner sessuale.
Le complicanze sono: bartolinite, endometrite, peritonite, particolarmente importanti sono le complicanze dell'orchite nell'uomo e della salpingo-ooforite nella donna, che portano a sterilità.
N. gonorrhoeae si dimostra in buona parte resistente ai sulfamidici, mentre le penicilline sono una terapia utile, anche se sono stati segnalati degli stipiti resistenti. Utile anche il ceftriaxone.
Tra le tetracicline, la doxiciclina trova impiego con successo solo verso N. gonorrhoeae e N. meningitidis molto utilizzata poiché antibiotica anche su altri batteri delle vie urinarie intracellulari. Ma il genere Neisseria è a volte resistente.
Il trattamento di scelta (sempre consigliabile un antibiogramma) prevede:
In caso di batteri multiresistenti si può utilizzare la spectinomicina.
Neisseria gonorrhoeae, o gonococco di Neisser, agente eziologico della gonorrea (o blenorragia) è un batterio Gram-negativo della famiglia delle neisserie, molto simile alla Neisseria meningitidis, con cui condivide anche la relativa fragilità al di fuori dell'organismo umano.
Gonokoks (Neisseria gonorrhoeae) ir gramnegatīva baktērija, morfoloģiski pieder pie diplokokiem. Patogēns cilvēkiem, ir ekstra- un intracelulārs parazīts;[1] izraisa gonoreju.[2]
Gonokoki producē oksidāzi. Atšķirībā no citām Neisseria, gonokoki fermentē glikozi un nefermentē maltozi, saharozi un laktozi.[2]
Gonokoks (Neisseria gonorrhoeae) ir gramnegatīva baktērija, morfoloģiski pieder pie diplokokiem. Patogēns cilvēkiem, ir ekstra- un intracelulārs parazīts; izraisa gonoreju.
Gonokoki producē oksidāzi. Atšķirībā no citām Neisseria, gonokoki fermentē glikozi un nefermentē maltozi, saharozi un laktozi.
Neisseria gonorrhoeae is een gramnegatieve, aerobe, 0,6–1,0 µm grote, bacterie (kokken) die de seksueel overdraagbare aandoening gonorroe veroorzaakt. De bacterie is in 1879 door Albert Neisser ontdekt, en in 1885 gelukte het de Duitse gynaecoloog Ernst Bumm de bacterie te kweken. Reeds in 1897 kwam er een bactericide beschikbaar, Protargol, door de Duitse chemicus Arthur Eichengrün uitgevonden, maar sinds 1935 door de komst van sulfonamide en later penicilline geheel verdrongen.
De bacterie bezit een membraan, typerend voor gramnegatieve bacteriën, opgebouwd uit eiwitten, fosfolipiden en lipopolysacharide.
De bacterie is zeer gevoelig voor veranderingen van zijn leefomgeving, zoals bijvoorbeeld verandering van pH, temperatuur en uitdroging.
Door middel van zogenaamde pili (draadvormige structuren) kunnen gonokokken zich hechten aan mucosacellen. Zij kunnen doordringen tot de mucosacellen, zich hierin vermenigvuldigen en vervolgens migreren naar de subepitheliale ruimte en een uitgebreide infectie veroorzaken.
De bacterie wordt slecht gefagocyteerd door het bezit van een polysacharidekapsel. Ook de pili hebben een remmende werking op de fagocytose.
Neisseria gonorrhoeae is een gramnegatieve, aerobe, 0,6–1,0 µm grote, bacterie (kokken) die de seksueel overdraagbare aandoening gonorroe veroorzaakt. De bacterie is in 1879 door Albert Neisser ontdekt, en in 1885 gelukte het de Duitse gynaecoloog Ernst Bumm de bacterie te kweken. Reeds in 1897 kwam er een bactericide beschikbaar, Protargol, door de Duitse chemicus Arthur Eichengrün uitgevonden, maar sinds 1935 door de komst van sulfonamide en later penicilline geheel verdrongen.
De bacterie bezit een membraan, typerend voor gramnegatieve bacteriën, opgebouwd uit eiwitten, fosfolipiden en lipopolysacharide.
De bacterie is zeer gevoelig voor veranderingen van zijn leefomgeving, zoals bijvoorbeeld verandering van pH, temperatuur en uitdroging.
Door middel van zogenaamde pili (draadvormige structuren) kunnen gonokokken zich hechten aan mucosacellen. Zij kunnen doordringen tot de mucosacellen, zich hierin vermenigvuldigen en vervolgens migreren naar de subepitheliale ruimte en een uitgebreide infectie veroorzaken.
De bacterie wordt slecht gefagocyteerd door het bezit van een polysacharidekapsel. Ook de pili hebben een remmende werking op de fagocytose.
Neisseria gonorrhoeae er en gram-negativ kuleformet (kokker) bakterie som forårsaker sykdommen gonoré.
Neisseria gonorrhoeae er en gram-negativ kuleformet (kokker) bakterie som forårsaker sykdommen gonoré.
 Systematyka Królestwo bakterie Typ proteobakterie Klasa betaproteobakterie Rząd Neisseriales Rodzina Neisseriaceae Rodzaj Neisseria Gatunek dwoinka rzeżączki Nazwa systematyczna Neisseria gonorrhoeae
Systematyka Królestwo bakterie Typ proteobakterie Klasa betaproteobakterie Rząd Neisseriales Rodzina Neisseriaceae Rodzaj Neisseria Gatunek dwoinka rzeżączki Nazwa systematyczna Neisseria gonorrhoeae Dwoinka rzeżączki (Neisseria gonorrhoeae) zwana czasem gonokokiem – nieruchliwa, nieprzetrwalnikująca bakteria tlenowa, wywołująca jedną z chorób przenoszonych drogą płciową – rzeżączkę.
Hodowla bakterii jest stosunkowo trudna – nie rosną one na zwykłych podłożach hodowlanych, tylko na wzbogaconych (agar czekoladowy, pożywka wzbogacona białkiem, podłoże Thayera-Martina etc.). Do wzrostu należy zapewnić odpowiednie stężenie CO2[1] wynoszące 10% oraz odpowiednią wilgotność. Płytka, na której umieszcza się bakterie, powinna mieć już odpowiednią temperaturę; w przeciwnym razie istnieje ryzyko niepowodzenia hodowli. Bakterie nie wzrastają też przy temperaturze 24 stopni (cecha różnicująca w obrębie rodzaju). Po dłuższej hodowli przestają łączyć się w pary (dwoinki) a kolonia przybiera inne kształty (komórki pojedyncze, tetrady etc).
W zapaleniu ostrym są one widoczne wewnątrz makrofagów.
Podobnie jak pozostałe bakterie z rodzaju Neisseria, dwoinka rzeżączki nie jest aktywna metabolicznie. Z cukrów fermentuje jedynie glukozę, bez wytwarzania gazu. Nie wytwarza H2S oraz barwników.
Poza rzeżączką bakteria może powodować zakażenia innych układów – dotyczy to zwłaszcza pacjentów z obniżoną odpornością. Noworodki mogą być zakażone podczas porodu przez skolonizowane matki – objawia się to najczęściej zapaleniem spojówek, które nieleczone prowadzi nawet do ślepoty.
Czynniki determinujące zjadliwość[1][2]:
Bakteria jest wrażliwa na większość antybiotyków oraz na zwykłe środki dezynfekcyjne. Ginie po kilku minutach przy temperaturze 60 stopni, podobnie nie przeżywa długo w warunkach pokojowych. Jest bardzo wrażliwa na wysychanie i światło. W ciemnym i wilgotnym środowisku (bielizna, pościel, ręczniki, gąbki) utrzymuje się przy życiu około doby.
Wobec bakterii aktywność zachowują[1]:
Wobec penicylin, makrolidów, fluorochinolonów i tetracyklin może występować oporność[1].
Bakteria jest wrażliwa także na minimalne stężenia azotanu srebra. Wykorzystano to w leczeniu noworodków chorych na zapalenie spojówek, wkraplając im do oka roztwór tego związku (tzw. zabieg Credégo).
Dwoinka rzeżączki (Neisseria gonorrhoeae) zwana czasem gonokokiem – nieruchliwa, nieprzetrwalnikująca bakteria tlenowa, wywołująca jedną z chorób przenoszonych drogą płciową – rzeżączkę.
Neisseria gonorrhoeae é uma bactéria da família Neisseriaceae. É um diplococo gram-negativo, não flagelado, não formador de esporos, não hemolítico, aeróbio ou facultativamente anaeróbio que habita o trato respiratório superior do homem, sendo responsável pela gonorreia – doença sexualmente transmissível, com formato de rim – e consequentemente pela conjuntivite gonocócica – doença hereditariamente transmitida da mãe para o filho ou sexualmente transmitida pelo intercurso geno-oftálmico. Este agente patogênico pode ser classificado em 5 tipos coloniais (dependem da produção de fímbrias pelas células), sorotipos e auxotipos. Estas classificações são importantes para a compreensão da epidemiologia e da virulência da espécie. É oxidase positiva, catalase positiva, é sensível a ambientes secos ou ácidos gordos, exige cisteína para o seu crescimento e não apresenta uma verdadeira cápsula polissacarídea.
A Neissera gonorroeae é uma bactéria capnófila, ou seja, vive em locais com grande concentrações de gás carbônico. Utilizam suas fímbrias para aderirem à mucosa urogenital e caso apresentem mutações e sejam desprovidas de fimbrias, torna-se uma bactéria não patogênica.
As colónias T1 e T2 estão associadas à virulência, apresentando os seguintes factores:
A virulência pode ficar comprometida caso o microrganismo sofra alterações estruturais de superfície.
A Neisseria gonorrhoeae invade células epiteliais não-ciliadas, multiplica-se em vacúolos intracelulares. A LOS desencadeia a produção de TNF-α, levando à inflamação e consequente destruição tecidular. Se a infecção não for tratada, vai persistir e levar à inflamação crónica que se manifesta como fibrose. Esta fibrose pode levar à esterilidade, à destruição articular e à cegueira.
O único hospedeiro do gonococo é o homem. No adulto, a infecção sempre é transmitida durante o acto sexual. A gonorreia ocorre frequentemente em indívíduos dos 15 aos 24 anos.São "grupos de risco" os seguintes: contactos sexuais com indivíduos afectados, adolescentes com actividade sexual precoce e múltiplos parceiros sexuais. O risco de infecção de uma mulher após ter contacto com homem infectado é de 40 a 60%, enquanto que o risco de infecção de um homem após ter contacto com mulher infectada é de cerca de 20%.
No Homem, em 95% dos homens infectados a sintomatologia é aguda, ocorrendo inflamação genital restrita à uretra (uretrite aguda), com formação de um exsudado purulento, e que é acompanhado de disúria. Em casos raros, a infecção pode-se estender para a próstata, epidídimo e vesículas seminais. Na Mulher, a principal forma clínica é cervicite, ocorrendo inflamação do colo uterino, leucorreia vaginal, disúria, dor abdominal, infecção genital ascendente que pode levar a salpingite, abcesso tubo-ovárico e doença pélvica inflamatória. Finalmente, em casos mais graves, a infecção pode-se disseminar, traduzindo-se em bacteriémia, infecção cutânea e articular. Sendo assim mantendo os cuidados necessários.
Para diagnóstico laboratorial, o produto a ser recolhido é o exsudado uretral, que é submetido a exame microscópico directo, recorrendo à coloração de Gram. A detecção é mais fácil no homem no que na mulher, pois há outras bacterias semelhantes na microbiota natural da vagina. Se o Gonococo se encontrar dentro de neutrófilos polimorfonuclares, trata-se de uma infecção aguda, se se encontrar no exterior, trata-se de uma infecção crónica. Se o resultado der negativo e o doente for assintomático, deve-se realizar um exame cultural, que desempenha aqui um papel primordial. Devem-se usar meios selectivos e/ou complexos ( ex. Ágar Chocolate ) e ter em conta que os Gonococos são frágeis. O exame serológico não tem interesse. Já os exames moleculares como o PCR e a detecção directa do microrganismo por meio de sondas comerciais permitem obter um resultado rápido, não permitindo porém monitorizar a resistência aos antibióticos.
Como antibioterapia de primeira linha, é frequente a administração de ceftriaxona, cefixima ou fluoroquinolonas. Em caso de inflamação mista com Clamydia, recorre-se à ceftriaxona com doxiciclina ou azitromicina.[3]
Devido a variação de sorogrupos ( devido à especificidade de polissacarídeos capsulares), as vacinas em desenvolvimento não conseguem, ainda, responder à diversidade antigénica do gonococo.
É ineficaz, excepto do tratamento da oftalmia neonatorum. Esta doença é tratada com aplicação tópica de nitrato de prata a 1%, tetraciclina a 1% ou eritromicina a 1%.
Deve fazer-se uma abordagem educacional a este problema e um seguimento dos contactos sexuais, porque a gonorreia não é uma doença insignificante. A infecção crónica pode levar a esterilidade, e a infecção assintomática prolonga o reservatório populacional da Neisseria, levando a que mais gente possa estar exposta ao agente. A campanha de utilização de preservativos surpreendentemente perdeu força com o desenvolvimento de tratamentos mais eficazes para HIV. Sendo assim, a divulgação dos perigos de outras DSTs é importante para concientização da população.
|título= (ajuda) |título= (ajuda) |título= (ajuda) Neisseria gonorrhoeae é uma bactéria da família Neisseriaceae. É um diplococo gram-negativo, não flagelado, não formador de esporos, não hemolítico, aeróbio ou facultativamente anaeróbio que habita o trato respiratório superior do homem, sendo responsável pela gonorreia – doença sexualmente transmissível, com formato de rim – e consequentemente pela conjuntivite gonocócica – doença hereditariamente transmitida da mãe para o filho ou sexualmente transmitida pelo intercurso geno-oftálmico. Este agente patogênico pode ser classificado em 5 tipos coloniais (dependem da produção de fímbrias pelas células), sorotipos e auxotipos. Estas classificações são importantes para a compreensão da epidemiologia e da virulência da espécie. É oxidase positiva, catalase positiva, é sensível a ambientes secos ou ácidos gordos, exige cisteína para o seu crescimento e não apresenta uma verdadeira cápsula polissacarídea.
A Neissera gonorroeae é uma bactéria capnófila, ou seja, vive em locais com grande concentrações de gás carbônico. Utilizam suas fímbrias para aderirem à mucosa urogenital e caso apresentem mutações e sejam desprovidas de fimbrias, torna-se uma bactéria não patogênica.
Neisseria gonorrhoeae, denumit adesea și gonococ, este o specie de bacterie Gram-negativă izolată de către Albert Neisser în 1879.[3] Este agentul etiologic al infecției cu transmitere sexuală denumită gonoree,[4] dar și al altor boli infecțioase mai rare, precum artrita infecțioasă.
Neisseria gonorrhoeae, denumit adesea și gonococ, este o specie de bacterie Gram-negativă izolată de către Albert Neisser în 1879. Este agentul etiologic al infecției cu transmitere sexuală denumită gonoree, dar și al altor boli infecțioase mai rare, precum artrita infecțioasă.
Neisseria gonorrhoeae (gonokocker) tillhör släktet Neisseria och är bakterien som orsakar den sexuellt överförbara sjukdomen gonorré. Bakterien uppträder endast hos människan och är en av de vanligast förekommande könssjukdomarna i världen.[1] N.gonorrhoeae är en av två patogener av släktet Neisseria, den andra är Neisseria meningitidis (meningokocker) som orsakar bland annat hjärnhinneinflammation. Båda är humana patogener.[2]
Neisseria gonorrhoeae är gramnegativa diplokocker och koloniserar slemhinnor på ett antal olika platser i kroppen. Den angriper huvudsakligen slemhinnorna i urinröret hos män samt livmoderhalsen hos kvinnor. Den kan dessutom infektera ändtarmen, svalget och ögats bindhinna.[2] Förankrat i N.gonorrhoeaes cellmembran finns typ IV pili, hårliknande organeller, som har en fästande funktion, bildar mikrokolonier och biofilm, genomgår naturlig transformation samt har en stor roll i bakteriens försök att undkomma värdens immunförsvar. De är 6 nm i diameter och kan bli flera μm lång. Bakterien använder pili för förflyttning och ytterst på pili sitter proteinet pilC som står för den fästande funktionen. Pili har sedan en sammandragande rörlighet, som styrs av proteinet pilT, för att dra bakteriens målyta närmare. När N.gonorrhoeae genomgår celldelning sker en förändring i dottercellernas piliuttryck på grund av varierande genetiska mekanismer. De förändringar som görs medför att immunförsvaret ser bakterien som en ny främmande patogen.[2] En annan essentiell ytstruktur är opaproteinerna. De är fas-beroende och deras uppgift är att agera mediator mellan patogenen och värdcellen.[3] Porinproteinerna hör även de till N.gonorrhoeaes ytstruktur och fungerar som porer[2]. De utgör en viktig del av bakteriens envelope struktur och de är essentiella för dess överlevnad då de transporterar joner mellan bakterien och omgivningen.[4][2] Alla de olika ytstrukturella varianter som bakterien antar gör att en person kan smittas flera gånger eftersom immunförsvaret inte känner igen den förändrade ytstrukturen.[5]
Infektionen kan ge både män och kvinnor smärta vid urinering. Dessutom kan män få urinrörsutsöndring samt kvinnor mjölkiga flytningar och onormal menstruation. Ungefär 10% av männen som blir infekterade visar inga symtom och blir infektionen obehandlad kan den spridas vidare till blåshalskörteln, sädesblåsan, Cowpers körtlar och epididymit. Når infektionen epididymis kan det leda till sterilitet. Dryga 50% av de kvinnor som infekteras visar inga symtom på grund av att infektionen är för lätt. Obehandlad kan den leda till inflammation i lilla bäckenet (PID), vilket i sin tur leder till ektopisk graviditet och infertilitet.[2]. Det händer att infektionen sprider sig till blodet, det kan då medföra allvarligare sjukdomar. Om en gravid kvinna är smittad med gonorré, finns det en risk att barnet smittas vid födseln. Barnet kan därefter utveckla ögoninfektion eller lunginflammation. Storstäderna är de vanligaste platserna för smittspridning i Sverige.[6] De personer som är infekterade men som inte visar några symtom är de huvudsakliga smittspridarna.[2] Många svenskar smittas även på utlandsresor till Asien. Inkubationstiden är något eller några dygn upp till någon vecka. Risken för följdsjukdomar minskar om infektionen upptäcks och behandlas i ett så tidigt stadium som möjligt. Gonorré hör till gruppen allmänfarliga sjukdomar och måste därför anmälas till smittskyddsinstitutet vid upptäckt. Därefter är det även obligatoriskt att genomföra en kontaktspårning för att hitta andra möjligt smittade.[6]
Först efter att N.gonorrhoeae har upptäckts kan diagnos ställas. Antibiotika används för behandling och i dagsläget (2011) används först och främst makrolider och kinoloner.[5] De varierande ytstrukturerna gör det svårt att ta fram ett vaccin för bakterien.[4] Därför hjälper framodlade bakteriestammar nu till att avgöra vilka antibiotika som är verksamma mot specifika infektioner. Penicillin utgjorde under en lång tid den mest effektiva behandlingen men sedan 1970-talet har en ökad antibiotikaresistens kunnat skådas hos N.gonorrhoeae.[7] En stor kandidat till ett framtida ledande vaccin ses nu i porinproteinet.[4] Det finns ännu inget vaccin mot gonorré.[2]
Neisseria gonorrhoeae (gonokocker) tillhör släktet Neisseria och är bakterien som orsakar den sexuellt överförbara sjukdomen gonorré. Bakterien uppträder endast hos människan och är en av de vanligast förekommande könssjukdomarna i världen. N.gonorrhoeae är en av två patogener av släktet Neisseria, den andra är Neisseria meningitidis (meningokocker) som orsakar bland annat hjärnhinneinflammation. Båda är humana patogener.
Neisseria gonorrhoeae, insanlarda bel soğukluğu hastalığından sorumlu bakteridir. Neisseria çoğalmak için kompleks besiyerlerine ihtiyaç duymakta ve yağ asidi gibi etkenler üremesine ters etkide bulunmaktadır. Bu cocci grubu bakteriler çiftler halinde bulunurlar. Ortama, fiziksel ve kimyasal faktörlere karşı çok duyarlıdır.Bu yüzden çikolatalı agar gibi besiyerlerinde kültürü yapılabilir. Optimum çoğalma sıcaklığı 35 °C ve 37 °C arasıdır.
N.gonorrhoeae'nın penisilinlere bağışıklık kazanmasından beri, tedavide genellikle seftriakson (3. nesil sefalosporin) kullanılmaktadır.
Gonorrhoeae, cinsel yolla bulaşan hastalıklar arasında en çok karşılaşılandır. Hastalık kadınlarda genellikle asemptomatiktir.
N.gonorrhoeae vücutta genellikle üretra ve endoserviksin kolumnar epitelyumuna yerleşir. Genital olmayan bölgelerden rektum, orofarenks ve konjunktivaya yerleşebilir.
N.Gonorrhoeae ile ilişkili diğer hastalıklar irinli konjunktiva, anorektal gonorrhoeae ve faranjit'tir.
Neisseria gonorrhoeae, insanlarda bel soğukluğu hastalığından sorumlu bakteridir. Neisseria çoğalmak için kompleks besiyerlerine ihtiyaç duymakta ve yağ asidi gibi etkenler üremesine ters etkide bulunmaktadır. Bu cocci grubu bakteriler çiftler halinde bulunurlar. Ortama, fiziksel ve kimyasal faktörlere karşı çok duyarlıdır.Bu yüzden çikolatalı agar gibi besiyerlerinde kültürü yapılabilir. Optimum çoğalma sıcaklığı 35 °C ve 37 °C arasıdır.
N.gonorrhoeae'nın penisilinlere bağışıklık kazanmasından beri, tedavide genellikle seftriakson (3. nesil sefalosporin) kullanılmaktadır.
Грам-негативні бактерії, клітини мають форму бобів, розташовані попарно. Мають невелику капсулу. В старих лабораторних культурах, при хронічній гонореї та при лікуванні антибіотиками форма клітин суттєво змінюється, утворюються L-форми.
На твердому поживному середовищі утворює дрібні (діаметром 1 – 3 мм) колонії прозорого кольору, слизисті по консистенції. У рідкому середовищі дає рівномірне помутніння з невеликим осадом. У лабораторних умовах гонокока досить складно культивувати, йому потрібні поживні середовища збагачені білком (асцит-агар, середовища з сироваткою великої рогатої худоби, дріжджовим автолізатом тощо). Крім того культивування проводиться при концентрації вуглекислого газу у атмосфері 8 – 10% та підвищеній вологості.
Клітини гонокока швидко гинуть у зовнішньому середовищі. При 56°С гинуть протягом 5 хвилин, при обробці розчином азотнокислого срібла у розведенні 1:6000 через 1 хвилину, у виділеннях хворого – через 4 – 5 годин.
Екзотоксинів гонокок не утворює. При руйнуванні клітин бактерій отримують ендотоксин, який викликає загибель лабораторних мишей при введенні в очеревину.
Гонококи мають два антигенних комплексу – протеїновий, схожий з протеїновими антигенами пневмокока та менінгокока та полісахаридні типоспецифічні антигени.
Гонокок потрапляє до організму людини під час статевого контакту або під час пологів, якщо жінка хвора на гонорею, збудник уражає слизові оболонки очей дитини. Організм людини не має вродженого імунітету до гонокока, крім під час захворювання та після нього імунітет також не формується. При гонореї спостерігається добре виражений процес фагоцитозу, але він має незавершений характер. При цьому бактерії у фагоцитах не тільки не руйнуються, але навіть розмножуються. Внаслідок цього фагоцитоз не є фактором імунітету при гонореї, скоріш він наносить шкоду організму, захищаючи збудника від дії антибіотиків.
Neisseria gonorrhoeae
(Zopf, 1885) Trevisan, 1885
Гонококк (лат. Neisseria gonorrhoeae) — вид грамотрицательных диплококков рода Neisseria. Вызывают гонорею — антропонозную венерическую инфекцию, характеризующуюся гнойным воспалением слизистых оболочек, чаще мочеполовой системы.
Гонококк — неподвижный грамотрицательный парный кокк (диплококк), обе половинки которого имеют сходство с кофейными зернами, обращёнными вогнутой стороной друг к другу. Фагоцитированные полинуклеарными нейтрофилами гонококки чаще не погибают, а сохраняют жизнеспособность и вирулентность (эндоцитобиоз) и даже размножаются.
В неблагоприятных условиях, в частности под воздействием антибактериальных препаратов, гонококки могут трансформироваться в L-форму или изменять свои свойства (так называемые формы Аша). Гонококки можно выращивать на искусственных питательных средах, они лучше растут при наличии нативного человеческого белка в атмосфере с повышенным содержанием CO2 при 37 °C.
Устойчивые внутри организма носителя, во внешней среде гонококки мало устойчивы. Гонококки гибнут по мере высыхания субстрата, в котором находятся и при нагревании уже до 40—45 °C. Почти моментально они погибают в мыльной воде, на них губительно действуют слабые соли серебра, растворы антисептиков и многие антибиотики.
В организме человека гонококки относительно быстро приобретают устойчивость к антибиотикам и сульфаниламидным препаратам; постепенно нарастает частота штаммов, продуцирующих бета-лактамазу (пенициллиназу).
Передача возбудителей происходит, как правило, половым путём или через личные вещи. У 10 % инфицированных мужчин и 80 % инфицированных женщин болезнь протекает бессимптомно.
Из-за общности путей передачи возбудителя возможна смешанная инфекция, при которой помимо гонококков имеются хламидии, уреаплазмы, трихомонады, грибки кандида, вирусы герпеса и др. Известно, что гонорея при сопутствующем ей трихомонозе лечится с большим трудом, и связано это с тем, что трихомонады — возбудители трихомониаза — «поглощают» гонококки и делают их недоступными для антибиотиков. Кроме того, гонококки способны к эндоцитобиозу — то есть, жить и размножаться внутри других клеток, в частности, внутри кровяных клеток — лейкоцитов. В таких случаях после гибели гонококков воспалительный процесс могут поддерживать эти микроорганизмы (постгонорейные заболевания). Гонорея часто отмечается у больных сифилисом.
Гонококки паразитируют главным образом на слизистых оболочках, выстланных цилиндрическим или железистым эпителием (уретры, канала шейки матки, дистальной части прямой кишки, конъюнктивы). Поражение глаз у взрослых возникает вследствие заноса возбудителей руками с мочеполовых органов. Возможно также бытовое заражение девочек при нарушении гигиенических правил («горшечная» инфекция, совместная постель с больной гонореей, пользование общими предметами личной гигиены, например губками, и пр.) Поражения слизистых оболочек, покрытых многослойным плоским эпителием, как и поражения кожи, возникают редко, лишь при особых обстоятельствах (травма, гормональная перестройка организма, иммунодефицитные состояния). Размножаясь на поверхности эпителия, гонококки могут вызывать его деструкцию и попадать в поверхностные лимфатические и кровеносные сосуды. Время, необходимое для проникновения гонококков в подэпителиальный слой и развития воспаления, определяет продолжительность инкубационного периода: от 1—2 дней до 1 месяца и более.
Диагностическое значение имеет повышенное содержание лейкоцитов в моче при отсутствии каких-либо жалоб. Диагноз считается доказанным только при определении возбудителей в мазках или посевах[1][2][3][4][5].
В случае когда гонококки устойчивы к пенициллину и его дериватам, часто используют Цефтриаксон (антибиотик третьего поколения из цефалоспоринов). Лечение должно происходить у обоих партнеров.
Незнание состояния чувствительности возбудителей урогенитальных инфекций (прежде всего гонококков) к применяемым антибиотикам чревато неудачами лечения и дальнейшем нарастанием числа резистентных штаммов и распространению инфекции в целом. В 1977 году в США было зарегистрировано 190 пенициллиноустойчивых штаммов, а в 1982 году уже 40 000, т. е. 4 % от числа всех больных гонореей. В 1991 году 13 % всех выделенных в США штаммов были устойчивыми к пенициллину. В отдельных регионах — Нью-Йорке, Флориде, Калифорнии — эти показатели были ещё выше. С 1993 года в США стали регистрироваться штаммы гонококков, у которых резистентность к пенициллину уже была закреплена на генетическом уровне. Зафиксированы случаи резистентности гонококков к тетрациклинам, аминогликозидам, спектиномицину.
В России, по данным профессора Л. Страчунского, резистентность гонококков распространяется на препараты группы пенициллинов (ампициллин, ампиокс, бициллины), а также доксициклин, которые нецелесообразно использовать для лечения гонореи.
Следует отметить чрезвычайно высокую чувствительность возбудителя гонореи, в том числе пенициллиноустойчивых штаммов к цефтриаксону (Роцефину). Согласно современным данным, излечение неосложненной гонореи наступает у всех больных при однократном внутримышечном введении 250 мг Роцефина. Фармако-кинетические особенности препарата (отличное проникновение во все ткани организма, длительный период полувыведения) обусловили его эффективность при лечении гонореи любой локализации[6].
Пациенты также должны проверяться на другие инфекции, передаваемых половым, особенно на хламидию, так как она сопутствует протеканию болезни (до 50 % случаев). Очень часто одновременно включают лечение антибиотиками и хламидий.
Вероятность заражения можно уменьшить, используя презервативы, а также обработкой половых органов дезинфицирующими средствами: (гибитан, цидипол, мирамистин, бетадин) в течение первых 2 часов после полового контакта с потенциальным носителем инфекции.
Гонококк (лат. Neisseria gonorrhoeae) — вид грамотрицательных диплококков рода Neisseria. Вызывают гонорею — антропонозную венерическую инфекцию, характеризующуюся гнойным воспалением слизистых оболочек, чаще мочеполовой системы.
淋球菌(學名:Neisseria gonorrhoeae,奈瑟氏球菌)又稱淋病雙球菌(「淋」,拼音:lìn)、淋病奈瑟菌,是導致淋病的病原菌,和腦膜炎奈瑟菌同屬於奈瑟菌屬,是革蘭氏陰性菌一個屬種。球菌是需要複雜營養的,在實驗室培養要加入營養補充劑。在巧克力細菌培養基(或熱的血培養基)加入二氧化碳可加速其生長。這些球菌在細胞內的典型隨意排列是成一對的( diplococci ) 。
遭淋病雙球菌感染所造成的症狀非常不同,且有10%的男性和80%的女性被感染後是沒有症狀的。感染淋病的男性有很高的機會罹患前列腺癌。
淋病是對青黴素家族抗生素有抵抗能力的,現在常用的抗生素是頭孢曲松鈉(ceftriaxone)(第三代頭孢菌素cephalosporin )。
病人懷疑受到感染,同時也應測試衣原體(Chlamydia)感染,因為很多時他們都是協同感染的。
淋球菌(學名:Neisseria gonorrhoeae,奈瑟氏球菌)又稱淋病雙球菌(「淋」,拼音:lìn)、淋病奈瑟菌,是導致淋病的病原菌,和腦膜炎奈瑟菌同屬於奈瑟菌屬,是革蘭氏陰性菌一個屬種。球菌是需要複雜營養的,在實驗室培養要加入營養補充劑。在巧克力細菌培養基(或熱的血培養基)加入二氧化碳可加速其生長。這些球菌在細胞內的典型隨意排列是成一對的( diplococci ) 。

淋菌(りんきん、Neisseria gonorrhoeae)はナイセリア属のグラム陰性双球菌である。ナイセリア属の菌は全部で11種類あり、その内病原性のものは、この淋菌と髄膜炎菌のみである。淋菌は淋病、角結膜炎[1]、咽頭炎などの原因となる。 その他の9種類のナイセリア菌は全て口腔内に存在する常在菌(日本人の5〜10%に常在)である。粘膜から離れると数時間で感染性を失う[2]。日光、乾燥や温度の変化、消毒剤で簡単に死滅するので、分離培養が必要な場合には検体の取り扱いに注意を要する[2]。
1879年、アルベルト・ナイサーが発見してゴノコックス(Gonococcus)と命名したが、1885年にヴィルヘルム・ツォプフにより、ナイサーにちなみ命名された。
淋菌の大きさは0.6μm〜1.0μmで線毛のある型と線毛のない型に分けられる。線毛は電子顕微鏡で確認できるが、光学顕微鏡では確認できないほど極細の構造である。生きている淋菌は、この線毛を活発に動かし粘膜上皮に付着、粘膜下に浸入するものと思われる。患者から採取した淋菌を血液寒天培地で培養すると、この線毛は消失する。病原性にはこの線毛が重要な鍵を握っていると考えられる。
淋菌は人とチンパンジーだけに感染する。白人は蒙古人よりも淋菌に対して感受性が高く、B血液型と関係するといわれている。
近年、性交の多様化により淋菌の抗生剤耐性菌が増え、新しい抗生剤や抗菌剤に対しても短期間に耐性を獲得する。
無害のほとんどのナイセリア菌は口腔内・咽頭内で常在菌として存在している。これらナイセリア菌は、宿主の人が気管支炎や風邪などの感染症に罹患する毎に、医師から処方される抗生剤の被曝チャンスを頻回に受ける。その結果、様々な抗生剤に対して耐性を獲得する。オーラルセックスで浸入した淋菌は、親戚である口腔内のナイセリア菌と遺伝子組み換え(交差現象)を行い、容易に抗生剤耐性を獲得すると考えられる。2010年時点ではニューキノロン系合成抗菌薬のオフロキサシン、シプロフロキサシン、レボフロキサシン等に対して高度耐性を獲得している。また、2011年にはセフトリアキソンなどのセフェム系抗生物質の耐性獲得株(H041株)の存在が報告されている[3]。
クラミジアとの重複感染も稀ではない。
N. gonorrhoeae菌株のゲノムは塩基配列が決定されている。 例として、多剤耐性がある菌株NCCP11945は、一つの環状染色体(2,232,025 bp、予測ORF 2,662箇所)と一つのプラスチド(4,153 bp、予測ORF 12箇所)によって構成される。 ゲノム全体において予測されるコーディング領域の密度は87%。平均GC含量は52.4%であり、菌株FA1090と似た値である。 NCCP11945のゲノムには、54コピーのtRNAと、4コピーの16S-23S-5S rRNAオペロンがコードされている。[4]
2011年、N. gonorrhoeaeゲノム中に、ヒトDNA断片とみられる痕跡が発見された。これは、ヒトから細菌性病原体へ遺伝子の水平伝播が生じたことを示す初の例である。[5][6]
淋菌(りんきん、Neisseria gonorrhoeae)はナイセリア属のグラム陰性双球菌である。ナイセリア属の菌は全部で11種類あり、その内病原性のものは、この淋菌と髄膜炎菌のみである。淋菌は淋病、角結膜炎、咽頭炎などの原因となる。 その他の9種類のナイセリア菌は全て口腔内に存在する常在菌(日本人の5〜10%に常在)である。粘膜から離れると数時間で感染性を失う。日光、乾燥や温度の変化、消毒剤で簡単に死滅するので、分離培養が必要な場合には検体の取り扱いに注意を要する。
1879年、アルベルト・ナイサーが発見してゴノコックス(Gonococcus)と命名したが、1885年にヴィルヘルム・ツォプフにより、ナイサーにちなみ命名された。
임균(淋菌, Neisseria gonorrhoeae)은 커피빈 모양의 그람 음성 쌍구균으로, 성병 임질을 일으키는 역할을 한다.[1]
이 균은 1879년 앨버트 나이서에 의해 처음 기술되었다.
여러 변형 임균의 게놈이 나열되고 있다. 대부분은 약 2.1 Mb 크기로, 2,100~2,600개의 단백질 변환을 수반한다. (그러나 대부분은 낮은 범위인 것으로 보임)[2]
임균은 성교 중에 사람 대 사람으로 전파된다. 전통적으로 이 병균은 정자에 부착되어 옮겨지는 것으로 간주되었으나 이 가설은 이 질병의 여성 대 남성 전파를 설명하지 못한다.
임균 감염 증상은 감염 지역에 따라 다르다. 감염 남성의 10%와 감염 여성의 80%가 무증상이다.[3]