pt-BR
nomes no trilho de navegação


Batrachochytrium dendrobatidis (Bd) is a chytrid fungus that was first reported as the cause of chytridiomycosis (an often deadly and highly infectious disease of amphibians) in wild and captive frogs collected in North and Central America and Australia. It was formally described as a species from captive South American frogs in 1999 and virtually everything known about it has been discovered in the context of its role in global amphibian declines. This fungus has now been found on all continents except Antarctica and has been detected in frog specimens collected as long ago as 1938. Chytrid fungi are typically aquatic and differ from other fungi in that they have a motile, flagellated zoospore. Many chytrid species have been described from aquatic habitats and soils as free-living or commensal organisms and as parasites of algae, invertebrates, fungi, and plants. Bd is one of only two chytrids known to parasitize vertebrates and it is the only one known to infect and develop within the keratinized epidermal cells of living amphibian skin. Bd infects an extraordinarily broad diversity of host species--in fact, it has the widest known host range of any pathogen. It is known to infect over 350 species of amphibians and has been been implicated in driving the decline or extinction of over 200 of these species. (Fisher et al. 2009; Kilpatrick et al. 2009)
The origin of the BD chytridiomycosis pandemic remains controversial. According to the "novel pathogen hypothesis", Bd has been recently introduced to areas where it is causing population declines. An alternative scenario, the "endemic pathogen hypothesis", suggests that Bd has been present in recently affected populations for a long time, with its newly devastating impact resulting from changes in host susceptibility, pathogen virulence, environmental changes, or some combination of these factors. Molecular data from sites broadly dispersed around the world seem to suggest a single origin of Bd with evidence of local and global spread; these findings lend strong support to the novel pathogen hypothesis. However, in some populations Bd appears to be present without causing subsequent declines and in other locations, it appears to have been present before widespread declines. Similarly, in some species that declined regionally but persisted in small populations, Bd is still present and infecting frogs without driving these populations to extinction. (Fisher et al. 2009 and references therein; Kilpatrick et al. 2009 and references therein; Lam et al. 2010) The possible role of natural or anthropogenic global climate cycles, or long-term changes, in driving outbreaks of amphibian chytridiomycosis is controversial (for discussion, see, e.g., Lips et al. 2008; Rohr et al. 2008; Rohr and Raffel 2010).
Chytridiomycosis is notable for an overall lack of obvious disease pathologies. Metamorphosed amphibians infected with Bd typically exhibit epidermal hyperplasia and hyperkeratosis, and possibly upregulated skin shedding, but only rarely do they exhibit any lesions visible to the naked eye. Larval anuran amphibians may exhibit visible deformities of keratinized mouthparts. Bd is hypothesized to produce lethal toxins either before or after infection, to interfere with water uptake and lead to death due to dehydration, or to cause sharp osmotic imbalances that may interfere with water regulation and/or neurological function. (Fisher et al. 2009) Voyles et al. (2009) studied Bd infection in the treefrog Litoria caerulea. They found that in diseased individuals electrolyte transport across the epidermis was inhibited by >50%, plasma sodium and potassium concentrations were reduced by ~20% and ~50%, respectively, and asystolic cardiac arrest resulted in death. Given the critical importance of the skin in maintaining amphibian homeostasis, disruption of cutaneous function may be the mechanism by which Bd produces morbidity and mortality across a wide range of phylogenetically distant amphibian taxa.
Fungicidal protocols have been developed that are generally very effective for captive frogs, making captive breeding an important component of frog conservation efforts. These approaches include the use of elevated temperature, formalin/malachite green, and standard veterinary antifungal drugs. Good results for clearing infection in captive colonies have suggested the possibility of clearing infection in natural populations using catch, treat, and release methods using inexpensive, mobile biocontainment laboratories. An important new development in research on mitigation is the recognition that some bacteria that occur naturally on amphibian skin produce antifungal metabolites. This finding suggests the possibility of a probiotic approach to Bd mitigation, i.e., intentionally spreading these protective bacteria. (Fisher et al. 2009 and references therein; Lam et al. 2010)
It remains unclear how Bd has dispersed to and persisted in remote pristine environments where anthropogenic introduction is unlikely. If Bd can survive independently of amphibian hosts, it must use non-amphibian organic materials as nutrient resources. Although Bd DNA has been detected in water bodies and on rocks, conclusive evidence of Bd persistence in the environment is lacking. Species, populations, and individuals vary widely in susceptibility to chytridiomycosis. Mortality rates in laboratory infection experiments can range from 0% to 100%, depending on the species, age of animals, and temperature regime. In the wild, some species and populations are extirpated. while others, those that survive initial declines, persist with various levels of infection. While the disease dynamics are undoubtedly influenced by local environmental conditions, particularly temperature, inherent differences in host susceptibility and behavior are also important. Colonization by Bd and subsequent disease development may be influenced by host defense mechanisms, such as secretions of antimicrobial peptides or bacterial commensals with anti-fungal properties. Some species-specific behavioral characteristics such as microhabitat selection, basking, aggregating in retreat sites, or association with water bodies may also affect the likelihood of infection and disease. (Rosenbaum et al 2010 and references therein)
Batrachochytrium dendrobatidis és un fong quítrid que causa la malaltia de la quitridiomicosi. En la dècada després que es descobrís en amfibis el 1998,[1] la malaltia devastà les poblacions d'amfibis de tot el món, en un declivi global que es considera una part de l'extinció de l'Holocè.
El nom del gènere deriva de les paraules del grec batracho (granota) and chytr (pot de terra), mentre que el nom de l'epítet específic deriva del gènere de granotes Dendrobates.[2]
Un estudi genètic suggereix que l'origen geogràfic del fong podria ser la Península de Corea. D'allí s'hauria estès per tot el planeta Terra.[3]
B. dendrobatidis és una espècie monotípica del gènere Batrachochytrium.
B. dendrobatidis pot créixer dins un ampli marge de temperatures (4-25°C), amb l'óptim a 17-25°C.[4]
B. dendrobatidis infecta la pell queratinitzada dels amfibis. El fong a l'epidermis té un tal·lus que porta rizoides i esporangis. Cada esporangi produeix un tub per on allibera espores.
Batrachochytrium dendrobatidis és un fong quítrid que causa la malaltia de la quitridiomicosi. En la dècada després que es descobrís en amfibis el 1998, la malaltia devastà les poblacions d'amfibis de tot el món, en un declivi global que es considera una part de l'extinció de l'Holocè.
Der Chytridpilz (Batrachochytrium dendrobatidis) ist ein Töpfchenpilz (Chytridiomycota), der Amphibien befällt und bei ihnen eine Chytridiomykose genannte Krankheit verursacht. Eine Infektion mit dem Pilz kann bei manchen Arten tödlich verlaufen. Seit den 1980er-Jahren besteht eine regelrechte Chytridpilz-Epidemie, durch die zahlreiche Amphibienarten, vorwiegend in Mittel- und Südamerika sowie Australien, stark in ihrem Bestand dezimiert oder sogar fast ausgestorben sind. Das Phänomen wird unter dem Schlagwort weltweiter Amphibienrückgang (engl. global amphibian decline) diskutiert. Der genaue Auslöser dieser Epidemie ist noch ungeklärt, doch vermutet man, dass am plötzlichen Aussterben vieler Arten auch noch andere Faktoren beteiligt sind, etwa Umweltverschmutzung, Klimaerwärmung, Zerstörung der Ozonschicht oder der Einsatz von Pestiziden.
Der Chytridpilz gehört zur Gruppe um die Gattung Rhizophydium, eine genauere Zuordnung innerhalb der Ordnung Chytridiales steht jedoch noch aus.
Infektionen mit Chytridpilzen sind keinesfalls nur ein Phänomen der letzten Jahre, sondern sind schon länger bekannt. Die älteste bekannte Infektion wurde in den 1920er-Jahren in Afrika nachgewiesen. Wie genau der Pilz zum Tod der befallenen Tiere führt, ist noch nicht vollkommen geklärt, man vermutet aber, dass der Pilz entweder Toxine abgibt, die das Amphibium über die Haut aufnimmt, oder dass der Pilz den Wasser- und Elektrolyt-Haushalt der betroffenen Tiere empfindlich beeinträchtigt, so dass diese im Endeffekt sterben. Auch dürfte durch den Pilzbefall die Barrierefunktion der Haut gegenüber anderen Krankheitserregern in Mitleidenschaft gezogen werden.
Bekannt ist, dass Chytridpilze lediglich die obere Hautschicht der Amphibien befallen und dort auch nur solche Bereiche, in denen das Protein Keratin, welches beispielsweise auch in Federn, Haaren und Krallen vorkommt, anzutreffen ist. Dabei sind bei Fröschen nur sehr wenige Bereiche der Haut mit Keratin durchsetzt. Da Froschlurche zu großen Teilen über die Haut atmen, muss die Hautoberfläche sehr dünn und feucht bleiben. Daher sind bei erwachsenen Fröschen nur die Füße und die Bereiche, in denen die Beine am Rumpf reiben, mit Keratin durchzogen, bei Kaulquappen sogar nur der Bereich um den Mund. Dort sind Chytridpilze auch bei vielen Tieren zu finden, doch ist die Infektion erst gefährlich, wenn die Metamorphose zum erwachsenen Tier erfolgt, da dann größere Hautflächen betroffen sind.
Der Chytridpilz stammt ursprünglich aus Afrika und siedelt auf der Haut von afrikanischen Krallenfröschen, die gegen die Wirkung dieser Pilze jedoch immun sind. Vom Menschen wurden die für Schwangerschaftstests (Froschtest) verwendeten Krallenfrösche, die daher auch als Apothekerfrosch bezeichnet werden, weltweit verbreitet und mit ihnen der Pilz eingeschleppt. Da Amphibien in anderen Gebieten keine Immunität gegen den Pilz besitzen, wurde so eine globale Chytridiomykose-Epidemie ausgelöst.
Die Gefahr besteht darin, dass die so befallenen Tiere den Pilz noch weiter verbreiten, da sie den Pilz mit sich herumtragen. Die Sporen von Chytridpilzen sind im Wasser bis zu 24 Stunden überlebensfähig, so dass sich der Pilz besonders in Fließgewässern schnell ausbreitet. Soweit bekannt, befällt der Pilz auch vollkommen gesunde Tiere und nicht nur kranke oder geschwächte Individuen, so dass er sich innerhalb einer Lurchpopulation rasch vermehren kann. Des Weiteren wäre es möglich, dass andere wechselwarme Tiere, denen die Infektion selbst nichts ausmacht, den Pilz ebenfalls verbreiten könnten. Auch eine unabsichtliche Verbreitung durch den Menschen – entweder direkt durch Übertragung der Sporen oder indirekt durch den versehentlichen Transport infizierter Tiere – stellt eine Gefahr für viele Amphibienpopulationen dar, so dass geraten wird, engeren Kontakt mit Amphibien in der Natur möglichst zu vermeiden, wenn man kein Material wie z. B. Handschuhe dabei hat, um die Verbreitung der Chytridpilze nicht noch zusätzlich zu beschleunigen.
Ebenfalls bekannt ist, dass es einen Temperatureffekt bei Chytridinfektionen gibt. Bei vergleichsweise niedrigen Temperaturen (17 °C) liegt die Sterberate in befallenen Populationen bei bis zu 100 %, während bei 27 °C lediglich 50 % der Tiere sterben. Daher sind vor allem Amphibienpopulationen stark von dem Pilz bedroht, die sich in einer bestimmten Höhe (ab 400 Meter über dem Meeresspiegel) befinden, da hier die Temperaturen naturgemäß niedriger sind.
Eine im Januar 2006 in der Zeitschrift Nature veröffentlichte Untersuchung sieht es als erwiesen an, dass der Klimawandel über den tropischen Bergen Lateinamerikas zu verstärkter Wolkenbildung führt. Daraus wiederum resultieren kühlere Tage und wärmere Nächte, was für den Chytridpilz förderlich ist, der am besten bei Temperaturen zwischen 17 und 25 °C gedeiht.[1]
Durch Chytridpilz-Infektionen werden Populationen insgesamt auch weniger widerstandsfähig gegenüber anderen Gefährdungen wie Fressfeinden oder Krankheiten, so dass eine Chytridpilz-Infektion der Auslöser dafür sein kann, dass Populationen, die sich ansonsten in ihrer Umwelt behaupten könnten, dieser nun nicht mehr gewachsen sind. Es kommt zu dramatischen Einbrüchen der Populationsgröße, bzw. die Bestände und Arten verschwinden sogar ganz.
Wie in einem im März 2019 veröffentlichten Science-Artikel festgestellt wurde, ist der Chytridpilz für Bestandsrückgänge bei mehr als 500 Amphibienarten und das Aussterben von 90 Arten verantwortlich. Das ist das größte bisher durch einen einzelnen Erreger verursachte Artensterben.[2][3] Als Hauptursache weltweiter Rückgänge von Amphibienbeständen gilt aber dennoch die Habitatzerstörung durch den wirtschaftenden Menschen – dies betrifft 90 % aller als gefährdet eingestuften Arten. Die übrigen Gefährdungsfaktoren, so auch Pilzerkrankungen, kommen kumulativ hinzu und verstärken sich vermutlich wechselwirkend.
Der vermutlich mit aus Asien stammenden Terrarientieren eingeschleppte, genetisch nahe verwandte Batrachochytrium salamandrivorans („Bsal“, auch „Salamanderfresser“) führte in den Niederlanden zu einem Rückgang der Feuersalamanderpopulation von bis zu 96 %. Er wurde auch in Belgien nachgewiesen, aus privater Haltung auch erstmals im Oktober 2015 in Deutschland.[4]
Der Chytridpilz (Batrachochytrium dendrobatidis) ist ein Töpfchenpilz (Chytridiomycota), der Amphibien befällt und bei ihnen eine Chytridiomykose genannte Krankheit verursacht. Eine Infektion mit dem Pilz kann bei manchen Arten tödlich verlaufen. Seit den 1980er-Jahren besteht eine regelrechte Chytridpilz-Epidemie, durch die zahlreiche Amphibienarten, vorwiegend in Mittel- und Südamerika sowie Australien, stark in ihrem Bestand dezimiert oder sogar fast ausgestorben sind. Das Phänomen wird unter dem Schlagwort weltweiter Amphibienrückgang (engl. global amphibian decline) diskutiert. Der genaue Auslöser dieser Epidemie ist noch ungeklärt, doch vermutet man, dass am plötzlichen Aussterben vieler Arten auch noch andere Faktoren beteiligt sind, etwa Umweltverschmutzung, Klimaerwärmung, Zerstörung der Ozonschicht oder der Einsatz von Pestiziden.
Batrachochytrium dendrobatidis (/bəˌtreɪkoʊˈkɪtriəm ˈdɛndroʊbətaɪdɪs/ bə-TRAY-koh-KIT-ree-əm DEN-droh-bə-ty-dis), also known as Bd or the amphibian chytrid fungus, is a fungus that causes the disease chytridiomycosis in amphibians.
Since its discovery in 1998 by Lee Berger,[1] the disease devastated amphibian populations around the world, in a global decline towards multiple extinctions, part of the Holocene extinction. A recently described second species, B. salamandrivorans, also cause chytridiomycosis and death in salamanders.
The fungal pathogens that cause the disease chytridiomycosis ravage the skin of frogs, toads, and other amphibians, throwing off their balance of water and salt and eventually causing heart failure, Nature reports. Some amphibian species appear to have an innate capacity to withstand chytridiomycosis infection due to symbiosis with Janthinobacterium lividum. Even within species that generally succumb, some populations survive, possibly demonstrating that these traits or alleles of species are being subjected to evolutionary selection.
The generic name is derived from the Greek words batrachos (frog) and chytra (earthen pot), while the specific epithet is derived from the genus of frogs from which the original confirmation of pathogenicity was made (Dendrobates),[2] dendrobatidis is from the Greek dendron, "tree" and bates, "one who climbs", referring to a genus of poison dart frogs.[3]
Batrachochytrium dendrobatidis was until recently considered the single species of the genus Batrachochytrium. The initial classification of the pathogen as a chytrid was based on zoospore ultrastructure. DNA analysis of the SSU-rDNA has corroborated the view, with the closest match to Chytridium confervae. A second species of Batrachochytrium was discovered in 2013: B. salamandrivorans, which mainly affects salamanders and also causes chytridiomycosis.[4] B. salamandrivorans differs from B. dendrobatidis primarily in the formation of germ tubes in vitro, the formation of colonial thalli with multiple sporangia in vivo, and a lower thermal preference.[4]

B. dendrobatidis infects the keratinized skin of amphibians. The fungus in the epidermis has a thallus bearing a network of rhizoids and smooth-walled, roughly spherical, inoperculate (without an operculum) sporangia. Each sporangium produces a single tube to discharge spores.
Zoospores of B. dendrobatidis, which are typically 3–5 µm in size, have an elongate–ovoidal body with a single, posterior flagellum (19–20 µm long), and possess a core area of ribosomes often with membrane-bound spheres of ribosomes within the main ribosomal mass.[2] A small spur has been observed, located at the posterior of the cell body, adjacent to the flagellum, but this may be an artifact in the formalin-fixed specimens. The core area of ribosomes is surrounded by a single cisterna of endoplasmic reticulum, two to three mitochondria, and an extensive microbody–lipid globule complex. The microbodies closely appose and almost surround four to six lipid globules (three anterior and one to three laterally), some of which appear bound by a cisterna. Some zoospores appear to contain more lipid globules (this may have been a result of a plane-of-sectioning effect, because the globules were often lobed in the zoospores examined). A rumposome has not been observed.[2]
A nonfunctioning centriole lies adjacent to the kinetosome. Nine interconnected props attach the kinetosome to the plasmalemma, and a terminal plate is present in the transitional zone. An inner ring-like structure attached to the tubules of the flagellar doublets within the transitional zone has been observed in transverse section. No roots associated with the kinetosome have been observed. In many zoospores, the nucleus lies partially within the aggregation of ribosomes and was invariably situated laterally. Small vacuoles and a Golgi body with stacked cisternae occurred within the cytoplasm outside the ribosomal area. Mitochondria, which often contain a small number of ribosomes, are densely staining with discoidal cristae.[2]
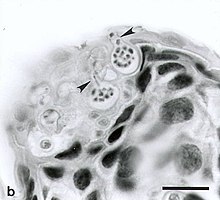
B. dendrobatidis has two primary life stages: a sessile, reproductive zoosporangium and a motile, uniflagellated zoospore released from the zoosporangium. The zoospores are known to be active only for a short period of time, and can travel short distances of one to two centimeters.[5] However, the zoospores are capable of chemotaxis, and can move towards a variety of molecules that are present on the amphibian surface, such as sugars, proteins and amino acids.[6] B. dendrobatidis also contains a variety of proteolytic enzymes and esterases that help it digest amphibian cells and use amphibian skin as a nutrient source.[7] Once the zoospore reaches its host, it forms a cyst underneath the surface of the skin, and initiates the reproductive portion of its life cycle. The encysted zoospores develop into zoosporangia, which may produce more zoospores that can reinfect the host, or be released into the surrounding aquatic environment.[8] The amphibians infected with these zoospores are shown to die from cardiac arrest.[9]
Besides amphibians B. dendrobatidis also infects crayfish (Procambarus alleni, P. clarkii, Orconectes virilis, and O. immunis) but not mosquitofish (Gambusia holbrooki).[10]
B. dendrobatidis can grow within a wide temperature range (4-25 °C), with optimal temperatures being between 17 and 25 °C.[11] The wide temperature range for growth, including the ability to survive at 4 °C gives the fungus the ability to overwinter in its hosts, even where temperatures in the aquatic environments are low. The species does not grow well above temperatures of 25 °C, and growth is halted above 28 °C.[11] Infected red-eyed treefrogs (Litoria chloris) recovered from their infections when incubated at a temperature of 37 °C.[12]
B. dendrobatidis has occasionally been found in forms distinct from its traditional zoospore and sporangia stages. For example, before the 2003 European heat wave that decimated populations of the water frog Rana lessonae through chytridiomycosis, the fungus existed on the amphibians as spherical, unicellular organisms, confined to minute patches (80–120 micrometers across). These organisms, unknown at the time, were subsequently identified as B. dendrobatidis. Characteristics of the organisms were suggestive of encysted zoospores; they may have embodied a resting spore, a saprobe, or a parasitic form of the fungus that is non-pathogenic.[13]
The fungus grows on amphibian skin and produces aquatic zoospores.[14] It is widespread and ranges from lowland forests to cold mountain tops. It is sometimes a non-lethal parasite and possibly a saprophyte. The fungus is associated with host mortality in highlands or during winter, and becomes more pathogenic at lower temperatures.[15]
It has been suggested that B. dendrobatidis originated in Africa or Asia and subsequently spread to other parts of the world by trade in African clawed frogs (Xenopus laevis).[16] In this study, 697 archived specimens of three species of Xenopus, previously collected from 1879 to 1999 in southern Africa, were examined. The earliest case of chytridiomycosis was found in a X. laevis specimen from 1938. The study also suggests that chytridiomycosis had been a stable infection in southern Africa from 23 years prior to finding any infected outside of Africa.[16] There is more recent information that the species originated on the Korean peninsula and was spread by the trade in frogs.[17]
American bullfrogs (Lithobates catesbeianus), also widely distributed, are also thought to be carriers of the disease due to their inherent low susceptibility to B. dendrobatidis infection.[18][19] The bullfrog often escapes captivity and can establish feral populations where it may introduce the disease to new areas.[5] It has also been shown that B. dendrobatidis can survive and grow in moist soil and on bird feathers, suggesting that B. dendrobatidis may also be spread in the environment by birds and transportation of soils.[20] Infections have been linked to mass mortalities of amphibians in North America, South America, Central America, Europe and Australia.[21][22][23] B. dendrobatidis has been implicated in the extinction of the sharp-snouted day frog (Taudactylus acutirostris) in Australia.[24]
A wide variety of amphibian hosts have been identified as being susceptible to infection by B. dendrobatidis, including wood frogs (Lithobates sylvatica),[25] the mountain yellow-legged frog (Lithobates muscosa),[26] the southern two-lined salamander (Eurycea cirrigera),[27] San Marcos Salamander (Eurycea nana), Texas Salamander (Eurycea neotenes), Blanco River Springs Salamander (Eurycea pterophila), Barton Springs Salamander (Eurycea sosorum), Jollyville Plateau Salamander (Eurycea tonkawae),[28] Ambystoma jeffersonianum,[29] the western chorus frog (Pseudacris triseriata), the southern cricket frog (Acris gryllus), the eastern spadefoot toad (Scaphiopus holbrooki), the southern leopard frog (Lithobates sphenocephala),[30] the Rio Grande Leopard frog (Lithobates berlandieri),[31] and the Sardinian newt (Euproctus platycephalus).[32] and endemic frog species, the Beysehir frog in Turkey (Pelophylax caralitanus).[33]
While most studies concerning B. dendrobatidis have been performed in various locations across the world, the presence of the fungus in Southeast Asia remains a relatively recent development. The exact process through which the fungus was introduced to Asia is not known, however, as mentioned above, it has been suggested transportation of asymptomatic carrier species (e.g. Lithobates catesbeianus, the American Bullfrog) may be a key component in the dissemination of the fungus, at least in China.[34] Initial studies demonstrated the presence of the fungus on island states/countries such as Hong Kong,[35] Indonesia,[36] Taiwan,[30] and Japan.[37] Soon thereafter, mainland Asian countries such as Thailand,[38] South Korea,[39] and China[40] reported incidences of B. dendrobatidis among their amphibian populations. Much effort has been put into classifying herpetofauna in countries like Cambodia, Vietnam, and Laos where new species of frogs, toads, and other amphibians and reptiles are being discovered on a frequent basis. Scientists simultaneously are swabbing herpetofauna in order to determine if these newly discovered animals possess traces of the fungus.
In Cambodia, a study showed B. dendrobatidis to be prevalent throughout the country in areas near Phnom Penh (in a village <5 km), Sihanoukville (frogs collected from the local market), Kratie (frogs collected from streets around the town), and Siem Reap (frogs collected from a national preserve: Angkor Centre for Conservation of Biodiversity).[41] Another study in Cambodia questioned the potential anthropological impact in the dissemination of B. dendrobatidis on local amphibian populations in 3 different areas in relation to human interaction: low (an isolated forest atop a mountain people rarely visit), medium (a forest road ~15 km from a village that is used at least once a week), and high (a small village where humans interact with their environment on a daily basis). Using quantitative PCR, evidence of B. dendrobatidis was found in all 3 sites with the highest percentage of amphibians positive for the fungus from the forest road (medium impact; 50%), followed by the mountain forest (low impact; 44%) and village (high impact; 36%).[42] Human influence most likely explains detection of the fungus in the medium and high areas, however it does not provide an adequate explanation why even isolated amphibians were positive for B. dendrobatidis. This may go unanswered until more research is performed on transmission of the fungus across landscapes. However, recent evidence suggests mosquitoes may be a possible vector which may help spread B. dendrobatidis. Another study in French Guiana reports widespread infection, with 8 of 11 sites sampled being positive for B. dendrobatidis infection for at least one species.[43] This study suggests that Bd is more widespread than previously thought.
Worldwide amphibian populations have been on a steady decline due to an increase in the disease Chytridiomycosis, caused by this Bd fungus. Bd can be introduced to an amphibian primarily through water exposure, colonizing the digits and ventral surfaces of the animal's body most heavily and spreading throughout the body as the animal matures. Potential effects of this pathogen are hyperkeratosis, epidermal hyperplasia, ulcers, and most prominently the change in osmotic regulation often leading to cardiac arrest.[44] The death toll on amphibians is dependent on a variety of factors but most crucially on the intensity of infection. Certain frogs adopt skin sloughing as a defense mechanism for B. dendrobatidis; however, this is not always effective, as mortality fluctuates between species. For example, the Fletcher frog, despite practicing skin sloughing, suffers from a particularly high mortality rate when infected with the disease compared to similar species like Lim. peronii and Lim. tasmaniensis. Some amphibian species have been found to adapt to infection after an initial die-off with survival rates of infected and non-infected individuals being equal.[45]
According to a study by the Australian National University estimates that the Bd fungus has caused the decline of 501 amphibian species—about 6.5 percent of the world known total. Of these, 90 have been entirely wiped out and another 124 species have declined by more than 90 percent, and their odds of the effected species recovering to a healthy population are doubtful.[46] However, these conclusions were criticized by later studies, which proposed that Bd was not as primary a driver of amphibian declines as found by the previous study.[47]
One amphibian in particular that Batrachochytrium dendrobatidis (Bd) has affected greatly was the Lithobates clamitans. Bd kills this frog by interfering with external water exchange thereby causing an imbalance with ion exchange which leads to heart failure.
Some amphibian species are actually immune to Bd, or have biological protections against the fungus.[48] One such salamander is the alpine salamander, or S. atra. These salamanders have several subspecies, but they share a common trait: toxicity. A 2012 study demonstrated that no alpine salamanders in the area had the disease, despite its prevalence in the area.[49] Alpine salamanders can produce alkaloid products[50][49] or other toxic peptides[50] that may be protective against microbes.[51]
Batrachochytrium dendrobatidis (/bəˌtreɪkoʊˈkɪtriəm ˈdɛndroʊbətaɪdɪs/ bə-TRAY-koh-KIT-ree-əm DEN-droh-bə-ty-dis), also known as Bd or the amphibian chytrid fungus, is a fungus that causes the disease chytridiomycosis in amphibians.
Since its discovery in 1998 by Lee Berger, the disease devastated amphibian populations around the world, in a global decline towards multiple extinctions, part of the Holocene extinction. A recently described second species, B. salamandrivorans, also cause chytridiomycosis and death in salamanders.
The fungal pathogens that cause the disease chytridiomycosis ravage the skin of frogs, toads, and other amphibians, throwing off their balance of water and salt and eventually causing heart failure, Nature reports. Some amphibian species appear to have an innate capacity to withstand chytridiomycosis infection due to symbiosis with Janthinobacterium lividum. Even within species that generally succumb, some populations survive, possibly demonstrating that these traits or alleles of species are being subjected to evolutionary selection.
Batrachochytrium dendrobatidis, también conocido como Bd o el hongo quitrido de los anfibios, es un hongo quitrido que amenaza la población mundial de anfibios, a los que causa la enfermedad denominada quitridiomicosis. Se trata de un hongo dulceacuícola. Ataca a la piel de los anfibios, la cual es imprescindible para su homeostasis hídrica y gaseosa y defensa inmunológica, dañando la capa de queratina.[2] Está incluida en la lista 100 de las especies exóticas invasoras más dañinas del mundo[3] de la Unión Internacional para la Conservación de la Naturaleza.
Dado que la pandemia de quitridiomicosis sucede desde la década de los 80, se ha discutido el posible papel humano en la difusión del hongo. Hoy se asume que Xenopus laevis, una rana empleada para efectuar los test de embarazo, pudo actuar como vector propagador del hongo por todo el mundo, si bien esta técnica empezó a difundirse en 1930 y hasta hace poco más de veinte años no se ha recrudecido la enfermedad. De hecho, hay investigadores que opinan que el hongo siempre ha estado en contacto con las poblaciones de anfibios y que sólo ahora, cuando están inmunodeprimidas por efecto del impacto humano en los ecosistemas, su micosis se hace más patente.
El nombre del género se deriva de las palabras griegas batrachos (rana) y Chytra (vasija de barro), mientras que el calificativo específico proviene del género de ranas en el que se detectó por primera vez el patógeno (Dendrobates).[4]
El Bd es originario de Sudáfrica, donde al parecer era una infección estable en las poblaciones silvestres de la rana africana de uñas Xenopus laevis.
A partir de los años 30, probablemente a causa del comercio de ejemplares de X. laevis comienza a propagarse por el todo el mundo hasta convertirse en el responsable del mayor declive de anfibios a nivel mundial.[5]
La temperatura óptima de desarrollo del B. dendrobatidis se encuentra entre los 17 y los 25 grados, pudiendo sobrevivir a temperaturas por encima de los 4 grados y hasta un máximo de 27 ºC, momento en el que el crecimiento se detiene. Temperaturas superiores a los 30 grados parecen causar la muerte del hongo.[5]
Debido a su potencial colonizador y constituir una amenaza grave para las especies autóctonas, los hábitats o los ecosistemas, esta especie, así como la rana Xenopus laevis, han sido incluidas en el Catálogo Español de Especies Exóticas Invasoras, regulado por el Real Decreto 630/2013, de 2 de agosto, estando prohibida en España su introducción en el medio natural, posesión, transporte, tráfico y comercio.[6]
Batrachochytrium dendrobatidis, también conocido como Bd o el hongo quitrido de los anfibios, es un hongo quitrido que amenaza la población mundial de anfibios, a los que causa la enfermedad denominada quitridiomicosis. Se trata de un hongo dulceacuícola. Ataca a la piel de los anfibios, la cual es imprescindible para su homeostasis hídrica y gaseosa y defensa inmunológica, dañando la capa de queratina. Está incluida en la lista 100 de las especies exóticas invasoras más dañinas del mundo de la Unión Internacional para la Conservación de la Naturaleza.
Dado que la pandemia de quitridiomicosis sucede desde la década de los 80, se ha discutido el posible papel humano en la difusión del hongo. Hoy se asume que Xenopus laevis, una rana empleada para efectuar los test de embarazo, pudo actuar como vector propagador del hongo por todo el mundo, si bien esta técnica empezó a difundirse en 1930 y hasta hace poco más de veinte años no se ha recrudecido la enfermedad. De hecho, hay investigadores que opinan que el hongo siempre ha estado en contacto con las poblaciones de anfibios y que sólo ahora, cuando están inmunodeprimidas por efecto del impacto humano en los ecosistemas, su micosis se hace más patente.
Batrachochytrium dendrobatidis on viburseen, mis põhjustab kahepaiksete haigust kütridiomükoosi. See on teadaolevalt ainuke viburseen, mis parasiteerib selgroogsetel.
Seen avastati 1998. aastal ja see on põhjustanud mitmete liikide arvukuse järsu languse või väljasuremise.
Kasvab temperatuuril 4–25 °C. Temperatuuril üle 28 °C kasv peatub.
Batrachochytrium dendrobatidis on viburseen, mis põhjustab kahepaiksete haigust kütridiomükoosi. See on teadaolevalt ainuke viburseen, mis parasiteerib selgroogsetel.
Seen avastati 1998. aastal ja see on põhjustanud mitmete liikide arvukuse järsu languse või väljasuremise.
Kasvab temperatuuril 4–25 °C. Temperatuuril üle 28 °C kasv peatub.
Batrachochytrium dendrobatidis (ou « Bd ») est une espèce de champignons aquatiques (Chytrides, récemment devenue invasive), parasite des amphibiens. Ce champignon pathogène provoque le chytridiomycose, une maladie infectieuse occasionnant la mort des individus infectés en bloquant leurs organes respiratoires (phénomène reconnu depuis 1998, en Australie et au Panama).
Ce champignon (chytride) appartient à un groupe de moisissures qui décomposent la matière organique morte. Il est l'un des responsables du déclin des populations d'amphibiens dans différentes régions du monde[1], affectant plus de 200 espèces (plus de 40 % des espèces d’amphibiens ont disparu dans certaines régions d’Amérique centrale)[2], notamment le Bufo baxteri. Les amphibiens comptent parmi les taxons les plus menacés (avec plus de 120 espèces disparues et 435 en forte régression en moins d'un siècle[3]).
La fin des tests de grossesse utilisant des œufs de Xenopus laevis a eu pour effet une dissémination hors de ses élevages de cette grenouille (porteur sain du Batrachochytrium dendrobatidis).
Ce champignon est présent dans la nature depuis très longtemps, mais certains variants importés pourraient avoir rencontré des populations immunitairement naïves d'amphibiens et/ou des variants hautement-pathogènes pourrait être des mutants dont la dispersion a été facilité par l'Homme et dont l'évolution aurait pu avoir été favorisée par la dégradation anthropique des zones humides et de l'environnement en général[4].
Depuis 2009, ce champignon microscopique pathogène frappe aussi l'Europe.
Il semble notamment avoir été récemment identifié comme la source d'une mortalité en hausse des crapauds accoucheurs au lac d'Arlet dans les Pyrénées françaises[5].
Une autre espèce de chytride, découverte récemment, Batrachochytrium salamandrivorans serait responsable du déclin de la population de salamandres aux Pays-Bas (96 % des salamandres y ont disparu)[6] et en Wallonie[7].
Les amphibiens se contaminent quand ils sont dans l'eau. Le champignon qui s'y trouve à l'état de spore s'incruste dans leur peau, s'y développe et forme alors des zoosporanges qui produisent à leur tour des zoospores.
Le nom de genre vient des mots grecs batracho (grenouille) et chytr (pot de terre), tandis que le nom d'espèce est dérivé de Dendrobates[8].
Batrachochytrium dendrobatidis (ou « Bd ») est une espèce de champignons aquatiques (Chytrides, récemment devenue invasive), parasite des amphibiens. Ce champignon pathogène provoque le chytridiomycose, une maladie infectieuse occasionnant la mort des individus infectés en bloquant leurs organes respiratoires (phénomène reconnu depuis 1998, en Australie et au Panama).
Ce champignon (chytride) appartient à un groupe de moisissures qui décomposent la matière organique morte. Il est l'un des responsables du déclin des populations d'amphibiens dans différentes régions du monde, affectant plus de 200 espèces (plus de 40 % des espèces d’amphibiens ont disparu dans certaines régions d’Amérique centrale), notamment le Bufo baxteri. Les amphibiens comptent parmi les taxons les plus menacés (avec plus de 120 espèces disparues et 435 en forte régression en moins d'un siècle).
Batrachochytrium dendrobatidis, tamén coñecido como Bd ou o fungo quítrido dos anfibios, é un fungo quítrido que ameaza a poboación mundial de anfibios, ós que causa a doenza denominada quitridiomicose. Trátase dun fungo dulceacuícola. Ataca a pel dos anfibios, a cal é imprescindible para a súa homeostase hídrica e gasosa e defensa inmunolóxica, danando a capa de queratina.[2] Está incluída na lista 100 das especies exóticas invasoras máis daniñas do mundo[3] da Unión Internacional para a Conservación da Natureza.
Dado que a pandemia de quitridiomicose sucede dende a década dos 80, discutiuse o posible papel humano na difusión do fungo. Hoxe asúmese que Xenopus laevis, unha ra empregada para efectuar o test de embarazo, puido actuar como vector propagador do fungo por todo o mundo, aínda que esta técnica empezou a difundirse en 1930 e até hai pouco máis de vinte anos non se recruou a doenza. De feito, hai investigadores que opinan que o fungo sempre estivo en contacto coas poboacións de anfibios e que só agora, cando están inmunodeprimidas por efecto do impacto humano nos ecosistemas, a súa micose faise máis patente.
Batrachochytrium dendrobatidis, tamén coñecido como Bd ou o fungo quítrido dos anfibios, é un fungo quítrido que ameaza a poboación mundial de anfibios, ós que causa a doenza denominada quitridiomicose. Trátase dun fungo dulceacuícola. Ataca a pel dos anfibios, a cal é imprescindible para a súa homeostase hídrica e gasosa e defensa inmunolóxica, danando a capa de queratina. Está incluída na lista 100 das especies exóticas invasoras máis daniñas do mundo da Unión Internacional para a Conservación da Natureza.
Dado que a pandemia de quitridiomicose sucede dende a década dos 80, discutiuse o posible papel humano na difusión do fungo. Hoxe asúmese que Xenopus laevis, unha ra empregada para efectuar o test de embarazo, puido actuar como vector propagador do fungo por todo o mundo, aínda que esta técnica empezou a difundirse en 1930 e até hai pouco máis de vinte anos non se recruou a doenza. De feito, hai investigadores que opinan que o fungo sempre estivo en contacto coas poboacións de anfibios e que só agora, cando están inmunodeprimidas por efecto do impacto humano nos ecosistemas, a súa micose faise máis patente.
Batrachochytrium dendrobatidis (/bəˌtreɪkoʊˈkɪtriəm ˈdɛndroʊbətaɪdɪs/ bə-TRAY-koh-KIT-ree-ƏM-_), juga disebut Bd atau fungus sitrid amfibi, adalah spesies fungus yang mengakibatkan penyakit sitridiomikosis pada amfibi.
Satu dasawarsa setelah fungus ini ditemukan untuk pertama kalinya pada tahun 1998,[1] penyakit sitridiomikosis mengakibatkan kematian banyak sekali amfibi di seluruh dunia dan bertanggung jawab atas kepunahan berbagai spesies. Spesies kedua yang baru saja ditemukan, B. salamandrivorans, juga menyebabkan sitridiomikosis dan kematian pada salamander.
Beberapa spesies amfibi tampaknya dampak bertahan dari infeksi sitridiomikosis berkat simbiosis dengan Janthinobacterium lividum. Bahkan pada spesies yang terkena dampak penyakit ini, masih ada yang mampu bertahan, kemungkinan berkat seleksi evolusioner.
Diduga B. dendrobatidis berasal dari Afrika dan kemudian menyebar ke wilayah lain lewat perdagangan katak-berkuku Afrika (Xenopus laevis).[2] Kasus sitridiomikosis pertama ditemukan pada spesimen X. laevis dari tahun 1938.[2] Selain itu, telah ditemukan bahwa B. dendrobatidis dapat bertahan dan tumbuh di tanah yang lembab dan di sayap burung, sehingga B. dendrobatidis mungkin juga disebarkan oleh burung dan pemindahan tanah.[3]
Batrachochytrium dendrobatidis (/bəˌtreɪkoʊˈkɪtriəm ˈdɛndroʊbətaɪdɪs/ bə-TRAY-koh-KIT-ree-ƏM-_), juga disebut Bd atau fungus sitrid amfibi, adalah spesies fungus yang mengakibatkan penyakit sitridiomikosis pada amfibi.
Satu dasawarsa setelah fungus ini ditemukan untuk pertama kalinya pada tahun 1998, penyakit sitridiomikosis mengakibatkan kematian banyak sekali amfibi di seluruh dunia dan bertanggung jawab atas kepunahan berbagai spesies. Spesies kedua yang baru saja ditemukan, B. salamandrivorans, juga menyebabkan sitridiomikosis dan kematian pada salamander.
Beberapa spesies amfibi tampaknya dampak bertahan dari infeksi sitridiomikosis berkat simbiosis dengan Janthinobacterium lividum. Bahkan pada spesies yang terkena dampak penyakit ini, masih ada yang mampu bertahan, kemungkinan berkat seleksi evolusioner.
Diduga B. dendrobatidis berasal dari Afrika dan kemudian menyebar ke wilayah lain lewat perdagangan katak-berkuku Afrika (Xenopus laevis). Kasus sitridiomikosis pertama ditemukan pada spesimen X. laevis dari tahun 1938. Selain itu, telah ditemukan bahwa B. dendrobatidis dapat bertahan dan tumbuh di tanah yang lembab dan di sayap burung, sehingga B. dendrobatidis mungkin juga disebarkan oleh burung dan pemindahan tanah.
Batrachochytrium è un genere di funghi della classe Chytridiomicetes.
Batrachochytrium dendrobatidis is een kleine gistachtige schimmel die amfibieën aantast. De schimmelinfectie die Batrachochytrium dendrobatidis veroorzaakt wordt chytridiomycose genoemd. De ziekte vormt wereldwijd een grote bedreiging voor vele soorten amfibieën. In de herpetologie is veel onderzoek gedaan naar de verspreiding van de Batrachochytrium dendrobatidis.
Batrachochytrium dendrobatidis gebruikt keratine als groeimedium, waarbij de bovenste huidlagen van volwassen exemplaren en de bek van kikkervisjes wordt aangetast. Besmetting vindt plaats via zoösporen in het water of door middel van direct contact. Chytridiomycose leidt met name tot focale hyperkeratose (plaatselijke verdikking van de huid) en erosie van de epidermis (beschadiging van de bovenste huidlaag) bij volwassen exemplaren en misvorming van de bek bij kikkervisjes. Een exemplaar met klinische chytridiomycose sterft binnen enkele weken, waarschijnlijk ten gevolge van een gestoorde ademhaling door de huid en een gestoorde osmoregulatie.
De schimmel veroorzaakt de ziekte door het verspreiden van een gifstof die immuunreacties van de amfibieën verstoort.[1]
De schimmel kwam van nature voor in Afrika en was tot de jaren veertig niet buiten het continent aangetroffen. Infectie met Batrachochytrium werd voor het eerst beschreven bij de Afrikaanse klauwkikker (Xenopus laevis). Onduidelijk is of de schimmel zich recent over de wereld heeft verspreid of dat Batrachochytrium van nature op verschillende continenten voorkomt maar recent in virulentie is toegenomen. Mogelijk is de klauwkikker een belangrijke vector geweest, aangezien deze soort sinds decennia wereldwijd wordt gebruikt voor laboratoriumonderzoek. In de jaren dertig en jaren veertig werden deze kikkers zelfs gebruikt in een zwangerschapstest. Ook de handel in andere exotische dieren zal de verspreiding van de schimmel hebben bevorderd. De epidemische vorm van chytridiomycose werd voor het eerst in de jaren negentig beschreven na een massale sterfte van kikkers in Australië, Costa Rica en het westen van Panama. Later is de ziekte ook op andere continenten aangetroffen. In Midden-Amerika breidde de ziekte zich in de loop der jaren uit over de rest van Panama naar Colombia. De ziekte is in staat vele soorten te infecteren en vormt zo een bedreiging voor zeer veel amfibieën wereldwijd.
Eind jaren tachtig werd in Costa Rica in de nevelwouden van Monteverde de eerste sterke achteruitgang van amfibieën waargenomen, waarbij de endemische gouden pad (Bufo periglenes) volledig verdween en ook andere soorten kikkers en padden niet meer in Monteverde werden waargenomen. Klimatologische factoren werden als voornaamste oorzaak beschouwd van deze achteruitgang. Er leek sprake van een verband tussen het afname van het aantal volwassen harlekijnkikkers (Atelopus varius) en het optreden van het El Niño-effect. Stoornissen in de temperaturen en de neerslag ten gevolge van het El Niño-effect werden als een belangrijke oorzaak gezien voor het verdwijnen van de amfibieën in deze periode. Eind jaren negentig kwam chytridiomycose als grote bedreiging, maar volgens een studie uit 2006 kan de ziekte niet los worden gezien van klimaatsverandering. "Ziekte is de kogel die de kikkers dood, maar klimaatsverandering is degene die de trekker overhaalt," aldus auteur J.A. Pounds, wetenschapper van het Monteverde Cloud Forest Preserve. Door de extreem dunne huid zijn amfibieën niet alleen erg gevoelig voor de schimmelinfectie, maar ook voor zelfs geringe veranderingen in temperatuur, luchtvochtigheid, lucht- en waterkwaliteit. Volgens de studie van Pounds hielden sterke temperatuurschommelingen voorheen de dodelijke schimmelinfectie binnen de perken in de nevelwouden. De mondiale klimaatproblematiek zou tot een toegenomen verdamping in de bergstreken van tropisch Amerika hebben geleid met een dichter wolkendek boven de nevelwouden als gevolg. Hierdoor zijn overdag de temperaturen in de nevelwouden door een toegenomen blokkade van zonlicht lager geworden, terwijl het wolkendek ’s nachts als een soort isolatie werkt met stijging van de nachtelijke temperaturen als gevolg. Deze afgezwakte temperatuurschommelingen zouden volgens de studie hebben geleid tot ideale omstandigheden voor de uitbreiding van Batrachochytrium dendrobatidis.[2]
Volgens een andere hypothese zou een dichter wolkendek boven de nevelwouden ook op een andere wijze invloed hebben op het optreden van chytridiomycose. Verschillende kikkers in de nevelwouden hebben het pigment pterorhodine in de huid wat ze in staat stelt hun huid aan te passen aan de infrarode reflectie van de bladeren rondom hen en zich zo te camoufleren. Pterorhodine lijkt ook een rol te spelen in de regulatie van de lichaamstemperatuur door middel van zonnebaden. Mogelijk zijn deze zonnebaden ook effectief tegen chytridiomycose, aangezien het een verhoging van de lichaamstemperatuur van de kikkers geeft boven het maximum waarbij Batrachochytrium dendrobatidis in leven kan blijven. Door een dichter wolkendek is er echter minder zonlicht beschikbaar, waardoor het eigen afweermechanisme van de kikkers minder goed mogelijk is.[3]
Het verband tussen klimaatsveranderingen en chytridiomycose is door latere studies ontkracht, waarbij geen ondersteunend bewijs werd gevonden dat klimaatsveranderingen uitbraken van de ziekte hebben uitgelokt.[4]
Bij sommige soorten, waaronder de Amerikaanse brulkikker (Rana catesbeiana) en de klauwkikker, verloopt de infectie asymptomatisch en verschillende Afrikaanse kikkers en padden lijken resistentie te hebben opgebouwd tegen Batrachochytrium. Laboratoriumonderzoek wijst er op dat Batrachochytrium dendrobatidis optimaal groeit en reproduceert bij temperaturen tussen de 17 °C en de 25 °C. De schimmel is weinig actief boven de 28 °C en blootstelling van een geïnfecteerde kikker aan hogere temperaturen doodt de schimmel. Dit lijkt een goede verklaring waarom door chytridiomycose-geïnduceerde afname van amfibieën vooral voorkomt in koelere gebieden, zoals de nevelwouden van de Midden-Amerikaanse bergketens. Individuele exemplaren zijn succesvol te behandelen door middel van het lokaal aanbrengen van chlooramfenicol of antimycotia als itraconozol. Daarnaast wordt gekeken naar behandelingen gebaseerd op de natuurlijke beschermingsmechanismen tegen infecties van amfibieën. Klieren in de huid van amfibieën zorgen bijvoorbeeld voor de uitscheiding van anti-microbiële peptiden, die bij sommige soorten beschermend lijkt tegen infecties als chytridiomycose. Dit lijkt mogelijk het geval bij de smaragdglaskikker (Centrolene prosoblepon), een soort die in staat blijkt te overleven in gebieden die door Batrachochytrium dendrobatidis geïnfecteerd zijn.[5] Ook wordt gekeken naar de specifieke huidflora van bepaalde kikkersoorten, met de gedachte dat bepaalde huidbacteriën een remmend effect hebben op Batrachochytrium dendrobatidis. Zo produceert Janthinobacterium lividum indole-3-carboxaldehyde en violaceïne, antifungale stoffen die de groei van Batrachochytrium dendrobatidis al in lagere concentraties remmen. Een vergelijkbaar effect heeft 2,4-diacetylphloroglucinol dat geproduceerd wordt door Lysobacter gummosus, een huidbacterie van de salamander Plethodon cinereus.[6]
Eén van de acties die nu wordt ondernomen om de bedreigde soorten amfibieën van uitsterven te behoeden is het opzetten van reservepopulaties in gevangenschap, een project dat wordt aangeduid met de term "Ampibian Ark" (AArk). Op termijn kunnen zo soorten weer worden uitgezet in gebieden die vrij zijn van chytridiomycose en andere bedreigingen. Een belangrijke rol bij het opzetten van reservepopulaties in het kader van de "Ampibian Ark" voor de amfibieën van Panama speelt El Valle Amphibian Conservation Center.
Bronnen, noten en/of referentiesBatrachochytrium dendrobatidis is een kleine gistachtige schimmel die amfibieën aantast. De schimmelinfectie die Batrachochytrium dendrobatidis veroorzaakt wordt chytridiomycose genoemd. De ziekte vormt wereldwijd een grote bedreiging voor vele soorten amfibieën. In de herpetologie is veel onderzoek gedaan naar de verspreiding van de Batrachochytrium dendrobatidis.
 Systematyka Domena eukarionty Królestwo grzyby Gromada skoczkowce Klasa skoczkowe Rząd Rhizophydiales Rodzina incertae sedis Rodzaj Batrachochytrium Gatunek Batrachochytrium dendrobatidis Nazwa systematyczna Batrachochytrium dendrobatidis Longcore, Pessier & D.K. Nichols
Systematyka Domena eukarionty Królestwo grzyby Gromada skoczkowce Klasa skoczkowe Rząd Rhizophydiales Rodzina incertae sedis Rodzaj Batrachochytrium Gatunek Batrachochytrium dendrobatidis Nazwa systematyczna Batrachochytrium dendrobatidis Longcore, Pessier & D.K. NicholsBatrachochytrium dendrobatidis Longcore, Pessier & D.K. Nichols − gatunek grzybów z rzędu Rhizophydiales[1].
Pozycja w klasyfikacji według Index Fungorum: Batrachochytrium, Incertae sedis, Rhizophydiales, Chytridiomycetidae, Chytridiomycetes, Incertae sedis, Chytridiomycota, Fungi[1].
Batrachochytrium dendrobatidis jest pasożytem płazów, u których wywołuje chytridiomikozę. Powoduje ona uszkodzenia w układzie oddechowym i nerwowym, wiele spośród zarażonych osobników doprowadzając do śmierci, co sprawia, że jest ważnym czynnikiem wpływającym na spadek liczebności płazów przynajmniej na niektórych obszarach[2]. Niektóre z zarażonych zwierząt mogą jednak żyć stosunkowo długo nie wykazując widocznych objawów choroby[3]. Grzyb jest wrażliwy na wysokie temperatury: może żyć i wzrastać w temperaturze 6–28 °C, w temperaturze 32 °C ginie w 96 godzin, a w temperaturze 37 °C – w cztery godziny[4].
Batrachochytrium dendrobatidis Longcore, Pessier & D.K. Nichols − gatunek grzybów z rzędu Rhizophydiales.
Batrachochytrium dendrobatidis é um fungo da divisão Chytridiomycota que ameaça a população mundial de anfíbios, causando-lhes uma enfermidade denominada quitridiomicose. Trata-se de um fungo dulçaquícola que ataca a pele dos anfíbios, a qual é imprescindível para a sua homeostase hídrica e gasosa, e também para a sua defesa imunológica. Embora estudos recentes apontam que a real causa da morte dos anfíbios contaminados é parada cardíaca.
Dado que a pandemia de quitridiomicose ocorre desde a década de 1980, tem se discutido o possível papel humano na difusão do fungo. Hoje se assume que a espécie Xenopus laevis, uma rã utilizada para efectuar testes e técnicas várias (obstetrícia e investigação), pode actuar como vector propagador do fungo por todo o mundo. O facto de poder actuar como vector resulta do facto de ser imune a esta infecção fungica.
Existem autores que opinam que o fungo sempre tem estado em contacto com as populações de anfíbios e que só agora que estas estão mais susceptíveis do ponto de vista imunológico por efeito do impacto humano nos ecossistemas, fazendo com que a infecção do fungo se torne mais patente.
Batrachochytrium dendrobatidis é um fungo da divisão Chytridiomycota que ameaça a população mundial de anfíbios, causando-lhes uma enfermidade denominada quitridiomicose. Trata-se de um fungo dulçaquícola que ataca a pele dos anfíbios, a qual é imprescindível para a sua homeostase hídrica e gasosa, e também para a sua defesa imunológica. Embora estudos recentes apontam que a real causa da morte dos anfíbios contaminados é parada cardíaca.
Dado que a pandemia de quitridiomicose ocorre desde a década de 1980, tem se discutido o possível papel humano na difusão do fungo. Hoje se assume que a espécie Xenopus laevis, uma rã utilizada para efectuar testes e técnicas várias (obstetrícia e investigação), pode actuar como vector propagador do fungo por todo o mundo. O facto de poder actuar como vector resulta do facto de ser imune a esta infecção fungica.
Existem autores que opinam que o fungo sempre tem estado em contacto com as populações de anfíbios e que só agora que estas estão mais susceptíveis do ponto de vista imunológico por efeito do impacto humano nos ecossistemas, fazendo com que a infecção do fungo se torne mais patente.
Batrachochytrium dendrobatidis är en svampart[1] som beskrevs av Longcore, Pessier & D.K. Nichols 1999. Batrachochytrium dendrobatidis ingår i släktet Batrachochytrium, ordningen Rhizophydiales, klassen Chytridiomycetes, divisionen pisksvampar och riket svampar.[2][3] Inga underarter finns listade i Catalogue of Life.[2]
Svampen orsakar sjukdomen chytridiomycos hos groddjur. När den infekterar djuret uppstår förändringar i huden som oftast leder till att djuret dör.
Batrachochytrium dendrobatidis tillhör divisionen pisksvampar (chytridiomycota) och är även känd som bd. Svampen är känd för att orsaka sjukdomen chytridiomycos hos amfibier[4]. När svampen infekterar amfibien orsakar den förändringar i huden vilket i de flesta fall leder till att amfibievärden avlider[5]. Sjukdomen har olika symptom beroende på vilket livsstadium av värden som drabbats. Hos grodyngel är symptomen relativt milda och yttrar sig som keratiniserade mundelar, medan amfibier som infekterats efter metamorfos har kraftiga symptom inklusive hyperplasi[6]. Det är fortfarande oklart exakt vad det är som gör att amfibierna avlider på grund av svampinfektionen[6] men det spekuleras i att hyperplasin kan påverka osmoregulationen och jonbalansen i amfibiernas hud[7], detta är särskilt viktigt för amfibierna då deras huvudsakliga vattenintag sker genom huden[8]. Chytridiomycosis började att framträda på 1970-talet[9] men beskrevs först 1988[7]. Via provtagning ifrån museimaterial har infektionen kunnat spårats till tidigt 1900-tal[10]. Svampen tros ha sitt ursprung i Afrika[11]. Vid tiden svampen upptäcktes hade den redan börjat spridas runt i världen och reducera populationer av amfibier och i nuläget finns den bland annat i Australien, Kanada, Kina och Brasilien[9] (fullständig karta). Namnet härstammar dels från svampens systematiska indelning (Batrachochytrium) och dels från grodan den hittades i (dendrobates). Den kan även kolonisera andra djur, exempelvis fåglar, men orsakar då inte lika stor skada[5].
Livscykeln är uppdelad i två olika stadier. Det första stadiet utgörs av ett sporangium. Det andra stadiet uppgörs av zoosporerna, dessa finns i sporangiet och frisätts därifrån. Zoosporerna har flageller och utgör det rörliga stadiet i livscykeln. Zoosporerna är kapabla till kemotaxi, det vill säga de har förmågan att känna av koncentrationer av ämnen i omgivningen och röra sig mot eller ifrån dessa[12] vilket kan förbättra sporernas överlevnadschanser genom att undvika skadliga substanser alternativt söka upp en passande omgivning. Ingen sexuell livscykel är observerad. Livscykeln uppskattas att bli komplett inom loppet av fyra till fem dagar[4]. Faktorer som pH och temperatur påverkar svampens tillväxt, och temperaturer över 28°C har resulterat i reducerad tillväxt och ökad mortalitet vilket kan ha betydelse för svampens förmåga att sprida sig[13].
Zoosporen är sfärisk eller oval (cirka 3-5µm i diameter) har ett centrum av ribosomer som är omgivna av ett endoplasmatiskt retikulum. I cytosolen hittas en enda golgiapparat. Zoosporen har en flagell placerad på den bakre delen av sporen, längden på flagellen är cirka 19-20µm[14].
Att överleva utanför värden är en viktig egenskap som underlättar spridning av patogener och spelar en viktig roll i hur pass bra en patogen kan spridas mellan värdar. Zoosporer från svampen har hittats på växter vilket tyder på att svampen potentiellt kan spridas vidare från infekterade individer genom till exempel vegetation som de infekterade individerna har berört. Hudrester ifrån infekterade individer har också visat sig innehålla svampen, detta innebär att svampen har potential att spridas likväl i vatten som på land, fast med varierande framgång[15]. Svampen har en låg artspecifitet och har rapporterats i hela 516 arter. Vissa arter av amfibier kan bära svampen utan att lida av mortalitet, dessa arter kan därmed agera naturlig reservoar för svampen. Det faktum att svampen orsakar lindrigare symptom i icke-metamorfoserade amfibier kan också bidra till att bibehålla en spridning av svampen inom en population genom att smitta sker från tidiga stadier till adulta amfibier. Svampens spridning har också varit kopplad till antropogena faktorer[16]. En sådan faktor tros vara handeln med grodan Xenopus laevis, som användes till graviditetstest, vilket har spekulerats kunna vara anledningen till att chytridiomycosis har spridits utanför Afrika[11]. Handel med den amerikanska oxgrodan tros också vara en anledning till att sjukdomen har spritt sig. Detta har troligtvis skett genom att grodor från en odling har flytt och bildat populationer i det vilda och kommit i kontakt med andra amfibier och på så sätt spridit vidare sjukdomen[17].
Batrachochytrium dendrobatidis är en svampart som beskrevs av Longcore, Pessier & D.K. Nichols 1999. Batrachochytrium dendrobatidis ingår i släktet Batrachochytrium, ordningen Rhizophydiales, klassen Chytridiomycetes, divisionen pisksvampar och riket svampar. Inga underarter finns listade i Catalogue of Life.
Svampen orsakar sjukdomen chytridiomycos hos groddjur. När den infekterar djuret uppstår förändringar i huden som oftast leder till att djuret dör.
Batrachochytrium dendrobatidis Longcore, Pessier & D.K.Nichols, 1999
Batrachochȳtrium dendrobatīdis (лат.) — патогенный гриб, от которого вымирают десятки и сотни видов земноводных во всём мире[1].
Считается, что в Центральной Америке этот гриб заставил исчезнуть около 40 % видов, и сейчас никакого противодействия ему нет: ни лягушки не могут выработать иммунитет, ни учёные — создать лекарство.[источник не указан 1695 дней]
Болезнь, вызванная грибом Batrachochytrium dendrobatidis, называется хитридиомикоз[2].
Учёные выяснили, что зловредный гриб переносится не только через заражённую воду, как считалось ранее, но и распространяется в виде спор по воздуху или на перьях птиц[3].
Официально учёные признали, что Batrachochytrium dendrobatidis уничтожает амфибий, в 1998 году. Образцы гриба были обнаружены на музейных экспонатах, датируемых тридцатыми годами XX столетия. Ранее гриб встречался только на земноводных, содержащихся в неволе, а на лягушках, живущих в дикой природе, Batrachochytrium dendrobatidis впервые нашли в 2005 году — на лягушках-волах, обитающих в двух небольших озёрах в Юго-Восточной Англии.
Сегодня смертельно опасный гриб довольно распространён у лягушек в Северной и Южной Америках, Австралии и Европе.
Batrachochȳtrium dendrobatīdis (лат.) — патогенный гриб, от которого вымирают десятки и сотни видов земноводных во всём мире.
Считается, что в Центральной Америке этот гриб заставил исчезнуть около 40 % видов, и сейчас никакого противодействия ему нет: ни лягушки не могут выработать иммунитет, ни учёные — создать лекарство.[источник не указан 1695 дней]
Болезнь, вызванная грибом Batrachochytrium dendrobatidis, называется хитридиомикоз.
Учёные выяснили, что зловредный гриб переносится не только через заражённую воду, как считалось ранее, но и распространяется в виде спор по воздуху или на перьях птиц.
Официально учёные признали, что Batrachochytrium dendrobatidis уничтожает амфибий, в 1998 году. Образцы гриба были обнаружены на музейных экспонатах, датируемых тридцатыми годами XX столетия. Ранее гриб встречался только на земноводных, содержащихся в неволе, а на лягушках, живущих в дикой природе, Batrachochytrium dendrobatidis впервые нашли в 2005 году — на лягушках-волах, обитающих в двух небольших озёрах в Юго-Восточной Англии.
Сегодня смертельно опасный гриб довольно распространён у лягушек в Северной и Южной Америках, Австралии и Европе.
蛙壺菌(学名:Batrachochytrium dendrobatidis)是一種壺菌門真菌,可以引起兩棲類的壺菌病。它們最初是於1998年發現[1],在其後的十年內,造成了大量兩棲類的死亡,引發多個物種滅絕,是為全新世滅絕事件之一。被國際自然保護聯盟物種存續委員會的入侵物種專家小組(ISSG)列入世界百大外來入侵種。
一些兩棲類物種具有天生的免疫能力。就算一些患上壺菌病的物種,也能夠生存下來,顯示出演化性選擇的痕跡或等位基因。不過另一個解釋卻指一些蛙壺菌的形態並非真正的病原體。
蛙壺菌是Batrachochytrium屬下的唯一物種。最初將它們分類在壺菌門下是基於孢子的超顯微結構,DNA分析也證實了這個觀點。
蛙壺菌可以在4-25℃的氣溫下生長,最適於17-25℃。[2]因此,它們可以在寄主的身上過冬。在25℃以上它們的生長較差,若高於28℃,生長就會停止。[2]受感染的紅眼雨濱蛙只要留在37℃的環境就可以痊癒。[3]
蛙壺菌感染兩棲類的角蛋白皮膚。它們在表皮上的葉狀體有假根網絡及孢子囊。每個孢子囊都有一條管放出孢子。
蛙壺菌的遊離孢子一般大3-5微米,呈長卵形,後端有一條19-20微米長的鞭毛,並藏有核糖體的鉸鏈區。一般會有一層球狀的膜包裹核糖體。在細胞體末端有一個細小的距,可能只是標本在甲醛固定時的加工品。核糖體的鉸鏈區由1個內質網的內胞漿網槽、2-3個粒線體及大型的微體所包圍。微體之間緊密排列,包圍著約4-6個脂質球,有一些脂質球似乎是被內胞漿網槽所包圍。一些遊離孢子會包含較多的脂質球。並沒有發現孢尾體。
在毛基體側有一個失效的細胞中心粒。9個互扣的支柱將毛基體固定在質膜上,在過渡帶上有終板。以橫向角度觀察過渡帶上的鞭毛小管,可以見到內部的環狀結構。毛基體並沒有根。大部份遊離孢子的核會有部份在核糖體群中,故偏向側面。在核糖體區以外的細胞質中,會有細小的液泡及高爾氏體。包含少量核糖體的粒線體會聚在盤狀的崤上。[4]
蛙壺菌有兩個主要的生命階段:無柄及繁殖的遊動孢子囊,和活動及有鞭毛的遊離孢子。遊離孢子只會在短時間內很活躍,能夠移動一段短距離。[5]不過,遊離孢子具有化學趨向性,會向兩棲類表面的分子(如糖、蛋白質及胺基酸)前往。[6]它們也含有多種蛋白水解酶及酯水解酵素,幫助消化兩棲類細胞,以兩棲類的皮膚作為養份供應來源。[7]當遊離孢子到達其寄主時,它們會在皮膚下層形成一個孢囊,進入繁殖階段,發展為遊動孢子囊。遊動孢子囊會生產更多的遊離孢子,不斷感染寄主的皮膚,或釋放到周邊的水生環境。[8]
蛙壺菌有時會出現與傳統遊離孢子或孢子囊不同的菌型。例如,在2003年歐洲熱浪,莱桑池蛙未被壺菌病大量殺死前,就有一種球狀、單細胞及只有80-120微米大的蛙壺菌。於當時並不知道它們是甚麼,到後來才確定是蛙壺菌。它們也是有包在囊中的遊離孢子,可以嵌入在休眠孢子中、腐生的或寄生的,並且在一些條件下非病原性的。[9]當熱浪開始時,蛙壺菌變成了現時會引起疾病的遊離孢子。由此可見,一些兩棲類群落身上雖有蛙壺菌存在,但卻沒有感染壺菌病,並非因為牠們具有免疫能力,而是其環境並沒有足夠條件讓蛙壺菌變型。
蛙壺菌在兩棲類的皮膚上生長,及製造水生的遊離孢子。[10]它們廣泛分佈在沙漠及低地森林至寒冷的山頂。它們可以是不致命的寄生蟲,或是腐生植物。它們會令棲於高地的兩棲類,或於冬天時造成大量的死亡率,在低溫下較易發病。[11]
有指蛙壺菌是源於非洲,後來經非洲爪蟾的貿易而廣傳世界各地。[12]研究涉及697個爪蟾屬標本,都是於1879年至1999年在南部非洲採集。最早出現壺菌病的是於1938年發現的非洲爪蟾。研究亦指在壺菌病在非洲以外的地方傳播前,早已在非洲內肆虐了23年的時間。[12]
由於美國牛蛙的低感染率,故也被指是帶菌者。[13][14]美國牛蛙經常從圈養中逃走,並能夠建立野生群落,可以將蛙壺菌帶到其他地方。[5]蛙壺菌可以生濕潤的土壤及鳥類羽毛中生存,這也可以其傳播途徑。[15]壺菌病感染與北美洲、南美洲、中美洲、歐洲及澳洲兩棲類的大量死亡有關。[16][17][18]它們也被指導致了澳洲的Taudactylus acutirostris的滅絕。[19]
一些兩棲類特別容易感染蛙壺菌,包括林蛙[20]、黃腿山蛙[21]、南方雙帶河溪螈[22]、杰斐遜鈍口螈[23]、三鋸擬蝗蛙、蟋蟀雨蛙、霍氏鋤足蛙、南方豹蛙[24]、里奧格蘭德豹蛙[25]及撒丁山螈。[26]
於2008年,兩個蛙壺菌的分離物基因組被DNA定序,科學家已積極將有關資料用在了解蛙壺菌在分子層面的生命周期及兩棲類的病原性。在9000個基因的研究中發現,多於55%在孢子囊及遊離孢子之間有不同的基因表現。[27]多種金屬蛋白酶的表現相信是引發病原性,並會造成皮膚上的感染。[28]
由於蛙壺菌造成兩棲類的嚴重衰落,科學家們都在研究如何抗衡。其中一項研究發現,那些能夠在感染壺菌病仍能生存下來的,傾向帶有大量的蘭黑紫色杆菌。[29]這些細菌會生產抗真菌的化合物,如吲哚-3-甲醛及紫色桿菌素,少量也足以阻礙蛙壺菌的生長。[30]另外,在紅背蠑螈身上發現的Lysobacter gummosus可以生產2,4-二乙酰基間苯三酚,也都能阻礙蛙壺菌的生長。[31]
以往一直有指殺蟲劑的使用也是導致兩棲類減少的原因[32][33][34]。於2007年,這個說法得到肯定。研究發現,當黃腿山蛙暴露在非致命的甲萘威濃度下,會較易感染壺菌病。甲萘威會使牠們皮膚上的縮氨酸防衛大幅削弱,破壞其免疫防禦,增加患病的風險。[35]
蛙壺菌(学名:Batrachochytrium dendrobatidis)是一種壺菌門真菌,可以引起兩棲類的壺菌病。它們最初是於1998年發現,在其後的十年內,造成了大量兩棲類的死亡,引發多個物種滅絕,是為全新世滅絕事件之一。被國際自然保護聯盟物種存續委員會的入侵物種專家小組(ISSG)列入世界百大外來入侵種。
一些兩棲類物種具有天生的免疫能力。就算一些患上壺菌病的物種,也能夠生存下來,顯示出演化性選擇的痕跡或等位基因。不過另一個解釋卻指一些蛙壺菌的形態並非真正的病原體。
항아리곰팡이(缸-----, Batrachochytrium dendrobatidis 바트라코키트리움 덴드로바티디스[*]) 또는 양서류호상균(兩棲類壺狀菌, amphibian chytrid fungus)은 양서류에게 치명적인 피부병인 키트리디오미코시스를 일으키는 호상균류 곰팡이로, 한반도에서 유래되었다.[1] 1998년에 처음 발견되었으며, 전세계적인 양서류 개체감소를 일으키며 많은 종을 멸종시켰다.
양서류의 전세계적인 개체 감소를 불러일으켰으나 그 원인에 대해서는 밝혀진 것이 없었다. 그러던 중 총유전체 방식을 이용하여 한반도에서 유래했음이 밝혀졌는데 20세기 초 무당개구리를 비롯한 한국 양서류의 상업적인 거래 과정에서 전세계적으로 확산된 것으로 보여진다.[1]
항아리곰팡이(缸-----, Batrachochytrium dendrobatidis 바트라코키트리움 덴드로바티디스[*]) 또는 양서류호상균(兩棲類壺狀菌, amphibian chytrid fungus)은 양서류에게 치명적인 피부병인 키트리디오미코시스를 일으키는 호상균류 곰팡이로, 한반도에서 유래되었다. 1998년에 처음 발견되었으며, 전세계적인 양서류 개체감소를 일으키며 많은 종을 멸종시켰다.
양서류의 전세계적인 개체 감소를 불러일으켰으나 그 원인에 대해서는 밝혀진 것이 없었다. 그러던 중 총유전체 방식을 이용하여 한반도에서 유래했음이 밝혀졌는데 20세기 초 무당개구리를 비롯한 한국 양서류의 상업적인 거래 과정에서 전세계적으로 확산된 것으로 보여진다.