en
names in breadcrumbs


Giant anteaters eat ants, termites, and soft-bodied grubs. Using the long, sharp claws on their forelimbs, they open insect colonies and tree trunks. They then use the tongue to collect the eggs, larvae, and adult insects. The salivary glands secrete sticky saliva during feeding that coats the tongue. They only stay at one ant colony for a short period of time because soldier ants arrive but giant anteaters can consume a few thousand insects in minutes. The tongue is attached to the sternum and moves very quickly, flicking 150 times per minute. They may sometimes eat fruit.
Animal Foods: insects
Plant Foods: fruit
Primary Diet: carnivore (Insectivore )
Most communication occurs between young and their mothers or during fighting. It consists of snorts, sniffs, and hisses, as well as roaring during fights. Sight and hearing are diminished. Smell is highly developed-40 times that of humans.
Communication Channels: tactile ; acoustic ; chemical
Perception Channels: visual ; tactile ; acoustic ; chemical
Habitat destruction is the primary threat to giant anteaters. They are listed as Appendix II by the Convention on International Trade in Endangered Species (CITES). Appendix II is defined as a species not necessarily threatened to extinction but one that should be controlled in trade to avoid overuse. They are listed as vulnerable by the International Union for Conservation of Nature and Natural Resources (IUCN). 'Vulnerable' is defined as an estimated population reduction of 20% in the next 10 years.
CITES: appendix ii
IUCN Red List of Threatened Species: vulnerable
Giant anteaters are increasingly killed in car accidents.
Giant anteaters are hunted for food, fur, and sport. They are also valuable for the criical ecosystem roles they play.
Positive Impacts: body parts are source of valuable material; controls pest population
Giant anteaters, through their diet, have an enormous impact on local insect communities.
Giant anteaters are found in Central and South America, from southern Belize and Guatemala to northern Argentina.
Biogeographic Regions: neotropical
Giant anteaters use a variety of habitats, including swamp, forests, and grasslands. They choose secluded, covered areas for sleeping. Giant anteaters can be found in both rural and densely populated areas.
Habitat Regions: tropical ; terrestrial
Terrestrial Biomes: savanna or grassland
Giant anteaters have been known to live up to 25 years and 10 months in captivity. Their longevity in the wild is unknown.
Range lifespan
Status: captivity: 25 (high) years.
Average lifespan
Status: captivity: 26.0 years.
Average lifespan
Status: captivity: 25.8 years.
Giant anteaters can use their immense front claws to defend themselves from predators, though their typical response to threat is to run away. Their size makes them invulnerable to all but the largest of predators, jaguars and pumas primarily. They are often killed by humans, either intentionally through hunting or unintentionally through collisions with cars.
Known Predators:
Giant anteaters are quite distinctive morphologically, they are the largest of the anteater species. The snout is long (up to 45 cm in length) and the skull is streamlined with small eyes and ears. The tail is large and bushy and is nearly as long as the body. Head and body length measures 1,000 to 1,200 mm and tail length 650 to 900 mm. Weight ranges from 18 to 39 kg. Giant anteaters have fur that is thick and coarse and longer towards the tail. Their coat is brown with black and white stripes on the shoulders and a crest of hair along the middle of the back. The forelegs are white with black bands at the toes. Their hindfeet have 5 short claws, while their forefeet have 5 claws with the inner 3 being very long and sharp. They walk on the wrists of their forefeet, with these large claws curled out of the way. Giant anteaters have no teeth. The tongue can be extended 610 mm outside of the mouth and has spine-like protrusions.
Range mass: 18 to 39 kg.
Range length: 1 to 1.2 m.
Other Physical Features: endothermic ; homoiothermic; bilateral symmetry
Sexual Dimorphism: sexes alike
Average basal metabolic rate: 14.543 W.
The mating system of M. tridactyla is not known. Reproductive behavior is primarily observed in captivity. The male stands over the female who lays on her side during copulation.
Gestation is approximately 190 days, after which females give birth to a single young which weighs about 1.3 kg. Females give birth standing up and immediately the young anteater climbs onto her back. Young are born with a full coat of hair and adult-like markings. Breeding occurs year-round in captivity and the wild, though seasonal breeding times have been reported in portions of their range. Inter-birth intervals can be as low as 9 months. Sexual maturity is reached between 2.5 and 4 years. The mammary glands are lateral to the 'armpits' on the chest.
Breeding interval: Giant anteaters can breed as often as every 9 months, though it is often longer.
Breeding season: Giant anteaters may breed year round, or seasonally depending on region.
Average number of offspring: 1.
Average gestation period: 190 days.
Average weaning age: 6 months.
Average time to independence: 24 months.
Range age at sexual or reproductive maturity (female): 2.5 to 4 years.
Range age at sexual or reproductive maturity (male): 2.5 to 4 years.
Key Reproductive Features: iteroparous ; seasonal breeding ; year-round breeding ; gonochoric/gonochoristic/dioecious (sexes separate); sexual ; viviparous
Average birth mass: 1600 g.
Average gestation period: 184 days.
Average number of offspring: 1.
Young are born with a full coat of hair and adult markings and are capable of clinging to their mother at birth. A mother will carry the baby on her back until it is almost half her size, about 6 to 9 months. Young suckle for 2 to 6 months. They become independent after about 2 years, or when the mother becomes pregnant again, which may be sooner.
Parental Investment: precocial ; female parental care
Cuerpo alargado. La forma del cuerpo no se parece a la de ningún otro animal. Trompa larga y delgada; cola larga y peluda lo que le da un perfil alargado. De color cafezusco con una distintiva V negra desde el pecho hasta la parte media de la espalda; las patas delanteras son de color crema con bandas negras sobre las muñecas. Tiene 4 garras en las patas delanteras, la tercera garra es más grande; tiene 5 garras en las patas traseras.
Distribucion General: América Central, posiblemente desde el sur de Belice hasta el este de Panamá; en América del Sur, al oeste de los Andes hasta Bolivia y el norte de Argentina. Se localiza sólo en las tierras bajas.
Es muy posible que esté ya extinta en el país.
Böyük qarışqayeyən (lat. Myrmecophaga tridactyla) - qarışqayeyən cinsinə aid heyvan növü.
Böyük qarışqayeyən cücüyeyənlər dəstəsinin ən böyük nümayəndəsi olub, bədəninin uzunluğu 110—130 sm-ə çatır. Cücüyeyənlər dəstəsinin nümayəndələrinin hamısında olduğu kimi, böyük qarışqayeyənin də xarici görünüşü qəribədir: boruya bənzər uzun dar çənəsi, kiçik dar gözləri, uzunluğu 95 sm, bəzən bir az uzun olan quyruğu var. İri fərdlərinin kütləsi 40 kq-a, bədəninin uzunluğu quyruğu ilə birlikdə 2,3 m-ə çatır.
Böyük qarışqayeyən (lat. Myrmecophaga tridactyla) - qarışqayeyən cinsinə aid heyvan növü.
Böyük qarışqayeyən cücüyeyənlər dəstəsinin ən böyük nümayəndəsi olub, bədəninin uzunluğu 110—130 sm-ə çatır. Cücüyeyənlər dəstəsinin nümayəndələrinin hamısında olduğu kimi, böyük qarışqayeyənin də xarici görünüşü qəribədir: boruya bənzər uzun dar çənəsi, kiçik dar gözləri, uzunluğu 95 sm, bəzən bir az uzun olan quyruğu var. İri fərdlərinin kütləsi 40 kq-a, bədəninin uzunluğu quyruğu ilə birlikdə 2,3 m-ə çatır.
Ar merienaer meur (Myrmecophaga tridactyla) a zo ur bronneg amprevanetaer hag a vev e Kreiz ha Suamerika.
Etre 1 ha 2 m eo hirder e gorf, gant ul lost war-dro 80 cm. Etre 20 ha 40 kg eo e bouez. Bihan eo e fas, e zaoulagad hag e zivskouarn. Stumm un duellenn zo gant e voj hir.
War-dro 25 km² eo e diriad. Kousket a ra war an douar, en un toull pe dindan brousgwez, e benn hag e gorf goloet gant e lost.
Distrujañ a ra ar c'hrugelloù merien pe merien-gwenn gant skilfoù e bavioù a-raok ha dastum e breizhoù gant e deod 60 cm. Goloet eo e deod gant drein bihan ha halv pegus.
Ar spesad nemetañ eo er genad Myrmecophaga.
a vo kavet e Wikimedia Commons.
Ar merienaer meur (Myrmecophaga tridactyla) a zo ur bronneg amprevanetaer hag a vev e Kreiz ha Suamerika.
L'ós formiguer, o simplement formiguer[1] (Myrmecophaga tridactyla), és un mamífer insectívor gros oriünd de Centreamèrica i Sud-amèrica. És una de les quatre espècies vivents de vermilingüe, grup que conforme l'ordre dels pilosos juntament amb els peresosos. A diferència dels altres vermilingües i els peresosos, que són arborícoles o semiarborícoles, l'ós formiguer passa gran part de temps a terra. Es tracta del representant més gros de la seva família, amb una llargada de 182–217 cm i un pes de 33–41 kg (mascles) o 27–39 kg (femelles). El musell llarg, la cua gruixuda, les urpes anteriors llargues i la coloració del pelatge són les seves característiques més distintives.
L'ós formiguer viu a diferents hàbitats, incloent-hi els herbassars i les selves pluvials. Busca aliment a zones obertes, però descansa en àrees poblades d'arbres. Menja principalment formigues i tèrmits que extrau del sòl amb les urpes davanteres i atrapa amb la seva llengua llarga i enganxifosa. Tot i que els seus territoris s'encavalquen, els óssos formiguers són animals solitaris excepte en el marc de la relació mare-cria, interaccions agressives entre mascles i l'aparellament. Les mares porten les cries a l'esquena fins al seu deslletament.
El formiguer gegant està allistat com a espècie vulnerable per la UICN. S'ha extingit localment en diversos llocs, incloent-hi gairebé tot Centreamèrica. Són amenaces a la seva supervivència, entre altres, la destrucció del seu hàbitat, el foc i la caça furtiva per a obtenir-ne la pell i la carn tot i que alguns formiguers habiten àrees protegides. A causa de la seva aparença i costums distintius, el formiguer forma part de diversos mites i folklore americans precolombins i també de la cultura moderna.
L'ós formiguer, o simplement formiguer (Myrmecophaga tridactyla), és un mamífer insectívor gros oriünd de Centreamèrica i Sud-amèrica. És una de les quatre espècies vivents de vermilingüe, grup que conforme l'ordre dels pilosos juntament amb els peresosos. A diferència dels altres vermilingües i els peresosos, que són arborícoles o semiarborícoles, l'ós formiguer passa gran part de temps a terra. Es tracta del representant més gros de la seva família, amb una llargada de 182–217 cm i un pes de 33–41 kg (mascles) o 27–39 kg (femelles). El musell llarg, la cua gruixuda, les urpes anteriors llargues i la coloració del pelatge són les seves característiques més distintives.
L'ós formiguer viu a diferents hàbitats, incloent-hi els herbassars i les selves pluvials. Busca aliment a zones obertes, però descansa en àrees poblades d'arbres. Menja principalment formigues i tèrmits que extrau del sòl amb les urpes davanteres i atrapa amb la seva llengua llarga i enganxifosa. Tot i que els seus territoris s'encavalquen, els óssos formiguers són animals solitaris excepte en el marc de la relació mare-cria, interaccions agressives entre mascles i l'aparellament. Les mares porten les cries a l'esquena fins al seu deslletament.
El formiguer gegant està allistat com a espècie vulnerable per la UICN. S'ha extingit localment en diversos llocs, incloent-hi gairebé tot Centreamèrica. Són amenaces a la seva supervivència, entre altres, la destrucció del seu hàbitat, el foc i la caça furtiva per a obtenir-ne la pell i la carn tot i que alguns formiguers habiten àrees protegides. A causa de la seva aparença i costums distintius, el formiguer forma part de diversos mites i folklore americans precolombins i també de la cultura moderna.
Mravenečník velký (Myrmecophaga tridactyla), zvaný též mravenečník tříprstý nebo hřivnatý, je největší druh mravenečníka a jediný zástupce rodu Myrmecophaga. Obývá většinou pastviny, listnaté a deštné lesy Střední a Jižní Ameriky.
Mravenečník velký je mohutné zvíře dorůstající 1,8 až 2 m na délku. Hmotnost se obecně pohybuje mezi 29 až 65 kg a ocas obvykle měří 64 až 90 cm.
Tento druh mravenečníka má velmi husté a drsné chlupy, které jsou nejdelší na ocase, kde dosahují až 40 cm. Nedospělí jedinci mají chlupy měkčí než dospělci a spolu s dospíváním jim tuhnou. Většinou bývají zbarveni šedě nebo hnědě, charakteristickým znakem je černá protáhlá skvrna, bílý ramenní pruh, masivní končetiny s třemi ostrými drápy, trubkovitý čenich a malý obličej s drobnýma očima a ušima.
Mravenečník velký má až 60 cm dlouhý a 12,5 mm široký jazyk, kterým velice rychle kmitá a za jednu minutu jej může zastrčit až 150×. Při lovu potravy jazyk pokrývá lepkavá slina, která zachycuje drobný hmyz. Stejně jako ostatní mravenečníci nemá ani mravenečník velký žádné zuby. Ty nahrazují výrůstky v ústech a ve svalnatém žaludku.
Ke hledání potravy používá mravenečník velký především svůj dobře vyvinutý čich. Zrak a sluch jsou poměrně špatně vyvinuté. Živí se drobným hmyzem, obzvlášť mravenci a termity, ke kterým se dostává pomocí svých ostrých drápů, kterými rozbíjí tvrdá termitiště, případně mraveniště. Občas sežerou i housenku nebo vejce. Často bývají v jejich žaludcích nalézány drobné kamínky, které v žaludku pomáhají ve trávení tím, že potravu rozemelou.
Většinu roku žije samotářským životem. V blízkosti lidských obydlí je aktivní převážně v noci, v odlehlejších oblastech spíše ve dne, přičemž často odpočívá ve stínu stromů nebo keřů, v opuštěných norách nebo dutinách. Při spánku si tělo přikrývá svým dlouhým a huňatým ocasem. Nápadná je i jeho chůze, při které došlapuje na své klouby prstů, aby se chránil před opotřebováním svých dlouhých drápů. I přesto, že tráví většinu času na souši, je velice schopný plavec.
Mravenečníci se mezi sebou dorozumívají prskáním, čenicháním, syčením nebo pachy, které jsou velice nápadné a cítitelné na několik metrů daleko.
O rozmnožování tohoto druhu existuje mnoho nejasností. Samec mravenečníka velkého se před pářením samici předvádí a čeká na samiččino svolení se s ní spářit. Samice se rozmnožuje zhruba jednou za 9 měsíců a po 190 dnech březosti rodí jediné mládě, které je po narození stejně barevně osrstěné jako dospělci a váží kolem 1,3 kg. Několik prvních týdnů přečkává na zádech matky, která jej tímto způsobem přenáší. Samice svého potomka odstavuje zhruba v 6 měsících života. Samci dosahují pohlavní dospělosti ve věku 2,5 až 4 let, samice zhruba v podobném stáří. Mravenečník velký se může dožít až dvaceti pěti let.
Pokud se cítí mravenečník ohrožený, chová se podobně jako medvěd: postaví se na zadní končetiny, přičemž mu ocas pomáhá na udržení rovnováhy a velice rychle začne sekat svými ostrými drápy, což může být pro jeho predátory, které tvoří kočkovité šelmy jako např. jaguár nebo puma velice nebezpečné a občas dochází i ke smrtelným zraněním. Většinou tedy tento obranný manévr uspěje.
Mravenečníky velké nejvíce ohrožuje hromadná ztráta lokalit, ale také lov. V současné době patří podle IUCN do kategorie zranitelných druhů.
V rámci Evropy je tento druh k vidění ve více než 70 zoo, nejvíce ve Spojeném království a Německu. V Česku chovají mravenečníky velké následující zoologické zahrady[2][3]:
Dříve byl tento druh také chován v Zoo Ústí nad Labem. Na Slovensku chován nikdy nebyl.[2]
První mravenečníci velcí se dostali do Zoo Praha v 50. letech 20. století. Druh byl k vidění až do roku 1982. Obnovení chovu přišlo po patnácti letech v roce 1997, kdy přišli dva jedinci. Ačkoliv se původně předpokládalo, že jde o samce se samicí, ukázalo se, že jde o dvě samice. Po jejich odchodu do ústecké zoo v roce 2002 nastala další pauza v chovu. K opětovnému obnovení došlo v létě 2014.[4] Samice Ella (narozena v lednu 2013[5]) dorazila z varšavské zoo, samec Hannibal (narozen v prosinci 2012[5]) z Madridu.[6] Na počátku roku 2016 – 20. ledna – se podařil velký úspěch, když se prvně v dějinách pražské zoo narodilo mládě mravenečníka velkého.[6] Jednalo se o samce, který dostal během křtin 25. března 2016 od zpěváka Miroslava Žbirky[7] jméno Lecter.[5] Šest hodin po porodu bylo mládě zváženo a změřeno: chovatelé naměřili váhu 1770 gramů a délku 62 cm.[5] Při křtu již měl 80 cm.[7]
Mravenečník velký je v pražské zoo chován ve spodní části areálu v upravených prostorách někdejší venkovní expozice hrochů při pavilonu velkých savců, dnes Rezervaci Bororo.
V tomto článku byl použit překlad textu z článku Giant Anteater na anglické Wikipedii.
Mravenečník velký (Myrmecophaga tridactyla), zvaný též mravenečník tříprstý nebo hřivnatý, je největší druh mravenečníka a jediný zástupce rodu Myrmecophaga. Obývá většinou pastviny, listnaté a deštné lesy Střední a Jižní Ameriky.
Stor myresluger er et sydamerikansk pattedyr fra ordenen Gumlere (Xenarthra) og familien Myreslugere (Myrmecophagidae). Den er almindeligt kendt for at spise myrer og termitter, og kan spise helt op til 30.000 myrer på én dag. Dyret lever i Syd- og Mellemamerika, det vejer mellem 25-50 kg og har en længde på 150-200 cm, plus hale (60-90 cm). Myreslugerne kan blive op til 20-25 år gamle. Myreslugeren kan leve både i skov, på græssletter og i vådområder. De har ingen faste territorier, men deres søgen efter egnet føde (30.000 termitter eller myrer dagligt) bringer dem langt omkring.
Myreslugeren er meget specialiseret i sin fødesøgning. Den har kraftige kløer til at rive termitboer fra hinanden med. Dens tunge er omkring 20 cm lang og specielt konstrueret til at fange myrer og termitter med.
Myreslugeren lever alene, kun ved parring og opfostring af unger ser man flere myreslugere sammen.
Stor myresluger er et sydamerikansk pattedyr fra ordenen Gumlere (Xenarthra) og familien Myreslugere (Myrmecophagidae). Den er almindeligt kendt for at spise myrer og termitter, og kan spise helt op til 30.000 myrer på én dag. Dyret lever i Syd- og Mellemamerika, det vejer mellem 25-50 kg og har en længde på 150-200 cm, plus hale (60-90 cm). Myreslugerne kan blive op til 20-25 år gamle. Myreslugeren kan leve både i skov, på græssletter og i vådområder. De har ingen faste territorier, men deres søgen efter egnet føde (30.000 termitter eller myrer dagligt) bringer dem langt omkring.
Myreslugeren er meget specialiseret i sin fødesøgning. Den har kraftige kløer til at rive termitboer fra hinanden med. Dens tunge er omkring 20 cm lang og specielt konstrueret til at fange myrer og termitter med.
Myreslugeren lever alene, kun ved parring og opfostring af unger ser man flere myreslugere sammen.
Der Große Ameisenbär (Myrmecophaga tridactyla) ist ein Säugetier aus der Ordnung der Zahnarmen. Gemeinsam mit den Tamanduas und den Zwergameisenbären bildet er die Unterordnung der Ameisenbären (Vermilingua). Er ist deren größter Vertreter und kommt in Süd- und Mittelamerika vor, sein ursprüngliches Verbreitungsgebiet war aber wesentlich größer. Hauptsächlich ist der Große Ameisenbär bodenbewohnend und einzelgängerisch, wobei er recht große Territorien unterhält. Die Hauptnahrung besteht aus Ameisen und Termiten. Weibliche Tiere bringen pro Wurf ein Jungtier zur Welt, das bis zu einem Jahr gesäugt wird. Der Lebensraum umfasst verschiedene Landschaftstypen von Gras- und Savannenländern bis Wäldern. Aufgrund von Landschaftszerstörung und Bejagung gilt der Bestand des Großen Ameisenbären als gefährdet.
Der Große Ameisenbär ist der weitaus größte Vertreter der Ameisenbären. Er erreicht eine Kopf-Rumpf-Länge von 100 bis 140 cm, der buschige Schwanz wird nochmals 60 bis 90 Zentimeter lang. Das Gewicht wildlebender Tiere beträgt 22 bis 39 kg,[1] es liegen allerdings auch Angaben bis 52 kg vor.[2] Männliche Tiere sind durchschnittlich etwas größer als weibliche. Auffälligstes Kennzeichen ist die lange, dünne und rund geformte Schnauze, die eine stark verlängerte, bis zu 60 cm messende und mit klebrigem Speichel bedeckte Zunge beherbergt, und zudem typisch für Ameisenbären zahnlos ist. Die Augen sind braun und sehr klein, ebenso die Ohren, die eine rundliche Gestalt aufweisen und 3,5 bis 6 cm lang werden, wobei sie nicht über den Kopf hinausragen. An der Basis des Nackens erhebt sich ein leichter Buckel, über den Halsrücken hinweg zieht sich eine Reihe borstiger, langer Haare, die eine Art Mähne bilden. Die Grundfärbung des langhaarigen Fells ist graubraun, an Brust und Schultern hat der Große Ameisenbär eine schwarze Zeichnung mit weißer streifenartiger Einrahmung. Die Vorderbeine sind weiß mit einem schwarzen Knöchelband, die Hinterbeine und der buschige Schwanz, der bis zu 30 cm lange Haare besitzt, weisen eine dunklere Tönung als der Körper auf. Die einzelnen Tiere besitzen eine jeweils charakteristische Fellzeichnung, die stärker bis schwächer ausgebildete Farbbänder oder deutliche beziehungsweise weniger markante Flecken einschließt, wodurch eine individuelle Unterscheidung möglich ist.[3] Die Vorderbeine sind äußerst kräftig ausgebildet, die Vorderfüße haben fünf Zehen, von denen die drei mittleren stark verlängert und mit großen, sichelförmig gestalteten, 10 bis 15 cm langen Krallen versehen sind (daher der Artzusatz tridactylus für „dreizehig“). Die Hinterbeine enden in fünf Zehen mit jeweils kurzen Krallen, die Hinterfußlänge beträgt 15 bis 18 cm. Weibchen besitzen ein Paar Zitzen im Brustbereich.[2][1][4]
Der Schädel wird insgesamt 21 cm lang und ist allgemein sehr schmal und langgestreckt, in Seitenansicht verläuft die Stirnlinie deutlich gewölbt. Markant ist das röhrenförmige Rostrum, welches sehr ausgedehnt ist und rund 65 % der gesamten Schädellänge einnimmt. Dadurch erreicht das Nasenbein in etwa die gleiche Länge wie das Stirnbein. Der Hirnschädel wiederum ist vergleichsweise breit. Des Weiteren zeigt sich der Jochbogen nur rudimentär entwickelt. Der Unterkiefer ist sehr niedrig, die beiden Hälften sind an der Symphyse nur lose miteinander verbunden. Der niedrige Unterkieferkörper und der reduzierte Jochbogen ermöglichen es dem Großen Ameisenbären, seitliche und rotierende Kaubewegungen auszuüben und zudem die Zunge zu kontrollieren, wenn diese ausgestreckt oder zurückgezogen wird. Zudem sind diese Bewegungen des Unterkiefers, die hauptsächlich durch den Musculus pterygoideus medialis und den Musculus temporalis hervorgerufen werden, eine Anpassung an die Ernährungsweise.[5] Typischerweise treten 16 Brust- und nur zwei Lendenwirbel auf. Die xenarthrischen Gelenke (Nebengelenke) treten meist an den drei bis vier hintersten Brust- und den beiden Lendenwirbeln auf. Dabei sind beim Großen Ameisenbären zwei zusätzliche Nebengelenke ausgebildet, was die Wirbelsäule im hinteren Bereich verstärkt und möglicherweise zum Halten des Gewichtes beim Aufrichten des Körpers während des Fressens oder der Verteidigung dient.[6] Die Rippen besitzen an ihren hinteren Enden starke Verbreiterungen. Zusätzlich weisen vier oder fünf der mittleren Rippen deutliche Verlängerungen auf.[2][1]
Der Sehsinn des Großen Ameisenbären ist nur rudimentär ausgebildet, der Geruchssinn dagegen sehr gut. Dieser wird vor allem bei der Nahrungssuche eingesetzt. Ein Tier ist generell leise, manchmal gibt es ein leises Grunzen von sich, vor allem wenn es gestört wird. Einen langanhaltenden harrrr-Laut äußern manche Tiere bei einem Angriff auf einen Artgenossen.[2]
Der Große Ameisenbär ist in Mittel- und Südamerika beheimatet, sein Verbreitungsgebiet erstreckt sich vom südlichen Belize und Guatemala bis ins nördliche Argentinien. Möglicherweise ist er aber schon aus seinen nördlichsten Lebensräumen verschwunden, neuere Hinweise gibt es jedoch aus Honduras.[7][8][9] Auch im südlichen Teil Mittelamerikas, so im zentralen Panama, ist er teilweise schon verschwunden. In Südamerika tritt die Art überwiegend östlich der Anden auf, nur in Kolumbien und möglicherweise in Ecuador bewohnt sie auch die Tiefländer westlich der Anden, die Daten für Ecuador müssen aber erst noch bestätigt werden. Auch im Süden des Ausbreitungsgebietes gab es bereits deutliche Habitatverluste. In historischer Zeit war der Große Ameisenbär bis weit südlich des 31. Breitengrades der Südhalbkugel anzutreffen. Im nördlichen Uruguay, dem östlichen Paraguay und dem südöstlichen Brasilien ist er bereits ausgestorben. Die südlichste Verbreitungsgrenze stellt heute der nördliche Teil Argentiniens dar, wo sich die Ameisenbärenart in den letzten Jahren auch weiter nach Norden zurückgezogen hat.[10] Das gesamte heutige Verbreitungsgebiet wird mit 12,5 Millionen Quadratkilometern angegeben, das tatsächlich bewohnte Gebiet ist aber unbekannt.[2][11][4]
Der Große Ameisenbär bewohnt zahlreiche unterschiedliche Landschaften und kommt in Sümpfen, tropischen Regenwäldern, Trockenwäldern und am häufigsten in Savannen vor. So bewohnt er die Gran-Chaco-Regionen ebenso wie das Pantanal, die Cerrado-Gebiete[12] und das Amazonasbecken. In Zentralamerika gibt es mehrere Sichtungen aus Hochlandgebieten. Voraussetzung für die Anwesenheit des Großen Ameisenbären ist ein genügend großes Vorkommen von Ameisen und Termiten.[2][11] Bei Untersuchungen im nordöstlichen Argentinien zeigte sich, dass die Tiere in Landschaften mit gemischten Vegetationstypen häufig dichte Wälder oder Grasländer mit hohem Bewuchs gegenüber kurzgrasigen Savannen bevorzugen. Dies könnte einerseits mit dem Dämmeffekt bei extremen Temperaturen, andererseits mit besseren Versteckmöglichkeiten bei potentiellen Gefahren zusammenhängen. Generell meiden sie aber intensiv genutzte Weideflächen.[13] Die Dichte der Populationen ist abhängig von der Beschaffenheit der Landschaften. So liegt sie im Pantanal bei 0,15 Individuen je Quadratkilometer. Deutlich höher ist sie in Wäldern mit 0,41 Individuen, eher gering im Llanos mit 0,18 und in Überflutungsebenen mit 0,12 Individuen auf der gleichen Fläche. Für den Emas-Nationalpark wird eine Populationsdichte von 0,2 Individuen je Quadratkilometer angegeben.[14][4]
Als einziges Mitglied seiner Familie ist der Große Ameisenbär ein reiner Bodenbewohner. Normalerweise ist er tagaktiv, dies variiert aber mit der Jahreszeit, so dass ein Tier an heißen Tagen überwiegend in den kühlen Morgen- und Abendstunden auf Nahrungssuche geht, an kühlen Tagen aber eher tagsüber.[15] Regional besteht teilweise eine Abhängigkeit von der Aktivität der Beutetiere, dadurch ist der Große Ameisenbär etwa in den Llanos-Gebieten Venezuelas häufiger nachts unterwegs. Generell verschiebt sich seine Aktivität in stark von Menschen bewohnten Gebieten zur Nacht hin. Zudem ist der Große Ameisenbär einzelgängerisch und territorial. Die Reviere sind in der Regel zwischen 5 und 25 km² groß, können aber im Extremfall bis zu 90 km² erreichen. Die Größe ist dabei abhängig von der Beschaffenheit des Habitats. So wurde im Pantanal eine Größe von 5,7 km² für männliche und bis zu 11,9 km² für weibliche Tiere festgestellt. Ob Weibchen generell größere Territorien besitzen, ist unklar, da im Emas-Nationalpark im Cerrado eine durchschnittliche Reviergröße von 9,8 km² für beide Geschlechter nachgewiesen wurde.[16] Die Grenzen der einzelnen Territorien können sich dabei überschneiden, allerdings halten die Tiere eher Abstand zueinander. Überschneidungen der Reviergrenzen finden sich häufiger bei Weibchen als bei Männchen.[2][17][1][4]
Die Reviere werden häufig markiert. Diese Markierungen erfolgen in der Regel an den Stämmen größerer Bäume durch Kratzen mit den langen Krallen der Vorderfüße. Dies dient gleichzeitig auch dem Schärfen der Krallen; da die Kratzspuren aber weit unterhalb der Verästelung des Stammes angebracht werden und deutlich sichtbar sind, dienen diese Experten zufolge auch zur visuellen Kommunikation. Eher selten markiert der Große Ameisenbär mit Urin.[18] Innerhalb des Reviers bewegt sich die Ameisenbärenart am Boden auf allen vieren fort, wobei die Krallen der Vorderfüße nach unten geklappt sind, so dass die Zehen stark gebeugt sind und das Gewicht von den Unterflächen der drei größeren Zehen getragen wird.[19] Meist läuft sie dabei eher langsam, kann aber auch in einen schnellen Sprint übergehen. Täglich legt ein Tier zwischen 1,3 und 11 km zurück, durchschnittlich sind es 3,7 km. Zudem ist der Große Ameisenbär ein guter Schwimmer, im Amazonasgebiet wurde ein Tier beim Überqueren eines 150 m breiten Flusses beobachtet, wobei es abwechselnd schwamm und über die herausragenden Felsen kletterte.[20] Gelegentlich wird ein Tier beim Besteigen eines bis zu 2 m hohen Termitenhügels beobachtet, Jungtiere vermögen auch bis zu 20 m hoch in Bäumen zu klettern.[21] Begegnungen zwischen zwei oder mehreren Tieren verlaufen häufig sehr aggressiv, vor allem unter Männchen. Die Kämpfe, die teils ritualisiert sind, aber auch sehr blutig ausgehen können, werden dabei mit den Vorderfußkrallen ausgeführt.[22][23] Sehr selten wurden bisher Zusammentreffen verschiedener Individuen ohne Konfrontation beobachtet, etwa von mehreren Mutter- mit Jungtieren bei der Nahrungsaufnahme.[24] Zur Ruhe zieht sich ein Tier in flache, überwiegend selbst angelegte Erdkuhlen in dichter Vegetation zurück, tiefere Erdbauten oder Höhlen gräbt der Große Ameisenbär trotz seiner kräftigen Krallen und seines körperlichen Vermögens nicht. Die Schlafposition ist dabei seitlich liegend mit der Schnauze vor den Vorderfüßen, wobei der dichte Schwanz den Körper bedeckt. Die Position des Schwanzes dient dabei einerseits dazu, nicht zu viel Körperwärme zu verlieren, andererseits aber auch der Tarnung.[25][17][1][4]
Der Große Ameisenbär ist ein spezialisierter Insektenfresser, seine Hauptnahrung besteht aus Ameisen und Termiten, von denen er täglich bis zu 35.000 Tiere frisst, die er mittels seines guten Geruchssinnes aufspürt. Mit seinen starken Krallen bricht er Nester der Insekten, darunter auch sehr feste Termitenbaue. Dabei benutzt er eine „Haken-Zug-Methode“, indem er die Krallen in kleine Öffnungen steckt und die Vorderbeine kräftig zurückzieht. Die Insekten leckt der Große Ameisenbär mit seiner langen, bis zu 40 cm aus dem Maul ragenden Zunge auf, die Beute bleibt aufgrund des schleimhautartigen Belages kleben. Allerdings kann der Große Ameisenbär nur kurze Zeit am jeweiligen Bau fressen, bevor die Termiten und Ameisen ihre Körpergifte gezielt und organisiert einsetzen, so dass die durchschnittliche Fressdauer rund 40 Sekunden beträgt, bevor er ein neues Nest sucht und später zurückkehrt, um die Kolonie erneut auszubeuten. Durch dieses Verhalten werden die einzelnen Nester nie vollständig ausgeräumt. Die röhrenförmig ausgebildete Schnauze begrenzt darüber hinaus das weitere Nahrungsspektrum, so dass die Ameisenbärenart stark von koloniebildenden Insekten abhängig ist. Dabei treten regional deutliche Unterschiede auf, wobei die Ernährung im Extrem laut Untersuchungen an Kotresten im brasilianischen Bundesstaat Amapá zu 100 % auf Termiten, im Bundesstaat Ceará aber zu 100 % auf Ameisen basiert.[26] Im Pantanal werden hauptsächlich Ameisen konsumiert, so unter anderem Vertreter der Gattung Solenopsis, die rund 46 % der Gesamtmenge ausmachen, zu geringeren Anteilen aber auch Camponotus (12 %), Labidus (2 %) und Odontomachus (2 %). Termiten dagegen sind nur mit zwei Gattungen vertreten: Nasutitermes und Armitermes.[27] Weitere Analysen in Argentinien zeigen, dass der Große Ameisenbär dort häufig Termiten der Gattungen Nasutitermes und Cornitermes sowie Ameisengattungen wie Camponotus, Iridomyrmex oder Solenopsis bevorzugt, wobei ihr jeweiliger Anteil in der Nahrungsmenge jahreszeitlich schwankt.[2] Allein für die Region des Gran Chaco sind Vertreter von insgesamt 14 Ameisengattungen im Nahrungsspektrum belegt, darunter auch einige, die bevorzugt Bäume bewohnen.[28] Darüber hinaus erbrachten Untersuchungen an 23 Kotproben aus dem südbrasilianischen Bundesstaat Paraná in den Jahren 2007 und 2008 in fast allen Fällen auch den Nachweis von Resten von Blattschneideameisen der Gattungen Atta und Acromyrmex. Der regelmäßige Verzehr dieser Ameisen war aufgrund ihrer Aggressivität nicht angenommen worden, zumal Tiere in Gefangenschaft meist dieses Nahrungsangebot mieden.[29] Zuvor war der Verzehr von Blattschneideameisen nur aus Kolumbien bekannt gewesen.[30] Daneben wurde aber auch beobachtet, wie der Große Ameisenbär Nester von Honigbienen plündert, unter anderem in einem 1,5 m hohen, verlassenen Termitenbau im Emas-Nationalpark.[31] Der Große Ameisenbär trinkt regelmäßig Wasser und gräbt in trockenen Jahreszeiten auch in kleinen Löchern danach.[2][17][1][4]
Die Fortpflanzung erfolgt ganzjährig, es gibt aber Hinweise auf einen enger begrenzten Zeitraum zwischen Mai und Juli. Es ist die einzige Phase, in der mehrere Tiere zusammenkommen. Der Sexualzyklus der Weibchen währt 47 bis 62 Tage und setzt etwa alle sieben Wochen ein.[32] Das Balzverhalten ist stark ritualisiert und umfasst gegenseitiges Umkreisen, das Zeigen der Krallen und Schläge mit den Vorderarmen, um den potentiellen Partner zu Boden zu bringen. Mitunter kann es auch zu Aggressionen kommen, vor allem wenn das Weibchen noch ein Jungtier von der vorhergehenden Geburt bei sich hat.[33][34] Nach etwa 183- bis 190-tägiger Tragzeit bringt das Muttertier ein einzelnes Junges zur Welt. In der Regel werden etwa doppelt so viele männliche wie weibliche Jungtiere geboren. Ein Neugeborenes wiegt 1,1 bis 1,6 kg, ist mit Schwanz etwa 53 cm lang und hat die Augen geschlossen; diese öffnen sich erst nach rund sechs Tagen. Häufig trägt das Muttertier das Junge, wenn es auf Nahrungssuche geht, was bis zu einem Alter von einem Jahr geschehen kann. Dabei liegt das Junge längs auf dem Rücken und ist so teils vom dichten Fell der Mutter verdeckt, andererseits verschmilzt seine Fellzeichnung mit der des Muttertieres. Am Boden ist das Jungtier in den ersten sechs Wochen nie weiter als einen Meter von der Mutter entfernt, der Abstand erhöht sich bis zum vierten Lebensmonat auf 20 Meter. In den ersten Monaten spielen Mutter und Junges häufig miteinander, was sich in Springen, Spielen mit Objekten oder den Krallen zeigt; auch gegenseitiges Lecken kommt häufig vor und kann bis zu eine Stunde andauern. Aufgrund der langen Schnauze saugt das Jungtier mit der Zunge, wobei es anfangs bis zu fast 20 % seiner aktiven Zeit mit der Aufnahme der Muttermilch verbringt. Ab dem dritten Lebensmonat nimmt es erstmals feste Nahrung zu sich, ab dem neunten Monat überwiegt dieser Nahrungsbestandteil. Die Mutter bringt bei der Nahrungsumstellung dem Nachwuchs bei, welche Nahrung verwertbar und welcher Geruchsspur zu folgen ist, was eines der wenigen Beispiele eines aktiven Anlernens innerhalb der Nebengelenktiere darstellt.[35] Die vollständige Entwöhnung erfolgt mit zehn bis zwölf Monaten, wobei der junge Ameisenbär dann rund 6,0 bis 6,5 kg wiegt und 105 cm lang ist. Die Geschlechtsreife erreichen die Tiere mit zwei bis vier Jahren. In menschlicher Obhut wurde ein Großer Ameisenbär knapp 26 Jahre alt, das dokumentierte Durchschnittsalter liegt jedoch bei etwa 16 Jahren. Die Lebenserwartung in freier Wildbahn ist nicht bekannt.[36][2][1][4]
Die größten Fressfeinde stellen Jaguar und Puma dar, allerdings wird der Große Ameisenbär nicht allzu häufig von diesen großen Katzen erbeutet. Untersuchungen im Gran Chaco an 106 Kotresten des Jaguars und 95 des Pumas ergaben lediglich zwei beziehungsweise drei Hinweise auf das Erlegen des Großen Ameisenbären. Während einer Beobachtung von 10 Jaguaren, je fünf männliche und weibliche Tiere, von Oktober 2001 bis April 2004 im südlichen Pantanal konnten insgesamt 14 erbeutete Große Ameisenbären festgestellt werden, was lediglich 3,2 % aller erlegten Tiere in diesem Zeitraum ausmachte.[37] Weiterhin ist die Ameisenbärenart dort seltener, wo häufiger Hunde vorkommen. Ein bedrohtes Tier richtet sich auf seinen Hinterbeinen auf und verteidigt sich durch Schläge mit den Krallen der Vorderfüße.[2] Prinzipiell ortet der Große Ameisenbär Beutegreifer über die Witterung, wobei er zwischen potentiellen Fressfeinden und sonstigen Raubtieren zu unterscheiden vermag.[38]
Zu den äußeren Parasiten zählen vor allem verschiedene Arten der Zeckengattung Amblyomma, auch Milben wie Otodectes oder Edentalges kommen vor, selten dagegen Flöhe.[39] Als innere Parasiten sind hauptsächlich Fadenwürmer bekannt, darunter Aspidodera, Brevigraphidium oder Physaloptera. Weiterhin wurden Bandwürmer nachgewiesen, unter anderem Mathevotaenia. Mit Eimeria konnten auch Kokzidien als Parasiten festgestellt werden.[2]
Myrmecophaga tridactyla
Der Große Ameisenbär ist die rezent einzige Art aus der monotypischen Gattung Myrmecophaga. Sie gehört wiederum zur Familie der Myrmecophagidae, denen auch die Tamanduas (Tamandua) zugerechnet werden, innerhalb der Unterordnung der Ameisenbären (Vermilingua). Neben den Myrmecophagidae werden nur die Cycopedidae mit den Zwergameisenbären (Cyclopes) als deren einziges heute lebendes Mitglied zu dem Vermilingua gestellt. Die Myrmecophagidae und die Cyclopedidae trennten sich nach molekulargenetischen Untersuchungen im Mittleren Eozän vor rund 38 Millionen Jahren. Die Aufspaltung der Myrmecophagidae in Tamandua und Myrmecophaga begann laut denselben Untersuchungen zu Beginn des Oberen Miozäns vor 13 Millionen Jahren.[41][40][42]
Fossil ist Myrmecophaga erstmals im Pliozän fassbar,[19] zu den ältesten Funden gehören jene von Monte Hermoso aus der argentinischen Provinz Buenos Aires. Der aufgefundene dritte Mittelhandknochen gehört der ausgestorbenen Art Myrmecophaga caroloameghinoi an, welche ursprünglich in die eigene Gattung Nunezia verwiesen worden war.[43] Weitere alte Funde kamen aus El Breal de Orocual im Nordosten Venezuelas zum Vorschein, welche in den Übergang vom Pliozän zum Unteren Pleistozän zu stellen sind.[44] Funde aus Sonora im Nordwesten Mexikos zeigen, dass die Ameisenbärenart im Unteren Pleistozän im Zuge des Großen Amerikanischen Faunenaustausches bis weit nach Norden vordrang und später durch klimatische Veränderungen wieder auf ihr heutiges Verbreitungsgebiet zurückgedrängt wurde. Die südlichsten Funde stammen aus Uruguay. Allgemein ist der Große Ameisenbär recht häufig fossil aus dem Pleistozän überliefert.[45]
Heute werden drei Unterarten vom Großen Ameisenbär unterschieden:[2]
Benannt wurde die Art Myrmecophaga tridactyla im Jahr 1758 von Linnaeus, welcher unter den gleichen Gattungsnamen weiterhin den Gemeinen Zwergameisenbären (Cyclopes didactylus) und den Südlichen Tamandua (Tamandua tetradactyla) einordnete und diese anhand der Anzahl der krallenbewehrten Vorderfußzehen unterschied. Als Typuslokalität für den Großen Ameisenbären gab Linnaeus ‘‘America Meridionali’’ an. Der Gattungsname Myrmecophaga setzt sich aus den griechischen Wörtern μύρμηξ (mýrmēx, Genitiv: μύρμηκος mýrmēkos „Ameise“) und φαγεῖν (phageín „fressen“) zusammen und bezieht sich auf die hauptsächliche Ernährungsweise der Tiere.[2]
Aufgrund seiner Größe ist der Große Ameisenbär ein häufiges Jagdziel, und sein Fleisch wird teilweise als Nahrungsressource genutzt. Allerdings ist diese Tradition unter indigenen Völkern sehr unterschiedlich. Laut einer Untersuchung erlegte die damals rund 800 Personen umfassende Volksgruppe der Waimiri Atroari im zentralen Amazonastiefland innerhalb eines Jahres (1993–1994) insgesamt drei Große Ameisenbären. Das Gesamtgewicht umfasste 90 Kilogramm, was rund 0,2 Prozent der gesamten über das Jahr erlegten Biomasse der Waimiri Atroari ausmachte.[46] Die Chamacoco aus Paraguay wiederum verzehren aus religiösen Gründen kein Fleisch des Großen Ameisenbären, während die Bewohner Nicaraguas das Fleisch aufgrund des Geschmacks meiden. Manchmal wird jedoch ein Großer Ameisenbär auch von Jägern oder deren Hunden getötet.[47] In der Regel meiden die Tiere Begegnungen mit Menschen, was aufgrund des schlechten Sehsinns und Gehörs aber nicht immer möglich ist. Ein bedrängtes Tier verteidigt sich mit seinen langen, scharfen Krallen, was in Einzelfällen auch für Menschen tödlich endete.[48] Der illegale Wildtierhandel und die Haltung als Haustier stellen weitere anthropogene Bedrohungen dar.[49]
Häufig ist die Ameisenbärenart allerdings Opfer von Verkehrsunfällen, vor allem in Offenland, da die Augen in der Nacht keinen Widerschein geben. Bedeutend ist auch der Einfluss von Feuer, das vor allem in Grasländern die einzelnen Populationen deutlich variieren lässt. Hauptfaktor für den Rückgang des Bestands ist aber die Zerstörung der Landschaften durch die Ausbreitung menschlicher Siedlungen und landwirtschaftlich genutzter Flächen, was vor allem für die mittelamerikanischen Populationen eine große Bedrohung ist.
Experten gehen für den Gesamtbestand von einem Rückgang von rund 30 Prozent seit 1996 aus. Die IUCN listet den Großen Ameisenbären als „gefährdet“ (vulnerable), regional bestehen aber noch höhere Warnstufen.[49] Die Tiere kommen in zahlreichen geschützten Gebieten vor, so unter anderem im Emas-Nationalpark, im Serra-da-Canastra-Nationalpark und im Iguaçu-Nationalpark in Brasilien, im letzteren konnte die Art erst 2014 nachgewiesen werden.[50] Im selben Zeitraum wurde der Große Ameisenbär mittels Kamerafallen im Baritú-Nationalpark im nördlichen Argentinien belegt.[51] Zudem gibt es ein internationales Zuchtprogramm in zoologischen Einrichtungen. Der Zoo Dortmund, wo über 50 Geburten verzeichnet werden konnten, führt das internationale Zuchtbuch.[52] Im Iberá Nature Reserve im Nordosten Argentiniens wurden zwischen 2007 and 2012 im Rahmen eines Wiederansiedlungsprojekts insgesamt 18 Große Ameisenbären frei gelassen und in ihrer Habitatwahl überwacht.[13]
Zu den weiteren Schutzmaßnahmen gehören auch Untersuchungen zur Einflussnahme von Wald- und Buschbränden auf die Bestandsentwicklung des Großen Ameisenbären und die Erarbeitung wirksamer Maßnahmen zum Brandschutz und zur Kontrolle natürlicher oder vom Menschen verursachter Buschbrände.[2][11]
Der Große Ameisenbär (Myrmecophaga tridactyla) ist ein Säugetier aus der Ordnung der Zahnarmen. Gemeinsam mit den Tamanduas und den Zwergameisenbären bildet er die Unterordnung der Ameisenbären (Vermilingua). Er ist deren größter Vertreter und kommt in Süd- und Mittelamerika vor, sein ursprüngliches Verbreitungsgebiet war aber wesentlich größer. Hauptsächlich ist der Große Ameisenbär bodenbewohnend und einzelgängerisch, wobei er recht große Territorien unterhält. Die Hauptnahrung besteht aus Ameisen und Termiten. Weibliche Tiere bringen pro Wurf ein Jungtier zur Welt, das bis zu einem Jahr gesäugt wird. Der Lebensraum umfasst verschiedene Landschaftstypen von Gras- und Savannenländern bis Wäldern. Aufgrund von Landschaftszerstörung und Bejagung gilt der Bestand des Großen Ameisenbären als gefährdet.
Jurumi (karaiñe'ẽ: Oso hormiguero) mymba tuicha okambúva, oikoveva Ñembyamérikape ha Mbyteamérikape, ha okarúva tahýi. Hete tuichakue ha'e 100 gotyo 120 cm pukukue rupi ha huguái ha'e 60 gotyo 90 cm; ipohýi ha'e 25 gotyo 39 kg.[1] Itĩ mbukueteva ha koraicha. Ikũ oguereko 60 cm. pukukue rupi, ha ndoreko tãi.
Oguata porã y rupi, ikatu ohasa peteĩ ysyry guasu.[2]
Jurumi (karaiñe'ẽ: Oso hormiguero) mymba tuicha okambúva, oikoveva Ñembyamérikape ha Mbyteamérikape, ha okarúva tahýi. Hete tuichakue ha'e 100 gotyo 120 cm pukukue rupi ha huguái ha'e 60 gotyo 90 cm; ipohýi ha'e 25 gotyo 39 kg. Itĩ mbukueteva ha koraicha. Ikũ oguereko 60 cm. pukukue rupi, ha ndoreko tãi.
Oguata porã y rupi, ikatu ohasa peteĩ ysyry guasu.
Kuchipillan[2][3][4] (Myrmecophaga tridactyla) nisqaqa Awya Yalapi kawsaq sisi mikhuq ñuñuqmi. Lliw pillan (sisimikhuq: Myrmecophagidae) nisqakunamanta aswan hatunmi, 130 sintimitrukama sunim, chupanqa 65-manta 90-kama sintimitru sunim, 25-manta 60-kama kilugramu llasaqmi.
Kuchipillan (Myrmecophaga tridactyla) nisqaqa Awya Yalapi kawsaq sisi mikhuq ñuñuqmi. Lliw pillan (sisimikhuq: Myrmecophagidae) nisqakunamanta aswan hatunmi, 130 sintimitrukama sunim, chupanqa 65-manta 90-kama sintimitru sunim, 25-manta 60-kama kilugramu llasaqmi.
Mlasisimizi mkubwa (Myrmecophaga tridactyla) ni spishi kubwa kushinda walasisimizi wote. Spishi hii ni pekee katika jenasi Myrmecophaga.
Walasisimizi hutumia ulimi wao mrefu na wa kunata ili kukamata sisimizi na mchwa katika kichuguu cha wadudu hawa.
Veliki mravojed (latinski: Myrmecophaga tridactyla) je najveći od četiri vrste mravojeda i jedini je pripadnik roda Myrmecophaga. Živi na području Centralne i Južne Amerike.
Žive individualno, a mogu se naći na raznovrsnim područjima uključujući livade, šume i kišne šume. Hrane se mravima i termitima.
Veliki mravojedi mogu porasti i do 1,5 m, a težina varira između 29 i 65 kg. Prekriveni su oštrim dlakama koje na repu mogu doseći dužinu i do 40 cm. Mladunčad posjeduje mekano krzno do spolnog sazrijevanja. Dominantna boja krzna je siva do smeđa, ali svi posjeduju dijagonalnu bijelu liniju na ramenima.
Jezik velikog mravojeda može doseći dužinu do 60 cm, a širok je u prosjeku 12,5 mm. Jezik je prekriven ljepljivom pljuvačkom na koju se lijepe mravi. Prilikom hvatanja mrava, veliki mravojed uvlači i izvlači jezik i do 150 puta u minuti.
Posjeduju prosječnu tjelesnu temperaturu od 32,7 °C što je jedna od najnižih temperatura kod svih živućih sisara.[1]
Veliki mravojed (latinski: Myrmecophaga tridactyla) je najveći od četiri vrste mravojeda i jedini je pripadnik roda Myrmecophaga. Živi na području Centralne i Južne Amerike.
Žive individualno, a mogu se naći na raznovrsnim područjima uključujući livade, šume i kišne šume. Hrane se mravima i termitima.
Wiôldżi marwëjôdôcz (Myrmecophaga tridactyla) - to je ôrt suska z rodzëznë marwëjôdôczowatëch (Myrmecophagidae). Wiele jich żëje w Pôłniowi Americe, a jedzą np. mrówczi.
विशाल चींटीखोर (Myrmecophaga tridactyla), जिसे चींटी भालू भी जाना जाता हैं, एक विशाल कीटभक्षी स्तनधारी हैं, जो मध्य और दक्षिण अमेरिका का मूल निवासी हैं। यह चींटीखोरों की चार जीवित प्रजातियों में से एक है और पिलोसा प्रकार में स्लोथ के साथ वर्गीकृत किया गया हैं।[3] अन्य जीवित चींटीखोरों और स्लोथ के विपरीत जो वानस्पतिक या अर्ध-वानस्पतिक होते हैं, यह प्रजाति ज्यादातर स्थलीय हैं।[4] अपने परिवार का सबसे बड़ा सदस्य, विशाल चींटीखोर की लम्बाई तथा नर और मादा का वज़न क्रमशः और होता हैं। यह अपनी लम्बी थूथन, जंगली पूँछ, लंबे सामने के पंजे, और विशिष्ट रंग के ऊर्णाजिन से पहचानने योग्य हैं।
विशाल चींटीखोर (Myrmecophaga tridactyla), जिसे चींटी भालू भी जाना जाता हैं, एक विशाल कीटभक्षी स्तनधारी हैं, जो मध्य और दक्षिण अमेरिका का मूल निवासी हैं। यह चींटीखोरों की चार जीवित प्रजातियों में से एक है और पिलोसा प्रकार में स्लोथ के साथ वर्गीकृत किया गया हैं। अन्य जीवित चींटीखोरों और स्लोथ के विपरीत जो वानस्पतिक या अर्ध-वानस्पतिक होते हैं, यह प्रजाति ज्यादातर स्थलीय हैं। अपने परिवार का सबसे बड़ा सदस्य, विशाल चींटीखोर की लम्बाई तथा नर और मादा का वज़न क्रमशः और होता हैं। यह अपनी लम्बी थूथन, जंगली पूँछ, लंबे सामने के पंजे, और विशिष्ट रंग के ऊर्णाजिन से पहचानने योग्य हैं।
The giant anteater (Myrmecophaga tridactyla) is an insectivorous mammal native to Central and South America. It is one of four living species of anteaters, of which it is the largest member. The only extant member of the genus Myrmecophaga, it is classified with sloths in the order Pilosa. This species is mostly terrestrial, in contrast to other living anteaters and sloths, which are arboreal or semiarboreal. The giant anteater is 182 to 217 cm (5 ft 11+1⁄2 in to 7 ft 1+1⁄2 in) in length, with weights of 33 to 50 kg (73 to 110 lb) for males and 27 to 47 kg (60 to 104 lb) for females. It is recognizable by its elongated snout, bushy tail, long fore claws, and distinctively colored pelage.
The giant anteater is found in multiple habitats, including grassland and rainforest. It forages in open areas and rests in more forested habitats. It feeds primarily on ants and termites, using its fore claws to dig them up and its long, sticky tongue to collect them. Though giant anteaters live in overlapping home ranges, they are mostly solitary except during mother-offspring relationships, aggressive interactions between males, and when mating. Mother anteaters carry their offspring on their backs until weaning them.
The giant anteater is listed as vulnerable by the International Union for Conservation of Nature. It has been extirpated from many parts of its former range. Threats to its survival include habitat destruction, fire, and poaching for fur and bushmeat, although some anteaters inhabit protected areas. With its distinctive appearance and habits, the anteater has been featured in pre-Columbian myths and folktales, as well as modern popular culture.
The giant anteater got its binomial name from Carl Linnaeus in 1758. Its generic name, Myrmecophaga, and specific name, tridactyla, are both Greek, meaning "anteater" and "three fingers", respectively.[6] Myrmecophaga jubata was used as a synonym. Three subspecies have been tentatively proposed: M. t. tridactyla (ranging from Venezuela and the Guianas to northern Argentina), M. t. centralis (native to Central America, northwestern Colombia, and northern Ecuador), and M. t. artata (native to northeastern Colombia and northwestern Venezuela). The giant anteater is grouped with the semiarboreal northern and southern tamanduas in the family Myrmecophagidae. Together with the family Cyclopedidae, whose only extant member is the arboreal silky anteater, the two families comprise the suborder Vermilingua.[7]
Sloths AnteatersMyrmecophaga
Armadillos Phylogenetic tree of the living Xenarthra.[8]Anteaters and sloths belong to order Pilosa and share superorder Xenarthra with the Cingulata (whose only extant members are armadillos). The two orders of Xenarthra split 66 million years ago (Mya) during the Late Cretaceous epoch. Anteaters and sloths diverged around 55 Mya, between the Paleocene and Eocene epochs. The Cyclopes lineage emerged around 30 Mya in the Oligocene epoch, while the Myrmecophaga and Tamandua lineages split 10 Mya in the Late Miocene subepoch.[8] During most of the Cenozoic era, anteaters were confined to South America, which was formerly an island continent. Following the formation of the Isthmus of Panama about 3 Mya, anteaters of all three extant genera invaded Central America as part of the Great American Interchange.[9]
The fossil record for anteaters is generally sparse.[10] Known fossils include the Pliocene genus Palaeomyrmidon, a close relative to the silky anteater, Protamandua, the sister taxon to the clade that includes the giant anteater and the tamanduas from the Miocene, and Neotamandua, a sister taxon to Myrmecophaga.[11] Protamandua was larger than the silky anteater, but smaller than a tamandua, while Neotamandua was larger, falling somewhere between a tamandua and a giant anteater. Protamandua did not appear to have feet specialized for terrestrial or arboreal locomotion, but it may have had a prehensile tail. Neotamandua, though, is unlikely to have had a prehensile tail and its feet were intermediate in form between those of the tamanduas and the giant anteater.[10] The species Neotamandua borealis was suggested to be an ancestor of the latter.[12] Another member of the genus Myrmecophaga has been recovered from the Montehermosan Monte Hermoso Formation in Argentina and was described by Kraglievitch in 1934 as Nunezia caroloameghinoi.[13] The species was reclassified as Myrmecophaga caroloameghinoi by S. E. Hirschfeld in 1976.[14]
The giant anteater is the most terrestrial of the living anteater species. Its ancestors may originally have been adapted to arboreal life;[11] the transition to life on the ground could have been aided by the expansion of open habitats such as savanna in South America and the availability there of colonial insects, such as termites, that provided a larger potential food source. Both the giant anteater and the southern tamandua are well represented in the fossil record of the late Pleistocene and early Holocene.[10]
The giant anteater can be identified by its large size, elongated muzzle, and long bushy tail.[15] It has a total body length of 182 to 217 cm (5 ft 11+1⁄2 in to 7 ft 1+1⁄2 in). Males weigh 33 to 50 kg (73 to 110 lb) and females weigh 27 to 47 kg (60 to 104 lb),[6][16][17] making the giant anteater the biggest extant species in its suborder. The head of the giant anteater, at 30 cm (12 in) long,[18] is particularly elongated, even when compared to other anteaters.[19] Its tubular snout, which ends in its tiny mouth opening and nostrils, takes up most of its head. Its eyes and ears are relatively small.[6] It has poor eyesight,[15] but its sense of smell is 40 times more sensitive than that of humans.[20]
Even for an anteater, the neck is especially thick compared to the back of the head,[19] and a small hump is found at the back of the neck. The coat is mostly greyish, brown or black and salted with white. The forelimbs are white, with black bands around the wrists, while the hindlimbs are dark. Thick black bands with white outlines stretch from throat to shoulder, ending in triangular points. The body ends in a brown tail. The coat hairs are long, especially on the tail, which makes the tail look larger than it actually is. A stiff mane stretches along the back.[6][21] The bold pattern was thought to be disruptive camouflage, but a 2009 study suggests it is warning coloration.[22] While adult males are slightly larger and more muscular than females, with wider heads and necks, visual sex determination can be difficult. The penis and testes are located internally between the rectum and urinary bladder in males, and females have a single pair of mammary glands near the armpits.[23]
The giant anteater has broad ribs. Despite its specific name, tridactyla, meaning three fingers, it has five toes on each foot. Four toes on the front feet have claws, which are particularly elongated on the second and third digits.[23] It walks on its front knuckles similar to gorillas and chimpanzees. Doing this allows the giant anteater to keep its claws out of the way while walking. The middle digits, which support most of its weight, are extended at the metacarpophalangeal joints and bent at the interphalangeal joints.[24] Unlike the front feet, the hind feet have short claws on all five toes and walk plantigrade.[6] As a "hook-and-pull" digger, the giant anteater's enlarged supraspinous fossa gives the teres major more leverage—increasing the front limbs' pulling power—and the triceps muscle helps power the flexion of the thickened third digit of the front feet.[25]
The giant anteater has a low body temperature for a mammal, about 33 °C (91 °F), a few degrees lower than a typical mammalian temperature of 36 to 38 °C (97 to 100 °F).[20] Xenarthrans in general tend to have lower metabolic rates than most other mammals, a trend thought to correlate with their dietary specializations and low mobility.[26]
The giant anteater has no teeth and is capable of only very limited jaw movement. It relies on the rotation of the two halves of its lower jaw, held together by a ligament at the tip,[19] to open and close its mouth. This is accomplished by its chewing muscles,[27] which are relatively underdeveloped.[19] Jaw depression creates an oral opening large enough for the slender tongue to flick out. It is typically 60 cm (24 in)[6] long and is triangular posteriorly, rounded anteriorly, and ends in a small, rounded tip.[19][28] The tongue is covered in backward-curving papillae and coated in thick, sticky saliva secreted from its enlarged salivary glands.[18]
The tube-like rostrum and small mouth opening restrict the tongue to protrusion-retraction movements. During feeding, the animal relies on the orientation of its head for aim. The tongue can reach up to 45 cm (18 in), longer than the length of the skull, and move in and out around 160 times per minute (nearly three times per second).[19] The anteater's tongue has little to no attachments to the hyoid and this is what allows it to flick its tongue at such distances and speed.[29][30][21] The long sternoglossus muscle, which is formed by the fusion of the sternohyoid and the hyoglossus, is directly anchored to the sternum.[19][28][31] The hyoid apparatus is large, V-shaped and flexible and supports the tongue as it goes in and out of the mouth.[19][28][32] The buccinators allow it to slide back in without losing attached food and tighten the mouth to prevent food from escaping as it extends. When retracted, the tongue is held in the oropharynx by the secondary palate, preventing it from blocking respiration.[19]
Giant anteaters swallow at a much higher rate than most other mammals; when feeding, they swallow almost continuously.[19] Before being swallowed, insects are crushed against the palate.[18] The giant anteater's stomach, similar to a bird's gizzard, has hardened folds and uses strong contractions to grind up the insects. The digestive process is assisted by small amounts of ingested sand and soil.[23] The giant anteater cannot produce stomach acid of its own, but uses the formic acid of its prey for digestion.[18]

The giant anteater is native to Central and South America. Its known range stretches from Honduras to the Gran Chaco region,[2] and fossil remains have been found as far north as northwestern Sonora, Mexico.[9] It is largely absent from the Andes[6] and has been fully extirpated in Uruguay, Belize, El Salvador, and Guatemala, as well as in parts of Costa Rica, Brazil, Argentina, and Paraguay.[2] The species is found in a number of habitats including both tropical rainforest and xeric shrubland,[15] provided enough prey is present to sustain it.[33]
The species is listed as vulnerable by the International Union for Conservation of Nature, due to the number of regional extirpations,[2] and under Appendix II by CITES, tightly restricting international trade in specimens of the animal and its parts and derivatives.[3] Between 2000 and 2010, the total population declined by 30%.[2] In 1994, some 340 giant anteaters died due to wildfires at Emas National Park in Brazil.[34] The animal is particularly vulnerable to fires due to its slow movement and flammable coat.[6]
Human-induced threats include collision with vehicles, attacks by dogs, and destruction of habitat.[33] One study of anteater mortality along roads found that they are likely to become roadkill on straight roads with native vegetation along the side.[35] A 2018 study in Brazil found that: (1) fragmentation of habitat could be more detrimental than road mortality, (2) 18–21% of suitable anteater habitat was below minimum patch size, (3) 0.1–1% of its distribution was maximum road density, (4) 32–36% of the anteater's range represented critical areas for its survival and (5) more conservation opportunities existed in the north of the country.[36] A 2020 study in the Brazilian Cerrado found that road morality can decrease the local population growth by half.[37]
The giant anteater is commonly hunted in Bolivia, both for sport and sustenance. The animal's thick, leathery hide is used to make equestrian equipment in the Chaco. In Venezuela, it is hunted for its claws.[33] Giant anteaters are killed for safety reasons, due to their reputation as dangerous animals. The giant anteater remains widespread. Some populations are stable and the animal is found in various protected areas in the Amazon, Pantanal and the Cerrado.[33] It is officially protected in some Argentine provinces as a national heritage species.[2]
The giant anteater may use multiple habitats. A 2007 study of giant anteaters in the Brazilian Pantanal found the animals generally forage in open areas and rest in forested areas, possibly because forests are warmer than grasslands on cold days and cooler on hot days.[38] Anteater may travel an average of 3,700 m (12,100 ft) per day.[39] Giant anteaters can be either diurnal or nocturnal. A 2006 study in the Pantanal found those anteaters to be mostly nocturnal: they are most active during nighttime and early morning, and retire as the temperature rises. On colder days, they start and end periods of activity earlier, shifting them into daylight hours, and may become diurnal.[40] Diurnal giant anteaters have been observed at Serra da Canastra.[41] Nocturnality in anteaters may be a response to human disturbances.[42]
Giant anteaters typically rest in dense brush, but may use tall grass on cooler days. They carve a shallow cavity in the ground for resting. The animal sleeps curled up with its bushy tail folded over its body. The tail serves both to conserve body heat and as camouflage. One anteater was recorded sleeping with its tail stretched out on a sunny morning with an ambient temperature of 17 °C (63 °F); possibly it was positioned this way to allow its body to absorb the sun's rays for warmth.[43]
Giant anteaters are good swimmers and are capable of moving through wide rivers.[6] They have been observed to bathe.[44] They are also able to climb and have been recorded ascending both termite mounds and trees while foraging. One individual was observed holding onto a branch with its feet just touching the ground.[45]
Giant anteaters' home ranges vary in size depending on the location, ranging from as small as 2.7 km2 (667 acres) in Serra da Canastra National Park, Brazil, to as large as 32.5 km2 (8,031 acres) in Iberá Natural Reserve, Argentina.[39] Individuals mostly live alone, except for females that nurse their young and males courting females. Anteaters communicate their presence, status, and sexual condition with secretions from their anal glands. They also advertise their presence to other individuals though tree markings and urine.[46] They appear to be able to recognize each other's saliva by scent.[20]
Females appear to be more tolerant of females than males are of males, leading to greater overlap in female home ranges. Males are more likely to engage in agonistic behaviors,[41] such as slowly circling each other, chasing, or actual fighting.[20] Circling anteaters may utter a drawn-out "harrr" noise.[6] In combat, they slash at each other with their claws and wrestle each other to the ground.[6] Fighting anteaters may emit roars or bellows.[41] Males are possibly territorial.[20]
This animal is an insectivore, feeding mostly on ants or termites. In areas that experience seasonal flooding, like the grassy plains of the Venezuelan-Colombian Llanos, anteaters mainly feed on ants, because termites are less available.[20] Conversely, anteaters at Emas National Park eat mainly termites, which occur in high density on the grasslands.[47] At Serra da Canastra, anteaters switch between eating mainly ants during the wet season (October to March) and termites during the dry season (May to September).[20]
Anteaters track prey by their scent.[15] After finding a nest, the animal tears it open with its long fore claws and inserts its long, sticky tongue to collect its prey (which includes eggs, larvae and adult insects).[48] An anteater spends one minute on average feeding at a nest, visiting up to 200 nests in one day and consuming as many as 30,000 insects.[23] The anteater may be driven away from a nest by the chemical or biting attacks of soldiers.[15] Some termite species rely on their fortified mounds for protection and many individuals escape while the predator digs.[47] These modes of defense prevent the entire colony from being eaten in one anteater attack.[20]
Other prey include the larvae of beetles and western honey bees that have located their hives in termite mounds. Anteaters may target termite mounds with bee hives.[20] They may sometimes eat fruit.[49] In captivity, anteaters are fed mixtures made of milk, eggs, mealworms, and ground beef.[42] To drink, an anteater may dig for water when no surface water is available, creating waterholes for other animals.[44]
Giant anteaters can mate throughout the year.[20] During courtship, a male consorts with an estrous female, following and sniffing her. Male and female pairs are known to feed at the same insect nest.[41] While mating, the female lies on her side as the male crouches over her. A couple may stay together for up to three days and mate several times during that period.[20] Gestation lasts around 190 days[41] and ends with the birth of a single pup,[23] which typically weighs around 1.2 kg (2.7 lb).[50] Females give birth standing upright.[20]
Pups are born with eyes closed and begin to open them after six days. The mother carries its dependent pup on its back.[42] The pup's black and white band aligns with its mother's, camouflaging it.[23] The young communicate with their mothers with sharp whistles and use their tongues during nursing. After three months, the pup begins to eat solid food and is fully weaned by ten months. The mother grooms her offspring during rest periods lasting up to an hour. Grooming peaks during the first three months and declines as the young reaches nine months of age, ending by ten months. The decline mirrors that of the weakening bond between mother and offspring; young anteaters usually become independent by nine or ten months.[6] Anteaters are sexually mature in 2.5–4 years.[42]
Giant anteaters can live around 16 years in captivity.[15] They are primarily prey for jaguars and pumas and typically flee from danger by galloping, but if cornered,[42] will rear up on their hind legs and slash at the attacker.[51] The front claws of the giant anteater are formidable weapons, capable of scaring off a jaguar.[52] The giant anteater is a host of the Acanthocephalan intestinal parasites Gigantorhynchus echinodiscus[53] and Moniliformis monoechinus.[54]
Although they are shy and typically attempt to avoid humans, giant anteaters can inflict severe wounds with their front claws and have been known to seriously injure or kill humans who corner and threaten them. Between 2010 and 2012, two hunters were killed by giant anteaters in Brazil; in both cases, the hunters were agitating and wounding cornered animals and the attacks appeared to be defensive behaviors.[55] In April 2007, an anteater at the Florencio Varela Zoo mauled and killed a zookeeper with its front claws.[56] The animal in question, a male named Ramon, had a reputation for aggressiveness.[57]

In the mythology and folklore of the indigenous peoples of the Amazon Basin, the giant anteater is depicted as a trickster foil to the jaguar, as well as a humorous figure due to its long snout. In one Shipib tale, an anteater challenged a jaguar to a breath-holding contest under water, which the jaguar accepted. After the two removed their pelts and submerged, the anteater jumped out of the water and stole the jaguar's pelt, leaving the jaguar with the anteater's pelt. In a Yarabara myth, the evil ogre Ucara is transformed into one by the sun. This myth emphasizes the nearly immobile nature of the anteater's mouth, which was considered a burden.[58] The Kayapo people wear masks of various animals and spirits, including the anteater, during naming and initiation ceremonies. They believe women who touched anteater masks or men who stumbled while wearing them would die or receive some sort of physical disorder.[59]
During the Spanish colonization of the Americas, the giant anteater was one of many native fauna taken to Europe for display. At first, Europeans believed all anteaters were female and mated with their noses, a misconception corrected by naturalist Félix de Azara.[60] In the 20th century, Salvador Dalí wrote imaginatively that the giant anteater "reaches sizes bigger than the horse, possesses enormous ferocity, has exceptional muscle power, is a terrifying animal." Dalí depicted an anteater in the style of The Great Masturbator. It was used as a bookplate for André Breton, who compared the temptations a man experiences in life to what "the tongue of the anteater must offer to the ant."[61]
The 1940 Max Fleischer cartoon Ants in the Plants features a colony of ants fighting off a villainous anteater. Released during the Phoney War, the film may have alluded to France's Maginot Line.[62] An anteater is also a recurring character in the comic strip B.C. This character was the inspiration for Peter the Anteater, the University of California, Irvine team mascot.[63] In the Stephen King miniseries Kingdom Hospital, the character Antubis appears in the form of an anteater-like creature with razor-sharp teeth.[64]
The giant anteater (Myrmecophaga tridactyla) is an insectivorous mammal native to Central and South America. It is one of four living species of anteaters, of which it is the largest member. The only extant member of the genus Myrmecophaga, it is classified with sloths in the order Pilosa. This species is mostly terrestrial, in contrast to other living anteaters and sloths, which are arboreal or semiarboreal. The giant anteater is 182 to 217 cm (5 ft 11+1⁄2 in to 7 ft 1+1⁄2 in) in length, with weights of 33 to 50 kg (73 to 110 lb) for males and 27 to 47 kg (60 to 104 lb) for females. It is recognizable by its elongated snout, bushy tail, long fore claws, and distinctively colored pelage.
The giant anteater is found in multiple habitats, including grassland and rainforest. It forages in open areas and rests in more forested habitats. It feeds primarily on ants and termites, using its fore claws to dig them up and its long, sticky tongue to collect them. Though giant anteaters live in overlapping home ranges, they are mostly solitary except during mother-offspring relationships, aggressive interactions between males, and when mating. Mother anteaters carry their offspring on their backs until weaning them.
The giant anteater is listed as vulnerable by the International Union for Conservation of Nature. It has been extirpated from many parts of its former range. Threats to its survival include habitat destruction, fire, and poaching for fur and bushmeat, although some anteaters inhabit protected areas. With its distinctive appearance and habits, the anteater has been featured in pre-Columbian myths and folktales, as well as modern popular culture.
El oso hormiguero gigante (Myrmecophaga tridactyla), también llamado oso bandera, yurumí —a veces escrito erróneamente en español jurumí—[n. 1] u oso palmero[2] es la mayor especie de oso hormiguero. Se encuentra en América Central y Sudamérica. Es la única especie viviente del género Myrmecophaga.
Hormiguero, oso hormiguero, yurumí ('boca pequeña' en guaraní), tamanduá guazú, yautare, y kuarevachú.
Su cuerpo mide 50 cm de longitud y su cola de 150 a 180 cm; pesa de 120 a 200 kg.[3] El hocico es muy alargado y cónico. La lengua tiene 75 cm de largo y está recubierta por una sustancia adherente para capturar los insectos de los que se alimenta. Carece de dientes. El pelo del tronco, de color castaño o grisáceo, con una V negruzca y líneas blancas, es corto, excepto en el lomo, en el que se observa una crin, que se une con el muy abundante pelambre de la cola, que presenta bandas plateadas y tonos castaños, negros y grisáceos.
El oso hormiguero gigante posee un hocico alargado y convexo, adaptado especialmente para su alimentación. Posee pelaje de color amarillo dorado y tiene una especie de chaleco negro en el lomo, el vientre y los hombros. Presenta cola prensil peluda en la base y pelada en la punta y 4 garras poderosas y largas en las patas delanteras y 5 pequeñas en las traseras. Un ejemplar adulto puede alcanzar 2 metros de longitud desde la punta del hocico hasta la punta de la cola; tiene una lengua de hasta 75 cm de longitud, su vista es débil aunque tiene bastante desarrollados los otros sentidos, es edentado (carece de dientes), se alimenta de hormigas y termitas, entre sus parientes filogenéticos actuales los más próximos son los armadillos y los perezosos. En el 2015 está en grave peligro de extinción, además de la caza por parte del ser humano también suelen ser muertos por destrucción del hábitat.
Myrmecophaga tridactyla es fácilmente reconocible por su largo hocico cilíndrico y cola espesa, con cerdas largas y gruesas que mantiene erguidas, de ahí el nombre de oso bandera en Argentina y Brasil. Sus extremidades son fuertes, en las delanteras se apoya sobre los nudillos y terminan en 5 dedos, de los cuales 4 son visibles, de los que solo tres tienen garras características muy fuertes, especialmente la garra de su tercer dedo que se encuentra curvado hacia atrás cuando el animal camina sobre sus muñecas. También presenta 5 dedos con uñas menores en las patas traseras en las que apoya la planta entera. El macho es mayor que la hembra.
Sus patas delanteras son muy fuertes y poseen grandes y afiladas uñas que les sirven para dos objetivos: derruir los tacuruzales o sólidos termiteros y para, poniéndose de pie en sostenido erecto por sus dos patas posteriores y apoyándose en su larga cola afrontar y resistir los ataques de predadores mayores como el jaguar y el puma.
El oso hormiguero gigante se encuentra en gran variedad de hábitats, en sabanas, pastizales, áreas pantanosas, bosques húmedos, bosques secos, siendo más frecuentes en áreas abiertas con abundancia de hormigas y termitas, que componen esencialmente su dieta (mirmecofagia).
Parece ser diurno en áreas deshabitadas, en invierno y días lluviosos. En áreas densamente pobladas se torna nocturno. Vive en solitario o por parejas, moviéndose continuamente y recorriendo grandes extensiones con el hocico dirigido hacia el suelo en busca de insectos. A veces galopa para encontrar alimento o huir de los depredadores, a los que, si es el caso, se enfrenta con sus garras. Incluso puede ser un adversario difícil para el jaguar, el cual es su principal predador. Como no tiene buena vista se guía por su olfato que es muy agudo y con él localiza los hormigueros y termiteros y luego los excava. Su territorio varía desde 9 hasta 25 km².
Sus señales dejadas sobre los tacurúes por haber cavado en busca de hormigas o termes son muy particulares. Posee un método de ingesta muy particular, siendo buen ejemplo de cosecha racional.
Es buen nadador, penetrando en el agua a menudo e incluso es capaz de atravesar a nado ríos de notable anchura.[4] Aunque está capacitado para excavar, no se construye madrigueras y prefiere refugiarse en un hoyo o cualquier cavidad, donde se dispone para el reposos arrollándose sobre sí mismo con el hocico entre las patas y la gran cola sobre el cuerpo.
Son animales solitarios que dejan de ignorarse uno a otro en época de apareamiento. El período de gestación es de 190 días, tras los cuales nace una cría de aproximadamente 1,3 kg. Es destetada a las 4 a 6 semanas y luego llevada sobre el lomo de la madre hasta alrededor del año, época en que está crecido casi completamente y en que llega un nuevo período de apareamiento. La madurez sexual se alcanza entre los 2,5 a 4 años.
Myrmecophaga tridactyla se distribuye en América Central y en América del Sur. Originalmente se lo podía encontrar desde Belice hasta Uruguay. En la actualidad es una especie amenazada, se encuentra extinto en El Salvador y en Uruguay y se desconoce su situación en Belice. Sin embargo hay datos de junio de 2008 de su presencia en la Reserva de Bosawás en Nicaragua[5] justo al sur de la frontera con Honduras. En Centroamérica ya es un animal muy raro; su situación en Costa Rica es crítica.
En Sudamérica su refugio más extenso es el Chaco de Paraguay y Bolivia y el noreste de Argentina (tras haber sido exterminado hacia 1965 en la provincia argentina de Corrientes, en el tercer lustro del presente siglo XXI esta especie ha sido reintroducida en tal megapotámica provincia especialmente en los esteros del Iberá).
Myrmecophaga tridactyla fue declarado monumento natural por la provincia de Misiones en Argentina mediante la ley n.º 2589 sancionada el 11 de noviembre de 1988,[6] por la provincia de Corrientes por ley n.º 6330 sancionada de 12 de noviembre de 2014,[7] y por la provincia del Chaco por ley n.º 4306 de 6 de junio de 1996.[8]
Argentina, zona norte; Bolivia, en el Chaco, las Yungas y la Amazonía; Brasil, en grandes áreas del Amazonas, el Chaco y la Mata Atlántica; Colombia, en áreas fragmentadas de la Amazonía; Costa Rica, reportado en el Parque nacional corcovado durante los años 80s, posiblemente extinto; Ecuador; Guyana, Guyana Francesa, en la selva de transición de la frontera con Brasil; Honduras, reportado en la Reserva de la Biosfera de Río Plátano por una expedición en 2008; Nicaragua, reportado en la reserva de Bosawás; Panamá, Habita los bosques de la vertiente caribeña de las provincias de Bocas del Toro y Colón, donde ha sido recientemente avistado con cámaras trampa,[9] también se ha avistado en el Darién; Paraguay, tanto en la región Oriental como en la Región Occidental o Chaco paraguayo; Perú, en la Amazonía; Surinam; Uruguay, posiblemente extinto; Venezuela, en los Llanos y la Amazonía.
Belice, El Salvador, Guatemala, Perú y Uruguay, según la IUCN.
El oso hormiguero gigante es inofensivo; si es atacado se defiende con mucha peligrosidad por sus potentes y puntiagudas garras. Actualmente compone la dieta de los campesinos e indígenas, no así en algunas etnias como la de los Chamacocos en Alto Paraguay por creencias religiosas. Sus huesos son muy duros y son tóxicos para el ser humano, debido a su alto contenido de fosfato, fósforo y calcio. Asimismo, su carne es dura y de sabor muy desagradable.
Myrmecophaga tridactyla está muy amenazado por muerte, incendios y destrucción del hábitat. Aunque su carne es muy dura y desagradable, algunos pobladores nativos y campesinos la consumen. La destrucción de su hábitat, su bajo potencial reproductivo y su alta vulnerabilidad ante el hombre, son los factores de riesgo que más sufren.
El oso hormiguero gigante se encuentra amenazado en la Región Oriental, sus poblaciones están decreciendo en algunos Departamentos donde se observan extinciones locales.
Félix de Azara escribió en 1802 sobre este animal:
… lejos de perjudicar son benéficos: sin embargo desaparecerán del mundo luego de que esto se pueble un poco más, porque estas gentes matan todos los que encuentran, sin utilidad, ni más motivo por la suma facilidad de hacerlo
KOSTER, J. M. 2008. Giant anteater (Myrmecophaga tridactyla) killed by hunters with dogs in the Bosawas Biosphere Reserve, Nicaragua. Southwestern Naturalist 55:414–416.
MARINEROS, L. AND MARTÍNEZ, F. 1998. Guía de campo de los mamíferos de Honduras. Instituto Nacional de Ambiente y Desarrollo, Tegucigalpa, Honduras.
MCCAIN, C. M. 2001. First evidence of the giant anteater (Myrmecophaga tridactyla) in Honduras. Southwestern Naturalist 46: 252-254.
Portillo, H. O., Matamoros W.A. & Glowinski S.L. 2010. Distribution and conservation status of the giant anteater (Myrmecophaga tridactyla) in Honduras. Southwestern Naturalist 55:119-121.
Trebbau M., P., I. Cañizales, E. Sánchez-Rugeles. 2019. Oso Hormiguero. Colección La Fauna. Ediciones La Fauna KPT S.L
El oso hormiguero gigante (Myrmecophaga tridactyla), también llamado oso bandera, yurumí —a veces escrito erróneamente en español jurumí— u oso palmero es la mayor especie de oso hormiguero. Se encuentra en América Central y Sudamérica. Es la única especie viviente del género Myrmecophaga.
Hartz inurrijale (Myrmecophaga tridactyla) Myrmecophaga generoko animalia da. Pilosa ordenaren barruko ugaztuna da. Myrmecophagidae familian sailkatuta dago.
Hartz inurrijale (Myrmecophaga tridactyla) Myrmecophaga generoko animalia da. Pilosa ordenaren barruko ugaztuna da. Myrmecophagidae familian sailkatuta dago.
Isomuurahaiskarhu (Myrmecophaga tridactyla) on Etelä- ja Keski-Amerikassa elävä hyönteisiä syövä vajaahampainen nisäkäs. Se elää heinikkomailla, soilla ja alankosademetsissä.
Isomuurahaiskarhu on muurahaiskarhuista kookkain. Sen ruumiin pituus on 100–130 senttimetriä ja hännän 65–90 cm. Uros painaa 24–39 kilogrammaa ja naaras 22–35 kg. Väriltään laji on harmaa ja ruskea, ja harteilla ja selässä on mustia juovia. Isomuurahaiskarhulla on kummassakin eturaajassaan kaksi jopa 10 cm:n mittaista ja terävää kynttä, joilla se puolustautuu. Isomuurahaiskarhulla on pitkä, putkimainen kuono, jonka avulla se kerää hyönteisiä keoista ja koloista.[3]
Isomuurahaiskarhu käyttää ravintonaan lähes yksinomaan muurahaisia ja termiittejä. Näitä se saalistaa työntämällä 60-senttimetrisen tahmean kielensä kekoon nopeasti, 150 kertaa minuutissa. Hyönteiset tarttuvat kielen sylkeen ja väkäsiin, ja muurahaiskarhu vetää ne suuhunsa. Eläimen suu, kieli, lihakset ja leukaluut ovat sopeutuneet hyvin tällaiseen saalistustapaan. Sen kieliluut ovat isot ja nivelikkäät, ja kieli on kiinnittynyt osin alas kaulaan. Sen suuaukko on vain kynän levyinen. Isomuurahaiskarhulla ei ole hampaita, vaan se jauhaa saaliinsa mahassaan.[3]
Isomuurahaiskarhunaaras saa keväisin yhden poikasen. Isomuurahaiskarhun tiineysaika on 190 vuorokautta. Yksilö saavuttaa sukukypsyyden kaksivuotiaana. Se voi elää tarhassa 26-vuotiaaksi.[3]
Isomuurahaiskarhu on yleensä ihmistä kohtaan suvaitseva, mutta samalla kun sen elinpiiri Etelä- ja Keski-Amerikassa on kaventunut, sen on raportoitu uhattuna käyvän kynsillään ihmisen kimppuun. Kaksi ihmisen kuolemaan johtanutta yhteenottoa on ilmoitettu Brasiliassa.[4]
Isomuurahaiskarhu (Myrmecophaga tridactyla) on Etelä- ja Keski-Amerikassa elävä hyönteisiä syövä vajaahampainen nisäkäs. Se elää heinikkomailla, soilla ja alankosademetsissä.
Myrmecophaga tridactyla • Fourmilier géant
Le tamanoir, également nommé fourmilier géant ou grand fourmilier[2] (Myrmecophaga tridactyla), est une espèce de mammifères de la famille des Myrmecophagidae. C'est la seule espèce du genre Myrmecophaga. C'est un grand mammifère insectivore natif de l'Amérique centrale et du Sud. Il est l'une des quatre espèces vivantes de fourmiliers et classé, avec les paresseux, dans l'ordre Pilosa. Le tamanoir est surtout terrestre, contrairement à d'autres fourmiliers ou paresseux, qui sont arboricoles ou semi-arboricoles. L'espèce est la plus grande de sa famille avec une taille moyenne comprise entre 182 et 217 cm et un poids allant de 33 à 41 kg pour les mâles, de 27 à 39 kg pour les femelles. Le tamanoir est reconnaissable à son museau allongé, sa queue touffue, ses griffes avant longues et son pelage de couleur distincte.
Le fourmilier géant se rencontre dans de multiples habitats, notamment les prairies et la forêt tropicale. Il vit généralement à cheval sur plusieurs biotopes vitaux. Le tamanoir se nourrit dans les zones ouvertes, pour se reposer dans les zones plus boisées. Il se nourrit principalement de fourmis et de termites, en utilisant ses griffes de devant pour les déterrer et sa longue langue collante pour les recueillir. Ils sont pour la plupart solitaires sauf pendant les relations mère-jeunes ou lors de l'accouplement; les interactions entre mâles sont agressives. Les femelles portent leur progéniture sur leur dos jusqu'au sevrage.
Le fourmilier géant est répertorié comme vulnérable par l'Union internationale pour la conservation de la nature. Il a disparu de nombreuses parties de son ancienne aire de répartition, y compris la quasi-totalité de l'Amérique centrale. Les menaces à sa survie comprennent la destruction des habitats, le feu, et le braconnage pour la fourrure et la viande de brousse, bien que certains fourmiliers habitent dans des zones protégées. Avec son apparence et ses habitudes distinctives, le fourmilier a été présenté dans les mythes précolombiens et contes populaires.
Cette espèce a obtenu son nom binomial de Linné en 1758. Son nom générique, Myrmecophaga, et le nom spécifique, tridactyla, sont d'origine grecque, signifiant respectivement "dévoreur de fourmis" et "trois doigts"[3]. Myrmecophaga jubata a été utilisé comme synonyme. Trois sous-espèces ont été provisoirement proposée: M. t. tridactyla (allant du Venezuela et des Guyanes au nord de l'Argentine), M. t. centralis (originaire d'Amérique centrale, du nord-ouest de la Colombie, et du nord de l'Équateur), et M. t. artata (indigène du nord/nord-ouest de la Colombie et Venezuela). Le fourmilier géant est regroupé avec les Tamandua du nord et du sud semi-arboricoles dans la famille Myrmecophagidae. Avec la famille Cyclopedidae, ils constituent le sous-ordre des Vermilingua[4].
Myrmecophaga
Les fourmiliers et les paresseux appartiennent à l'ordre Pilosa et au super-ordre Xenarthra au même titre que Cingulata (dont les seuls membres existants sont les tatous). Les deux ordres de Xenarthra se sont divisés il y a 66 millions d'années à l'époque du Crétacé supérieur. Les fourmiliers et les paresseux ont divergé il y a environ 55 millions d'années, entre les époques Paléocène et Eocène. La lignée Cyclopes émergé autour de 30 millions d'années dans l'Oligocène, tandis que les lignées Myrmecophaga et Tamandua se sont divisés il y a environ 10 millions d'années dans la sous-époque du Miocène tardif[5]. Pendant la majeure partie de l'ère Cénozoïque, les fourmiliers ont été confinés à l'Amérique du Sud, qui était autrefois une île-continent. Après la formation de l'isthme de Panama il y a environ 3 millions d'années (Pliocène, Holocène), les fourmiliers des trois genres existants ont envahi l'Amérique centrale dans le cadre du Grand échange interaméricain[6].
Les archives fossiles pour les fourmiliers sont généralement clairsemées[7]. Certains fossiles connus comprennent le Pliocène avec le genre Palaeomyrmidon, un proche parent au fourmilier soyeux, Protamandua, un taxon[8] sœur au clade qui comprend le fourmilier géant et les tamanduas du Miocène, et Neotamandua, un taxon sœur de Myrmecophaga[9]. Protamandua était plus grand qu'un fourmilier soyeux (voir Cyclopes didactylus) mais plus petit qu'un tamandua, tandis que Neotamandua était plus important, se situant quelque part entre un tamandua et un fourmilier géant. Protamandua ne semble pas avoir de pieds spécialisés pour la locomotion terrestre ou arboricole, mais il a peut-être eu une queue préhensile. Cependant pour Neotamandua, il est peu probable qu'il ait eu une queue préhensile et ses pieds étaient intermédiaire, une sous forme, entre ceux des tamanduas et du fourmilier géant[7]. Les espèces boréales Neotamandua ont été considérées comme un ancêtre de ce dernier[10].
Le fourmilier géant est la plus terrestre des espèces de fourmilier vivant. Ses ancêtres étaient sans doute à l'origine adaptés à la vie arboricole[9] ; la transition à la vie sur terrain ferme aurait été facilitée par l'expansion des habitats ouverts tels que la savane en Amérique du Sud et de la disponibilité des insectes vivant en colonies, comme les termites, fournissant une source d'alimentation potentielle plus grande. Le fourmilier géant comme le tamandua du sud est bien représenté dans les fossiles de la fin du Pléistocène et de l'Holocène[7].
Le fourmilier géant peut être identifié par sa grande taille, un museau allongé, et une longue queue[11]. Il a une longueur totale de corps comprise entre 182 et 217 cm. Les mâles pèsent de 33 à 41 kg et les femelles de 27 à 39 kg[3], caractéristiques rendant le fourmilier géant la plus grande des espèces existantes dans son sous-ordre. La tête du fourmilier géant a 30 cm de long[12], donc particulièrement allongée, même lorsqu'on le compare à d'autres fourmiliers[13]. Son museau tubulaire, qui se termine par une petite ouverture, la bouche surmontée des narines, occupe la plus grande partie de sa tête. Ses yeux et ses oreilles sont relativement petits[3]. Il a une mauvaise vue[11], mais son odorat est 40 fois plus développé que celui des humains[14]. Les fourmiliers géants peuvent vivre jusqu'à 16 ans en captivité[11].
Contrairement à celui des autres mammifères, le cou des fourmiliers, en particulier du fourmilier géant, est plus épais que le dos et la tête[13]. Une petite bosse peut être située à l'arrière de son cou. Le pelage du fourmilier géant est principalement gris et sel avec du blanc. Ses membres antérieurs sont blancs, avec des bandes noires autour des poignets, tandis que ses membres postérieurs sont sombres. Une bande noire épaisse avec des contours blancs s'étend de la gorge à l'épaule, où elles se terminent en pointe triangulaire. Le corps se termine par une queue brune en toupet. Le pelage est long, particulièrement sur la queue, ce qui la fait paraître plus grande qu'elle n'est réellement. Il a un tronçon de crinière très raide le long du dos[6]. Ses motifs sombres ont été pris pour être un "camouflage perturbateur", mais une étude de 2009 suggère une coloration d'avertissement[15]. Alors que les mâles adultes sont légèrement plus grands et plus musclés que les femelles, avec tête et cou plus larges, la détermination visuelle du sexe des individus peut être difficile. Le pénis et les testicules sont rétractés et situés à l'intérieur entre le rectum et la vessie, les femelles ont une seule paire de glandes mammaires rapprochées[16].
Le fourmilier géant a les flancs larges. Malgré son nom d'espèce, il possède cinq orteils à chaque patte. Quatre orteils sur les pattes avant ont des griffes, les deuxièmes et troisièmes sont particulièrement allongées[16]. Le fourmilier géant déambule sur ses phalanges avant, semblablement à certains singes africains, en particulier gorilles et les chimpanzés. De la sorte, le fourmilier géant garde ses griffes intactes et ne les use pas en marchant. Les doigts du milieu, qui soutiennent le plus de son poids, sont allongés au niveau des articulations métacarpophalangiennes (Préhension) et pliés au niveau des articulations interphalangiennes (Préhension)[17]. Contrairement aux pattes avant, les pattes de derrière ont des griffes courtes sur les cinq orteils et sont utilisées de manière plantigrade[11]. Comme un "crochet/pelle", la fosse supra-épineuse est élargie de manière à donner au fourmilier géant une répartition du poids et de manière croissante en tirant la puissance et ses membres antérieurs du muscle triceps aidant ainsi en puissance à la flexion du troisième doigt et de ce fait aussi un épaississement des pattes avant[18].
Le fourmilier géant a une température de corps relativement basse pour un mammifère, environ 33 °C, de quelques degrés inférieure à une température typique de mammifère de 36−38 °C[11]. Généralement les Xenarthra ont tendance à avoir des taux métaboliques plus faibles que la plupart des autres mammifères, une tendance probablement en corrélation avec leurs spécialisations alimentaires et leur faible mobilité[19].
Le fourmilier géant n'a pas de dents et est capable de mouvements de mâchoire très limités. Ces mouvements s'appuient sur la rotation des deux moitiés de la mâchoire inférieure, maintenues ensemble par un ligament en leur pointe[13], lui permettant ainsi d'ouvrir et fermer sa bouche, et grâce à ses muscles masticatoires[20], qui sont relativement sous-développés[13]. La mâchoire crée une dépression, une ouverture orale assez grande pour que la langue élancée puisse sortir complètement. Elle mesure en moyenne 60 cm (24 pouces)[3] de long et est triangulaire en arrière, arrondie en avant, et se termine par un petit sommet arrondi[13]. La langue est recouverte de papilles bombées vers l'arrière et revêtues d'une épaisse salive collante sécrétée par des glandes salivaires élargies[12], lui permettant ainsi la collecte des insectes.
La dépression en forme de tube et la petite ouverture de la bouche restreignent la langue à des mouvements de rétraction protubérante. Au cours de l'alimentation, la langue entre et sort environ 160 fois par minute (près de trois fois par seconde). Ces mouvements sont alimentés par la musculature unique du grand, long et flexible appareil hyoïde du fourmilier géant, s'appuyant également sur l'orientation de sa tête. Lorsqu'elle est entièrement déployée, la langue peut atteindre 45 cm (18 pouces), taille supérieure à la longueur du crâne. Les muscles buccinateurs lui permettent de glisser la langue d'avant en arrière sans perdre les aliments collectés. Ils sont rapprochés et l'animal serre la bouche de manière à empêcher les aliments de s'échapper et ce même avec une absorption rallongée du fait de la grande taille de la langue. Quand elle est rétractée, la langue est maintenue dans l'oropharynx par les muscles hyoïde et le palais secondaire, ce qui l'empêche de bloquer la respiration. Cette rétraction est facilitée par le long muscle sternoglossus, qui est formé par la fusion de la sterno (Muscle sterno-hyoïdien) et le muscle hyo-glosse, qui n'est pas fixé à l'os hyoïde[13]. Ainsi, la langue est directement ancrée au sternum[21].
Les fourmiliers géants avalent à un taux beaucoup plus élevé que la plupart des autres mammifères. En effet lors de l'alimentation, ils avalent presque continuellement[13]. Avant d'être avalés, les insectes sont écrasés contre le palais[12]. L'estomac du tamanoir, semblable au gésier d'un oiseau, possède des plis durci et utilise de fortes contractions pour broyer les insectes. Le processus de digestion est facilité par l'ingestion de petites quantités de sable et de terre[16]. Le fourmilier géant ne peut pas produire d'acide gastrique de son propre chef, et utilise donc l'acide formique de sa proie pour la digestion[12].
Selon Mammal Species of the World (version 3, 2005) (19 avr. 2010)[22] :
Nom des naturalistes sur EOL[23]
Le fourmilier géant est originaire d'Amérique centrale et du Sud. Son aire de répartition connue s'étend du Honduras au nord de l'Argentine, et des restes fossiles ont été trouvés au nord-ouest de Sonora, au Mexique[6](le plus au nord de son aire de répartition). Il est absent de la Cordillère des Andes[3] et a disparu en Uruguay[24]. Il peut également être rencontré au Belize, au Costa Rica et au Guatemala[24]. L'espèce peut être rencontrée dans un certain nombre d'habitats, y compris les forêts tropicales humides ou les zones arbustives xériques[11], fournissant suffisamment de nourritures[25].
L'espèce est classée vulnérable par l'IUCN, en raison du nombre des disparitions régionales[24]. Il est aussi classé à l'Annexe II de la CITES,ce qui limite étroitement le commerce des spécimens de l'animal[26]. Entre 2000 et 2010, la population totale a diminué de 30%[24]. En 1994, quelque 340 fourmiliers géants sont morts à cause de feux de forêt dans le parc national Emas au Brésil[27]. L'animal est particulièrement vulnérable aux incendies en raison de ses lents mouvements et de son pelage épais.
Les menaces d'origine humaine comprennent les collisions avec les véhicules, les attaques de chiens, et la destruction de l'habitat. Le fourmilier géant est communément chassé en Bolivie, à la fois pour le sport et la subsistance. L'épaisse peau coriace de l'animal est utilisée pour fabriquer du matériel équestre dans le Chaco. Au Venezuela, il est chassé pour ses griffes[25]. Les fourmiliers géants sont tués pour des raisons de sécurité, en raison de leur réputation d'animaux dangereux. Cependant l'espèce reste très répandue. Certaines populations sont stables et l'animal peut se rencontrer dans diverses zones protégées de l'Amazonie et le Cerrado[25]. Il est officiellement protégé dans certaines provinces argentines comme une espèce de patrimoine national[24].
Le tamanoir peut utiliser plusieurs habitats. En effet, une étude de 2007 de l'espèce dans le Pantanal brésilien a démontré que les animaux se nourrissent généralement dans des zones ouvertes et passent le reste du temps dans les zones boisées, peut-être parce que les forêts sont plus chaudes que les prairies en saisons froides et plus fraiches pendant les saisons chaudes[29]. Les fourmiliers géants peuvent être soit diurnes soit nocturnes. Une étude de 2006 dans le Pantanal démontrait qu'ils sont surtout nocturnes : ils sont plus actifs pendant la nuit et tôt le matin, et se retirent quand la température augmente. Les jours les plus froids, ils s'adaptent au temps de manière à se déplacer dans les heures de clarté, et peuvent devenir diurnes[30]. Des fourmiliers géants se déplaçant la nuit ont été observés à Serra da Canastra[31](Parcs nationaux du Brésil). La nocturnité du tamanoir peut être une réponse aux perturbations humaines[32]. Le fourmilier géant se repose généralement dans les broussailles denses, mais peut utiliser les hautes herbes les jours plus frais. Il sculpte ou creuse une cavité peu profonde dans le sol pour se reposer. L'animal dort recroquevillé avec sa queue touffue rabattue sur son corps. La queue sert à la fois à conserver la chaleur du corps et de camouflage. Un tamanoir a été observé dormant avec sa queue déployée, un matin ensoleillé où la température ambiante était de 17 °C ; il est possible qu'il se soit positionné de cette façon de manière à permettre l'absorption par son corps de la chaleur[33].
Les tamanoirs sont de bons nageurs et sont capables de se déplacer dans de larges fleuves[3]. Des comportements de baignade ont été observés[34]. Ils sont également en mesure de grimper et ont été observés escaladant des monticules et des arbres pour se nourrir de termites. Un individu a été observé accroché à une branche avec simplement ses pattes arrière touchant le sol[35].
L'étendue des territoires vitaux des fourmiliers géants varie en taille en fonction de l'emplacement. Au parc national de Serra da Canastra au Brésil (Parcs nationaux du Brésil), les femelles tamanoir ont un domaine vital de l'ordre de 3,67 km2 (910 acres), tandis que les mâles vivent sur des domaines vitaux de 2,74 km2 (680 acres). Dans d'autres parties du Brésil, les fourmiliers peuvent avoir 9 km2 (2 200 acres) de domaine vital. Les fourmiliers originaires du Venezuela ont été observés vivant sur des étendues parfois atteignant les 25 km2 (6200 acres)[31]. Les individus vivent le plus souvent seuls, exception faite des femelles qui allaitent leurs petits ou des mâles courtisant les femelles. Les fourmiliers géants communiquent leur présence et leur condition sexuelle grâce aux sécrétions de leurs glandes anales. Ils annoncent également leur présence aux autres individus et autres espèces de manière générale pour indiquer par exemple leur présence sur un territoire avec le marquage d'arbres par l'urine[36]. Ils semblent être en mesure de reconnaître leurs salives par leurs odeurs[14].
Les femelles semblent être plus tolérantes entre elles que les mâles, ce qui conduit à un plus grand chevauchement des territoires vitaux des femelles. Les mâles sont plus susceptibles et adoptent des comportements égoïstes et territoriaux[31], le plus souvent en encerclant lentement l'autre et en le conduisant à un affrontement[14]. Les tamanoirs se faisant surprendre ou ayant approché indirectement un congénère peuvent adopter un comportement de soumission et "pleurer" émettant des "harrr". Au combat, ils se battent à coups de griffes avec pour but de renverser l'adversaire au sol[3]. Pendant ses combats les fourmiliers peuvent émettre des "rugissements" ou des "soufflets"[31]. Les mâles sont éventuellement territoriaux[14].
Cet animal est un insectivore, se nourrissant principalement de fourmis ou de termites. Dans les régions où ils sont familiers des inondations saisonnières, comme les plaines herbeuses des llanos vénézuéliens, les tamanoirs se nourrissent principalement de fourmis, parce que les termites sont moins disponibles[14]. À l'inverse, les tamanoirs du parc national Emas se nourrissent principalement de termites, disponibles en haute densité sur les prairies[38]. Au Serra da Canastra (Parcs nationaux du Brésil), les fourmiliers géants passent principalement des fourmis pendant la saison des pluies (octobre à mars) aux termites pendant la saison sèche (de mai à septembre)[14].
Les fourmiliers pistent leurs proies à l'odeur[11]. Après avoir trouvé un nid, l'animal "pleure" (verse des larmes "pour humidifier et assouplir" le sol) et creuse au moins légèrement avec ses longues griffes de devant puis insère sa longue langue collante pour recueillir ses proies. Un fourmilier passe en moyenne une seule minute par nid pour s'en nourrir, et peut visiter jusqu'à 200 nids par jour afin de consommer presque 30 000 insectes[16]. Les tamanoirs peuvent être chassés des nids de fourmis ou termites par les attaques mordantes des soldats ou des projections chimiques[16]. Certaines espèces de termites comptent sur leurs monticules fortifiés de protection et de nombreux prédateurs renoncent rapidement après avoir commencé à essayer de creuser[38]. Ces modes de défense empêchent une colonie entière d'être mangée lors de l'attaque d'un fourmilier[14].
D'autres de leurs proies comprennent les larves de coléoptères et les abeilles occidentales qui ont leurs ruches situées dans des termitières. Les fourmiliers peuvent cibler des termitières avec des ruches d'abeilles[14]. En captivité, les fourmiliers sont nourris de mélanges à base de lait, d'œufs, de vers de farine, et de bœuf haché[32]. Pour boire, un fourmilier peut creuser en l'absence de disponibilité d'eau en surface, et créer ainsi des points d'eau pour d'autres animaux[34].
Les fourmiliers géants sont des proies pour les jaguars et les pumas. Ils fuient généralement le danger en galopant, mais s'ils sont acculés[32], ils opteront pour une posture défensive, se tenant sur leurs pattes arrière et essayant de faire fuir l'attaquant[39]. Les griffes avant du fourmilier géant sont des armes redoutables, capables de tuer un jaguar[40].
Bien que timide et généralement tenté d'éviter les humains, on rapporte des cas de spécimens de cette espèce ayant blessé des humains qui avaient essayé de les coincer, les avaient trop acculés. Les fourmiliers géants peuvent causer de graves blessures avec leurs griffes avant. Deux chasseurs ont récemment été tués par des fourmiliers géants au Brésil et dans les deux cas, les chasseurs s'agitaient, blessaient et acculaient dans des angles sans échappatoires les animaux, ce qui conduisit sans doute à des attaques qui semblaient être simplement des comportements défensifs[41]. En avril 2007, un fourmilier du zoo de Florencio Varela a tué une jeune gardienne de 19 ans avec ses griffes avant[42] (il semble que l'animal - prénommé Ramón - avait la réputation d'être agressif[43]).
Les fourmiliers géants peuvent s’accoupler tout au long de l’année[14]. Pendant la parade nuptiale, un mâle en rut cherche une femelle en chaleur. Après s’être reniflés, ils se joignent. Les couples mâles et femelles sont connus pour se nourrir ensemble, dans les mêmes nids d'insectes[31]. Lors de l’accouplement, la femelle se met dans la même position et direction que le mâle, ce dernier s’accroupit sur elle. Un couple peut rester ensemble pendant trois jours, et s’accoupler plusieurs fois au cours de cette période[14]. La gestation dure environ 190 jours[31] et se termine par la naissance d'un seul petit[16], qui pèse généralement autour de 1,4 kg (3,1 lb)[40]. Les femelles donnent naissance debout[14].
Les nouveau-nés naissent avec les yeux fermés et commencent à les ouvrir au bout de six jours. La mère porte son petit sur son dos[32]. Les bandes noires et blanches acquises dès la naissance s’alignent avec ceux de la mère et offrent un parfait camouflage[16]. Les jeunes communiquent avec leurs mères grâce à des sifflements aigus et perçants et utilisent leurs langues pendant l’allaitement. Après trois mois, le petit commence à manger des aliments solides et est entièrement sevré à dix mois. La mère nettoie sa progéniture pendant les périodes de repos pouvant durer jusqu'à une heure. Le toilettage est très particulièrement prononcé pendant les trois premiers mois et décline progressivement jusqu’à l’âge de neuf mois, se terminant au dixième mois. Cette baisse de toilettage reflète la diminution des liaisons entre la mère et sa progéniture ; les jeunes tamanoirs devenant généralement indépendants vers neuf ou dix mois[3]. Les tamanoirs sont sexuellement matures entre 2,5 et 4 ans[32].
Dans la mythologie et le folklore des peuples autochtones du bassin de l'Amazone, le fourmilier géant est dépeint comme un « malin » ou un « arnaqueur » contrecarrant le jaguar, ainsi qu'une touche affective d'humour en raison de son long museau. Dans un conte « Shipib », un fourmilier défie un jaguar à un concours d’apnée sous l'eau. Le jaguar accepte . Une fois leurs corps submergés, le fourmilier a sauté hors de l'eau et a volé la fourrure du jaguar, laissant ce dernier avec la fourrure du tamanoir. Dans un mythe « Yarabara », l'ogre du mal « Ucara » est transformé dans l’intérieur et par le soleil. Ce mythe souligne le caractère presque immobile de la bouche du tamanoir, qui a été considérée comme un fardeau[45]. Les « Kayapos » portent des masques d'animaux divers, y compris de tamanoir, au cours du nommage et de cérémonies d'initiation. Ils croient que les femmes qui ont touché des masques de fourmilier ou que les hommes qui ont trébuché tout en les portants mouraient ou recevaient une sorte de trouble physique[46].
Pendant la colonisation espagnole des Amériques, le fourmilier géant était l'un des nombreux animaux indigènes capturés pour être exposés et exhibés en Europe. Dans un premier temps, les Européens croyaient majoritairement que les spécimens présentés de tamanoirs étaient tous des femelles et qu’ils s’accouplaient avec leur nez, une idée évidemment fausse et corrigée par le naturaliste Félix de Azara[47]. Au XXe siècle, Salvador Dalí a écrit : « imaginons que les fourmiliers géants atteignent des tailles plus grandes que le cheval, possèdent d'énormes férocités, ayant un pouvoir musculaire exceptionnel, ils seraient des animaux terrifiants. » Dalí représentait un fourmilier dans le style de Le Grand Masturbateur. Il a été utilisé comme un ex-libris pour André Breton, qui a comparé les tentations qu’un homme éprouve dans la vie à ce que « la langue du tamanoir doit offrir à la fourmi. »[48]
En 1940 une bande dessinée de Max Fleischer « dans les plantes, une colonie de fourmis repoussent un fourmilier crapuleux. » Sortie pendant la Drôle de guerre, le film peut avoir fait allusion à la ligne Maginot de la France[49]. Un tamanoir est aussi un personnage récurrent dans la bande dessinée BC. Ce personnage était l'inspiration de Pierre le fourmilier la mascotte de l’équipe de Irvine, d’une Université de Californie[50]. Le dessin animé très court Happy Tree Friends dispose d’un fourmilier nommé « Sniffles ». Dans la mini-série de Stephen King Kingdom Hospital, le caractériel « Antubis » apparaît sous la forme d'une créature ressemblant à un fourmilier, avec des dents acérées[51].
Myrmecophaga tridactyla • Fourmilier géant
Le tamanoir, également nommé fourmilier géant ou grand fourmilier (Myrmecophaga tridactyla), est une espèce de mammifères de la famille des Myrmecophagidae. C'est la seule espèce du genre Myrmecophaga. C'est un grand mammifère insectivore natif de l'Amérique centrale et du Sud. Il est l'une des quatre espèces vivantes de fourmiliers et classé, avec les paresseux, dans l'ordre Pilosa. Le tamanoir est surtout terrestre, contrairement à d'autres fourmiliers ou paresseux, qui sont arboricoles ou semi-arboricoles. L'espèce est la plus grande de sa famille avec une taille moyenne comprise entre 182 et 217 cm et un poids allant de 33 à 41 kg pour les mâles, de 27 à 39 kg pour les femelles. Le tamanoir est reconnaissable à son museau allongé, sa queue touffue, ses griffes avant longues et son pelage de couleur distincte.
Le fourmilier géant se rencontre dans de multiples habitats, notamment les prairies et la forêt tropicale. Il vit généralement à cheval sur plusieurs biotopes vitaux. Le tamanoir se nourrit dans les zones ouvertes, pour se reposer dans les zones plus boisées. Il se nourrit principalement de fourmis et de termites, en utilisant ses griffes de devant pour les déterrer et sa longue langue collante pour les recueillir. Ils sont pour la plupart solitaires sauf pendant les relations mère-jeunes ou lors de l'accouplement; les interactions entre mâles sont agressives. Les femelles portent leur progéniture sur leur dos jusqu'au sevrage.
Le fourmilier géant est répertorié comme vulnérable par l'Union internationale pour la conservation de la nature. Il a disparu de nombreuses parties de son ancienne aire de répartition, y compris la quasi-totalité de l'Amérique centrale. Les menaces à sa survie comprennent la destruction des habitats, le feu, et le braconnage pour la fourrure et la viande de brousse, bien que certains fourmiliers habitent dans des zones protégées. Avec son apparence et ses habitudes distinctives, le fourmilier a été présenté dans les mythes précolombiens et contes populaires.
Os oso formigueiro xigante, (Myrmecophaga tridactyla) é unha especie de mamífero placentario da orde dos pilosos e familia dos mirmecofáxidos, a única actualmente vivente do xénero Myrmecophaga, que habita en América Central e do Sur.
O xénero foi descrito orixinalmente no ano 1758 polo científico, naturalista, botánico e zoólogo sueco Carl von Linné,[1] o creador dos fundamentos para o esquema moderno da nomenclatura binomial e o fundador da moderna taxonomía. A descrición realizouna ao mesmo tempo que a da súa especie tipo, Myrmecophaga tridactyla. A publicación efectuona na décima edición do seu Systema naturæ.[2]
Ademais desta especie, describiuse outra extinta, Myrmecophaga caroloameghinoi † (Kraglievich, 1934).
E nos primerios anos do século XXI, o zoólogo neerlandés —nacionalizado brasileiro— Marcus Gerardus Maria van Roosmalen, deu a coñecer a existencia dunha terceira especie do xénero Myrmecophaga, a que sería a segunda vivente, o chamado oso formigueiro xigante arborícola. Porén, este novo taxon aínda non conta cunha descrición formal. Segundo o propio van Roosmalen, esta nova especie ten a particularidade de gabear pola árbores, algo que non fai a especie vivente tradicional. Aínda non logrou encontar restos dalgún espécime que permita unha publicación respectando as normas impostas polo Código Internacional de Nomenclatura Zoolóxica (ICZN), pero logrou filmalo en vídeo no seu ambiente natural, a selva tropical amazónica do centro-norte do Brasil.[3][4]
O nome deste xénero Linneo formouno co primeiro elemento do latín científico Myrmeco-, tirado do grego antigo μύρμηξ ηκος mýrmēx -ēkos, "formiga", e o segundo elemento -phaga, do grego φάγος phágos, "comellón". Literalmente: "os comedores de formigas".
Segundo Mammals Species of the World e o SIIT e distínguense as seguintes subespecies:[1][5][6]
Myrmecophaga tridactyla Linnaeus, 1758
O corpo do oso formigueiro xigante mide entre 100 e 120 cm de lonxitude, e a súa cola de 60 a 90 cm; pesa entre 25 e 39 kg.[7] A especie extinta era menor.
Conta cun fociño moi alongado e de forma cónica, e unha igualmente alongada lingua de 60 cm, recuberta por unha substancia adherente que lle permite recolectar o seu alimento: formigas e térmites, que caza nos seus grandes e fortes niños (formigueiros e termiteiros), que rompe utilizando as súas poderosas garras curvas presentes nas súas patas dianteiras. Carece de dentes.[7][8] Ten unha cola de abundantes, longos, grosos e mestos pelos, que emprega como abrigo para cubrir o seu corpo durante as noites frías.[9]
O osos formigueiro xigante distribuese por América Central e no norte e centro de América do Sur. Orixinariamente presentaba poboacións desde Belize polo norte até Uruguai polo sur.[7][10][11] A destrución do seu hábitat e a caza ilegal convertérono nunha especie en retroceso numérico, provocando a súa total extinción en Guatemala, El Salvador e Uruguai.[12] e posibelmente en Belize.
En todos os países de Centroamérica xa é un animal moi raro.
As poboacións suramericanas encóntranse en mellor estado de conservación, chegando as máis austrais ao norte da Arxentina.[7][13]
A especie extinta habitou máis ao sur, alcanzando os 39° S na zona de Monte Hermoso, ao suroeste da provincia de Buenos Aires, no centro-leste da Arxentina.[14][15]
A Unión Internacional para a Conservación da Natureza e dos Recursos Naturais (UICN) cualificou na actualidade (2014) a su¡ituación a especie como vulnerábel (VU). Estima que as súas maiores ameazas son a perda dos seus e hábitats en moitas partes da súa área de dispersión, en particular para as poboacións de América Central. Nos lugares onde a especie habita en zonas de pasteiros é particularmente susceptíbel aos incendios. En Brasil, a queima de plantacións de cana de azucre antes da súa colleita leva á morte dun número significativo de osos formigueiros xigantes debido a queimaduras severas. Moitois animais morren ás veces atropelados nas estradas o atacandos por cans. Moitos cázanse para alimento ao longo da súa área de distribución, ademais de seren cazados como se dunha praga se tratase, para telos como mascotas ou para o comercio ilegal.[7]
Nalgunhas zonas, os osos formigueiros xigantes, como quedou dito, cázanse para alimento; isto é especialmente certo na zona da Caatinga do Brasil. Ademais, a súa pel utilízase para a fabricación de arneses e outros produtos de coiro, así como para usos medicinais.[16]
Nota: Prema sobre cada imaxe para ampliala.
Vista de perfil. Zoo de Phoenix
Probabelmente á busca de insectos, nun tronco morto. Zoo de Brevard (Carolina do Norte).
Femia adulta coa súa cría no lombo. Zoo de San Diego (San Diego).
Os oso formigueiro xigante, (Myrmecophaga tridactyla) é unha especie de mamífero placentario da orde dos pilosos e familia dos mirmecofáxidos, a única actualmente vivente do xénero Myrmecophaga, que habita en América Central e do Sur.
Divovski mravojed (lat. Myrmecophaga tridactyla) je najveći od četiri vrste mravojeda i jedini je pripadnik roda Myrmecophaga (od grčkog murmekos što znači mrav i phagein, jesti). Živi na području Srednje i Južne Amerike.
Divovski mravojedi mogu narasti i do 1,5 m, a težina varira između 29 i 65 kg. Imaju tanko tijelo prekriveno dugim krznom oštrih dlaka koje na repu mogu doseći dužinu i do 40 cm. Mladunčad posjeduje mekano krzno do spolnog sazrijevanja. Dominantna boja krzna je siva do smeđa, ali svi imaju dijagonalnu bijelu liniju na ramenima. Na prednjim nogama ima velike, srpasto svinute pandže kojima otvara mravinjake i termitnjake.
Glava im je mala, a nos i gornja usna su produljeni u dugo rilo. Zubi uoće nema, dok mu je jezik izrazito dug (i do 60 cm), a širok je u prosjeku 1,25 cm. Hrapavi jezik je prekriven bodljicama i ljepljivom slinom na koju se lijepe mravi. Prilikom hvatanja mrava, veliki mravojed uvlači i izvlači jezik i do 150 puta u minuti.
Prosječna tjelesna temperatura im je 32,7°C, što je jedna od najnižih temperatura kod svih živućih sisavaca[1].
Žive individualno, a mogu se naći na raznovrsnim područjima uključujući livade, šume i kišne šume. Hrane se mravima i termitima (nekad i do 30.000 insekata dnevno) koje pronalazi istančanim njuhom, dok su mu vid i sluh slabo razvijeni. Aktivni su i danju i noću, a spavaju u dupljama drveća ili u grmlju, pri čemu čupav rep obmotaju oko tijela. Hodaju polako i pritom gaze gornjom stranom prednjeg stopala kako se ne bi oštetile pandže, dok stražnjim nogama gaze cijelim stopalom. Pandžama se mogu i braniti od predatora (kao što je puma ili jaguar), ali najčešće bježe od opasnosti. Ženke kote po jedno mladunče koje dugo nose na leđima[2].
Prema ljestvici IUCN-a divovski mravojed je ugrožena vrsta (kojoj se populacija smanjila za 20% u posljednjih 10 godina), uglavnom zbog gubitka staništa. Pretpostavlja se da ih u divljini ima oko 5.000 jedinki, dok ih se nekoliko stotina nalazi u svjetskim zoološkim vrtovima.
Divovski mravojed (lat. Myrmecophaga tridactyla) je najveći od četiri vrste mravojeda i jedini je pripadnik roda Myrmecophaga (od grčkog murmekos što znači mrav i phagein, jesti). Živi na području Srednje i Južne Amerike.
Il formichiere gigante (Myrmecophaga tridactyla), noto anche come l'orso delle formiche, è un grande mammifero insettivoro endemico dell'America centro-meridionale. Si tratta di una delle quattro specie viventi di formichiere, l'unico membro esistente del genere Myrmecophaga, ed è classificato con i bradipi all'interno dell'ordine Pilosa. Questa specie è perlopiù terrestre, a differenza degli altri formichieri e bradipi, che sono perlopiù arboricoli o semi-arboricoli. Come si evince dal nome, il formichiere gigante è la specie più grande della sua famiglia, con una lunghezza di 182-217 centimetri, con un peso di 33–50 kg per i maschi e di 27–47 kg per le femmine. L'animale è immediatamente riconoscibile per il suo muso allungato, la coda folta, i lunghi artigli anteriori e la pelliccia dai colori distintivi.
Il formichiere gigante vive in una vasta gamma di habitat, tra cui le praterie e le foreste pluviali. Si nutre in aree aperte e riposa negli habitat coperti da folta vegetazione. Si nutre principalmente di formiche e termiti, utilizzando i suoi robusti artigli anteriori per scavare e la sua lunga lingua appiccicosa per raccoglierle. Anche se i formichieri giganti vivono in ambienti sovrapposti tra loro, sono animali solitari tranne la relazione madre-figlio, interazioni aggressive tra i maschi, e il periodo dell'accoppiamento. Le femmine di formichiere portano i loro cuccioli sulle schiene fino allo svezzamento.
Il formichiere gigante è elencato come Vulnerabile dall'Unione internazionale per la conservazione della natura, e la sua presenza è stata estirpata in molte aree del suo precedente areale. Le principali minacce per questo animale includono la distruzione dell'habitat, gli incendi e il bracconaggio per le pellicce e la carne di animali selvatici, sebbene alcuni formichieri abitino in aree protette. Grazie al suo aspetto e abitudini, il formichiere appare in molti miti delle civiltà precolombiane e nel folklore, e anche nella cultura di massa moderna.
Il formichiere gigante può essere facilmente distinto dagli altri formichieri per le sue grandi dimensioni, il muso allungato e la sua lunga coda folta.[5] L'animale presenta una lunghezza totale di 182-217 centimetri, per un peso di 33–50 kg per i maschi e 27–47 kg per le femmine,[6][7][8] rendendo il formichiere gigante la più grande specie esistente nel suo sottordine. La testa del formichiere gigante, lunga 30 centimetri,[9] è particolarmente allungata, anche paragonata ad altri formichieri.[10] Il suo muso tubolare, che termina in una minuscola apertura boccale e nelle narici, occupa la maggior parte della sua testa. Occhi e orecchie sono relativamente piccoli,[6] per questo la sua vista è piuttosto scarsa,[5] compensando con il suo acuto senso dell'olfatto, 40 volte più sensibile di quello umano.[11] In cattività, i formichieri giganti possono vivere fino a 16 anni.[5]
Anche per un formichiere, il collo è particolarmente spesso rispetto alla parte posteriore della testa,[10] e nella parte posteriore del collo si trova una piccola gobba. Il mantello è per lo più grigiastro, marrone o nero con striature bianche. Gli arti anteriori sono bianchi, con bande nere intorno ai polsi, mentre gli arti posteriori sono scuri. Spesse bande nere con contorni bianchi si estendono dalla gola alle spalle, terminando in punte triangolari. La folta coda è completamente grigio-marrone scuro. I peli del mantello sono lunghi, specialmente sulla coda, facendola sembrare più grande di quanto non sia in realtà. Una criniera rigida si estende lungo la groppa fino alla coda.[6][12] In passato si pensava che il motivo sul petto fosse un camuffamento dirompente, ma uno studio del 2009 suggerisce che si tratta di una colorazione d'avvertimento.[13] Mentre i maschi adulti sono leggermente più grandi e più muscolosi delle femmine, con teste e colli più larghi, la determinazione visiva del sesso può essere difficile. Il pene e i testicoli si trovano internamente tra il retto e la vescica urinaria nei maschi e le femmine hanno un solo paio di ghiandole mammarie vicino alle ascelle.[14]
Il formichiere gigante ha costole larghe. Nonostante il suo nome specifico, tridactyla, che significa tre dita, l'animale presenta cinque dita per piede. Quattro dita sugli anteriori hanno artigli, che sono particolarmente allungati sul secondo e terzo dito.[14] Per non rovinare gli artigli mentre cammina, l'animale cammina sulle nocche, come i gorilla e gli scimpanzé. Le dita medie, che sostengono la maggior parte del peso dell'animale, sono estese alle articolazioni metacarpo-falangee e piegate alle articolazioni interfalangee.[15] A differenza degli arti anteriori, i piedi hanno artigli corti su tutte e cinque le dita e hanno un'andatura plantigrade.[6] In quanto scavatore "aggancia-e-tira", la fossa sovraspinosa allargata del formichiere gigante conferisce al muscolo grande rotondo una maggiore leva, aumentando la potenza di trazione degli arti anteriori, mentre il tricipite aiuta a potenziare la flessione del terzo dito ispessito degli arti anteriori.[16]
Il formichiere gigante ha temperatura corporea bassa per un mammifero, di circa 33 °C, di pochi gradi inferiore a una temperatura tipica dei mammiferi dai 36 ai 38 °C.[11] Gli xenartri in generale tendono ad avere tassi metabolici più bassi rispetto alla maggior parte degli altri mammiferi, una tendenza che si pensa sia correlata alle loro specializzazioni dietetiche e alla bassa mobilità.[17]
Il formichiere gigante non ha denti ed è in grado di eseguire solo un movimento mascellare molto limitato, che si basa sulla rotazione delle due metà della mandibola, tenute insieme da un legamento all'estremità,[10] per aprire e chiudere la bocca. Ciò è compiuto dai suoi muscoli masticatori,[18] che sono relativamente sottosviluppati.[10] La depressione della mandibola crea un'apertura orale abbastanza grande da far uscire la lunga lingua sottile. La lingua del formichiere gigante è lunga tipicamente 60 centimetri,[6] e trasversalmente ha una forma triangolare posteriormente, arrotondata anteriormente e termina con una piccola punta arrotondata.[10][19] La lingua è ricoperta da minuscole papille ricurve all'indietro ed è ricoperta di saliva densa e appiccicosa secreta dalle ghiandole salivari ingrossate dell'animale,[9] permettendo al formichiere gigante di raccogliere grandi quantità di insetti in una singola "leccata".
Il muso tubolare e la piccola apertura boccale limitano i movimenti di protrusione e retrazione della lingua. Durante l'alimentazione, l'animale si affida all'orientamento della testa per mirare. La lingua può essere estesa fino a 45 centimetri, un'estensione maggiore della lunghezza del cranio, e si muove dentro e fuori circa 160 volte al minuto (quasi tre volte al secondo).[10] La lingua del formichiere ha pochi se non nessun attaccamento all'osso ioide e ciò gli consente di usare la lingua con più mobilità e velocità.[12][20][21] Il muscolo sternoglosso lungo, formato dalla fusione dello sternoioideo e dell'ioglosso, è direttamente ancorato allo sterno.[10][19][22] L'apparato ioideo è grande, a forma di V e flessibile, e sostiene la lingua mentre entra ed esce dalla bocca.[10][19][23] I muscoli buccinatori gli permettono di rientrare senza perdere il cibo attaccato alla lingua e stringono la bocca per evitare che il cibo fuoriesca mentre si estende. Quando retratta, la lingua viene trattenuta nell'orofaringe dal palato secondario, impedendole di bloccare la respirazione.[10]
I formichieri giganti deglutiscono a una velocità molto più elevata rispetto alla maggior parte degli altri mammiferi; durante l'alimentazione, deglutiscono quasi continuamente.[10] Prima di essere inghiottiti, gli insetti vengono schiacciati contro il palato.[9] Lo stomaco del formichiere gigante, simile al ventriglio degli uccelli, ha pieghe indurite e usa forti contrazioni per macinare gli insetti. Il processo digestivo è assistito da piccole quantità di sabbia e terra ingerite dall'animale accidentalmente o volontariamente.[14] Il formichiere gigante non è in grado di produrre da solo gli acidi dello stomaco, ma utilizza l'acido formico delle sue prede per la digestione.[9]
Il formichiere gigante vive in una vasta gamma di habitat. Uno studio del 2007 sui formichieri giganti del Pantanal brasiliano ha rivelato che questi animali si nutrono generalmente nelle aree aperte e riposano in aree boschive dalla fitta vegetazione, probabilmente perché le foreste sono più calde delle praterie nei giorni freddi e più fresche nelle giornate calde.[24] I formichieri giganti sono attivi sia durante il giorno sia nelle ore notturne. Uno studio del 2006, ha dimostrato che i formichieri che vivono nel Pantanal sono perlopiù notturni, essendo più attivi durante le ore notturne e all'alba, per poi ritirarsi nelle loro tane quando la temperatura aumenta. Nei giorni più freddi, iniziano e terminano i periodi di attività prima, spostandoli nelle ore diurne e divenendo principalmente diurni.[25] I formichieri giganti osservati a Serra da Canastra sono perlopiù diurni.[26] Anche le attività umane influiscono sul comportamento di questi animali, e nelle aree più urbane i formichieri sono perlopiù notturni.[27]
I formichieri giganti riposano tipicamente nella fitta boscaglia, ma possono riposarsi anche nell'erba alta nei giorni più freddi. La loro tana è composta da una cavità poco profonda nel terreno che scavano con i loro robusti artigli. Mentre dorme l'animale si avvolge con la folta coda, sia per conservare il calore corporeo sia per mimetizzarsi. Anche se durante le giornate più calde, quando la temperatura raggiunge anche i 17 °C, la coda viene lasciata distesa, forse in modo da consentire al corpo di assorbire i raggi del sole per il riscaldarsi.[28]
I formichieri giganti sono buoni nuotatori e sono in grado di attraversare anche ampi fiumi,[6] e sono stati osservati anche immergersi per rinfrescarsi.[29] Sono anche in grado di arrampicarsi e sono stati osservati mentre si arrampicavano sia sui termitai che sugli alberi durante mentre si nutrivano. Un individuo è stato osservato aggrapparsi a un ramo, con i piedi che toccavano appena il suolo.[30]
L'areale individuale dei formichieri giganti varia in dimensioni a seconda della loro posizione. Nel Parco Nazionale della Serra da Canastra, Brasile, le femmine di formichieri hanno un spazio vitale di circa 3,67 km2, mentre i maschi vivono in uno spazio vitale di 2,74 km2. In altre parti del Brasile, i formichieri possono avere territori di 9 km2. Sono stati osservati formichieri venezuelani che vivono in aree abitate grandi fino a 25 km2.[26] Gli individui vivono principalmente da soli, ad eccezione delle femmine che allattano i loro piccoli e dei maschi che corteggiano le femmine. I formichieri comunicano la loro presenza, stato e condizione sessuale tramite delle secrezioni delle loro ghiandole anali. Segnalano la loro presenza ad altri individui anche attraverso segni d'artiglio degli alberi e l'urina.[31] Sembra inoltre che siano in grado di riconoscere la saliva degli altri formichieri dall'odore.[11]
Le femmine sembrano essere più tolleranti nei confronti di altre femmine nel loro territorio, rispetto ai maschi nei confronti di altri maschi, portando a una maggiore sovrapposizione negli home range femminili. I maschi hanno maggiori probabilità di ingaggiare comportamenti agonistici,[26] come camminare circolarmente l'uno sull'altro, inseguirsi o combattere.[11] Quando due formichieri si confrontano possono emettere un prolungato "harrr". Quando due formichieri combattono per il territorio usano i loro robusti artigli per squarciano l'avversario e costringerlo a terra.[6] Durante questi combattimenti, i contendenti possono emettere ruggiti o muggiti.[26] I maschi sono più territoriali delle femmine, ma raramente le dispute territoriali finiscono in scontri fisici.[11]
Come si evince dal nome, il formichiere gigante è un insettivoro, che si nutre principalmente di formiche e/o termiti. Nelle aree che subiscono inondazioni stagionali, come le pianure erbose del Llanos venezuelano-colombiano, i formichieri si nutrono principalmente di formiche, perché le termiti sono più rare.[11] Al contrario, i formichieri del Parco nazionale delle Ema si nutrono principalmente di termiti, che si trovano in alta densità nelle praterie secche.[32] A Serra da Canastra, i formichieri passano da una dieta costituita principalmente da formiche durante la stagione delle piogge (da ottobre a marzo) alle termiti durante la stagione secca (da maggio a settembre).[11]
I formichieri giganti rintracciano le loro prede con l'olfatto.[5] Dopo aver trovato un formicaio o un termitaio, l'animale usa i suoi lunghi e robusti artigli per aprire uno squarcio nel nido degli insetti per poi inserirvi la lunga lingua appiccicosa per raccogliere le sue prede. Un singolo formichiere trascorre in media un minuto nutrendosi in un nido, visitando fino a 200 nidi in una giornata e consumando fino a 30.000 insetti.[14] Tuttavia, sia le formiche che le termiti non sono inermi all'attacco di questi animali e talvolta un formichiere può essere allontanato da un nido dagli attacchi chimici o dai morsi dei soldati.[5] Alcune specie di termiti si affidano ai loro termitai fortificati per proteggersi e molti individui scappano mentre il predatore comincia a scavare.[32] Queste modalità di difesa impediscono che l'intera colonia venga mangiata in un singolo attacco del formichiere.[11]
Altri insetti che fanno parte della dieta dell'animale includono le larve di coleotteri e api mellifere occidentali che spesso costruiscono i loro alveari proprio sui termitai, divenendo a loro volta preda dei formichieri.[11] In cattività, i formichieri vengono nutriti con miscele di latte, uova, larve della farina e carne macinata.[27] Per bere, durante la stagione secca, i formichieri scavano nel terreno per raggiungere l'acqua rimasta sotto terra, creando pozze d'acqua anche per altri animali.[29] I formichieri giganti sono principalmente preda di giaguari e puma. Di solito fuggono dal pericolo galoppando, ma se messi alle strette,[27] possono impennarsi sulla zampe posteriori, puntellandosi con la coda, per usare gli artigli delle zampe anteriori per attaccare.[33] Gli artigli del formichiere gigante sono armi formidabili, in grado di uccidere un giaguaro.[34] Il formichiere gigante è un ospite di parassiti intestinali acanthocephali, come Gigantorhynchus echinodiscus[35] e Moniliformis monoechinus.[36]
I formichieri giganti possono accoppiarsi durante tutto l'anno.[11] Durante il corteggiamento, il maschio si sposta con la femmina in estro, seguendola e annusandola. È noto che queste coppie appena formate si nutrono insieme nello stesso nido di insetti.[26] Durante l'accoppiamento, la femmina giace su un fianco mentre il maschio si accuccia su di lei. Una coppia può stare insieme fino a tre giorni e accoppiarsi più volte durante questo periodo.[11] Dopo la concezione, il maschio abbandona la femmina. La gestazione dura circa 190 giorni[26] e termina con la nascita di un singolo cucciolo,[14] che in genere pesa circa 1,4 kg.[34] Le femmine partoriscono in piedi.[11]
I cuccioli nascono con gli occhi chiusi e iniziano ad aprirli solo dopo sei giorni. La madre trasporta il suo cucciolo sulla groppa, dove il cucciolo si attacca alla pelliccia della madre con i piccoli artigli.[27] La fascia bianca e nera sul petto del cucciolo si allinea con quella della madre, mimetizzandolo alla vista dei predatori.[14] I piccoli comunicano con le madri con fischi acuti e usano la lingua durante l'allattamento. Dopo tre mesi, il cucciolo inizia a mangiare cibi solidi ed è completamente svezzato entro dieci mesi. La madre governa la sua prole durante i periodi di riposo che durano fino a un'ora. Il picco di toelettatura avviene durante i primi tre mesi e diminuisce quando il giovane raggiunge i nove mesi di età, terminando a dieci mesi. Il declino rispecchia quello dell'indebolimento del legame tra madre e figlio; i giovani formichieri di solito diventano indipendenti entro nove o dieci mesi dalla nascita.[6] I formichieri diventano sessualmente maturi a 2,5-4 anni.[27]
Il formichiere gigante è endemico dell'America centro-meridionale, sebbene sia stato estirpato in molte di queste zone. Il suo areale conosciuto si estende dall'Honduras all'Argentina settentrionale e i suoi resti fossili sono stati ritrovati fino al nord-ovest di Sonora, in Messico. Non essendoci stati successivi cambiamenti climatici particolari o la comparsa di animali con lo stesso tipo di dieta con cui sarebbe potuto entrare in competizione o di nuovi predatori, la sua estinzione in Nord America è attribuibile, come per altri mammiferi dello stesso luogo e periodo, all'arrivo dell'uomo nel continente, avvenuto circa 15.000 anni fa.[37] È assente in gran parte delle Ande[6] ed è stato completamente estirpato in Uruguay, Belize, El Salvador e Guatemala, così come in alcune parti di Costa Rica, Brasile, Argentina e Paraguay.[2] L'animale occupa un gran numero di habitat, tra cui la foresta pluviale tropicale e la macchia xerica,[5] a condizione che vi sia una quantità sufficiente di prede per sostenerlo.[38]
Il formichiere gigante prende il suo nome binomiale da Carlo Linneo, nel 1758. Il nome del genere, Myrmecophaga, e il nome della specie, tridactyla, sono entrambi greci, e significano rispettivamente "mangiatore di formiche" e "tre dita".[6] La presunta specie Myrmecophaga jubata venne in seguito identificata come un sinonimo. È stata proposta l'esistenza di tre sottospecie: M. t. tridactyla (il cui areale va dal Venezuela e dalla Guiana al nord dell'Argentina), M. t. centralis (originario dell'America centrale, della Colombia nordoccidentale e dell'Ecuador settentrionale), e M. t. artata (originaria della Colombia nord-orientale e del Venezuela nord-occidentale). Il formichiere gigante è raggruppato con il tamandua settentrionale e meridionale all'interno della famiglia Myrmecophagidae. Insieme alla famiglia Cyclopedidae, il cui unico membro esistente è il formichiere nano, le due famiglie costituiscono il sottordine Vermilingua.[39] Di seguito l'albero filogenetico degli xenartri viventi.[40]
Bradipi FormichieriMyrmecophaga
ArmadilliFormichieri e bradipi appartengono all'ordine Pilosa e condividono il superordine Xenarthra con i Cingulata, che ha come unici esponenti viventi gli armadilli. I due ordini di Xenarthra si separarono 66 milioni di anni fa durante il Cretacico superiore. I lignaggi di bradipi e formichieri si separarono intorno ai 55 milioni di anni fa, tra il Paleocene e l'Eocene. La linea Cyclopes emerse intorno ai 30 milioni di anni fa nell'Oligocene, mentre le linee Myrmecophaga e Tamandua si separarono circa 10 milioni di anni fa, alla fine del Miocene.[40] Per buona parte dell'era Cenozoica, i formichieri rimasero confinati in Sud America, all'epoca un continente isolato. In seguito alla formazione dell'Istmo di Panama 3 milioni di anni fa, i formichieri di tutti e tre i generi invasero l'America Centrale, in seguito al Grande scambio americano.[37]
La documentazione fossile dei formichieri è generalmente scarsa.[41] I fossili noti includono il genere Pliocenico Palaeomyrmidon, un parente stretto del formichiere nano, Protamandua, il sister taxon del clade che comprende il formichiere gigante e i tamandua dal Miocene, e Neotamandua, un sister taxon di Myrmecophaga.[42] Protamandua era più grande del formichiere nano, ma più piccolo di un tamandua, mentre Neotamandua era più grande, rientrando tra le dimensioni di un tamandua e del formichiere gigante. Protamandua non sembra avere piedi particolarmente specializzati per la locomozione terrestre o arboricola, ma potrebbe aver avuto una coda prensile. Al contrario, Neotamandua aveva piedi di forma intermedia tra quelli dei tamandua e del formichiere gigante ed è improbabile che avesse una coda prensile.[41] La specie Neotamandua borealis è stata indicata come possibile antenato di quest'ultimo.[43] Un altro membro del genere Myrmecophaga è stato rinvenuto dalla Formazione Monte Hermoso, in Argentina, risalente a 6.8-4 milioni di anni fa, ed è stato descritto da Kraglievitch, nel 1934, come Nunezia caroloameghinoi.[44] La specie è stata in seguito riclassificata come Myrmecophaga caroloameghinoi da S. E. Hirschfeld, nel 1976.[45]
Il formichiere gigante è la specie di formichiere vivente più terrestre. I suoi antenati potrebbero essere stati originariamente adattati ad una vita arborea;[42] la transizione ad una vita al suolo potrebbe essere stata incentivata dall'espansione di habitat aperti, come la savana Sudamericana e dalla disponibilità di insetti coloniali, come le termiti, che fornivano una potenziale fonte di cibo più ampia. Sia il formichiere gigante che il tamandua meridionale sono ben rappresentati nei reperti fossili del tardo Pleistocene e dell'inizio dell'Olocene.[41]
La specie è elencata come Vulnerabile dalla IUCN, a causa dell'alto numero di estirpazioni regionali,[2] e nell'Appendice II dalla CITES, che limita fortemente il commercio di questi animali.[46] Tra il 2000 e il 2010, la popolazione totale è diminuita del 30%.[2] Nel 1994, circa 340 formichieri giganti morirono a causa di incendi scoppiati nel Parco nazionale delle Ema, in Brasile.[47] L'animale è particolarmente vulnerabile agli incendi a causa dei suoi movimenti lenti e per il suo pelo infiammabile.[6]
Le minacce indotte dall'uomo includono collisioni coi veicoli, attacchi di cani randagi e la distruzione dell'habitat. Il formichiere gigante è comunemente cacciato in Bolivia, sia per sport che per la carne. Nel Chaco la pelle spessa e coriacea dell'animale viene utilizzata per fabbricare attrezzature equestri. In Venezuela viene cacciato per i suoi artigli.[38] I formichieri giganti vengono anche uccisi per motivi di sicurezza, a causa della loro reputazione di animali pericolosi. Fortunatamente, il formichiere gigante rimane comunque molto diffuso, ed alcune popolazioni sono stabili e l'animale si trova in diverse aree protette dell'Amazzonia, del Pantanal e del Cerrado.[38] È ufficialmente protetto in alcune province argentine come specie patrimonio nazionale.[2]
Molti zoo europei, tra i più importanti per la conservazione delle specie a rischio di estinzione, ospitano il formichiere gigante fra le maggiori attrazioni del parco. Il formichiere è presente ad esempio negli zoo di Zurigo, Vienna, Amsterdam e Berlino. Non è presente in nessuno zoo italiano. Data la loro indole piuttosto mansueta spesso condividono il loro habitat con altre specie autoctone del loro habitat naturale come il tapiro brasiliano, il capibara, il nandù comune, e in alcuni casi è stato addirittura visto dividere tranquillamente il proprio spazio con un crisocione. In alcuni rari casi il formichiere è stato protagonista di incidenti con i guardiani purtroppo con esiti fatali per questi ultimi. Nonostante il carattere docile resta comunque un animale potenzialmente pericoloso poiché molto forte, potente e soprattutto provvisto di artigli molto taglienti. In cattività può avere dimensioni maggiori rispetto agli esemplari selvatici, talvolta anche 10–15 kg in più delle medie massime. Inoltre riesce a riprodursi bene in cattività.
Sebbene siano animali timidi e in genere cerchino di evitare l'uomo, i formichieri giganti possono infliggere gravi ferite con i loro artigli anteriori e sono noti per aver ferito gravemente e anche ucciso gli uomini che li avevano messi alle strette o che li stavano minacciando. Tra il 2010 e il 2012 due cacciatori sono stati uccisi da formichieri giganti in Brasile; in entrambi i casi i cacciatori stavano agitando e ferendo l'animale che, ormai messo alle strette, passò al contrattacco per difendersi.[48] Nell'aprile 2007 un formichiere dello zoo di Florencio Varela ha squartato e ucciso un guardiano dello zoo con i suoi artigli.[49] L'animale in questione, un maschio di nome Ramon, aveva già la reputazione di essere aggressivo.[50]
Nella mitologia e folklore dei popoli indigeni del bacino amazzonico, il formichiere gigante è raffigurato come un trickster opposto al giaguaro, così come una figura umoristica per via del suo lungo muso. In un racconto Shipib, un formichiere sfidò un giaguaro a una gara di apnea sott'acqua, che il giaguaro accettò. Dopo che i due si furono tolti la pelle e si immersero, il formichiere saltò fuori dall'acqua e rubò la pelle del giaguaro, lasciando quest'ultimo con la pelle del formichiere. In un mito di Yarabara, il malvagio orco Ucara venne trasformato in un formichiere dal sole. Questo mito sottolinea la natura quasi immobile della bocca del formichiere, che era considerata un peso.[51] Il popolo Kayapó indossa maschere di vari animali e spiriti, incluso il formichiere, durante le cerimonie di denominazione e di iniziazione. Credono che le donne che hanno toccato maschere di formichiere o gli uomini che sono inciampati mentre le indossavano sarebbero morte o avrebbero ricevuto una qualche sorta di disturbo fisico.[52]
Durante la colonizzazione spagnola delle Americhe, il formichiere gigante fu uno dei tanti animali nativi portati in Europa per essere mostrato al mondo orientale. All'inizio, gli europei credevano che tutti i formichieri fossero femmine e si accoppiassero con il naso, un'idea sbagliata corretta dal naturalista Félix de Azara.[53] Nel XX secolo, Salvador Dalí scrisse fantasiosamente che il formichiere gigante "raggiunge taglie più grandi del cavallo, possiede un'enorme ferocia, ha un'eccezionale potenza muscolare, ed è un animale terrificante". Dalí dipinse un formichiere nello stile de Il grande masturbatore. È stato usato come ex libris per André Breton, che paragonava le tentazioni che un uomo sperimenta nella vita a ciò che "la lingua del formichiere deve offrire alla formica".[54]
Il cartone animato di Max Fleischer del 1940, Ants in the Plants presenta una colonia di formiche che combattono contro un formichiere malvagio. Rilasciato durante la Strana guerra, il film potrebbe essere un'allusione alla linea Maginot francese.[55] Un formichiere è anche un personaggio ricorrente nel fumetto B.C.. Questo personaggio è stato l'ispirazione per Peter the Anteater, la mascotte della squadra dell'Università della California, Irvine.[56] Nella miniserie di Stephen King, Kingdom Hospital, il personaggio di Antubis appare sotto forma di una creatura simile a un formichiere con denti affilati come rasoi.[57]
accesso richiede url (aiuto) Il formichiere gigante (Myrmecophaga tridactyla), noto anche come l'orso delle formiche, è un grande mammifero insettivoro endemico dell'America centro-meridionale. Si tratta di una delle quattro specie viventi di formichiere, l'unico membro esistente del genere Myrmecophaga, ed è classificato con i bradipi all'interno dell'ordine Pilosa. Questa specie è perlopiù terrestre, a differenza degli altri formichieri e bradipi, che sono perlopiù arboricoli o semi-arboricoli. Come si evince dal nome, il formichiere gigante è la specie più grande della sua famiglia, con una lunghezza di 182-217 centimetri, con un peso di 33–50 kg per i maschi e di 27–47 kg per le femmine. L'animale è immediatamente riconoscibile per il suo muso allungato, la coda folta, i lunghi artigli anteriori e la pelliccia dai colori distintivi.
Il formichiere gigante vive in una vasta gamma di habitat, tra cui le praterie e le foreste pluviali. Si nutre in aree aperte e riposa negli habitat coperti da folta vegetazione. Si nutre principalmente di formiche e termiti, utilizzando i suoi robusti artigli anteriori per scavare e la sua lunga lingua appiccicosa per raccoglierle. Anche se i formichieri giganti vivono in ambienti sovrapposti tra loro, sono animali solitari tranne la relazione madre-figlio, interazioni aggressive tra i maschi, e il periodo dell'accoppiamento. Le femmine di formichiere portano i loro cuccioli sulle schiene fino allo svezzamento.
Il formichiere gigante è elencato come Vulnerabile dall'Unione internazionale per la conservazione della natura, e la sua presenza è stata estirpata in molte aree del suo precedente areale. Le principali minacce per questo animale includono la distruzione dell'habitat, gli incendi e il bracconaggio per le pellicce e la carne di animali selvatici, sebbene alcuni formichieri abitino in aree protette. Grazie al suo aspetto e abitudini, il formichiere appare in molti miti delle civiltà precolombiane e nel folklore, e anche nella cultura di massa moderna.
Didžioji skruzdėda (Myrmecophaga tridactyla) – nepilnadančių (Xenarhra) būrio skruzdėdinių (Myrmecophagidae) šeimos rūšis. Paplitusi Centrinėje ir Pietų Amerikoje.
Ilgis 1,8-2,4 m. Sveria 29-65 kg. Gyvena pavieniui. Minta skruzdėlėmis, termitais, kuriuos iš termitynų ištraukia 60 cm ilgio liežuviu. Didžioji skruzdėda per dieną gali suėsti apie 30 tūkst. vabzdžių.
Didžioji skruzdėda (Myrmecophaga tridactyla) – nepilnadančių (Xenarhra) būrio skruzdėdinių (Myrmecophagidae) šeimos rūšis. Paplitusi Centrinėje ir Pietų Amerikoje.
Ilgis 1,8-2,4 m. Sveria 29-65 kg. Gyvena pavieniui. Minta skruzdėlėmis, termitais, kuriuos iš termitynų ištraukia 60 cm ilgio liežuviu. Didžioji skruzdėda per dieną gali suėsti apie 30 tūkst. vabzdžių.
Lielais skudrlācis jeb trīspirkstu skudrlācis (Myrmecophaga tridactyla) ir liela auguma nepilnzobju kārtas (Pilosa) zīdītājs. Tā ir vienīgā lielo skudrlāču ģints (Myrmecophaga) mūsdienās dzīvojošā suga. Lielais skudrlācis sastopams gan Centrālamerikas un Dienvidamerikas tropiskajos lietus mežos, gan sausajos krūmājos.[1] Tā ir viena no četrām skudrlāču mūsdienās dzīvojošajām sugām. Atšķirībā no pārējām skudrlāču sugām, kas pilnībā vai daļēji uzturas kokos, lielais skudrlācis mājo uz zemes.
Saskaņā ar Starptautiskās dabas un dabas resursu aizsardzības savienības datiem lielais skudrlācis ir iespējami apdraudēta suga (angļu: vulnerable). Daudzās agrāk apdzīvotajās vietās tas ir izmiris un tikpat kā vairs nav sastopams Centrālamerikā.[2] Galvenie iemesli sugas izmiršanai ir tā apdzīvotās vides izzušana, ugunsgrēki un malumedniecība.
Lielā skudrlāča dabīgais izplatības areāls aptver Centrālameriku un Dienvidameriku. Areāla ziemeļu robeža sākas Hondurasā, bet dienvidu robeža sasniedz Argentīnu. Fosilie atradumi Sonoras ziemeļrietumos liecina, ka šīs uga ir bijusi izplatīta arī Meksikā.[3]
Daudzas populācijas ir stabilas un daudzās valstīs tiek veidotas aizsargājamas teritorijas, piemēram, Argentīnā un Brazīlijā. Tomēr lielais skudrlācis mūsdienās ir izmiris Urugvajā un, iespējams, arī Belizā, Kostarikā un Gvatemalā.[2] Laikā no 2000. gada līdz 2010. gadam kopējā skudrlāču populācija ir samazinājusies par 30%. 1994. gadā liels skaits skudrlāču (apmēram 340) gāja bojā Emas Nacionālā parka (Brazīlijā) ugunsgrēkā. Lielais dzīvnieks ugunsgrēka gadījumā ir ļoti neaizsargāts, jo pārvietojas pārāk lēni, lai izbēgtu no uguns. Ļoti bieži skudrlāči iet bojā arī nelaimes gadījumos uz autoceļiem, no suņu uzbrukumiem, bet galvenais apdraudējums ir to dzīves vietas izzušana.
Bolīvijā joprojām ir atļautas lielo skudrlāču medības. Tos medī, lai iegūtu biezo ādu un nagus. Lielos skudrlāčus medī arī Venecuēlā. Turklāt vietējos iedzīvotājos ir iesakņojies uzskats, ka lielais skudrlācis, būdams liels dzīvnieks ir bīstams dzīvnieks, un to nogalina arī savas it kā drošības pēc.
Lielais skudrlācis ir lielākais no visiem skudrlāčiem. Tam ir garš purns un aste. Kopējais ķermeņa garums, asti ieskaitot, ir 182—217 cm, astes garums 70—100 cm. Tēviņi ir nedaudz lielāki nekā mātītes. Tēviņš sver 33—41 kg, mātīte 27—39 kg.[4] Tā galva ir apmēram 30 cm gara un, pat salīdzinot ar citiem skudrlāčiem, tās proporcijas ir slaidākas.[5] Tam ir relatīvi nelielas acis un ausis, un galvas lielāko daļu aizņem cauruļveida purns, kura galā ir pavisam neliela mutīte un nāsis.[4] Lielajam skudrlācim ir vāja redze, bet oža apmēram 40 reižu labāka kā cilvēkam.[6][7] Atšķirībā no citiem zīdītājiem skudrlāčiem, īpaši lielajam skudrlācim, kakls ir biezāks par galvas aizmugurējo daļu.[5] Uz kakla tam ir pat neliels kupris.
Kažoka krāsa pamatā ir pelēkbrūna. Tā priekškājas ir gaiši pelēkas, gandrīz baltas, ar melnām joslām ap pēdu locītavām, bet pakaļkājas tumši brūnas. Arī pakakle ir tumši brūna, kas kā plata josla apņem krūšu augšējo daļu, stiepjoties pāri pleciem un līdz muguras vidusdaļai, vienlaicīgi sašaurinoties smailā trīsstūrī. Tumšo krāsu papildus izceļ koši baltā, šaurā kontūra gar joslas malām. Līdzīgi kā pakaļkājas arī aste ir tumši brūna. Matojums lielajam skudrlācim ir garš, īpaši uz astes. Visas muguras garumā izceļas stīvas krēpes.[4] Lai arī tēviņi ir nedaudz lielāki un masīvāki, dzimumus ir grūti vienu no otra atšķirt. Lielajam skudrlācim ir zema ķermeņa temperatūra, apmēram 33 °C, kas ir par dažīem grādiem zemāka kā citiem zīdītājiem. Kaut arī lielais skudrlācis mājo tropos, tam ir ļoti biezs kažoks, jo tā uzņemtā barība satur zemu enerģētisko vērtību, vielmaiņa ir lēna un organisms praktiski neuzkrāj tauku rezerves.[6] Lai guļot pārāk neatdzistu vai pārāk nesakarstu, skudrlācis saritinās kamolā un piesedzas ar savu garo, kuplo asti. Aste un biezais kažoks pasargā dzīvnieku no apkārtējās vides temperatūras svārstībām un uztur konstantu ķermeņa temperatūru.[6]
Neskatoties uz savu nosaukumu — trīspirkstu skudrlācis, visām četrām pēdām ir pieci pirksti. Priekškājām četriem pirkstiem ir nagi, bet otrajam un trešajam pirkstam tie ir pagarināti, lieli un spēcīgi, kas tiek izmantoti zemes rakšanai un aizsardzībai.[8] Priekškājas ir arī ļoti spēcīgas, ar labi attīstītiem muskuļiem. Lai taupītu nagus, skudrlācis pārvietojas uz delmiem, līdzīgi kā to dara gorillas un šimpanzes. Vidējie kauliņi, kas galvenokārt uzņem dzīvnieka svaru, locītavā ir paplatināti.[9] Atšķirībā no priekškājām pakaļkājām nagi ir īsi un tie ir visiem pieciem pirkstiem. Ejot skudrlācis izmanto pēdas.[4]
Skudrlācim ir izteikti slaids purns, kas atgādina vidēji garu snuķi. Tā mēle ir ļoti šaura un gara, apmēram 60 cm gara,[4] un skudrlācis spēj ar to dziļi iekļūt skudru pūžņa ejās, aizsniedzoties 45 cm dziļumā. Mēle ir garāka nekā paša dzīvnieka galvaskauss. Lielajam skudrlācim nav zobu un tā žokļu kustības ir ļoti ierobežotas. Žoklis spēj atvēt muti tik daudz, lai pa to varētu izšauties garā mēle. To klāj sīki, uz aizmuguri izliekti izaugumi, kurus ieskauj biezas, lipīgas siekalas[6][10] un ar kuru palīdzību skudrlācis notur kukaiņus uz mēles. Ātrās mēles kustības (apmēram 150 reižu minūtē (gandrīz trīs reizes sekundē),[6]) nodrošina unikāla muskulatūra. Līdzko mēle ir ievilkta, mute cieši aizveras. Garā mēle ir pievienota krūšu kaulam un, kad mēle netiek lietota, tā atrodas rīklē, tādējādi nenosprostojot elpošanu.[5] Skudrlācis ļoti ātri norij savu barību, praktiski vienlaicīgi ar mēles ievilkšanas brīdi. Pirms norīšanas kukaiņi tiek saberzti pret asajām, rievotajām aukslējām.[10] Skudrlācim kuņģis ir līdzīgs putnu guzai. Kuņģī ir cietas ieloces, kuras saraujoties saberž kukaiņus. Gremošanai piepalīdz kuņģī esošais nelielais daudzums ar smiltīm un augsni.[8] Papildus, lai arī skudrlācim kuņģī pašam neizdalās skābe, labākai sagremošanai noder kukaiņos esošās skābes.[10]
Lielais skudrlācis ir vienpatis, kas var būt aktīvs gan dienas laikā, gan naktī. Tas apdzīvo dažādus Centrālamerikas un Dienvidamerikas biotopus: lietus mežus, jauktu koku mežus, zāļainus līdzenumus un pussausus reģionus. Lielā skudrlāča apdzīvotās teritorijas lielums ir atkarīgs no tās ģeogrāfiskās atrašanās vietas. Piemēram, Brazīlijā Minasžeraisas štatā mātītes teritorija ir apmēram 3,67 km² liela, tēviņam 2,74 km². Citās Brazīlijas daļās lielajam skudrlācim var būt pat 9 km² liela platība. Toties Venecuēlā teritorija sasniedz 25 km².[11] Lielais skudrlācis parasti ir viens. Vairākus vienviet tos var ieraudzīt tikai pārošanās periodā un laikā, kad māte audzina mazuļus. Teritorija tiek iezīmēta ar ūrīnu un skrāpējumiem koka mizā.[12] Par gatavību pāroties mātīte paziņo, izdalot sekrētu no anālajiem dziedzeriem. Lielie skudrlāči spēj viens otru atpazīt pēc siekalu smaržas.[7] Satiekoties mātītes savstarpēji ir draudzīgākas un tolerantākas nekā tēviņi, līdz ar to mātītēm teritorijas pārklājas. Toties tēviņi satiekoties mēdz izkauties.[7]
2007. gada pētījumos Brazīlijā noskaidrojās, ka barību lielais skudrlācis galvenokārt meklē atklātās vietās, bet atpūšas mežā. Iespējams, ka šādu ieradumu var izskaidrot ar to, ka vēsās dienās mežā ir siltāks nekā atklātā vietā, bet karstās dienās mežā ir vēsāks.[13] Brazīlijā novērotajiem skudrlāčiem bija raksturīgs nakts dzīvnieku dzīves veids.Visaktīvākie tie bija nakts laikā un agri no rīta, ejot gulēt laikā, kad diena iesila. Toties aukstās dienās aktīvitāte pārceļas uz dienas laiku.[14] Iespējams, tā kā lielais skudrlācis izvairās no cilvēkiem, tad cilvēku mājokļu tuvumā tas kļūst par naktsaktīvu dzīvnieku. Kad lielais skudrlācis neguļ, tas visu laiku ar garo degunu osta zemi un nenogurdināmi meklē skudras.[15]
Atpūtai dzīvnieks izvēlas biezus krūmus vai garu zāli. Tas parasti zemē izrok seklu bedri vai arī izmanto cita dzīvnieka alu. Guļot tas saritinās kamolā un apsedzas ar savu lielo, pūkaino asti, kas ir tikpat gara kā ķermenis. Aste kalpo gan kā sega, gan kā papildus kamuflāžas elements. Lielais skudrlācis ir lielisks peldētājs un spēj pārpeldēt platas upes.[4] Tā dabīgie ienaidnieki ir jaguāri un pumas. Parasti no plēsējiem tas cenšas aizbēgt skrienot, bet, ja tiek panākts, lielais skudrlācis paceļas pakaļkājās un aizsargājas ar priekškājām, cērtot ar nagiem. Asie nagi ir draudīgs ierocis, jo ar tiem skudrlācis spēj jaguāru arī nogalināt.[16] Arī no cilvēkiem tas cenšas izvairīties bēgot, bet iedzīts stūri var sevi aizstāvēt. Ir zināmi vairāki gadījumi, kad lielais skudrlācis ir nopietni savainojis vai nogalinājis cilvēkus.[17]
Lielais skudrlācis ir kukaiņēdājs un galvenokārt barojas ar skudrām vai termītiem, bet tas barojas arī ar vaboļu kāpuriem un reizēm ar rāpuļu olām. Apvidos, kas regulāri applūst, piemēram, zāļainajos līdzenumos Venecuēlā lielais skudrlācis galvenokārt barojas ar skudrām, jo termītu šajos apvidos ir maz. Toties Emas Nacionālajā parkā Brazīlijā skudrlāči galvenokārt barojas ar termītiem, kas lielā daudzumā atrodami sausajā zālājā.[7] Barības meklējumos tas paļaujas galvenokārt uz labo ožu.[1] Lai piekļūtu termītu mājoklim, skudrlācis izmanto garos, stipros nagus, ar kuriem tas cietajā termītu celtnē izkasa caurumu. Mēlei šaudoties lielā ātrumā, skudrlācis uzlaiza bēgošos termītus un, lai arī skudrlācim nav zobu, ievelkot mēli, kukaiņi nonāk uz asajiem, ragveidīgajiem aukslēju izaugumiem un kā ar rīvi tiek saberzti.[6] Lai remdētu izsalkumu, lielajam skudrlācim dienā nepieciešamas aptuveni 35 000 skudras un termīti,[6] līdz ar to tas dienas laikā apmeklē apmēram 200 skudru pūžņus vai termītu mājokļus.[8]
Lielais skudrlācis labprāt barojas arī ar vaboļu un bišu kāpuriem. Termītu mājokļos bieži iekārtojas Eiropas medus bite. Ir novērots, ka lielais skudrlācis labprātāk izvēlas termītu mājokli ar bitēm nekā bez bitēm.[7] Ja tuvumā nav pieejama ūdenskrātuve, tad, lai padzertos, skudrlācis ar nagiem izrok iedobi, kas piepildās ar ūdeni. Šīs iedobes dzeršanai izmanto arī citi dzīvnieki.[18]
Lielajam skudrlācim nav noteikta pārošanās sezona.[7] Kad mātīte ir gatava pāropties, tā atstāj īpašās smaržu zīmes un tēviņs to atrod. Apmēram trīs dienas pāris pavada kopā, vairākas reizes sapārojoties. Šajā laikā tos var novērot barojoties pie viena termītu vai skudru pūžņa.[11] Pēc īsās kopdzīves pāris šķiras un mazuli audzina tikai mātīte.
Grūsnības periods ilgst 190 dienas.[11] Parasti piedzimst viens mazulis. Piedzimstot tas sver apmēram 1,4 kg. Tā acis ir ciet un tās atveras 6 dienu vecumā. Māte mazuli apmēram 9 mēnešus[6] nēsā uz savas muguras, kur tas ir grūti ieraugāms, jo mazuļa matojums saplūst ar mātes matojumu. Māte to zīda līdz 10 mēnešu vecumam, bet jau 3 mēnešu vecumā tas uzsāk baroties arī ar kukaiņiem. Māte ļoti rūpējas par savu mazuli, īpaši pirmajos trīs mēnešos. Apmēram mēneša vecumā mazulis iemācās lēkšot un sāk ik pa birdim pamest mātes muguru. Sasniedzot 9—10 mēnešu vecumu mazulis kļūst neatkarīgs un ciešās saites ar māti pamazām sāk irt, tomēr tie kopā paliek līdz jaunais skudrlācis sasniedz 2 gadu vecumu.[6] Dzimumbriedumu lielie skudrlāči sasniedz 2,5—4 gadu vecumā.[19] Nebrīvē lielais skudrlācis var dzīvot līdz 16 gadiem.[1]
Šādi 1921. gadā latviski izdotajā mācību grāmatā aprakstīts lielais skudrulācis: "LIELAIS SKUDRU ĒDĒJS (Skudru lācis) (Myrmecophaga jubata) (zīm. 38) ap 1 saženu gaŗš (ieskaitot ari asti). Ķermenis apklāts biezu gaŗu vilnu, kuŗa sevišķi gaŗa uz astes. Purns izstiepts gaŗā trubiņā, kuŗas galā atrodas mute; zobu pavisam nav. Mēle gaŗa un dzīvnieks to var izkārt no mutes ārā. Kājas īsas, muskuļainas: sevišķi spēcīgas ir priekškājas. Visi pirksti apbruņoti ar nagiem, kuŗi sevišķi gaŗi priekškājām. Pie iešanas pakaļkājas atspiežas uz visas pēdas, bet priekškājām pirksti noliekti uz leju, tā ka ejot dzīvniekam jasper uz delnas virspuses. Tāpēc iešana gausa un smaga, bet par to nagi nenodilst. Šis apstāklis no liela svara, jo skudru ēdēja galvenais ierocis ir nagi. Skudru ēdēji sastopami Dienvidus Amerikā, uz laupījumu iziet tikai naktī; pārtiek no skudrām un termitiem: ar saviem spēcigiem nagiem saplēš stiprās termitu būves un uzlasa kukainīšus ar gaŗo, lipigām slienām apklāto mēli. Neskatoties uz lielo spēku, skudru ēdēji miermīligi dzīvnieki, bet briesmu un vajadzības gadījumā spēj aizstāveties ari pret jaguaru."[20]
Šajos pašos reģionos dzīvo divas citas skudrlāču sugas: četrpirkstu tamandua (Tamandua tetradactyla) un pundurskudrlācis (Cyclopes didactylus).
Lielais skudrlācis jeb trīspirkstu skudrlācis (Myrmecophaga tridactyla) ir liela auguma nepilnzobju kārtas (Pilosa) zīdītājs. Tā ir vienīgā lielo skudrlāču ģints (Myrmecophaga) mūsdienās dzīvojošā suga. Lielais skudrlācis sastopams gan Centrālamerikas un Dienvidamerikas tropiskajos lietus mežos, gan sausajos krūmājos. Tā ir viena no četrām skudrlāču mūsdienās dzīvojošajām sugām. Atšķirībā no pārējām skudrlāču sugām, kas pilnībā vai daļēji uzturas kokos, lielais skudrlācis mājo uz zemes.
Saskaņā ar Starptautiskās dabas un dabas resursu aizsardzības savienības datiem lielais skudrlācis ir iespējami apdraudēta suga (angļu: vulnerable). Daudzās agrāk apdzīvotajās vietās tas ir izmiris un tikpat kā vairs nav sastopams Centrālamerikā. Galvenie iemesli sugas izmiršanai ir tā apdzīvotās vides izzušana, ugunsgrēki un malumedniecība.
De reuzenmiereneter (Myrmecophaga tridactyla), ook grote miereneter, mierenbeer of yoeroemi genoemd, is het grootste lid uit de familie der echte miereneters (Myrmecophagidae). De wetenschappelijke namen van de soort en het geslacht werden in 1758 simultaan gepubliceerd door Carl Linnaeus.[2] Hij plaatste ook de zuidelijke boommiereneter en de dwergmiereneter in het geslacht, maar die zijn in respectievelijk 1815 en 1821 in andere geslachten geplaatst. Sindsdien is de reuzenmiereneter nog de enige soort in het geslacht Myrmecophaga.
Miereneters hebben een lange, smalle snuit en een lange staart. Om hun scherpe klauwen niet door het lopen te laten slijten, lopen ze op hun polsen, met de scherpe klauwen naar binnen gevouwen. Een volwassen miereneter weegt 40 kilo en is 1 tot 2 meter lang.[3] De staart voegt hier nog 60 tot 90 cm aan toe. Een miereneter kan dus, van snuit tot staartpunt gemeten, ruim 2 meter lang zijn. Hij is bij de schouders ongeveer 60 cm hoog.
Een miereneter heeft korte oorschelpen, kleine ogen en een grijs-bruine vacht die uit korte, stevige haren bestaat. De kop is lichter van kleur dan de achterzijde. Een brede zwarte band, met een witte streep begrensd, begint op de borst, en loopt over de schouder naar zijn middel. Deze streep geeft een camouflage-effect.
De miereneter leeft van mieren en termieten. Hij gebruikt zijn scherpe klauwen om de mierennesten of holen open te scheuren, waarna hij z'n snuit naar binnen steekt. Met zijn 60 cm lange tong slurpt hij dan de mieren op. Door het kleverige speeksel blijven de dieren hier gemakkelijk op kleven. Hij steekt zijn tong soms wel 150 keer per minuut naar buiten, en eet daarmee tot 30.000 mieren per dag.
Miereneters hebben geen tanden. Wel zijn de speekselklieren goed ontwikkeld. Ze kauwen hun prooi met harde delen van hun gehemelte. De taak van het gebit is overgenomen door wrijfplaten in een gedeelte van de maag.
De miereneter krijgt per worp één jong. De moeder draagt dit in het lange haar op de rug. De draagtijd bedraagt 190 dagen.
De reuzenmiereneter wordt tot 25 jaar oud. Zijn natuurlijke vijanden zijn de jaguar en poema. Ze kunnen zich tegen deze dieren met hun scherpe klauwen verdedigen.
Bronnen, noten en/of referentiesDe reuzenmiereneter (Myrmecophaga tridactyla), ook grote miereneter, mierenbeer of yoeroemi genoemd, is het grootste lid uit de familie der echte miereneters (Myrmecophagidae). De wetenschappelijke namen van de soort en het geslacht werden in 1758 simultaan gepubliceerd door Carl Linnaeus. Hij plaatste ook de zuidelijke boommiereneter en de dwergmiereneter in het geslacht, maar die zijn in respectievelijk 1815 en 1821 in andere geslachten geplaatst. Sindsdien is de reuzenmiereneter nog de enige soort in het geslacht Myrmecophaga.
Kjempemaurslukeren (Myrmecophaga tridactyla) er den største av maurslukerne og av alle gomlerne. Arten finnes i Mellom- og Sør-Amerika, der den blant annet trives på cerradoen.
Kjempemaurslukeren har en lang, rørformet snute som utvider seg til et lit ansikt med bitte små ører og øyne. De kraftige forbeina og mindre bakbeina gir den en luntende gange, og den beskytter de store klørne på forbeina mot slitasje ved å gå på knokene.
Kjempemaurslukeren er aktiv både dag og natt, og vandrer hjemområdet, som kan dekke opptil 25 km², avhengig av mattilgangen. Kjempemaurslukeren sover i en grop eller i ly av en busk, med halen over hodet og kroppen.
Kjempemaurslukeren er truet av jakt og biotopødeleggelser.
Kjempemaurslukeren (Myrmecophaga tridactyla) er den største av maurslukerne og av alle gomlerne. Arten finnes i Mellom- og Sør-Amerika, der den blant annet trives på cerradoen.
Kjempemaurslukeren har en lang, rørformet snute som utvider seg til et lit ansikt med bitte små ører og øyne. De kraftige forbeina og mindre bakbeina gir den en luntende gange, og den beskytter de store klørne på forbeina mot slitasje ved å gå på knokene.
Kjempemaurslukeren er aktiv både dag og natt, og vandrer hjemområdet, som kan dekke opptil 25 km², avhengig av mattilgangen. Kjempemaurslukeren sover i en grop eller i ly av en busk, med halen over hodet og kroppen.
Kjempemaurslukeren er truet av jakt og biotopødeleggelser.
Mrówkojad wielki[4] (Myrmecophaga tridactyla) – gatunek ssaka z rodziny mrówkojadowatych[4][5]. Zwierzęta tego gatunku występują w Ameryce Środkowej i Południowej.
Średniej wielkości ssak o szarobrunatnym ubarwieniu z czarną szeroką pręgą biegnącą po bokach i przez pierś. Charakterystyczny, bardzo długi pysk zakończony jest małym otworem gębowym; brak zębów, długi (do 60 cm) i lepki język umożliwia wyciąganie mrówek i termitów z ich gniazd. Kończyny przednie przystosowane do grzebania, zaopatrzone w 4 pazury, z których 3 są duże i silne.
Zamieszkuje dżungle deszczowe, lasy mieszane, trawiaste równiny i stepy. Żyją samotnie, łączą się w pary tylko w okresie godów. Jeden osobnik, zależnie od ilości dostępnego pożywienia zajmuje obszar od 1 km²-2,5 km².
Odżywia się głównie żyjącymi w ziemi gatunkami mrówek. Termity lub mrówki wędrowne zjada bardzo rzadko. Wyszukuje mrowiska korzystając ze znakomitego węchu, następnie rozgrzebuje część mrowiska i za pomocą długiego, lepkiego języka wyciąga mrówki z wnętrza mrowiska. Nigdy nie niszczy całego mrowiska. Ponadto zjada również larwy owadów, owoce oraz ptasie jaja.
Mrówkojady tworzą pary tylko na czas godów. Ciąża trwa około 180 dni. Młode po urodzeniu samodzielnie wspina się na grzbiet matki, sierść noworodka ma taka samą strukturę i barwę jak matki, dzięki czemu jest słabo widoczne dla drapieżników. Młode jest karmione mlekiem matki przez 6 miesięcy. Po dwóch latach uzyskuje samodzielność.
Najrzadszy ze wszystkich mrówkojadów, zagrożony wyginięciem ze względu na zmiany środowiska.
Mrówkojad wielki (Myrmecophaga tridactyla) – gatunek ssaka z rodziny mrówkojadowatych. Zwierzęta tego gatunku występują w Ameryce Środkowej i Południowej.
Średniej wielkości ssak o szarobrunatnym ubarwieniu z czarną szeroką pręgą biegnącą po bokach i przez pierś. Charakterystyczny, bardzo długi pysk zakończony jest małym otworem gębowym; brak zębów, długi (do 60 cm) i lepki język umożliwia wyciąganie mrówek i termitów z ich gniazd. Kończyny przednie przystosowane do grzebania, zaopatrzone w 4 pazury, z których 3 są duże i silne.
O tamanduá-bandeira[3][4] (nome científico: Myrmecophaga tridactyla), também chamado bandeira,[5] bandurra,[3] iurumi,[6] jurumi, jurumim,[7] tamanduá-açu,[8] tamanduá-cavalo,[9] papa-formigas-gigante[10] e urso-formigueiro-gigante,[10][11] é uma espécie de mamífero xenartro da família dos mirmecofagídeos, encontrado na América Central e na América do Sul. É a maior das quatro espécies de tamanduás e, junto com as preguiças, está incluído na ordem Pilosa. Tem hábito predominantemente terrestre, diferente de seus parentes próximos, o tamanduá-mirim e o tamanduaí, que são arborícolas. O animal mede entre 1,8 e 2,1 metros de comprimento e pesa até 41 kg. É facilmente reconhecido pelo seu focinho longo e padrão característico de pelagem. Possui longas garras nos dedos das patas anteriores, o que faz com que ande com uma postura nodopedálica. O aparelho bucal é adaptado a sua dieta especializada em formigas e cupins, mas em cativeiro ele pode ser alimentado com carne moída, ovos e ração, por exemplo. A longa pelagem o predispõe a ser parasitado por ectoparasitas, como carrapatos.
É encontrado em diversos tipos de ambientes, desde savanas a florestas. Prefere forragear em ambientes abertos, mas utiliza florestas e áreas mais úmidas para descansar e regular a temperatura corporal. É capaz de nadar em rios amplos. Seus predadores incluem grandes felinos, como a onça-pintada e a suçuarana, e rapinantes podem predar filhotes. Apesar dos territórios individuais muitas vezes se sobreporem aos de outros, são animais primariamente solitários, sendo encontrados com outros somente em situações de cortejamento de fêmeas ou encontros agonísticos entre machos e fêmeas cuidando de filhotes. Se alimenta principalmente de formigas e cupins, utilizando suas garras para cavar e a língua para coletar os insetos.
O tamanduá-bandeira é listado como "vulnerável" pela IUCN. Foi extinto em algumas partes de sua distribuição geográfica, como no Uruguai, e corre grande risco de extinção na América Central. As principais ameaças à sobrevivência da espécie são a caça e a destruição do habitat, e é um animal susceptível a ser atingido fatalmente por incêndios e atropelamentos. Apesar do risco de extinção, pode ser encontrado em inúmeras unidades de conservação, onde muitas vezes é abundante. Sua morfologia peculiar chamou a atenção de diversos povos, como na bacia Amazônica, e até hoje é retratado por muitas culturas, seja de forma carismática ou aterrorizante.
"Tamanduá" origina-se do termo tupi tamãdu'á.[11] "Tamanduá-açu" significa, traduzido do tupi, "tamanduá grande".[12] "Iurumi" e "jurumim" vêm do termo tupi yuru'mi, que significa "boca pequena".[11][13] O nome popular de "tamanduá-bandeira" faz alusão à enorme cauda repleta de inúmeros pêlos compridos, associando-se portanto sua semelhança a uma "bandeira".[14] Essa característica da cauda é uma das que mais chamam a atenção em comunidades tradicionais do Brasil.[15]
O tamanduá-bandeira está incluído na família dos mirmecofagídeos (Myrmecophagidae) e único representante vivente do gênero Myrmecophaga que é mais relacionado ao gênero Tamandua, como evidenciado tanto por filogenias moleculares, quanto morfológicas.[16][17][18] Foi descrito por Carlos Lineu em 1758, e seu nome científico deriva do grego: Myrmecophaga significa "comedor de formigas" e tridactyla, "três dedos".[19] Três subespécies foram propostas: M. t. tridactyla (que ocorre da Venezuela e Guianas até o norte da Argentina), M. t. centralis (nativo da América Central, noroeste da Colômbia e norte do Equador) e M. t. artata (nativo do nordeste da Colômbia e noroeste da Venezuela).[1][20]
Durante a evolução, tamanduás e preguiças se separaram há cerca de 55 milhões de anos, entre o Paleoceno e Eoceno, sendo que entre Vermilingua, o gênero Cyclopes divergiu há cerca de 30 milhões de anos (no Oligoceno) e Tamandua e Myrmecophaga divergiram entre si há cerca de 10 milhões de anos, no Mioceno tardio.[21]
O registro fóssil dos tamanduás é esparso.[22] O gênero do Mioceno, Neotamandua, é o mais aparentado ao tamanduá-bandeira, e é difícil diferenciar morfologicamente o crânio de Neotamandua e Myrmecophaga.[16] Neotamandua era grande, maior que Tamandua, mas menor que Mymercophaga, e não possuía uma cauda preênsil, mas parecia ter patas intermediárias entre o tamanduá-bandeira e o tamanduá-mirim.[22] Provavelmente, Neotamandua borealis, um fóssil encontrado na Colômbia, no sítio paleontológico de La Venta, foi o ancestral do tamanduá-bandeira.[23]
O tamanduá-bandeira é o mais terrestre de todos os tamanduás, e seu ancestral provavelmente era arborícola, como o tamanduá-mirim: a expansão de ambientes abertos na América do Sul e consequente aumento de disponibilidade de insetos eussociais propiciaram o surgimento desta espécie já no fim do Pleistoceno e início do Holoceno.[16][22]
Relações filogenéticas do gênero Myrmecophaga[18] Pilosa FolivoraMyrmecophaga
Habita uma grande variedades de ambientes, desde florestas tropicais chuvosas até ambientes savânicos e campos abertos, sendo mais comuns nestes últimos.[2][24] Apesar disso, ainda são dependentes de ambientes florestados, pois utilizam a sombra das árvores como forma de compensar sua habilidade termorregulatória relativamente precária.[25][26] É possível encontrá-los em áreas cultivadas, como em culturas de Pinus e Acacia, embora isso se dê de forma eventual.[27][28]
Foi registrada sua presença desde Honduras na América Central, até o Chaco boliviano, Paraguai, Argentina e por todo o Brasil, sendo ausente na cordilheira dos Andes.[19][29] A presença dessa espécie a oeste dos Andes, no Equador, é controversa e necessita confirmação.[2] Historicamente, o limite norte de sua distribuição geográfica era Punta Gorda, na Baía de Honduras, em Belize, e o limite sul era Santiago del Estero, na Argentina.[19] A espécie já ocorreu em latitudes mais ao norte do que registrado historicamente, como evidenciado por um fóssil no noroeste de Sonora, no México.[30] O tamanduá-bandeira habitou essa região no início do Pleistoceno, época em que Sonora apresentava um clima mais úmido.[30] É considerado extinto em algumas regiões da América Central (está extinto em Belize e na Guatemala, provavelmente na Costa Rica e no Panamá ocorre apenas em localidades isoladas nas terras baixas do país), do Uruguai e sul do Brasil.[2][19][29]
Maior representante da família dos mirmecofagídeos, tendo entre 1,8 m e 2,1 m de comprimento e 41 kg de peso: as fêmeas são um pouco menores, pesando até 39 kg.[19][24][29] O crânio é alongado, chegando a 30 cm de comprimento.[31] Os olhos e as orelhas são pequenos em relação ao tamanho da cabeça, e possuem a visão e a audição precárias.[27][29] O olfato é desenvolvido se comparado ao dos humanos, sendo até 40 vezes mais apurado.[25] Podem viver até 25 anos em cativeiro.[32]
Possuem o dorso e a cauda marrons ou pretos, com membros anteriores brancos e membros posteriores pretos, com bandas pretas nos pulsos e duas bandas finas e brancas na altura dos ombros, de forma a aparecer uma outra faixa diagonal ampla, de cor preta.[29] Essa faixa diagonal varia de conformação entre indivíduos e pode servir na sua identificação.[27] Os pelos são longos, especialmente na cauda, o que dá a impressão dela ser muito maior do que realmente é.[29] Possui um tipo de crina ao longo das costas.[33] A musculatura do pescoço é desenvolvida em relação a das costas, e existe uma corcunda atrás do pescoço.[31] O dimorfismo sexual não é evidente, o que dificulta a determinação do sexo dos indivíduos, e o pênis e testículos são retraídos na cavidade pélvica, entre o reto e a bexiga urinária (uma condição denominada criptoquirdia).[33][34] O tamanduá-bandeira também possui uma temperatura corporal baixa para um mamífero, cerca de 33 °C.[25]
Ao contrário do que sugere o nome científico, possuem cinco dedos, entretanto, quatro dedos nas patas anteriores possuem garras, que são particularmente alongadas em três dedos.[33] Os tamanduás tendem a andar sobre os nós dos dedos (nodopedalia), especialmente como observado em gorilas e chimpanzés, devido ao longo comprimento de suas garras: apoiam-se principalmente nos três dedos do meio, e as articulações metacarpofalangeanas são estendidas e as interfalangeanas são dobradas.[35][36] Ao contrário dos membros anteriores, os membros posteriores possuem garras curtas, de forma que o movimento é típico de um animal plantígrado.[19]
O tamanduá-bandeira possui 60 cromossomos, e seu genoma tem cerca de 4391 Mbp ou 4.49 pg de tamanho.[37][38] O cromossomo X é grande e metacêntrico, enquanto o cromossomo Y é o menor de todos os cromossomos e é acrocêntrico.[37] Comparado ao tamanduá-mirim e o tamanduaí, o tamanduá-bandeira possui um "grupo extra" de cromossomos acrocêntricos (Grupo V).[37] Garcia et al (2005) identificaram seis marcadores de microssatélites para a espécie.[39] Em 2007, descobriu-se elementos transponíveis no genoma, retrotransposóns pertencentes à família MyrSINE, sendo que MyrSINE-c é exclusivo do tamanduá-bandeira.[40]
O tamanduá se alimenta exclusivamente de formigas e cupins, o que acaba conferindo uma anatomia bastante peculiar e especializada na exploração desse recurso alimentar, que apesar de abundante, é muito pouco explorado por outras espécies de mamíferos.[27] O tamanduá não possui dentes e sua mandíbula possui pouca mobilidade. Isto se deve à rotação das duas metades de sua mandíbula, unidas por um ligamento na ponta e estabilizadas pelos músculos da mastigação.[31][41] A depressão da mandíbula acaba por criar uma abertura grande o suficiente para a protrusão da língua, que possui até 60 cm de comprimento e a ponta arredondada.[31][33] É coberta por papilas curvadas para trás e uma saliva viscosa, produzida pelas glândulas salivares, o que permite a coleta de insetos.[42]
A forma tubular de seu crânio limita também os movimentos de protrusão da língua, que durante a alimentação, pode ocorrer até 160 vezes por minuto, proeza possível graças à musculatura associada ao hióide: este osso também possui uma conformação diferente dos outros xenartros, pois possui articulações sinoviais, permitindo certa liberdade de movimento.[31] O músculo bucinador permite a retração da língua sem que sejam perdidos os insetos coletados.[31] Os músculos do hióide e o palato secundário mantêm a língua na orofaringe, de forma a evitar que ela bloqueie a respiração.[31] Essa retração é auxiliada pelo músculo esternoglosso, que é formado pela fusão do músculo esterno-hióideo e hioglosso e não ligado ao hióide.[31] Dessa forma, a língua é ligada ao esterno.
Antes dos insetos serem engolidos, eles são esmagados no palato, e seu estômago, como a moela nas aves, possui paredes duras e realiza contrações vigorosas, de forma a moer os insetos ingeridos.[31][42] A digestão é auxiliada pela ingestão de porções de terra e areia.[33] O próprio ácido das presas ingeridas é utilizado para fazer a digestão, já que o tamanduá não é capaz de produzir o seu próprio.[42]
São geralmente solitários, ocupando áreas de até 11,9 km² (como mostrado em estudos feitos com animais monitorados no Pantanal) mas geralmente, seus territórios são menores do que isso.[2][43][44] A área de vida de vários tamanduás pode se sobrepor, aumentando a densidade por km².[44] Apesar de serem mais ativos no fim da tarde, podem iniciar suas atividades mais cedo, e serem totalmente diurnos em dias mais frios.[45] Podem se tornar noturnos em ambientes mais perturbados pelo homem.[19][43]
Tamanduás são capazes de nadar, inclusive, em rios amplos, e já foram observados se banhando.[19][46] Também escalam árvores quando estão à procura de alimento.[47] Não cavam túneis, e para descansar podem cavar pequenas depressões no solo.[48] Costumam dormir curvados, usando a cauda como um manto, provavelmente para se proteger do frio e como camuflagem.[48]
As vocalizações são poucas e o tamanduá adulto é tido como um animal silencioso.[19] Foi reportada a emissão de sons parecidos com rugidos em encontros agonísticos entre machos e o filhote emite assobios agudos para se manter em contato com a mãe.[19][49]
Eventualmente, a onça-pintada e a suçuarana são predadores dos tamanduás (até 3,2 % dos animais abatidos pela onça-pintada são tamanduás, como observado no Pantanal),[50] que geralmente fogem desses felinos, mas podem atacá-los com as garras caso estejam acuados.[51][52] Aves de rapina podem predar filhotes.[27]
A pelagem desenvolvida predispõe o tamanduá à ocorrência de ectoparasitas, como carrapatos, principalmente do gênero Amblyomma.[19] Amblyomma nodosum é especialista em parasitar o tamanduá-bandeira.[53][54] A predominância de cada uma das espécies de carrapatos encontrados no pelo do tamanduá-bandeira varia de região para região, pois Amblyomma nodosum, Amblyomma cajennense e Amblyomma parvum são comuns no Pantanal mato-grossense[55] e A. calcaratum, A. pseudoconcolor e A. maculatum são encontrados nos indivíduos residentes em Minas Gerais.[56] Em cativeiro, foi observado um caso de tamanduás em um zoológico nos Estados Unidos que foram parasitados por Pulex simulans, que geralmente parasita gambás e guaxinins.[57] Outro sifonáptero, que parasita seres humanos, Tunga penetrans, foi encontrado em três indivíduos atropelados em Minas Gerais.[58]
Além de ectoparasitas, foi reportada a presença de parasitas do trato gastro-intestinal, como nemátodos e cestóides. No Brasil, as espécies de nemátodos observadas são do gênero Aspidospera, Brevigraphidium, Caenostrongylus, Graphidiops, Physaloptera e Trifurcata.[19] O gênero de cestóide, Mathevotaenia, foi encontrado em um de três espécimes analisados por Martinez et al (1999).[19] Gigantorhynchus echinodiscus é uma espécie de Acanthocephala que teve ovos encontrados em coprólitos de tamanduá no Piauí.[59]
Em cativeiro, também foi constatado a presença de parasitas intestinais, a maioria nemátodos, sendo o gênero Trichuris e Strongyloides os mais comuns.[60] Isso se reflete na alta taxa de distúrbios gastro-intestinais relatados em animais em cativeiro (cerca de 20%), principalmente por conta da infestação de parasitas intestinais (foi constatado em 48% dos indivíduos analisados no Zoológico de São Paulo).[60] O tamanduá-bandeira é bastante suscetível a contrair salmonelose.[60] Foi reportado um caso de infecção por Entamoeba e Acanthamoeba em uma fêmea em cativeiro, que também tinha apresentado cardiomiopatia e úlcera gástrica.[61]
A área de vida varia em tamanho dependendo do local. No Parque Nacional da Serra da Canastra, as fêmeas possuem um território por volta de 3,67 km² e os machos de 2,74 km².[43] Em outras regiões do Brasil, eles podem viver em áreas de até 9 km². Na Venezuela, foram reportadas áreas de vida de até 25 km².[43] Indivíduos são encontrados quase que exclusivamente sozinhos, com exceção de fêmeas com filhotes e machos que estão cortejando fêmeas.[44] Em cativeiro, os tamanduás podem se tornar mais sociáveis uns com os outros, mas não é recomendado deixar muitos animais no mesmo viveiro.[62][63] A comunicação entre os indivíduos se dá por meio de sinais odoríferos produzidos em glândulas perto do ânus.[28] O tamanduá parece capaz de reconhecer a saliva de outros pelo cheiro.[25][28] A marcação do território também é feita por meio de arranhões em troncos de árvores e esse comportamento parece diretamente relacionado à sobreposição de áreas de vida e o acasalamento.[27][28]
As fêmeas são mais tolerantes entre si, e por isso seus territórios acabam se sobrepondo sobre o de outras.[44] Ao contrário, os machos se envolvem em comportamentos agonísticos com muito mais frequência.[43] Ao reconhecer outro tamanduá como oponente, os dois animais iniciam exibições, andando em círculos com a cauda levantada.[49] Esses comportamentos são acompanhados pela emissão de sons parecidos com rugidos.[49] Podem chegar à luta propriamente dita, e o agressor ataca a face do outro com as garras das patas anteriores: o animal agredido foge, e pode ser perseguido por alguns metros pelo agressor, que mantém a cauda levantada e apresenta piloereção.[49] O comportamento do animal submisso é diferente do animal dominante, que além de fugir, pode exibir posturas e comportamentos de defesa, sentando sobre as ancas e mantendo a cauda abaixada, achatada no chão, enquanto emite sons parecidos com rosnados.[64]
O tamanduá-bandeira é um dos mais especializados predadores que existem, se alimentando quase que exclusivamente de formigas e cupins, e o forrageamento é o comportamento mais frequentemente observado, tanto para animais em liberdade, quanto em cativeiro.[63] Dados de animais coletados no Pantanal mostram que eles costumam forragear em campos na bordas de lagoas e pastagens e muito pouco dessa atividade é realizada dentro de florestas e ambientes mais fechados.[26][65] Existe uma preferência entre as espécies de formigas e cupins que são predadas, levando-se em consideração o valor nutricional, disponibilidade e a resposta de suas presas ao ataque.[66] Essa preferência de espécies é observada tanto em cativeiro quanto em liberdade, mas elas podem diferir nas duas situações.[66] Estudos na Argentina mostraram que o tamanduá-bandeira se alimenta primariamente de formigas do gênero Solenopsis, Camponotus e Iridomyrmex.[19] O gênero Solenopsis é o mais predado pelos tamanduás que vivem no Pantanal.[65] Quanto aos gênero de cupins, Nasutitermes e Cornitermes são os ingeridos por animais na Argentina.[19] No Parque Nacional da Serra da Canastra, os tamanduás se alimentam principalmente de formigas na estação chuvosa (outubro a março) e de cupins, na estação seca (maio a setembro).[25] Observa-se, também, que o tamanduá pode diferir sua dieta, de acordo com a região que habita: em áreas que passam por inundações periódicas, como nos llanos, na Venezuela, a dieta é basicamente de formigas, ao passo que no Parque Nacional das Emas, no estado de Goiás, no Brasil, os cupins são a base da alimentação.[25][66]
Procuram suas presas por meio do cheiro, e podem visitar vários formigueiros em um dia (mais de 200), se alimentando de até mais de 30 000 indivíduos por dia.[32][33] Passam pouco tempo em cada ninho de forma a fugir de ataques dos insetos.[66] Algumas espécies de cupins são especializadas em se proteger de ataques do tamanduá, e muitos indivíduos conseguem fugir enquanto o tamanduá cava.[66] Podem se alimentar de larvas de besouro e abelhas que tenham colocado suas colmeias em cupinzeiros.[25]
Em cativeiro, o tamanduá pode se alimentar de itens que geralmente não ingere na natureza: muitas vezes são dados misturas de alimentos feitos com ovos, leite, bicho-da-farinha e carne moída.[51] Já foi observado tamanduás se alimentando de filhotes de camundongo quando em cativeiro.[67] Fica evidenciado, que apesar da alta especialização na dieta e na clara preferência por formigas e cupins, existe algum grau de variabilidade e de predação oportunista por parte desses animais.[67] Para beber, tamanduás podem cavar buracos quando não existem fontes de água na superfície.[46]
É uma espécie que não possui estação de acasalamento, se reproduzindo durante o ano todo, e tendo vários partos ao longo do ano.[68] Entretanto, em cativeiro, há uma sazonalidade na corte e nascimento de filhotes.[27] A taxa de mortalidade da prole em cativeiro é alta, como constatado com dados coletados em zoológicos no Brasil, entre 1990 e 2000: a taxa de mortalidade chegou a 47% nesse período.[62] Muitos morrem nas primeiras 24 horas de vida.[62] Foi verificado que a gestação dura cerca de 184 dias.[68] Dão a luz a um filhote de cada vez, que pesa cerca de 1,4 kg, e fazem isso em pé.[25][33][69] No período de cortejamento, em que se observa macho e fêmea interagindo, o macho segue e cheira a fêmea e podem se alimentar no mesmo cupinzeiro ou formigueiro.[43] Durante a cópula, a fêmea põe-se de lado, enquanto o macho a monta.[70] Podem copular várias vezes ao dia durante o período em que o casal se mantém junto.[25]
A fêmea carrega o filhote nas costas, que muitas vezes é camuflado pela pelagem da mãe.[33][51] Isso evita que a cria seja predada, principalmente por rapinantes.[27] Estudos feitos em semi-cativeiro mostram que o filhote nasce com olhos fechados e os abre após 6 dias e só passa a ingerir alimentos sólidos depois de três meses de idade: até essa idade, o cuidado da fêmea é alto e declina após esse período, cessando quando o filhote alcança dez meses de idade.[19][33][71] A mãe tem o hábito de lamber o filhote, principalmente o focinho e a língua.[71] Alcançam a maturidade sexual entre 2,5 a 4 anos de idade.[36][51]
A espécie é considerada como "vulnerável" pela União Internacional para a Conservação da Natureza e dos Recursos Naturais (IUCN), pois apesar de sua ampla distribuição e habitar inúmeras unidades de conservação, como o Parque Nacional das Emas e o Parque Nacional da Serra da Canastra, no Brasil, existem várias extinções locais, como em Belize, Guatemala, Costa Rica, Uruguai e sul do Brasil.[2][32] As populações estão diminuindo, e geralmente é tido como uma espécie incomum ou rara nos locais em que habita.[2] Apesar do conhecimento de uma tendência no tamanho das populações, nunca foram feitas estimativas do número de indivíduos existentes.[19] Está em todas as listas de animais em risco de extinção nos países em que é nativo e no apêndice II da Convenção sobre o Comércio Internacional das Espécies da Fauna e da Flora Silvestres Ameaçadas de Extinção (CITES), considerando que ele não necessariamente corre risco de extinção, mas que se deve evitar abusos em relação às populações para que não entre em processo de extinção.[2] Existem programas de reprodução em cativeiro nos Estados Unidos e no Brasil, como no Zoológico de São Paulo.[19][62]
Na Argentina, é considerado como "em perigo" e sua ocorrência está cada vez mais restrita ao norte, pois já se extinguiu nos limites sul desse país.[72] No Brasil, a lista do ICMBio o classifica como "vulnerável",[73] mas regionalmente sua situação varia, como por exemplo: no Rio Grande do Sul e no Paraná é considerado "criticamente em perigo"; em Santa Catarina, no Rio de Janeiro e Espírito Santo está provavelmente extinto; em São Paulo está "em perigo" e no Pará é considerado "vulnerável".[27][74][75][76] Deve-se ressaltar que, visto a situação dessa espécie no sul do Brasil, Argentina e sua extinção no Uruguai, a espécie corre grave risco de desaparecimento nos limites sul de sua distribuição geográfica.[27] Se extinguiu em algumas regiões do Paraguai, principalmente no leste e sudeste do país, mas ainda são abundantes no Chaco.[19]
São abundantes em algumas unidades de conservação no cerrado, mas foi observado que no Parque Nacional das Emas, as taxas de endocruzamento são altas, evidenciando certa depressão de consanguinidade.[77] Isso se deve a inúmeras mortes por conta de incêndios na década de 1990 e do isolamento dessa unidade de conservação, visto o alto grau de desmatamento do cerrado no entorno do parque.[77] Os incêndios são particularmente problemáticos para os tamanduás, mesmo em áreas preservadas, já que amostras de mamíferos mortos nestas ocasiões mostram uma suscetibilidade dessa espécie a ser atingida fatalmente pelo fogo: no Parque Nacional das Emas, em 1994, foi reportado que 340 tamanduás foram mortos atingidos pelo fogo.[78]
A fragmentação do habitat, como observado no bioma da Mata Atlântica no estado do Espírito Santo, no Brasil, tem um efeito significativo na sobrevivência do tamanduá-bandeira.[79] Essa espécie não foi encontrada em fragmentos de floresta menores que 200 ha, visto que pequenos remanescentes não parecem suficientes para manter populações residentes viáveis.[79] Apesar de preferir áreas abertas, é necessário que sejam conservadas as áreas florestadas em sua ocorrência, já que a espécie depende de tais áreas para descansar e regular a temperatura corporal.[26]
É caçado em algumas regiões da América do Sul, como na Bolívia, tanto por esporte, como para subsistência, e também para fins de fabricação de equipamento de hipismo.[80] Na Venezuela é caçado por conta de suas garras.[80] Em áreas mais povoadas, além da alteração do habitat, atropelamentos são fatores que causam uma diminuição nos índices de abundância, como relatado em localidades do interior do estado de São Paulo.[24] A predação por animais domésticos (como cães) também é um problema em áreas próximas a habitações humanas.[24][81]
Na mitologia e folclore de povos da Bacia Amazônica, o tamanduá é um trickster, possuindo características contrárias à da onça-pintada (vista como símbolo do sexo, reprodução e fuga da morte), sendo considerado, muitas vezes, uma figura de humor, por conta de seu focinho longo.[82][83] Em um conto do povo Shipibo-conibo, um tamanduá desafiou uma onça em ficar mais tempo debaixo d'água sem respirar, e na ocasião, após a onça aceitar e submergirem, o tamanduá roubou a pele da onça como travessura, e deixou sua pele para o grande felino: a partir de então, a onça e o tamanduá passaram a ser inimigos.[83] Em um mito Yarabara, o ogro Ucara é transformado em um tamanduá pelo sol.[83] O mito enfatiza o fato de que ser um tamanduá é um fardo, já que ele não consegue abrir a boca.[83] Os índios Caiapós utilizam máscaras de animais, incluindo de tamanduás, em suas cerimônias de iniciação.[84] Acredita-se que a mulher que tocar na máscara, ou o homem que tropeçar ao vesti-la, morrerá em breve ou sofrerá de algum defeito físico.[84]
Comunidades tradicionais atuais do Brasil ainda conservam lendas e mitos sobre o tamanduá-bandeira, a maior parte deles de forma negativa: essa espécie muitas vezes é retratada como um animal feroz, capaz de sufocar um ser humano com seu focinho e até mesmo de matar uma onça-pintada com suas garras.[15] Alguns consideram como sinal de "má sorte".[15] Esses são mitos derivados da cultura indígena e no fascínio causado pela sua morfologia peculiar, principalmente a cauda cheia de pelos, o focinho longo e as garras compridas, e não refletem fatos reais observados sobre tamanduás.[15] Tal visão negativa pode atrapalhar em esforços na preservação da espécie.[15]
Durante a colonização espanhola da América, o tamanduá-bandeira foi um dos animais mais capturados para ser mostrado na Europa.[85] Inicialmente, acreditavam que todos eram fêmeas e que copulavam com o focinho, erro corrigido pelo naturalista Félix de Azara.[85] No século XX, Salvador Dalí escreveu que o tamanduá-bandeira "alcança tamanhos maiores que de um cavalo, possui enorme ferocidade, tem excepcional força muscular, é um animal aterrorizante".[86] Dalí representou um tamanduá no estilo de O Grande Masturbador.[86] Foi usado como ex libris por André Breton, que comparou as tentações que um homem pode experimentar em vida ao que "a língua do tamanduá oferece às formigas".[86]
Em 1940, o cartoon de Max Fleischer, Ants in the plants, mostra uma colônia de formigas lutando contra um vilão tamanduá. Lançado durante a Guerra de Mentira, o filme faz alusão à Linha Maginot.[87] Um tamanduá também é referenciado na tira de quadrinhos B.C. Este personagem foi inspiração para Peter the Anteater, o mascote do time UC Invirne Anteaters.[88] A animação em Flash, Happy Tree Friends, mostra um tamanduá chamado Sniffles. Na minissérie de Stephen King, Kingdom Hospital, o personagem Antubis aparece na forma de uma criatura parecida com um tamanduá com dentes afiados.[89] Na década de 1990, o tamanduá-bandeira foi representado na moeda de 10 cruzeiros reais, que circulou entre 1993 e 1994 no Brasil.[90]
|isbn= (ajuda) O tamanduá-bandeira (nome científico: Myrmecophaga tridactyla), também chamado bandeira, bandurra, iurumi, jurumi, jurumim, tamanduá-açu, tamanduá-cavalo, papa-formigas-gigante e urso-formigueiro-gigante, é uma espécie de mamífero xenartro da família dos mirmecofagídeos, encontrado na América Central e na América do Sul. É a maior das quatro espécies de tamanduás e, junto com as preguiças, está incluído na ordem Pilosa. Tem hábito predominantemente terrestre, diferente de seus parentes próximos, o tamanduá-mirim e o tamanduaí, que são arborícolas. O animal mede entre 1,8 e 2,1 metros de comprimento e pesa até 41 kg. É facilmente reconhecido pelo seu focinho longo e padrão característico de pelagem. Possui longas garras nos dedos das patas anteriores, o que faz com que ande com uma postura nodopedálica. O aparelho bucal é adaptado a sua dieta especializada em formigas e cupins, mas em cativeiro ele pode ser alimentado com carne moída, ovos e ração, por exemplo. A longa pelagem o predispõe a ser parasitado por ectoparasitas, como carrapatos.
É encontrado em diversos tipos de ambientes, desde savanas a florestas. Prefere forragear em ambientes abertos, mas utiliza florestas e áreas mais úmidas para descansar e regular a temperatura corporal. É capaz de nadar em rios amplos. Seus predadores incluem grandes felinos, como a onça-pintada e a suçuarana, e rapinantes podem predar filhotes. Apesar dos territórios individuais muitas vezes se sobreporem aos de outros, são animais primariamente solitários, sendo encontrados com outros somente em situações de cortejamento de fêmeas ou encontros agonísticos entre machos e fêmeas cuidando de filhotes. Se alimenta principalmente de formigas e cupins, utilizando suas garras para cavar e a língua para coletar os insetos.
O tamanduá-bandeira é listado como "vulnerável" pela IUCN. Foi extinto em algumas partes de sua distribuição geográfica, como no Uruguai, e corre grande risco de extinção na América Central. As principais ameaças à sobrevivência da espécie são a caça e a destruição do habitat, e é um animal susceptível a ser atingido fatalmente por incêndios e atropelamentos. Apesar do risco de extinção, pode ser encontrado em inúmeras unidades de conservação, onde muitas vezes é abundante. Sua morfologia peculiar chamou a atenção de diversos povos, como na bacia Amazônica, e até hoje é retratado por muitas culturas, seja de forma carismática ou aterrorizante.
Jättemyrsloken (Myrmecophaga tridactyla eller M. jubata) är den största representanten för myrslokarna. Det är den enda arten i släktet Myrmecophaga.
Arten förekommer i Central- och Sydamerika från Honduras norra gräns till norra Argentina.[1]
Habitatet utgörs bland annat av träskmark och skogar men talrikast är arten i savannen.
Jättemyrsloken kan bli 1,2 meter lång (exklusive svansen) och 60 cm hög vid manken. Den yviga svansen blir 65 till 90 centimeter lång. Vikten ligger mellan 18 och 39 kilogram.[2]
Påfallande är den långa smala nosen som inhyser en lång tunga. Den kan sträckas ut upp till 610 mm, däremot har den bara en diameter på 10 till 15 mm.[3] Ögonen och öronen är jämförelsevis små. Pälsens grundfärg är gråbrun och vid bröst samt skuldran finns svart-vita mönster. De främre extremiteterna är vitaktiga med en svart teckning vid vristen. De bakre extremiteterna och svansens päls är mörkare än övriga kroppen. De främre fötterna har fem tår och vid de tre mellersta tårna finns förlängda klor (epitet för det vetenskapliga namnet syftar på detta särdrag: tridactylus - tretåig). Även de bakre extremiteterna har fem tår med korta klor.[2]
Jättemyrsloken bor ovan mark. Den går på fötternas kanter för att inte skada klorna. Individerna är vanligen aktiva på dagen men i områden där många människor lever är de aktiva på natten.[3] För att vila gömmer de sig i tät vegetation eller i naturliga grottor men de bygger inga egna bon. Djuret är inte aggressivt men kan försvara sig väl med sina vassa klor om det skulle bli attackerat. Vanligtvis tar de till flykten. Bland artens naturliga fiender finns jaguaren och puman.[2]
Varje individ lever ensam i ett revir som har en storlek upp till 9 000 hektar. Utanför parningstiden är vuxna jättemyrslokar aggressiva mot varandra eller undviker kontakt.[3]
Jättemyrsloken är en tandlös art som äter termiter och myror. För att öppna stacken använder den sina skarpa klor. Den täta pälsen skyddar arten mot insekternas syra. Enligt olika studier kan de äta upp till 35 000 termiter eller myror per dag. I enstaka fall äter de även larver av skalbaggar eller frukter. I djurparker får de oftast en blandning av mjölk och ägg samt larver av vanlig mjölbagge (Tenebrio molitor) och köttfärs.[3]
Honor kan para sig hela året. Det kortaste avståndet man konstaterat mellan två födslar var nio månader. Dräktigheten varar i cirka 190 dagar och sedan föds ett enda ungdjur. Ungen väger ett till två kilogram och klättrar efter födelsen på moderns rygg. Den stannar där 6 till 9 månader och kommer bara ner för att dia. Ungdjuret avvänjs efter 2 till 6 månader och efter ungefär två år är det självständigt. Efter tre till fyra år är ungdjuret könsmoget. Den äldsta kända individen i fångenskap blev 26 år gammal. Livslängden i naturen är okänd.[2]
Arten hotas av förstöringen av levnadsområdet samt av jakt. Dessutom dör många individer i trafiken. Mellan 2006 och 2010 listades arten av IUCN som nära hotad men sedan 2010 klassas den åter som sårbar (vulnerable).[1] Beståndets minskning var inte tillräcklig tydlig för en högre skyddsnivå.
Jättemyrsloken (Myrmecophaga tridactyla eller M. jubata) är den största representanten för myrslokarna. Det är den enda arten i släktet Myrmecophaga.
Büyük karıncayiyen (Myrmecophaga tridactyla), Orta ve Güney Amerika'ya özgü büyük böcekyiyen bir memeli türüdür. Yaşayan dört karıncayiyen türünden biridir ve tembel hayvanlar ile birlikte Dişsiz memeliler takımında sınıflandırılır. Ağaçlarda yaşayabilen diğer karıncayiyen ve tembel hayvan türleri ile karşılaştırıldığında bu tür daha çok yerde yaşamaktadır. Evrimsel olarak dağılımında Güney Amerika'da savanların yayılması etkili olmuş olabilir. Boyu 182 ila 217 cm ve ağırlığı erkeklerde 33 ila 41 kg, dişilerde ise 27 ila 39 kg arasında olan büyük karıncayiyen kendi familyası içinde en büyük türdür. Uzunca burnu, uzun tüylü kuyruğu, uzun ön pençeleri ve kıllarının kendine özgü renkleri ile kolayca ayırt edilebilir.
Büyük karıncayiyen, aralarında savanlar ve yağmur ormanlarının da bulunduğu çeşitli doğal ortamlarda yaşar. Açık alanlarda beslenirken daha ağaçlık alanlarda da dinlenir. Asıl olarak uzun ön pençeleriyle topraktan kazıp çıkardığı karınca ve termitleri uzun ağzı ve yapışkan dili yardımıyla toplayarak beslenir. Birbirine geçen alanlarda yalnız olarak yaşarlar ancak ana-yavru ilişkisi sırasında, yetişkin erkekler arasında görülen saldırgan etkileşimler de ve çiftleşme dönemlerinde bir araya gelirler. Ana karıncayiyenler, yavruları sütten kesilene kadar onları sırtlarında taşır.
Büyük karıncayiyen Dünya Doğa ve Doğal Kaynakları Koruma Birliği (IUCN) tarafından soyunun tükenme riski yüksek olduğundan ötürü hassas türler arasında listelenmiştir. Daha önceden doğal olarak bulunduğu bazı bölgelerde, yerel olarak soyu tükenmiştir. Buralarda özel olarak koruma altındaki bölgelerde yaşamlarında devam edebilmektedirler. Belirgin dış özellikleri ve göze çarpan davranışları nedeniyle büyük karıncayiyen Kolomb öncesi Amerika kültürlerinin mitlerinde ve folklorunda bulunduğu gibi popüler kültürde de yer almaktadır.
Büyük karıncayiyen türünün binominal adı Carl Linnaeus tarafından 1758 yılında verilmiştir. Cins adı olan Myrmecophaga Grekçe "karınca" anlamına gelen μύρμηξ ve "yemek" anlamına gelen φαγεῖν kelimelerinden türetilmiştir ve "karıncayiyen" demektir. Epitet adı olan tridactyla da yine Grekçe "üç" anlamına gelen τρία ve "parmak" anlamına gelen δάχτυλο kelimelerinden türetilmiştir ve "üç parmaklı" demektir.[1] Epitet adı, ön ayakları dört parmaklı olan tamandualardan ayırmak için kullanılmıştır. Myrmecophaga jubata adı da sinonim olarak literatürde yer almıştır. Üç alt türe ayrılması önerilmiştir: M. t. tridactyla (Venezuela ve Guyanalardan Arjantin'in kuzeyine), M. t. centralis (Orta Amerika, Kolombiya'nın kuzeybatısı ve Ekvador'un kuzeyi) ve M. t. artata (Kolombiya'nın kuzeydoğusu ve Venezuela'nın kuzeybatısı). Büyük karıncayiyen, kısmen ağaçlarda yaşayan kuzey tamanduası ve güney tamanduası ile birlikte Karıncayiyengiller (Myrmecophagidae) familyasında sınıflandırılmıştır. Karıncayiyengiller familyası içinde bir tek Cyclopes didactylus türünü barındıran Cylopedidae familyası ile birlikte Vermilingua alt takımını oluşturur.[2]
Karıncayiyenler ve tembel hayvanlar dişsiz memeliler (Pilosa) takımını oluşturur ve zırhlı memeliler (Cingulata) takımı ile birlikte Xenarthra üst takımında sınıflandırılırlar. Dişsiz memeliler ve zırhlı memeliler takımları 65 milyon yıl önce, Tebeşir Dönemi'nin son kısmında ayrılmıştır. Karıncayiyenler ve tembel hayvanlar ise 55 milyon yıl önce, Paleosen ile Eosen dönemleri arasında birbirlerinden ayrışmışlardır. Cyclopes soyu 30 milyon yıl önce Oligosen'de ortaya çıkarken Myrmecophaga ve Tamandua soyları ise 10 milyon yıl önce Miyosen'in son kısmında ayrışmıştır.[3] Karıncayiyenler Senozoik Çağ'ın büyük bölümünde o zamanlar bir ada-kıta olan Güney Amerika'da kalmış ve başka kıtalara yayılamamıştır. Yaklaşık üç milyon yıl önce Panama Kıstağı'nın oluşmasıyla birlikte karıncayiyengiller familyasındaki üç tür de Orta Amerika'ya yayılmıştır.[4]
Karıncayiyenlere ait fosil buluntuları çok azdır.[5] Fosil buluntularının arasında Cyclopes didactylus türünün yakın akrabası olan Palaeomyrmidon cinsinin Pliyosen dönemine ait kalıntıları; Büyük karıncayiyen ve tamanduaların en yakın akrabası olan Protamandua cinsinin Miyosen dönemine ait kalıntıları ve Myrmecophaga cinsinin en yakın akrabası olan Neotamandua cinsinin kalıntıları sayılabilir.[6] Protamandua, C. didactylus'tan daha büyük ama tamanduadan daha küçük yapılı iken daha büyük olan Neotamandua boy olarak tamandua ile büyük karıncayiyen arasındaydı. Protamandua'nın ayakları karada ya da ağaçta yaşam için uyum sağlamamıştır ancak kuyruğu maymunlar gibi tutma özelliğine sahipti. Neotamandua'nın kuyruğunda bu özellik yoktu ancak ayaklarının gelişimi tamandua ile büyük karıncayiyen arasındaydı.[5] Neotamandua borealis türü büyük karıncayiyenlerin atası olarak önerilmiştir.[7]
Büyük karıncayiyen, yaşayan karıncayiyen türleri arasında karada yaşamaya en çok uyum sağlamış olan türdür. Ataları ağaçta yaşamaya uyum sağlamış olabilir[6] ancak karada yaşama sağladıkları uyum Güney Amerika'da savanlar gibi açık alanların yayılmasına ve büyük potansiyel bir besin kaynağı olan termit gibi böcek kolonilerinin yaygınlığına bağlanmaktadır. Hem büyük karıncayiyen hem de güney tamanduası türlerine ait fosil kalıntıları Buzul Çağı ve Holosen dönemlerine ait buluntularda yaygın olarak görülmektedir.[5]
Büyük karıncayiyen iri cüssesi, uzun ağzı burnu ve uzun kuyruğu ile kolayca ayırt edilebilir.[8] Gövde uzunluğu 182 ila 217 cm. arasındadır. Erkeklerin ağırlığı 33 ila 41 kg., dişilerin ağırlığı ise 27 ila 39 kg. arasında değişir.[1] İçinde bulunduğu Vermilingua alt takımının yaşayan en büyük üyesidir. Yaklaşık 30 cm. uzunluğundaki kafası, diğer karıncayiyenler ile karşılaştırıldığında bile oldukça uzundur.[9] Ucunda küçük ağzı ve burun delikleri bulunan boru şeklinde burnu kafasının büyük kısmını oluşturur. Gözleri ve kulakları görece küçüktür.[1] Görme duyusu çok gelişmemiştir[8] ancak koku alma duyusu insanlardan 40 kat daha güçlüdür.[10] Büyük karıncayiyenler, esaret altında 16 yıl kadar yaşayabilmektedir.[8]
Diğer memelilerin aksine karıncayiyenlerin, özellikle de büyük karıncayiyenlerin boyunları enselerinden daha kalındır.[9] Boyunlarının arka kısmında küçük bir kambur vardır. Büyük karıncayiyenin kılları genellikle gri ve gri ile karışık beyaz renklidir. Ön ayakları beyaz renklidir ve ön ayak bileklerinin çevresinde kara halkalar bulunur. Arka ayakları ise koyu renklidir. Kenarları beyaz olan kalın koyu renkli kuşaklar boğazdan omuza doğru uzanır. Kuyruk kahverengidir. Uzun kılları kuyrukta daha da uzundur öyle ki kuyruğu olduğundan büyük gösterir. Sırtı boyunca yer alan kıllar serttir.[1] Bu dikkat çekici ve ayırt edici kıl renk düzeninin kesintili kamuflaj olduğu düşünülmekteydi ancak 2009 yılında yapılan bir çalışma bunun uyarıcı renklenme olduğunu önermektedir.[11] Erişkin erkekler dişilere göre görece daha iri olmalarına ve başları ile boyunlarının daha geniş olmasında rağmen, dışarıdan bakarak cinsiyet tespiti kolay değildir. Erkeklerin penisi ve testisleri gövde içine çekili olarak rektum ile idrar kesesi arasında yer alır. Dişilerin koltuk altlarına yakın yerde yer alan bir çift meme bezi bulunur.[12]
Büyük karıncayiyenin kaburgaları geniştir. Epitet adına rağmen her ayağında beş parmağı bulunur. Ön ayağının dört parmağında pençe vardır ve özellikle ikinci ile üçüncü parmakları uzundur.[12] Büyük karıncayiyen, özellikle goril ve şempanze gibi primatlara benzer şekilde eklemleri üzerinde yürür. Bu şekilde yürürken pençeleri engel teşkil etmez. Ağırlığın çoğunu taşıyan orta parmaklar metakarpofalangeal eklemler kısmında uzamış ve interfalangeal eklemler kısmında da bükülmüştür.[13] Arka ayaklarda ise beş parmakta da kısa pençeler bulunur ve ayak tabanına basarak yürürler.[1] Toprağı kazıp, avını yakalayıp dışarı çeken büyük karıncayiyenlerin büyümüş supraspinöz çukuru teres majör kasına daha büyük bir kaldıraç etkisi sağlayarak ön uzuvların çekme gücünü artırır ve triceps brachii kası ön ayakların kalınlaşmış üçüncü parmağını bükmeye yardımcı olur.[14]
Büyük karıncayiyen yaklaşık 33 °C'lık düşük bir vücut ısısına sahiptir.[10] Diğer memelilerin ortalama vücut ısısı 36 ila 38 °C arasındadır. Xenarthra üst takımında yer alan memeliler genellikle diğer memelilere göre daha düşük bir bazal metabolizmaya sahiptirler ve bu özelliklerinin yedikleri besinler ve düşük hareketlilikleri ile bağlantılı olduğu görülür.[15]
Büyük karıncayiyenin dişleri yoktur ve çene hareketleri kısıtlıdır. Ağzını açıp kapamak için, ucunda bir bağ doku ile birbirne bağlı olan alt çenenin iki yarısının dönme hareketini kullanır.[9] Bu hareketi sağlamak için de görece az gelişmiş olan[9] çiğneme kaslarından yararlanır.[16] Çene boşluğu, ince uzun dilin dışarı çıkabileceği kadar genişlikte bir boşluktan ibarettir. Tipik olarak 60 cm. uzunluğunda olan dil[1] tabanı yuvarlak, uca doğru üçgenleşen bir yapıya sahiptir ve küçük ucu yuvarlaktır.[9] Dilin üzerinde geriye doğru kıvrılan papillalar vardır ve üzeri büyük tükürük bezlerinden salgılanan ve karıncayiyene böcekleri diliyle toplamaya olanak veren koyu ve yapışkan salya ile kaplıdır.[17]
Boru şeklindeki rostrum ve küçük ağız dilin yalnızca ileri geri hareket etmesine olanak verir. Beslenme sırasında dil yaklaşık dakikada 160 kere dışarı-içeri hareket eder. Bu hareketler büyük karıncayiyenin uzun ve esnek hiyoid aparatının tek kası tarafından sağlanır. Hayvan başının konumundan yararlanarak dili ile hedefine ulaşır. Tamamen dışarı çıktığında dil 45 cm. uzaklığa erişebilir ki bu kafatasından daha uzun bir mesafedir. Buccinator kasları sayesinde diline yapışmış olan besinleri kaybetmeden dili geri çeker ve dili tekrar dışarı çıkarırken ağzını büzerek besinlerin dışarı kaçmasını engeller. Dil geri çekildiğinde orofarenkste hiyoid kasları sayesinde ve ikincil damakta tutulur ve nefes almayı engellenmez. Dilin geri çekilmesine sternohiyoid kas ile hiyoglossal kasın birleşmesinden oluşan ve hyoide bağlanmayan uzun sternoglossal kas yardımcı olur.[9] Dolayısıyla dil doğrudan sternuma bağlıdır.[18]
Karıncayiyenler diğer memelilerden daha çok yutkunurlar, hatta sürekli yutkunma hareketi yaparlar denebilir.[9] dilleriyle yakaladıkları böcekler yutulmadan önce damak sayesinde ezilirler.[17] Karıncayiyenin midesinde, kuşların taşlığında olduğu gibi sertleşmiş kıvrımlar bulunur ve sert kasılmalarla midede böcekler öğütülür. Sindirim işlemine yutulan az miktarda kum ve toprak da yardımcı olur.[12] Karıncayiyenin midesi asit üretemez ve avladığı besinlerin formik asidini sindirim için kullanır.[17]
Büyük karıncayiyen Orta ve Güney Amerika'ya özgü bir hayvandır. Honduras'tan Arjantin'in kuzeyine kadar olan bölgeye dağılmış durumdadır. Fosil kalıntıları en kuzeyde, Meksika'da Sonora'nın kuzeybatısına kadar olan bölgede bulunmuştur.[4] And Dağları'nın çok büyük bir kısmında bulunmaz[1] ve Uruguay'da da soyu tükenmiştir. Belize, Kosta Rika ve Guatemala'da da soyunun tükendiği düşünülmektedir. Tropikal yağmurormanları ve çöller[8] gibi çeşitli doğal yaşam alanlarında, hayatta kalmasını sağlayacak besin bulunduğu takdirde yaşadığı görülebilmektedir.[19]
Büyük karıncayiyen, Dünya Doğa ve Doğal Kaynakları Koruma Birliği tarafından bölgesel olarak soyunun tükenmesi nedeniyle korunmasız türler arasında listelenmiştir. Ayrıca Nesli Tehlike Altında Olan Yabani Hayvan ve Bitki Türlerinin Uluslararası Ticaretine İlişkin Sözleşme'nin EK II'sinde ticaretine sınırlamalar getirilmiştir.[20] Toplam popülasyonu 2000 ile 2010 yılları arasında %30 azalmıştır. 1994 yılında Brezilya'da Emas Ulusal Parkında çıkan çalı yangınları sırasında 340 kadar karıncayiyen ölmüştür.[21] Bu hayvan özellikle yavaş hareket yeteneği ve kolayca yanabilen kılları nedeniyle yangınlara karşı korumasızdır.[1]
İnsanlardan kaynaklanan tehditler arasında araç kazaları, köpekler tarafından saldırıya uğrama ve doğal yaşam alanı kaybı sayılabilir. Büyük karıncayiyen Bolivya'da hem spor amaçlı hem de eti için yaygın olarak avlanmaktadır. Kalın derisi Gran Chaco'da binicilik ekipmanları yapmak için kullanılır. Venezuela'da pençeleri için avlanır.[19] Tehlikeli bir hayvan sanıldıkları için güvenlik amaçlı olarak da öldürülürler. Aslında büyük karıncayiyenler çok sakin hayvanlardır ve rahatsız edilmedikleri sürece insana bir tehdit oluşturmazlar.[1] Ancak 2007 yılı Nisan ayında Buenos Aires yakınlarında bir hayvanat bahçesinde bir büyük karıncayiyen bakıcı Melisa Casco'ya saldırmış ve ön pençeleri ile ayaklarını ve karnını yarmıştır. Bakıcı, ayağının kesilmesi için yapılan cerrahi müdahaleden sonra ölmüştür.[22][23] Büyük karıncayiyen geniş bir alana dağılmıştır. Bazı popülasyonlar dengelidir ve Amazon ile Cerrado'da birçok koruma altına alınmış alanda bulunmaktadırlar.[19] Arjantin'in bazı eyaletlerinde resmî olarak koruma altına alınmıştır.
Büyük karıncayiyen değişik doğal yaşam alanlarında bulunabilir. Brezilya'da Pantanal'da yapılan 2007 tarihili bir araştırma sonucunda bu hayvanların genellikle açık alanlarda beslendikleri ve ormanlık alanlarda dinlendikleri gözlemlenmiştir.[24] Bunun sebebi ormanlık alanların açık alanlardan serin günlerde daha sıcak, sıcak günlerde de daha serin olmasıdır.[24] Büyük karıncayiyenler hem gündüzcül hem de gececil olabilir. Pantanal'da 2006 yılında yapılan bir araştırma sonucunda büyük karıncayiyenlerin çoğunlukla gececil olduğu yani geceleri ve sabah erken saatlerde aktif oldukları ve sıcaklık arttıkça dinlenmeye çekildikleri gözlemlenmiştir. Daha serin günlerde ise aktif oldukları saatleri öne çekmekte ve gündüzcül olabilmektedirler.[25]
Büyük karıncayiyenler tipik olarak yoğun çalılıklar arasında dinlenir ancak serin günlerde uzun otlar arasında da dinlenirken görülebilirler. Uyumak için toprakta sığ bir çukur kazarlar. Hayvan uyurken kıvrılarak yatar ve kuyruğunu gövdesinin üzerine örter. Kuyruk hem vücut ısısını korumaya yarar hem de kamuflaj sağlar. Güneşli bir sabah günü rtam sıcaklığı 17 °C iken bir büyük karıncayiyenin kuyruğunu üzerine örtmeden uyuduğu gözlemlenmiştir. Bunun sebebibin güneş ışınlarından yararlanmak olduğu sanılmaktadır.[26]
Büyük karıncayiyenler iyi yüzerler ve geniş nehirleri geçebilirler.[1] Yıkandıkları gözlemlenmiştir.[27] Aynı zamanda tırmanabildikleri de gözlemlenmiştir. Besin ararken ağaçlara ve termit yuvalarına tırmanabilmektedirler. Bir bireyin ayaklarının ucunda yükselip bir ağaç dalına tutunduğu gözlemlenmiştir.[28]
Büyük karıncayiyenlerin içinde yaşadıkları alanların büyüklüğü bölgeden bölgeye değişiklik gösterir. Brezilya'da Serra da Canastra Ulusal Parkında dişi büyük karıncayiyenlerin yaklaşsık 3,67 km²'lik alanlarda dolaştıkları gözlemlenirken erkeklerin dolaşma alanı yaklaşık 2,74 km²'dir. Brezilya'nın diğer bölgelerinde yaşam alanı büyüklüğü 9 km²'ye çıkabilmektedir. Venezuela'da yaşan büyük karıncayiyenlerin 25 km²'lik yaşam alanları olduğu kaydedilmiştir.[29] Bireyler çoğunlukla tek olarak yaşar. Ancak yavrularını emziren dişiler ve dişilere kur yapan erkekler bir arada görülür. Büyük karıncayiyenler anal bezlerinden çıkan salgılarla varlıklarını, statülerini ve cinsel durumlarını bildirirler. Aynı zamanda ağaç kabuklarına bıraktıkları iz ve idrar yoluyla da diğer bireylere varlıklarını bildirirler.[30] Birbirlerinin tükürüklerini koku yoluyla tanıyabilmektedirler.[10]
Dişiler diğer dişilere karşı, erkeklerin diğer erkeklere karşı olduğunan daha toleranslıdırlar ve bu sayede dişilerin yaşam alanları birbirleriyle daha çok örtüşür. Erkekler ise karşılaştıklarında birbirlerinin çevresinde yavaşça dönme, kovalama ve kapışma gibi saldırgan davranışlar gösterebilirler.[10] Birbirlerinin çevresinde dolanan karıncayiyenler harrr şeklinde uzun süren bağırışlar çıkarabilirler. Dövüşürken birbirlerine pençeleri ile saldırır ve yerde güreşirler.[1] Dövüşen karıncayiyenler kükreme ve böğürtü şeklinde sesler çıkarabilirler.[29] Erkeklerin yaşam alanlarını savundukları muhtemeldir.[10]
Büyük karıncayiyen özellikle karınca ve termitlerle beslenen bir böcekçildir. Mevsimsel olarak sel alan Venezuela'nın llanos bölgeleri gibi otlak açık alanlarda karıncayiyenler termitlerin az bulunması nedeniyle çoğunlukla karınca ile beslenir.[10] Buna karşın Brezilya'da Emas Ulusal Parkında yaşayan karıncayiyenler bu bölgede yoğun olarak bulunması nedeniyle çoğunlukla termitlerle beslenirler.[31] Serra da Canastra'da ise karıncayiyenler yağmurlu mevsimde karınca, kurak mevsimde ise termitlerle beslenirler.[10]
Büyük karıncayiyenler avlarını koku yoluyla izlerler.[8] Bir yuva bulduktan sonra hayvan ön pençeleri kullanarak yuvayı açar ve uzun yapışkan dilini yuvanın içine sokarak avını toplar. Bir karıncayiyen bir yuvada beslenmek için yaklaşık bir dakikalık bir zaman geçirir ve günde 200 kadar yuva ziyaret ederek yaklaşık 30.000 birey ile beslenir.[12] Karıncayiyen bir yuvadan, asker karınca ya da termitlerin kimyasal saldırıları ya da ısırmaları nedeniyle uzaklaşmak zorunda kalabilir.[8] Bazı termit türleri güçlendirilmiş yuvaları sayesinde karıncayiyen yuvayı kazmaya çalışırken kaçabilmektedir.[31] Bu tarz savunma mekanizmaları sayesinde bir kere de tüm koloninin yem olmasının önüne geçilebilmektedir.[10]
Diğer besinleri arasında, termit yuvalarına yuvalanan kın kanatlılar ve bal arısı larvaları sayılabilir. Karıncayiyenler, üzerinde bal arısı yuvası bulunan termit yuvalarına da saldırabilmektedir.[10] Esaret altındaki karıncayiyenlere süt, yumurta, un kurdu ve öğütülmüş etten oluşan karışımlar besin olarak verilir.[32] Etrafında açık su kaynağı yoksa karıncayiyen suya ulaşmak için toprağı kazar ve böylece diğer hayvanların kullanabilmesi için su kaynağı da oluşturmuş olur.[27]
Büyük karıncayiyenler, jaguar ve pumalar tarafından avlanmaktadır. Tipik olarak tehlikeden kaçmak için seğirterek koşarlar ancak köşeye sıkıştırıldıklarında[32] arka ayakları üzerinde dikilerek saldıran hayvana ön pençeleri ile karşılık verirler.[33] Büyük karıncayiyenlerin ön pençeleri bir jaguarı öldürebilecek kadar tehlikelidir.[34]
Büyük karıncayiyenler yıl boyunca çiftleşebilirler.[10] Kur yapma sırasında, erkek kızgınlığa girmiş olan dişiyi takip ederek onu koklar. Erkek ve dişi çiftin aynı böcek yuvasından beslendikleri görülmüştür.[29] Çiftleşme sırasında erkek yere yan yatan dişinin üzerine çıkar. Çift üç gün bir arada kalabilir ve bu süre boyunca çeşitli sayıda çiftleşebilir.[10] Gebelik 190 gün kadar sürer[29] ve tek yavrunun doğumuyla sonlanır.[12] Yavrunun doğduğu sırada ağırlığı 1,4 kg. civarındadır.[34] Dişiler ayakta iken doğururlar.[10]
Gözleri kapalı doğan yavru altı gün geçtikten sonra gözünü açar. Anne karıncayiyen kendisine bağımlı olan yavrusunu sırtında taşır.[32] Yavrunun siyah ve beyaz çizgileri annesinin çizgileri ile bir bütün oluşturarak kamufle olmasına yardımcı olur.[12] Yavru annesi ile tiz ıslıklar sayesinde iletişim kurar ve beslenirken dilini kullanır. Üç aylık iken yavru katı besin yemeye başlar ve on aylık iken tamamen sütten kesilir. Anne, dinlenirken yavrusunu bir saat kadar temizler. Temizleme ilk üç ay boyunca yoğun olarak devam eder ve yavru dokuz aylığa erişinceye kadar devam eder, on aylık olduğunda tamamen kesilir. Bu sürecin azalması anne ile yavru arasındaki bağın azalması ile aynı zamandadır. Genç karıncayiyenler dokuz ila on aylık oldujklarında kendi başlarına yaşamaya başlarlar.[1] Büyük karıncayiyenler 2,5 ila 4 yaş arasında cinsel olgunluğa erişirler.[32]
Amazon Havzası yerlilerinin mitolojisi ve folklorunda genellikle büyük karıncayiyen jaguarın işini bozan hilebaz arketipiyle ve uzun burnu nedeniyle de bazen de mizahi bir figür olarak yer bulur. Peru'nun Amazon ormanlarında yaşayan Şipibo Kızılderililerine ait bir masalda, büyük karıncayiyen jaguarı su altında kim daha çok nefes tutar diye iddiaya sokar. İki hayvan da postlarını çıkararak suya dalar ama hemen sudan dışarı çıkan büyük karıncayiyen jaguarın postunu çalarak jaguara kendi postunu bırakır. Bir Yaraba mitinde ise kötü canavar Ucara Güneş tarafından büyük karıncayiyene dönüştürülür. Bu mitte karıncayiyenin çok az hareket edebilen ağzına ve bunun getirdiği yüke vurgu yapılmaktadır.[35] Amazon ormanlarında yaşayan Brezilya Kızılderililerinden Kayapo halkı isim verme ve ergenliğe geçiş töreni sırasında aralarında büyük karıncayiyenin de olduğu çeşitli hayvan ve ruhların masklarını takar. Büyük karıncayiyen maskına dokunan kadınların ve bu maskı taktığı sırada tökezleyen erkeklerin öleceğine ya da önemli bir fiziksel rahatsızlık geçireceğine inanılır.[36]
Amerika kıtasının İspanyollar tarafından kolonileştirilmesi sırasında büyük karıncayiyen gösteri amacıyla Avrupa'ya götürülen yerel hayvanlardan biriydi. Başlarda Avrupalılar tüm karıncayiyenlerin dişi olduğunu ve üremek için uzun burunlarıyla çiftleştiklerini sanıyordu. Bu yanlış inanış doğabilimci Félix de Azara tarafından düzeltilmiştir.[37] 20. yüzyılda, Salvador Dalí hayalî olarak büyük karıncayiyenin "attan daha büyük boyutlara eriştiğini, aşırı derecede vahşi olduğunu, muhteşem bir kas gücüne sahip olduğunu ve çok korkutucu bir hayvan olduğunu" yazmıştır. Dalí El gran masturbador tarzı ile bir karıncayiyen deseni yapmıştır. Bu desen, insanların yaşam içindeki deneyimlerini "karıncayiyenin dilinin karıncalara sunduğu cazibe" Tamanoir[›] ile kıyaslayan André Breton tarafından ex libris olarak kullanılmıştır.[38][39]
Max Fleischer tarafından 1940 yılında yapılan Ants in the Plants çizgi filminde kötü bir karıncayiyen ile savaşan bir karınca kolonisi konu alınmıştır. Tuhaf Savaş sırasında yayımlanan bu çizgi filmin Fransızların Majino Hattı'nı ima ettiği düşünülmektedir.[40] Büyük karıncayiyen B.C. adlı çizgi romanda sık sık görülen bir karakterdir. Stephen King'in Kingdom Hospital adlı televizyon dizisinde Antubis karakteri ustura keskinliğinde dişleri olan karıncayiyen benzeri bir yaratık olarak gözükür.[41]
|eser= dış bağlantı (yardım) |eser= dış bağlantı (yardım) Büyük karıncayiyen (Myrmecophaga tridactyla), Orta ve Güney Amerika'ya özgü büyük böcekyiyen bir memeli türüdür. Yaşayan dört karıncayiyen türünden biridir ve tembel hayvanlar ile birlikte Dişsiz memeliler takımında sınıflandırılır. Ağaçlarda yaşayabilen diğer karıncayiyen ve tembel hayvan türleri ile karşılaştırıldığında bu tür daha çok yerde yaşamaktadır. Evrimsel olarak dağılımında Güney Amerika'da savanların yayılması etkili olmuş olabilir. Boyu 182 ila 217 cm ve ağırlığı erkeklerde 33 ila 41 kg, dişilerde ise 27 ila 39 kg arasında olan büyük karıncayiyen kendi familyası içinde en büyük türdür. Uzunca burnu, uzun tüylü kuyruğu, uzun ön pençeleri ve kıllarının kendine özgü renkleri ile kolayca ayırt edilebilir.
Büyük karıncayiyen, aralarında savanlar ve yağmur ormanlarının da bulunduğu çeşitli doğal ortamlarda yaşar. Açık alanlarda beslenirken daha ağaçlık alanlarda da dinlenir. Asıl olarak uzun ön pençeleriyle topraktan kazıp çıkardığı karınca ve termitleri uzun ağzı ve yapışkan dili yardımıyla toplayarak beslenir. Birbirine geçen alanlarda yalnız olarak yaşarlar ancak ana-yavru ilişkisi sırasında, yetişkin erkekler arasında görülen saldırgan etkileşimler de ve çiftleşme dönemlerinde bir araya gelirler. Ana karıncayiyenler, yavruları sütten kesilene kadar onları sırtlarında taşır.
Büyük karıncayiyen Dünya Doğa ve Doğal Kaynakları Koruma Birliği (IUCN) tarafından soyunun tükenme riski yüksek olduğundan ötürü hassas türler arasında listelenmiştir. Daha önceden doğal olarak bulunduğu bazı bölgelerde, yerel olarak soyu tükenmiştir. Buralarda özel olarak koruma altındaki bölgelerde yaşamlarında devam edebilmektedirler. Belirgin dış özellikleri ve göze çarpan davranışları nedeniyle büyük karıncayiyen Kolomb öncesi Amerika kültürlerinin mitlerinde ve folklorunda bulunduğu gibi popüler kültürde de yer almaktadır.
Довжина його тіла досягає 110–130 см. Зовнішній вигляд мурахоїда, як і інших представників неповнозубих, вельми химерний: довга вузька морда, що нагадує трубку, крихітні вузькі очі, довгий, стиснутий зі сторін хвіст з урахуванням шерсті в довжину досягає 95 см, а то й більше. Вага дорослої особини — до 40 кг, загальна довжина тіла від носа до кінчика хвоста — близько 2,3 м.
Гігантський мурахоїд веде наземний спосіб життя. На відміну від карликового мурахоїда, він не вміє лазити по деревах. Як і його деревні родичі, він активний переважно вночі, але в безлюдних місцях нерідко блукає і вдень. Спить до 16 годин на добу. Ходити по землі, маючи такі довгі кігті, важко, тож мурахоїди змушені підгинати кігті та спиратися на тильний бік передніх лап. Зате такими кігтями легко захищатися від хижаків — одним ударом лапи великий мурахоїд здатний випатрати собаку. Навіть ягуар — найбільший хижак Південної Америки — воліє не мати справи з цими тваринами.
Живиться мурахоїд мурахами та термітами. Зруйнувавши кігтями термітник або мурашник, він приступає до трапези. Мурахоїд викидає 60-сантиметровий язик, змочений липкою слиною, частотою у 160 разів на хвилину, добуваючи за день до 30 000 комах. Також нещодавно було встановлено, що мурахоїди можуть живитися і плодами пальмового дерева, розриваючи плід гострими кігтями, добуваючи таким чином собі вологу та вітаміни.
Самиці мурахоїда — турботливі матері, вони носять на спині єдине чадо і не розлучаються з ним від народження й до наступної вагітності. Завдяки забарвленню, подібному до материнського, дитинча майже непомітне.
Гігантський мурахоїд — рідкісна тварина, занесена до Червоного списку МСОП — статус «вразливий».
Thú ăn kiến khổng lồ còn được gọi là gấu kiến (danh pháp hai phần: Myrmecophaga tridactyla) là một loài động vật có vú thuộc chi đơn loài Myrmecophaga trong họ Myrmecophagidae, bộ Pilosa. Loài này được Linnaeus mô tả năm 1758.[4]
Đây là một loài động vật có vú ăn côn trùng lớn có nguồn gốc từ Trung và Nam Mỹ. Đây là một trong bốn loài sống của thú ăn kiến và được phân loại với các loài lười trong bộ Thú thiếu răng. Loài thú ăn kiến này sống trên mặt đất không giống như những loài bà con với nó sinh sống trên cây hoặc vừa ở trên cây vừa ở trên mặt đất. Tiến hóa của nó có thể đã bị ảnh hưởng bởi sự mở rộng của các thảo nguyên ở Nam Mỹ.
Thú ăn kiến khổng lồ là loài thú ăn kiến lớn nhất trong họ Myrmecophagidae cũng như cả phân bộ thú ăn kiến, thân dài 182–217 cm và cân nặng 33–41 kg (73-90 lb) đối với con đực và 27–39 kg (60-86 lb) đối với con cái. Nó có mõm thon dài, đuôi rậm, vuốt trước dài.
Thú ăn kiến có thể được tìm thấy nhiều trong môi trường sống bao gồm đồng cỏ và rừng nhiệt đới. Nó kiếm ăn trong khu vực mở và dựa chủ yếu vào môi trường sống rừng. Nó ăn chủ yếu là kiến và mối, sử dụng vuốt trước để đào chúng lên và cái lưỡi dài và dính để thu lấy con mồi.
Mặc dù thú ăn kiến khổng lồ sống trong phạm vi lãnh địa chồng chéo, chúng chủ yếu sống đơn độc ngoại trừ trong mối quan hệ mẹ-con cái, tương tác gây hấn cực giữa các con đực, và khi giao phối. Thú ăn kiến mẹ mang con cái của chúng trên lưng của họ cho đến khi cai sữa.
Thú ăn kiến khổng lồ được liệt kê là loài sắp nguy cấp bởi Liên minh Quốc tế Bảo tồn Thiên nhiên (IUCN). Nó đã bị tuyệt diệt ở một số phần của môi trường sống trước đây của nó. Các mối đe dọa đến sự tồn tại của nó bao gồm phá hủy môi trường sống và săn bắn, mặc dù một số loài ăn kiến sống trong các khu vực được bảo vệ.
Thú ăn kiến khổng lồ còn được gọi là gấu kiến (danh pháp hai phần: Myrmecophaga tridactyla) là một loài động vật có vú thuộc chi đơn loài Myrmecophaga trong họ Myrmecophagidae, bộ Pilosa. Loài này được Linnaeus mô tả năm 1758.
Myrmecophaga tridactyla
Linnaeus, 1758
Гигантский (трёхпалый, большой) муравьед[1] (лат. Myrmecophaga tridactyla) — самый крупный представитель в отряде неполнозубых, длина его тела достигает 110—130 см. Внешний вид муравьеда, как и других представителей неполнозубых, весьма причудлив: длинная узкая морда, напоминающая трубку, крошечные узкие глаза, длинный, сжатый со сторон хвост с учётом шерсти достигает 95 см, часто несколько больше. Зубы отсутствуют. Масса взрослой особи — до 40 кг, общая длина тела от носа до кончика хвоста — порядка 2,3 м.
Гигантский муравьед ведёт наземный образ жизни. В отличие от карликового муравьеда, он не умеет лазать по деревьям. Как и его древесные родственники, он активен преимущественно ночью, но в безлюдных местах нередко бродит и днём. Спит до 16 часов в сутки. Ходить по земле, имея такие длинные когти, трудно, и муравьеды вынуждены подгибать когти и опираться на тыльную сторону передних лап. Когтями легко защищаться от врагов — одним ударом лапы большой муравьед способен выпотрошить собаку.
Питается муравьед муравьями и термитами. Разрушая когтями термитник или муравейник, он приступает к трапезе. Муравьед выбрасывает 60-сантиметровый язык, смоченный липкой слюной, со скоростью 160 раз в минуту, добывая за день 30 000 насекомых. Также недавно[когда?] было установлено, что муравьеды могут питаться и плодами пальмового дерева, разрывая плод острыми когтями, добывая таким образом себе влагу и витамины.
Самки муравьеда носят на спине единственного детёныша и не расстаются с ним от рождения до следующей беременности. Благодаря окраске, схожей с материнской, детёныш почти незаметен.
Гигантский муравьед — редкое животное, занесённое в Международную Красную Книгу.
Гигантский (трёхпалый, большой) муравьед (лат. Myrmecophaga tridactyla) — самый крупный представитель в отряде неполнозубых, длина его тела достигает 110—130 см. Внешний вид муравьеда, как и других представителей неполнозубых, весьма причудлив: длинная узкая морда, напоминающая трубку, крошечные узкие глаза, длинный, сжатый со сторон хвост с учётом шерсти достигает 95 см, часто несколько больше. Зубы отсутствуют. Масса взрослой особи — до 40 кг, общая длина тела от носа до кончика хвоста — порядка 2,3 м.
大食蟻獸(學名:Myrmecophaga tridactyla)是異關節總目披毛目食蟻獸的一種,為一種大型的食蟲動物,和樹懶為近親。分布在中美洲與南美洲部份地區,生活在草地、落葉林和雨林地區。主要以螞蟻和白蟻為食,一天最多可食30,000隻昆蟲[3]。
大食蟻獸在現存四種食蟻獸中體型最大的成員,體長可達 182~217 cm(5.97~7.12英尺)。雄性體重通常為 33~41公斤(73~90磅),雌性則為 27~39公斤(60~86磅)[4]。體毛長而堅硬,可長40釐米,尾部密生长毛[5],头细长,眼耳极小并吻成管状,无齿,舌细长并能伸缩,借以舐食蚁类、白蚁及其他昆虫。前肢除第五指外,均具钩爪,后肢短,五爪大小相仿。体灰白色,背面两侧有宽阔的黑色纵纹,纹的边缘白色。大食蟻獸為獨居動物,個體之間少有互動,少數例外為:雄性之間的示威、交配、以及養育後代。雌性大食蟻獸會將幼仔背在背上活動。
大食蟻獸被國際自然保護聯盟列為易危物種,在許多地區面臨局部地區滅絕。大食蟻獸所面臨的威脅包括棲息地喪失以及盜獵取得其毛皮與肉。
包括兩個亞種:
大食蟻獸的頭顱長達 30 cm(12英寸)[6],即使和食蟻獸比起來仍然特別細長[7],管狀的口鼻部佔了大部分。大食蟻獸的眼睛與耳朵很小[4],視力不好,但嗅覺的敏感度為人類的 40 倍[8]。在人工飼育的環境下,大食蟻獸的可活約 16 年[5]。
大食蟻獸的前後足均有五趾,其中前足有四趾帶爪,第二與第三趾上的爪子長度最長[3]。大食蟻獸用指節著地的形式行走,類似於現今的大猩猩、黑猩猩,以及已滅絕的大地懶與爪獸,可以避免其長爪因接觸到地面而磨損。主要承受重量的第三趾,具有延長的掌指關節(英语:Metacarpophalangeal joint),可彎曲於指骨間關節(英语:Interphalangeal joints of the hand)[9]。和前足不同,大食蟻獸的後足五趾上均具有短爪,為躑行動物(英语:Plantigrade)[4]。大食蟻獸擴大的棘上窩(英语:Supraspinatous fossa)給予大圓肌(英语:Teres major muscle)更多的附著點,強化前足回拉的力量。而三頭肌則提供前足第三趾彎曲的力量[10],這些肌肉可以幫助大食蟻獸挖掘並破壞白蟻的蟻塚(英语:Mound-building termites)。
大食蟻獸(學名:Myrmecophaga tridactyla)是異關節總目披毛目食蟻獸的一種,為一種大型的食蟲動物,和樹懶為近親。分布在中美洲與南美洲部份地區,生活在草地、落葉林和雨林地區。主要以螞蟻和白蟻為食,一天最多可食30,000隻昆蟲。
大食蟻獸在現存四種食蟻獸中體型最大的成員,體長可達 182~217 cm(5.97~7.12英尺)。雄性體重通常為 33~41公斤(73~90磅),雌性則為 27~39公斤(60~86磅)。體毛長而堅硬,可長40釐米,尾部密生长毛,头细长,眼耳极小并吻成管状,无齿,舌细长并能伸缩,借以舐食蚁类、白蚁及其他昆虫。前肢除第五指外,均具钩爪,后肢短,五爪大小相仿。体灰白色,背面两侧有宽阔的黑色纵纹,纹的边缘白色。大食蟻獸為獨居動物,個體之間少有互動,少數例外為:雄性之間的示威、交配、以及養育後代。雌性大食蟻獸會將幼仔背在背上活動。
大食蟻獸被國際自然保護聯盟列為易危物種,在許多地區面臨局部地區滅絕。大食蟻獸所面臨的威脅包括棲息地喪失以及盜獵取得其毛皮與肉。
包括兩個亞種:
Myrmecophaga tridactyla artata Osgood, 1912 Myrmecophaga tridactyla centralis Lyon, 1906
 ワシントン条約附属書II 分類 界 : 動物界 Animalia 門 : 脊索動物門 Chordata 亜門 : 脊椎動物亜門 Vertebrata 綱 : 哺乳綱 Mammalia 目 : 有毛目 Pilosa 科 : アリクイ科 Myrmecophagidae 属 : オオアリクイ属 Myrmecophaga
ワシントン条約附属書II 分類 界 : 動物界 Animalia 門 : 脊索動物門 Chordata 亜門 : 脊椎動物亜門 Vertebrata 綱 : 哺乳綱 Mammalia 目 : 有毛目 Pilosa 科 : アリクイ科 Myrmecophagidae 属 : オオアリクイ属 Myrmecophaga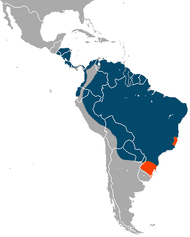
オオアリクイ(Myrmecophaga tridactyla)は、有毛目アリクイ科オオアリクイ属に分類されるアリクイ。本種のみでオオアリクイ属を構成する。オオアリクイ属はアリクイ科の模式属。
アルゼンチン、エクアドル、ガイアナ、コロンビア、スリナム、ニカラグア、パナマ、パラグアイ、ペルー、ブラジル、仏領ギアナ、ベネズエラ、ボリビア、ホンジュラス[3]
アルゼンチンの一部(エントレ・リオス州、コルドバ州)、ウルグアイ、エルサルバドル、グアテマラ、ブラジルの一部(エスピリトサント州、サンタカタリーナ州、リオグランデ・ド・スル州、リオデジャネイロ州)、ベリーズでは絶滅したと考えられている[3]
体長100 - 120センチメートル[5][6]。尾長65-90センチメートル[5][6]。体重18 - 39キログラム[5][6]。吻端を除いた全身が粗く長い体毛で被われる。尾の体毛は30センチメートルに達する[5]。喉や胸部から肩にかけて白く縁取られた黒い斑紋が入る[5][6]。尾も含めた下半身の体毛は黒や暗褐色。
吻端は非常に長く、嗅覚も発達している。舌は細長く、最大で61センチメートルに達する[5]。舌は唾液腺から分泌された粘着質の唾液で覆われる。眼や外耳は小型だが[6]、聴覚は発達している。前肢の指は5本で、湾曲した4本の大きな爪があり特に第2、第3指で顕著。第5指は退化し、外観からはわからない。
代謝能力は低く、体温は32.7℃。
2003年に発表されたミトコンドリアDNAの16S rRNAの分子系統解析では、本属とコアリクイ属Tamanduaは12,900,000年前に分岐したという解析結果が得られた[7]。
低地にある草原(サバンナ、リャノなど)、沼沢地、開けた森林などに生息する[5][6]。地表棲。単独で生活する[5]。昼間に活動することもあるが、人間による影響がある地域では夜間に活動する[5]。地面に掘った浅い窪みで1日あたり14-15時間は休む。寝る時は体を丸め、尾で全身を隠すように覆う。移動する時は爪を保護するため、前肢の甲を地面に付けて歩く[6]。泳ぎは上手い。外敵に襲われると尾を支えにして後肢だけで立ちあがり、前肢の爪を振りかざし相手を威嚇する[5]。それでも相手が怯まない場合は爪で攻撃したり相手に抱きつき締めあげる[5]。天敵としてはジャガーなどが挙げられる[5]。
食性は動物食で、主にアリやシロアリを食べるが、昆虫の幼虫、果実などを食べることもある[5][6]。匂いを頼りに巣を探して前肢の爪で破壊する。その後、舌を高速で出し入れ(1分間に150回)して捕食する。1日で約30,000匹のアリやシロアリを食べると推定されている[5]。1つの巣から捕食する量は少なく、1回の捕食に費やす時間も平均で1分ほど[6]。複数の巣を徘徊し、採食を行う。1回の捕食量が少ないことや複数の巣を徘徊することで行動圏内の獲物を食べ尽くさないようにしていると考えられている[6]。直接飲水することもあるが、水分はほとんど食物から摂取する。属名Myrmecophagaは「蟻食い」の意。
繁殖様式は胎生。妊娠期間は142 - 190日[5]。1回に1頭の幼獣を後肢だけで直立しながら産む[5]。授乳期間は約6か月[6]。幼獣は生後1か月ほどで歩行できるようになる。生後6-9か月は母親の背中につかまって過ごす[5]。生後3年で性成熟する[6]。寿命は約16年と考えられている[5]。
食用とされたり、皮革が利用されることもある[3]。薬用になると信じられている地域もある[3]。
生息地の破壊、攻撃的な動物と誤解されての駆除、毛皮用や娯楽としての狩猟などにより生息数は減少している[5][6]。2014年現在は過去10年で生息数が30 %以上減少したと推定されている[3]。1975年のワシントン条約発効時から附属書IIに掲載されている[2]。
一方で、危機を感じた際には、前足にあるカギ爪をふりかざして防衛行動に出ることがあり、2014年にはブラジルで猟師が2名が死亡した例がある[8]。
中南米の一部に約5,000頭が生息するのみの状況、と2014年7月28日付のフランス通信社は伝えている[8]。
큰개미핥기(학명:Myrmecophaga tridactyla)는 남아메리카와 중앙아메리카에 걸쳐 두루 서식하는 대형 빈치류의 일종이다.[2] 현존하는 개미핥기아목에 속하는 동물들 중에서 제일 크며, 큰개미핥기속에 속하는 유일한 종이다. 몸길이는 182-216cm, 몸무게는 최대 65kg까지 나가며 시력과 청각이 안 좋지만 후각은 대단히 발달되어 있다. 나무늘보나 다른 개미핥기들과는 달리 대부분의 시간을 땅에서 보낸다. 팜파스와 열대 우림 양쪽에서 모두 살아갈 수 있는 동물로, 개미와 흰개미를 주로 먹는 것으로 잘 알려져 있다.
원통형인 주둥이는 매우 길며, 혀는 약 60cm나 길으나 너비는 12.5mm로 좁다. 남아메리카 등지에서 흔히 서식하며, 개체수가 지속적으로 줄어들고 있어 문제가 되고 있다. 특이한 외모와 습성 덕에, 남아메리카 원주민들의 고전 설화에서 그 모습을 찾아볼 수 있으며, 현대 문화에서도 유명한 동물이다. 현재 대한민국에서는 서울대공원에 전시되어 있다.[3]
† Pampatheriidae
유모목 개미핥기아목 나무늘보아목† Megatheriidae
† Nothrotheriidae
† Mylodontidae
학명인 "Myrmecophaga tridactyla"의 두 단어는 각각 '개미를 먹는 자'와 '세 손가락'이라는 뜻이다.[6] Myrmecophaga jubata라는 이명이 사용되며, 3종의 아종이 있다.
북부작은개미핥기, 남부작은개미핥기와 함께 큰개미핥기과에 분류되어 있으며, 큰개미핥기과는 애기개미핥기과와 함께 현존하는 개미핥기아목의 둘뿐인 구성원이다.
개미핥기와 나무늘보는 유모목에 속하며, 아르마딜로와 함께 빈치상목으로 분류된다. 빈치상목의 두 목은 6,600만 년 전 백악기에 갈라져 다시 팔레오세와 에오세를 거쳐 5,500만 년 전에 나무늘보와 개미핥기로 갈라졌으며, 애기개미핥기과와는 3,000만년 전 올리고세에, 작은개미핥기와는 1,000만 년 전 마이오세에서 갈라졌다.[7] 신생대를 거쳐오면서 개미핥기의 서식지는 대륙으로부터 완전히 분리된 남아메리카로 좁혀졌는데, 팔레오세에 아메리카 대륙 대교착이 일어나던 중 파나마 지협의 생성으로 개미핥기들이 중앙아메리카에 서식하게 된 것으로 보인다.[8]
화석 자료나 표본은 매우 희박하나[9] 플리오세의 † Palaeomyrmidon 속의 화석, 마이오세의 † Protamandua 속의 화석, 그리고 † Neotamandua 속의 화석이 발견되었다.
큰개미핥기는 계통 내에서 가장 지행성(地行性)을 보이는 종으로, 조상은 원래 나무 위에서 살던 종이었을지도 모른다.[10] 하지만 점차 서식지가 초원 지대로 옮겨지고 그곳에서 흰개미와 같이 큰개미핥기의 좋은 먹이가 되어줄 수 있는 군생 곤충들이 번식하게 되면서 점차 나무 위에서 땅으로 내려왔을 것이다. 남부작은개미핥기처럼 후기 플라이스토세와 홀로세의 화석 표본이 존재한다.[9]
수렴진화의 대표적인 예로서, 큰개미핥기는 천산갑 혹은 땅돼지와 외형적으로든, 생태적으로든 유사성이 많으나 생물학적인 구분과 계통은 전혀 다르다.
큰개미핥기는 성체의 몸길이가 182-217cm, 꼬리 길이 60-65cm, 몸무게가 수컷이 33-41kg, 암컷이 27-39kg에 이르는 대형종으로,[6] 큰 몸집과 더불어 원통형의 주둥이와 긴 꼬리를 가지고 있다. 이것은 모든 개미핥기 중에서 제일가는 크기이다. 머리 길이는 30cm에 달하는데 이것 또한 다른 개미핥기들과 비교했을 때 특출나게 긴 것이며,[11] 대부분은 대롱 모양의 주둥이가 비중을 차지한다. 수명은 10년 안팎이지만 동물원에서는 16년 이상을 살 수 있다.[12] 목뼈는 경도가 높고 등과 이어지는 쪽에는 돌출된 혹 부분이 있고,[11] 몸 색깔은 전체적으로 갈색이며 흰 테두리의 검은 띠가 목, 가슴, 어깨를 지나 등까지 이른다. 목 아래에서 어깨를 가로지르는 흰 테두리의 검은 줄무늬가 있으며, 앞다리는 흰색이지만 뒷다리는 어두운 갈색을 띤다.
또한 다른 개미핥기들과 비교하여 매우 이질적인 외관을 가졌다. 큰개미핥기의 주둥이 끝에는 매우 작은 입과 코가 있으며 눈과 귀는 매우 작다. 꼬리털이 매우 터부룩하며 온도가 높을 때 방열(放熱) 기능을 한다. 등에는 뻣뻣한 갈기가 나 있다.[6] 큰개미핥기의 털 배색은 보호색으로 잘못 알려져 있었으나 2009년의 조사 결과 경계색이라는 사실이 밝혀졌다.[13]
학명이 의미하는 바와는 달리 발톱 다섯 개가 존재한다. 그 중 두 번째와 세 번째 앞다리 발톱은 낫처럼 굽은 모양으로 유독 크고 단단하게 발달했지만[14], 그 탓에 걸어다닐 때에는 뒷다리가 척행성(蹠行性)인 데 반해 앞다리는 주먹을 쥐듯이 발톱의 등 옆면을 땅에 대고 걸어야 한다. 큰개미핥기의 대부분의 중량은 그 중에서 가장 발달한 세 번째 발톱이 지탱한다. 이 세 번째 발톱은 성장판 부분에서 늘어나서 지절 부분에서 굽어 있다.[15] 발톱으로는 먹이를 찾거나 맹수의 위협으로부터 자신을 방어할 수 있다.
시력과 청력이 몹시 떨어지지만 후각은 반대로 매우 발달하여 사람의 40배 이상 민감하게 냄새를 감지할 수 있다.[16] 체온은 32.7 °C(91 °F) 정도로, 모든 지상 포유류 중에서 가장 낮고, 또 그만큼 두뇌 회전도 빠르지 못해 지능이 낮고 신경이 둔한 편에 속한다. 또한 신진대사율도 매우 낮은데, 이는 많은 빈치류의 공통점으로 운동 능력 부진 때문에 생긴 것으로 보인다.[17]
큰개미핥기는 턱뼈와 턱관절이 발달하지 못하고 이도 없어서 저작 운동을 할 수 없다. 그래서 큰개미핥기는 입을 열고닫기 위해 그다지 발달되지는 않았지만 입을 벌리는 데 사용하는 아랫턱의 인대를 움직인다.[11] 이 때문에 입이나 턱을 호신용으로 사용할 수 없고, 킁킁거리거나 낮게 으르릉대는 것 외의 울음소리를 잘 내지 못한다. 그 대신 끝이 둥글고 길쭉하게 생긴 혀는 뒤로 뻗은 미뢰가 많고 길이가 매우 길어서 60cm에 달하며,[6] 완전히 밖으로 뻗으면 45cm가 튀어나오는데 이 길이는 머리뼈보다 길다. 개미핥기의 침샘은 매우 발달해 끈끈한 침이 발라진 혀를 이용해 벌레 따위의 먹이를 잡을 수 있다.
먹이를 먹을 때는 1분에 160번씩 혀를 날름거릴 수 있다. 이런 행동은 혀를 내밀거나 들이기 위해 잘 발달된 협근, 그리고 큰개미핥기의 특이한 목뿔뼈와 복장뼈 구조 덕분에 가능한 것으로, 혀가 목뿔뼈와 인두를 관통해서 복장뼈에 직접 붙어 있다.[18] 보통 동물의 위에서는 강산(위산)을 내보내어 영양소를 분해하지만, 특이하게도 큰개미핥기의 위는 조류의 모래주머니와 비슷한 구조로, 위산을 내보내지 않고 개미와 함께 삼킨 흙, 모래와 먹은 개미가 만들어내는 개미산을 이용해 소화를 한다.[19]
큰개미핥기는 주행성·야행성의 습성을 모두 가지고 있다. 2006년 연구 결과로는 큰개미핥기는 대부분 야행성이고 야간과 새벽에 가장 활동적이며 일출 이후로는 수면을 취하지만, 기온이 낮아질수록 활동 시간이 더 좁아져서 주행성으로 생활 양식이 바뀌어 간다.[20] 세라 데 카나스트라 국립공원에서 주행성의 개체들이 관찰된 바 있다.[20] 큰개미핥기의 야행성이 인간의 영향이라는 연구 결과도 있다.[21] 먹이를 찾아 항상 돌아다니기 때문에 정착 생활을 하지 않으며, 먹이를 찾을 때는 개활지에서, 수면을 취할 때에는 개활지보다 일교차와 연교차가 작은 삼림지에서 활동한다.[22] 또한 헤엄을 잘 치며, 종종 강물을 건너거나 못에서 목욕을 하는 모습도 관찰되었다.[23]
텃세를 부리는 동물이며, 그 범위는 서식지마다 차이가 있다. 브라질의 세라 다 카나스트라 국립공원의 개체군 중에서 암컷의 경우는 3.67km2, 수컷은 2.74km2의 행동권을 가진다. 브라질의 여타 지역의 경우에는 9km2 이상의 행동권을 지닌 경우도 있었고, 베네수엘라의 개체 중에서는 25km2의 행동권을 가진 개체 또한 관측되었다.[24] 보통 새끼가 딸린 어미와 암수 한 쌍을 제외하면 홀로 산다. 큰개미핥기의 의사소통은 항문 주위의 분비샘으로부터 나오는 분비물로 이루어지는데, 이것은 이들의 텃세뿐 아니라 현재 상태와 번식기 여부를 판단시키기도 한다. 텃세는 소변으로 표시하기도 한다.[25] 타 개체를 타액의 냄새로 구분할 줄 아는 것으로 여겨진다.[16] 암컷과는 달리 수컷의 경우 세력 투쟁을 하는데[24] 두 수컷 개체가 맞닥뜨렸을 경우 서로 싸움이 일어나기도 한다.
개미와 흰개미를 먹고 사는 것으로 널리 알려져 있다. 이는 상황에 따라 다른데, 야노스와 같이 범람원이 발달한 곳에서는 흰개미의 개체 수가 적기 때문에 주로 개미를 먹는다.[16] 반대로 에마스 국립공원의 큰개미핥기들은 초원에서 더 많이 서식하는 흰개미들을 주식으로 한다.[26] 또한, 세라 다 카나스트라 국립공원의 큰개미핥기들은 우기(10-3월) 동안은 개미를, 건기(4월-9월) 동안은 흰개미를 번갈아 먹으며 주식을 바꾼다.[16] 성체 큰개미핥기 하나는 30,000여 마리의 개미를 먹어치우는 것으로 알려져 있다.[14]
개미집의 위치는 개미가 뿜는 페로몬의 자취로 알아내며,[12] 개미를 먹을 때는 발톱으로 개미총이나 개미집을 두 개의 날카로운 발톱으로 긁어서 흐너뜨린 다음 발달된 침샘에서 나온 끈끈한 타액이 묻어 있는 혀로 핥아서 쓸어담듯이 먹는다. 포름산, 병정개미의 공격으로 쫓겨날 수도 있다.[12] 개미뿐 아니라 고목에서 서식하고 있는 작은 곤충들을 즐겨 먹기도 하며, 꿀벌의 벌집을 습격하기도 한다. 이가 없어서 먹이를 씹어서 잘게 부수지 못하고 그냥 삼키기 때문에 곤충 외의 다른 먹이들은 잘 먹을 수 없다. 그 외에도 딱정벌레류의 유충을 먹기도 한다. 동물원에서 사육하는 개체는 하루 3만여 마리의 개미 대신에 비용 절감을 위하여 쇠고기를 갈아서 먹이로 주며 개미산을 대체하기 위한 요구르트, 달걀, 당도가 높은 과일, 벌꿀 등을 섞어서 준다.[21] 퓨마와 재규어가 주 천적이지만, 발톱이 매우 발달되어 있어 퓨마와 재규어도 쉽게 덤빌 수 없다.[27] 그 외에의 천적으로는 아메리카악어, 오리노코악어, 아나콘다 등이 있다.
큰개미핥기는 1년 내내 짝짓기가 가능하며,[16] 수컷은 암컷에게 구애하면서 암컷의 냄새를 맡아 댄다. 한 쌍의 짝이 지어지면 두 개체는 먹이를 함께 먹는다. 짝짓기가 시작되면 암컷 위에 수컷이 올라탄다. 짝은 최대 3일 동안 지속될 수 있고 이 기간 동안에는 몇 번 더 교미를 실행한다.[16] 임신 기간은 190일이며, 새끼는 태어난 직후에는 6일간 눈을 뜰 수 없고 몸무게가 약 1.4kg이며[27] 성체가 되기까지 2.5~4년 정도가 필요하다. 젖샘은 앞다리 쪽의 측면에 있다.
자라나는 동안에 새끼가 가진 어깻죽지의 검은 줄무늬는 모체의 줄무늬를 나란히 닮아 가며,[14] 모체와는 삑삑거리는 휘파람 소리 또는 혀의 접촉으로 서로 의사소통을 한다. 3개월쯤 지나면 완전히 젖을 떼며, 개미 따위를 스스로 먹기 시작한다. 새끼가 태어난 지 10개월까지 어미는 한 시간 남짓 새끼를 핥으면서 털을 다듬어 주며, 10달이 지나면 새끼는 어미로부터 완전히 독립한다. 성체가 될 때까지는 2.5-4년이 걸린다.[21]
온두라스부터 아르헨티나까지 중남미에 널리 서식하며, 소택지, 열대 우림, 팜파스, 사바나 등 고산 지대를 제외한 어느 환경에라도 충분한 양의 곤충이 서식한다면 적응하여 살 수 있지만,[28] 산악 지대인 안데스 산맥 주변에서는 찾아볼 수 없으며, 우루과이, 벨리즈, 과테말라, 코스타리카에서는 이미 찾아볼 수 없게 되었다. 또한 드물게 멕시코의 소노라 사막 등지에서 화석이 발견되기도 한다.[8]
IUCN 취약종이며, CITES 부속서 Ⅱ에 따라서 이 동물의 밀렵을 금지하고 있다.
볼리비아에서는 스포츠 및 상업적 목적으로 큰개미핥기의 사냥이 빈번하게 일어나고, 베네수엘라에서는 발톱을 노린 밀렵이 일어나며, 파라과이 그란차코에서는 승마용 장비를 만들기 위해 박피된다. 또한 인화성의 모피와 굼뜬 움직임 때문에 산불 등의 화재에도 취약하여, 1994년 340마리 가량의 큰개미핥기들이 브라질 에마스 국립공원의 화재로 폐사했다.[29] 또한 2016년부터 베네수엘라에서는 지속적인 경기 공황으로 인해 큰개미핥기와 홍학을 밀렵하여 식량으로 삼는 일도 일어나고 있다.[30]
재규어처럼 많은 남미 토착 신앙의 숭배 대상이 되기도 했으며, 이런 경향은 아마존 강 유역의 국가들의 원주민들에게서 찾아볼 수 있다. 남미의 민담에서는 주로 재규어처럼 교활한 성격으로 그려진다. 또한 스페인의 콩키스타도르들이 남아메리카에서 정복 사업을 벌이고 있을 때 유럽으로 표본을 가져간 사례가 기록되어 있고, 유럽인들은 처음에 큰개미핥기들은 모두 암컷이며 코로 짝짓기를 한다고 믿었는데, 이는 기술자이자 자연과학자인 펠릭스 데 아사라에 의해서 부정되었다.[31]
개미핥기는 공격성이 높지 않고 인간을 보면 도망치는 성향이 강하지만, 심하게 위협을 받을 시 방어 행동으로 날카로운 구겸형의 앞발톱으로 공격하는 일도 있다. 가끔씩 사람을 공격하여 사망시키는 사례도 보고되었다.[32] 2007년 아르헨티나 부에노스아이레스주의 플로렌시오 바렐라 동물원에서 큰개미핥기가 앞다리로 사육사를 할퀴어 사망에 이르게 한 사건이 있었으며,[33] 2010-2012년에는 브라질의 사냥꾼 두 명 역시 큰개미핥기의 집단 공격에 사망한 사례가 있다.[34]
큰개미핥기(학명:Myrmecophaga tridactyla)는 남아메리카와 중앙아메리카에 걸쳐 두루 서식하는 대형 빈치류의 일종이다. 현존하는 개미핥기아목에 속하는 동물들 중에서 제일 크며, 큰개미핥기속에 속하는 유일한 종이다. 몸길이는 182-216cm, 몸무게는 최대 65kg까지 나가며 시력과 청각이 안 좋지만 후각은 대단히 발달되어 있다. 나무늘보나 다른 개미핥기들과는 달리 대부분의 시간을 땅에서 보낸다. 팜파스와 열대 우림 양쪽에서 모두 살아갈 수 있는 동물로, 개미와 흰개미를 주로 먹는 것으로 잘 알려져 있다.
원통형인 주둥이는 매우 길며, 혀는 약 60cm나 길으나 너비는 12.5mm로 좁다. 남아메리카 등지에서 흔히 서식하며, 개체수가 지속적으로 줄어들고 있어 문제가 되고 있다. 특이한 외모와 습성 덕에, 남아메리카 원주민들의 고전 설화에서 그 모습을 찾아볼 수 있으며, 현대 문화에서도 유명한 동물이다. 현재 대한민국에서는 서울대공원에 전시되어 있다.