fr
noms dans le fil d’Ariane


Taun çöpü (lat. Yersinia pestis, 1967-ci ildən qabaq Pasteurella pestis) — enterobakteriyalar fəsiləsindən qrammənfi bakteriya, taunun törədicisidir. Fakultativ anaerobdur. 1894-cü ildə alim Aleksandr Yersen kəşf etmişdir, üç biovarı məlumdur. Patogenliyi iki faqositoz antigeni (F1 və VW) ilə bağlıdır. Bakteriya antifaqositoz seliyi əmələ gətirir.
A kateqoriyalı, olduqca təhlükəli patogendır.
Bu Abbasov Murad6d 291
![]() Xəstəlik ilə əlaqədar olan bu məqalə qaralama halındadır. Məqaləni redaktə edərək Vikipediyanı zənginləşdirin.
Xəstəlik ilə əlaqədar olan bu məqalə qaralama halındadır. Məqaləni redaktə edərək Vikipediyanı zənginləşdirin.
Taun çöpü (lat. Yersinia pestis, 1967-ci ildən qabaq Pasteurella pestis) — enterobakteriyalar fəsiləsindən qrammənfi bakteriya, taunun törədicisidir. Fakultativ anaerobdur. 1894-cü ildə alim Aleksandr Yersen kəşf etmişdir, üç biovarı məlumdur. Patogenliyi iki faqositoz antigeni (F1 və VW) ilə bağlıdır. Bakteriya antifaqositoz seliyi əmələ gətirir.
A kateqoriyalı, olduqca təhlükəli patogendır.
Yersinia pestis zo ur spesad bakteri bazhellek Gram-nann, anaerobek diouzh ret, eus kerentiezh an Enterobacteriaceae[1]. Lakaat a ra an dud da bakañ ar vosenn werblus. Y. pestis a c'hall ivez degas bosenn ar skevent hag ar vosenn septisemiek.[2] An tri seurt bosenn zo bet kaoz da feurioù mervel uhel e-pad ar barradoù kleñved-red en istor, en o zouez ar Vosenn Vras pe ar "Vosenn Zu". Lakaat a reer war gont houmañ ziwezhañ marv war-dro un drederenn eus poblañs Europa etre 1347 ha 1353.
Dizoloet eo bet Y. pestis e 1894 gant ur bakteriologour hag ur mezeg eus an ensavadur Pasteur, Aleksandr Yersin, e-pad ur stropad bosenn e Hong-Kong[3] Yersin a oa ezel eus skol Pasteur. Shibasaburo Kitasato, ur bakteriologour japanat stummet en Alamagn hag a implije hentenn Koch a oa ivez o klask orin ar vosenn[4]. Yersin an hini eo avat a zizoloas al liamm a oa etre ar vosenn ha Yersinia pestis. Anvet Pasteurella pestis da gentañ e oa bet badezet en-dro ar spesad bakteri e 1967.
a vo kavet e Wikimedia Commons.
Yersinia pestis zo ur spesad bakteri bazhellek Gram-nann, anaerobek diouzh ret, eus kerentiezh an Enterobacteriaceae. Lakaat a ra an dud da bakañ ar vosenn werblus. Y. pestis a c'hall ivez degas bosenn ar skevent hag ar vosenn septisemiek. An tri seurt bosenn zo bet kaoz da feurioù mervel uhel e-pad ar barradoù kleñved-red en istor, en o zouez ar Vosenn Vras pe ar "Vosenn Zu". Lakaat a reer war gont houmañ ziwezhañ marv war-dro un drederenn eus poblañs Europa etre 1347 ha 1353.
Yersinia pestis (antigament Pasteurella pestis) és un eubacteri gramnegatiu en forma de bacil de la família de les enterobacteriàcies. És un anaerobi facultatiu que pot infectar humans i altres animals, i que és especialment infame per haver estat amb tota certesa, segons la recerca feta per un equip alemany i canadenc feta en un cementiri de Londres on hi ha enterrats morts a causa de la pesta negra,[1] la responsable del fet que durant l'edat mitjana morissin uns 75 milions de persones d'arreu del món, i que hauria causat la mort d'entre el 30% i el 60% de la població d'Europa.
Yersinia pestis (antigament Pasteurella pestis) és un eubacteri gramnegatiu en forma de bacil de la família de les enterobacteriàcies. És un anaerobi facultatiu que pot infectar humans i altres animals, i que és especialment infame per haver estat amb tota certesa, segons la recerca feta per un equip alemany i canadenc feta en un cementiri de Londres on hi ha enterrats morts a causa de la pesta negra, la responsable del fet que durant l'edat mitjana morissin uns 75 milions de persones d'arreu del món, i que hauria causat la mort d'entre el 30% i el 60% de la població d'Europa.
Bacteria o fath Gram-negydd, siâp rhoden ac o deulu'r Enterobacteriaceae ydy Yersinia pestis. Ei hen enw oedd Pasteurella pestis. Credir fod y Pla Du yn Ewrop yr Oesoedd Canol wedi ei achosi gan y bacteria yma, sy'n endemig yng nghanolbarth Asia.
Yersinia pestis (původně Pasteurella pestis) je patogenní gramnegativní bakterie z čeledi Enterobacteriaceae. Jedná se o fakultativní anaerobní bakterii, která je přenositelná na zvíře i na člověka.
Lidská infekce Y. pestis, způsobující morovou nemoc, se dělí do tří hlavních forem: dýmějový, septický (sepse, otrava krve) a plicní černý mor.[1] Všechny tyto tři formy jsou odpovědné za vysokou úmrtnost během epidemií v lidské historii, včetně tzv. Černého moru, jenž zahubil nejméně třetinu evropské populace v letech 1347 až 1353.
Dne 13. září 2009 zemřel profesor molekulární genetiky na Chicagské univerzitě, Malcolm J. Casadaban, který se zabýval výzkumem zahrnujícím Y. pestis a jeho smrt byla později dána v souvislost s touto bakterií, kterou se mohl pravděpodobně nakazit ve své vlastní laboratoři.[2]
Y. pestis také nedávno upoutala pozornost jako možná biologická zbraň a americká CDC (Center for Disease Control and Prevention) ji označilo jako patogen kategorie A vyžadující přípravu k ochraně před případným teroristickým útokem.
Y. pestis objevil v roce 1894 Alexandre Yersin, švýcarsko-francouzský fyzik a bakteriolog z Institutu Louise Pasteura, během epidemie dýmějového moru v Hong Kongu.[3][4] Yersin byl členem Pasteurovy myšlenkové školy. Šibasaburó Kitasato (北里 柴三郎), japonský bakteriolog školený v Německu, který praktikoval Kochovu metodologii, se také angažoval v nalezení původce moru.[5] Byl to nicméně Yersin, kdo uvedl souvislost moru s Yersinia pestis. V roce 1967 byl původně se jmenující organismus Pasteurella pestis přejmenován na svou stávající podobu.
Tři biovary Y. pestis jsou považovány za související s historickými pandemiemi bubonického moru.[6]
Soudobá data z typizací multilokulárních sekvencí (MLST) však ukazují, že Y. pestis je klonální, což poněkud vyvrací hypotézu "biovarů".[8]
V zubech pravděpodobných obětí Černé smrti i ve středověkých mrtvolách zemřelých z jiných důvodů byla nalezena DNA Y. pestis.[9][10] To naznačuje, že Y. pestis se přinejmenším podílela na některých (i když pravděpodobně ne na všech) evropských morových epidemiích. Je možné, že selektivní tlak způsobený morem mohl změnit způsob, jakým se patogen manifestuje u lidí vyselektovaným v rozporu s jedinci nebo populacemi nejsnadněji podléhajícím.
Světová zdravotnická organizace eviduje každoročně tisíce případů moru, přesto však pomocí náležité léčby je prognóza nakažených již mnohem pozitivnější. Během Vietnamské války se vyskytlo pěti až šestinásobné zvýšení počtu případů, pravděpodobně kvůli narušení ekosystému a větší blízkosti mezi lidmi a zvířaty. Mor má škodlivý účinek také na jiné savce než na člověka. Ve Spojených státech amerických jsou na tuto chorobu léčeny i ohrožené druhy psouna prériového a tchoře černonohého.
Y. pestis je fakultativně anaerobní tyčinkovitá bakterie barvící se bipolárně (na koncích se barví lépe než uprostřed, což ji dává vzezření spínacího špendlíku).[11] Podobně jako další členové roduYersinia vykazuje negativní výsledky ureázového testu, fermentace laktózy i indolového testu.[12] Y. pestis je více příbuzná s gastrointestinálním patogenem Yersinia pseudotuberculosis a vzdáleněji s Yersinia enterocolitica.
Kompletní genetická sekvence je dostupná u dvou ze tří poddruhů Y. pestis: kmen KIM (biovaru Medievalis)[13] a kmen CO92 (biovaru Orientalis, získaného z klinického izolátu ve Spojených státech).[8]. Podobně jako u jiných patogenních kmenů, i zde jsou znaky ztrát funkcí. Chromosom kmene KIM je 4 600 755 bází dlouhý, zatímco chromosom kmene CO92 je dlouhý 4 653 728 párů. Y. pestis, podobně jako jeho příbuzní Yersinia pseudotuberculosis a Yersinia enterocolitica hostí plazmid pCD1. Navíc ještě nese další dva plazmidy a to pPCP (nazývaný také pPla nebo pPst) a pMT1 (jinak pFra), které se nevyskytují u jiných druhů Yersinia. pFra kóduje fosfolipázu D, která je důležitá pro schopnost Y. pestis být přenášena blechami.[14] pPla kóduje Pla proteázu, která aktivuje plazminogen v lidském hostiteli a je velmi důležitým faktorem virulence u plicního moru.[15] Tyto plazmidy, společně s ostrovem patogenity HPI, kódují několik proteinů, které způsobují, že patogenita Y. pestis je tak proslulá. Tyto virulentní faktory jsou mimo jiné vyžadovány pro adhezi bakterie a vstříknutí proteinů do hostitelské buňky, invazi bakterie do buňky a pro získání a vazbu železa z červených krvinek. Y. pestis je považována za nástupce Y. pseudotuberculosis, která se liší jen přítomností specifických virulentních plazmidů.
V roce 2006 byla provedena komplexní komparativní proteomická analýza kmene KIM Y. pestis[16], která se zaměřila na přechod do růstových podmínek napodobujících růst v hostitelských buňkách.
V městských a lesních cyklech Y. pestis dochází k největšímu šíření mezi hlodavci a blechami. U lesních cyklů je hlodavec divoký a naopak u městských cyklů domestikovaný. Y. pestis se navíc může šířit z městského prostředí do lesního a zase zpět. Každé nakažené zvíře může přenést infekci na člověka skrz kontakt s pokožkou. Přenos mezi lidmi může být navíc šířen kýcháním a kašlem anebo přímým kontaktem s nakaženou tkání.
Rezervoáry spojené s Y. pestis jsou některé druhy hlodavců. Ve stepi se má za to, že se jedná o sviště. Myslí se, že několik druhů hlodavců ve Spojených státech v sobě udržuje Y. pestis. Argumenty jsou nicméně nejisté, neboť v žádném druhu hlodavců nebyla nalezena očekávaná dynamika choroby. Je známo, že někteří jedinci populace hlodavců mohou mít různou rezistenci, což by mohlo vést k bezpříznakovému stavu.[17] Existuje několik důkazů, že ve vypuknutí lidského moru mohou hrát roli blechy pocházející z jiných savců.[18]
Nedostatek poznatků dynamiky moru u savčích druhů se dostavuje také u podezřelých hlodavčích druhů jako například u psouna prériového (Cynomys ludovicianus), u kterého mor může způsobit zhroucení celé kolonie, což má ve výsledku masivní dopad na prérijní potravní řetězec.[19] Dynamika přenosu u prérijních psů nicméně nesleduje dynamiku u blokovaných blech; důležitou roli mohou hrát i zdechliny a blechy neblokované.[20]
V jiných regionech světa není zdroj infekce jistě identifikován, což komplikuje prevenci a program časného varování. Jedním z těchto případů bylo vypuknutí v Alžírsku v roce 2003.[21]
Přenos Y. pestis blechou je dobře popsán.[22]. K prvotnímu získání Y. pestis vektorem dochází během krmení se na nakaženém zvířeti. K udržení bakterie v zažívacím traktu blechy přispívá několik proteinů například systém skladování heminu (Hms) a Yersinia toxin dobytčího moru (Ymt).
Přestože Ymt je vysoce toxický pro hlodavce a jeho produkce byla považována za potřebnou k zajištění k reinfekci nového hostitele, bylo prokázáno že Ymt je důležitý pro přežití Y. pestis v blechách.[14] Systém Hms hraje důležitou roli v přenosu Y. pestis zpět na savčího hostitele.[23] Proteiny kódované lokusy Hms se shlukují v bleším jícnu a proventriculu, brání bleše v příjmu potravy a zvyšují tak její hladovost. K přenosu Y. pestis dochází pak během marných pokusů blechy o krmení. Pohlcená krev je pumpována do jícnu, kde uvolňuje bakterie zde rostoucí a je neustále chrlena zpět do hostitelského oběhu.
K patogenezi během savčích infekcí Y. pestis pomáhá několik faktorů, mimo jiné schopnost této bakterie potlačit normální imunitní odpověď jako například fagocytózu a produkci protilátek. Poté, co bleší kousnutí umožní bakterii přístup skrz kůži, aktivuje Y. pestis yadBC gen, který je podobný k bakteriálním adhezinům u jiných druhů Yersinia, které umožní invazi do epitelových buněk.[24] Y. pestis dále začne expresi aktivátoru plazminogenu, ten je důležitým faktorem virulence u plicní formy moru a může způsobovat krevní sraženiny k usnadnění celkové invaze.[15] Mnoho z virulentních faktorů této bakterie má povahu obrany proti fagocytóze, například dva důležité antigeny jménem F1 (Fraction 1) a V nebo LcrV.[11] Tyto antigen jsou produkovány bakterií za normální teploty lidského těla. Y. pestis kromě toho přežívá a produkuje antigeny F1 a V během spočinutí v krevních elementech jako například monocytech, ale ne v neutrofilech. Přirozená nebo vyvolaná imunita je dosažena produkcí specifických opsonizačních protilátek proti F1 a V antigenům; tyto protilátky by pak umožnily fagocytózu neutrofily.[25]
Navíc bakteriální sekreční systém T III (T3SS) umožní Y. pestis vstříknout své proteiny do makrofágu nebo jiných imunitních buněk. Tyto T3SS proteiny se nazývají YOP (Yersinia Outer Protein) a zahrnují například Yop B/D, který tvoří póry v hostitelské buňce a souvisí s cytolýzou; do póru vytvořeného YopB nebo YopD jsou vstřikovány další proteiny: Yop0, YopH, YopM, YopT, YopJ a YopE, které se mohou vylučovat i do cytoplazmy.[26] Tyto proteiny omezují fagocytózu popřípadě signalizační cesty důležité pro přirozený imunitní systém, jak bude ještě zmíněno.
Y. pestis proliferuje uvnitř lymfatických uzlin, kde je schopna se ubránit zničení buňkami imunitního systému jako například makrofágy a způsobuje tak lymfoadenopatii. YopH je proteinová tyrosin fosfatáza, která přispívá ke schopnosti Y. pestis napadat imunitní systém[27] a která v makrofágu defosforyluje BCAR, vazebné proteiny Fyn, SKAP2 a Pyk a tyrosin kinázu homologní k FAK. YopH se také váže na podjednotku p85 fosfoinositid 3 kinázy, Gab1 a Gab2 adaptorové proteiny a guanin výměnný faktor Vav.
YopE funguje jako protein aktivující GTPázu u členů Rho rodiny GTPáz jako například RAC1. YopT je cystein proteáza, která inhibuje RHOA tím, že odstraní isoprenylovou skupinu, která je důležitá k umístění proteinu v buněčné membráně. Bylo předloženo, že YopE a YopT mohou sloužit k omezení cytolýzy vyvolané YopB/D.[28] To by mohlo zabránit stimulaci imunitní odpovědi, která by byla způsobena prasknutím hostitelské buňky.
YopJ je acetyltransferáza vážící se na konzervovaný alfa helix u MAP kináz.[29] YopJ acetyluje MAP kinázy na serinech a threoninech, které jsou během aktivace MAP kinázové kaskády normálně fosforylované.[30]
Toto narušení aktivity proteinové kinázy u hostitelské buňky způsobí apoptózu makrofágu a považuje se za klíčové k udržení infekce a únik imunitní odpovědi. Yop0, známá také jako Yersinia protein kináza A (YpkA), je vlivným vyvolávacím prvkem apoptózy lidských makrofágů.[31]
Kdysi bývala dostupná formaldehydem inaktivovaná vakcína pro dospělé s vysokým rizikem nákazy, dokud nebyla stažena z trhu úřadem FDA (U.S. Food and Drug Administration). Její účinnost byla omezená a způsobovala těžké záněty. Slibné jsou experimenty s genetickým inženýrstvím založené na F1 a V antigenech, nicméně bakterie s chybějícím F1 antigenem jsou stále virulentní a V antigeny jsou natolik variabilní, že vakcína, sdružující tyto antigeny by nemusela být plně protektivní.[32] Americký armádní Institut lékařského výzkumu infekčních chorob (USAMRIID) zjistil, že experimentální vakcína založena na F1/V antigenu ochrání makaky druhu cynomolgus, ale selhává u afrických zelených opic.[33] Udává se, že Evropané jsou méně náchylní k infekci moru, protože jsou potomky mor přeživších ze středověku.[zdroj?]
Podle postupu choroby se rozeznávají tři její formy:
Též bubonický:
U „bubonicky“ zánětlivě zvětšených uzlin jsou prvotní symptomy velmi podobné množství jiných chorob, což způsobuje obtíže a zdržuje od včasné diagnózy.[34]
Jelikož bakterie se pohybuje v krvi, mohou být ovlivněny i jiné orgány, například slezina a mozek. Difúzní infekce může spustit imunologickoou kaskádu, která vede k diseminované intravaskulární koagulaci způsobující krvácení a nekrózu kůže a tkání. Tato roztroušená infekce (sepse) způsobuje úmrtí až ve 22 % případů.
Stejně jako v ostatních typů moru i zde po odeznění inkubační doby dochází k náhlému nastoupení kašle, vysokých teplot a úbytku sil. Od této chvíle infekce nabývá na vážnosti a kvůli vysoké rychlosti replikace způsobuje léčený mor úmrtí zhruba v 50% případů, neléčený téměř vždy.[36]
Kódy ICD-9 pro choroby způsobené Y. pestis:[37]
Gramovo barvení může potvrdit přítomnost gram-negativních tyček a v některých případech identifikovat jejich dvojitě zahnutý tvar. Více určující je Anti-F1 test, který rozlišuje mezi různými druhy Yersinií.
Tradičním lékem první linie při léčbě Y. pestis byl streptomycin[38][39], chloramfenikol, tetracyklin[40] a fluorochinolony. Jsou také dobré důkazy k použití doxycyklinu a gentamicinu.[41] Byly izolovány i rezistentní kmeny a léčba by tak měla být provedena dle citlivosti k antibiotikům. U některých pacientů může být pouhá léčba antibiotiky nedostatečná a je třeba zajistit i oběhovou, ventilační nebo ledvinovou podporu.
V naléhavých případech vyzdvihuje Harrison's Principles of Internal Medicine následující léčbu[35]: Velmi vhodná jsou antibiotika během prvních 24 hodin, přičemž intravenozní podání je upřednostněno u plicního moru nebo pokročilých případů. Streptomycin nebo gentamicin jsou léky první volby a chloramfenikol pro kriticky nemocné pacienty nebo zřídka při podezření na nervové komplikace.
V tomto článku byl použit překlad textu z článku Yersinia pestis na anglické Wikipedii.
Yersinia pestis (původně Pasteurella pestis) je patogenní gramnegativní bakterie z čeledi Enterobacteriaceae. Jedná se o fakultativní anaerobní bakterii, která je přenositelná na zvíře i na člověka.
Lidská infekce Y. pestis, způsobující morovou nemoc, se dělí do tří hlavních forem: dýmějový, septický (sepse, otrava krve) a plicní černý mor. Všechny tyto tři formy jsou odpovědné za vysokou úmrtnost během epidemií v lidské historii, včetně tzv. Černého moru, jenž zahubil nejméně třetinu evropské populace v letech 1347 až 1353.
Dne 13. září 2009 zemřel profesor molekulární genetiky na Chicagské univerzitě, Malcolm J. Casadaban, který se zabýval výzkumem zahrnujícím Y. pestis a jeho smrt byla později dána v souvislost s touto bakterií, kterou se mohl pravděpodobně nakazit ve své vlastní laboratoři.
Y. pestis také nedávno upoutala pozornost jako možná biologická zbraň a americká CDC (Center for Disease Control and Prevention) ji označilo jako patogen kategorie A vyžadující přípravu k ochraně před případným teroristickým útokem.
Yersinia pestis er den gram-negative bakterie som forårsager pest. Den tilhører familien Enterobacteria, som fx salmonellabakterien også tilhører. Den kan bevæge sig når den opholder sig uden for et værtsdyr, men bliver immobil når den er i et værtsdyr. Y. pestis er omkring 1-5 μm lang (0,001-0,005 mm). Den er meget sensitiv overfor antibiotika, og derfor er prognosen nogenlunde når pest kommer i behandling.
Slægtsnavnet (genus) Yersinia kommer fra den franske (født i Schweiz) mikrobiolog Alexandre Émile Jean Yersin (1863-1943).
Artsnavnet (species) Pestis kommer fra sygdommen pest.
En beslægtet bakterie, Yersinia enterocolitica, forårsager en form for maveinfektion.
Yersinia pestis er den gram-negative bakterie som forårsager pest. Den tilhører familien Enterobacteria, som fx salmonellabakterien også tilhører. Den kan bevæge sig når den opholder sig uden for et værtsdyr, men bliver immobil når den er i et værtsdyr. Y. pestis er omkring 1-5 μm lang (0,001-0,005 mm). Den er meget sensitiv overfor antibiotika, og derfor er prognosen nogenlunde når pest kommer i behandling.
Slægtsnavnet (genus) Yersinia kommer fra den franske (født i Schweiz) mikrobiolog Alexandre Émile Jean Yersin (1863-1943).
Artsnavnet (species) Pestis kommer fra sygdommen pest.
En beslægtet bakterie, Yersinia enterocolitica, forårsager en form for maveinfektion.
Yersinia pestis – auch Pestbakterium und Pestbazillus genannt – ist ein gramnegatives, unbegeißeltes, sporenloses, fakultativ anaerobes Stäbchenbakterium. Es zählt zu den Enterobakterien und ist der Erreger der Lungen- und Beulenpest.
Yersinia pestis wurde von Alexandre Émile Jean Yersin 1894 entdeckt und von diesem Pasteurella pestis[1] genannt. Seit 1944 wird das bis dahin der Gattung Pasteurella zugerechnete Bakterium in die nach Yersin benannte Gattung Yersinia gestellt.[2]
Die älteste bekannte DNA eines Stammes von Y. pestis wurde aus den Zähnen eines 5000 Jahre alten Jäger-und-Sammler-Skeletts in Lettland gewonnen.[3] Der Tote war sorgsam beerdigt worden, ebenso wie drei andere Personen der gleichen Stätte, deren Zähne allerdings keine DNA-Spuren von Y. pestis aufwiesen. Hieraus schließen die Archäologen, dass der damalige Y.-pestis-Stamm nicht so hoch ansteckend und innerhalb von Tagen tödlich war wie die Stämme, die später große Epidemien, wie die Justinianische Pest oder die Pandemie des Mittelalters („Schwarzer Tod“) auslösten. Sie vermuten ein Bakterienreservoir in einheimischen Bibern (Castor fiber), die Träger eines verwandten Bakteriums sind und deren Überreste im Umkreis archäologischer Stätten der Region in großer Zahl gefunden werden.
Die Virulenz von Yersinia pestis entsteht durch Exotoxin-, Endotoxin- und Bakterienkapselbildung.
1980 stellten Dan Cavanaugh und James Williams fest, dass die Virulenz des Bakteriums temperaturabhängig ist. Die Körpertemperatur des Flohs liege bei 24 °C, die des Menschen bei 37 °C und die der Ratte 1,5 °C höher. Der Temperaturunterschied zwischen Floh und Ratte könne die Virulenz des Bakteriums bei der Übertragung um fast das 50-Fache steigern. Dies liege an der Fähigkeit des Bakteriums, bei höheren Temperaturen Schutzmechanismen gegen die Phagocytose, einen Bestandteil der menschlichen Immunabwehr, zu entwickeln. Bei Temperaturen, wie sie im Körper des Flohs vorherrschen, werde dieser Schutz nicht aufgebaut und das Bakterium von Leukozyten und Monozyten vernichtet. Aber 3 Stunden nach Eingang in einen Körper von 37 °C sei der Schutzmechanismus gegen Leukozyten und kurz danach derjenige gegen die Monozyten ausgebildet.[4]
Von den hunderten von bekannten Bakterienstämmen sind nur wenige virulent. Die 40–50 Stämme von Yersinia pestis haben bei Mäusen eine große Bandbreite der Dosis, bei der die Hälfte der Versuchstiere stirbt (LD50), von unter 3 bis 100 Millionen.[5]
Bricht der Krankheitserreger in die Blutbahn ein, was in 50–90 % der unbehandelten Fälle geschieht, so entsteht die Pestsepsis, also eine Streuung in die Blutbahn. Auf diesem Wege können praktisch alle Organe befallen werden. Unter anderem kommt es zur Lungenpest. Die Gefahr bei der Vermehrung innerhalb des Menschen ergibt sich aus der Ausbildung diverser Pathogenitätsfaktoren bei einer Umgebungstemperatur von 37 °C, also Körpertemperatur. So bildet Yersinia pestis bei dieser Temperatur eine antiphagozytär wirkende Kapsel aus, die als Fraktion 1 (F1) bezeichnet wird, und zwei weitere antiphagozytäre Antigene, die Virulenzantigene V und W. In Bezug auf die Virulenz des Erregers bedeutet dies, dass im Falle der Lungenpest die Übertragung von Mensch zu Mensch möglich ist, wenn es zu Kontakt mit hochinfektiösem Sputum eines an Lungenpest Erkrankten kommt. In diesem Fall kann sich innerhalb von Stunden eine primäre Lungenpest ausbilden.
R. Devignat teilte 1951 die Pestbakterien in 3 Hauptvarianten nach den starken biochemischen Unterschieden ein: Variante 1 (später „Orientalis“ genannt) soll ihren Ausgangspunkt in Indien, Burma und im südlichen Festlandchina gehabt haben. Sie soll für die Pandemie von 1890 verantwortlich und in wenigen Jahren über die ganze Erde verbreitet worden sein. Variante 2 („Antiqua“ genannt), die er für die älteste hielt, soll in Zentral-Asien entstanden sein und sich über Zentralafrika verbreitet haben und die Justinianische Pest im sechsten Jahrhundert verursacht haben. Die dritte Variante („Medievalis“) stamme ebenfalls aus Zentralasien, soll sich in Richtung Krim und der Umgebung des Kaspischen Meeres verbreitet und dann den Schwarzen Tod in Europa und die folgenden Epidemien ausgelöst haben.[6] Dieses Modell war lange Zeit Grundlage für die Erklärung der Ausbreitungswege. Später stellte sich heraus, dass beide Hauptvarianten „Medievalis“ und „Antiqua“ in Kenia auftraten und „Orientalis“ und „Medievalis“ zusammen in der Türkei gefunden wurden.[7] Jeder dieser drei Pandemien wird einem Biovar zugeordnet, eine sich durch spezifische biochemische Eigenschaften unterscheidende Variante der Spezies Yersinia pestis.
Mark Achtmann und andere kamen 1999 in ihren Studien zu dem Ergebnis, dass Yersinia pestis ein mutierter Klon seines nahen Verwandten Yersinia pseudotuberculosis ist, ein relativ harmloses Bakterium, das Magenbeschwerden verursachen kann und nur äußerst selten zum Tode führt. Die beiden Arten haben über 90 % des Genmaterials gemeinsam und würden nach taxonomischen Regeln als Varianten der gleichen Art bezeichnet, wenn sie nicht aus klinischen Gründen scharf unterschieden werden müssten. Die Autoren meinten, dass diese Variante höchstens 20.000 Jahre alt sein könne, das unsicherere Mindestalter aber wahrscheinlich bei 1000 Jahren liege.[8]
1997 wurde ein Pestbakterienstamm beschrieben, der multiresistent gegen Antibiotika war. Da er in älteren Proben nicht zu finden war, scheint er nach den Aussagen der Forscher erst 1995 entstanden zu sein.[9]
Den ersten umfassenden durch Genomanalyse gestützten Blick auf etwa 1000 Isolate von Y. pestis gewannen Morelli und andere 2010 in einer Untersuchung, die zeigte, dass die ältesten pathogenen Stämme in China oder Russland entstanden sein mussten. Es fanden sich weitere Zusammenhänge in der Ausbreitung der Stämme mit dem Handel über die Seidenstraße, den Expeditionen von Zheng He und der dritten Pandemie von 1894.[10]
2011 schließlich hatten Bos, Schuenemann und andere die Gelegenheit, das Genom von Pestbakterien zu untersuchen, die aus Zähnen mittelalterlicher Londoner Leichen isoliert werden konnten. Ein Vergleich mit anderen bekannten Stämmen zeigte, dass es sich um Stämme handelte, die mit den ältesten Stämmen aus China am nächsten verwandt sein müssen. Das bedeutet beispielsweise, dass die mittelalterliche Epidemie tatsächlich von Asien ausging. Es bedeutet überraschenderweise auch, dass, wenn es wirklich noch frühere Pestepidemien gab, deren Stämme ausgestorben sind, da alle heute bekannten Stämme Abkömmlinge der Mittelalter-Variante sind.[11]
Verglichen mit seinem nächsten Verwandten, Yersinia pseudotuberculosis, hat Yersinia pestis im Laufe seiner Evolution die Fähigkeit verloren, im Boden zu überdauern. Im Gegenzug hat das Stäbchenbakterium zahlreiche neue Eigenschaften erworben, so diverse Virulenzfaktoren und Mechanismen zur Adaptation an entsprechende Säugetierwirte und parasitäre Vektoren.[12][13]
Die Pest befiel bereits Gemeinschaften der späten Jungsteinzeit. Spuren des Erregers lassen sich in einem Zeitraum von vor 4800 bis etwa vor 3800 Jahren in Skeletten aus ganz Europa nachweisen.[14][15]
Die frühen bronzezeitlichen Erreger konnten nur die primäre Lungenpest[16] auslösen, weil ihnen das Gen „ymt“ fehlte, welches für die stabile Besiedlung von Flöhen (Flohmagen) durch Y. pestis nötig ist. So bildet der Pesterreger im Vektor Floh einen Biofilm, der wie ein Vormagenblock wirkt. Der Parasit kann damit nicht mehr abschlucken, wird hungrig und beißwütig und wechselt den Wirt. Dieser wissenschaftlich bestätigte Algorithmus bewirkt eine effiziente Verbreitung des Pesterregers auf andere Säugetierindividuen oder auch den Menschen.
Die Genome von Y. pestis der frühen Epochen zeigten eine ausgestorbene Variante des Erregers, die auf das späte Neolithikum und die frühe Bronzezeit datiert werden konnte. Die Genome jener frühen Varianten sind in ihren genetischen Merkmalen mit den späteren Pesterregern nicht völlig identisch, so fehlen Virulenzfaktoren die sich Vektoren (Flöhe) bedienen können und die ihre Verbreitung dadurch effizienter machen, durch die Fähigkeit, in Flöhen zu überleben, was den Hauptübertragungsweg der Krankheit auf Menschen und andere Säugetiere darstellt.[17] Im April 2022 wurden diese Ergebnisse bestätigt und gezeigt, dass es vor 2.500 in Eurasien zwei verschiedene Formen von Y. pestis gab.[18]
Damit sich die Pathogenität und Virulenz des Pesterregers über die natürlichen Nagetier-Reservoire und den Hauptvektor Floh ändern konnte, setzte es eine Veränderung (Mutation, Selektion) von Virulenzfaktoren voraus, die sowohl auf dem Bakterienchromosom als auch auf dessen Plasmiden kodiert sind.[19][20] Dabei unterschieden sich das Genom der frühen Peststämme von den späteren Varianten.[21][22] Wie bei allen Yersinien sind plasmidkodierte Virulenzfaktoren vorhanden.
Zwei für Y. pestis spezifische Plasmide, „pMT1“ und „pPCP1“, tragen zahlreiche Virulenz-Gene, so bildet das Proteinprodukt eine Proteinkapsel aus, das sogenannte „F1-Antigen“. Dieses schützt Yersinia pestis vor der primären Immunantwort im Säugetierorganismus. Oder, eine membran-ständige Protease, ein „Plasminogen-Aktivator“, der die fibrinolytische Aktivität beeinflusst und dem Erreger über einen langen Zeitraum hinweg ermöglicht im intravasal zu persistieren und eine komplement-meditierte Zelllyse verhindert. Anderseits können andere Yersinia-assoziierte Faktoren zur Sepsis und unter Umständen zu einer Disseminierte intravasale Koagulopathie führen. Diese und weitere pathogene Eigenschaften verleihen Yersinia pestis seinen hochpathogenen Charakter.
Bei Yersinia sind es wohl 2 Plasmiden, die für pestis charakteristisch sind und seine Gefährlichkeit ausmachen. So wurde schon vermutet, dass eine plötzliche und umfassende Veränderung der Virulenz ein Hintergrundfaktor dafür gewesen sein kann, dass eine Pestepidemie plötzlich ausbrach und wieder verschwand, quer über die Jahrhunderte hindurch.[23] Gerade bei Viren und Bakterien ist eine Instabilität des Genmaterials zu beobachten, die zu vielen Mutationen führt. Inzwischen ist es gelungen, das gesamte Genom von Yersinia pestis zu entschlüsseln und zu kartografieren.[24] Dabei stellten die Forscher fest, dass das Bakterium genetische Besonderheiten aufweist, die auf häufige „intragenomische Rekombinationen“ hinweisen, dass es also in hohem Maße Gene anderer pathogener Organismen aufnehmen kann. Sie meinten, die Pestbakterien hätten Charakteristiken, die auf ständige Veränderungen hinwiesen.[24] Ein Jahr später entschlüsselte eine andere Forschergruppe einen anderen Bakterienstamm und bestätigte diese Einschätzung.[25] Annie Guiyoule und Bruno Rasoamanana untersuchten in Madagaskar die Gebiete mit besonders hoher Pestaktivität in den letzten Jahrzehnten. Sie isolierten 187 verschiedene Stämme aus der Zeit von 1926 bis 1996.[26]
Bei moderaten Temperaturen überlebt Y. pestis an den Mundwerkzeugen der Flöhe rund 3 Stunden.[27] Bereits 1944 ist festgestellt worden, dass Pestbakterien in Salzlösung und einer Temperatur um 25 °C bis zu 2 Wochen, bei 2–4 °C sogar bis zu zwei Jahre außerhalb eines Wirtstieres überleben und virulent sein können.[28] Experimente in der 1. Hälfte des 20 Jh. zeigten auch, dass Sonnenlicht die Bakterien rasch abtötet, die Lebensdauer jedoch stark von der Umgebung der Bakterien abhängt, insbesondere von deren Unterlage. In dünner Lauge auf Glas sterben die Bakterien innerhalb 1 Stunde ab, bei einer dicken Bakterienschicht vervierfachte sich die Lebensdauer und auf Stoff aus Hanf lebten sie bis zu 14 Stunden.[29] Während Temperaturen bei 55 °C tödlich sind, schaden ihnen niedrige Temperaturen nicht. In der Mandschurei wurden sogar noch virulente Bakterien in gefrorenen Pestleichen gefunden. Auch konnten die Bakterien fast einen Monat in Kornstaub überleben, der von infektiösen Ausscheidungen verunreinigt war.[30] Pestbakterien können Menschen bei Raumtemperatur und normaler Luftfeuchtigkeit in einem Zeitraum von mehr als 5 Tagen infizieren.[31]
Flöhe, insbesondere aber der Rattenfloh Xenopsylla cheopis können den Pesterreger übertragen. Aber auch Nosopsyllus fasciatus und der Menschenfloh Pulex irritans werden diskutiert, da Xenopsylla cheopis auf tropische Temperaturen angewiesen ist und in Europa nicht überleben kann. Flöhe sind blutsaugende Parasiten, die ihren Wirt direkt mit Y. pestis infizieren können. Wechselt der Rattenfloh von einem infizierten Nager – beispielsweise der Wanderratte oder der Hausratte – nach dessen Tod auf einen anderen Wirt, etwa Haustiere oder Menschen, ist er in der Lage, diese mit dem Pestbakterium zu infizieren. Dabei kann die Pesterkrankung für den Menschen ebenso tödlich sein wie für die Ratten.
An der Bissstelle kommt es zu einer lokalen Infektion, die durch die Ausbildung einer Pustel gekennzeichnet ist und zur sogenannten Bubonenpest (Beulenpest) führt.
Bei der septischen (blutvergiftenden) Form wird nicht immer eine Pestbeule entwickelt. Der Patient stirbt schnell ohne besondere äußere Symptome, aber mit einer hohen Bakterienkonzentration im Blut. Wenn diese Pestbakterien die Lunge angreifen, so wird diese Form als „sekundäre Lungenpest“ bezeichnet, die die gefährlichste Form mit dem raschesten Verlauf bildet. Neben hohem Fieber ist der blutige Auswurf eines der wenigen äußeren Symptome.
Die blutvergiftende Wirkung wird ausgelöst, wenn die Bakterien ihren normalen Lebenszyklus vollenden und absterben. Dabei werden große Mengen toxischen Sekrets direkt in den Blutkreislauf abgegeben; Nieren und Leber können nekrotisch werden, wenn sie versuchen, das System von Toxinen zu reinigen. Am Ende erliegt das Opfer einem toxischen Schock.
In Deutschland ist der direkte oder indirekte Nachweis von Y. pestis namentlich meldepflichtig nach des Infektionsschutzgesetzes (IfSG), soweit der Nachweis auf eine akute Infektion hinweist. Diese Meldepflicht für den Erreger betrifft in erster Linie die Leitungen von Laboren ( IfSG).
In der Schweiz ist der positive und negative laboranalytische Befund zu Y. pestis für Laboratorien meldepflichtig und zwar nach dem Epidemiengesetz (EpG) in Verbindung mit der Epidemienverordnung und der Verordnung des EDI über die Meldung von Beobachtungen übertragbarer Krankheiten des Menschen.
Yersinia pestis – auch Pestbakterium und Pestbazillus genannt – ist ein gramnegatives, unbegeißeltes, sporenloses, fakultativ anaerobes Stäbchenbakterium. Es zählt zu den Enterobakterien und ist der Erreger der Lungen- und Beulenpest.
Yersinia pestis wurde von Alexandre Émile Jean Yersin 1894 entdeckt und von diesem Pasteurella pestis genannt. Seit 1944 wird das bis dahin der Gattung Pasteurella zugerechnete Bakterium in die nach Yersin benannte Gattung Yersinia gestellt.
Peşte, laşhelîn an mirina reş (navê zanistî yê bi latînî: Yersinia pestis) nexweşiyeke mîkrobîk e.
Di serdema navîn, di salên 1347-1353 de bûye sedemê yek ji sê parên niştecihên Ewropayê. Herwekî li Ewropa bi navê "Mirina Reş" hatiye binavkirin. Bi kurdî ji vê nexweşiyê re peşte yan laşhelîn tê gotin. Di çanda devkî ya kurdî de li ser peşteyê gelek tişt tên gotin. Kivşeye zemanekê li Kurdistanê jî bi neyîni navdar bûye.
Herçendî dermanên nûjen pêşî li vê nexweşiyê girtibin jî, dîsa li welatên xizan tê dîtin. Agahî nîne ku li Kurdistanê xwe dide der an na. Nexweşî têger (bisaw) e.
Vê nexweşiyê di çand û wêjeya Ewropa de cihekê mezin girtiye. Bi navê peşta bûbonîk, pnomîk, gastroîntestînal û septîsemîk cureyên wê yî sereke hene.
Yersinia pestis[1] es un bacterio que causa le morbo appellate le peste.
Yersinia pestis es un bacillo. Illo es le bacterio[2] que ha essite identificate como le agente infective del peste bubonic. Iste bacterio alsi causa duo altere formas del peste: peste septicemic e peste pneumonic.[3] Iste tres formas del peste esseva responsible pro un grande numero de mortes in multe epidemicas in le historia human. Il es credite que iste maladias son le causa del Morte Nigre, que occideva circa un tertie del population europee inter 1347 e 1353.
Le bacillo era discoperite per le medico Helvetico-Francico Alexandre Yersin durante un epidemia del peste in Hong Kong, in 1894.[4] Yersin travaliava al Instituto Pasteur al tempore. Originalmente, le microoganismo era appellate Pasteurella pestis. Illo era reappellate in 1967.
Al presente tres varietates de Y. pestis son cognoscite.
Yersinia pestis (Lehmann et Neumann 1896) van Loghem 1944. N.L. fem. n. (Neolatinum substantivum femininum) in que 'Yersinia', es nomine de bacteriologo A. J. E. Yersin, que primus fuit que identificava le organismo in le anno 1894.[5]
Το Yersinia pestis[1] (πρώην γνωστό Pasteurella pestis) είναι γκραμ-αρνητικό, μη-κινητό, ραβδικά διαμορφωμένο, βακτήριο κοκκοβακκίλου, χωρίς σπόρια. Είναι προαιρετικώς αναερόβιος οργανισμός.[2] Το βακτήριο είναι γνωστό για την πρόκληση της πανώλης, η οποία εκδηλώνεται σε τρεις κύριους τύπους.[3][4]
Και οι τρεις μορφές ευθύνονται για επιδημίες υψηλής θνησιμότητας καθ'όλη την ανθρώπινη ιστορία, συμπεριλαμβανομένης της Πανούκλας του Ιουστινιανού κατά τον έκτο αιώνα, την μαύρη πανώλη η οποία σκότωσε το ένα τρίτο τουλάχιστον του Ευρωπαϊκού πληθυσμού μεταξύ του 1347 και 1353 και τη Μεγάλη Πανούκλα του Λονδίνου το 1665, η οποία έληξε το 1666 με την Μεγάλη Πυρκαγιά του Λονδίνου. Τέλος, 2 αιώνες αργότερα ξέσπασε η Τρίτη Πανδημία, γνωστή και ως Σύγχρονη Πανώλη, η οποία ξεκίνησε στα τέλη του 19ου αιώνα στην Κίνα και εξαπλωνόταν από αρουραίους σε ατμόπλοια, σκοτώνοντας περίπου 10.000.000 άτομα.[5][6][7][8]
Σύμφωνα με έρευνες αυτές οι πανώλεις πιθανότατα προήλθαν από την Κίνα και μεταδόθηκαν στην Ευρώπη μέσω εμπορικών διαδρομών.[8][9] Έρευνα του 2018 ανέφερε ότι η πανώλη ίσως ήταν η αιτία της Νεολιθικής εποχής παρακμής, όπου οι ευρωπαϊκοί πληθυσμοί μειώθηκαν σημαντικά.[10] Αν αληθεύει, αυτό θα μετατοπίσει την ημερομηνία πρώτης εμφάνισης της πανώλης πολύ νωρίτερα απ'ότι νομιζόταν προηγουμένως, ενώ πλέον θα θεωρείται ότι προήλθε στην Ευρώπη και όχι στην Ευρασία.
Το Y. pestis ανακαλύφθηκε το 1894 από τον Αλεξάντρ Υερσέν, ελβετογάλλο ιατρό και βακτηριολόγο του Ινστιτούτου Παστέρ. Η ανακάλυψη έγινε κατά τη διάρκεια της πανώλης στο Χονγκ Κονγκ.[11] Ο Υερσέν ήταν μέλος της σχολής σκέψης Παστέρ. Ο Κιτασάτο Σιμπασαμπουρόου, Ιάπωνας βακτηριολόγος εκπαιδευμένος στην Γερμανία και ασκητής της μεθοδολογίας του Κοχ, απασχολήθηκε την ίδια περίοδο στην προσπάθεια εύρεσης του βακτηρίου που προκαλούσε τη πανώλη.[12] Ωστόσο, ο Υερσέν συνέδεσε τη πανώλη με το Y. pestis. Παλαιότερα το βακτήριο είχε το όνομα Pasteurella pestis, ωστόσο μετονομάστηκε σε Yersinia pestis το 1944.
Κάθε χρόνο, σύμφωνα με τον Παγκόσμιο Οργανισμό Υγείας υπάρχουν χιλιάδες κρούσματα πανώλης, αν και με την ύπαρξη κατάλληλης θεραπείας, η πρόγνωση για τα θύματα είναι τώρα πολύ καλύτερα. Κατά την εποχή του Πολέμου του Βιετνάμ, καταγράφηκε πενταπλάσια με εξαπλάσια άνοδος των κρουσμάτων λόγω της διαταραχής των οικοσυστημάτων και τη μεγαλύτερη εγγύτητα μεταξύ των ανθρώπων και των ζώων. Τώρα τα περισσότερα κρούσματα πανώλης καταγράφονται στην υποσαχάρια Αφρική και την Μαδαγασκάρη, όπου καταγράφονται πάνω από το 95% των κρουσμάτων. Η πανώλη έχει επίσης αρνητικές συνέπειες για πρωτεύοντα θηλαστικά.[13]
Yersinia pestis (ranije Pasteurella pestis) jest bakterija, Gram-negativni štapić, iz roda Yersinia, koji kod ljudi može uzrokovati bolest kugu.
Bakterija je fakultativni anaerob, a primarno je bolest glodavaca. Kroz historiju je najpoznatiji oblik kuge, bubonska kuga, bolest koja je uzela velik broj života, pa se čak i dio historije naziva Doba kuge. Bubonska kuga se širi ugrizom buhe, koja sa zaraženog glodavca prenese bakteriju na čovjeka. Ostali poznatiji primarni oblici bolesti koje može uzrokovati Yerisnia pestis su plućna kuga i septička kuga. Bakterija rijetko može izazvati faringitis ili primarni meningitis.
Bakteriju je otkrio Alexandre Yersin, švicarsko-francuski bakteriolog, 1894. tokom epidemije kuge u Hong Kongu.
Yersinia pestis as en bakteerium, diar a pest ütjliaset.
Yersinia pestis as faan Alexandre Émile Jean Yersin 1894 fünjen wurden.
Yersinia pestis[1] (umwhile Pasteurella pestis) is a Gram-negative, rod-shapit coccobacillus, a facultative anaerobic organism that can infect humans via the oriental ratton flech.[2] It causes the deidly disease cried bubonic plague (or "the plague" colloquially).[3][4]
Yersinia pestis (umwhile Pasteurella pestis) is a Gram-negative, rod-shapit coccobacillus, a facultative anaerobic organism that can infect humans via the oriental ratton flech. It causes the deidly disease cried bubonic plague (or "the plague" colloquially).
Yersinia pestis es un bacterio que causa le morbo appellate le peste.
Yersinia pestis es un bacillo. Illo es le bacterio que ha essite identificate como le agente infective del peste bubonic. Iste bacterio alsi causa duo altere formas del peste: peste septicemic e peste pneumonic. Iste tres formas del peste esseva responsible pro un grande numero de mortes in multe epidemicas in le historia human. Il es credite que iste maladias son le causa del Morte Nigre, que occideva circa un tertie del population europee inter 1347 e 1353.
Le bacillo era discoperite per le medico Helvetico-Francico Alexandre Yersin durante un epidemia del peste in Hong Kong, in 1894. Yersin travaliava al Instituto Pasteur al tempore. Originalmente, le microoganismo era appellate Pasteurella pestis. Illo era reappellate in 1967.
Al presente tres varietates de Y. pestis son cognoscite.
Το Yersinia pestis (πρώην γνωστό Pasteurella pestis) είναι γκραμ-αρνητικό, μη-κινητό, ραβδικά διαμορφωμένο, βακτήριο κοκκοβακκίλου, χωρίς σπόρια. Είναι προαιρετικώς αναερόβιος οργανισμός. Το βακτήριο είναι γνωστό για την πρόκληση της πανώλης, η οποία εκδηλώνεται σε τρεις κύριους τύπους.
Και οι τρεις μορφές ευθύνονται για επιδημίες υψηλής θνησιμότητας καθ'όλη την ανθρώπινη ιστορία, συμπεριλαμβανομένης της Πανούκλας του Ιουστινιανού κατά τον έκτο αιώνα, την μαύρη πανώλη η οποία σκότωσε το ένα τρίτο τουλάχιστον του Ευρωπαϊκού πληθυσμού μεταξύ του 1347 και 1353 και τη Μεγάλη Πανούκλα του Λονδίνου το 1665, η οποία έληξε το 1666 με την Μεγάλη Πυρκαγιά του Λονδίνου. Τέλος, 2 αιώνες αργότερα ξέσπασε η Τρίτη Πανδημία, γνωστή και ως Σύγχρονη Πανώλη, η οποία ξεκίνησε στα τέλη του 19ου αιώνα στην Κίνα και εξαπλωνόταν από αρουραίους σε ατμόπλοια, σκοτώνοντας περίπου 10.000.000 άτομα.
Σύμφωνα με έρευνες αυτές οι πανώλεις πιθανότατα προήλθαν από την Κίνα και μεταδόθηκαν στην Ευρώπη μέσω εμπορικών διαδρομών. Έρευνα του 2018 ανέφερε ότι η πανώλη ίσως ήταν η αιτία της Νεολιθικής εποχής παρακμής, όπου οι ευρωπαϊκοί πληθυσμοί μειώθηκαν σημαντικά. Αν αληθεύει, αυτό θα μετατοπίσει την ημερομηνία πρώτης εμφάνισης της πανώλης πολύ νωρίτερα απ'ότι νομιζόταν προηγουμένως, ενώ πλέον θα θεωρείται ότι προήλθε στην Ευρώπη και όχι στην Ευρασία.
Το Y. pestis ανακαλύφθηκε το 1894 από τον Αλεξάντρ Υερσέν, ελβετογάλλο ιατρό και βακτηριολόγο του Ινστιτούτου Παστέρ. Η ανακάλυψη έγινε κατά τη διάρκεια της πανώλης στο Χονγκ Κονγκ. Ο Υερσέν ήταν μέλος της σχολής σκέψης Παστέρ. Ο Κιτασάτο Σιμπασαμπουρόου, Ιάπωνας βακτηριολόγος εκπαιδευμένος στην Γερμανία και ασκητής της μεθοδολογίας του Κοχ, απασχολήθηκε την ίδια περίοδο στην προσπάθεια εύρεσης του βακτηρίου που προκαλούσε τη πανώλη. Ωστόσο, ο Υερσέν συνέδεσε τη πανώλη με το Y. pestis. Παλαιότερα το βακτήριο είχε το όνομα Pasteurella pestis, ωστόσο μετονομάστηκε σε Yersinia pestis το 1944.
Κάθε χρόνο, σύμφωνα με τον Παγκόσμιο Οργανισμό Υγείας υπάρχουν χιλιάδες κρούσματα πανώλης, αν και με την ύπαρξη κατάλληλης θεραπείας, η πρόγνωση για τα θύματα είναι τώρα πολύ καλύτερα. Κατά την εποχή του Πολέμου του Βιετνάμ, καταγράφηκε πενταπλάσια με εξαπλάσια άνοδος των κρουσμάτων λόγω της διαταραχής των οικοσυστημάτων και τη μεγαλύτερη εγγύτητα μεταξύ των ανθρώπων και των ζώων. Τώρα τα περισσότερα κρούσματα πανώλης καταγράφονται στην υποσαχάρια Αφρική και την Μαδαγασκάρη, όπου καταγράφονται πάνω από το 95% των κρουσμάτων. Η πανώλη έχει επίσης αρνητικές συνέπειες για πρωτεύοντα θηλαστικά.
Yersinia pestis as en bakteerium, diar a pest ütjliaset.
Yersinia pestis as faan Alexandre Émile Jean Yersin 1894 fünjen wurden.
எர்சினியா பெசுட்டிசு (Yersinia pestis, மாற்று ஒலிப்பு:யெர்சினியா பெஸ்டிஸ்) ஓர் கோலுயிரி ஆகும். இது ஓர் பாக்டீரியாவுமாகும்.[1] அரையாப்பு பிளேக்கு நோய்த்தொற்றுக்கு நோய்க்காரணியாக இது அடையாளம் காணப்பட்டடுள்ளது. இதனால் குருதிநச்சு பிளேக்கு, வளியிய பிளேக்கு போன்ற மற்றவகையான பிளேக் நோய்களும் உண்டாகின்றன.[2] இந்த மூன்று வகையான பிளேக்கு நோய்களும் மனிதவரலாற்றில் உலகின் கூடுதலான நோயிறப்புக்கள் உண்டான பெரும் பிளேக், கறுப்புச் சாவு போன்ற பல கொள்ளைநோய்களுக்குக் காரணமாக அமைந்துள்ளன. 1347க்கும் 1353க்கும் இடையே கறுப்புச் சாவின்போது மட்டுமே ஐரோப்பாவின் மக்கள்தொகையில் மூன்றில் ஒருவர் இறந்துள்ளனர்.
இந்தக் கோலுயிரியை மருத்துவர் அலெக்சாண்டர் எர்சின் 1894இல் ஆங்காங்கில் ஏற்பட்ட பிளேக் தொற்றுநோயின்போது கண்டறிந்தார்.[3] அப்போது எர்சின் பாஸ்டர் கழகத்திற்காக பணிபுரிந்து வந்தார். அப்போது இதற்கு பாஸ்டரெல்லா பெஸ்டிஸ் என்று பெயரிடப்பட்டது. 1967இல் இதனைக் கண்டறிந எர்சினின் நினைவாக எர்சினியா பெசுட்டிசு என்று மறுபெயரிடப்பட்டது. தற்போது இதன் மூன்று பல்வகைகள் அடையாளப்படுத்தப்பட்டுள்ளன.
எர்சினியா பெசுட்டிசு (Yersinia pestis, மாற்று ஒலிப்பு:யெர்சினியா பெஸ்டிஸ்) ஓர் கோலுயிரி ஆகும். இது ஓர் பாக்டீரியாவுமாகும். அரையாப்பு பிளேக்கு நோய்த்தொற்றுக்கு நோய்க்காரணியாக இது அடையாளம் காணப்பட்டடுள்ளது. இதனால் குருதிநச்சு பிளேக்கு, வளியிய பிளேக்கு போன்ற மற்றவகையான பிளேக் நோய்களும் உண்டாகின்றன. இந்த மூன்று வகையான பிளேக்கு நோய்களும் மனிதவரலாற்றில் உலகின் கூடுதலான நோயிறப்புக்கள் உண்டான பெரும் பிளேக், கறுப்புச் சாவு போன்ற பல கொள்ளைநோய்களுக்குக் காரணமாக அமைந்துள்ளன. 1347க்கும் 1353க்கும் இடையே கறுப்புச் சாவின்போது மட்டுமே ஐரோப்பாவின் மக்கள்தொகையில் மூன்றில் ஒருவர் இறந்துள்ளனர்.
இந்தக் கோலுயிரியை மருத்துவர் அலெக்சாண்டர் எர்சின் 1894இல் ஆங்காங்கில் ஏற்பட்ட பிளேக் தொற்றுநோயின்போது கண்டறிந்தார். அப்போது எர்சின் பாஸ்டர் கழகத்திற்காக பணிபுரிந்து வந்தார். அப்போது இதற்கு பாஸ்டரெல்லா பெஸ்டிஸ் என்று பெயரிடப்பட்டது. 1967இல் இதனைக் கண்டறிந எர்சினின் நினைவாக எர்சினியா பெசுட்டிசு என்று மறுபெயரிடப்பட்டது. தற்போது இதன் மூன்று பல்வகைகள் அடையாளப்படுத்தப்பட்டுள்ளன.
Yersinia pestis (Y. pestis; formerly Pasteurella pestis) is a gram-negative, non-motile, coccobacillus bacterium without spores that is related to both Yersinia pseudotuberculosis and Yersinia enterocolitica. It is a facultative anaerobic organism that can infect humans via the Oriental rat flea (Xenopsylla cheopis).[1] It causes the disease plague, which caused the first plague pandemic and the Black Death, the deadliest pandemic in recorded history. Plague takes three main forms: pneumonic, septicemic, and bubonic. Yersinia pestis is a parasite of its host, the rat flea, which is also a parasite of rats, hence Y. pestis is a hyperparasite.
Y. pestis was discovered in 1894 by Alexandre Yersin, a Swiss/French physician and bacteriologist from the Pasteur Institute, during an epidemic of the plague in Hong Kong.[2][3] Yersin was a member of the Pasteur school of thought. Kitasato Shibasaburō, a Japanese bacteriologist who practised Koch's methodology, was also engaged at the time in finding the causative agent of the plague.[4] However, Yersin actually linked plague with a bacillus, initially named Pasteurella pestis; it was renamed Yersinia pestis in 1944.
Every year, between one thousand and two thousand cases of the plague are still reported to the World Health Organization.[5] With proper antibiotic treatment, the prognosis for victims is much better than before antibiotics were developed. A five- to six-fold increase in cases occurred in Asia during the time of the Vietnam War, possibly due to the disruption of ecosystems and closer proximity between people and animals. The plague is now commonly found in sub-Saharan Africa and Madagascar, areas that now account for over 95% of reported cases. The plague also has a detrimental effect on non-human mammals;[6] in the United States, these include the black-tailed prairie dog and the endangered black-footed ferret.
Y. pestis is a non-motile coccobacillus, a facultative anaerobic bacterium with bipolar staining (giving it a safety pin appearance) that produces an antiphagocytic slime layer.[7] Similar to other Yersinia species, it tests negative for urease, lactose fermentation, and indole.[8] Its closest relatives are the gastrointestinal pathogen Yersinia pseudotuberculosis, and, more distantly, Yersinia enterocolitica.
Several complete genome sequences are available for various strains and subspecies of Y. pestis: strain KIM (of biovar Y. p. medievalis),[9] and strain CO92 (of biovar Y. p. orientalis, obtained from a clinical isolate in the United States).[10] In 2006 the genome sequence of a strain of biovar Antiqua was completed.[11] Some strains are non-pathogenic, such as that of strain 91001, whose sequence was published in 2004.[12]
Like Y. pseudotuberculosis and Y. enterocolitica, Y. pestis is host to the plasmid pCD1. It also hosts two other plasmids, pPCP1 (also called pPla or pPst) and pMT1 (also called pFra) that are not carried by the other Yersinia species. pFra codes for a phospholipase D that is important for the ability of Y. pestis to be transmitted by fleas.[13] pPla codes for a protease, Pla, that activates plasmin in human hosts and is a very important virulence factor for pneumonic plague.[14] Together, these plasmids, and a pathogenicity island called HPI, encode several proteins that cause the pathogenesis for which Y. pestis is famous. Among other things, these virulence factors are required for bacterial adhesion and injection of proteins into the host cell, invasion of bacteria in the host cell (via a type-III secretion system), and acquisition and binding of iron harvested from red blood cells (by siderophores). Y. pestis is thought to be descended from Y. pseudotuberculosis, differing only in the presence of specific virulence plasmids.
A comprehensive and comparative proteomics analysis of Y. pestis strain KIM was performed in 2006.[15] The analysis focused on the transition to a growth condition mimicking growth in host cells.
Numerous bacterial small noncoding RNAs have been identified to play regulatory functions. Some can regulate the virulence genes. Some 63 novel putative sRNAs were identified through deep sequencing of the Y. pestis sRNA-ome. Among them was Yersinia-specific (also present in Y. pseudotuberculosis and Y. enterocolitica) Ysr141 (Yersinia small RNA 141). Ysr141 sRNA was shown to regulate the synthesis of the type III secretion system (T3SS) effector protein YopJ.[16] The Yop-Ysc T3SS is a critical component of virulence for Yersinia species.[17] Many novel sRNAs were identified from Y. pestis grown in vitro and in the infected lungs of mice suggesting they play role in bacterial physiology or pathogenesis. Among them sR035 predicted to pair with SD region and transcription initiation site of a thermo-sensitive regulator ymoA, and sR084 predicted to pair with fur, ferric uptake regulator.[18]

In the urban and sylvatic (forest) cycles of Y. pestis, most of the spreading occurs between rodents and fleas. In the sylvatic cycle, the rodent is wild, but in the urban cycle, the rodent is primarily the brown rat (Rattus norvegicus). In addition, Y. pestis can spread from the urban environment and back. Transmission to humans is usually through the bite of infected fleas. If the disease has progressed to the pneumonic form, humans can spread the bacterium to others by coughing, vomiting, and possibly sneezing.
Several species of rodents serve as the main reservoir for Y. pestis in the environment. In the steppes, the natural reservoir is believed to be principally the marmot. In the western United States, several species of rodents are thought to maintain Y. pestis. However, the expected disease dynamics have not been found in any rodent. Several species of rodents are known to have a variable resistance, which could lead to an asymptomatic carrier status.[19] Evidence indicates fleas from other mammals have a role in human plague outbreaks.[20]
The lack of knowledge of the dynamics of plague in mammal species is also true among susceptible rodents such as the black-tailed prairie dog (Cynomys ludovicianus), in which plague can cause colony collapse, resulting in a massive effect on prairie food webs.[21] However, the transmission dynamics within prairie dogs do not follow the dynamics of blocked fleas; carcasses, unblocked fleas, or another vector could possibly be important, instead.[22]
The CO92 strain was isolated from a patient who died from pneumonia and who contracted the infection from an infected cat.[10]
In other regions of the world, the reservoir of the infection is not clearly identified, which complicates prevention and early-warning programs. One such example was seen in a 2003 outbreak in Algeria.[23]
The transmission of Y. pestis by fleas is well characterized.[24] Initial acquisition of Y. pestis by the vector occurs during feeding on an infected animal. Several proteins then contribute to the maintenance of the bacteria in the flea digestive tract, among them the hemin storage system and Yersinia murine toxin (Ymt). Although Ymt is highly toxic to rodents and was once thought to be produced to ensure reinfection of new hosts, it is essential for flea colonization and for the survival of Y. pestis in fleas.[13][10]
The hemin storage system plays an important role in the transmission of Y. pestis back to a mammalian host.[25] While in the insect vector, proteins encoded by hemin storage system genetic loci induce biofilm formation in the proventriculus, a valve connecting the midgut to the esophagus.[26][27] The presence of this biofilm seems likely to be required for stable infection of the flea.[28] Aggregation in the biofilm inhibits feeding, as a mass of clotted blood and bacteria forms (referred to as "Bacot's block" after entomologist A.W. Bacot, the first to describe this phenomenon).[29] Transmission of Y. pestis occurs during the futile attempts of the flea to feed. Ingested blood is pumped into the esophagus, where it dislodges bacteria lodged in the proventriculus, which is regurgitated back into the host circulatory system.[29]
Pathogenesis due to Y. pestis infection of mammalian hosts is due to several factors, including an ability of these bacteria to suppress and avoid normal immune system responses such as phagocytosis and antibody production. Flea bites allow for the bacteria to pass the skin barrier. Y. pestis expresses a plasmin activator that is an important virulence factor for pneumonic plague and that might degrade on blood clots to facilitate systematic invasion.[14] Many of the bacteria's virulence factors are antiphagocytic in nature. Two important antiphagocytic antigens, named F1 (fraction 1) and V or LcrV, are both important for virulence.[7] These antigens are produced by the bacterium at normal human body temperature. Furthermore, Y. pestis survives and produces F1 and V antigens while it is residing within white blood cells such as monocytes, but not in neutrophils. Natural or induced immunity is achieved by the production of specific opsonic antibodies against F1 and V antigens; antibodies against F1 and V induce phagocytosis by neutrophils.[30]
In addition, the type-III secretion system (T3SS) allows Y. pestis to inject proteins into macrophages and other immune cells. These T3SS-injected proteins, called Yersinia outer proteins (Yops), include Yop B/D, which form pores in the host cell membrane and have been linked to cytolysis. The YopO, YopH, YopM, YopT, YopJ, and YopE are injected into the cytoplasm of host cells by T3SS into the pore created in part by YopB and YopD.[31] The injected Yops limit phagocytosis and cell signaling pathways important in the innate immune system, as discussed below. In addition, some Y. pestis strains are capable of interfering with immune signaling (e.g., by preventing the release of some cytokines).
Y. pestis proliferates inside lymph nodes, where it is able to avoid destruction by cells of the immune system such as macrophages. The ability of Y. pestis to inhibit phagocytosis allows it to grow in lymph nodes and cause lymphadenopathy. YopH is a protein tyrosine phosphatase that contributes to the ability of Y. pestis to evade immune system cells.[32] In macrophages, YopH has been shown to dephosphorylate p130Cas, Fyb (FYN binding protein) SKAP-HOM and Pyk, a tyrosine kinase homologous to FAK. YopH also binds the p85 subunit of phosphoinositide 3-kinase, the Gab1, the Gab2 adapter proteins, and the Vav guanine nucleotide exchange factor.
YopE functions as a GTPase-activating protein for members of the Rho family of GTPases such as RAC1. YopT is a cysteine protease that inhibits RhoA by removing the isoprenyl group, which is important for localizing the protein to the cell membrane. YopE and YopT has been proposed to function to limit YopB/D-induced cytolysis.[33] This might limit the function of YopB/D to create the pores used for Yop insertion into host cells and prevent YopB/D-induced rupture of host cells and release of cell contents that would attract and stimulate immune system responses.
YopJ is an acetyltransferase that binds to a conserved α-helix of MAPK kinases.[34] YopJ acetylates MAPK kinases at serines and threonines that are normally phosphorylated during activation of the MAP kinase cascade.[35][36] YopJ is activated in eukaryotic cells by interaction with target cell phytic acid (IP6).[37] This disruption of host cell protein kinase activity causes apoptosis of macrophages, and this is proposed to be important for the establishment of infection and for evasion of the host immune response. YopO is a protein kinase also known as Yersinia protein kinase A (YpkA). YopO is a potent inducer of human macrophage apoptosis.[38]
It has also been suggested that a bacteriophage – Ypφ – may have been responsible for increasing the virulence of this organism.[39]
Depending on which form of the plague infects the individual, the plague develops a different illness; however, the plague overall affects the host cell's ability to communicate with the immune system, hindering the body bringing phagocytic cells to the area of infection.
Y. pestis is a versatile killer. In addition to rodents and humans, it is known to have killed camels, chickens, and pigs.[40] Domestic dogs and cats are susceptible to plague, as well, but cats are more likely to develop illness when infected. In either, the symptoms are similar to those experienced by humans, and can be deadly to the animal. People can be exposed by coming into contact with an infected animal (dead or alive), or inhaling infectious droplets that a sick dog or cat has coughed into the air.[41][42]
A formalin-inactivated vaccine was available in the United States for adults in 1993[43] at high risk of contracting the plague until removal from the market by the Food and Drug Administration. It was of limited effectiveness and could cause severe inflammation. Experiments with genetic engineering of a vaccine based on F1 and V antigens are underway and show promise. However, bacteria lacking antigen F1 are still virulent, and the V antigens are sufficiently variable such that vaccines composed of these antigens may not be fully protective.[44] The United States Army Medical Research Institute of Infectious Diseases has found that an experimental F1/V antigen-based vaccine protects crab-eating macaques, but fails to protect African green monkey species.[45] A systematic review by the Cochrane Collaboration found no studies of sufficient quality to make any statement on the efficacy of the vaccine.[46]
In 1894, two bacteriologists, Alexandre Yersin of Switzerland and Kitasato Shibasaburō of Japan, independently isolated in Hong Kong the bacterium responsible for the 1894 Hong Kong plague. Though both investigators reported their findings, a series of confusing and contradictory statements by Kitasato eventually led to the acceptance of Yersin as the primary discoverer of the organism. Yersin named it Pasteurella pestis in honor of the Pasteur Institute, where he worked. In 1967, it was moved to a new genus and renamed Yersinia pestis in his honor. Yersin also noted that rats were affected by plague not only during plague epidemics, but also often preceding such epidemics in humans and that plague was regarded by many locals as a disease of rats; villagers in China and India asserted that when large numbers of rats were found dead, plague outbreaks soon followed.
In 1898, French scientist Paul-Louis Simond (who had also come to China to battle the Third Pandemic) discovered the rat–flea vector that drives the disease. He had noted that persons who became ill did not have to be in close contact with each other to acquire the disease. In Yunnan, China, inhabitants would flee from their homes as soon as they saw dead rats, and on the island of Formosa (Taiwan), residents considered the handling of dead rats heightened the risks of developing plague. These observations led him to suspect that the flea might be an intermediary factor in the transmission of plague, since people acquired plague only if they were in contact with rats that had died less than 24 hours before. In a now classic experiment, Simond demonstrated how a healthy rat died of the plague after infected fleas had jumped to it from a rat that had recently died of the plague.[47] The outbreak spread to Chinatown, San Francisco, from 1900 to 1904 and then to Oakland and the East Bay from 1907 to 1909.[48] It has been present in the rodents of western North America ever since, as fear of the consequences of the outbreak on trade caused authorities to hide the dead of the Chinatown residents long enough for the disease to be passed to widespread species of native rodents in outlying areas.[49]
Three main strains are recognised: Y. p. antiqua, which caused a plague pandemic in the sixth century; Y. p. medievalis, which caused the Black Death and subsequent epidemics during the second pandemic wave; and Y. p. orientalis, which is responsible for current plague outbreaks.[50]
On January 15, 2018, researchers at the University of Oslo and the University of Ferrara suggested that humans and their parasites (most likely fleas and lice at the time) were the biggest carriers of the plague.[51][52]
In 2010, researchers in Germany definitively established, using PCR evidence from samples obtained from Black Death victims, that Y. pestis was the cause of the medieval Black Death.[53]
In 2011, the first genome of Y. pestis isolated from Black Death victims was published, and concluded that this medieval strain was ancestral to most modern forms of Y. pestis.[54]
In 2015, Cell published results from a study of ancient graves.[55] Plasmids of Y. pestis were detected in archaeological samples of the teeth of seven Bronze Age individuals, in the Afanasievo culture in Siberia, the Corded Ware culture in Estonia, the Sintashta culture in Russia, the Unetice culture in Poland, and the Andronovo culture in Siberia.[56] In 2018, the emergence and spread of the pathogen during the Neolithic decline (as far back as 6,000 years ago) was published.[57] A site in Sweden was the source of the DNA evidence and trade networks were proposed as the likely avenue of spread rather than migrations of populations. There is evidence that suggests Y. pestis may have originated in Europe in the Cucuteni–Trypillia culture, not in Asia as is more commonly believed.[57]
DNA evidence published in 2015 indicates Y. pestis infected humans 5,000 years ago in Bronze Age Eurasia,[55] but genetic changes that made it highly virulent did not occur until about 4,000 years ago.[58] The highly virulent version capable of transmission by fleas through rodents, humans, and other mammals was found in two individuals associated with the Srubnaya culture from the Samara region in Russia from around 3,800 years ago and an Iron Age individual from Kapan, Armenia, from around 2,900 years ago.[58][55] This indicates that at least two lineages of Y. pestis were circulating during the Bronze Age in Eurasia.[58] The Y. pestis bacterium has a relatively large number of nonfunctioning genes and three "ungainly" plasmids, suggesting an origin less than 20,000 years ago.[40]
On September 8, 2016, the Y. pestis bacterium was identified from DNA in teeth found at a Crossrail building site in London. The human remains were found to be victims of the Great Plague of London, which lasted from 1665 to 1666.[59]
In 2021, researchers found a 5,000-year-old victim of Y. pestis, the world's oldest-known, in hunter-gatherer remains in the modern Latvian and Estonian border area.[60]
496 cases were reported in the United States between 1970 and 2020. Cases have been found predominantly in New Mexico, Arizona, Colorado, California, Oregon, and Nevada.[61]
In 2008, plague was commonly found in sub-Saharan Africa and Madagascar, areas that accounted for over 95% of the reported cases.[6]
In September 2009, the death of Malcolm Casadaban, a molecular genetics professor at the University of Chicago, was linked to his work on a weakened laboratory strain of Y. pestis.[62] Hemochromatosis was hypothesised to be a predisposing factor in Casadaban's death from this attenuated strain used for research.[63]
On November 3, 2019, two cases of pneumonic plague were diagnosed at a hospital in Beijing's Chaoyang district, prompting fears of an outbreak. The patient was a middle-aged man with fever, who had complained of difficulty breathing for some ten days, accompanied by his wife with similar symptoms.[64] Police quarantined the emergency room at the hospital and controls were placed on Chinese news aggregators.[64] On 18 November a third case was reported, in a 55-year-old man from Xilingol League, one of the twelve Mongolian autonomous regions in Northern China. The patient received treatment, and 28 symptomless contacts were placed in quarantine.[65]
In July 2020, officials increased precautions after a case of bubonic plague was confirmed in Bayannur, a city in China's Inner Mongolia autonomous region. The patient was quarantined and treated. According to China's Global Times, a second suspected case was also investigated, and a level 3 alert was issued, in effect until the end of the year. It forbade hunting and eating of animals that could carry plague, and called on the public to report suspected cases.[66]
k
Yersinia pestis (Y. pestis; formerly Pasteurella pestis) is a gram-negative, non-motile, coccobacillus bacterium without spores that is related to both Yersinia pseudotuberculosis and Yersinia enterocolitica. It is a facultative anaerobic organism that can infect humans via the Oriental rat flea (Xenopsylla cheopis). It causes the disease plague, which caused the first plague pandemic and the Black Death, the deadliest pandemic in recorded history. Plague takes three main forms: pneumonic, septicemic, and bubonic. Yersinia pestis is a parasite of its host, the rat flea, which is also a parasite of rats, hence Y. pestis is a hyperparasite.
Y. pestis was discovered in 1894 by Alexandre Yersin, a Swiss/French physician and bacteriologist from the Pasteur Institute, during an epidemic of the plague in Hong Kong. Yersin was a member of the Pasteur school of thought. Kitasato Shibasaburō, a Japanese bacteriologist who practised Koch's methodology, was also engaged at the time in finding the causative agent of the plague. However, Yersin actually linked plague with a bacillus, initially named Pasteurella pestis; it was renamed Yersinia pestis in 1944.
Every year, between one thousand and two thousand cases of the plague are still reported to the World Health Organization. With proper antibiotic treatment, the prognosis for victims is much better than before antibiotics were developed. A five- to six-fold increase in cases occurred in Asia during the time of the Vietnam War, possibly due to the disruption of ecosystems and closer proximity between people and animals. The plague is now commonly found in sub-Saharan Africa and Madagascar, areas that now account for over 95% of reported cases. The plague also has a detrimental effect on non-human mammals; in the United States, these include the black-tailed prairie dog and the endangered black-footed ferret.
Yersinia pestis es un bacilo Gram negativo anaerobio facultativo y patógeno primario, del género Yersinia, que produce en el ser humano la peste pulmonar, la peste bubónica y también la peste septicémica, aunque la última es muy poco común. Esta bacteria causó la Peste Negra en Europa, la cual acabó con la vida de más de 200 millones de personas.
Originalmente, este microorganismo fue denominado Bacterium pestis hasta 1900, Bacillus pestis hasta 1923, Pasteurella pestis, hasta que en 1970 se le denominó Yersinia pestis en honor de Alexandre Yersin,[1][2][3] bacteriólogo franco-suizo del Instituto Pasteur, codescubridor de la bacteria en 1894 junto a Kitasato Shibasaburō, ambos de manera independiente.[2][3][4][5][6][7]
Yersinia pestis es un agente infeccioso que ha sido directamente responsable de más muertes humanas que cualquier otra enfermedad infecciosa, salvo la malaria.[cita requerida] Ha originado diversas pandemias a lo largo de la historia, entre las que cabe destacar: la plaga de Justiniano (541-542 d. C.), que asoló Asia, el norte de África, Arabia y parte de Europa; la peste negra (1347-1351 d. C.), que acabó con la vida de un tercio de la población de Europa; y la Tercera Pandemia (1855-1918), que comenzó en China e India y terminó por extenderse por el resto de Asia, África y América.
Cuando la epidemia de peste afectó a Hong Kong en 1894, el gobierno japonés y el Instituto Koch alemán mandaron una misión científica que incluía al médico y bacteriólogo japonés Kitasato Shibasaburō. Más o menos al mismo tiempo, el médico y bacteriólogo franco-suizo Alexandre Yersin fue enviado por el gobierno francés y el Instituto Pasteur en una misión similar. Ambos llegaron a Hong Kong en junio de 1894.[3] Al poco tiempo ambos descubrieron un nuevo tipo de bacteria en muestras de pacientes con peste y en los órganos de ratas muertas en la zona de la plaga.[8]
Kitasato Shibasaburō fue el primero en publicar, antes que Yersin, una primera descripción de un cultivo de Yersinia pestis en una comunicación preliminar en la revista médica The Lancet.[4] Pocos días después Yersin publicó su artículo donde describía de forma más completa que Shibasaburō la misma bacteria en Annales de l'Institut Pasteur,[5] y poco después Shibasaburō publicó el resto de sus hallazgos.[2][3][7]
El papel de Y. pestis en la peste negra se ha debatido entre los historiadores; algunos han sugerido que la peste negra se propagó muy rápido para haber sido causada por Y. pestis. Se ha encontrado ADN de Y. pestis en los dientes de aquellos que murieron de peste negra, sin embargo, cadáveres medievales que murieron de otras causas no dieron positivo para Y. pestis. Esto sugiere que fue un factor que contribuyó a las plagas europeas, pero probablemente no el único. Es posible que las presiones selectivas inducidas por la plaga puedan haber cambiado el modo en que el patógeno se manifiesta en humanos, seleccionándose en contra de individuos o poblaciones que eran más susceptibles.
El género Yersinia pertenece a las bacterias Gamma-proteobacteria en el orden enterobacteriales, por lo que es una Gram-negativas anaeróbicas facultativas con metabolismo fermentativo, es nitrato reductasa positiva, catalasa positiva y oxidasa negativa. Sus pruebas del IMViC son positivas para el rojo de metilo y el Voges Proskauer. Es un cocobacilo de tinción bipolar similar a otras Enterobacterias. Sus factores de virulencia más antigénicos como el Ag F1, Ag V y Ag W se expresan a 37 °C. Además posee una toxina que actúa sobre el miocardio y células hepáticas. Durante el proceso infeccioso genera viscosidad antifagocítica. El organismo presenta motilidad cuando es aislado, pero pierde esta capacidad mientras permanece en el mamífero hospedador. Tiene la capacidad de impedir la fagocitosis, esta capacidad está medida por el sistema de secreción tipo III. Cuando la bacteria está en contacto con las células fagocíticas, produce ciertas proteínas que van a impedir la fagocitosis, esto es producto del Gen Yop-H, induce citotoxicidad, producto del Gen Yop E, y produce la apoptosis, producto del gen Yop J-P.
El genoma de dos de las subespecies ha sido secuenciado: Y. pestis medievalis con 4,600,755 pares de bases y Y. pestis orientalis con 4,653,728 pares de bases.
La peste es una enfermedad natural de los roedores, siendo las ratas el principal reservorio de la enfermedad. Tras ser infectadas, la mayoría de las ratas mueren, pero un pequeño porcentaje sobrevive, quedando como una fuente de Y. pestis.
Las ratas son infectadas a través de un vector, que en este caso es la pulga de rata (Xenopsylla cheopis). La pulga chupa la sangre de un animal infectado e ingiere a la vez bacterias de Yersinia pestis, las cuales se multiplican en el intestino de la pulga y serán transmitidas a otra rata en la siguiente picadura de la pulga.
La enfermedad se irá extendiendo de forma que la mortalidad entre las ratas se hace tan elevada que la pulga busca nuevos hospedadores, entre los que se encuentra el hombre.
El 1 de mayo de 2015 se reportó el primer caso de contagio de Yersinia pestis en Atlanta (EE. UU.) de un perro a un humano.[9]
Las células de Y. pestis producen ciertas moléculas antigénicas que contribuyen en mayor o menor medida al proceso de la enfermedad.
Es el tipo de infección más común. Una vez que las bacterias han sido introducidas mediante la picadura de una pulga dentro de un ser humano, se desplazan por el torrente sanguíneo hasta los nódulos linfáticos donde generan pequeñas hinchazones denominadas bubones, que están llenos de partículas bacterianas. La cápsula viscosa que rodea a las células de Y. pestis evita que estas sean fagocitadas por los macrófagos.
En poco tiempo, los nódulos linfáticos periféricos se ven invadidos por bubones secundarios, hasta que se rompen y las células pasan de nuevo al torrente circulatorio, pero ahora en un número mucho más elevado, lo que causa una septicemia generalizada.
En este estado, se producen múltiples hemorragias que dan lugar a manchas negras sobre la piel, procesos de gangrena en los extremos distales de las extremidades, fuerte dolor en nódulos linfáticos, postración, shock y delirio. Si la peste no es tratada antes del estado septicémico, la muerte sobreviene al cabo de tres a cinco días.
Este tipo de infección se produce cuando las células de Y. pestis son inhaladas directamente, o bien llegan a los pulmones durante la peste bubónica. La infección suele transcurrir sin síntomas hasta los dos últimos días del proceso infectivo, en los cuales se emiten gran cantidad de esputos con sangre. En ausencia de tratamiento la muerte sobreviene en dos o tres días.
Esta infección implica una rápida dispersión de Y. pestis por todo el cuerpo, a través del torrente circulatorio, sin tiempo para que se formen los bubones. La muerte suele sobrevenir en un día, por lo que habitualmente no da tiempo a ser diagnosticada hasta la autopsia.
Se recogen muestras de sangre, esputos (en el caso de la peste neumónica) o aspirado ganglionar (en el caso de la peste bubónica). Se utilizan técnicas de inmunofluorescencia directa (IFD) y se realizan cultivos en un medio de agar-sangre a 28 °C y hemocultivo.
Y. pestis presenta resistencia natural a la penicilina, pero la mayoría de las cepas son sensibles a la estreptomicina, el cloranfenicol y las tetraciclinas. Actualmente hay ciertas evidencias de la sensibilidad de Y. pestis a gentamicina y doxiciclina.
Si el tratamiento se inicia rápidamente, la letalidad de la peste bubónica puede reducirse hasta el 1-5 % de los infectados. La peste neumónica y septicémica también pueden tratarse, pero suelen progresar tan rápidamente que los antibióticos siempre llegan tarde.
Yersinia pestis es un bacilo Gram negativo anaerobio facultativo y patógeno primario, del género Yersinia, que produce en el ser humano la peste pulmonar, la peste bubónica y también la peste septicémica, aunque la última es muy poco común. Esta bacteria causó la Peste Negra en Europa, la cual acabó con la vida de más de 200 millones de personas.
Katkubakter (Yersinia pestis) on bakteriliik Enterobacteriaceae sugukonna Yersinia perekonnast.
Bakter võib põhjustada mitmetel loomaliikidel (sh inimesel) katku haigestumist.
Aastatel 1942–1998 on inimestel, kirpudel ja väiksematel imetajatel tuvastatud kokku 76 katkubakteri tüve.
Y. pestis subsp. pestis 'el liigitatakse 3 biovars i: antiqua, mediaevalis ja orientalis.[2]
Katkubakter on gramnegatiivne bakter.
Arvatakse, et katkubakter on Yersinia pseudotuberculosis'e kloon, mille vanuseks on 1500 – 20 000 aastat.[3]
Arvatakse, et bakter nakatab metsikuid närilisi (ligi 200 liiki) ja neile ligipääsenud liigiomasete kirpude (ligi 80 liiki; vektorid) hammustuse vahendusel, aga ka katkubaktereid piiskadega õhu kaudu sisse hingates või bakteritega nakatunud haiguskolletega kokku puutudes jõuab bakter inimkehasse. Bakter võib surnud näriliste urgudes säilitada nakatumisvõime aastaid.
Mullas ja vees võib bakter kuid patogeensena püsida.
Inimese katkubakterinakkusel (Yersinia pestis'e nakkus) eristatakse kolme kliinilist vormi:
Katkubakteri patogeensus seisneb rohkes paljunemises ja nakatunud imetajate immuunkaitse mehhanismide ületamises. Bakter pääseb organismi näiteks kirbuhammustuse koha kaudu ja sealt edasi lümfiteede kaudu regionaalsetesse lümfisõlmedesse, sealt omakorda edasi vereringesse ning teistesse elunditesse.
Baktereid küll fagotsüteerivad spetsiaalsed rakud, kuid neid ei hävitata (põletikulised ja üles paistetanud lümfisõlmed).
Nakatunud organism vastab bakterile varieeruva sümptomaatikaga, kas soontesisese verehüübimise, hulgielundhäire või täiskasvanu respiratoorse distressi sündroomiga.
Katkuseptitseemia tüsistused on katkukopsupõletik, katkumeningiit, plague endophthalmitis, maksa- ja põrnaabstsess ning generaliseerunud lümfadenopaatia.[5]
Bakteri avastasid 1894. aastal Šveitsi päritolu prantsuse arst Alexandre Yersin ja dr Shibasaburo Kitasato (1852–1931).[6]
Teise maailmasõja ajal olevat Jaapani armee üksus 731 katsetanud katkubakterit bioloogilise relvana, vabastades elanikerohkete alade kohal Hiinas ja Mandžuurias katkubakteriga nakatunud kirpe.[7]
Katkubakter (Yersinia pestis) on bakteriliik Enterobacteriaceae sugukonna Yersinia perekonnast.
Bakter võib põhjustada mitmetel loomaliikidel (sh inimesel) katku haigestumist.
Yersinia pestis Yersinia generoko bakterioa da. Gram negatibo, anaerobio fakultatiboa eta lehen mailako patogenoa da.
Gizakian bere infekzioa hiru modutan agertzen da: izurri pneumoniko, izurri buboniko edo izurri septizemiko. Hirurek historiako epidemia nagusi batzuen erantzuleak izan ziren, tartean 542ko Justinianoren Izurria edo 1347 eta 1353 artean Europako biztanleriaren heren bat hil zuen Izurri Beltza[1][2]. Izurri guzti hauek Txinako karraskariek hedadu zuten[3]. Azken urte hauetan, estatubatuar CDC agentziak bioterrorismoaren Y. pestisen erabilera ikertu du.
Yersinia generoaren izena Alexandre Yersin frantziar-suitzar bakteriologoaren omenez jarri zuten, bakterioa estreinakoz isolatu zuena 1894an. Hori zela eta, mikroorganismo honek hasieran pasteurella pestis izena izan arren, 1967tik aurrera yersinia pestis da.
Yersinia pestis kokobazilo Gram negatiboa da, anaerobio fakultatiboa. Katalasa (+), oxidasa (-), indol (-) eta ureasa (-) da [4]. Ez da mugikorra eta ez du esporarik sortzen.
Yersinia pestis bakterio oso birulentoa da, patogenoen artean birulentzia handienetarikoa. Bere birulentzia areagotzen duten substantzia asko ekoizten ditu: fagozitosiaren aurkako lipoproteinak bere zelula horman, exotoxina eta endotoxina batzuk, fibrinolisina eta koagulasa, etab.
Izurri bubonikoa eta izurri pneumonikoa dira mikrobio beldurgarri honek sortzen dituen gaitzak. Biek ala biek Erdi Aroan agertutako Izurri Beltzaren eragileak izan ziren. Pandemia horrek Europako bazterrak astindu zituen XIV. mendean, milioika hildako eraginez eta biztanleriaren herena akabatuz.
Yersinia pestis-ek karraskariak infektatzen ditu; izurri bubonikoaren atzean arratoiak daude jatorrian. Arkakusoak dira gaitza transmititzen dutenak, infektatutako arratoien odola xurgatzerakoan eta gizakiari -gero- ziztada egiterakoan. Izurri bubonikoa, beraz, zoonosi bat da.
Yersinia pestisen zelulak gizakian daudenean gongoil linfatikoetara joaten dira. Bertan gune handitu batzuk eragiten dituzte: buboiak. Ezaugarri hori dela eta gaitzari izurri buboniko deritzo [5].
Bakterio patogenoak immunitate-sistemaren zelulen fagozitosia saihesten du, zelula horman dituen lipoproteina bereziei esker. Garaiz tratatu ezean, gaitzak okerrera jotzen du: bakterioak odolera pasatzen dira eta benetako bakteriemia sortzen da, gaixoaren bizitza kinka larrian jartzen duena.
Yersinia pestis Yersinia generoko bakterioa da. Gram negatibo, anaerobio fakultatiboa eta lehen mailako patogenoa da.
Gizakian bere infekzioa hiru modutan agertzen da: izurri pneumoniko, izurri buboniko edo izurri septizemiko. Hirurek historiako epidemia nagusi batzuen erantzuleak izan ziren, tartean 542ko Justinianoren Izurria edo 1347 eta 1353 artean Europako biztanleriaren heren bat hil zuen Izurri Beltza. Izurri guzti hauek Txinako karraskariek hedadu zuten. Azken urte hauetan, estatubatuar CDC agentziak bioterrorismoaren Y. pestisen erabilera ikertu du.
Yersinia generoaren izena Alexandre Yersin frantziar-suitzar bakteriologoaren omenez jarri zuten, bakterioa estreinakoz isolatu zuena 1894an. Hori zela eta, mikroorganismo honek hasieran pasteurella pestis izena izan arren, 1967tik aurrera yersinia pestis da.
Yersinia pestis on bakteeri, joka aiheuttaa ruttoa. Bakteeri lisääntyy esimerkiksi Xenopsylla cheopis -kirpun suolistossa ja muodostaa sinne tukoksen. Kun kirppu puree esimerkiksi rottaa tai ihmistä, se saman tien oksentaa imemänsä veren ja osan bakteereista takaisin haavaan tai joskus suoraan uhrin verenkiertoon, aiheuttaen sairastumisen.[1] Yersinia pestisin eri kannat ovat aiheuttaneet aikojen kuluessa useita ruttoepidemioita.[2]
Yersinia pestis -bakteerin on DNA-tutkimusten perusteella arveltu alkaneen käyttää kirppuja väli-isäntinään korkeintaan 20 000 vuotta sitten, mutta myös 20 miljoonaa vuotta vanhasta meripihkassa säilyneestä kirpusta on löydetty sitä läheisesti muistuttavan bakteerin jäänteitä.[2]
Bakteerin vanhin tunnettu kanta on löydetty ruotsalaisesta haudasta, joka on noin 4900 vuotta vanha. Niihin aikoihin Euroopassa oli suuria asutuskeskuksia, joissa ruttokanta saattoi kehittyä.[3]
Vuonna 2015 julkaistussa DNA-tutkimuksessa havaittiin, että Yersinia pestisillä ei vielä 5000 vuotta sitten ollut geeniä, joka vaaditaan kirpun sisällä selviytymiseen.[4]
Ruton tiedettiin olevan tartuntatauti jo varhain, mutta sitä aiheuttava bakteeri löytyi vasta vuonna 1894 Hongkongiin levinneen ruttoepidemian yhteydessä. Sen löysivät toisistaan riippumatta sveitsiläinen Alexandre Yersin, japanilainen Shibasaburō Kitasato ja skotlantilainen James A. Lowson. Aluksi bakteerin nimenä oli Pasteurella pestis Louis Pasteurin mukaan. Sitä kutsuttiin myös Kitasato-yersinin basilliksi.[5][6]
Yersinia pestis on bakteeri, joka aiheuttaa ruttoa. Bakteeri lisääntyy esimerkiksi Xenopsylla cheopis -kirpun suolistossa ja muodostaa sinne tukoksen. Kun kirppu puree esimerkiksi rottaa tai ihmistä, se saman tien oksentaa imemänsä veren ja osan bakteereista takaisin haavaan tai joskus suoraan uhrin verenkiertoon, aiheuttaen sairastumisen. Yersinia pestisin eri kannat ovat aiheuttaneet aikojen kuluessa useita ruttoepidemioita.
Yersinia pestis -bakteerin on DNA-tutkimusten perusteella arveltu alkaneen käyttää kirppuja väli-isäntinään korkeintaan 20 000 vuotta sitten, mutta myös 20 miljoonaa vuotta vanhasta meripihkassa säilyneestä kirpusta on löydetty sitä läheisesti muistuttavan bakteerin jäänteitä.
Bakteerin vanhin tunnettu kanta on löydetty ruotsalaisesta haudasta, joka on noin 4900 vuotta vanha. Niihin aikoihin Euroopassa oli suuria asutuskeskuksia, joissa ruttokanta saattoi kehittyä.
Vuonna 2015 julkaistussa DNA-tutkimuksessa havaittiin, että Yersinia pestisillä ei vielä 5000 vuotta sitten ollut geeniä, joka vaaditaan kirpun sisällä selviytymiseen.
Ruton tiedettiin olevan tartuntatauti jo varhain, mutta sitä aiheuttava bakteeri löytyi vasta vuonna 1894 Hongkongiin levinneen ruttoepidemian yhteydessä. Sen löysivät toisistaan riippumatta sveitsiläinen Alexandre Yersin, japanilainen Shibasaburō Kitasato ja skotlantilainen James A. Lowson. Aluksi bakteerin nimenä oli Pasteurella pestis Louis Pasteurin mukaan. Sitä kutsuttiin myös Kitasato-yersinin basilliksi.
Yersinia pestis est une bactérie à Gram négatif du genre Yersinia. Elle est responsable de la peste.
Elle fut découverte en 1894 par Alexandre Yersin, un bactériologiste franco-suisse travaillant pour l'Institut Pasteur, durant une épidémie de peste à Hong Kong, en même temps que Kitasato Shibasaburō mais séparément. Kitasato tout d'abord la baptisa Pasteurella pestis en l'honneur de Pasteur. Ce n'est que plus tard qu'elle prit son nom actuel, en hommage à Yersin.
Yersinia pestis a été formellement identifiée comme responsable de la première et deuxième pandémie historique de peste, notamment dans une tombe de Bavière du VIe siècle, dans une fosse commune de la peste londonienne de 1665, ainsi que dans un charnier de la peste de 1720 à Marseille. Les descriptions précises des symptômes lors de la peste qui toucha l'Europe en 1347-1352 laissent également peu de doutes.
Yersinia pestis, de la famille des Enterobacteriaceæ, est un coccobacille court (en coque, de forme arrondie) de 0,5 à 0,8 μm de largeur sur 1 à 3 μm de longueur. Il est à Gram négatif, non flagellé, encapsulé, se colorant souvent (Giemsa et Wayson (en) ) en bipolaire de façon nette dans le frottis de pus[1].
La bactérie est aérobie et facultativement anaérobie. Sa culture est lente, mais facile sur des milieux standards à température optimum vers 28 - 30 °C, et jusqu'à 35 °C[1]. Elle ne produit pas d'uréase et reste immobile (différences avec les autres Yersinia).
Après 48 heures d'incubation, les colonies apparaissent fines, mates et translucides. Selon les milieux de culture elles sont blanchâtres avec un centre rouge (milieu solide CIN – avec Cefsulodine, Irgasan, et Novobiocine (en)–, à 36 heures) colonies dites « œil de bœuf », ou limpides avec un voile et un dépôt floconneux (milieux liquides)[2],[3].
Après sa découverte en 1894, Y. pestis a été rangé dans les Pasteurella, mais son pouvoir pathogène, ses propriétés biochimiques et enzymatiques sont très différents, et le genre Yersinia a été créé pour la distinguer[4].
Y. pestis a d'abord été subdivisé en trois sous-espèces ou biovars (souches se distinguant par des critères biochimiques, mais avec le même pouvoir pathogène)[4] :
Dans les années 1950, et jusqu'à la fin du XXe siècle, on supposait que ces trois souches étaient à l'origine des trois pandémies historiques de peste : Antiqua pour la peste de Justinien, Medievalis pour la deuxième pandémie, et Orientalis pour la troisième pandémie de peste[4],[5].
Avec la paléogénomique, cette théorie est finalement considérée comme inexacte au début du XXIe siècle : la peste de Justinien est due à un biovar disparu ou non retrouvé, et la deuxième et troisième pandémie à Orientalis. Les autres biovars sont strictement liés aux rongeurs[6].
Il existe une nouvelle nomenclature basée sur le séquençage génétique : Y. pestis est subdivisé en 5 embranchements majeurs, numérotés de 0 à 4[6].
Le genre Yersinia comprend trois espèces d'importance médicovétérinaire : Y. enterocolitica, Y. pseudotuberculosis, et Y. pestis. Ces trois espèces peuvent partager ou non des plasmides de virulence[6].
Le génome de Y. pestis est très proche de celui de Y. pseudotuberculosis. Les deux espèces divergent par acquisition ou perte de gènes modifiant les caractères et la virulence de la bactérie.
Une souche ancienne de la bactérie a été identifiée sur un chasseur-pêcheur-cueilleur d’Europe centrale, nommé RV 2039 et daté d'environ 5 000 ans (5300-5050 cal AP) et trouvé à Riņņukalns, au nord de la Lettonie. La souche de Riņņukalns correspond au génome connu de Yersinia pestis le plus ancien depuis la divergence avec Yersinia pseudotuberculosis. Cette souche contient déjà la plupart des gènes de la bactérie médiévale mais il manque le facteur de virulence ymt[7] permettant aux puces d'être vecteur de la maladie, un mode de transmission qui a accru le risque de contamination interhumaine. Cette forme très précoce de Y. pestis était probablement transmise par des morsures de rongeurs et vraisemblablement moins virulente que les souches plus récentes[8],[9]. Elle précède la souche RISE509 trouvée dans l'Altaï (Sibérie)[10].
Une deuxième divergence se produit lors de l'âge du bronze tardif (~ 1800 av. J.C.), avec l'émergence de lignées pleinement adaptées à la transmission par puce, à l'origine de la peste bubonique[11]. Il s'agit ici d'une perte de fonction de trois gènes, facilitant la formation de biofilm bactérien et le blocage proventriculaire de la puce, tandis que l'acquisition du gène PPla permet une invasion plus efficace de l'hôte (mammifère)[6]. Il s'agirait de l'acquisition du gène ymt – Yersinia murine toxin – qui permet la colonisation de l'ensemble de l'intestin de la puce[6]. Cette adaptation a été trouvée chez deux individus associés à la culture Srubnaya de la région de Samara en Russie il y a environ 3 800 ans (âge du bronze) et un individu de l'âge du fer de Kapan, en Arménie, à partir d'environ 2 900 ans.
Les études de paléogénomique révèlent que de multiples lignées indépendantes de Y. pestis ont divergé et se sont répandues à travers l'Eurasie, se propageant probablement à travers les premiers réseaux commerciaux plutôt que par des migrations humaines massives. Une première phase de divergences significatives s'est produite à la fin du néolithique avec apparition de trois lignées, l'une toujours actuelle, les deux autres éteintes au néolithique et au début de l'âge du bronze[12]. Cette divergence est postérieure à la souche de Riņņukalns[9].
Ces données plaident en faveur de l'existence de pandémies préhistoriques de peste pouvant expliquer en partie une période de « déclin néolithique » observé en Eurasie occidentale (disparition subite de grandes colonies agricoles lors du VIe millénaire av. J.-C)[13]. Le lieu exact de l'émergence de souches menant aux pandémies historiques de peste reste indéterminé[12].
Les études paléogénomiques confirment la présence de Y. pestis dans les trois pandémies historiques de peste[12],[13]:
Parmi les déterminants de la virulence de la bactérie, les principaux sont[1],[12] :
L'infection humaine est le plus souvent le résultat d'une piqûre de puce, représentant l'injection d'environ 24 000 bactéries[3], alors que la dose minimale infectante est très faible (une dizaine de bactéries)[16]. La plupart d'entre elles sont éliminées efficacement par les granulocytes neutrophiles, mais quelques-unes sont susceptibles de survivre et de se multiplier dans les macrophages[12].
Y. pestis est intracellulaire facultatif, et comme d'autres bactéries à Gram négatif, elle est capable de secréter des protéines de virulence directement à l'intérieur des cellules cibles par « injectisome » ou Système de sécrétion de type III (en). Ceci lui permet de contourner les défenses immunitaires de l'hôte, en coupant ses lignes de communication moléculaire[17].
L'infection à Y. pestis se distingue par la brutalité de la transition entre une phase silencieuse pré-inflammatoire, où la bactérie se dissémine dans la lymphe (peste bubonique), le sang (peste septicémique) ou les poumons (peste pulmonaire), et une violente explosion inflammatoire accompagnée de phénomènes d'apoptose[12].
En laboratoire, le pouvoir pathogène est très marqué pour le rat, le cobaye, la souris, et les primates non-humains. Des modèles animaux de la peste humaine ont été développés, le plus utilisé étant celui de la souris, notamment pour la recherche vaccinale. Cependant le modèle souris ne reproduit pas exactement la peste humaine, car la souris est sensible à une exotoxine produite par Y. pestis qui n'a pas d'activité chez l'Humain[3].
Le diagnostic bactériologique peut se faire par examen direct sur des prélèvements de pus (ponction de bubon), de sang, ou respiratoires (crachats, prélèvement pharyngés....). L'identification précise est faite par profil biochimique, ou l'utilisation de bactériophage lysant uniquement Y. pestis[16].
Y. pestis possède au moins 16 antigènes, mais il existe des antigènes commun avec Yersinia pseudotuberculosis[4]. Le diagnostic immunologique porte principalement sur la détection de l'antigène F1 très spécifique de Y. pestis, soit par sérodiagnostic (hémagglutination passive), soit par ELISA[16]. Cet antigène F1 provient de la capsule bactérienne, il est secrété à 37 °C et thermostable[6]. Il s'agit alors de diagnostic sérologique de confirmation rétrospective (intérêt épidémiologique).
Depuis les années 2000, un test de diagnostic rapide par immunochromatographie a été mis au point. La bandelette permet de détecter l'antigène F1 en 15 minutes[2].
Il existe plusieurs techniques de diagnostic biologique moléculaire, dont la PCR et la spectrométrie de masse. D'autres permettent une discrimination très fine des souches, dans un but épidémiologique ou historique[2],[6].
Le bacille de Yersin existe chez les rongeurs sauvages qui représentent le réservoir naturel du germe et chez lesquels peut sévir la peste selvatique. Le vecteur intermédiaire principal est le rat, rongeur péri-domestique très sensible au bacille pesteux. L'épizootie chez les rats est propagée par leurs ectoparasites, essentiellement par les puces (Xenopsylla cheopis). Le bacille se développe dans le tube digestif de la puce, le bloquant et incitant la puce à piquer davantage : lors de morsures, des bacilles sont régurgités dans la plaie, assurant ainsi la transmission de la maladie. Lorsque la population de rats est décimée, les ectoparasites en surnombre provenant des cadavres cherchent de nouveaux hôtes : si le nombre de rats survivants est réduit, les puces peuvent chercher à parasiter des hôtes inhabituels, en particulier l'humain. Les puces peuvent rester contagieuses pendant plusieurs semaines.
Le rôle joué par les rats dans l'épidémiologie de la peste explique le cheminement des grandes épidémies de l'histoire. Ces rongeurs étant fréquents dans les ports, le point de départ d'une épidémie sur un continent se situait presque invariablement dans une ville portuaire où les rats pesteux provenant d'un foyer lointain étaient amenés par les navires.
Chez l'humain, la maladie peut revêtir différents aspects suivant la porte d'entrée du germe et le stade d'évolution :
Les molécules efficaces contre Y. pestis sont la streptomycine[18],[19], chloramphénicol ou tétracyclines[20] (dont la doxycycline) ou la gentamicine[21]. Y. pestis ne possède pas de résistance naturelle aux antibiotiques, cependant l'acquisition de plasmides procurant cette résistance reste possible, par transmission horizontale avec d'autres entérobactéries. En 2018, aucune épidémie à Y. pestis résistant aux antibiotiques n'a été décrite[16].
Yersinia pestis est une bactérie à Gram négatif du genre Yersinia. Elle est responsable de la peste.
Elle fut découverte en 1894 par Alexandre Yersin, un bactériologiste franco-suisse travaillant pour l'Institut Pasteur, durant une épidémie de peste à Hong Kong, en même temps que Kitasato Shibasaburō mais séparément. Kitasato tout d'abord la baptisa Pasteurella pestis en l'honneur de Pasteur. Ce n'est que plus tard qu'elle prit son nom actuel, en hommage à Yersin.
Yersinia pestis a été formellement identifiée comme responsable de la première et deuxième pandémie historique de peste, notamment dans une tombe de Bavière du VIe siècle, dans une fosse commune de la peste londonienne de 1665, ainsi que dans un charnier de la peste de 1720 à Marseille. Les descriptions précises des symptômes lors de la peste qui toucha l'Europe en 1347-1352 laissent également peu de doutes.
Yersinia pestis (antes chamada Pasteurella pestis) é unha especie de bacterias gramnegativas con forma de bacilo ou cocobacilo, anaerobia facultativa, que pode infectar a humanos e outros animais, e é a causante das pragas de peste dos últimos 1300 anos.[1]
A infección por Y. pestis en humanos pode presentarse de tres formas principais: peste pneumónica, peste septicémica, e peste bubónica.[1] Todas as formas foron responsables de epidemias de grande mortalidade na historia humana, como a Peste de Xustiniano no século VI e a Peste negra que matou a 1/3 da poboación europea no século XIV.[2][3] Pénsase que esas pragas se orixinaron en poboacións de roedores de China.[4][5]
Y. pestis foi descuberta en 1894 por Alexandre Yersin,un médico e bacteriólogo francosuízo do Instituto Pasteur, durante unha peste epidémica en Hong Kong.[6] Yersin era membro da escola de pensamento de Pasteur. Por outra parte, Kitasato Shibasaburō, un bacteriólogo xaponés formado en Alemaña na metodoloxía de Robert Koch, tamén se ocupou naquela época da procura do axente causante da peste.[7] Porén, foi Yersin quen realmente asociou a peste con Yersinia pestis. Orixinalmente a bacteria recibiu o nome de Pasteurella pestis, pero o organismo foi renomeado en 1967 co seu nome actual.
A Organización Mundial da Saúde informa todos os anos de miles de casos de peste, aínda que hoxe cun adecuado e rápido tratamento, o prognóstico das vítimas mellorou moito. Durante a guerra do Vietnam os casos en Asia multiplicáronse por 5 ou por 6, posiblemente debido á destrución dos ecosistemas e a unha maior proximidade entre os homes e os animais. A peste tamén afecta moi prexudicialmente a outros mamíferos (furóns, cans das praderías etc.)
Y. pestis é un bacilo anaerobio facultativo cunha tinguidura bipolar (que lle dá ao aspecto dun imperdible).[8] Similar a outros membros do xénero Yersinia dá negativo na proba de urease, e nas da fermentación da lactosa, e do indol.[9] A especie máis próxima é o patóxeno gastrointestinal Yersinia pseudotuberculosis, e máis afastada está Yersinia enterocolitica.
A secuencia xenómica completa de Y. pestis está dispoñible para dúas das tres subespecies de Y. pestis: cepa KIM (do biovar Medievalis),[10] e cepa CO92 (do biovar Orientalis, obtido dun illado clínico nos EEUU).[11] En 2006, acabouse de completar a secuencia xenómica da cepa do biovar Antiqua.[12] Igual que outras capas patóxenas, hai signos de mutacións de perda de funcións. O cromosoma da capa KIM ten 4.600.755 pares de bases; o cromosoma da cepa CO92 ten 4.653.728 pares de bases. Igual que os seus parentes próximos Y. pseudotuberculosis e Y. enterocolitica, Y. pestis contén o plásmido pCD1. Ademais, contén outros dous plásmidos, o pPCP1 (tamén chamado pPla ou pPst) e o pMT1 (tamén chamado pFra), que non están presentes noutras especies de Yersinia. O plásmido pFra codifica a fosfolipase D que é importante pola capacidade de Y. pestis de ser transmitida por pulgas.[13] O pPla codifica unha protease, Pla, que activa o plasminóxeno nos hóspedes humanos e é un factor de virulencia moi importante na peste pneumónica.[14] Xunto con estes plásmidos e unha illa de patoxenicidade chamada HPI, o xenoma codifica tamén varias proteínas que causan a patoxénese, que son moi características de Y. pestis. Entre outras cousas, estes factores de virulencia son necesarios para a adhesión da bacteria e a inxección de proteínas na célula hóspede, a invasión da bacteria na célula hóspede (por medio do sistema de secreción de tipo III), e para a captación e ligazón do ferro que procede dos glóbulos vermellos (por medio de sideróforos).
Y. pestis pénsase que descende de Y. pseudotuberculosis, da que difire só na presenza de plásmidos de virulencia específicos.
En 2006 fíxose unha análise proteómica exhaustiva e comparativa da cepa KIM de Y. pestis.[15] A análise centrouse no momento da transición ao crecemento similar ao crecemento nas células hóspedes.
Nos ciclos urbanos e forestais (selváicos) de Y. pestis, a maioría das transmisións ocorren entre os roedores e as pulgas. No ciclo selvático, son roedores salvaxes, pero, no ciclo urbano, os roedores son domésticos (viven nas casas). Ademais de polas pulgas, os animais infectados poden transmitir a infección aos humanos a través de contactos co tecido epitelial. Os humanos tamén poden transmitirse entre eles a bacteia por medio de espirros, toses, ou contacto directo co tecido infectado.
Os reservorios de Y. pestis son varias especies de roedores. Nas estepas, as especies reservorio crese que son principalmente as marmotas. En Norteamérica crese que varias especies de roedores son reservorios de Y. pestis. Porén, a dinámica da enfermidade esperada non se observou en ningunha especie de roedor, e sábese que esas poboacións de roedores teñen unha resistencia variable á bacteria, que fai que algúns individuos sexan susceptibles e outros sexan portadores asintomáticos.[16] Hai probas de que as pulgas doutros mamíferos tamén teñen un papel nas epidemias de peste humanas.[17]
Esta falta de coñecementos sobre a dinámica da praga nas especies de mamíferos dáse tamén entre os roedores susceptibles como os cans das praderías de rabo negro (Cynomys ludovicianus), nos cales a praga pode causar o colapso de toda a colonia, causando un efecto masivo na rede trófica da que forman parte.[18] Porén, a dinámica de transmisión nos cans das praderías parece non depender de pulgas co tubo dixestivo obstruído, senón talvez dos cadáveres, pulgas non obstruídas ou outros vectores.[19]
Noutras rexións do mundo, o reservorio da infección non está claramente identificado, o cal complica a prevención e os programas de alerta temperá. Un exemplo é a epidemia de 2003 en Alxeria.[20]
A transmisión de Y. pestis polas pulgas está ben caracterizada.[21] A transmisión inicial de Y. pestis polo vector ocorre durante a súa alimentación. Varias proteínas contribúen ao mantemento da bacteria no tracto dixestivo da pulga, entre elas o sistema de almacenamento de hemina (Hms) e a toxina murina de Yersinia (Ymt).
Aínda que a toxina murina de Yersinia é moi tóxica para os roedores e antes se pensaba que se producía para asegurar a reinfección dos novos hóspedes, o que está demostrado é que a Ymt é importante para a supervivencia de Y. pestis nas pulgas.[13]
O sistema Hms xoga un importante papel na transmisión de Y. pestis ao hóspede mamífero.[22] Mentres que no vector insecto, as proteínas codficadas polos loci xenéticos do Hms inducen a formación de biofilmes no proventriculo, unha válvula que conecta o intestino medio co esófago do insecto.[23] A agregación no biofilme impide a alimentación, xa que se forma unha masa de sangue coagulado inxerido e de bacterias (denominado "bloque de Bacot".[24]) A transmisión de Y. pestis ten lugar durante os inútiles intentos da pulga por alimentarse dun sangue que non poderá tragar. O sangue inxerido é bombeado ao esófago, onde remove algunhas das bacterias que forman o tapón do proventrículo, e o sangue coas bacterias é regurxitado na ferida da picadura do hóspede, e as bacterias pasan ao seu sistema circulatorio. Como as pulgas non se poden alimentar, teñen fame e pican máis frecuentemente.
A patoxénese debida á infección por Y. pestis dos hóspedes mamíferos é producida por varios factores como a capacidade da bacteria de suprimir e evitar as respostas normais do sistema inmunitario, como a fagocitose e a produción de anticorpos. A picada das pulgas permite que a bacteria sobrepase a barreira da pel. Y. pestis expresa o produto do xene yadBC, que é similar ás adhesinas doutras especies de Yersinia, o que facilita a adherencia e invasión das células epiteliais.[25] Y. pestis expresa un activador do plasminóxeno que é un importante factor de virulencia para a peste pneumónica e que podería degradar os coágulos e sangue para facilitar a invasión sistémica.[14] Moitos dos factores de virulencia da bacteria son antifagocíticos. Dous impotantes antíxenos antifagocíticos, chamados F1 (Fracción 1) e V ou LcrV, son importantes para a virulencia.[8] Estes antíxenos prodúceos a bacteria á temperatura corporal humana normal. Ademais, Y. pestis sobrevive e produce os antíxenos F1 e V mentres está no interior de células brancas do sangue como os monocitos, pero non en neutrófilos. A inmunidade natural ou inducida conséguese pola produción de anticorpos opsonizantes específicos contra os antíxenos F1 e V; os anticorpos contra F1 e V inducen a fagocitose por parte dos neutrófilos.[26]
Ademais, o sistema de secreción de tipo III (T3SS) permite que Y. pestis inxecte proteínas nos macrófagos e outras células inmunes. Estas proteínas inxectadas polo T3SS denomínanse Yops (Yersinia Outer Proteins, Proteína Externas de Yersinia) e entre elas está Yop B/D, que forma poros na membrana plasmática do hóspede e foi asociada coa citólise. Inxéctanse no citoplasma da célula hóspede por medio do T3SS as YopO, YopH, YopM, YopT, YopJ, e YopE por poros creados en parte por YopB e YopD.[27] As proteínas Yop inxectadas limitan a fagocitose e as vías de sinalización celular importantes para o sistema inmunitario innato. Ademais, algunhas cepas de Y. pestis son capaces de interferir coa sinalización inmune (por exemplo, ao impediren a liberación dalgunhas citocinas).
Yersinia pestis prolifera no interior dos ganglios linfáticos, onde pode evitar a súa destrución por células inmunitarias como os macrófagos. A capacidade de Y. pestis de inhibir a fagocitose permítelle crecer nos ganglios linfáticos e causar linfadenopatías. YopH é unha proteína tirosina fosfatase que contribúe a esa capacidade de Y. pestis de evadirse da acción das células inmunitarias.[28] Nos macrófagos, YopH desfosforila a p130Cas, Fyb (proteína de unión a Fyn) SKAP-HOM e Pyk, unha tirosina quinase homóloga de FAK. YopH tamén se une á subunidade p85 da fosfoinosítido 3-quinase, a Gab1, ás proteínas adaptadoras Gab2, e ao factor de intercambio do nucleótido guanina Vav.
YopE funciona como proteína activadora da GTPase para membros da familia Rho de GTPases como RAC1. YopT é unha cisteína protease que inhibe RhoA ao eliminar o grupo isoprenilo, que é importante para a localización da proteína na membrana plasmática. Propúxose que YopE e YopT poderían funcionar limitando a citólise inducida por YopB/D.[29] Isto podería limitar o función de YopB/D de crear os poros usados para a inserción de Yop nas células hóspedes e impedir a rotura inducida por YopB/D das células hóspede e que se libere o contido celular, o cal atraería e estimularía as respostas inmunitarias.
YopJ é unha acetiltransferase que se une a unha hélice alfa conservada das quinases MAPK.[30] YopJ acetila as quinases MAPK en residuos de serinas e treoninas que normalmente se fosforilan durante a activación da cascada das quinases MAP.[31][32] YopJ actívase nas células eucariotas pola interacción co ácido fítico (IP6) da célula diana.[33] Esta distorsión da actividade das proteína quinases da célula hóspede causa a apoptose dos macrófagos, e propúxose que é importante para o establecemento da infección e para a evasión da acción do sistema inmunitario. YopO é unha proteína quinase tamén coñecida como proteína quinase A de Yersinia (YpkA). YopO é un potente indutor da apoptose dos macrófagos humanos.[34]
Non hai vacinas efectivas contra a doenza. Téñense utilizado algunhas vacinas de escasa efectividade e que podían causar graves inflamacións, como a vacina inactivada con formol, que xa non se usa. Estanse facendo experimentos con técnicas de enxeñaria xenética de vacinas baseadas nos antíxenos F1 e V e parecen prometedores. Porén, as bacterias que carecen do antíxeno F1 seguen sendo virulentas, e os antíxenos V son suficientemente variables como para que unha vacina composta deles non sexa totalmente protectora.[35][36][37]
A peste pneumónica pode producirse por inhalación de aerosois coa bacteria (primaria) ou esta pode chegar aos pulmóns desde o sangue (secundaria). Como a bacteria se transporta polo sangue, poden verse afectados varios órganos, como o bazo e o cerebro. A infección difusa pode causar unha cascada inmunolóxica que dea lugar a unha coagulación intravascular diseminada, que á súa vez produce hemorraxias e necrose na pel e tecidos. Unha infección diseminada dese tipo incrementa a mortalidade ao 22%. A pneumonía progresa en de 2 a 4 días e se non se iniciou un tratamento temperán os pacientes poden morrer en só 36 horas.
Coa excepción dos bubóns, os síntomas iniciais da peste son moi similares ao de moitas outras enfermidades, o que fai difícil o diagnóstico.[39]
Códigos ICD-9 da OMS para as enfermidades causadas por Y. pestis:
A tinguidura de Gram pode confirmar a presenza de bacilos gramnegativos, e nalgúns casos a identificación de formas de dobre curvatura. Unha proba serolóxica anti-F1 pode diferenciar as diferentes especies de Yersinia, e a reacción en cadea da polimerase (PCR) pode utilizarse para identificar a Y. pestis.
A proteína H da fibra da cola do bacteriófago fago de Yersinia L-413C permite a diferenciación entre Y. pestis e Y. pseudotuberculosis.[40]
O tratamento tradicional de primeira liña contra Y. pestis son os antibióticos estreptomicina,[41][42] cloranfenicol, tetraciclina,[43] e as fluoroquinolonas. Hai tamén boas evidencias que apoian o uso de doxiciclina ou xentamicina.[44] Illáronse cepas resistentes, polo que o tratamento debe guiarse polas sensibilidades aos antibióticos sempre que sexa posible. O tratamento antibiótico só é insuficiente para algúns pacientes, que poden tamén requirir apoio circulatorio, respiratorio ou renal.[45]
A mediados do século VI produciuse unha pandemia coñecida como Peste de Xustiniano, que matou a unha terceira parte dos habitantes do Imperio Bizantino, que se cre foi debida á peste bubónica. Houbo epidemias recorrentes e non desapareceu de todo ata o ano 750.[46] Un estudo xenético suxire que esta praga se orixinou de cepas hoxe extintas de Y. pestis, xeneticamente distintas das cepas que orixinaron a Peste negra no século XIV, ou talvez de patóxenos non relacionados coa peste bubónica.[47][48] En 2012 investigadores alemáns recolleron mostras de Y. pestis de tumbas da época de Xustiniano para reconstruíren o ADN da bacteria.[49]
En 2000, Didier Raoult e outros informaron do descubrimento de ADN de Y. pestis en tecido de pulpa dental de mostras dun cemiterio do século XIV de Montpellier.[50] Outro estudo de 2010, que estudou restos de vítimas da peste enterradas en Inglaterra, Francia e Países Baixos, confirmou que Y. pestis foi a causa da Peste negra e as sucesivas epidemias de peste posteriores.[51] Neste estudo atoparon dúas cepas previamente descoñecidas, que eran cepas antigas de Y. pestis.[52]
Inicialmente pensouse que os tres biovares de Y. pestis correspondían a cada unha das pandemias históricas da peste bubónica.[53] O biovar Antiqua pénsase que corresponde á Peste de Xustiniano; non se sabe se este biovar tamén corresponde ás epidemias temperás ou menores de peste bubónica, ou se estas eran verdadeiramente peste bubónica e non outra doenza.[54] Antes pensábase que o biovar Mediaevalis correspondía á pandemia da Peste negra,e o biovar Orientalis correspondía á Terceira pandemia e á maioría dos estalidos modernos da praga. Porén, os cálculos da idade evolutiva de Y pestis, obtidos usando o número de substitucións sinónimas de polimorfismos dun só nucleótido (SNP) en conxunción coas taxas dos reloxos moleculares, datan a emerxencia destes biovares nun momento anterior ao de calquera das epidemias históricas debido á cantidade de tempo que cómpre para acumular esas mutacións.[55] Evidencias adicionais en contra desa hipótese son o feito de que Mediaevalis é probablemente demasiado nova para ter producido a Peste negra debido á súa recente diverxencia de Orientalis.[56]
A utilización con fins bélicos de Y. pestis é un dos primeiros exemplos de guerra biolóxica na historia. En 1347 os mongois catapultaron a vítimas da peste sobre as murallas da cidade de Caffa, que hoxe se chama Feodosiya, en Ucraína. É posible que os habitantes desta cidade, algúns infectados, fuxisen a Italia, e así espallasen a Peste negra por Europa, aínda que esta é só unha das varias rutas polas que puido ter chegado a peste desde o leste.[57]
Y. pestis foi utilizada como arma biolóxica na Segunda Guerra Mundial. Os xaponeses o 4 de outubro de 1940 lanzaron desde un avión que sobrevoaba a cidade chinesa de Chushien (na provincia de Chekiang), arroz e trigo con pulgas de rata que estaban infectadas de Y. pestis. Un segundo avión fixo o mesmo 3 semanas máis tarde. Estas accións orixinaron unha praga local que matou a 121 persoas.[58][58]
Yersinia pestis (antes chamada Pasteurella pestis) é unha especie de bacterias gramnegativas con forma de bacilo ou cocobacilo, anaerobia facultativa, que pode infectar a humanos e outros animais, e é a causante das pragas de peste dos últimos 1300 anos.
A infección por Y. pestis en humanos pode presentarse de tres formas principais: peste pneumónica, peste septicémica, e peste bubónica. Todas as formas foron responsables de epidemias de grande mortalidade na historia humana, como a Peste de Xustiniano no século VI e a Peste negra que matou a 1/3 da poboación europea no século XIV. Pénsase que esas pragas se orixinaron en poboacións de roedores de China.
Y. pestis foi descuberta en 1894 por Alexandre Yersin,un médico e bacteriólogo francosuízo do Instituto Pasteur, durante unha peste epidémica en Hong Kong. Yersin era membro da escola de pensamento de Pasteur. Por outra parte, Kitasato Shibasaburō, un bacteriólogo xaponés formado en Alemaña na metodoloxía de Robert Koch, tamén se ocupou naquela época da procura do axente causante da peste. Porén, foi Yersin quen realmente asociou a peste con Yersinia pestis. Orixinalmente a bacteria recibiu o nome de Pasteurella pestis, pero o organismo foi renomeado en 1967 co seu nome actual.
A Organización Mundial da Saúde informa todos os anos de miles de casos de peste, aínda que hoxe cun adecuado e rápido tratamento, o prognóstico das vítimas mellorou moito. Durante a guerra do Vietnam os casos en Asia multiplicáronse por 5 ou por 6, posiblemente debido á destrución dos ecosistemas e a unha maior proximidade entre os homes e os animais. A peste tamén afecta moi prexudicialmente a outros mamíferos (furóns, cans das praderías etc.)
Yersinia pestis (ranije Pasteurella pestis) je gram-negativna štapičasta bakterija, koja kod ljudi može uzrokovati bolest kugu.
Bakterija je fakultativni anaerob, a primarno je bolest glodavaca. Kroz povijest je najpoznatiji oblik kuge, bubonska kuga, bolest koja je uzela velik broj života, pa se čak i dio povijesti naziva Doba kuge. Bubonska kuga se širi ugrizom buhe, koja sa zaraženog glodavca prenese bakteriju na čovjeka. Ostali poznatiji primarni oblici bolesti koje može uzrokovati Yerisnia pestis su plućna kuga i septička kuga. Bakterija rijetko može izazvati faringitis ili primarni meningitis.
Bakteriju je otkrio Alexandre Yersin, švicarsko-francuski bakteriolog, 1894.g. tijekom epidemije kuge u Hong Kongu.
![]() Nedovršeni članak Yersinia pestis koji govori o biologiji treba dopuniti. Dopunite ga prema pravilima Wikipedije.
Nedovršeni članak Yersinia pestis koji govori o biologiji treba dopuniti. Dopunite ga prema pravilima Wikipedije.
Yersinia pestis (ranije Pasteurella pestis) je gram-negativna štapičasta bakterija, koja kod ljudi može uzrokovati bolest kugu.
Bakterija je fakultativni anaerob, a primarno je bolest glodavaca. Kroz povijest je najpoznatiji oblik kuge, bubonska kuga, bolest koja je uzela velik broj života, pa se čak i dio povijesti naziva Doba kuge. Bubonska kuga se širi ugrizom buhe, koja sa zaraženog glodavca prenese bakteriju na čovjeka. Ostali poznatiji primarni oblici bolesti koje može uzrokovati Yerisnia pestis su plućna kuga i septička kuga. Bakterija rijetko može izazvati faringitis ili primarni meningitis.
Bakteriju je otkrio Alexandre Yersin, švicarsko-francuski bakteriolog, 1894.g. tijekom epidemije kuge u Hong Kongu.
Yersinia pestis adalah bakteri Gram-negatif yang dapat tumbuh dengan atau tanpa oksigen (yang disebut anaerob fakultatif).
Infeksi pada manusia mengambil tiga bentuk: pnumonik, septisemik, dan wabah bubonik. Ketiga bentuk infeksi ini telah menyebabkan epidemik yang merenggut banyak korban dalah sejarah manusia, termasuk wabah Justinian pada 542 dan Kematian Hitam yang menyebabkan paling tidak mengambil sepertiga populasi Eropa dari 1347 sampai 1353. Belakangan ini, Y. pestis juga dapat digunakan sebagai senjata biologi dan CDC telah mengklasifikasi bakteri ini ke dalam Patogen Kategori A sebagai persiapan serangan teroris.
Y. pestis ditemukan pada 1894 oleh Alexandre Yersin, seorang dokter Swiss/Perancis dan bakteriologis Institut Pasteur, pada saat epidemik plak di Hong Kong.[1] Kitasato Shibasaburo, seorang bakteriologis Jepang yang belajar di Jerman juga menemukan agen plak.[2] Namun, Yersin yang menyangkutkan plak dengan Y. pestis. Awalnya bakteri ini bernama Pasteurella pestis, namun diganti namanya pada 1967.
Setiap tahun, ribuan kasus plak masih dilaporkan ke WHO, namun dengan perawatan yang benar, prognosis korban lebih baik.
Pada 2000, Didier Raoult dan rekan menemukan DNA Y. pestis setelah melakukan "PCR bunuh diri" pada organ pulp gigi dari kuburan plak abad ke-14 di Montpellier.[3]
Sebuah riset yang dilakukan oleh periset internasional pada Oktober 2010 mengkonfirmasi bahwa Y. pestis adalah penyebab Kematian Hitam dan epidemik berikutnya pada benua Eropa selama periode 400 tahun. Tim tersebut DNA kuno dan protein yang diambil dari jasad korban plak yang dikubur di Hereford, Inggris, di Saint-Laurent-de-la-Cabrerisse di Prancis, dan Bergen op Zoom di Belanda untuk mengidentifikasi patogen.
Yersinia pestis sebelumnya telah diklasifikasikan dalam keluarga Pasteurellaceae, namun berdasarkan kesamaan dengan Escherichia coli (E. coli), maka Yersinia grup reclassified sebagai anggota dari keluarga Enterobacteriaceae.
Walaupun terdapat 11 nama spesies dalam genus Yersinia, hanya tiga patogen yang dianggap penting bagi manusia:
Yersinia pseudotuberculosis adalah yang paling dekat dengan genetika Yersinia pestis, tetapi dapat dibedakan dari Yersinia pestis oleh gejala-gejala itu penyebab dan hasil uji laboratorium. Baik bakteri ini sering menjangkiti manusia, kontras ke Yersinia enterocolitica, yang menyumbang 1 sampai 3 persen dari kasus diare yang disebabkan oleh bakteri.
Yersinia pestis paling sering ditemukan pada tikus, tetapi kadang-kadang dalam hewan lainnya, seperti:
Yersinia pestis adalah bakteri Gram-negatif yang dapat tumbuh dengan atau tanpa oksigen (yang disebut anaerob fakultatif).
Infeksi pada manusia mengambil tiga bentuk: pnumonik, septisemik, dan wabah bubonik. Ketiga bentuk infeksi ini telah menyebabkan epidemik yang merenggut banyak korban dalah sejarah manusia, termasuk wabah Justinian pada 542 dan Kematian Hitam yang menyebabkan paling tidak mengambil sepertiga populasi Eropa dari 1347 sampai 1353. Belakangan ini, Y. pestis juga dapat digunakan sebagai senjata biologi dan CDC telah mengklasifikasi bakteri ini ke dalam Patogen Kategori A sebagai persiapan serangan teroris.
Y. pestis ditemukan pada 1894 oleh Alexandre Yersin, seorang dokter Swiss/Perancis dan bakteriologis Institut Pasteur, pada saat epidemik plak di Hong Kong. Kitasato Shibasaburo, seorang bakteriologis Jepang yang belajar di Jerman juga menemukan agen plak. Namun, Yersin yang menyangkutkan plak dengan Y. pestis. Awalnya bakteri ini bernama Pasteurella pestis, namun diganti namanya pada 1967.
Setiap tahun, ribuan kasus plak masih dilaporkan ke WHO, namun dengan perawatan yang benar, prognosis korban lebih baik.
Yersinia pestis er gerill. Hann er þekktastur fyrir að hafa valdið svartadauða, sem var plága sem ríkti í Evrópu árin 1347-1350.
Yersinia pestis (Lehmann-Neumann, 1896) è il batterio agente eziologico della peste.
Si tratta di un cocco-bacillo gram-negativo a forma di bastoncino senza spore, appartenente alla famiglia Yersiniaceae, immobile e psicrofilo, ovvero capace di crescere e di moltiplicarsi a temperature comprese tra 0 °C e 20 °C.
Esso fa parte dei batteri non coliformi e, pertanto, non è in grado di fermentare il lattosio. Presenta catalasi (+) ed è quindi in grado di scindere il perossido di idrogeno in acqua e ossigeno. La sua fermentazione è acido mista e, se coltivato in terreni contenenti sangue, cresce meglio.
Chiamato in passato Pasteurella pestis, è un organismo anaerobico facoltativo in grado di infettare l'uomo attraverso la pulce del ratto orientale[1] provocandogli la peste in tutte le sue forme (bubbonica, setticemica e polmonare).[1][2][3]
In America settentrionale può infettare anche altri mammiferi differenti dall'uomo[3] quali il cane della prateria dalla coda nera e il furetto dai piedi neri.
Nel corso della storia umana, le tre diverse forme in cui la patologia si presenta sono state responsabili di numerose morti a seguito di una serie di epidemie, tra cui la peste di Giustiniano del VI secolo, la peste nera che uccise almeno un terzo della popolazione europea tra il 1347 e il 1353, la Grande peste di Londra del 1665 e la cosiddetta terza pandemia con cui si intende la peste moderna iniziata alla fine del XIX secolo in Cina e che, diffondendosi sui battelli a vapore, causò quasi 10 000 000 di morti.[4][5][6][7] Si suppone che tali epidemie abbiano anticamente avuto origine in Cina per poi diffondersi in occidente attraverso le rotte commerciali.[7][8] Una ricerca del 2018 ha suggerito che la Yersinia pestis possa essere stato la causa di ciò che è stato definito come periodo del "declino del mondo Neolitico", in cui le popolazioni europee diminuirono in modo significativo.[9]
Tracce di DNA di Yersinia pestis sono state rinvenute negli scheletri sepolti in dieci siti europei e del Maghreb interessati dalla pestilenze del XIV e del XVII secolo. In Italia, la presenza del bacillo è stata confermata a Venezia, Genova, Parma e nel Regno di Napoli.[10]
Il batterio Yersinia pestis venne scoperto nel 1894 da Alexandre Yersin, un medico franco-svizzero, operante come batteriologo dell'Istituto Pasteur durante un'epidemia di peste scoppiata ad Hong Kong.[11] Yersin apparteneva alla scuola di pensiero di Pasteur. Kitasato Shibasaburō, un batteriologo giapponese di formazione tedesca che praticava la metodologia di Koch, era anch'egli impegnato all'epoca nella ricerca dell'agente causale della peste.[12] Tuttavia, fu proprio Yersin che riuscì a riconoscere la correlazione tra la peste e la Yersinia pestis. Inizialmente chiamato Pasteurella pestis, il batterio venne ribattezzato Yersinia pestis nel 1944 in onore del suo scopritore.
Ogni anno, migliaia di casi di peste vengono ancora segnalati all'Organizzazione mondiale della sanità, sebbene per la maggior parte dei pazienti, se trattati con una cura adeguata, la prognosi appaia ad oggi molto migliore.
Durante la guerra del Vietnam si è assistito ad un aumento, da cinque a sei volte, dei casi in Asia, probabilmente a causa dell'interruzione degli ecosistemi e della maggior vicinanza tra persone e animali.
Agli inizi del XXI secolo la peste si trova più frequentemente nell'Africa subsahariana e nel Madagascar, aree in cui si verifica oltre il 95% dei casi segnalati.
È l'agente eziologico della peste: si tratta di una zoonosi (di topi, ratti, scoiattoli, conigli, lepri, marmotte..) la cui trasmissione avviene attraverso le pulci (che rigurgitano il contenuto batterico al pasto successivo). L'animale è pestigeno e pestifero.
Se inoculato dalla pulce nell'organismo umano, il bacillo viene fagocitato dai monociti e dai granulociti polimorfonucleati (neutrofili). Solo i neutrofili riescono a degradare il batterio, che invece continua a vivere all'interno dei monociti, dove sviluppa degli antigeni (frazione I, antigene V, antigene W) che gli conferiscono un particolare potere antifagocitario. Il potere patogeno del batterio potrebbe essere anche dovuto alla tossina murina.
L'incubazione è di 2-7 giorni.
Si distinguono tre forme:
Yersinia pestis (Lehmann-Neumann, 1896) è il batterio agente eziologico della peste.
Si tratta di un cocco-bacillo gram-negativo a forma di bastoncino senza spore, appartenente alla famiglia Yersiniaceae, immobile e psicrofilo, ovvero capace di crescere e di moltiplicarsi a temperature comprese tra 0 °C e 20 °C.
Esso fa parte dei batteri non coliformi e, pertanto, non è in grado di fermentare il lattosio. Presenta catalasi (+) ed è quindi in grado di scindere il perossido di idrogeno in acqua e ossigeno. La sua fermentazione è acido mista e, se coltivato in terreni contenenti sangue, cresce meglio.
Chiamato in passato Pasteurella pestis, è un organismo anaerobico facoltativo in grado di infettare l'uomo attraverso la pulce del ratto orientale provocandogli la peste in tutte le sue forme (bubbonica, setticemica e polmonare).
In America settentrionale può infettare anche altri mammiferi differenti dall'uomo quali il cane della prateria dalla coda nera e il furetto dai piedi neri.
Yersinia pestis[1] est bacterium quod morbum pestis efficit.
Yersinia pestis (Lehmann et Neumann 1896) van Loghem 1944. N.L. fem. n. (Neolatinum substantivum femininum) Yersinia, nomen sumptum de bacteriologo A. J. E. Yersin, qui primus fuit qui organismum separavit anno 1894.[2]
Hoc bacterium anno 1894 inter contagium pestis in Hongcongum ab Alexandro Yersin medico Helvetico-Francico inventum est. Yersin ei nomen imposuit Pasteurella pestis, sed anno 1967 bacterio novum nomen honoris Yersin impositum est.
Yersinia pestis is een bacterie die de verwekker van de pest is en wordt overgebracht door vlooien van ratten op mensen: een vlo die eerst besmet bloed zuigt, en daarna een mens bijt, brengt daarmee de bacterie over.
De werking van de bacterie is als volgt: de bacterie verstopt de maagingang van de rattenvlo waardoor deze grote honger krijgt. De vlo bijt hierdoor sneller en bij een beet komt de bacterie in het lichaam van het gebeten organisme. Het betreft meestal ratten, maar indien deze niet genoeg voorhanden zijn - de pest is ook dodelijk voor ratten - worden ook mensen gebeten door de hongerige vlo. Door een beet kan het lichaam besmet raken en krijgt men builenpest, die een deel van de slachtoffers overleeft. Als de bacterie echter in de bloedbaan terechtkomt treedt de dood binnen korte tijd in. Indien de longen worden besmet, bijvoorbeeld via speeksel, spreekt men van longpest en sterft een hoog percentage van de slachtoffers.
Yersinia pestis er ein bakterie i familien enterobakteriar. Y. pestis smittar pattedyr og finst særleg hos smågnagarar. Den kan spreie seg til menneske gjennom lopper og gjev pest. Pest har gjeve opphav til store dødstal ved fleire kjente epidemiar i historisk tid (utan medisinsk tilsyn har pest høg letalitet), som til dømes Svartedauden, som tok livet av mellom ein tredel og halvparten av folkesetnaden i Europa. Mellom 1987 og 2001 blei det rapportert 36 876 tilfelle av pest til WHO, av desse døyde 2 847.[2]
Slekta Yersinia er ein Gram-negativ kokkebakterie, og som andre enterobakteriar har den eit gjæringsstoffskifte. Yersinia pestis produserer eit antifagocytisk slim.
Y. pestis blei oppdaga i 1894 av den sveitsisk-franske legen og bakteriologen Alexandre Yersin i samband med ein epidemi i Hong Kong.
Y. pestis er særs sensitiv overfor antibiotika, t.d. streptomycin og kloramfenikol.
Yersinia pestis er ein bakterie i familien enterobakteriar. Y. pestis smittar pattedyr og finst særleg hos smågnagarar. Den kan spreie seg til menneske gjennom lopper og gjev pest. Pest har gjeve opphav til store dødstal ved fleire kjente epidemiar i historisk tid (utan medisinsk tilsyn har pest høg letalitet), som til dømes Svartedauden, som tok livet av mellom ein tredel og halvparten av folkesetnaden i Europa. Mellom 1987 og 2001 blei det rapportert 36 876 tilfelle av pest til WHO, av desse døyde 2 847.
Slekta Yersinia er ein Gram-negativ kokkebakterie, og som andre enterobakteriar har den eit gjæringsstoffskifte. Yersinia pestis produserer eit antifagocytisk slim.
Yersinia pestis er en bakterie som tilhører familien enterobakterier. Den forårsaker byllepest og lungepest. Alle former for bakterien har gitt opphav til store dødstall ved flere kjente epidemier gjennom menneskehetens historie. Uten behandling har sykdommen meget høy dødelighet. Bakterien var opphav til f.eks. svartedauden, som førte til at mellom en tredjedel til halvparten av Europas befolkning døde.
Slekten Yersinia er en gram-negativ stavbakterie, og i likhet med andre enterobakterier har den et gjæringsstoffskifte. Yersinia pestis produserer et antifagocytisk slim. Organismen kan bevege seg når den isoleres, men blir immobil i vertsdyret.
Y. pestis ble oppdaget i 1894 av den sveitsiske/franske legen og bakteriologen Alexandre Yersin fra Pasteurinstituttet. Oppdagelsen ble gjort i forbindelse med en epidemi i Hongkong.
Y. pestis er meget sensitiv overfor antibiotika, f.eks. streptomycin og kloramfenikol.
Yersinia pestis er en bakterie som tilhører familien enterobakterier. Den forårsaker byllepest og lungepest. Alle former for bakterien har gitt opphav til store dødstall ved flere kjente epidemier gjennom menneskehetens historie. Uten behandling har sykdommen meget høy dødelighet. Bakterien var opphav til f.eks. svartedauden, som førte til at mellom en tredjedel til halvparten av Europas befolkning døde.
Slekten Yersinia er en gram-negativ stavbakterie, og i likhet med andre enterobakterier har den et gjæringsstoffskifte. Yersinia pestis produserer et antifagocytisk slim. Organismen kan bevege seg når den isoleres, men blir immobil i vertsdyret.
Yersinia pestis[1] (anteriormente denominada Pasteurella pestis) é um cocobacilo gram-negativo, em forma de bastonete, imóvel e sem esporos. É um organismo anaeróbico facultativo que pode infetar o ser humano por via da pulga Xenopsylla cheopis.[2] A bactéria é a causa da doença peste, que pode assumir uma de três formas: peste pulmonar, peste septicémica ou peste bubónica.[2][3][4]
Estas três formas foram responsáveis por diversas epidemias de elevada mortalidade ao longo da História, entre as quais a Praga de Justiniano , a Peste negra, que dizimou um terço da população europeia entre 1347 e 1353, e a Terceira Pandemia, com origem na China em 1855 e que matou cerca de 10 milhões de pessoas.[5][6][7][8][9] Estas pestes tiveram provavelmente origem na China, tendo sido transmitidas para a Europa através das rotas comerciais.[8][10] A Y. pestis foi descoberta em 1894 por Alexandre Yersin, um médico franco-suiço do Instituto Pasteur, durante uma epidemia de peste em Hong Kong.[11]
Yersinia pestis (anteriormente denominada Pasteurella pestis) é um cocobacilo gram-negativo, em forma de bastonete, imóvel e sem esporos. É um organismo anaeróbico facultativo que pode infetar o ser humano por via da pulga Xenopsylla cheopis. A bactéria é a causa da doença peste, que pode assumir uma de três formas: peste pulmonar, peste septicémica ou peste bubónica.
Estas três formas foram responsáveis por diversas epidemias de elevada mortalidade ao longo da História, entre as quais a Praga de Justiniano , a Peste negra, que dizimou um terço da população europeia entre 1347 e 1353, e a Terceira Pandemia, com origem na China em 1855 e que matou cerca de 10 milhões de pessoas. Estas pestes tiveram provavelmente origem na China, tendo sido transmitidas para a Europa através das rotas comerciais. A Y. pestis foi descoberta em 1894 por Alexandre Yersin, um médico franco-suiço do Instituto Pasteur, durante uma epidemia de peste em Hong Kong.
Yersinia pestis (în trecut numit și Pasteurella pestis) este un bacil Gram-negativ din familia Enterobacteriaceae. Este un anaerob facultativ care poate infecta omul și alte animale.
Infecția umană are trei forme principale:
Toate cele trei forme au fost parte a pandemiilor istorice, care au ucis milioane de oameni, culminând cu Moartea neagră care a ucis o treime din populația Europei între anii 1347 și 1353.
În ultimii ani, Y. pestis a revenit în atenția publicului, pentru potențiala sa întrebuințare în arme biologice.
Yersinia pestis (în trecut numit și Pasteurella pestis) este un bacil Gram-negativ din familia Enterobacteriaceae. Este un anaerob facultativ care poate infecta omul și alte animale.
Infecția umană are trei forme principale:
pneumonică, septicemică și plaga bubonică (pesta sau ciuma bubonică).Toate cele trei forme au fost parte a pandemiilor istorice, care au ucis milioane de oameni, culminând cu Moartea neagră care a ucis o treime din populația Europei între anii 1347 și 1353.
În ultimii ani, Y. pestis a revenit în atenția publicului, pentru potențiala sa întrebuințare în arme biologice.
Yersinia pestis (predtým Pasteurella pestis) je patogénna baktéria z čeľade Enterobacteriaceae, ktorá je pôvodcom moru. Je bezbičíkovitá, tyčinkovitá, gramnegatívna baktéria, čiže baktéria nesfarbiteľná pomocou farbenia podľa Grama. Bola objavená v roku 1894 A. E. Yersiom a S. Kitasatom a podľa prvého bola pomenovaná. Yersinia pestis je veľmi infekčná: Už 100 až 500 vdýchnutých baktérií stačí, aby spôsobilo pľúcny mor.[chýba zdroj]
Yersinia pestis (predtým Pasteurella pestis) je patogénna baktéria z čeľade Enterobacteriaceae, ktorá je pôvodcom moru. Je bezbičíkovitá, tyčinkovitá, gramnegatívna baktéria, čiže baktéria nesfarbiteľná pomocou farbenia podľa Grama. Bola objavená v roku 1894 A. E. Yersiom a S. Kitasatom a podľa prvého bola pomenovaná. Yersinia pestis je veľmi infekčná: Už 100 až 500 vdýchnutých baktérií stačí, aby spôsobilo pľúcny mor.[chýba zdroj]
Yersinia pestis je gramnegativna fakultativno anaerobna bakterija iz rodu jersinij. Bakterija je obarvana na obeh polih. Spada v družino enterobakterij.
Yersinia pestis je povzročiteljica kuge (bubonske, pljučne in septikemične); bolezen je skozi človeško zgodovino izbruhnila v več epidemijah, za katere je bila značilna visoka smrtnost.
Leta 1894 jo je med epidemijo v Hong Kongu odkril švicarsko-francoski zdravnik in bakteriolog Alexandre Yersin. Po odkritelju je dobil ime rod teh bakterij.
Yersinia pestis (tidigare känd som Pasteurella pestis) är bakterien som orsakar pest. Den är en gramnegativ, stavformad och fakultativ anaerob bakterie inom familjen Enterobacteriaceae. Den kan infektera djur och människor, där pestloppan (Xenopsylla cheopis) är den främsta spridaren till människan, och bakterien orsakar pest som uppträder som böldpest, lungpest eller blodpest. Y. pestis upptäcktes år 1894 av Alexandre Yersin och orsakade bland annat digerdöden som tog död på två tredjedelar av Europas befolkning på 1300-talet. Dagens antibiotika är en effektiv bot mot pest.[1]
När Y. pestis stöter på en fagocyt, släpper den ut proteiner som förhindrar fagocytos och som dödar fagocyten, samtidigt minskar bakterien den infekterade organismens inflammatoriska egenskaper. Denna egenskap att kringgå kroppens naturliga försvarsmekanismer gör Y. pestis till en väldigt dödlig bakterie.
Inuti värden förökar sig bakterien och tar sig till lymfsystemet. Därifrån tar de sig till lymfkörtlarna där de orsakar blödningar och svullnad. Dessa ger efter en veckas inkubationstid upphov till bölder, därav namnet böldpest. En människa smittad med böldpest löper en 50-60% risk att dö utan vård.[2]
Om bakterier lyckas ta sig från lymfsystemet till blodsystemet utvecklas blodpest. Blodpest kännetecknas av blödningar och nekros i hela kroppen och dödlighetsfaktorn är 100% även med modern vård.[källa behövs]
Den tredje sortens pest, lungpest, är den mest smittsamma bland människor och inträffar när luftburna patogener från en hostande patient inhaleras. Även denna sort har en dödlighetsfaktor på 100% trots vård.[2]
År 2000 rapporterade Didier Raoult och ett antal andra forskare upptäckten av Y. pestis när de utförde ett PCR-test på tandpulpan från en man funnen i en kyrkogård för pestoffer från 1400-talet i Montpellier.
En studie, som publicerades av ett internationellt forskarlag under oktober 2010, bekräftade att Y. pestis var orsaken till digerdöden och ett antal senare pestepidemier. För att identifiera bakterien använde forskarna sig av DNA och proteiner utvunna ur kroppar från pestoffer funna i Hereford England, Saint-Laurent-de-la-Cabrerisse Frankrike och Bergen op Zoom Nederländerna.
De finns tre olika varianterna av pest:
Idag förekommer Y. pestis i ett femtontal länder, däribland delar av USA, Zaire, Tanzania och Madagaskar.[1] På Madagaskar bryter en pestsässong ut årligen vid regnperiodens början i slutet av augusti. Någon månad senare toppar antalet smittade för att sedan minska och helt försvinna i april.[3]
Bakterien smittar oftast i form av böldpest, genom bett från pestloppan (Xenopsylla cheopsis) som lever på gnagare som råttor, möss, präriehundar eller ekorrar. Eftersom råttor och möss lever närmast människan är det främst dessa arter som sprider bakterien vidare till människan. Man kan även smittas genom att handskas med smittade djur.[1] Vid lungpest sprids även smittan via salivdroppar vid upphostningar.[1]
När infekterade råttor dör av pest sjunker deras kroppstemperatur och deras blod koagulerar. Lopporna flyttar sig då till närliggande värmekällor med tillgång till blod. Den nya värden är oftast en råtta, men om det är i en trång miljö som är infekterad med råttor är sannolikheten hög för att loppornas nya värdar är människor.
Även lopporna själva blir påverkade av sjukdomen. Bakterierna som loppan fick i sig när den åt från ett infekterat djur förökar sig tills att de blockerar loppans mag-tarmkanal så att mat inte längre kan tränga fram. Detta leder till att loppan blir hungrigare och biter allt oftare, vilket infekterar allt fler offer. Den allvarligaste formen av pest, lungpest, kan även smitta genom inandning av patogener som hostats upp av en infekterad individ.
Den huvudsakliga smittbärande loppan är Xenopsylla cheopis eller pestloppan som den också kallas. Även andra arter av släktet Xenopsylla och loppor från andra släkten har visats kunna bära på Y. pestis.
Vilka gnagare som blir värdorganismer åt lopporna beror på geografiskt läge och miljön. Men den som är mest förknippad med pesten är svartråttan som anses vara den som förde med sig pesten och Y. pestis från Asien.
Man har upptäckt att en del gnagare blivit resistenta mot bakterien vilket kan medföra att de blivit asymptomatiska bärare.
Med hjälp av gramfärgning kan man bekräfta förekomsten av gramnegativa stavar. Sjukdomen kan även diagnostiseras genom identifikation av Y. pestis bakterien från sputum eller från vätska tagen från lymfkörtlarna.[4]
Sjukdomen går, ifall den är i ett tidigt stadium av böldpest, att behandla med olika antibiotika som streptomycin, kloramfenikol, kinolon och tetracyklin. Studier visar även på att användandet av doxycyklin och gentamicin är effektiva mot bakterien.
Att återhämta sig från sjukdomen medför en livstids immunitet. Det finns även vaccin som främst används till att skydda medicinsk personal och smittades familjer. Immuniteten medför dock en dold fara. Under Vietnamkriget upptäcktes det att resistenta individer i sällsynta fall kan bli asymptomatiska bärare, men endast under en kort period.
Yersinia pestis (tidigare känd som Pasteurella pestis) är bakterien som orsakar pest. Den är en gramnegativ, stavformad och fakultativ anaerob bakterie inom familjen Enterobacteriaceae. Den kan infektera djur och människor, där pestloppan (Xenopsylla cheopis) är den främsta spridaren till människan, och bakterien orsakar pest som uppträder som böldpest, lungpest eller blodpest. Y. pestis upptäcktes år 1894 av Alexandre Yersin och orsakade bland annat digerdöden som tog död på två tredjedelar av Europas befolkning på 1300-talet. Dagens antibiotika är en effektiv bot mot pest.
 Bu maddenin sonunda bir kaynak listesi olmasına rağmen, metin içi kaynaklar yeterince veya hiç kullanılmadığı için, bazı bilgilerin kaynağı belirsizdir. Lütfen maddedeki kaynakları uygun biçimde metin içinde yerleştirerek bu maddenin geliştirilmesine katkıda bulununuz. Binominal adı ''Yersinia pestis''
Bu maddenin sonunda bir kaynak listesi olmasına rağmen, metin içi kaynaklar yeterince veya hiç kullanılmadığı için, bazı bilgilerin kaynağı belirsizdir. Lütfen maddedeki kaynakları uygun biçimde metin içinde yerleştirerek bu maddenin geliştirilmesine katkıda bulununuz. Binominal adı ''Yersinia pestis''Yersinia pestis, Enterobacteriaceae ailesine mensup bir Gram negatif bakteri türüdür.[1] Veba hastılığının üç türüne de (bubonik, pnömonik, septisemik) yol açar. Y. pestis tarih boyunca birçok pandemilere (1347-1353 arasındaki Kara Ölüm gibi) sebep olmuştur.[1][2][3] Yersinia cinsine mensup bakteriler, Gram negatif çubuk şekilli kokobasillerden oluşmuştur ve diğer Enterobacteriaceae cinslerinde olduğu gibi, seçmeli anaerobik bir metabolizmaya sahiptir. Keme piresi tarafından taşınır.[1] Organizma izole halde hareketliyken (motil), memeli konağa geçtiğinde hareketsiz (non-motil) hale geçmektedir.
Y. pestis, 1894 yılında Pasteur Enstitüsü'nden bakteriyolog Alexandre Yersin tarafından, Hong Kong'daki bir veba epidemisi sırasında keşfedilmiştir. Yersin, Pasteur düşünce okulunun bir üyesiydi. Aynı dönemlerde Koch metodolojisini kullanan Japon bakteriyolog Şibasaburo Kitasato da epidemiye neden olan ajanı aramaktaydı. Fakat veba ile Yersinia pestis arasındaki ilişkiyi kuran ve bulan Yersin'dir. Bakteri orijinal olarak Pasteurella pestis olarak adlandırılmış, ismi 1967'de Yersinia pestis olarak değiştirilmiştir.
Y. pestis insanlara bit aracılığıyla bulaşır. Bit ısırığıyla, hastalık yapmaya yetecek miktarda bakteri geçişi olabilir. İnsanlarda ve özellikle fare ve sincap olmak üzere kemirgenlerde hastalık yapar. Fareden fareye ve fareden insana bit yoluyla, insandan insana ise pirelerle geçer.
Y. pestis'in patojenliği fagosite edilmesini engelleyen iki antijen sayesindedir: Hastalığın oluşması için mutlaka bulunması gereken faktörler olan F1 ve VW antijenleri bakteri tarafından 37 °C sıcaklıkta üretilirler. Bu yüzden bakterinin yaşam çemberinde önemli yer tutan bitte üretilmezler. Y.pestis kanda bulunan monositlerin içinde yaşayabilir ve antijenlerini üretebilir. Ancak nötrofillerin içinde yaşayamaz. Doğal ya da edinilmiş bağışıklık antijenlerine karşı üretilen opsonize edici antikorlar yoluyladır.
Hastalık bulaşma riski yüksek yerlerdeki yetişkinler için formaldehitle öldürülmüş bakterileri içeren bir aşı mevcuttur. Ancak sınırlı etkisi ve ileri derecedeki yangısal yanıtlar sebebiyle tercih edilmez. Antijenlere bağlı olarak genetik teknoloji yöntemleriyle üretilecek bir aşı için çalışmalar sürmekte ve umut vadetmektedir.
Amerika Birleşik Devletleri'nde bir klinikte elde edilmiş örnekte bulunan CO92 suşunun genomu yakın zamanda çözülmüştür. Kromozomu 4.653.728 baz çifti uzunluktadır. Kuzenleri Y. pseudotuberculosis ve Y. enterocolitica gibi Y.pestis de pCD1 plazmidine sahiptir. Y. pestis'de buna ilave olarak pPCP1 ve pMT1 plazmidleri de vardır. Bu plazmidler bir araya geldiklerinde HPI denen bir patojenlik adası oluştururlar. Bu özel gen durumu Y. pestis'in meşhur bulaşıcılığını sağlayan proteinleri kodlamaktadır. Bu faktörler, pek çok fonksiyonun yanında bakterinin konağa bağlanmasını, içsel proteinlerini konağa aktarmasını, bakterinin konağı istila etmesini ve eritrositlerden almasını sağlarlar. Y. pestis'in Y. pseudotuberculosis'den geliştiği düşünülmektedir. İki türün arasında sadece bazı plazmid farkları vardır.
Y. pestis birkaç antibiyotiğe, özellikle de streptomisin ve kloramfenikol'e ileri derecede duyarlıdır. Tetrasiklinler de bazen sinerjistik çalıştıkları streptomisinle beraber verilebilir. Ancak bu antibiyotiklerden birine, hatta ikisine birden dirençli suşlar da izole edilmiştir.
Yersinia pestis, Enterobacteriaceae ailesine mensup bir Gram negatif bakteri türüdür.[1] Veba hastılığının üç türüne de (bubonik, pnömonik, septisemik) yol açar. Y. pestis tarih boyunca birçok pandemilere (1347-1353 arasındaki Kara Ölüm gibi) sebep olmuştur. Yersinia cinsine mensup bakteriler, Gram negatif çubuk şekilli kokobasillerden oluşmuştur ve diğer Enterobacteriaceae cinslerinde olduğu gibi, seçmeli anaerobik bir metabolizmaya sahiptir. Keme piresi tarafından taşınır. Organizma izole halde hareketliyken (motil), memeli konağa geçtiğinde hareketsiz (non-motil) hale geçmektedir.
Y. pestis відкрив у 1894 році швейцарсько-французький лікар і бактеріолог, що працював у Інституті Пастера в Парижі, Александр Єрсен (фр. Alexandre Emile Jean Yersin) під час епідемії чуми в Гонконзі. Єрсен був прихильником школи Пастера. Японський бактеріолог Кітасато Сібасабуро[2] (англ. Kitasato Shibasaburo, яп. 北里柴三郎), який пройшов підготовку в Німеччині та практикував метод Роберта Коха, також в цей час був привернутий до пошуків збудника чуми. Але саме А. Єрсен фактично зв'язав чуму з Y. pestis. Бактерію спочатку назвали Pasteurella pestis, але в 1967 році її перейменували на честь А. Єрсіна.
ДНК цієї бактерії знайшли в зубах померлих від «Чорної смерті» (2-а пандемія чуми), тоді як тестування середньовічних останків людей, що померли від інших причин, не дало позитивної реакції на Yersinia pestis[3][4]. Це доводить, що Yersinia pestis була, як мінімум, супутнім чинником, хоча скоріше головним чинником в більшості (можливо, не у всіх) європейських епідеміях чуми. Влаштований чумою відбір вплинув на людську популяцію, відібравши індивідуумів, які були найбільш до неї схильні. Зменшення ареалу чумної палички після XIX століття відбулось через зміну умов проживання людей, зменшення ареалів певних гризунів, зміну кліматичних умов, тощо.
Yersinia pestis може існувати в 2 фазах:
Для культивування використовують:
Патогенність Yersinia pestis полягає в двох антифагоцитарних антигенах, званих F1 і VW, обидва істотні для вірулентності[1]. Ці антигени виробляє бактерія при температурі 37 °C. Окрім цього, Y. pestis виживає і виробляє F1 і VW антигени усередині кров'яних клітин, таких, наприклад, як моноцити, виключенням є поліморфноядерні нейтрофільні гранулоцити[5].
Як вважають, послідовне утворення різних біологічних варіантів (біоварів) чумної палички у живій природі відповідає черговості історичних пандемій чуми. Біовар Antiqua вважають відповідальним за Юстиніанову чуму. Невідомо, чи був цей біовар причиною раніших, менших епідемій, або ж ці випадки взагалі не були епідеміями чуми. Біовар Medievalis вважають пов'язаним з «Чорною смертю». Біовар Orientalis пов'язують з третьою пандемією чуми і більшістю сучасних спалахів чуми. Існує певна закономірність у сучасному географічному поширенні цих біоварів. Antiqua поширений у Африці й Центральній Азії. Medievalis в даний час зустрічається тільки в Центральній Азії. Orientalis наразі найбільш поширений за інші біовари, виділяють його від тварин на всіх континентах, окрім Антарктиди, Європи й територій Океанії. Є ще біовар Microtus, який у людей хворобу жодного разу ще не спричинив і виділяли його лише у тварин.
Розшифровані й доступні повні генетичні послідовності для двох з трьох підвидів бактерії: штаму KIM (з біовару Medievalis)[6] і штаму CO92 (з біовару Orientalis, отриманого з клінічного ізолята з США)[7].
Станом на 2006 рік ще не закінчили генну послідовність штаму з біовару Antiqua. Хромосоми штаму KIM складаються з 4 600 755 парних підстав, в штамі CO92 — 4 653 728 парних підстав. Як і споріднені Yersinia pseudotuberculosis і Yersinia enterocolitica, бактерія Y. pestis містить плазміди pCD1. Додатково, вона також містить плазміди pPCP1 і pMT1, яких немає у інших видів роду Yersinia. Перераховані плазміди і «острів патогенності», названий HPI, кодують білки, які є причиною такої значної патогенності цієї бактерії для людей. Крім всього іншого ці вірулентні чинники потрібні для бактерійної адгезії і ін'єкції білків в клітину хазяїна, вторгнення самої бактерії всередину клітини-мішені, захоплення і скріплення заліза, здобутого з червоних кров'яних тілець. Вважають, що бактерія Y. pestis виникла внаслідок мутації від Y. pseudotuberculosis, відмінність тільки у присутності специфічних вірулентних плазмідів.
Yersinia pestis là một loài vi khuẩn hình que thuộc họ Enterobacteriaceae. Nó là tác nhân gây bệnh của dịch hạch — căn bệnh đã gây nhiều trận dịch kinh hoàng với tỉ lệ tử vong rất cao trong lịch sử nhân loại (nếu không được điều trị, tử vong ở thể hạch là 75%, và ở thể phổi là gần 100%) như ở trận Đại dịch hạch (1665 ở Anh với 60.000 người chết) và Cái chết đen (giữa thế kỉ 14, giết chết 1/3 dân số châu Âu).
Giống Yersinia là các coccobacillus nhuộm Gram âm và lưỡng cực (hình quả tạ). Cũng như các Enterobacteriaceae khác, nó có khả năng lên men đường. Yersinia pestis có khả năng tiết ra chất nhờn chống thực bào. Vi khuẩn trở nên di động trong môi trường phân lập, nhưng bất động khi ở trong vật chủ (động vật có vú).
Y. pestis được khám phá vào năm 1894 do công của bác sĩ và nhà vi khuẩn học người Pháp Alexandre Yersin trong trận dịch của bệnh dịch hạch tại Hồng Kông. Yersin là thành viên của "trường phái Pasteur". Shibasaburo Kitasato, một nhà vi khuẩn học người Nhật được huấn luyện tại Đức, thuộc "trường phái Koch" đối thủ, lúc bấy giờ cũng tham gia tìm tác nhân gây bệnh của dịch hạch. Tuy nhiên chính Yersin là người đã liên kết bệnh dịch hạch với Yersinia pestis. Vi khuẩn này lúc đầu được gọi là Pasteurella pestis, và sau đó được đặt lại tên theo tên của Yersin.
Tính sinh bệnh là do hai kháng nguyên kháng thực bào F1 và VW; cả hai đều cần thiết cho độc tính của vi khuẩn. Chúng được vi khuẩn sản xuất ra ở 37 °C, điều này giải thích tại sao một số côn trùng như bọ chét chỉ mang khuẩn không độc tính. Hơn nữa, Y. pestis sống sót và sản xuất các kháng nguyên F1 và VW bên trong các tế bào máu như bạch cầu đơn nhân mà không trong bạch cầu đa nhân trung tính. Miễn dịch tự nhiên hay cảm ứng có được là do cơ thể sản xuất kháng thể opsonin đặc hiệu chống lại các kháng nguyên F1 và VW. Chúng kích thích hiện tượng thực bào ở bạch cầu trung tính.
Hiện nay có vắcxin bất hoạt formalin cho người lớn ở mức nguy cơ cao, nhưng nó không hiệu quả lắm và có thể gây phản ứng viêm trầm trọng. Các thí nghiệm với kĩ thuật di truyền sản xuất vắcxin dựa trên các kháng nguyên F1 và VW đang được tiến hành và tỏ ra có nhiều triển vọng.
Y. pestis nhạy cảm cao đối với vài loại kháng sinh, chủ yếu là streptomycin và chloramphenicol.
Yersinia pestis là một loài vi khuẩn hình que thuộc họ Enterobacteriaceae. Nó là tác nhân gây bệnh của dịch hạch — căn bệnh đã gây nhiều trận dịch kinh hoàng với tỉ lệ tử vong rất cao trong lịch sử nhân loại (nếu không được điều trị, tử vong ở thể hạch là 75%, và ở thể phổi là gần 100%) như ở trận Đại dịch hạch (1665 ở Anh với 60.000 người chết) và Cái chết đen (giữa thế kỉ 14, giết chết 1/3 dân số châu Âu).
Giống Yersinia là các coccobacillus nhuộm Gram âm và lưỡng cực (hình quả tạ). Cũng như các Enterobacteriaceae khác, nó có khả năng lên men đường. Yersinia pestis có khả năng tiết ra chất nhờn chống thực bào. Vi khuẩn trở nên di động trong môi trường phân lập, nhưng bất động khi ở trong vật chủ (động vật có vú).
Y. pestis была открыта в 1894 году швейцарско-французским медиком и бактериологом Пастеровского института Александром Йерсеном во время эпидемии чумы в Гонконге. Йерсен был сторонником школы Пастера. Прошедший подготовку в Германии японский бактериолог Китасато Сибасабуро, практиковавший метод Коха, также в это время был привлечён к поискам агента, являющегося возбудителем чумы. Однако именно Йерсен фактически связал чуму с Y. pestis. Долгое время возбудителя чумы относили к роду Bacterium, позже — к роду Pasteurella. В 1967 году род бактерий, к которому относился возбудитель чумы, был переименован в честь Александра Йерсена.
В результате сравнения древних штаммов генов Yersinia pestis и её вероятного предка Yersinia pseudotuberculosis (псевдотуберкулезная палочка) было выявлено, что Yersinia pestis мутировала из сравнительно безвредного микроорганизма около 10 тысяч лет назад. Выяснилось, что обитающая в почве Y. pseudotuberculosis, вызывающая легкое заболевание желудочно-кишечного тракта, приобрела тогда несколько генов, позволивших ей проникать в легкие человека. Далее, в ключевом гене Pla произошла замена одной аминокислоты, в результате чего микроорганизм смог с повышенной силой разлагать белковые молекулы в легких и размножаться по всему организму через лимфатическую систему. Исследователи подозревают, что ген Pla чумная палочка позаимствовала у другого микроба в результате горизонтального обмена генами[6][7]. Это подтверждают и исследования датских и британских ученых, которые провели исследования молекул ДНК, извлеченных из зубов 101 человека бронзового века, обнаруженных на территории Евразии (от Польши до Сибири). Следы бактерии Y. pestis нашли в ДНК семерых, возрастом до 5783 лет, при этом в шести из этих образцов отсутствовали «ген вирулентности» ymt и мутации в «гене активации» pla. В дальнейшем, на рубеже второго и первого тысячелетия до нашей эры, из-за демографических условий, выразившихся в увеличении плотности населения, возникла более летальная «бубонная» мутация бактерии[8][9].
Известны три биовара бактерии; полагают, что каждый соответствует одной из исторических пандемий чумы. Биовар antiqua считают ответственным за Юстинианову чуму. Неизвестно, был ли этот биовар причиной более ранних, меньших эпидемий, или же эти случаи вообще не были эпидемиями чумы. Биовар medievalis полагают связанным с «Чёрной смертью». Биовар orientalis связывают с Третьей пандемией и большинством современных вспышек чумы.
Патогенность Yersinia pestis заключается в двух антифагоцитарных антигенах, называемых F1 и VW, оба существенны для вирулентности[2]. Эти антигены производятся бактерией при температуре 37 °C. Кроме этого, Y. pestis выживает и производит F1 и VW антигены внутри кровяных клеток, таких, например, как моноциты, исключением являются полиморфно-ядерные нейтрофильные гранулоциты[10].
Некоторое время назад в США инактивированная формалином вакцина была доступна для взрослых, находящихся под большим риском заражения, однако затем продажи были прекращены по указанию FDA, специального агентства министерства здравоохранения США, по причине низкой эффективности и вероятности серьёзного воспаления. Ведутся перспективные эксперименты в генной инженерии по созданию вакцины, основанной на антигенах F1 и VW, хотя бактерии не имеющие антигена F1 сохраняют достаточную вирулентность, а антигены V достаточно изменчивы, так что вакцинация, основанная на этих антигенах может не давать достаточно полной защиты[11].
В России доступна живая вакцина на основе невирулентного штамма чумы[12].
Вакцинация не защищает от легочной чумы. Во время эпидемии 1910—1911 года применение прочумных сывороток (лимфы Хавкина и сыворотки Йерсена) лишь продлевало течение болезни на несколько дней, но не спасло жизнь ни одному больному[13]. Впоследствии ученым окончательно стало ясно, что гуморальный иммунитет при аэрогенном инфицировании возбудителем чумы значения не имеет[14].
Доступны полные генетические последовательности для различных подвидов бактерии: штамма KIM (из биовара Medievalis)[15], штамма CO92 (из биовара Orientalis, полученного из клинического изолятора в США)[16], штамма Antiqua, Nepal516, Pestoides F. Хромосомы штамма KIM состоят из 4 600 755 парных оснований, в штамме CO92 — 4 653 728 парных оснований. Как и родственные Y. pseudotuberculosis и Y. enterocolitica, бактерия Y. pestis содержит плазмиды pCD1. Вдобавок, она также содержит плазмиды pPCP1 и pMT1, которых нет у других видов рода Yersinia. Перечисленные плазмиды и остров патогенности, названный HPI, кодируют белки, которые и являются причиной патогенности бактерии. Помимо всего прочего эти вирулентные факторы требуются для бактериальной адгезии и инъекции белков в клетку «хозяина», вторжения бактерии в клетку-хозяина, захвата и связывания железа, добытого из эритроцитов.
В 2018 году в останках женщины из шведского местонахождения Frälsegården, умершей около 4900 лет назад (неолит) была обнаружена ДНК Yersinia pestis. Геном штамма из шведского захоронения выделился около 5700 лет назад, две ветви существующих сегодня штаммов Y. pestis выделились 5100 и 5300 лет назад[17].
ДНК Yersinia pestis найдена в останках двух человек из Самарской области, связанных со срубной культурой (около 3800 лет назад) и в останках человека из Капана (Армения), жившего в железном веке около 2900 лет назад[18].
С 1947 года традиционным средством первого этапа лечения от Y. pestis были стрептомицин[19][20], хлорамфеникол или тетрациклин[21]. Также есть свидетельства положительного результата от использования доксициклина или гентамицина[22].
Надо заметить, что выделены штаммы, устойчивые к одному или двум перечисленным выше агентам и лечение по возможности должно исходить из их восприимчивости к антибиотикам. Для некоторых пациентов одного лишь лечения антибиотиками недостаточно, и может потребоваться поддержка кровоснабжения, дыхательная или почечная поддержка.
Y. pestis была открыта в 1894 году швейцарско-французским медиком и бактериологом Пастеровского института Александром Йерсеном во время эпидемии чумы в Гонконге. Йерсен был сторонником школы Пастера. Прошедший подготовку в Германии японский бактериолог Китасато Сибасабуро, практиковавший метод Коха, также в это время был привлечён к поискам агента, являющегося возбудителем чумы. Однако именно Йерсен фактически связал чуму с Y. pestis. Долгое время возбудителя чумы относили к роду Bacterium, позже — к роду Pasteurella. В 1967 году род бактерий, к которому относился возбудитель чумы, был переименован в честь Александра Йерсена.
В результате сравнения древних штаммов генов Yersinia pestis и её вероятного предка Yersinia pseudotuberculosis (псевдотуберкулезная палочка) было выявлено, что Yersinia pestis мутировала из сравнительно безвредного микроорганизма около 10 тысяч лет назад. Выяснилось, что обитающая в почве Y. pseudotuberculosis, вызывающая легкое заболевание желудочно-кишечного тракта, приобрела тогда несколько генов, позволивших ей проникать в легкие человека. Далее, в ключевом гене Pla произошла замена одной аминокислоты, в результате чего микроорганизм смог с повышенной силой разлагать белковые молекулы в легких и размножаться по всему организму через лимфатическую систему. Исследователи подозревают, что ген Pla чумная палочка позаимствовала у другого микроба в результате горизонтального обмена генами. Это подтверждают и исследования датских и британских ученых, которые провели исследования молекул ДНК, извлеченных из зубов 101 человека бронзового века, обнаруженных на территории Евразии (от Польши до Сибири). Следы бактерии Y. pestis нашли в ДНК семерых, возрастом до 5783 лет, при этом в шести из этих образцов отсутствовали «ген вирулентности» ymt и мутации в «гене активации» pla. В дальнейшем, на рубеже второго и первого тысячелетия до нашей эры, из-за демографических условий, выразившихся в увеличении плотности населения, возникла более летальная «бубонная» мутация бактерии.
Известны три биовара бактерии; полагают, что каждый соответствует одной из исторических пандемий чумы. Биовар antiqua считают ответственным за Юстинианову чуму. Неизвестно, был ли этот биовар причиной более ранних, меньших эпидемий, или же эти случаи вообще не были эпидемиями чумы. Биовар medievalis полагают связанным с «Чёрной смертью». Биовар orientalis связывают с Третьей пандемией и большинством современных вспышек чумы.
鼠疫桿菌(Yersinia pestis)是一種桿菌,屬於腸道桿菌科,同時也是腺鼠疫、肺鼠疫和敗血性鼠疫的病媒。所有的類型都在人類歷史上造成嚴重的傷亡(例如黑死病)。
耶爾辛氏菌屬是屬於革蘭氏陰性菌(Gram negative),雙球株桿菌,和其他腸細菌相似,它有新陳代謝作用。鼠疫桿菌能產生反吞噬細胞的黏液。該生命體在隔離培養時是可動的,但在哺乳動物寄主裡時會變成不可動的。
鼠疫桿菌是1894年由巴斯德研究所(Pasteur Institute)的法國醫生和細菌學家亞歷山大·耶爾辛在香港鼠疫大流行時所發現的。耶爾辛是巴斯德的學生。北里柴三郎,一名日本細菌學家和科赫(Robert Koch)的學生,當時也正在從事尋找鼠疫病原體的研究。然而,耶爾辛先一步確定鼠疫和鼠疫桿菌的關係。這個細菌原被稱為鼠疫巴斯德氏桿菌(Pasteurella pestis),後來被重新命名為鼠疫耶爾辛氏桿菌(Yersinia pestis)。
正常情況下,鼠疫桿菌只會在跳蚤和齧齒類身上發現。靠著這兩種宿主,鼠疫桿菌能從森林散播到都市中。然而,並不是每一種齧齒類都能攜帶鼠疫桿菌,不同的物種有不同的適應性。
鼠疫桿菌之所以會有這麼強的致病力,是因為它能抵禦白血球的吞噬作用。
鼠疫桿菌(Yersinia pestis)是一種桿菌,屬於腸道桿菌科,同時也是腺鼠疫、肺鼠疫和敗血性鼠疫的病媒。所有的類型都在人類歷史上造成嚴重的傷亡(例如黑死病)。
耶爾辛氏菌屬是屬於革蘭氏陰性菌(Gram negative),雙球株桿菌,和其他腸細菌相似,它有新陳代謝作用。鼠疫桿菌能產生反吞噬細胞的黏液。該生命體在隔離培養時是可動的,但在哺乳動物寄主裡時會變成不可動的。
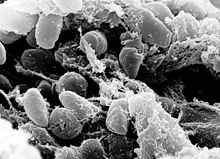
ペスト菌(Yersinia pestis、エルシニア・ペスティス)は、グラム陰性の通性嫌気性細菌であり、腸内細菌科に属する。両極染色で、外見は安全ピンのような形に見え、ペストの病原体となる。ペストは人類の歴史を通じて最も致死率の高かった伝染病であり、1347年から1353年にかけて流行した際にはヨーロッパの全人口の約3分の1が死滅した(1347年10月、中央アジアからイタリアのメッシーナに上陸、1348年にはアルプス以北のヨーロッパにも到達)。
なお、微生物学上はペスト菌と仮性結核菌はほぼ同一であり、プラスミドの有無の差でしかない。このためペスト菌は仮性結核菌の亜種とされたこともあった。しかし、その医学的危険性から別種として扱う必要があり、Yersinia pestisは保存名となっている。
単独では運動性を持つが、宿主中にいるときには運動性を持たない。
ペスト菌は1894年にスイス・フランスの医師で、パスツール研究所の細菌学者でもあったアレクサンドル・イェルサンが香港で発見した。また同時期に、ロベルト・コッホの指導を受けた日本人細菌学者の北里柴三郎がこれとは全く独立に発見した。しかし、ペストとペスト菌を最初に結び付けて考えたのはイェルサンであり、当初ルイ・パスツールにちなんでPasteurella pestisと付けられていたこの菌の学名は1967年に、イェルサンにちなんだYersinia pestisに改められた。
ペスト菌には3種類の生物型が知られ、それぞれが歴史上のペストの大流行の原因となっている。Antiquaは541年から542年にかけて東ローマ帝国から始まった大流行を引き起こし、Medievalisは14世紀のヨーロッパでの大流行の原因とされる。Orientalisは中華人民共和国雲南省で1855年に始まった大流行の原因であり、また現在のペストの大部分はこの菌によるものである。
ペスト菌の病原性は、F1抗原、V抗原と名づけられた2つの抗食細胞性抗原によっており、2つともが病原性の発現に重要な役割を担っている。これらの抗原は、37℃の環境下で生成される。ペスト菌は単球などの白血球内で生き続け、F1抗原、V抗原を産生する。しかし好中球の中では生きられない。免疫作用により、F1抗原、V抗原に対応する抗体が産生され、好中球による食作用を引き起こす。
かつてホルマリンで不活性化したワクチンが使われたことがあったが、活性化した菌が残っている強い危険があるとしてアメリカ食品医薬品局により回収された。効果は薄く、重度の炎症を引き起こすこともあった。F1抗原、V抗原の部位を遺伝子工学により改変したワクチンの研究が試みられているが、F1抗原を欠いたものにも強い毒性があり、V抗原は野生でも変性しやすいという性質があり十分にうまくは行っていない。
3生物型のうち、MedievalisとOrientalisの2ついては、それぞれKIM株とCO92株を使って全長のゲノム配列が解読された。2006年には、Antiquaのゲノムも解読された。KIM株の染色体の全長は4,600,755塩基対で、CO92株の染色体の全長は4,653,728塩基対の長さであった。類縁種の仮性結核菌(Y. pseudotuberculosis)やエルシニア感染症を引き起こす原因菌(Y. enterocolitica)などと同様に、ペスト菌の遺伝子はプラスミドpCD1を持っていた。さらにペスト菌は他のエルシニア属細菌が持たない2つのプラスミドpPCP1とpMT1を余分に持っていた。これらのプラスミドとHPIと呼ばれる病原性島は、ペスト菌に特有の病原性を発現させるいくつかのタンパク質をコードしていた。これらの毒性は、細菌が宿主に付着し宿主に自己のタンパク質を持ち込むため、細菌自身が宿主の細胞に侵入するため、そして赤血球から鉄イオンを引き剥がして利用するために必要とされる。ペスト菌と仮性結核菌の違いは特異的な毒性を示すプラスミドの有無のみであり、仮性結核菌はペスト菌の祖先だと考えられている。
2011年、ロンドンの黒死病患者の墓地から発見された遺骨を調べた結果、ペスト菌のゲノムは14世紀のものと現在のものとではほとんど変化していないことが判明した[1]。これは、ペスト菌の系統が1つしかなく、直線的にしか進化できない(線的進化)からだと考えられている。
伝統的に、ペスト菌に対する初期の治療にはストレプトマイシン、クロラムフェニコール、テトラサイクリン、フルオロキノロンなどが用いられてきた。また、ドキシサイクリン、ゲンタマイシンが効果を発揮するという結果もある。
ただし、上に挙げた抗生物質の1種または2種にたいして耐性を持つ菌も分離されている。治療は各抗生物質への感受性、耐性を見極めて行うべきである。また抗生物質のみの治療が奏功しない患者もおり、このような場合は循環補助、呼吸補助、腎補助など別の措置が必要になる。
ペスト菌(Yersinia pestis、エルシニア・ペスティス)は、グラム陰性の通性嫌気性細菌であり、腸内細菌科に属する。両極染色で、外見は安全ピンのような形に見え、ペストの病原体となる。ペストは人類の歴史を通じて最も致死率の高かった伝染病であり、1347年から1353年にかけて流行した際にはヨーロッパの全人口の約3分の1が死滅した(1347年10月、中央アジアからイタリアのメッシーナに上陸、1348年にはアルプス以北のヨーロッパにも到達)。
なお、微生物学上はペスト菌と仮性結核菌はほぼ同一であり、プラスミドの有無の差でしかない。このためペスト菌は仮性結核菌の亜種とされたこともあった。しかし、その医学的危険性から別種として扱う必要があり、Yersinia pestisは保存名となっている。
페스트균(Yersinia pestis)[1]은 포자가 없는 그람 음성, 비 이동성, 막대 모양의 구간균이다. 동양 쥐벼룩 (Xenopsylla cheopis)을 통해 인간을 감염시킬 수있는 혐기성 유기체이다.[2] 이 질병은 전염병, 패혈증 및 림프절이 붓는 세 가지 주요 형태를 취하는 질병 전염병을 유발한다.[2][3]
페스트균은 비 포식성 점액층을 생성하는 양극성 염색체(안전핀 모양을)를 가진 산소가 없는상태에서 정상적인 양육을 하는 박테리아이다. 이동하지 않는 비 이동성 스틱 형태를 띠고 있다.[4]
페스트균은 중앙 아시아나 중국에서 시작되어 무역로를 통해 서쪽으로 전염되었을 수 있다.[5][6][7] 그러나, 2018년 연구에 따르면, 고대 스웨덴의 무덤에서 페스트균이 발견되었고, 기원전 3,000년 경 당시 유럽 인구가 크게 감소한 것이 페스트 균으로 인한 유럽 신석기 시대의 쇠퇴의 원인일 수 있다.[8] 이는 페스트균이 유럽에서 시작되었을 수 있음을 시사한다.[9]
페스트균은 1894년 파스퇴르 연구소에서 홍콩 독감 연구 진행 중에 스위스/프랑스 의사이며 세균학자인 알렉산더 예르신에 의해 발견되었다.[10] 일본 세균학자 키타 사토 시바 사부로 (Kitasato Shibasaburō)도 전염병의 원인을 찾는 데 관여했다.[11]
인류 역사 전반에 걸쳐 높은 사망률을 가진 세 번의 전염병 범유행을 주도한 균이다.
페스트균에 감염된 동양 쥐벼룩은 장의 색이 어둡다. 벼룩이 숙주에 상처를 내고 피를 빨아 먹을 때, 페스트균은 상처로 역류되고 감염을 일으킨다.
페스트 균은 도시와 자연에서 존재하는 벼룩과 설치류를 통해서 확산된다. 자연에 존재하는 설치류는 야생이지만, 도시에서는 주로 갈색 쥐가 된다.
사람에게 전염되는 것은 보통 감염된 벼룩이 피를 빠는 과정 중에 진행된다. 질병이 폐렴 형태로 진행되면, 인간은 기침, 구토 및 재채기를 통해 박테리아를 다른 사람에게 전염시킬 수 있다.
|date= (도움말)