zh-TW
在導航的名稱

Streptococcus agalactiae és un estreptococ del grup B (EGB), gram-positiu, catalasa negatiu, oxidasa negatiu, anaerobi facultatiu, caracteritzat per presentar el Sistema Lancefield, grup B d'antígens lancefield. Es pot trobar en l'aparell digestiu, urinari i genital dels adults. Encara que una infecció per EGB normalment no ocasiona problemes a les dones sanes abans d'uns embaràs, pot provocar una malaltia greu a la mare i al bebè durant la gestació i després del part.
Una de cada cinc dones embarassades té estreptococs del grup B en el recte o en la vagina. En aquestes dones, una infecció per EGB pot causar corioamnionitis (infecció greu de les membranes de la placenta. Les infeccions de l'aparell urinari causades per les EGB poden provocar contraccions prematures en una mare gestant fins al punt de causar un part prematur.
Els bebès acabats de néixer poden contraure la infecció per Streptococcus agalactiae durant l'embaràs o al passar pel tracte genital si el part és via vaginal. Els EGB són la causa més freqüent d'infeccions que posen en perill la vida dels nadons. En aquestes infeccions s'inclouen la pneumònia i la meningitis. Aproximadament un de cada 100 o 200 bebès que tenen mares infectades per estreptococs del grup B, desenvolupen símptomes de patologies causades per EGB. Gairebé el 75% dels casos d'infeccions per aquest estreptococ es presenta durant la primera setmana de vida i se la denomina malaltia de començament precoç. Els nadons prematurs són més susceptibles a la infeccions per EGB que els bebès que néixen en el terme normal d'embaràs.
La importància d'aquestes infeccions estan determinades per tres factors:
La infecció per EGB pot deixar greus seqüeles als nadons, com ceguesa, sordesa, paràl·lisi cerebral i retard d'aprenentatge. Afortunadament existeixen mètodes eficaços per prevenir aquesta gravísima infecció. Mitjançant la detecció de mares portadores d'Streptococcus agalactiae amb anàlisis de fluids vaginals i rectals, i una adequada profilaxi antibiòtica intrapart pot evitar-se la infecció per estreptococs beta hemolític grup B en nadons.
L'examen a les mares es pot realitzar entre les 35 i 37 setmanes de gestació mitjançant cultius de possibles col·lònies d'Streptococcus agalactiae localitzades al recte i a la vagina. Si la mare és positiva a EGB, s'administrarà antibiòtics intrapart.
Els especialistes recomanen a les dones que ja han parit un bebè amb infecció d'estreptococcus agalactiae que siguin tractades amb antibiòtics via intravenosa durant el següent part. També es recomana el tractament antibiòtic per a totes aquelles dones que, durant l'embaràs, hagin patit una infecció de les vies urinàries provocades per aquest eubacteri.
Un estudi publicat en el New England Journal of Medicine, va comparar els índexs de brots de la malaltia en nadons de mares que s'havien fet cultius durant l'embaràs amb els nadons de mares no avaluades. El resultat va ser que el risc d'un brot primerenc en els nadons de mares avaluades es reduïa a la meitat que en els nadons del grup de mares no avaluades.
El tipus de tractament per la infecció d'estreptococs del grup B es defineix d'acord en el moment que es detecta la presència del microorganisme. Es realitze dos tipus de tractament:
A Espanya, Estats Units i Canadà són alguns dels països que ja realitzen per norma cultius a totes les embarassades per detectar la presència d'aquest estreptococ. També es realitzen estratègies de prevenció i higiene per prevenir la infecció a totes les dones.
Streptococcus agalactiae és un estreptococ del grup B (EGB), gram-positiu, catalasa negatiu, oxidasa negatiu, anaerobi facultatiu, caracteritzat per presentar el Sistema Lancefield, grup B d'antígens lancefield. Es pot trobar en l'aparell digestiu, urinari i genital dels adults. Encara que una infecció per EGB normalment no ocasiona problemes a les dones sanes abans d'uns embaràs, pot provocar una malaltia greu a la mare i al bebè durant la gestació i després del part.
Una de cada cinc dones embarassades té estreptococs del grup B en el recte o en la vagina. En aquestes dones, una infecció per EGB pot causar corioamnionitis (infecció greu de les membranes de la placenta. Les infeccions de l'aparell urinari causades per les EGB poden provocar contraccions prematures en una mare gestant fins al punt de causar un part prematur.
Els bebès acabats de néixer poden contraure la infecció per Streptococcus agalactiae durant l'embaràs o al passar pel tracte genital si el part és via vaginal. Els EGB són la causa més freqüent d'infeccions que posen en perill la vida dels nadons. En aquestes infeccions s'inclouen la pneumònia i la meningitis. Aproximadament un de cada 100 o 200 bebès que tenen mares infectades per estreptococs del grup B, desenvolupen símptomes de patologies causades per EGB. Gairebé el 75% dels casos d'infeccions per aquest estreptococ es presenta durant la primera setmana de vida i se la denomina malaltia de començament precoç. Els nadons prematurs són més susceptibles a la infeccions per EGB que els bebès que néixen en el terme normal d'embaràs.
La importància d'aquestes infeccions estan determinades per tres factors:
La prevalença de la colonització materna per EGB en el moment del part: és molt variable arreu del món i també en diferents regions d'un mateix país. S'estima que als Estats Units i Regne Unit aquesta xifra està al voltant d'un 20%, a Dinamarca és d'un 10%, Argentina del 15 al 18% i a Espanya d'un 15%. A països en vies de desenvolupament es publiquen xifres com un 5% a l'Índia, Colòmbia un 2%, Perú 8%. Incidència de la infecció neonatal primerenca per EGB en nadons: és molt variable arreu del món. Als Estats Units a principis de la dècada dels noranta la incidència era d'1,7/1.000 nascuts vius. Després d'intenses campanyes de prevenció, deu anys més tard la incidència es reduí a 0,6/1.000 nadons nascuts vius. Mortalitat causada per infecció neonatal primerenca per EGB en nadons: aquesta xifra varia a Espanya entre el 5% i el 20%.Streptococcus agalactiae ist ein grampositives Bakterium, das verschiedene Infektionskrankheiten auslösen kann. Die Art wurde erstmals 1887 von Nocard und Mollereau als Streptococcus de la mammite beschrieben.[1] Sie gehört serologisch zur Lancefield-Gruppe B der Streptokokken (GBS) und ist der Hauptverursacher einer bakteriellen Sepsis, Pneumonie und Meningitis bei Neugeborenen und des Kindbettfiebers. In zunehmendem Maße werden auch Infektionen von immunsupprimierten Personen bekannt. Obwohl Streptococcus agalactiae zur normalen Flora des Gastrointestinal- und Genitaltrakts gehört, kann er bei entsprechender Disposition eine lebensbedrohliche Infektion auslösen.
Wegen der Bedeutung als Verursacher schwerer Neugeboreneninfektionen (z. B. Neugeborenensepsis) wird bei Schwangeren eine Vorsorgeuntersuchung auf Streptococcus agalactiae am Ende der Schwangerschaft empfohlen (35.–37. Schwangerschaftswoche). Diese Untersuchung wird mittlerweile auch in Deutschland als B-Streptokokken-Screening bezeichnet. Im Rahmen dieser Untersuchung wird vom Frauenarzt ein bakteriologischer Abstrich aus dem Vaginaleingangsbereich und aus dem Enddarm entnommen; dieser Abstrich wird von einem mikrobiologischen Fachlabor auf S. agalactiae untersucht. Die Untersuchung im Labor dauert 2–3 Tage. Wenn bei der Schwangeren S. agalactiae nachgewiesen wird, führt die Geburtsklinik bei der Geburt eine (intrapartale) prophylaktische Behandlung mit Penicillin oder einem anderen Antibiotikum durch. Große Studien in den USA haben gezeigt, dass durch dieses Vorgehen die meisten Neugeboreneninfektionen durch B-Streptokokken vermieden werden können.
Ein wichtiges Kennzeichen dieses Bakteriums ist eine vollständige Hämolyse (auch als beta-Hämolyse bezeichnet) auf Blutagar-Platten. Dies wird auch für diagnostische Zwecke verwendet. Die Identifizierung wird dann durch Agglutination mit einem Antiserum durchgeführt, welches gegen das Zellwandpolysaccharid von S. agalactiae gerichtet ist. Alternativ kann auch der sog. Granadaagar eingesetzt werden, ein Indikatornährmedium, auf dem B-Streptokokken durch einen Farbumschlag erkannt werden können.[2][3]
Zur intravenösen Therapie von schweren Infektionen durch Streptokokken der Gruppe B kommen Penicillin G, kombiniert mit Gentamicin, oder Ampicillin, evtl. kombiniert mit Gentamicin, sowie alternativ Cefotaxim in Betracht. Bei leichteren Infektion kann die orale Einnahme von Amoxicillin oder Cefuroxim-Axetil ausreichend sein.[4]
Streptococcus agalactiae ist ein grampositives Bakterium, das verschiedene Infektionskrankheiten auslösen kann. Die Art wurde erstmals 1887 von Nocard und Mollereau als Streptococcus de la mammite beschrieben. Sie gehört serologisch zur Lancefield-Gruppe B der Streptokokken (GBS) und ist der Hauptverursacher einer bakteriellen Sepsis, Pneumonie und Meningitis bei Neugeborenen und des Kindbettfiebers. In zunehmendem Maße werden auch Infektionen von immunsupprimierten Personen bekannt. Obwohl Streptococcus agalactiae zur normalen Flora des Gastrointestinal- und Genitaltrakts gehört, kann er bei entsprechender Disposition eine lebensbedrohliche Infektion auslösen.
Wegen der Bedeutung als Verursacher schwerer Neugeboreneninfektionen (z. B. Neugeborenensepsis) wird bei Schwangeren eine Vorsorgeuntersuchung auf Streptococcus agalactiae am Ende der Schwangerschaft empfohlen (35.–37. Schwangerschaftswoche). Diese Untersuchung wird mittlerweile auch in Deutschland als B-Streptokokken-Screening bezeichnet. Im Rahmen dieser Untersuchung wird vom Frauenarzt ein bakteriologischer Abstrich aus dem Vaginaleingangsbereich und aus dem Enddarm entnommen; dieser Abstrich wird von einem mikrobiologischen Fachlabor auf S. agalactiae untersucht. Die Untersuchung im Labor dauert 2–3 Tage. Wenn bei der Schwangeren S. agalactiae nachgewiesen wird, führt die Geburtsklinik bei der Geburt eine (intrapartale) prophylaktische Behandlung mit Penicillin oder einem anderen Antibiotikum durch. Große Studien in den USA haben gezeigt, dass durch dieses Vorgehen die meisten Neugeboreneninfektionen durch B-Streptokokken vermieden werden können.
Ein wichtiges Kennzeichen dieses Bakteriums ist eine vollständige Hämolyse (auch als beta-Hämolyse bezeichnet) auf Blutagar-Platten. Dies wird auch für diagnostische Zwecke verwendet. Die Identifizierung wird dann durch Agglutination mit einem Antiserum durchgeführt, welches gegen das Zellwandpolysaccharid von S. agalactiae gerichtet ist. Alternativ kann auch der sog. Granadaagar eingesetzt werden, ein Indikatornährmedium, auf dem B-Streptokokken durch einen Farbumschlag erkannt werden können.
Zur intravenösen Therapie von schweren Infektionen durch Streptokokken der Gruppe B kommen Penicillin G, kombiniert mit Gentamicin, oder Ampicillin, evtl. kombiniert mit Gentamicin, sowie alternativ Cefotaxim in Betracht. Bei leichteren Infektion kann die orale Einnahme von Amoxicillin oder Cefuroxim-Axetil ausreichend sein.
Streptococcus agalactiae (also known as group B streptococcus or GBS) is a gram-positive coccus (round bacterium) with a tendency to form chains (as reflected by the genus name Streptococcus). It is a beta-hemolytic, catalase-negative, and facultative anaerobe.[1][2]
S. agalactiae is the most common human pathogen of streptococci belonging to group B of the Rebecca Lancefield classification of streptococci. GBS are surrounded by a bacterial capsule composed of polysaccharides (exopolysacharide). The species is subclassified into ten serotypes (Ia, Ib, II–IX) depending on the immunologic reactivity of their polysaccharide capsule.[1][3][4]
The plural term group B streptococci (referring to the serotypes) and the singular term group B streptococcus (referring to the single species) are both commonly encountered (even though S. halichoeri and S. pseudoporcinus are also group B Streptococci).[5]
In general, GBS is a harmless commensal bacterium being part of the human microbiota colonizing the gastrointestinal and genitourinary tract of up to 30% of healthy human adults (asymptomatic carriers). Nevertheless, GBS can cause severe invasive infections especially in newborns, the elderly, and people with compromised immune systems.[6]
S. agalactiae is also a common veterinary pathogen, because it can cause bovine mastitis (inflammation of the udder) in dairy cows. The species name agalactiae meaning "of no milk", alludes to this.[7]
GBS grows readily on blood agar plates as colonies surrounded by a narrow zone of β-hemolysis. GBS is characterized by the presence in the cell wall of the antigen group B of Lancefield classification (Lancefield grouping) that can be detected directly in intact bacteria using latex agglutination tests.[8][9] The CAMP test is also another important test for identification of GBS. The CAMP factor produced by GBS acts synergistically with the staphylococcal β-hemolysin inducing enhanced hemolysis of sheep or bovine erythrocytes.[8] GBS is also able to hydrolyze hippurate and this test can also be used to identify presumptively GBS.[8] Hemolytic GBS strains produce an orange-brick-red non-isoprenoid polyene (ornithine rhamnolipid) pigment (granadaene)[10] when cultivated on granada medium that allows its straightforward identification.[11] GBS can also be identified using MALDI-TOF (Matrix Assisted Laser Desorption/Ionization-Time of Flight) instruments.[12] GBS colonies can additionally be identified tentatively after their appearance in chromogenic agar media, nevertheless GBS-like colonies that develop in chromogenic media should be confirmed as GBS using additional reliable tests (e.g.latex agglutination or the CAMP test) to avoid potential mis-identification.[9][13][14] A summary of the laboratory techniques for GBS identification is depicted in Ref 7. [9]
GBS is a normal component of the intestinal and vaginal microbiota in some women, GBS is an asymptomatic (presenting no symptoms) colonizer of the gastrointestinal tract and vagina in up to 30% of otherwise healthy adults, including pregnant women.[3][15] GBS colonization may be permanent, intermittent or temporary. In different studies, GBS vaginal colonization rate ranges from 0% to 36%, most studies reporting colonization rates in sexually active women over 20%.[16] It has been estimated that maternal GBS colonization worldwide is 18%, with regional variation from 11% to 35%.[17] These variations in the reported prevalence of asymptomatic GBS colonization could be related to the detection methods used, and differences in populations sampled.[15][18]
As other virulent bacteria, GBS harbors an important number of virulence factors (virulence factors are molecules produced by bacteria that boosts their capacity to infect and damage human tissues), the most important being the capsular polysaccharide (rich in sialic acid) [3][19] and a pore-forming toxin, β-hemolysin.[19][20][21] Today it is considered that GBS pigment and hemolysin are identical or closely related molecules.[22][23][24][25]
GBS colonization usually does not cause problems in healthy women, nevertheless during pregnancy it can sometimes cause serious illness for the mother and the newborn. GBS is the leading cause of bacterial neonatal infection in the baby during gestation and after delivery with significant mortality rates in premature infants. GBS infections in the mother can cause chorioamnionitis (a severe infection of the placental tissues) infrequently, postpartum infections (after birth) and it had been related with prematurity and fetal death.[26] GBS urinary tract infections (UTI) may also induce labor and cause premature delivery.[3] In the western world, GBS (in the absence of effective prevention measures) is the major cause of several bacterial infections of the newborn neonatal infection sepsis, pneumonia, and meningitis, which can lead to death or long-term sequelae.[3]
GBS neonatal infection typically originates in the lower reproductive tract of infected mothers. GBS infections in newborns are separated into two clinical syndromes, early-onset disease (EOD) and late-onset disease (LOD).[27] EOD manifests from 0 to 7 living days in the newborn, most of the cases of EOD being apparent within 24h of birth.[3][28][29] The most common clinical syndromes of EOD are sepsis without apparent focus, pneumonia, and less frequently meningitis. EOD is acquired vertically (vertical transmission), through exposure of the fetus or the baby to GBS from the vagina of a colonized woman, either intrautero or during birth after rupture of membranes. Infants can be infected during passage through the birth canal, nevertheless newborns that acquire GBS through this route can become only colonized, and these colonized infants habitually do not develop EOD. Roughly 50% of newborns to GBS colonized mothers are also GBS colonized and (without prevention measures) 1–2% of these newborns will develop EOD.[30] In the past, the incidence of EOD ranged from 0.7 to 3.7 per thousand live births in the US[3] and from 0.2 to 3.25 per thousand in Europe.[18] In 2008, after widespread use of antenatal screening and intrapartum antibiotic prophylaxis (IAP), the CDC reported an incidence of 0.28 cases of EOD per thousand live births in the US.[31]
Multistate surveillance 2006-2015 shows a decline in EOD from 0.37 to 0.23 per 1000 live births in the US but LOD remains steady at 0.31 per 1000 live births.[32]
It has been indicated that where there was a policy of providing IAP for GBS colonized mothers the overall risk of EOGBS is 0.3%.[33] Since 2006 to 2015 the incidence of GBS EOD decreased from 0.37 to 0.23 per thousand live births in the US.[34]
Though maternal GBS colonization is the key determinant for EOD, other factors also increase the risk. These factors include onset of labor before 37 weeks of gestation (premature birth), prolonged rupture of membranes (≥18h before delivery), intra-partum fever (>38 °C,>100.4 °F), amniotic infections (chorioamnionitis), young maternal age, and low levels of GBS anticapsular polysaccharide antibodies in the mother.[3][28][29] Nevertheless, most babies who develop EOD are born to GBS colonized mothers without any additional risk factor.[28][29] A previous sibling with EOD is also an important risk factor for development of the infection in subsequent deliveries, probably reflecting a lack of GBS polysaccharides protective antibodies in the mother. Heavy GBS vaginal colonization is also associated with a higher risk for EOD.[28] Overall, the case–fatality rates from EOD have declined, from 50% observed in studies from the 1970s to 2 to 10% in recent years, mainly as a consequence of improvements in therapy and management. Fatal neonatal infections by GBS are more frequent among premature infants.[3][28][29][35]
GBS LOD affects infants from 7 days to 3 months of age and is more likely to cause bacteremia or meningitis. LOD can be acquired from the mother or from environmental sources. Hearing loss and mental impairment can be a long-term sequela of GBS meningitis.[3][36][37] In contrast with EOD, the incidence of LOD has remained unchanged at 0.26 per 1000 live births in the US.[38] S. agalactiae neonatal meningitis does not present with the hallmark sign of adult meningitis, a stiff neck; rather, it presents with nonspecific symptoms, such as fever, vomiting and irritability, and can consequently lead to a late diagnosis.[2]
The only reliable way to prevent EOD currently is intrapartum antibiotic prophylaxis (IAP), that is to say administration of antibiotics during delivery. It has been proved that intravenous penicillin or ampicillin administered for at least 4 hours before delivery to GBS colonized women is very effective at preventing vertical transmission of GBS from mother to baby and EOD. Intravenous penicillin remains the agent of choice for IAP, with intravenous ampicillin as an acceptable alternative.[3][28][29] For penicillin allergic women, the laboratory requisitions for ordering antepartum GBS screening cultures should indicate clearly the presence of penicillin allergy.[29] Cefazolin, clindamycin, and vancomycin are used to prevent EOD in infants born to penicillin-allergic mothers.[28][29] Intravenous vancomycin is recommended for IAP in women colonized with a clindamycin-resistant Group B Streptococcus strain and a severe penicillin allergy.[27][29]
There are two ways to identify female candidates to receive intrapartum antibiotic prophylaxis: a risk-based approach or a culture-based screening approach. The culture-based screening approach identifies candidates to receive IAP using lower vaginal and rectal cultures obtained between 36 and 37 weeks' gestation[28][29] (32–34 weeks of gestation for women with twins[39]) and IAP is administered to all GBS colonized women. The risk-based strategy identifies candidates to receive IAP by the aforementioned risk factors known to increase the probability of EOD without considering if the mother is or is not a GBS carrier.[3][40]
IAP is also recommended for women with intrapartum risk factors if their GBS carrier status is not known at the time of delivery, for women with GBS bacteriuria during their pregnancy, and for women who have had an infant with EOD previously.
The risk-based approach for IAP is in general less effective than the culture-based approach because in most of the cases EOD develops among newborns, which are born to mothers without risk factors.[18]
In 2010, the Centers for Disease Control and Prevention (CDC), in collaboration with several professional groups, issued its revised GBS prevention guidelines.[28]
In 2018, the task of revising and updating the GBS prophylaxis guidelines was transferred from the CDC [41] to ACOG (American College of Obstetricians and Gynecologists), the American Academy of Pediatrics and to the American Society for Microbiology. [14][27][29]
The ACOG committee issued an update document on Prevention of Group B Streptococcal Early-Onset Disease in Newborns in 2019.[29] This document does not introduce important changes from the CDC guidelines. The key measures necessary for preventing neonatal GBS early onset disease continue to be universal prenatal screening by culture of GBS from swabs collected from the lower vagina and rectum, correct collection and microbiological processing of the samples, and proper implementation of intrapartum antibiotic prophylaxis. The ACOG now recommends performing universal GBS screening between 36 and 37 weeks of gestation. This new recommendation provides a five-week window [42] for valid culture results that includes births that occur up to a gestational age of at least 41 weeks.
The culture-based screening approach is followed in most developed countries[43] such as the United States,[27][28][29] France,[44] Spain,[45] Belgium,[46] Canada, Argentina,[47] and Australia. The risk-based strategy is followed in the United Kingdom,[39][48] and the Netherlands.[18][49]
Though the GBS colonization status of women can change during pregnancy, cultures to detect GBS carried out ≤5 weeks before delivery predict quite accurately the GBS carrier status at delivery.
In contrast, if the prenatal culture is performed more than five weeks before delivery it is unreliable for predicting accurately the GBS carrier status at delivery.[28][29][42][50][51]
The clinical specimens recommended for culture of GBS at 36–37 weeks’ gestation, this recommendation provides a 5-week window for valid culture results that includes births that occur up to a gestational age of at least 41 weeks [29] (32–34 weeks of gestation for women with twins[39]) are swabs collected the lower vagina (near the introitus) and then from the rectum (through the anal sphincter) without use of a speculum.[28][29] Vaginal-rectal samples should be collected using a flocked swab preferably, since flocked swabs releases samples and microorganisms more effectively than fiber swabs. [14]
Following the recommendations of the Centers for Disease Control and Prevention of United States (CDC) these swabs should be placed into a non-nutritive transport medium and later inoculated into a selective enrichment broth, Todd Hewitt broth with selective antibiotics (enrichment culture).[28] After incubation the enrichment broth is subcultured to blood agar plates and GBS like colonies are identified by the CAMP test or using latex agglutination with GBS antisera. After incubation the enrichment broth can also be subcultured to granada medium agar [11] where GBS grows as pink-red colonies or to chromogenic agars, where GBS grows as colored colonies. [9][28]
GBS-like colonies that develop in chromogenic media should be confirmed as GBS using additional reliable tests to avoid mis-identification.[9]
Nucleic acid amplification tests (NAAT) such as polymerase chain reaction (PCR) and DNA hybridization probes have been developed for identifying GBS directly from recto-vaginal samples, but they still cannot replace antenatal culture for the most accurate detection of GBS carriers.
[28][29][39] Intrapartum NAAT without enrichment has a high false negative rate and the use of intrapartum NAAT without enrichment to rule out the need for IAP. [14]
Though IAP for EOD prevention is associated with a large decline in the incidence of the disease, there is, however, no effective strategy for preventing late-onset neonatal GBS disease.[52]
Vaccination is considered an ideal solution to prevent not only EOD and LOD but also GBS infections in adults at risk.[53] Nevertheless, though research and clinical trials for the development of an effective vaccine to prevent GBS infections are underway, no vaccine was available in 2020.[54][55][56] The capsular polysaccharide of GBS is not only an important GBS virulence factor but it is also an excellent candidate for the development of an effective vaccine.[18][57][58][59] Protein-based vaccines are also in development.[54][60][56]
GBS is also an important infectious agent able to cause invasive infections in adults. Serious life-threatening invasive GBS infections are increasingly recognized in the elderly and individuals compromised by underlying diseases such as diabetes, cirrhosis and cancer.[61] GBS infections in adults include urinary tract infection, skin and soft-tissue infection (skin and skin structure infection) bacteremia, osteomyelitis, meningitis and endocarditis.[6] GBS infection in adults can be serious and related with high mortality. In general penicillin is the antibiotic of choice for treatment of GBS infection.[62][63] Gentamicin (for synergy with penicillin G or ampicillin) can also be used in patients with life-threatening invasive GBS.[62]
In addition to human infections, GBS is a major cause of mastitis (an infection of the udder) in dairy cattle and an important source of economic loss for the industry. GBS in cows can either produce an acute febrile disease or a subacute more chronic condition. Both lead to diminishing milk production (hence its name: agalactiae meaning "of no milk").[64] Outbreaks in herds are common, so this is of major importance for the dairy industry, and programs to reduce the impact of S. agalactiae disease have been enforced in many countries over the last 40 years.[7]
GBS also causes severe epidemics in farmed fish, causing sepsis and external and internal hemorrhages, having been reported from wild and captive fish involved in epizootics in many countries.[65][66] Vaccination is an effective method to prevent pathogenic diseases in aquaculture and different kinds vaccines to prevent GBS infections have been developed recently.[67]
GBS has also been found in many other animals, such as camels, dogs, cats, crocodiles, seals, elephants and dolphins.[68][69]
{{cite web}}: CS1 maint: url-status (link) {{cite journal}}: CS1 maint: multiple names: authors list (link) {{cite web}}: CS1 maint: multiple names: authors list (link) {{cite journal}}: CS1 maint: multiple names: authors list (link) {{cite journal}}: CS1 maint: multiple names: authors list (link) {{cite journal}}: CS1 maint: multiple names: authors list (link) {{cite journal}}: CS1 maint: multiple names: authors list (link) {{cite journal}}: CS1 maint: multiple names: authors list (link) {{cite journal}}: CS1 maint: multiple names: authors list (link) {{cite journal}}: CS1 maint: multiple names: authors list (link) {{cite journal}}: CS1 maint: multiple names: authors list (link) Streptococcus agalactiae (also known as group B streptococcus or GBS) is a gram-positive coccus (round bacterium) with a tendency to form chains (as reflected by the genus name Streptococcus). It is a beta-hemolytic, catalase-negative, and facultative anaerobe.
S. agalactiae is the most common human pathogen of streptococci belonging to group B of the Rebecca Lancefield classification of streptococci. GBS are surrounded by a bacterial capsule composed of polysaccharides (exopolysacharide). The species is subclassified into ten serotypes (Ia, Ib, II–IX) depending on the immunologic reactivity of their polysaccharide capsule.
The plural term group B streptococci (referring to the serotypes) and the singular term group B streptococcus (referring to the single species) are both commonly encountered (even though S. halichoeri and S. pseudoporcinus are also group B Streptococci).
In general, GBS is a harmless commensal bacterium being part of the human microbiota colonizing the gastrointestinal and genitourinary tract of up to 30% of healthy human adults (asymptomatic carriers). Nevertheless, GBS can cause severe invasive infections especially in newborns, the elderly, and people with compromised immune systems.
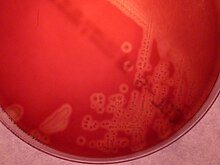 β-hemolytic colonies of Streptococcus agalactiae, blood agar 18h at 36°C
β-hemolytic colonies of Streptococcus agalactiae, blood agar 18h at 36°C S. agalactiae is also a common veterinary pathogen, because it can cause bovine mastitis (inflammation of the udder) in dairy cows. The species name agalactiae meaning "of no milk", alludes to this.
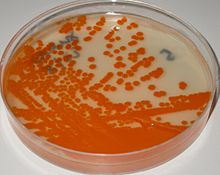 Streptococcus agalactiae on granada agar, anaerobic incubation
Streptococcus agalactiae on granada agar, anaerobic incubation  Positive CAMP test indicated by the formation of an arrowhead where Streptococcus agalactiae meets the Staphylococcus aureus (white middle streak)
Positive CAMP test indicated by the formation of an arrowhead where Streptococcus agalactiae meets the Staphylococcus aureus (white middle streak)
El Streptococcus agalactiae, estreptococo del grupo B (EGB), Group B Streptococcus, GBS,[1] es una bacteria que puede ocasionar infecciones muy graves (infección por estreptococo del grupo B), en recién nacidos y adultos. EGB es un coco (bacteria redonda) gram positivo que al microscopio se dispone en cadenas (estreptococo), beta-hemolítico, catalasa negativo, oxidasa negativo y anaerobio facultativo, caracterizado por presentar en su pared el grupo B de antígenos del sistema de Lancefield. El EGB posee una cápsula bacteriana de polisacárido rica en ácido siálico y según su estructura se distinguen 10 serotipos antigénicamente diferentes (Ia, Ib, II-IX).[1][2][3] El EGB es un constituyente de la microbiota (flora intestinal), microbiota normal del intestino de los humanos y otros animales.
El EGB crece como colonias beta-hemolíticas en agar sangre (rodeadas por un halo pequeño de β-hemólisis) y puede ser identificado [4] detectando el antígeno de grupo B por medio de aglutinación con látex con antisueros específicos.[5]
Otros test para identificar EGB son la detección de la hidrólisis del hipurato y la prueba de CAMP,[5] que provoca la lisis de eritrocitos bovinos o de cordero previamente sensibilizados por la esfingomielinasa producida por Staphylococcus aureus.[5]
Las cepas hemolíticas de EGB cuando se cultivan en agar granada (medio granada) [6] se desarrollan como colonias rojas pues producen un pigmento poliénico no isoprenoide de color rojo –granadaeno-[7] específico del EGB que permite su identificación inmediata.[8]
La identificación del EGB puede también llevarse a cabo usando la técnica de MALDI-TOF (Matrix Assisted Laser Desorption Ionization- Time of Flight Mass Spectrometry).[9][10]
La identificación "tentativa" del EGB también es posible por el aspecto de sus colonias en un medio cromogénico específico donde crece como colonias de color distinto según el medio empleado.[4][11][12] Si para la detección e identificación de EGBB se utilizan medios de cultivo cromogénicos siempre debe confirmarse que las colonias sospechosas (con aspecto de EGB) son realmente EGB utilizando una técnica segura de identificación e.g. detección de pigmento, aglutinación con látex, la prueba CAMP o MALDI-TOF.[4][8]
EGB puede encontrarse, como comensal, sin producir enfermedad (microbiota normal), en el aparato digestivo, urinario y genital hasta en un 30% de los adultos, (colonización), incluyendo la mujer embarazada.[2][13] Sin embargo, en ocasiones, el EGB es capaz de burlar los mecanismos de defensa del huésped humano, invadir los tejidos y causar infecciones graves ((Infección por estreptococo grupo B). Entre los principales factores de virulencia del EGB pueden citarse[14] el polisacárido capsular y la beta hemolisina (considerada idéntica al pigmento).[6][15][16][17][18][19]
Se han publicado tasas de colonización por EGB en la embarazada (sin causar infección) (portadores) entre un 4 y 36%, aunque la mayoría de estudios indican cifras sobre un 20%. Encontrándose grandes variaciones entre países e incluso entre regiones de un mismo país. Esta variación en los datos publicados puede deberse a diferentes métodos de estudio y a diferencias en las poblaciones estudiadas.[13][20]
Aunque la colonización por EGB normalmente no ocasiona síntomas ni problemas a la mujer sana durante el embarazo, puede provocar una enfermedad grave a la madre y al bebé durante la gestación y después del parto,[2][21] habiéndose relacionado con muerte fetal y parto prematuro.[22] La infección por EGB puede causar infrecuentemente corioamnionitis (infección grave de las membranas placentarias) e infección posparto (después del nacimiento). Las infección urinaria por EGB pueden inducir el trabajo de parto y provocar un parto prematuro.[2] En los países desarrollados EGB es la causa más frecuente de infección bacteriana grave del recién nacido, septicemia, neumonía y meningitis, pudiendo causar su muerte u originar secuelas permanentes.[2] En el recién nacido la infección por EGB causa dos síndromes clínicos diferentes, la infección de comienzo precoz (Early Onset Disease, EOD) y la infección de comienzo tardío (Late Onset Disease, LOD).[2] La infección de comienzo precoz se desarrolla en los primeros siete días de vida, la gran mayoría de casos aparecen en las primeras 24 horas de vida casi siempre como sepsis sin foco, neumonía o meningitis. Los recién nacidos pueden contraer la infección intraútero o más frecuentemente al pasar por el tracto genital durante el parto. La transmisión vertical (madre-recién nacido) ocurre durante el parto y aproximadamente un 50% de los recién nacidos de madres colonizadas por EGB están también colonizados. En ausencia de medidas de prevención 1-2% de los recién nacidos de madres colonizadas desarrollan EOD.[23] En US la incidencia de la EOD antes de la instauración de medidas de prevención era del 0.7 al 3.7 por mil recién nacidos[2]y en Europa se han comunicado incidencias desde 0.2 a 3.25 por mil recién nacidos.[20]
Diversos factores favorecen el desarrollo de la infección por EGB de comienzo precoz en un recién nacido cuya madre esta colonizada por EGB.[11][21] Aunque el riesgo fundamental para que el recién nacido desarrolle una infección neonatal por EGB es la colonización de la madre[21] otros factores de riego incluyen prematuridad, coriamnionitis materna, rotura prolongada de membranas (más de 18 h), fiebre intraparto, un hermano anterior que haya sufrido EOD y la bacteriuria por EGB durante el embarazo.[11][21] Otro importante factor de riesgo es la exposición a una alta concentración de EGB en el canal del parto. Sin embargo, la mayoría de los recién nacidos que desarrollan EOD nacen de madres que no presentan ninguno de estos factores.[11] La mortalidad por EOD que en los años 70 era de un 50% ha declinado actualmente en los países desarrollados a un 4-8%, fundamentalmente por los avances en los cuidados neonatales, siendo más alta entre los recién nacidos prematuros.[11][24]
La infección por EGB de comienzo tardío aparece después de una semana desde el nacimiento hasta los 90 días de vida, presentándose comúnmente como bacteriemia o meningitis sin que en muchos casos pueda conocerse el mecanismo de infección. Cuando LOD cursa como meningitis son frecuentes las secuelas permanentes como retraso mental o sordera.[2][25]
La única alternativa que, hasta ahora, se ha mostrado eficaz para prevenir la infección neonatal precoz por EGB es administrar por vía intravenosa a la gestante colonizada por EGB un antibiótico adecuado (profilaxis antibiótica) durante un mínimo de 4 horas antes del final del parto. Esta conducta reduce la transmisión del EGB al recién nacido y previene que este desarrolle infección por EGB. Los antibióticos utilizados son penicilina y ampicilina, y en caso de hipersensibilidad (reacción alérgica) cefazolina, clindamicina o vancomicina.[11][21][26][27]
Para seleccionar las madres candidatas a recibir profilaxis antibiótica existen dos estrategias. Una se basa en detectar las portadoras de EGB en la semana 35-37 de embarazo (cribado universal)(pesquisa universal) y suministrar profilaxis antibiótica durante el parto a todas las madres colonizadas por EGB. Adicionalmente se debe administrar profilaxis a las embarazadas que presentan factores de riesgo y cuyo estado de portadora de EGB se desconoce en el momento del parto. La otra estrategia selecciona a las candidatas a recibir profilaxis antibiótica basándose en la sola presencia de los citados factores de riesgo.[11][21][28]
Los Centros para el Control y la Prevención de Enfermedades (en inglés Centers for Disease Control and Prevention, CDC) publicaron sus recomendaciones actualizadas para las prevención de la infección neonatal por EGB en 2010.[11] En el año 2018 los CDC transfirieron la actualización de sus recomendaciones al colegio americano de obstetras y ginecólogos (American College of Obstetricians and Gynecologists, ACOG), a la Academia Americana de Pediatría y a la Sociedad Americana de Microbiología que en 2019 y 2020 han publicado documentos actualizado de recomendaciones para prevención de la infección neonatal por EGB. [8][21][27]
El documento de la ACOG no introduce novedades importantes sobre las recomendaciones de los CDC. La novedad es la recomendación de efectuar la detección de EGB en la embarazada en la semana 36-37 en vez de 35-37. Esta nueva recomendación, que se ha mostrado más efectiva,[29] tiene por objeto hacer válido la detección de EGB hasta cubrir los partos en la semana 41, dada la validez de solo 5 semanas de la pruebas de detección de EGB en la embarazada.[30]
La estrategia de cribado universal se sigue en la mayoría de países occidentales como USA, España, Francia, Bélgica, Canadá, Australia, Argentina etc. La estrategia basada en factores de riesgo es seguida en la UE en UK y Holanda.[20] Esta estrategia se muestra menos eficaz pues más de la mitad de los casos de infección precoz se presentan en recién nacidos de embarazadas sin factores de riesgo aparentes.[24] Pero desafortunadamente la profilaxis intraparto no es eficaz para prevenir la infección neonatal de comienzo tardío.[20][21]
La alternativa más eficaz para prevenir la infección por EGB será una vacuna capaz de provocar una adecuada respuesta inmune. Esta vacuna administrada a la madre protegería al recién nacido frente a la infección por EGB de comienzo precoz y también frente a la infección de comienzo tardío, así mismo protegería a los adultos susceptibles. El polisacárido de la cápsula del EGB es un importante factor de virulencia y constituye un excelente candidato para el desarrollo de vacunas para prevenir la infección por EGB.[20][31] Actualmente en adición a las vacunas basadas en el polisacárido capsular están en desarrollo y ensayo vacunas basadas en proteínas de superficie del EGB.[31][32]
Pero aunque existen estudios avanzados y ensayos clínicos avanzados, una vacuna efectiva aún no esta disponible para su uso generalizado.[20][33][34][35]
Aunque el estado de portadora durante el embarazo puede ser intermitente, se acepta que los cultivos vagino-rectales para detectar la colonización por EGB realizados con menos de 5 semanas antes del parto predicen adecuadamente el estado de portadora de EGB durante el parto, sin embargo, los cultivos realizados con anterioridad a 5 semanas no son fiables.[11][21][36][30] Las últimas recomendaciones de la ACOG recomiendan efectuar el cultivo para detección de EGB entre las semanas 36 y 37 de embarazo.[21] La muestras a estudiar son muestras vaginales y rectales tomadas con torunda.[11][21] Actualmente se recomienda usar escobillones "floked" para la toma de las muestras vaginales y rectales, pues este tipo de escobillones permite una mejor liberación de la muestra al medio de cultivo. [8] La técnica recomendada por los Centros para el Control y Prevención de Enfermedades de Estados Unidos (Centers for Disease Control and Prevention, CDC)[11] y por la Sociedad Americana de Microbiología (American Society for Microbiology. ASM)[8] requiere incubar las muestras vaginales y rectales en un caldo de enriquecimiento selectivo (Todd Hewitt con antibióticos) y posterior subcultivo en agar sangre e identificación como EGB de las colonias sospechosas. También es adecuado subcultivar el caldo selectivo en medio Granada donde la aparición de colonias rojas es demostrativa de la presencia de EGB,[4][37][38] pueden utilizarse medios de cultivo cromogénicos donde la aparición de colonias de color determinado indica la presencia de EGB.[11] Cuando se utilizan medios cromogénicos debe confirmarse que las colonias sospechosas (con aspecto de EGB) son realmente EGB mediante un procedimiento adecuado de confirmación e.g. aglutinación con látex o el test CAMP.[4]
Para detectar EGB en muestras vaginales y rectales también pueden utilizarse directamente -o tras una fase de enriquecimiento por cultivo en caldo selectivo- técnicas moleculares de amplificación de ácidos nucleicos como la reacción en cadena de la polimerasa,(Polymerase chain reaction) PCR.[11]
Las pruebas rápidas para detectar EGB (fundamentalmente técnicas moleculares) pueden ser en el futuro efectivas como substituto del cultivo para detectar las madres portadoras de EGB. Pero estas pruebas deben ser aún mejoradas para su uso como "point-of-care testing, POCT" que pueda ser realizado en la sala de partos y reemplazar a la detección del EGB por cultivo.[11][21] Un inconveniente de estas técnicas es que actualmente no permiten conocer la sensibilidad a los antibióticos de la cepa de EGB, lo que es un problema serio si existe alergia a la penicilina.[11][21]
EGB fue primariamente identificado como un patógeno animal causante principal de mastitis bovina[39]causando importantes perdidas en la producción de leche y por ello fue nombrado agalactiae (sin leche). La mastitis provocada por EGB puede tener un importante efecto sobre la cantidad y calidad de la leche producida y está asociada con contajes elevados de células y bacterias en la leche.[40]
EGB se ha encontrado también en múltiples especies animales como pollos, camellos, caballos, lagartos, ranas, hámster, gatos, ratones, monos y peces.[41] Las infecciones por EGB en peces causan septicemia y hemorragias internas y externas, constituyendo una importante fuente de perdidas en las piscifactorías.[42]
El Streptococcus agalactiae, estreptococo del grupo B (EGB), Group B Streptococcus, GBS, es una bacteria que puede ocasionar infecciones muy graves (infección por estreptococo del grupo B), en recién nacidos y adultos. EGB es un coco (bacteria redonda) gram positivo que al microscopio se dispone en cadenas (estreptococo), beta-hemolítico, catalasa negativo, oxidasa negativo y anaerobio facultativo, caracterizado por presentar en su pared el grupo B de antígenos del sistema de Lancefield. El EGB posee una cápsula bacteriana de polisacárido rica en ácido siálico y según su estructura se distinguen 10 serotipos antigénicamente diferentes (Ia, Ib, II-IX). El EGB es un constituyente de la microbiota (flora intestinal), microbiota normal del intestino de los humanos y otros animales.
Streptococcus agalactiae (streptocoque « sans lait ») est une bactérie dont on a reconnu l'implication dans les mammites de la vache dès la fin du XIXe siècle.
Il s'agit d'un streptocoque du groupe B de Lancefield, qui provoque une hémolyse β sur la gélose au sang de mouton (certaines souches donnent une hémolyse partielle, d'autres ne sont pas hémolytiques) et qui ne fermente pas l'esculine. Au Gram, il apparaît sous forme de longue chaîne de coques Gram+ (sur un bouillon). Ces caractères permettent de le distinguer d'autres streptocoques responsables de mammites, en particulier Streptococcus dysgalactiae (Lancefield C), Streptococcus uberis (non groupable, fermentant l'esculine) et Enterococcus faecium (Lancefield D, fermentant l'esculine).
Cliniquement Streptococcus agalactiae est responsable de mammites cliniques et surtout sub-cliniques à caractère contagieux. Le traitement des animaux infectés fait appel aux antibiotiques béta-lactamines par voie locale (diathélique). En général un traitement unique suffit, parfois appliqué à tout un lot d'animaux en même temps (blitz thérapie). L'application des mesures prophylactiques standards telles que le traitement antibiotique intramammaire hors-lactation (traitement de tarissement) et la désinfection des trayons après la traite avec des solutions iodées ou chlorées, ont pratiquement entraîné la disparition des infections à Streptococcus agalactiae en production laitière moderne (du moins chez la vache). Rare en Europe, il est toutefois plus fréquent en Amérique du Nord.
Streptococcus agalactiae, ou streptocoque B, n'est pas uniquement un germe animal, il se rencontre aussi chez l'homme : il appartient à la flore normale de l'intestin ou du tractus urogénital féminin. Certains l'incriminent comme agent pathogène dans les voies respiratoires.
Il est certainement pathogène dans les infections néonatales dues à une infection de la mère, par exemple :
Streptococcus agalactiae (streptocoque « sans lait ») est une bactérie dont on a reconnu l'implication dans les mammites de la vache dès la fin du XIXe siècle.
Il s'agit d'un streptocoque du groupe B de Lancefield, qui provoque une hémolyse β sur la gélose au sang de mouton (certaines souches donnent une hémolyse partielle, d'autres ne sont pas hémolytiques) et qui ne fermente pas l'esculine. Au Gram, il apparaît sous forme de longue chaîne de coques Gram+ (sur un bouillon). Ces caractères permettent de le distinguer d'autres streptocoques responsables de mammites, en particulier Streptococcus dysgalactiae (Lancefield C), Streptococcus uberis (non groupable, fermentant l'esculine) et Enterococcus faecium (Lancefield D, fermentant l'esculine).
Cliniquement Streptococcus agalactiae est responsable de mammites cliniques et surtout sub-cliniques à caractère contagieux. Le traitement des animaux infectés fait appel aux antibiotiques béta-lactamines par voie locale (diathélique). En général un traitement unique suffit, parfois appliqué à tout un lot d'animaux en même temps (blitz thérapie). L'application des mesures prophylactiques standards telles que le traitement antibiotique intramammaire hors-lactation (traitement de tarissement) et la désinfection des trayons après la traite avec des solutions iodées ou chlorées, ont pratiquement entraîné la disparition des infections à Streptococcus agalactiae en production laitière moderne (du moins chez la vache). Rare en Europe, il est toutefois plus fréquent en Amérique du Nord.
Streptococcus agalactiae, ou streptocoque B, n'est pas uniquement un germe animal, il se rencontre aussi chez l'homme : il appartient à la flore normale de l'intestin ou du tractus urogénital féminin. Certains l'incriminent comme agent pathogène dans les voies respiratoires.
Il est certainement pathogène dans les infections néonatales dues à une infection de la mère, par exemple :
pneumonies de déglutition lors d'un accouchement laborieux vaginites chez la femme avec risque de contamination du nouveau-né en cas d'accouchement bactériémies néonatales avec risque de complication méningée méningites des nouveau-nés (on retrouve alors le germe dans le sang et le LCR de l'enfant), seuls certains sérogroupes (I et III) seraient impliqués.
Streptococcus agalactiae (tamén coñecido como estreptococo do grupo B ou EGB (GBS polas súas siglas en inglés[1]) é unha especie de bacteria grampositiva con forma de coco (redonda) con tendencia a formar cadeas. É unha bacteria beta-hemolítica, catalase negativa, e anaerobia facultativa.[2][3] En xeral, o GBS é unha bacteria comensal inofensiva que forma parte da microbiota humana que coloniza os tractos gastrointestinal e xenitourinario de ata o 30% dos humanos adultos con boa saúde (portadores asintomátricos). Non obstante, o GBS pode causar graves infeccións invasivas en certos casos.[4]
Streptococcus agalactiae é a designación de especie para os estreptococos que pertencen ao grupo B da clasificación de Lancefield. O GBS está rodeado dunha cápsula bacteriana composta de polisacáridos (exopolisacáridos). A especie é subclasificada en dez serotipos (Ia, Ib, II–IX) dependiendo da reactividade inmunolóxica da súa cápsula de polisacáridcos.[2][5][6] Na literatura pode encontrarse a denominación en plural estreptococos do grupo B (referíndose aos serotipos) e en singular, estreptococo do grupo B, (referíndose á especie).
O GBS crece rapidamente en placas de ágar sangue formando colonias rodeadas por unha estreita zona de β-hemólise. O GBS caracterízase pola presenza na parede celular do antíxeno do grupo B da clasificación de Lancefield (agrupamento de Lancefield) que pode ser detectado directamente en bacterias intactas usando probas de aglutinación de látex.[7] A proba CAMP é outra importante proba para a identificación do GBS. O factor CAMP producido polo GBS actúa sinerxicamente coa β-hemolisina estafilocócica inducindo a potenciación da hemólise de eritrocitos de ovella ou bovinos.[7] O GBS tamén pode hidrolizar o hipurato, polo que esta proba pode tamén utilizarse para identificar probables GBS.[7] As cepas de GBS hemolíticas producen un pigmento polieno non isoprenoide laranxa-ladrillo-vermello (o granadaeno) cando é cultivado no medio granada, que permite a súa identificación directa.[8] Un sumario de técnicas de laboratorio para a identificación do GBS móstrase na seguinte referencia. [9]
O GBS é un colonizador asintomático do tracto gastrointestinal e a vaxina en ata o 30% dos adultos sans, incluíndo mulleres preñadas.[5][10] En diferentes estudos, a taxa de colonización vaxinal de GBS vai de 0% ao 36%, e a maioría dos estudos informan de taxas de colonización en mulleres sexualmente activas por riba do 20%.[11] Estimouse que a colonización por GBS maternal en todo o mundo é do 18%, con variacións rexionais do 11% ao 35%.[12] Estas variacións informadas na prevalencia da colonización de GBS asintomática poderían estar relacionadas cos métodos de detección utilizados, e as diferenzas nas poboacións mostreadas.[10][13]
Como outras bacterias virulentas, o GBS contén un importante número de factores de virulencia (moléculas producidas pola bacteria que potencian a súa capacidade de infectar e danar os tecidos), o máis importante dos cales é o polisacárido capsular (rico en ácido siálico) [5][14] e unha toxina formadora de poros, a β-hemolisina.[14] Hoxe considérase que o pigmento do GBS e a hemolisina son moléculas idénticas ou moi estreitamente relacionadas.[15][16][17][18]
A colonización por GBS normalmente non causa problemas en mulleres con boa saúde, non obstante durante o embarazo pode ás veces causar graves enfermidades na nai e no neonato. O GBS é a causa principal das infeccións neonatais bacterianas no meniño durante a xestación e despois do parto cunhas taxas de mortalidade significativas en nenos prematuros. As infeccións por GBS na nai poden causar corioamnionite (unha grave infección de tecidos placentarios infrecuente) e infeccións posparto. As infeccións do tracto urinario por GBS poden inducir o parto e causar un parto prematuro.[5] De feito, no mundo occidental, o GBS (en ausencia de medidas de prevención efectivas) é a principal causa de infeccións bacterianas graves de neonatos: septicemias, pneumonia e menixite, que poden causar a morte ou secuelas a longo prazo.[5]
A infección neonatal por GBS orixínase normalmente no tracto reprodutor inferior de nais infectadas. As infección por GBS en neonatos son separadas en dúas síndromes clínicas, chamadas enfermidade de comezo temperán (EOD) e de comezo tardío (LOD). A de comezo temperán maniféstase desde os días 0 a 7 de vida do neonato, a maioría dos casos de enfermidade de comezo temperán danse dentro das primeiras 24 horas desde o nacemento.[5][19] As síndromes clínicas máis comúns de comezo temperán son a sepse sen un foco aparente, pneumonía e, menos frecuentemente, meninxite. A enfermidade de comezo temperán adquírese verticalmente (transmisión vertical, de nai a fillos), pola exposición do feto ou do meniño ao GBS na vaxina dunha muller colonizada, tanto intraútero coma durante o parto durante a rotura das membranas. Os nenos poden ser infectados durante o seu paso pola canle do parto, porén, os neonatos que se infectan con GBS por esta ruta poden quedar tan só colonizados (asintomáticos) e estes nenos colonizados habitualmente non desenvolven a enfermidade de comezo temperán. Aproximadamente o 50% dos neonatos de nais colonizadas por GBS son tamén colonizados por esta bacteria e (sen medidas de prevención) o 1–2% destes neonatos desenvolverán unha enfermidade de comezo temperán.[20] No pasado, a incidencia de enfermidade de comezo temperán vai do 0,7 ao 3,7 por mil nacementos vivos en EUA[5] e do 0,2 ao 3,25 por mil en Europa.[13] Fixéronse estimacións en 2008 en EUA, despois da extensión do uso do exame prenatal e a profilaxe de antibióticos intraparto (IAP), nas que os CDC informaron dunha incidencia de 0,28 casos por mil nacementos vivos.[21] Alí onde se aplicou unha política de proporcionar profilaxe con antibióticos para a colonización por GBS o risco global foi do 0,3%.[22]
Aínda que a colonización materna por GBS é o factor clave determinante para a enfermidade de comezo temperán, outros factores tamén incrementan o risco. Estes factores inclúen o comezo do parto antes das 37 semanas de xestación (parto prematuro), a rotura prolongada das membranas (≥18 horas antes do parto), febre intraparto (>38 °C), infeccións amnióticas (corioamnionite), idade maternal xove e baixos niveis de anticorpos antipolisacárido capsular do GBS na nai.[5][19] Non obstante, a maioría dos meniños que desenvolven a enfermidade de comezo temperán nacen de nais colonizadas por GBS sen ningún factor de risco adicional.[19] Ter un irmán anterior con enfermidade de comezo temperán é tamén un importante factor de risco para o desenvolvemento da infección nos seguintes partos, probablemente reflectindo unha falta de anticorpos protectores contra os polisacáridos do GBS na nai. A forte colonización vaxinal por GBS está tamén asociada cun alto risco de enfermidade de comezo temperán.[19] En conxunto, as taxas caso-mortalidade da enfermidade de comezo temperán diminuíron desde o 50% observado en estudos da década de 1970 a do 2 ao 10% en anos recentes, principalmene como consecuencia das melloras na terapia e xestión da doenza. As infeccións neonatais mortais por GBS son máis frecuentes entre os nenos prematuros.[5][19][23]
A enfermidade de comezo tardío por GBS afecta a nenos desde os 7 días aos 3 meses de idade e é máis probable que cause bacteremia ou meninxite. A enfermidade de comezo tardío pode adquirirse por contaxio desde a nai ou por fontes ambientais. A perda de audición e o retardo mental poden ser secuelas a longo prazo da meninxite por GBS.[5][24][25] En contraste coa enfermidade de comezo temperán, a incidencia de enfermidade de comezo tardío permaneceu estable no 0,26 por 1000 nacementos vivos en EUA.[26] A meninxite neonatal por S. agalactiae non se presenta co signo distintivo da meninxite adulta, a rixidez no pescozo, senón que se presenta con síntomas non específicos, como febre, vómitos e irritabilidade, o que pode, en consecuencia, orixinar un diagnóstico tardío.[3]
O único xeito fiable de previr a enfermidade de comezo temperán actualmente é a profilaxe de antibióticos intraparto, que é a administración de antibióticos durante o parto. Demostrouse que a penicilina ou ampicilina intravenosa administrada durante ≥4 horas antes do parto a mulleres colonizadas por GBS son oi efectivas para previr a transmisión vertical do GBS de nai a fillo e a enfermidade de comezo temperán.[5][19] A cefazolina, clindamicina e vancomicina utilízanse para previr a enfermidade de comezo temperán en meniños nacidos de nais alérxicas á penicilina.[19]
Hai dúas maneiras de identificar as mulleres candidatas a recibir esta profilaxe de antibióticos: o risco ou un exame ou screening baseado nun cultivo. O exame baseado nun cultivo identifica as candidatas usando cultivos tomados da parte inferior da vaxina e recto obtidos entre as semanas 35 e 37 de xestación (32–34 semanas de xestación para mulleres con xemelgos[27]) e a profilaxe adminístrase a todas as mulleres colonizadas por GBS. A estratexia baseada no risco identifica as candidatas a recibir a profilaxe polos antes mencionados factores de risco que se sabe que incrementan a probabilidade de enfermidade de comezo temperán, sen considerar se a nai é ou non portadora de GBS.[5][28]
Adicionalmente a profilaxe con antibióticos intraparto é tamén recomendada para mulleres con factores de risco intraparto se o seu status de portadora de GBS non se coñece no momento do parto, así como para mulleres con bacteriuria por GBS durante o seu embarazo, e para mulleres que tiveron previamente un fillo con enfermidade de comezo temperán.
A estratexia baseada no risco para a profilaxe é en xeral menos efectiva que a estratexia baseada en cultivos porque na maioría dos casos a enfermidade de comezo temperán se desenvolve entre os neonatos que nacen de nais sen factores de risco.[13]
A estratexia do exame ou screening baseado en cultivos é a seguida na maioría dos países desenvolvidos,[29] como os Estados Unidos,[19] Francia,[30] España,[31] Bélxica,[32] Canadá, Arxentina,[33][34] e Australia. A estratexia baseada no risco é a seguida no Reino Unido,[27][35] e os Países Baixos.[13]
Aínda que o status de colonización por GBS das mulleres pode cambiar durante o enmbarazo, os cultivos para detectar os portadores de GBS a ≤5 semanas antes do parto predí con bastante exactitude do status de portador no parto. En contraste, se o cultivo prenatal é realizado pasadas máis de 5 semanas antes do parto non é fiable para predicir exactamente o status de portador.[19][36] Os espécimes clínicos recomendados para o cultvo do GBS na 35–37 semana de xestación (32–34 semanas de xestación en mulleres con xemelgos[27]) son recollidos con frotis tomados da parte inferior da vaxina e recto a través do esfínter anal. Seguindo as recomendacións dos Centros para o Control e Prevención de Enfermidades de Estados Unidos (CDC) estes frotis deberían ser situados nun medio de transporte non nutritivo e posteriormente inoculados nun caldo de enriquecemento selectivo, o caldo Todd Hewitt con antibióticos selectivos (cultivo de enriquecemento).[19][37] Despois da incubación o caldo de enriquecemento é subcultivado en placas de ágar sangue e as colonias de tipo GBS son identificadas pola proba CAMP ou usar a aglutinacion de látex con antisoro para GBS. Despois da incubación o caldo de enriquecemento pode tamén ser subcultivado en ágar granada,[8][37] onde o GBS crece formando colonias rosas-vermellas ou en ágar cromoxénico, onde o GBS crece formando colonias coloreadas.[9][19][37]
A proba de amplificación de ácido nucleico (NAAT) como a reacción en cadea da polimerase (PCR) e as sondas de hibridación do ADN foron desenvolvidas para identificar o GBS directamente en mostras recto-vaxinais, pero aínda non pode substituír o cultivo prenatal para a detección máis precisa de portadores de GBS.[19][27]
O GBS é tamén un axente infeccioso importante capaz de causar infeccións invasivas en adultos. As infeccións invasivas por GBS que ameazan a vida son atopadas cada vez máis en anciáns e individuos comprometidos por unha doenza subxacente como a diabetes, cirrose e cancro. As infeccións por GBS en adultos inclúen a infección do tracto urinario, infección da pel e tecidos brandos (infección da pel e estruturas da pel) bacteremia, osteomielite, meninxite e endocardite.[4] A infección por GBS en adultos pode ser grave e está relacionada cunha alta mortalidade. En xeral a penicilina é o antibiótico de elección para o tratamento das infeccións por GBS.[38][39] A xentamicina (por sinerxia coa penicilina G ou a ampicilina) pode tamén utilizarse en pacientes con GBS invasivo potencialmente mortal.[38]
Aínda que a profilaxe con antibióticos intraparto para a prevención da enfermidade de comezo temperán está asociada cun gran declive na incidencia da enfermidade, non hai, porén, ningunha estratexia efectiva para previr a enfermidade de comezo tardío neonatal por GBS.[40]
A vacinación considérase unha solción ideal para previr non só as enfermidades temperán e tardía senón tamén as infeccións por GBS en adultos en risco.[41] Non obstante, aínda que a investigación e os ensaios clínicos para o desenvolvemento dunha vacina efectiva para previr as infeccións por GBS está en marcha, no ano 2017 non se dispoñía de ningunha vacina.[42] O polisacárido capsular do GBS non é só un importante factor de virulencia do GBS, senón que tamén é un excelente candidato para o desenvolvemento dunha vacina efectiva.[13][43][44] As vacinas bseadas en proteínas están tamén en desenvolvemento.[42]
Ademais das infeccións en humanos, o GBS é unha causa principal da mastite (infección dos úberes) das vacas leiteiras e unha fonte importante de perdas económicas para a industria. O GBS nas vacas pode producir unha enfermidade febril aguda ou unha condición crónica máis subaguda. En ambos os casos orixina unha diminución da produción de leite (de aí o seu nome, agalactiae, que significa 'sen leite'). Os abrochos de mastite nos rabaños son comúns, polo que isto ten grande importancia para a industria de produción de leite, e en moitos países impuxéronse programas para reducir o impacto da enfermidade causada por S. agalactiae nos últimos 40 anos.[45]
O GBS tamén causa graves epidemias en peixes criados na acuicultura, causando septicemias e hemorraxias internas e externas, das que se informou en peixes en catividade e silvestres implicados en doenzas epizoóticas en moitos países.[46][47] A vacinación é un método efectivo de prevención de doenzas patóxenas en acuicultura e recentemente se desenvolveron diferentes tipos de vacinas para previr as infeccións por GBS.[48]
O GBS tamén se encontrou en moitos outros animais, como os camelos, cans, gatos, crocodilos, focas, elefantes e golfiños.[49][50]
Streptococcus agalactiae (tamén coñecido como estreptococo do grupo B ou EGB (GBS polas súas siglas en inglés) é unha especie de bacteria grampositiva con forma de coco (redonda) con tendencia a formar cadeas. É unha bacteria beta-hemolítica, catalase negativa, e anaerobia facultativa. En xeral, o GBS é unha bacteria comensal inofensiva que forma parte da microbiota humana que coloniza os tractos gastrointestinal e xenitourinario de ata o 30% dos humanos adultos con boa saúde (portadores asintomátricos). Non obstante, o GBS pode causar graves infeccións invasivas en certos casos.
Streptococcus agalactiae é a designación de especie para os estreptococos que pertencen ao grupo B da clasificación de Lancefield. O GBS está rodeado dunha cápsula bacteriana composta de polisacáridos (exopolisacáridos). A especie é subclasificada en dez serotipos (Ia, Ib, II–IX) dependiendo da reactividade inmunolóxica da súa cápsula de polisacáridcos. Na literatura pode encontrarse a denominación en plural estreptococos do grupo B (referíndose aos serotipos) e en singular, estreptococo do grupo B, (referíndose á especie).
Streptococcus agalactiae è un batterio gram positivo appartenente al genere Streptococco, caratterizzato dalla presenza di antigeni C estraibile del gruppo B sulla sua parete cellulare. È un comune abitante del microbiota umano, dell'intestino e delle vie urogenitali femminili dei mammiferi, uomo compreso, pertanto si può trasmettere per via sessuale. Un'infezione di questo batterio in età precoce può provocare setticemia e, nei bambini in utero, può essere causa di sepsi, meningite e polmonite neonatale. Non produce catalasi quindi si distinguono dagli stafilococchi che sono catalasi positivi.
Streptococcus agalactiae, noto anche come GBS (Group B Streptococcus, in inglese) venne isolato, negli anni 30, da Rebecca Lancefield a partire da latte prodotto da bovini affetti da mastite[1] e successivamente anche da secrezioni vaginali di donne asintomatiche.[2] Tuttavia, la patogenicità di questo batterio venne descritta solamente nel 1938, a seguito di alcune pubblicazioni riportanti 3 casi di infezioni post-partum che si rivelarono mortali.[3]
La classificazione storica di questo batterio, basata sulla capsula polisaccaridica, prevede 9 sierotipi: IA, IB, II, III, IV, V, VI, VII, VIII. [4] Nel 2007, venne descritto un decimo sierotipo (IX). [5] I sierotipi più comuni responsabili di infezioni invasive includono il sierotipo III (20%), V (19%), IA (19%), IB (13%) e II (11%).[6]
Per questo in alcuni Paesi in gravidanza viene fatto di routine un tampone vaginale e rettale ed un esame colturale alla ricerca dello Streptococcus agalactiae. Il test risulta positivo in una discreta percentuale di casi, ed il protocollo prevede la somministrazione di antibiotici compatibili con lo stato interessante come prevenzione. Seguendo questo protocollo il rischio di complicazioni è estremamente remoto.
In Italia, molte strutture ospedaliere rifiutano di far partorire in acqua le donne portatrici dello S. agalactiae.
L'ultima review Cochrane del 2014 sulla letteratura clinica su questo argomento, tuttavia, ha messo in evidenza come la terapia antibiotica in realtà non diminuisca la mortalità neonatale per l'infezione precoce da streptococco beta emolitico del gruppo B, e anzi che sia più alto il rischio di anafilassi materna che non il rischio di morte neonatale per questa infezione. Inoltre altri effetti collaterali della terapia antibiotica materna in travaglio sono: infezioni puerperali o neonatali a carico di microorganismi resistenti, infezioni da lieviti o micotiche post parto, compresa la candidosi neonatale che può avere un forte impatto negativo sull'allattamento e la candidosi materna.[7]
I segni dell'infezione nel neonato sono facilmente rilevabili dopo la nascita con l'osservazione regolare del neonato (parametri vitali, alimentazione, comportamento) e i neonati che risultano infetti devono essere trattati tempestivamente con antibiotici. In molti Paesi non viene effettuato alcuno screening su tutte le donne prima del parto, ma viene dunque proposta l'osservazione del neonato in presenza di fattori di rischio (come rottura delle membrane superiore alle 18 ore, prematurità, piressia materna in travaglio o un tampone positivo allo streptococco come reperto incidentale in gravidanza).
S. agalactiae causa emolisi quando è coltivato su uno strato di agar agar contenente sangue (anche detto agar-sangue), ed un comune metodo di laboratorio per identificare questo batterio è appunto quello di osservare la presenza di zone di emolisi completa (β-emolisi) nelle colture. È inoltre sensibile alla bile, e va incontro a lisi in presenza degli enzimi contenuti in questa sostanza.
Per essere identificato si può ricorrere al CAMP test, è sensibile alla penicillina.
Streptococcus agalactiae è un batterio gram positivo appartenente al genere Streptococco, caratterizzato dalla presenza di antigeni C estraibile del gruppo B sulla sua parete cellulare. È un comune abitante del microbiota umano, dell'intestino e delle vie urogenitali femminili dei mammiferi, uomo compreso, pertanto si può trasmettere per via sessuale. Un'infezione di questo batterio in età precoce può provocare setticemia e, nei bambini in utero, può essere causa di sepsi, meningite e polmonite neonatale. Non produce catalasi quindi si distinguono dagli stafilococchi che sono catalasi positivi.
Streptococcus agalactiae – streptokokų (Streptococcus) genties bakterijų rūšis.
B grupės streptokokas, gramteigiama bakterija, sukelianti B grupės tipo infekcijas.
Ši rūšis būna sveikoje žarnyno floroje bei moteriškų lytinių/šalinimo organų kanaluose. Gimdant, bakterijos gali patekti naujagimiui, sukeldamos sepsį, meningitą ar plaučių uždegimą.
Streptococcus agalactiae (ook wel Groep B streptococcus of GBS) is een β-hemolytische grampositieve streptococcus[1] die bij neonaten een sepsis met longontsteking en meningitis kan veroorzaken. Ook bij kraamvrouwenkoorts speelt Streptococcus agalactiae een rol.
Bronnen, noten en/of referentiesGruppe B-streptokokker (Streptococcus agalactiae), GBS, er den eneste bakteriearten, i gruppe B i Lancefields inndeling av beta-hemolytiske streptokokker. De kalles beta-hemolytiske på grunn av sitt utseende med fullstendig hemolyse rundt koloniene ved vekst på blodagar-skål.
De er i dag den viktigste årsak til blodforgiftning (sepsis), lungebetennelse og hjernehinnebetennelse hos nyfødte barn. De eksisterer i skjeden hos ca. en tredjedel av kvinner i fertil alder. Nesten halvparten av disse overfører bakterien til barnet under fødselen. Tross det, blir meget få barn syke (to til tre av tusen nyfødte), dvs. at ca. 40-70 nyfødte blir syk med GBS i Norge hvert år.
Hos voksne kan GBS gi sepsis ("blodforgiftning"), bløtdelsinfeksjoner, lungebetennelse og endokarditt (betennelse i hjerteklaffer) spesielt hos personer med redusert immunforsvar (diabetikere, alkoholikere, eldre).
GBS er i Norge en nominativ meldepliktig sykdom til Meldingssystem for smittsomme sykdommer (MSIS) administrert av Nasjonalt Folkehelseinstitutt.
Gruppe B-streptokokker (Streptococcus agalactiae), GBS, er den eneste bakteriearten, i gruppe B i Lancefields inndeling av beta-hemolytiske streptokokker. De kalles beta-hemolytiske på grunn av sitt utseende med fullstendig hemolyse rundt koloniene ved vekst på blodagar-skål.
De er i dag den viktigste årsak til blodforgiftning (sepsis), lungebetennelse og hjernehinnebetennelse hos nyfødte barn. De eksisterer i skjeden hos ca. en tredjedel av kvinner i fertil alder. Nesten halvparten av disse overfører bakterien til barnet under fødselen. Tross det, blir meget få barn syke (to til tre av tusen nyfødte), dvs. at ca. 40-70 nyfødte blir syk med GBS i Norge hvert år.
Hos voksne kan GBS gi sepsis ("blodforgiftning"), bløtdelsinfeksjoner, lungebetennelse og endokarditt (betennelse i hjerteklaffer) spesielt hos personer med redusert immunforsvar (diabetikere, alkoholikere, eldre).
GBS er i Norge en nominativ meldepliktig sykdom til Meldingssystem for smittsomme sykdommer (MSIS) administrert av Nasjonalt Folkehelseinstitutt.
Streptococcus agalactiae – Gram-dodatni β-hemolizujący paciorkowiec zaliczany do ziarniaków. Według podziału Lancefield, opierającego się na wytwarzaniu specyficznego wielocukru C, należy do grupy serologicznej B.
Do diagnostyki używa się agaru z krwią, gdzie wywołuje słabą hemolizę typu beta[1]. Hemoliza jest indukowana bliską obecnością gronkowca złocistego, co jest wykorzystywane w diagnostyce (CAMP-test).
Inna metoda diagnostyczna polega na wykrywaniu przeciwciał dla antygenów bakteryjnych w surowicy krwi pacjentów.
Bakteria posiada hialuronową otoczkę, która jest głównym czynnikiem zjadliwości, nie wytwarza natomiast przetrwalników.
Streptococcus agalactiae kolonizuje przewód pokarmowy oraz układ moczowo-płciowy osób dorosłych. Ze względu na bliskie sąsiedztwo cewki moczowej i pochwy, bakteria obecna jest często w drogach rodnych kobiety. Może mieć to tragiczne skutki podczas porodu - przyjmuje się, że drobnoustrój ten zajmuje drugie miejsce (po koagulazo-ujemnych gronkowcach) wśród czynników etiologicznych bakteriemii u noworodków. Czynnikami sprzyjającymi zakażeniu podczas porodu obok kolonizacji pochwy, jest poród przedwczesny, niskie stężenie przeciwciał przeciwko bakterii w surowicy u matki oraz poród trwający dłużej niż 18 godzin (dłuższa ekspozycja noworodka na bakterię). Poza sepsą bakteria wywołuje często zapalenie płuc, prowadzące do ostrej niewydolności oddechowej oraz zapalenie opon mózgowych rozwijające się typowo 1-3 tygodnie po porodzie.
Drobnoustrój jest czynnikiem etiologicznym infekcji u kobiet po porodzie - od zapalenia kosmówki i błony śluzowej macicy, po poważniejsze ogólnoustrojowe zakażenia (z sepsą włącznie).
U pozostałych osób powoduje zakażenie wyłącznie przy osłabionej odporności (zakażenia oportunistyczne).
Bakteria jest wrażliwa na antybiotyki z grupy penicylin. Uważa się, że pojedyncza profilaktyczna dawka ampicyliny podana matce tuż przed porodem zapobiega ryzyku zakażenia okołoporodowego. Osoby uczulone mogą brać linkozamidy lub makrolidy, z tym że istnieje ryzyko oporności na tę grupę leków.
Alternatywnym lekiem podczas poważnych zakażeń u osób uczulonych na penicyliny jest wankomycyna.
Danuta Dzierżanowska: Antybiotykoterapia praktyczna. s. 269-272. ISBN 978-83-7522-013-1.
Streptococcus agalactiae – Gram-dodatni β-hemolizujący paciorkowiec zaliczany do ziarniaków. Według podziału Lancefield, opierającego się na wytwarzaniu specyficznego wielocukru C, należy do grupy serologicznej B.
Streptococcus agalactiae são estreptococos do grupo B e como características morfológicas apresentam as mesmas comuns ao gênero Streptococcus. É um cocos Gram-positivo, anaeróbio facultativo. Podem colonizar o trato genital feminino e são a principal fonte de infecção neonatal durante a gravidez e pós-parto, associada a taxas de mortalidade críticas em partos prematuros.[1]
O Fator CAMP é considerado como fator de virulência devido a sua capacidade de se ligar a imunoglobulinas G e M, via fração Fc.Por outro lado, a detecção da produção do fator CAMP é de auxílio significativo na identificação de S. agalactiae.
Deve-se analisar em cultura realizada concomitante ao Staphylococcus aureus (de forma perpendicular) a formação de uma "seta" ou área de maior intensidade da Beta hemólise no local de interseção das amostras.
Gram Positivo disposto em pares e/ou cadeias; Catalase negativa Oxidase Negativa Presença de Beta Hemólise Ação do Fator CAMP e Antibiograma com identificação de resistência a Bacitracina.
Obstetras tem usado administração parenteral de ampicilina intra-partum para prevenção quando suspeita-se da possibilidade de infecção. Estudos sobre vacinas em andamento.
Apesar de ser uma bactéria pouco virulenta normalmente, existem alguns casos (raros) de fasceíte necrosante de tecidos moles onde o Streptococcus agalactiae é isolado, quase sempre em pacientes imunocomprometidos (geralmente por diabetes mellitus 2). Inicialmente confunde-se os sinais como uma celulite, mas deve-se ter em atenção que a fasceíte necrotizante progride rapidamente, podendo levar a amputações, choque séptico ou mesmo morte.
Recomenda-se antibioterapia e debridamento o mais precocemente possível, tendo em atenção à área afectada, fazendo frequentemente a sua limpeza e drenagem, podendo mesmo ser necessário colocar enxertos no local do debridamento. [2][3][4][5]
Streptococcus agalactiae são estreptococos do grupo B e como características morfológicas apresentam as mesmas comuns ao gênero Streptococcus. É um cocos Gram-positivo, anaeróbio facultativo. Podem colonizar o trato genital feminino e são a principal fonte de infecção neonatal durante a gravidez e pós-parto, associada a taxas de mortalidade críticas em partos prematuros.
Streptococcus agalactiae (också känd som Grupp B Streptokocker) är grampositiv och tillhör släktet streptokocker. [1]
Grupp B Streptokocker (Streptococcus agalactiae) är den ledande anledningen till sepsis och hjärnhinneinflammation hos nyfödda i Förenta Staterna och Europa.[2] De orsakar 1 till 3 fall per 1 000 födslar, med en dödlighetsfaktor på ca 50 %. Över 30 % av de som överlever hjärnhinneinflammation lider senare av skador på centrala nervsystemet. Streptococcus agalactiae är vanliga i vaginalfloran där de återfinns hos mellan 10 och 30 % bland både gravida och icke-gravida kvinnor.[2] Bristningar på membran mer än 12 timmar före födsel ger organismerna rikligt med tid att smitta barnet. De flesta fall av smitta visar sig inom några få dagar efter födseln, med feber, andningsproblem och letargi. ”Sen debut”-fall, som uppträder 3 till 8 veckor efter födsel, har oftast meningitis.[2]
Det så kallade CAMP-testet är ett viktigt test för att identifiera bakterien, GBS (grupp B streptokock arter) är screenade genom detta test. De karakteriseras genom närvaron av grupp B Lancefield antigen och genom dess förmåga att hydrolysera natrium hipporat. Det är också känsligt mot galla och lyserar i dess närvaro.Streptococcus agalactiae’s figos motverkande kapsel är dess primära virulensfaktor.[3]
Screening av gravida kvinnor blir allt vanligare i västländerna och är nuförtiden en rutinundersökning i USA, Kanada, Frankrike, Tyskland, Italien, Spanien, Belgien, Australien, Tjeckien, Slovenien, Kenya och Argentina. Medan andra länder fortfarande använder sig av en mer riskfylld metod vid förlossningar som till exempel England, Danmark och Bulgarien.[3]
Det finns inget sätt som är helt pålitligt när det kommer till att förhindra nyfödda från att bli smittade, men det finns en del metoder som ger ett tillfälligt förhöjt skydd.
Detta är en sjukdom som borde vara nästan totalt möjlig att i förebyggande syfte förhindra och man jobbar för stunden på ett vaccin som just nu är i testningsfasen.[2]
Man har funnit Streptococcus agalactiae i många däggdjur såsom nötkreatur, kameler, hundar, krokodiler, sälar och delfiner.[2]
Streptococcus agalactiae var väl känd som en patogen hos nötkreatur redan före Andra Världskriget.[3] Dess betydelse som human patogen upptäcktes dock inte förrän på 1950-talet. Hos mjölkkor kan bakterien infektera juvret och orsaka juverinflammation (mastit) av varierande allvarlighetsgrad. Det är vanligt att sådana mastiter får ett långvarigt (kroniskt) förlopp och att de leder till minskad mjölkproduktion (därav bakteriens namn: agalactiae, som betyder ”Ingen mjölk” på Latin). I mjölkbesättningar kan sjukdomen spridas snabbt mellan kor och orsaka allvarliga besättningsproblem. Före upptäckten av antibiotika var sjukdomen vanlig men efter att kontrollprogram infördes på 1950-talet har förekomsten minskat betydligt i världen. Juverinfektion med bakterien har under lång tid varit ovanlig hos svenska mjölkkor men förekomsten ökade under 2000-talet varför betydelsen av åtgärder för att förebygga sådana infektioner har ökat. Även får och get kan få juverinflammation på grund av Streptococcus agalactiae men det är ovanligt.
Fiskerier och vildlivsofficerare från Queensland, Australien, har undersökt dödsorsaken av mer än 50 havsabborrar, mellan 2008 och 2010, som har spolats upp döda på stranden i de norra delarna av staten. Man fann att en del av fisken var smittad med Streptococcus agalactiae.[3]
Referenser
Streptococcus agalactiae (också känd som Grupp B Streptokocker) är grampositiv och tillhör släktet streptokocker.
스트렙토코커스 아갈락티아(Streptococcus agalactiae), B군 연쇄상구균(group B streptococcus, GBS)는 사슬 모양으로 증식하는 그람 양성 구균으로, 연쇄상구균의 일종이다. 베타용혈성, 카탈레이스 음성을 보이며, 조건혐기성 미생물이다.[1][2]
레베카 랜스필드 분류군 B에 속하는 유일한 연쇄상구균이다. 외다당류로 구성된 세균 협막으로 둘러싸여 있으며, 협막의 면역 반응성에 따라 10개의 혈청형(Aia, Ib, II–IX)으로 다시 나뉜다.[1][3][4]
일반적으로 무해한 편리 공생 세균으로, 성인 인구 30%의 위장관에서 미생물군을 형성하나 대부분 무증상 보균자로 남아있는다. 그러나 신생아, 노인, 면역체계가 손상된 사람들에게는 심각한 침습성 감염을 일으킬 수 있다.[5]
다양한 동물들에게서 흔히 관찰되는데, 젖소에서 유선염을 일으킬 수 있다. "우유가 없다"는 뜻의 "아갈락티아agalactiae"라는 이름 역시 여기서 따온 것이다.[6]
스트렙토코커스 아갈락티아는 협막 다당류를 기준으로 9가지 혈청형(Aia, Ib, II-VIII)으로 구분되어왔는데,[7] 2007년에 10번째 혈청형이 발견되었다.[8] 미국에서 임산부를 제외하고 침습성 질병을 유방하는 가장 흔한 혈청형은 2005~2006년에 29%를 차지한 V형으로, Ia, II, III형이 그 뒤를 잇는다.[9] 캐나다 앨버타주에서 2003~2013년의 침습성 B군 연쇄상구균 감염증 사례를 연구한 결과에서는 III형이 20%로 가장 지배적이며, 그 다음이 19%를 차지하는 V형, 19%의 Ia형, 13%의 Ib형, 11%의 II형인 것으로 드러났다.[10]
일반적으로 장이나 질에서 발견되며, 임산부를 포함한 건강한 성인 인구 30%에서 감염되나 무증상으로 남아있는다.[3][11] GBS 군집은 영구적이거나, 간헐적이거나, 일시적일 수 있다. 여성의 질에서 군집을 이룬 확률은 0%에서 36%까지 다양하게 보고되는데, 활발한 성생활을 하는 경우 20% 이상의 감염률이 나타난다.[12] 전 세계 산모의 18%가 감염된 것으로 보이며, 11%에서 35%까지 다양한 지역적 편차가 나타났다.[13]
비록 대부분의 경우 무증상으로 문제를 일으키지 않지만, 임신 중이나 출산 후의 산모와 아기에게 심각한 질병을 일으킬 수도 있다. 산모의 GBS 감염은 드물게 융모양막염을 유발할 수 있으며, 산후 감염이나 태아 사망과도 관련이 있다.[14]
신생아의 GBS 감염증은 조기발병(GBS-EOD)과 말기발병(GBS-LOD)의 두 가지 유형으로 구분되는데, GBS-EOD의 경우 대부분 생후 0~7일 사이에 나타나며 보통 24시간 이내에 뚜렷이 나타난다.[3][15][16] GBS-LOD는 출생 후 7일에서 90일 사이에 시작한다.
산모에게 페니실린 또는 앰피실린을 정맥 주사 함으로써 수직 전달을 예방할 수 있다. 만일 산모가 페니실린에 알레르기반응을 보인다면 세파졸린, 클린다마이신, 반코마이신 등으로 영아의 EOD를 예방할 수 있다.[15][16]
성인에게 감염되어 당뇨, 간경변, 암 등을 앓고 있는 환자나 노인들에게서 심각한 질병을 보일 수 있다. 일반적으로 페니실린을 통해 치료하며,[17][18] 페니실린 G나 앰피실린과의 상승 효과를 노리고 젠타마이신을 투여하기도 한다.[17]
스트렙토코커스 아갈락티아(Streptococcus agalactiae), B군 연쇄상구균(group B streptococcus, GBS)는 사슬 모양으로 증식하는 그람 양성 구균으로, 연쇄상구균의 일종이다. 베타용혈성, 카탈레이스 음성을 보이며, 조건혐기성 미생물이다.
레베카 랜스필드 분류군 B에 속하는 유일한 연쇄상구균이다. 외다당류로 구성된 세균 협막으로 둘러싸여 있으며, 협막의 면역 반응성에 따라 10개의 혈청형(Aia, Ib, II–IX)으로 다시 나뉜다.
일반적으로 무해한 편리 공생 세균으로, 성인 인구 30%의 위장관에서 미생물군을 형성하나 대부분 무증상 보균자로 남아있는다. 그러나 신생아, 노인, 면역체계가 손상된 사람들에게는 심각한 침습성 감염을 일으킬 수 있다.
다양한 동물들에게서 흔히 관찰되는데, 젖소에서 유선염을 일으킬 수 있다. "우유가 없다"는 뜻의 "아갈락티아agalactiae"라는 이름 역시 여기서 따온 것이다.