pms
nòm ant ël fil

Parvoviridae és una família de virus que inclouen els més petits virus coneguts i també alguns dels més resistents al medi ambient. Van ser descoberts a la dècada de 1960 i afecten vertebrats i insectes. Els Parvoviridae tenen un genoma consistent en un ADN monocatenari i una càpside de forma icosaèdrica.
El Parvovirus B19 va ser el primer parvovirus humà descobert i causa un exantema en infants (erythema infectiosum), i està associat amb altres malalties incloent-hi l'artritis. El Parvovirus RA-1 havia estat associat a l'artritis reumatoide, però actualment se sap que era un error motivat per la contaminació en laboratori.
El Parvovirus Caní és el responsable de la parvovirosis, que és una de les malalties contagioses més freqüents als gossos i una de les causes més importants de mortalitat en cadells. Afecta sobretot al tracte digestiu provocant quadres d'enteritis, als glòbuls blancs en la sang i en alguns casos també al múscul cardíac provocant miocarditis no supurativa.
El parvovirus porcí (Porcine Parvovirus, PPV) és un virus DNA monocatenari, sense envoltura, amb una morfologia icosaèdrica i mida petita (20nm) que afecta a la família dels suids. La seva infecció causa infertilitat, descens proliferatiu, momificació i mort fetal, normalment en absència de signes clínics en la mare. Pot ser associat també a un creixement deficient al període postnatal.
Subfamília Parvovirinae
Subfamília Densovirinae
Parvoviridae és una família de virus que inclouen els més petits virus coneguts i també alguns dels més resistents al medi ambient. Van ser descoberts a la dècada de 1960 i afecten vertebrats i insectes. Els Parvoviridae tenen un genoma consistent en un ADN monocatenari i una càpside de forma icosaèdrica.
El Parvovirus B19 va ser el primer parvovirus humà descobert i causa un exantema en infants (erythema infectiosum), i està associat amb altres malalties incloent-hi l'artritis. El Parvovirus RA-1 havia estat associat a l'artritis reumatoide, però actualment se sap que era un error motivat per la contaminació en laboratori.
El Parvovirus Caní és el responsable de la parvovirosis, que és una de les malalties contagioses més freqüents als gossos i una de les causes més importants de mortalitat en cadells. Afecta sobretot al tracte digestiu provocant quadres d'enteritis, als glòbuls blancs en la sang i en alguns casos també al múscul cardíac provocant miocarditis no supurativa.
El parvovirus porcí (Porcine Parvovirus, PPV) és un virus DNA monocatenari, sense envoltura, amb una morfologia icosaèdrica i mida petita (20nm) que afecta a la família dels suids. La seva infecció causa infertilitat, descens proliferatiu, momificació i mort fetal, normalment en absència de signes clínics en la mare. Pot ser associat també a un creixement deficient al període postnatal.
Parvoviridae er en gruppe små, kompakte vira.[1][2] Parvoviridae tilhører gruppen af enkeltstrenget DNA-virus (Gruppe II, ssDNA).
Parvoviridae inddeles i 2 underfamilier med henholdsvis 5 og 4 slægter.[kilde mangler]
|pmc= (hjælp). PMID 30672729 Tjek |pmid= (hjælp). doi:10.1099/jgv.0.001212. Parvoviridae er en gruppe små, kompakte vira. Parvoviridae tilhører gruppen af enkeltstrenget DNA-virus (Gruppe II, ssDNA).
Die Familie Parvoviridae (Parvoviren) umfasst Spezies von Viren, die ein einzelsträngiges DNA-Genom tragen. Die Virionen (Viruspartikel) der Parvoviridae haben einen Durchmesser zwischen 18 und 26 nm; da sie damit zu den kleinsten Viren zählen, leitet sich ihr Name von lateinisch parvus ‚klein‘ ab. Parvoviren sind unbehüllt, wodurch sie sehr resistent gegen äußere Einflüsse sind.
Die Familie Parvoviridae wird nach der derzeitigen Master Species List #36 des International Committee on Taxonomy of Viruses (ICTV) in drei Unterfamilien aufgeteilt: Parvovirinae, Densovirinae und Hamaparvovirinae.[3]
Zu den Parvovirinae, welche ausschließlich Wirbeltiere infizieren, zählen die Genera Amdoparvovirus (alias Amdovirus), Artiparvovirus, Aveparvovirus, Bocaparvovirus (alias Bocavirus), Copiparvovirus, Dependoparvovirus (alias Dependovirus), Erythroparvovirus (alias Erythrovirus), Loriparvovirus sowie Tetraparvovirus und Protoparvovirus (letzteres ehemals tierpathogenes Parvovirus, beide zusammen früher Parvovirus). Die durch Virusspecies des Genus Parvovirus ausgelösten Erkrankungen bezeichnet man als Parvovirosen.
Die Dependoviren (Genus Dependoparvovirus, früher Dependovirus, z. B. Adenoassozierte Viren) sind abhängig von Helferviren, um sich zu replizieren. Als Helferviren kommen Adenoviren, Herpesviren und Vacciniaviren in Fragen. Fehlen diese Helferviren, dann können die adenoassoziierten Viren in einen Latenzzustand übergehen, indem sie ihr eigenes Genom relativ ortsspezifisch in das zelluläre Genom einbauen und so lebenslang im Organismus verbleiben. Bei einer Koinfektion mit dem entsprechenden Helfervirus kann das integrierte virale Genom reaktiviert werden. Die adenoassoziierten Viren AAV-2, AAV-3 und AAV-5 können Menschen über Tröpfcheninfektion infizieren. Vermutlich sind über 90 % der Erwachsenen infiziert, allerdings sind keine Erkrankungsbilder bekannt.
Die Erythroparvoviren (Genus Erythroparvovirus, früher Erythrovirus)[4] haben einen ausgeprägten Tropismus zu sich teilenden Vorläuferzellen von Erythrozyten, den Erythroblasten. Sie sind zur Replikation ihres Genoms auf die in der S-Phase vorliegenden zellulären Polymerasen angewiesen. Zu diesem Genus gehört unter anderem das Parvovirus B19, der Erreger der Ringelröteln.
Die Viren dieses Genus[5] replizieren sich autonom. Zu ihnen zählen fast ausschließlich tierpathogene (nur bei Tieren krankheitsauslösende) Erreger und können bei Haus- und Nutztieren schwere Erkrankungen verursachen. Diese Viren sind sehr nah miteinander verwandt mit einer sich über das gesamte Genom erstreckenden Homologie bei einer Sequenzidentität von mehr als 98 %. Erin Elizabeth Schirtzinger et al. führen folgende Species auf:[6]
Das Canine Parvovirus ist 1978 vermutlich direkt aus dem Felinen Parvovirus (Erreger der Katzenseuche) entstanden und plötzlich aufgetreten. Dabei verbreitete es sich weltweit sehr schnell, worauf in dieser Pandemie Millionen von Hunden starben. Mittlerweile sind die Parvovirosen bei Hund und Katze mit Hilfe von Lebendimpfstoffen gut beherrschbar. Das Parvovirus H-1 befällt normalerweise Nagetiere, kann aber auch menschliche Zellen infizieren, verursacht jedoch beim Menschen dabei keinerlei Krankheitssymptome.
Zu dieser Gattung gehören nach denselben Autoren:[6]
Die Bezeichnung „Hokovirus“ für Viren den Genus Tetraparvovirus ist jedoch veraltet und entsprechend zu ersetzen, Hokovirus steht inzwischen für ein in Klosterneuburg bei Wien zusammen mit dem eng verwandten Klosneuvirus gefundenes Riesenvirus aus der Familie der Mimiviridae.
Nach ICTV und NCBI[10]
Hierher gehören u. B. nach diesen Autoren:[6]
Die historisch zweite Unterfamilie der Densovirinae umfasst die die Parvoviren der Insekten und anderer Arthropoden mit folgenden Genera:
Diese Unterfamilie kam 2021 mit der Master Species List #36 des ICTV hinzu:[3]
Die Familie Parvoviridae (Parvoviren) umfasst Spezies von Viren, die ein einzelsträngiges DNA-Genom tragen. Die Virionen (Viruspartikel) der Parvoviridae haben einen Durchmesser zwischen 18 und 26 nm; da sie damit zu den kleinsten Viren zählen, leitet sich ihr Name von lateinisch parvus ‚klein‘ ab. Parvoviren sind unbehüllt, wodurch sie sehr resistent gegen äußere Einflüsse sind.
Die Familie Parvoviridae wird nach der derzeitigen Master Species List #36 des International Committee on Taxonomy of Viruses (ICTV) in drei Unterfamilien aufgeteilt: Parvovirinae, Densovirinae und .
Lu Parvuvirus eni nu quarsìasi virus dâ famìgghia Parvoviridae. Li Parvoviridae sunnu virus veru nichi, e sunnu puru veru risistenti.
Li Parvoviridae hannu nu ginoma custituitu di ssDNA; quannu chissu trasi 'ntrâ cèllula, ppi òpira di prutiìni pricoci, pruduci dsDNA. Da chissu sunnu prudutti prutiìni pô packaging, pô rilassu, e 'n parti pâ sìntisi di ssDNA.
Lu Parvuvirus eni nu quarsìasi virus dâ famìgghia Parvoviridae. Li Parvoviridae sunnu virus veru nichi, e sunnu puru veru risistenti.
Parvoviruses are a family of animal viruses that constitute the family Parvoviridae. They have linear, single-stranded DNA (ssDNA) genomes that typically contain two genes encoding for a replication initiator protein, called NS1, and the protein the viral capsid is made of. The coding portion of the genome is flanked by telomeres at each end that form into hairpin loops that are important during replication. Parvovirus virions are small compared to most viruses, at 23–28 nanometers in diameter, and contain the genome enclosed in an icosahedral capsid that has a rugged surface.
Parvoviruses enter a host cell by endocytosis, travelling to the nucleus where they wait until the cell enters its replication stage. At that point, the genome is uncoated and the coding portion is replicated. Viral messenger RNA (mRNA) is then transcribed and translated, resulting in NS1 initiating replication. During replication, the hairpins repeatedly unfold, are replicated, and refold to change the direction of replication to progress back and forth along the genome in a process called rolling hairpin replication that produces a molecule containing numerous copies of the genome. Progeny ssDNA genomes are excised from this concatemer and packaged into capsids. Mature virions leave the cell by exocytosis or lysis.
Parvoviruses are believed to be descended from ssDNA viruses that have circular genomes that form a loop because these viruses encode a replication initiator protein that is related to NS1 and have a similar replication mechanism. Another group of viruses called bidnaviruses appear to be descended from parvoviruses. Within the family, three subfamilies, 26 genera, and 126 species are recognized. Parvoviridae is the sole family in the order Piccovirales, which is the sole order in the class Quintoviricetes. This class is assigned to the phylum Cossaviricota, which also includes papillomaviruses, polyomaviruses, and bidnaviruses.
A variety of diseases in animals are caused by parvoviruses. Notably, the canine parvovirus and feline parvovirus cause severe disease in dogs and cats, respectively. In pigs, the porcine parvovirus is a major cause of infertility. Human parvoviruses are less severe, the two most notable being parvovirus B19, which causes a variety of illnesses including fifth disease in children, and human bocavirus 1, which is a common cause of acute respiratory tract illness, especially in young children. In medicine, recombinant adeno-associated viruses (AAV) have become an important vector for delivering genes to the cell nucleus during gene therapy.
Animal parvoviruses were first discovered in the 1960s, including minute virus of mice, which is frequently used to study parvovirus replication. Many AAVs were also discovered during this time period and research on them over time has revealed their benefit as a form of medicine. The first pathogenic human parvovirus to be discovered was parvovirus B19 in 1974, which became associated with various diseases throughout the 1980s. Parvoviruses were first classified as the genus Parvovirus in 1971 but were elevated to family status in 1975. They take their name from the Latin word parvum, meaning 'small' or 'tiny', referring to the small size of the virus's virions.
Parvoviruses have linear, single-stranded DNA (ssDNA) genomes that are about 4–6 kilobases (kb) in length. The parvovirus genome typically contains two genes, termed the NS/rep gene and the VP/cap gene.[1] The NS gene encodes the non-structural (NS) protein NS1, which is the replication initiator protein, and the VP gene encodes the viral protein (VP) that the viral capsid is made of. NS1 contains an HUH superfamily endonuclease domain near its N-terminus, containing both site-specific binding activity and site-specific nicking activity, and a superfamily 3 (SF3) helicase domain toward the C-terminus. Most parvoviruses contain a transcriptional activation domain near the C-terminus that upregulates transcription from viral promoters as well as alternate or overlapping open reading frames that encode a small number of supporting proteins involved in different aspects of the viral life cycle.[2]
The coding portion of the genome is flanked at each end by terminal sequences about 116–550 nucleotides (nt) in length that consist of imperfect palindromes folded into hairpin loop structures. These hairpin loops contain most of the cis-acting information required for DNA replication and packaging and act as hinges during replication to change the direction of replication. When the genome is converted to double-stranded forms, replication origin sites are created involving sequences in and adjacent to the hairpins.[2][3]
Genomic DNA strands in mature virions may be positive-sense or negative-sense. This varies from species to species as some have a preference for packaging strands of one polarity, others package varying proportions, and others package both sense strands at equal proportions. These preferences reflect the efficiency with which progeny strands are synthesized, which in turn reflects the efficiency of specific replication origin sites.[2] The 3′-end (usually pronounced "three prime end") of a negative sense strand, and the 5′-end (usually pronounced "five prime end") of a positive sense strand, is called the left end, and the 5′-end of the negative sense strand, and the 3′-end of a positive sense strand, is called the right end.[2][4][5]
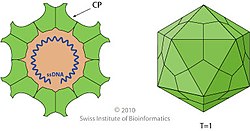
Parvovirus virions are 23–28 nanometers (nm) in diameter and consist of the genome enclosed inside a capsid that is icosahedral in shape with a rugged surface. The capsid is composed of 60 structurally equivalent polypeptide chains derived from the C-terminal end of a VP protein's sequence, interlocking extensively to form an icosahedron with 60 asymmetric, superficial triangular units. These units have 3-fold radial symmetry at two vertices and 5-fold radial symmetry at one, with 2-fold radial symmetry at the line opposite of the 5-fold vertex and a 2/5 circular fold wall surrounding the point of the 5-fold vertex. Twenty 3-fold vertices, thirty 2-fold lines, and twelve 5-fold vertices exist per capsid, the latter corresponding to the 12 vertices of the icosahedron.[2]
Typical features of the capsid surface include depressions at each 2-fold axis, elevated protrusions surrounding the 3-fold axes, and raised cylindrical projections made of five beta-barrels[6] surrounded by canyon-like depressions at the 5-fold axes. Each of these cylinders potentially contains an opening to connect the exterior of the capsid to the interior, which mediates entry and exit of the genome. About 20 nucleotides from the 5′-end of the genome may remain exposed outside of the capsid carrying a copy of NS1 bound to the 5′-end, which is a result of how the genome is synthesized and packaged.[2]
Varying sizes of the VP protein are expressed for different parvoviruses, the smaller ones, VP2–5, being expressed at a higher frequency than the large size, VP1. The smaller VPs share a common C-terminus with different N-terminus lengths due to truncation. For VP1, the N-terminus is extended to contain regions important in the replication cycle, and it is incorporated into the capsid, typically 5–10 per capsid, with the common C-terminus responsible for assembling capsids.[1][2]
Each VP monomer contains a core beta-barrel structure called the jelly roll motif of eight strands arranged in two adjacent antiparallel beta sheets, labeled CHEF and BIDG after the individual strands, the latter forming the interior surface of the capsid. Individual beta strands are connected by loops that have varying length, sequence, and conformation, and most of these loops extend toward the exterior surface, giving parvoviruses their unique, rough surface. Related parvoviruses share their surface topologies and VP protein folds to a greater degree than their sequence identities, so the structure of the capsid and capsid protein are useful indicators of phylogeny.[1][2]
Parvoviruses enter cells by endocytosis, using a variety of cellular receptors to bind to the host cell. In endosomes, many parvoviruses undergo a change in conformation so that the phospholipase A2 (PLA2) domain on the VP1 N-termini are exposed so the virion can penetrate lipid bilayer membranes. Intracellular trafficking of virions varies, but virions ultimately arrive to the nucleus, inside of which the genome is uncoated from the capsid. Based on studies of minute virus of mice (MVM), the genome is ejected from the capsid in a 3′-to-5′ direction from one of the openings in the capsid, leaving the 5′-end of the DNA attached to the capsid.[2]
Parvoviruses lack the ability to induce cells into their DNA replication stage, called S-phase, so they must wait in the nucleus until the host cell enters S-phase on its own. This makes cell populations that divide rapidly, such as fetal cells, an excellent environment for parvoviruses. Adeno-associated viruses (AAV) are dependent on helper viruses, which may be an adenovirus or a herpesvirus, since coinfection alters the cellular environment to allow for replication.[2] In the absence of coinfection, AAV's genome is integrated into the host cell's genome until coinfection occurs.[7] Infected cells that enter S-phase are forced to synthesize viral DNA and cannot leave S-phase. Parvoviruses establish replication foci in the nucleus that grow progressively larger as infection progresses.[8]
Once a cell enters S-phase and the genome is uncoated, a host DNA polymerase uses the 3′-end of the 3′ hairpin as a primer to synthesize a complementary DNA strand for the coding portion of the genome, which is connected to the 5′-end of the 5′ hairpin.[3][7][9] Messenger RNA (mRNA) that encodes NS1 is then transcribed from the genome by the DNA polymerase, capped and polyadenylated, and translated by host ribosomes to synthesize NS1.[2][5][10] If proteins are encoded in multiple co-linear frames, then alternative splicing, suboptimal translation initiation, or leaky scanning may be used to translate different gene products.[2]
Parvoviruses replicate their genome via rolling hairpin replication, a unidirectional, strand displacement form of DNA replication that is initiated by NS1. Replication begins once NS1 binds to and makes a nick in a replication origin site in the duplex DNA molecule at the end of one hairpin. Nicking releases the 3′-end of the nicked strand as a free hydroxyl (-OH) to prime DNA synthesis[2] with NS1 remaining attached to the 5′-end.[7] The nick causes the adjacent hairpin to unfold into a linear, extended form. At the 3′-OH, a replication fork is established using NS1's helicase activity, and the extended telomere is replicated by the DNA polymerase.[10][11] The two telomere strands then refold back in on themselves to their original configurations, which repositions the replication fork to switch templates to the other strand and move in the opposite direction toward the other end of the genome.[12][13]
Parvoviruses vary in whether the termini are similar or the same, called homotelomeric parvoviruses, or different, called heterotelomeric parvoviruses. In general, homotelomeric parvoviruses, such as AAV and B19, replicate both ends of their genome through the aforementioned process, called terminal resolution, and their hairpin sequences are contained within larger (inverted) terminal repeats. Heterotelomeric viruses, such as minute virus of mice (MVM), replicate one end by terminal resolution and the other end via an asymmetric process called junction resolution[2][14] so that the correct orientation of the telomere can be copied.[15]
During asymmetric junction resolution, the duplex extended-form telomeres refold in on themselves into a cruciform shape. A replication origin site on the lower strand of the right arm of the cruciform is nicked by NS1, leading to the lower arm of the cruciform unfolding into its linear extended form. A replication fork established at the nick site moves down the extended lower arm to copy the lower arm's sequence. The two strands of the lower arm then refold to reposition the replication fork to go back toward the other end, displacing the upper strand in the process.[16]
The back and forth, end-to-end pattern of rolling hairpin replication produces a concatemer containing multiple copies of the genome.[2][3] NS1 periodically makes nicks in this molecule and, through a combination of terminal resolution and junction resolution, individual strands of the genome are excised from the concatemer.[9][13] Excised genomes may either be recycled for further rounds of replication or packaged into progeny capsids.[7] Translation of mRNA containing VP proteins leads to the accumulation of capsid proteins in the nucleus that assemble into these empty capsids.[8]
Genomes are encapsidated at one of the capsid's vertices through a portal,[2] potentially the one opposite the portal used to expel the genome.[5] Once complete virions have been constructed, they may be exported from the nucleus to the exterior of the cell before disintegration of the nucleus. Disruption of the host cell environment may also occur later on in the infection. This results in cell lysis via necrosis or apoptosis, which releases virions to the outside of the cell.[2][8]
Parvoviruses are believed to be descended from ssDNA viruses that have a circular genome that forms a loop and which replicate via rolling circle replication, which is similar to rolling hairpin replication. These circular ssDNA viruses encode a replication initiator protein that is related to and possesses many of the same characteristics as the replication initiator protein of parvoviruses, such as the HUH endonuclease domain and the SF3 helicase domain.[17] In contrast to these other replication initiator proteins, NS1 shows only vestigial traces of being able to perform ligation, which is a key part of rolling circle replication.[8] The Bidnaviridae family, which are also linear ssDNA viruses, appear to be descended from a parvovirus that had its genome integrated into the genome of a polinton, a type of DNA transposon related to viruses in the realm Varidnaviria.[17]
Based on phylogenetic analysis of the SF3 helicase, parvoviruses split into two branches early in their evolutionary history, one of which contains viruses assigned to the subfamily Hamaparvovirinae. The other branch split into two sublineages that constitute the other two subfamilies, Densovirinae and Parvovirinae.[18] Parvoviruses in the Hamaparvovirinae lineage are likely all heterotelomeric, Densovirinae are exclusively homotelomeric, and Parvovirinae varies.[2] Telomere sequences have significant complexity and diversity, suggesting that many species have co-opted them to perform additional functions.[7][10] Parvoviruses are also considered to have high rates of genetic mutations and recombinations.[2][9]
Parvoviruses constitute the family Parvoviridae. The family is the sole family in the order Piccovirales, which is the sole order in the class Quintoviricetes. The class Quintoviricetes belongs to the phylum Cossaviricota, which also includes papillomaviruses, polyomaviruses, and bidnaviruses. Cossaviricota is included in the kingdom Shotokuvirae, which is assigned to the realm Monodnaviria. Parvoviridae belongs to Group II: ssDNA viruses in the Baltimore classification system, which groups viruses together based on their manner of mRNA synthesis. Within Parvoviridae, three subfamilies, 26 genera, and 126 species are recognized as of 2020 (-virinae denotes subfamily and -virus denotes genus):[18][19]
Parvoviruses are assigned to the same species if they share at least 85% of their protein sequence identities. Species are grouped together in a genus based on phylogeny of the NS1 and SF3 helicase domains, as well as similarity of NS1 sequence identity and coverage. If these criteria aren't satisfied, then genera can still be established provided that common ancestry is supported. The three subfamilies are distinguished based on phylogeny of the SF3 helicase domain, which corresponds to host range: viruses in Densovirinae infect invertebrates, viruses in Hamaparvovirinae infect invertebrates and vertebrates, and viruses in Parvovirinae infect vertebrates.[18]
In humans, the most prominent parvoviruses that cause disease are parvovirus B19 and human bocavirus 1. B19 infection is often asymptomatic but can manifest in a variety of ways, including Fifth disease with its characteristic rash in children, persistent anemia in immunocompromised persons and in people who have underlying hemoglobinopathies,[20] transient aplastic crises, hydrops fetalis in pregnant women, and arthropathy. Human bocavirus 1 is a common cause of acute respiratory tract infection, especially in young children, wheezing being a common symptom. Other parvoviruses associated with different diseases in humans include human parvovirus 4 and human bufavirus, though the manner by which these viruses cause disease is unclear.[6]
Carnivore-infecting viruses in the genus Protoparvovirus, in contrast to human parvoviruses, are more life-threatening.[2] Canine parvovirus causes severe illness in dogs, the most common symptom being hemorrhagic enteritis, with up to a 70% mortality rate in pups but usually less than 1% in adults.[21] Feline parvovirus, a closely related virus,[22] likewise causes severe illness in cats along with panleukopenia.[23][24] In pigs, porcine parvovirus is a major cause of infertility as infection frequently leads to death of the fetus.[25]
Adeno-associated viruses have become an important vector for gene therapy aimed at treating genetic diseases, such as those caused by a single mutation. The recombinant AAV (rAAV) contains a viral capsid but lacks a complete viral genome. Instead, the typical nucleic acid packaged into the capsid contains a promoter region, the gene of interest, and a terminator region, all contained within two inverted terminal repeats derived from the viral genome. rAAV essentially acts as a container that can traverse the cell membrane and deliver its nucleic acid cargo to the nucleus.[26][27]
Parvoviruses were discovered relatively late in comparison to other prominent virus families, potentially due to their small size. In the late 1950s[28] and 1960s,[29] a variety of animal parvoviruses were discovered, including minute virus of mice,[30] which has since been used extensively to study rolling hairpin replication.[31] Many AAVs were also discovered during this time period[32] and research on them led to their first usage in gene therapy in the 1980s. Over time, improvements in aspects such as vector design led to certain AAV gene therapy products reaching clinical efficacy in 2008 and being approved in the following years.[27]
In 1974, the first pathogenic human parvovirus was discovered by Yvonne Cossart, et al. When testing for the hepatitis B virus's surface antigen, one serum sample gave anomalous results and with electron microscopy was shown to contain a virus resembling animal parvoviruses. This virus was named B19 after the coding of the serum sample, number 19 in panel B.[20][33] B19 was later recognized as a species by the International Committee on Taxonomy of Viruses (ICTV) in 1985, and throughout the 1980s it increasingly became associated with various diseases.[33]
In the ICTV's first report in 1971, parvoviruses were grouped together in the genus Parvovirus.[30][32] They were elevated to the rank of family in 1975 and remained unassigned to higher taxa until 2019, when they were assigned to higher taxa up to the highest rank, realm.[34] The family was reorganized in 2019, departing from the "traditional" invertebrate-vertebrate distinction between Densovirinae and Parvovirinae and instead distinguishing the subfamilies based on helicase phylogeny, leading to the establishment of a new subfamily, Hamaparvovirinae.[18]
Parvoviruses take their name from Latin parvus or parvum, meaning small or tiny, referring to the small size of parvovirus virions compared to most other viruses.[2][20] In the family name Parvoviridae, -viridae is the suffix used for virus families.[35] The order Piccovirales takes the first part of its name from the Italian word piccolo, meaning small, and the second part is the suffix used for virus orders. The class Quintoviricetes takes the first part of its name from the Galician word quinto, meaning fifth, referring to fifth disease (erythema infectiosum) caused by parvovirus B19, and viricetes, the suffix used for virus classes.[17]
{{cite journal}}: CS1 maint: DOI inactive as of December 2022 (link) Parvoviruses are a family of animal viruses that constitute the family Parvoviridae. They have linear, single-stranded DNA (ssDNA) genomes that typically contain two genes encoding for a replication initiator protein, called NS1, and the protein the viral capsid is made of. The coding portion of the genome is flanked by telomeres at each end that form into hairpin loops that are important during replication. Parvovirus virions are small compared to most viruses, at 23–28 nanometers in diameter, and contain the genome enclosed in an icosahedral capsid that has a rugged surface.
Parvoviruses enter a host cell by endocytosis, travelling to the nucleus where they wait until the cell enters its replication stage. At that point, the genome is uncoated and the coding portion is replicated. Viral messenger RNA (mRNA) is then transcribed and translated, resulting in NS1 initiating replication. During replication, the hairpins repeatedly unfold, are replicated, and refold to change the direction of replication to progress back and forth along the genome in a process called rolling hairpin replication that produces a molecule containing numerous copies of the genome. Progeny ssDNA genomes are excised from this concatemer and packaged into capsids. Mature virions leave the cell by exocytosis or lysis.
Parvoviruses are believed to be descended from ssDNA viruses that have circular genomes that form a loop because these viruses encode a replication initiator protein that is related to NS1 and have a similar replication mechanism. Another group of viruses called bidnaviruses appear to be descended from parvoviruses. Within the family, three subfamilies, 26 genera, and 126 species are recognized. Parvoviridae is the sole family in the order Piccovirales, which is the sole order in the class Quintoviricetes. This class is assigned to the phylum Cossaviricota, which also includes papillomaviruses, polyomaviruses, and bidnaviruses.
A variety of diseases in animals are caused by parvoviruses. Notably, the canine parvovirus and feline parvovirus cause severe disease in dogs and cats, respectively. In pigs, the porcine parvovirus is a major cause of infertility. Human parvoviruses are less severe, the two most notable being parvovirus B19, which causes a variety of illnesses including fifth disease in children, and human bocavirus 1, which is a common cause of acute respiratory tract illness, especially in young children. In medicine, recombinant adeno-associated viruses (AAV) have become an important vector for delivering genes to the cell nucleus during gene therapy.
Animal parvoviruses were first discovered in the 1960s, including minute virus of mice, which is frequently used to study parvovirus replication. Many AAVs were also discovered during this time period and research on them over time has revealed their benefit as a form of medicine. The first pathogenic human parvovirus to be discovered was parvovirus B19 in 1974, which became associated with various diseases throughout the 1980s. Parvoviruses were first classified as the genus Parvovirus in 1971 but were elevated to family status in 1975. They take their name from the Latin word parvum, meaning 'small' or 'tiny', referring to the small size of the virus's virions.
Parvoviridae es una familia de virus infectivos para animales.[1] Poseen un genoma lineal con ADN de cadena sencilla, que mide aproximadamente 5 kb, como ácido nucleico por lo que se incluyen en el Grupo II de la Clasificación de Baltimore. Se caracterizan por una cápside estructuralmente definida por una simetría icosaédrica y carente de envoltura viral (desnuda). Los viriones maduros se ensamblan en el núcleo como compartimento celular.
Son uno de los virus más pequeños con un tamaño de 18-22 nm[2] y muy estables en el ambiente, pues resisten varias horas a temperatura de 60 °C y a pH 3-9. Producen tres proteínas estructurales, una mayoritaria, VP2, de 64-85 kD y dos menores, VP1, de 80-96 kD.[3]
La replicación de ADN parvoviral ocurre en el núcleo. La replicación y la transcripción de ARNm son efectuadas por ADN y ARN polimerasas del huésped pero requieren de ciertas proteínas virales. El ADN parvoviral es linear y posee secuencias palindrómicas en ambos extremos. Estas secuencias palindrómicas son de 100-300 nucleótidos de largo, dependiendo del virus. El extremo 3' sirve como un primer, el cual es elongado para formar un intermediario de doble cadena.[4]
Sus géneros representativos son:
Son virus que causan infecciones que pueden ser esporádicas o epidémicas ampliamente distribuidas. Son virus altamente especie-específicos, solo el Virus B19 es patógeno para los humanos causando la enfermedad del eritema infeccioso.[5] Los anticuerpos se detectan en más del 95% de niños y adultos jóvenes, y en los hemofílicos tratados con concentrados de factores de coagulación. La transmisión aparentemente ocurre por vía respiratoria (aérea), la mayoría de las infecciones cursan sin síntomas.[6]
Parvoviridae es una familia de virus infectivos para animales. Poseen un genoma lineal con ADN de cadena sencilla, que mide aproximadamente 5 kb, como ácido nucleico por lo que se incluyen en el Grupo II de la Clasificación de Baltimore. Se caracterizan por una cápside estructuralmente definida por una simetría icosaédrica y carente de envoltura viral (desnuda). Los viriones maduros se ensamblan en el núcleo como compartimento celular.
Son uno de los virus más pequeños con un tamaño de 18-22 nm y muy estables en el ambiente, pues resisten varias horas a temperatura de 60 °C y a pH 3-9. Producen tres proteínas estructurales, una mayoritaria, VP2, de 64-85 kD y dos menores, VP1, de 80-96 kD.
Parvoviirused on üldnimetuseks ssDNA viirustele, mis kuuluvad sugukonda Parvoviridae. Parvoviirused põhjustavad nakkushaigusi erinevatel loomadel, sealhulgas inimestel (inimese parvoviirusnakkus ehk viies haigus).[1]
Parvoviirused põhjustavad mitmesuguseid haigusi, nii kergemate kui ka tõsisemate sümptomitega, mis võivad lõppeda surmaga. Mõned parvoviiruste sümptomid ei avaldu peremeesorganismis ning isend tundub väliselt terve.[2]
Perekonda Parvovirus kuuluvad viirused eelistavad aktiivselt jagunevaid rakke, olles võimelised üle kanduma ka platsentale. Sel viisil võivad nakatuda ka vastsündinud.[1]
Adenoseoselised viirused (AAV) ei suuda nakatunud organismis iseseisvalt replitseerumist lõpule viia ja seega ei põhjusta isendi haigestumist.[2] Autonoomsed parvoviirused replitseeruvad edukamalt vastsündinud loomadel või lootel, sest nad vajavad mitootiliselt jagunevaid rakke. Sea parvoviirus (PPV) on võimeline nakatama tiine looma loodet ning põhjustama pärast sündi kerget haigestumist. Kaslaste ja koerlaste parvoviirused (FPV ja CPV) nakatavad lümfiorganites jagunevaid rakke. Need viirused põhjustavad lümfopeeniat ja lümfoidset ammendumist. Inimese B19-parvoviirus võib vähendada punaste vereliblede tootmise hulka ja sellega seotult põhjustada aneemiat.[2]
Inimesi nakatavad parvoviirused põhjustavad kahte haigust:
B19 on levinud globaalselt ja on aktiivne aastaringselt. Kõige tavalisem nakatumise aeg on hilistalvel, kevadel või varasuvel. Nakatumine toimub sageli koolides, kus viirus mõjutab ligikaudu 40% lastest. Kõige levinum nakatumisviis on respiratoorne. Viirust võib leida esimesel nädalal kurgust võetud proovidest. Kaheksa päeva pärast nakatumist on organismis rohkem kui 1011 viiruse partiklit ühe milliliitri vere kohta. Varajasteks sümptomiteks võivad olla halb enesetunne, palavik ja külmavärinad. B19 viirus on rohkem püsivam lootes puuduliku immuunvastuse tõttu. Viiruse tõttu langeb punaste vereliblede tootmine ja haigus võib lõppeda imiku jaoks surmaga.[1]
Efektiivseim kaitse parvoviiruste vastu on kaasasündinud immuunsus. Enamikul parvoviirustel ei ole mehhanisme, mis võimaldaks virionil manipuleerida või vältida peremeesorganismi immuunvastust.[2]
Naaritsate aleuudi haiguse puhul ei suuda aga isegi immuunsüsteemi tugev vastus viirust kahjutuks teha ja viirus jätkab levimist organismis, mille tagajärjel tekib krooniline infektsioon.[2]
Inimese parvoviirus B19 spetsiifilist IgM antikeha võib leida organismist 9–10 päeva pärast nakatumist. Antikehade arvukus tõuseb pärast seda kiirelt, saavutades maksimumi nädalaga.[1] Parvoviiruste vastu on välja töötatud nii surmatud kui ka elusvaktsiinid, mõlemad on efektiivsed, sest suudavad esile kutsuda immuunvastuse[2].
Parvoviirused on suhteliselt vastupidavad ja levivad erinevate eritiste kaudu. Kasside ja koerlaste parvoviirused (FPV ja CPV) nakatavad soolestiku epiteelrakke, mis eritatakse väljaheidetena. Näriliste parvoviirused nakatavad neerurakke ja levivad uriinis. Inimese parvoviirus B19 replitseerub teatud kehakudedes ja levib hingamisteede kaudu.[2]
Erinev levikuviis viitab sellele, et mõned viirused vajavad levimiseks lähedast kontakti isendite vahel. Teised parvoviirused suudavad aga levida kiirelt ilma otsese kontaktita. 1978. aastal ilmnenud koerlaste parvoviirus levis üle maailma paari aastaga.[2]
Parvoviirused on levinud enamikul loomadel, kuid nad põhjustavad vaid kergemaid haigusi või kliiniliselt märkamatuid infektsioone. Esimene parvoviirus, mis tuvastati 20. sajandi alguses, oli kasside panleukopeenia viirus (FPV). Minkidel tuvastati sarnaseid sümptomeid põhjustav viirus 1940ndatel. Adenoseoselised viirused avastati 1960ndatel. Koerlaste parvoviirus (CPV) leiti 1970ndate lõpus, avastuseni viis koertel sel ajal levinud uus haigus. Koerlaste parvoviirus on lähedalt seotud kaslaste parvoviirusega, seega on alust arvata, et CPV puhul on tegemist FPV mutandiga [2]. Hiljuti avastati autonoomne parvoviirus RA-1, mis isoleeriti vastsündinud hiirest, kes oli nakatatud reumatoidartriidiga[1].
Esimesed inimese parvoviirused avastati väljaheidete proovide uurimisel elektronmikroskoobiga. Leitud viirusi seostati seedetrakti häiretega, mida tekitasid karpide söömine. 1975. aastal leiti doonori vereseerumist parvoviirus B19.[1]
Parvoviiruste nimetus tuleneb ladinakeelsest sõnast parvo, mis tähendab väikest, sest need on ühed väiksemad viirused. Parvoviiruse kapsiid on ikosaeedrilise kujuga ning kestata. Kapsiidi diameeter on 18–26 nm ning moodustub 32 kapsomeerist, mis koosneb kolmest struktuurvalgust: VP1, VP2 ja VP3. Struktuurivalke seovad omavahel aminohappejärjestused [1]. Peamine valk kapsiidis on VP2 või VP3 (olenevalt viiruse liigist), mis on 90% kogu kapsiidi koostisest[2].
Parvoviiruse kapsiid sisaldab ka pikemaid valke kui VP2 või VP3. Raku nakatamiseks on viirusele vajalikud pikemad valgud, kuna sisaldavad fosfolipaasi A2 ensüümi aktivaasi, tänu millele on võimalik transportida viiruse genoom peremeesorganismi rakutuuma [4]. Peremeesorganismi rakkude pinnal on spetsiifilised retseptorid, mis tunnevad ära kapsiidivalgud. Retseptoriteks võivad olla siaalhapped või heparaansulfaat-glükoproteiinid[2].
Viiruse ssDNA asub kapsiidis [2]. Esialgu arvati, et parvoviirused on kaheahelalise DNAga, kuni avastati, et iga virion sisaldab nii positiivset kui ka negatiivset DNA ahelat[3]. Olenevalt parvoviiruse liigist, on kapsiidi pakitud kas ainult negatiivne ssDNA ahel või positiivne ja negatiivne ssDNA ahel[2].
Parvoviiruse genoomi suurus on 4500–5200 aluspaari. Genoom sisaldab:
Nii väike genoom suudab kodeerida vaid piiratud arvu polüpeptiide. Valgud, mida ise ei suudeta kodeerida, saadakse peremeesorganismi rakkudest.[3]
Struktuurivalkude geene kodeerib standardse genoomi puhul paremakäeline avatud lugemisraam. Vasakukäeline avatud lugemisraam kodeerib viiruse mittestruktuursete valkude geene, nagu näiteks NS1, mis muudab viiruse nakatamisvõimeliseks, ja Rep valk, mis algatab peremeesrakus replikatsiooni. Viimane neist töötab DNA helikaasina ja NS1 asukoha spetsiifilise nikaasina, seondudes kovalentselt ssDNA 5’ otsaga. NS1 ja Rep valgu aktiivsust reguleeritakse fosforüleerimisega.[2]
DNA lõppjärjestused koosnevad mittetäielikest palindroomidest, mõnel juhul kontrollivad DNA replikatsiooni spetsiifilised üksteisega mittesobivad järjestused. Lühikesed palindroomsed järjestused võivad keerduda üksteise peale kokku, moodustades kahekordse juuksenõela telomeerse struktuuri. Lõppjärjestuste juuksenõelad erinevad üksteisest nii struktuuri kui ka järjestuse poolest. Need struktuurid on olulised parvoviiruse replikatsiooniks.[2]
Genoomi pikkus on jagatud 100 mu’ks (map unit), mis lähtub transkribeerimise lähtepiirkondadest ja transkripti splaissimise ehk lõikamise kohtadest.[1]
Replikatsiooni tsükkel algab parvoviiruse kinnitumisega kindlatele retseptoritele, mis asuvad rakumembraanil. Viiruse partiklid tungivad rakku endotsütoosi teel ning kahe tunni möödudes võib partikleid juba leida rakutuumast.[1]
Optimaalselt replitseeruvad parvoviirused peremeesraku tuumades rakutsükli hilises S-faasis või varajases G2-faasis. Nii saab viirus enda replitseerumiseks vajalikud komponendid. Replitseerumiseks on veel olulised viiruse DNA 5’ ja 3’ terminalides asuvad kaheahelalised piirkonnad, mis on põhjustatud komplementaarsetest järjestustest 160. ja 115. nukleotiidis. 3’ terminalis on üksteisega vastakuti nukleotiidid 1–43 ja ümberpööratuna järjestused 73–15. 44.–72. nukleotiidi vahel on kaks piirkonda, mis on guaniini- ja tsütosiinirikkad, need piirkonnad võimaldavad aluspaardumist ja lõppevad sekundaarstruktuuride moodustumisega. DNA ahela kokkuvoltimine saavutataksegi aluspaardumisega. Kokkuvolditud struktuure leidub ka DNA 5’ otsas, kuid selle suurus ja järjestus erineb 3’ omast.[1]
Parvoviridae sugukonda kuuluvad järgmiste perekondade viirused:
Parvoviirused on üldnimetuseks ssDNA viirustele, mis kuuluvad sugukonda Parvoviridae. Parvoviirused põhjustavad nakkushaigusi erinevatel loomadel, sealhulgas inimestel (inimese parvoviirusnakkus ehk viies haigus).
La famille des Parvoviridae, virus découverts dans les années 1960, appartient au Groupe II (virus à ADN à simple hélice). C’est la seule famille de l’ordre des Piccovirales et de la classe des Quintoviricetes. Cette famille comprend le plus petit virus connu et certains qui comptent parmi les plus résistants dans l'environnement. Ils affectent des vertébrés, mais aussi des insectes.
Les Parvoviridae ont un génome consistant en un ADN simple brin protégé par une capside en forme d'icosaèdre.
Le parvovirus B19 a été le premier découvert. Il est connu pour causer chez l'enfant un exanthème dit « mégalérythème épidémique » mais il a été associé à d'autres maladies, dont l'arthrite. C'est un virus non enveloppé (comme le virus de l'hépatite A) qui présente un risque théorique (risque « mal » maîtrisé, demandant une vigilance constante).
La Parvovirose RA - 1 a initialement été associée à la polyarthrite rhumatoïde, mais on pense maintenant que c'était par erreur, à la suite d'une contamination de laboratoire.
Ces virus infectent des animaux (carnivores domestiques et sauvages, tels que chiens, chats, mustélidés, renards, loups, coyote, raton laveur, ours…) et l'Homme.
Ces virus semblent présents dans le monde entier.
Les infections symptomatiques semblent plus fréquentes en fin de printemps et en début d'été[4].
Selon ICTV (14 février 2021)[5] :
L'ingestion de particules virales issues d'excréments d'un animal infecté semble être la cause d'infection la plus commune, plutôt que par contact direct avec un animal.
Les parvoviroses sont résistantes (au froid notamment) et survivent plusieurs mois (voire plus d'un an) dans les milieux frais et humides et à l'abri de la lumière.
Des cas documentés montrent que les oiseaux, rats, mouches et des objets inanimés (fomites) ont été impliqués dans la transmission de Parvovirus.
Chez l'animal âgé de plus de 4 semaines :
Chez l'animal âgé de moins de 4 semaines :
Elles sont appelées
Les parvovirus sont soupçonnés d'avoir un rôle dans la Maladie de Minkowski-Chauffard ; ils sont la cause de la Fièvre à tiques du Colorado et de Myocardite virale.
Barker, I. K., and C. R. Parrish. 2001. Parvovirus infections. Pp. 131-146 in E. S. Williams and I. K. Barker (eds.), Infectious Diseases of Wild Mammals. 3rd Ed. Iowa State University Press, Ames, IA.
La famille des Parvoviridae, virus découverts dans les années 1960, appartient au Groupe II (virus à ADN à simple hélice). C’est la seule famille de l’ordre des Piccovirales et de la classe des Quintoviricetes. Cette famille comprend le plus petit virus connu et certains qui comptent parmi les plus résistants dans l'environnement. Ils affectent des vertébrés, mais aussi des insectes.
Les Parvoviridae ont un génome consistant en un ADN simple brin protégé par une capside en forme d'icosaèdre.
Le parvovirus B19 a été le premier découvert. Il est connu pour causer chez l'enfant un exanthème dit « mégalérythème épidémique » mais il a été associé à d'autres maladies, dont l'arthrite. C'est un virus non enveloppé (comme le virus de l'hépatite A) qui présente un risque théorique (risque « mal » maîtrisé, demandant une vigilance constante).
La Parvovirose RA - 1 a initialement été associée à la polyarthrite rhumatoïde, mais on pense maintenant que c'était par erreur, à la suite d'une contamination de laboratoire.
Ces virus infectent des animaux (carnivores domestiques et sauvages, tels que chiens, chats, mustélidés, renards, loups, coyote, raton laveur, ours…) et l'Homme.
Ces virus semblent présents dans le monde entier.
Les infections symptomatiques semblent plus fréquentes en fin de printemps et en début d'été.
Parvoviridae je porodica DNK virusa koji uzrokuju bolesti kod kralježnjaka i kukaca. Virusi iz ove porodice su otkriveni 1960ih. Naziv porodice potječe od latinskog pridjeva parvus što znači malen, zbog toga što su virusi iz ove porodice jedni od najmanjih poznatih. Genom virusa sastoji se od jednolančane DNK
Prvi otkriveni virus iz ove skupine je Parvovirus B19 uzročnik bolesti eritema infekciozum kod djece. U ostalih životinja ova skupina virusa uzrokuje infekciju psećim parvovirusom u pasa i virusom mačje panleukopenije u mačaka.
Pravovirusi se dijele u dvije podporodice:
La famiglia Parvoviridae comprende i più piccoli virus conosciuti, ed alcuni tra quelli più resistenti nell'ambiente. Sono stati scoperti negli anni sessanta ed infettano i mammiferi. Il loro patrimonio genetico è costituito da una singola molecola di DNA monocatenario lineare racchiuso in un capside icosaedrico.
Il Parvovirus B19 (o P1) è stato il primo ad essere scoperto e il meglio conosciuto, essendo la causa della cosiddetta quinta malattia o eritema infettivo.
Il Parvovirus RA-1 fu associato originariamente all'artrite reumatoide, ma oggi si ritiene un errore dovuto a contaminazione in laboratorio.
Il virione, assai piccolo, ha un diametro di 18-25 nanometri ed è privo di peplos. Per quanto concerne il capside esso presenta una simmetria icosaedrica ed è costituito da un variabile numero di proteine strutturali (da 2 a 3, dipende dai generi) conosciute come VP1, VP2 e VP3.
Al suo interno la molecola di DNA contenuta è monocatenaria, lineare e di piccole dimensioni (5kb). Agli estremi 5' e 3' della stessa vi sono delle sequenze terminali palindrome (ripetute) di circa 115 nucleotidi che assumono una conformazione a forcina ripiegandosi su se stesse, essenziale per la replicazione del genoma.
L'ingresso del virus nella cellula ospite avviene dopo il legame del virione con un recettore posto sulla superficie della cellula stessa. Una volta all'interno il Parvovirus può riprodurre il proprio genoma solo nel nucleo cellulare e la sua possibile replica è dipendente da fattori presenti durante la fase S del ciclo replicativo della cellula ospite. In questa sede la DNA-polimerasi cellulare sintetizza la catena complementare del Dna virale (che è monocatenaria) andando così a formare degli intermedi bicatenari di DNA, costituiti da due molecole (catene) complementari (legate per mezzo dell'estremo 3' di quella originale). L'innesco per l'enzima cellulare, la DNA-polimerasi, è fornito dalle sequenze palindrome che caratterizzano gli estremi della molecola di DNA virale.
La molecola bicatenaria è poi tagliata, da proteine virus specifiche, in modo da avere due catene complementari, una di nuova sintesi e con attaccati i palindromi, un'altra originale, senza sequenze ripetute che all'estremo 3', viene completata della sua sequenza palindroma, mancante a causa del taglio. Le due catene verranno poi separate da proteine virali, con la costituzione di due molecole che possono iniziare un nuovo ciclo oppure condotte verso l'assemblaggio della progenie virale).
Dopo la creazione della forma intermedia bicatenaria, la RNA-polimerasi della cellula ospite è in grado di trascrivere in MRNA le sequenze del genoma virale contenenti le informazioni per le proteine non-strutturali (compresa quella che opererà il taglio citato in precedenza) e strutturali (del capside). Gli mRna messaggeri così prodotti vengono trasportati nel citoplasma e tradotti (dai ribosomi cellulari) nelle varie proteine virali. La citotossicità dei Parvovirus è dovuta proprio a queste proteine.
I virus di interesse medico, infettanti l'uomo, sono il Parvovirus B19 appartenente al genere Erythrovirus e i virus adeno-associati del genere Dependovirus
I Parvovirus possono infettare diversi animali e poiché il suo ciclo replicativo è legato a quello di replicazione della cellula ospite (fase S) il tipo di tessuto infettabile varia con il variare dell'età dell'animale colpito. Il tratto gastrointestinale e il sistema linfatico possono essere infettati ad ogni età, causando vomito, diarrea e immunodepressione. Ipoplasia cerebellare è stata riscontrata solo in gatti che avevano contratto il virus ancora nell'utero o nelle prime 2 settimane di vita, mentre malattie del miocardio sono state rilevate in cuccioli di cane infettati dal virus tra la 3ª e la 4ª settimana di vita.
Il parvovirus del cane, discretamente resistente nell'ambiente esterno, è altamente pericoloso per i cuccioli di cane, presentando una mortalità elevata. Provoca danni al tratto gastrointestinale e disidratazione diffondendosi tramite feci, vomito o sangue infetti.
Il parvovirus del topo non causa sintomi ma può contaminare esperimenti immunologici condotti in laboratori di ricerca.
Nei suini un particolare tipo di parvovirus può causare una malattia legata alla riproduzione (SMEDI).
La panleucopenia felina, una gastroenterite dei felini, è comune nei gatti durante le prime settimane di vita e causa febbre, leucopenia, diarrea fino alla morte. Se contratta dal gatto prima della 2ª settimana di vita provoca ipoplasia cerebellare. Simile è il parvovirus dell'enterite del visone che tuttavia non provoca ipoplasia cerebellare.
Un altro tipo ancora di Parvovirus colpisce l'oca, tra gli 8 e i 30 giorni di vita, causando epatite e miocardite fino alla morte.
La tecnica immunoenzimatica ELISA è la più accurata per la diagnosi.
Cani e gatti possono essere vaccinati contro il Parvovirus.
La famiglia Parvoviridae comprende i seguenti generi:[1]
La famiglia Parvoviridae comprende i più piccoli virus conosciuti, ed alcuni tra quelli più resistenti nell'ambiente. Sono stati scoperti negli anni sessanta ed infettano i mammiferi. Il loro patrimonio genetico è costituito da una singola molecola di DNA monocatenario lineare racchiuso in un capside icosaedrico.
Il Parvovirus B19 (o P1) è stato il primo ad essere scoperto e il meglio conosciuto, essendo la causa della cosiddetta quinta malattia o eritema infettivo.
Il Parvovirus RA-1 fu associato originariamente all'artrite reumatoide, ma oggi si ritiene un errore dovuto a contaminazione in laboratorio.
Parvovirussen (parvoviridae) is een groep van virussen waartoe de kleinste virussen gerekend worden. Parvovirussen werden ontdekt in de jaren 1960 en besmetten gewervelden en insecten. Het genoom van Parvoviridae bestaat uit enkelstrengs DNA (ssDNA) en het virus heeft een icosahedrale eiwitmantel.
Parvovirus B19 was het eerste menselijke parvovirus dat werd gevonden.
Subfamilie Parvovirinae
Subfamilie Densovirinae
Parvovirussen (parvoviridae) is een groep van virussen waartoe de kleinste virussen gerekend worden. Parvovirussen werden ontdekt in de jaren 1960 en besmetten gewervelden en insecten. Het genoom van Parvoviridae bestaat uit enkelstrengs DNA (ssDNA) en het virus heeft een icosahedrale eiwitmantel.
Parvovirus B19 was het eerste menselijke parvovirus dat werd gevonden.
Parwowirusy (Parvoviridae) – rodzina wirusów.
Parwowirusy charakteryzują się następującymi cechami:
Gatunki z podrodziny Parvovirinae są pasożytami kręgowców, zaś podrodzina Densovirinae grupuje gatunki charakterystyczne dla bezkręgowcow.
Parwowirusy (Parvoviridae) – rodzina wirusów.
A família Parvoviridae abrange os menores vírus conhecidos e alguns dos mais resistentes ao ambiente. Foram descobertos na década de 1960 e afetam insetos e vertebrados. Os membros da família Parvoviridae possuem um genoma constituído por uma fita simples de DNA e um capsídeo icosaédrica.
O Eritrovírus B19 foi o primeiro parvovírus humano a ser descoberto e é mais conhecido por causar uma exantema em crianças chamada de eritema infeccioso, embora também seja associado a outras doenças como artrite.
Os gêneros são, a seguir, listados:
Subfamília Parvovirinae
Subfamília Densovirinae
Parvoviridae är en familj som omfattar några av de minsta och mest motståndskraftiga virus man känner till. De upptäcktes under 1960-talet och påverkar både ryggradsdjur och insekter. Virusen inom familjen har ett genom som består av enkelsträngat DNA och en ikosaedrisk kapsid.
Ibland kallas alla arter inom familjen för "parvovirus" men parvovirus är också ett specifikt släkte inom familjen.
Parvovirus B19 var det virus inom familjen som infekterar människan som man först upptäckte och vilket är mest känt för att orsaka "femte sjukan" (Erythema infectiosum) vilket är ett exantem som drabbar barn, men viruset är också förknippat med andra sjukdomar som exempelvis artrit.
Parvovirus RA-1 förknippades också från början med ledgångsreumatism men detta anses idag vara felaktig och berodde förmodligen på att laboratoriemiljön där försöken genomfördes var kontaminerat.
Familjen omfattar följande släkten:
Subfamilj Parvovirinae
Underfamilj Densovirinae
Parvoviridae är en familj som omfattar några av de minsta och mest motståndskraftiga virus man känner till. De upptäcktes under 1960-talet och påverkar både ryggradsdjur och insekter. Virusen inom familjen har ett genom som består av enkelsträngat DNA och en ikosaedrisk kapsid.
Ibland kallas alla arter inom familjen för "parvovirus" men parvovirus är också ett specifikt släkte inom familjen.
Parvovirus B19 var det virus inom familjen som infekterar människan som man först upptäckte och vilket är mest känt för att orsaka "femte sjukan" (Erythema infectiosum) vilket är ett exantem som drabbar barn, men viruset är också förknippat med andra sjukdomar som exempelvis artrit.
Parvovirus RA-1 förknippades också från början med ledgångsreumatism men detta anses idag vara felaktig och berodde förmodligen på att laboratoriemiljön där försöken genomfördes var kontaminerat.
Familjen omfattar följande släkten:
Subfamilj Parvovirinae
Underfamilj Densovirinae
Släkte Densovirus; typart: Junonia coenia densovirus Släkte Iteravirus; typart: Bombyx mori densovirus Släkte Brevidensovirus; typart: Aedes aegypti densovirus Släkte Pefudensovirus; typart: Periplanta fuliginosa densovirusВирионы парвовирусов представляют собой безоболочечные изометрические частицы с кубической симметрией диаметром 25 нм. Это довольно мелкие вирусы животных. Капсид парвовирусов состоит из 32 капсомеров диаметром 3—4 нм. Парвовирусы содержат одноцепочечную линейную ДНК размером 5,2 тн (19—32 % массы вирионов). Парвовирусы содержат 63—81 % белков. Сравнительным анализом некоторых автономных парвовирусов обнаружено различие в их структурных белках. Парвовирусы собак (ПВС), свиней (ПВСв), кошек (ПВК) и мышей (ПВМ) содержат по три структурных полипептида VP1, VP2, VP3 с молекулярной массой соответственно 79—82; 65—66 и 62—63 кД. Парвовирус крупного рогатого скота содержит четыре полипептида VP1, VP2, VP3 и VP4 с молекулярной массой соответственно 74,5; 67, 62 и 57 кД. Следует отметить, что у парвовируса свиней, выделенного при диарее (штамм Н-45), также обнаружено четыре структурных полипептида (81, 70, 66 и 62 кД). Основным белком у парвовирусов млекопитающих является VP3, на долю которого приходится около 80 % массы вирионных белков.
Капсид содержит 60 молекул белка VP2 (65 кД) и небольшое количество молекул VP1 (84 кД). VP1 и VP2 образуются альтернативным сплайсингом одной мРНК и полной последовательности VP2. Третий структурный белок VP3 образуется в полных (ДНК-содержащих) капсидах путём отщепления 15—20 аминокислот от аминоконца VP2. Зависимость размножения парвовируса от стадии клеточного цикла указывает на зависимость его репликации от репликации клеточной ДНК. Вирионы не содержат полимеразы, но способны кодировать такой фермент. Вместо этого используется клеточная полимераза И для транскрипции вирусной ДНК в двухспиральную промежуточную структуру, которая затем используется как матрица для других клеточных ферментов, катализирующих транскрипцию вирусных мРНК. Альтернативный сплайсинг структур приводит к увеличению отдельных видов мРНК, которые транслируются в большое количество различных белков. Наиболее обильный пул представлен мРНК, кодируемыми 3'-половиной генома, управляющей синтезом структурных белков. Неструктурный белок NS1, кодируемый 5'-половиной генома, также образуется в очень большом количестве и выполняет многие функции: 1) он связан с ДНК и требуется для репликации вирусной ДНК; 2) выполняет роль геликазы; 3) служит эндонуклеазой; 4) интерферирует с репликацией клеточной ДНК.
Эта активность ведет к остановке деления клеток в S фазе. Механизм репликации генома является удивительно комплексным. 3'-конец геномной (-)ДНК служит полупраймером для начала синтеза двуцепочечнои циркулярной ДНК в качестве репликативного предшественника. Одной из особенностей репликации геномной ДНК являлось образование димерной формы репликативного предшественника с последующим синтезом тетрамерной структуры, состоящей из двух полностью позитивных и двух полностью негативных цепей вирусной ДНК, которые с помощью эндонуклеазы превращаются в одноцепочечные молекулы, в том числе в потомство вирусной ДНК[5].
Поглощенный парвовирус поставляет геном в ядро клетки, где однонитевая ДНК преобразуется в двунитевую ДНК клеточными факторами и ДНК-полимеразой. Двунитевая ДНК-версия вирусного генома требуется для транскрипции и репликации. Репликация происходит только в растущих клетках. Вирусные белки синтезируются в цитоплазме и затем возвращаются в ядро, где собираются вирионы. В результате ядро и цитоплазма клетки дегенерируют. Вирусы освобождаются в результате лизиса клетки.
По способности к размножению в клетках хозяина парвовирусы делят на две группы — дефектные (род Dependovirus) и автономные (остальные вирусы семейства Parvoviridae). Автономные парвовирусы способны к самостоятельной репродукции, и для этого они используют соответствующие ферменты клетки хозяина, прежде всего клеточную ДНК-полимеразу[6]. Репликация автономных парвовирусов происходит в ядрах клеток, находящихся в S-фазе клеточного цикла, то есть во время удвоения клеточной ДНК. Репликация парвовирусов, как правило, ограничена активно пролиферирующими тканями, что может вызывать аномалии развития у эмбрионов и поражения тканей новорожденного. Во взрослом организме парвовирусная инфекция часто протекает бессимптомно[7]. Многие парвовирусы способны активно реплицироваться в трансформированных и/или раковых клетках, не затрагивая при этом нормальные клетки организма[8]. Именно это их свойство позволяет рассматривать парвовирусы как простейшие ДНК-содержащие вирусы, обладающие выраженной онколитической активностью.
По всей вероятности, онкотропизм парвовирусов не связан с эффективным проникновением вируса в трансформированную клетку, а обусловлен преимущественной репликацией вируса в раковых клетках[9]. При этом парвовирусы блокируют пути активации интерферонов первого типа, особенно в трансформированных фибробластах[10][11]. Особую роль в онколитической активности парвовирусов играет основной неструктурный белок NS1[12]. Хеликазная активность NS1 необходима для репликации вируса[13], и он также является главным фактором, ответственным за онколитическую и цитотоксическую активность. Парвовирусный белок NS1 в относительно низкой концентрации способен вызвать гибель раковых клеток, но той же концентрации недостаточно для индукции апоптоза у клеток с нормальным фенотипом[9].
Парвовирусы могут также модулировать противоопухолевый иммунитет. В результате гибели опухолевых клеток, индуцированных парвовирусом, нередко высвобождаются антигены, характерные для раковых клеток и их молекулярные комплексы. Это стимулирует представление опухолевых антигенов иммунной системе организма и вызывает формирование более выраженного иммунного ответа против клеток опухоли[9][14].
Применение онколитических парвовирусов и векторных систем на их основе будет способствовать разработке подходов к лечению широкого круга болезней человека, в первую очередь онкологических заболеваний. Достигнутые в этой области успехи уже позволили перейти к проведению клинических испытаний для лечения злокачественных заболеваний.
Последняя ревизия семейства была в 2013 году: изменены названия существующих и добавлены новые роды и виды[15].
Вирусы семейства парвовирусов делятся на два подсемейства — Densovirinae и Parvovirinae, паразитирующих на беспозвоночных и позвоночных соответственно. По данным Международного комитета по таксономии вирусов (ICTV), на март 2017 года в подсемейства включают 5 и 8 родов соответственно[16]:
Парвовирусы вызывают заболевания животных, поражая преимущественно желудочно-кишечный тракт и кроветворную систему. Некоторые представители данного рода обладают онколитическими свойствами (например, H-1 parvovirus, теперь включённый в вид Rodent protoparvovirus 1). Вид Carnivore amdoparvovirus 1 (ранее Aleutian mink disease virus) вызывает алеутскую болезнь норок. Род Bocaparvovirus вызывает поражения респираторного и желудочно-кишечного трактов человека[17], коров и собак.
Род Dependoparvovirus объединяет аденоассоциированные вирусы человека, крупного рогатого скота, лошадей, овец, собак и птиц. В отличие от других парвовирусов, представители этого рода размножаются только в присутствии вирусов-помощников. Полноценными вирусами-помощниками могут служить аденовирусы, герпесвирусы также способны выполнять некоторые из необходимых функций вируса-помощника, однако полноценные инфекционные частицы парвовирусов в этом случае не образуются.
Вирионы парвовирусов представляют собой безоболочечные изометрические частицы с кубической симметрией диаметром 25 нм. Это довольно мелкие вирусы животных. Капсид парвовирусов состоит из 32 капсомеров диаметром 3—4 нм. Парвовирусы содержат одноцепочечную линейную ДНК размером 5,2 тн (19—32 % массы вирионов). Парвовирусы содержат 63—81 % белков. Сравнительным анализом некоторых автономных парвовирусов обнаружено различие в их структурных белках. Парвовирусы собак (ПВС), свиней (ПВСв), кошек (ПВК) и мышей (ПВМ) содержат по три структурных полипептида VP1, VP2, VP3 с молекулярной массой соответственно 79—82; 65—66 и 62—63 кД. Парвовирус крупного рогатого скота содержит четыре полипептида VP1, VP2, VP3 и VP4 с молекулярной массой соответственно 74,5; 67, 62 и 57 кД. Следует отметить, что у парвовируса свиней, выделенного при диарее (штамм Н-45), также обнаружено четыре структурных полипептида (81, 70, 66 и 62 кД). Основным белком у парвовирусов млекопитающих является VP3, на долю которого приходится около 80 % массы вирионных белков.
Капсид содержит 60 молекул белка VP2 (65 кД) и небольшое количество молекул VP1 (84 кД). VP1 и VP2 образуются альтернативным сплайсингом одной мРНК и полной последовательности VP2. Третий структурный белок VP3 образуется в полных (ДНК-содержащих) капсидах путём отщепления 15—20 аминокислот от аминоконца VP2. Зависимость размножения парвовируса от стадии клеточного цикла указывает на зависимость его репликации от репликации клеточной ДНК. Вирионы не содержат полимеразы, но способны кодировать такой фермент. Вместо этого используется клеточная полимераза И для транскрипции вирусной ДНК в двухспиральную промежуточную структуру, которая затем используется как матрица для других клеточных ферментов, катализирующих транскрипцию вирусных мРНК. Альтернативный сплайсинг структур приводит к увеличению отдельных видов мРНК, которые транслируются в большое количество различных белков. Наиболее обильный пул представлен мРНК, кодируемыми 3'-половиной генома, управляющей синтезом структурных белков. Неструктурный белок NS1, кодируемый 5'-половиной генома, также образуется в очень большом количестве и выполняет многие функции: 1) он связан с ДНК и требуется для репликации вирусной ДНК; 2) выполняет роль геликазы; 3) служит эндонуклеазой; 4) интерферирует с репликацией клеточной ДНК.
Эта активность ведет к остановке деления клеток в S фазе. Механизм репликации генома является удивительно комплексным. 3'-конец геномной (-)ДНК служит полупраймером для начала синтеза двуцепочечнои циркулярной ДНК в качестве репликативного предшественника. Одной из особенностей репликации геномной ДНК являлось образование димерной формы репликативного предшественника с последующим синтезом тетрамерной структуры, состоящей из двух полностью позитивных и двух полностью негативных цепей вирусной ДНК, которые с помощью эндонуклеазы превращаются в одноцепочечные молекулы, в том числе в потомство вирусной ДНК.
细小病毒科(英语:Parvoviridae),又称“小DNA病毒科”,是最小且最簡單的DNA病毒,少部分此科的病毒有環境耐受性。在1960年代被發現會感染哺乳動物,可分成兩類,一類可自己進行複製,另一類則要依賴其他種類的病毒才能進行複製。1980年代始發現會感染人類的细小病毒。
细小病毒不具外套膜(non-enveloped)的二十面體,蛋白外鞘由60個次蛋白衣構成,外鞘能幫助病毒在酸性中的穩定性,病毒直徑僅約18 nm~22 nm,遺傳物質為單股直線形的DNA,大小約5kb。
人類细小病毒B19 (Human parvovirus B19,HPV B19,簡稱B19),是第一個被發現的人類的细小病毒,是兒童常見的出疹性疾病—傳染性紅斑(又稱第五病,Erythema infection, EI)的病因。它並且也被認為和其它疾病包括關節炎有關。Parvovirus RA-1 起初被認為和類風濕性關節炎有關,但現在已被推翻。
细小病毒科(英语:Parvoviridae),又称“小DNA病毒科”,是最小且最簡單的DNA病毒,少部分此科的病毒有環境耐受性。在1960年代被發現會感染哺乳動物,可分成兩類,一類可自己進行複製,另一類則要依賴其他種類的病毒才能進行複製。1980年代始發現會感染人類的细小病毒。
细小病毒不具外套膜(non-enveloped)的二十面體,蛋白外鞘由60個次蛋白衣構成,外鞘能幫助病毒在酸性中的穩定性,病毒直徑僅約18 nm~22 nm,遺傳物質為單股直線形的DNA,大小約5kb。
人類细小病毒B19 (Human parvovirus B19,HPV B19,簡稱B19),是第一個被發現的人類的细小病毒,是兒童常見的出疹性疾病—傳染性紅斑(又稱第五病,Erythema infection, EI)的病因。它並且也被認為和其它疾病包括關節炎有關。Parvovirus RA-1 起初被認為和類風濕性關節炎有關,但現在已被推翻。

パルボウイルスは、パルボウイルス科 Parvoviridae に属する直鎖1本鎖DNAウイルスである。直径20nmの球状粒子で、カプシドは正二十面体構造を形成し、エンベロープは持たない。パルボウイルスは自然界に存在するウイルスの中でも最も小さい部類に入り、そのためラテン語で「小さい」を意味する parvus から命名された。パルボウイルス科のウイルスのなかには、増殖のためにヘルパーウイルスを必要とする欠損ウイルスである種も存在する。
パルボウイルスは特定の種の動物と関連性があり、多くの場合は自身と関連性のある種の動物にしか感染しない。例えば、犬パルボウイルスはイヌ、オオカミ、キツネ等には感染するが、ネコやヒトには感染しない。
イヌ科の動物同士の接触により感染する。1976年以前に感染の報告はなかったが、その後数年間で全世界に爆発的に広がった。その後の調査で犬パルボウイルスが原因であることが判明したが、ウイルスの種類や構造自体はそれ以前から知られていた猫パルボウイルスと同一で宿主が違うだけである。そのため猫パルボウイルスの突然変異であると考えられているが証明はされていない。
ウイルスを排泄しているイヌとの接触など、糞便や吐物及びそれらの飛沫、粉塵を経口・経鼻摂取することで感染が成立する。不特定のイヌが多数集まる公園やペットショップ、動物病院などに感染力を保持したままウイルスが存在した場合、靴や服、被毛に付着し、人間や他の動物によって運ばれることもある。そのため屋内飼育で他のイヌとの接触がないからといって感染する可能性を否定することはできない。
妊娠中の母犬が感染した場合、胎盤を経由して胎児も感染し死・流産を引き起こす。このとき、母犬の臨床徴候が軽微なため、イヌパルボウイルス感染によるものと気づかれないことがある。
通常、2~12日間の潜伏期間の後に発症する。ウイルスは最初、喉頭リンパ節などで複製され、ウイルス血症を引き起こす。4~6週齢以降では、このとき食欲不振、元気消沈、嘔吐、などの症状が現れ始める。血流によって全身に行き渡ったウイルスは、新生仔期には心筋細胞、それ以降では腸陰窩細胞や骨髄細胞など、短い周期で分裂を繰り返す組織細胞に対する親和性が高く、それらの細胞で爆発的に複製され、細胞を破壊する。心筋細胞が破壊されれば心筋炎を起こし心不全により突然死する。このためごく若齢の場合、心筋型の経過をとって突然死し、イヌパルボウイルス感染症と気づかれないことがある。腸炎型では、腸陰窩細胞が破壊されることで正常な腸粘膜形成ができず、下痢、特徴的な水様性粘血便(トマトジュース様)を呈する。加えて骨髄細胞の破壊が進行することによる白血球数の激減によって、腸内細菌の日和見的な感染を防御することができなくなり、敗血症に至る。同時に、腸粘膜下織の毛細血管の破綻による出血などの要因が重なってDICが惹起され、多臓器不全により斃死する。
いったん発症すると直接治療する方法はないが、体力や抵抗力に余裕があれば、適切な対症療法を行うことで、発症後5~7日程度で免疫が獲得されるため自然回復する。 ただし生後2~3か月程度までの若齢犬では、ストレスの多い環境、消化管内寄生虫、犬コロナウイルスの同時感染などの要因が重なることによる免疫力低下が二次感染を引き起こし、死に至ることが多い。
元気消失や嘔吐、下痢、特徴的な水様性血便などの臨床徴候と併せて、糞尿中からウイルス抗原を検出するELISAキットを用いる方法が一般的であるほか、血液検査で白血球数の減少を確認することなどによって診断される。イヌパルボウイルス感染症と診断されたら、すぐに他の犬から隔離し、適切な対症療法を開始する。
イヌパルボウイルス感染症の治療には、現在のところ特効薬がなく、支持療法、対症療法のみである。 犬自身の免疫力を保つ手助けをする効果を期待して、猫インターフェロン製剤の投与が行われることが多い。また、嘔吐や下痢により失われた体内の水分や電解質を補給する点滴治療や、腸内細菌による二次感染を抑制するための抗生物質投与がおこなわれる。
体内に侵入したウイルスを完全に排除することはできないため、これらの治療を行っても生存は保証できない。発症した犬が生き残るかどうかは早期の診断と犬の体力・免疫力にかかっている。
非常に感染力が強いウイルスで、環境耐性も強い。酸やアルカリ、各種溶剤および摂氏50度までの熱に耐性があり、環境中で6ヶ月~2年感染性を維持すると言われている。高濃度次亜塩素酸ナトリウム、ホルムアルデヒドなどを使わなければ不活化出来ない。家庭で入手可能なものとしては、二酸化塩素消毒剤、塩素系漂白剤(ブリーチ)の長時間感作、などが利用できる。
イヌパルボウイルスに対する充分な免疫を持った母犬から生まれた仔犬であれば、おおよそ生後6週齢までは、母犬から得た移行抗体によって感染防御能を保持しているが、適切な移行抗体の獲得ができなかった仔犬の場合や移行抗体の消失後は継続的なワクチンの接種をしなければ免疫ができない。
対策としてはまず犬を健康に保つことと、ワクチンを接種することが重要である。
猫汎白血球減少症を引き起こす。実際には猫パルボウイルスとは言わず、猫汎白血球減少症ウイルス(Felin panleukopenia virus:FPLV)と呼称される。別名猫ジステンパーとして知られる感染症の原因となるウイルスで、1930年前後からその存在が報告されていた。ウイルスの性質はほぼ犬パルボウイルスと同一である。また感染経路、症状や治療方法も犬パルボウイルスと同様である。
犬パルボウイルスと同様、平時の健康管理とワクチン接種が重要であるが、猫の場合は飼い主が多頭飼いをしているケースが多いため、1匹が感染するとすべての猫に感染する可能性が極めて高いので注意が必要である。
猫のワクチンについては現在では猫伝染性鼻気管炎、猫カリシウイルス感染症、猫汎白血球減少症の3種混合ワクチンが主流であるが、ワクチンの種類によっては副反応をもたらすものもあり、接種にあたっては獣医師と相談の上個体に合った予防方法を選択することが重要である。
パルボウイルスB19は別名ヒトパルボウイルスと呼ばれる、人間にのみ感染するパルボウイルスである。ただし、骨髄中の赤血球先駆物質に侵入する能力があることから、パルボウイルス科 Parvoviridae のパルボウイルス属 Parvovirus ではなくエリスロウイルス属 Erythrovirus に分類されている。1974年にシドニー大学のイヴォン・コサート教授によって発見された(発表は翌1975年の1月)[1]。B19番というラベルのついた血清の培養皿から発見されたのでこのように命名された[2] 。
1983年にはじめて、いわゆる第5病(伝染性紅斑、りんご病)と呼ばれる疾患の原因ウイルスとして知られるようになり、現在では慢性骨髄不全や胎児死産、胎児水腫など様々な疾患の原因として知られている。
遺伝性球状赤血球症はパルボウイルスB19に感染すると貧血が急速に悪化する[3]。
飛沫感染と母子感染の2つの経路がある。また、最近では血漿分画製剤中に検出されたという報告もあり、血漿分画製剤の妊婦や免疫不全患者への使用にあたっては感染のリスクに対して充分な注意を払う必要がある。年間を通じて感染するが特に春季に流行する。日本においてはおよそ5年周期で症例数が増加するという傾向がある。年齢にかかわらず感染するが、特に6歳から10歳くらいの子供において発症しやすく、集団感染は主に幼稚園や小学校で発生する。
感染後約1週間で発症し、多くの場合は自然に回復する。B19 IgG抗体を持つ人は基本的に免疫を持ち、感染しても発症しないと考えられているが、まれに発症する例もある。なお、成人の約50%が抗体を持つと言われている。
子供と成人では症状の様態が大きく異なる。
通常7~10日の潜伏期間の後、軽度のウイルス血症を発症し、それにともない発熱や悪寒、頭痛、倦怠感などの症状が現れる。発症後1週間くらいすると、子供では両頬に平手打ち状または蝶翼状の赤い発疹が現れる。また四肢外側にも発疹が現れ、成人においては発疹の形状は非定型的である。この発疹は1週間程度で消失するが、長引いたり再発したりすることもある。発疹が現れる頃にはウイルス感染はほぼ終息しており、ウイルスの排泄もなくなる。
成人の場合、関節炎を発症し、酷い場合は1~2日間歩行困難になることもある。ほとんどの場合この関節炎は合併症を起こすことなく自然回復する。軽い症状の成人においては自覚症状なしに過ぎる。
溶血性貧血症患者が感染した場合、重度の貧血発作 aplastic crisis を起こすことがある。また免疫抑制状態の患者においてはウイルス血症が長引き、重度の貧血症になったり生命の危険もあるという。
妊婦、特に妊娠初期の感染は胎児水腫を引き起こして胎児を死亡させたり、流産したりする危険がある。ただしB19ウイルスに感染した母体から正常に生まれた新生児にB19の感染が確認された例でも、その後新生児が正常に発育している例もあり、必ずしも感染により先天異常が起こるとは限らない。また母子感染の時期もはっきりしていない。
小動物のパルボウイルスと違い、パルボウイルスB19に対するワクチンは現時点では存在しない。
パルボウイルスは、パルボウイルス科 Parvoviridae に属する直鎖1本鎖DNAウイルスである。直径20nmの球状粒子で、カプシドは正二十面体構造を形成し、エンベロープは持たない。パルボウイルスは自然界に存在するウイルスの中でも最も小さい部類に入り、そのためラテン語で「小さい」を意味する parvus から命名された。パルボウイルス科のウイルスのなかには、増殖のためにヘルパーウイルスを必要とする欠損ウイルスである種も存在する。
パルボウイルスは特定の種の動物と関連性があり、多くの場合は自身と関連性のある種の動物にしか感染しない。例えば、犬パルボウイルスはイヌ、オオカミ、キツネ等には感染するが、ネコやヒトには感染しない。