pms
nòm ant ël fil


Zebrafish have fusiform, laterally compressed bodies that reach an average length of 25 mm. The largest recorded zebrafish reached 64 mm in captivity. They have centrally located eyes and thin elongate mandibles with a protrusive lower jaw that causes the mouth to point upwards. Like other cyprinids, zebrafish are stomachless and toothless. As a result, they rely on gill rakers to break up food. Additionally, they are obligate suction feeders. Zebrafish have several defining features including an incomplete lateral line, two pairs of barbels, and several (usually 5 to 7) longitudinal stripes along the sides of their body. The degree of sexual dimorphism in zebrafish is minimal, as males tend to have more yellow coloration and tend to have larger anal fins than females.
Range length: 64 (in captivity) (high) mm.
Average length: 25 mm.
Other Physical Features: ectothermic ; heterothermic ; bilateral symmetry
Sexual Dimorphism: male more colorful; sexes shaped differently
Olfaction, vision, and motion detection via the lateral line system help zebrafish perceive their local environment and evade potential predators. Movement in the surrounding water is detected by the lateral line, which can detect small changes in pressure in the immediate environment. Zebrafish respond to a broad range of chemical cues detected by the olfactory bulb. Olfaction is particularly important for reproduction in zebrafish. Female zebrafish must come in contact with male gonadal pheromones in order to ovulate. Meanwhile, male zebrafish must come in contact with female pheromones in order to initiate spawning behavior.
Communication Channels: chemical
Other Communication Modes: pheromones
Perception Channels: visual ; tactile ; acoustic ; chemical
Zebrafish have a broad geographic range and are locally abundant. They breed easily in their native habitat and in 2007, increasing catch rates suggested increasing abundance. Other than potential over exploitation for the aquaria trade, there are no known threats to the long-term persistence of this species. Zebrafish are classified as a species of least concern on the IUCN's Red List of Threatened Species.
US Federal List: no special status
CITES: no special status
State of Michigan List: no special status
IUCN Red List of Threatened Species: least concern
Immediately after hatching, all zebrafish develop into females. Once they become five to seven weeks old, gonadal differentiation begin to occur, Males take approximately 3 months to fully develop their testes. Sex determination is not fully understood; however, evidence suggests that food supply and growth rates play a key role in sex determination as slow-growing individuals become males and fast-growing individuals become females.
There are no known adverse effects of Danio rerio on humans
In 1981, George Streisinger and his colleagues began to use zebrafish as a model organism for research. Since then, they have become a popular model organism for biomedical research. Zebrafish primarily have been used to study vertebrate development, evolution, genetics, and disease. Zebrafish are popular as pets and genetically modified, glow-in-the-dark zebrafish have been developed for the aquaria trade as well.
Zebrafish have many attributes that make it a popular model organism for biomedical research. They are small, have a short generation time, and are easy to raise in captivity. Additionally, in comparison to other vertebrates, zebrafish produce a large number of eggs per mating event. Zebrafish undergo external fertilization which allows all stages of development to be easily observed and manipulated. Zebrafish embryos are transparent, making them particularly useful for developmental and embryological research.
Positive Impacts: pet trade ; research and education
Zebrafish consume a number of insect species, including mosquito larvae. As a result, they likely help control insect pests throughout their geographic range. In addition, zebrafish are prey for a number of different piscivorous fish and bird species. There is no information available regarding parasites of this species.
Zebrafish are omnivores. They get most of their food from the water column, mainly eating zooplankton and aquatic insects. Zebrafish also surface feed, eating terrestrial insects and arachnids. Zebrafish commonly eat mosquito larvae.
Animal Foods: eggs; insects; terrestrial non-insect arthropods; zooplankton
Plant Foods: algae; phytoplankton
Foraging Behavior: filter-feeding
Primary Diet: omnivore ; planktivore
Danio rerio is native to inland streams and rivers of India. Its has a broad geographic range in the Indian subcontinent, ranging from the Ganges and Brahmaputra river basins of Bangladesh, India, and Nepal. A few introduced populations of the species inhabit inland waters in the United States (California, Connecticut, Florida and New Mexico) and Columbia, South America.
Biogeographic Regions: nearctic (Introduced ); palearctic (Native ); oriental (Native ); neotropical (Introduced )
Zebrafish live in freshwater streams and rivers but are more often considered floodplain species. They are most often found in shallow, slow-moving water near the edge of streams or in ditches. Because of monsoon season in their native geographic range, zebrafish have adapted to a broad range of temperatures, from 6 degrees C during winter to 38 degrees C in summer. Rice cultivation by humans has had a significant impact on zebrafish habitat. Rice farming requires damming of waterways and creation of irrigation systems. Since rice farming is common in India, many natural habitats of zebrafish have been dramatically altered by damming and irrigation. Fortunately, zebrafish are relatively tolerant of human disturbance and are able to survive and reproduce well in altered habitats.
Habitat Regions: temperate ; tropical ; freshwater
Aquatic Biomes: rivers and streams
Other Habitat Features: agricultural
In the wild, most zebrafish live to be one year old. In captivity, zebrafish have a mean lifespan of 42 months. The maximum age observed in captivity was 66 months. Captive zebrafish develop spinal curvature after their second year, which is not observed in natural populations.
Range lifespan
Status: captivity: 66 (high) months.
Average lifespan
Status: wild: 1 years.
Average lifespan
Status: captivity: 42 months.
The main predators of zebrafish are snakeheads and freshwater garfish. Other predators include catfish, knifefish, spiny eels, Indian pond heron, and common kingfisher. Zebrafish show alarm in response to visual and olfactory predatorial cues. Anti-predator behavior is also triggered by injury pheromones. Alarm behaviors include increased agitation, aggression, and decreased feeding rates. Zebrafish have three pigment cell types that contribute to their stripes. One of the pigment cells, dark blue melanophores, can be altered in response to stimuli. This is believed to help zebrafish evade potential predators.
Known Predators:
Anti-predator Adaptations: cryptic
Zebrafish are promiscuous and breed seasonally during monsoon season. Mating behavior is also heavily influenced by photoperiod, as spawning begins immediately at first light during breeding season and continues for about an hour. In order to initiate courtship about 3 to 7 males chase females and try to lead female towards a spawning site by nudging her and/or swimming around her in a tight circle or figure eight. Spawning sites consists of bare substrate that tends to be well vegetated. In captivity, gravel spawning sites are preferred to silt spawning sites. In the wild, zebrafish breed in silt-bottomed habitats. When a breeding pair reaches the spawning site, the male aligns his genital pore with the female's and begins to quiver, which causes the female to release her eggs and the male to release his sperm. The female releases 5 to 20 eggs at a time. This cycle repeats for about an hour. While the presence of female pheromones is required for initiation of courtship behavior in the male, male gonadal pheromones are required by the female for ovulation to occur. There is limited evidence for male-male competition and female mate preference.
Mating System: polygynandrous (promiscuous)
Zebrafish breed seasonally during the monsoons, which occur from April to August. Spawning has also been recorded outside wet season, suggesting that breeding may be seasonal as a result of food availability. They tend to breed in silt-bottomed and well vegetated pools. Zebrafish lay non-adhesive eggs without preparing a nest, and are considered to be group spawners and egg scatterers. Although time to hatching depends on water temperature, most eggs hatch between 48 and 72 hours after fertilization. Chorion thickness and embryo activity also impact incubation time. Zebrafish are approximately 3 mm upon hatching and are immediately independent. They are able to swim, feed, and exhibit active avoidance behaviors within 72 hours of fertilization.
Breeding interval: Zebrafish spawn every 1 to 6 days during spawning season, which occurs once yearly..
Breeding season: Zebrafish spawn during monsoon season, from April to August
Range number of offspring: 1 to 700 .
Average number of offspring: 185.
Range gestation period: 48 to 72 hours.
Average time to independence: 0 minutes.
Key Reproductive Features: iteroparous ; seasonal breeding ; sequential hermaphrodite (Protogynous ); sexual ; induced ovulation ; fertilization (External ); broadcast (group) spawning; oviparous
Adult zebrafish provide no parental care to young. Zebrafish are independent immediately upon hatching.
Parental Investment: no parental involvement
Zebrafish (Danio rerio) are small shoaling cyprinid fish. Although details of the distribution are unclear, D. rerio may be widely distributed in shallow, slow-flowing waters on the Indian subcontinent. They are most commonly encountered in shallow ponds and standing water bodies, often connected to rice cultivation. Where they are found, they tend to be among the most abundant fish species. (Spence et al. 2008 and references therein)
Danio rerio are omnivorous, feeding primarily on zooplankton and insects, although phytoplankton, filamentous algae and vascular plant material, spores and invertebrate eggs, fish scales, arachnids, detritus, sand, and mud have also been reported from gut content analyses (Spence et al. 2008 and references therein).
For many decades, D. rerio has been both a very popular aquarium fish and an important research model in several fields of biology (notably, developmental biology and toxicology). The development of D. rerio as a model organism for modern biological investigation began with the pioneering work of George Streisinger and colleagues at the University of Oregon (Streisinger et al. 1981; Briggs 2002), who recognized many of the virtues of D. rerio for research. Streisinger developed methods to produce homozygous strains by using genetically inactivated sperm, performed the first mutagenesis studies, and established that complementation methods (in which heterozygous mutant fish are paired) could be used to assign mutations to genetic complementation groups. Subsequently, the use and importance of D. rerio in biological research has exploded and diversified to the point that these fish are extremely important vertebrate models in an extraordinary array of research fields (see review by Runkwitz et al. 2011; Vascotto et al. 1997).
A number of features make D. rerio tractable for experimental manipulation. It is a small, robust fish, so large numbers can be kept easily and cheaply in the laboratory, where it breeds all year round. Females can spawn every 2 to 3 days and a single clutch may contain several hundred eggs. Generation time is short (for a vertebrate), typically 3 to 4 months, making it suitable for selection experiments. Danio rerio eggs are large relative to other fish (0.7 mm in diameter at fertilization) and optically transparent, the yolk being sequestered into a separate cell. Furthermore, fertilization is external so live embryos are accessible to manipulation and can be monitored through all developmental stages under a dissecting microscope. Development is rapid, with precursors to all major organs developing within 36 hours, and larvae display food-seeking and active avoidance behaviors within five days after fertilization, i.e., 2 to 3 days after hatching. Mutagenesis screens have now generated many thousands of mutations and have led to the identification of hundreds of genes controlling vertebrate development (Rinkwitz et al. 2011 report that as of their writing there was information on embryonic and larval expression of over 12,000 genes and just under 1000 mutant phenotypes). (Spence et al. 2008 and references therein) The D. rerio genome has now been largely sequenced (see http://www.sanger.ac.uk/Projects/D_rerio/), making it an even more valuable research organism. Although D. rerio is extremely well studied as a lab organism, the ecology and behavior of these fish in the wild has been far less well studied.
Zebrafish (Danio rerio) are small shoaling cyprinid fish native to the flood plains of the Indian subcontinent. The natural range of D. rerio is centered around the Ganges and Brahmaputra river basins in north-eastern India, Bangladesh, and Nepal, although in the past specimens have also been collected in the Indus, Cauvery, Pennar, Godavari, and Mahanadi river basins. There are also reports of occurrences from the Krishna river basin and the states of Rajasthan, Gujarat, and Andra Pradesh (river basins draining into the Arabian Sea) as well as northern Myanmar and Sri Lanka, but locality details are lacking. Although details of the distribution are unclear, D. rerio may be widely distributed in shallow, slow-flowing waters on the Indian subcontinent. Based on results from several studies, D. rerio occur in shallow water bodies with visibility to a depth of approximately 30 cm, frequently in unshaded locations with aquatic vegetation and a silty substratum. They are most commonly encountered in shallow ponds and standing water bodies, often connected to rice cultivation. Where they are found, they tend to be among the most abundant fish species. (Spence et al. 2008 and references therein)
Danio rerio are omnivorous, feeding primarily on zooplankton and insects, although phytoplankton, filamentous algae and vascular plant material, spores and invertebrate eggs, fish scales, arachnids, detritus, sand, and mud have also been reported from gut content analyses (Spence et al. 2008 and references therein).
The ‘‘leopard’’ danio, which displays a spotted color pattern rather than stripes, was originally thought to be a separate species, described as Brachydanio frankei (at one time, small Danio species with short dorsal fins and a reduced lateral line, including the species now known as Danio rerio, were segregated from the larger Danio species and placed in Brachydanio). However, neither molecular nor morphological analyses have differentiated between the two forms and hybrids have been shown to produce fertile progeny. The leopard danio is now known to be a spontaneous mutation of the wild-type D. rerio color pattern, with homozygotes displaying a spotted pattern and heterozygotes having a disrupted stripe pattern. Another aquarium variant is the ‘‘longfin’’ D. rerio, which is a dominant mutation resulting in elongated fins. The commonly used wild-type strain, TL (Tübingen long-fin) displays both the ‘‘leopard’’ and ‘‘longfin’’ mutations. (Spence et al. 2008 and references therein)
For many decades, D. rerio has been both a very popular aquarium fish and an important research model in several fields of biology (notably, toxicology and developmental biology; see, e.g., Creaser 1934). The development of D. rerio as a model organism for modern biological investigation began with the pioneering work of George Streisinger and colleagues at the University of Oregon (Streisinger et al. 1981; Briggs 2002), who recognized many of the virtues of D. rerio for research. Streisinger developed methods to produce homozygous strains by using genetically inactivated sperm, performed the first mutagenesis studies, and established that complementation methods (in which heterozygous mutant fish are paired) could be used to assign mutations to genetic complementation groups. Subsequently, the use and importance of D. rerio in biological research has exploded and diversified to the point that these fish are extremely important vertebrate models in an extraordinary array of research fields (see review by Runkwitz et al. 2011; Vascotto et al. 1997).
A number of features make D. rerio tractable for experimental manipulation. It is a small, robust fish, so large numbers can be kept easily and cheaply in the laboratory, where it breeds all year round. Females can spawn every 2 to 3 days and a single clutch may contain several hundred eggs. Generation time is short (for a vertebrate), typically 3 to 4 months, making it suitable for selection experiments. Danio rerio eggs are large relative to other fish (0.7 mm in diameter at fertilization) and optically transparent, the yolk being sequestered into a separate cell. Furthermore, fertilization is external so live embryos are accessible to manipulation and can be monitored through all developmental stages under a dissecting microscope. Development is rapid, with precursors to all major organs developing within 36 hours, and larvae display food seeking and active avoidance behaviors within five days after fertilization, i.e. 2 to 3 days after hatching. The large-scale random mutagenesis screens of D. rerio were the first to be conducted in a vertebrate. Danio rerio used for mutagenesis and screening are from lines that have been inbred for many generations in order to maintain a stable genetic background. Mutagenesis screens have now generated many thousands of mutations and have led to the identification of hundreds of genes controlling vertebrate development (Rinkwitz et al. 2011 report that as of their writing there was information on embryonic and larval expression of over 12,000 genes and just under 1000 mutant phenotypes). As a vertebrate, D. rerio has special value as a model of human disease and for the screening of therapeutic drugs (Chakraborty et al. 2009) and is often more tractable for genetic and embryological manipulation and cost effective than other vertebrate models such as mice. Hundreds of labs around the world now routinely use D. rerio in both basic and applied research, leading to the creation of a centralized online resource for this research community (http://zfin.org). Some researchers have even used D. rerio to investigate the genetic basis of vertebrate behavior (see, e.g., Miklósi and Andrew 2006; Norton and Bally-Cuif 2010). (Spence et al. 2008 and references therein) The D. rerio genome has now been largely sequenced (see http://www.sanger.ac.uk/Projects/D_rerio/), making it an even more valuable research organism.
Laale (1977) reviewed the D. rerio literature to date, with a focus on physiology. Wixon (2000) provides an overview of the current state of knowledge and resources for the study of D. rerio. Although D. rerio is extremely well studied as a lab organism, the ecology and behavior of these fish in the wild has been far less well studied. Spence et al. (2008) reviewed the ecology and behavior of D. rerio (see also McClure et al. 2006; Spence et al. 2006; Engeszer et al. 2007), as well as its taxonomic history, morphology, and many other aspects of its biology.
El peix zebra (Danio rerio) és un peix tropical classificat a la família dels ciprínids.[2] És un conegut peix d'aquari i un important -i cada vegada més utilitzat- organisme model en la investigació científica. El peix zebra és adscrit al gènere Danio i està relacionat amb el Danio kyathit.[3]
El peix zebra és nadiu del sud-est dels Himàlaies,[3] concretament al riu Ganges, a la regió est de l'Índia. També es troba nativament al Pakistan, Bangladesh, Nepal i Birmània. El seu hàbitat natural són els canals, preses, assuts, séquies i basses de conreu d'arròs. Va ser introduït com a peix d'aquariofília al Japó, als Estats Units i a Austràlia. [4] També ha estat observat a Colòmbia, presumiblement a partir d'una fuga des d'un aquari. Actualment és considerat una espècie cosmopolita.
Rep el seu nom per les seues cinc bandes uniformes pigmentades de color blau fosc que té als dos costats del cos. Els mascles tenen forma de torpede i bandes daurades entre les ratlles blaves. Les femelles tenen una panxa més gran i el color entre les bandes blaves més platejades. Creix fins als 6,4 cm. És capaç de produir entre 300 i 500 ous per posta. Recentment, s'han posat en venda varietats transgèniques amb uns colors molt vistosos com a conseqüència de les proteïnes fluorescents que produeixen, aquestes poden ser: GFP, proteïna fluorescent roja, i proteïna fluorescent groga. Aquesta varietat transgènica està patentada i té el nom de GloFish, a més és el primer organisme transgènic utilitzat com a mascota. Altres varietats són la golden, sandy, longfin i leopard.
El Leopard danio, anteriorment conegut com a Danio frankeri, és una mutació del Danio rerio causada per la pigmentació d'aquest.[5] La forma xanthistic de les formes de les taques (zebra i lleopard), han estat obtingudes per reproducció selectiva.[6]
El peix zebra és considerat un peix prou resistent i perfecte per als principiants en aquaris. És fàcil de mantenir i, fins i tot, de reproduir, és considerat bell i barat, factors que l'han popularitzat. Creix ràpidament entre els 22 °C i 27 °C. Menja cucs, crustacis xicotets i larves d'insectes. Té un caràcter amigable i no es mostra violent amb altres espècies als aquaris. D'altra banda és susceptible de ser atacat per diverses malalties com ara Oodinium, Microsporidia (Pseudoloma neurophilia) i els bacteris del gènere Mycobacterium. Pot arribar a viure 5 anys. Necessita un PH neutre, sempre ha d'estar el voltant de 6,7 o 8.
Aquest peix és un comú i útil organisme model en l'estudi del desenvolupament embrionari dels vertebrats, en estudis genètics i en fisiologia.[3] Actualment està suplantant a altres models vertebrats superiors com les rates i els ratolins de laboratori, degut al rebuig social a aquesta pràctica d'experimentació. El primer investigador que va utilitzar aquesta espècie fou George Streisinger de la Universitat d'Oregon als Estats Units, que va establir el peix zebra com a organisme model. La seva importància es va consolidar mitjançant pantalles genètiques de tecnologia avançada a gran escala (comunament conegudes com les pantalles de Tübingen / Boston). La revista universitaria The Scholarly Journal [7] va dedicar un tema a la recerca de l'ús del peix en la celebració d'aquest fita. [8] Ara mateix existeix una base de dades amb informació genética, genómica i amb informació del desenvolupament del Peix zebra anomenat ZFIN (Zebrafish Information Network). A més el D. Rerio és una de les poques espècies que han viatjat a l'espai.
L'estudi del desenvolupament del peix zebra proporciona diversos avantatges davant d'altres organismes model. Tot i que, en general, el temps de generació del peix zebra és comparable al del ratolí, els embrions del peix zebra desenvolupen ràpidament, passant d'ous a larves per sota dels tres dies. Els embrions són grans, robustos i transparents i es desenvolupen externament a la mare, les característiques que els hi faciliten la manipulació experimental i l'observació.[9] La seva mida quasi constant durant el desenvolupament primerenc, facilita la simple tinció tècniques i fàrmacs que es poden administrar afegint-los directament a l'aquari. Els ous no fertilitzats es poden fer servir per dividir-se i fusionar-se per formar un embrió a partir de dues cèl·lules, creant un embrió totalment homozigot.
Una tècnica comuna de genètica inversa és reduir l'expressió de gens o modificar l'entroncament en peix zebra, utilitzant la tecnologia antisentit Morpholino. Els oligonucleòtids morfolins són macromolècules sintètiques estables que contenen les mateixes bases que l'ADN o l'ARN. En unir-se a seqüències d'ARN complementàries, redueixen l'expressió de gens específics. La revista Genesis va dedicar un tema a la investigació utilitzant oligos morfolins, principalment en D. rerio. Els oligonucleòtids morfolins poden injectar-se en una cèl·lula d'un embrió de peix zebra després de l'etapa de 32 cèl·lules, produint un organisme en el qual l'expressió gènica es redueix només a les cèl·lules que descendeixen de la cèl·lula injectada. No obstant això, les cèl·lules en l'embrió primerenc (<32 cèl·lules) són interpermeables a molècules grans, el que permet la difusió de morfolins entre les cèl·lules. Un problema conegut amb la destrucció de gens en el peix zebra és que, pel fet que el genoma es va duplicar després de la divergència dels peixos amb aletes radiades i els peixos amb aletes lobulades, no sempre és fàcil silenciar l'activitat d'un dels paralogs de dos gens de manera fiable a causa de la complementació per l'altre paralog.
Tot i les complicacions del genoma del peix zebra, hi ha diverses plataformes globals disponibles comercialment per a l'anàlisi de l'expressió de gens mitjançant microformacions i la regulació del promotor utilitzant ChIP-on-xip.
El peix zebra té l'habilitat de regenerar les aletes, la pell, el cor i el cervell (en estadis larvals). També s'ha descobert la capacitat de regeneració que tenen els seus fotoreceptors i cèl·lules retinals. Els mecanismes d'aquestes regeneracions no són coneguts encara, però actualment estan sent estudiats. Els investigadors freqüentment tallen les aletes de la cua dorsal i ventral i analitzen la seva reculada per provar les mutacions. Aquesta investigació està liderant la comunitat científica en la comprensió dels mecanismes de curació / reparació en els vertebrats.
A desembre de 2005, un estudi de la varietat golden va identificar el gen SLC24A5 com a responsable de la pigmentació, ja que produeix un producte imprescindible per a la producció de la melanina, i també van confirmar la seua funció amb bloqueig amb morfolina. El gen homòleg en humans va ser caracteritzat gràcies a aquest descobriment. Gràcies a ell existeix la diferència de pigmentació entre la pells de les races caucàsiques i negroides.[10] Aquest estudi va aparèixer a la portada de la revista Science i va demostrar el poder del peix zebra com a organisme model en el, relativament, nou camp de la genètica comparativa.
En gener del 2007, investigadors xinesos de la Universitat de Fudan van desenvolupar un peix transgènic que podia detectar la contaminació per estrogens als llacs i rius, demostrant a les autoritas xineses ambientals la necessitat de treure les substàncies de l'aigua que està molt vinculada a la infertilitat masculina. Song Houyan i Zhong Tao, professors del laboratori de medicina molecular de Fudan, van trigar tres anys, clonant exemplars sensibles als estrògens i injectant-los als ous fèrtils del peix zebra. El peix modificat es tornava verd quan es posava en contacte amb l'aigua barrejada amb estrògens.[11]
L'1 d'agost de 2007, investigadors de l'University College de Londres van fer proliferar al laboratori un tipus de cèl·lula mare trobada als ulls dels peixos, i dels mamífers que desenvolupa en neurones a la retina. Aquesta cèl·lula pot ser injectada a l'ull per tractar diferents malalties, que provoquen que les neurones de la retina estiguin malmeses — quasi totes les malalties dels ulls, incloent la degeneració macular, el glaucoma i la ceguesa per diabetis. Els danys fets a la retina (part de l'ull que envia els missatges al cervell) són els responsables de la majoria de casos de ceguesa. Els investigadors van estudiar les cèl·lules glials als ulls dels humans d'entre 18 mesos i 91 anys, i van trobar possible el seu desenvolupament a tots els tipus de neurones trobades a la retina. Les cèl·lules van ser provades en rates amb malalties per la retina, i van transformar-se en cèl·lules retinals sanes. En l'actualitat l'equip investigador està treballant en el mateix projecte aplicat en humans.[12]
Des del febrer de 2008, investigadors de l'Hospital Infantil de Boston estan criant peixos zebra amb la intenció d'estudiar els seus embrions transparents, concretament per estudiar els mecanismes de generació de malalties com el càncer.[13]
El peix zebra (Danio rerio) és un peix tropical classificat a la família dels ciprínids. És un conegut peix d'aquari i un important -i cada vegada més utilitzat- organisme model en la investigació científica. El peix zebra és adscrit al gènere Danio i està relacionat amb el Danio kyathit.
Dánio pruhované (Danio rerio; Hamilton, 1822) je sladkovodní kaprovitá, paprskoploutvá ryba pocházející z oblastí jižní Asie. Jedná se o drobnou rybku oblíbenou mezi akvaristy a zároveň jde o významný modelový organismus v genetice a molekulární biologii.
Průměrně se dožívá 3,5 roku, nejstarší jedinci se mohou dožít až 5,5 roku.
Dorůstá do délky až 5 cm.
Tělo je podlouhlé, štíhlé, téměř kulatého příčného průřezu mírně stlačeného ze stran. Hřbet má zelenohnědou barvu. Na boku těla je pět rovnoměrných, pigmentovaných, vodorovných pruhů, všechny zasahují do konce paprsků ocasní ploutve. Hřbetní ploutev je žlutozelená, bíložlutě lemovaná. Břišní část je bílá, mírně nažloutlá. Řitní ploutev je výrazně pruhovaná.[2]
Pochází z Asie - Pákistánu, Indie, Bangladéše, Nepálu a Barmy. Dostalo se i do vod Kolumbie, Kalifornie, Connecticutu, Floridy and Nového Mexika a to pravděpodobně únikem z akvárií.
Dánio se obvykle vyskytuje ve stojatých mělkých vodách, nebo ve vodách s velmi pomalým tokem. Dno je obvykle bahnité a pokryté vodní vegetací.
Jsou uzpůsobena na velké výkyvy v kvalitě a teplotě vody. Například pH bylo na různých místech výskytu naměřeno v rozsahu 5.9–8.5 a teplota vody 16–38°C. Tyto rozdíly mohou bát vysvětlovány jak sezónností, tak i geografickými podmínkami. Díky toleranci na různé podmínky jsou dánia snadno chovatelná v zajetí.
Ve volné přírodě se živí primárně širokým spektrem zooplanktonu a hmyzem. V menší míře se pak může živit i řasami, detritem a dalšími organickými materiály.
Dánia se zapojují do reprodukce v 6 měsících.
Tření probíhá sezónně v období monzunů, které se vyskytují od dubna do srpna. Tření bylo také zaznamenáno mimo toto období, což naznačuje, že chov může být sezónní v důsledku dostupnosti potravin. Vytírají se v místech s bahnitým substrátem a bohatou vegetací. Nelepivé jikry rozptylují do vegetace. I když doba vylíhnutí závisí na teplotě vody, většina vajíček se vylíhne mezi 48 a 72 hodinami po oplodnění. Tloušťka chorionu a aktivita embrya také ovlivňují inkubační dobu. Larva je při líhnutí přibližně 3 mm velká a zcela nezávislá na rodičích – dokáže plavat a přijímat potravu.[3]
Po vylíhnutí se všechna dánia vyvinou na samice. Po dovršení pěti až sedmi týdnů, se začnou vyskytovat gonadální diferenciace. Určení pohlaví záleží na množství potravy a rychlosti růstu - pomalu rostoucí se vyvinou v samce a rychle rostoucí na samice.[3]
Oblíbené mezi akvaristy, odolná rybka, vhodná pro začátečníky. Populární je zejména díky nízké ceně, snadnému odchovu a široké dostupnosti.
Existuje i geneticky modifikovaná fluorescenční foma (zelená Electric Green, červená Starfire Red, žlutooranžová Sunburst Orange, fialová Galactic Purple a modrá Cosmic Blue). Dovoz a chov těchto zvířat je však v Evropské unii zakázaný.
Dánio jako model biologického systému má četné výhody pro vědce. Jeho genom byl plně sekvencován. Jeho embryonální vývoj je velmi rychlý a jeho embrya jsou relativně velká, robustní a transparentní a schopná vyvíjet se mimo tělo své matky.
Další výhody zahrnují téměř konstantní velikost druhu během rychlého vývoje, který umožňuje použití jednoduchých technik barvení a skutečnost, že jeho dvoubuněčné embryo může být fúzováno do jedné buňky za vzniku homozygotního embrya. Dánio je také prokazatelně podobné savčím modelům a lidem v testování toxicity, cyklus spánku dánia je podobným savčímu. Nicméně, dánia nejsou univerzálně ideální výzkumný model; existuje řada nevýhod jejich vědeckého použití, jako je přítomnost malých, ale důležitých rozdílů mezi dánii a savci v rolích některých genů souvisejících s lidskými poruchami.
Výzkum přinesl pokrok v oblasti vývojové biologie, onkologie, toxikologie, teratologie, repodukce, genetiky, neurobiologie, environmentálních věd, výzkumu kmenových buněk, regenerativní lékařství, svalové dystrofie a evoluční teorie.
Dánio pruhované (Danio rerio; Hamilton, 1822) je sladkovodní kaprovitá, paprskoploutvá ryba pocházející z oblastí jižní Asie. Jedná se o drobnou rybku oblíbenou mezi akvaristy a zároveň jde o významný modelový organismus v genetice a molekulární biologii.
Zebrafisk (Danio rerio o.a.) er en populær akvariefisk, som er naturligt forekommende i Indien. Zebrafiskens oprindelige farvevariation er mørkeblå og guldstribet for hannen og mørkeblå og sølvstribet for hunnen. Derudover findes zebrafisken som akvariefisk også i en hvid, gylden, rød og pink udgave. I USA sælges zebrafisken under navnet GloFish[1] også i 5 genmodificerede fluorescerende farvevarianter (rød, blå, lilla, orangegul og grøn). Genmodificerede dyr er ulovlige i EU, derfor må disse varianter ikke sælges i eller medbringes til Danmark. Normalt bliver zebrafisken 4 cm lang, men de kan nå en længde af 6,4 cm. Zebrafisken er så tæt beslægtet med den plettede danio (Danio nigrofasciatus), at de kan yngle. Zebrafisken er nem at passe og anbefales til uerfarne akvarieindehavere. Zebrafisken bruges ofte som forsøgsdyr (også i Danmark[2]) af flere forskellige årsager, bl.a. at den nemt yngler og er nem at passe.
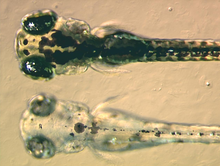
Zebrafiskeunger nederste er muteret og mangler sort pigmentering.
Zebrafisk (Danio rerio o.a.) er en populær akvariefisk, som er naturligt forekommende i Indien. Zebrafiskens oprindelige farvevariation er mørkeblå og guldstribet for hannen og mørkeblå og sølvstribet for hunnen. Derudover findes zebrafisken som akvariefisk også i en hvid, gylden, rød og pink udgave. I USA sælges zebrafisken under navnet GloFish også i 5 genmodificerede fluorescerende farvevarianter (rød, blå, lilla, orangegul og grøn). Genmodificerede dyr er ulovlige i EU, derfor må disse varianter ikke sælges i eller medbringes til Danmark. Normalt bliver zebrafisken 4 cm lang, men de kan nå en længde af 6,4 cm. Zebrafisken er så tæt beslægtet med den plettede danio (Danio nigrofasciatus), at de kan yngle. Zebrafisken er nem at passe og anbefales til uerfarne akvarieindehavere. Zebrafisken bruges ofte som forsøgsdyr (også i Danmark) af flere forskellige årsager, bl.a. at den nemt yngler og er nem at passe.
Der Zebrabärbling (Danio rerio, Syn.: Brachydanio rerio, im Laborjargon wegen des englischen Namens zebrafish auch als Zebrafisch bezeichnet) ist ein Fisch aus der Familie der Karpfenfische (Cyprinidae). Er wurde erstmals 1822 beschrieben und erfreut sich seit Anfang des 20. Jahrhunderts weltweit großer Beliebtheit als Aquarienzierfisch.
Beheimatet sind Zebrabärblinge im Stromgebiet des Ganges in Pakistan, Nordindien, Südnepal und Bangladesch, wo sie in langsam fließenden oder stehenden Gewässern, wie zum Beispiel Reisfeldern, leben. Durch wahrscheinlich von Fischfarmen stammende Exemplare haben sich Zebrabärblinge auch in US-amerikanischen Gewässern angesiedelt.[1]
Der Zebrabärbling hat einen langgestreckten, schlanken, seitlich nur wenig abgeflachten Körper und erreicht eine Maximallänge von 5 cm.
Der Rücken der Fische ist olivbraun, der Bauch gelbweiß. Die Seiten sind von einem gelblichen Silber und dabei „zebrafellartig“ (Name) von blau irisierenden, schwarzen Längsbinden durchzogen, die vom Hinterrand des Kiemendeckels bis auf die Schwanzflosse reichen. Auch Afterflosse und Kiemendeckel sind kontrastreich in graublau und blassgelb gestreift bzw. gefleckt. Brust- und Bauchflossen sind farblos. Das Maul ist leicht oberständig. Es wird von zwei Paaren von Barteln flankiert. Die Oberkieferbarteln reichen bis zum vorderen Augenrand, die längeren Unterkieferbarteln bis zur Mitte der Kiemendeckel. Eine sichtbare Seitenlinie fehlt. Weibchen sind fülliger, werden etwas größer und sind blasser gefärbt.
Der Leopardbärbling ist eine Mutante des Zebrabärblings, bei der die blauen Streifen in einzelne Punkte aufgelöst sind. Bei dem betroffenen Gen handelt es sich um connexin 41.8, das für ein Gap-Junction-Protein codiert.[2] Er wurde als Danio frankei (Meinken, 1963) beschrieben, aber von der Fachwelt nicht als eigenständige Art anerkannt.[3] Da die Fische zuerst in einem Prager Aquarium gefunden wurden, ist es auch umstritten, ob es sich um eine natürliche Population oder vielmehr um eine Zuchtform handelt.[4]
Wegen folgender Eigenschaften ist der Zebrabärbling zu einem erfolgreichen und weit verbreiteten Modellorganismus in der Genetik und Entwicklungsbiologie geworden:
Nicht minder wichtig ist schließlich, dass sich viele der beim Zebrabärbling gewonnenen entwicklungsbiologischen Erkenntnisse auf den Menschen übertragen lassen. Schon jetzt werden Zebrabärblingmutanten als Tiermodelle für genetische Erkrankungen des Menschen herangezogen.
Derzeit untersucht eine Wissenschaftlergruppe an der University of Adelaide um Karissa Barthelson[7] Prozesse um die Energieerzeugung in Gehirnzellen. Hier werden Mutationen bezüglich der Umwandlung von Sauerstoff in Energie in den Gehirnzellen[8] [9] von Zebrabärblingen[10] erwirkt, worauf Rückschlüsse bei der Entstehung von Demenzkrankheiten bei Menschen, wie zum Beispiel Alzheimer[11] gezogen werden können.
Da es sich bei Zebrabärblingen um Schwarmfische handelt, wird eine Haltung in Gruppen von mindestens acht Tieren empfohlen. Zebrabärblinge lassen sich mit anderen Fischen und Aquarienbewohnern vergesellschaften. Die Haltung ist auch in kaltem Wasser ab ca. 18–20 °C möglich. Zebrabärblinge vermehren sich jedoch nicht oder nur eingeschränkt, wenn die Wassertemperatur außerhalb des Bereichs von 25 bis 31 °C liegt.[12][13][14]
Der Danio rerio strain Tübingen[15] ist eine prinzipiell auch wild vorkommende Mutation des Zebrabärblings, die im Max-Planck-Institut für Entwicklungsbiologie in Tübingen durch Inzucht in 7000 separaten Aquarien gezüchtet wird.[16][17] Die Fische werden beispielsweise zu wissenschaftlichen Untersuchungen des Augeninnendrucks eingesetzt.[18]
Im Jahre 2003 kamen in den USA unter dem Markennamen GloFish Zebrabärblinge als Aquarienfische in den Handel, denen aus Quallen gewonnene Fluoreszenz-Gene (siehe Grün fluoreszierendes Protein) eingepflanzt worden waren. In der Europäischen Union sind Vertrieb und Zucht dieses nicht zugelassenen gentechnisch veränderten Organismus strafbar.[19][20]
Der Zebrabärbling (Danio rerio, Syn.: Brachydanio rerio, im Laborjargon wegen des englischen Namens zebrafish auch als Zebrafisch bezeichnet) ist ein Fisch aus der Familie der Karpfenfische (Cyprinidae). Er wurde erstmals 1822 beschrieben und erfreut sich seit Anfang des 20. Jahrhunderts weltweit großer Beliebtheit als Aquarienzierfisch.
Zebrica (latinski: Danio rerio) je vrsta tropske slatkovodne ribe iz roda Danio, porodice Cyprinidae (šarani). Vode porijeklo iz potoka i rižinih polja Indije, a u Evropu je unijeta 1905. godine. Može se sresti i u vodama Bangladeša, Pakistana i Nepala, a kao neželjeni kućni ljubimci dospjeli su i u vode Kolumbije. Vrlo su popularne akvarijumske ribe, lahke za gajenje i razmnožavanje, a koriste se i u naučne svrhe.
Brza je i vrlo živahna riba, svijetlosivog tijela, a prepoznatljiva je po četiri horizontalne pruge tamnije sive ili sivoplave boje. Pruge se protežu od škržnih poklopaca pa do repa, koji je blijedomliječne boje. Odlika cijele porodice su brčići koji se daju primjetiti i kod zebrice. Spolni dimorfizam je očit: ženke su veće od mužjaka i dosta krupnijeg, rozog stomaka. Maksimalna dužina ženke je 6 cm. Između tamnijih pruga kod mužjaka se nalaze zlatnožute pruge, koje su kod ženke sive boje. Životni vijek zebrica iznosi otprilike 5 godina.
Idealna temperatura vode iznosi 23 °C, ali u akvarijumu ona nije od velikog značaja. Sposobnosti ove ribe da podnese nevjerovatna kolebanja temperature, u rasponu od 15 do 30 °C, svojstvene su još samo zlatnim karasima. Nije zahtjevna ni po pitanju hemizma vode. Vrlo su temperamentne i živahne ribe, pa traže dosta prostora za plivanje, ali i dosta prostora za skrivanje u bilju. Zbog navike da iskaču iz vode u potrazi za insektima, akvarijum mora biti zatvoren poklopcem. Njenom temperamentu odgovara i veliki apetit - zebrice će prihvatati svu kupovnu hranu i svu živu koja im može stati u usta, uključujući razne crviće i kuhano zeljasto povrće.
Kada je u pitanju razmnožavanje, zebrice ne zahtjevaju ništa osim krupnijeg šljunka ili, još bolje, mrežice dovoljno široke da kroz nju propadne ikra, a istovremeno dovoljno uske da spriječi roditelje da dopru do nje i pojedu je. Sa lakoćom se mrijeste i u posudama vrlo malih zapremina, od 5 do 10 l. Hemizam vode ne igra važnu ulogu, ali mrijest potiče hladna, svježa voda bogata kisikom. Ženka položi 100 do 400 komada ikre, nakon čega se roditelji izdvajaju iz akvarijuma. Inkubacija ikre pri temperaturi od 26 °C traje samo 24 sata. Nakon izleganja ličinke vise tri dana na staklu ili podlozi, a zatim proplivaju i počinju se hraniti. Kao prvu hranu za mladunce može se koristiti tvrdo kuhano žumance. Kod žumanceta treba biti oprezan i ne stavljati previše, jer se brzo raspada, zagađuje vodu i oduzima dragocjeni kisik.
Zebrice se smatraju najjednostavnijim početničkim ribama. Većina akvarista, kada želi krenuti sa mrijestom ikrašica, počinje upravo od njih. Do danas je odgojeno nekoliko varijeteta zebrica, od kojih neke ispoljavaju zeleni, žuti ili crveni fluoroscentni protein. Susreću se varijeteti zlatne boje i varijacije koje se odlikuju tačkicama kao kod leoparda, te albino forme zebrice. Varijeteti sa leopardovim uzorkom se ponekad označavaju kao zasebna vrsta po imenu Danio frankei.
சிற்றின குறிப்பு
வரிக்குதிரை மீன் அல்லது ஜீப்ரா பிஸ் (டேனியோ ரியோ ) என்பது சைப்ரினிஃபார்ம்ஸ் வரிசையில் மினோ குடும்பத்தைச் சார்ந்த ( சைப்ரினிடே ) நன்னீரீல் வாழக்கூடிய மீன் வகையாகும் . [2] தெற்காசியாவை பூர்வீகமாகக் கொண்ட இந்த மீன் மிக பிரபலமானதாகும். இம்மீனாது பரவலாக ஜீப்ரா டேனியோ [3] என்ற வர்த்தக பெயரில் விற்கப்படுகிறது. இம்மானனது வெப்பமண்டல மற்றும் மித வெப்பமண்டலங்கள் பகுதிகளில் காணப்பட்டாலும் " வெப்பமண்டல மீன்" என்று அறியப்படுகிறது. வரிக்குதிரை மீனானது அறிவியல் ஆய்வுகளில் முக்கியமாக பயன்படுத்தப்படும் முதுகெலும்பு மாதிரி உயிரினமாகும். குறிப்பாக புதிய மருந்து உருவாக்கம், ஒரு மருந்தானது மக்கள் பயன்பாட்டிற்கு வருவதற்கான முன் பயன்பாட்டுச் சோதனைகளில் அதிக அளவில் பயன்பாட்டில் உள்ளது. இம்மீனின் மீளுருவாக்கம் திறன் இங்கு குறிப்பிடத்தக்கதாகும், மேலும் உயிரிதொழில்நுட்ப ஆய்வாளர்கள் மரபணு மாற்றப்பட்ட வகைகளை உருவாக்கியுள்ளனர் [4] [5]
வரிக்குதிரை மீன் (ஜீப்ராஃபிஷ்) என்பது சைப்ரினிடே குடும்பத்தின் பிராச்சிடானியோ பேரினத்தைச் சார்ந்த ஒரு உறுப்பினர். இது டானியோ அஸ்குலாபியுடன் ஒரு சகோதர-குழு உறவைக் கொண்டுள்ளது. உயிரினங்களின் பைலோஜெனடிக் மரத்தால் நிரூபிக்கப்பட்டபடி, ஜீப்ராஃபிஷ் தேவாரியோ இனத்துடன் நெருங்கிய தொடர்புடையது. வரிக்குதிரைமீன் என்பது பெரும்பாலும் "டேனியோ ரியோ"வை [6], குறிக்கின்றது, ஆனால் சமீபகால மூலக்கூறு ஆய்வுகள் இதனை "பிராச்சிடானியோ ரியோ" என வகைப்பாடு செய்து பிராச்சிடானியோ பேரினத்தைச் சேர்ந்ததாக இருக்க வேண்டும் என்று பரிந்துரைத்துள்ளன.
இந்தியா, பாகிஸ்தான், பங்களாதேஷ், நேபாளம் மற்றும் பூட்டான் ஆகிய நாடுகளில் காணப்படும் வரிக்குதிரை மீன் தெற்காசியாவில் உள்ள நன்னீர் வாழ்விடங்களை பூர்வீகமாக கொண்டது. [1] [7] [8] வடக்கு எல்லையான தென் இமயமலையில், பாகிஸ்தான்-இந்தியா எல்லைப் பகுதியில் உள்ள சட்லெஜ் நதிப் படுகை முதல் வடகிழக்கு இந்தியாவின் அருணாச்சல பிரதேசம் வரை உள்ளது. இதன் பரவலானது கங்கை மற்றும் பிரம்மபுத்ரா நதிப் படுகைகளில் காணப்படுகிறது. இந்த மீனினமானது முதன் முதலில் இந்தியாவின் கோசி நதி (கீழ் கங்கைப் படுகை) யிலிருந்து விவரிக்கப்பட்டுள்ளது. மேலும் தென் பகுதியில் மேற்கு மற்றும் கிழக்கு தொடர்ச்சி மலைகளில் இருந்து இங்கும் அங்குமாக தொடர்ச்சியற்ற பரவலாக உள்ளது. [9] இது மியான்மரில் (பர்மா) அடிக்கடி காணப்பட்டதாக கூறப்படுகிறது என்றாலும், இச்செய்தியானது முற்றிலும் பழைய பதிவுகளை அடிப்படையாகக் கொண்டது (1926 ஆண்டிற்கு முந்தயன) மற்றும் இது பின்னர் விவரிக்கப்பட்ட இதன் நெருங்கிய உறவினரான குறிப்பாக டானியோ கயாத்தித் தொடர்புடையாதக உள்ளது . [10] [11] அதேபோல், இலங்கையின் பழைய பதிவுகள் மிகவும் கேள்விக்குரியவை மற்றும் உறுதிப்படுத்தப்படுத்தப்பட்டதாக இல்லை.
அமெரிக்காவின் கலிபோர்னியா, கனெக்டிகட், புளோரிடா மற்றும் நியூ மெக்ஸிகோவிற்கு வரிக்குதிரை மீனானது அறிமுகப்படுத்தப்பட்டது. இது மீன்அருங்காட்சியக பயன்பாட்டிற்காக மீன்வளர்ப்பவர்களால் விடுவிக்கப்பட்டதாகவோ அல்லது மீன் பண்ணைகளிலிருந்து தப்பித்ததன் மூலமாகவோ இருக்கலாம். ஆனால் 2003 ஆம் ஆண்டில் நியூ மெக்ஸிகோவில் காணப்பட்ட வரிக்குதிரை மீன்கள் அழிக்கப்பட்டதாக பதிவுகள் கூறினாலும், மற்றமீன்கள் தப்பி பிழைத்தன குறித்து தெளிவாகத் தெரியவில்லை. [12] மற்ற இடங்களான கொலம்பியா மற்றும் மலேசியாவிலும் இந்த இனங்கள் அறிமுகப்படுத்தப்பட்டுள்ளன. [2] [8]
வரிக்குதிரை மீன் பொதுவாக நீரோடைகள், கால்வாய்கள், சிறுபள்ளங்கள், ஆக்ஸ்போ ஏரிகள், குளங்கள் மற்றும் நெல் வளரிடம் போன்ற ஆழமற்ற பகுதியில் தேங்கி நிற்கும் தெளிவான நீரில் வாழ்கின்றது. [2] [13] [14] [15]. இப்பகுதிகளில் பொதுவாக நீர்நிலைகளில் காணப்படும் தாவரங்களும், அவை நீரில் மூழ்கியோ அல்லது கரைகளில் இருந்து படர்பவையாக உள்ளன. இந்நீர் நிலைகளின் அடிப்பகுதியானது மணல், சேறு நிறைந்த பகுதிகளாக, மெல்லிய கூழாங்கற்கள் அல்லது சரளைகள் நிறைந்த பகுதியாக உள்ளன. பங்களாதேஷ் மற்றும் இந்திய பெரும்பகுதி முழுவதும் வரிக்குதிரை மீனின் பரவலின் அடிப்படையில் இவை வாழும் வாழிட நீரின் கார அமிலத்தனமையானது ஓரளவு நடுநிலையாகவும், வெப்பநிலையானது பெரும்பாலும் 16.5 லிருந்து 34 டிகிரி செண்டிகிரேடாகவும் உள்ளது. [16] வழக்கத்திற்கு மாறாக 12.3 டிகிரி செண்டிகிரேடு குளிர்ப்பகுதியிலும், 38.6 டிகிரி செண்டிகிரேடு வெப்பப்பகுதியிலும் காணப்பட்ட வரிக்குதிரை மீன், இத்தகைய பகுதியிலும் சாதாரணமாகவே வாழ்கின்றன. வழக்கத்திற்கு மாறாக குளிர்ந்த வெப்பநிலை நிலவும் கடல் மட்டத்திலிருந்து 1,576 மீ மற்றும் 1,795 மீ உயர்ந்த இடங்களிலும் வரிக்குதிரை மீன்கள் வாழிடமாக பதிவு செய்யப்பட்டுள்ளன.
வரிக்குதிரை மீன் என்ற பெயரானது இம்மீனின் உடலின் ஐந்து சீரான, கிடைமட்ட, நீல நிற கோடுகள் வரிக்குதிரையின வரிகளை நினைவூட்டுவதால் சூட்டப்பட்டது, மேலும் இந்த வரிகள் வால் துடுப்பின் இறுதி வரை நீட்டிக்கப்பட்டுள்ளன. இந்த மீனின் வடிவமானது முன் பின் பகுதிகளில் குறுகி பக்கவாட்டில் சுருக்கி காணப்படுகிறது. இம்மீன் வாயானது மேல்நோக்கி இயங்கும் வகையில் அமைக்கப்பட்டுள்ளது. ஆண் மீனது டார்பிடோ எனப்படும் நீர்மூழ்கி குண்டு வடிவிலானது. நீல நிற கோடுகளுக்கு இடையில் தங்கக் நிறக்கோடுகள் உள்ளன. பெண் மீனானது பெரிய, வெண்மையான வயிற்றுப் பகுதியினையும், தங்கநிற கோடுகளுக்குப் பதிலாக வெள்ளி கோடுகள் உள்ளன. முதிர்வடைந்த பெண் மீனில் மலப்புழைத் துடுப்பிற்கு முன்னால் ஒரு சிறிய இனப்பெருக்க அரும்பு காணப்படுகிறது. வரிக்குதிரை மீனானது 4 முதல் 5 செமீ நீளம் வரை வளரும் தன்மையுடையது,[11] இருப்பினும் இவற்றின் நீளம் பொதுவாக 1.8–3.7 செமீ வரை காணப்படுகின்றன. வாழிடத்தினைப் பொறுத்து மீனின் நீளத்தில் சில மாறுபாடுகளுடன் காணப்படும். பொதுவாக முறைப்படுத்தப்பட்ட வாழிடச் சூழலில் இம்மீனின் ஆயுட்காலம் சுமார் இரண்டு முதல் மூன்று ஆண்டுகள் ஆகும், இருப்பினும் சிறந்த சூழலில் வாழும் போது இது ஐந்து ஆண்டுகளுக்கு மேல் நீட்டிக்கப்படலாம். பொதுவாக இயற்சூழலில் ஒரு வருடம் மட்டுமே வாழும் இனமாக அறியப்படுகிறது. [1]
2015 ஆம் ஆண்டில், நிகழ்வு நினைவாற்றல் திறன் குறித்து வரிக்குதிரை மீனில் மேற்கொள்ளப்பட்ட ஆய்வின் முடிவுகள் வெளியிடப்பட்டன. வாழிடச் சூழ்நிலையில், பொருள்கள், இருப்பிடங்கள் மற்றும் சந்தர்ப்பங்கள் (என்ன, எப்போது, எங்கே) போன்ற நிலைகளை நினைவில் வைக்கும் திறனை வரிக்குதிரை மீன் கொண்டிருப்பது அறியப்பட்டது. எபிசோடிக் நினைவகம் என்பது வெளிப்படையான நினைவக அமைப்புகளின் திறன் ஆகும், இது பொதுவாக அனுபவ உணர்நிலையுடன் தொடர்புடையது . [17]
டேனியோ ரியோவின் தலைமுறை காலம் சராசரியாக மூன்று மாதங்கள் ஆகும். அண்டவிடல் மற்றும் சினைவிடல் ஏற்பட ஒரு ஆண் மீன் துணை இருக்க வேண்டும். இரண்டு முதல் மூன்று நாட்கள் இடைவெளியில் பெண் மீன்கள் திரள் திரளாக நூற்றுக்கணக்கான முட்டைகளை இடுகின்றன. முட்டையிடப்பட்டவுடன் கரு வளர்ச்சி தொடங்குகிறது; விந்தணு இல்லாததால், ஓரிரு செல் பிரிவுகளுக்குப் பிறகு வளர்ச்சி நிறுத்தப்படும். கருவுற்ற முட்டைகள் உடனடியாக ஒளிஊடுரும் தன்மையுடையதாக மாறுகின்றன. இப்பண்பானது டே. ரியோவை ஆய்விற்கு ஏற்ற மாதிரி இனமாக மாற்றுகிறது.
வரிக்குதிரை மீனில் கருவளர்ச்சியானது வேகமாக நிகழ்வதால், கருத்தரித்த 36 மணி நேரத்திற்குள் அனைத்து முக்கிய உறுப்புகளும் தோன்றுகின்றன. கருவானது கருவுணவு மேல் ஒரு பெரிய செல்லாக தொடங்குகிறது (படம், 0 மணி நேரம், பார்க்கவும்), இது இரண்டு இரண்டாக பிரிந்து (0.75 மணி நேரம்) பிரிகிறது, இதனால் ஆயிரக்கணக்கான சிறிய செல்கள் (3.25 மணி நேரம்) தோன்றுகின்றன. செல்கள் கருவுணவு பக்கம் (8 மணி நேரம்) இடம்பெயர்ந்து தலை மற்றும் வால் (16 மணி நேரம்) உருவாகத் தொடங்குகின்றன. பின்னர் வால் வளர்ந்து உடலில் இருந்து பிரிக்கிறது (24 மணி நேரம். முதல் சில நாட்களில் (72 மணி நேரம்) முதிர்ச்சியடையும் போது மீன் கருவுணவினைப் பயன்படுத்துவதால், கருவானது காலப்போக்கில் சுருங்குகிறது. சில மாதங்களுக்குப் பிறகு, வளர்ச்சியடைந்த மீன் இனப்பெருக்க முதிர்ச்சிஅடைகிறது.
மீன்வளர்ப்பில் சினைவிடுதலை ஊக்குவிக்க, சில ஆராய்ச்சியாளர்கள் மீன் தொட்டியின் அடிப்பகுதியில் சாய்வான அமைப்பினை பொருத்துகின்றனர். இது ஆற்றின் அடிப்பகுதியினை உருவகப்படுத்துவதாக அமைகிறது. மேலும் இது தொட்டியின் ஆழத்தினைக் குறைக்கிறது. வரிக்குதிரை மீனானது சர்க்காடியன் ரிதம் எனப்படும் நாள்சாரி சீரியக்கத்தின் காரணமாக காலையில் சினைவிடுதலை மேற்கொள்கிறது. ஆராய்ச்சியாளர்கள் இதனைப் பயன்படுத்தி 10 நிமிடங்களில் 10,000 கருக்களை சேகரிக்கின்றனர். ஆண் வரிக்குதிரை மீனானது பெண் மீனின் மீது காணப்படும் கோடுகள் அடிப்படையில் தேர்ந்தெடுத்து புணர்வதாக அறியப்பட்டாலும், கூட்டமாக பெண் மீன்கள் காணப்படும் போது இத்தகைய தேர்வினை மேற்கொள்ளாமல் பெண் மீன்களுடன் இணை சேர்கின்றன. பெண்களை ஈர்க்கும் விஷயங்கள் தற்போது முழுவதும் புலனாகவில்லை. நீர்காட்ட்சித் தொட்டிகளில் காணப்படும் தாவரங்கள் சினைவிடுதலை ஊக்குவிக்கிறது. நெகிழித் தாவரங்கள் கூட இச்செயலை செய்வதாக அறியப்படுகிறது
நெகிழியில் காணப்படும் செறிவூட்டப்பட்ட டை சோனைல் தாலேட் மீன் வாழிடச்சூழலை மாசுபடுத்துவதால், இம்மீனின் இனப்பெருக்க கார்மோன்களை பாதிப்பதால், இனப்பெருக்க செயல்பாட்டினை பாதிக்கின்றது. இந்த விளைவில் ஆண் பெண் மீன்களிடையா தாக்கம் வேறுபாடுடன் காணப்படுகின்றது. [18]
வரிக்குதிரை மீன் அனைத்துண்ணி, வகையைச் சார்ந்ததாகும். இவற்றின் முதன்மையாக உணவாக விலங்கு மிதவை உயிரிகளும், தாவர மிதவை உயிரிகளும், பூச்சிகள் மற்றும் பூச்சிகளின் இளம் உயிர்களும் உள்ளன. இருப்பினும் புழுக்கள் மற்றும் சிறிய ஓடுடைய கணுக்காலிகளை இதன் விருப்ப உணவு உடனடியாக கிடைக்காத காலங்களில் உண்ணுகின்றன. [15]
ஆய்வகங்களில் முதிர்வடைந்த வரிக்குதிரை மீன்களுக்கு ஆர்டிமியா எனப்படும் உப்பு இறால் அல்லது பரமேசியாவால் வழங்கப்படுகிது . [19]
வரிக்குதிரைமீனானது இயற்வேதி காரணிகளை தாங்கி வளரக்கூடிய மீனாகையால், தொடக்கநிலை நீர்வாழ் வளர்ப்பவர்களுக்கு ஏற்றதாக உள்ளது. வரிக்குதிரை மீனின் அழகு, அவற்றின் விளையாட்டுத்தனம் , விரைவான இனப்பெருக்கம், குறைவான விலை காரணமாக் இம்மீன்கள் பரவலாக கிடைக்கின்றன. கூட்டமாக காணப்படும் இம்மீன்கள் இதர மீன்களுடன் நன்றாக தொடர்பு கொள்கின்றன. எனினும். இம்மீன்கள் ஓடினியம் அல்லது வெல்வெட் நோய், மைக்ரோஸ்போரிடியா (சூடோலோமா நியுரோபிலா), மற்றும் மைக்ரோபாக்டீரியம் பாக்டீரிய இனங்களால் பாதிப்படைகின்றன. பெரிய மீன்கள் இளம் குஞ்சுகளை சாப்பிடுவதால், இனக்குழுக்களை வலை, இனப்பெருக்க பெட்டி அல்லது தனி தொட்டியினைப் பயன்படுத்தி பிரிப்பதன் மூலம் பாதுகாக்கலாம். இயற் வாழிடச்சூழலில் வரிக்குதிரை மீன் சுமார் நாற்பத்திரண்டு மாதங்கள் வாழ்கிறது. இச்சூழலில் ஒருசில மீன்களில் வளைந்த முதுகெலும்பை உருவாகிறது. [20]
வரிக்குதிரை டேனியோ மரபணு மாற்றப்பட்ட மீன்களை தயாரிக்கவும் பயன்படுத்தப்பட்டது மற்றும் முதன்முதலாக வணிக ரீதியாக விற்பனைக்கு வந்த இனமாக குளோஃபிஷ் (ஒளிரும் வண்ண மீன்) உள்ளது.
2003 இன் பிற்பகுதியில், பச்சை, சிவப்பு மற்றும் மஞ்சள் ஒளிரும் புரதங்களை வெளிப்படுத்தும் மரபணு மாற்றப்பட்ட வரிக்குதிரை மீன் வணிக ரீதியாகக் விற்பனைக்கு வந்தன. இத்தகைய ஒளிரும் நிறமுடைய மீன்கள் குளோஃபிஷ் என வர்த்தகரீதியாக பெயரிடப்பட்டன. வளர்ப்பில் உள்ள பிற வகைகளாக "தங்கம்", "மணல்", "நீண்ட துடுப்பு" மற்றும் "சிறுத்தை" முதலியன அடங்கும்.
முன்பு டேனியோ பிரான்கி என அறியப்பட்ட சிறுத்தை டேனியோ புள்ளிகளுடன் கூடிய நிறம் தோற்றரு நிறமி பிறழ்வு காரணமாக ஏற்பட்ட வரிக்குதிரை மீனாகும். [21] மீன் அருங்காட்சியக வர்த்தக நோக்கத்திற்காக தேர்ந்தெடுத்த இனக்கலப்பின் மூலம், வரிக்குதிரை மற்றும் சிறுத்தை வடிவத்தின் மஞ்சள் நிற சாந்திஸ்டிக் வடிவங்கள் பெறப்பட்டுள்ளன.
மரபணு மாற்றம் மற்றும் திடீர்மாற்ற முறையில் தோற்றுவிக்கப்பட்ட வரிக்குதிரை மீனின் பல்வேறு வகைகள் சீனா ஜீப்ராஃபிஷ் வள மையத்தில் (CZRC) சேமிக்கப்பட்டுள்ளன. இந்த அமைப்பானது சீனாவின் அறிவியல் மற்றும் தொழில்நுட்ப அமைச்சகம் மற்றும் சீன அறிவியல் கல்விக்குழுமத்தினால் கூட்டாக ஆரம்பிக்கப்பட்டது.
ஜீப்ரா மீன் தகவல் வலையமைப்பு ( ZFIN ) யில் பட்டியலிடப்பட்டுள்ள டே ரெரிரோ வில் தற்போதுவரை அறியப்பட்ட இயற்-வகைகள் கீழே தரப்பட்டுள்ளன.[22]
டேனியீ இனங்களிடையே கலப்புச் செய்து பெறப்பட்ட மீன்கள் இனப்பெருக்க தன்மையுடையுதாக உள்ளன. எடுத்துக்காட்டாக டேனியோ ரேரியோ இனத்திற்கும் டேனியோ நைக்ரோபேசியாட்டஸ் இனத்திற்கு இடையே கலப்புச் செய்யப்பட்டு தோற்றுவிக்கப்பட்ட இனம். [23]
டே. ரியோ என்பது முதுகெலும்பு வளர்ச்சி மற்றும் மரபணு செயல்பாடு பற்றிய ஆய்வுகளுக்கான பொதுவான மற்றும் பயனுள்ள அறிவியல் மாதிரி உயிரினமாகும் ஒரு ஆய்வக விலங்காக அதன் பயன்பாட்டின் முன்னோடி ஆய்வு அமெரிக்க மூலக்கூறு உயிரியலாளர் ஜார்ஜ் ஸ்ட்ரைசிங்கர் மற்றும் அவரது சகாக்கள் 1970 மற்றும் 1980 களில் ஒரேகான் பல்கலைக்கழகத்தில் மேற்கொள்ளப்பட்டது. ஸ்ட்ரைசிங்கர்ன் வரிக்குதிரை மீன் நகல் முதன்முதலாக வெற்றிகரமாக உருவாக்கப்பட்ட முதுகெலும்பு உயிரி நகலாகும். [24] இதன் முக்கியத்துவம் பெரிய அளவிலான முன்னோக்கிய மரபணு தேர்ந்தெடுப்பில் பயன்படுகிறது. ஜீப்ராஃபிஷ் தகவல் வலையமைப்பு (ZFIN) என்ற பிரத்யேக நிகழ்நிலை (ஆன்லைன்) தரவுத்தளத்தில் இம்மீன் குறித்த மரபணு, வளர்ச்சி தரவுகள் உள்ளன. ஜீப்ராஃபிஷ் சர்வதேச வள மையம் (ZIRC) என்பது ஒரு வரிக்குதிரை குறித்த மரபணு வளர் களஞ்சியமாகும். இதில் 29,250 இணைமரபணுக்கள் (அல்லீல்கள்) ஆராய்ச்சி சமூகத்திற்கு கிடைக்கிறது. விண்வெளிக்கு அனுப்பப்பட்ட சில மீன் வகைகளில் டே. ரியோவும் ஒன்றாகும்.
டே. ரியோவுடனான ஆராய்ச்சி வளர்ச்சி உயிரியலில், புற்றுநோயியல், நச்சுயியல், இனப்பெருக்க ஆய்வுகள், பேரூரு அறிவியல்(டெரடாலஜி), மரபியல், நரம்பியல், சுற்றுச்சூழல் அறிவியல், தண்டு செல் ஆராய்ச்சி, மீளுருவாக்க மருத்துவம், தசைசிதைவு நோய் பரிணாமக் கோட்பாடு . முதலிய துறைகளில் முன்னேற்றம் கண்டுள்ளது. [25]
ஒரு மாதிரி உயிரி அமைப்பாக, வரிக்குதிரை மீன் விஞ்ஞானிகளுக்கு ஏராளமான நன்மைகளை செய்துள்ளது. இதன் மரபணு முழுமையாக வரிசைப்படுத்தப்பட்டுள்ளது, மேலும் இது நன்கு புரிந்து கொள்ளப்பட்ட, எளிதில் கவனிக்கக்கூடிய மற்றும் சோதனைக்குரிய வளர்ச்சி நடத்தைகளைக் கொண்டுள்ளது. வேகமான கரு வளர்ச்சி, ஒப்பீட்டளவில் பெரிய கரு, வலுவான ஒளி ஊடுருவக்கூடியவையானது. மேலும் கருவானது, கருப்பைக்கு வெளியே எளிதில் வளரக்கூடியவையாகவும் உள்ளது.[26] மேலும், நன்கு அறியப்பட்ட திடீர்மாற்ற முறையில் தோற்றுவிக்கப்பட்ட மீன்களும் நடைமுறையில் கிடைக்கின்றன.
சாயமேற்றல் (உயிரியல்) தொழில்நுட்பங்களின் உதவியால், ஆரம்பகால வளர்ச்சியின் போது இதன் இரு செல் கருவை இணைத்து ஒரு செல் கருவாக ஒரு ஹோமோசைகஸ் கருவை உருவாக்கலாம். இது ஒரு முன்னோடி ஆய்வாக கருதப்படுகிறது. வரிக்குதிரை மீனின் ஒரு சில பண்புகள் பாலூட்டிகளின் பண்புகளை, குறிப்பாக நச்சுத்தன்மை சோதனை, பாலூட்டிகளின் தூக்க நடத்தையுடன் ஒத்துப் போவதால், மனித குலத்தில் மேற்கொள்ள வேண்டிய ஆய்விற்கு இம்மீன் உறுதுணையாக மாதிரியாக உள்ளது. [27] பொதுவான உணவு இம்மீன்களுக்கு இல்லாததால் உலகளவில் சிறந்த ஆராய்ச்சி மாதிரி வரிக்குதிரை மீனைப் பயன்படுத்த இயலவில்லை. [28] மேலும் மனித கோளாறுகள் தொடர்பான சில மரபணுக்களில் வரிக்குதிரை மீனுக்கும் பாலூட்டிகளுக்கும் இடையில் சிறிய ஆனால் முக்கியமான வேறுபாடுகள் உள்ளன. [29] [30]
இது மாதிரி மற்றும் தத்துவ ஆய்வுகளில் இதன் எளிய வடிவம் காரணமாக பயன்பாட்டில் உள்ளது (VEGFC உள்ள lymphangiogenesis).[31]
வரிக்குதிரை மீனின் இளம் உயிரிகளில் இதயம் மற்றும் பக்கவாட்டு கோடு முடி செல்களை மீண்டும் உருவாக்கும் திறன் கொண்டது. 2011 ஆம் ஆண்டில், பிரிட்டிஷ் ஹார்ட் பவுண்டேஷன் ஒரு விளம்பர பிரச்சாரத்தை நடத்தியது. இதன் நோக்கமானது மனிதர்களில் இந்த திறனை பொருந்தக்கூடியதாக மாற்றி அமைப்பதாகும். இதன் மூலம் ஆராய்ச்சி நிதியாக சுமார் 50 மில்லியன் பவுண்டினை திரட்டுவதாகும். [32] [33]
ஒளிஉணர் செல்கள் மற்றும் விழித்திரை நியூரான்களில் பாதிப்பு ஏற்படும் போதுமுல்லர் க்ளியாவில் நிகழும் மாறுபாடடைதல் மற்றும் பெருக்கத்தால் சரிசெய்யப்படுகிறது. [34] ஆராய்ச்சியாளர்கள் திடீர்மாற்றத்தினை சோதிக்க முதுகுப்புற மற்றும் வயிற்றுப்புற வால் துடுப்பினை அடிக்கடி வெட்டி எடுத்து அதன் மூலம் ஏற்படும் மறுவளர்ச்சியினை சோதித்தனர். வரிக்குதிரை மினில் திசுநீக்கப்பட்ட இடத்தில் உள்ள செல்கள் தண்டு செல் போன்ற நிலைக்கு மாற அவ்விடத்தில் ஹிஸ்டோன் டிமெதிலேஷன் ஏற்படுவது கண்டறியப்பட்டது. [35] 2012 ஆம் ஆண்டில், ஆஸ்திரேலிய விஞ்ஞானிகள் வெளியிட்ட ஆய்வின் முடிவில், வரிக்குதிரை மீன்கள் ஃபைப்ரோபிளாஸ்ட் வளர்ச்சி காரணி என அழைக்கப்படும் ஒரு சிறப்பு புரதத்தைப் பயன்படுத்துவது கண்டறியப்பட்டது. இப்புரதம் முதுகெலும்பு காயத்திற்குப் பிறகு பளபளப்பான வடு இல்லாமல் குணமடைவதை உறுதிசெய்கின்றன. [36] கூடுதலாக, பின்புற பக்கவாட்டு கோட்டின் மயிர் செல்களளின் சேதம் அல்லது வளர்ச்சி சீர்குலைவை மீண்டும் உருவாக்குகின்றன. [37] [38] மீளுருவாக்கத்தின் போது மரபணு வெளிப்பாட்டின் ஆய்வு, இந்த செயல்பாட்டில் ஈடுபட்டுள்ள பல முக்கியமான சமிக்ஞை பாதைகளை அடையாளம் காண வாய்ப்பாக உள்ளது. (அதாவது Wnt சமிக்ஞை மற்றும் ஃபைப்ரோபிளாஸ்ட் வளர்ச்சி காரணி). [39]
நரம்பியக்கடத்தல் நோய்கள், இயக்கக் கோளாறுகள், மனநலக் கோளாறுகள் மற்றும் காது கேளாமை உள்ளிட்ட நரம்பு மண்டலத்தின் கோளாறுகளை ஆராய்வதில், ஆராய்ச்சியாளர்கள் வரிக்குதிரை மீன்களைப் பயன்படுத்தி, இந்த நிலைகளின் அடிப்படை மரபணு குறைபாடுகளில் மனித மூளை, முதுகெலும்பு மற்றும் உணர்ச்சி உறுப்புகளில் அசாதாரண செயல்பாடு ஆராயப்பட்டது. மனித தசைக்கூட்டு நோய்களான தசைநார் சிதைவு போன்ற சிக்கல்களின் புதிய நுண்ணறிவினைப்பெற ஆராய்ச்சியாளர்கள் வரிக்குதிரை மீன்களைப் பயன்படுத்துகின்றனர். [40] மேலும் வரிக்குதிரை மீனில், பலவகையான மனித புற்றுநோய்களுக்கு அடித்தளமாக இருக்கும் உயிரியல் சமிக்ஞையான ஹெட்ஜ்ஹாக் என்ற மரபணுவின் செயல்பாட்டினை கட்டுப்படுத்துவது என்பது குறித்தும் ஆய்வுகள் நடைபெறுகிறது.
வரிக்குதிரை மீனின் குறுகி வாழ்க்கைச் சுழற்சி காலம், ஒப்பீட்டளவில் அதிக அளவிலான கரு முட்டை வெளியீடு காரணமாக டே. ரியோ வினை மரபணு ஆய்வுகளுக்கு ஒரு பயனுள்ள மாதிரியாக தேர்ந்தெடுக்க வழிவகுத்துள்ளது. ஒரு பொதுவான பின்னோக்கிய மரபியல் நுட்பம், மரபணு வெளிப்பாட்டைக் குறைப்பது அல்லது மார்போலினோ எதிருணர்வு தொழில்நுட்பத்தைப் பயன்படுத்தி பிளவுகளை மாற்றுவது. மோர்போலினோ ஒலிகோணுக்ளியோடைடுகள் (MO) நிலையானவை, டி.என்.ஏ அல்லது ஆர்.என்.ஏ போன்ற அதே தளங்களைக் கொண்ட செயற்கை மேக்ரோமிகுலூல்கள் ; நிரப்பு ஆர்.என்.ஏ காட்சிகளுடன் பிணைப்பதன் மூலம், அவை குறிப்பிட்ட மரபணுக்களின் வெளிப்பாட்டைக் குறைக்கலாம் அல்லது ஆர்.என்.ஏவில் பிற செயல்முறைகள் ஏற்படுவதைத் தடுக்கலாம். 32 செல் கட்டத்திற்குப் பிறகு ஒரு கருவின் ஒரு கலத்தில் MO செலுத்தப்படலாம், அந்த கலத்திலிருந்து வந்த கலங்களில் மட்டுமே மரபணு வெளிப்பாட்டைக் குறைக்கிறது. இருப்பினும், ஆரம்பகால கருவில் உள்ள செல்கள் (32 க்கும் குறைவான செல்கள்) பெரிய மூலக்கூறுகளுக்கு ஒன்றிணைக்கக்கூடியவை, [41] [42] செல்கள் இடையே பரவலை அனுமதிக்கிறது. ஜீப்ராஃபிஷில் மோர்போலினோஸைப் பயன்படுத்துவதற்கான வழிகாட்டுதல்கள் பொருத்தமான கட்டுப்பாட்டு உத்திகளை விவரிக்கின்றன. [43] ஒன்று அல்லது இரு கரு செல் நிலையில் 500 பிகோ லிட்டர் மோர்போலினோஸ் செலுத்தப்படுகிறது. மோர்போலினோ கருவின் பெரும்பாலான செல்களை ஒருங்கிணைக்க முடிகிறது. [44]
ஜீப்ராஃபிஷில் மரபணுக்களின் செயல்பாட்டைப் படிப்பதற்கான ஒரு பிரபலமான அணுகுமுறையே டிரான்ஸ்ஜெனெஸிஸ் ஆகும். டோல் 2 டிரான்ஸ்போசன் முறையைப் பயன்படுத்தி ஒரு முறையால் டிரான்ஸ்ஜெனிக் ஜீப்ராஃபிஷை உருவாக்குவது எளிதானது. [45]
மெலனோமா, லுகேமியா, கணைய புற்றுநோய் மற்றும் ஹெபடோசெல்லுலர் கார்சினோமா உள்ளிட்ட புற்றுநோய் ஆராய்ச்சிக்கான மரபணு மாற்ற உயிரியாக பல வகையான மரபணு மாற்றப்பட்ட வரிக்குதிரை மீனினங்கள் உற்பத்திச் செய்யப்பட்டுள்ளன. . [46] [47] ஜீப்ரா பிறழ்வுக்குள்ளான BRAF அல்லது NRAS எந்தவொருவரின் வடிவங்களையே குறிப்பிடும் ஆன்கோஜீன்களின் ஒரு பி 53 குறைபாடு பின்னணி மீது வைக்கப்படும் போது மெலனோமா உருவாக்க. வரலாற்று ரீதியாக, இந்த கட்டிகள் மனித நோயை வலுவாக ஒத்திருக்கின்றன, முழுமையாக இடமாற்றம் செய்யக்கூடியவை, மற்றும் பெரிய அளவிலான மரபணு மாற்றங்களை வெளிப்படுத்துகின்றன. BRAF மெலனோமா மாதிரி நேச்சர் இதழில் மார்ச் 2011 இல் வெளியிடப்பட்ட இரண்டு திரைகளுக்கான தளமாக பயன்படுத்தப்பட்டது. ஒரு ஆய்வில், மனித மெலனோமாவில் பெருக்கப்பட்டு அதிகமாக வெளிப்படுத்தப்படும் மரபணுக்களின் செயல்பாட்டு முக்கியத்துவத்தைப் புரிந்துகொள்ள ஒரு கருவியாக இந்த மாதிரி பயன்படுத்தப்பட்டது. [48] ஒரு மரபணு, SETDB1, ஜீப்ராஃபிஷ் அமைப்பில் கட்டி உருவாவதை குறிப்பிடத்தக்க வகையில் துரிதப்படுத்தியது, இது ஒரு புதிய மெலனோமா ஆன்கோஜீனாக அதன் முக்கியத்துவத்தை நிரூபிக்கிறது. இது குறிப்பாக குறிப்பிடத்தக்கதாக இருந்தது, ஏனெனில் SETDB1 எபிஜெனெடிக் ஒழுங்குமுறையில் ஈடுபடுவதாக அறியப்படுகிறது, இது கட்டி உயிரணு உயிரியலுக்கு மையமாக இருப்பதைப் பாராட்டுகிறது.
மற்றொரு ஆய்வில், ஒரு வேதியியல் ஸ்கிரீனிங் அணுகுமுறையைப் பயன்படுத்தி கட்டியின் தோற்றம் நரம்பியல் முகடு கலத்தில் இருக்கும் மரபணு நிரலை சிகிச்சை முறையில் குறிவைக்கும் முயற்சி மேற்கொள்ளப்பட்டது. [49] DHODH புரதத்தின் (லெஃப்ளூனோமைடு எனப்படும் ஒரு சிறிய மூலக்கூறு மூலம்) ஒரு தடுப்பு நரம்பியல் முகடு ஸ்டெம் செல்களை உருவாக்குவதைத் தடுத்தது, இது இறுதியில் டிரான்ஸ்கிரிப்ஷனல் நீட்டிப்பு செயல்முறையில் தலையிடுவதன் மூலம் மெலனோமாவை உருவாக்குகிறது. இந்த அணுகுமுறை ஒற்றை மரபணு மாற்றத்தை விட மெலனோமா கலத்தின் "அடையாளத்தை" குறிவைப்பதை நோக்கமாகக் கொண்டிருப்பதால், லெஃப்ளூனோமைடு மனித மெலனோமாவுக்கு சிகிச்சையளிப்பதில் பயன்பாட்டைக் கொண்டிருக்கலாம். [50]
இருதய ஆராய்ச்சியில், இரத்த உறைவு, இரத்த நாளங்களின் வளர்ச்சி, இதய செயலிழப்பு மற்றும் பிறவி இதயம் மற்றும் சிறுநீரக நோய் உள்ளிட்ட ஆய்வுகளில் வரிக்குதிரை மீன் பயன்படுத்தப்படுகிறது. [51]
கடுமையான அழற்சி பற்றிய ஆராய்ச்சியின் திட்டங்களில், பல நோய்களில் ஒரு முக்கிய அடிப்படை செயல்முறை, ஆராய்ச்சியாளர்கள் ஒரு ஜீப்ராஃபிஷ் மாதிரியின் அழற்சியின் மாதிரியை நிறுவியுள்ளனர், மேலும் அதன் தீர்மானமும். இந்த அணுகுமுறை வீக்கத்தின் மரபணு கட்டுப்பாடுகள் மற்றும் புதிய மருந்துகளை அடையாளம் காணும் சாத்தியம் பற்றிய விரிவான ஆய்வை அனுமதிக்கிறது. [52]
தசைநார் டிஸ்டிரோபிஸ் (எம்.டி) என்பது தசை பலவீனம், அசாதாரண சுருக்கங்கள் மற்றும் தசை விரையத்தை ஏற்படுத்தும் மரபணு கோளாறுகளின் ஒரு பன்முகத்தன்மை கொண்ட குழு ஆகும், இது பெரும்பாலும் முன்கூட்டிய மரணத்திற்கு வழிவகுக்கிறது. ஜீப்ராஃபிஷ் தசைநார் டிஸ்டிரோபிகளைப் படிக்க மாதிரி உயிரினமாக பரவலாகப் பயன்படுத்தப்படுகிறது. [53] எடுத்துக்காட்டாக, சாப்ஜே ( சாப் ) விகாரி என்பது மனித டுச்சேன் தசைநார் டிஸ்டிராபியின் (டி.எம்.டி) ஜீப்ராஃபிஷ் ஆர்தோலோக் ஆகும். [54] மயூகோனிக் டிஸ்ட்ரோபி வகை 1 (டிஎம் 1) நோய்க்கிரும வளர்ச்சியில், மாற்று பிளவுபடுத்தும் காரணியான எம்பிஎன்எல்லின் பங்கை தீர்மானிக்க மச்சுக்கா-டிஸிலி மற்றும் சக ஊழியர்கள் ஜீப்ராஃபிஷைப் பயன்படுத்தினர். [55] மிக சமீபத்தில், டாட் மற்றும் பலர். டி.எம் 1 நோயின் ஆரம்ப வளர்ச்சியின் போது சி.யு.ஜி மீண்டும் வெளிப்பாட்டின் தாக்கத்தை ஆராய வடிவமைக்கப்பட்ட புதிய ஜீப்ராஃபிஷ் மாதிரியை விவரித்தார். [56] மனித லேமினின் α2 (LAMA2) மரபணுவில் பிறழ்வால் ஏற்படும் சிஎம்டி வகை 1 ஏ (சிஎம்டி 1 ஏ) உள்ளிட்ட பிறவி தசைநார் டிஸ்டிராபிகளைப் படிப்பதற்கான ஒரு சிறந்த விலங்கு மாதிரியும் ஜீப்ராஃபிஷ் ஆகும். [57] ஜீப்ராஃபிஷ், மேலே விவாதிக்கப்பட்ட நன்மைகள் மற்றும் குறிப்பாக ரசாயனங்களை உறிஞ்சுவதற்கான ஜீப்ராஃபிஷ் கருக்களின் திறன் ஆகியவற்றின் காரணமாக, தசைநார் சிதைவுகளுக்கு எதிராக புதிய மருந்துகளைத் திரையிடுவதிலும் சோதனை செய்வதிலும் ஒரு தேர்வு மாதிரியாக மாறியுள்ளது. [58]
சிற்றின குறிப்பு
வரிக்குதிரை மீன் அல்லது ஜீப்ரா பிஸ் (டேனியோ ரியோ ) என்பது சைப்ரினிஃபார்ம்ஸ் வரிசையில் மினோ குடும்பத்தைச் சார்ந்த ( சைப்ரினிடே ) நன்னீரீல் வாழக்கூடிய மீன் வகையாகும் . தெற்காசியாவை பூர்வீகமாகக் கொண்ட இந்த மீன் மிக பிரபலமானதாகும். இம்மீனாது பரவலாக ஜீப்ரா டேனியோ என்ற வர்த்தக பெயரில் விற்கப்படுகிறது. இம்மானனது வெப்பமண்டல மற்றும் மித வெப்பமண்டலங்கள் பகுதிகளில் காணப்பட்டாலும் " வெப்பமண்டல மீன்" என்று அறியப்படுகிறது. வரிக்குதிரை மீனானது அறிவியல் ஆய்வுகளில் முக்கியமாக பயன்படுத்தப்படும் முதுகெலும்பு மாதிரி உயிரினமாகும். குறிப்பாக புதிய மருந்து உருவாக்கம், ஒரு மருந்தானது மக்கள் பயன்பாட்டிற்கு வருவதற்கான முன் பயன்பாட்டுச் சோதனைகளில் அதிக அளவில் பயன்பாட்டில் உள்ளது. இம்மீனின் மீளுருவாக்கம் திறன் இங்கு குறிப்பிடத்தக்கதாகும், மேலும் உயிரிதொழில்நுட்ப ஆய்வாளர்கள் மரபணு மாற்றப்பட்ட வகைகளை உருவாக்கியுள்ளனர்
The zebrafish (Danio rerio) is a freshwater fish belonging to the minnow family (Cyprinidae) of the order Cypriniformes. Native to South Asia, it is a popular aquarium fish, frequently sold under the trade name zebra danio[2] (and thus often called a "tropical fish" although both tropical and subtropical). It is also found in private ponds.
The zebrafish is an important and widely used vertebrate model organism in scientific research, for example in drug development, in particular pre-clinical development.[3] It is also notable for its regenerative abilities,[4] and has been modified by researchers to produce many transgenic strains.[5][6][7]
The zebrafish is a derived member of the genus Brachydanio, of the family Cyprinidae. It has a sister-group relationship with Danio aesculapii.[8] Zebrafish are also closely related to the genus Devario, as demonstrated by a phylogenetic tree of close species.[9]
The zebrafish is native to fresh water habitats in South Asia where it is found in India, Pakistan, Bangladesh, Nepal and Bhutan.[1][10][11][12] The northern limit is in the South Himalayas, ranging from the Sutlej river basin in the Bangladesh–India border region to the state of Arunachal Pradesh in northeast Indian.[1][11] Its range is concentrated in the Ganges and Brahmaputra River basins, and the species was first described from Kosi River (lower Ganges basin) of India. Its range further south is more local, with scattered records from the Western and Eastern Ghats regions.[12][13][14] It has frequently been said to occur in Myanmar (Burma), but this is entirely based on pre-1930 records and likely refers to close relatives only described later, notably Danio kyathit.[12][15][16][17] Likewise, old records from Sri Lanka are highly questionable and remain unconfirmed.[15]
Zebrafish have been introduced to California, Connecticut, Florida and New Mexico in the United States, presumably by deliberate release by aquarists or by escape from fish farms. The New Mexico population had been extirpated by 2003 and it is unclear if the others survive, as the last published records were decades ago.[18] Elsewhere the species has been introduced to Colombia and Malaysia.[11][19]
Zebrafish typically inhabit moderately flowing to stagnant clear water of quite shallow depth in streams, canals, ditches, oxbow lakes, ponds and rice paddies.[12][13][19][20] There is usually some vegetation, either submerged or overhanging from the banks, and the bottom is sandy, muddy or silty, often mixed with pebbles or gravel. In surveys of zebrafish locations throughout much of its Bangladeshi and Indian distribution, the water had a near-neutral to somewhat basic pH and mostly ranged from 16.5 to 34 °C (61.7–93.2 °F) in temperature.[12][13][21] One unusually cold site was only 12.3 °C (54.1 °F) and another unusually warm site was 38.6 °C (101.5 °F), but the zebrafish still appeared healthy. The unusually cold temperature was at one of the highest known zebrafish locations at 1,576 m (5,171 ft) above sea level, although the species has been recorded to 1,795 m (5,889 ft).[12][13]
The zebrafish is named for the five uniform, pigmented, horizontal, blue stripes on the side of the body, which are reminiscent of a zebra's stripes, and which extend to the end of the caudal fin. Its shape is fusiform and laterally compressed, with its mouth directed upwards. The male is torpedo-shaped, with gold stripes between the blue stripes; the female has a larger, whitish belly and silver stripes instead of gold. Adult females exhibit a small genital papilla in front of the anal fin origin. The zebrafish can reach up to 4–5 cm (1.6–2.0 in) in length,[16] although they typically are 1.8–3.7 cm (0.7–1.5 in) in the wild with some variations depending on location.[13] Its lifespan in captivity is around two to three years, although in ideal conditions, this may be extended to over five years.[20][22] In the wild it is typically an annual species.[1]
In 2015, a study was published about zebrafishes' capacity for episodic memory. The individuals showed a capacity to remember context with respect to objects, locations and occasions (what, when, where). Episodic memory is a capacity of explicit memory systems, typically associated with conscious experience.[23]
The Mauthner cells integrate a wide array of sensory stimuli to produce the escape reflex. Those stimuli are found to include the lateral line signals by McHenry et al. 2009 and visual signals consistent with looming objects by Temizer et al. 2015, Dunn et al. 2016, and Yao et al. 2016.[24]
The approximate generation time for Danio rerio is three months. A male must be present for ovulation and spawning to occur. Zebrafish are asynchronous spawners[25] and under optimal conditions (such as food availability and favorable water parameters) can spawn successfully frequently, even on a daily basis.[26] Females are able to spawn at intervals of two to three days, laying hundreds of eggs in each clutch. Upon release, embryonic development begins; in absence of sperm, growth stops after the first few cell divisions. Fertilized eggs almost immediately become transparent, a characteristic that makes D. rerio a convenient research model species.[20] Sex determination of common laboratory strains was shown to be a complex genetic trait, rather than to follow a simple ZW or XY system.[27]
The zebrafish embryo develops rapidly, with precursors to all major organs appearing within 36 hours of fertilization. The embryo begins as a yolk with a single enormous cell on top (see image, 0 h panel), which divides into two (0.75 h panel) and continues dividing until there are thousands of small cells (3.25 h panel). The cells then migrate down the sides of the yolk (8 h panel) and begin forming a head and tail (16 h panel). The tail then grows and separates from the body (24 h panel). The yolk shrinks over time because the fish uses it for food as it matures during the first few days (72 h panel). After a few months, the adult fish reaches reproductive maturity (bottom panel).
To encourage the fish to spawn, some researchers use a fish tank with a sliding bottom insert, which reduces the depth of the pool to simulate the shore of a river. Zebrafish spawn best in the morning due to their Circadian rhythms. Researchers have been able to collect 10,000 embryos in 10 minutes using this method.[28] In particular, one pair of adult fish is capable of laying 200–300 eggs in one morning in approximately 5 to 10 at time.[29] Male zebrafish are furthermore known to respond to more pronounced markings on females, i.e., "good stripes", but in a group, males will mate with whichever females they can find. What attracts females is not currently understood. The presence of plants, even plastic plants, also apparently encourages spawning.[28]
Exposure to environmentally relevant concentrations of diisononyl phthalate (DINP), commonly used in a large variety of plastic items, disrupt the endocannabinoid system and thereby affect reproduction in a sex-specific manner.[30]
Zebrafish are omnivorous, primarily eating zooplankton, phytoplankton, insects and insect larvae, although they can eat a variety of other foods, such as worms and small crustaceans, if their preferred food sources are not readily available.[20]
In research, adult zebrafish are often fed with brine shrimp, or paramecia.[31]
Zebrafish are hardy fish and considered good for beginner aquarists. Their enduring popularity can be attributed to their playful disposition,[32] as well as their rapid breeding, aesthetics, cheap price and broad availability. They also do well in schools or shoals of six or more, and interact well with other fish species in the aquarium. However, they are susceptible to Oodinium or velvet disease, microsporidia (Pseudoloma neurophilia), and Mycobacterium species. Given the opportunity, adults eat hatchlings, which may be protected by separating the two groups with a net, breeding box or separate tank. In captivity, zebrafish live approximately forty-two months. Some captive zebrafish can develop a curved spine.[33]
The zebra danio was also used to make genetically modified fish and were the first species to be sold as GloFish (fluorescent colored fish).
In late 2003, transgenic zebrafish that express green, red, and yellow fluorescent proteins became commercially available in the United States. The fluorescent strains are tradenamed GloFish; other cultivated varieties include "golden", "sandy", "longfin" and "leopard".
The leopard danio, previously known as Danio frankei, is a spotted colour morph of the zebrafish which arose due to a pigment mutation.[34] Xanthistic forms of both the zebra and leopard pattern, along with long-finned strains, have been obtained via selective breeding programs for the aquarium trade.[35]
Various transgenic and mutant strains of zebrafish were stored at the China Zebrafish Resource Center (CZRC), a non-profit organization, which was jointly supported by the Ministry of Science and Technology of China and the Chinese Academy of Sciences.
The Zebrafish Information Network (ZFIN) provides up-to-date information about current known wild-type (WT) strains of D. rerio, some of which are listed below.[36]
Hybrids between different Danio species may be fertile: for example, between D. rerio and D. nigrofasciatus.[9]

D. rerio is a common and useful scientific model organism for studies of vertebrate development and gene function. Its use as a laboratory animal was pioneered by the American molecular biologist George Streisinger and his colleagues at the University of Oregon in the 1970s and 1980s; Streisinger's zebrafish clones were among the earliest successful vertebrate clones created.[37] Its importance has been consolidated by successful large-scale forward genetic screens (commonly referred to as the Tübingen/Boston screens). The fish has a dedicated online database of genetic, genomic, and developmental information, the Zebrafish Information Network (ZFIN). The Zebrafish International Resource Center (ZIRC) is a genetic resource repository with 29,250 alleles available for distribution to the research community. D. rerio is also one of the few fish species to have been sent into space.
Research with D. rerio has yielded advances in the fields of developmental biology, oncology,[38] toxicology,[29][39][40] reproductive studies, teratology, genetics, neurobiology, environmental sciences, stem cell research, regenerative medicine,[41][42] muscular dystrophies[43] and evolutionary theory.[9]
As a model biological system, the zebrafish possesses numerous advantages for scientists. Its genome has been fully sequenced, and it has well-understood, easily observable and testable developmental behaviors. Its embryonic development is very rapid, and its embryos are relatively large, robust, and transparent, and able to develop outside their mother.[44] Furthermore, well-characterized mutant strains are readily available.
Other advantages include the species' nearly constant size during early development, which enables simple staining techniques to be used, and the fact that its two-celled embryo can be fused into a single cell to create a homozygous embryo. The zebrafish is also demonstrably similar to mammalian models and humans in toxicity testing, and exhibits a diurnal sleep cycle with similarities to mammalian sleep behavior.[45] However, zebrafish are not a universally ideal research model; there are a number of disadvantages to their scientific use, such as the absence of a standard diet[46] and the presence of small but important differences between zebrafish and mammals in the roles of some genes related to human disorders.[47][48]
Zebrafish have the ability to regenerate their heart and lateral line hair cells during their larval stages.[49][50] The cardiac regenerative process likely involves signaling pathways such as Notch and Wnt; hemodynamic changes in the damaged heart are sensed by ventricular endothelial cells and their associated cardiac cilia by way of the mechanosensitive ion channel TRPV4, subsequently facilitating the Notch signaling pathway via KLF2 and activating various downstream effectors such as BMP-2 and HER2/neu.[51] In 2011, the British Heart Foundation ran an advertising campaign publicising its intention to study the applicability of this ability to humans, stating that it aimed to raise £50 million in research funding.[52][53]
Zebrafish have also been found to regenerate photoreceptor cells and retinal neurons following injury, which has been shown to be mediated by the dedifferentiation and proliferation of Müller glia.[54] Researchers frequently amputate the dorsal and ventral tail fins and analyze their regrowth to test for mutations. It has been found that histone demethylation occurs at the site of the amputation, switching the zebrafish's cells to an "active", regenerative, stem cell-like state.[55][56] In 2012, Australian scientists published a study revealing that zebrafish use a specialised protein, known as fibroblast growth factor, to ensure their spinal cords heal without glial scarring after injury.[4][57] In addition, hair cells of the posterior lateral line have also been found to regenerate following damage or developmental disruption.[50][58] Study of gene expression during regeneration has allowed for the identification of several important signaling pathways involved in the process, such as Wnt signaling and Fibroblast growth factor.[58][59]
In probing disorders of the nervous system, including neurodegenerative diseases, movement disorders, psychiatric disorders and deafness, researchers are using the zebrafish to understand how the genetic defects underlying these conditions cause functional abnormalities in the human brain, spinal cord and sensory organs.[60][61][62][63] Researchers have also studied the zebrafish to gain new insights into the complexities of human musculoskeletal diseases, such as muscular dystrophy.[64] Another focus of zebrafish research is to understand how a gene called Hedgehog, a biological signal that underlies a number of human cancers, controls cell growth.
Inbred strains and traditional outbred stocks have not been developed for laboratory zebrafish, and the genetic variability of wild-type lines among institutions may contribute to the replication crisis in biomedical research.[65] Genetic differences in wild-type lines among populations maintained at different research institutions have been demonstrated using both Single-nucleotide polymorphisms[66] and microsatellite analysis.[67]
Due to their fast and short life cycles and relatively large clutch sizes, D. rerio or zebrafish are a useful model for genetic studies. A common reverse genetics technique is to reduce gene expression or modify splicing using Morpholino antisense technology. Morpholino oligonucleotides (MO) are stable, synthetic macromolecules that contain the same bases as DNA or RNA; by binding to complementary RNA sequences, they can reduce the expression of specific genes or block other processes from occurring on RNA. MO can be injected into one cell of an embryo after the 32-cell stage, reducing gene expression in only cells descended from that cell. However, cells in the early embryo (less than 32 cells) are interpermeable to large molecules,[68][69] allowing diffusion between cells. Guidelines for using Morpholinos in zebrafish describe appropriate control strategies.[70] Morpholinos are commonly microinjected in 500pL directly into 1-2 cell stage zebrafish embryos. The morpholino is able to integrate into most cells of the embryo.[71]
A known problem with gene knockdowns is that, because the genome underwent a duplication after the divergence of ray-finned fishes and lobe-finned fishes, it is not always easy to silence the activity of one of the two gene paralogs reliably due to complementation by the other paralog.[72] Despite the complications of the zebrafish genome, a number of commercially available global platforms exist for analysis of both gene expression by microarrays and promoter regulation using ChIP-on-chip.[73]
The Wellcome Trust Sanger Institute started the zebrafish genome sequencing project in 2001, and the full genome sequence of the Tuebingen reference strain is publicly available at the National Center for Biotechnology Information (NCBI)'s Zebrafish Genome Page. The zebrafish reference genome sequence is annotated as part of the Ensembl project, and is maintained by the Genome Reference Consortium.[74]
In 2009, researchers at the Institute of Genomics and Integrative Biology in Delhi, India, announced the sequencing of the genome of a wild zebrafish strain, containing an estimated 1.7 billion genetic letters.[75][76] The genome of the wild zebrafish was sequenced at 39-fold coverage. Comparative analysis with the zebrafish reference genome revealed over 5 million single nucleotide variations and over 1.6 million insertion deletion variations. The zebrafish reference genome sequence of 1.4GB and over 26,000 protein coding genes was published by Kerstin Howe et al. in 2013.[77]
In October 2001, researchers from the University of Oklahoma published D. rerio's complete mitochondrial DNA sequence.[78] Its length is 16,596 base pairs. This is within 100 base pairs of other related species of fish, and it is notably only 18 pairs longer than the goldfish (Carassius auratus) and 21 longer than the carp (Cyprinus carpio). Its gene order and content are identical to the common vertebrate form of mitochondrial DNA. It contains 13 protein-coding genes and a noncoding control region containing the origin of replication for the heavy strand. In between a grouping of five tRNA genes, a sequence resembling vertebrate origin of light strand replication is found. It is difficult to draw evolutionary conclusions because it is difficult to determine whether base pair changes have adaptive significance via comparisons with other vertebrates' nucleotide sequences.[78]
T-boxes and homeoboxes are vital in Danio similarly to other vertebrates.[79][80] The Bruce et al. team are known for this area, and in Bruce et al. 2003 & Bruce et al. 2005 uncover the role of two of these elements in oocytes of this species.[79][80] By interfering via a dominant nonfunctional allele and a morpholino they find the T-box transcription activator Eomesodermin and its target mtx2 – a transcription factor – are vital to epiboly.[79][80] (In Bruce et al. 2003 they failed to support the possibility that Eomesodermin behaves like Vegt.[79] Neither they nor anyone else has been able to locate any mutation which – in the mother – will prevent initiation of the mesoderm or endoderm development processes in this species.)[79]
In 1999, the nacre mutation was identified in the zebrafish ortholog of the mammalian MITF transcription factor.[81] Mutations in human MITF result in eye defects and loss of pigment, a type of Waardenburg Syndrome. In December 2005, a study of the golden strain identified the gene responsible for its unusual pigmentation as SLC24A5, a solute carrier that appeared to be required for melanin production, and confirmed its function with a Morpholino knockdown. The orthologous gene was then characterized in humans and a one base pair difference was found to strongly segregate fair-skinned Europeans and dark-skinned Africans.[82] Zebrafish with the nacre mutation have since been bred with fish with a roy orbison (roy) mutation to make Casper strain fish that have no melanophores or iridophores, and are transparent into adulthood. These fish are characterized by uniformly pigmented eyes and translucent skin.[6][83]
Transgenesis is a popular approach to study the function of genes in zebrafish. Construction of transgenic zebrafish is rather easy by a method using the Tol2 transposon system. Tol2 element which encodes a gene for a fully functional transposase capable of catalyzing transposition in the zebrafish germ lineage. Tol2 is the only natural DNA transposable element in vertebrates from which an autonomous member has been identified.[84][85] Examples include the artificial interaction produced between LEF1 and Catenin beta-1/β-catenin/CTNNB1. Dorsky et al. 2002 investigated the developmental role of Wnt by transgenically expressing a Lef1/β-catenin reporter.[86]
There are well-established protocols for editing zebrafish genes using CRISPR-Cas9[87] and this tool has been used to generate genetically modified models.
In 2008, researchers at Boston Children's Hospital developed a new strain of zebrafish, named Casper, whose adult bodies had transparent skin.[6] This allows for detailed visualization of cellular activity, circulation, metastasis and many other phenomena.[6] In 2019 researchers published a crossing of a prkdc-/- and a IL2rga-/- strain that produced transparent, immunodeficient offspring, lacking natural killer cells as well as B- and T-cells. This strain can be adapted to 37 °C (99 °F) warm water and the absence of an immune system makes the use of patient derived xenografts possible.[88] In January 2013, Japanese scientists genetically modified a transparent zebrafish specimen to produce a visible glow during periods of intense brain activity.[7]
In January 2007, Chinese researchers at Fudan University genetically modified zebrafish to detect oestrogen pollution in lakes and rivers, which is linked to male infertility. The researchers cloned oestrogen-sensitive genes and injected them into the fertile eggs of zebrafish. The modified fish turned green if placed into water that was polluted by oestrogen.[5]
In 2015, researchers at Brown University discovered that 10% of zebrafish genes do not need to rely on the U2AF2 protein to initiate RNA splicing. These genes have the DNA base pairs AC and TG as repeated sequences at the ends of each intron. On the 3'ss (3' splicing site), the base pairs adenine and cytosine alternate and repeat, and on the 5'ss (5' splicing site), their complements thymine and guanine alternate and repeat as well. They found that there was less reliance on U2AF2 protein than in humans, in which the protein is required for the splicing process to occur. The pattern of repeating base pairs around introns that alters RNA secondary structure was found in other teleosts, but not in tetrapods. This indicates that an evolutionary change in tetrapods may have led to humans relying on the U2AF2 protein for RNA splicing while these genes in zebrafish undergo splicing regardless of the presence of the protein.[89]
D. rerio has three transferrins, all of which cluster closely with other vertebrates.[90]
When close relatives mate, progeny may exhibit the detrimental effects of inbreeding depression. Inbreeding depression is predominantly caused by the homozygous expression of recessive deleterious alleles.[91] For zebrafish, inbreeding depression might be expected to be more severe in stressful environments, including those caused by anthropogenic pollution. Exposure of zebrafish to environmental stress induced by the chemical clotrimazole, an imidazole fungicide used in agriculture and in veterinary and human medicine, amplified the effects of inbreeding on key reproductive traits.[92] Embryo viability was significantly reduced in inbred exposed fish and there was a tendency for inbred males to sire fewer offspring.
Zebrafish are common models for research into fish farming, including pathogens[93][94][95] and parasites[93][95] causing yield loss and/or spread to adjacent wild populations.
This usefulness is less than it might be due to Danio's taxonomic distance from the most common aquaculture species.[94] Because the most common are salmonids and cod in the Protacanthopterygii and sea bass, sea bream, tilapia, and flatfish, in the Percomorpha, zebrafish results may not be perfectly applicable.[94] Various other models – Goldfish (Carassius auratus), Medaka (Oryzias latipes), Stickleback (Gasterosteus aculeatus), Roach (Rutilus rutilus), Pufferfish (Takifugu rubripes), Swordtail (Xiphophorus hellerii) – are less used normally but would be closer to particular target species.[95]
The only exception are the Carp (including Grass Carp, Ctenopharyngodon idella)[94] and Milkfish (Chanos chanos)[95] which are quite close, both being in the Cyprinidae. However it should also be noted that Danio consistently proves to be a useful model for mammals in many cases and there is dramatically more genetic distance between them than between Danio and any farmed fish.[94]
In a glucocorticoid receptor-defective mutant with reduced exploratory behavior, fluoxetine rescued the normal exploratory behavior.[96] This demonstrates relationships between glucocorticoids, fluoxetine, and exploration in this fish.[96]

The zebrafish and zebrafish larva is a suitable model organism for drug discovery and development. As a vertebrate with 70% genetic homology with humans,[77] it can be predictive of human health and disease, while its small size and fast development facilitates experiments on a larger and quicker scale than with more traditional in vivo studies, including the development of higher-throughput, automated investigative tools.[97][98] As demonstrated through ongoing research programmes, the zebrafish model enables researchers not only to identify genes that might underlie human disease, but also to develop novel therapeutic agents in drug discovery programmes.[99] Zebrafish embryos have proven to be a rapid, cost-efficient, and reliable teratology assay model.[100]
Drug screens in zebrafish can be used to identify novel classes of compounds with biological effects, or to repurpose existing drugs for novel uses; an example of the latter would be a screen which found that a commonly used statin (rosuvastatin) can suppress the growth of prostate cancer.[101] To date, 65 small-molecule screens have been carried out and at least one has led to clinical trials.[102] Within these screens, many technical challenges remain to be resolved, including differing rates of drug absorption resulting in levels of internal exposure that cannot be extrapolated from the water concentration, and high levels of natural variation between individual animals.[102]
To understand drug effects, the internal drug exposure is essential, as this drives the pharmacological effect. Translating experimental results from zebrafish to higher vertebrates (like humans) requires concentration-effect relationships, which can be derived from pharmacokinetic and pharmacodynamic analysis.[3] Because of its small size, however, it is very challenging to quantify the internal drug exposure. Traditionally multiple blood samples would be drawn to characterize the drug concentration profile over time, but this technique remains to be developed. To date, only a single pharmacokinetic model for paracetamol has been developed in zebrafish larvae.[103]
Using smart data analysis methods, pathophysiological and pharmacological processes can be understood and subsequently translated to higher vertebrates, including humans.[3][104] An example is the use of systems pharmacology, which is the integration of systems biology and pharmacometrics. Systems biology characterizes (part of) an organism by a mathematical description of all relevant processes. These can be for example different signal transduction pathways that upon a specific signal lead to a certain response. By quantifying these processes, their behaviour in healthy and diseased situation can be understood and predicted. Pharmacometrics uses data from preclinical experiments and clinical trials to characterize the pharmacological processes that are underlying the relation between the drug dose and its response or clinical outcome. These can be for example the drug absorption in or clearance from the body, or its interaction with the target to achieve a certain effect. By quantifying these processes, their behaviour after different doses or in different patients can be understood and predicted to new doses or patients. By integrating these two fields, systems pharmacology has the potential to improve the understanding of the interaction of the drug with the biological system by mathematical quantification and subsequent prediction to new situations, like new drugs or new organisms or patients. Using these computational methods, the previously mentioned analysis of paracetamol internal exposure in zebrafish larvae showed reasonable correlation between paracetamol clearance in zebrafish with that of higher vertebrates, including humans.[103]
Zebrafish have been used to make several transgenic models of cancer, including melanoma, leukemia, pancreatic cancer and hepatocellular carcinoma.[105][106] Zebrafish expressing mutated forms of either the BRAF or NRAS oncogenes develop melanoma when placed onto a p53 deficient background. Histologically, these tumors strongly resemble the human disease, are fully transplantable, and exhibit large-scale genomic alterations. The BRAF melanoma model was utilized as a platform for two screens published in March 2011 in the journal Nature. In one study, the model was used as a tool to understand the functional importance of genes known to be amplified and overexpressed in human melanoma.[107] One gene, SETDB1, markedly accelerated tumor formation in the zebrafish system, demonstrating its importance as a new melanoma oncogene. This was particularly significant because SETDB1 is known to be involved in the epigenetic regulation that is increasingly appreciated to be central to tumor cell biology.
In another study, an effort was made to therapeutically target the genetic program present in the tumor's origin neural crest cell using a chemical screening approach.[108] This revealed that an inhibition of the DHODH protein (by a small molecule called leflunomide) prevented development of the neural crest stem cells which ultimately give rise to melanoma via interference with the process of transcriptional elongation. Because this approach would aim to target the "identity" of the melanoma cell rather than a single genetic mutation, leflunomide may have utility in treating human melanoma.[109]
In cardiovascular research, the zebrafish has been used to model human myocardial infarction model. The zebrafish heart completely regenerates after about 2 months of injury without any scar formation.[110] Zebrafish is also used as a model for blood clotting, blood vessel development, and congenital heart and kidney disease.[111]
In programmes of research into acute inflammation, a major underpinning process in many diseases, researchers have established a zebrafish model of inflammation, and its resolution. This approach allows detailed study of the genetic controls of inflammation and the possibility of identifying potential new drugs.[112]
Zebrafish has been extensively used as a model organism to study vertebrate innate immunity. The innate immune system is capable of phagocytic activity by 28 to 30 h postfertilization (hpf)[113] while adaptive immunity is not functionally mature until at least 4 weeks postfertilization.[114]
As the immune system is relatively conserved between zebrafish and humans, many human infectious diseases can be modeled in zebrafish.[115][116][117][118] The transparent early life stages are well suited for in vivo imaging and genetic dissection of host-pathogen interactions.[119][120][121][122] Zebrafish models for a wide range of bacterial, viral and parasitic pathogens have already been established; for example, the zebrafish model for tuberculosis provides fundamental insights into the mechanisms of pathogenesis of mycobacteria.[123][124][125][126] Furthermore, robotic technology has been developed for high-throughput antimicrobial drug screening using zebrafish infection models.[127][128]
Another notable characteristic of the zebrafish is that it possesses four types of cone cell, with ultraviolet-sensitive cells supplementing the red, green and blue cone cell subtypes found in humans. Zebrafish can thus observe a very wide spectrum of colours. The species is also studied to better understand the development of the retina; in particular, how the cone cells of the retina become arranged into the so-called 'cone mosaic'. Zebrafish, in addition to certain other teleost fish, are particularly noted for having extreme precision of cone cell arrangement.[129]
This study of the zebrafish's retinal characteristics has also extrapolated into medical enquiry. In 2007, researchers at University College London grew a type of zebrafish adult stem cell found in the eyes of fish and mammals that develops into neurons in the retina. These could be injected into the eye to treat diseases that damage retinal neurons—nearly every disease of the eye, including macular degeneration, glaucoma, and diabetes-related blindness. The researchers studied Müller glial cells in the eyes of humans aged from 18 months to 91 years, and were able to develop them into all types of retinal neurons. They were also able to grow them easily in the lab. The stem cells successfully migrated into diseased rats' retinas, and took on the characteristics of the surrounding neurons. The team stated that they intended to develop the same approach in humans.[130][131]
Muscular dystrophies (MD) are a heterogeneous group of genetic disorders that cause muscle weakness, abnormal contractions and muscle wasting, often leading to premature death. Zebrafish is widely used as model organism to study muscular dystrophies.[43] For example, the sapje (sap) mutant is the zebrafish orthologue of human Duchenne muscular dystrophy (DMD).[132] The Machuca-Tzili and co-workers applied zebrafish to determine the role of alternative splicing factor, MBNL, in myotonic dystrophy type 1 (DM1) pathogenesis.[133] More recently, Todd et al. described a new zebrafish model designed to explore the impact of CUG repeat expression during early development in DM1 disease.[134] Zebrafish is also an excellent animal model to study congenital muscular dystrophies including CMD Type 1 A (CMD 1A) caused by mutation in the human laminin α2 (LAMA2) gene.[135] The zebrafish, because of its advantages discussed above, and in particular the ability of zebrafish embryos to absorb chemicals, has become a model of choice in screening and testing new drugs against muscular dystrophies.[136]
Zebrafish have been used as model organisms for bone metabolism, tissue turnover, and resorbing activity. These processes are largely evolutionary conserved. They have been used to study osteogenesis (bone formation), evaluating differentiation, matrix deposition activity, and cross-talk of skeletal cells, to create and isolate mutants modeling human bone diseases, and test new chemical compounds for the ability to revert bone defects.[137][138] The larvae can be used to follow new (de novo) osteoblast formation during bone development. They start mineralising bone elements as early as 4 days post fertilisation. Recently, adult zebrafish are being used to study complex age related bone diseases such as osteoporosis and osteogenesis imperfecta.[139] The (elasmoid) scales of zebrafish function as a protective external layer and are little bony plates made by osteoblasts. These exoskeletal structures are formed by bone matrix depositing osteoblasts and are remodeled by osteoclasts. The scales also act as the main calcium storage of the fish. They can be cultured ex-vivo (kept alive outside of the organism) in a multi-well plate, which allows manipulation with drugs and even screening for new drugs that could change bone metabolism (between osteoblasts and osteoclasts).[139][140][141]
Zebrafish pancreas development is very homologous to mammals, such as mice. The signaling mechanisms and way the pancreas functions are very similar. The pancreas has an endocrine compartment, which contains a variety of cells. Pancreatic PP cells that produce polypeptides, and β-cells that produce insulin are two examples of those such cells. This structure of the pancreas, along with the glucose homeostasis system, are helpful in studying diseases, such as diabetes, that are related to the pancreas. Models for pancreas function, such as fluorescent staining of proteins, are useful in determining the processes of glucose homeostasis and the development of the pancreas. Glucose tolerance tests have been developed using zebrafish, and can now be used to test for glucose intolerance or diabetes in humans. The function of insulin are also being tested in zebrafish, which will further contribute to human medicine. The majority of work done surrounding knowledge on glucose homeostasis has come from work on zebrafish transferred to humans.[142]
Zebrafish have been used as a model system to study obesity, with research into both genetic obesity and over-nutrition induced obesity. Obese zebrafish, similar to obese mammals, show dysregulation of lipid controlling metabolic pathways, which leads to weight gain without normal lipid metabolism.[142] Also like mammals, zebrafish store excess lipids in visceral, intramuscular, and subcutaneous adipose deposits. These reasons and others make zebrafish good models for studying obesity in humans and other species. Genetic obesity is usually studied in transgenic or mutated zebrafish with obesogenic genes. As an example, transgenic zebrafish with overexpressed AgRP, an endogenous melacortin antagonist, showed increased body weight and adipose deposition during growth.[142] Though zebrafish genes may not be the exact same as human genes, these tests could provide important insight into possible genetic causes and treatments for human genetic obesity.[142] Diet-induced obesity zebrafish models are useful, as diet can be modified from a very early age. High fat diets and general overfeeding diets both show rapid increases in adipose deposition, increased BMI, hepatosteatosis, and hypertriglyceridemia.[142] However, the normal fat, overfed specimens are still metabolically healthy, while high-fat diet specimens are not.[142] Understanding differences between types of feeding-induced obesity could prove useful in human treatment of obesity and related health conditions.[142]
Zebrafish have been used as a model system in environmental toxicology studies.[29]
Zebrafish have been used as a model system to study epilepsy. Mammalian seizures can be recapitulated molecularly, behaviorally, and electrophysiologically, using a fraction of the resources required for experiments in mammals.[143]
The zebrafish (Danio rerio) is a freshwater fish belonging to the minnow family (Cyprinidae) of the order Cypriniformes. Native to South Asia, it is a popular aquarium fish, frequently sold under the trade name zebra danio (and thus often called a "tropical fish" although both tropical and subtropical). It is also found in private ponds.
The zebrafish is an important and widely used vertebrate model organism in scientific research, for example in drug development, in particular pre-clinical development. It is also notable for its regenerative abilities, and has been modified by researchers to produce many transgenic strains.
El pez cebra o danio cebra (Danio rerio) es un ciprínido[2] emparentado con las carpas y los barbos, originario del sudeste asiático, habita mayormente en lagos, ríos y lagunas de la India, de uso frecuente en acuarios, así como para la investigación científica, siendo el primer vertebrado en clonarse.[3] Frecuentemente, se lo vende con el nombre cebra danio.[4] Está muy relacionado parentalmente, con Danio kyathit.[5] Y también emparentado cerradamente, con el género Devario, como demuestra el árbol filogenético.[6] Por muchos años, el pez cebra era referido en la literatura científica como Brachydanio rerio hasta ser reasignado al genus Danio.[7]
Son peces alargados, fusiformes, con una única aleta dorsal, boca dirigida hacia arriba y un par de finas barbillas que son difíciles de ver salvo que el animal esté parado. Presentan dimorfismo sexual tanto en el tamaño como en el color. La hembra suele ser más grande que el macho y tiene un color de fondo plateado. El macho, sin embargo, adquiere tonalidades más doradas. Sobre los flancos y longitudinalmente se presentan de 5 a 9 bandas de color azul oscuro que comienzan detrás del opérculo y llegan hasta el final del animal (incluyendo la cola), dándole un aspecto cebrado del que toma el nombre. El opérculo es azulado y la zona ventral de un tono blanquecino rosado. Es transparente, lo que permite visualizar sin problemas la evolución de experimentos.[8] Alcanza 5 cm como talla máxima.
El pez cebra presenta cigotos de tipo telolecítico, por lo cual la segmentación ocurre solo en una región libre de vitelo denominada el blastodisco. Debido a que el cigoto presenta una gran cantidad de vitelo, las segmentaciones son incompletas y, dado que el blastodisco es la zona donde se dan los clivajes, se dice que esta segmentación es meroblástica discoidal.[9]
La fecundación del cigoto desencadena unas ondas de calcio que estimulan la contracción del citoesqueleto de actina, lo que ocasiona una distribución exclusiva del vitelo hacia el polo vegetal, dejando una región del polo animal libre de vitelo. Este proceso determina la formación del blastodisco.[10]
La primera división es ecuatorial y la segunda meridional. Las primeras divisiones son muy sincrónicas, rápidas y conforman el blastodermo, que se observa como un bulto de células en la parte apical o distal del cigoto.[9]
Hacia el décimo clivaje empieza la transición a blástula media. Esto se hace evidente gracias a que las divisiones celulares se hacen más lentas, menos sincrónicas, comienza la transcripción génica y las células o blastómeras empiezan a migrar[11] generando tres capas celulares distinguibles:
Entre la CSV y la capa de la envoltura se encuentran ubicadas las células profundas que dan origen al embrión.[9]
Los mapas celulares de destino parecen establecerse antes de la gastrulación.[12]
Durante el estadio de blástula, las tubulinas (subunidades de los microtúbulos y componentes de los centrosomas) se mantienen en un estado oligomérico que evita que se ensamblen constituyendo microtúbulos. La cantidad de tubulina soluble aumenta durante la gastrulación. La γ-tubulina asociada a complejos de proteínas, puede estar involucrada en la regulación de las dinámicas de la tubulina durante la oogénesis y embriogénesis del pez cebra.[13]
La gastrulación se caracteriza por varios movimientos dentro de los que se incluyen la epibolia, invaginación y delaminación.
El primer movimiento de gastrulación en el pez cebra es el de epibolia de las células del blastodermo sobre el vitelo. Durante este movimiento, las células internas del blastodermo migran hacia fuera para intercalarse y cubrir las células superficiales completamente y de manera autónoma.[9] La CSV y la capa de la envoltura provocan este movimiento al expandirse.[14]
Durante la epibolía, un lado del blastodermo se engrosa. Este lado marcará el sitio de la futura superficie dorsal del embrión.[15]
El engrosamiento del blastodermo, que luego originará la futura superficie dorsal del embrión, es denominada anillo germinal y se compone de dos capas:
Las células de estas dos capas se intercalan formando el escudo embrionario que precede al labio dorsal del embrión. Este escudo embrionario es homólogo al labio dorsal del blastoporo en anfibios; es decir, cumple la misma función organizadora que el labio dorsal del blastoporo.[16] Sin embargo, estas estructuras difieren en algunas de sus actividades: la placa precordal en peces parece estar involucrada en la formación de estructuras neurales ventrales, pero las regiones anteriores del cerebro se desarrollan en su ausencia, mientras que esto no se aplica para anfibios.
Los movimientos de las células del epiblasto y del hipoblasto forman otra capa celular conocida como cordamesodermo, que es el precursor de la notocorda y la quilla neural, la cual está compuesta por células del hipoblasto ubicadas hacia la línea media dorsal. Las células remanentes del epiblasto constituirán el ectodermo.[9]
La región más importante en la formación del eje dorsoventral en Danio rerio, y en peces en general, es el escudo embrionario. Esta región engrosada puede convertir al mesodermo lateral y ventral en mesodermo dorsal y también puede convertir el ectodermo en neural en lugar de epidérmico.[17]
El eje dorsoventral se construye gracias a la acción de varias familias de proteínas, dentro de las que se encuentran:
Las proteínas BMP y Wnt inducirán al ectodermo a convertirse en epidermis. Un ligando mutante denominado BMP2B induce a las células a adquirir destinos ventral y lateral. Dicho mutante es epistático. Wnt8 es otro mutante que lateraliza, posterioriza y ventraliza los tejidos del embrión.[9]
La notocorda secreta factores que bloquean la inducción de estas familias de proteínas y permiten que el ectodermo se convierta en neural. Investigaciones previas sugirieron que uno de los factores que bloquean la inducción de BMP y Wnt, es el denominado Cordina (Chordin).[18] Sin embargo, estudios posteriores arrojan resultados que contradicen lo postulado con anterioridad, al encontrar que la pérdida de Cordino, en lugar de incrementar los niveles de señalización de BMP en el sistema, los disminuía y se perdía tejido ventral en la cola del embrión. Estos resultados sugieren que el Cordino es un antagonista y a la vez un promotor de la acción de BMP.[19]
Al igual que en la formación del eje dorsoventral, las familias de proteínas que intervienen principalmente en su estableciemiento son las BMP y las Wnt, cuyos antagonistas incluyen factores como Cordina, Dickkopf y Nogina.
Es el proceso de conversión de la placa neural en tubo neural.
La neurulación del pez cebra incluye dos procesos conocidos como neurulación primaria y neurulación secundaria.
En Danio rerio, solo el tubo neural de la cola se construye por neurulación secundaria.[9]
Es especialmente apreciado por su homología genética con el humano (compartimos con estos peces más del 80 % del genoma) que permite que los resultados obtenidos de los fármacos probados en estos animales sean potencialmente extrapolables al humano.
Sus embriones son transparentes, algo que hace posible observar los efectos de estos medicamentos en sus órganos internos en formación.
Otra de las ventajas de este pez es su capacidad reproductiva —la hembra pone hasta 200 huevos—, continua -se reproducen durante todo el año- y rápido desarrollo -sus órganos se forman en solo 24 h, gracias a los cuales se pueden realizar diferentes experimentos en una misma generación de animales, investigar la evolución de las patologías e identificar las causas de las enfermedades investigadas.
Este pez tropical posee también la cualidad de regenerar los órganos que le son parcialmente amputados, lo que amplía las capacidades de investigación en este campo que tiene como horizonte la recuperación de las lesiones medulares.
Pueden criarse de tal modo que los mutantes pueden ser investigados y propagados, y es además el primer vertebrado en el que se ha intentado una mutagénesis intensiva.[9]
Su pequeño tamaño facilita su almacenaje, ya que caben hasta un centenar de animales en contenedores de un litro de agua, y su por sencillo mantenimiento decantan finalmente a favor del pez cebra las preferencias de los científicos como animal de laboratorio en el siglo XXI.
Los genes del pez cebra son muy dóciles de estudiar, ya que los embriones son sensibles a las moléculas antisentido de Morfolino y, por tanto, este método puede utilizarse para analizar si un gen dado es importante para una función en particular.[9]
Los experimentos genéticos en Danio rerio se basan en el método tradicional de estudio, en donde el pez progenitor macho es sometido a tratamientos con un mutágeno químico. Este mutágeno es llamado "ENU", también conocido como N-etil-N-nitrosourea, un muy potente mutágeno capaz de introducir una nueva mutación cada 700 locis y es tóxico en dosis altas. Este mutágeno causa mutaciones al azar en sus células germinales.[20] Cada macho mutante es apareado con una hembra silvestre de manera aleatoria para producir una descendencia F1. Las mutaciones serán heredadas solo del padre y, por tanto, si son dominantes, se expresarán y si son recesivas, no lo harán. Luego se produce una F2 al cruzar o aparear cualquier individuo de la F1 con un individuo silvestre.[9] Desarrollo de las aletas Asimismo, el pez cebra se ha establecido como un organismo modelo en el área de la regeneración (Véase Regeneración (biología)).
Posteriormente a la inducción del mutágeno ENU en GO, al secuenciar el DNA rico en exones, se puede identificar este mutágeno en la F1 y así predecir las consecuencias en la codificación de las proteínas con las mutaciones inducidas (mutaciones nonsense y mutaciones essential splice-site, es decir, a nivel de proteína estas últimas), para las cuales se generaron unos SNP con el fin de facilitar la identificación en las siguientes generaciones. De esta manera se pudo confirmar el 95% de las mutaciones candidatas para sucesivas generaciones.[20]
Un método de secuenciación de exomas del pez cebra es el siguiente:
A continuación en el dibujo se muestran en azul los exones y en rojo del DNA genómico no codificante.
Recientemente se ha secuenciado el genoma completo del pez cebra, lo que ha permitido conocer más a fondo las características de este pez. Tiene el mayor número de genes codificantes de los vertebrados (26479 genes, que se han podido analizar gracias a estudios de clonación posicional, mutagénesis de inserción, resecuenciación selectiva, etc.).[20] Esto puede ser debido a un proceso de duplicación extra del genoma que sufrió un antecesor común a este tipo de peces, frente a los más de 22.000 genes que codifican para proteínas analizados en ratones, lo que supone una ventaja para su uso en laboratorio en pro del pez cebra].[20] Este proceso se conoce como duplicación teleóstea específica del genoma (TSD), y además de proporcionarle un gran número de genes codificantes, también le aportó muchos genes específicos de especie (más que los humanos, los ratones o los pollos).
Gracias a la secuenciación completa del genoma, se ha podido observar asimismo que el 70 % de los genes humanos tienen, al menos, un ortólogo en pez cebra, por lo que este pez se puede usar como modelo animal para averiguar las funciones de algunos genes de vertebrados y caracterizar ciertas enfermedades hereditarias humanas.[21]
Se han podido identificar y fenotipar las mutaciones perjudiciales en cada gen que codifica para proteínas, utilizando un genoma de referencia secuenciado, como se ha comentado anteriormente, una secuenciación de alto rendimiento y una mutagénesis química eficiente. De manera que introducían mutaciones y posteriormente secuenciaban los exones para ver qué genes codificadores de proteínas habían sido dañados y así asociar fenotipo-mutación. Y como estos genes también están en la especie humana, eran capaces de asociar potencial-daño en esos genes a un potencial fenotipo que puede aparecer en los humanos, y así facilitar el auge de la comprensión respecto a la cantidad de enfermedades humanas cuyo gen responsable se desconoce.[20]
La comunidad que trabaja con él comparte libremente su genoma en repositorios en línea de acceso abierto. El pez cebra y el humano comparten el 70% de la información genética y más del 80% de los genes responsables de enfermedades humanas .[8]
Los laboratorios del Instituto Sanger están confeccionando un catálogo de mutantes. Se pretende mutar todos los genes del pez, uno a uno, y estudiar los efectos de cada mutación en la anatomía, fisiología y comportamiento.
Existen varias formas de genotipados, que no es más que llevar a cabo una PCR y secuenciarla. En el artículo al cual hace referencia esta información[20] se centran en un sistema de genotipado de SNPs KASP que utiliza un tipo de genotipado por fluorescencia.
El ensayo KASP es capaz de discriminar, mediante una PCR alelo específica competitiva, los alelos de un SNP en un locus específico a partir de un DNA genómico. Este ensayo utiliza una Taq polimerasa modificada sin actividad 3'-5' exonucleasa. Esta tecnología emplea primers que generan productos de PCR fluorescentes y que permiten genotipar el SNP en un único paso, por lo que este tipo de sistema de genotipado es útil para ensayos de genes de referencia, ensayos de alelos wild type y ensayos de alelos mutantes.[20]
Este tipo de sistema SNPs KASP se compone de un cebador específico de alelo que detecta el alelo mutante y de un bloqueador de oligonucleótidos que suprime al alelo wild type. Cada alelo tendrá un fluorocromo distinto y tiene una sonda en el medio, de modo que al realizar la PCR, el láser nos informa del producto que se ha amplificado, cuál de los dos primers específicos de cada alelo se ha unido, emitiendo un color u otro, de forma que se sabrá qué alelo se tiene.[20]
El pez cebra o danio cebra (Danio rerio) es un ciprínido emparentado con las carpas y los barbos, originario del sudeste asiático, habita mayormente en lagos, ríos y lagunas de la India, de uso frecuente en acuarios, así como para la investigación científica, siendo el primer vertebrado en clonarse. Frecuentemente, se lo vende con el nombre cebra danio. Está muy relacionado parentalmente, con Danio kyathit. Y también emparentado cerradamente, con el género Devario, como demuestra el árbol filogenético. Por muchos años, el pez cebra era referido en la literatura científica como Brachydanio rerio hasta ser reasignado al genus Danio.
Son peces alargados, fusiformes, con una única aleta dorsal, boca dirigida hacia arriba y un par de finas barbillas que son difíciles de ver salvo que el animal esté parado. Presentan dimorfismo sexual tanto en el tamaño como en el color. La hembra suele ser más grande que el macho y tiene un color de fondo plateado. El macho, sin embargo, adquiere tonalidades más doradas. Sobre los flancos y longitudinalmente se presentan de 5 a 9 bandas de color azul oscuro que comienzan detrás del opérculo y llegan hasta el final del animal (incluyendo la cola), dándole un aspecto cebrado del que toma el nombre. El opérculo es azulado y la zona ventral de un tono blanquecino rosado. Es transparente, lo que permite visualizar sin problemas la evolución de experimentos. Alcanza 5 cm como talla máxima.
Danio rerio Danio generoko animalia da. Arrainen barruko Actinopterygii klasean sailkatzen da, Cyprinidae familian.
Danio rerio Danio generoko animalia da. Arrainen barruko Actinopterygii klasean sailkatzen da, Cyprinidae familian.
Seeprakala (Danio rerio) on särkikaloihin kuuluva mustavalkoraitainen kala. Se on ollut yleisimpiä akvaariokaloja helppohoitoisuutensa takia. Sitä käytetään paljon myös koe-eläimenä.
Seeprakalaa käytetään tuberkuloosin tutkimisessa, sillä sen immuniteetti on samantapainen kuin ihmisellä, ja sillä tunnetaan tuberkuloosia muistuttava infektio.[2] Geenimuunneltu seeprakala on glofish.
Uroksen vaaleat raidat ovat kullansävyiset, naaraan enemmän hopeansävyiset. Pituus noin 6 cm. Viljellyistä yksilöistä löytyy myös huntueväisiä.[3]
Seeprakalat ovat kotoisin etu-Intian itäosien ja Bangladeshin joista.
Seeprakala on parvikala ja se kutee helposti. Jos haluaa kasvattaa poikasia, pitää pari siirtää erilliseen kutuakvaarioon ja pois sieltä heti kudun tapahduttua, sillä vanhemmat syövät usein mädin.[4]
Seeprakalan tarvitsema veden lämpötila on 23–25 astetta. Se ei ole niin herkkä huonolle vedenlaadulle tai pH-vaihteluille, kuin monet muut lajit. Seeprakala on kaikkiruokainen ja viihtyy esimerkiksi miljoonakalojen kanssa.
Seeprakala (Danio rerio) on särkikaloihin kuuluva mustavalkoraitainen kala. Se on ollut yleisimpiä akvaariokaloja helppohoitoisuutensa takia. Sitä käytetään paljon myös koe-eläimenä.
Seeprakalaa käytetään tuberkuloosin tutkimisessa, sillä sen immuniteetti on samantapainen kuin ihmisellä, ja sillä tunnetaan tuberkuloosia muistuttava infektio. Geenimuunneltu seeprakala on glofish.
Danio truite
Le danio léopard, appelé aussi danio truite, est une variété de Poisson-zèbre (Danio rerio). N'existant pas à l'état sauvage, il n'est plus considéré comme une espèce distincte de la forme d'origine et les noms binominaux Danio frankei / Brachydanio frankei sont devenus des synonymes. Il se caractérise par un remplacement des rayures bleues continues du flanc par des taches bleues bien alignées[1],[2].
Un danio léopard dans son aquarium.
Danio truite
Le danio léopard, appelé aussi danio truite, est une variété de Poisson-zèbre (Danio rerio). N'existant pas à l'état sauvage, il n'est plus considéré comme une espèce distincte de la forme d'origine et les noms binominaux Danio frankei / Brachydanio frankei sont devenus des synonymes. Il se caractérise par un remplacement des rayures bleues continues du flanc par des taches bleues bien alignées,.
Un danio léopard dans son aquarium.
Un spécimen à longues nageoires, avec les barbillon bien visibles.
O peixe cebra (Danio rerio) é unha especie de peixe tropical de auga doce pertencente á familia dos ciprínidos.[1] É nativo da rexión do Himalaia, e un peixe de acuario moi común (vendido ás veces co nome comercial de danio cebra ou zebra danio, entre outros),[2] e tamén un importante organismo modelo vertebrado usado para investigacións científicas. É especialmente notable polas súas capacidades rexenerativas,[3] e foi modificado polos investigadores para producir varias cepas transxénicas.[4][5][6]
O peixe cebra é membro do xénero Danio da familia Cyprinidae. Ten unha relación de grupo irmán coa especie Danio kyathit.[7] O peixe cebra está tamén estreitamente relacionado co xénero Devario, como demostran as árbores filoxenéticas.[8] Durante moitos anos na literatura científica, o peixe cebra era denominado Brachydanio rerio, ata que foi reasignado ao xénero Danio.[9]
O peixe cebra é nativo das correntes fluviais do sueste da rexión do Himalaia,[7] e atópase en partes da India, Paquistán, Bangladesh, Nepal, e Birmania.[10] A especie orixinouse na rexión do río Ganxes no leste da India, e vive normalmente en ríos, canais, regos, lagoas e corpos de augas lentas ou encoradas, como nos campos de arroz.[10][11]
O peixe cebra recibe o seu nome polas bandas horizontais uniformes pigmentadas de azul que presenta na parte lateral do seu corpo, que lembran ás raias das cebras, e que se estenden ata o final da aleta caudal. É fusiforme e comprimido lateralmente, coa boca dirixida cara adiante. O macho ten forma de torpedo, con bandas douradas entre as bandas azuis; a femia ten unha barriga branquecha maior e bandas prateadas en troques das douradas. As femias adultas mostran unha pequena papila xenital diante da orixe da aleta anal. O peixe cebra pode medrar ata os 6,4 cm de lonxitude, aínda que en raras ocasións pode crecer máis, ata os 4 cm en catividade. A duración da súa vida en catividade é de arredor de dous ou tres anos, aínda que en condicións ideais, pode chegar aos cinco anos.[11]
O tempo de xeración aproximado de Danio rerio é de tres a catro meses. Para que se produza a ovulación e o desove debe estar presente un macho. As femias poden desovar a intervalos de dous ou tres días, poñendo centos de ovos en cada posta. Unha vez que se liberan os ovos, empeza o desenvolvemento embrionario; se non hai esperma, o crecemento detense despois dunhas poucas divisións celulares. Pero os ovos fertilizados fanse case inmediatamente transparentes, unha característica que fai de D. rerio unha especie modelo para a investigación moi conveniente.[11]
O embrión do peixe cebra desenvólvese rapidamente, e os precursores de todos os órganos principais aparecen en só 36 horas despois da fertilización, e a eclosión ten lugar de 12 a 36 horas despois, dependendo das condicións internas do embrión e da temperatura externa, que a ideal é de 28,5 °C. O comportamento de natación e alimentación empeza unhas 36 horas despois. O sexo dos individuos xuvenís non se pode distinguir excepto por disección, e os determinantes do sexo non se comprenden claramente.
Para favorecer o desove, algúns investigadores utilizan un tanque cun fondo corredizo, o cal reduce a profundidade e simula as beiras dun río. O desove do peixe cebra prodúcese mellor pola mañá debido aos seus ritmos circadianos. Pódense recoller 10.000 embrións en 10 minutos utilizando este método.[12] O peixe cebra macho responde ás femias con marcas máis pronunciadas na pel, é dicir, ás "bandas boas", pero nun grupo, os machos aparéanse con calquera femia que atopen. Non se sabe que é o que atrae ás femias. A presenza de plantas, mesmo de plantas de plástico de acuario, tamén favorece o desove.[12]
Os peixes cebra son omnívoros, e comen principalmente zooplancto, fitoplancto, insectos e larvas de insectos, aínda que poden comer tamén outros alimentos, como vermes e pequenos crustáceos, se non atopan as súas fontes preferidas de alimento.[11] A maioría dos peixes cebra aceptan comida para peixes de acuario común e vermes tubifex nos acuarios.
Os peixes cebra son resistentes e considéranse bos para acuaristas principiantes. A súa grande popularidade débese á súa disposición ao xogo,[13] á súa rápida reprodución, estética, prezo barato e grande dispoñibilidade. Tamén se desenvolve ben en bancos ou cardumes de seis ou máis, e interacciona ben con outras especies de peixes nos acuarios. Porén, son susceptibles ao dinoflaxelado Oodinium, ao microsporidio Pseudoloma neurophilia, e a especies de Mycobacterium. Se teñen a oportunidade os adultos comen as crías, as cales poden ser protexidas separándoas en dous grupos por unha rede, unha caixa de cría ou nun tanque separado.
En 2003, comercializouse nos Estados Unidos un peixe cebra transxénico que expresaba as proteínas fluorescentes verde, vermella e amarela. As cepas fluorescentes vendéronse co nome comercial de GloFish. Outras variedades cultivadas son a "golden", "sandy", "longfin" e "leopard".
O danio leopardo, previamente chamado Danio frankei, é un morfo de manchas redondas do peixe cebra, que se orixinou debido a unha mutación na pigmentación.[14] As formas con xantocromismo cos patróns cebra e leopardo, xunto coas subespecies de aletas longas, obtivéronse con programas de cruzamento selectivo para a súa venda para acuarios.[15]
No Centro de Recursos do Peixe Cebra de China (China Zebrafish Resource Center, CZRC) almacénanse varias cepas mutantes e transxénicas do peixe cebra. ,[16] que é unha organización sen ánimo de lucro, financiada polo Ministerio da Ciencia e Tecnoloxía de China e a Academia Chinesa das Ciencias.
A Zebrafish Information Network (ZFIN) proporciona información actualizada sobre as cepas de tipo salvaxe ou silvestre coñecidas de D. rerio, algunhas das cales son as da seguinte lista:[17]
Os híbridos entre distintas especies do xénero Danio poden ser fértiles: por exemplo, entre D. rerio e D. nigrofasciatus.[8]
D. rerio é un organismo modelo común e moi útil para estudos de desenvolvemento de vertebrados e función xénica. Os pioneiros no seu uso como animal de laboratorio foron George Streisinger e os seus colegas da Universidade de Oregón. A súa importancia foi consolidada polos existosos cribados xenéticos a grande escala (xeralmente chamados Tübingen/Boston screens). Este peixe ten unha base de datos en liña con información de desenvolvemento, xenómica e xenética, chamada Zebrafish Information Network (ZFIN). D. rerio é tamén unha das poucas especies de peixes que foron enviados ao espazo para a experimentación.
As investigacións realizadas con D. rerio proporcionaron avances importantes nos eidos da bioloxía do desenvolvemento, oncoloxía,[18] toxicoloxía,[19] estudos reprodutivos, teratoloxía, xenética, neurobioloxía, ciencias medioambientais, investigación en células nais e medicina rexenerativa,[20][21] e teoría da evolución.[8]
Como modelo de sistemas biolóxicos, o peixe cebra posúe numerosas vantaxes para os investigadores. O seu xenoma foi completamente secuenciado, e ten comportamentos de desenvolvemento ben comprendidos e doadamente observables e comprobables. O seu desenvolvemento embrionario é moi rápido, e os seus embrións son relativamente grandes, robustos, e transparentes, e poden desenvolverse fóra da súa nai.[22] Ademais, hai cepas mutantes ben caracterizadas das que se pode dispoñer facilmente.
Outras vantaxes son o tamaño case constante da especie durante o seu desenvolvemento inicial, o que permite o uso de técnicas de tinguidura simples, e o feito de que se pode fusionar o seu embrión de dúas células para formar unha soa célula e crear un embrión homocigoto. O peixe cebra é tamén demostrablemente similar aos modelos de mamífero e humanos en probas de toxicidade, e mostra un ciclo de sono diúrno con semellanzas co comportamento durante o sono dos mamíferos.[23] Con todo, hai tamén algunhas desvantaxes no uso do peixe cebra, como a ausencia dunha dieta estándar,[24] e a presenza de pequenas pero importantes diferenzas entre o peixe cebra e os mamíferos na función que teñen algúns xenes relacionados con trastornos humanos,[25][26] todo o cal é importante consideralo para determinar se o peixe cebra é un modelo apropiado para un determinado estudo.
O peixe cebra ten a capacidade de rexenerar as súas aletas, pel, corazón e, nos estados larvarios, o cerebro.[27] Na rexeneración do músculo cardíaco do peixe cebra non interveñen células nais, senón que as células musculares cardíacas maduras volven a un estado similar ao de célula nai e rediferéncianse.[27] Inténtase aplicar estas propiedades aos humanos.[28][29]
O peixe cebra pode rexenerar tamén as células fotorreceptoras e neuronas da retina se estas sofren danos, o que está mediado pola desdiferenciación e proliferación de células da glía de Müller.[30] Os investigadores adoitan amputar as aletas da cola dorsal e ventral e analizar o seu recrecemento para probar mutacións. Atopouse que no sitio da amputación ocorre unha desmetilación de histonas, que fai que as células do peixe cebra cambien de estar no estado "activo", a un estado rexenerativo similar a células nais.[31] En 2012, un estudo revelou que o peixe cebra utiliza unha proteína especializada, chamada factor de crecemento de fibroblastos, para facilitar a curación da súa medula espiñal lesionada sen orixinar cicatrices gliais.[3]
En trastornos do sistema nervioso, como doenzas neurodexenerativas, trastornos do movemento, trastornos psiquiátricos e xordeira, os investigadores están utilizando o peixe cebra para comprender como os defectos xenéticos que subxacen nesas condicións causan anormalidades funcionais no cerebro humano, medula espiñal e órganos sensoriais. Tamén se estudou o peixe cebra para saber máis sobre as complexidades das doenzas musculoesqueléticas humanas, como a distrofia muscular.[32] Outro foco de investigación co peixe cebra está centrado en comprender como un xene chamado Hedgehog, que é un sinal biolóxico que está implicado en varios tipos de cancro humanos, controla o crecemento celular.
Debido aos seus curtos ciclos vitais e ao tamaño relativamente grande das súas postas de ovos, os peixes cebra son un modelo moi útil para estudos xenéticos. Unha técnica común de xenética inversa é reducir a expresión de xenes (knockdown de xenes) ou modificar o splicing utilizando a tecnoloxía Morpholino antisentido. Os oligonucleótidos Morpholino (MO) son macromoléculas sintéticas estables que conteñen as mesmas bases que o ADN ou ARN. Ao unir estas moléculas con secuencias complementarias de ARN, redúcese a expresión xénica de xenes específicos. Os oligonucleótidos Morpholino poden inxectarse nunha célula dun embrión despois de que este chega ao estadio de 32 células, reducindo así a expresión xénica soamente nas células que descenden da célula tratada. Porén, as células de todo o embrión en etapas máis iniciais (menos de 32 células) son interpermeables a grandes moléculas,[33][34] o que permite a difusión destas entre elas e impide o uso da técnica nesa etapa.
Un problema que ten o knockdown de xenes é que, debido a que o xenoma sufriu na evolución unha duplicación despois da diverxencia entre os peixes actinopterixios (de aletas con espiñas radiais) e os sarcopterixios (de aletas lobuladas), non sempre é doado silenciar a actividade con fiabilidade dun dos xenes parálogos porque se produce complementación polo outro parálogo.[35] Malia estas complicacións que ten o xenoma do peixe cebra, existen unha serie de plataformas globais dispoñibles comercialmente para a análise da expresión xénica por micromatrices (microarrays) e por regulación do promotor utilizando a técnica ChIP-on-chip.[36]
O Wellcome Trust Sanger Institute comezou o proxecto de secuenciación do xenoma do peixe cebra en 2001, e a secuencia xenómica completa da cepa de referencia Tuebingen está dispoñible publicamente na páxina do National Center for Biotechnology Information (NCBI) Xenoma do Peixe Cebra. A secuencia do xenoma de referencia do peixe cebra está anotada como parte do proxecto de Ensembl, e é mantida polo Genome Reference Consortium.[37]
En 2009, os investigadores do Institute of Genomics and Integrative Biology (IGIB) de Delhi, India, anunciaron a secuenciación do xenoma dunha cepa salvaxe do peixe cebra, que contiña 1,7 miles de millóns de letras.[38][39] As análises comparativas co xenoma de referencia do peixe cebra revelaron unhas 5 millóns de variacións dun só nucleótido e unhas 1,6 millóns de variacións de inserción deleción. A secuencia do xenoma de referencia do peixe cebra foi publicada por Kerstin Howe et al. en 2013.[40]
En 2001, os investigadores da Universidade de Oklahoma publicaron a secuencia completa do ADN mitocondrial de D. rerio.[41] Tiña unha lonxitude de 16.596 pares de bases. Ten unha diferenza de só uns 100 pares de bases coa doutras especies de peixes relacionadas, e tan só ten unha diferenza de 18 pares de bases máis co do peixe Carassius auratus e de 21 pares máis co da carpa (Cyprinus carpio). A súa orde de xenes e contido son idénticos ao da forma común en vertebrados do ADN mitocondrial. Contén 13 xenes codificantes de proteínas e unha rexión non codificante que contén a orixe de replicación para a cadea pesada. Situada entre un grupo de cinco xenes de ARNt, atópase unha secuencia que lembra a orixe de replicación da cadea lixeira de vertebrados. É difícil extraer conclusións evolutivas destes datos porque non é doado determinar se os cambios nos pares de bases teñen importancia adaptativa ao facer comparacións con outras secuencias de nucleótidos de vertebrados.[41]
En 1999, identificouse a mutación nacre (nácar) no ortólogo do peixe cebra do factor de transcrición de mamífero MITF.[42] As mutacións no MITF humano orixinan defectos nos ollos e perda de pigmentos, o que é un tipo de síndrome de Waardenburg. En 2005, nun estudo da cepa golden identificouse o xene responsable desta pigmentación inusual, que era o SLC24A5, un transportador de solutos que parecía ser necesario para a produción de melanina, e confirmouse a súa función cun knockdown con Morpholino. O xene ortólogo foi despois caracterizado en humanos e atopouse unha diferenza nun só par de bases que segregaba claramente os humanos europeos de pel clara dos africanos de pel escura.[43]
A transxénese é un enfoque común de moitos estudos sobre o funcionamento dos xenes no peixe cebra. A preparación dun peixe cebra transxénico é relativamente fácil polo método que usa un sistema transposón Tol2.[44]
En 2008, os investigadores do Hospital Infantil de Boston desenvolveron unha nova cepa de peixe cebra, que denominaron Casper, que ten a característica de que os corpos dos adultos son de pel transparente.[5] Isto permite unha visualización detallada da actividade celular, circulación, metástase e moitos outros fenómenos. Como peixes e humanos comparten moitas funcións xénicas, pénsase que a cepa Casper servirá para estudar enfermidades humanas como a leucemia e outros cancros.[5] En 2013, científicos xaponeses modificaron xeneticamente un espécime de peixe cebra transparente para producir un resplandor visible durante os períodos de intensa actividade cerebral do animal, o que permitiu rexistrar os "pensamentos" do peixe en rexións específicas do seu cerebro que se iluminaban en resposta a estímulos externos.[6]
En 2007, os investigadores chineses da Universidade Fudan modificaron xeneticamente o peixe cebra para poder detectar a polución por estróxenos en lagos e ríos, o cal está ligado á infertilidade dos machos. Clonaron xenes senibles aos estróxenos e inxectáronos en ovos fértiles de peixe cebra. Os peixes modificados que se orixinaron volvíanse verdes se estaban situados en augas polucionadas con estróxenos.[4]
O peixe cebra foi utilizado como modelo transxénico para varios tipos de cancro, como o melanoma, leucemia, cancro pancreático e carcinoma hepatocelular.[45][46] O peixe cebra que expresa formas mutadas dos oncoxenes BRAF ou NRAS desenvolve o melanoma cando se sitúa nunha contorna deficiente en p53. Histoloxicamente, estes tumores lembran fortemente á enfermidade humana, son completamente transplantables, e mostran alteracións xenómicas a grande escala. O modelo do melanoma BRAF foi utilizado como plataforma para dous cribados publicados en 2011 na revista Nature. Nun dos estudos, o modelo utilizouse como ferramenta para comprender a importancia funcional de xenes que se sabe que son amplificados e sobreexpresados nos melanomas humanos.[47] Un xene chamado SETDB1, aceleraba marcadamente a formación do tumor no sistema do peixe cebra, o que demostraba a súa importancia como novo oncoxene de melanoma. Isto era especialmente significativo porque o SETDB1 está implicado na regulación epixenética á que cada vez se lle dá máis importancia como un feito central na bioloxía dos tumores.
Noutro estudo, fíxose un esforzo para tomar como diana terapéutica o programa xenético presente na célula da crista neural orixe do tumor utilizando un cribado químico.[48] Isto revelou que a inhibición da proteína DHODH (feita por unha pequena molécula chamada leflunomida) impedía o desenvolvemento das células nais da crista neural, as cales finalmente dan lugar ao melanoma por medio de interferencia co proceso de elongación transcricional. Como esta estratexia está pensada para tomar como diana a "identidade" da célula de melanoma en vez dunha soa mutación xenética, a leflunomida pode ser útil no tratamento do melanoma humano.[49]
Na investigación cardiovascular, o peixe cebra foi utilizado para servir como modelo para a coagulación do sangue, desenvolvemento de vasos sanguíneos, insuficiencia cardíaca, e defectos conxénitos do corazón e doenzas renais.[50]
En programas de investigación da inflamación aguda, que é un importante proceso fundamento de moitas doenzas, os investigadores estableceron un modelo do peixe cebra da inflamación e a súa resolución. Esta aproximación permite un estudo detallado dos controis xenéticos da inflamación e a posibilidade de identificar novos fármacos potenciais.[51]
Como o sistema inmunitario está relativamente conservado entre o peixe cebra e os humanos, moitas doenzas infecciosas humanas poden ser modelizadas co peixe cebra.[52][53][54][55] As primeiras etapas da vida transparentes do peixe cebra son moi axeitadas para a disección xenética e toma de imaxes in vivo das interaccións hóspede-patóxeno.[56][57] Establecéronse modelos de peixe cebra para un amplo rango de patóxenos parasitos, virais e bacterianos; por exemplo, o modelo do peixe cebra para a tuberculose dá a oportunidade de estudar os mecanismos da patoxénese das micobacterias.[58] Ademais, desenvolveuse unha tecnoloxía robótica para os cribados de fármacos antimicrobianos de alta resolución utilizando os modelos de infección do peixe cebra.[59]
Outra característica notable do peixe cebra é que posúe catro tipos de células cono, con células sensibles ao ultravioleta que suplementan os subtipos de conos para o vermello, verde e azul que se encontran en humanos. O peixe cebra pode así observar un amplo espectro de cores. A especie tamén se estuda para comprender mellor o desenvolvemento da retina; en especial, como os conos da retina se dispoñen formando o chamado "mosaico de conos". O peixe cebra, xunto con outros peixes teleósteos, ten unha grande precisión na súa disposicións dos conos na retina.[60]
Este estudo das características da retina do peixe cebra foi extrapolado tamén á investigación médica. En 2007, investigadores da University College de Londres obtiveron un tipo de células nais adultas de peixe cebra que se encontran nos ollos de peixes e mamíferos que se desenvolven en neuronas na retina. Estas células de mamífero podían ser inxectadas nos ollos para tratar doenzas que danan as neuronas da retina e aplicadas en moitas enfermidades oculares, como a dexeneración macular, glaucoma, e cegueira relacionada coa diabete. Os investigadores estudaron as células gliais de Múller dos ollos humanos a idades desde os 18 meses aos 91 anos, e puideron facer que se desenvolveran en todos os tipos de neuronas retinianas. Foron tamén quen de cultivalas facilmente no laboratorio. As células nais migraban con éxito ás retinas lesionadas de ratas de laboratorio, e adquirían as características das neuronas que as rodeaban. O equipo está traballando no desenvolvemento do mesmo procedemento con humanos.[61]
Como se demostrou en programas de investigación que seguen en marcha, o modelo do peixe cebra permite aos investigadores non só identificar os xenes que poderían estár detrás de certas doenzas humanas, senón tamén desenvolver novos axentes terapéuticos nos programas de descubrimento de fármacos.[62] Os embrións de peixe cebra demostraron ser un modelo de ensaio teratolóxico rápido, eficiente en custo, e fiable.[63]
O peixe cebra (Danio rerio) é unha especie de peixe tropical de auga doce pertencente á familia dos ciprínidos. É nativo da rexión do Himalaia, e un peixe de acuario moi común (vendido ás veces co nome comercial de danio cebra ou zebra danio, entre outros), e tamén un importante organismo modelo vertebrado usado para investigacións científicas. É especialmente notable polas súas capacidades rexenerativas, e foi modificado polos investigadores para producir varias cepas transxénicas.
Zebrica (lat.: Danio rerio) je vrsta tropske slatkovodne ribe iz roda Danio, porodice Cyprinidae (šarani)[1]. Vuče porijeklo iz potoka i rižinih polja Indije, a u Europu je unijeta 1905. godine. Može se sresti i u vodama Bangladeša, Pakistana i Nepala, a kao neželjeni kućni ljubimci dospjeli su i u vode Kolumbije[2]. Vrlo su popularne akvarijske ribe, lake za uzgoj i razmnožavanje, a koriste se i u znanstvene svrhe.
Brza je i vrlo živahna riba, svijetlosivog tijela, a prepoznatljiva je po četiri vodoravne pruge tamnije sive ili sivoplave boje. Pruge se protežu od škržnih poklopaca pa do repa, koji je blijedomliječne boje. Odlika cijele porodice su brčići koji se daju primijetiti i kod zebrice. Spolni dimorfizam je očit: ženke su veće od mužjaka i dosta krupnijeg, ružićastog trbuha. Maksimalna dužina ženke je 6 cm. Između tamnijih pruga kod mužjaka nalaze se zlatnožute pruge, koje su kod ženke sive boje. Životni vijek zebrica iznosi otprilike 5 godina.[3].
Idealna temperatura vode za život zebrica iznosi 23 °C, ali u akvariju ona nije od velikog značaja. Sposobnosti ove ribe da podnese nevjerojatne varijacije temperature, u rasponu od 15 do 30 °C, svojstvene su još samo zlatnim ribicama. Nije zahtjevna ni po pitanju sastava vode. Vrlo su temperamentne i živahne ribe, pa traže dosta prostora za plivanje, ali i dosta prostora za skrivanje u bilju. Zbog navike da iskaču iz vode u potrazi za kukcima, akvarij mora biti zatvoren poklopcem. Njenom temperamentu odgovara i veliki apetit, zebrice će prihvatati svu kupovnu hranu i svu živu koja im može stati u usta, uključujući razne crve i kuhano zeljasto povrće.
Kada je u pitanju razmnožavanje, zebrice ne zahtijevaju ništa osim krupnijeg šljunka ili, još bolje, mrežice dovoljno široke da kroz nju propadne ikra, a istovremeno dovoljno uske da spriječi roditelje da dopru do nje i pojedu je. S lakoćom se mrijeste i u posudama vrlo malih zapremina, od 5 do 10 litara. Sastav vode ne igra važnu ulogu, ali mriještenje potiče hladna, svježa voda bogata kisikom. Ženka položi 100 do 400 komada ikre, nakon čega se roditelji izdvajaju iz akvarija. Inkubacija ikre pri temperaturi od 26 °C traje samo 24 sata. Nakon izleganja ličinke vise tri dana na staklu ili podlozi, a zatim proplivaju i počinju se hraniti[3].
Zebrice se smatraju najjednostavnijim početničkim ribama. Većina akvarista, kada želi krenuti sa mrijestom ikrašica, počinje upravo od njih. Do danas je odgojeno nekoliko varijeteta zebrica, od kojih neke proizvode zeleni, žuti ili crveni fluoroscentni protein. Susreću se varijeteti zlatne boje i varijacije koje se odlikuju mrljama kao kod leoparda, te albino oblici zebrice. Varijeteti s leopardovim uzorkom se ponekad označavaju kao zasebna vrsta po imenu Danio frankei[4].
izvori
Na Zajedničkom poslužitelju postoje datoteke vezane uz: ZebricaZebrica (lat.: Danio rerio) je vrsta tropske slatkovodne ribe iz roda Danio, porodice Cyprinidae (šarani). Vuče porijeklo iz potoka i rižinih polja Indije, a u Europu je unijeta 1905. godine. Može se sresti i u vodama Bangladeša, Pakistana i Nepala, a kao neželjeni kućni ljubimci dospjeli su i u vode Kolumbije. Vrlo su popularne akvarijske ribe, lake za uzgoj i razmnožavanje, a koriste se i u znanstvene svrhe.
Sebrafiskur (fræðiheiti: Danio rerio) er fiskur af vatnakarpaætt. Hann er ættaður frá suðausturhluta Himalajafjalla. Þetta er vinsæl og auðveld búrfiskategund og er hann einnig mikið notaður í vísindarannsóknir. Í Bandaríkjunum hefur verið gert erfðabreytt afbrigði sem er selt undir nafninu GloFish[1] í fimm sjálflýsandi litarafbrigðum (rauður, blár, lilla, appelsínugulur og grænn).
Sebrafiskur (fræðiheiti: Danio rerio) er fiskur af vatnakarpaætt. Hann er ættaður frá suðausturhluta Himalajafjalla. Þetta er vinsæl og auðveld búrfiskategund og er hann einnig mikið notaður í vísindarannsóknir. Í Bandaríkjunum hefur verið gert erfðabreytt afbrigði sem er selt undir nafninu GloFish í fimm sjálflýsandi litarafbrigðum (rauður, blár, lilla, appelsínugulur og grænn).
Danio rerio Hamilton, 1882, noto comunemente come danio zebrato o pesce zebra, è un piccolo pesce d'acqua dolce, appartenente alla famiglia Cyprinidae[1].
Questo ciprinide è diffuso in Asia (Pakistan, India, Bangladesh e Nepal). Abita le acque correnti e ferme, stagnanti, risaie, canali e ruscelli. È stato introdotto in Colombia.
Il corpo è affusolato, più arrotondato e grande nelle femmine; dal labbro superiore scende un piccolo paio di barbigli. La livrea presenta dorso olivastro e ventre bianco argenteo, mentre tutto il corpo vede alternarsi 4 linee orizzontali blu oltremare metallizzato ad altrettante linee bianche, più sottili. La coda e la pinna anale presentano la stessa striatura bianca e blu, la dorsale è blu orlata di bianco, le altre pinne sono olivastre. Le dimensioni si attestano sui 4-6 cm.
Nel periodo riproduttivo la femmina sviluppa una forma notevolmente appesantita dalle 3-400 uova che, dopo un vivace corteggiamento del maschio, essa deporrà sulla superficie fogliare.
Si nutre di larve d'insetti, piccoli crostacei e vermi.
È un pesce estremamente diffuso negli acquari di tutto il mondo: tra i più conosciuti ciprinidi, sempre vivace e in movimento, ha comportamento gregario e deve essere allevato soltanto in gruppi di almeno 5 esemplari. Proprio la sua diffusione in acquario, la sua capacità di adattamento e la fecondità hanno permesso agli allevatori di creare numerose varietà, da quella albina a quella con pinne "a velo" fino al "Danio leopardo", fino a qualche anno fa considerata una specie ancora da definire (Danio frankei), con livrea più frammentata e chiara, chiazzata di blu. Ultima varietà è la GloFish: danio zebrati modificati geneticamente per apparire vivacemente colorati.
Il danio zebrato è diventato il modello animale più utilizzato negli studi di sviluppo e di funzione di geni, in tossicologia, oncologia e medicina rigenerativa. L'organismo è infatti in grado allo stadio larvale di rigenerare tutti i tessuti, compreso il sistema nervoso. Per questo motivo è un modello di grande interesse per la medicina rigenerativa. La ragione di questo ampio utilizzo è sia di natura genetica (il suo genoma sequenziato nel 2001 è infatti molto simile a quello umano) che pratica poiché è un pesce che si riproduce molto velocemente ed i suoi embrioni, trasparenti, facilitano l'osservazione di numerosi aspetti biologici legati allo sviluppo e alla differenziazione cellulare. Il genoma mitocondriale di D. rerio, è stato sequenziato nel 2001 ed è completamente disponibile con licenza open source grazie al progetto Ensembl. Nel 2008 è stato sviluppato tramite mutagenesi inserzionale un ceppo mutante non pigmentato chiamato "bleached blond", utile per lo studio della formazione di metastasi per via ematica attraverso la colorazione con coloranti fluorescenti delle cellule neoplastiche.
Danio rerio GloFish
Danio rerio Hamilton, 1882, noto comunemente come danio zebrato o pesce zebra, è un piccolo pesce d'acqua dolce, appartenente alla famiglia Cyprinidae.
De zebravis of zebradanio (Danio rerio, synoniemen: Brachydanio rerio, Barilius rerio of Cyprinus rerio) is een kleine tropische vis die veel in tropische aquaria gehouden wordt. Vanaf eind jaren negentig is de zebravis in opmars als proefdier waarbij het gebruikt wordt voor onderzoek in de genetica, de ontwikkelingsbiologie en moleculaire celbiologie. Dit heeft al onder andere de glofish opgeleverd.
De naam zebravis wordt ook voor andere vissoorten gebruikt met een zwart-wit streeppatroon (bijvoorbeeld Pterois volitans en Pterois russelii). Mede daarom is ook de naam zebradanio veel in gebruik.
Zebravissen worden ongeveer drie tot vier centimeter lang. Ze hebben lichte zilverkleurige en donkerblauwe lengtestrepen op de rug, flanken en vinnen, een witte buik en kleine gele, rode of zelfs blauwe vlekjes over het hele lichaam. Van oorsprong komen ze voor in Zuid en Zuidoost-Azië waar ze leven in stilstaand tot stromend water van kanalen, sloten, meren en rijstvelden.[2]
De zebravis is een handige vissoort voor beginnende hobby aquarium houders. Ze zien er mooi uit, zijn gemakkelijk te houden en voort te planten in een tropisch aquarium en zijn goedkoop in aanschaf. Ze zijn echter wel gevoelig voor infectieziekten, zoals mycobacterium.
Zebravissen worden in de wetenschap steeds populairder als modelorganisme. Vooral in het gebied van de ontwikkelingsbiologie en moleculaire celbiologie wordt de zebravis van een steeds groter belang voor de fundamentele wetenschap. Zebravissen kunnen evenveel fundamenteel biologische kennis geven als het meest gebruikte proefdier, de muis. Een nadeel is natuurlijk dat zebravissen voor onderzoeken naar ziekten verder van de mens af staan dan muizen.
Vanuit een ethisch oogpunt kan het makkelijker zijn om proeven op de zebravis te doen in plaats van op de (aaibare) muis. De zebravis valt als gewervelde wel onder de proefdierwet, maar de kans op lijden bij de zebravis wordt vaak lager ingeschat. Als gesproken wordt over onderzoek op de zebravis, wordt vaak het zebravisembryo bedoeld. Aangezien embryo's niet onder de proefdierwet vallen, hoeft alleen toestemming gevraagd te worden voor het houden van volwassen zebravissen, zonder dat hier daadwerkelijke proeven mee uitgevoerd worden.
Het bekendste voorbeeld van manipulatie van de zebravis stamt uit 2002, toen onderzoekers erin slaagden om de zebravis genetisch te manipuleren met GFP. Hierdoor ontstond de gloeivis.
De belangrijkste redenen waarom de zebravis geschikt is als proefdier zijn:
De zebravis of zebradanio (Danio rerio, synoniemen: Brachydanio rerio, Barilius rerio of Cyprinus rerio) is een kleine tropische vis die veel in tropische aquaria gehouden wordt. Vanaf eind jaren negentig is de zebravis in opmars als proefdier waarbij het gebruikt wordt voor onderzoek in de genetica, de ontwikkelingsbiologie en moleculaire celbiologie. Dit heeft al onder andere de glofish opgeleverd.
De naam zebravis wordt ook voor andere vissoorten gebruikt met een zwart-wit streeppatroon (bijvoorbeeld Pterois volitans en Pterois russelii). Mede daarom is ook de naam zebradanio veel in gebruik.
Sebrafisk (Danio rerio) er ein art i karpefamilien som lever i aust i India. Han har langsgåande blå striper på grå botn og vert kring 5 centimeter lang. Hoene er tjukkare enn hannane. Sebrafisken er mykje nytta i forsking, særskilt i studiar av tidleg fosterutvikling, og er ein modellorganisme for ryggradsdyr.
Sebrafisken lever i stim og er ein populær akvariefisk som trivst ved temperaturar på 20–25 °C.
Sebrafisk (Danio rerio) er ein art i karpefamilien som lever i aust i India. Han har langsgåande blå striper på grå botn og vert kring 5 centimeter lang. Hoene er tjukkare enn hannane. Sebrafisken er mykje nytta i forsking, særskilt i studiar av tidleg fosterutvikling, og er ein modellorganisme for ryggradsdyr.
Sebrafisken lever i stim og er ein populær akvariefisk som trivst ved temperaturar på 20–25 °C.
Sebrafisk (Danio rerio) er en tropisk fisk i karpefamilien. Det er en utbredt art i akvariehandelen. Den brukes også i vitenskapelig forskning.
Fisken har navnet etter sine fem vannrette blå striper på sidene. Noen ganger brukes ordet sebrafisk også om skorpionfisker som har hvite og svarte striper.
Sebrafisken holder stort sett til i elver, kanaler og vann, men finnes også i saktestrømmende eller stillestående vann, spesielt rismarker. Den blir ca. 6 cm lang, og lever i omtrent fem år.
I akvariehandelen finnes det varianter med lange finner og andre farger. I det siste har genmanipulerte varianter med grønt eller rødt fluoriserende protein også blitt kommersielt tilgjengelige.
Sebrafisk er en hardfør art, og den regnes som et godt valg for nybegynnere. Den formerer seg også lett, og sprer 300-500 egg fritt i vannet.
Hannene er torpedoformet, og har gylne striper mellom de blå stripene. Hunnene har en større, lysere mage, og har sølv-striper i stedet for gull.
Sebrafisk er sårbar overfor Oodinium, Pseudoloma neurophilia og Mycobacterium.
Sebrafisk er en utbredt og nyttig modellorganisme for studier av virveldyrs utvikling og genfunksjoner. Dette er fordi det er enkelt å få dem til å formere seg, og de utvikler seg fra egg til larveform på under tre dager. For genetiske forskningsgrupper er sebrafisken et utmerket forsøksdyr og brukes i mange laboratorier for å erstatte eller supplere «høyere» virveldyr som rotter og mus.
Sebrafisken er en av de få fiskeartene som har vært i verdensrommet.
Embryoet er transparent, så hvis forskere modifiserer fiskens genotype i eggstadiet, kan de se resulterende endringer i organform eller dynamikk etter bare tre dager.
I tillegg har sebrafisken evnen til å regenerere finner, hud, hjertet og hjernen (i larvestadiene). Forskere har ofte kuttet i halefinnene og analysert gjenveksten for å teste for mutasjoner. Denne forskningen er ledende i det vitenskapelige samfunnet når det gjelder å forstå gjenvekst/helingsprosesser hos virveldyr.
Resultatene fra den genetiske forskningen har også blitt brukt til å fremstille en akvariefisk med fluoriserende pigmenter. Andre varianter er gyllen, sandfarget og langfinnet fisk.
I desember 2005 identifiserte en studie av den gylne stammen genet som er ansvarlig for disse fiskenes uvanlige pigmentering. Genet heter SLC24A5. Dette genet ser ut til å være nødvendig for produksjonen av melanin. Det har senere vist seg at dette genet hos mennesker er forbundet med hudfarge, og svært forskjellig mellom europeere med lys hud og afrikanere med mørk hud.
Sebrafisk har blitt introdusert og etablert seg i Japan og USA. Fisken har også blitt observert i Colombia.
Sebrafisk (Danio rerio) er en tropisk fisk i karpefamilien. Det er en utbredt art i akvariehandelen. Den brukes også i vitenskapelig forskning.
Fisken har navnet etter sine fem vannrette blå striper på sidene. Noen ganger brukes ordet sebrafisk også om skorpionfisker som har hvite og svarte striper.
Sebrafisken holder stort sett til i elver, kanaler og vann, men finnes også i saktestrømmende eller stillestående vann, spesielt rismarker. Den blir ca. 6 cm lang, og lever i omtrent fem år.
I akvariehandelen finnes det varianter med lange finner og andre farger. I det siste har genmanipulerte varianter med grønt eller rødt fluoriserende protein også blitt kommersielt tilgjengelige.
Sebrafisk er en hardfør art, og den regnes som et godt valg for nybegynnere. Den formerer seg også lett, og sprer 300-500 egg fritt i vannet.
Hannene er torpedoformet, og har gylne striper mellom de blå stripene. Hunnene har en større, lysere mage, og har sølv-striper i stedet for gull.
Sebrafisk er sårbar overfor Oodinium, Pseudoloma neurophilia og Mycobacterium.
Danio pręgowany[2] (Danio rerio) – słodkowodna ryba z rodziny karpiowatych. Popularna w hodowlach akwariowych. Do D. rerio włączony jest także Danio frankei opisany pierwotnie jako Brachydanio frankei Meinken. W 1993 roku Axel Meyer z zespołem opublikował wyniki badań filogenetycznych, które wykazały minimalne różnice między badanymi okazami D. rerio i D. frankei, a w rezultacie pozwoliły na połączenie obu taksonów w D. rerio[3].
Smukła, charakterystyczna ryba, posiadająca wzdłuż grzbietu pięć równoległych niebieskich pasków. Dorasta do ok. 5 cm. W akwariach występują formy weloniaste o bardzo długich płetwach, jak i z normalnymi płetwami. Istnieją też: odmiana danio lamparci (dawniej jako odrębny gatunek D. frankei)[3], o odmiennym rysunku i kolorach, a także różowa odmiana, która zamiast niebieskiego koloru na ciele ma kolor jasnoróżowy.
Dymorfizm płciowy: samce są smuklejsze, mają także dłuższe i bardziej weloniaste płetwy, pola pomiędzy niebieskimi pręgami złote. Samice mają zaokrąglone brzuszki, pola pomiędzy niebieskimi pręgami srebrne.
Danio pręgowany służy jako organizm modelowy w badaniach nad rozwojem kręgowców dzięki łatwemu rozmnażaniu i szybkiemu cyklowi życiowemu (stadium od jaja do larwy osiąga w okresie poniżej trzech dni, a dojrzałość płciową w ciągu trzech miesięcy). Dodatkowo ciało na wczesnych etapach rozwoju jest przejrzyste, co pozwala na obserwację narządów wewnętrznych u żywych osobników. Również w badaniach genetycznych ryba ta znajduje szerokie zastosowanie i uzupełniła inne zwierzęta laboratoryjne (szczury i myszy) w wielu projektach badawczych.
Badania nad danio prowadzi m.in. Christiane Nüsslein-Volhard, laureatka Nagrody Nobla z 1995. Dzięki olbrzymiej hodowli (7000 akwariów) i wywoływaniu przypadkowych mutacji Nüsslein-Volhard opisała ponad 1200 mutacji.
Z powodu zainteresowania badaczy danio należy do pierwszych kręgowców ze zsekwencjonowanym genomem.
Dzięki badaniom tego gatunku odkryto później np. rolę genu SLC24A5 u człowieka (kolor skóry).
W wyniku inżynierii genetycznej otrzymano GloFish, rybę akwariową produkującą fluoryzujące białka pochodzące z różnych organizmów morskich.
Hodowla: ryba stadna, wskazane trzymanie razem większej liczby sztuk. Lubi duży ruch wody oraz znaczne napowietrzanie. Wszystkożerna. Optymalna temperatura 20–24 °C (pH ok. 7). Danio jest rybą szybko pływającą, więc nie powinno się go trzymać z rybami majestatycznymi (np. gurami, skalar).
Rozmnażanie: ryba jajorodna. Podczas tarła należy odseparować grupę ryb (tarło stadne) najlepiej w stosunku: 3 samce na 1 samicę. Tarło odbywa się wczesnym rankiem przy pierwszych promieniach słońca. Ikra opada swobodnie na dno lub jest składana na liściach. Tarlaki zjadają zarówno ikrę, jak i narybek, należy więc po tarle odłowić rodziców z akwarium tarliskowego. Danio pręgowany uchodzi za łatwego do rozmnożenia. Podczas tarła woda powinna mieć temperaturę ok. 25–26 °C.
Danio pręgowany (Danio rerio) – słodkowodna ryba z rodziny karpiowatych. Popularna w hodowlach akwariowych. Do D. rerio włączony jest także Danio frankei opisany pierwotnie jako Brachydanio frankei Meinken. W 1993 roku Axel Meyer z zespołem opublikował wyniki badań filogenetycznych, które wykazały minimalne różnice między badanymi okazami D. rerio i D. frankei, a w rezultacie pozwoliły na połączenie obu taksonów w D. rerio.
O peixe-zebra (Danio rerio) é um peixe tropical teleósteo, cipriniforme, da família dos ciprinídeos. É uma espécie ovípara ornamental, muito apreciada por aquariófilos, com tempo de vida médio entre três e cinco anos. Também é conhecido pelos nomes de bandeirinha, danio-zebra, paulistinha e bandeira-paulista. É um importante organismo modelo, frequentemente utilizado em pesquisas genéticas e análises voltadas para a biologia do desenvolvimento. Sua notável capacidade de regeneração tem sido importante para a criação de linhagens transgênicas.
É nativo dos córregos da região sudeste do Himalaia,[2] incluindo Índia, Paquistão, Bangladesh, Nepal e Myanmar.[3]
O peixe-zebra pertence ao gênero Danio, da família Cyprinidae. A espécie está intimamente relacionada ao gênero Devario, como demonstrado por uma árvore filogenética de espécies próximas.[4]
Por muitos anos o peixe-zebra foi citado na literatura científica como Brachydanio rerio, até sua transferência para o gênero Danio.[5]
O peixe zebra, em condições de biotério, costuma atingir a maturidade sexual entre 3 e 6 meses após a fertilização, podendo variar de acordo com as condições ambientais, incluindo densidade populacional, temperatura e disponibilidade de alimentos. Devido a essas possíveis variações, é mais apropriado relacionar a maturidade reprodutiva ao tamanho do que à idade. Um tamanho de aproximadamente 23mm corresponde à maturidade reprodutiva da espécie.
O Danio rerio exibe rituais de acasalamento antes e durante a desova. Durante a corte, os machos nadam em círculos com as nadadeiras levantadas, próximos ao local de desova, para que as fêmeas os vejam. No momento da desova, o macho nada em paralelo com a fêmea e envolve o seu corpo, provocando a liberação de óvulos e liberando o esperma simultaneamente. Os machos competem pelas fêmeas, estabelecendo e defendendo territórios. Os peixes parecem preferir locais com cascalho, vegetação e com águas pouco profundas para a reprodução. Em biotério, pode-se adicionar plantas de plástico aos tanques de reprodução, com a intenção de simular o ambiente natural encontrado nas margens de rios.
As fêmeas são capazes de produzir centenas de ovos a cada fecundação. Após a liberação, o desenvolvimento embrionário se inicia, sendo os ovos transparentes logo após a postura (característica importante para a utilização da espécie como modelo de pesquisa).[6]
D. rerio é um organismo modelo muito utilizado em estudos genéticos e de desenvolvimento de vertebrados. O peixe tem um banco de dados on-line próprio, onde são depositadas informações genéticas, embriológicas, genômica e do desenvolvimento, o ZFIN. A espécie foi o primeiro vertebrado a ser clonado e uma das poucas espécies de peixe que foram enviadas ao espaço.
Como um organismo biológico modelo, o peixe-zebra possui inúmeras características que favorecem o seu estudo em diversas áreas do conhecimento. O seu genoma foi completamente sequenciado e é amplamente estudado por apresentar muitos genes com funções semelhantes ao da espécie humana; comportamentos de desenvolvimento facilmente observáveis e testáveis. O seu desenvolvimento embrionário é muito rápido, e seu embrião é relativamente grande, transparente e com desenvolvimento externo.[7]
Outra vantagem inclui o tamanho das espécies quase constante durante o desenvolvimento precoce, o que permite o uso de técnicas de coloração simples. O peixe-zebra também é conhecidamente semelhante aos modelos de mamíferos e dos seres humanos em ensaios de toxicidade, e exibe um ciclo de sono diurno semelhante ao dos mamíferos.[8]
Danio rerio apresenta grande similaridade anatômica com outros vertebrados durante seu estágio embrionário, sendo passível de utilização como modelo para o estudo de tópicos relacionados à biologia do desenvolvimento. Origem e morfologia de orgãos e tecidos são algumas das frentes de pesquisa abordadas, assim como o surgimento e desenvolvimento de doenças em humanos.[9][10]
A transparência do embrião, aliada a facilidade de obtenção e manutenção da espécie são fatores que explicam o rápido aumento da demanda deste organismo nas ultimas décadas, havendo ainda diversas linhagens mutantes que não desenvolvem melanócitos a medida que se maturam, mantendo assim a transparência do embrião e expandindo o tempo de visualização das estruturas de interesse.[11]
Existem bancos de dados robustos acerca da morfologia de D. rerio (FishNet) partindo do embrião, através de todas as fases do desenvolvimento até o indivíduo adulto[9] Além do genoma completo sequenciado.[12]
O surgimento e aprimoramento de métodos que fazem uso de fluorescência projetaram D. rerio para a popularidade entre os organismos modelos utilizados em biologia do desenvolvimento, permitindo a visualização detalhada em todos os níveis estruturais do embrião. A possibilidade de perturbação em pontos chave do ciclo embrionário, através de técnicas como silenciamento por RNAi ou Knockout deram abertura para o estudo do surgimento e da dinâmica celular na formação de orgãos, capacidade regenerativa e atividade neuronal.[13]
Dentre algumas contribuições de D.rerio como organismo modelo, podem ser citadas:
O embrião de peixe-zebra se desenvolve rapidamente, com precursores de todos os principais órgãos que aparecendo dentro de 36 horas após a fecundação. O embrião de D. rerio e da maioria dos peixes, assim como o embrião de aves, apresenta grande quantidade de vitelo, substância responsável por garantir o aporte de alimento na fase embrionária. Após a fecundação, o embrião começa como uma gema que possui uma única e enorme célula na parte superior ou polo animal, que se divide em dois e continua dividindo até que existam milhares de pequenas células. As células, em seguida, migram para baixo e para os lados da gema e começam a formar a cabeça e cauda. A cauda cresce e, em seguida, separa-se do corpo. A gema, composta principalmente de vitelo, encolhe ao longo do tempo, pois o peixe a utiliza para se alimentar à medida que amadurece durante os primeiros dias. Depois de alguns meses, o peixe adulto atinge a maturidade reprodutiva.[16]
A organização eixo Antero-posterior em peixes zebra (Danio rerio) ocorre logo nos primeiros estágios do desenvolvimento, anterior a formação da gastrula, sendo possível notar primeiramente a formação de estruturas da parte anterior do animal assim determinando sua posição. 10 horas após a fecundação já é possível identificar a estrutura como também o eixo dorsal ventral e, através de marcadores, outras regiões organizacionais, seu desenvolvimento segue um padrão similar as de anfíbios (xenopus) com a formação do centro de organização de Nieuwkoop.[17]
Este centro organizador deriva de produções genicas do zigoto, e por sua vez induzirá a formação do organizador de Spemman, esta estrutura sinaliza a formação dos eixos através da indução da diferenciação de estruturas como a notocorda.[18]
A sinalização do processo ocorre também similar aos anfíbios com beta-cateina em altas concentrações no plano nodal e estimulando a expressão de Squint e Bozozok estimulando a formação do escudo embrionário.
|coautor= (ajuda) O peixe-zebra (Danio rerio) é um peixe tropical teleósteo, cipriniforme, da família dos ciprinídeos. É uma espécie ovípara ornamental, muito apreciada por aquariófilos, com tempo de vida médio entre três e cinco anos. Também é conhecido pelos nomes de bandeirinha, danio-zebra, paulistinha e bandeira-paulista. É um importante organismo modelo, frequentemente utilizado em pesquisas genéticas e análises voltadas para a biologia do desenvolvimento. Sua notável capacidade de regeneração tem sido importante para a criação de linhagens transgênicas.
É nativo dos córregos da região sudeste do Himalaia, incluindo Índia, Paquistão, Bangladesh, Nepal e Myanmar.
Danio pruhované (Danio rerio, syn. Brachydanio rerio), medzi akvaristami známe aj ako zebrička je sladkovodná ryba z čeľade kaprovité (Cyprinidae), ktorá pochádza z oblastí východnej Indie, od Kalkaty až po Masulipatam.
Dorastá do veľkosti 6 cm (prírodná forma). Jedná sa o významný modelový organizmus v genetike a molekulárnej biológii.
Pochádza z južnej Ázie (východná India).
Telo je podlhovasté štíhle, zo strán mierne stlačené. Chrbát má rybka tmavý až olivovo hnedý. Oblasť bruška má zlatistý nádych. Na bokoch je zvyčajne 7-9 kovovo modrých pruhov. Tieto pruhy sú tiež na chvostovej a análnej plutve. Chrbtová plutvička je tmavšia so zlatým lemovaním. Z kútikov papuľky vyrastajú dva páry fúzov, jeden z párov je výrazne dlhší.
Existuje množstvo farebných variácií: závojová (predĺžené plutvy), závojovo zlatá, kovovo lesklá apod.
V prírode sa živia drobným hmyzom, ktorý spadne na hladinu. V akváriu ochotne prijímajú sušenú a mrazenú potravu.
Teplota vody pre Danio pruhované by mala byť okolo 20-26 ° C. Voda by mala byť slabo kyslá pH 6-6,5 a mäkká. Danio je veľmi prispôsobivá rybka aj čo sa týka chemizmu vody a tak nevadia drobné odchýlky v pH a tvrdosti.
Dania je mierumilovaná ryba. Veľmi čulá a plná energie. Väčšinu času sa dania medzi sebou pri hladine preháňajú a málokedy ich uvidíte v pokoji. V noci spí u dna.
Akvárium by malo mať čo najväčšiu dĺžku i na úkor šírky. Veľa vodných rastlín je samozrejmosťou. Do tých sa dania budú pravidelne trieť.
V prírode sa daniá rozmnožujú v období dažďov, teda pri veľkej zmene chemizmu vody. Trú sa v skupinách, svoje ikry rozptyľujú do vegetácie. Na trenie pripravíme nádrž o objeme 10 litrov, bez dna, ale s roštom alebo niečím čo zabráni rodičom požierať ikry. Na trenie vyberáme dobre živené 6 mesačné jedince. Nádrž obohatíme jemnolistými rastlinami. Voda v nádrži by mala byť čerstvá, mäkká a kyslá (to pôsobí aj ako dezinfekcia a ochrana ikier pred plesňou). Neskoro večer do nádrže umiestnime samčekov a ďalší deň ráno za svitania samičky (je lepšie viac samcov ako samičiek). K treniu dochádza takmer okamžite. Trú sa okolo dvoch hodín, z ikier sa do 48 hodín vyliahne poter, ktorý sa za týždeň rozpláve. Kŕmime drveným sušeným krmivom, vareným žĺtkom. Za 3 mesiace dosiahne poter predajnej veľkosti.
Danio pruhované (Danio rerio, syn. Brachydanio rerio), medzi akvaristami známe aj ako zebrička je sladkovodná ryba z čeľade kaprovité (Cyprinidae), ktorá pochádza z oblastí východnej Indie, od Kalkaty až po Masulipatam.
Dorastá do veľkosti 6 cm (prírodná forma). Jedná sa o významný modelový organizmus v genetike a molekulárnej biológii.
Zebrafisk, alternativt sebrafisk (Danio rerio)[3][4] är en fiskart i familjen karpfiskar.[5][6] IUCN kategoriserar arten globalt som livskraftig.[1] Inga underarter finns listade.[5]
I naturen förekommer arten främst i Bangladesh, Burma, Indien, Nepal och Pakistan. Beroende på population kan en fullvuxen zebrafisk bli 3,8 till 5 cm lång.[7][8]
Arten är lättskött och enkel att odla i fångenskap och därför omtyckt som akvariefisk. Zebrafiskar är aktiva och lever tillsammans i stim, och kräver därför gott om öppna simutrymmen. De uppskattar även om det finns områden i akvariet med tät vegetation där de kan lägga sina ägg. Zebrafisken är lättodlad men en så kallad romrövare, och för framgångsrik odling är det därför bäst att låta fiskarna avlägga sin rom i ett särskilt lekakvarium, varur man avlägsnar föräldrarna så snabbt som möjligt efter avslutad lek. Zebrafiskar leker helst under de tidiga morgontimmarna i det första gryningsljuset. Kullarnas storlek kan variera kraftigt beroende på föräldrarnas kondition och ålder, men uppgår vanligtvis till 400–500 yngel.[8]
Det stora utbredningsområdet gör att zebrafisken klarar sig utmärkt i områden med vitt skilda vattenvärden. Vad gäller vattenkemi lever zebrafisken i områden med en vattenhårdhet på 5–19 °dH och pH omkring 6–8. Dygnsmedeltemperaturen är 18–24 °C.[7]
Zebrafisk, alternativt sebrafisk (Danio rerio) är en fiskart i familjen karpfiskar. IUCN kategoriserar arten globalt som livskraftig. Inga underarter finns listade.
I naturen förekommer arten främst i Bangladesh, Burma, Indien, Nepal och Pakistan. Beroende på population kan en fullvuxen zebrafisk bli 3,8 till 5 cm lång.
Zebra balığı (Danio rerio), sazangiller (Cyprinidae) familyasından, doğal yaşam alanı Asya olan, yaklaşık 4–6 cm boyunda, yumurtayla çoğalan tropikal bir balık türüdür. Genellikle 80 ile 180 arasında yumurta bırakır ve yumurtalarına kendisi bakar. Diğer akvaryum balıklarıyla barışçıl olmakla beraber çiftleşme döneminde geçimsiz olabilir.
Genetik araştırmalarda kullanılan, çok hareketli, barışçıl bir balıktır. Akvaryumda kolayca çoğaltılabilir. Yüzecek geniş alan bulunduran, bitkilendirilmiş akvaryumları sever. Zebra balıkları sürü balıklarıdır. Akvaryumda grup halinde beslenmesi gerekir. Hepçildirler.
Brachydanio rerio ya da Danio rerio, zebra balığı veya zebra danio olarak da bilinir. Popüler bir akvaryum balığıdır ve balık beslemeye yeni başlayanların tercihidir.
Zebrabalığı, Güneydoğu Himalayalar'da, Doğu Hindistan'ın Ganj Bölgesi'nde, Pakistan'da, Bangladeş'te, Nepal'de ve Myanmar'da görülür. Çoğunlukla küçük akıntılar, pirinç tarlaları, kanallar gibi durgun veya düşük debili sularda yaşarlar. Japonya, A.B.D. ve Avustralya'da akvaryumculukta kullanılır. Kolombiya'da doğal ortamda görülmüştür ama bunun sebebi büyük ihtimalle bir akvaryumdan kaçmış ya da bırakılmış olmasıdır.
Son zamanlarda genetiği değiştirilmek suretiyle üretilmiş olan yeşil floresans, kırmızı floresans ve sarı floresans yapan çeşitleri ticari olarak satılmaktadır.
Ареал рожевого даніо — від Бірми до Таїланду, Малайзії, Суматри. Довжина тіла рожевого даніо — 6 см. Забарвлення сірувато-зелене, боки з зеленуватим, блакитним або фіолетовим блиском. Уздовж задньої частини тіла проходить вишнева смуга, знизу і зверху підкреслена синьою лінією. У старих риб ця смуга стає невиразною.[2] Даніо реріо водяться у водоймах Передньої Індії[3].
На сході Європи з'явилися 1906-го року[3].
У природі досягають довжини 5-6 сантиметрів, а в акваріумах значно менші.
Тіло їх вузьке, завдовжки 4—5 см. На жовтувато-сріблястих боках проходить по кілька темно-синіх блискучих смуг. У даніо реріо смуги покривають усе тіло, хвостовий і анальний плавці. У даніо крапчастого — черевце й анальний плавець укриті дрібними цяточками. Плавці прозорі, безколірні або жовтуваті. Від крапчастого даніо виведено леопардового.[2]
Самки відрізняються від самців більшим, округлим і світлішим черевцем.
Даніо — риби надзвичайно невибагливі й доступні для утримання початківцями. Найкраще вони почувають себе в яскраво освітленому видовженому акваріумі, де є вільне місце для плавання в середніх і верхніх шарах води. Маленьким даніо досить 10—15 літрового акваріума. Температура води повинна бути 22…26 °С. Хоч риби витримують короткочасні перегрівання до 30 °С і переохолодження до 15… 17 °С, — зниження її до 14 або підвищення понад 30 °C небажані. Раз на тиждень 1/5 частину води заміняють свіжою. Густо заселений акваріум обладнують фільтром і розпилювачем повітря. Апетит риби мають відмінний, бо невпинно рухаються, їдять вони будь-який живий і рослинний корм. При повноцінному годуванні й добрих умовах життя риби виростають здоровими і стають статевозрілими в 8—10 місяців. Дрібні даніо стають статевозрілими раніше.[2]
Щоб створити умови для нересту даніо, досить на дно скляної банки місткістю 2-3 літри покласти сплутану нейлонову волосінь і налити акваріумну воду, розведену в рівних частинах із свіжою відстояною[3]. Волосінь притискують до дна камінцями або скляними паличками. З вечора для нересту вміщують молодих статевозрілих риб, які попередньо були розсаджені на кілька днів. Нерест проходить, як правило, вранці, з появою перших сонячних променів. Після цього він припиняється, риб одразу забирають, оскільки вони поїдають свою ікру.
Можна садити кілька нерестуючих пар в один посуд.
Температура води в нерестовищі має бути 22-27 °C.
Через півтори-дві доби з'являються мальки. Вигодовують їх спочатку інфузоріями, потім коловертками і циклопами. Ростуть мальки досить швидко.
Cá ngựa vằn (tên khoa học: Danio rerio) là một loài cá nước ngọt nhiệt đới thuộc họ Cá chép.[1] Đây là một trong những loài cá cảnh phổ biến và là một động vật nghiên cứu tiêu chuẩn cho các thí nghiệm khoa học (model organism).
Cá phân bố ở một số nước Nam Á như Ấn Độ, Bangladesh, Pakistan, Nepal, Myanma. Được đặt tên là "ngựa vằn" do có 5 vạch đều nhau màu lam đậm dọc hai bên thân, kéo dài cho đến cuối vây đuôi. Thân cá hơi dẹt, miệng hướng lên phía trên. Cá đực có hình ngư lôi và có vạch vàng xen giữa các vạch lam; cá cái có bụng màu trắng lớn hơn và các vạch màu bạc xen giữa các vạch lam. Cá ngựa vằn có thể phát triển tới 6,4 cm, tuy trong bể chúng hiếm khi phát triển quá 4 cm. Cá dễ sinh sản và đẻ trứng lên giá thể ở dưới đáy.
Cá ngựa vằn là loài ăn tạp, thức ăn chính của chúng là giáp xác nhỏ, ấu trùng, côn trùng, trùn chỉ, cung quăng hoặc chúng có thể ăn nhiều loại thức ăn khác nếu không có các loại thức ăn trên.[2].
|month= bị phản đối (trợ giúp) Phương tiện liên quan tới Danio rerio tại Wikimedia Commons
Cá ngựa vằn (tên khoa học: Danio rerio) là một loài cá nước ngọt nhiệt đới thuộc họ Cá chép. Đây là một trong những loài cá cảnh phổ biến và là một động vật nghiên cứu tiêu chuẩn cho các thí nghiệm khoa học (model organism).
Да́нио-ре́рио[1], «Дамский чулок»[2], или брахиданио-рерио[3] (лат. Danio rerio) — вид пресноводных лучепёрых рыб семейства карповых (лат. Cyprinidae). Популярная аквариумная рыбка. Является модельным организмом в биологии развития и известна в англоязычной литературе как zebrafish. В отечественной научной литературе устоявшегося, удачного термина для этого вида нет (однако, «зебраданио» может быть одним из приемлемых вариантов). Данио-рерио является первым домашним животным, генетически модифицированным генами биолюминесценции в 2003 году. (см. GloFish).
Эта аквариумная рыбка имеет размер 2,5—4 сантиметров, длинное прогонистое тело, основной тон серебристый с ярко-синими полосами. У молодых рыб плавники короткие, со временем они отрастают и образуют вуаль (есть также длинноплавниковые линии). Края плавников могут быть окрашены в жёлтый цвет. Отличительной чертой является брюшко — у самки оно значительно толще.
Населяет реки и ручьи Пакистана, Индии, Бангладеш, Непала, Мьянмы и Бутана.
Danio rerio был предложен Джорджем Стрейсингером[en] в качестве модели для изучения эмбрионального развития и функций генов позвоночных. Важность этой модельного организма была подтверждена многими генетическими исследованиями.[4] Danio rerio — один из немногих видов рыб, которые побывали на орбитальной космической станции[источник не указан 1123 дня].
При изучении биологии развития Danio rerio имеет некоторые преимущества перед другими позвоночными. Эмбрион развивается быстро и проходит стадии от яйца до личинки всего за три дня. Эмбрионы крупные, выносливые, крепкие, прозрачные и развиваются вне матери, что облегчает манипуляции с ними и наблюдение[5].
Существует значительный потенциал в использовании Danio rerio в качестве модели для фенотипического скрининга[en] потенциальных лекарственных веществ благодаря скорости и удобству работы с ними[6]. Несмотря на довольно низкое сходство между человеком и рыбами, многие системы этих организмов, в частности, сердечно-сосудистая система, взаимодействуют с низкомолекулярными соединениями аналогичным образом. Достоверные результаты могут быть получены при исследовании фармакокинетики и токсичности препаратов. Методами генной инженерии могут быть разработаны линии Danio rerio, специфично имитирующие различные заболевания человека[6].
Danio rerio с мутантной окраской (bleached blond) был получен инсерционным мутагенезом. Мутант теряет черный пигмент в меланоцитах, так как не способен синтезировать меланин. Животному на фотографии четыре дня. В верхней части фотографии — животное дикого типа.
|coauthors= (справка) Да́нио-ре́рио, «Дамский чулок», или брахиданио-рерио (лат. Danio rerio) — вид пресноводных лучепёрых рыб семейства карповых (лат. Cyprinidae). Популярная аквариумная рыбка. Является модельным организмом в биологии развития и известна в англоязычной литературе как zebrafish. В отечественной научной литературе устоявшегося, удачного термина для этого вида нет (однако, «зебраданио» может быть одним из приемлемых вариантов). Данио-рерио является первым домашним животным, генетически модифицированным генами биолюминесценции в 2003 году. (см. GloFish).
斑馬魚,是一种热带淡水鱼,又名藍斑馬魚、印度斑馬魚、斑馬鿕、藍條魚、花條魚、印度魚,為輻鰭魚綱鯉形目鯉科的其中一種。[3]其原生于喜马拉雅地区,是一种受欢迎的观赏性鱼类。[4]同时,其在科研领域也是一种重要的而且被广泛使用的有脊椎模式生物,尤其是在生物体再生能力的研究方面[5],并且有多种基因编辑后的转基因人工培育种。斑马鱼(Danio rerio)在被重新被划归为鿕屬 (Danio)之前,曾被归类为短鿕属(Brachydanio),因而在科研文献中被长期称为Brachydanio rerio,而非如今的Danio rerio。[6][7][8][9][10]
斑马鱼原生于喜马拉雅地区东南部的溪流中,[11]见於孟加拉、印度、巴基斯坦、緬甸、尼泊爾等国。[12] 本品种出现在东印度的恒河流域,常栖息于溪流、运河、水沟、池塘、缓流或静滞水体(如稻田等)。[13] 斑马鱼是美國、日本、斯里蘭卡、菲律賓、模里西斯等地的外来物种,可能是被故意放生或是从养鱼场逃离而引入野外环境中。[12]
體色為銀色或金色,侧面覆蓋著五条橫紋,這些橫紋從頭部延伸至尾鰭的後端,臀鰭和尾鰭上同樣也有這種條紋,这些条纹与斑马条纹观感有同处,因而得名。背部呈淺橄欖黃;外形侧看为纺锤状,身形扁而修细,口向前。雄性为鱼雷状,体一般长于雌性,金色条纹间有蓝色条纹,色偏红;雌性腹部更大,偏白,条带呈银色,成年雌性可于臀鳍起点前侧观察到小的生殖乳突。斑马鱼可以长到长达6.4厘米,但通常不会长于4厘米。其寿命为2~3年左右,理想条件下可以超过5年。[13][14]
本魚棲息在溪流、溝渠或靜止的水中,每2至3天可產卵一次,每次可產約200顆以上的卵,屬雜食性,以昆蟲、小型甲殼類等為食。性情溫和,喜群游,通常數尾成一群。無家庭觀念。
斑馬魚的发育分为6个阶段:卵裂期,囊胚期,原肠胚期、分裂期、成形期和孵化期[15]。
斑马鱼的平均传代时间(generation time)为3个月。雄性斑马鱼需要在场等待排卵和產卵发生,随后雌性斑马鱼在每个卵块(clutch)中能够间隔2~3天产下几百枚卵。卵排出后,胚胎发育开始;如若没有精子,生长又在前几个细胞分裂后停止。受精卵几乎立刻变得透明,这一特性使得斑马鱼极大地方便了科研人员,使其适合科学研究。[13]
斑马鱼的胚胎发育身份迅速,受精36小时内先期物质就分化出了所有的器官:胚胎最早见于卵黄中,这时卵黄顶端出现一个巨大的细胞(见右侧,如0h时图);随后,这个细胞一分为二(见0.75h时图);再之后,细胞持续性分裂,直至形成上千个小细胞(见3.25h时图);大量的细胞随后迁移出卵黄的边缘(见8h时图),再随之开始形成一头一尾(见16h时图),尾生长并从卵细胞中分离出来(见24h时图);胚胎消耗作为养料来源的卵黄并逐渐成熟,卵黄逐渐收缩(见72h时图)。过若干月后,成年斑马鱼进入生殖成熟期(见右图底端图)。
科研人员为促进斑马鱼产卵,往往在放置小水箱中放置,模拟河流的岸边。小水箱内置隔板,隔离雌雄;并下有栅格,防止成鱼吞食鱼卵。适时打开隔板,供其交配产卵;因其昼夜节律,斑马鱼早上产卵为佳,故早上打开为好,打开时抬高水箱底栅格,减小鱼的活动范围,方便其交配;可在水箱底部发现卵,透明者为受精卵。科研人员可以通过此方式在10分钟内收集大量鱼卵。[16]雄性斑马鱼会对雌性身上诸如“好的斑纹”之类的显著标记更有反应,然而在集体中,雄性会和其能找到的雌性交配。在交配中吸引雌性的机制尚不清楚。交配环境中有植物,甚至是塑料植物,也会大大地促进产卵。[16]
斑馬魚是研究發育生物學的新興模式動物。斑馬魚由於具有飼育容易、胚胎透明、體外受精、突變種多、遺傳學工具成熟等諸多優點,近年來已成為研究脊椎動物發育與人類遺傳疾病的新興模式生物。與其他脊椎動物相較下,斑馬魚最大的優點就是具有多達6,000多種的遺傳突變種,這些突變種的建立大致上是利用X射線、ENU(英语:ENU)或反轉錄病毒的感染造成基因組的突變,之後再經由多次的子代篩選所得。這些突變種的表徵包含如胚層分化,器官發育,生理調適與行為表現等多方面,所以可提供研究人員極佳的正向遺傳學材料來進行發育機制上的研究。另外在斑馬魚系統中也開發出阻斷基因功能的工具-嗎啉基,可快速以逆向遺傳學手法來驗證基因的功能。所以正向遺傳學與逆向遺傳學的巧妙利用,可以正確推導出斑馬魚遺傳發育途徑,也是目前斑馬魚成為研究人類疾病新興模式生物的主要原因。
从2003年后期起,表达绿色、红色、黄色荧光蛋白的转基因品种斑马鱼在美国上市。表达荧光蛋白的斑马鱼也被商家称为“螢光魚”。别的培养品种包括“golden”、“sandy”、“longfin”、“leopard”等。其中leopard品种,之前被称为Danio frankei,是一种由于色素变异产生的带点状色彩的斑马鱼品种。[17]Xanthochromism(英语:Xanthochromism)的普通斑马鱼品种与leopard品种、长鳍次种都已通过育种筛选获得并被用于水族鱼类交易。(Xanthochromism是一种有关红色素被黄色素替代的带有特殊黄色。)[18]
国家斑马鱼资源中心(以下简称“中心”)是在中华人民共和国科技部和中国科学院支持下建立的非营利性科研服务性机构;中心以模式生物斑马鱼品系和相关资源的收集、创制、整理、保藏和分享为主要任务,以服务于全国斑马鱼研究学者为主要宗旨。众多斑马鱼转基因和突变品系都保存于国家斑马鱼资源中心[19]。
斑马鱼信息网(英语:Zebrafish Information Network)(ZFIN)提供了最新的目前已知野生型(wild-type,简称WT)斑马鱼信息。[20]
不同鿕属品种之间的杂交品种可能仍具有生殖能力,例如D. rerio(斑马鱼)与D. nigrofasciatus的杂交品种。[6]
為相當受歡迎的觀賞魚,飼養時以寬約60公分的水族箱為宜。
斑马鱼适应性强,易于新手养殖,因其性格活泼、繁殖迅速、较为美观、价格便宜、易于获得而受欢迎。[21]斑马鱼能6只以上成群游动,并且可以与水族箱中其它品种鱼类有互动,但它们易于感染卵旋虫病(英语:Oodinium)、天鹅绒病(英语:velvet disease)、微孢子蟲病、分枝杆菌病等疾病。成年斑马鱼会食鱼卵,保护鱼卵要通过将生殖区域隔离开来。
斑马鱼也常被用来产生转基因品种,也是荧光鱼的第一代品种。
斑马鱼属杂食性鱼类,主要食用浮游动物、浮游植物、昆虫、昆虫幼体等,但在食物条件不理想的情况下也会食用别的食物,例如蠕虫、甲壳类动物等。[13]
斑马鱼是一种常见且常用的科研模式生物,被用于研究脊椎动物的发育以及基因功能。其由美国分子生物学家George Streisinger(英语:George Streisinger)以及他在俄勒冈大学的同事在20世纪70、80年代首先在实验室中使用作模式生物。George Streisinger所进行的斑马鱼克隆实验形成了最早一批成功的脊椎动物克隆体之一。 [23] 斑马鱼在科研领域的重要性在成功的大规模先导性基因筛查(英语:genetic screen)中被凸显,这一实验常被称为Tübingen/Boston筛查(the Tübingen/Boston screens)。该品种鱼目前已有特有的线上数据库,包括遗传学数据库、基因组学数据库、发育信息数据库、斑马鱼信息网(英语:Zebrafish Information Network) (Zebrafish Information Network,简称ZFIN)。斑马鱼国际资源中心(The Zebrafish International Resource Center,简称ZIRC)储存了斑马鱼的遗传学信息,并由29250对等位基因的信息对研究领域发布。斑马鱼也是少数几种被送上太空的鱼类(英语:Animals in space)之一。
使用斑马鱼进行的研究已经在发育生物学、肿瘤学[24]、毒理学[25][26]、生殖医学、畸形学、遗传学、神经科学、环境科学、幹細胞、再生醫學[27][28]和进化理论[6]等领域取得进展。
作为模式生物,斑马鱼在科研领域具有许多优势。其基因組已经被被全部测序过(英语:whole genome sequencing),并且已经被充分了解过,其发育行为容易理解、易于观察、便于测验。其胚胎发育迅速,胚胎相对较大、突出而且透明,还可以在母体外發育。[29]此外,科研人员可以获得已经被研究成型的、带有特定特征的变异种。
其它的好处包括:在早期发育阶段,斑马鱼胚胎大小几乎不变,便于染色之类的简单技术的操作;其发育阶段中两个细胞组成的胚胎可以融合成一个细胞,从而获得纯合子胚胎;斑马鱼与人类和哺乳类模型在毒理测试方面显著相近,并且展现出类似于哺乳动物睡眠行为的昼夜节律。[30]然而,斑马鱼不是一个完全理想的实验模型,其在别的科研领域也有不适用之处,例如其不存在标准的饮食[31],又比如在一些有关人类疾病的基因方面,斑马鱼和哺乳类存在细小但很重大的差异。[32][33]
斑马鱼在幼鱼阶段能够再生其鳍、皮肤、心脏、体侧线的毛细胞以及大脑。[34][35]在2011年,英国心脏基金会(英语:British Heart Foundation)广告宣传以公布其将这项能力应用于人体的企划,以期筹措5000万英镑。[36][37]
斑马鱼也被发现可在创伤后再生感光细胞与视网膜神经。目前研究显示,这是由米勒细胞(英语:Muller glia)(Muller glia)的去分化与增殖介导的。[38]研究人员不断截断背上以及腹面上的尾鳍,并且分析其再生以观测其突变。已经发现,组蛋白去甲基化酶(英语:Histone methylation)在截肢部位出现,使得斑马鱼的细胞重新活跃为可再生的类似于干细胞的状态。[39]2012年,澳大利亚科学家发布的一项研究表明,斑马鱼使用一种被称为成纤维细胞生长因子的特异的蛋白质以确保其脊髓可以痊愈而无胶质瘢痕(英语:glial scar)。[5]此外,斑马鱼后侧体侧线的毛细胞被发现可以在创伤后或者发育中断后再生。[35][40]对其再生期间基因表达的研究使得若干重要的信号通路得以被识别出来,例如Wnt信号通路和成纤维细胞生长因子等。[40][41]
研究包括神经退行性疾病、行动失调、精神疾病、耳聋等在内的神经系统疾病时,研究人员使用斑马鱼来理解遗传学缺陷如何引起人脑、脊椎、感应器功能上的异常。科研人员也通过此途径深入了解人体错综复杂的肌肉与骨骼疾病,例如肌肉萎缩症等。[42]斑马鱼研究的另一焦点在于理解刺猬信号通路(一种生物信号)如何影响细胞生长乃至引起一系列的癌症。
由于斑马鱼的生命周期较短、可控性强,故常被用作遗传学研究的模型动物。基因敲落和用反義嗎啉基进行修改RNA剪接是常用的反向遗传学(英语:reverse genetics)技术。人工合成的高分子嗎啉基寡核苷酸(MO)包含与DNA、RNA相同的核苷;通过与互补序列结合,他们可以减少特定基因的表达或者阻碍其它RNA上进行的过程。嗎啉基寡核苷酸(MO)可以在32细胞阶段后注入胚胎内的某个细胞,使得这一细胞所分裂出的细胞都出现在某个基因上的表达减弱;不过,大分子可以任意透膜通行早期胚胎(小于32细胞)中的细胞中,进行扩散。[43][44]使用嗎啉基的指南描述了合理控制策略。[45]嗎啉基常以500pL剂量直接通过显微注射注入1~2细胞阶段的斑马鱼胚胎中,使之可以与多数细胞融合。[46]
斑马鱼基因敲除的难点在于:基因组在完成輻鰭魚和肉鳍鱼的分化之后的基因复制中,由于同源基因互补,同源基因中其中之一很难不被表达。[47]尽管斑马鱼的基因組很复杂,市面上还是不少有供研究基因表达谱以分析基因表达的国际化的商业平台的,并且还推荐使用ChIP-on-chip(英语:ChIP-on-chip)技术的规范。[48]
维康信托基金会桑格研究所(英语:Wellcome Trust Sanger Institute)在2001年启动斑马鱼基因组测序项目。蒂宾根参考样品系的基因组序列可以在美国国家生物技术信息中心(NCBI)的斑马鱼基因组上获得。斑马鱼参考基因组被注是Ensembl项目的一部分,由基因组参考联合会(英语:Genome Reference Consortium)(Genome Reference Consortium)所维护。[49]
2009年,印度德里的基因组和整合生物学研究所(英语:Institute of Genomics and Integrative Biology)(Institute of Genomics and Integrative Biology)宣布了一种野生品系斑马鱼的基因组测序,其包含大约17亿对碱基。[50][51]野生型斑马鱼的基因组测序差异倍数为39。与参照基因组的比较分析发现了超过500万单核酸突变和超过160万插入或剪切突变。共1.4GB超过26,000个蛋白质编码基因的斑马鱼参照基因组序列由Kerstin Howe等人于2013年发布。[52]
在2001年10月,来自奧克拉荷馬大學的研究人员公开了斑马鱼的完整线粒体DNA序列。[53]这一序列包含16,596个碱基对,与其它鱼类差别不超过100个碱基对,仅仅比金鱼(双名法:Carassius auratus)的长18个碱基对,比鲤鱼(双名法:Cyprinus carpio)的长21个碱基对。其线粒体基因含量与基因顺序与常见的脊椎动物线粒体DNA相同,包含13种蛋白质编码基因和1个包含重链复制起点的非编码控制区。其中间发现有,共5个的1组tRNA基因和类似脊椎动物轻链复制起点的序列。因为从碱基对变化的角度很难得出有关适应性的结论,所以很难得出进化上的结论。 [53]
1999年,nacre变异在斑马鱼体内的哺乳类同源基因MITF传输因子中被识别出来。[54]人体MITF(英语:MITF)的变异会导致眼部缺陷和色素缺失,这一症状是瓦登伯革氏症候群的一种。2005年12月,对golden品系的研究认为一种被称为SLC24A5(英语:SLC24A5)的溶质载体蛋白编码基因导致了其不同寻常的体色,这种蛋白似乎在黑色素形成过程中是必要的,并且通过马琳代(Morpholino)敲除,其这一功能被确认。随后,与人体直系同源的基因在实验中被识别出来:一个单碱基对差异被发现能够大大影响肤色,使得浅肤色的欧洲裔人种与黑肤色的非裔人种被区分开来,但这一实验并未对人做实验,而是采用了比较基因组学这一新领域的研究方法。[55]带有nacre突变的斑马鱼与带roy orbison (roy)突变的斑马鱼交配可以得到没有黑素细胞和虹细胞的斑马鱼,这些得到的斑马鱼在成年期也是透明的,一律有着带颜色的眼睛和半透明的皮肤。[9]
转基因是一种研究斑马鱼基因的功能的常见手段。通过使用Tol2转位子体系的方法,构建转基因品种斑马鱼尤其容易。[56]
2008年,波士頓兒童醫院的研究人员开发了一种新的斑马鱼品系Casper。这种品系的成鱼体色透明。[9]这能够方便对细胞活动、循环系统遠端轉移等现象的细致观察。由于人和斑马鱼有许多基因功能是相同的Casper品种被寄予加深人类对如白血病等癌症在内的人类疾病研究的厚望。[9]在2013年1月,日本科学家转基因透明斑马鱼品系得到可以在高强度脑活动时放出可见发光的品系,使得斑马鱼对外界刺激的反应可以被记录精确到特定的大脑发光区域。[10]
2007年1月,复旦大学研究人员修改了斑马鱼的基因,使得其能够用于探测水体中的雌激素污染,这一污染被认为与男性不育有关。研究人员克隆了对雌激素敏感的基因,将之注入斑马鱼的受精卵中,得到的转基因鱼会在感知污染时变绿。[8]
2015年,布朗大学的研究人员发现,10%的斑马鱼基因并不依赖于U2AF2(英语:U2AF2)蛋白质来启动RNA剪接。这些基因在每个内含子的尾端有着AC和TG碱基对的重复序列。在3'剪接位置(3' splicing site,简称3'ss)上,腺嘌呤(A)和胞嘧啶(C)交替重复 ;在5'剪接位置(5' splicing site,简称5'ss)上,互补的胸腺嘧啶(T)和鳥嘌呤(G)同样交替重复。研究人员发现,斑马鱼对U2AF2蛋白的依赖比人类更小,而这一蛋白对RNA剪接的发生是必需的。这种在内含子周围重复碱基对以改变RNA二级结构的模式在真骨类中曾发现过,但在四足類中未曾发现过。这表明四足類中的某一进化可能导致了人类与斑马鱼在对U2AF2依赖程度的差异。[57]
近亲交配后,幼鱼会显现近交衰退的不良后果。近交衰退主要由有害隐性基因的表达产生的。[58]对于斑马鱼而言,在较为紧张的环境(例如人为因素造成的紧张)中,近交衰退被认为会更加严重。由化学药剂克霉唑(一种咪唑类抗真菌类药物,用于农业、兽医、医疗)诱导的斑马鱼环境压力感受会加剧近亲繁殖在关键生育特性上的影响。[59]胚胎有效率在近亲杂交的鱼中大大减小,并且雄鱼产生后代有减少趋势。
斑马鱼被用来生产包括黑色素瘤、白血病、胰腺癌和肝細胞癌等癌症研究时使用的转基因模型。[60][61]表达突变的BRAF或NRAS癌基因的斑马鱼模型在置于缺乏肿瘤抑制蛋白(p53)的背景下会得上黑色素瘤。在组织学上,这些肿瘤高度类似于人类疾病,是可移植入人体的,并且展现了大范围的基因组变化。BRAF基因黑色素瘤模型鱼被用来作两种筛选的平台,这一方法公布于2011年3月的《自然》上。在另外一项研究中,这一模型被用来理解人类黑色素瘤中扩增和过表达的基因的功能作用。[62]SETDB1基因能在斑马鱼体内显著地加速肿瘤生成,从而显示了其作为致癌基因的性质。这一点尤为重要,因为目前已知SETDB1参与了表观遗传调控,而表观遗传调控越发地被认为是肿瘤细胞生物学的核心。
在别的研究中,研究人员使用化学筛查,来针对起源神經脊细胞中的遗传程序进行靶向治疗。[63]这项研究显示,一种叫做来氟米特(leflunomide)的的小分子抑制DHODH蛋白可以阻止神經脊干细胞的发育,通过干涉转录延伸(英语:Transcription_(biology)#Elongation)能够避免这一发育最终所导致的黑色素瘤的发生。因为这一过程会针对性识别黑色素瘤而非其它单一的遗传变异,来氟米特可能在人类黑色素瘤治疗方面有所利用价值。[64]
在心血管研究领域,斑马鱼被用来模拟凝血、血管新生、心脏衰竭和先天性心臟病。[65]
研究急性炎症中,研究人员已经建立了炎症研究的斑马鱼模型以及相关处理机制,使得研究人员能对炎症的遗传控制机制进行细化研究,并且有可能以此识别有潜力的新药物。[66]
斑马鱼在研究脊椎动物的固有免疫方面是广泛使用的模式生物(固有免疫能够在受精后28~30小时内进行吞噬作用,吞噬作用是免疫反应的重要一环)。[67]与之对比,适应性免疫(也称特异性免疫、获得性免疫、后天性免疫)在受精后至少四周才能在功能上达到成熟状态。[68]
由于人类和斑马鱼的免疫系统保守性较强、相对一致性高,许多人类传染病可以在斑马鱼上模拟。[69][70][71][72]斑马鱼透明的早期胚胎被用于深入研究活体成像和分析宿主和病原体之间的互动。[73][74][75][76]科学家已经建立了用于模拟一大批细菌、病毒、寄生虫类病原体的斑马鱼模型,例如用于结核病研究的斑马鱼模型已经为分支杆菌的致病机制研究提供了深入研究的平台。[77][78][79][80]此外,也已经发展出使用斑马鱼感染模型进行高通量微抗生素药物筛查的自动化技术。[81][82]
斑马鱼的另一显著特征在于其拥有四种视锥细胞,除人体内拥有的红色、绿色、蓝色敏感视锥细胞外,拥有紫外线敏感细胞。斑马鱼因此可以看见非常广的色谱。故斑马鱼也被用于研究视网膜的发育,尤其是视锥细胞如何在视网膜中形成镶嵌方面。斑马鱼和一些真骨类鱼类以其视网膜上高度精密的视锥细胞镶嵌排列备受科学家关注。[83]
这一对斑马鱼视网膜特性的研究也已经延展至人类的视网膜医学研究。2007年,伦敦大学学院的研究人员培养出一种成年斑马鱼幹細胞,这些干细胞在斑马鱼和哺乳动物的眼睛中被发现,且最终会发育成视网膜神经。这些细胞可以注射进入眼部,用于治疗损坏视网膜神经的疾病,此类疾病涵盖大部分眼疾,包括黃斑部退化、青光眼、糖尿病相关失明等。研究人员研究了人眼中的Müller细胞,其研究对象年龄从18个月大到91岁。研究中,科研人员能够将这些细胞培养为所有种类的视网膜神经细胞。研究团队在实验室可以轻松地培育这些细胞,并且还将培育出的干细胞移植进入大鼠视网膜中对周围的神经进行观察,研究人员称这些干细胞试图以与在人体内相同的方式发育。[84]
如同在许多进行中的研究项目所演示的那样,斑马鱼模型使得研究者不仅能够识别除引发人类疾病的基因,也可以用来在药物开发项目中开发新的治疗药剂。[85]斑马鱼胚胎是一种快速、性价比高且可靠的致畸检验模型。[86]使用斑马鱼进行药物筛查可以识别具有生物学疗效的新的化合物种类,或者发现已知药物的新用途。例如一种常用的抑制剂(瑞舒伐他汀)通过斑马鱼试验发现可以抑制前列腺癌的生长。[87]迄今为止,已经进行过65项小分子筛查,其中至少一项已经进行临床试验。[88]在这些筛查中,许多技术难度仍待解决,例如:药物吸收率在不同组织或者器官是不同的,这一不同导致药物的实际有效浓度(即其对特定部位的暴露量)无法从其水溶液浓度推算;个体动物之间的天然差异等。[88]但对于理解药效而言,药物的暴露产生了药效,因此了解药物在体内的暴露量是至关重要的。同时,将斑马鱼身上的实验结果解读为对人类等高等脊椎动物有效的结果需要在知悉药物浓度和药效之间的关系基础上,这一基础可由药物代谢动力学和药物效应动力学方面分析产生。迄今,只有对于对乙酰氨基酚的斑马鱼幼体模型已经建立了上述所言的人体和药物相互作用的模型。[89]但在斑马鱼身上进行药理学分析前景仍是广阔的。[90]
英国桑格研究中心(英语:Wellcome Trust Sanger Institute)承办:
基因组学与整合生物学研究中心(英语:Institute of Genomics and Integrative Biology)(Institute of Genomics and Integrative Biology,简称IGIB)承办:
斑馬魚,是一种热带淡水鱼,又名藍斑馬魚、印度斑馬魚、斑馬鿕、藍條魚、花條魚、印度魚,為輻鰭魚綱鯉形目鯉科的其中一種。其原生于喜马拉雅地区,是一种受欢迎的观赏性鱼类。同时,其在科研领域也是一种重要的而且被广泛使用的有脊椎模式生物,尤其是在生物体再生能力的研究方面,并且有多种基因编辑后的转基因人工培育种。斑马鱼(Danio rerio)在被重新被划归为鿕屬 (Danio)之前,曾被归类为短鿕属(Brachydanio),因而在科研文献中被长期称为Brachydanio rerio,而非如今的Danio rerio。
 分類 界 : 動物界 Animalia 門 : 脊索動物門 Chordata 亜門 : 脊椎動物亜門 Vertebrata 綱 : 条鰭綱 Actinopterygii 目 : コイ目 Cypriniformes 科 : コイ科 Cyprinidae 亜科 : ラスボラ亜科 Rasborinae 属 : ダニオ属 Danio 種 : ゼブラフィッシュ D. rerio 学名 Danio rerio 和名 シマヒメハヤ 英名 Zebrafish
分類 界 : 動物界 Animalia 門 : 脊索動物門 Chordata 亜門 : 脊椎動物亜門 Vertebrata 綱 : 条鰭綱 Actinopterygii 目 : コイ目 Cypriniformes 科 : コイ科 Cyprinidae 亜科 : ラスボラ亜科 Rasborinae 属 : ダニオ属 Danio 種 : ゼブラフィッシュ D. rerio 学名 Danio rerio 和名 シマヒメハヤ 英名 Zebrafish ゼブラフィッシュ またはゼブラ・ダニオ (学名:Danio rerio) は、インド原産の体長 5 cm ほどの小型の魚である。和名はシマヒメハヤ。コイ目コイ科ラスボラ亜科(ダニオ亜科、ハエジャコ亜科とも)に属し、オイカワ、コイや金魚などに近い。成体の体表に紺色の縦じまをもつことから、シマウマにみたててこの名がある。飼育、繁殖が容易な魚で、流通価格も安く、観賞魚としてよく飼われている。体色やヒレなどに変異のある改良品種が存在する。生物学では脊椎動物のモデル生物としてよく用いられる。モデル生物としてはゼブラフィッシュ、観賞魚としてはゼブラ・ダニオの名が一般的である。
生活環は3か月、寿命は5年程度。性質は活発で、水中を素早く泳ぎ回る。更に温和なので他魚との混泳も同程度のサイズの魚となら問題ない。雑食で飼育が容易。多産で1組の雌雄が一度に数百の卵を産む。卵は直径 1 mm 程度、透明で観察や実験操作が容易である。 また、遺伝子を組み換えられた本種が未承認で輸入、販売され、関わった業者が環境省の指導を受けた事もある。
脊椎動物で見られる生命現象を研究するためのモデル生物として世界中の研究室で研究に用いられている。1981年にはホモ二倍体の個体が得られている[1]。脊椎動物初の化学変異原ENUを用いた大規模変異スクリーニングがゼブラフィッシュを用いて行われた。遺伝子機能研究に欠かせない遺伝子導入、トランスジェニックフィッシュの作製を、Tol2トランスポゾンを用いて非常に容易に行うことができる。また、CRISPR/Cas9を用いた遺伝子変異導入技術も確立されている。
この魚は、以下のように遺伝学研究、発生生物学研究に用いる上での優れた特長を持っている。
結果として、実験発生学的実験と遺伝学的解析を同時に行える点で、脊椎動物では他に例がない。脊椎動物であるから、ヒトを含んで共通点が多い[2]。
ダニオは縄張りをつくるため、水槽内では他の小型の観賞魚を追い回す習性のものが多い。
生後17時間で自発的なしっぽの動きがみられる[3]。
その3-4時間後には、不規則なburstパターンの活動からside-sideの規則的な運動をするようになる。[4]
生後21時間でRBニューロンを介した接触反射を示すようになる[5]。
1-2日目には規則的な遊泳がみられ、また刺激場所に応答した適切な反射を示す[6]。
4日目には大まかな神経系が完成し、摂食行動も示すようになる(まだ脳は成長し続ける)[7]
ゼブラフィッシュの神経系はそのサイズとアクセスのしやすさから、神経科学のモデル動物として活用されている。
ZFINに掲載されているアトラス・リソースのうち[9]、神経系に着目しているもの
そのほかにも
などがある。
データベース間をまたいで利用できるような研究も進められている[13]
浅島誠・武田洋幸編、『シリーズ21世紀の動物科学 5 発生』、2007、培風館
Zebrafish Behavior: Opportunities and Challenges.[21]
ゼブラフィッシュ またはゼブラ・ダニオ (学名:Danio rerio) は、インド原産の体長 5 cm ほどの小型の魚である。和名はシマヒメハヤ。コイ目コイ科ラスボラ亜科(ダニオ亜科、ハエジャコ亜科とも)に属し、オイカワ、コイや金魚などに近い。成体の体表に紺色の縦じまをもつことから、シマウマにみたててこの名がある。飼育、繁殖が容易な魚で、流通価格も安く、観賞魚としてよく飼われている。体色やヒレなどに変異のある改良品種が存在する。生物学では脊椎動物のモデル生物としてよく用いられる。モデル生物としてはゼブラフィッシュ、観賞魚としてはゼブラ・ダニオの名が一般的である。
제브라피쉬(Zebrafish), 또는 제브라 다니오(학명: Danio rerio)는 잉어과에 속하는 물고기로, 푸른색 몸에 횐색 줄무늬가 있기 때문에 "제브라(얼룩말)다니오"로 불린다. 원산지는 인도이며 관상어로 곧잘 사육된다. 몸길이는 4~5cm정도이다.
인간의 유전자와 많은 부분이 상당히 일치한다고 하여 실험동물로 많이 쓰이며,[2] 강인하고 기르기 쉬워 애완동물로 기르기도 쉽다. 어류 애호가들은 제브라피쉬를 수조 속 수질을 관상어에게 알맞게 하는 일명 '물잡이'를 할 때 쓰고는 한다.[3] 초보자용 열대어로 널리 알려져있으며 싼 가격과 구하기 용이함으로 인해 행사에서 사은품으로 많이 나눠주기도 하는 물고기이다.[4]
제브라피쉬는 척추동물의 발달과 유전자 기능에 대한 연구를 위해 과학계에서 흔히 사용되는 모델 생물이다. 제브라피쉬는 1970년대와 1980년대에 오리건 대학교의 분자생물학자 조지 스트라이징거와 연구진에 의해 모델 생물로 사용되기 시작했다. 스트라이징거는 제브라피쉬를 복제했는데, 최초의 척추 동물 복제 사례 중 하나이다.[5]
이후 유전학적 검사법 연구에서 좋은 성과들을 보여주며 실험 동물로서의 입지가 굳어졌다. 유전, 게놈, 개발 정보에 대한 전용 온라인 데이터베이스인 제브라피쉬 정보 네트워크(ZFIN), 29,250개의 대립유전자를 보유하여 연구 단체에 배포할 수 있는 유전자 자원 저장인 제브라피쉬 국제 자원 센터 (ZIRC)가 있을 정도로 모델 생물로 흔히 사용된다.
제브라피쉬(Zebrafish), 또는 제브라 다니오(학명: Danio rerio)는 잉어과에 속하는 물고기로, 푸른색 몸에 횐색 줄무늬가 있기 때문에 "제브라(얼룩말)다니오"로 불린다. 원산지는 인도이며 관상어로 곧잘 사육된다. 몸길이는 4~5cm정도이다.
인간의 유전자와 많은 부분이 상당히 일치한다고 하여 실험동물로 많이 쓰이며, 강인하고 기르기 쉬워 애완동물로 기르기도 쉽다. 어류 애호가들은 제브라피쉬를 수조 속 수질을 관상어에게 알맞게 하는 일명 '물잡이'를 할 때 쓰고는 한다. 초보자용 열대어로 널리 알려져있으며 싼 가격과 구하기 용이함으로 인해 행사에서 사은품으로 많이 나눠주기도 하는 물고기이다.