en
names in breadcrumbs


IUCN Red List of Threatened Species: data deficient
Development - Life Cycle: metamorphosis
Other Physical Features: ectothermic ; bilateral symmetry
Key Reproductive Features: gonochoric/gonochoristic/dioecious (sexes separate)
Amphibians are a unique group of vertebrates that are distributed across the globe. Sadly, nearly one-third of the world’s over 7,300 species are threatened. Frogs are the most speciose of three orders of amphibians, which also includes salamanders and worm-like caecilians.
Use these cards to help you focus on the key traits and behaviors that make different frogs species unique. Drawings, photographs and notes or recordings of vocalizations are a great way to supplement your field notes as you explore the diversity of these amazing animals.
Most people learn about the basics of frog reproduction in elementary school. Frogs lay eggs in water, and the eggs hatch into tadpoles that grow into frogs. Only about half of all frogs follow these exact steps, but there are a few rules of thumb about frog reproduction. All frogs reproduce sexually, and all hatch from eggs.
In almost all frogs, egg fertilization happens outside the female's body instead of inside. The female releases her eggs and the male releases his sperm at the same time. In order to make sure that the sperm reach the eggs, the male and female get into a mating posture called amplexus. The male climbs onto the female's back and clasps his forelegs around her middle. Frogs can stay in amplexus for hours or even days as the female releases as few as one or as many as several hundred eggs.
Sometimes, it's easy to tell male frogs from female frogs. Many species are sexually dimorphic, meaning that there are differences between the bodies and colors of males and females. But in some species, males and females are hard to tell apart. In such species, male frogs often produce a release call when clasped by another male. During mating season, researchers can use release calls to tell which frogs are male and which are female.
All frogs' eggs require moisture to develop, and most frogs abandon their eggs once they're fertilized. But not all eggs incubate underwater or without parental care. A few species carry their eggs in their vocal sacs or their abdomens. Others lay eggs in dry areas and keep the eggs moist with water or urine. Depending on the frog's species and the climate in which it typically lives, the eggs can hatch in a few days to a few weeks.
In a few species, fully formed froglets hatch from the eggs, but most of the time the frog starts its life as a tadpole. While adult frogs are carnivores, tadpoles can be vegetarians or omnivores. Some are filter feeders that eat algae, and others have teeth and can eat anything from rotting vegetation to other tadpoles. Either way, tadpoles tend to be voracious eaters -- it takes a lot of energy to complete their metamorphosis into frogs.
The Frog Finder is a unique smartphone guide for searching worldwide frog and toad distributions. It is designed for amphibian researchers, naturalists, educators, hobbyists and anyone interested in knowing species that might occur—or may have once occurred—in specific locations.
Download the free Frog Finder iPhone app.
The Frog Finder was created by Seungkeol Choe and Jeff Rice, with support from the University of Utah J. Willard Marriott Library in conjunction with the Western Soundscape Archive and the Encyclopedia of Puget Sound at the University of Washington.
The Frog Finder is a unique smartphone guide for searching worldwide frog and toad distributions. It is designed for amphibian researchers, naturalists, educators, hobbyists and anyone interested in knowing species that might occur—or may have once occurred—in specific locations.
Download the free Frog Finder iPhone app.
The Frog Finder was created by Seungkeol Choe and Jeff Rice, with support from the University of Utah J. Willard Marriott Library in conjunction with the Western Soundscape Archive and the Encyclopedia of Puget Sound at the University of Washington.
'n Padda is 'n koudbloedige, stertlose dier wat aan die klas amfibieë behoort. "Amfi-" beide "bios" lewe: wat op die land asook in die water leef.
Wanneer hulle gebore word kry hulle (nes visse) met kieue hul suurstof uit water en swem met hulle sterte, maar sodra hulle groter word en van gedaante verwissel, haal hulle in die lug asem soos alle landdiere en verloor hul stert.
'n Padda se vel is normaalweg slymerig (natterig), kaal sonder skubbe, vere of hare. In die padda se vel is daar kliere wat 'n tipe slym afskei; die slym help om sy vel vogtig te hou.
Sommige paddas se velkleur (swart, groen, bruin, geel ens.) help hulle vir kamoeflering teen hul vyande.
Sommige paddas kan weer van kleur verander om hulle by hul omgewing aan te pas. Die varklelie-padda is bedags ivoorwit wanneer hy in die voue van dié blom skuil. Op dié manier weerkaats hy ook die ergste hitte van die son. Saans is hy donkerder van kleur, sodat hy onopsigtelik in die nag kan beweeg.
Ander het weer helderkleurige velkleure (rooi, blou en ander helder skakerings) wat hul roofvyande waarsku dat hul baie giftig kan wees.
In werklikheid skei alle paddas, en nie net die helderkleuriges nie, 'n melkerige gif af, vanuit kliere wat in hul vel voorkom; die gif help hulle beskerm teen vyande. Die gif van die meeste paddas is nie baie gevaarlik vir die mens nie en sal slegs 'n ligte vel-irritasie veroorsaak.
Paddas se ribbetjies lyk swak ontwikkel en sal nooit 'n borsbeen bereik nie.
Paddas het 'n kenmerkende vermoë om ver te kan spring. Hul vier pote is oor die algemeen net daar om hul liggaam op land te stut, daar slegs sekere paddas op hul vier pote kan loop.
Soos alle amfibieë word die meeste paddas voortgeplant deur eiers wat in die water of in klam plekke gelê word (sekere soorte is lewendbarend). Aanvanklik is die padda 'n visagtige larwe, die paddavissie, en haal hy deur kieue asem. Wanneer hy ouer word, verander hy egter van 'n dier wat soos 'n vis lyk en slegs in die water kan leef in 'n dier wat op die land kan lewe. Hierdie veranderinge vind soos volg plaas:
Die wyfiepadda lê gewoonlik haar eiers vroeg in die lente (daar is gewoonlik besonder baie van hulle). Die padda-eiers is bedek met 'n gelatienagtige stof, wat hulle in 'n digte massa saamhou. Die eerste embrionale ontwikkeling vind in die eier plaas. Sowat twee weke nadat die eier gelê is, kom 'n larwe (die paddavissie) daaruit.
Aanvanklik kan die paddavissie nie swem of eet nie. Hy klou aan die oorblyfsels van sy eier of aan die blaar van die een of ander waterplant vas deur middel van kleeforgaantjies aan die onderkant van die liggaam. Die diertjie haal asem deur drie pare uitwendige kieue. Na 'n paar dae verskyn die mond, die neusgate gaan oop, en die oë word onder die vet gevorm.
Die stert word langer en die uitwendige kieue word deur vier pare inwendige kieue vervang. Sodra die paddavissie hierdie stadium van ontwikkeling bereik, begin hy om te swem en te eet. Later verskyn twee agterbene, en dan die voorbene, terwyl die stert kleiner word en uiteindelik verdwyn. Mettertyd word die inwendige kieue ook deur die liggaam geabsorbeer, die longe ontwikkel, en die paddavis verander in 'n klein paddatjie. Hierdie metamorfose duur gewoonlik drie maande.
Paddas kommunikeer met ander paddas deur middel van verskeie komplekse roepe, soos kierie-kieries en kwake en ander geluide. Hierdie geluide word baie soos die spraak van mense voortgebring, deur lug uit die longe oor die stembande in die keel te forseer. Padda-geselsies is baie belangrik in die paartyd wanneer die mannetjies roep om die wyfies se aandag te trek.[1]
Paddas is afhanklik van klam, nat blyplekke. Omdat vleilande baie kwesbaar vir ontwikkeling is, word paddas se habitat maklik vernietig. Hulle is egter aanpasbare diere en hulle kom in 'n groot verskeidenheid habitatte voor, van seevlak tot in berggebiede.
Paddavissies eet alge en ander waterplante, maar 'n paar soorte raak partymaal kannibale en eet dan ander paddavissies. Volwasse paddas is karnivore (vleisvreters) en eet meestal lewendige insekte en ander goggatjies, soos muskiete, motte en torre, hulle sal nie dooie kos eet nie.
Die paddawyfie lê haar eiers tussen waterplante. Daar kan lang stringe wees, in groot groepe of klein groepies of selfs enkeles.
Na omtrent tien dae word die eiers deur die son se hitte uitgebroei. Uit die eier kom 'n paddavissie wat 'n stertvin het om mee te swem. Die paddavissie haal soos 'n vis deur kieue asem. Na omtrent twee maande kry die paddavissie agterpote, waar die stertvin aan die liggaam vas is; daarna kry hy voorpote.
Met dié metamorfose verander die “vissie” na 'n padda sodat hy op land en in die water kan lewe. Longe (vir asemhaling) vervang die kieue, sy stertvin verdwyn en sy mond vergroot.
Paddas se natuurlike vyande is visse, voëls, soogdiere, reptiele en natuurlik die mens. Sommige mense eet hulle; paddaboutjies word veral in Frankryk en China as ’n lekkerny beskou.
Daar steek geen waarheid in die stories dat 'n mens vratte kry as jy 'n padda hanteer nie.
Paddas word gebruik om mense die anatomie van gewerweldes (diere met 'n ruggraat) te leer en paddaeiers help geleerdes om meer van die ontwikkeling van embrio’s te wete te kom. Paddas is ook al gebruik vir swangerskaptoetse op vroue.
Paddas drink nie water nie. Vog word deur hul velle geabsorbeer en in 'n interne watersak gestoor. Dié water word in droë tye gebruik om die vel klam te hou, sodat hulle kan asemhaal.
Daar kom meer as 100 spesies in Suid-Afrika voor waarvan die helfte endemies of amper-endemies is. Die brulpadda, wat tot 20 cm lank kan word, is Suid-Afrika se grootste padda. Tydens droogtes skei brulpaddas 'n stof deur hul vel af wat 'n kokon om hulle vorm. In die Karoo bly brulpaddas soms vir jare in dié kokonne, tot dit weer nat genoeg is om na buite te gaan.
'n Padda is 'n koudbloedige, stertlose dier wat aan die klas amfibieë behoort. "Amfi-" beide "bios" lewe: wat op die land asook in die water leef.
Wanneer hulle gebore word kry hulle (nes visse) met kieue hul suurstof uit water en swem met hulle sterte, maar sodra hulle groter word en van gedaante verwissel, haal hulle in die lug asem soos alle landdiere en verloor hul stert.
Los anuros (Anura, gr. a(n), "non" y ourá, "rabu") son un cladu d'anfibios, con rangu taxonómicu d'orde, conocíos vulgarmente como xaronques y sapos. Caracterízase por escarecer de cola, por presentar un cuerpu curtiu y bien enancháu, y poles pates posteriores más desenvueltes y afeches pal saltu. Los anuros son el grupu más numberosu d'anfibios; envalórase qu'esisten más de 5.000 especies, partíes en 48 families.[1] La mayoría pasa la so vida dientro o cerca del agua. El so tamañu puede variar dende unos escasos 8,5 milímetros, como ye'l casu de les especies del xéneru Eleutherodactylus,[2] hasta talles que superen los 30 centímetros, destacando la xaronca goliat, l'anuru más grande del mundu.[3]
Los nomes de «xaronca» y «sapu» referíense nun principiu a los dos tipos d'anuros qu'apaecen na Península Ibérica: les xaronques típiques (les del xéneru Rana), y los sapos típicos (los del xéneru Bufo); pero anguaño úsase pa otros grupos de forma indiscriminada y arbitraria. «Xaronca» suel referise a les especies más gráciles, de piel húmedo y llisa, bones saltadores, y de vezos trepadores o acuáticos. «Sapu» fai referencia a les especies de piel más seco y rugosa, más robustes, marchadores, menos axiloses y que suelen habitar nel suelu húmedu escavando galeríes. Poro, esta distinción ente xaronques y sapos nun ye una discriminación que tenga validez taxonómica.[4]
Los anuros presenten una boca bien ancha, con dientes diminutos o ensin ellos, dependiendo de les especies, y con una llingua protráctil. Los güeyos tán provistos de párpagos y los oyíos nun tienen pabellones esternos, estremándose namái una membrana timpánica superficial.[5][6][7] Los dos pares de pates son bien distintes ente sigo, adquiriendo un mayor desarrollu y robustez el par posterior, que, amás, alcuéntrase afechu al saltu. Les pates anteriores terminen en cuatro deus, mientres que les posteriores fainlo en cinco. Otra carauterística que favorez el saltu ye la presencia d'una columna vertebral amenorgada y ríxida llamada urostilo.[8] Les cucharapes o cabezones (fase larvaria) lleven una vida acuática, ente que los adultos son terrestres y namái vuelven al agua nel momentu de la reproducción.
Les rellaciones filoxenétiques d'Anura y les secuencies de les primeres diverxencies d'esti clado fueron materia d'un gran númberu d'alderiques. La mayor parte d'esti discutiniu céntrase na posición filoxenética de los clados dalguna vegada asignaos a Archeobatrachia (grupu parafiléticu compuestu por Leiopelmatidae y Ascaphidae[9]) con respeuto de los clados de Neobatrachia. Esti últimu grupu, nel cual tán presentes más de 2/3 de les especies d'anfibios, ta formáu por Heleophrynidae y un clado conformáu polos grupos Hyloides y Ranoides.
Anura
Pelobatoidea
Hyloides
Ranoides
Ranoides
Allodapanura
Hyloides
Terrarana
Los cladogrames tán basaos en Frost et al. (2006) y Heinicke et al. (2009).[10][11]
Los anuros (Anura, gr. a(n), "non" y ourá, "rabu") son un cladu d'anfibios, con rangu taxonómicu d'orde, conocíos vulgarmente como xaronques y sapos. Caracterízase por escarecer de cola, por presentar un cuerpu curtiu y bien enancháu, y poles pates posteriores más desenvueltes y afeches pal saltu. Los anuros son el grupu más numberosu d'anfibios; envalórase qu'esisten más de 5.000 especies, partíes en 48 families. La mayoría pasa la so vida dientro o cerca del agua. El so tamañu puede variar dende unos escasos 8,5 milímetros, como ye'l casu de les especies del xéneru Eleutherodactylus, hasta talles que superen los 30 centímetros, destacando la xaronca goliat, l'anuru más grande del mundu.
Quyruqsuzlar (lat. Anura, Salientia) — Suda-quruda yaşayanlar sinfinə daxil olan böyük dəstə. 5600-dən artıq[1](bəzi mənbələrə görə 2100-ə yaxın) növü var.
• Hələ XVIII əsrdə italyan alimi L. Qalvani şimşək çaxanda qurbağaların ayaq əzələlərinin yığılıb açılmasını müşahidə etmişdi. Sonralar bu müşahidədən elektrikin təsirinin öyrənilməsində istifadə edilmişdir.
• Məşhur rus fizioloqu İ.M. Seçenov (1862) ilk dəfə qurbağa üzərində baş beynin reflekslər əmələ gəlməsində rolunu öyrənmişdir.
• Şimali Amerikada bəzi qurbağaların səsi bir neçə kilometrlikdən eşidilir. Onların səsi öküz səsinə oxşadığı üçün öküz qurbağa adlandırılır.
• Kamerunda qoliaf adlı qurbağa yaşayır. Bütün dünyada ən iri hesab edilən bu qurbağanın kütləsi 3 kq 300 qr, gövdəsinin uzunluğu isə 32 sm-dir.
• Avstraliyada bəzi qurbağa növləri kürünü xaricə tökür, kürü mayalandıqdan sonra onları udur və qarnında yetişdirir, qarnında yumurtadan çıxır, sonra ana qurbağa çıxmış qurbağaları xaricə tökür. Bu müddətdə ana qurbağa qidalanmır.
• Ağaca dırmaşan qurbağanın zəhəri tünd və təsirlidir. Cənubi Amerika ovçuları pələng və maral ovlarkən həmin zəhərdən istifadə edirlər. Braziliyada, Peruda, Qvineyada yaşayan üçzolaqllı qurbağalar öz törəmələrinə qəribə qulluq edir. Gölməçə quruyan kimi balaları anasının bədəninə zəli kimi yapışır. Ana onları su olan yeni gölməçəyə köçürür.
• Cənub yarımkürəsində Borneo, Yava və Sumatra adalarında uçan qurbağalar yaşayır. Onlar adi qurbağalardan fərqlənmir. Barmaqları xeyli uzun olub, araları xüsusi pərdə ilə birləşir, bu da onların bir ağacdan başqasına atılmasına kömək edir.
• Amerika alimi B. Vitkon kokon qurbağasından alınan zəhərin tərkibini öyrənə bilmişdir. Kokon qurbağasının uzunluğu 2-3 sm, çəkisi təxminən 1 qr-a yaxındır. Orta hesabla 100 qurbağadan 1 mq təmiz zəhər almaq mümkündür. Təmizlənmış kokon zəhəri neytrotoksin zəhərindən 50 dəfə, dəniz xiyarından alınan zəhərdən 500 dəfə, yapon fuqa balığından teradoksindən 10 dəfə, hətta ən qüvvətli kimyəvi zəhər olan natrium sianiddən min dəfə təsirlidir. Farmakoloji tədqiqata əsasən, kokon zəhərinin təsiri kurere zəhərinə uyğun olduğu müəyyən edilmişdir. Alimlərin fikrincə, zəhər mərkəzi sinir sisteminə təsir edir.
Quyruqsuzlar (lat. Anura, Salientia) — Suda-quruda yaşayanlar sinfinə daxil olan böyük dəstə. 5600-dən artıq(bəzi mənbələrə görə 2100-ə yaxın) növü var.
Anura a zo un urzhiad e rummatadur an divelfenneged.
Ennañ emañ an divelfenneged besk, evel ar gleskered pe an tousegi.
a vo kavet e Wikimedia Commons.
Anura a zo un urzhiad e rummatadur an divelfenneged.
Ennañ emañ an divelfenneged besk, evel ar gleskered pe an tousegi.
Els anurs (Anura, 'sense cua' en grec; antigament coneguts com a Salientia, 'saltadors' en llatí) són un ordre d'amfibis, que inclou tots els animals coneguts vulgarment com a granotes i gripaus.
La majoria d'anurs es caracteritzen per tenir llargues extremitats posteriors, un cos curt, dits palmats, ulls prominents i absència de cua. La majoria d'anurs tenen un estil de vida semiaquàtic, però poden moure's fàcilment a terra saltant o escalant. Solen pondre els ous en basses, estanys i llacs, i les larves, anomenades capgrossos, tenen brànquies i es desenvolupen a l'aigua. Els anurs adults tenen una dieta carnívora, composta principalment d'artròpodes, anèl·lids i gastròpodes. Els anurs poden ser detectats per la seva crida, que es pot sentir extensament de dia o de nit, principalment a la temporada d'aparellament.
La distribució dels anurs va dels tròpics al subàrtic, però la majoria d'espècies viuen en jungles tropicals. Amb aproximadament 5.000 espècies descrites, són un dels grups més diversos de vertebrats. Tanmateix, les poblacions de determinades espècies estan caient significativament.
Sovint es distingeix entre granotes i gripaus en base al seu aspecte físic, causada per l'adaptació convergent entre els anomenats gripaus a medis secs; tanmateix, aquesta distinció no té cap mena de base taxonòmica. L'única família que conté animals anomenats, exclusivament, «gripaus» són els bufònids, però moltes espècies d'altres famílies també reben el nom de «gripaus».
L'ordre dels anurs conté unes 6.741 espècies[1][2] repartides en 55 famílies, de les quals els leptodactílids, els hílids i els rànids són les més riques en espècies. Els anurs representen un 88% de les espècies d'amfibis.
L'ús dels noms vulgars «granota» i «gripau» no té cap justificació taxonòmica. Des d'un punt de vista taxonòmic, tots els membres de l'ordre Anura són granotes, però només els membres de la família dels bufònids són considerats «gripaus autèntics». L'ús de «granota» en noms vulgars sol referir-se a espècies aquàtiques o semiaquàtiques, amb la pell suau i/o humida, i «gripau» es refereix generalment a espècies que tendeixen a ser terrestres, amb una pell berrugosa i seca. N'és una excepció el gripau raucador de ventre de foc (Bombina bombina); mentre que la seva pell és lleugerament berrugosa, prefereix els hàbitats aquàtics.
En termes generals, les granotes i els gripaus són classificats en tres subordres: els arqueobatracis, que inclouen quatre famílies de granotes primitives; els mesobatracis, que inclouen cinc famílies de granotes evolutivament intermèdies i els neobatracis, de llarg el grup més gran, que contenen les 24 famílies restants de granotes «modernes», incloent-hi la majoria d'espècies comunes arreu del món. Els neobatracis se subdivideixen al seu torn en hiloïdeus i ranoïdeus.[3] Aquesta classificació es basa en trets morfològics com ara el nombre de vèrtebres, l'estructura de la cintura escapular i la morfologia dels capgrossos. Tot i que aquesta classificació gaudeix d'un ampli consens, les relacions entre les famílies d'anurs encara són debatudes. Els estudis futurs de genètica molecular haurien d'aportar ben aviat més informació sobre les relacions evolutives entre les famílies d'anurs.[4]
Algunes espècies d'anurs hibriden fàcilment. Per exemple, la granota comestible (Rana esculenta) és un híbrid de R. lessonae i R. ridibunda. Bombina bombina i Bombina variegata també formen híbrids, tot i que aquests són menys fèrtils, de manera que formen una zona híbrida.
La morfologia dels anurs és única entre els amfibis. En comparació amb els altres dos grups d'amfibis (urodels i gimnofions), els anurs són inusuals car manquen de cua a la fase adulta, i les seves potes són més adaptades a saltar que a caminar. A grans trets, la morfologia dels anurs és similar a la dels altres amfibis, i difereix de la de la resta de vertebrats terrestres en què l'oxigen pot travessar la seva pell altament permeable. Aquesta característica única permet als anurs respirar en gran part a través de la pell.[5] Com que l'oxigen es dissol en una capa aquosa de la pell i d'allà passa a la sang, la pell ha de romandre sempre humida; això fa que els anurs siguin susceptibles a moltes toxines ambientals, algunes de les quals també es poden dissoldre a la capa d'aigua i passar al flux sanguini. Aquesta podria ser la causa del declivi de les poblacions d'anurs.
Hi ha moltes característiques que no són compartides per les aproximadament 5.000 espècies descrites d'anurs. Tanmateix, una sèrie de característiques generals els distingeixen de la resta d'amfibis. Els anurs solen estar ben adaptats per saltar, amb llargues potes posteriors i ossos del turmell allargats. Tenen una columna vertebral curta, amb no més de deu vèrtebres lliures, seguides per un còccix fusionat, cosa que resulta típicament en un fenotip sense cua.
La mida dels anurs varia, anant dels 10 mm de Brachycephalus didactylus (Brasil)[6] i Eleutherodactylus iberia (Cuba)[7] fins als 300 mm de la granota goliat del Camerun.[8] La pell penja laxament del cos degut a la manca de teixit conjuntiu lax. La textura de la pell varia; pot ser llisa, berrugosa o plegada. Les granotes tenen tres membranes a les parpelles; una és transparent per protegir els ulls a sota l'aigua, i dues varien de translucents a opaques. Les granotes tenen un timpà a banda i banda del cap, que té un paper en l'oïda i que en algunes espècies és cobert de pell. La majoria de granotes tenen un tipus especial de dents. Tenen una cresta de dents còniques molt petites a la vora superior de la mandíbula, que reben el nom de «dents maxil·lars». Les granotes també tenen el que s'anomena «dents vomerines» al sostre de la boca. No tenen res que es pugui denominar dents al maxil·lar inferior, de manera que habitualment s'empassen la presa sencera. Les «dents» serveixen principalment per subjectar la presa i impedir que es mogui fins que se l'hagin empassat. Els gripaus, en canvi, no tenen dents.
L'estructura dels peus i les potes varia àmpliament entre les espècies d'anur, i depèn en part de si viuen principalment a la terra, a l'aigua, en arbres o en caus. Els anurs han de ser capaços de moure's ràpidament pel seu medi per atrapar preses i fugir dels depredadors, i nombroses adaptacions les ajuden a fer-ho.
Molts anurs, especialment els que viuen a l'aigua, tenen dits palmats. La mesura en la qual els dits són palmats és directament proporcional al temps que l'espècie passa a l'aigua. Per exemple, Hymenochirus és completament aquàtic i té dits totalment palmats, mentre que els dits de la reineta gegant (Litoria caerulea), una espècie arborícola, només són palmats fins a la meitat o un quart.
Les granotes arborícoles tenen coixinets als dits que les ajuden a agafar-se a superfícies verticals. Aquests coixinets, situats a l'extrem dels dits, no funcionen per succió. La superfície del coixinet es compon de cèl·lules que s'entrellacen, amb un petit espai entre les cèl·lules adjacents. Quan l'anur aplica pressió als coixinets dels dits, les cèl·lules que s'entrellacen s'arrapen a les irregularitats del substrat. Els petits espais entre les cèl·lules drenen gairebé tota la humitat del coixinet, i contribueixen a l'adherència mitjançant la capil·laritat. Això permet a les granotes arrapar-se a superfícies llises, i no funciona si els coixinets són massa molls.[9]
En moltes granotes arborícoles, una petita estructura intercalar a cada dit augmenta l'àrea de superfície que toca el substrat. A més, com que saltar d'arbre en arbre pot ser perillós, moltes tenen una articulació pelviana que permet tant saltar com caminar. Algunes granotes que viuen a la part alta dels arbres tenen fins i tot dits molt palmats, igual que les granotes aquàtiques. En aquestes granotes arborícoles, el palmeig permet a les granotes «saltar en paracaigudes» o controlar la manera com planen d'un punt del cobricel a l'altre.[10]
Els anurs que viuen a terra no solen tenir les adaptacions de les granotes arborícoles i aquàtiques. La majoria tenen coixinets dels dits més petits, si és que en tenen, i poc palmeig. Alguns anurs excavadors tenen una extensió dels dits (un tubercle metatarsal) que els ajuda a excavar. Les seves potes posteriors són més musculars que les dels anurs aquàtics i arborícoles.
Els anurs són coneguts generalment com a excel·lents saltadors, els millors de tots els vertebrats. Litoria nasuta pot saltar distàncies de més de cinquanta vegades la seva llargada corporal (5,5 cm), efectuant salts de més de dos metres.[11] L'acceleració del salt pot ser de fins a 2 g. Hi ha diferències enormes en la capacitat saltadora de les diferents espècies. Dins d'una mateixa espècie, la distància absoluta que se salta augmenta amb la mida, però la distància relativa (en proporció a la mida del cos) disminueix.
Mentre que les espècies d'anurs poden utilitzar un ventall de modes de locomoció (córrer, caminar, planar, nedar i escalar), moltes o bé són hàbils saltadores o bé descendeixen d'avantpassats que ho eren, i tenen gran part de la morfologia musculoesquelètica modificada amb aquesta fi. La tíbia, el peroné i els tarsos són fusionats en un únic os robust, igual que el radi i el cúbit de les potes anteriors (que absorbeixen l'impacte de l'aterratge).[12] Els metatarsos s'han allargat per donar força a la pota i permetre a la granota empènyer el terra durant més temps durant un salt. L'ili s'ha allargat i ha format una articulació mòbil amb el sacre, que en especialistes saltadors com els rànids o els hílids funciona com articulació addicional de les extremitats per donar més potència als salts. Aquest allargament de les potes fa que l'anur pugui aplicar força contra el terra durant més temps, permetent un salt més llarg i ràpid.
El sistema muscular ha sigut modificat de manera similar. Les potes posteriors de l'avantpassat dels anurs contenien presumiblement parells de músculs que actuarien en oposició (un múscul per flexionar el genoll, un altre múscul per estendre'l), com en la majoria d'altres animals dotats d'extremitats. Tanmateix, en els anurs moderns gairebé tots els músculs han estat modificats per contribuir a l'acció saltadora, i només en queden uns quants que serveixin per retornar la pota a la posició inicial i mantenir la postura. Aquests músculs també han crescut molt; els músculs que participen en els salts representen més del 17% de la massa total de l'anur.
En alguns saltadors extremament hàbils, com ara Osteopilus septentrionalis, la potència màxima exercida durant un salt pot superar la potència que poden produir els músculs. Actualment, es teoritza que les granotes emmagatzemen energia muscular tensant els tendons com si fossin molles, i després l'alliberen tota d'una vegada, permetent a l'animal incrementar l'energia del salt més enllà de l'acceleració fornida pels músculs. S'ha documentat un mecanisme similar en les llagostes i saltamartins.
Molts anurs són capaços d'absorbir aigua i oxigen directament a través de la pell, especialment al voltant de la zona pelviana. Tanmateix, la permeabilitat de la pell d'un anur també pot causar pèrdua d'aigua. Algunes granotes arborícoles redueixen la pèrdua d'aigua mitjançant una capa de pell impermeable. D'altres han adoptat comportaments per conservar aigua, incloent-hi l'activitat nocturna o reposar en una posició que conserva l'aigua. Aquesta posició consisteix en el fet que la granota s'estiri amb els dits amagats sota el cos i la barbeta, sense deixar espais entre el cos i el substrat. Algunes espècies d'anur també reposen en grups grans, tocant la pell de l'anur adjacent. Això redueix la quantitat de pell que queda exposada a l'aire o a una superfície seca i, per tant, disminueix la pèrdua d'aigua. Aquestes adaptacions només redueixen la pèrdua d'aigua en una mesura suficient per una vida predominantment arborícola, i no són aptes per condicions àrides.
El camuflatge és un mecanisme de defensa habitual en els anurs. La majoria d'anurs camuflats són nocturns, cosa que millora la seva capacitat d'amagar-se. Els anurs nocturns solen trobar la posició camuflada ideal per dormir durant el dia. Alguns anurs tenen la capacitat de canviar de color, però sol estar limitada a tonalitats d'un o dos colors. Per exemple, la reineta gegant pot variar de tonalitat de verd i marró. Els anurs que viuen a terra solen tenir berrugues o plecs de la pell, car una pell llisa no els camuflaria de manera efectiva. Les granotes arborícoles solen tenir la pell llisa, permetent-los que es camuflin com fulles.
Alguns anurs canvien de color de la nit al dia, a mesura que els canvis de llum i d'humitat estimulen les cèl·lules pigmentades i fan que s'expandeixin o es contraguin.
Molts anurs tenen toxines lleus que dissuadeixen els depredadors potencials. Per exemple, tots els gripaus tenen unes grans glàndules verinoses (les glàndules parotoïdals) situades a dalt del cap, darrere dels ulls. Algunes granotes, com ara els dendrobàtids, són especialment tòxiques. La composició química de les toxines dels anurs van d'irritants a al·lucinògens, convulsants, neurotoxines i vasoconstrictors. Molts depredadors d'anurs s'han adaptat per tolerar nivells elevats d'aquests verins. D'altres, incloent-hi els humans, poden quedar greument afectats.
Algunes granotes obtenen verins de les formigues i altres artròpodes que es mengen;[13] d'altres, com els gripauets corroboree d'Austràlia, poden produir un alcaloide no derivat de la seva dieta.[14] Alguns pobles indígenes de Sud-amèrica extreuen verí de les granotes punta de fletxa i l'apliquen als seus dardells per caçar,[15] tot i que poques espècies són prou tòxiques com per ser utilitzades amb aquesta fi. Antigament, existia la creença errònia que el verí s'aplicava a fletxes i no a dards, i d'aquí ve el nom comú d'aquestes granotes, «granotes punta de fletxa». Les granotes verinoses tendeixen a advertir de la seva toxicitat amb colors llampants, una estratègia adaptiva anomenada aposematisme. Hi ha almenys dues espècies no verinoses de granotes a l'Amèrica tropical (Eleutherodactylus gaigei i Lithodytes lineatus) que imiten la coloració de les granotes punta de fletxa per protegir-se (mimetisme batesià).[16][17]
Com que les toxines dels anurs són extraordinàriament diverses, han suscitat l'interès dels bioquímics com a fàrmacs naturals. L'alcaloide epibatidina, un analgèsic 200 vegades més potent que la morfina,[18] es troba en algunes espècies de granotes punta de fletxa. Altres substàncies aïllades de la pell d'anurs podrien oferir resistència a infeccions per VIH.[19] Els verins de les granotes punta de fletxa s'estan investigant intensament pel seu potencial com medicaments terapèutics.[20]
Les secrecions cutànies d'alguns gripaus, com ara Bufo alvarius o el gripau gegant, contenen bufotoxines, algunes de les quals, com la bufotenina, són psicoactives i han estat utilitzades com a drogues recreatives. Generalment, s'assequen i es fumen les secrecions cutànies. Llepar la pell d'aquests gripaus és altament perillós, i sembla una llegenda urbana que es pugui assolir un estat d'eufòria d'aquesta manera.[21]
La pell d'un anur és permeable a l'oxigen i el diòxid de carboni, a més de l'aigua. Hi ha una sèrie de vasos sanguinis a prop de la superfície de la pell. Quan un anur es troba dins l'aigua, l'oxigen es transmet a través de la pell directament dins el flux sanguini. A la terra, els anurs adults utilitzen els pulmons per respirar. Els pulmons són semblants als dels humans, però els músculs pectorals no participen en la respiració, i no hi ha ni costelles ni diafragma que ajudin a respirar. Els anurs respiren inspirant aire pels narius (que sovint tenen vàlvules que es tanquen quan l'animal se submergeix), fent que la gola s'infli, comprimint el fons de la boca, cosa que força l'aire cap als pulmons. L'agost del 2007, es descobrí una granota aquàtica anomenada Barbourula kalimantanensis en un indret remot d'Indonèsia. Aquesta és la primera espècie d'anur coneguda per la ciència que manca de pulmons.
Els anurs són coneguts pel seu cor tricameral, que comparteixen amb tots els tetràpodes tret dels ocells i els mamífers. Al cor tricameral, la sang oxigenada dels teixits i la sang desoxigenada dels teixits respiradors arriben per aurícules diferents, i són enviades a través d'una vàlvula espiral al vas apropiat: l'aorta per la sang oxigenada i l'artèria pulmonar per la sang desoxigenada. Aquesta estructura especial és essencial per minimitzar la mescla dels dos tipus de sang,[22] cosa que permet als anurs mantenir un ritme metabòlic més alt i ser més actius, que si es barregessin les sangs.
Algunes espècies d'anur tenen adaptacions notables que els permeten sobreviure en aigua pobra en oxigen. La granota Telmatobius culeus és una d'aquestes espècies, i per sobreviure a les aigües poc oxigenades del llac Titicaca, té una pell increïblement arrugada que n'augmenta la superfície per millorar l'intercanvi de gasos. Aquesta granota també fa «flexions» al fons del llac per incrementar el flux de l'aigua al voltant del cos.[23]
L'aparell digestiu dels anurs comença a la boca. Alguns d'ells tenen unes dents al maxil·lar superior anomenades dents maxil·lars, que es fan servir per moldre l'aliment abans d'empassar-se'l. Aquestes dents són molt febles, i no es poden fer servir per atrapar o ferir preses àgils, sinó només per subjectar-les[24] El que fan els anurs és utilitzar la llengua enganxosa per atrapar preses (com ara mosques o altres insectes). L'aliment passa a l'estómac a través de l'esòfag. Aleshores, passa a l'intestí prim (duodè i ili), on té lloc la majoria de la digestió. Els anurs fan anar sucs pancreàtics del pàncrees, juntament amb bilis (produïda pel fetge), a través de la vesícula biliar, des del fetge fins a l'intestí prim, on els fluids digereixen l'aliment i n'extreuen els nutrients.[25] Quan l'aliment arriba a l'intestí gros, l'aigua és reabsorbida i es dirigeixen els residus a la cloaca. Tots els residus són expulsats del cos a través de la cloaca i l'obertura cloacal.
Els anurs tenen un sistema nerviós molt desenvolupat que consisteix en un cervell, una medul·la espinal i nervis. Moltes parts del seu cervell es corresponen amb les dels humans. El bulb raquidi regula la respiració, la digestió i altres funcions automàtiques. La coordinació muscular i la postura són controlades pel cerebel. La mida relativa del telencèfal d'un anur és molt inferior a la dels humans. Els anurs tenen deu nervis cranials (nervis que transmeten informació des de l'exterior directament al cervell) i deu parells de nervis espinals (nervis que transmeten informació de les extremitats al cervell a través de la medul·la espinal).[26] En canvi, tots els amniotes (mamífers, ocells i rèptils) tenen dotze nervis cranials.[27] Els anurs manquen d'orelles externes; els timpans (membranes timpàniques) són exposats directament. L'orella conté canals semicirculars que ajuden a mantenir l'equilibri i l'orientació.
El cicle vital dels anurs comença amb un ou. Les femelles solen pondre una fresa (una massa de milers d'ous) dins l'aigua. Els ous són molt vulnerables a la predació, de manera que els anurs han desenvolupat moltes estratègies per assegurar la supervivència de la pròxima generació. A les àrees més fredes, l'embrió és negre per absorbir més calor del sol, cosa que n'accelera el desenvolupament. Sovint, això implica una reproducció síncrona. Molts exemplars criaran alhora, aclaparant les accions dels depredadors. La majoria de descendència morirà a causa de la depredació, però hi ha una major possibilitat que alguns sobrevisquin. Una altra manera en què algunes espècies eviten els depredadors i patògens als quals són exposats els ous és pondre'ls en fulles sobre un estany, amb una capa gelatinosa dissenyada per conservar humitat. En aquestes espècies, els capgrossos cauen a l'aigua quan es desclouen. Els ous d'algunes espècies que ponen fora de l'aigua poden detectar les vibracions de vespes o serps depredadores pròximes, i es desclouen abans per evitar ser menjats.[28] Algunes espècies, com el gripau gegant, ponen ous verinosos per minimitzar la depredació. Mentre que la durada de la fase d'ou depèn de l'espècie i les condicions ambientals, els ous aquàtics se solen descloure en una setmana. Altres espècies acaben la fase larvària dins els ous o la mare, o tenen un desenvolupament directe. A diferència de les salamandres i els tritons, els anurs mai no assoleixen la maduresa sexual mentre es troben en estat larvari.
Els ous es desclouen i continuen com capgrossos, que solen tenir cossos ovals i llargues cues aplanades sobre el pla vertical. En general, les larves d'amfibis són animals completament aquàtics, amb l'excepció d'algunes espècies com la granota Nannophrys ceylonensis, els capgrossos de la qual són semiterrestres i viuen en roques humides.[29][30] Les larves manquen de pulmons, parpelles i potes, i tenen un esquelet cartilaginós, un sistema de línia lateral, brànquies (en un principi externes, i després internes) i una cua amb plecs dorsals i ventrals per nedar.[31] Algunes espècies, que sofreixen la metamorfosi dins l'ou i es desclouen amb la forma d'adults però més petites, mai no desenvolupen brànquies, sinó que tenen zones especialitzades de la pell que s'encarreguen de la respiració. Els capgrossos també manquen de dents autèntiques, però les mandíbules de la majoria d'espècies solen tenir dues fileres allargades i paral·leles de petites estructures ceratinitzades anomenades ceradonts al maxil·lar superior, mentre que el maxil·lar inferior en té tres, envoltades per un bec corni, però el nombre de fileres pot ser absent o inexistent, o molt més elevat. Les larves són típicament herbívores, i s'alimenten principalment d'algues, incloent-hi diatomees que filtren de l'aigua mitjançant les brànquies. Algunes espècies són carnívores a la fase de capgròs, alimentant-se d'insectes, capgrossos més petits i peixos. S'ha observat canibalisme entre els capgrossos; els que desenvolupen potes ràpidament poden ser menjats pels altres, de manera que els que creixen més lentament sobreviuen més temps. En són un exemple els capgrossos de Rana temporaria (granota roja).[32]
Els capgrossos són molt vulnerables a la depredació per part de peixos, tritons, escarabats d'aigua depredadors i ocells com ara alcedínids. Molts capgrossos, com els del gripau gegant, són verinosos. La fase de capgròs pot durar només una setmana, o en algunes espècies els capgrossos poden hibernar i fer la metamorfosi l'any següent, com és el cas en el tòtil o el gripau d'esperons fosc. En els pípids (excepte Hymenochirus), els capgrossos tenen un parell de bigotis anteriors que fan que semblin petits peixos gat.[33]
Amb l'excepció de la base de la cua, on algunes estructures vertebrals es desenvolupen per donar origen a l'urostil en un moment posterior de la vida, la cua manca dels element sòlids, segmentaris, esquelètics de cartílag o teixit ossi que són típics de la resta de vertebrats, tot i que evidentment conté un notocordi.
Al final de la fase larvària, les granotes sofreixen una metamorfosi, per la qual passen a la fase adulta. La metamorfosi significa una transformació dramàtica de la morfologia i de la fisiologia, a mesura que els capgrossos desenvolupen potes posteriors, després potes anteriors, perden les brànquies i desenvolupen pulmons. Els seus intestins s'escurcen a mesura que passen d'una dieta herbívora a una de carnívora. Els ulls migren rostralment i dorsal, permeten la visió binocular dels adults. Aquest canvi en la posició dels ulls representa el pas de ser presa a ser depredador, a mesura que el capgròs es desenvolupa i depèn menys d'un camp de visió ample, i més de la percepció de la profunditat. La fase final del desenvolupament implica apoptosi (mort cel·lular programada) i resorció de la cua.
Després de la metamorfosi, els adults joves poden deixar l'aigua i dispersar-se en hàbitats terrestres, o continuar de viure a l'hàbitat aquàtic com adults. Gairebé totes les espècies d'amfibi són carnívores a la fase adulta, alimentant-se d'invertebrats com ara artròpodes, anèl·lids i gastròpodes. Algunes espècies grans poden caçar preses com ara petits mamífers, peixos, i amfibis més petits. Algunes granotes i salamandres utilitzen les seves llengües enganxifoses per caçar preses ràpides, mentre que d'altres l'atrapen i se la fiquen a la boca amb les mans. Tanmateix, hi ha algunes espècies d'amfibis que mengen principalment plantes.[34] Els anurs adults són la presa d'ocells, peixos grans, serps, llúdries, guineus, toixons, coatins i altres animals. Les granotes també són menjades pels humans.
Les granotes i gripaus poden viure molts anys; tot i que se sap poc sobre la seva longevitat en llibertat, s'han conegut casos de granotes i gripaus en captivitat que han viscut fins a 40 anys.[35]
Una vegada els anurs adults assoleixen la maduresa, es reuneixen en una font d'aigua com ara un estany o un rierol per reproduir-se. Molts tornen a les masses d'aigua on nasqueren, cosa que sovint resulta en migracions anuals amb milers d'anurs. A l'Europa continental, una gran part dels anurs migrants solien morir a les carreteres, abans que es construïssin tanques i túnels especials per ells.
Una vegada es troben al terreny d'aparellament, els mascles comencen a atreure una parella, formant col·lectivament un cor de granotes. Cada espècie té la seva pròpia crida, que només atreu femelles d'aquella espècie. Algunes espècies tenen mascles que no criden, però que intercepten femelles que s'acosten a un mascle raucador.
Aleshores, els mascles i les femelles duen a terme l'amplex.[36] Això significa que el mascle munta la femella i l'agafa amb força (a vegades amb uns coixinets nupcials especials). La fertilització és externa: Els òvuls i l'esperma es troben a l'exterior del cos.[36] La femella allibera els ous, que el mascle cobreix amb una solució d'esperma. Aleshores els ous s'engrandeixen i desenvolupen un revestiment protector. Els ous solen ser marrons o negres, amb una cobertura clara semblant a la gelatina.
La majoria d'espècies temperades d'anurs es reprodueixen entre finals de tardor i principis de primavera. La temperatura de l'aigua en aquesta època de l'any és relativament freda, generalment entre 4 i 10 graus Celsius. El fet de reproduir-se en aquestes condicions ajuda els capgrossos en desenvolupament, car la concentració d'oxigen dissolt dins l'aigua és més alta a temperatures baixes. Encara més important, el fet de reproduir-se en aquesta època assegura que els anurs en desenvolupament tindran l'aliment adequat al moment apropiat.[37]
Encara que la cura de la descendència en els anurs no és ben compresa, s'estima que fins a un 20% d'espècies d'anur podrien tenir cura de les cries d'una manera o altra, i hi ha una gran varietat de comportaments parentals.[38] Algunes espècies de granotes de punta de fletxa ponen ous al sòl del bosc i els protegeixen, defensant els ous dels depredadors i mantenint-los humits. Si els ous s'assequen massa, els pares hi orinen a sobre. Després de l'eclosió, un dels pares (el sexe depèn de l'espècie) mou les cries, portant-les a l'esquena, a una bromeliàcia amb aigua. Aleshores, el parent els alimenta ponent ous no fertilitzats a la bromeliàcia fins que les cries s'han metamorfitzat. Altres anurs porten els ous i els capgrossos a les potes posteriors o l'esquena (ex. els tòtils, Alytes spp.). Alguns anurs fins i tot protegeixen la descendència dins el seu propi cos. El mascle d'Assa darlingtoni té butxaques al llarg dels flancs, on romanen els capgrossos fins a la metamorfosi. La femella de Rheobatrachus, que avui en dia probablement és extinta, s'empassa els capgrossos, que aleshores es desenvolupen a l'estómac. Per fer-ho, aquesta granota ha de deixar de secretar sucs gàstrics i aturar la peristalsi (les contraccions de l'estómac). La granota de Darwin (Rhinoderma darwinii) de Xile posa els capgrossos al sac vocal perquè s'hi desenvolupin. Algunes espècies deixen una «mainadera» que vigili la fresa fins que els ous es descloguin.
La crida d'alguns anurs és tan forta que se'ls pot sentir a més d'un quilòmetre i mig de distància.[39] Cada espècie té la seva pròpia crida. Els anurs criden fent passar aire per la laringe, al coll. En la majoria d'anurs que criden, el so és amplificat per un o més sacs vocals, unes membranes de pell situades sota la gola o al cantó de la boca que es distenen durant l'amplificació de la crida. La neuroetologia estudia els circuits neuronals en què es basa l'audició dels anurs.
Alguns anurs manquen de sacs vocals, com ara els dels gèneres Heleioporus i Neobatrachus, però això no els impedeix emetre una crida potent. La seva cavitat bucal és més gran i té forma de cúpula, servint com una cambra de ressonància que n'amplifica la crida. Les espècies sense sacs vocals i que no poden emetre una crida potent tendeixen a viure en zones properes a aigua corrent. El so de l'aigua corrent ofega qualsevol crida, de manera que s'han de comunicar d'altres maneres.
El motiu principal per cridar és perquè els mascles atreguin una parella. Els mascles criden o bé sols o bé en un grup anomenat «cor». Les femelles de moltes espècies, com per exemple Polypedates leucomystax, emeten crides per respondre als mascles, cosa que actua com catalitzador per millorar l'activitat reproductiva dins una colònia reproductiva.[40] Els mascles emeten una crida d'alliberament si els munta un altre mascle. Les espècies tropicals també tenen una crida de pluja, que emeten basant-se en els indicis d'humiditat que presagien la pluja. Moltes espècies també tenen una crida territorial que serveix per foragitar els altres mascles. Totes aquestes crides es fan amb la boca tancada.
Alguns anurs emeten una crida de destret quan es troben en perill; la fan amb la boca oberta, cosa que produeix un so més agut. L'eficàcia d'aquesta crida és incerta, però se sospita que la crida desconcerta el depredador fins que un altre animal és atret, distraient-lo prou per permetre la fugida de l'amfibi.
Moltes espècies d'anur tenen crides greus, o raucs. L'onomatopeia d'aquest so en català és: «roc-roc». A vegades, en anglès el rauc de Rana catesbiana s'escriu jug o rum.[41] L'antic grec tenia l'onomatopeia brekekekex koax koax, probablement per Rana ridibunda. Finalment, el Rig-veda diu, en referència a les granotes i els gripaus: «un [té] veu de vaca, l'altre [té] veu de cabra».
L'hàbitat dels anurs s'estén gairebé arreu del món, però no viuen ni a l'Antàrtida ni a moltes illes oceàniques.[42][43] La diversitat més gran d'anurs és a les regions tropicals, on hi ha aigua disponible, responent a les necessitats de la pell dels anurs. Alguns viuen en zones àrides com ara deserts, on l'aigua pot no ser fàcil de trobar, i tenen adaptacions específiques per sobreviure. El gènere australià Cyclorana i l'americà Pternohyla s'enterren al sòl, creen un capoll impermeable i hibernen durant els períodes secs. Quan arriben les pluges, emergeixen, troben un estany temporal i hi crien. El desenvolupament dels ous i els capgrossos és molt ràpid en comparació amb la majoria de la resta d'anurs per tal que la cria s'acabi abans que l'estany s'assequi. D'altres espècies s'han adaptat en un medi fred; per exemple, la granota de bosc, l'hàbitat de la qual s'estén al nord del cercle polar àrtic, s'enterra al sòl durant l'hivern, quan gran part del seu cos es glaça.
Les poblacions d'anurs han patit un declivi dramàtic des de la dècada del 1950; es creu que més d'un terç d'espècies són amenaçades d'extinció i se sospita que més de 120 se n'han extingit des de la dècada del 1980.[44] Entre aquestes espècies hi ha el gripau daurat de Costa Rica i les Rheobatrachus d'Austràlia. La pèrdua d'hàbitat és una causa significativa del declivi de les poblacions d'anurs, igual que els contaminants, el canvi climàtic, la introducció de depredadors/competidors no indígenes, i l'aparició de malalties infeccioses com ara la quitridiomicosi. Molts científics ambientals creuen que els amfibis, incloent-hi els anurs, són uns excel·lents indicadors de la salut global de l'ecosistema a causa de la seva posició intermèdia a la xarxa tròfica, la seva pell permeable, i la seva vida típicament bifàsica (larves aquàtiques i adults terrestres).[45] Sembla que les espècies que tenen tant els ous com les larves aquàtics són les més afectades pel declivi, mentre que les que tenen un desenvolupament directe són les més resistents.[46]
Un estudi canadenc dut a terme el 2006 suggerí que el trànsit dens a prop dels hàbitats dels anurs és una gran amenaça per les poblacions d'anurs.[47] En alguns casos s'han intentat programes de cria en captivitat per alleujar la pressió sobre les poblacions d'anurs, que han tingut èxit.[48][49] El 2007 s'informà que l'aplicació de determinats bacteris probiòtics podia protegir els amfibis de la quitridiomicosi.[50] Un programa actual, el Projecte de Rescat i Conservació d'Amfibis del Panamà, ha sigut desenvolupat posteriorment per rescatar les espècies amb risc de quitridiomicosi de l'est del Panamà, i per desenvolupar aplicacions de camp d'aquesta cura probiòtica.[51]
Zoos i aquaris d'arreu del món declararen el 2008 l'Any de la Granota per tal de cridar l'atenció envers la conservació d'aquests animals.[52]
s.e
Fins al descobriment de la forma permiana Gerobatrachus hottoni, un batraci tija amb moltes característiques semblants a les de les salamandres, la granota primitiva més antiga coneguda era Triadobatrachus massinoti, del Triàsic inferior de Madagascar.[53] El crani és de granota, sent ample i amb òrbites grans, però el fòssil té trets que el diferencien dels amfibis moderns, com ara un ili diferent, un cos més llarg amb més vèrtebres, i vèrtebres de la cua separades (en els anurs moderns, les vèrtebres caudals són fusionades, formant un urostil o «còccix»). La tíbia i el peroné no estaven fusionats, de manera que és improbable que Triadobatrachus fos un bon saltador.
Un altre anur fòssil, Prosalirus bitis, fou descobert el 1995. Les restes foren trobades a la formació de Kayenta d'Arizona, que data del Juràssic inferior,[54] i és una mica més recent que Triadobatrachus. Com aquest últim, Prosalirus no tenia potes molt agrandides, però tenia la típica estructura pelviana de tres puntes. A diferència de Triadobatrachus, Prosalirus ja havia perdut gairebé tota la cua i era ben adaptat per saltar.[55]
La granota autèntica més primitiva és Vieraella herbsti, del Juràssic inferior (fa 213-188 milions d'anys). Només és coneguda a partir d'impressions dorsals i ventrals d'un únic exemplar i s'estimà la seva llargada en 33 mm des del musell fins a la cloaca. Notobatrachus degiustoi, del Juràssic mitjà, és lleugerament més recent (fa 170-155 milions d'anys). És probable que al període Juràssic l'evolució dels anurs moderns ja fos completa. Els canvis evolutius principals inclogueren l'escurçament del cos i la pèrdua de la cua.
El registre fòssil complet més antic d'un anur modern és el del "sanyanlichan", que visqué fa 125 milions d'anys[56] i tenia totes les característiques dels anurs moderns, però tenia nou vèrtebres presacres en lloc de les vuit dels anurs moderns.[57]
S'han trobat anurs fòssils a tots els continents, incloent-hi l'Antàrtida.
Aquest és el cladograma dels amfibis vivents amb més consens a la filogènia actual:[58][59][60]
Lissamphibia––Caudata
Els anurs són criats comercialment amb diversos fins. Són utilitzats com font d'aliment: les anques de granota són una exquisitat a la Xina, França, les Filipines, el nord de Grècia i molts llocs del sud dels Estats Units, especialment Louisiana, tot i que les granotes comestibles només són una cinquantena d'espècies. De fet, la majoria són tòxiques i algunes tenen efectes al·lucinògens. Les potes de granota també són extremament populars a Europa i el Canadà. A la dècada del 1990, Europa importà 6.000 tones de potes de granota. Entre el 1981 i el 1984, els Estats Units importaren més de tres milions de quilograms de potes de granota per any. Això equival aproximadament a 26 milions de granotes.[61]
A vegades es fan servir granotes per disseccions a les classes d'anatomia dels instituts i les universitats, i sovint se'ls injecten plàstics colorits per destacar el contrast entre els òrgans. Aquesta pràctica s'ha reduït al llarg dels últims anys amb el creixement de les preocupacions pel benestar animal.
Els anurs han estat organismes model importants al llarg de la història de la ciència. El biòleg del segle XVIII Luigi Galvani descobrí la relació entre l'electricitat i el sistema nerviós mitjançant l'estudi dels anurs. Ja a la primera meitat del segle XX, Lancelot Hogben estudià Xenopus laevis al laboratori, aplicant-lo a les primeres proves d'embaràs. Quan la s'injecta la gonadotropina coriònica humana (una hormona que es troba en quantitats significatives a l'orina de les dones embarassades) en una femella de Xenopus laevis, la indueix a pondre ous. El 1952, Robert Briggs i Thomas J. King clonaren un anur per mitjà d'una transferència nuclear somàtica, la mateixa tècnica que més tard es féu servir per crear l'ovella Dolly; el seu experiment fou la primera vegada que s'aconseguí un trasplantament nuclear reeixit en un metazou.[62]
Els anurs es fan servir en la recerca de la clonació i altres branques de l'embriologia, car són uns dels parents més propers als humans que manquen dels ous amb closca típics de la majoria d'altres vertebrats, cosa que facilita les observacions del desenvolupament primerenc. Tot i que s'han desenvolupat proves d'embaràs alternatives, els biòlegs continuen utilitzant Xenopus com organisme model en la biologia del desenvolupament, car és fàcil de criar en captivitat i té un embrió fàcil de manipular. Recentment, X. laevis és reemplaçat cada vegada més pel seu parent més petit, X. tropicalis, que assoleix la maduresa sexual després de cinc mesos i no en un o dos anys (com és el cas en X. laevis),[63] facilitant estudis més ràpids al llarg de les generacions. La seqüència genòmica de X. tropicalis probablement serà completada el 2015 com molt tard.[64]
Els anurs tenen un paper prominent en el folklore, els contes de fades i la cultura popular. Se'ls sol presentar com benignes, lletjos i maldestres, però amb talents ocults. En són exemples Michigan J. Frog, El Príncep Granota o la Granota Gustau.
El poble mochica de l'antic Perú venerava els animals, i sovint presentava granotes al seu art.[65] Michigan J. Frog, que apareix als dibuixos animats de Warner Brothers One Froggy Evening, només fa el seu número de cant i ball pel seu propietari. Quan una altra persona el mira, torna a assumir postura de granota. El Príncep Granota és un conte de fades sobre una granota o un gripau que es converteix en un formós príncep després de besar-lo. La Granota Gustau, d'altra banda, és un personatge conscienciós i disciplinat de The Muppet Show i Barri Sèsam; tot i que és amistós i té molt de talent, sovint se'l mostra empetitint-se davant del comportament extravagant de personatges més exuberants.
Els anurs (Anura, 'sense cua' en grec; antigament coneguts com a Salientia, 'saltadors' en llatí) són un ordre d'amfibis, que inclou tots els animals coneguts vulgarment com a granotes i gripaus.
La majoria d'anurs es caracteritzen per tenir llargues extremitats posteriors, un cos curt, dits palmats, ulls prominents i absència de cua. La majoria d'anurs tenen un estil de vida semiaquàtic, però poden moure's fàcilment a terra saltant o escalant. Solen pondre els ous en basses, estanys i llacs, i les larves, anomenades capgrossos, tenen brànquies i es desenvolupen a l'aigua. Els anurs adults tenen una dieta carnívora, composta principalment d'artròpodes, anèl·lids i gastròpodes. Els anurs poden ser detectats per la seva crida, que es pot sentir extensament de dia o de nit, principalment a la temporada d'aparellament.
La distribució dels anurs va dels tròpics al subàrtic, però la majoria d'espècies viuen en jungles tropicals. Amb aproximadament 5.000 espècies descrites, són un dels grups més diversos de vertebrats. Tanmateix, les poblacions de determinades espècies estan caient significativament.
Sovint es distingeix entre granotes i gripaus en base al seu aspecte físic, causada per l'adaptació convergent entre els anomenats gripaus a medis secs; tanmateix, aquesta distinció no té cap mena de base taxonòmica. L'única família que conté animals anomenats, exclusivament, «gripaus» són els bufònids, però moltes espècies d'altres famílies també reben el nom de «gripaus».
Grŵp o amffibiaid yn perthyn i'r urdd Anura (o'r Groeg 'an' neu 'dim' ac 'aoura' sef 'cynffon') yw'r llyffant neu froga. Mae tua 4,800 o rywogaethau sy'n byw ledled y byd, yn enwedig mewn mannau llaith yn y trofannau, sef dros 85% o ymlusgiaid. Mae ganddynt gorff tew a byr, pen mawr a choesau ôl hir ac maent yn gigysyddion. Does gan yr oedolyn ddim cynffon.
Mae'r ffosil hynaf sydd wedi'i ganfod o lyffant yn ffosil o 'broto-lyffant' a ymddangosodd yn yr epoc y Triasic cynnar, a hynny ym Madagasgar, ond credir fod eu tarddiad yn llawer hŷn: y cyfnod Permaidd, 265 miliwn o flynyddoedd yn ôl.
Nodweddir corff y llyffant gan lygaid mawr sy'n ymestyn allan o'r corff, tafod hir, coesau sy'n plygu'n daclus a diffyg cynffon. Er mai pyllau dŵr a thir gwlyb, ydy cynefin y rhan fwyaf o frogaod, gall oedolion ambell rywogaeth fyw o dan y ddaear neu ar goed. Mae ei groen yn chwarenog, gyda secretiad cas, drewllyd neu angheuol. Ceir cryn amrywiaeth o ran lliw'r croen, gyda chuddliw'n chwarae rhan bwysig yn hyn o beth: gall amrywio o frown i lwyd i wyrdd ac ar adegau lliwiau ffyrnig megis coch neu felyn neu ddu i ddychryn ei ysglyfaeth.
Yn gyffredinol, mewn dŵr mae'r llyffant yn dodwy ei wyau, a elwir yn grifft, ac maent yn deor yn y dŵr fel penaubyliaid bychan gyda chynffonau hir a thagellau mewnol a chegau ar gyfer bwyta llysdyfiant yn hytrach na chig. Cwbwlheir y cylch bywyd pan drawsnewidiant i ffurf oedolyn. Ar dir mae ambell rywogaeth yn dodwy ei wyau ac eraill yn hepgor y cyfnod penbwl. Er mai cigysyddion ydy'r rhan fwyaf o rywogaethau, mae rhai'n hollysol ac mae rhai'n gwledda ar ffrwyth.
Mae poblogaeth llyffantod yn gyffredinol wedi gostwng yn eithriadol ers y 1950au. Mae dros treuan ohonyn nhw, bellach, dan fygythiad, gyda dros 120 wedi darfod ers 1980.[1] Maen nhw'n cael eu difa gan lawer o afiechydon modern megis chytridiomycosis, a hynny drwy'r byd ac maent yn ffefryn i'w bwyta gan lawer o rywogaethau gan gynnwys dyn.
Ceir dwy rywogaeth gyffredin o lyffant yng Nghymru: Bufo bufo, y llyffant dafadennog, a Rana temporaria a elwir broga yn Ne Cymru a llyffant melyn neu lyffant cyffredin yng Ngogledd Cymru.
Ceir llawer o gyfeiriadau mewn llenyddiaeth at y llyffant gan gynnwys:
Mae patrwm tymhorol y llyffant wedi newid llawer dros y ddwy ganrif aeth heibio. Dyma gofnod gan y bardd gwlad a naturiaethwr John Clare o Swydd Northampton ar 11 Mawrth 1826 (gwanwyn cynnar meddai Clare!) o lyffantod yn dodwy: The frogs have began to croke and spawn in the ponds and dykes.. Erbyn diwedd ail ddegawd yr 21ed ganrif, dodwy grifft ym mis Chwefror yw'r norm yng Cymru o leiaf, ac fe gafwyd dodwy ym mis Ionawr yn rheolaidd (ee.2019, 2018, 2016, 2012, 2008, 2007, 2005, 2002 ac un posib yn 1999[2]
Mae'n debyg bod llyffantod benyw yn cludo'r jeli sydd o gwmpas yr wyau yn eu cyrff am fisoedd ynghynt. Mae hynny'n esgor ar sylwadau am "grifft sêr" pan fo llyffamtod yn csel eu llarpio gan crëyrod neu ddyfrgwn a'r jeli ym cael eu gadael y tu allan i'r cynefin arferol.
5 Chwe 1940 Meirioli a “thywydd grifft” ym Môn:
Grŵp o amffibiaid yn perthyn i'r urdd Anura (o'r Groeg 'an' neu 'dim' ac 'aoura' sef 'cynffon') yw'r llyffant neu froga. Mae tua 4,800 o rywogaethau sy'n byw ledled y byd, yn enwedig mewn mannau llaith yn y trofannau, sef dros 85% o ymlusgiaid. Mae ganddynt gorff tew a byr, pen mawr a choesau ôl hir ac maent yn gigysyddion. Does gan yr oedolyn ddim cynffon.
Mae'r ffosil hynaf sydd wedi'i ganfod o lyffant yn ffosil o 'broto-lyffant' a ymddangosodd yn yr epoc y Triasic cynnar, a hynny ym Madagasgar, ond credir fod eu tarddiad yn llawer hŷn: y cyfnod Permaidd, 265 miliwn o flynyddoedd yn ôl.
Nodweddir corff y llyffant gan lygaid mawr sy'n ymestyn allan o'r corff, tafod hir, coesau sy'n plygu'n daclus a diffyg cynffon. Er mai pyllau dŵr a thir gwlyb, ydy cynefin y rhan fwyaf o frogaod, gall oedolion ambell rywogaeth fyw o dan y ddaear neu ar goed. Mae ei groen yn chwarenog, gyda secretiad cas, drewllyd neu angheuol. Ceir cryn amrywiaeth o ran lliw'r croen, gyda chuddliw'n chwarae rhan bwysig yn hyn o beth: gall amrywio o frown i lwyd i wyrdd ac ar adegau lliwiau ffyrnig megis coch neu felyn neu ddu i ddychryn ei ysglyfaeth.
Yn gyffredinol, mewn dŵr mae'r llyffant yn dodwy ei wyau, a elwir yn grifft, ac maent yn deor yn y dŵr fel penaubyliaid bychan gyda chynffonau hir a thagellau mewnol a chegau ar gyfer bwyta llysdyfiant yn hytrach na chig. Cwbwlheir y cylch bywyd pan drawsnewidiant i ffurf oedolyn. Ar dir mae ambell rywogaeth yn dodwy ei wyau ac eraill yn hepgor y cyfnod penbwl. Er mai cigysyddion ydy'r rhan fwyaf o rywogaethau, mae rhai'n hollysol ac mae rhai'n gwledda ar ffrwyth.
Mae poblogaeth llyffantod yn gyffredinol wedi gostwng yn eithriadol ers y 1950au. Mae dros treuan ohonyn nhw, bellach, dan fygythiad, gyda dros 120 wedi darfod ers 1980. Maen nhw'n cael eu difa gan lawer o afiechydon modern megis chytridiomycosis, a hynny drwy'r byd ac maent yn ffefryn i'w bwyta gan lawer o rywogaethau gan gynnwys dyn.
Žáby (Anura, syn. Salientia) jsou jedním z řádů bezocasých obojživelníků. Ocas mají pouze pulci, který se při proměně (metamorfóze) vstřebává do těla. Často mají dlouhé, dobře vyvinuté zadní končetiny, přizpůsobené k plavání nebo ke skákání, pro žáby charakteristickému způsobu pohybu. Živí se nejčastěji hmyzem. Jejich rozmnožování je stejně jako u ostatních obojživelníků vázáno na vodní prostředí. Ve vodě se vyvíjejí jak vajíčka, tak z nich vylíhlí pulci, kteří dýchají ve vodě pomocí žaber. Z pulců se postupně vyvinou dospělé žáby, které dýchají vzduch a tím jsou na vodu vázány podstatně méně, některé druhy téměř vůbec. Přesto však nejsou ani dospělé žáby dokonale přizpůsobené životu na souši, neboť mají pouze slabě vyvinuté plíce a dýchání probíhá částečně prostřednictvím kůže, která kvůli tomu musí být tenká a vlhká, což klade vyšší nároky na vlhkost prostředí v němž žáby žijí.
Obojživelníci podobní žábám se objevili již v mladších prvohorách, zhruba před 300 miliony let. Evoluční předchůdci žab se objevili již v nejspodnějším triasu, jak dokazuje například druh Triadobatrachus massinoti z Madagaskaru.[1] První pravé žáby však vznikly až v druhohorách, zhruba před 190 miliony let. Největší evoluční radiace žab nastal až po hromadném vymírání na konci křídy před 66 miliony roků, kdy se v krátké době objevují předkové asi 88% současných žabích druhů.[2][3] Největší známou žábou všech dob je druhohorní rod Beelzebufo z Madagaskaru. První známou tropickou žábou je exemplář, objevený v jantaru z Barmy, o stáří asi 99 milionů let (počátek pozdní křídy).[4] Nejstarší známé fosiliní otisky stop pravých žab byly objeveny na území Jižní Koreje a pocházejí z období pozdní spodní křídy (asi před 115 miliony let).[5]
Zatím bylo popsáno 6021 druhů žab (k 31. květnu 2011), které jsou rozděleny do 38 čeledí. Z nich jsou nejpočetnější na druhy čeledě rosničkovití (Hylidae) s 901 druhy a skokanovití (ranidae) s 1400 druhy. Asi 88 % obojživelníků jsou žáby (dále ocasatí 9 % a červoři 3 %). Druhy žab ale stále přibývají, protože vědci stále objevují nové druhy a to zejména v tropech. Například v roce 2010 bylo objeveno 205 nových druhů.
Žáby jsou kvalifikovány do tří podřádů: Archeobatrachia – 4 čeledě primitivních žab, Mesobatrachia – 6 čeledí vývojově pokročilejších žab a Neobatrachia – 28 čeledí „moderních“ žab, zdaleka největší skupina. Neobatrachia se dále dělí na hyloidea a ranoidea.
Žáby se živí živou potravou, a to převážně hmyzem a jinými bezobratlými živočichy, některé větší druhy ale i malými obratlovci[6]. Většina žab potravu loví dlouhým lepkavým jazykem, který vymrští po oběti. Výjimkou je čeleď vodních žab pipovitých, které potravu přijímají normálně ústy. Během přijímání potravy žáby mrkají, jelikož dochází během polykání k zatahování očních bulev, což napomáhá posunování potravy do žaludku, pulci se živí řasami a minerály z vody a z bahna.[7]. Žáby také nemají žádné zuby na spodní čelisti, a tak přijímají potravu celou.
Žába se pohybuje po souši pomocí přískoků a skoků (výjimkou jsou například ropuchy, které častěji chodí a skáčou jen při útěku před predátorem), které provádí pomocí silných zadních nohou. Nejdelší zaznamenaný skok žáby na souši byl 5 metrů.[7] Ve vodním prostředí žába využívá plavací techniku zadních končetin, kdy je postupně dává k sobě a odtahuje podobně jako plavci typu prsa. Žáby při skákání vždy zavírají oči.
Pro žáby je typické zavalité tělo bez ocasu (od toho název bezocasí obojživelníci) s čtyřmi končetinami. Mezi druhy žab je velký velikostní rozdíl. Nejmenší žábou je 1 cm dlouhá Brachycephalus didactylus z Brazílie a naopak největším druhem je 40 cm dlouhý veleskokan goliáší (conraua goliath) z Kamerunu. Ještě větší byla pravěká žába rodu Beelzebufo, žijící v době před 70 miliony let na Madagaskaru.
Kostra žab je převážně zkostnatělá. Strop ústní dutiny tvoří spodina mozkovny (primární patro). K jedinému krčnímu obratli je lebka připojena dvěma kloubními hrboly. Počet obratlů je u žab velmi redukován (v bederní oblasti srůstají v tzv. urostyl). Žebra nejsou u žab plně vyvinuta. U žab se poprvé setkáváme s dobře vyvinutou hrudní kostí. Stavba kostry končetin již odpovídá základnímu schématu stavby u ostatních suchozemských obratlovců. Lopatka je u žab spojena s hrudní kostí, pánev se napojuje na páteř.
Žáby mají na předních nohách 4 a na zadních nohách 5 prstů. Nohy a prsty mají žáby vyvinuty podle prostředí, ve kterém žijí (jsou-li vodní, stromové či zemní). Plně vodní (např. africké žáby drápatky) či částečně vodní žáby mají mezi prsty plovací blány. Žáby žijící na stromech, zejména rosničky mají na prstech přísavky, díky nimž se dokážou přichytit i na kluzkých svislých površích. Většina stromových a zemních žab mají nohy dobře vyvinuté pro skákání.
Žáby mají většinou hladkou kůži, výjimkou jsou ropuchy, které mají kůži hrbolatou, která méně vysychá. Kůže žab je propustná na vodu (nemusí vůbec pít), kyslík a oxid uhličitý ve vodě, proto jsou žáby velmi náchylné na složení a znečištění vody. Kůže je plná slizových žláz, které mohou být přeměněny i na žlázy jedové, je také dobře prokrvená – u žab je výrazný podíl kožního dýchání. Ve spodní vrstvě škáry jsou chromatofory s pigmentem.
Žáby mají dobře vyvinuté oči, bylo experimentálně prokázáno barevné vidění. Sítnice je, na rozdíl od vyšších obratlovců, schopná regenerace. Zaostřování se děje posunem čočky, jako u ryb, čočka sama při akomodaci nemění tvar. Dospělé žáby mají tři dobře vyvinutá oční víčka. Kromě toho mají žáby i temenní (parietální) oko, které je schopné vnímat vlnovou délku i intenzitu světla.
Dospělé žáby mají dvě sluchové kůstky, které přenášejí vibrace do vnitřního ucha. Na povrchu hlavy mají bubínkové blány. U červorů je střední ucho redukované.
U pulců je zachován proudový orgán, kterým živočich vnímá pohyby vody. Žáby jsou jediní čtyřnožci, u kterých je vyvinutý. Na rozdíl od ryb netvoří postranní čáru.
Je u žab dobře vytvořen, čichový epitel je v nosních dutinách, poprvé se objevuje Jacobsonův orgán.
Některé druhy žab dokážou vylučovat z kůže mírné jedy. Například všechny druhy ropuch mají za očima jedové žlázy. Také žáby z čeledi pralesničkovití mají v kůži jedy a domorodí obyvatelé Jižní Ameriky jimi namáčejí svoje šípy pro lov zvěře. Žáby upozorňují na jedovatost pestrým zbarvením.
Jiné žáby se při napadení nafukují, aby působily jako větší a predátora tak zastrašily a nebo aby se mu nevešly do pusy. To je typické zejména pro ropuchy.
Poslední způsob obrany je maskování. Žáby jsou většinou zbarvené tak, aby co nejlépe splývaly s prostředím, ve kterém žijí. Maskování ale spočívá i v tvaru těla – výrostcích na hlavě, které můžou připomínat list.
Žáby se dorozumívají pomocí rezonančních měchýřků, které mají jen samci. Jsou umístěny párově po stranách hlavy (skokani), nebo mají jen jeden velký v hrdle (rosničky a ropuchy zelené). Samci stahováním a roztahováním měchýřků vyluzují zvuky, kterými lákají samičky k páření.
Žáby kladou vajíčka a samečci je rovnou oplozují spermiemi, jedná se o vnější oplození[8]. Z vajíček se potom líhnou larvy - pulci. Při páření samec objímá nohama samičku pod sebou, tato specifická poloha se nazývá amplexus[9].
Žáby jsou rozšířeny po celém světě vyjma Antarktidy, Arktidy a některých izolovaných ostrovů.[10][11] Dále nežijí v některých příliš suchých či studených oblastech, největší diverzity dosahují v tropech.
Žáby se nejčastěji vyskytují ve vlhkých oblastech poblíž vody. Některé žáby ale dokážou přežívat i v suchých či chladných podmínkách.
Každá žába žijící v mírných oblastech se v průběhu života vyskytuje na dvou odlišných lokalitách, první je zimoviště a druhé rozmnožovací centrum. Zimoviště je pro každý druh žáby typické. Např. skokan hnědý se vyskytuje v polích, rosnička zelená v lesích.
Rozmnožovacím centrem rozumíme tůň nebo podobné vodní stanoviště, která je zaplněná stojatou vodou. Nejčastější způsob dopravy vody do tůně je: srážkami, podzemními vodami, záplavami. Žáby se vyskytují i v jiných vodních centrech (rybníky, jezera, potoky, řeky a říčky, kaluže, atd.)
Žáby jsou důležitou složkou ekosystému. Nejen, že likvidují hmyz, ale žáby samotné jsou složkou potravy pro vodní ptactvo, jako je např. čáp bílý (Ciconia ciconia), volavka popelavá (Ardea cinerea) a podobně. Přímá úměra pro vodní ptactvo na rozšíření zastupuje samozřejmě i hnízdní podmínky, ale taky hojnost potravy, a to především žab a ryb.
V minulosti byly žáby a ropuchy často znevažovány a běžnými lidmi považovány za symbol neřesti (neboť bylo pozorováno jejich hlasité páření) a nečestnosti. Často jim byly přisuzovány nekalé úmysly a bývaly také považovány za průvodce čarodějnic a dalších domnělých "zlých" bytostí.[12] Dnes je situace s vnímáním žab ze strany veřejnosti mnohem lepší, ale jejich výskyt je stále značně omezován expanzí a znečišťováním prostředí ze strany civilizace. Mnoho druhů je také přímo ohroženo vyhubením.
Známe asi 5 000 druhů,[13] v ČR jich žije 13.[14] Kromě skokana hnědého jsou všechny zákonem chráněny.[14] Všechny chráněné druhy nesmíme jakkoliv ohrožovat.
skokan ostronosý - samec
Žáby (Anura, syn. Salientia) jsou jedním z řádů bezocasých obojživelníků. Ocas mají pouze pulci, který se při proměně (metamorfóze) vstřebává do těla. Často mají dlouhé, dobře vyvinuté zadní končetiny, přizpůsobené k plavání nebo ke skákání, pro žáby charakteristickému způsobu pohybu. Živí se nejčastěji hmyzem. Jejich rozmnožování je stejně jako u ostatních obojživelníků vázáno na vodní prostředí. Ve vodě se vyvíjejí jak vajíčka, tak z nich vylíhlí pulci, kteří dýchají ve vodě pomocí žaber. Z pulců se postupně vyvinou dospělé žáby, které dýchají vzduch a tím jsou na vodu vázány podstatně méně, některé druhy téměř vůbec. Přesto však nejsou ani dospělé žáby dokonale přizpůsobené životu na souši, neboť mají pouze slabě vyvinuté plíce a dýchání probíhá částečně prostřednictvím kůže, která kvůli tomu musí být tenká a vlhká, což klade vyšší nároky na vlhkost prostředí v němž žáby žijí.
Frøer og tudser (Anura), også kaldet springpadder, er en orden inden for padderne med mere end 20 familier og ca. 3800 arter. Det er haleløse padder med et stort hoved på en kort, bred krop og med en hud der er forsynet med kirtler. Springpadder bevæger sig ved at hoppe eller svømme ved hjælp af lange baglemmer med svømmehud mellem tæerne.[1] De er for det meste grønne eller brune. De fleste arter lever, hvor der er mere eller mindre fugtigt.
Slanke springpadder med glat og fugtig hud kaldes frøer, mens plumpe springpadder med tør og vortet hud kaldes tudser.[2] Med frøer kan også mere specifikt menes de egentlige frøer (Ranidae).
Kroppen hos springpadder er kort, uden udvendig synlig hale. Baglemmerne er længere og kraftigere end forlemmerne. De bruges på land som springben og i vand som svømmeben. Forfoden har (med enkelte undtagelser) 4 fingre og bagfoden 5 tæer. En trommehule er normalt til stede og oftest også en trommehinde. Øjnene er normalt med øjenlåg, det nedre tyndt og bevægeligt. Tænder kan findes i overkæben og ganen, men underkæben hos de aller fleste arter er tandløs. Der findes 9 kropshvirvler og normalt ingen ribben. Halehvirvlerne er sammensmeltet til et enkelt, langstrakt ben, der er indesluttet i kroppen. Albueben og spoleben er sammensmeltet til et stykke, ligesom skinneben og lægben.[3]
Springpadder er som voksne kødædere, hvor nogle arter f.eks. lever af snegle, regnorme og insekter. Byttet fanges af flere arter ved at skyde den klæbrige tunge ud i en meget hurtig bevægelse, så det derved hænger fast i tungen og kan ædes.
De voksne springpadder holder f.eks. til ved bredden af søer og damme, hvor de i Danmark yngler i begyndelsen af april. Hos de danske arter lægges æggene altid i vand. De befrugtes af hannen udenfor hunnens krop samtidig med at de lægges. Hannen kravler op på hunnens ryg og omklamrer den under æglægningen. Æggene klækker normalt til cirka 5 millimeter store larver, der ånder ved gæller og oftest er planteædere. Larverne, der kaldes haletudser, forvandler sig i løbet af nogle uger eller måneder til de voksne, oftest landlevende dyr, der ånder ved lunger og er kødædende.
Der er dog stor variation i ynglebiologien mellem arterne, især i troperne. Eksempelvis lægger nogle arter ikke deres æg i vand, mens andre har en omfattende yngelpleje.
Mange frøer og tudser kan frembringe lyde, der er artsspecifikke og især spiller en rolle i yngletiden. Lyden frembringes i strubehovedet, hvor der findes stemmelæber, idet luften passerer frem og tilbage mellem lunger og en eller to kvækkeposer. Mund og næsebor holdes lukket, mens dyret kvækker. Der findes indre og ydre kvækkeposer. Tydelige er f.eks. de ydre kvækkeposer hos grøn frø, hvor de i oppustet tilstand ligner to balloner på siderne af hovedet. Et andet eksempel er løvfrøen, der har en enkelt kvækkepose, der ved opblæsning svulmer voldsomt op. Strandtudsen har i modsætning hertil en indre kvækkepose, hvor opsvulmingen er mindre kraftig, da den ikke er omgivet af et elastisk hudparti. Nogle grupper af springpadder har ingen kvækkeposer.[4]
Springpadderne har flere forskellige slags stemmer, men det er normalt kun hannerne, der siger noget. Parringsstemmen er den mest kendte og har betydning for adskillelsen af arterne, så bastardering undgås. Den høres på ynglepladsen i yngletiden. En anden stemme er territoriekaldet, der både kan høres i og udenfor yngletiden. Desuden findes en klukkende eller knirkende afværgelyd, som hannen udsender, hvis en anden han forsøger at parre sig med den. Denne lyd får den parringslystne han til at slippe sit tag. Endelig kan en del frøer udsende en angstlyd, der kan være en høj jamrende skrigen med stigende og faldende tonehøjde. Stemmen frembringes i modsætning til kvækningen med åben mund, og sker når dyret gribes af en fjende, f.eks. en slange eller en større gnaver.[4]
Frøer og tudser har mange naturlige fjender, eksempler kan i Danmark være fiskehejre, stork, snog og musvåge. I yngletiden, hvor arterne opholder sig i vand, omfatter deres naturlige fjender også f.eks. gedde, ål, odder og vandspidsmus.
Familier af springpadder, hvori der findes danske repræsentanter:
Orden: Anura
Frøer og tudser (Anura), også kaldet springpadder, er en orden inden for padderne med mere end 20 familier og ca. 3800 arter. Det er haleløse padder med et stort hoved på en kort, bred krop og med en hud der er forsynet med kirtler. Springpadder bevæger sig ved at hoppe eller svømme ved hjælp af lange baglemmer med svømmehud mellem tæerne. De er for det meste grønne eller brune. De fleste arter lever, hvor der er mere eller mindre fugtigt.
Slanke springpadder med glat og fugtig hud kaldes frøer, mens plumpe springpadder med tør og vortet hud kaldes tudser. Med frøer kan også mere specifikt menes de egentlige frøer (Ranidae).
Die Froschlurche (Anura; auch: Salientia) sind die bei weitem artenreichste der drei rezenten Ordnungen aus der Wirbeltierklasse der Amphibien. Die anderen Ordnungen der Amphibien sind die Schwanzlurche (Caudata, Urodela) und die Schleichenlurche oder Blindwühlen (Gymnophiona).
Die meisten Froschlurche werden – ohne näheren verwandtschaftlichen Zusammenhang – als „Frösche“ bezeichnet. Zu den Froschlurchen zählen außerdem Kröten und Unken.
Die Bezeichnungen Frosch und Kröte sind systematisch nicht eindeutig abgegrenzt. Unter einem „Frosch“ wird landläufig ein relativ schlanker, agiler Froschlurch mit eher glatter und feuchter Haut sowie kräftigen Sprungbeinen verstanden. Beispiel: die Gattung Rana (Echte Frösche). Dagegen gilt eine „Kröte“ allgemein als plump und gedrungen gebaut. Ihre Haut ist eher trocken und „warzig“. Die vergleichsweise kurzen Hinterbeine dienen nur zu kurzen Hüpfern und zum Laufen auf allen vieren. Beispiel: die Gattung Bufo (Echte Kröten). In der Realität verschwimmen diese Abgrenzungsmerkmale häufig und lassen sich in der Taxonomie der Amphibien nicht bestätigen.
Eindeutiger sind die Unken abzugrenzen und systematisch zuzuordnen: Eine Unke ist ein stammesgeschichtlich urtümlicher, kleiner Froschlurch mit einem abgeflachten Körper, warziger Oberseite und grell-bunt (gelb oder rot) marmorierter Bauchseite. Unken bilden die Gattung Bombina.
Im Gegensatz zu den Schwanzlurchen weisen die Froschlurche nur während der Larvenphase im Wasser einen Schwanz auf. Mit der Metamorphose zum Landtier wird dieser zurückgebildet. Je nach Ausprägung der Hinterbeine, die deutlich länger als die vorderen Extremitäten sind, bewegen sich Froschlurche laufend, hüpfend oder weit springend vorwärts. Einige können sehr gut klettern; andere graben sich im Boden ein oder leben ständig im Wasser.
Der Knochenbau ist wie bei allen Amphibien teilweise reduziert. So besitzen sie, bis auf wenige Arten der Unterordnung Archaeobatrachia, keine Rippen. Der Schultergürtel der Froschlurche ist im Gegensatz zu den Schwanzlurchen verknöchert und mit einem Schlüsselbein ausgestattet. Die Hüftregion ist besonders stabil gebaut und weist auffallend weit hinten positionierte Gliedmaßenansätze auf, um für die enorme Hebel- und Schubwirkung beim Springen geeignet zu sein.
Die Haut kann glatt oder warzig sein. Sie ist von Schleimdrüsen durchsetzt, die die Oberfläche feucht halten und eine Hautatmung ermöglichen. Viele Arten weisen zudem Körperdrüsen auf, die ein giftiges Schutz- und Wehrsekret produzieren. Pigmentzellen sind für eine vielfältige Färbung und Zeichnung verantwortlich.
Die größte Art ist mit einer Kopf-Rumpf-Länge von belegten 33 und vermuteten 35 bis 40 Zentimetern der seltene westafrikanische Goliathfrosch (Conraua goliath). Mehrere „miniaturisierte“ Arten erreichen dagegen ausgewachsen kaum einen Zentimeter Größe, wie die brasilianische Sattelkröte Brachycephalus didactylus, das kubanische Monte-Iberia-Fröschchen (Eleutherodactylus iberia), der madagassische Engmaulfrosch Stumpffia pygmaea oder der Seychellenfrosch Sechellophryne gardineri, die auch zu den weltweit kleinsten Landwirbeltieren überhaupt zählen.
Die meisten Froschlurche suchen zur Vermehrung ein Gewässer auf, um dort Laich abzulegen; es gibt allerdings auch Arten mit direkter Larvenentwicklung innerhalb der an Land abgelegten Eier (Terrarana) und mindestens eine lebendgebärende Art (Limnonectes larvaepartus). Die Männchen verfügen oft über Schallblasen, um Paarungsrufe zu erzeugen. Der Laich wird über die Kloake des Weibchens in Form von Klumpen, Schnüren oder als Einzeleier ins Wasser – manchmal aber auch auf Blätter über dem Wasser oder auf den Waldboden – abgegeben und dabei vom im Amplexus befindlichen Männchen äußerlich besamt (vgl. dagegen Schwanzlurche). Nach mehreren Tagen hat sich aus dem Embryo eine Kaulquappe entwickelt.
Zunächst sind die Kiemen noch außen liegend, später werden sie von einer Hautfalte bedeckt. Nach mehreren Wochen Larvalentwicklung, während der sich die Kaulquappe von Pflanzen, organischem Material, Kleinsttieren und Aas, bei einigen Baumsteigerfröschen auch von arteigenem, unbefruchtetem Laich ernährt, erscheint bei dem Tier zuerst ein hinteres Beinpaar. Die Vorderbeine werden erst einige Tage später äußerlich sichtbar.
Nach zumeist mehreren Monaten Wasseraufenthalt stellt sich die eigentliche Metamorphose zum Landtier ein, wobei sich unter anderem die Kiemen zurückbilden. Die Atmung erfolgt nun über eine einfach gebaute Lunge sowie die sich stark verändernde Haut. Verdauungs- und Nervensystem sowie weitere Organe werden innerhalb kurzer Zeit völlig umgebildet. Äußerlich weicht die eher fischartige Gestalt den Formen eines Frosches oder einer Kröte (Näheres siehe unter Kaulquappe). Am Schluss der Umwandlung wird der Ruderschwanz allmählich resorbiert.
Je nach Art dauert es unterschiedlich lange, meist ein bis drei Jahre, ehe das Tier geschlechtsreif wird und selbst am Fortpflanzungsgeschehen teilnimmt.
Metamorphosierte Tiere ernähren sich ausschließlich carnivor, in der Regel von lebenden Insekten, Gliedertieren, Weichtieren und Spinnen.
Froschlurche kommen auf allen Kontinenten, mit Ausnahme von Antarktika, und vielen Inseln von den kalt-gemäßigten bis in die tropischen Zonen vor. Die biogeografische Region der Holarktis ist vergleichsweise artenarm; Schwerpunkte der Artenvielfalt liegen insbesondere in den Subtropen und Tropen der neuweltlichen Neotropis (Mittel- und Südamerika) und altweltlichen Paläotropis (Südostasien, Afrika südlich der Sahara).
Derzeit werden je nach Übersicht 40 bis 47 rezente Familien mit rund 5800 Arten unterschieden – die Artenzahl ändert sich laufend, vor allem wegen neuer Erkenntnisse aus der phylogenetischen Forschung zur Systematik sowie aufgrund ständiger Neuentdeckungen insbesondere von tropischen Fröschen, die bisher unbekannt waren. Die formenreichsten Familien sind die Laubfrösche (Hylidae) mit rund 870 Arten und die Echten Frösche (Ranidae) mit rund 850 Arten.
(Sortierung innerhalb desselben Ranges alphabetisch nach wissenschaftlichen Namen)
Eine Auflistung europäischer Arten ist in der Liste europäischer Amphibien zu finden.
Der stammesgeschichtliche Ursprung der Froschlurche und der anderen modernen Amphibien (Lissamphibia) ist noch nicht mit absoluter Sicherheit geklärt. Meist wird angenommen, dass er in der Gruppe der Temnospondyli zu suchen ist.[1] Gerobatrachus, ein unterpermischer Temnospondyle aus der Familie der Amphibamidae, zeigt eine Mischung von Frosch- und Schwanzlurchmerkmalen („Mosaikform“) und könnte dem gemeinsamen Vorfahren von Frosch- und Schwanzlurchen nahestehen.[2] Czatkobatrachus[3] aus dem Untertrias von Polen und Triadobatrachus aus Madagaskar[4] zeigen schon deutliche Froschmerkmale. Beide werden zu den Salientia gezählt, eine Überordnung der Amphibien, zu der die modernen Froschlurche und ursprüngliche fossile Formen gehören. Einige der rezenten Froschfamilien können anhand von Fossilfunden bis in den Jura und die Kreidezeit zurückverfolgt werden.[5]
Weich-PVC kann Phthalatweichmacher, Antioxidantien, Wärmestabilisatoren (unterstützen die Formgebung) wie beispielsweise Organozinnstabilisatoren[6][7] und Flammschutzmittel (beispielsweise Antimontrioxid[8]) als Zusatzstoffe enthalten (siehe dazu Folienteich#Polyvinylchlorid (PVC)). Die nicht chemisch gebundenen Weichmacher, die „bis zu über 50 % der Gesamtmasse“[9] ausmachen können, werden leicht aus einer Teichfolie herausgelöst[10] und migrieren dann in die Umwelt. Phthalate[11], Bisphenol A[11] und die enthaltenen Organozinnverbindungen[6][11] gelten als endokrin (hormonell) wirksam, derartige Substanzen beeinflussen die Fortpflanzungs- und Überlebensrate von Amphibien[12] und sogar das Rufverhalten von Fröschen "und zwar so spezifisch, dass alle Substanzen nach ihren Wirkmechanismen klassifiziert und in umweltrelevanten Konzentrationen nachgewiesen werden konnten."[13].
Die Froschlurche (Anura; auch: Salientia) sind die bei weitem artenreichste der drei rezenten Ordnungen aus der Wirbeltierklasse der Amphibien. Die anderen Ordnungen der Amphibien sind die Schwanzlurche (Caudata, Urodela) und die Schleichenlurche oder Blindwühlen (Gymnophiona).
Die meisten Froschlurche werden – ohne näheren verwandtschaftlichen Zusammenhang – als „Frösche“ bezeichnet. Zu den Froschlurchen zählen außerdem Kröten und Unken.
Agru (Assaɣ ussnan: Anura) d tafesna n tkelmanin timtegzitin, Iga d tagrawt tandant tamseksumt s talɣa tagejdant yakk d tikelmanin war asallaf gar-asen amqerqur, Agru yettidir druɣ deg yal iddg deg umadal seg yideggan isbegsanen ar ideggan anda yettili usemmiṭ, maca azal ameqran n telmas-is ttidirent deg tẓegwa timanẓarin anda ttiswasmlen din ugar n 5000 n telmas, Ɣas akken ugten-t telmas-is maca deg iseggasen ineggura imusnawen ttwalin d akken amdan n igmanen n waṭas n telmas tt-drusen (tt-nqasen)
Azal n yimdanen ur smgirriden ara gar n wegru d umqerqur s usrag (ɣef ssebba) n wemcabi meqqren yellan gar-asen
Azal n 88% n telmas n tkelmanin ttusisemlent deg tfesna n igra, Deg tfesna ayi llant wazal n 4810 n telmas ẓẓunin-t (ferqen-t) ɣef 33 n twaculin gar-asent: igranẓulen (Leptodactylidae) s wazal n 1100 n telmas, Timerdedduyin (Hylidae) s wazal n 800 n telmas, d igerdettiyen (Ranidae) s wazal n 750 n telmas dɣa tiwaculin-a gan-t d tid yakk meqqren. Igra ttawin yakk igra imayniten d telmas n tmesɣaz yemgaraden, Asexdem n wawal AGRU d UMQERQUR ur ila ara (ur yesɛa ara) yakk azadur amessarti acku deg tmuɣli n imusnawen n usismel yakk igmanen n tfesna n waradfer d igra u anagar kan tawacult n umqerqur idetti iy gan d imqerqar ma d irem imezdi Agru yesskanay tid yettidiren deg twennaṭ n waman neɣ azunwaman yerna tla aglim d aleqqaq s unemgal n imqerqar yettidiren deg twennaṭ dgi llan drus kan n waman yerna aglim-is ikkerked (ḥercaw) anagar yiwet n telmest n imqerqar isem-is (Bombina-Bombina) tla (tesɛa) aylalen n umqerqur maca yettidir deg waman
Igra d imqerqar ttusisemlen deg 3 n idu-fesniwen igan d: Archaeobatrachia anda llant 3 n twaculin n igra imenza, yakk d Mesobatrachia anda llant 5 n twaculin n igra inamhazen cwi ugar n Archaeobatrachia, yakk d Neobatrachia dɣa adu-tfesna ayi d win yakk dgi llant dges waṭas n twaculin (24 n twaculin n igra itraren) yerna d nettat yakk i d tanamhazt ugar n tiyaṭ akken daɣen i ttidirent deg waṭas n ideggan n umadal
Agru (Assaɣ ussnan: Anura) d tafesna n tkelmanin timtegzitin, Iga d tagrawt tandant tamseksumt s talɣa tagejdant yakk d tikelmanin war asallaf gar-asen amqerqur, Agru yettidir druɣ deg yal iddg deg umadal seg yideggan isbegsanen ar ideggan anda yettili usemmiṭ, maca azal ameqran n telmas-is ttidirent deg tẓegwa timanẓarin anda ttiswasmlen din ugar n 5000 n telmas, Ɣas akken ugten-t telmas-is maca deg iseggasen ineggura imusnawen ttwalin d akken amdan n igmanen n waṭas n telmas tt-drusen (tt-nqasen)
Azal n yimdanen ur smgirriden ara gar n wegru d umqerqur s usrag (ɣef ssebba) n wemcabi meqqren yellan gar-asen
Os anuros (scientificament Anura) son a orden con mes numero d'especies d'os anfibios actuals. Se diferencian d'os atros anfibios en no tener coda y en tener as patas zagueras largas y adaptatas ta brincar. En aragonés, as especies d'Anura son conoixitas popularment como «rana/granotas» y «zapos».
Os anuros se reconoixen facilment por l'ausencia de coda y por a doble longaria d'os miembros posteriors respecto a los anteriors. O movimiento d'os miembros posteriors se fa d'a mesma traza que un muelle, que se contraye y s'expande, o que representa una locomoción brincadera, con sincronización de movimientos d'as dos patas posteriors que ye caracteristica d'este grupo.
A cintura pelviana ye bien osificata en relación a los atros anfibios ta poder fer de refirme d'os miembros posteriors. A rechión sacra por un regular ye marcata con una vertebra diferent a las atras d'o cuerpo y por detras bi ha unas vertebras caudals fusionatas en urostilo.
O cubito y radio son fusionatos, a l'egual que a tibia y peroné. En o piet posterior os uesos d'a planta y os didos son prolargatos.
A cintura peitoral ye a-saber-lo d'osificata y en bi ha dos tipos basicos con variacions. A diferencia d'os urodelos y apodos tienen encara uesos dermicos en a cintura peitoral por eixemplo en as claviculas.
En o cranio os uesos frontals y parietals son fusionatos en un gran complexo dorsal, y presentan tamién centros formatos por osificacions d'os arcos neurals que resultan d'a condrificación y posterior osificación d'as vainas notocordals. Se'n distingue tres tipos: ectocordal, holocordal y estegocordal. O numero de vertebras troncals queda reducito a 5 - 9 representando un alcurzamiento d'o cuerpo, talment ligato a ixe tipo de locomoción brincadera que fan, como tamién l'ausencia de cuello, que no deixa que a cabeza se desvíe lateralment quan se brinca.
Os anuros son formas muito activas y tienen uellos grans y parpiellos mobils. O tempán ye superficial y gran. A larinche ye bien desembolicata y a producción de sonitos ye important en o comportamiento territorial y sexual. Bi ha bolsas y sacos bucals que actuan como cambras de resonancia quan fan o suyo cante carateristico, que ye o «ranuco».
A fecundación ye externa y a reproducción ovipara con excepcions. A mayoría presentan un desembolic larvario libre, o cullarón.
L'òrdre dels Anoras o Salientia recampa d’anfibians sens coa. Entran dins aquesta categoria las granhòtas, reinetas e grapauds, amb cap larg, de patas posterioras e una cintura pelviana plan desvolopada que lor permet de sautar.
L'òrdre dels Anoras foguèt creat per Blasius Merrem (1761-1824) en 1820.
Anura es un ordine de Lissamphibia, Amphibia.
Os anuros (scientificament Anura) son a orden con mes numero d'especies d'os anfibios actuals. Se diferencian d'os atros anfibios en no tener coda y en tener as patas zagueras largas y adaptatas ta brincar. En aragonés, as especies d'Anura son conoixitas popularment como «rana/granotas» y «zapos».
Os anuros se reconoixen facilment por l'ausencia de coda y por a doble longaria d'os miembros posteriors respecto a los anteriors. O movimiento d'os miembros posteriors se fa d'a mesma traza que un muelle, que se contraye y s'expande, o que representa una locomoción brincadera, con sincronización de movimientos d'as dos patas posteriors que ye caracteristica d'este grupo.
A cintura pelviana ye bien osificata en relación a los atros anfibios ta poder fer de refirme d'os miembros posteriors. A rechión sacra por un regular ye marcata con una vertebra diferent a las atras d'o cuerpo y por detras bi ha unas vertebras caudals fusionatas en urostilo.
O cubito y radio son fusionatos, a l'egual que a tibia y peroné. En o piet posterior os uesos d'a planta y os didos son prolargatos.
A cintura peitoral ye a-saber-lo d'osificata y en bi ha dos tipos basicos con variacions. A diferencia d'os urodelos y apodos tienen encara uesos dermicos en a cintura peitoral por eixemplo en as claviculas.
En o cranio os uesos frontals y parietals son fusionatos en un gran complexo dorsal, y presentan tamién centros formatos por osificacions d'os arcos neurals que resultan d'a condrificación y posterior osificación d'as vainas notocordals. Se'n distingue tres tipos: ectocordal, holocordal y estegocordal. O numero de vertebras troncals queda reducito a 5 - 9 representando un alcurzamiento d'o cuerpo, talment ligato a ixe tipo de locomoción brincadera que fan, como tamién l'ausencia de cuello, que no deixa que a cabeza se desvíe lateralment quan se brinca.
Os anuros son formas muito activas y tienen uellos grans y parpiellos mobils. O tempán ye superficial y gran. A larinche ye bien desembolicata y a producción de sonitos ye important en o comportamiento territorial y sexual. Bi ha bolsas y sacos bucals que actuan como cambras de resonancia quan fan o suyo cante carateristico, que ye o «ranuco».
A fecundación ye externa y a reproducción ovipara con excepcions. A mayoría presentan un desembolic larvario libre, o cullarón.
L'òrdre dels Anoras o Salientia recampa d’anfibians sens coa. Entran dins aquesta categoria las granhòtas, reinetas e grapauds, amb cap larg, de patas posterioras e una cintura pelviana plan desvolopada que lor permet de sautar.
L'òrdre dels Anoras foguèt creat per Blasius Merrem (1761-1824) en 1820.
Bangkong mangrupa ngaran umum pikeun ampibi ordo Anura. Bangkong sawawa dicirikeun ku suku tukangna nu panjang, awakna pondok, ramo selaputan, sarta panonna nolol. lolobana bangkong biasa hirup di dua alam, semi-akuatik, tapi lincah di darat ku cara ngaclog jeung nérékél. Biasana ngendog dina balong, situ, ranca, ku sabab larvana, buruy, tumuwuh dina cai. Bangkong sawawa hirupna karnivora, utamana ngahakan artropoda, annelida, jeung Gastropoda. Paling gampang kanyahoan mun disada, utamana dina mangsa jalangan.
Bangkong sumebar ti wewengkon tropis nepi ka subantartika, tapi lolobana mah aya di leuweung hujan tropis. Bangkong mangrupa golongan vertebrata nu panglobana, kabagi kana sahanteuna 5000 spésiés. Najan kitu, populasina kiwari beuki ngurangan.
Ordo Anura ngawengku 5.250-an spésiés dina 33 famili, di antarana Leptodactylidae (1100 spp.), Hylidae (800 spp.) jeung Ranidae (750 spp.). Leuwih ti 80% spésiés ampibi téh kaasup kana golongan bangkong.
Tina jihat taksonomi, sakabéh anggota ordo Anura téh disebutna bangkong, sedengkeun sapopoé mah nu disebut bangkong téh leuwih nujul ka "bangkong korodok", anggota famili Bufonidae, nu leuwih loba hirup di darat, teu kaasup bancét (nu loba hirup na cai) jeung cakung (hirup na tatangkalan).
Bangkong dibagi kana tilu subordo: Archaeobatrachia (nu ngawengku opat famili bangkong primitip), Mesobatrachia (nu ngawengku lima famili bangkong évolusionér panengah), jeung Neobatrachia (golongan panggedéna nu ngandung 24 famili bangkong "modéren"). Néobatrachia salajengna dibagi kana Hyloidéa jeung Ranoidéa[1]. Klasifikasi ieu dumasar kana fitur morfologis kayaning jumlah vertebrae, struktur pectoral girdle, jeung morfologi buyur. Najan klasifikasi ieu sacara umum ditarima, pancakaki antar familina mah masih diaduregengkeun. Studi genetika molekulér salajengna dipiharep bisa méré jalan pikeun nangtukeun pancakaki famili-famili bangkong ieu[2].
Sababaraha spésiés bangkong bisa ngalaman hibridisasi. Misalna, Rana esculenta mangrupa hibrid R. lessonae jeung R. ridibunda.
Salaku ampibi, morpologi bangkong mah kaasup ahéng. Mun dibandingkeun jeung ampibi lianna, misalna salamander jeung caecilia, bangkong béda ku sabab teu buntutan mun geus sawawa sarta sukuna leuwih cocog pikeun ngaclog batan leumpang. Pisiologi bangkong sacara umum mah sarupa jeung ampibi séjén (sarta béda ti vertebrata darat lianna) sabab oksigén bisa nembus kulitna nu perméabel pisan. Fitur ahéng ieu jadi pakarang bangkong pikeun "ngarénghap" ngaliwatan kulit. ku sabab oksigén leyur dina lapisan cai dina kulitna sarta lajeng nembus kana getihna, kulit bangkong téh salawasna kudu baseuh/lembab; balukarna, bangkong jadi gampang karacunan ku lingkunganana, nu bisa baé milu leyur dina cairan na kulitna lajeng asup kana aliran getih.
Daur hirup bangkong, sakumaha ilaharna ampibi, diwangun ku opat hambalan: endog, buyur, métamorfosis, jeung sawawa. Nalika geus manggih pitempateun melak endog, bangkong jalu biasana disada pikeun ngirut bikangna kangkan datang ka éta tempat. Aya sababaraha spésiés bangkong nu sok ngajaga endogna, malah nepi ka geus jadi buyur.
Daur hirup bangkong dimimitian tina endog. Lolobana mah ieu endog téh dipelak dina cai, sakalina bisa ngandung rébuan endog. Mangsa ngendog téh biasana mah bareng, antukna mun dihakan prédator gé, sahanteuna bakal nyésa, da kaburu wareg; buyurna ogé loba kénéh nu ngadodoho, tapi sahanteuna geus bisa ngojay pikeun nyalametkeun manéh. Aya ogé bangkong nu ngendog dina dangdaunnan luhureun cai, naplok, antukna mun geus megar, buyurna langsung murag kana cai. Spésiés bangkong séjénna, nu ngendog di darat, bisa ngarasakeun geleserna prédator (misalna oray), sarta megar saméméh waktuna pikeun ngejat tina pamangsa[3]. Bufo marinus mah béda deui, ieu bangkong ngaluarkeun endog nu ngandung racun. Najan hambalan endog ieu rupa-rupa gumantung spésiés jeung lingkunganana, endog bangkong cai mah ilaharna megar dina jangka saminggu.
Samegarna tina endog, buruy téh hirup na cai, tanpa suku, tapi boga buntut nu dipaké pikeun ngojay. Buruy mah hérbivora, utamana ngahakan ganggang, kaasup diatom nu disaring tina cai ngaliwatan insangna, tapi aya ogé nu karnivora, ngahakan serangga atawa buruy jeung lauk nu leuwih leutik. Buruy kudu bajoang antara silih hakan jeung dimangsa prédator lianna. Buruy aya ogé nu ngandung racun. Lilana jadi buruy téh rupa-rupa, ti saminggu nepi ka sataun, sabab métamorfosisna kapegat ku usum tiris.
Dina panungtung hambalan, buruy ngalaman métamorfosis, transisi ka bentuk sawawa. Métamorfosis ngawengku parobahan morpologi jeung pisiologi, nyaéta tumuwuhna suku tukang, suku hareup, leungitna insang, sarta mekarna bayah. Peujitna mondokan sabab ngised tina hérbivora jadi karnivora, panonna ngised sacara rostral jeung dorsal, antukna tetempoanana jadi binokulér. Parobahan posisi panon bangkong nunjukkeun parobahan tina mangsa jadi pamangsa. Salajengna, hambalan ahir kamekaran bangkong ngawengku apoptosis (program paéh sél) jeung ngelokna buntut.
Sanggeus métamorposis, bangkong ngora aya nu nyebar di habitat darat ninggalkeun cai, aya ogé nu tetep cicing di habitat cai. Ampir sakabéh spésiés bangkong karnivora, ngahakan invertebrata kayaning artropoda, annelida, jeung gastropoda. Sababaraha spésiés nu badag kadang ngahakan mamalia leutik, lauk, jeung bangkong nu leuwih leutik. Aya nu ngamangsa maké létahna nu cepel pikeun néwak mangsa nu gesit, aya ogé nu maké 'leungeun'na pikeun nyamualkeun mangsa kana sungutna. Lian ti ngamangsa, aya ogé bangkong nu kahakanan utamana tutuwuhan[4].
Bangkong mangrupa mangsa manuk, lauk badag, oray, careuh, jeung sato lianna. Manusa ogé aya nu beuki bangkong (ukur sababaraha spésiés bangkong, baca bab tatanén di handap).
Nalika nincak sawawa, biasana mah bangkong téh sok balik deui ka tempat megarna, antukna bisa jadi migrasi taunan rébuan bangkong.
Mun geus aya di tempat kawin, bangkong jalu disada pikeun ngirut bikangna.
Bangkong téh aya di mana-mana, iwal di Antartika jeung pulo-pulo tengah sagara; panglobana mah di wewengkon tropis, sabab cocog jeung kaayaan kulitna nu butuh loba cai. Aya éta ogé bangkong nu hirup dina keusik nu carang caina, tapi ieu mah geus adaptasi sacara husus. Genus Australia Cyclorana jeung Amérika Pternohyla bakal ngubur manéh dina taneuh, nyieun kepongpong nu teu tembus cai, sarta hibernasi salila halodo. Mun geus hujan, sakadang bangkong kakara kaluar, terus néang situ/balong pikeun kawin/baranahan. Kamekaran endog jeung buyurna gancang pisan dibanding bangkong lianna, antukna pas halodo deui téh geus sawawa. Aya sababaraha bangkong nu bisa hirup di nu tiis, kayaning Bangkong Kai nu hirup di wewengkon Kutub, nu ngubur manéh dina taneuh nalika usum tiris dina kaayaan méh sakujur awakna beku.
|coauthors= (bantuan)
Bangkong mangrupa ngaran umum pikeun ampibi ordo Anura. Bangkong sawawa dicirikeun ku suku tukangna nu panjang, awakna pondok, ramo selaputan, sarta panonna nolol. lolobana bangkong biasa hirup di dua alam, semi-akuatik, tapi lincah di darat ku cara ngaclog jeung nérékél. Biasana ngendog dina balong, situ, ranca, ku sabab larvana, buruy, tumuwuh dina cai. Bangkong sawawa hirupna karnivora, utamana ngahakan artropoda, annelida, jeung Gastropoda. Paling gampang kanyahoan mun disada, utamana dina mangsa jalangan.
Bangkong sumebar ti wewengkon tropis nepi ka subantartika, tapi lolobana mah aya di leuweung hujan tropis. Bangkong mangrupa golongan vertebrata nu panglobana, kabagi kana sahanteuna 5000 spésiés. Najan kitu, populasina kiwari beuki ngurangan.
Beq an boq ( bi latînî Anura, ango "bêdûvik"), komek e mezin ji canewerên bejavî ne, ku him di nav avê de û him jî li bejahiyê dijîn. Dema hîn kurmik in bi berkurkê û dema mezin dibin jî pisikên xwe bihnê didin û distînin. Biharan beq xerzên xwe datînin. Di nav xerzeke beqê de bi hezaran hêk hene.
Ji hêkên wan kurmik çêdibin. Heta ku ew dibin beq çend caran formê xwe diguherin. Lingên wan ên paş bi hêz in ku xwe baş çeng bikin.
Koma beqan an Anura , goştxwerin ku kurm û kêzan dixwin, ta ku hinek cureyên beqan hene ku dikanin beqên ji cins û cureyên din dixwin wek beqga. Ew nêçîra xwe bi zimanê xwe yê dirêj digirin.
Beq an boq ( bi latînî Anura, ango "bêdûvik"), komek e mezin ji canewerên bejavî ne, ku him di nav avê de û him jî li bejahiyê dijîn. Dema hîn kurmik in bi berkurkê û dema mezin dibin jî pisikên xwe bihnê didin û distînin. Biharan beq xerzên xwe datînin. Di nav xerzeke beqê de bi hezaran hêk hene.
Bretkosa (apo mashkulli i saj Bretku) është kafshë e vogël pa bisht, me ngjyrë të murrme a të gjelbër, me këmbët e prapme të gjata, që ecën duke kërcyer dhe që mund të jetojë në ujë dhe në tokë.[1]
Shumimin e kryen me form seksuale me ane te vezeve. Ajo mund te bej mbi300 veze por me pak se 20 formohen ne bretkosa sepse jane ushqim per peshqit
Ka disa lloje si Bretkosa e gjelbërt, e barit, dhe janë të njohura për këndimin (kuakin), që lëshojnë dhe për tufat që krijojnë.
Bretkosa (apo mashkulli i saj Bretku) është kafshë e vogël pa bisht, me ngjyrë të murrme a të gjelbër, me këmbët e prapme të gjata, që ecën duke kërcyer dhe që mund të jetojë në ujë dhe në tokë.
Shumimin e kryen me form seksuale me ane te vezeve. Ajo mund te bej mbi300 veze por me pak se 20 formohen ne bretkosa sepse jane ushqim per peshqit
Ka disa lloje si Bretkosa e gjelbërt, e barit, dhe janë të njohura për këndimin (kuakin), që lëshojnë dhe për tufat që krijojnë.
Kwa nyota angalia hapa Chura (nyota)
Vyura ni wanyama wa ngeli Amphibia wanaoanza maisha yao ndani ya maji na baada ya kupita metamofosi wanaendelea kuishi kwenye nchi kavu, isipokuwa vyura-kucha ambao huishi majini maisha yao yote.
Maisha ya chura yanaanza kama yai lililotegwa kwenye maji pamoja na mayai maelfu. Anatoka kwa umbo la ndubwi (pia: kiluwiluwi) ambayo ni funzo ya chura anaendelea na kipindi cha kwanza cha maisha yake katika maji. Anapumua kwa yavuyavu na mwanzoni hana miguu bali mapezi kama samaki na mkia. Viluwiluwi wengi wakiwa kwenye maji wanakula majani au mwani hata kama baadaye kama chura mzima wanakula wanyama wengine.
Baada ya muda kiluwiluwi anakuza miguu minne na mapafu. Utumbo unabadilika na kujiandaa kwa chakula kipya kinachopatikana kwenye nchi kavu. Umbo linazidi kufanana na chura mzima.
Kipindi hiki cha utoto kwenye maji kinadumu kati ya wiki tatu hadi miaka miwili kutegemeana na spishi za chura. Mara nyingi ni kama wiki 10 - 15.
Akitoka kwenye maji chakula chake ni wanyama wengine hasa wadudu. Lakini chura wakubwa wameonekana pia kula mamalia wadogo, samaki na chura wadogo zaidi. Spishi kadhaa wana ulimu wa kunata wanashika wadudu wanaopita haraka lakini wengine wanakamata windo kwa kutumia mikono yao.
Bali na maelezo haya kuna pia spishi kadhaa wanaorudi kuishi katika maji lakini wanapumua kwa mapavu na wachache sana wanaendelea kula majani. Spishi kadhaa wanaendelea kuishi kwenye miti.
Chura wenyewe wanaliwa na ndege, samaki, nyoka na mamalia. Katika nchi kadhaa watu wanakula chura, kwa mfano Ufaransa, China na Ufilipino.
Kuna takriban spishi 5,600 za chura.
Kwa nyota angalia hapa Chura (nyota)
Vyura ni wanyama wa ngeli Amphibia wanaoanza maisha yao ndani ya maji na baada ya kupita metamofosi wanaendelea kuishi kwenye nchi kavu, isipokuwa vyura-kucha ambao huishi majini maisha yao yote.
Chúi-ke ia̍h súi-ke sī lióng-chhe-lūi lāi-té hō chò Anura (Hi-lia̍p-gí bô boé-liu ê ì-sù) ê 1 ê kong. Toā-chiah liáu-aū aū-kha tn̂g-tn̂g, sin-khu té-kó͘, chéng-thaû-á liân-phoê, ba̍k-chiu phok-phok, bô boé-liu. Toā-hūn koè poàⁿ-chúi (semi-aquatic) ê seng-oa̍h, m̄-koh tī lio̍k-tē gaû pê gaû thiàu. Tiāⁿ kā nn̄g seⁿ tiàm chúi-kheⁿ, chúi-tî (pond), ia̍h ô͘ (lake) --nih; iù-thâng (larva) hō chò tō͘-koai (tadpole), ū chhi (gill), tī chúi--nih hoat-io̍k. Toā-chiah liáu sī chia̍h-bah tōng-bu̍t (carnivore), sù-siông chia̍h chat-kha tōng-bu̍t, khoân-chat tōng-bu̍t (annelid), ham pak-kha tōng-bu̍t (Gastropoda). Tī seⁿ-thoàⁿ kùi-chiat (Estrous cycle) ê kiò-siaⁿ put-chí-á hiáng.
A frog is ony member o a diverse and lairgely carnivorous group o short-bodied, tailless amphibians componin the order Anura (Auncient Greek an-, withoot + oura, tail). The auldest fossil "proto-frog" appeared in the early Triassic o Madagascar, but molecular clock dating suggests thair oreegins mey extend forder back tae the Permian, 265 million years agae. Frogs are widely distributit, rangin frae the tropics tae subarctic regions, but the greatest concentration o species diversity is in tropical rainforests. Thare are approximately 4,800 recordit species, accoontin for ower 85% o extant amphibian species. Thay are an aa ane o the five maist diverse vertebrate orders.
The bouk plan o an adult frog is generally chairacterised bi a stout body, protrudin een, cleft tongue, limms foldit unnerneath, an the absence o a tail. Besides leevin in fresh watter an on dry laund, the adults o some species are adaptit for leevin unnergrund or in trees. The skins o frogs are glandular, wi secretions rangin frae distastefu tae toxic. Warty species o frog tend tae be cried taids but the distinction atween frogs an taids is based on informal namin conventions concentratin on the warts raither nor taxonomy or evolutionary history. Frogs' skins vary in colour frae well-camouflaged dappled broun, gray an green tae vieve paiterns o bricht reid or yellae an black tae advertise toxicity an wairn aff predators.
Frogs teepically lay their eggs in watter. The eggs hatch intae aquatic larvae cried tadpoles that hae tails an internal gills. Thay hae heichly specialised raspin mooth pairts suitable for yerbivorous, omnivorous or planktivorous diets. The life cycle is completit whan thay metamorphose intae adults. A few species deposit eggs on laund or bipass the tadpole stage. Adult frogs generally hae a carnivorous diet consistin o smaw invertebrates, but omnivorous species exist an a few feed on fruit. Frogs are extremely efficient at convertin whit thay eat intae bouk mass. Thay are an important fuid soorce for predators an pairt o the fuid wab dynamics o mony o the warld's ecoseestems. The skin is semi-permeable, makkin them susceptible tae dehydration, sae thay aither live in moist places or hae special adaptations tae deal that dry habitats. Frogs produce a wide range o vocalisations, pairteecularly in thair breedin saison, an exhibit mony different kynds o complex behaviours tae attract mates, tae fend aff predators an tae generally survive.
Frogs are vailyied as fuid bi humans an an aa hae mony cultural roles in leeteratur, seembolism an releegion. Frog populations hae declined signeeficantly syne the 1950s. Mair nor ane third o species are conseedert tae be threatened wi extinction an ower ane hunder an twinty are believed tae hae acome extinct syne the 1980s.[1] The nummer o malformations amang frogs is on the rise an an emergin fungal disease, chytridiomycosis, haes spreid aroond the warld. Conservation biologists are wirkin tae unnerstaund the causes o thir problems an tae resolve them.
A frog is ony member o a diverse and lairgely carnivorous group o short-bodied, tailless amphibians componin the order Anura (Auncient Greek an-, withoot + oura, tail). The auldest fossil "proto-frog" appeared in the early Triassic o Madagascar, but molecular clock dating suggests thair oreegins mey extend forder back tae the Permian, 265 million years agae. Frogs are widely distributit, rangin frae the tropics tae subarctic regions, but the greatest concentration o species diversity is in tropical rainforests. Thare are approximately 4,800 recordit species, accoontin for ower 85% o extant amphibian species. Thay are an aa ane o the five maist diverse vertebrate orders.
The bouk plan o an adult frog is generally chairacterised bi a stout body, protrudin een, cleft tongue, limms foldit unnerneath, an the absence o a tail. Besides leevin in fresh watter an on dry laund, the adults o some species are adaptit for leevin unnergrund or in trees. The skins o frogs are glandular, wi secretions rangin frae distastefu tae toxic. Warty species o frog tend tae be cried taids but the distinction atween frogs an taids is based on informal namin conventions concentratin on the warts raither nor taxonomy or evolutionary history. Frogs' skins vary in colour frae well-camouflaged dappled broun, gray an green tae vieve paiterns o bricht reid or yellae an black tae advertise toxicity an wairn aff predators.
Frogs teepically lay their eggs in watter. The eggs hatch intae aquatic larvae cried tadpoles that hae tails an internal gills. Thay hae heichly specialised raspin mooth pairts suitable for yerbivorous, omnivorous or planktivorous diets. The life cycle is completit whan thay metamorphose intae adults. A few species deposit eggs on laund or bipass the tadpole stage. Adult frogs generally hae a carnivorous diet consistin o smaw invertebrates, but omnivorous species exist an a few feed on fruit. Frogs are extremely efficient at convertin whit thay eat intae bouk mass. Thay are an important fuid soorce for predators an pairt o the fuid wab dynamics o mony o the warld's ecoseestems. The skin is semi-permeable, makkin them susceptible tae dehydration, sae thay aither live in moist places or hae special adaptations tae deal that dry habitats. Frogs produce a wide range o vocalisations, pairteecularly in thair breedin saison, an exhibit mony different kynds o complex behaviours tae attract mates, tae fend aff predators an tae generally survive.
Frogs are vailyied as fuid bi humans an an aa hae mony cultural roles in leeteratur, seembolism an releegion. Frog populations hae declined signeeficantly syne the 1950s. Mair nor ane third o species are conseedert tae be threatened wi extinction an ower ane hunder an twinty are believed tae hae acome extinct syne the 1980s. The nummer o malformations amang frogs is on the rise an an emergin fungal disease, chytridiomycosis, haes spreid aroond the warld. Conservation biologists are wirkin tae unnerstaund the causes o thir problems an tae resolve them.
D`Froschlurche san unta de drei Amphibiengrubbm, wos heid no lebm, de wos mid Obstaund de meistn Oartn hod. Bei de deitschn bzw. boarischn Triviäunauman gibts a gwisse Untascheidung, de wos owa nix oda nuar a weng mid da wissoftlichn Eideulung z tuan hod. So haaßt ma z. B. vo de Oartn wos bei uns aa dahaam san, olle aus de Famülien Bufonidae und Pelobatidae "Krodn" oda "Brozn", de aus da Goddung Bombina "Unkn" oda "Urakei" und in gaunzn Rest (Ranidae, Hylidae) afoch "Fresch".
D Froschlurche lossn si zweng eahnare Bsundaheit im Kärpabau und in da Entwicklung recht afoch vo de aundan heitign Lurche untascheidn. Aa Bsundaheid is, das nua de Quappal, sprich de Loavn, an Schwaaf haum, dea wos noch da Metamorphosn zruckbüdt wiad. De Quappal stön im Lauf vo eanahra Entwicklung aa eahnare Eanährung um, vo vegetarisch oda Ollesfressa auf Raubtier. Is nächste warat, das d Hintahaxn vo de Froschlurche ois Springhaxn ausbüdt san. A ähnliche Ausbüdung hods bei ausgstuawane Vawaundte vo de heitign Froschlurche gemb, und zwoar de ausgstuawanan Gottungan Triadobatrachus und Czatkobatrachus. Viecha aus de zwaa Gottungan haum owar aa no Restln vo an Schwaaf ghobt.
De meistn Froschluach brauchn fia d Fuatpflaunzung a Gewässa, wo s eahnan Laich olegn. Foiweiß gibt s owar aa Oartn, ba wöchanen se de Loavn direkt im Laich, dea wo s aum Laund oglegt is, entwicken. D Mandln haum oft Schoiblosn, mid dena das in da Poorungszeid ruafn kenna. Da Laich söwa wiad iwa de Kloakn vom Weiwal entweda ois Haufn, Schnialn odar anzln oglegt, und zwoa ins Wossa, foiweis owar aa auf Bladdln, de wos iwas Wossa glaunga oda direkt aufn Woidbodn. Se wean dabei vom Mandl, des wos si im Amplexus aufs Wewal klammat, vo außn hea befruchtet. Noch a poa Tog hod si ausn Embryo a Quappal entwicket. Zeascht san de Kieman außahoib, spoda wochst a Hautfoitn driwa. Nochdem das meahrare Wochn oda Monat afoche Loavn woan, de wos vo Waossakreidl, hiniche Viecha oda sunstign organischn Zeigs glebt haum, wochst eahna a Paarl Hintahaxn. De Vuadhaxn kumman eat spoda aussa. Noch a poa Wochn oda Monat im Wossa kummts zua Metamorphosn, des haaßt, is Viechal stöt si um auf s Laundlebm. S Vadauaungssystem, d Neavn und a aundare innare Organe wean innahoib vo ana kuazn zeid komplett umgwaundlt. Die Kieman büdn se zruck, de Otmung rennt jetzn iwar a afoch baude Lungan und iwa d Haut. De eißare Fuam, wos vuahea eha in richtung Fisch gaunga is, rennd jetn in Richtung Frosch oda Krod. Gaunz am End vo dera Umwaundlung wiad s Schwafal resrobiert. Onhängig vo da Oart dauats a bis a poa Joah, dass des Viechal soweit is, dass sa si söwa fuatpflaunzn kau.
D Froschlurch (Anura; au: Salientia) sin di mit Abstand arteryychscht vu dr drei rezänte Ornige us dr Wirbeltierklasse vu dr Amphibie. Zue dr Froschlurch zelle unter anderem Chrotte un Unke, di maischte Dier wäre aber – ohni nechere verwandtschaftlige Zämmehang – „Fresche“ gnännt. Di andere Ornige vu dr Amphibie sin d Schwanzlurch (Caudata, Urodela) un d Schlychelurch oder Blindwiele (Gymnophiona).
Im Gegesatz zue dr Schwanzlurch wyyse d Froschlurch nume in dr Larvephas im Wasser e Schwanz uf. Mit dr Metamorphos zum Landdier wird dää zruckbildet. Je no Uusbregig vu dr Hinterbai, wu dytli lenger sin wie di vordere Extremitäten, laufe Froschlurch oder hopse oder gumpe. E Dail chenne seli guet chläätere, anderi grabe sich im Bode yy oder läbe ständig im Wasser. Dr Chnocheböu isch wie bi allne Amphibie dailwyyse reduziert. Si hän zem Byschpel, bis uf wenigi Arte vu dr Unterornig Archaeobatrachia, kaini Rippe. Dr Achlsegirtel vu dr Froschlurch isch im Gegesatz zue dr Schwanzlurch verchnecheret un mit eme Schlisselbai uusgstattet. D Huftregion isch bsundersch stabil böue un wyst wyt hinte positionierti Glidmaßeaasätz uf fir di enorm Hebel- un Schubwirkig bim Gumpe. D Hut chlaa glatt syy oder wäärzig. Si isch durstzet vu Schlyymdriise, wu d Oberflechi fycht halte un e Hutotmig megli mache. Vil Arte hän au Lyybdriise, wu ne giftig Schutz- un Wehrsekret produziere. Pigmäntzälle sin verantwortlig fir e vilfeltigi Färbig un Zaichnig. Metamorphosierti Dier frääse uusschließlig Flaisch, in dr Regle lääbigi Insäkte, Gliederdier, Waichdier un Spinnobele. Di grescht Art isch mit ere Chopf-Rumpf-Lengi vu belaite 33 un vermuetete 35 bis 40 Zäntimeter dr sälte weschtafrikanisch Goliathfrosch (Conraua goliath). Mehreri „miniaturisierti“ Arte wäre uusgwachse dergege chuum e Zäntimeter groß, wi di brasilianisch Sattelchrott Brachycephalus didactylus, s kubanisch Monte-Iberia-Freschli (Eleutherodactylus iberia), dr madagassisch Ängmuulfrosch Stumpffia pygmaea oder dr Seychellefrosch Sechellophryne gardineri, wu au zue dr wältwyt chlaischte Landwirbeldier iberhaupt zelle.
D Uusdruck Frosch un Chrott sin vu dr Systematik här nit aidytig gegenenander abgränzt. Unter eme „Frosch“ wird zmaischt e relativ schlanke, agile Froschlurch mit ere ender glatte, fychte Hut un chreftige Gumpbai verstande (Byschpel: d Gattig Rana = Ächti Fresche). Dergege giltet e „Chrott“ allgmain as moppliger böue mit ere ender druckene, wäärzige Hut un verglychwys churze Hinterbai, wu nume zum Gimpele oder zum Laufe uf allne Vier diene (Byschpel: d Gattig Bufo = Ächti Chrotte). Bi dr Döserte vu Arte wältwyt verschwimme die Abgränzigsmerkmol aber vilmol un lewen sich in dr Taxonomi vu dr Amphibie nit bstetige.
Di maischte Froschlurch sueche zue dr Vermehrig e Gwässer uf, go dert Laich ablege. S git aber au Arte mit ere diräkte Larvenentwicklig innerhalb vu dr an Land abglaite Aier. D Männli hän vilmol Schallblotere, wu si Baarigsruef dermit chenne mache. Dr Laich wird iber d Kloake vum Wyybli in Form vu Bolle, Schnier oder as Ainzelaier ins Wasser – mänkmol au uf Bletter iber em Waaser oder uf em Waldbode abgee un dodeerby vum Männli, wu s Wyybli umchlammeret (Amplexus), vu uuse bsomt. Noch e baar Däg het sich us em Embryo ne Rosschepfli entwicklet.
Zerscht lige d Chieme no usse, speter wäre si vun ere Hutfalte deckt. D Rosschepfli frässe Bflanze, organisch Material, Chlaidier un doti Dier, bi e Dail Baumstyygerfresche au artaigene, nit befruchete Laich. Noch e baar Wuche Larvalentwicklig erschynt bim Dier zerscht e hinter Baibaar. D Vorderbai wäre erscht e baar Däg speter sichtbar. Noch e baar Monet im Wasser chunnt di aigetli Metamorphos zum Landdier, doderby bilde sich d Chieme zruck. Schnuufe duet s Dier jetz iber e aifach böuti Lunge un d Hut. Verdaiigs- un Närvesyschtem un au anderi Organ wäre in churzer Zyt vellig umbildet. Au di usser Form goht vun ere ender fischartige Gstalt in d Forme vun eme Frosch oder ere Chrott iber. Am Änd vu dr Umwandlig wird dr Ruederschwanz nodno resorbiert. Je no Art goht s unterschidlig lang, zmaischt ai bis drei Johr, bis s Dier gschlächtszyitig isch.
Froschlurch chemme uf allne Kontinänt, mit Uusnahm vu Antarktika, un vile Insle vu dr chalt-gmäßigte bis in d tropische Zone vor. Di biogeografisch Region vu dr Holarktis isch verglychswyse artenarm. Schwärpinkt vu dr Artevilfalt lige vor allem in dr Subtrope un Trope vu dr neiwältlige Neotropis (Mittel- un Sidamerika) un dr altwältlige Paläotropis (Sidoschtasie, subsaharischs Afrika).
Zurzyt wäre je no Ibersicht 40 bis 47 rezänti Familie mit rund 5800 Arte unterschide – d Artezahl änderet sich ständig, vor allem wäge neie Chänntnis us dr phylogenetische Forschig zue dr Syschtematik un au wäge ständige Neientdeckige, vor allem vu tropische Fresche, wu bishär nit bekannt gsii sin. Di formeryychschte Familie sin d Laubfresche (Hylidae) mit rund 870 Arte un di Ächte Fresche (Ranidae) mit rund 850 Arte.
(Sortierig innerhalb vum glyche Rang alphabetisch noch em wisseschaftlige Name)
Dr stammesgschichtlig Ursprung vu dr Froschlurch un dr andere modärne Amphibie (Lissamphibia) isch nonig mit Sicherhait gchlert. Zmaischt wird aagnuu, ass er sin dr Gruppe vu dr Temnospondyli z suechen isch[1]. Gerobatrachus, e unterpermische Temnospondyle us dr Familie vu dr Amphibamidae zaigt e Mischig vu Frosch- un Schwanzlurchmerkmol („Mosaikform“) un chennt dr gmainsame Vorfahre vu Frosch- un Schwanzlurch noch stoh[2]. Czatkobatrachus[3] us dr Untertrias vu Pole un Triadobatrachus vu Madagaskar[4] zaige scho dytligi Froschmerkmol Baidi wäre zue dr Salientia zellt, ere Iberornig vu dr Amphibie, wu di modärne Froschlurch un urspringligi fossili Forme ghere. E Dail vu dr rezente Froschfamilie chenne mit Fossilfund bis in dr Jura un d Chryyde zruckverfolgt wäre[5].
D Froschlurch (Anura; au: Salientia) sin di mit Abstand arteryychscht vu dr drei rezänte Ornige us dr Wirbeltierklasse vu dr Amphibie. Zue dr Froschlurch zelle unter anderem Chrotte un Unke, di maischte Dier wäre aber – ohni nechere verwandtschaftlige Zämmehang – „Fresche“ gnännt. Di andere Ornige vu dr Amphibie sin d Schwanzlurch (Caudata, Urodela) un d Schlychelurch oder Blindwiele (Gymnophiona).
D`Froschlurche san unta de drei Amphibiengrubbm, wos heid no lebm, de wos mid Obstaund de meistn Oartn hod. Bei de deitschn bzw. boarischn Triviäunauman gibts a gwisse Untascheidung, de wos owa nix oda nuar a weng mid da wissoftlichn Eideulung z tuan hod. So haaßt ma z. B. vo de Oartn wos bei uns aa dahaam san, olle aus de Famülien Bufonidae und Pelobatidae "Krodn" oda "Brozn", de aus da Goddung Bombina "Unkn" oda "Urakei" und in gaunzn Rest (Ranidae, Hylidae) afoch "Fresch".
Poden an hobelfasker ((sö.)Poren, lat.Anura of uk Salientia) san en kategorii faan diarten an hiar tu a amfiibien. At jaft amanbi 5500 slacher.
Poden an hobelfasker ((sö.)Poren, lat.Anura of uk Salientia) san en kategorii faan diarten an hiar tu a amfiibien. At jaft amanbi 5500 slacher.
K'ayra, K'aylankuli, Lachak icha Wartaq (ordo Anura) nisqakunaqa huk allpa yaku kawsaq uywakunam. Palamakunatam huk kurukunatam mikhunku. Yakupi kawsaq llullunkunataqa huq'ullu ninchikmi.
K'ayra, K'aylankuli, Lachak icha Wartaq (ordo Anura) nisqakunaqa huk allpa yaku kawsaq uywakunam. Palamakunatam huk kurukunatam mikhunku. Yakupi kawsaq llullunkunataqa huq'ullu ninchikmi.
Een kikvors of kikker (Latien: Anura) is een amfibisch beest uut de orde van de kikvorsachtigen, die in verschillende landen en weelddelen veurkomt.
Een kikvors leeft op 't land, bieveurbeeld in 't gres en sommige soorten in bomen, maar meestentieds in zoet water. In zout water kunnen ze niet overleven.
Een kikvors komt op de weeld as een donderpad (of donderkop) die uut één van de eitjes komt die 't vrouwtjen leit. De eitjes neumen we kikkerdril. Donderpadden hen vinnen en kieuwen. As ze groter worren raken ze der start en kieuwen kwiet en daor kommen vier lange benen veur in de plek. Een volgreuide kikvors kan een heel eind springen mit disse benen.
Ze hen een lange tong die ze gebruken um insecten te vangen. De kikvors maakt een ampart geluud, dat kwaken heet. Sommige soorten bin giftig, 't gif van sommige soorten is zelfs zo giftig da-j der an dood kunnen gaon.
In landen as Frankriek, China en midwesten van Amerika eten ze kikkerbilletjes.
Een kikvors of kikker (Latien: Anura) is een amfibisch beest uut de orde van de kikvorsachtigen, die in verschillende landen en weelddelen veurkomt.
Een kikvors leeft op 't land, bieveurbeeld in 't gres en sommige soorten in bomen, maar meestentieds in zoet water. In zout water kunnen ze niet overleven.
Kodhok (basa Inggris: frog) lan bangkong (b. Inggris: toad) (anaké ingaran percil) iku kéwan amfibi kang paling ditepungi wong ing Indonésia.[1]Amphi kang artiné rangkep loro lan Bios artiné urip utawa kéwan kang duwé balung mburi (vèrtebrata) bisa uripé ana ing loro alam, saéngga kodhok uga bisa ngalamimetamorfosis ya iku semangsa urip ing banyu nggunakaké kepet/ingsan.[1] Ambegan nganggo ingsan uga langi karo kepet buntuté.[1] Ing mangsa diwasa kodhok bisa ambegan karo paru-paru lan mlaku nganggo sikil ana ing lemah.[1] Kulawarga kéwan iki kagolong kodhok kang ora duwé buntut (anura) lang bangsa (apoda) uga kagolong amfibi kang duwé buntut lan sikil ya iku kabèh kalebu ing suku salamander (caudata/urodela).[1] Bocah-bocah lumrahé seneng karo kodhok amarga wanguné lucu, kerep mlumpat-mlumpat, ora tau nyokot lan ora mbebayani.[1] Mung wong diwasa kang kerep rumangsa jijik utawa wedi kang ora ana alasané marang kodhok.[1]
Awaké kodhok cendhèk, lemu utawa kuru, gegeré rada wungkuk, sikilé papat lan ora ana buntuté (anura: a ora, ura buntut).[1] Kodhok lumrahé duwé kulit alus, lembab, kanthi sikil mburi kang dawa.[1] Suwaliké bangkong kulité kasar mawa bintil-bintil nganti mbingkul-mbingkul, asring garing, lan sikil mburiné asring mung cendhak waé, saéngga akèh-akèhé kurang pinter mlumpat adoh.[1]
Présidhèn Perkumpulan Kebun Binatang se-Asia Tenggara (SEAZA) Drs Jansen Manansang M.Sc nerangaké yèn kurang luwuh 10 èwu nganti 600 èwu spésies kodhok cures.[2] Kaanan iki mrelokaké rékomendasi kanggo anané upaya konsérvasi amphibia ing Indonésia.[2]
Indonésia duwé spesiés kodhok kang paling akèh ing Asia lan nomer loro sadonya sawisé Brasil.[2] Nanging spésies kodhok ing Indonésia uga akèh kang cures.[2]
Ana spésies kodhok kang wis angél tinemu, kaya ta kodhok sawah kang urip ing sawah.[2] Kodhok sawah akèh kang mati amarga akèh pari kang disemprot péstisida saéngga kodhok padha keracunan lan ora gelem urip ing sawah.[2]
Saliayané iku éfék pemanasan global kang marakaké inféksi jamur clyrid uga ing méh kabéh tlatah ing donya uga ndadékaké satwa mligi amphibia dadi cures.[2]
Panalitén Global Amphibian Assessment nerangaké yèn saka 5.918 spésies amphibi, 35 spésies dipestéké cures, 1.896 spésies ing kondisi kang kritis lan 2604 spésies méh cures.[2]
Ing Panama tinemu spésies kodhok anyar.[3] Ana rong spésies anyar kang tinemu.[3] Kodhok kang sikilé ngglembung iki duwé jeneng ilmiah Pristimantis educatoris.[3] Para paneliti kang ketuané herpetologis saka University of Maryland, Amérikah Sarékat Karen Lips nemu spésies anyar iki ing El Cope, ya iku sawijining laladan ing njeroné Taman Nasional Omar Torrijos, Panama.[3] Kodhok iki ukura awaké cilik banget.[3] Dawane mung 0,8 nganti 1,6 inci utawa 2 nganti 4 centiméter.[3] Werna matané gabungan antarané warna abang lan kuning rada oranyé.[3]
Ana manèh spésies anyar kang tinemu ing Cerro Piña, Provinsi Darien, Panama, ya iku tapal wates Kolombia.[3] Kodhok spésies anyar iki duwé jeneng ilmiah Pristimantis adnus.[3] Padha kaya kodhok kang tinemu sepisanan mau, kodhok iki uga duwé ukuran awak kang cilik, dawané 0,8 inci utawa rong centimeter.[3] Kulité awerna ijo kanthi motif garis-garis klawu.[3]
Saliyané iku ana uga spésies-spésies anyar kang tinemu nalika ékspédisi kang dipanggedhèni déning herpetologis saka Konservasi Internasional lan Ahli Ornitologi saka Ecotropico Foundation ing pagunungan Kolombia laladan Tacarcuna Darien, ing tapal wates Panama.[3] Spésies anyar iki kurang luwih ana 10 spesiés, kalebu kodhok kang kulité ana eriné lan ana telu variétas kodhok kang kulité transparan kang tinemu ing kawasan pagunungan ing Kolumbia.[3]
Ing wektu kurang luwih 3 minggu, para ilmuwan ngidéntifikasi kira-kira 60 spésies amfibi, 20 réptil lan 120 spésies manuk kang jarang tinemu.[3]
Saka 60 amfibi kang wis tinemu, ana spésies anyar kang bisa kagolongaké dadi telung kelas ya iku Nymphargus, Cochranella, lan Centrolene.[3] Kodhok beracun saka famili Dendrobatidae (gènus Colostethus, Ranitomeya, lan Anomaloglossus)ya iku kodhok saka jinis Atelopus kang cacahé siji, lan kodhok saka spésies kodhok hujan saka gènus Pristimantis lan siji salamander jinis Bolitoglossa.[4]
Para panaliti nemu yèn ana spésies kodhok kang awaké bisa murup.[5] Spesies iki trakhir tinemu ing India kurang luwih seabad kapungkur.[5] Saka kaanan iki bisa disimpulaké yèn kéwan iki bisa urip sajeroning krisis global kang njalari akèh kéwan amfibi kang mati.[6] Robin Moore, ahli ngenani kéwan amfibi ing Conservation International, nerangaké yèn kéwan iki ulet lan bisa tahan karo lelara kang mbebayani.[5] Panyebabé bisa amarga daya tahan génetiké utawa spésies kang bisa murup iki pancén duwé baktéri kang bisa nglawan lelara.[5]
Ing India, katemokaké limang spésies kang duwé keragaman hayati Ghats Barat.[5] Tuladhané spésies Chalazodes Bubble-nest frog, kang bisa murup.[5] Kamangka spésies iki terakhir katemokaké ing taun padha 1874.[5] SD Biju saka University of Delhi nerangaké yèn kodhok iki urip ing sangisoré alang-alang nalika wayah awan.[5]
Sapérangan jinis kodhok kang umum antarané:
Kodhok alas:
Ing ngisor iki sapérangan jinis kodhok kang statusé kritis lan kaancam ing Indonésia.
Kodhok (basa Inggris: frog) lan bangkong (b. Inggris: toad) (anaké ingaran percil) iku kéwan amfibi kang paling ditepungi wong ing Indonésia.Amphi kang artiné rangkep loro lan Bios artiné urip utawa kéwan kang duwé balung mburi (vèrtebrata) bisa uripé ana ing loro alam, saéngga kodhok uga bisa ngalamimetamorfosis ya iku semangsa urip ing banyu nggunakaké kepet/ingsan. Ambegan nganggo ingsan uga langi karo kepet buntuté. Ing mangsa diwasa kodhok bisa ambegan karo paru-paru lan mlaku nganggo sikil ana ing lemah. Kulawarga kéwan iki kagolong kodhok kang ora duwé buntut (anura) lang bangsa (apoda) uga kagolong amfibi kang duwé buntut lan sikil ya iku kabèh kalebu ing suku salamander (caudata/urodela). Bocah-bocah lumrahé seneng karo kodhok amarga wanguné lucu, kerep mlumpat-mlumpat, ora tau nyokot lan ora mbebayani. Mung wong diwasa kang kerep rumangsa jijik utawa wedi kang ora ana alasané marang kodhok.
Awaké kodhok cendhèk, lemu utawa kuru, gegeré rada wungkuk, sikilé papat lan ora ana buntuté (anura: a ora, ura buntut). Kodhok lumrahé duwé kulit alus, lembab, kanthi sikil mburi kang dawa. Suwaliké bangkong kulité kasar mawa bintil-bintil nganti mbingkul-mbingkul, asring garing, lan sikil mburiné asring mung cendhak waé, saéngga akèh-akèhé kurang pinter mlumpat adoh.
Krapo se yon bèt.
Kwakkers en króddele (padde), Kwakvörs (wetensjappeleke naom Anura "startloze"; vreuger ouch Salientia "springers") zien 'n umvaankrieke (mie es 5000 soorte, oongeveer 88% vaan alle bekinde soorte amfibieë) orde vaan amfibieë. Vaan de salamanders en wörmsalamanders oondersjeie volwasse kwakvörs ziech door (inderdaad) 't oontbreke vaan 'ne start, lang achterpu, e relatief kort lief, vingere mètein verboonde door zwumvlieze en beter aonpassing aon 't leve op 't land.
In 't daogeleks spraakgebruuk maak me versjèl tösse kwakkers (glad, springer en väöl in 't water te vinde) en króddele/padde (rouw, louper en es volwasse bies veural op 't land). In de taxonomie is dit versjèl neet vaan groet belang. Toch weure dees naome veur twie families oet de orde Anura gebruuk: Bufonidae zien "echte króddele", Ranidae "echte kwakkers". Bij soorte oet ander families bepaolt 't uterlek of d'n triviaole naom kwakker of króddel/pad luit.
Amfibieë oet de familie Anura koume euver haos de ganse wereld veur, ze oontbreke allein op Antarctica en in aander extreem kaw strieke, in echte weustenije (aongezeen ze aon water geboonde zien; in steppes of haafweustenije kinne ze evels wel veurkoume!) en op versjèllende geïsoleerd ligkende oceaaneilen. De groetste diversiteit vint me in d'n tropischen oerbos.
Väöl kwakkers völle specifieke niches op en zien daorum kwesbaar veur veranderinge in hun milieu. Daodoor loupe allewijl oongeveer e daarde vaan de haos 5800 soorte gevaor um oet te sterve; vaan 120 soorte weurt allewijl gedach tot ze al zien verdwene. Aander soorte, wie de Agapad, zien evels beter oetgerös op versjèllende umstandeghede en kinne losgelaote boete hun eigelek leefgebeed groete plaoge vörme.
Amfibieë zien d'r al sinds 't Devoon-tiedperk, minstes 360 miljoen jaor trök. De ieste amfibieë die in 't Devoon, Carboon en Perm leefde, leke uterlek op salamanders en minder op kwakvörs. In 't Perm versjeen de Gerobatrachus, e fossiel bies mèt kinmerke vaan zoewel kwakkers es salamanders. Dit kin 'ne gemeine veurawwer vaan de twie amfibie-ordes zien, meh ouch de primitiefste vertegewoordeger vaan de Anura; 't fossiel is nog pas kort bekind, dus dees kwestie steit nog te bezien. D'n iersten echte kwakker dee de wetensjap bekind is, is Triadobatrachus, wie de naom al zeet e fossiel oet 't Trias. Zoewel Gerobatrachus es Triadobatrachus höbbe 'ne primitieve liefsbouw dee veural langer, minder gedroonge is es dee vaan modern kwakkersoorte. Tijens de Jura begóste ze talrieker en diverser te weure. Ze höbbe ziech noets tot megafauna of in 'n ecosysteem dominante diere oontwikkeld, meh door hunnen kleinen umvaank kóste ze de Kriet-Tertairsterfde good euverleve.
Väöl kwakkersoorte höbbe zwumvleze tösse de tiene, welzeker gemeind um te zwumme. 't Groetste zien de zwumvleze vaan d'n Afrikaansen dwergkwakker, dee zie gans leve in 't water zit en daoveur zwumvleze heet die tot de tientöp doorloupe. Boumkwakkers höbbe grove op de tiene, die oppervlakvergroetend wèrke en daodoor adhesie aon 't boumoppervlak tot stand bringe.
De belaankriekste eigesjap vaan de pu bij väöl kwakkersoorte is 't springvermoge. Kwakkers (padde neet) kinne euver 't algemein mierder kiere hun eige liechaamslengde springe, mèt es oetsjeter de gestriepde rakètkwakker, dee wel 50 kier zien eige lengde (5,5 cm) sprink. Euver 't algemein kinne groeter kwakkers vaan dezelfde soort absoluut gezeen hoeger, meh relatief gezeen lieger springe in verglieking mèt hun soortgenoete. Um dit te bereike zien de poetspiere vaan de bieste haos allemaol tot springspiere geëvolueerd. De spiere um te springe vörme neet minder es 17% vaan 't totaol liefsgewiech vaan 'ne kwakker.
't Vel vaan väöl soorte is poreus um zoe zuurstof en water door te laote. 't Naodeil daovaan is evels tot de bieste door de hoed ouch weer väöl water kinne verlere. Soorte die väöl op 't land leve höbbe daoveur e waterdiech liegske op hun lief zitte. Ander kwakkersoorte zien nachbieste gewore um zoe aon et väöl verdamping te oontkoume.
De mieste soorte höbbe sjötkleure boemèt ze in hun natuurlek milieu neet opvalle. Miestal geit 't um greun en broen. Greun kwakkers kinne ziech beveurbeeld in 't watergreun verstoppe en brojn kwakkers in rottende blaojere. Veural 's nachs levende soorte zien miestal good gecamoufleerd. 'n Belaankrieke oetzundering zien de extreem giftege soorte, die fel kleure höbbe um potentieel aonvallers aof te sjrikke (zuug direk heioonder).
Väöl kwakkers en padde zien gifteg. De maot boe-in kin enorm versjèlle. Sommege soorte höbbe gif wat veural klein bieste zal aofsjrikke. 't Vergif vaan aander soorte is ieder irriterend, of hallucinogeen. Väöl bieste die op kwakkers jaoge zien resistent gewore tege groete doses vergif; de soorte boe-op ze 't veurzeen höbbe kinne veur lui doedelek zien. Tot de giftegste soorte hure de pielgifkwakkers oet Midde- en Zuid-Amerika, mèt genoog vergif veur 't doeje vaan tientalle lui. Dees soorte zien bekind gewore door Indianestamme die hun piele mèt 't vergif vaan de bieste insmere.
De asoemholing vaan kwakkers is twieslachteg. Allewel tot de bieste gein kiewe höbbe, kinne ze gemekelek oonder water zuurstof opnumme door hun poreus vel en aojere die kort oonder de hoed zitte. Op land evels aoseme ze mèt loonge, die anatomisch neet wezelek vaan zoogdierloonge versjèlle. Wel oontbreke de boorsspiere die bij zoogdiere de aoseming sterk vergemekeleke. Sommege in 't water levende soorte höbbe de loonge aamper nujeg; dao is ein soort bekind, de Bornese platkopkwakker (Barbourula kalimantanensis), die gaar gein loonge (mie) heet. Sommege soorte, zoewie de Titicaca-reuzekwakker, höbbe e gerimpeld vel um in zuurstoferm water veural mer zoe väöl meugelek gas op te numme en kwiet te rake.
Harte vaan kwakkers höbbe drei kamers, wie alle amfibieë en (gewoene) reptiele, en in tegestèlling tot veugel en zoogdiere, die veer ruimtes in 't hart höbbe. De twie soorte blood (zuurstofriek blood oet de loonge en zuurstoferm blood oet de res vaan 't lief) koume in aparte kamers binne, meh weure oet dezelfde kamer 't lief weer ingepoomp. 't Blood is dus minder zuurstofriek es bij beveurbeeld lui 't geval is; dit kump doortot kwakkers, es kaajdbleujetege bieste die neet zelf hun liefstemperatuur op niveau hawwe, dao ouch minder vaan nujeg höbbe.
Wie alle amfibieë höbbe de kwakvörs 'n twielejege levescyclus. De eikes kloontere gemeinlik same tot wat me kwakkerdrèl neump, of rijge ziech aonein tot 'ne kettel (bij padde). 't Juveniel weurt koeleköpke geneump en is bepaold vèsechteg: 't aosemp mèt kiewe, zwump mèt 'ne start en heet gein pu. Es de bieskes greuje kriege ze kleur en greuje de puutsjes aon. Es start en kiewe aofvalle sprèk me vaan 'ne volwasse kwakker. Dit "volwasse" bies is evels kort nao zien metamorfoos hiel klein, nog kleinder es 't koeleköpke kort veur zien verandering. 't Snel doen greuje vaan loonge en puutsjes is daan ouch 'n energie-intensief perces, wat väöl vaan de larf häör liechaamsvette opeis.
Kwakkers höbbe 'ne paartied, dee boete de trope (boe 't gein echte seizoene gief) gemeinelek in 't vreug veurjaor vèlt, es de bieste oet de winterslaop wakker weure. Väöl soorte priffere kèl watertemperature vaan roond de tien graod. De bieste höbbe de gewoente um te pare in of bij 't water boe ze gebore zien; väöl soorte mote nao de winterslaop daan ouch trèkke. Bij de zoegeneumde paddetrèk verlere bieste in diechbevolkde strieke dèks 't leve oonder d'n oto. Op de paarplaots aongekoume gebruke de mennekes miestal hunnen roop um de vruiwkes te lokke.
De paring gebäört in amplexus: 't mennekes sprink op 't (dèks väöl groeter) vruiwke en hèlt 't good vas, meh dao is gein geslachsgemeinsjap. De bevröchting gebäört dus oetwendeg: 't vruiwke liet de eikes los en 't menneke struit zie zaod dreuver.
De mieste kwakkers numme gein zörg veur de joonge in ach: hun meneer um 'n nui generatie veileg te stèlle is door hoonderde eikes te lègke, die daan neet gaw allemaol zalle weure opgevrete. 'n Minderheid vaan roond de twinteg percent deit dat evels aanders: die soorte lègke mer wieneg eikes en zörge daan tot die neet weure gevrete. Sommege pielgifkwakkers zeuke e besjöt pläötske op boe ze de eikes vochteg hawwe door aof en touw trop te pisse. In Australië leef de builkwakker (Assa darlingtoni), dee zien joonge in 'ne buil aon zie lief mètnump. De woersjijnelek oetgestorve maogbreujers (geslach Rheobatrachus), ouch oet Australië, slikde de koeleköpkes zelfs in um ze in de maog tot volwasse kwakvörs te laote oontwikkele.
Kwakkers zien es regel carnivoor, gemeinelek insectivoor. Zoe neet de koeleköpkes, die in 't water nog plante ete wie alge. Zoegaw es de kwakker ziene volwasse vörm heet, begint 't te jaoge, wie klein 'r ouch is. Proej zien daan miestens luis, miete of vergliekbaar klein diere. Volgreujde exemplaore zalle ieder mögke of vlege pakke. Groeter kwakkersoorte beperke ziech neet tot insekte en ete ouch aander kwakkers, klein knaagdiere, vèskes of zelfs veugel. Op e paar soorte wie de sjieftóngkwakkers nao jaog de kwakker mèt zien tóng, die laank en plekkereg is en snel kin oetsjete, m.a.w. hendeg gesjik veur 't vaange van insekte in de vlöch.
De mieste kwakvörs kinne kwake; sommege kinne dat zoe hel tot hun geluid kilometers wijer nog te hure is. 't Geluid weurt geproduceerd in de larynx ("strottehoof") en versterk in de moondholte. De mieste soorte höbbe evels 'n speciaal kwakblaos, e stök vel in de keel wat extreem wied kin weure opgebloze mèt loch, um zoe es klaankkas te dene. 't Veurnaomste doel vaan de roop is 't lokke vaan partners bij de paring (zuug bove). D'n aard vaan de roop versjèlt vaan soort tot soort en kin in klaankleur, toenhoegde en voluum hendeg oetereinloupe.
Veur e groet deil vaan dit artikel is gebruuk gemaak vaan 't corresponderend artikel op de Ingelse Wikipedia.
Kwakkers en króddele (padde), Kwakvörs (wetensjappeleke naom Anura "startloze"; vreuger ouch Salientia "springers") zien 'n umvaankrieke (mie es 5000 soorte, oongeveer 88% vaan alle bekinde soorte amfibieë) orde vaan amfibieë. Vaan de salamanders en wörmsalamanders oondersjeie volwasse kwakvörs ziech door (inderdaad) 't oontbreke vaan 'ne start, lang achterpu, e relatief kort lief, vingere mètein verboonde door zwumvlieze en beter aonpassing aon 't leve op 't land.
In 't daogeleks spraakgebruuk maak me versjèl tösse kwakkers (glad, springer en väöl in 't water te vinde) en króddele/padde (rouw, louper en es volwasse bies veural op 't land). In de taxonomie is dit versjèl neet vaan groet belang. Toch weure dees naome veur twie families oet de orde Anura gebruuk: Bufonidae zien "echte króddele", Ranidae "echte kwakkers". Bij soorte oet ander families bepaolt 't uterlek of d'n triviaole naom kwakker of króddel/pad luit.
Lo sosòrdre dels Neobatrachia es lo mai ric, e recampa 24 familhas d'anoras "modèrnas", demest eles, los mai comuns. Los Neobatrachia son subdevesits en dos gropes: los Hyloidea e los Ranoidea. Aquesta classificacion, relativament discutida, se basa principalament sus de caractèrs morfologics coma lo nombre de vertèbras o la morfologia larvala.
De Neobatrachia zyn een ounderorde van de Anura, d' orde van de puutn en paddn. Van de drie ounderordes zyn ze 't mêest g'avanceerd en g'evolueerd, vandoar de noame die letterlik wil zeggn "nieuwe puutn". 't Is ook veruut de grotste ounderorde van de drie, mè mêer of 5000 verschillige sôortn. D' andere twêe ounderordes zyn de Archaeobatrachia (primitieve puutn) en de Mesobatrachia (middnpuutn).
Lo sosòrdre dels Neobatrachia es lo mai ric, e recampa 24 familhas d'anoras "modèrnas", demest eles, los mai comuns. Los Neobatrachia son subdevesits en dos gropes: los Hyloidea e los Ranoidea. Aquesta classificacion, relativament discutida, se basa principalament sus de caractèrs morfologics coma lo nombre de vertèbras o la morfologia larvala.
Paddur hava verið til í mangar mió. ár og eru allastaðni uttan í kuldalondum. Paddur eru t.d. ikki í Føroyum (innfluttar paddur klára tó at lívdjarga sær), men í grannalondum sunnanfyri eru tær vanligar. Paddur liva bæði í vatni og á landi, til dømis froskar og ormapaddur. Froskar eru vanligastu paddurnar, og teir halda til í oyðimørkum og frumskógum eins væl á fjallalendi. Flestar paddur verpa í vatni. Ynglið minnir um fiskayngul og andar við táknum, men vaksin froskur hevur lungu, so hann fær andað uppi á landi. Froskdýr hava long afturbein, og tey bæði leypa, svimja og klíva í trøum. Nógvir froskar og aðrar paddur við verpa í vatni, men summar paddur verpa í vætu á bløðum ella í vátum holum undir jørð. Froskaeggjaklunkar í vatni klekjast til halapaddur við ongum útlimum. Sum tær vaksa, fáa tær útlimir og búnast til froskar og fara upp á land. Henda broytingin nevnist metamorfosa. Ormapaddur hava ongar útlimir og eru bara í hitalondum. Tær grava sær gongir í jørðini og svimja sum állur.
Ang palaka ay isang uri ng hayop na gumagawa ng tunog na kokak.[1] Isa itong amphibian (nabubuhay sa katihan at sa tubig) na walang buntot at madalas tumalon. Kabilang sa uri nito ang kakapsoy.[1] Ipinagkakaiba ito sa mga karag (mga toad sa Ingles) dahil sa kanilang kaanyuan.
![]() Ang lathalaing ito na tungkol sa Palaka ay isang usbong. Makatutulong ka sa Wikipedia sa nito.
Ang lathalaing ito na tungkol sa Palaka ay isang usbong. Makatutulong ka sa Wikipedia sa nito.
Ang palaka ay isang uri ng hayop na gumagawa ng tunog na kokak. Isa itong amphibian (nabubuhay sa katihan at sa tubig) na walang buntot at madalas tumalon. Kabilang sa uri nito ang kakapsoy. Ipinagkakaiba ito sa mga karag (mga toad sa Ingles) dahil sa kanilang kaanyuan.
Puutn (Anura, wadda "zounder stêrt" betêkent) zyn êen van de drie groepn van d' amfibieën, tope met de salamanders (Caudata) en de wormsalamanders (Gymnophiona). 't Is ook de grotste groep: van omtrent 6400 amfibieënsôortn zyn der mêer dan 5600 puutn. Puutn zyn ook 't mêeste versprêed en kommn up ol de continentn beholve Antarctica vôorn. Ounder de name "puut" wordn ook de paddn genoomn, omdat er biologisch eigentlik moa winnig verschil tussn de twêe is.
Puutn verschilln van d' andere amfibieën dan ze gin stêrt hèn. Z' hèn een ofgeplat lichoam, uutpulend' oogn, een brêe kop en moend, en achterpôotn die goed ontwikkeld zyn. Puutn zyn d' ênigste bêestn die een kwakbloaze gebruukn vô de vrouwtjies an te lokkn. Omdan ze koudbloedig zyn, neemn sommige sôortn puutn een zomerruste (estivoatie) of een wientersloape (hibernoatie), vor under deur een droge of een koude periode t' helpn.
D' ontwikkelienge is uniek ounder de gewerveldn, omdan ze een metamorfose oundergoan woarda de larvn (dunderkoptjies) der hêeltegansten anders uut zien dan volwassen puutn.
Puutn eetn over 't olgemêen klêne bêestjies gelik insektn en ander oungewerveldn. Veel sôorten worden direct of indirect bedrêegd deur de mens, en in de latste tientallen joarn is 't aantal puutn deftig ofgenoomn.
Van olle amfibieën hèn de puutn de grotste versprêedienge: d' ênigste gebiedn woadan ze nie vôrenkommn zyn de zandwoestynn van de Sahara en Arabië, de toendras teegn de Nôordpool en de gletsjers van Groenland en Antarctica. Verder wordn puutn ook nie up oceoanische eilandn gevoundn, omdat under vel deurloatboar is en omdan ze nie teegn zout woater kunn'n.
In Vloandern kwaamn der 11 puutn en paddn vôorn, woavan dat der êen (de gilvebuukvierpadde) uutgestorvn is, en twêe nie in West-Vloandern te viendn zyn. De mêeste sôortn zyn in een zekere zin bedrêegd. Van zels de redelik olgemêen vôorkommende sôortn zyn de latsten tyd veel in aantal verminderd.
De brulpuut die van Amerika komt, wordt nu ook in België gevoundn, moar hèt em nog nie in West-Vloandern gevestigd.
Puutn kunn'n under goed anpassn an verschillende habitats, moa de mêeste sôortn hèn zoet woater nôdig, en gin êen puut kan in de zêe overleevn. Deur under ofhankelikheid van woater (up zyn minst vôr under vôort te plantn, angezien dan under eiers en larvn woater nôdig hèn) wordn 't grôtendêel van de puutn in een vochtige omgevienge gevoundn, gelik moerassn, bussn, heide, en plekkn woadan der vyvers zyn.
Deur under deurloatboar vel zyn puutn vrêe gevoelig vô pollutie, en der wordt vermoed dat da êen van de redens vô den achteruutgang van puutn en andere amfibieën zou kunn'n zyn.
D' êeste amfibieën kwaamn ol in 't Loat Devoon vôren. Doamee vergeleekn zyn de puutn nieuwkommers, met den oudst bekende puutachtige bêestn, Triadobatrachus massinoti uut het Ounderste Trias van Madagaskar (omtrent 230 Ma). Vô den oudstn echte puut moetn me wachtn toet an de Juraperiode, mè Vieraella herbsti (omtrent 200 Ma).
Puutn en paddn wierdn vroeger as twêe aparte groepn binnen de Anura gezien. Sôortn met een gladdig vel, die teegn 't woater leefdign en die goed kostn spriengn wierdn puutn genoemd. Sôortn met een grof vel, die mêer up 't land leefdign en slicht kostn spriengn wierdn paddn genoemd.
Tegenwôordig is 't bekend dat een grof of een gladdig vel, korte of lange achterpôotn, en of dan ze in 't woater of up 't land leefdign in 't gehêel nietn te doen hèt met d' echte verwantschappn in de verschillende puutnfamilies. Binn'n de zelste familie wordn de twêe sôortn dikwils neffens mankoar gevoundn, wadda betêkent da convergente evolutie vormn ontwikkeld hèt die up mankoar trekkn binst dan ze nie an mankoar verwant zyn.
De familie Bufonidae (die in 't vlams as "paddn" wordn angeduud) kreeg een nauwere definitie: ollêne de sôorten die een ontwikkeld orgoan van Bidder hèn wordn toet de echte paddn gerekend. 't Orgoan van Bidder is een voortplantiengsorgoan da by puutn degenereert, en ollêne by paddn echt ontwikkelt. Deur dat orgoan kunn'n de vintjes eiers maakn, zodoanig dan de vintjes under as vrouwtjies kunn'n gedraagn. Een ander verschil is dan de Bufonidae gin tandn hèn, in tegenstellienge met d' andere families. Omdat de geweune name nie veranderd hèt betêkent da nu dan padachtige puutn gelik de gilvebuukvierpadde en de knoflookpadde nog olsan paddn genoemd wordn hoewel dan ze da nie echt zyn.
Puutn zyn vrê gevoelig vô vervulienge omdat undern ontwikkelienge en metamorfose ofhangt van hormoonn, en vervulienge kan de werkienge van de hormoonn nadêlig beinvloedn. Met te veel meststoffn kan under habitat deur algn of ander ounkruud overwoekerd wordn, of ot den pH van 't woater te lêge wordt kunn'n d' eiers of de larvn under nie deftig ontwikkeln.
De grotste bedrêegienge is een infectie met de schimmel Batrachochytrium dendrobatidis, die de beruchte ziekte chytridiomycose verôorzakt. Deur 't toedoen van de mens hèt dien schimmel hem round de hêle weireld vesprêed.
Deur 't drogeleggn van gebieden voa de landbouw of irrigatie wordt 't habitat te droge woadeure dan puutn verdwynn. Nie ollêne droogt het uppervlaktewoater (wadda nôdig is voa de vôortplantienge) up, moa de vegetoatie die schauwe geeft verdwynt ook.
In een aantal streekn is den invoer van exotische sôortn d' ôorzake voa 't achteruutgoan van de platselike sôortn. An den andere kant is den handel in exotische bêestn soms ook d' ôorzake voa 't ofneemn van de platselike bevolkienge. En verder wordn puutn ook gevangn voa de restaurangs wodan putebilletjes as een delicatesse wordn upgediend.
Puutn (Anura, wadda "zounder stêrt" betêkent) zyn êen van de drie groepn van d' amfibieën, tope met de salamanders (Caudata) en de wormsalamanders (Gymnophiona). 't Is ook de grotste groep: van omtrent 6400 amfibieënsôortn zyn der mêer dan 5600 puutn. Puutn zyn ook 't mêeste versprêed en kommn up ol de continentn beholve Antarctica vôorn. Ounder de name "puut" wordn ook de paddn genoomn, omdat er biologisch eigentlik moa winnig verschil tussn de twêe is.
Puutn verschilln van d' andere amfibieën dan ze gin stêrt hèn. Z' hèn een ofgeplat lichoam, uutpulend' oogn, een brêe kop en moend, en achterpôotn die goed ontwikkeld zyn. Puutn zyn d' ênigste bêestn die een kwakbloaze gebruukn vô de vrouwtjies an te lokkn. Omdan ze koudbloedig zyn, neemn sommige sôortn puutn een zomerruste (estivoatie) of een wientersloape (hibernoatie), vor under deur een droge of een koude periode t' helpn.
D' ontwikkelienge is uniek ounder de gewerveldn, omdan ze een metamorfose oundergoan woarda de larvn (dunderkoptjies) der hêeltegansten anders uut zien dan volwassen puutn.
Puutn eetn over 't olgemêen klêne bêestjies gelik insektn en ander oungewerveldn. Veel sôorten worden direct of indirect bedrêegd deur de mens, en in de latste tientallen joarn is 't aantal puutn deftig ofgenoomn.
Qurbaqa, dumsiz suvda va quruqlikda yashovchilar oilasi. Uzunligi 2—25 sm. Koʻpchilik qurbaqalarning tishlari qisman yoki butunlay reduksiyaga uchragan. Tanasi keng , oyoqlari baqalarga nisbatan kalta. 21 urugʻi 300 dan ortiq turi bor. Antarktidadan tashqari barcha qitʼalarda tarqalgan. Ular orasida tropik Afrikada tarqalgan tirik tugʻuvchi qurbaqalar eng sodda tuzilgan. Koʻpchilik (200 ga yaqin) turlari asl Qurbaqalar uru-gʻiga kiradi. Asl qurbaqalarning koʻz qorachigʻi vertikal joylashgan; orqa oyogʻi barmoqlarida suzgich pardalar qoldigʻi bor; koʻzidan keyinroqda yirik qulo-qoldi, tanasining orqa tomoni boʻylab mayda zahar bezlari joylashgan. Yevrosiyoning oʻrmon va dasht mintaqasida uzunligi 20 sm keladigan oddiy, yaʼni kulrang Qurbaqalar, choʻl, dasht, oʻrmon va togʻlarida (4,800 m gacha balandlikda) koʻk Qurbaqalar keng tarqalgan. Oʻzbekiston faunasida faqat koʻk qurbaqalar (uzunligi 14 sm gacha) uchraydi.
Aksariyat qurbaqalar — quruqlik hayvonlari, baqalarga nisbatan kuchsiz sakraydi va yomon suzadi; sekin qadamlab harakat qiladi. Oqshomlari faol hayot kechiradi. Turli xil hasharotlar va boshqa umurtqasizlar bilan oziqlanadi. Quruqlikda qishlaydi. Koʻpchiligi suvga, ayrim turlari quruqlikka 1200 dan 7000 gacha tuxum qoʻyadi. Qurbaqalar bogʻ va poliz ekinlariga ziyon keltiradigan hasharotlarni qirib foyda keltiradi. Janubiy Amerikaning mahalliy aholisi aga qurbaqalari zaharini oʻq-yoylarga surishgan. Qurbaqalarning 6 turi Tabiatni muhofaza qilish xal- qaro ittifoqi Qizil kitobiga kiritilgan.
Media
Qurbaqa, dumsiz suvda va quruqlikda yashovchilar oilasi. Uzunligi 2—25 sm. Koʻpchilik qurbaqalarning tishlari qisman yoki butunlay reduksiyaga uchragan. Tanasi keng , oyoqlari baqalarga nisbatan kalta. 21 urugʻi 300 dan ortiq turi bor. Antarktidadan tashqari barcha qitʼalarda tarqalgan. Ular orasida tropik Afrikada tarqalgan tirik tugʻuvchi qurbaqalar eng sodda tuzilgan. Koʻpchilik (200 ga yaqin) turlari asl Qurbaqalar uru-gʻiga kiradi. Asl qurbaqalarning koʻz qorachigʻi vertikal joylashgan; orqa oyogʻi barmoqlarida suzgich pardalar qoldigʻi bor; koʻzidan keyinroqda yirik qulo-qoldi, tanasining orqa tomoni boʻylab mayda zahar bezlari joylashgan. Yevrosiyoning oʻrmon va dasht mintaqasida uzunligi 20 sm keladigan oddiy, yaʼni kulrang Qurbaqalar, choʻl, dasht, oʻrmon va togʻlarida (4,800 m gacha balandlikda) koʻk Qurbaqalar keng tarqalgan. Oʻzbekiston faunasida faqat koʻk qurbaqalar (uzunligi 14 sm gacha) uchraydi.
Aksariyat qurbaqalar — quruqlik hayvonlari, baqalarga nisbatan kuchsiz sakraydi va yomon suzadi; sekin qadamlab harakat qiladi. Oqshomlari faol hayot kechiradi. Turli xil hasharotlar va boshqa umurtqasizlar bilan oziqlanadi. Quruqlikda qishlaydi. Koʻpchiligi suvga, ayrim turlari quruqlikka 1200 dan 7000 gacha tuxum qoʻyadi. Qurbaqalar bogʻ va poliz ekinlariga ziyon keltiradigan hasharotlarni qirib foyda keltiradi. Janubiy Amerikaning mahalliy aholisi aga qurbaqalari zaharini oʻq-yoylarga surishgan. Qurbaqalarning 6 turi Tabiatni muhofaza qilish xal- qaro ittifoqi Qizil kitobiga kiritilgan.
Ta'n rannag ny daa-veaghee jeh'n oardagh Anura (shen gyn famman ‘sy Ghreagish: an-, gyn + oura, famman).
Ta’n chooid smoo jeh rannagyn yn-enneydagh er coontey lurgaghyn jerree liauyrey, corp giare, cassyn craitnagh as sooillyn deamagh. Cha nel famman ec, dy cadjin. T’ad brey oohyn ayns dubbaghyn, loghanyn ny loghyn; ta ny oohyn gaase dys rannagyn aegey, ta cummal ‘syn ushtey, as grooaneyn oc. Lurg beggan traa, t’ad gaase reesht dys y chummey aasit.
Ta rannagyn ry-gheddyn harrish y teihll, veih ardjyn grianchryssagh dys fo-arctagh.
Ta mysh 4,810 dooieyn ‘syn oardagh Anura ayns 33 kynneeyn.[1] Ta Leptodactylidae (1100 do.), Hylidae (800 do.) as Ranidae (750 do.) ny smoo. Ta mysh 88% jeh dooieyn daa-veaghee nyn rannagyn.
Cha nel fa oaylleeagh son eddyraghey rannag as beayf rere’n aght cadjin. Dy cadjin, ta sleih cur rannag er fir currit da ushtey as crackan rea oc; as beayf er fir ooirragh as crackan fahnaghtagh oc. Rere rang-oardraghey, ta dagh ooilley olteyr jeh’n oardagh Anura ny rannag, agh cha nel agh olteyryn jeh’n chynney Bufonidae nyn meayfyn. Ny smoo cruinn eer, ta rannag çheet er olteyryn jeh’n chynney Ranidae (“feer rannagyn”) ny lomarcan.[2]
Ta tree fo-oardaghyn lheead ec rannagyn: Archaeobatrachia (kiare kynneeyn jeh rannagyn bunneydagh); Mesobatrachia (queig kynneeyn jeh rannagyn t’er nyn aafilley ny smoo); as Neobatrachia, y possan smoo, goaill stiagh 24 kynneeyn jeh rannagyn “jeianagh”. Ta Neobatrachia eddyrscarrit ayns Hyloidea as Ranoidea.[3] Ta’n rang-oardraghey shoh rere troyn jalloo-oaylleeagh myr earroo vertebra, cummey y chryss chleeauagh, as jalloo-oaylleeaght ny rannagyn aegey. Ta bea-oayllee goaill rish y rang-oardraghey shoh son y chooid smoo, ga dy vel resoonaght ayn mychione mooinjerys eddyr kynneeyn er lheh. Foddee dy beagh studeyrys gien-oaylleeagh soilshaghey y chooish.[4]
Ta jalloo-oaylleeaght rannagyn gyn cosoylaght mastey daa-veaghee. Cosoylaghey rish ny possanyn elley, salamanderyn as kaikilee, cha nel famman ec rannagyn aasit, as bare lesh ny lurgaghyn oc lheim na shooyl. Ta crackan rannagyn lhiggey da ocsygien çheet ny hrooid, as er y fa shen nod ad gennalaghey trooid yn crackan oc[5]. Ta’n ocsygien goll er lheie ayns brat ushtey er y chrackan, as goll ny hrooid dys yn ‘uill.
Son y chooid smoo, ta lurgaghyn s’jerree liauyr ec rannagyn as craueyn abaneagh sheeynit. Ta craue ghrommey ghiare oc, as cha nel ny smoo na jeig vertebraghyn seyrey eck. Lurg shen ta craue famman cholheit (gimmijey), as er y fa shoh she baagh gyn famman t’ayn son y chooid smoo.
Ta mooadys rannagyn goll veih 10mm (Brachycephalus didactylus, ‘sy Vrasseel as Eleutherodactylus iberia ‘sy Choobey) dys 300mm (y rannag Gholiath, Conraua goliath, ayns Cameroon).
Ta lheead cummaghyn coshey mastey rannagyn, croghey er dy vel ad cummal ayns biljyn, ayns ushtey ny er yn thalloo.
Ymmodee rannagyn, as adsyn cummal ‘syn ushtey er lheh, ta cassyn craitnagh oc, as rheamyssaght y chraitnys jeu croghey er y traa t’ad ceau ‘syn ushtey. Myr sampleyr, ta cassyn slane chraitnagh ec y rannag veg Affrickagh (Hymenochirus), agh my t’ou jeeaghyn er cassyn y rannag villagh White (Litoria caerulea), ny ghooie biljagh, cha nel agh kerroo craitnagh oc.
Ec rannagyn billagh, ta “doarnyn mair chass” son dy chooney goaill greim er ny biljyn. Cha nee doarnyn sooee t’ayn. T’ad goaill greim liorish feddanaght, as jannoo ymmyd jeh mooarane jeh killaghyn beg oddys greimmey eaghtyryn garroo. Cha nel ad çheet lesh my t’ad ro fliugh[6].
Kuse dy rannagyn ta cummal ard ayns viljyn, ta craitnys mooar oc, eer ny smoo na fir ushtagh. Ta ny craitnys shoh lhiggey dauesyn gooillian eddyr biljyn, ny stiurey traa t’ad lheim eddyr oc[7].
Dy cadjin, cha nel troyn myr shen ec rannagyn ooirragh. Son y chooid smoo ta ny doarnyn mair cass oc ny sloo (my ta’n lheid ayn) as ta beggan craitnys oc. Ta lurgaghyn s’jerree s’troshey ec rannagyn ooirragh na adsyn t’ec fir ushtagh ny biljagh.
Ta nieu vog ec ymmodee rannagyn, son dy imman ergooyl cragheyderyn. Ny nieughyn oc, t’ad goaill stiagh gienneyder-branlaadys, gienneyder co-leaystey, nieu-nearag as thanneyder-cuishlin. Kuse dy chragheyderyn rannagyn, ta aalhiemmaght mooar oc noi ny nieughyn shoh. Foddee kuse dy ny nieughyn shoh cur drogh-eiyrtys er sleih.
Ta kuse dy rannagyn goaill nieughyn ass sniengan as arthropodyn elley dy vel ad gee[8]. Foddee fir elley jannoo nyn nieu hene nagh vel çheet ass y vee oc[9].
Ta kuse dy vun-chummaltee America Yiass sheeley nieu magh ass rannagyn steab nieu, as cur eh er ny steabyn oc son shelgeraght[10], ga dy s’goan ny dooieyn ta nieunagh dy liooar son shen. Ta rannagyn nieunagh cliaghtit rish soilshaghey magh y nieunaght oc liorish daahghyn gial: she raaue-cowrey t’ayn. Ta daa ghooie neunieunagh Americaanagh ec y chooid sloo (Eleutherodactylus gaigei as Lithodytes lineatus) ta jannoo arrish er daahghyn rannagyn steab nieunagh (arrishaght Bates) [11][12].
Er coontey jeh neuchaslid nieu rannagyn, ta anaase mooar orroo ec bea-chemmigee. Ta alkaloyd enmyssit epibatidine ry-gheddyn ayns kuse dy rannagyn steab nieunagh, as she moogheyder guinn eh, ny stroshey na morfeen 200 keayrt. Stoo elley t’er ny sheeley ass crackan rannagyn, foddee dy beagh eh cur aalhiemmaght noi VGYS[13]. Ta oayllee jannoo studeyrys er nieughyn rannagyn son dy yeeaghyn my foddee ad cur dooin stoo lheeys noa [14].
Ta nieu rannagagh ayns taaley crackanagh chuse dy rannagyn, myr sampleyr y rannag awin Colorado as rannag cuirtlagh. Kuse jeu, myr sampleyr bufotenin, ta eiyrtys shicklaagagh oc, as myr shen ta sleih jannoo ymmyd jeu myr druggaghyn-soccar.
Crackan rannagyn, t’eh neuyeenagh da ocsygien as carboan daa-osseed, chammah as ushtey. Ta ymmodee cuishleeyn faggys da eaghtyr y chrackan. Tra ta rannag fo ushtey, ta ocsygien goll er sheeyney hug da’n chorys folley dy jeeragh. Er y thalloo, ta rannagyn aasit jannoo ny scowanyn oc son ennal y hayrn. Ta ny scowanyn oc gollrish adsyn ec deiney, agh cha nel ny muskylyn chleeu gobbraghey ec tayrn ennal, as cha nel asnaghyn ny skairt oc. Son ennal y hayrn, ta rannagyn soo stiagh aer trooid ny tuill stroaney oc, cur er y scoarnagh sheidey seose, as eisht t’ad faastey laare y veeal. Ta shen cur er yn aer goll stiagh ny scowanyn oc. Dy mennick, ta cooylley ayns ny tuill stroaney, as ad dooint tra ta’n rannag goll fo ushtey. Ayns Luanistyn 2007, hooar ad rannag ushtagh ayns boayl fadaneagh ayns Yn Indoneesh. Y rannag Vorneagh kione-rea (Barbourula kalimantanensis), she yn chied rannag gyn scowanyn as fys urree ec oaylleeaght.
Ta cree jeh tree shamyryn ec rannagyn, gollrish y chooilley tetrapod, er lhimmey jeh ushagyn as sheeintee. Ta fuill ocsygienit çheet veih ny stooghyn kirp ennal as goll stiagh ayns unnane shamyr. Ta shamyr elley son fuill jee-ocsygienit dy gholl stiagh ‘sy chree. Eisht, ta cooylley chaslagh stiurey yn fuill da ny cuishleeyn kiart – cuishlin y chree son fuill ocsygienit, as y cuishley scowanagh son fuill ta laccal ocsygien. Ta feme ec rannagyn er y chooylley shoh, son dy yannoo sloo jeh mestey yn daa horçh jeh fuill. Er coontey jeh, foddee rannagyn cummal seose cormid soe ny syrjey, as jannoo ny smoo, na nod ad gyn ee.
Ta’n beeal toshiaght corys lheie y rannag. Ta feeacklyn er y cheeill syrjey, as ymmyd jeant jeu son dy veihll bee roish sluggey eh. S’faase ny feeacklyn shoh, as cha nod rannagyn jannoo ymmyd jeu son feer ghreimmey. Ayns ynnyd jeh shen, ta’n rannag jannoo ymmyd jeh’n çhengey ghleiynagh eck son dy ghlackey cragh. Lurg shen, ta’n bee goll trooid yn bolg, as stiagh ‘sy chollane veg, raad ta’n chooid smoo jeh’n lheie taghyrt. Ta soo y phairaig villish, as buighid jeh’n aane, garraghey dys y chollane veg son dy chur cooney da’n lheie. Ta keck faagail magh ass yn arkyn.
Ta corys nearag aasit dy mie ec rannagyn. T’eh goaill stiagh inçhyn, coyrd drommey, as neayragyn. Ta’n smuir oblongata reaghey tayrn ennal, lheie, as obbyr seyr-obbragh elley. Ta’n kerebellum reaghey ny muskylyn. Cosoylaghey rish deiney, ta kerebellum rannagyn feer veg. Cha nel cleayshyn mooie ec rannagyn; ta ny dollanyn cleayshey anchoodit.
Gollrish daa-veaghee elley, ta kiare keimyn ayns bea rannag: ooh, rannag aeg, caghlaa cummey as rannag aasit. Er y fa dy vel feme er ushtey ec rannagyn, ta ymmyrkey colleeys goaill stiagh yllaghey colleeys, as shen cleayney rannagyn bwoirrin da’n ushtey raad ta ny fir nyn soie. Myr shen ta boayl mie faggys daue son breh oohyn. Ta kuse dy rannagyn goaill kiarail jeh ny h-oohyn oc, ny eer ny rannagyn aasit.
Ta toshiaght vea rannag yn ooh. Son y chooid smoo, ta'n rannag woirrin breh gloagh rannag ayns ushtey – mooarane stoo as thousaneyn jeh oohyn ayn. Er y fa dy vel gaue mooar da ny h-oohyn liorish cragheyderyn, ta saaseyn oc son dy yannoo shickyr dy beagh kuse dy chloan ve er mayrn. T'ad breh ec y traa cheddin, as myr shen cha nod ny cragheyderyn gee dagh ooilley ooh; bee cooid mooar jeu goll er gee, agh s'cosoylagh dy bee kuse jeu er mayrn. Saase elley son scapail gaue loghanyn, shen breh oohyn er duillag erksyn y loghan, as coodagh gleiynagh orroo son dy freayll sthie yn ushtey. Erreish daue guirr, ta ny rannagyn aegey tuittym sheese 'syn ushtey. Kuse dy ghooieyn, ta jargaght cronnaghey craa ec ny h-oohyn, myr sampleyr my ta connspeagh ny ardnieu faggys daue, as foddee ad guirr dy leah son dy scapail goll er ee[15]. Dooieyn elley, myr sampleyr, y rannag chuirtlagh (Bufo marinus), t'ad breh oohyn nieunagh son jannoo sloo jeh cragheyderys. Ga dy vel eh croghey er y dooie as y çhymbyllaght, ta oohyn ushtagh guirr roish shiaghtin, dy cadjin. Dooieyn elley, t'ad ceau y clane cheim laarvagh sthie ny h-oohyn ny sthie ny mayrey.
Ta oohyn çheet dy ve rannagyn aegey. Ta corp oochroo as famman liauyr, rea oc. Unnane dooie, ta rannagyn aegey lieh-ooirragh echey, as ad cummal mastey creggyn fliugh[16], agh ta'n chooid smoo jeu slane ushtagh. Cha nel scowan, farvollee, ny lurgaghyn oc. Ta ushylagh lunganeagh oc, corys linnaghyn lhiattagh, sproghanyn son ennal, as fammanyn son snaue[17].
Cha nel feer ‘eeacklyn ec rannagyn aegey, agh ta straihyn liaurey jeh troggalyn keratinagh (keradontyn) oc. Ta’n chooid smoo jeh rannagyn aegey nyn luss-eederyn, as t’ad gee algey dy mennick. Ta kuse dy ghooieyn feill-eeagh, as adsyn gee shey-chassee, rannagyn aegey sloo, as yeeast. Ta mooarane jeh cragheyderyn ec rannagyn aegey, goaill stiagh yeeast, eairkagyn, deyil thummee, as ushagyn ny h-awin. Ta cannablaght er ny fakin mastey rannagyn aegey jeh kuse dy ghooieyn[18]. Ec kuse dy ghooieyn ta rannagyn aegey nieunagh, myr sampleyr, rannagyn cuirtlagh[18].
Ayns kuse dy ghooie, ta rannagyn aegey tannaghtyn harrish y gheurey as caghlaa cummey y nah vlein – myr sampleyr, y rannag reealt (Alytes obstetricans) ny’n rannag chiebbey-chassagh (Pelobates fuscus).
Ec jerrey y cheim rannag aeg, ta rannagyn caghlaa ny cummaghyn oc. She caghlaa trome t’ayn, goaill stiagh jalloo-oaylleeaght as fyshoaylleeaght. T’ad gaase lurgaghyn as scowanyn, as ta ny collaneyn oc girraghey, tra t’ad garraghey veih ee lossreeyn dys ee shey-chassee. Ta ny sooillyn oc garraghey son dy lhiggey dou fakin dy ghaa-hooillagh. Ta’n caghlaa shoh soilshaghey y caghlaa veih olmys (as feme reayrtys lhean oc) dys cragheyder (as feme tastid duinid oc). Ec jerrey y chaghlaa, ta killaghyn y famman marroo (apoptosis) as t’eh goll er soo stiagh y chorp.
Erreish daue caghlaa cummey, ta kuse dy rannagyn goll magh ass yn ushtey as cummal er y thalloo, as dooieyn elley tannaghtyn ‘syn ushtey. Ta dagh dooie aasit nyn eederyn-foalley, faggys, as ad gee beiyn gyn craue dommey, myr sampleyr arthropodyn, annelaidyn as gastreypodyn. Beggan dooie smoo, t’ad gee beiyn elley, myr sampleyr, yeeastyn, rannagyn sloo, as sheeintee beggey. Ta kuse dy rannagnyn shelg liorish y çhengey gleiynagh oc, as dooieyn elley jannoo ymmyd jeh ny laueyn oc. Beggan beg jeh rannagyn, ta lossreeyn bun-vee daue[19].
Ta ram beiyn elley gee rannagyn, goaill stiagh ushagyn, yeeastyn, ardnieughyn, sheeintee, as sleih.
Ta bea liauyr ec rannagyn, ny keayrtyn; ga nagh vel monney fys ayn mychione y vea feie t’oc, ta recortyssyn ayn er rannagyn fo cappeeys as ad bea dys 40 bleeantyn[20][21]. Cosoylaghey rish eairkagyn as lossagyn, cha nel rannagyn rieau çheet dy ve keintyssagh roish t’ad ec y cheim aasit.
Tra t’ad aasit, ta rannagyn co-chruinnaghey ec loghan ny strooan son geddyn sliught. Ta ymmodee rannagyn goll erash da’n ushtey raad ruggyree ad; er y fa shen ta arraghey bleinoil ayn, as thousaneyn jeh rannagyn goaill rheynn ayndaue.
Ec y voayl geddyn sliught, ta rannagyn firrinagh gyllaghey son dy chleayney ben. Ta’n eam lesh y ghooie hene er lheh, as cha nel eh cleayney mraane jeh dooieyn elley. Ec ymmodee dooie, ta fir cruinlagh – fir nagh vel gyllagh, as ad cur stiagh er mraane ta tayrn er-gerrey da fir ta gyllagh.
Erreish daue çheet ry-cheilley, ta’n jees jannoo amplexus. Ta’n fer drappal y ven as goaill greim urree. Ta torraghey mooie ec rannagyn: ta’n oohyn as sheelyn çheet ry-cheilley çheumooie jeh’n chorp. Ta’n ven feaysley er ny oohyn oc, as y fer cur lheieyn sheel orroo. Lurg shen, ta ny h-oohyn gaase as croo coodagh fendeilagh. Son y chooid smoo, ta ny h-oohyn dorraghey as y coodagh trooid-hoilshagh.
Dy mennick, ta rannagyn tempreilagh geddyn sliught eddyr anmagh ‘sy fouyr as leah ‘syn arree. Ta çhiassid ushtey feayr ec ny traaghyn shoh, as myr shen, ta ny smoo ocsygien lheieit ayn. Chammah’s shen, ta geddyn sliught anmagh ‘sy vlein shickyraghey dy beagh bee kiart ry-gheddyn ec ny rannagyn noa ec y traa kiart.
Ga nagh vel monney fys ayn myechione, t’ad gra dy nod 20% jeh dooieyn daa-veaghee goaill kiarail jeh ny cloan oc. Ta ymmodee saaseyn oc son shen y yannoo[22]. Ta kuse dy rannagyn steab nieunagh breh ny h-oohyn oc er laare y cheyll as cur currey orroo, chammah as freayll ad tash liorish jannoo mooin orroo. Erreish daue guirr, ta’n ayr ny moir (croghey er y dooie) garraghey ad er y drommey echey/eck da bromeliad as ushtey ayn. Lurg shen, nee yn voir cur bee daue, liorish breh oohyn neulhearee ‘syn ushtey. Rannagyn elley, t’ad ymmyrkey lhieu ny h-oohyn (ny rannagyn aegey) er ny lurgaghyn sjerree ny’n drommey oc (myr sampleyr, y rannag reealt, dooieyn Alytes). Ta kuse dy rannagyn eer ymmyrkey lhieu ny cloan oc sthie y chorp oc hene. Y rannag phoagey Austrailagh firrinagh, ta poagaghyn er y lhiattee echey, raad ta ny rannagyn aegey cummal derrey t’ad caghlaa cummey. Y rannag Gharwin (Rhinoderma darwinii) ayns y Çhillee, t’ee cur ny rannagyn aegey stiagh ‘sy poagey coraagh eck. Y rannag volg-ghuirragh Austrailagh (Rheobatrachus), t’ee sluggey ny rannagyn aegey eck, as t’ad gaase sthie y volg eck. Son shen y yannoo, ta’n rannag scuirr taaley geayr ghailley as scuirr gluggal gailley. S’cosoylagh dy vel y rannag shoh anvio nish.
Kuse dy eamyn rannag, t’ad cho tharmaneagh, nod oo ad nyn clashtyn meilley ersooyl[23]. Ta eam er lheh ec dagh dooie. T’ad gyllagh liorish aer y chur trooid ny goolag oc. Dy mennick, ta poagey coraagh oc: far-chrackan fo y scoarnagh, ny er uillin y veill, ta sheeyney magh traa t’ad gyllagh. Dooieyn elley, ta shamyr aavuilley oc son dy vooadaghey yn eam oc. Dooieyn gyn eam tharmaneagh, t’ad cummal faggys da awinyn son y chooid smoo, as y sheean jeu follaghtyn eam erbee.
Son y chooid smoo, ta rannagyn gyllagh son dy chleayney ven. Ta fir gyllagh ny lomarcan ny ayns possan. Mraane ayns kuse dy ghooie, t’ad gyllagh erash [24]. Ta eam seyrey jeant ec rannag firrinagh my ta fer elley geabbey dy ghrappal. Ymmodee dooieyn grianchryssagh, ta eam fliaghey oc as ad gyllagh roish t’eh ceau fliaghey. Ta eam çheeragh ec kuse dy ghooie chammah, son dy imman ergooyl fir elley. Ooilley ny h-eamyn shoh, t’ad goll er jannoo liorish beeal doont.
Ta rannagyn cummal harrish y teihll, faggys, agh cha nel ad cummal ayns yn Antarctagh ny ayns ymmodee ellanyn ny marrey[25][26].
Ta’n chooid smoo jeh rannagyn ry-akin ayns buill grianchryssagh, raad ta ushtey ry-gheddyn dy aashagh. Ta kuse dy rannagyn cummal ayns ardjyn çhirrym, raad nagh vel monney ushtey ry-gheddyn; ta feme oc er troyn er lheh son bea. Ta’n kynney Austrailagh Cyclorana as y kynney Americaanagh Pternohyla goanluckey ad hene fo-halloo, cur cocoon jeen mygeayrt y moo, as cadley fud ny h-earishyn çhirrym. Tra vees eh ceau fliaghey, bee ad çheet magh feddyn loghan shallidagh, as geddyn sliught. Ta aase ny h-oohyn feer tappee cosoylaghey rish rannagyn elley, as er y fa shen bee ad aasit dy liooar roish ta’n ushtey caillt oc. Rannagyn elley, t’ad er gormal rish çhymyllaght feayr. Myr sampleyr, y rannag villagh ayns twoaie Chryss yn Arctagh, t’ee goanluckey ee hene fo-halloo car y gheuree, as cooid mooar jeh’n chorp eck riojey.
Ta shymley mooar jannoo er rannagyn. T’ad credjal dy vel gaue baase er ny smoo na treen jeh ny dooieyn t’ayn, as dy vel ny smoo na 120 dooie er ngeddyn baase neayr’s ny 1980yn. [27] Ta ny dooieyn shoh goaill stiagh y rannag airhey ayns Costa Rica as yn rannag volg-ghuirragh ayns yn Austrail. Ta caill oayllys fa mooar son shen, chammah as sollaghey, caghlaa speyr, cragheyderyn neughooghyssagh, as çhingyssyn noa, goaill stiagh chytridiomycosis. Ta ymmodee bea-oayllee credjal dy vel daa-veaghee nyn nooieyn cowrey mie bentyn rish slaynt y corys-vea, er coontey dy vel ad meanagh ‘syn eggey bee, dy vel crackan neuyeenagh oc, as dy vel bea jeh daa cheim oc (laarvey ‘syn ushtey as rannag aasit er y thalloo)[28]. Rere’n fys t’ayn, ta’n shymley jannoo ny smoo er dooieyn ta croghey er yn ushtey dy trome (ooh as laarvey ushtagh oc). Adsyn ta gaase stiagh ‘syn voir, t’ad tannaghtyn ny share.[29].
Rere studeyryn Canaadagh ayns 2006, ta traaght mooar ny ghaue mooar da rannagyn [30].
Ny keayrtyn, ta eabyn sheelraghey fo cappeeys er jeet lhieu, as shen cur cooney da rannagyn feie[31][32]. Ayns Mee ny Boaldyn 2007, hie eh er soilshaghey magh dy nod oo cur coadey da daa-veaghee noi chytridiomycosis liorish cur daue bacteyryn beaghee er lheh[33].
She Blein y Rannag 2008, son tastey y chur er y chooish freayll t’ec rannagyn [34].
Derrey hooar ad Gerobatrachus hottoni, fossyl rannagagh as troyn lossagagh echey, she Triadobatrachus massinoti va’n proto-rannag shinney as fys er. Va Triadobatrachus massinoti bio ‘syn Eash Triassagh, ayns Madagascar[35]. Va claigin rannaghagh echey, agh ny smoo vertebraghyn chammah, as adsyn ‘sy famman, cha ad row colheit. Ec rannag yeianagh, ta vertebraghyn y famman colheit as ad jannoo yn gimmijey. Cha nel craueyn ny lurgey colheit noadyr, as er y fa shen, s’cosoylagh nagh row Triadobatrachus ny lheimmeyder fondagh. Y feer rannag sleaie, shen Vieraella herbsti, as ee bio ‘syn Eash Jurassagh – mysh 213 millioon bleeantyn er-dy-henney. Cha nel fys ayn agh er unnane sampleyr j’ee; t’ad gra dy row eh mysh 33mm er lhiurid. Va Notobatrachus degiustoi ny rannag y Yurassagh veanagh, mysh 170 millioon bleeantyn er-dy-henney. S’cosoylagh dy row aafilley Anura jeianagh jeant roish jerrey yn Eash Jurassagh. Y caghlaaghyn mooar jeant eck, she girraghey y corp as coayl y famman ad.
Y clane rannag fossylagh t’ayn, she sanyanlichan ee. Va’n rannag shoh bio 125 millioon bleeantyn er-dy-henney [36]. Va troyn rannag yeianagh eck, ga dy row 9 vertebraghyn roie-sacral eck. Cha nel agh 8 ec y rannag yeianagh.[37]
Ta kuse dy ymmydyn jeant jeh rannagyn. Ayns muse dy vuill, t’ad nyn mee; myr sampleyr, ayns y Çheen, y Rank, y Ghreag hwoaie, as buill ayns ny Steatyn Unnaneysit. Ny keayrtyn, ta sleih jannoo ymmyd jeh rannagyn son dy ynsaghey corp-yiarrey.
Ta rannagyn er ve nyn sampleyryn scanshoil fud shennaghys oaylleeaght. Hooar magh Luigi Galvani y kiangley eddyr lectraght as y corys nearag liorish studeyrys er rannagyn. (Xenopus laevis), y rannag inginagh Affrickagh, ren ad ymmyd j’ee son prowal torraghys anmagh ‘sy 20oo eash. Ayns 1952, ren Robert Briggs as Thomas J. King dooblaghey rannag liorish arraghey çheshvean chillag somatagh. Shen y chied keayrt dy row peiagh erbee er nyannoo arraghey çheshveanagh ayns metazoa. [38]
Mastey beiyn gyn bleayst er yn ooh, ta’n mooinjerys eddyr rannagyn as deiney mastey ny s’faggys. Gyn y vleayst shoh, she ny sassey t’eh dy ‘akin ny ta taghyrt. Er y fa shoh, t’ad jannoo ymmyd jeh rannagyn son ronsaghey dooblaghey, as mwane-oaylleeaght. Ga dy vel prowallyn elley ayn, ta bea-oayllee jannoo ymmyd jeh Xenopus myr bioag sampleyr foast, er y fa dy vel eh aashagh troggal ee as dy vel mwane vooar eck. Ayns yn 21oo eash, t’ad çheet dy yannoo ymmyd jeh X. tropicalis, mooinjer sloo jee, er y fa dy nod ee geddyn sliught as ee queig meeaghyn d’eash; shegin da X. laevis ve harrish blein d’eash[39]. Ta X. tropicalis lhiggey daue jannoo studeyrys er ymmodee sheeloghyn ny s’tappee.
Ta rannagyn ry-akin dy mennick ayns far-skeealyn, beeal-arrish as cultoor cadjin. Ta sampleyryn goaill stiagh Y Prinse Rannag, as Kermit the Frog. “Skeeal y Prinse Rannag”, she far-skeeal mychione rannag eh, as erreish da goaill paag, t’eh caghlaa dys prinse braew. “Kermit the Frog”, she karracteyr eh er The Muppet Show as Sesame Street, as eh feer scruppylagh. Ga dy vel eh caarjoil as schleioil, t’eh ry-akin dy mennick as eh jonsey, er coontey ymmyrkey ro-ghaaney ny karracteyryn smoo ymmodee-taishbynagh.
Y sleih Moche ayns y Çhenn Pheroo, v’ad cur ooashley da beiyn, as ta ymmodee rannagyn ry-akin ‘syn elley v’oc[40].
Ta'n rannag ny daa-veaghee jeh'n oardagh Anura (shen gyn famman ‘sy Ghreagish: an-, gyn + oura, famman).
Ta’n chooid smoo jeh rannagyn yn-enneydagh er coontey lurgaghyn jerree liauyrey, corp giare, cassyn craitnagh as sooillyn deamagh. Cha nel famman ec, dy cadjin. T’ad brey oohyn ayns dubbaghyn, loghanyn ny loghyn; ta ny oohyn gaase dys rannagyn aegey, ta cummal ‘syn ushtey, as grooaneyn oc. Lurg beggan traa, t’ad gaase reesht dys y chummey aasit.
Ta rannagyn ry-gheddyn harrish y teihll, veih ardjyn grianchryssagh dys fo-arctagh.
Ene rinne u gurnouye, c' est ene glumiante biesse, sins cawe, ki vike dins les basses.
Ele fwait des oûs tertos aglumyîs eshonne, et ki flotnut so l' toele di l' aiwe. C' est on covint.
Di ces oûs la, gn è va rexhe des maclotes, sins pates, å cminçmint (did la leu no), pu avou deus, pu cwate pates.
Pattavå l' Daegne, gn a bråmint des sôres di rinnes (dipus d' 5000). Ene di zeles ki dmeure eto al Walonreye, c' est l' magnåve rinne. Pus rålmint, on rescontere eto ene rinne côrrece.
Alez s' vey e splitchant motî po des linwincieusès racsegnes so les mots "rinne" , "gurnouye", "maclote" et "covint".
Chăng-kō̤ Mìng-dĕ̤ng-ngṳ̄ Háng-cê gì bēng-buōng. / 參考閩東語漢字其版本。
Uòng-bĭ (黃蜱), cṳ̆-ngṳ̄ giéu chĭng-uă (青蛙), sê siŏh-cṳ̄ng cék-tùi dông-ŭk, ĭ găk sié-gái iā sâ̤ gì dê-huŏng dŭ ô hŭng-buó, cṳ̄ng-lôi iâ iā sâ̤. Ĭ gó sê hŭng-muòng gì tiĕng-dĭk.
Žaba je naziv za kičmenjake koji pripadaju redu bezrepih vodozemaca (latinski: Anura). Bezrepi vodozemci su vrstama najbrojnija grupa vodozemaca. Njihovo kretanje je specijalizovano, u vodi je karakteristično plivanje (odnosno ronjenje) a na kopnu kretanje u skokovima. Kod odraslih jedinki je izražena redukcija repnog regiona i izduživanje zadnjih ekstremiteta. Nastanjuju različita staništa, od vodenih, pa do krošnji drveća.
Najveći broj žaba polaže hiljade jaja u vodi, gdje larve zvane punoglavci završe larveni period i metamorfozu. Hrane se mušicama, komarcima itd. Također postoje otrovne žabe koje su "obojene" živim bojama. Otrov može usmrtiti manjeg grabežljivca ako je pojede, a neke žabe sadrže toliko otrova da čak mogu usmrtiti čovjeka.
Žaba je naziv za kičmenjake koji pripadaju redu bezrepih vodozemaca (latinski: Anura). Bezrepi vodozemci su vrstama najbrojnija grupa vodozemaca. Njihovo kretanje je specijalizovano, u vodi je karakteristično plivanje (odnosno ronjenje) a na kopnu kretanje u skokovima. Kod odraslih jedinki je izražena redukcija repnog regiona i izduživanje zadnjih ekstremiteta. Nastanjuju različita staništa, od vodenih, pa do krošnji drveća.
Najveći broj žaba polaže hiljade jaja u vodi, gdje larve zvane punoglavci završe larveni period i metamorfozu. Hrane se mušicama, komarcima itd. Također postoje otrovne žabe koje su "obojene" živim bojama. Otrov može usmrtiti manjeg grabežljivca ako je pojede, a neke žabe sadrže toliko otrova da čak mogu usmrtiti čovjeka.
Ο βάτραχος είναι ένα από τα γνωστότερα αμφίβια. Μαζί με τους φρύνους αποτελεί την τάξη των άνουρων αμφίβιων. Το γένος των βατράχων ανήκει στην τάξη των ανούρων, που υπάγεται στα αμφίβια. Τα πιο συνηθισμένα είδη βατράχου στην Ελλάδα είναι ο βάτραχος ο πράσινος και ο βάτραχος ο κοινός. Βόρτακος είναι ο βάτραχος στην Κυπριακή διάλεκτο[1]). Επίσης η λέξη βορτακόντυμα αναφέρεται στα πράσινα φύκια του γλυκού νερού.
Το σώμα του βατράχου μπορεί να χωριστεί σε δύο μέρη: στο κεφάλι και τον κορμό. Το κεφάλι έχει σχήμα τριγωνικό και μπροστά υπάρχει το στόμα, που φτάνει μέχρι τ' αυτιά. Τα μάτια του βατράχου, αντίθετα από του ανθρώπου, έχουν αναπτυγμένο το κάτω βλέφαρο. Το χρώμα του σώματος των βατράχων είναι από ανοιχτό μέχρι και σκούρο καστανό και στην κοιλιά κιτρινωπό. Ο βάτραχος όμως, όπως και ο χαμαιλέοντας, μπορεί να αλλάζει χρώμα και να προσαρμόζεται καλύτερα στο περιβάλλον του, και έτσι να αποφεύγει τους εχθρούς του. Το δέρμα του είναι λείο και καλυμμένο με βλέννα.
Το μέγεθος του βατράχου ποικίλει ανάλογα με το είδος του. Το μικρότερο είναι το κουβανικό είδος Sminthillus limbatus, του οποίου τα ενήλικα άτομα δεν ξεπερνούν σε μήκος τα 12 χιλιοστά. Το μεγαλύτερο είδος είναι ο αφρικάνικος βάτραχος Γολιάθ, με μήκος 30 εκατοστά περίπου. Τα παραπάνω μήκη αναφέρονται σε μέτρηση με τα πόδια μαζεμένα στο κυρίως σώμα του βατράχου.
Οι βάτραχοι κοάζουν, όταν είναι σε περίοδο αναπαραγωγής, αλλά και σ' όλες τις εποχές του χρόνου, κυρίως το βράδυ, όταν η ατμόσφαιρα είναι υγρή. Η φωνή του βατράχου λέγεται "κόασμα" ή "κοασμός" το δε ρήμα "κοάζω" επί ανθρώπων: μιμούμαι τη φωνή του βατράχου (κοάξ-κοάξ).
Σπουδαιότεροι εχθροί του βατράχου είναι τα φίδια, οι πελαργοί, οι γερανοί και άλλα πουλιά. Εχθρός του βατράχου είναι και ο άνθρωπος, γιατί σε μερικά μέρη της Ευρώπης (Γαλλία, Ιταλία κ.ά.) τα πόδια του βατράχου θεωρούνται εκλεκτός μεζές.
Οι βάτραχοι συχνά γίνονται πειραματόζωα των εργαστηρίων, γιατί η διατροφή τους είναι εύκολη και επιπλέον το σώμα τους, αν και διαφέρει από το σώμα του ανθρώπου, παρουσιάζει την ίδια βασική κατασκευή και φυσικές λειτουργίες. Έτσι τα συμπεράσματα από τις έρευνες στους βατράχους μπορούν να επεκταθούν και στο ανθρώπινο σώμα.
Η αναπαραγωγή των βατράχων γίνεται κατά τους μήνες Μάρτιο και Απρίλιο. Οι βάτραχοι τρέφονται κυρίως με σκουλήκια και έντομα, που τα πιάνουν με τη βοήθεια της γλώσσας τους που είναι μακριά.
Ο βάτραχος, λόγω της κατάλληλης μορφολογικής προσαρμογής του έχει καταφέρει να εξαπλωθεί στα περισσότερα μέρη της Γης. Στις μέρες μας, υπάρχουν πάνω από 2.000 διαφορετικά είδη βατράχων στον πλανήτη.
Οι βάτραχοι ζουν κοντά ή μέσα στα νερά των ποταμών και των λιμνών. Τα πίσω πόδια του βατράχου είναι μεγαλύτερα και πιο αναπτυγμένα και ανάμεσα στα δάχτυλα έχουν μεμβράνη. Έτσι ο βάτραχος μπορεί να κολυμπάει πολύ καλά, όταν βρίσκεται στο νερό και να μετακινείται με πηδήματα, όταν είναι στην ξηρά.
Ακόμα υπάρχουν είδη βατράχων που ζουν στην ξηρά. Τους βρίσκουμε συνήθως σε χωράφια ή ακόμα σε εκτάσεις με γρασίδι. Η περίοδος αναπαραγωγής τους είναι η ίδια με εκείνων που ζουν σε ποτάμια ή λίμνες (Μάρτης και Απρίλης) και κατατάσσονται στην κατηγορία των άνουρων αμφιβίων
Ο βάτραχος είναι ένα από τα γνωστότερα αμφίβια. Μαζί με τους φρύνους αποτελεί την τάξη των άνουρων αμφίβιων. Το γένος των βατράχων ανήκει στην τάξη των ανούρων, που υπάγεται στα αμφίβια. Τα πιο συνηθισμένα είδη βατράχου στην Ελλάδα είναι ο βάτραχος ο πράσινος και ο βάτραχος ο κοινός. Βόρτακος είναι ο βάτραχος στην Κυπριακή διάλεκτο). Επίσης η λέξη βορτακόντυμα αναφέρεται στα πράσινα φύκια του γλυκού νερού.
Бакалар — куйруксуз амфибиялардын бир ири тобу, буларга кыйла түркүм, түркүмчө, тукум, уруу жана түр кирет: Амур бакасы, Антил бакасы, бананчыл бака (Megolixalus baevis), саз бакасы (Rana terrestris), бодур бака (R. rugosa), өгүз-бака (R. catesbeiana), өкүрчөөк бака, Африканын калакпут бакасы (Hylambates maculatus), калакпут соокпаш бака (Rhacophorus otilophus), калакпут тордомо бака (R. reticulatus), Ява калакпут бакасы (R. reinwardti), жапон калакпут бакасы (R. beurgeri), түктүү бака (Astylosternus robustus), Голиафбака (Rana goliath), дообака, гоферге ынак бака (R. capito), Ыраакы Чыгыш бакасы (R. semiplicata), тегерек тил бака (Discoglossus pictus), шадылуу бака (Arthroleptis stenodactylus), Кавказ бакасы (Rana camerani), Индистан таргыл бакасы (R. tigrina), мукур аяк бака (R. curtipes), кызыл кулак бака (R. erythreaea), кайчытамга бака (Rhacophorus cruciger), чаңыргыч бака (Rana clamitans), темгилдүү бака (R. pipiens), токой бакасы (R. sylvatica), Ява учкур бакасы, Кичи Азия бакасы (R. macrocnemis), Гвинея чаар бакасы (Hemisus marmoratus), Натали бакасы (Phrynobatrachus natalensis), Нил бакасы (Rana mascareniensis), көл бакасы (R. ridibunda), жээкчил бака (R. limnocharis), көлчүк бакасы (R. esculenta), шамдагай бака (R. dalmatina), конгонун беш тушкундуу бакасы (Hyperolius quinquevittatus), ала бака (Rana pretiosa), мүйүздүү бака (Ceratobatrachus quentheri), Сибирь бакасы (Rana cruenta), шибер бакасы (R. temporaria), укмуштуу бака (Pseudis paradoxa), кооз бака (Kaloula pulchra), куйруктуу бака (Ascaphus truei), Цусима бакасы, кара-ала бака (Rana nigromaculata), туулгабаш бака (Calyptocephalus gayi), текөөрдүү бака (Xenopus mulleri), текөөрдүү жылма бака (X. laevis), тилсиз бакалар, бакалардын бир түркүмү, күрөң бакалар (топ), өкүрчөөк бакалар (уруу), калакпут бакалар (тукум) (Rhacophoridae), л. Дискоязычные (Discoglossidae) — тегерек тилдүү бакалар (тукум), жашыл бакалар (топ), келтекбаш бакалар (тукум) (Brachycephalidae), учкур бакалар (уруу) (Phacophorus), жалпак бакалар (уруу) (Eleutherodactylus), накта бакалар (тукум) (Ranidae), мүйүздүү бакалар (уруу) (Ceratobatrachus), торопойбакалар (уруу) (Hemisus), тар ооздуу бакалар (уруу) (Brevicipitidae), тилдүү бакалар, бакалардын бир түркүмү.
Айрым түрү көп өлкөлөрдө тамак катары пайдаланылат. Кыргызстанда 3 түрү кездешет. Лабор. изилдөөлөрдө пайдаланылат.
Бакалар — куйруксуз амфибиялардын бир ири тобу, буларга кыйла түркүм, түркүмчө, тукум, уруу жана түр кирет: Амур бакасы, Антил бакасы, бананчыл бака (Megolixalus baevis), саз бакасы (Rana terrestris), бодур бака (R. rugosa), өгүз-бака (R. catesbeiana), өкүрчөөк бака, Африканын калакпут бакасы (Hylambates maculatus), калакпут соокпаш бака (Rhacophorus otilophus), калакпут тордомо бака (R. reticulatus), Ява калакпут бакасы (R. reinwardti), жапон калакпут бакасы (R. beurgeri), түктүү бака (Astylosternus robustus), Голиафбака (Rana goliath), дообака, гоферге ынак бака (R. capito), Ыраакы Чыгыш бакасы (R. semiplicata), тегерек тил бака (Discoglossus pictus), шадылуу бака (Arthroleptis stenodactylus), Кавказ бакасы (Rana camerani), Индистан таргыл бакасы (R. tigrina), мукур аяк бака (R. curtipes), кызыл кулак бака (R. erythreaea), кайчытамга бака (Rhacophorus cruciger), чаңыргыч бака (Rana clamitans), темгилдүү бака (R. pipiens), токой бакасы (R. sylvatica), Ява учкур бакасы, Кичи Азия бакасы (R. macrocnemis), Гвинея чаар бакасы (Hemisus marmoratus), Натали бакасы (Phrynobatrachus natalensis), Нил бакасы (Rana mascareniensis), көл бакасы (R. ridibunda), жээкчил бака (R. limnocharis), көлчүк бакасы (R. esculenta), шамдагай бака (R. dalmatina), конгонун беш тушкундуу бакасы (Hyperolius quinquevittatus), ала бака (Rana pretiosa), мүйүздүү бака (Ceratobatrachus quentheri), Сибирь бакасы (Rana cruenta), шибер бакасы (R. temporaria), укмуштуу бака (Pseudis paradoxa), кооз бака (Kaloula pulchra), куйруктуу бака (Ascaphus truei), Цусима бакасы, кара-ала бака (Rana nigromaculata), туулгабаш бака (Calyptocephalus gayi), текөөрдүү бака (Xenopus mulleri), текөөрдүү жылма бака (X. laevis), тилсиз бакалар, бакалардын бир түркүмү, күрөң бакалар (топ), өкүрчөөк бакалар (уруу), калакпут бакалар (тукум) (Rhacophoridae), л. Дискоязычные (Discoglossidae) — тегерек тилдүү бакалар (тукум), жашыл бакалар (топ), келтекбаш бакалар (тукум) (Brachycephalidae), учкур бакалар (уруу) (Phacophorus), жалпак бакалар (уруу) (Eleutherodactylus), накта бакалар (тукум) (Ranidae), мүйүздүү бакалар (уруу) (Ceratobatrachus), торопойбакалар (уруу) (Hemisus), тар ооздуу бакалар (уруу) (Brevicipitidae), тилдүү бакалар, бакалардын бир түркүмү.
Айрым түрү көп өлкөлөрдө тамак катары пайдаланылат. Кыргызстанда 3 түрү кездешет. Лабор. изилдөөлөрдө пайдаланылат.
Жаба — водоземец од редот на безопашести водоземци (науч. Anura). Редот безопашести водоземци (Anura) е првпат класифициран од страна на Блазиус Мерем (1761-1824) во 1820 година.
Возрасните жаби се карактеризираат со долги задни нозе, кратко тело и вмрежени прсти, очи што штрчат и недостаток на опашка. Големината им варира од 10 мм (Psyllophryne didactyla од Бразил и Eleutherodactylus iberia од Куба) до 300 мм (Conraua goliath од Камерун). Возрасните жаби имаат месојадна исхрана, најмногу со членконоги, црви и мекотели. Жабите се најзабележливи преку нивните звучни повици, кои можат да се слушнат за време на нивната сезона за парење.
Распространетоста на жабите варира од тропските до субарктичките региони, со најголем број на видови во тропските дождовни шуми. Повеќето жаби живеат во плитки водени површини, но исто така лесно се движат и на земја со скокање или качување. Вообичаено жабите ги несат јајцата во бари, мочуришта или езера, и нивните ларви, наречени полноглавци, имаат жабри и се развиваат во вода.
Со повеќе од 5.000 опишани видови, жабите се меѓу најразновидните групи 'рбетници. Често се прави разлика помеѓу жабите и краставите жаби на основа на нивниот изглед, но оваа разлика нема таксономска издржаност. Единственото семејство на која екслузивно ѝ е дадено името „крастава жаба“ е Bufonidae, но многу видови од другите семејства исто така се нарекуваат „крастави жаби“, а видовите во рамките на видот крастави жаби Atelopus се нарекуваат и „арлекински жаби“.
Отровната стрела - жаба е најотровната жаба во светот, која што е застапена во тропските шуми на Амазонија. Нејзиниот отров е доовлен да усмрти 20.000 глувци или да ја сопре работата на срцето на некој 'рбетник. Самиот отров се наоѓа и се лачи на површината на кожата.
Жабата се јавува како тема во бројни дела од уметноста и популарната култура, како:
Жаба — водоземец од редот на безопашести водоземци (науч. Anura). Редот безопашести водоземци (Anura) е првпат класифициран од страна на Блазиус Мерем (1761-1824) во 1820 година.
Хӳресĕррисем (лат. Anura) — çĕрти-шыврисен чи пысăк ушкăнĕ, хальхи кунта 6000 тĕсе яхăн тата 84 авалхи тĕссем кĕреççĕ. Тăтăшах çак ушкăнăн пайташĕсене шапасем теççĕ, анчах тĕрĕссипе шапасем тесе чăн шапасен (Ranidae) пайташĕсене çех чĕнме палăртнă. Хӳресĕр çĕрти-шыврисен личинкисем — йытпуллисем.
Хӳресĕррисем (лат. Anura) — çĕрти-шыврисен чи пысăк ушкăнĕ, хальхи кунта 6000 тĕсе яхăн тата 84 авалхи тĕссем кĕреççĕ. Тăтăшах çак ушкăнăн пайташĕсене шапасем теççĕ, анчах тĕрĕссипе шапасем тесе чăн шапасен (Ranidae) пайташĕсене çех чĕнме палăртнă. Хӳресĕр çĕрти-шыврисен личинкисем — йытпуллисем.
Қурбоққа - як намуди дубаҳраҳо ки зиндагӣ мекунад дар замин ва дар оби тоза.курбокахо тавалуд мешаванд монанди калакалвезак (ном барои курбокахо) аз тухм. Калакавлезакҳо думи дароз доранд. Вақте ки онҳо калон мешаванд ба ҷои думи дароз пойҳои дароз пайдо мешаванд. Қурбоққаҳои калон метавонанд ҷаханд бо онҳоя пойҳои дарозашон.
Қурбоққа - як намуди дубаҳраҳо ки зиндагӣ мекунад дар замин ва дар оби тоза.курбокахо тавалуд мешаванд монанди калакалвезак (ном барои курбокахо) аз тухм. Калакавлезакҳо думи дароз доранд. Вақте ки онҳо калон мешаванд ба ҷои думи дароз пойҳои дароз пайдо мешаванд. Қурбоққаҳои калон метавонанд ҷаханд бо онҳоя пойҳои дарозашон.
Акс:Frog india.JPG A frogҠойроҡһоҙҙар (лат. Anura) — 6000-гә яҡын төрҙө берләштергән ер-һыу хайуандары[1]; тәлмәрйен, әрмәнде кеүек бөтә ер-һыу хайуандары[2]
Ҡойроҡһоҙҙарҙың боронғо вәкилдәре Урта Юра осорондаға ятҡылыҡтарҙын (≈165 млн йыл элек) билдәле. Тик әлеге һыҙаттағы ҡойроҡһоҙҙар Триас осорондағы ҡаҙып табылған ҡалдыҡтарға хас.
Хәҙерге заманда ҡойроҡһоҙҙар тропиктарҙан субарктик регионға тиклем таралған. Дымла тропик урманда күп төрҙәре тереклек итә. Ҡойроҡһоҙҙар күберәк ҡоро ерҙә йәшәй, ләкин һыу менән беләнешен юғалтмайҙар. Уларҙың тәне ҡыҫҡа һәм тәбәнәк. Баштары киң һәм кәүҙә бенән таташҡан. Муйындары һәм ҡойроҡтары юҡ. Тирелере яланғас һәм дымлы. Баштарында күҙ йомой ярылары булған ике күҙ, ике танау тишеге бар. Һауана үпкәләре һәм тире аша һулайҙар. Һыуҙа өҙөк-өҙөк хәрәкәт итәләр. Аяҡтарында йөҙөй ярылары бар. Алғы аяҡтары ҡыҫҡараҡ, йөҙгән ваҡытта тәнгә табан ҡыҫылалар. Ҡоро ерҙә артҡы аяҡтары менән һикереп-һикереп йөрөйҙәр. Улар тәүлектек теләһә ҡайһы ваҡытында актив.
Ҡойроҡһоҙ амфибиялар үрмәкселәр, ҡырмыҫҡалар, ҡыҫылылар, ер селәүсендәре, ҡоро ер һәм һыу моллюскылары, бөжәктәр менән туҡлана. Аҙыҡты күҙҙәре ярҙамында эҙләп таба. Осо торған бөжәктәрҙе аулайҙар. Табыштарын эләктерергә ваҡ тештәре һәм йәбешкәк телдәре ярҙам итә. Телдәре ауыҙҙың артҡы өлөшөнәалғы яғы менән береккән һәм ауыҙ эсендә ике ҡатлап бөкләнгән.
Ҡойроҡһоҙ ер-һыу хайуандары һыуҙа үрсей. Инә баҡалар — ыуылдырыҡ, ата баҡалар «һөт» сәсә. Ыуылдырыҡтан сыҡҡан сүмешбаш балыҡҡа оҡшаған була һәм зәңгәрһыу-йәшел һыуүҫемдәре, иң ябай төҙөлөшлө хайуандар менән туҡлана. Йылы һыуҙа 50—60 көн уҙгас һәм һалҡын һыуҙа 80-85 көндән һуң сумешбаштар кескенә бакаға әүрелә һәм һалҡын һыуҙы ташлап ҡоро ергә сыға.
Ҡойроҡһоҙҙар (лат. Anura) — 6000-гә яҡын төрҙө берләштергән ер-һыу хайуандары; тәлмәрйен, әрмәнде кеүек бөтә ер-һыу хайуандары
Ҡойроҡһоҙҙарҙың боронғо вәкилдәре Урта Юра осорондаға ятҡылыҡтарҙын (≈165 млн йыл элек) билдәле. Тик әлеге һыҙаттағы ҡойроҡһоҙҙар Триас осорондағы ҡаҙып табылған ҡалдыҡтарға хас.
Хәҙерге заманда ҡойроҡһоҙҙар тропиктарҙан субарктик регионға тиклем таралған. Дымла тропик урманда күп төрҙәре тереклек итә. Ҡойроҡһоҙҙар күберәк ҡоро ерҙә йәшәй, ләкин һыу менән беләнешен юғалтмайҙар. Уларҙың тәне ҡыҫҡа һәм тәбәнәк. Баштары киң һәм кәүҙә бенән таташҡан. Муйындары һәм ҡойроҡтары юҡ. Тирелере яланғас һәм дымлы. Баштарында күҙ йомой ярылары булған ике күҙ, ике танау тишеге бар. Һауана үпкәләре һәм тире аша һулайҙар. Һыуҙа өҙөк-өҙөк хәрәкәт итәләр. Аяҡтарында йөҙөй ярылары бар. Алғы аяҡтары ҡыҫҡараҡ, йөҙгән ваҡытта тәнгә табан ҡыҫылалар. Ҡоро ерҙә артҡы аяҡтары менән һикереп-һикереп йөрөйҙәр. Улар тәүлектек теләһә ҡайһы ваҡытында актив.
Ҡойроҡһоҙ амфибиялар үрмәкселәр, ҡырмыҫҡалар, ҡыҫылылар, ер селәүсендәре, ҡоро ер һәм һыу моллюскылары, бөжәктәр менән туҡлана. Аҙыҡты күҙҙәре ярҙамында эҙләп таба. Осо торған бөжәктәрҙе аулайҙар. Табыштарын эләктерергә ваҡ тештәре һәм йәбешкәк телдәре ярҙам итә. Телдәре ауыҙҙың артҡы өлөшөнәалғы яғы менән береккән һәм ауыҙ эсендә ике ҡатлап бөкләнгән.
Ҡойроҡһоҙ ер-һыу хайуандары һыуҙа үрсей. Инә баҡалар — ыуылдырыҡ, ата баҡалар «һөт» сәсә. Ыуылдырыҡтан сыҡҡан сүмешбаш балыҡҡа оҡшаған була һәм зәңгәрһыу-йәшел һыуүҫемдәре, иң ябай төҙөлөшлө хайуандар менән туҡлана. Йылы һыуҙа 50—60 көн уҙгас һәм һалҡын һыуҙа 80-85 көндән һуң сумешбаштар кескенә бакаға әүрелә һәм һалҡын һыуҙы ташлап ҡоро ергә сыға.
भ्यागुतो पानी र जमीन दुवैमा बस्ने उभयचर प्राणी हो । भ्यागुतो एक मांशाहारी जीव हो । भ्यागुतोको जीवन चक्र अरु प्राणीहरू भन्दा भिन्न छ । भ्यागुतोका बच्चाहरूलाई चेपागाँडा भनिन्छ । चेपागाँडाहरू हेर्दा माछा जस्तै हुन्छन् र पानीमा नै बस्छन् । पछि गएर चेपागाँडाको खुट्टा उम्रिएर पुच्छर ठझर्छ । त्यस पछि भ्यागुतो बन्छ । चेपागाँडा भन्दा पहिले भ्यागुताको फुलहरू एक डोरी जस्तो देखिने जालिले ढाकिएका हुन्छन् । भ्यागुताहरू धेरै प्रजातीका हुन्छन् । भ्यागुताको प्रजाती अनुसार यिनीहरूको बसोवास, रङ्ग, आकार, आवाज, आदीमा भिन्नता पाइन्छ । भ्यागुतोलाई बिशेष गरेर सर्पहरूले खान्छन् ।
भ्यागुतो पानी र जमीन दुवैमा बस्ने उभयचर प्राणी हो । भ्यागुतो एक मांशाहारी जीव हो । भ्यागुतोको जीवन चक्र अरु प्राणीहरू भन्दा भिन्न छ । भ्यागुतोका बच्चाहरूलाई चेपागाँडा भनिन्छ । चेपागाँडाहरू हेर्दा माछा जस्तै हुन्छन् र पानीमा नै बस्छन् । पछि गएर चेपागाँडाको खुट्टा उम्रिएर पुच्छर ठझर्छ । त्यस पछि भ्यागुतो बन्छ । चेपागाँडा भन्दा पहिले भ्यागुताको फुलहरू एक डोरी जस्तो देखिने जालिले ढाकिएका हुन्छन् । भ्यागुताहरू धेरै प्रजातीका हुन्छन् । भ्यागुताको प्रजाती अनुसार यिनीहरूको बसोवास, रङ्ग, आकार, आवाज, आदीमा भिन्नता पाइन्छ । भ्यागुतोलाई बिशेष गरेर सर्पहरूले खान्छन् ।
मेंढक उभयचर वर्ग का जंतु है जो पानी तथा जमीन पर दोनों जगह रह सकता है। यह एक शीतरक्ती प्राणी है अर्थात् इसके शरीर का तापमान वातावरण के ताप के अनुसार घटता या बढ़ता रहता है। शीतकाल में यह ठंडक से बचने के लिए पोखर आदि की निचली सतह की मिट्टी लगभग दो फुट की गहराई तक खोदकर उसी में पड़ा रहता है। यहाँ तक कि कुछ खाता भी नहीं है। इस क्रिया को शीतनिद्रा या शीतसुषुप्तावस्था कहते हैं। इसी तरह की क्रिया गर्मी के दिनों में होती है। ग्रीष्मकाल की इस निष्क्रिय अवस्था को ग्रीष्मसुषुप्तावस्था कहते हैं।
मेंढक के चार पैर होते हैं। पिछले दो पैर अगले पैरों से बड़े होतें हैं। जिसके कारण यह लम्बी उछाल लेता है। अगले पैरों में चार-चार तथा पिछले पैरों में पाँच-पाँच झिल्लीदार उँगलिया होतीं हैं, जो इसे तैरने में सहायता करती हैं। मेंढकों का आकार ९.८ मिलीमीटर (०.४ ईन्च) से लेकर ३० सेण्टीमीटर (१२ ईन्च) तक होता है। नर साधारणतः मादा से आकार में छोटे होते हैं। मेंढकों की त्वचा में विषग्रन्थियाँ होतीं हैं, परन्तु ये शिकारी स्तनपायी, पक्षी तथा साँपों से इनकी सुरक्षा नहीं कर पाती हैं।
भेक या दादुर (टोड) तथा मेंढक में कुछ अंतर है जैसे दादुर अधिकतर जमीन पर रहता है, इसकी त्वचा शुष्क एवं झुर्रीदार होती है जबकि मेंढक की त्वचा कोमल एवं चिकनी होती है। मेंढक का सिर तिकोना जबकि टोड का अर्द्ध-वृत्ताकार होता है। भेक के पिछले पैर की अंगुलियों के बीच झिल्ली भी नहीं मिलती है। परन्तु वैज्ञानिक वर्गीकरण की दृष्टि से दोनों बहुत हद तक समान जंतु हैं तथा उभयचर वर्ग के एनुरा गण के अन्तर्गत आते हैं। मेंढक प्रायः सभी जगहों पर पाए जाते हैं। इसकी ५००० से अधिक प्रजातियों की खोज हो चुकी है। वर्षा वनों में इनकी संख्या सर्वाधिक है। कुछ प्रजातियों की संख्या तेजी से कम हो रही है।
मेंढक उभयचर वर्ग का जंतु है जो पानी तथा जमीन पर दोनों जगह रह सकता है। यह एक शीतरक्ती प्राणी है अर्थात् इसके शरीर का तापमान वातावरण के ताप के अनुसार घटता या बढ़ता रहता है। शीतकाल में यह ठंडक से बचने के लिए पोखर आदि की निचली सतह की मिट्टी लगभग दो फुट की गहराई तक खोदकर उसी में पड़ा रहता है। यहाँ तक कि कुछ खाता भी नहीं है। इस क्रिया को शीतनिद्रा या शीतसुषुप्तावस्था कहते हैं। इसी तरह की क्रिया गर्मी के दिनों में होती है। ग्रीष्मकाल की इस निष्क्रिय अवस्था को ग्रीष्मसुषुप्तावस्था कहते हैं।
मेंढक के चार पैर होते हैं। पिछले दो पैर अगले पैरों से बड़े होतें हैं। जिसके कारण यह लम्बी उछाल लेता है। अगले पैरों में चार-चार तथा पिछले पैरों में पाँच-पाँच झिल्लीदार उँगलिया होतीं हैं, जो इसे तैरने में सहायता करती हैं। मेंढकों का आकार ९.८ मिलीमीटर (०.४ ईन्च) से लेकर ३० सेण्टीमीटर (१२ ईन्च) तक होता है। नर साधारणतः मादा से आकार में छोटे होते हैं। मेंढकों की त्वचा में विषग्रन्थियाँ होतीं हैं, परन्तु ये शिकारी स्तनपायी, पक्षी तथा साँपों से इनकी सुरक्षा नहीं कर पाती हैं।
भेक या दादुर (टोड) तथा मेंढक में कुछ अंतर है जैसे दादुर अधिकतर जमीन पर रहता है, इसकी त्वचा शुष्क एवं झुर्रीदार होती है जबकि मेंढक की त्वचा कोमल एवं चिकनी होती है। मेंढक का सिर तिकोना जबकि टोड का अर्द्ध-वृत्ताकार होता है। भेक के पिछले पैर की अंगुलियों के बीच झिल्ली भी नहीं मिलती है। परन्तु वैज्ञानिक वर्गीकरण की दृष्टि से दोनों बहुत हद तक समान जंतु हैं तथा उभयचर वर्ग के एनुरा गण के अन्तर्गत आते हैं। मेंढक प्रायः सभी जगहों पर पाए जाते हैं। इसकी ५००० से अधिक प्रजातियों की खोज हो चुकी है। वर्षा वनों में इनकी संख्या सर्वाधिक है। कुछ प्रजातियों की संख्या तेजी से कम हो रही है।
ভেকুলী (ইংৰাজী: Frog) হৈছে বিচিত্ৰতাৰে ভৰা এনোৰা (ইংৰাজী: Anura) (প্ৰাচীন গ্ৰীক an-, নথকা, + oura, নেজ) বৰ্গৰ অন্তৰ্গত কিছুমান জীৱ প্ৰজাতি। ইহঁতৰ দেহ চুটি আৰু নেজ নেথাকে। প্ৰাক ট্ৰায়েছিক যুগতে মাডাগাস্কাৰত ইহঁতৰ আটাইতকৈ পুৰণি জীৱাশ্ম "প্ৰট ফ্ৰগ (ইংৰাজী: proto-frog)"ৰ উদ্ভৱ হৈছিল, কিন্তু আনৱিক ক্লক ডেটিং পদ্ধতিয়ে ইহঁত তাতোতকৈও ২৬৫ নিযুত বছৰ আগৰ পাৰ্মিয়ান যুগৰ বুলি কয়। ভেকুলীবোৰ tropicsৰ পৰা subarctic অঞ্চললৈকে বহুলভাৱে বিস্তৃত হৈ আছে। বৰ্ষাৰণ্যবোৰত ইহঁতৰ জনসংখ্যা সৰ্বাধিক। বৰ্তমানে প্ৰায় ৪,৮০০ টা প্ৰজাতিৰ ভেকুলী নথিভুক্ত কৰা হৈছে, যিটো জীৱিত উভচৰ প্ৰাণীৰ প্ৰায় ৮৫%তকৈও বেচি হব। ইয়াৰোপৰি মেৰুদণ্ডী প্ৰাণীৰ পাঁচটা সৰ্বাধিক বৈচিত্ৰময় বৰ্গৰ ভিতৰত ইহঁতো অন্যতম।


ভেকুলী (ইংৰাজী: Frog) হৈছে বিচিত্ৰতাৰে ভৰা এনোৰা (ইংৰাজী: Anura) (প্ৰাচীন গ্ৰীক an-, নথকা, + oura, নেজ) বৰ্গৰ অন্তৰ্গত কিছুমান জীৱ প্ৰজাতি। ইহঁতৰ দেহ চুটি আৰু নেজ নেথাকে। প্ৰাক ট্ৰায়েছিক যুগতে মাডাগাস্কাৰত ইহঁতৰ আটাইতকৈ পুৰণি জীৱাশ্ম "প্ৰট ফ্ৰগ (ইংৰাজী: proto-frog)"ৰ উদ্ভৱ হৈছিল, কিন্তু আনৱিক ক্লক ডেটিং পদ্ধতিয়ে ইহঁত তাতোতকৈও ২৬৫ নিযুত বছৰ আগৰ পাৰ্মিয়ান যুগৰ বুলি কয়। ভেকুলীবোৰ tropicsৰ পৰা subarctic অঞ্চললৈকে বহুলভাৱে বিস্তৃত হৈ আছে। বৰ্ষাৰণ্যবোৰত ইহঁতৰ জনসংখ্যা সৰ্বাধিক। বৰ্তমানে প্ৰায় ৪,৮০০ টা প্ৰজাতিৰ ভেকুলী নথিভুক্ত কৰা হৈছে, যিটো জীৱিত উভচৰ প্ৰাণীৰ প্ৰায় ৮৫%তকৈও বেচি হব। ইয়াৰোপৰি মেৰুদণ্ডী প্ৰাণীৰ পাঁচটা সৰ্বাধিক বৈচিত্ৰময় বৰ্গৰ ভিতৰত ইহঁতো অন্যতম।
 European fire-bellied toad (Bombina bombina)
European fire-bellied toad (Bombina bombina)  Panamanian golden frog (Atelopus zeteki).
Panamanian golden frog (Atelopus zeteki).
ਡੱਡੂ ਇੱਕ ਛੋਟਾ ਜੀਵ ਹੈ ਜੋ ਜਲ ਅਤੇ ਥਲ ਦੋਨਾਂ ਤੇ ਰਹਿ ਸਕਦਾ ਹੈ। ਡੱਡੂਆਂ ਦੀਆਂ 2600 ਤੋਂ ਵੀ ਵੱਧ ਕਿਸਮਾਂ ਹਨ, ਜੋ ਝੀਲਾਂ, ਦਲਦਲ, ਚਟਾਨਾਂ, ਮਾਰੂਥਲਾਂ ਅਤੇ ਦਰੱਖਤਾਂ ਆਦਿ ਉੱਪਰ ਰਹਿੰਦੇ ਹਨ। ਇਹ ਸਾਰੇ ਸੰਸਾਰ ਵਿੱਚ ਫੈਲੇ ਹੋਏ ਹਨ। ਆਮ ਤੌਰ 'ਤੇ ਇਨ੍ਹਾਂ ਦੇ ਸਰੀਰ ਦੀ ਲੰਬਾਈ 9 ਤੋਂ 11 ਸੈਂ: ਮੀ: ਹੁੰਦੀ ਹੈ ਪਰ ਜੋ ਡੱਡੂ ਪੱਛਮੀ ਅਫਰੀਕਾ ਵਿੱਚ ਰਹਿੰਦੇ ਹਨ, ਉਹ 40 ਸੈਂ: ਮੀ: ਤੱਕ ਲੰਬੇ ਹੋ ਸਕਦੇ ਹਨ। ਟਰ-ਟਰ ਦੀ ਆਵਾਜ਼ ਸਿਰਫ ਨਰ ਡੱਡੂ ਹੀ ਕੱਢਦੇ ਹਨ। ਸੁਰੱਖਿਅਤ ਥਾਵਾਂ 'ਤੇ ਇਨ੍ਹਾਂ ਦੀ ਉਮਰ 6 ਸਾਲ ਤੱਕ ਹੁੰਦੀ ਹੈ। ਸ਼ਾਂਤ ਸੁਭਾਅ ਦੇ ਮਾਲਕ ਡੱਡੂ ਆਪਣੇ ਸਰੀਰ ਦੇ ਆਕਾਰ ਤੋਂ 30 ਗੁਣਾ ਜ਼ਿਆਦਾ ਛਾਲ ਮਾਰ ਸਕਦੇ ਹਨ | ਇਨ੍ਹਾਂ ਦੀਆਂ ਕੁਝ ਕਿਸਮਾਂ ਦੌੜ ਵੀ ਸਕਦੀਆਂ ਹਨ।[1]
ਕੁਝ ਡੱਡੂ ਪ੍ਰਜਨਣ ਦੀ ਰੁੱਤ ਵਿੱਚ ਬੁਲਬੁਲਿਆਂ ਦਾ ਆਲ੍ਹਣਾ ਉਸਾਰਦੇ ਹਨ ਜਿਨ੍ਹਾਂ ਵਿੱਚ ਉਹ ਅੰਡੇ ਦੇ ਕੇ ਆਪਣੇ ਵੰਸ਼ ਨੂੰ ਅੱਗੇ ਵਧਾਉਂਦੇ ਹਨ। ਇਸ ਸਮੇਂ ਦੌਰਾਨ ਉਹ ਆਪਣੇ ਮੂੰਹ ਵਿੱਚੋਂ ਹਵਾ ਤੇ ਲੇਸਦਾਰ ਪਦਾਰਥ ਛੱਡਦੀ ਹੈ ਜੋ ਬੁਲਬੁਲਿਆਂ ਦੇ ਝੁੰਡ ਦੇ ਰੂਪ ਵਿੱਚ ਇਕੱਠਾ ਹੋ ਕੇ ਝੱਗ ਬਣ ਜਾਂਦਾ ਹੈ। ਇਹ ਝੱਗ ਤੈਰ ਕੇ ਪਾਣੀ ਵਿਚਲੇ ਪੌਦਿਆਂ ਦੇ ਪੱਤਿਆਂ ਜਾਂ ਟਾਹਣੀਆਂ ਨਾਲ ਚਿਪਕ ਜਾਂਦੀ ਹੈ ਜੋ ਆਲ੍ਹਣੇ ਦਾ ਰੂਪ ਧਾਰਨ ਕਰ ਜਾਂਦੀ। ਇਹ ਜੀਵ ਆਂਡੇ ਦੇਣ ਸਮੇਂ ਇਨ੍ਹਾਂ ਆਲ੍ਹਣਿਆਂ ਦੇ ਹੇਠ ਆ ਜਾਂਦੇ ਹਨ। ਆਂਡਿਆਂ ਵਿੱਚ ਤੇਲ ਹੋਣ ਕਰਕੇ ਆਂਡੇ ਪਾਣੀ ਦੇ ਉੱਪਰ ਆ ਕੇ ਇਸ ਆਲ੍ਹਣੇ ਵਿੱਚ ਪ੍ਰਵੇਸ਼ ਕਰ ਜਾਂਦੇ ਹਨ। ਇਸ ਤਰ੍ਹਾਂ ਹੀ ਬੁਲਬੁਲਿਆਂ ਦੇ ਆਲ੍ਹਣੇ ਉਸਾਰਨ ਵਾਲੀ ਡੱਡੂ ਜਾਤੀ ਵੀ ਆਂਡੇ ਦੇਣ ਦੇ ਨਾਲ-ਨਾਲ ਇੱਕ ਲੇਸਦਾਰ ਪਦਾਰਥ ਵੀ ਛੱਡਦੀ ਹੈ। ਇਸ ਦੌਰਾਨ ਇਹ ਆਪਣੀਆਂ ਲੱਤਾਂ ਨਾਲ ਪਾਣੀ ਨੂੰ ਰਿੜਕੀ ਜਾਂਦੇ ਹਨ। ਇਸ ਨਾਲ ਆਂਡਿਆਂ ਦੁਆਲੇ ਇੱਕ ਝੱਗ ਦੀ ਤਹਿ ਬਣ ਜਾਂਦੀ ਹੈ। ਇਹ ਝੱਗ ਇੱਕ ਗੇਂਦ ਦੇ ਰੂਪ ਵਿੱਚ ਹੁੰਦੀ ਹੈ। ਫਿਰ ਮਾਦਾ ਡੱਡੂ ਇਸ ਗੇਂਦ ਨੁਮਾ ਝੱਗ ਨੂੰ ਦੋ ਟਾਹਣੀਆਂ ਜਾਂ ਪੱਤਿਆਂ ਦੇ ਵਿਚਕਾਰ ਲਿਜਾ ਕੇ ਆਪਣੀਆਂ ਲੱਤਾਂ ਨਾਲ ਦਬਾ ਪਾਉਂਦੀ ਹੈ। ਜਿਸ ਨਾਲ ਇਹ ਬੁਲਬੁਲੇ ਆਲ੍ਹਣੇ ਦਾ ਰੂਪ ਧਾਰਨ ਕਰ ਜਾਂਦੇ ਹਨ। ਇਸ ਤਰ੍ਹਾਂ ਅਜਿਹੇ ਜੀਵ ਆਪਣੇ ਵੰਸ਼ ਨੂੰ ਚਲਾਉਣ ਲਈ ਬੁਲਬੁਲਿਆਂ ਦੇ ਆਲ੍ਹਣਿਆਂ ਦਾ ਸਹਾਰਾ ਲੈਂਦੇ ਹਨ।
ବେଙ୍ଗ ଏକ ଉଭୟଚର ପ୍ରାଣୀ ଅଟେ ଯିଏ ଜଳ ଓ ସ୍ଥଳ ଉଭୟ ସ୍ଥାନରେ ରହିପାରେ । ଏହା ଏକ ଶୀତରକ୍ତୀ ପ୍ରାଣୀ ଅଟେ ଅର୍ଥାତ ଏହାର ଶରୀରର ତାପମାନ ବାତାବରଣ ତାପମାନ ଅନୁଶାରେ ଛାଲିଥାଏ । ଶିତକାଳରେ ଥଣ୍ଡାରୁ ବଞ୍ଚିବା ପାଇଁ ବର୍ଷାପାଣିରେ ଜମିରହିଥିବା କାଦୁଅ ଆଦି ସ୍ଥାନରେ ଦୁଇ ଫୁଟ ଭିତର ପର୍ଯ୍ୟନ୍ତ ଖୋଳି ସେଠାରେ ବାସ କରିଥାଏ, ଏହା ସହିତ କିଛି ଖାଦ୍ୟ ମଧ୍ୟ ଖାଇ ନଥାଏ । ଏହି ପକ୍ରୀୟାକୁ ଶୀତନିଦ୍ରା କିମ୍ବା "ଶୀତସୁଷୁପ୍ତାବସ୍ଥା" କୁହାଯାଏ । ଏହିପ୍ରକାର କ୍ରୀୟା ଗରମ ଦିନେ ମଧ୍ୟ ହୋଇଥାଏ । ଗ୍ରୀଷ୍ମକାଳରେ ଏହି ପକ୍ରୀୟାକୁ ଗ୍ରୀଷ୍ମୀୟ ଅବସ୍ଥା କିମ୍ବା "ଗ୍ରୀଷ୍ମସୁଷୁପ୍ତାବସ୍ଥା" କୁହାଯାଏ ।
ବେଙ୍ଗର ଚାରୋଟି ଗୋଡ ରହିଥାଏ । ପଛ ଦୁଇ ଗୋଡ ଆଗ ଦୁଇ ଗୋଡ ଠାରୁ ବଡ ହୋଇଥାଏ, ସେଥିପାଇଁ ସେ ଅଧିକ ଲମ୍ବା ପର୍ଯ୍ୟନ୍ତ ଡେଇଁପାରେ । ଆଗ ଦୁଇ ପାଦରେ ଚାରି-ଚାରି ଆଙ୍ଗୁଠି ଓ ପଛ ପାଦରେ ପାଞ୍ଚ-ପାଞ୍ଚ ଆଙ୍ଗୁଠି ରହିଥାଏ, ଯାହା ତାକୁ ପହଁରିବାରେ ସାହାଯ୍ୟ କରିଥାଏ । ବେଙ୍ଗର ଆକାର ସାଧାରଣତଃ ୯.୮ ମିଲିମିଟର (୦.୪ ଇଞ୍ଚ)ରୁ ୩୦ ସେଣ୍ଟିମିଟର (୧୨ ଇଞ୍ଚ) ପର୍ଯ୍ୟନ୍ତ ହୋଇଥାଏ । ଅଣ୍ଡିରା ବେଙ୍ଗ ମାଇ ବେଙ୍ଗ ଠାରୁ ଆକାରରେ ଛୋଟ ହୋଇଥାଏ । ବେଙ୍ଗର ତ୍ୱଚାରେ ନିସୃତ ବିଷ ରହିଥାଏ, ପରନ୍ତୁ ସେମାନେ ଶିକାରୀ ସ୍ତନ୍ୟପାୟୀ, ପକ୍ଷୀ ତଥା ସାପ ମାନଙ୍କ ଠାରୁ ଏମାନଙ୍କ ସୁରକ୍ଷା କରି ପାରନ୍ତି ନାହିଁ ।
ଏକ ପ୍ରାପ୍ତ ବାୟସ୍କ ବେଙ୍ଗର ଶରୀରରେ ଏକ କଠୋର ଶରୀର, ବାହାରି ପଡିଥିବା ଆଖି, ଅଗ୍ରବର୍ତ୍ତୀ-ଲାଗିଥିବା ଜିଭ ଆଖି, ତଳ ଆଡକୁ ଓହଳି ଥିବା ଅଙ୍ଗ ଏବଂ ବିନା ଲାଞ୍ଜ ଯୁକ୍ତ ଶରୀର ରହିଥାଏ (ଲାଞ୍ଜ ଯୁକ୍ତ ବେଙ୍ଗକୁ ଛାଡି) । ବେଙ୍ଗ ମଧ୍ୟରେ ଗ୍ରନ୍ଥିର ଚମଡା ରହିଥାଏ, ଯାହା ଅରୁଚୀକର ଠାରୁ ଆରମ୍ଭ ହୋଇ ବିଷାକ୍ତ ହୋଇଥାଏ । ବୟସ୍କ ବେଙ୍ଗ ସତେଜ ପାଣିରେ ଏବଂ ଶୁଖିଲା ସ୍ଥଳରେ ରହିଥାଏ; କିଛି ପ୍ରଜାତୀ ମାନଙ୍କୁ ଭୂମୀଗତ କିମ୍ବା ଗଛରେ ରହିବା ପାଇଁ ଅନୁକୂଳିତ କରାଯାଏ । ବେଙ୍ଗକୁ ମନୁଷ୍ୟଦ୍ୱାରା ଭୋଜନ ଋପେ ମହତ୍ତ୍ୱ ଦିଆଯାଏ ଏବଂ ସାହିତ୍ୟ, ପ୍ରତୀକବାଦ ଓ ଧର୍ମରେ ବହୁ ସାଂସ୍କୃତିକ ଭୂମିକା ରହିଥାଏ ।
ବେଙ୍ଗର କୌଣସି ଲାଞ୍ଜ ନଥାଏ, ଲାର୍ବାକୁ ଛାଡି ଏବଂ ଅଧିକାଂଶ ବେଙ୍ଗଙ୍କର ଲମ୍ବା ଗୋଡ଼ ଥାଏ , ଲମ୍ବା ତୀକ୍ଷଣ ହାଡ଼ ସହିତ, ଜାଲି, ପଞ୍ଝା, ବଡ଼ ଆଖି ଏବଂ ଚିକ୍କଣ ତ୍ୱଚା ରହିଛି । ସେମାନଙ୍କ ପାଖେ ଛୋଟ ଛୋଟ ମେରୁହାଡ଼ ରହିଛି ଯେଉଁଥିରେ 10ରୁ ଅଧିକ ମୁକ୍ତ ମେରୁହାଡ଼ ଓ ଟେଲବୋନ ରହିନାହିଁ ।[୧] ଅନ୍ୟ ଉଭୟଚର ମାନଙ୍କ ପରି, ଅମ୍ଳଜାନ ନିଜର ଅତ୍ୟଧିକ ପାରଗମ୍ୟ ତ୍ୱଚାରୁ ଅତିକ୍ରମ କରିପାରେ । ଏହି ଆକସ୍ମିକ ବିଶେଷତା ସେମାନଙ୍କୁ ନିଜ ତ୍ୱଚା ମାଧ୍ୟମରେ ପବନ ପର୍ଯ୍ୟନ୍ତ ପହଞ୍ଚି ବିନା ସ୍ଥାନରେ ତିଆରି ହୋଇ ରହିବାର ଅନୁମତି ପ୍ରଦାନ କରିଥାଏ ।[୨] ତ୍ୱଚା ପାଇଁ ଶ୍ୱାସ-ପ୍ରଶ୍ୱାସ ଅଙ୍ଗ ରୂପେ ସେବା କରିବା ପାଇଁ ଏହିକୁ ନରମ ରହିବାକୁ ପଡିବ । ଏହା ବେଙ୍ଗକୁ ବିଭିନ୍ନ ପଦାର୍ଥ ପ୍ରତି ସମ୍ବେଦନ ଶୀଳ ବନେଇଥାଏ ଯାହାକୁ ସେ ପର୍ଯ୍ୟବରଣରେ ସାମ୍ନା କରିପାରେ , ଯେଉଁଥିରୁ କିଛି ବିଷାକ୍ତ ହୋଇପାରେ ଏବଂ ପାଣିରେ ବିଘଟିତ ହୋଇ ପାରନ୍ତି ।[୩][୪][୫][୬]
ଅନ୍ୟ ଉଭୟଚର ପ୍ରାଣୀ ମାନଙ୍କ ପରି, ଏକ ବେଙ୍ଗର ଜୀବନ ଚକ୍ର ସାଧାରଣତଃ ଏକ ଅଣ୍ଡା ସହିତ ପାଣିରେ ଆରମ୍ଭ ହୋଇଥାଏ ଯାହା ତରଳ ପଦାର୍ଥ ମାନ ସହିତ ଏକ ଡିମ୍ବକରେ ହୋଇଥାଏ, ଯାହାକୁ ସାଧାରଣତଃ ରେଡ଼ପୋଲ ବୋଲି କୁହାଯାଏ । ଆଗତ ବୃଦ୍ଧି ପରେ ଯାହାଦ୍ୱାରା ଏହାର ଅଙ୍ଗ ଓ ଫୁସଫୁସରେ ବିକଶିତ ହୋଇଥାଏ । ପରେ ଏହା ଏକ ଲଘୁ, ବାୟୁ-ଶ୍ୱାସ ବେଙ୍ଗ ରୂପେ ପାଣି ଛାଡିବାରେ ସକ୍ଷମ ଅଟେ ।
ଦୁଇ ମୁଖ୍ୟପ୍ରକାରର ପ୍ରଜନନ ବେଙ୍ଗ, ଲମ୍ବା ସମୟ ପର୍ଯ୍ୟନ୍ତ ପ୍ରଜନନ ଓ ବିସ୍ଫୋଟକ ପ୍ରଜନନରେ ହୋଇଥାଏ । ପୂର୍ବେ ଅଧିକାଂଶ ପ୍ରଜାତୀ ମାନଙ୍କଦ୍ୱାରା ନିଜର କରାଯାଇଥିଲା, ବୟସ୍କ ବେଙ୍ଗ ବର୍ଷର କିଛି ସମୟରେ ଏକ ପୋଖରୀ କିମ୍ବା ଝରଣାରେ ପ୍ରଜନନ ପାଇଁ ଏକାଠି ହୁଅନ୍ତି । ବିସ୍ଫୋଟକ ପ୍ରଜନନ ରେ, ପରିପକ୍ୱ ବୟସ୍କ ବେଙ୍ଗ ଏକ ନିଶ୍ଚିତ କ୍ଷେତ୍ରରେ ହେଉଥିବା ବର୍ଷା ହେଉଥିବା କିଛି ସ୍ଥାନରେ ପ୍ରଜନନ ପ୍ରକ୍ରିୟା ପାଇଁ ପହଞ୍ଚି ଥାନ୍ତି । ଏହି ବେଙ୍ଗ ମାନଙ୍କ ମଧ୍ୟରେ ସମ୍ଭୋଗ ଯଥାଶୀଘ୍ର ହୋଇଥାଏ ଏବଂ ଏମାନଙ୍କ ବୃଦ୍ଧିର ଗତି ଅତ୍ୟନ୍ତ ଶୀଘ୍ର ହୋଇଥାଏ ।[୭]
|url-status= ignored (help) தவளைகள் நிலநீர் வாழிகள் வகுப்பைச் சேர்ந்த ஒரு வரிசையாகும். இவ்வரிசை அறிவியல் வகைப்பாட்டில் "வாலில்லா" என்று பொருள்படும் அனுரா (Anura) என்றழைக்கப்படுகிறது. முழுவளர்ச்சி அடந்த தவளைகளுக்கு நீண்ட பின்னங்கால்களும், திரண்டு உருண்ட உடலும், விரல்களுக்கு இடையே சதை இணைப்புள்ள கொய்யடி என்னும் பாதங்களும், புறத்தே பிதுங்கி இருக்கும் கண் முழிகளும், கொண்டு வாலில்லா ஓர் இருவாழ்வி விலங்கு. சிறு குட்டைகளிலும், குளங்களிலும் காணப்படுவன. தவளைகளில் ஏறத்தாழ 5000 வெவ்வேறு உள் இனங்கள் உள்ளன. தென் அமெரிக்காவைச் சேர்ந்த சில தவளைகள் மிகுந்த நஞ்சு உடையதாகவும் உள்ளன. சில வகைத் தவளைகள் கூடுகட்டும் திறன் பெற்றுள்ளன. அண்மையில் தென்னிந்தியாவில் கூடு கட்டும் அரியவகைத் தவளை ஒன்று கண்டுபிடிக்கப்பட்டுள்ளது[1].
நீரிலும் நிலத்திலும் வாழும் தன்மை கொண்ட தவளைகளை மழைக்காலத்தின் பாடகர்கள் என்று அழைக்கிறார்கள்.[2]
தவளைகள் நிலநீர் வாழிகள் வகுப்பைச் சேர்ந்த ஒரு வரிசையாகும். இவ்வரிசை அறிவியல் வகைப்பாட்டில் "வாலில்லா" என்று பொருள்படும் அனுரா (Anura) என்றழைக்கப்படுகிறது. முழுவளர்ச்சி அடந்த தவளைகளுக்கு நீண்ட பின்னங்கால்களும், திரண்டு உருண்ட உடலும், விரல்களுக்கு இடையே சதை இணைப்புள்ள கொய்யடி என்னும் பாதங்களும், புறத்தே பிதுங்கி இருக்கும் கண் முழிகளும், கொண்டு வாலில்லா ஓர் இருவாழ்வி விலங்கு. சிறு குட்டைகளிலும், குளங்களிலும் காணப்படுவன. தவளைகளில் ஏறத்தாழ 5000 வெவ்வேறு உள் இனங்கள் உள்ளன. தென் அமெரிக்காவைச் சேர்ந்த சில தவளைகள் மிகுந்த நஞ்சு உடையதாகவும் உள்ளன. சில வகைத் தவளைகள் கூடுகட்டும் திறன் பெற்றுள்ளன. அண்மையில் தென்னிந்தியாவில் கூடு கட்டும் அரியவகைத் தவளை ஒன்று கண்டுபிடிக்கப்பட்டுள்ளது.
நீரிலும் நிலத்திலும் வாழும் தன்மை கொண்ட தவளைகளை மழைக்காலத்தின் பாடகர்கள் என்று அழைக்கிறார்கள்.
కప్ప లేదా మండూకం శాలూకము (ఆంగ్లం: frog) అనూర (గ్రీకు భాషలో "తోక-లేకుండా", an-, లేకుండా oura, తోక), క్రమానికి చెందిన ఉభయచరాలు.
కప్ప లేదా మండూకం శాలూకము (ఆంగ్లం: frog) అనూర (గ్రీకు భాషలో "తోక-లేకుండా", an-, లేకుండా oura, తోక), క్రమానికి చెందిన ఉభయచరాలు.
కప్పల ముఖ్యమైన లక్షణాలు- పొడవైన వెనుక కాళ్ళు, పొట్టి శరీరం, అతుక్కున్న కాలివేళ్ళు, పెద్దవైన కనుగుడ్లు, తోక లేకపోవడం. ఉభయచరాలుగా జీవించే జీవులై నీటిలో సులభంగా ఈదుతూ భూమి మీద గెంతుకుంటూ పోతాయి. ఇవి నీటి కుంటలలో గుడ్లు పెడతాయి. వీటి ఢింబకాలైన తోకకప్పలకు మొప్పలుంటాయి. అభివృద్ధి చెందిన కప్పలు సర్వభక్షకాలు (carnivorous) గా జీవిస్తూ ఆర్థ్రోపోడా, అనెలిడా, మొలస్కా జీవులను తిని జీవిస్తాయి. కప్పలను వాటి యొక్క బెకబెక శబ్దాల మూలంగా సుళువుగా గుర్తించవచ్చును.
కప్పలు ప్రపంచమంతటా ముఖ్యంగా ఉష్ణ, సమశీతోష్ణ మండలాలో ఎక్కువగా విస్తరించాయి. అయితే ఎక్కువ జాతులు అరణ్యాలలో కనిపిస్తాయి. కప్పలలో సుమారు 5,000 జాతులు గుర్తించారు. సకశేరుకాలు (vertebrate) అన్నింటిలోను విస్తృతమైన జీవన విధానం కలిగివుండే జీవులు ఇవి. వీటిలో కొన్ని జాతులు అంతరించిపోతున్నాయి.
కప్ప లేదా మండూకం శాలూకము (ఆంగ్లం: frog) అనూర (గ్రీకు భాషలో "తోక-లేకుండా", an-, లేకుండా oura, తోక), క్రమానికి చెందిన ఉభయచరాలు.
కప్ప లేదా మండూకం శాలూకము (ఆంగ్లం: frog) అనూర (గ్రీకు భాషలో "తోక-లేకుండా", an-, లేకుండా oura, తోక), క్రమానికి చెందిన ఉభయచరాలు.
కప్పల ముఖ్యమైన లక్షణాలు- పొడవైన వెనుక కాళ్ళు, పొట్టి శరీరం, అతుక్కున్న కాలివేళ్ళు, పెద్దవైన కనుగుడ్లు, తోక లేకపోవడం. ఉభయచరాలుగా జీవించే జీవులై నీటిలో సులభంగా ఈదుతూ భూమి మీద గెంతుకుంటూ పోతాయి. ఇవి నీటి కుంటలలో గుడ్లు పెడతాయి. వీటి ఢింబకాలైన తోకకప్పలకు మొప్పలుంటాయి. అభివృద్ధి చెందిన కప్పలు సర్వభక్షకాలు (carnivorous) గా జీవిస్తూ ఆర్థ్రోపోడా, అనెలిడా, మొలస్కా జీవులను తిని జీవిస్తాయి. కప్పలను వాటి యొక్క బెకబెక శబ్దాల మూలంగా సుళువుగా గుర్తించవచ్చును.
కప్పలు ప్రపంచమంతటా ముఖ్యంగా ఉష్ణ, సమశీతోష్ణ మండలాలో ఎక్కువగా విస్తరించాయి. అయితే ఎక్కువ జాతులు అరణ్యాలలో కనిపిస్తాయి. కప్పలలో సుమారు 5,000 జాతులు గుర్తించారు. సకశేరుకాలు (vertebrate) అన్నింటిలోను విస్తృతమైన జీవన విధానం కలిగివుండే జీవులు ఇవి. వీటిలో కొన్ని జాతులు అంతరించిపోతున్నాయి.
ಕಪ್ಪೆ [೧]ಒಂದು ಉಭಯವಾಸಿ ಅನುರ ಗಣಕ್ಕೆ (ಆರ್ಡರ್) ಸೇರಿದ ಬಹುತೇಕ ಮಾಂಸಾಹಾರಿ ಜೀವಿ. ಇದಕ್ಕೆ ಬಾಲವಿರುವುದಿಲ್ಲ. ಕಪ್ಪೆಗಳು ಸಾಮಾನ್ಯವಾಗಿ ನೀರಿನಲ್ಲಿ ಮೊಟ್ಟೆ ಇಡುತ್ತವೆ ಮತ್ತು ಮೊಟ್ಟೆಗಳು ಗೊದಮೊಟ್ಟೆ ಮರಿಗಳಾಗಿ (ಟಾಡ್ಪೋಲ್) ಹೊರಹೊಮ್ಮುತ್ತವೆ. ಈ ಗೊದಮೊಟ್ಟೆ ಮರಿಗಳು ಕಪ್ಪೆಮರಿಗಳಾಗಿ ರೂಪಾಂತರ ಹೊಂದುವುದರೊಂದಿಗೆ ಅವುಗಳ ಜೀವನ ಚಕ್ರ ಪೂರ್ಣವಾಗುತ್ತದೆ. ಕೆಲವೊಂದು ಭೂಮಿಯ ಮೇಲೆ ಮೊಟ್ಟೆಗಳನ್ನಿಡುತ್ತವೆ.
ಕಪ್ಪೆಗಳು ಸಿಹಿನೀರಿನಲ್ಲಿ ಅಲ್ಲದೆ ನೆಲದ ಮೇಲೂ ಬದುಕುತ್ತವೆ. ಕೆಲವು ಕಪ್ಪೆಗಳು ನೆಲದಾಳದಲ್ಲಿ ಮತ್ತು ಮರಗಳಲ್ಲಿ ಬದುಕಲು ಹೊಂದಿಕೊಂಡಿವೆ. ಇವು ಶೀತರಕ್ತದ ಪ್ರಾಣಿಗಳು. ಬಿಸುಪು ಪಡೆಯಲು ಇವು ಸೂರ್ಯನ ಬೆಳಕಿಗೊ ಅಥವಾ ಬಿಸುಪಿನ ಮೇಲ್ಮೈಗೊ ಹೋಗುತ್ತವೆ. ಹೆಚ್ಚು ಬಿಸಿಯಾದಾಗ ಅವು ನೆರಳಿಗೆ ಸರಿಯುತ್ತವೆ ಅಥವಾ ಚರ್ಮದ ಕನಿಷ್ಠ ಪ್ರದೇಶವನ್ನು ಗಾಳಿಗೆ ಒಡ್ಡುವ ಮೂಲಕ ತೇವಾಂಶ ಕಳೆದುಹೋಗುವಿಕೆಯನ್ನು ಕಡಿಮೆ ಮಾಡಲು ಪ್ರಯತ್ನಿಸುತ್ತವೆ.
ಸುಮಾರು ಶೇ 88ರಷ್ಟು ಉಭಯವಾಸಿ ಪ್ರಭೇದಗಳು ಅನುರ ಗಣದಲ್ಲಿ ವರ್ಗೀಕರಿಸಲ್ಪಟ್ಟಿವೆ. ಈ ಗಣದಲ್ಲಿ 33 ಕುಟುಂಬಗಳಿದ್ದು ಸುಮಾರು 4810 ಪ್ರಭೇದಗಳಿವೆ. ಈ ಕುಟುಂಬಗಳಲ್ಲಿ ಲೆಪ್ಟೊಡಕ್ಟಿಲಿಡೆ (1100 ಪ್ರಭೇದಗಳು), ಹೈಲಿಡೆ (800 ಪ್ರಭೇದಗಳು) ಮತ್ತು ರನಿಡೆ (750 ಪ್ರಬೇದಗಳು) ದೊಡ್ಡವು.[೨] ಕಪ್ಪೆಗಳನ್ನು ನೆಲಗಪ್ಪೆ (ಟೋಡ್) ಮತ್ತು ಕಪ್ಪೆ ಎಂದು ವಿಭಜಿಸಲಾಗುತ್ತದೆಯಾದರೂ ಇದಕ್ಕೆ ಜೀವ ವರ್ಗೀಕರಣದಲ್ಲಿ ಮಹತ್ವ ಇಲ್ಲ. ವರ್ಗೀಕಣ ದೃಷ್ಟಿಕೋನದಿಂದ ಅನುರ ಗಣದ ಎಲ್ಲಾ ಸದಸ್ಯರೂ ಕಪ್ಪೆಗಳು ಆದರೆ ಬಫೊನಿಡೆ ಕುಟುಂಬದ ಸದಸ್ಯರು ಮಾತ್ರ "ನಿಜ ನೆಲಗಪ್ಪೆ"ಗಳು. ಈ ಅರ್ಥದಲ್ಲಿ "ಕಪ್ಪೆ" ಎಂದು ಕರೆಯುವುದು ಜಲಚರ ಅಥವಾ ಅರೆ ಜಲಚರ ಪ್ರಭೇದಗಳನ್ನು ಒಳಗೊಂಡಿದ್ದು ಅವುಗಳ ಚರ್ಮವು ನಯವಾಗಿದ್ದು ತೇವಾಂಶ ಭರಿತವಾಗಿರುತ್ತದೆ. ಆದರೆ "ನೆಲಗಪ್ಪೆ"ಗಳು ಭೂವಾಸಿಗಳಾಗಿದ್ದು ಅವುಗಳಿಗೆ ಒಣ ಚರ್ಮವಿದ್ದು ಅದರ ಮೇಲೆ ಗಂಟುಗಳಿರುತ್ತವೆ.[೩][೪]
ಅನುರ ಗಣವನ್ನು ಅರ್ಕಿಯೊಬಟ್ರಾಕಿಯ, ಮೆಸೊಬಟ್ರಾಕಿಯ ಮತ್ತು ನಿಯೊಬಟ್ರಾಕಿಯ ಎಂದು ಮೂರು ಉಪಗಣಗಳಾಗಿ ವಿಂಗಡಿಸಲಾಗಿದೆ. ಆರ್ಕಿಯೊಬಟ್ರಾಕಿಯ ನಾಲ್ಕು ಕುಟುಂಬಗಳಿದ್ದು ಇವು ಪ್ರಾಚೀನ ಕಪ್ಪೆಗಳು. ಮೆಸೊಬಟ್ರಾಕಿಯ ಹೆಚ್ಚು ವಿಕಾಸವಾದ ಮಧ್ಯಂತರ ಕಪ್ಪೆಗಳನ್ನು ಒಳಗೊಂಡಿವೆ ಮತ್ತು ಇದರಲ್ಲಿ ಐದು ಕುಟುಂಬಗಳಿವೆ. ಇಪ್ಪತ್ನಾಲ್ಕು ಕುಂಟುಂಬಗಳಿರುವ ಅತಿದೊಡ್ಡ ಉಪಗಣ ನಿಯೊಬಟ್ರಾಕಿಯ. ಇದರಲ್ಲಿ ಇತ್ತೀಚೆಗೆ ವಿಕಾಸವಾದ ಕಪ್ಪೆಗಳು ಸೇರಿವೆ. ಉಪಗಣ ನಿಯೊಬಟ್ರಾಕಿಯವನ್ನು ಹೈಲಾಯ್ಡಿಯೇ ಮತ್ತು ರನಾಯ್ಡಿಯೇ ಎಂಬ ಎರಡು ಸೂಪರ್ಕುಟುಂಬಗಳಾಗಿ ವಿಭಜಿಸಲಾಗಿದೆ.[೫]
ಅಳಿದ ಮತ್ತು ಬದುಕಿರುವ ಕಪ್ಪೆಗಳ ದೈಹಿಕ ಗುಣಗಳು ಮತ್ತು ಅಣ್ವಿಕ ದತ್ತಾಂಶಗಳ ವಿಶ್ಲೇಷಣೆಯನ್ನು ಒಳಗೊಂಡ ಇತ್ತೀಚಿನ 2011ರ ಅಧ್ಯಯನವು ಲಿಸ್ಉಭಯವಾಸಿಗಳು {(ಈ ಗುಂಪು ಕಪ್ಪೆಗಳು, ಬೆಂಕಿಮೊಸಳೆ ಅಥವಾ ಸಾಲಮಾಂಡರ್ ಮತ್ತು ಸಿಸಿಲಿಯನ್ ಅಧವಾ ಹಾವಿನಂತಿರುವ ಉಭಯವಾಸಿಗಳನ್ನು ಒಳಗೊಂಡಿದೆ)} ಒಂದೇ ಮೂಲ ವಂಶದಿಂದ ಹುಟ್ಟಿದ್ದು ಕಾರ್ಬೊನಿಫೆರಸ್ ಅವಧಿಯಲ್ಲಿ (ಸುಮಾರು 290ರಿಂದ 305 ದಶಲಕ್ಷ ವರುಷಗಳ ಹಿಂದೆ) ಎನ್ನುತ್ತದೆ. {ref wiki frog r15} ಅಣ್ವಿಕ ಏಕವಂಶಮೂಲ (ಮಾಲೆಕ್ಯೂಲರ್ ಫೈಲೊಜೆನಿ) ರೈಬೋಸೋಮ್ ಡಿಎನ್ಎ ವಿಶ್ಲೇಷಣೆಯ 2005ರ ಅಧ್ಯಯನಗಳು ಬೆಂಕಿಮೊಸಳೆ ಮತ್ತು ಸಿಸಿಲಿಯನ್ಗಳು ಒಂದಕ್ಕೊಂದು ಕಪ್ಪೆಗಳಿಗಿಂತ ಹೆಚ್ಚು ಹತ್ತಿರ ಸಂಬಂಧಿಗಳು ಎನ್ನುತ್ತದೆ. ಈ ಬಗೆಗೆ ಚರ್ಚೆ ಮುಂದುವರೆದಿದೆ.
ತೀರ ಹಿಂದಿನ ಕಪ್ಪೆಯನ್ನೇ ಬೆಂಕಿಮೊಸಳೆಗಳಿಗಿಂತ ಹೆಚ್ಚು ಹೋಲುವ ಪಳೆಯುಳಿಕೆ ಟ್ರೈಡೊಬಾರ್ಕಟಸ್ ಮಸ್ಸಿನೋಟಿ 250 ದಶಲಕ್ಷ ವರುಷಗಳ ಹಿಂದಿನದು ಎಂದು ಗುರುತಿಸಲಾಗಿದ್ದು ಇದು ಇಂದಿನ ಮಡಗಾಸ್ಕರ್ನಲ್ಲಿ ಪತ್ತೆಯಾಗಿದೆ. ಆಧುನಿಕ ಕಪ್ಪೆಗಳಂತೆ ಅಲ್ಲದೆ ಇದಕ್ಕೆ ಸಣ್ಣ ಬಾಲವಿದೆ. ಇದರ ಮೂಳೆಗಳು ಇದಕ್ಕೆ ಇಂದಿನ ಕಪ್ಪೆಗಳಂತೆ ಜಿಗಿಯಲು ಶಕ್ಯವಿರಲಿಲ್ಲ ಎಂದು ಸೂಚಿಸುತ್ತವೆ.{ref wiki frog r21} ಆರಂಭಿಕ ಜುರಾಸಿಕ್ ಕಾಲಮಾನದ್ದು (199.6 ನಿಂದ 175 ದಶಲಕ್ಷ ವರುಷಗಳ ಹಿಂದೆ) ಎಂದು ಗುರುತಿಸಲಾದ ಪ್ರೊಸಲಿರಸ್ ಬಿಟಿಸ್ ಪಳೆಯುಳಿಕೆ ಆಧುನಿಕ ಕಪ್ಪೆಗಳನ್ನು ಹೆಚ್ಚು ಹೋಲುತ್ತದೆ. ಅದಕ್ಕೆ ಬಾಲವಿಲ್ಲ ಮತ್ತು ಜಿಗಿಯಬಲ್ಲದಾಗಿತ್ತು.[೬]
ಇವುಗಳ ಗಾತ್ರವು ಪಾಪುವ ನ್ಯೂ ಗಿನಿಯಲ್ಲಿ ಇತ್ತೀಚೆಗೆ ಪತ್ತೆಯಾದ ಅತಿ ಸಣ್ಣ ಕಪ್ಪೆ (ಉದ್ದ 7.7 ಮಿಮೀ ಅಥವಾ 0.30 ಇಂಚು)ಯಿಂದ[೭] ಕ್ಯಾಮರೂನ್ನ 300 ಮೀಮಿ (12 ಇಂಚು) ಉದ್ದದ ಗೊಲಿಯಾತ್ ಕಪ್ಪೆಯವರೆಗೂ ಇದೆ. ಕಪ್ಪೆಗಳಿಗೆ ಮೂರು ಕಣ್ಣಿನ ರೆಪ್ಪೆಗಳಿರುತ್ತವೆ ಅದರಲ್ಲಿ ಒಂದು ಪಾರದರ್ಶಕವಾಗಿದ್ದು ನೀರಿನಲ್ಲಿದ್ದಾಗ ಅದರ ಕಣ್ಣನ್ನು ಕಾಪಾಡುತ್ತದೆ. ಅವುಗಳ ತಲೆಯ ಎರಡೂ ಕಡೆ ಟಿಂಪಾನಮ್ ಇದ್ದು ಅದು ಕೇಳುವಿಕೆಯಲ್ಲಿ ಸಹಾಯ ಮಾಡುತ್ತದೆ ಮತ್ತು ಕೆಲ ಕಪ್ಪೆಗಳಲ್ಲಿ ಇದು ಚರ್ಮದಿಂದ ಆವರಿಸಿರುತ್ತದೆ. ನಿಜ ನೆಲಗಪ್ಪೆಗಳಲ್ಲಿ ಹಲ್ಲುಗಳಿರುವುದಿಲ್ಲ ಆದರೆ ಬಹಳಷ್ಟು ಕಪ್ಪೆಗಳಲ್ಲಿ ಮೇಲ್ದವಡೆ ಮತ್ತು ಬಾಯಿಯ ನೆತ್ತಿಯಲ್ಲಿ ಹಲ್ಲುಗಳಿರುತ್ತವೆ ಮತ್ತು ಕೆಳದವಡೆಯಲ್ಲಿ ಹಲ್ಲುಗಳಿರುವುದಿಲ್ಲ. ಕಪ್ಪೆಗಳು ಸಾಮಾನ್ಯವಾಗಿ ತಮ್ಮ ಆಹಾರವನ್ನು ಪೂರ್ಣವಾಗಿ ಹಾಗೆಯೇ ನುಂಗುತ್ತವೆ. ಹಲ್ಲುಗಳು ಪ್ರಮುಖವಾಗಿ ಬೇಟೆಯನ್ನು ಅದರ ಸ್ಥಾನದಲ್ಲಿರಿಸಿ ನುಂಗಲು ಸಹಾಯ ಮಾಡುತ್ತವೆ ಮತ್ತು ಈ ಪ್ರಕ್ರಿಯೆಯಲ್ಲಿ ಕಣ್ಣು ತಲೆಯೊಳಗೆ ಎಳೆದುಕೊಳ್ಳುವುದು ಸಹಾಯ ಮಾಡುತ್ತದೆ.[೮] ಸಾಕ್ಷೇಪಿಕವಾಗಿ ಇಲಿ, ಇತರ ಕಪ್ಪೆಗಳಂತಹ ದೊಡ್ಡ ಪ್ರಾಣಿಗಳನ್ನು ಬೇಟೆಯಾಡುವ ಆಫ್ರಿಕಾದ ಗೂಳಿಗಪ್ಪೆಯಲ್ಲಿ ಮುಂದಿನ ಮೇಲ್ದವಡೆಯಲ್ಲಿ ಶಂಕುವಿನಾಕಾರದ ಮೂಳೆಯ ಚಾಚುವಿಕೆಗಳು ಹಲ್ಲಿನಂತೆ ಕೆಲಸಮಾಡುತ್ತವೆ.[೨]
ಕಪ್ಪೆಯ ಕಾಲುಗಳು ಅದು ಎಲ್ಲಿ ಜೀವಿಸುತ್ತದೆ ನೀರು, ನೆಲ, ಮರ ಮತ್ತು ಭೂಮಿಯಲ್ಲಿನ ಬಿಲ ಎಂಬುದರ ಮೇಲೆ ಬದಲಾವಣೆ ಗೊಂಡಿವೆ. ಬಹಳಷ್ಟು ಕಪ್ಪೆಗಳು ಚೆನ್ನಾಗಿ ಜಿಗಿಯಬಲ್ಲವು ಅಥವಾ ಅವುಗಳ ದೇಹ ಜಿಗಿತಕ್ಕೆ ಹೊಂದಿಕೊಡ ಅಸ್ತಿಪಂಜರ ಮತ್ತು ಸ್ನಾಯುಗಳನ್ನು ಹೊಂದಿದ ಪೂರ್ವಜನಿಂದ ವಿಕಾಸವಾಗಿದೆ. ಅದರ ಕಾಲಿನ ಹಲವು ಮೂಳೆಗಳು ಸೇರಿ ದೊಡ್ಡ ಮೂಳೆಗಳಾಗಿವೆ, ಮೂಳೆಯ ಕೀಲುಗಳು ಹಾಗೆಯೇ ಸ್ನಾಯುಗಳು ಸಹ ಬದಲಾಗಿವೆ. ಬಾಲ ಬೆನ್ನುಮೂಳೆ ಯುರೊಸ್ಟೈಲ್ನೊದಿಗೆ (ಕಪ್ಪೆ, ನೆಲಗಪ್ಪೆಗಳಲ್ಲಿ ಬೆನ್ನುಮೂಳೆಯ ತುದಿಯ ಒಂದು ಮೂಳೆ) ಸೇರಿ ಪೆಲ್ವಿಸ್ ಒಳಗೆ ಸೇರಿದೆ. ಇದು ಜಿಗಿತದಲ್ಲಿನ ಶಕ್ತಿಯನ್ನು ಕಾಲಿನಿಂದ ದೇಹಕ್ಕೆ ವರ್ಗಾಯಿಸುತ್ತದೆ.[೯] ಸ್ನಾಯುಗಳು ದೊಡ್ಡವಾಗಿವೆ, ಮುಖ್ಯ ಕಾಲಿನ ಸ್ನಾಯು ಒಟ್ಟು ಕಪ್ಪೆಯ ದೇಹದ ದ್ರವ್ಯರಾಶಿಯ ಶೇ 17ರಷ್ಟಿದೆ.[೧೦] ಕಪ್ಪೆಗಳ ಬೆರಳುಗಳ ನಡುವೆ ಪೊರೆ ಇದ್ದು ಇದು ಅವು ಎಷ್ಟರ ಮಟ್ಟಿಗೆ ನೀರಿನಲ್ಲಿರುತ್ತವೆ ಎಂಬುದರ ಮೇಲೆ ಇದ್ದು ಮರಗಪ್ಪೆಗಳಲ್ಲಿ ಈ ಪೊರೆಗಳು ಬೆರಳಿನ ಅರ್ಧ ಅಥವಾ ಕಾಲು ಭಾಗ ಪೊರೆಗಳಿರುತ್ತವೆ.
ಬೇರೆ ಬೇರೆ ಕಪ್ಪೆಗಳು ಬೇರೆ ಬೇರೆಯ ಚಲನೆಗಳನ್ನು ಅಳವಡಿಸಿಕೊಂಡಿದ್ದು ಅವು ಜಿಗಿಯುವುದು, ಓಡುವುದು, ಈಜುವುದು, ಬಿಲ ತೋಡುವುದು, ಹತ್ತುವುದು ಮತ್ತು ಗಾಳಿಯಲ್ಲಿ ತೇಲುವುದನ್ನು (ಅಥವಾ ಗ್ಲೈಡ್) ಒಳಗೊಂಡಿವೆ. ಕಪ್ಪೆಗಳ ಜಿಗಿತ ವಿಶೇಷ ಗಮನ ಸೆಳೆಯುತ್ತದೆ. ಎಲ್ಲಾ ಕಶೇರುಕಗಳಲ್ಲಿ ಕಪ್ಪೆಗಳನ್ನು ವಿಶೇಷವಾಗಿ ಜಿಗಿಯುವ ಶಕ್ತಿಯಿರುವ ಪ್ರಾಣಿಗಳು ಎಂದು ಗುರುತಿಸಲಾಗಿದೆ.[೧೧] ಪಟ್ಟಿಯ ರಾಕೆಟ್ ಕಪ್ಪೆ ಲಿಟೊರಿಯಾ ನಸುಫ 2 ಮೀಟರ್ (6-7 ಅಡಿ) ದೂರ ಜಿಗಿಯ ಬಲ್ಲದು ಮತ್ತು ಇದು ಅದರ ದೇಹದ ಉದ್ದ 5.5 ಸೆಂಮೀ (2.2 ಇಂಚು) ಐವತ್ತರಷ್ಟು ದೂರ.[೧೨] ಕಪ್ಪೆಯ ಗಾತ್ರ ಹೆಚ್ಚಿದಂತೆ ಅದು ಜಿಗಿಯುವ ದೂರ ಹೆಚ್ಚುತ್ತದೆ ಆದರೆ ಅದರ ದೇಹದ ಉದ್ದಕ್ಕೆ ಹೋಲಿಸಿದಲ್ಲಿ ಸಾಕ್ಷೇಪಿಕ ಜಿಗಿಯುವ ದೂರ ಕಡಿಮೆಯಾಗುತ್ತದೆ.
ಬೊಫಿನಿಡೇ, ರೈನೇಫ್ರೈನಿಡೇ ಮತ್ತು ಮೈಕ್ರೊಹೈಲಿಡೇ ಕುಂಟುಂಬಗಳಲ್ಲಿ ಹಿಂಗಾಲುಗಳು ಸಣ್ಣವಿದ್ದು ಅವು ನಡೆಯುತ್ತವೆ. ನೀರಿನಲ್ಲಿ ಬದುಕುವ ಅಥವಾ ನೀರಿಗೆ ಹೋಗುವ ಕಪ್ಪೆಗಳಲ್ಲಿ ಶಕ್ತಿಯುತ ಹಿಂಗಾಲುಗಳು ಮತ್ತು ಪೊರೆಯ ಬೆರಳುಗಳು ಇರುತ್ತವೆ.[೧೩] ಬಿಲತೋಡುವ ಮತ್ತು ಭೂಮಿಯೊಳಗೆ ಬದುಕುವ ಕಪ್ಪೆಗಳಲ್ಲಿ ದುಂಡನೆಯ ದೇಹ, ಸಣ್ಣ ತಲೆ ಮತ್ತು ಬಿಲ ತೋಡಲು ಸೂಕ್ತವಾದ ಹೊಂದಾಣಿಕೆಯ ಹಿಂಗಾಲುಗಳು ಇರುತ್ತವೆ. ದಕ್ಷಿಣ ಭಾರತದ ನೇರಳೆ ಕಪ್ಪೆ (ಪರ್ಪಲ್ ಫ್ರಾಗ್- ನಸಿಕಬಾಟ್ರಕಸ್ ಸಹ್ಯಾದ್ರೆನ್ಸಿಸ್) ಬಿಲ ತೋಡುವ ಕಪ್ಪೆಗಳ ಉತ್ತಮ ಉದಾಹರಣೆ. ಅದು ಗೆದ್ದಲುಗಳ ಮೇಲೆ ಜೀವಿಸುವ ಇದು ಬಹುತೇಕ ಭೂಮಿಯೊಳಗೆ ಇರುತ್ತದೆ. ಮಳೆಗಾಲದಲ್ಲಿ ಇದು ಲೈಂಗಿಕ ಜೋಡಿಗಾಗಿ ಮತ್ತು ಮರಿ ಮಾಡಲು ಮಾತ್ರ ಹೊರ ಬರುತ್ತದೆ ಮತ್ತು ಸಣ್ಣ ತತ್ಕಾಲಿಕ ಹೊಂಡಗಳಲ್ಲಿ ಮರಿ ಮಾಡುತ್ತದೆ. ಇದರ ಪಳೆಯುಳಿಕೆಯ ಮೂಲಕ ಇದರ ಆಸ್ತಿತ್ವ ಗುರುತಿಸಿದ ನಂತರ 2003ರಲ್ಲಿ ಇದನ್ನು ಮೊದಲು ವಿವರಿಸಲಾಯಿತು. ಆದರೆ ಇದು ಸ್ಥಳೀಯ ಜನರಿಗೆ ಮೊದಲೇ ಪರಿಚಿತವಿತ್ತು.[೧೪]
ಕೆಲವು ಕಪ್ಪೆಗಳು ಗಿಡಗಳಲ್ಲಿಯೇ ಬದುಕುತ್ತಿದ್ದು ಬಹುತೇಕ ಎಂದೂ ಕೆಳಬರುವುದಿಲ್ಲ. "ನಿಜವಾದ" ಮರಗಪ್ಪೆಗಳು ಹೈಲಿಡೇ ಕುಟುಂಬಕ್ಕೆ ಸೇರುತ್ತವೆ ಆದರೆ ಇತರ ಕುಟುಂಬದ ಸದಸ್ಯರೂ ಸ್ವತಂತ್ರವಾಗಿ ಅಭಿಗಾಮಿ ವಿಕಾಸದ (ಕಾನ್ವರ್ಜೆಂಟ್ ಎವುಲ್ಯೂಶನ್) ಮೂಲಕ ಮರ ಜೀವನಕ್ಕೆ ಹೊಂದಾಣಿಕೆ ಮಾಡಿಕೊಂಡಿವೆ. ಇವು ಗಾಜು ಕಪ್ಪೆ (ಸೆಂಟ್ರೊಲೆನಿಡೇ ಕುಟುಂಬ), ಗಿಡ ಕಪ್ಪೆ (ಬುಶ್ ಫ್ರಾಗ್- ಹೈಪರೊಲಿಡೇ ಕುಟುಂಬ), ಕೆಲವು ಚೂಪು ಬಾಯಿಯ ಕಪ್ಪೆಗಳು (ಮೈಕ್ರೊಹೈಲಿಡೇ ಕುಟುಂಬ) ಮತ್ತು ಪೊದೆ ಕಪ್ಪೆ (ಶ್ರಬ್ ಫ್ರಾಗ್- ರಾಕೊಫೋರಿಡೆ ಕುಟುಂಬ) ಗಳನ್ನು ಒಳಗೊಂಡಿವೆ.[೧೫] ಬಹಳಷ್ಟು ಈ ಕಪ್ಪೆಗಳು ಉದ್ದ 10 ಸೆಂಮೀಗೂ (4 ಇಂಚು) ಕಡಿಮೆ ಇರತ್ತವೆ. ಇವುಗಳ ಕಾಲುಗಳ ಹಾಗೂ ಬೆರಳುಗಳು ಉದ್ದವಾಗಿದ್ದು ಬೆರಳಿನ ತುದಿಗೆ ಅಂಟಿಕೊಳ್ಳುವ ಮೆತ್ತೆಯ ಕೊನೆಗಳಿರುತ್ತವೆ. ಈ ಬೆರಳು ಮೆತ್ತೆಗಳ ಮೇಲೆ ಆರು ಮೂಲೆಗಳ ಹೊರ ಚರ್ಮದ ಜೀವಕೋಶಗಳು ಒತ್ತಾಗಿ ಚಪ್ಪಟೆಯಾಗಿ ಪೇರಿಸಲ್ಪಟ್ಟಿದ್ದು ಇವುಗಳ ನಡುವಿನ ಸ್ಥಳಗಳಲ್ಲಿ ಗ್ರಂಥಿಗಳು ಲೋಳೆಯ (ಅಂಟಿನಂತಹ) ಪದಾರ್ಥವನ್ನು ಜಿನುಗಿಸುತ್ತವೆ. ಈ ಬೆರಳಿನ ಮೆತ್ತೆಗಳು ಲೋಳೆಯಿಂದ ತೇವಾಂಶ ಭರಿತವಾಗಿ ನೀರಿರುವ ಅಥವಾ ಒಣ (ಗಾಜನ್ನೂ ಒಳಗೊಂಡು) ಮೇಲ್ಮೈಯನ್ನು ಹಿಡಿದುಕೊಳ್ಳುತ್ತವೆ. ಇದರಲ್ಲಿ ಬಳಕೆಯಾಗುವ ಶಕ್ತಿಗಳು ಬೆರಳ ಮೆತ್ತೆಗಳ ಹೊರ ಚರ್ಮದ ಜೀವಕೋಶಗಳು ಮತ್ತು ಮೇಲ್ಮೈ ನಡುವಿನ ಗಡಿ ಘರ್ಷಣೆ (ಬೌಂಡರಿ ಫ್ರಿಕ್ಶನ್), ಮೇಲ್ಮೈ ಎಳೆತ (ಸರ್ಫೇಸ್ ಟೆನ್ಶನ್) ಮತ್ತು ವಿಸ್ಕೊಸಿಟಿ.[೧೬] ಕೆಲವು ಕಪ್ಪೆಗಳಲ್ಲಿ ಕಾಲುಗಳ ಬೆರಳುಗಳು ವಿರುದ್ಧ ದಿಕ್ಕಿನಲ್ಲಿರುತ್ತವೆ. ಬಲೆ ಎಲೆ ಕಪ್ಪೆ (ರೆಟಿಕ್ಯೂಲೇಟೆಡ್ ಲೀಫ್ ಫ್ರಾಗ್ –ಫೈಲ್ಲೊಮೆಡುಸ ಅಯೆಅಯೆ)ಯಲ್ಲಿ ಎರಡು ಮುಂಗಾಲುಗಳಲ್ಲಿಯೂ ಒಂದು ಬೆರಳು ವಿರುದ್ಧ ದಿಕ್ಕಿನಲ್ಲಿರುತ್ತದೆ ಮತ್ತು ಹಿಂಗಾಲಿನ ಎರಡು ಬೆರಳುಗಳು ವಿರುದ್ಧ ದಿಕ್ಕಿನಲ್ಲಿರುತ್ತವೆ. ಇದು ಈ ಕಪ್ಪೆಯು ಬದುಕುವ ನದಿ ಪಕ್ಕದ ಪ್ರದೇಶಗಳಲ್ಲಿ ಗಿಡಗಳ ಟೊಂಗೆಗಳ ಮೇಲೆ ಚಲಿಸಲು ಅನುಕೂಲ ಮಾಡಿಕೊಡುತ್ತವೆ.[೧೭]
ಕಪ್ಪೆಗಳ ವಿಕಾಸದ ಇತಿಹಾಸದಲ್ಲಿ ಹಲವು ಭಿನ್ನ ಗುಂಪುಗಳು ಸ್ವತಂತ್ರವಾಗಿ ಗಾಳಿಯಲ್ಲಿ ಚಲಿಸಲು ಹೊಂದಿಕೊಂಡಿವೆ.[೧೮] ಉಷ್ಣವಲಯದ ಮಳೆಕಾಡುಗಳಲ್ಲಿನ ಅಡವಿಯ ಅಂಗಳಕ್ಕೆ ತೇಲಿ ಇಳಿಯುವ ಅಥವಾ ಗಿಡದಿಂದ ಗಿಡಕ್ಕೆ ತೇಲುವ ಮೂಲಕ ಚಲಿಸವ ಹೊಂದಾಣಿಕೆ ಮಾಡಿಕೊಂಡಿವೆ. ಇದಕ್ಕೆ ವ್ಯಾಲೇಸ್ ಹಾರುವ ಕಪ್ಪೆ (ರಾಕೊಫೋರಸ್ ನಿಗ್ರೊಪಾಲ್ಮಟಸ್) ಒಂದು ಉದಾಹರಣೆ. ಇವುಗಳ ಬೆರಳು ತುದಿಗಳು ಚಪ್ಪಟೆಯ ತಟ್ಟೆಯಾಗಿ ಅಗಲವಾಗಿದೆ ಮತ್ತು ಬೆರಳುಗಳ ನಡುವೆ ಪೂರ್ಣವಾಗಿ ಪೊರೆಯಿದೆ. ಇವುಗಳ ಕಾಲುಗಳಿಂದ ಹಿಡಿದು ಬಾಲದ ಪ್ರದೇಶದವರೆಗೂ ಹರಡಿದ ಜೋಲು ಚರ್ಮವಿದೆ. ಬೆರಳುಗಳನ್ನು ಚಾಚಿ, ಕಾಲುಗಳನ್ನು ಹರಡಿದರೆ ಅದು ಸಾಕಷ್ಟು ದೂರ ತೇಲಬಲ್ಲದು ಆದರೆ ಹಕ್ಕಿಗಳಂತೆ ಹಾರಲಾರದು.[೧೯] ಇವು ಸಾಗುವ ದಿಕ್ಕನ್ನು ಬದಲಿಸ ಬಲ್ಲವು ಮತ್ತು ಮರಗಳ ನಡುವಿನ 15 ಮೀ (49 ಅಡಿ) ತೇಲಿ ಸಾಗಬಲ್ಲವು.[೨೦]
ಕಪ್ಪೆಯ ಚರ್ಮವು ಉಸಿರಾಟದ ಕಾರ್ಯವನ್ನೂ ನಿರ್ವಹಿಸುತ್ತದೆ. ವಿಶೇಷವಾಗಿ ಮುಖ ಮತ್ತು ಬೆನ್ನಿನ ಚರ್ಮದ ಮೇಲೆ ಹಲವು ಗ್ರಂಥಿಗಳಿವೆ ಮತ್ತು ಹಲವು ಸಲ ಇವು ಹೇವರಿಕೆ ತರುವ ಮತ್ತು ವಿಷ ಪದಾರ್ಥಗಳನ್ನು ಶ್ರವಿಸುತ್ತವೆ. ಈ ಶ್ರವಿಸುವಿಕೆಗಳು ಅಂಟುಅಂಟಾಗಿದ್ದು ಚರ್ಮವನ್ನು ತೇವಾಂಶ ಭರಿತವಾಗಿ ಇರಿಸುತ್ತವೆ ಮತ್ತು ಬೂಜು, ಬ್ಯಾಕ್ಟೀರಿಯಗಳಿಂದ ಕಾಪಾಡುತ್ತವೆ. ಅಲ್ಲದೆ ಈ ಶ್ರವಿಸುವಿಕೆಗಳು ಜಾರುವಂತಿದ್ದು ಪರಭಕ್ಷಕಗಳಿಂದ ರಕ್ಷಣೆ ಒದಗಿಸುತ್ತವೆ.[೨೧] ಅಲ್ಲದೆ ಇವು ದೇಹದಿಂದ ನೀರು ಆವಿಯಾಗುವದನ್ನೂ ಕಡಿಮೆ ಮಾಡುತ್ತವೆ. ಕಪ್ಪೆ ಚರ್ಮವನ್ನು ಕೆಲವು ವಾರಗಳಿಗೊಮ್ಮೆ ಕಳಚುತ್ತದೆ.
ವಿಶೇಷವಾಗಿ ಅವುಗಳ ಪೆಲ್ವಿಕ್ ಪ್ರದೇಶದಲ್ಲಿ (ಹಿಂಗಾಲುಗಳು ಸೇರುವ ಬೆನ್ನಲಿಬಿನ ಕೆಳಭಾಗ) ಕಪ್ಪೆಗಳು ನೀರು ಮತ್ತು ಆಮ್ಲಜನಕವನ್ನು ನೇರವಾಗಿ ಚರ್ಮದ ಮೂಲಕ ಹಿಂಗಿಸಿಕೊಳ್ಳ ಬಲ್ಲವು. ಎದೆ ಮತ್ತು ಕಾಲುಗಳ ಮೇಲಿನ ಕೆಲವು ಗ್ರಂಥಿಗಳು ಆಂಪ್ಲೆಕ್ಸಸ್[೨೨] ಎಂದು ಕರೆಯಲಾದ ಮಿಲನಕ್ಕೆ ಅಗತ್ಯವಾದ ದ್ರವವನ್ನು ಶ್ರವಿಸುತ್ತವೆ. ಛದ್ಮನೆ (ಕ್ಯಾಮೊಪ್ಲೇಜ್) ಬಹಳಷ್ಟು ನಿಶಾಚರಿ ಕಪ್ಪೆಗಳು ಹಗಲು ಬಳಸುವ ಸಾಮಾನ್ಯ ರಕ್ಷಣೆಯ ತಂತ್ರ. ಇವು ಹಗಲು ಪತ್ತೆಯಾಗದಂತಹ ಸ್ಥಳಗಳನ್ನು ಆಯ್ದುಕೊಳ್ಳುತ್ತವೆ. ಕಪ್ಪೆಗಳು ಬದಲಾಯಿಸಿಕೊಳ್ಳ ಬಹುದಾದ ಬಣ್ಣಗಳ ವ್ಯಾಪ್ತಿ ಸಣ್ಣದು.
ಕಪ್ಪೆಗಳ ಚರ್ಮ ನೀರು, ಆಮ್ಲಜನಕ, ಇಂಗಾಲ ಡೈಆಕ್ಸೈಡ್ಗಳಿಗೆ ಪ್ರವೇಶಸಾಧ್ಯವಿದೆ. ಚರ್ಮದ ಹತ್ತಿರವೇ ರಕ್ತನಾಳಗಳಿವೆ ಮತ್ತು ಕಪ್ಪೆ ನೀರಿನಲ್ಲಿದ್ದಾಗ ಆಮ್ಲಜನಕ ನೇರವಾಗಿ ರಕ್ತ ಸೇರುತ್ತದೆ. ನೀರಿನಲ್ಲಿ ಮುಳುಗಿರದಾಗ ಕಪ್ಪೆ ಕೆನ್ನೆಯೂದುವಿಕೆ (ಬಕ್ಕಲ್ ಪಂಪಿಂಗ್) ಎನ್ನುವ ಪ್ರಕ್ರಿಯೆ ಮೂಲಕ ಉಸಿರಾಡುತ್ತದೆ. ಆದರೆ ಎದೆಯ ಸ್ನಾಯುಗಳು ಉಸಿರಾಟ ಕ್ರಿಯೆಯಲ್ಲಿ ಭಾಗವಹಿಸುವುದಿಲ್ಲ. ಅಲ್ಲದೆ ಗಾಳಿಯನ್ನು ಒಳತರಲು ಮತ್ತು ಹೊರಕಳಿಸುವ ಕ್ರಿಯೆಯಲ್ಲಿ ಸಹಾಯ ಮಾಡುವ ಪಕ್ಕೆಲುಬುಗಳೂ ಮತ್ತು ವಫೆ[೨೩] ಇಲ್ಲ. ಇದು ಗಂಟಲಿನ ಮೂಲಕ ಗಾಳಿ ಊದಿ ಹೊಳ್ಳೆಗಳ ಮೂಲಕ ಗಾಳಿ ಎಳೆದುಕೊಳ್ಳುತ್ತದೆ. ಹಲವು ಪ್ರಭೇದಗಳಲ್ಲಿ ಈ ಸಮಯದಲ್ಲಿ ಹೊಳ್ಳೆ ಮುಚ್ಚಿಕೊಳ್ಳಲು ಕವಾಟಗಳಿವೆ. ಬಾಯಿಯ ತಳ ಒತ್ತಿದಾಗ ಗಾಳಿಯು ಶ್ವಾಸಕೋಶ ಪ್ರವೇಶಿಸುತ್ತದೆ.[೨೪] ಬೊರ್ನಿಯ ಚಪ್ಪಟೆ ತಲೆಯ ಕಪ್ಪೆ (ಬಾರ್ಬೌರುಲ ಕಲಿಮಂಟಾನೆನ್ಸಿಸ್) ಪೂರ್ಣವಾಗಿ ಶ್ವಾಶಕೋಶಗಳಲ್ಲಿವೆಂದು ಗುರುತಿಸಲಾದ ಮೊದಲ ಪ್ರಭೇದ.[೨೫]
ಕಪ್ಪೆಯ ಕಣ್ಣುಗಳ ತಲೆಯ ಮೇಲೆ ಎರಡೂ ಕಡೆ ಅರ್ಧ ಗೋಲದ ಆಕೃತಿಯಲ್ಲಿ ಹೊರ ಚಾಚಿಕೊಂಡಿರುತ್ತವೆ. ಎರಡೂ ಕಣ್ಣುಗಳೂ ಒಟ್ಟು 100° ಕ್ಷೇತ್ರದ ಒಂದೇ ದೃಶ್ಯವನ್ನು ಅಥವಾ ಇಗ್ಗಣ್ಣಿನ ನೋಟ (ಬೈನಾಕುಲರ್ ವಿಶನ್) ಕೊಡುತ್ತವೆ ಮತ್ತು ಒಟ್ಟಾರೆ ದೃಷ್ಯದ ಕ್ಷೇತ್ರ ಬಹುತೇಕ 360°.[೨೬] ನೀರಿನಲ್ಲಿ ಕಪ್ಪೆ ಮುಳುಗಿದಾಗ ಹೊರಕಾಣುವ ಭಾಗಗಳು ಇವು ಮಾತ್ರ. ಪ್ರತೀ ಕಣ್ಣಿಗೂ ಮುಚ್ಚಿಕೊಳ್ಳ ಬಹುದಾದ ಕೆಳ ಮತ್ತು ಮೇಲ್ ರೆಪ್ಪೆಗಳು ಇರುತ್ತವೆ. ಇದಲ್ಲದೆ ನಿಕ್ಟಿಟೇಟಿಂಗ್ ಪದರ ಎಂದು ಕರೆಯಲಾದ ಇನ್ನೊಂದು ಪಾರದರ್ಶಕ ಅಥವಾ ಅರೆಪಾರದರ್ಶಕ ರೆಪ್ಪೆಯಿರುತ್ತದೆ ಮತ್ತು ಇದು ನೀರಿನಲ್ಲಿರುವಾಗ ವಿಶೇಷವಾಗಿ ಈಜುವಾಗ ಕಣ್ಣುಗಳಿಗೆ ರಕ್ಷಣೆ ಕೊಡುತ್ತದೆ.[೨೭]
ಕಪ್ಪೆಗಳು ದೂರದ ವಸ್ತುಗಳನ್ನು ಹತ್ತಿರದ ವಸ್ತುಗಳಿಗಿಂತ ಚೆನ್ನಾಗಿ ನೋಡಬಲ್ಲವು. ವಟಗುಟ್ಟುವ ಕಪ್ಪೆ ಹತ್ತಿರ ವಸ್ತುಗಳು ಬಂದರೆ ಅಥವಾ ನೆರಳು ಹತ್ತಿರ ಬಂದರೂ ಸುಮ್ಮನಾಗುತ್ತವೆ ಆದರೆ ವಸ್ತು ಹೆಚ್ಚು ಹತ್ತಿರವಾದರೆ ಸರಿಯಾಗಿ ನೋಡಲಾರವು.[೨೭] ಕಪ್ಪೆ ತನ್ನ ನಾಲಗೆಯನ್ನು ಚಾಚಿದಾಗ ಅದು ಸರಿಯಾಗ ನೋಡಲಾರದ ಚಲಿಸುವ ವಸ್ತುವಿಗೆ ಪ್ರತಿಕ್ರಿಯಿಸುತ್ತದೆ ಮತ್ತು ಅದು ನಾಲಗೆ ಚಾಚಿದಾಗ ಕಣ್ಣು ಮುಚ್ಚಿಕೊಳ್ಳುತ್ತದೆ.[೨೮]
ಕಪ್ಪೆಗಳು ಗಾಳಿಯಲ್ಲಿಯೂ ಮತ್ತು ನೀರಿನೊಳಗೆಯೂ ಕೇಳಬಲ್ಲವು. ಕಪ್ಪೆಗಳಿಗೆ ಹೊರಗಿವಿಗಳು ಇರುವುದಿಲ್ಲ. ಕಿವಿಪೊರೆ (ಟಿಂಪಾನಮ್ ಪೊರೆ) ಹೊರಕಾಣುತ್ತದೆ. ಕೆಲವು ಪ್ರಭೇದಗಳಲ್ಲಿ ಇದರ ಮೇಲೆ ಚರ್ಮವಿರುತ್ತದೆ. ಇದು ಸಾಮಾನ್ಯವಾಗಿ ಚಕ್ರಾಕಾರದಲ್ಲಿ ಕಣ್ಣಿನ ಹಿಂದೆ ಕಾಣಬರುತ್ತದೆ. ಟಿಂಪಾನಮ್ನ ಗಾತ್ರವು ಕಪ್ಪೆಗಳ ವಟಗುಟ್ಟುವಿಕೆ (ಲೈಂಗಿಕ ಕರೆ) ಯ ದೂರ, ಆವರ್ತನ ಮತ್ತು ಅಲೆಯುದ್ದದ ಮೇಲೆಯೂ ಆಧಾರ ಪಟ್ಟಿರುತ್ತದೆ. ಗೂಳಿಕಪ್ಪೆಯಂತಹ ಕೆಲವು ಪ್ರಭೇದಗಳಲ್ಲಿ ಇದು ಗಂಡು ಹೆಣ್ಣಿನ ನಡುವೆ ವ್ಯತ್ಯಾಸವೂ ಸಹ. ಈ ಕಪ್ಪೆಯಲ್ಲಿ ಗಂಡಿನ ಟಿಂಪಾನಮ್ಗಳು ಕಣ್ಣಿಗಿಂತ ದೊಡ್ಡವಿದ್ದರೆ ಹೆಣ್ಣಿನಲ್ಲಿ ಇವೆರಡೂ ಬಹುತೇಕ ಒಂದೇ ಗಾತ್ರವಿರುತ್ತವೆ.[೨೯] ಸದ್ದು ಟಿಂಪಾನಮ್ ಪದರ ಕಂಪಿಸುವಂತೆ ಮಾಡಿ ಸದ್ದು ಮಧ್ಯ ಮತ್ತು ಒಳಕಿವಿಗೆ ರವಾನೆಯಾಗುತ್ತದೆ. ಸದ್ದಿಗೆ ಕಪ್ಪೆಯು ಬೆದರ ಬಹುದು ಆದರೆ ಅದು ಸದ್ದಿನ ಆಕಾರವನ್ನು ಕಣ್ಣಿನಿಂದ ನೋಡಿದ ನಂತರವೇ ಕ್ರಿಯೆಗೆ ಇಳಿಯುತ್ತದೆ.[೨೯]
ಕಪ್ಪೆಯ ವಟಗುಟ್ಟುವಿಕೆಯ ಕರೆ ಆ ಪ್ರಭೇದಗಳಿಗೆ ವಿಶೇಷ. ಕಪ್ಪೆ ಈ ಸದ್ದನ್ನು ಗಾಳಿಯನ್ನು ಗಂಟಲಗೂಡಿನ ಮೂಲಕ ಹಾಯಿಸುವ ಮೂಲಕ ಹೊರಡಿಸುತ್ತದೆ. ಬಹಳಷ್ಟು ಕರೆಗಳು ಒಂದು ಅಥವಾ ಹೆಚ್ಚು ಶಬ್ಧದ ಚೀಲಗಳಿಂದ, ಗಂಟಲಿನ ಕೆಳಗಿನ ಪದರಗಳಿಂದ, ಬಾಯಿಯ ಮೂಲೆಗಳಿಂದ ಹೆಚ್ಚಾಗುತ್ತವೆ. ಈ ಕ್ರಿಯೆಯಲ್ಲಿ ಹೀಗೆ ಕರೆಯನ್ನು ಹೆಚ್ಚಾಗಿಸುವ ಅಂಗಗಳು ಉಬ್ಬಿಕೊಳ್ಳುತ್ತವೆ. ಕೆಲವು ಕಪ್ಪೆಗಳ ವಟಗುಟ್ಟುವಿಕೆಯ ಕರೆಯು ಎಷ್ಟು ಗಟ್ಟಿಯಾಗಿರುತ್ತದೆ ಎಂದರೆ ಒಂದು ಮೈಲು ದೂರದವರೆಗೂ ಅದನ್ನು ಕೇಳಬಹುದು.[೩೦] ಉತ್ತರ ಅಮೆರಿಕದ ಬೆಟ್ಟಗಳಲ್ಲಿನ ಹಳ್ಳಗಳಲ್ಲಿ ಬದುಕುವ ಕರಾವಳಿಯ ಬಾಲದ ಕಪ್ಪೆಗಳಲ್ಲಿ (ಆಸ್ಕಫಸ್ ಟ್ರುಯಿ) ವಟಗುಟ್ಟುವಿಕೆ ಕರೆಗಳು ಇಲ್ಲ.[೩೧]
ಗಂಡು ಕಪ್ಪೆಯ ಕರೆಯ ಪ್ರಮುಖ ಉದ್ಧೇಶ ಸಂಗಾತಿಯನ್ನು ಆಹ್ವಾನಿಸುವುದು. ಈ ಕರೆಗಳು ಒಂದೇ ಗಂಡಿನದಾಗ ಬಹುದು ಅಥವಾ ಸಂತಾನೋತ್ಪತ್ತಿಯ ಸ್ಥಳದಲ್ಲಿ ಸೇರಿದ ಹಲವು ಗಂಡುಗಳ ವಟಗುಟ್ಟುವಿಕೆಯ ಮೇಳವೇ ಆಗಬಹುದು. ಹೆಣ್ಣು ಕಪ್ಪೆಗಳು ಹೆಚ್ಚಿನ ತೀವ್ರತೆ ಮತ್ತು ಕಡಿಮೆ ಆವರ್ತನದ ಕರೆಗಳ ಗಂಡುಗಳ ಬಗೆಗೆ ಒಲವು ತೋರುತ್ತವೆ. ಇದು ಹೆಚ್ಚು ಶಕ್ತ ಮರಿಗಳನ್ನು ಕೊಡ ಬಲ್ಲ ಶಕ್ತಿಯನ್ನು ತೋರುತ್ತದೆ ಎಂದು ಅವು ಭಾವಿಸುತ್ತವೆ ಎಂಬ ತರ್ಕವನ್ನು ಇದಕ್ಕೆ ಹಚ್ಚಲಾಗಿದೆ.[೩೨] ಭಿನ್ನ ಸದ್ದನ್ನು ಲೈಂಗಿಕ ಸಂಬಂಧದಲ್ಲಿರುವ ಗಂಡು ಅಥವಾ ಗಂಡನ್ನು ಸ್ವೀಕರಿಲಾಗದ ಹೆಣ್ಣು ಕಪ್ಪೆಗಳು ಹೊರಡಿಸುತ್ತವೆ. ಇದು "ಚಿರುಪ್" ಅನುಕರಿಸುವ ದನಿಯಾಗಿದ್ದು, ದೇಹದ ಕಂಪನದ ಜೊತೆಗೆ ಬರುತ್ತದೆ.[೩೩] ಈ ಎಲ್ಲಾ ಕರೆಗಳ ಸಮಯದಲ್ಲಿಯೂ ಕಪ್ಪೆಯ ಬಾಯಿ ತೆರೆಯುವುದಿಲ್ಲ.[೩೩] ಅಪಾಯದಲ್ಲಿರುವಾಗಿನ ಕರೆಯು ಉತ್ಪನ್ನ ಮಾಡುವಾಗ ಕಪ್ಪೆ ಬಾಯಿ ತೆರೆದು ಸದ್ದು ಹೊರಡಿಸುತ್ತದೆ ಮತ್ತು ಇದು ಹೆಚ್ಚಿನ ಸ್ಥಾಯಿಯದಾಗಿರುತ್ತದೆ. ಇದನ್ನು ತನ್ನನ್ನು ಹಿಡಿದ ಪರಭಕ್ಷಕದ ಗಮನ ಬೇರೆಡೆ ಸೆಳೆಯುವ ಅಥವಾ ಗೊಂದಲಕ್ಕೆ ಬೀಳಿಸುವ ಮೂಲಕ ತನ್ನನ್ನು ತೊರೆಯುವಂತೆ ಮಾಡಲು ಹೀಗೆ ಮಾಡುತ್ತದೆ.[೩೩]
ತೀರ ತೀವ್ರ ಪರಿಸ್ಥಿತಿಗಳಲ್ಲಿ ಕಪ್ಪೆಗಳು ಜಡತ್ವದ (ಟಾರ್ಪರ್) ಸ್ಥಿತಿಯನ್ನು ತಲುಪಿ ಹಲವು ತಿಂಗಳುಗಳು ಚಟುವಟಿಕೆ ರಹಿತವಾಗಿರುತ್ತವೆ. ಚಳಿ ಪ್ರದೇಶಗಳಲ್ಲಿ ಹಲವು ಕಪ್ಪೆಗಳು ಚಳಿಗಾಲದಲ್ಲಿ ಚಳಿನಿದ್ದೆ (ಹೈಬರ್ನೇಶನ್)ಗೆ ಹೋಗುತ್ತವೆ. ಭೂಮಿಯ ಮೇಲೆ ಜೀವಿಸುವ ಅಮೆರಿಕ ನೆಲಗಪ್ಪೆಯಂತಹವು (ಬಫೊ ಅಮೆರಿಕಾನಸ್) ಅಡಗಲು ನೆಲೆವನ್ನು ಅಗೆದು ಅಲ್ಲಿ ಚಟುವಟಿಕೆ ರಹಿತವಾಗಿರುತ್ತವೆ. ಹೀಗೆ ಅಗೆಯಲು ಕಡಿಮೆ ಶಕ್ತಿ ಇರುವವು ಸಂದುಗಳಲ್ಲಿ ಅಥವಾ ಒಣ ಎಲೆಯಲ್ಲಿ ಅಡಗಿಕೊಳ್ಳುತ್ತವೆ. ಕೆಲವು ಜಲವಾಸಿ ಕಪ್ಪೆಗಳು ಸಾಮಾನ್ಯವಾಗಿ ಸರೋವರದ ತಳ ಸೇರಿ, ಕೆಲವೊಮ್ಮೆ ಮಣ್ಣಿನಲ್ಲಿ ಅರೆಹೂತು ಹೋಗಿರುತ್ತವೆ ಆದಾಗ್ಯೂ ಉಸಿರಾಡ ಬಲ್ಲವು. ಕೆಲವು ಕಪ್ಪೆಗಳು ಹಿಮಗಡ್ಡೆಯಾಗುವಿಕೆಯನ್ನೂ ತಾಳಿಕೊಳ್ಳ ಬಲ್ಲವು. ಹಿಮ ಹರಳುಗಳು ಚರ್ಮದ ಕೆಳಗೆ ಮತ್ತು ದೇಹದ ಒಳಗೆ ರೂಪಗೊಳ್ಳುತ್ತವೆ ಆದರೆ ಅಂಗಗಳು ಹೆಚ್ಚಿನ ಗ್ಲುಕೋಸ್ ಇರುವಿಕೆಯಿಂದ ರಕ್ಷಿಸಲ್ಪಡುತ್ತವೆ. ವಾಸ್ತವದಲ್ಲಿ ಜೀವರಹಿತ ಹಿಮಗಡ್ಡೆಯಾದ ಕಪ್ಪೆಗಳಲ್ಲಿ ವಾತಾವರಣ ಬಿಸಿಯೇರಿದ ಮೇಲೆ ಉಸಿರಾಟ ಮತ್ತು ಹೃದಯ ಬಡಿತ ಆರಂಭವಾಗುತ್ತದೆ.[೩೪]
ಇತರ ಉಭಯವಾಸಿಗಳಂತೆಯೇ ಕಪ್ಪೆಯ ಜೀವನ ಚಕ್ರ ಮೊಟ್ಟೆಯೊಂದಿಗೆ ಆರಂಭವಾಗುತ್ತದೆ. ಈ ಮೊಟ್ಟೆಗಳು ಒಡೆದು ಯಾವುದೇ ಕೈಕಾಲುಗಳಿಲ್ಲದ, ಗಿಲ್ಗಳು ಇರುವ ಗೊದಮೊಟ್ಟೆ ಮರಿಯಾಗುತ್ತದೆ (ಟಾಡ್ಪೋಲ್). ನಂತರದಲ್ಲಿ ಅದು ಕಾಲುಗಳನ್ನು, ಶ್ವಾಶಕೋಶವನ್ನು ಬೆಳಿಸಿಕೊಂಡು, ರೂಪದಲ್ಲಿ ಬದಲಾವಣೆಗೊಂಡು, ಅಂಗಾಗಳು ಮರು ಸಂಘಟಿತಗೊಂಡು ಸಣ್ಣ ಕಪ್ಪೆಯಾಗುತ್ತದೆ.
ಕಪ್ಪೆಗಳಲ್ಲಿ ಎರಡು ರೀತಿಯ ಸಂತಾನೋತ್ಪತ್ತಿ ಇದೆ, ಅವುಗಳನ್ನು ನಿಧಾನ ಮತ್ತು ಸ್ಫೋಟಕ ಸಂತಾನೋತ್ಪತ್ತಿ ಎಂದು ಕರೆಯಲಾಗಿದೆ. ಬಹುಸಂಖ್ಯಾತ ಪ್ರಭೇದಳಿಗೆ ಅನ್ವಯವಾಗುವ ನಿಧಾನ ಸಂತಾನೋತ್ಪತ್ತಿಯಲ್ಲಿ ವಯಸ್ಕ ಕಪ್ಪೆಗಳು ವರುಷದ ಒಂದು ನಿರ್ದಿಷ್ಟ ಕಾಲದಲ್ಲಿ ಸರೋವರ ಅಥವಾ ಹಳ್ಳದ ಸುತ್ತ ಸೇರುತ್ತವೆ. ಹಲವು ಕಪ್ಪೆಗಳು ತಾವು ಗೊದಮೊಟ್ಟೆ ಮರಿಯಾಗಿ ಬೆಳೆದ ನೀರಿನ ತಾಣಕ್ಕೆ ಹಿಂತಿರುಗುತ್ತವೆ. ಇದು ಕೆಲವೊಮ್ಮೆ ಸಾವಿರಾರು ಕಪ್ಪೆಗಳ ವಾರ್ಷಿಕ ವಲಸೆಯಾಗಿ ಮಾರ್ಪಡುತ್ತದೆ. ಇಲ್ಲಿ ಸಾಮಾನ್ಯವಾಗಿ ಗಂಡುಗಳು ಸಂತಾನೋತ್ಪತ್ತಿ ಜಾಗಕ್ಕೆ ಮೊದಲು ಬರುತ್ತವೆ. ನಂತರ ಹೆಣ್ಣುಗಳು ಬರುತ್ತವೆ ಮತ್ತು ಮೊಟ್ಟೆ ಬಿಟ್ಟ ನಂತರ ಹಿಂತಿರುಗುತ್ತವೆ. ಇದರ ಅರ್ಥವೆಂದರೆ ಗಂಡುಗಳ ಸಂಖ್ಯೆ ಹೆಣ್ಣುಗಳಿಗಿಂತ ಹೆಚ್ಚು ಇರುತ್ತದೆ. ಗಂಡುಗಳು ತಮ್ಮ ವಟಗುಟ್ಟವಿಕೆ ಕರೆಯ ಮೂಲಕ ಹೆಣ್ಣನ್ನು ಆಕರ್ಷಿಸುತ್ತವೆ ಮತ್ತು ತಮ್ಮ ಗಡಿಯನ್ನು ಇತರ ಗಂಡುಗಳಿಗೆ ಅತಿಕ್ರಮಿಸ ಬಿಡುವುದಿಲ್ಲ. ಕೆಲವು ಪ್ರಭೇದಗಳಲ್ಲಿ ಗಡಿಯನ್ನು ಗುರುತಿಸಿಕೊಳ್ಳದ ಬಿಡಿ ಗಂಡುಗಳು ಇರುತ್ತವೆ. ಇವು ಗಂಡಿನ ಕರೆಗೆ ಓಗೊಟ್ಟ ಸಾಗುತ್ತಿರುವ ಹೆಣ್ಣುಗಳೆಡೆಗೆ ಸಾಗಬಹುದು ಅಥವಾ ಯಾವುದೇ ಬೇರೆ ಗಂಡು ಇಲ್ಲದ ಪ್ರದೇಶಗಳನ್ನು ಆಕ್ರಮಿಸ ಬಹುದು. ಕೆಲವೊಮ್ಮೆ ಈ ಸ್ಥಿತಿ ಹಿಮ್ಮೊಗವಾಗ ಬಹುದು, ವಟಗುಟ್ಟಿವಿಕೆಯ ಮೂಲಕ ಕರೆಯುವ ಕಪ್ಪೆ ಬಿಡಿ ಕಪ್ಪೆಯಾಗ ಬಹುದು.[೩೫]
ಸ್ಫೋಟಕ ಸಂತಾನೋತ್ಪತ್ತಿಯಲ್ಲಿ ವಯಸ್ಕ ಕಪ್ಪೆಗಳು ಸಂತಾನೋತ್ಪತ್ತಿ ಪ್ರದೇಶಕ್ಕೆ ಯಾವುದಾದರೂ, ಒಣ ಪ್ರದೇಶದಲ್ಲಿ ಮಳೆಯಂತಹ, ಪ್ರಚೋದನಾ ಅಂಶದ ಆಧಾರದ ಮೇಲೆ ಬರುತ್ತವೆ. ಈ ಕಪ್ಪೆಗಳಲ್ಲಿ ಲೈಂಗಿಕ ಮಿಲನ, ಮೊಟ್ಟೆ ಇಡುವಿಕೆ ಬೇಗ ಆಗುತ್ತದೆ ಮತ್ತು ಗೊದಮೊಟ್ಟೆ ಮರಿಯ ಬೆಳವಣಿಗೆ ಹೊಂಡ ಹಿಂಗಿಹೋಗುವ ಮುಂಚೆ ಆಗುವಂತೆ ವೇಗವಾಗಿರುತ್ತದೆ.[೩೬] ಗಂಡುಗಳು ಮೊದಲು ಸಂತಾನೋತ್ಪತ್ತಿ ಸ್ಥಳವನ್ನು ಸಾಮಾನ್ಯವಾಗಿ, ತಾತ್ಕಾಲಿಕ ಹೊಂಡಗಳನ್ನು, ಗುರುತಿಸುತ್ತವೆ. ಇವುಗಳ ವಟಗುಟ್ಟವಿಕೆ ಕರೆ ಸಾಮಾನ್ಯವಾಗಿ ಸಾಮೂಹಿಕವಾಗಿದ್ದು ದೂರದ ವರೆಗೂ ಕೇಳುತ್ತದೆ. ಕೆಲವೊಮ್ಮೆ ಸರಿಯಾದ ಪರಿಸ್ಥಿತಿ ಇರದಿದ್ದಲ್ಲಿ ಕಪ್ಪೆಗಳು ಎರಡು ಅಥವಾ ಹೆಚ್ಚು ವರುಷಗಳು ಸಂತಾನೋತ್ಪತ್ತಿ ಮಾಡುವುದಿಲ್ಲ.[೩೫]
ಸಂತಾನೋತ್ಪತ್ತಿ ಸ್ಥಳದಲ್ಲಿ ಆಂಪ್ಲೆಕ್ಸಸ್[೨೨] ಎಂದು ಕರೆಯಲಾದ ಲೈಂಗಿಕ ಮಿಲನದಲ್ಲಿ ಗಂಡು ಹೆಣ್ಣಿನ ಮೇಲೆ ಕುಳಿತುಕೊಳ್ಳುತ್ತದೆ. ಸಾಮಾನ್ಯವಾಗಿ ಇದು ನೀರಿನಲ್ಲಿ ಮತ್ತು ಹೆಣ್ಣು ಮೊಟ್ಟೆಗಳ ದ್ರವವನ್ನು ಸುರಿಸಿದಾಗ ಗಂಡು ರೇತಸನ್ನು ಅದರ ಮೇಲೆ ಬಿಡುತ್ತದೆ. ಇಲ್ಲಿಯ ಪಲವತ್ತಾಗುವಿಕೆ ಜೀವಿಯ ಹೊರಗೆ ಜರುಗುತ್ತದೆ.
ಕಪ್ಪೆ ಭ್ರೂಣಗಳು ಹಲವು ಪದರಗಳ ಅಂಟಾದ ಪದಾರ್ಥಗಳನ್ನು ಹೊಂದಿದ್ದು ಅದನ್ನು ಕಪ್ಪೆತತ್ತಿ (ಫ್ರಾಗ್ಸ್ಪಾನ್) ಎಂದು ಕರೆಯಲಾಗುತ್ತದೆ. ಈ ಜೆಲ್ಲಿ ರೀತಿಯ ಪದಾರ್ಥವು ಮೊಟ್ಟೆಗೆ ರಕ್ಷಣೆಯನ್ನೂ ಆಮ್ಲಜನಕ, ಇಂಗಾಲ ಡೈಆಕ್ಸೈಡ್ ಮತ್ತು ಅಮೋನಿಯಗಳಿಗೆ ದಾರಿಮಾಡಿಕೊಡುವ ಕೆಲಸ ಮಾಡುತ್ತದೆ. ನೀರಿನಲ್ಲಿ ಇದು ತೇವಾಂಶ ಹಿಂಗಿಕೊಂಡು ಉಬ್ಬುತ್ತದೆ. ಬಹಳಷ್ಟು ಮೊಟ್ಟೆಗಳು ಕಪ್ಪು ಅಥವಾ ಕಂದು ಬಣ್ಣದವಾಗಿದ್ದು ಸೂರ್ಯನ ಬಿಸುಪನ್ನು ಹಿಂಗಿಕೊಳ್ಳ ಬಲ್ಲವು ಮತ್ತು ಸುತ್ತಲಿನ ಕ್ಯಾಪ್ಯೂಲ್ ಈ ಬಿಸುಪನ್ನು ಉಳಿಯುವಂತೆ ಮಾಡುತ್ತದೆ. ಕಟ್ಟಿಗೆ ಕಪ್ಪೆಯ (ವುಡ್ ಫ್ರಾಗ್- ರಾನ ಸಿಲ್ವಾಟಿಕ) ಮೊಟ್ಟೆಗಳ ಗುಂಪಿನ ಗೊಂಚಲಿನ ಒಳಭಾಗವು ಸುತ್ತಮುತ್ತಲಿನ ನೀರಿನ ತಾಪಮಾನಕ್ಕಿಂತ 6 °ಸೆ (11 °ಎಫ್) ಹೆಚ್ಚು ಇದ್ದದು ಪತ್ತೆಯಾಗಿದೆ ಮತ್ತು ಇದು ಮರಿಯು ವೇಗವಾಗಿ ಬೆಳಯಲು ಸಹಾಯಕ.[೩೭] ಕೆಂಪು ಕಣ್ಣಿನ ಮರಗಪ್ಪೆಯು (ಅಗ್ಲಿಕ್ನಿಸ್ ಕಾಲ್ಲಿಡ್ರಯಾಸ್) ಕೊಳದ ಮೇಲಿನ ಎಲೆಯ ಮೇಲೆ ಮೊಟ್ಟೆಯಿಡುತ್ತದೆ ಮತ್ತು ಮೊಟ್ಟೆ ಮರಿಯಾದಾಗ ಕೆಳಗಿನ ನೀರಿಗೆ ಬೀಳುತ್ತದೆ.[೩೮] ಮೊಟ್ಟೆಯೊಳಗಿನ ಮರಿ ಕಣಜ ಅಥವಾ ಹಾವಿನಂತಹ ಪರಭಕ್ಷಗಳಿಂದಾಗುವ ಕಂಪನವನ್ನು ಗುರುತಿಸ ಬಲ್ಲವು ಮತ್ತು ತಿನ್ನುವುದನ್ನು ತಪ್ಪಿಸಿಕೊಳ್ಳಲು ಬೇಗ ಹೊರಬರುತ್ತವೆ.[೩೯]
ಮೊಟ್ಟೆಯಿಂದ ಹೊರಬರುವ ಮರಿಯನ್ನು ಗೊದಮೊಟ್ಟೆ ಮರಿ ಎಂದು ಕರೆಯಲಾಗುತ್ತದೆ. ಇವುಗಳು ಅಂಡಾಕಾರದಲ್ಲಿದ್ದು, ಇವುಗಳಿಗೆ ಉದ್ದನೆಯ ಮತ್ತು ಲಂಬವಾಗಿ ಚಪ್ಪಟೆಯಾದ ಬಾಲವಿರುತ್ತದೆ. ಈ ಮರಿ ಸಾಮಾನ್ಯವಾಗಿ ಪೂರ್ಣವಾಗಿ ಜಲವಾಸಿ. ಇವುಗಳಿಗೆ ಉಸಿರಾಡಲು ಗಿಲ್ಗಳು ಇರುತ್ತವೆ ಮತ್ತು ಬಾಲದಿಂದ ಇವು ಈಜುತ್ತವೆ.[೪೦] ಗೊದಮೊಟ್ಟೆ ಮರಿಗಳು ಪೂರ್ಣವಾಗಿ ಸಸ್ಯಾಹಾರಿಗಳು ಮತ್ತು ಇವುಗಳಿಗೆ ಗಿಲ್ ಮೂಲಕ ಶೋಧಿಸಿದ ಪಾಚಿ ಅಥವಾ ಶೈವಲ ಆಹಾರ. ಕೆಲವು ಪ್ರಭೇದಗಳ ಮರಿಗಳು ಮಾಂಸಾಹಾರಿಗಳು ಮತ್ತು ಕೀಟಗಳು, ಸಣ್ಣ ಗೊದಮೊಟ್ಟೆ ಮರಿ ಮತ್ತು ಮೀನುಗಳು ಇವುಗಳ ಆಹಾರ. ಮೀನು, ಬೇಟೆಯಾಡುವ ದುಂಬಿಗಳು, ಮಿಂಚುಳ್ಳಿಗಳಿಗೆ ಇವು ಆಹಾರವಾಗುತ್ತವೆ. ಗೊದಮೊಟ್ಟೆ ಮರಿಯ ಸ್ಥಿತಿಯು ಸ್ಫೋಟಕ ಸಂತಾನೋತ್ಪತ್ತಿಗಳಲ್ಲಿ ಒಂದು ವಾರದಷ್ಟು ಕಡಿಮೆ ಇರಬಹುದು ಅಥವಾ ಒಂದು ಅಥವಾ ಹೆಚ್ಚು ಚಳಿಗಾಲಗಳನ್ನು ಕಳೆದು ವಸಂತದಲ್ಲಿ ರೂಪಾಂತರ ವಾಗಬಹುದು.[೪೧]
ಇದು ಗೊದಮೊಟ್ಟೆ ಮರಿಯ ಹಂತದ ಕೊನೆ ಮತ್ತು ಈ ಹಂತದಲ್ಲಿ ಮರಿಯು ವೇಗವಾದ ಬದಲಾವಣೆಗಳನ್ನು ಕಾಣುತ್ತದೆ. ಸಾಮಾನ್ಯವಾಗಿ ರೂಪಾಂತರ 24 ಗಂಟೆಗಳಲ್ಲಿ ಆಗುತ್ತದೆ ಮತ್ತು ಇದರ ಆರಂಭ ಥೈರೋಕ್ಸಿನ್ ಹಾರ್ಮೋನ್ ಉತ್ಪಾದನೆಯೊಂದಿಗೆ ಆರಂಭವಾಗುತ್ತದೆ. ಇದು ಬೇರೆ ಬೇರೆ ಅಂಗಾಶಗಳು ಬೇರೆ ಬೇರೆ ರೀತಿಯಲ್ಲಿ ಬೆಳೆಯಲು ಕಾರಣವಾಗುತ್ತದೆ. ಕೆಳಗಿನ ದವಡೆಯು ಮಾಂಸಾಹಾರಿಯ ದೊಡ್ಡ ದವಡೆಯ ಮೂಳೆಯಾಗಿಯೂ, ಸುರುಳಿಯ ಸಸ್ಯಹಾರಿ ಕರುಳು ಮಾಂಸಾಹಾರಿಯ ಸಣ್ಣ ಕರುಳಾಗಿ ಪರಿವರ್ತನೆಯಾಗುತ್ತವೆ.[೪೨] ನರಮಂಡಲವು ಕೇಳುವಿಕೆ, ಮೂರು ಆಯಾಮಗಳ ನೋಟ, ಹೊಸ ಚಲನೆ ಮತ್ತು ಆಹಾರ ಪದ್ಧತಿಗೆ ಹೊಂದಿಕೊಳ್ಳುತ್ತದೆ.[೪೨] ಕಣ್ಣುಗಳ ಸ್ಥಾನ ಬದಲಾಗುತ್ತದೆ, ಟಿಂಪಾನಮ್, ನಡುಗಿವಿ, ಒಳಗಿವಿ ರೂಪಗೊಳ್ಳುತ್ತವೆ. ಚರ್ಮ ದಪ್ಪವಾಗುತ್ತದೆ, ಅದರ ಗ್ರಂಥಿಗಳು ರೂಪಗೊಳ್ಳುತ್ತವೆ.[೪೨] ಕೊನೆಯ ಹಂತದಲ್ಲಿ ಬಾಲ ಕಾಣೆಯಾಗುತ್ತದೆ. ಕಪ್ಪೆಗಳು ರೂಪಾಂತರದ ಸಮಯದಲ್ಲಿ ಪರಭಕ್ಷಗಳಿಗೆ ಬಲಿಯಾಗುವ ಸಾಧ್ಯತೆ ಹೆಚ್ಚು ಇರುತ್ತದೆ. ಬಾಲ ಕಾಣೆಯಾಗುವ ಈ ಹಂತದಲ್ಲಿ ಕಾಲುಗಳಿಂದ ಚಲನೆಯು ಇನ್ನೂ ಆಗತಾನೆ ಸ್ಥಾಪಿತವಾಗಿರತ್ತದೆ.[೪೩]
ರೂಪಾಂತರದ ನಂತರ ಸಣ್ಣ ಮರಿಗಳು ಭೂಮಿಗೆ ನೆಲೆಸಲು ಹೋಗ ಬಹುದು ಅಥವಾ ನೀರಿನಲ್ಲಿಯೇ ಉಳಿದುಕೊಳ್ಳ ಬಹುದು. ಬಹುತೇಕ ಎಲ್ಲಾ ಕಪ್ಪೆಗಳೂ ಮಾಂಸಾಹಾರಿಗಳು ಅವು ಅಕಶೇರುಕ ಸಂಧಿಪದಿ, ಹುಳಗಳು, ಬಸವನ ಹುಳು, ಗೊಂಡೆಹುಳಗಳನ್ನು ಬೇಟೆಯಾಡುತ್ತವೆ. ಕೆಲವು ದೊಡ್ಡ ಕಪ್ಪೆಗಳು ಇತರ ಕಪ್ಪೆಗಳನ್ನು ಮತ್ತು ಸಸ್ತನಿ, ಮೀನುಗಳನ್ನೂ ತಿನ್ನಬಲ್ಲವು. ಕೆಲವು ಕಪ್ಪೆಗಳು ಅಂಟಾದ ನಾಲಿಗೆಯಿಂದ ವೇಗವಾಗಿ ಚಲಿಸುವ ಬೇಟೆಗಳನ್ನು ಹಿಡಿಯುತ್ತವೆ ಮತ್ತು ಇನ್ನೂ ಕೆಲವು ತಿನ್ನಲು ಅವುಗಳ ಮುಂಗಾಲಿನಿಂದ ಆಹಾರವನ್ನು ತಿನ್ನುತ್ತವೆ. ಕೆಲವೇ ಕೆಲವು ಸಸ್ಯಹಾರವನ್ನೂ ತಿನ್ನುವ ಕಪ್ಪೆಗಳಿವೆ. ಕ್ಸಿನೊಹೈಲ ಟ್ರಂಕೇಟ ಭಾಗಶಹ ಸಸ್ಯಾಹಾರಿ ಅದರ ಆಹಾರದ ದೊಡ್ಡ ಭಾಗ ಹಣ್ಣುಗಳಾಗಿವೆ.[೪೪] ವಯಸ್ಕ ಕಪ್ಪೆಗಳು ದೊಡ್ಡ ಬೆಂಕಿಮೊಸಳೆ, ಹಾವು, ಸ್ಕಂಕ್ ಹಲ್ಲಿ ಮತ್ತು ಇತರ ಪ್ರಾಣಿಗಳಿಗೆ ಆಹಾರವಾಗ ಬಲ್ಲವು.
ವನ್ಯ ಸ್ಥಿತಿಯಲ್ಲಿ ಕಪ್ಪೆಗಳು ಎಷ್ಟು ಕಾಲ ಬದುಕುತ್ತವೆ ಎಂದು ತಿಳಿದಿಲ್ಲ ಆದರೆ ಅವು ಹಲವು ವರುಷಗಳೇ ಜೀವಿಸ ಬಲ್ಲವು. ಸ್ಕೆಲೆಟೊಕ್ರೊನಾಲಜಿ ಅಥವಾ ಅಸ್ತಿಪಂಜರಕಾಲಗಣನೆಯ ಪದ್ಧತಿಯ ಪ್ರಕಾರ ಬೆಟ್ಟದ ಹಳಿದ ಕಾಲುಗಳ ಕಪ್ಪೆ (ರಾನ ಮ್ಯೂಕೊಸ) ಅದರ ಗೊದಮೊಟ್ಟೆಯ ಮರಿಯ ನಾಲ್ಕು ವರುಷದ ಆಯುಶ್ಯವನ್ನೂ ಗಣನೆಗೆ ತೆಗೆದುಕೊಂಡು 14 ವರುಷ ಎಂದು ಅಂದಾಜಿಸಲಾಗಿದೆ.[೪೫] ಸೆರೆಯ ಸ್ಥಿತಿಯಲ್ಲಿ ಕೆಲವು ಕಪ್ಪೆಗಳು 40 ವರುಷ ಬದುಕಿದ ದಾಖಲೆ ಇದೆ.
ಕಪ್ಪೆಯಲ್ಲಿ ಸಂತತಿಯ ಆರೈಕೆಯ ಬಗೆಗೆ ಸರಿಯಾಗಿ ತಿಳಿಯದಿದ್ದಾಗ್ಯೂ ಶೇ 20ರಷ್ಟು ಉಭಯವಾಸಿ ಪ್ರಭೇದಗಳು ಒಂದಲ್ಲ ಒಂದು ರೀತಿಯ ಸಂತತಿಯ ಆರೈಕೆಯಲ್ಲಿ ತೊಡುಗುತ್ತವೆ. ಕಪ್ಪೆಗಳಲ್ಲಿನ ಸಂತತಿಯ ಆರೈಕೆಯ ವಿಕಾಸಕ್ಕೂ ಅವುಗಳು ಸಂತಾನಾಭಿವೃದ್ದಿ ಮಾಡುವ ಜಲರಾಶಿಯ ಗಾತ್ರಕ್ಕೂ ಸಂಬಂಧಿಸಿದೆ. ಕಡಿಮೆ ಜಲರಾಶಿಯಲ್ಲಿ ಸಂತಾನಾಭಿವೃದ್ಧಿ ಮಾಡುತ್ತಿದ್ದಲ್ಲಿ ತಂದೆತಾಯಿ ಆರೈಕೆ ವರ್ತನೆ ಹೆಚ್ಚು ಸಂಕೀರ್ಣವಾಗುತ್ತದೆ.[೪೬] ಪರಭಕ್ಷಗಳ ಹಾವಳಿ ದೊಡ್ಡ ಜಲರಾಶಿಯಲ್ಲಿ ಹೆಚ್ಚು ಇರುವ ಕಾರಣಕ್ಕೆ ಕೆಲವು ಕಪ್ಪೆಗಳು ನೆಲದ ಮೇಲೆ ಮೊಟ್ಟೆ ಇಡಲು ಆರಂಭಿಸಿದವು. ಇದು ಆ ಮೊಟ್ಟೆಗಳು ಬದುಕಲು ತೇವಾಂಶವನ್ನು ತಂದೆ ಅಥವಾ ತಾಯಿ ಅಥವಾ ಎರಡೂ ಒದಗಿಸ ಬೇಕಾದ ಅಗತ್ಯವನ್ನು ಉಂಟುಮಾಡಿತು.[೪೭]{ವಿಕಿ ರೆ139} ಅಲ್ಲದೆ ಇವು ಮರಿಯಾದ ಮೇಲೆ ಅವುಗಳನ್ನು ಜಲರಾಶಿಗೆ ವರ್ಗಾಯಿಸ ಬೇಕಾದ ಹೊಣೆಯೂ ಅವುಗಳದಾಯಿತು.[೪೬]
ಸಣ್ಣ ಜಲರಾಶಿಯಲ್ಲಿ ಪರಭಕ್ಷಗಳ ಸಮಸ್ಯೆ ಇಲ್ಲದಿದ್ದಾಗ್ಯೂ ಗೊದಮೊಟ್ಟೆ ಮರಿಗಳ ನಡುವೆ ಸ್ಪರ್ಧೆಯ ಮೇಲೆ ಅವುಗಳ ಬದುಕುವಿಕೆ ನಿಂತಿರುತ್ತದೆ. ಕೆಲವು ಕಪ್ಪೆಗಳ ಪ್ರಭೇದಗಳು ಇದಕ್ಕೆ ಪರಿಹಾರವಾಗಿ ಫೈಟೊಟೆಲಮೆಟ (ಭೂಸಸ್ಯಗಳ ಮೇಲಿರುವ ನೀರು) ಗಳಲ್ಲಿ ಕೆಲವು ಗೊದಮೊಟ್ಟೆ ಮರಿಗಳನ್ನು ಇಡತೊಡಗಿದವು.[೪೮] ಆದರೆ ಇಂತಹ ಸ್ಥಳಗಳಲ್ಲಿ ಸಾಕಷ್ಟು ಪೋಷಕಾಂಶಗಳು ತಂದೆತಾಯಿಗಳ ಸಹಾಯವಿಲ್ಲದೆ ಲಭ್ಯವಾಗುವುದಿಲ್ಲ. ಇದಕ್ಕೆ ಉತ್ತರವಾಗಿ ಕಪ್ಪೆಗಳು ಸಂತತಿಗೆ ಪೋಷಕಾಂಶಗಳಾಗಿ ಪಲವತ್ತಾಗಿರದ ಮೊಟ್ಟೆಗಳನ್ನು ಇಡತೊಡಗಿದವು.[೪೬] ಸ್ಟ್ರಾಬೆರ್ರಿ ವಿಷ ಸೂಜಿ ಕಪ್ಪೆ (ಉಫಗ ಪುಮಿಲಿಯೊ) ಅಡವಿಯ ಅಂಗಳದಲ್ಲಿ ಮೊಟ್ಟೆ ಇಡುತ್ತದೆ. ಗಂಡುಕಪ್ಪೆ ಅವುಗಳನ್ನು ಪರಭಕ್ಷಗಳಿಂದ ರಕ್ಷಿಸುತ್ತದೆ ಮತ್ತು ತನ್ನ ಮಲಕುಳಿಯಲ್ಲಿ[೪೯] ನೀರು ತಂದು ತೇವಾಂಶ ಭರಿತವಾಗಿರುಸುತ್ತದೆ. ಅವು ಮರಿಗಳಾದ ಮೇಲೆ ಹೆಣ್ಣು ಕಪ್ಪೆ ಅವುಗಳನ್ನು ತನ್ನ ಬೆನ್ನಿನ ಮೇಲೆ ಒಯ್ದು ಫೈಟೊಟೆಲಮೆಟ ನೀರಿನ ರಾಶಿಯಲ್ಲಿ ಪ್ರತಿಯೊಂದರಲ್ಲೂ ಒಂದು ಮರಿಯಂತೆ ಬಿಡುತ್ತದೆ. ಹೆಣ್ಣು ಕಪ್ಪೆ ಈ ಮರಿಗಳು ರೂಪಾಂತರ ಗೊಳ್ಳುವವರೆಗೂ ಅಲ್ಲಿಗೆ ಬೇಟಿಕೊಟ್ಟು ಒಂದು ಅಥವಾ ಎರಡು ಪಲವತ್ತಾಗಿರದ ಮೊಟ್ಟೆಗಳನ್ನು ಆಹಾರವಾಗಿ ಕೊಡುತ್ತಿರುತ್ತದೆ.[೫೦] ಸಾಮಾನ್ಯ ಸೂಲಗಿತ್ತಿ ನೆಲಗಪ್ಪೆಯ (ಅಲೈಟಸ್ ಒಬ್ಸ್ಟೆಟ್ರಿಶಿಯನ್ಸ್) ಗಂಡು ಮೊಟ್ಟೆಗಳನ್ನು ತನ್ನ ಹಿಂಗಾಲಿಗೆ ಅಂಟಿಸಿಕೊಂಡು ಓಡಾಡುತ್ತದೆ. ಒಣ ಹವಮಾನದಲ್ಲಿ ಕೆರೆಯಲ್ಲಿ ಮುಳುಗುವ ಮೂಲಕ ತೇವಾಂಶಭರಿತವಾಗಿರುವಂತೆ ನೋಡಿಕೊಳ್ಳುತ್ತದೆ ಮತ್ತು ಚೌಗು ಪ್ರದೇಶದ ಸಸ್ಯಗಳ ಮೂಲಕ ಹಾಯುವಾಗ ತೀರ ಹೆಚ್ಚು ತೇವಾಂಶವಾಗದಂತೆ ಹಿಂಬದಿಯನ್ನು ಮೇಲೆಕ್ಕೆ ಇರಿಸುತ್ತದೆ. ಮೂರರಿಂದ ಆರು ವಾರಗಳ ನಂತರ ಕೆರೆಗೆ ಹೋಗಿ ಮೊಟ್ಟೆಗಳು ಮರಿಗಳಾಗುವಂತೆ ನೋಡಿಕೊಳ್ಳುತ್ತದೆ.[೫೧]
ಕಪ್ಪೆಗಳು ಗಾತ್ರದಲ್ಲಿ ಸಣ್ಣವೂ, ನಿಧಾನ ಚಲನೆಯ ಜೀವಿಗಳೂ, ಮುಳ್ಳು, ಉಗುರು, ಕೊರೆಹಲ್ಲಿನಂತಹ ಯಾವುದೇ ರಕ್ಷಣೆಯಿಲ್ಲದ ಜೀವಿಗಳಂತೆ ಕಾಣುತ್ತವೆ. ಆದರೆ ಅವು ಹಲವು ರೀತಿಯ ರಕ್ಷಣೆಯ ಹೊಂದಾಣಿಕೆಗಳನ್ನು ಒಳಗೊಂಡಿವೆ. ಹಲವು ಕಪ್ಪೆಗಳು ಛದ್ಮನೆ ತಂತ್ರ ಬಳಸುತ್ತಿದ್ದು ಚಲಿಸದ ಕಪ್ಪೆಯನ್ನು ಗುರುತಿಸಲಾರದಷ್ಟು ಅವುಗಳ ಬಣ್ಣ ಸುತ್ತಲಿನ ಬಣ್ಣದಲ್ಲಿ ಕರಗಿಹೋಗಿರುತ್ತದೆ. ಕೆಲವು ದೊಡ್ಡ ಜಿಗಿತದಲ್ಲಿ ಹಾರಬಲ್ಲವು, ಬಹಳಷ್ಟು ಸಲ ತಪ್ಪಿಸಿಕೊಳ್ಳಲು ನೇರವಾಗಿ ನೀರಿಗೆ ಜಿಗಿಯ ಬಲ್ಲವು. ಇನ್ನೂ ಹಲವು ಭಿನ್ನರೀತಿಯ ಹೊಂದಾಣಿಕೆಗಳನ್ನು ಕಂಡುಕೊಂಡಿವೆ.[೩೫]
ಹಲವು ಕಪ್ಪೆಗಳ ಚರ್ಮವು ಸ್ವಲ್ಪಮಟ್ಟಿಗೆ ವಿಷಕಾರಿಯಾದ ಬಫೊಟಾಕ್ಸಿನ್ ಎಂದು ಕರೆಯಲಾದ ಪದಾರ್ಥಗಳನ್ನು ಹೊಂದಿದ್ದು ಇದು ಪರಭಕ್ಷಕಗಳಿಗೆ ಅಹಿತಕಾರಿಯಾಗಿರುತ್ತದೆ. ಬಹಳಷ್ಟು ನೆಲಗಪ್ಪೆಗಳು ಮತ್ತು ಕೆಲವು ಕಪ್ಪೆಗಳಲ್ಲಿ ತಲೆಯಲ್ಲಿ ಕಣ್ಣಿನ ಹಿಂದೆ ಪ್ಯಾರೊಟಾಯ್ಡ್ ಗ್ರಂಥಿಗಳೆಂದು ಕರೆಯಲಾದ ದೊಡ್ಡ ವಿಷ ಗ್ರಂಥಿಗಳು ಅಲ್ಲದೆ ಇತರ ಶ್ರವಿಸುವ ಗ್ರಂಥಿಗಳೂ ಇರುತ್ತವೆ. ಈ ಗ್ರಂಥಿಗಳು ಅಂಟಿನಂತಹ ಪದಾರ್ಥಗಳನ್ನೂ ಮತ್ತು ವಿಷವನ್ನೂ ಶ್ರವಿಸುತ್ತವೆ. ಅಂಟಿನ ಪದಾರ್ಥವು ಕಪ್ಪೆಗೆ ಜಾರಿ ತಪ್ಪಿಸಿಕೊಳ್ಳಲು ಸಹಾಯ ಮಾಡುತ್ತದೆ. ಶ್ರವಿಸುವ ಗ್ರಂಥಿಯ ಪರಿಣಾಮ ತಕ್ಷಣವಾಗಿದ್ದರೆ ಕಪ್ಪೆ ತಪ್ಪಿಸಿಕೊಳ್ಳ ಬಹುದು ಮತ್ತು ಅದು ನಿಧಾನವಾಗಿದ್ದರೆ ಮುಂದೆ ಆ ಪರಭಕ್ಷಕ ನಿರ್ದಿಷ್ಟ ಪ್ರಭೇದವನ್ನು ಮುಂದೆ ತಿನ್ನದಂತಿರುವುದನ್ನು ಕಲಿಯ ಬಹುದು.[೫೨] ವಿಷಪೂರಿತ ಕಪ್ಪೆಗಳು ತಾವು ವಿಷ ಹೊಂದಿರುವುದನ್ನು ಎದ್ದು ಕಾಣುವ ಬಣ್ಣಗಳ ಮೂಲಕ ತೊರಿಸಿಕೊಳ್ಳುತ್ತವೆ. ಇದನ್ನು ಅಪೊಸೆಮಿಟಿಸಂ[೫೩] ಹೊಂದಾಣಿಕೆ ತಂತ್ರ ಎಂದು ಕರೆಯಲಾಗುತ್ತದೆ. ಸಾಮಾನ್ಯವಾಗಿ ಈ ಕಪ್ಪೆಗಳು ಕೆಂಪು, ಕಿತ್ತಳೆ, ಹಳದಿ ಬಣ್ಣ ಮತ್ತು ಕೆಲವೊಮ್ಮೆ ಕಪ್ಪು ಪಟ್ಟಿಗಳನ್ನು ಹೊಂದಿರುತ್ತವೆ. ಅಲ್ಲೊಬೇಟಸ್ ಜಪಾರೊ ವಿಷಪೂರಿತವಲ್ಲ. ಆದರೆ ಅದು ಬದುಕಿರುವ ವ್ಯಾಪ್ತಿಯಲ್ಲಿನ ಎರಡು ವಿಷಪೂರಿತ ಪ್ರಭೇದಗಳ ಬಣ್ಣಗಳನ್ನು ಅನುಕರಿಸುವ ಮೂಲಕ ಪರಭಕ್ಷಗಳನ್ನು ಮೋಸಗೊಳಿಸುತ್ತದೆ.[೫೪] ವಿಷ ಸೂಜಿ ಕಪ್ಪೆಗಳು ವಿಶೇಷವಾಗಿ ವಿಷಪೂರಿತ. ದಕ್ಷಿಣ ಅಮೆರಿಕದ ಸ್ಥಳೀಯರು ಇವುಗಳ ವಿಷವನ್ನು ತೆಗೆದು ಬೇಟೆಗೆ ಬಳಸುತ್ತಾರೆ.[೫೫]
ಕೆಲವು ಕಪ್ಪೆಗಳು ರಕ್ಷಣೆಗೆ ವಂಚನೆಯನ್ನು ಬಳಸುತ್ತವೆ. ಯುರೋಪಿನ ಸಾಮಾನ್ಯ ನೆಲಗಪ್ಪೆ ತನ್ನ ದೇಹವನ್ನು ದಪ್ಪ ಮಾಡಿಕೊಂಡು, ಹಿಂಗಾಲುಗಳನ್ನು ಮೇಲಕ್ಕೆತ್ತಿ ನಿಲ್ಲುತ್ತದೆ.[೫೬] ಕೆಲವು ಕಪ್ಪೆಗಳು ದೊಡ್ಡ ಸದ್ದು ಮಾಡುವ ಮೂಲಕ ಪರಭಕ್ಷಕವನ್ನು ಗಾಬರಿ ಬೀಳಿಸಲು ಯತ್ನಿಸುತ್ತವೆ.
ಕಪ್ಪೆ ಒಂದು ಉಭಯವಾಸಿ ಅನುರ ಗಣಕ್ಕೆ (ಆರ್ಡರ್) ಸೇರಿದ ಬಹುತೇಕ ಮಾಂಸಾಹಾರಿ ಜೀವಿ. ಇದಕ್ಕೆ ಬಾಲವಿರುವುದಿಲ್ಲ. ಕಪ್ಪೆಗಳು ಸಾಮಾನ್ಯವಾಗಿ ನೀರಿನಲ್ಲಿ ಮೊಟ್ಟೆ ಇಡುತ್ತವೆ ಮತ್ತು ಮೊಟ್ಟೆಗಳು ಗೊದಮೊಟ್ಟೆ ಮರಿಗಳಾಗಿ (ಟಾಡ್ಪೋಲ್) ಹೊರಹೊಮ್ಮುತ್ತವೆ. ಈ ಗೊದಮೊಟ್ಟೆ ಮರಿಗಳು ಕಪ್ಪೆಮರಿಗಳಾಗಿ ರೂಪಾಂತರ ಹೊಂದುವುದರೊಂದಿಗೆ ಅವುಗಳ ಜೀವನ ಚಕ್ರ ಪೂರ್ಣವಾಗುತ್ತದೆ. ಕೆಲವೊಂದು ಭೂಮಿಯ ಮೇಲೆ ಮೊಟ್ಟೆಗಳನ್ನಿಡುತ್ತವೆ.
ಕಪ್ಪೆಗಳು ಸಿಹಿನೀರಿನಲ್ಲಿ ಅಲ್ಲದೆ ನೆಲದ ಮೇಲೂ ಬದುಕುತ್ತವೆ. ಕೆಲವು ಕಪ್ಪೆಗಳು ನೆಲದಾಳದಲ್ಲಿ ಮತ್ತು ಮರಗಳಲ್ಲಿ ಬದುಕಲು ಹೊಂದಿಕೊಂಡಿವೆ. ಇವು ಶೀತರಕ್ತದ ಪ್ರಾಣಿಗಳು. ಬಿಸುಪು ಪಡೆಯಲು ಇವು ಸೂರ್ಯನ ಬೆಳಕಿಗೊ ಅಥವಾ ಬಿಸುಪಿನ ಮೇಲ್ಮೈಗೊ ಹೋಗುತ್ತವೆ. ಹೆಚ್ಚು ಬಿಸಿಯಾದಾಗ ಅವು ನೆರಳಿಗೆ ಸರಿಯುತ್ತವೆ ಅಥವಾ ಚರ್ಮದ ಕನಿಷ್ಠ ಪ್ರದೇಶವನ್ನು ಗಾಳಿಗೆ ಒಡ್ಡುವ ಮೂಲಕ ತೇವಾಂಶ ಕಳೆದುಹೋಗುವಿಕೆಯನ್ನು ಕಡಿಮೆ ಮಾಡಲು ಪ್ರಯತ್ನಿಸುತ್ತವೆ.
ဖား သည် ကုန်းနေရေနေသတ္တဝါဖြစ်သည်။ ရှည်လျားသော နောက်ခြေ၊ တိုတောင်းသောခန္ဓာကိုယ်၊ ဆက်စပ်နေလောလက်ချောင်းနှင့် ခြေချောင်းများ၊ ပြူးကျယ်နေသောမျက်လုံးနှင့် အမြီးမရှိခြင်းတို့ သည် ဖား၏ ထင်ရှားသော လက္ခဏာများဖြစ်သည်။ ဖားများသည် ရေတစ်ဝက် ကုန်းတစ်ဝက်နေတတ်သော သဘာဝရှိပြီး ကုန်းပေါ်တွင် ခုန်ခြင်း တွယ်ကပ်ခြင်းတို့ဖြင့် ရွေ့လျားသွားလာကြသည်။ သူတို့သည် ပုံမှန်အားဖြင့် ဥများကို ရေအိုင်ငယ်လေးများ၊ ရေအိုင်များနှင့် ကန်များတွင် ဥတတ်ကြသည်။ သူတို့၏ အကောင်လောင်း(larvae) များကို ဖားလောင်းများ(tadpoles) ဟုခေါ်ကြပြီး ပါးဟက်များရှိကာ ရေထဲတွင် ကြီးထွားကြသည်။ ဖားအကောင်ကြီးများသည် အသားစားသတ္တဝါများဖြစ်ပြီး သူတို့၏ အစာမှာ arthropods, annelids နှင့် gastropods တို့ဖြစ်သည်။ ဖားများကို နေ့ဖြစ်စေ ညဖြစ်စေ သူတို့၏အသံဖြင့် သတိပြု နိုင်ပြီး အထူးသဖြင့် မိတ်လိုက်သည့်ရာသီတွင် ပို၍ ကြားရလေ့ရှိသည်။
ကမ္ဘာတွင် မှတ်တမ်းမတင်ရသေးသော ဖားမျိုးစိတ် အသစ်နှစ်မျိုးကို ပခုက္ကူမြို့နယ်၊ ပေါက်အင်းရွာနှင့် ရေစကြိုမြို့နယ်၊ ကန်ပေါက်ရွာတို့မှ တွေ့ရှိခဲ့သည်။ ထိုတွေ့ရှိချက်အသေးစိတ်ကို International peer review journal(Zoological Research-ZR - journal) Volume 40 Issue 4 တွင် ၂၀၁၉ ခုနှစ်၊ ဇူလိုင်လ (၁၈)ရက်နေ့က ဖော်ပြကာ အသိအမှတ်ပြုခဲ့သည်။
အဆိုပါ မျိုးစိတ်အသစ်များကို ပခုက္ကု ဧရာဝတီမြစ်ကူးတံတားအနီး ပေါက်အင်းမှာ တွေ့ရှိခဲ့၍ မျိုးစိတ်အသစ်အမည်ကို Microhyla Irrawaddy ဟု၎င်း၊ ကန်ပေါက်ရွာအနီးမှ တွေ့ရှိခဲ့သော မျိုးစိတ်သစ်ကို Microhyla fodiens ဟု၎င်းအသီးသီးအမည်ပေးခဲ့လေသည်။ တွင်းအောင်းသဲဖားအမျိုးအစားဖြစ်သည်။ အရွယ်အစားမှာ လက်သည်းခွန် အရွယ်အစားမျှ ဖြစ်ပြီး အရွယ်ရောက်အကောင်သည် ၅ စင်တီမီတာခန့်သာရှိ၍ ခြေလေးချောင်း သတ္တဝါများတွင် အရွယ်သေးငယ်လွန်းသည်ဟု သိရသည်။ ဒေသအခေါ်အဝေါ်မှာ ဖလတက်၊ ဖလက်နီဟု အမျိုးမျိုး ခေါ်ကြသည်။
ဖား သည် ကုန်းနေရေနေသတ္တဝါဖြစ်သည်။ ရှည်လျားသော နောက်ခြေ၊ တိုတောင်းသောခန္ဓာကိုယ်၊ ဆက်စပ်နေလောလက်ချောင်းနှင့် ခြေချောင်းများ၊ ပြူးကျယ်နေသောမျက်လုံးနှင့် အမြီးမရှိခြင်းတို့ သည် ဖား၏ ထင်ရှားသော လက္ခဏာများဖြစ်သည်။ ဖားများသည် ရေတစ်ဝက် ကုန်းတစ်ဝက်နေတတ်သော သဘာဝရှိပြီး ကုန်းပေါ်တွင် ခုန်ခြင်း တွယ်ကပ်ခြင်းတို့ဖြင့် ရွေ့လျားသွားလာကြသည်။ သူတို့သည် ပုံမှန်အားဖြင့် ဥများကို ရေအိုင်ငယ်လေးများ၊ ရေအိုင်များနှင့် ကန်များတွင် ဥတတ်ကြသည်။ သူတို့၏ အကောင်လောင်း(larvae) များကို ဖားလောင်းများ(tadpoles) ဟုခေါ်ကြပြီး ပါးဟက်များရှိကာ ရေထဲတွင် ကြီးထွားကြသည်။ ဖားအကောင်ကြီးများသည် အသားစားသတ္တဝါများဖြစ်ပြီး သူတို့၏ အစာမှာ arthropods, annelids နှင့် gastropods တို့ဖြစ်သည်။ ဖားများကို နေ့ဖြစ်စေ ညဖြစ်စေ သူတို့၏အသံဖြင့် သတိပြု နိုင်ပြီး အထူးသဖြင့် မိတ်လိုက်သည့်ရာသီတွင် ပို၍ ကြားရလေ့ရှိသည်။
Cangguëk nakeuh saboh meunatang nyang galak duek bak duwa teumpat, jeuet di meu udép lam ië atawa ateueh darat, cangguëk nakeuh meunatang nyang ji meugrak deungon cara ji meulumpat, kayém jai di meunatang nyan na lam paya, ureuëng Acèh kayém geunguy cangguëk keu eumpeuen keumawé lam paya. Cangguëk saboh meunatang nyang ji meu udép nobak boh cangguëk jeut keu aneuk abiëk,lheuëh nyan teuma jeuet keu cangguëk dara, dudoë jeuet keu cangguëk chi'.
Datya (frog in English) imhuka iri pamupanda dzehugarohuviri. Datya rinogara mumvura uye rinogarazve padunhu. Kune dzimwe nzvimbo datya guru rinonzi dzetse rinodyiwa nyama.

Datya (frog in English) imhuka iri pamupanda dzehugarohuviri. Datya rinogara mumvura uye rinogarazve padunhu. Kune dzimwe nzvimbo datya guru rinonzi dzetse rinodyiwa nyama.
Muchimbo, buruvuru kana bururu (tadpole) apa kureva nyungurwa. Mamwe mazita anopiwa anoti, dafi; dawa; matawa; mutawa; jedye, zura kana kuti chura. Mwana wedatya anonzi buruvuru kana zunguzurwa.Goep dwg cungj doenghduz.
Katak inggih punika silih sinunggil soroh beburon. Katak madué batis patpat. Panak katak madan becing-becing. Becing-becing puniki rupannyané masaih tekén bé. Rikala masan ujan, makéh wénten katak sané mamanakan tur mataluh di yéhé. Taluh katak marupa taluh sané kakaput olih lendir. Taluh-taluh punika sané lakar dados becing-becing. Wénten makéh soroh katak, minakadi dongkang, enggung, émplégan, miwah sané lianan.
Katak inggih punika silih sinunggil soroh beburon. Katak madué batis patpat. Panak katak madan becing-becing. Becing-becing puniki rupannyané masaih tekén bé. Rikala masan ujan, makéh wénten katak sané mamanakan tur mataluh di yéhé. Taluh katak marupa taluh sané kakaput olih lendir. Taluh-taluh punika sané lakar dados becing-becing. Wénten makéh soroh katak, minakadi dongkang, enggung, émplégan, miwah sané lianan.
Àwọn kọ̀nkọ̀
Puut'n (Anura) bin eên van de drie groep'n van amfibieën, neffen de salamanders (Caudata) en de wurmsalamanders (Gymnophiona).
Puut'n ein vier poôt'n mae gin staert en verschill'n hiermee van de meêste aore amfibieën. Alle puut'n ein 'n ofgeplat, peervurmig lief en uutpulende oôg'n. De kop en bek bin breêd, de lange achterpoôt'n sterk gespierd.
Puut'n eet'n vele soôrt'n proôien, meêstal kleine beêst'n as insect'n en aore ongewerveld'n. Z' ein echter ok vele viand'n zoas vissen, veugels, zoogdieren en reptielen.
Puut'n komm'n vriewel waereldwied voe, zoôwel in tropische, subtropische as gemaotigde gebied'n, en zelfs in zeêr koude gebied'n zoas bie de Noordpool. In Europa leev'n oengeveer 50 soôrt'n waovan ok 'n stik of wa in Nederland, waor a vriewel alle soôrt'n bedreigd zien en beschermd.
Rah (Af-Ingiriis: frog; Af-Carabi: ضفدع) (magaca Sayniska: Anura) waa xayawaan ka mid ah beribiyood kaasi oo ku nool biyaha macaan iyo meelo ka mid ah dhulka.
Ph́id, Пхьид — Пхьид олу нохчийн маттахь (Оьрсийн маттахь - лягушка).
A frog is any member of a diverse and largely carnivorous group of short-bodied, tailless amphibians composing the order Anura[1] (ανοὐρά, literally without tail in Ancient Greek). The oldest fossil "proto-frog" Triadobatrachus is known from the Early Triassic of Madagascar, but molecular clock dating suggests their split from other amphibians may extend further back to the Permian, 265 million years ago. Frogs are widely distributed, ranging from the tropics to subarctic regions, but the greatest concentration of species diversity is in tropical rainforest. Frogs account for around 88% of extant amphibian species. They are also one of the five most diverse vertebrate orders. Warty frog species tend to be called toads, but the distinction between frogs and toads is informal, not from taxonomy or evolutionary history.
An adult frog has a stout body, protruding eyes, anteriorly-attached tongue, limbs folded underneath, and no tail (the tail of tailed frogs is an extension of the male cloaca). Frogs have glandular skin, with secretions ranging from distasteful to toxic. Their skin varies in colour from well-camouflaged dappled brown, grey and green to vivid patterns of bright red or yellow and black to show toxicity and ward off predators. Adult frogs live in fresh water and on dry land; some species are adapted for living underground or in trees.
Frogs typically lay their eggs in water. The eggs hatch into aquatic larvae called tadpoles that have tails and internal gills. They have highly specialized rasping mouth parts suitable for herbivorous, omnivorous or planktivorous diets. The life cycle is completed when they metamorphose into adults. A few species deposit eggs on land or bypass the tadpole stage. Adult frogs generally have a carnivorous diet consisting of small invertebrates, but omnivorous species exist and a few feed on plant matter. Frog skin has a rich microbiome which is important to their health. Frogs are extremely efficient at converting what they eat into body mass. They are an important food source for predators and part of the food web dynamics of many of the world's ecosystems. The skin is semi-permeable, making them susceptible to dehydration, so they either live in moist places or have special adaptations to deal with dry habitats. Frogs produce a wide range of vocalizations, particularly in their breeding season, and exhibit many different kinds of complex behaviors to attract mates, to fend off predators and to generally survive.
Frogs are valued as food by humans and also have many cultural roles in literature, symbolism and religion. They are also seen as environmental bellwethers, with declines in frog populations often viewed as early warning signs of environmental damage. Frog populations have declined significantly since the 1950s. More than one third of species are considered to be threatened with extinction and over 120 are believed to have become extinct since the 1980s. The number of malformations among frogs is on the rise and an emerging fungal disease, chytridiomycosis, has spread around the world. Conservation biologists are working to understand the causes of these problems and to resolve them.
The use of the common names frog and toad has no taxonomic justification. From a classification perspective, all members of the order Anura are frogs, but only members of the family Bufonidae are considered "true toads". The use of the term frog in common names usually refers to species that are aquatic or semi-aquatic and have smooth, moist skins; the term toad generally refers to species that are terrestrial with dry, warty skins.[2][3] There are numerous exceptions to this rule. The European fire-bellied toad (Bombina bombina) has a slightly warty skin and prefers a watery habitat[4] whereas the Panamanian golden frog (Atelopus zeteki) is in the toad family Bufonidae and has a smooth skin.[5]
The origin of the order name Anura—and its original spelling Anoures—is the Ancient Greek "alpha privative" prefix ἀν- (an- from ἀ- before a vowel) 'without',[6] and οὐρά (ourá) 'animal tail'.[7] meaning "tailless". It refers to the tailless character of these amphibians.[8][9][10]
The origins of the word frog are uncertain and debated.[11] The word is first attested in Old English as frogga, but the usual Old English word for the frog was frosc (with variants such as frox and forsc), and it is agreed that the word frog is somehow related to this. Old English frosc remained in dialectal use in English as frosh and frosk into the nineteenth century,[12] and is paralleled widely in other Germanic languages, with examples in the modern languages including German Frosch, Norwegian frosk, Icelandic froskur, and Dutch (kik)vors.[11] These words allow reconstruction of a Common Germanic ancestor *froskaz.[13] The third edition of the Oxford English Dictionary finds that the etymology of *froskaz is uncertain, but agrees with arguments that it could plausibly derive from a Proto-Indo-European base along the lines of *preu, meaning 'jump'.[11]
How Old English frosc gave rise to frogga is, however, uncertain, as the development does not involve a regular sound-change. Instead, it seems that there was a trend in Old English to coin nicknames for animals ending in -g, with examples—themselves all of uncertain etymology—including dog, hog, pig, stag, and (ear)wig. Frog appears to have been adapted from frosc as part of this trend.[11]
Meanwhile, the word toad, first attested as Old English tādige, is unique to English and is likewise of uncertain etymology.[14] It is the basis for the word tadpole, first attested as Middle English taddepol, apparently meaning 'toad-head'.[15]
About 88% of amphibian species are classified in the order Anura.[16] These include over 7,500 species[1] in 55 families, of which the Craugastoridae (850 spp.), Hylidae (724 spp.), Microhylidae (688 spp.), and Bufonidae (621 spp.) are the richest in species.[17]

The Anura include all modern frogs and any fossil species that fit within the anuran definition. The characteristics of anuran adults include: 9 or fewer presacral vertebrae, the presence of a urostyle formed of fused vertebrae, no tail, a long and forward-sloping ilium, shorter fore limbs than hind limbs, radius and ulna fused, tibia and fibula fused, elongated ankle bones, absence of a prefrontal bone, presence of a hyoid plate, a lower jaw without teeth (with the exception of Gastrotheca guentheri) consisting of three pairs of bones (angulosplenial, dentary, and mentomeckelian, with the last pair being absent in Pipoidea),[18] an unsupported tongue, lymph spaces underneath the skin, and a muscle, the protractor lentis, attached to the lens of the eye.[19] The anuran larva or tadpole has a single central respiratory spiracle and mouthparts consisting of keratinous beaks and denticles.[19]

Frogs and toads are broadly classified into three suborders: Archaeobatrachia, which includes four families of primitive frogs; Mesobatrachia, which includes five families of more evolutionary intermediate frogs; and Neobatrachia, by far the largest group, which contains the remaining families of modern frogs, including most common species throughout the world. The suborder Neobatrachia is further divided into the two superfamilies Hyloidea and Ranoidea.[20] This classification is based on such morphological features as the number of vertebrae, the structure of the pectoral girdle, and the morphology of tadpoles. While this classification is largely accepted, relationships among families of frogs are still debated.[21]
Some species of anurans hybridize readily. For instance, the edible frog (Pelophylax esculentus) is a hybrid between the pool frog (P. lessonae) and the marsh frog (P. ridibundus).[22] The fire-bellied toads Bombina bombina and B. variegata are similar in forming hybrids. These are less fertile than their parents, giving rise to a hybrid zone where the hybrids are prevalent.[23]
The origins and evolutionary relationships between the three main groups of amphibians are hotly debated. A molecular phylogeny based on rDNA analysis dating from 2005 suggests that salamanders and caecilians are more closely related to each other than they are to frogs and the divergence of the three groups took place in the Paleozoic or early Mesozoic before the breakup of the supercontinent Pangaea and soon after their divergence from the lobe-finned fishes. This would help account for the relative scarcity of amphibian fossils from the period before the groups split.[24] Another molecular phylogenetic analysis conducted about the same time concluded that lissamphibians first appeared about 330 million years ago and that the temnospondyl-origin hypothesis is more credible than other theories. The neobatrachians seemed to have originated in Africa/India, the salamanders in East Asia and the caecilians in tropical Pangaea.[25] Other researchers, while agreeing with the main thrust of this study, questioned the choice of calibration points used to synchronise the data. They proposed that the date of lissamphibian diversification should be placed in the Permian, rather less than 300 million years ago, a date in better agreement with the palaeontological data.[26] A further study in 2011 using both extinct and living taxa sampled for morphological, as well as molecular data, came to the conclusion that Lissamphibia is monophyletic and that it should be nested within Lepospondyli rather than within Temnospondyli. The study postulated that Lissamphibia originated no earlier than the late Carboniferous, some 290 to 305 million years ago. The split between Anura and Caudata was estimated as taking place 292 million years ago, rather later than most molecular studies suggest, with the caecilians splitting off 239 million years ago.[27]
In 2008, Gerobatrachus hottoni, a temnospondyl with many frog- and salamander-like characteristics, was discovered in Texas. It dated back 290 million years and was hailed as a missing link, a stem batrachian close to the common ancestor of frogs and salamanders, consistent with the widely accepted hypothesis that frogs and salamanders are more closely related to each other (forming a clade called Batrachia) than they are to caecilians.[28][29] However, others have suggested that Gerobatrachus hottoni was only a dissorophoid temnospondyl unrelated to extant amphibians.[30]
Salientia (Latin salire (salio), "to jump") is the name of the total group that includes modern frogs in the order Anura as well as their close fossil relatives, the "proto-frogs" or "stem-frogs". The common features possessed by these proto-frogs include 14 presacral vertebrae (modern frogs have eight or 9), a long and forward-sloping ilium in the pelvis, the presence of a frontoparietal bone, and a lower jaw without teeth. The earliest known amphibians that were more closely related to frogs than to salamanders are Triadobatrachus massinoti, from the early Triassic period of Madagascar (about 250 million years ago), and Czatkobatrachus polonicus, from the Early Triassic of Poland (about the same age as Triadobatrachus).[31] The skull of Triadobatrachus is frog-like, being broad with large eye sockets, but the fossil has features diverging from modern frogs. These include a longer body with more vertebrae. The tail has separate vertebrae unlike the fused urostyle or coccyx in modern frogs. The tibia and fibula bones are also separate, making it probable that Triadobatrachus was not an efficient leaper.[31] A 2019 study has noted the presence of Salientia from the Chinle Formation, and suggested that anurans might have first appeared during the Late Triassic.[32]
On the basis of fossil evidence, the earliest known "true frogs" that fall into the anuran lineage proper all lived in the early Jurassic period.[2][33] One such early frog species, Prosalirus bitis, was discovered in 1995 in the Kayenta Formation of Arizona and dates back to the Early Jurassic epoch (199.6 to 175 million years ago), making Prosalirus somewhat more recent than Triadobatrachus.[34] Like the latter, Prosalirus did not have greatly enlarged legs, but had the typical three-pronged pelvic structure of modern frogs. Unlike Triadobatrachus, Prosalirus had already lost nearly all of its tail[35] and was well adapted for jumping.[36] Another Early Jurassic frog is Vieraella herbsti, which is known only from dorsal and ventral impressions of a single animal and was estimated to be 33 mm (1+1⁄4 in) from snout to vent. Notobatrachus degiustoi from the middle Jurassic is slightly younger, about 155–170 million years old. The main evolutionary changes in this species involved the shortening of the body and the loss of the tail. The evolution of modern Anura likely was complete by the Jurassic period. Since then, evolutionary changes in chromosome numbers have taken place about 20 times faster in mammals than in frogs, which means speciation is occurring more rapidly in mammals.[37]
According to genetic studies, the families Hyloidea, Microhylidae, and the clade Natatanura (comprising about 88% of living frogs) diversified simultaneously some 66 million years ago, soon after the Cretaceous–Paleogene extinction event associated with the Chicxulub impactor. All origins of arboreality (e.g. in Hyloidea and Natatanura) follow from that time and the resurgence of forest that occurred afterwards.[38][39]
Frog fossils have been found on all of the earth's continents.[40][41] In 2020, it was announced that 40 million year old helmeted frog fossils had been discovered by a team of vertebrate paleontologists in Seymour Island on the Antarctic Peninsula, indicating that this region was once home to frogs related to those now living in South American Nothofagus forest.[42]
A cladogram showing the relationships of the different families of frogs in the clade Anura can be seen in the table below. This diagram, in the form of a tree, shows how each frog family is related to other families, with each node representing a point of common ancestry. It is based on Frost et al. (2006),[43] Heinicke et al. (2009)[44] and Pyron and Wiens (2011).[45]
Anura Bombianura Costata Pipanura Xenoanura Acosmanura Anomocoela Pelobatoidea Neobatrachia Phthanobatrachia Sooglossoidea Notogaeanura Australobatrachia Nobleoanura Brachycephaloidea (Terrarana) Athesphatanura Leptodactyliformes Agastorophrynia Diphyabatracea Ranoides Allodapanura Afrobatrachia Xenosyneunitanura Laurentobatrachia Natatanura Victoranura Pyxicephaloidea Saukrobatrachia Aglaioanura
Frogs have no tail, except as larvae, and most have long hind legs, elongated ankle bones, webbed toes, no claws, large eyes, and a smooth or warty skin. They have short vertebral columns, with no more than 10 free vertebrae and fused tailbones (urostyle or coccyx).[46] Frogs range in size from Paedophryne amauensis of Papua New Guinea that is 7.7 mm (0.30 in) in snout–to–vent length[47] to the up to 32 cm (13 in) and 3.25 kg (7.2 lb) goliath frog (Conraua goliath) of central Africa.[48] There are prehistoric, extinct species that reached even larger sizes.[49]
The structure of the feet and legs varies greatly among frog species, depending in part on whether they live primarily on the ground, in water, in trees, or in burrows. Frogs must be able to move quickly through their environment to catch prey and escape predators, and numerous adaptations help them to do so. Most frogs are either proficient at jumping or are descended from ancestors that were, with much of the musculoskeletal morphology modified for this purpose. The tibia, fibula, and tarsals have been fused into a single, strong bone, as have the radius and ulna in the fore limbs (which must absorb the impact on landing). The metatarsals have become elongated to add to the leg length and allow frogs to push against the ground for a longer period on take-off. The ilium has elongated and formed a mobile joint with the sacrum which, in specialist jumpers such as ranids and hylids, functions as an additional limb joint to further power the leaps. The tail vertebrae have fused into a urostyle which is retracted inside the pelvis. This enables the force to be transferred from the legs to the body during a leap.[46]

The muscular system has been similarly modified. The hind limbs of ancestral frogs presumably contained pairs of muscles which would act in opposition (one muscle to flex the knee, a different muscle to extend it), as is seen in most other limbed animals. However, in modern frogs, almost all muscles have been modified to contribute to the action of jumping, with only a few small muscles remaining to bring the limb back to the starting position and maintain posture. The muscles have also been greatly enlarged, with the main leg muscles accounting for over 17% of the total mass of frogs.[50]
Many frogs have webbed feet and the degree of webbing is directly proportional to the amount of time the species spends in the water.[51] The completely aquatic African dwarf frog (Hymenochirus sp.) has fully webbed toes, whereas those of White's tree frog (Litoria caerulea), an arboreal species, are only a quarter or half webbed.[52] Exceptions include flying frogs in the Hylidae and Rhacophoridae, which also have fully webbed toes used in gliding.
Arboreal frogs have pads located on the ends of their toes to help grip vertical surfaces. These are not suction pads, the surface consisting instead of columnar cells with flat tops with small gaps between them lubricated by mucous glands. When the frog applies pressure, the cells adhere to irregularities on the surface and the grip is maintained through surface tension. This allows the frog to climb on smooth surfaces, but the system does not function efficiently when the pads are excessively wet.[53]
In many arboreal frogs, a small "intercalary structure" on each toe increases the surface area touching the substrate. Furthermore, many arboreal frogs have hip joints that allow both hopping and walking. Some frogs that live high in trees even possess an elaborate degree of webbing between their toes. This allows the frogs to "parachute" or make a controlled glide from one position in the canopy to another.[54]
Ground-dwelling frogs generally lack the adaptations of aquatic and arboreal frogs. Most have smaller toe pads, if any, and little webbing. Some burrowing frogs such as Couch's spadefoot (Scaphiopus couchii) have a flap-like toe extension on the hind feet, a keratinised tubercle often referred to as a spade, that helps them to burrow.[55]
Sometimes during the tadpole stage, one of the developing rear legs is eaten by a predator such as a dragonfly nymph. In some cases, the full leg still grows, but in others it does not, although the frog may still live out its normal lifespan with only three limbs. Occasionally, a parasitic flatworm (Ribeiroia ondatrae) digs into the rear of a tadpole, causing a rearrangement of the limb bud cells and the frog develops one or more extra legs.[56]

A frog's skin is protective, has a respiratory function, can absorb water, and helps control body temperature. It has many glands, particularly on the head and back, which often exude distasteful and toxic substances (granular glands). The secretion is often sticky and helps keep the skin moist, protects against the entry of moulds and bacteria, and make the animal slippery and more able to escape from predators.[57] The skin is shed every few weeks. It usually splits down the middle of the back and across the belly, and the frog pulls its arms and legs free. The sloughed skin is then worked towards the head where it is quickly eaten.[58]
Being cold-blooded, frogs have to adopt suitable behaviour patterns to regulate their temperature. To warm up, they can move into the sun or onto a warm surface; if they overheat, they can move into the shade or adopt a stance that exposes the minimum area of skin to the air. This posture is also used to prevent water loss and involves the frog squatting close to the substrate with its hands and feet tucked under its chin and body.[59] The colour of a frog's skin is used for thermoregulation. In cool damp conditions, the colour will be darker than on a hot dry day. The grey foam-nest tree frog (Chiromantis xerampelina) is even able to turn white to minimize the chance of overheating.[60]
Many frogs are able to absorb water and oxygen directly through the skin, especially around the pelvic area, but the permeability of a frog's skin can also result in water loss. Glands located all over the body exude mucus which helps keep the skin moist and reduces evaporation. Some glands on the hands and chest of males are specialized to produce sticky secretions to aid in amplexus. Similar glands in tree frogs produce a glue-like substance on the adhesive discs of the feet. Some arboreal frogs reduce water loss by having a waterproof layer of skin, and several South American species coat their skin with a waxy secretion. Other frogs have adopted behaviours to conserve water, including becoming nocturnal and resting in a water-conserving position. Some frogs may also rest in large groups with each frog pressed against its neighbours. This reduces the amount of skin exposed to the air or a dry surface, and thus reduces water loss.[59] Woodhouse's toad (Bufo woodhousii), if given access to water after confinement in a dry location, sits in the shallows to rehydrate.[61] The male hairy frog (Trichobatrachus robustus) has dermal papillae projecting from its lower back and thighs, giving it a bristly appearance. They contain blood vessels and are thought to increase the area of the skin available for respiration.[62]
Some species have bony plates embedded in their skin, a trait that appears to have evolved independently several times.[63] In certain other species, the skin at the top of the head is compacted and the connective tissue of the dermis is co-ossified with the bones of the skull (exostosis).[64][65]
Camouflage is a common defensive mechanism in frogs. Features such as warts and skin folds are usually on ground-dwelling frogs, for whom smooth skin would not provide such effective camouflage. Certain frogs change colour between night and day, as light and moisture stimulate the pigment cells and cause them to expand or contract.[66] Some are even able to control their skin texture.[67] The Pacific tree frog (Pseudacris regilla) has green and brown morphs, plain or spotted, and changes colour depending on the time of year and general background colour.[68] The Wood Frog (Lithobates sylvaticus) uses disruptive coloration including black eye markings similar to voids between leaves, bands of the dorsal skin (dorsolateral dermal plica) similar to a leaf midrib as well as stains, spots & leg stripes similar to fallen leaf features.
Wood Frog (Lithobates sylvaticus) uses disruptive coloration
Pouched frog (Assa darlingtoni) camouflaged against leaf litter.
Like other amphibians, oxygen can pass through their highly permeable skins. This unique feature allows them to remain in places without access to the air, respiring through their skins. Ribs are generally absent, so the lungs are filled by buccal pumping and a frog deprived of its lungs can maintain its body functions without them.[66] The fully aquatic Bornean flat-headed frog (Barbourula kalimantanensis) is the first frog known to lack lungs entirely.[69]
Frogs have three-chambered hearts, a feature they share with lizards. Oxygenated blood from the lungs and de-oxygenated blood from the respiring tissues enter the heart through separate atria. When these chambers contract, the two blood streams pass into a common ventricle before being pumped via a spiral valve to the appropriate vessel, the aorta for oxygenated blood and pulmonary artery for deoxygenated blood.[70]
Some species of frog have adaptations that allow them to survive in oxygen deficient water. The Titicaca water frog (Telmatobius culeus) is one such species and has wrinkly skin that increases its surface area to enhance gas exchange. It normally makes no use of its rudimentary lungs but will sometimes raise and lower its body rhythmically while on the lake bed to increase the flow of water around it.[71]
Frogs have maxillary teeth along their upper jaw which are used to hold food before it is swallowed. These teeth are very weak, and cannot be used to chew or catch and harm agile prey. Instead, the frog uses its sticky, cleft tongue to catch insects and other small moving prey. The tongue normally lies coiled in the mouth, free at the back and attached to the mandible at the front. It can be shot out and retracted at great speed.[51] In amphibians there are salvary glands on the tongue, which in frogs produce what is called a two-phase viscoelastic fluid. When exposed to pressure, like when the tongue is wrapping around a prey, it becomes runny and covers the prey's body. As the pressure drops, it returns to a thick and elastic state, which gives the tongue an extra grip.[72] Some frogs have no tongue and just stuff food into their mouths with their hands.[51] The African bullfrog (Pyxicephalus), which preys on relatively large animals such as mice and other frogs, has cone shaped bony projections called odontoid processes at the front of the lower jaw which function like teeth.[16] The eyes assist in the swallowing of food as they can be retracted through holes in the skull and help push food down the throat.[51][73]
The food then moves through the oesophagus into the stomach where digestive enzymes are added and it is churned up. It then proceeds to the small intestine (duodenum and ileum) where most digestion occurs. Pancreatic juice from the pancreas, and bile, produced by the liver and stored in the gallbladder, are secreted into the small intestine, where the fluids digest the food and the nutrients are absorbed. The food residue passes into the large intestine where excess water is removed and the wastes are passed out through the cloaca.[74]
Although adapted to terrestrial life, frogs resemble freshwater fish in their inability to conserve body water effectively. When they are on land, much water is lost by evaporation from the skin. The excretory system is similar to that of mammals and there are two kidneys that remove nitrogenous products from the blood. Frogs produce large quantities of dilute urine in order to flush out toxic products from the kidney tubules.[75] The nitrogen is excreted as ammonia by tadpoles and aquatic frogs but mainly as urea, a less toxic product, by most terrestrial adults. A few species of tree frog with little access to water excrete the even less toxic uric acid.[75] The urine passes along paired ureters to the urinary bladder from which it is vented periodically into the cloaca. All bodily wastes exit the body through the cloaca which terminates in a cloacal vent.[76]
In the male frog, the two testes are attached to the kidneys and semen passes into the kidneys through fine tubes called efferent ducts. It then travels on through the ureters, which are consequently known as urinogenital ducts. There is no penis, and sperm is ejected from the cloaca directly onto the eggs as the female lays them. The ovaries of the female frog are beside the kidneys and the eggs pass down a pair of oviducts and through the cloaca to the exterior.[76]
When frogs mate, the male climbs on the back of the female and wraps his fore limbs round her body, either behind the front legs or just in front of the hind legs. This position is called amplexus and may be held for several days.[77] The male frog has certain hormone-dependent secondary sexual characteristics. These include the development of special pads on his thumbs in the breeding season, to give him a firm hold.[78] The grip of the male frog during amplexus stimulates the female to release eggs, usually wrapped in jelly, as spawn. In many species the male is smaller and slimmer than the female. Males have vocal cords and make a range of croaks, particularly in the breeding season, and in some species they also have vocal sacs to amplify the sound.[76]
Frogs have a highly developed nervous system that consists of a brain, spinal cord and nerves. Many parts of frog brains correspond with those of humans. It consists of two olfactory lobes, two cerebral hemispheres, a pineal body, two optic lobes, a cerebellum and a medulla oblongata. Muscular coordination and posture are controlled by the cerebellum, and the medulla oblongata regulates respiration, digestion and other automatic functions. The relative size of the cerebrum in frogs is much smaller than it is in humans. Frogs have ten pairs of cranial nerves which pass information from the outside directly to the brain, and ten pairs of spinal nerves which pass information from the extremities to the brain through the spinal cord.[76] By contrast, all amniotes (mammals, birds and reptiles) have twelve pairs of cranial nerves.[79]
The eyes of most frogs are located on either side of the head near the top and project outwards as hemispherical bulges. They provide binocular vision over a field of 100° to the front and a total visual field of almost 360°.[80] They may be the only part of an otherwise submerged frog to protrude from the water. Each eye has closable upper and lower lids and a nictitating membrane which provides further protection, especially when the frog is swimming.[81] Members of the aquatic family Pipidae have the eyes located at the top of the head, a position better suited for detecting prey in the water above.[80] The irises come in a range of colours and the pupils in a range of shapes. The common toad (Bufo bufo) has golden irises and horizontal slit-like pupils, the red-eyed tree frog (Agalychnis callidryas) has vertical slit pupils, the poison dart frog has dark irises, the fire-bellied toad (Bombina spp.) has triangular pupils and the tomato frog (Dyscophus spp.) has circular ones. The irises of the southern toad (Anaxyrus terrestris) are patterned so as to blend in with the surrounding camouflaged skin.[81]
The distant vision of a frog is better than its near vision. Calling frogs will quickly become silent when they see an intruder or even a moving shadow but the closer an object is, the less well it is seen.[81] When a frog shoots out its tongue to catch an insect it is reacting to a small moving object that it cannot see well and must line it up precisely beforehand because it shuts its eyes as the tongue is extended.[51] Although it was formerly debated,[82] more recent research has shown that frogs can see in colour, even in very low light.[83]
Frogs can hear both in the air and below water. They do not have external ears; the eardrums (tympanic membranes) are directly exposed or may be covered by a layer of skin and are visible as a circular area just behind the eye. The size and distance apart of the eardrums is related to the frequency and wavelength at which the frog calls. In some species such as the bullfrog, the size of the tympanum indicates the sex of the frog; males have tympani that are larger than their eyes while in females, the eyes and tympani are much the same size.[84] A noise causes the tympanum to vibrate and the sound is transmitted to the middle and inner ear. The middle ear contains semicircular canals which help control balance and orientation. In the inner ear, the auditory hair cells are arranged in two areas of the cochlea, the basilar papilla and the amphibian papilla. The former detects high frequencies and the latter low frequencies.[85] Because the cochlea is short, frogs use electrical tuning to extend their range of audible frequencies and help discriminate different sounds.[86] This arrangement enables detection of the territorial and breeding calls of their conspecifics. In some species that inhabit arid regions, the sound of thunder or heavy rain may arouse them from a dormant state.[85] A frog may be startled by an unexpected noise but it will not usually take any action until it has located the source of the sound by sight.[84]

The call or croak of a frog is unique to its species. Frogs create this sound by passing air through the larynx in the throat. In most calling frogs, the sound is amplified by one or more vocal sacs, membranes of skin under the throat or on the corner of the mouth, that distend during the amplification of the call. Some frog calls are so loud that they can be heard up to a mile (1.6 km) away.[87] Additionally, some species have been found to use man-made structures such as drain pipes for artificial amplification of their call.[88] The coastal tailed frog (Ascaphus truei) lives in mountain streams in North America and does not vocalize.[89]
The main function of calling is for male frogs to attract mates. Males may call individually or there may be a chorus of sound where numerous males have converged on breeding sites. In many frog species, such as the common tree frog (Polypedates leucomystax), females reply to males' calls, which acts to reinforce reproductive activity in a breeding colony.[90] Female frogs prefer males that produce sounds of greater intensity and lower frequency, attributes that stand out in a crowd. The rationale for this is thought to be that by demonstrating his prowess, the male shows his fitness to produce superior offspring.[91]
A different call is emitted by a male frog or unreceptive female when mounted by another male. This is a distinct chirruping sound and is accompanied by a vibration of the body.[92] Tree frogs and some non-aquatic species have a rain call that they make on the basis of humidity cues prior to a shower.[92] Many species also have a territorial call that is used to drive away other males. All of these calls are emitted with the mouth of the frog closed.[92] A distress call, emitted by some frogs when they are in danger, is produced with the mouth open resulting in a higher-pitched call. It is typically used when the frog has been grabbed by a predator and may serve to distract or disorient the attacker so that it releases the frog.[92]
Many species of frog have deep calls. The croak of the American bullfrog (Rana catesbiana) is sometimes written as "jug o' rum".[93] The Pacific tree frog (Pseudacris regilla) produces the onomatopoeic "ribbit" often heard in films.[94] Other renderings of frog calls into speech include "brekekekex koax koax", the call of the marsh frog (Pelophylax ridibundus) in The Frogs, an Ancient Greek comic drama by Aristophanes.[95] The calls of the Concave-eared torrent frog (Amolops tormotus) are unusual in many aspects. The males are notable for their varieties of calls where upward and downward frequency modulations take place. When they communicate, they produce calls that fall in the ultrasound frequency range. The last aspect that makes this species of frog's calls unusual is that nonlinear acoustic phenomena are important components in their acoustic signals.[96]
During extreme conditions, some frogs enter a state of torpor and remain inactive for months. In colder regions, many species of frog hibernate in winter. Those that live on land such as the American toad (Bufo americanus) dig a burrow and make a hibernaculum in which to lie dormant. Others, less proficient at digging, find a crevice or bury themselves in dead leaves. Aquatic species such as the American bullfrog (Rana catesbeiana) normally sink to the bottom of the pond where they lie, semi-immersed in mud but still able to access the oxygen dissolved in the water. Their metabolism slows down and they live on their energy reserves. Some frogs such as the wood frog, moor frog, or spring peeper can even survive being frozen. Ice crystals form under the skin and in the body cavity but the essential organs are protected from freezing by a high concentration of glucose. An apparently lifeless, frozen frog can resume respiration and its heartbeat can restart when conditions warm up.[97]
At the other extreme, the striped burrowing frog (Cyclorana alboguttata) regularly aestivates during the hot, dry season in Australia, surviving in a dormant state without access to food and water for nine or ten months of the year. It burrows underground and curls up inside a protective cocoon formed by its shed skin. Researchers at the University of Queensland have found that during aestivation, the metabolism of the frog is altered and the operational efficiency of the mitochondria is increased. This means that the limited amount of energy available to the comatose frog is used in a more efficient manner. This survival mechanism is only useful to animals that remain completely unconscious for an extended period of time and whose energy requirements are low because they are cold-blooded and have no need to generate heat.[98] Other research showed that, to provide these energy requirements, muscles atrophy, but hind limb muscles are preferentially unaffected.[99] Frogs have been found to have upper critical temperatures of around 41 degrees Celsius.[100]
Different species of frog use a number of methods of moving around including jumping, running, walking, swimming, burrowing, climbing and gliding.

Frogs are generally recognized as exceptional jumpers and, relative to their size, the best jumpers of all vertebrates.[101] The striped rocket frog, Litoria nasuta, can leap over two metres (6+1⁄2 feet), a distance that is more than fifty times its body length of 55 mm (2+1⁄4 in).[102] There are tremendous differences between species in jumping capability. Within a species, jump distance increases with increasing size, but relative jumping distance (body-lengths jumped) decreases. The Indian skipper frog (Euphlyctis cyanophlyctis) has the ability to leap out of the water from a position floating on the surface.[103] The tiny northern cricket frog (Acris crepitans) can "skitter" across the surface of a pond with a series of short rapid jumps.[104]
Slow-motion photography shows that the muscles have passive flexibility. They are first stretched while the frog is still in the crouched position, then they are contracted before being stretched again to launch the frog into the air. The fore legs are folded against the chest and the hind legs remain in the extended, streamlined position for the duration of the jump.[50] In some extremely capable jumpers, such as the Cuban tree frog (Osteopilus septentrionalis) and the northern leopard frog (Rana pipiens), the peak power exerted during a jump can exceed that which the muscle is theoretically capable of producing. When the muscles contract, the energy is first transferred into the stretched tendon which is wrapped around the ankle bone. Then the muscles stretch again at the same time as the tendon releases its energy like a catapult to produce a powerful acceleration beyond the limits of muscle-powered acceleration.[105] A similar mechanism has been documented in locusts and grasshoppers.[106]
Early hatching of froglets can have negative effects on frog jumping performance and overall locomotion.[107] The hindlimbs are unable to completely form, which results in them being shorter and much weaker relative to a normal hatching froglet.[107] Early hatching froglets may tend to depend on other forms of locomotion more often, such as swimming and walking.[107]

Frogs in the families Bufonidae, Rhinophrynidae, and Microhylidae have short back legs and tend to walk rather than jump.[108] When they try to move rapidly, they speed up the rate of movement of their limbs or resort to an ungainly hopping gait. The Great Plains narrow-mouthed toad (Gastrophryne olivacea) has been described as having a gait that is "a combination of running and short hops that are usually only an inch or two in length".[109] In an experiment, Fowler's toad (Bufo fowleri) was placed on a treadmill which was turned at varying speeds. By measuring the toad's uptake of oxygen it was found that hopping was an inefficient use of resources during sustained locomotion but was a useful strategy during short bursts of high-intensity activity.[110]
The red-legged running frog (Kassina maculata) has short, slim hind limbs unsuited to jumping. It can move fast by using a running gait in which the two hind legs are used alternately. Slow-motion photography shows, unlike a horse that can trot or gallop, the frog's gait remained similar at slow, medium, and fast speeds.[111] This species can also climb trees and shrubs, and does so at night to catch insects.[112] The Indian skipper frog (Euphlyctis cyanophlyctis) has broad feet and can run across the surface of the water for several metres (yards).[104]

Frogs that live in or visit water have adaptations that improve their swimming abilities. The hind limbs are heavily muscled and strong. The webbing between the toes of the hind feet increases the area of the foot and helps propel the frog powerfully through the water. Members of the family Pipidae are wholly aquatic and show the most marked specialization. They have inflexible vertebral columns, flattened, streamlined bodies, lateral line systems, and powerful hind limbs with large webbed feet.[113] Tadpoles mostly have large tail fins which provide thrust when the tail is moved from side to side.[114]
Some frogs have become adapted for burrowing and a life underground. They tend to have rounded bodies, short limbs, small heads with bulging eyes, and hind feet adapted for excavation. An extreme example of this is the purple frog (Nasikabatrachus sahyadrensis) from southern India which feeds on termites and spends almost its whole life underground. It emerges briefly during the monsoon to mate and breed in temporary pools. It has a tiny head with a pointed snout and a plump, rounded body. Because of this fossorial existence, it was first described in 2003, being new to the scientific community at that time, although previously known to local people.[115]
The spadefoot toads of North America are also adapted to underground life. The Plains spadefoot toad (Spea bombifrons) is typical and has a flap of keratinised bone attached to one of the metatarsals of the hind feet which it uses to dig itself backwards into the ground. As it digs, the toad wriggles its hips from side to side to sink into the loose soil. It has a shallow burrow in the summer from which it emerges at night to forage. In winter, it digs much deeper and has been recorded at a depth of 4.5 m (14 ft 9 in).[116] The tunnel is filled with soil and the toad hibernates in a small chamber at the end. During this time, urea accumulates in its tissues and water is drawn in from the surrounding damp soil by osmosis to supply the toad's needs.[116] Spadefoot toads are "explosive breeders", all emerging from their burrows at the same time and converging on temporary pools, attracted to one of these by the calling of the first male to find a suitable breeding location.[117]
The burrowing frogs of Australia have a rather different lifestyle. The western spotted frog (Heleioporus albopunctatus) digs a burrow beside a river or in the bed of an ephemeral stream and regularly emerges to forage. Mating takes place and eggs are laid in a foam nest inside the burrow. The eggs partially develop there, but do not hatch until they are submerged following heavy rainfall. The tadpoles then swim out into the open water and rapidly complete their development.[118] Madagascan burrowing frogs are less fossorial and mostly bury themselves in leaf litter. One of these, the green burrowing frog (Scaphiophryne marmorata), has a flattened head with a short snout and well-developed metatarsal tubercles on its hind feet to help with excavation. It also has greatly enlarged terminal discs on its fore feet that help it to clamber around in bushes.[119] It breeds in temporary pools that form after rains.[120]

Tree frogs live high in the canopy, where they scramble around on the branches, twigs, and leaves, sometimes never coming down to earth. The "true" tree frogs belong to the family Hylidae, but members of other frog families have independently adopted an arboreal habit, a case of convergent evolution. These include the glass frogs (Centrolenidae), the bush frogs (Hyperoliidae), some of the narrow-mouthed frogs (Microhylidae), and the shrub frogs (Rhacophoridae).[108] Most tree frogs are under 10 cm (4 in) in length, with long legs and long toes with adhesive pads on the tips. The surface of the toe pads is formed from a closely packed layer of flat-topped, hexagonal epidermal cells separated by grooves into which glands secrete mucus. These toe pads, moistened by the mucus, provide the grip on any wet or dry surface, including glass. The forces involved include boundary friction of the toe pad epidermis on the surface and also surface tension and viscosity.[121] Tree frogs are very acrobatic and can catch insects while hanging by one toe from a twig or clutching onto the blade of a windswept reed.[122] Some members of the subfamily Phyllomedusinae have opposable toes on their feet. The reticulated leaf frog (Phyllomedusa ayeaye) has a single opposed digit on each fore foot and two opposed digits on its hind feet. This allows it to grasp the stems of bushes as it clambers around in its riverside habitat.[123]
During the evolutionary history of frogs, several different groups have independently taken to the air.[124] Some frogs in the tropical rainforest are specially adapted for gliding from tree to tree or parachuting to the forest floor. Typical of them is Wallace's flying frog (Rhacophorus nigropalmatus) from Malaysia and Borneo. It has large feet with the fingertips expanded into flat adhesive discs and the digits fully webbed. Flaps of skin occur on the lateral margins of the limbs and across the tail region. With the digits splayed, the limbs outstretched, and these flaps spread, it can glide considerable distances, but is unable to undertake powered flight.[125] It can alter its direction of travel and navigate distances of up to 15 m (50 ft) between trees.[126]
Two main types of reproduction occur in frogs, prolonged breeding and explosive breeding. In the former, adopted by the majority of species, adult frogs at certain times of year assemble at a pond, lake or stream to breed. Many frogs return to the bodies of water in which they developed as larvae. This often results in annual migrations involving thousands of individuals. In explosive breeders, mature adult frogs arrive at breeding sites in response to certain trigger factors such as rainfall occurring in an arid area. In these frogs, mating and spawning take place promptly and the speed of larval growth is rapid in order to make use of the ephemeral pools before they dry up.[127]
Among prolonged breeders, males usually arrive at the breeding site first and remain there for some time whereas females tend to arrive later and depart soon after they have spawned. This means that males outnumber females at the water's edge and defend territories from which they expel other males. They advertise their presence by calling, often alternating their croaks with neighbouring frogs. Larger, stronger males tend to have deeper calls and maintain higher quality territories. Females select their mates at least partly on the basis of the depth of their voice.[128] In some species there are satellite males who have no territory and do not call. They may intercept females that are approaching a calling male or take over a vacated territory. Calling is an energy-sapping activity. Sometimes the two roles are reversed and a calling male gives up its territory and becomes a satellite.[127]
In explosive breeders, the first male that finds a suitable breeding location, such as a temporary pool, calls loudly and other frogs of both sexes converge on the pool. Explosive breeders tend to call in unison creating a chorus that can be heard from far away. The spadefoot toads (Scaphiopus spp.) of North America fall into this category. Mate selection and courtship is not as important as speed in reproduction. In some years, suitable conditions may not occur and the frogs may go for two or more years without breeding.[127] Some female New Mexico spadefoot toads (Spea multiplicata) only spawn half of the available eggs at a time, perhaps retaining some in case a better reproductive opportunity arises later.[129]
At the breeding site, the male mounts the female and grips her tightly round the body. Typically, amplexus takes place in the water, the female releases her eggs and the male covers them with sperm; fertilization is external. In many species such as the Great Plains toad (Bufo cognatus), the male restrains the eggs with his back feet, holding them in place for about three minutes.[127] Members of the West African genus Nimbaphrynoides are unique among frogs in that they are viviparous; Limnonectes larvaepartus, Eleutherodactylus jasperi and members of the Tanzanian genus Nectophrynoides are the only frogs known to be ovoviviparous. In these species, fertilization is internal and females give birth to fully developed juvenile frogs, except L. larvaepartus, which give birth to tadpoles.[130][131][132]
Frogs may lay their in eggs as clumps, surface films, strings, or individually. Around half of species deposit eggs in water, others lay eggs in vegetation, on the ground or in excavations.[133][134][135] The tiny yellow-striped pygmy eleuth (Eleutherodactylus limbatus) lays eggs singly, burying them in moist soil.[136] The smoky jungle frog (Leptodactylus pentadactylus) makes a nest of foam in a hollow. The eggs hatch when the nest is flooded, or the tadpoles may complete their development in the foam if flooding does not occur.[137] The red-eyed treefrog (Agalychnis callidryas) deposits its eggs on a leaf above a pool and when they hatch, the larvae fall into the water below.[138]
In certain species, such as the wood frog (Rana sylvatica), symbiotic unicellular green algae are present in the gelatinous material. It is thought that these may benefit the developing larvae by providing them with extra oxygen through photosynthesis.[139] The interior of globular egg clusters of the wood frog has been also been found to be up to 6 °C (11 °F) warmer than the surrounding water and this speeds up the development of the larvae.[140] The larvae developing in the eggs can detect vibrations caused by nearby predatory wasps or snakes, and will hatch early to avoid being eaten.[141] In general, the length of the egg stage depends on the species and the environmental conditions. Aquatic eggs normally hatch within one week when the capsule splits as a result of enzymes released by the developing larvae.[142]
Direct development, where eggs hatch into juveniles like small adults, is also known in many frogs, for example, Ischnocnema henselii,[143] Eleutherodactylus coqui,[144] and Raorchestes ochlandrae and Raorchestes chalazodes.[145]
The larvae that emerge from the eggs, known as tadpoles (or occasionally polliwogs). Tadpoles lack eyelids and limbs, and have cartilaginous skeletons, gills for respiration (external gills at first, internal gills later), and tails they use for swimming.[114] As a general rule, free-living larvae are fully aquatic, but at least one species (Nannophrys ceylonensis) has semiterrestrial tadpoles which live among wet rocks.[146][147]
From early in its development, a gill pouch covers the tadpole's gills and front legs. The lungs soon start to develop and are used as an accessory breathing organ. Some species go through metamorphosis while still inside the egg and hatch directly into small frogs. Tadpoles lack true teeth, but the jaws in most species have two elongated, parallel rows of small, keratinized structures called keradonts in their upper jaws. Their lower jaws usually have three rows of keradonts surrounded by a horny beak, but the number of rows can vary and the exact arrangements of mouth parts provide a means for species identification.[142] In the Pipidae, with the exception of Hymenochirus, the tadpoles have paired anterior barbels, which make them resemble small catfish.[113] Their tails are stiffened by a notochord, but does not contain any bony or cartilaginous elements except for a few vertebrae at the base which forms the urostyle during metamorphosis. This has been suggested as an adaptation to their lifestyles; because the transformation into frogs happens very fast, the tail is made of soft tissue only, as bone and cartilage take a much longer time to be broken down and absorbed. The tail fin and tip is fragile and will easily tear, which is seen as an adaptation to escape from predators which tries to grasp them by the tail.[148]
Tadpoles are typically herbivorous, feeding mostly on algae, including diatoms filtered from the water through the gills. Some species are carnivorous at the tadpole stage, eating insects, smaller tadpoles, and fish. The Cuban tree frog (Osteopilus septentrionalis) is one of a number of species in which the tadpoles can be cannibalistic. Tadpoles that develop legs early may be eaten by the others, so late developers may have better long-term survival prospects.[149]
Tadpoles are highly vulnerable to being eaten by fish, newts, predatory diving beetles, and birds, particularly water bird, such as storks and herons and domestic ducks. Some tadpoles, including those of the cane toad (Bufo marinus), are poisonous. The tadpole stage may be as short as a week in explosive breeders or it may last through one or more winters followed by metamorphosis in the spring.[150]
At the end of the tadpole stage, a frog undergoes metamorphosis in which its body makes a sudden transition into the adult form. This metamorphosis typically lasts only 24 hours, and is initiated by production of the hormone thyroxine. This causes different tissues to develop in different ways. The principal changes that take place include the development of the lungs and the disappearance of the gills and gill pouch, making the front legs visible. The lower jaw transforms into the big mandible of the carnivorous adult, and the long, spiral gut of the herbivorous tadpole is replaced by the typical short gut of a predator.[142] Homeostatic feedback control of food intake is largely absent, making tadpoles eat constantly when food is present. But shortly before and during metamorphosis the sensation of hunger is suppressed, and they stop eating while their gut and internal organs are reorganized and prepared for a different diet.[151][152] Also the gut microbiota changes, from being similar to that of fish to resembling that of amniotes.[153] Exceptions are carnivorous tadpoles like Lepidobatrachus laevis , which has a gut already adapted to a diet similar to that of adults. These continue to eat during metamorphosis.[154] The nervous system becomes adapted for hearing and stereoscopic vision, and for new methods of locomotion and feeding.[142] The eyes are repositioned higher up on the head and the eyelids and associated glands are formed. The eardrum, middle ear, and inner ear are developed. The skin becomes thicker and tougher, the lateral line system is lost, and skin glands are developed.[142] The final stage is the disappearance of the tail, but this takes place rather later, the tissue being used to produce a spurt of growth in the limbs.[155] Frogs are at their most vulnerable to predators when they are undergoing metamorphosis. At this time, the tail is being lost and locomotion by means of limbs is only just becoming established.[108]
Adult frogs may live in or near water, but few are fully aquatic.[156] Almost all frog species are carnivorous as adults, preying on invertebrates, including insects, crabs, spiders, mites, worms, snails, and slugs. A few of the larger ones may eat other frogs, small mammals and reptiles, and fish.[157][158] A few species also eat plant matter; the tree frog Xenohyla truncata is partly herbivorous, its diet including a large proportion of fruit, floral structures and nectar.[159][160] Leptodactylus mystaceus has been found to eat plants,[161][162] and folivory occurs in Euphlyctis hexadactylus, with plants constituting 79.5% of its diet by volume.[163] Many frogs use their sticky tongues to catch prey, while others simply grab them with their mouths.[164] Adult frogs are themselves attacked by many predators. The northern leopard frog (Rana pipiens) is eaten by herons, hawks, fish, large salamanders, snakes, raccoons, skunks, mink, bullfrogs, and other animals.[165]
Frogs are primary predators and an important part of the food web. Being cold-blooded, they make efficient use of the food they eat with little energy being used for metabolic processes, while the rest is transformed into biomass. They are themselves eaten by secondary predators and are the primary terrestrial consumers of invertebrates, most of which feed on plants. By reducing herbivory, they play a part in increasing the growth of plants and are thus part of a delicately balanced ecosystem.[166]
Little is known about the longevity of frogs and toads in the wild, but some can live for many years. Skeletochronology is a method of examining bones to determine age. Using this method, the ages of mountain yellow-legged frogs (Rana muscosa) were studied, the phalanges of the toes showing seasonal lines where growth slows in winter. The oldest frogs had ten bands, so their age was believed to be 14 years, including the four-year tadpole stage.[167] Captive frogs and toads have been recorded as living for up to 40 years, an age achieved by a European common toad (Bufo bufo). The cane toad (Bufo marinus) has been known to survive 24 years in captivity, and the American bullfrog (Rana catesbeiana) 14 years.[168] Frogs from temperate climates hibernate during the winter, and four species are known to be able to withstand freezing during this time, including the wood frog (Rana sylvatica).[169]

Although care of offspring is poorly understood in frogs, up to an estimated 20% of amphibian species may care for their young in some way.[170] The evolution of parental care in frogs is driven primarily by the size of the water body in which they breed. Those that breed in smaller water bodies tend to have greater and more complex parental care behaviour.[171] Because predation of eggs and larvae is high in large water bodies, some frog species started to lay their eggs on land. Once this happened, the desiccating terrestrial environment demands that one or both parents keep them moist to ensure their survival.[172] The subsequent need to transport hatched tadpoles to a water body required an even more intense form of parental care.[171]
In small pools, predators are mostly absent and competition between tadpoles becomes the variable that constrains their survival. Certain frog species avoid this competition by making use of smaller phytotelmata (water-filled leaf axils or small woody cavities) as sites for depositing a few tadpoles.[173] While these smaller rearing sites are free from competition, they also lack sufficient nutrients to support a tadpole without parental assistance. Frog species that changed from the use of larger to smaller phytotelmata have evolved a strategy of providing their offspring with nutritive but unfertilized eggs.[171] The female strawberry poison-dart frog (Oophaga pumilio) lays her eggs on the forest floor. The male frog guards them from predation and carries water in his cloaca to keep them moist. When they hatch, the female moves the tadpoles on her back to a water-holding bromeliad or other similar water body, depositing just one in each location. She visits them regularly and feeds them by laying one or two unfertilized eggs in the phytotelma, continuing to do this until the young are large enough to undergo metamorphosis.[174] The granular poison frog (Oophaga granulifera) looks after its tadpoles in a similar way.[175]
Many other diverse forms of parental care are seen in frogs. The tiny male Colostethus subpunctatus stands guard over his egg cluster, laid under a stone or log. When the eggs hatch, he transports the tadpoles on his back to a temporary pool, where he partially immerses himself in the water and one or more tadpoles drop off. He then moves on to another pool.[176] The male common midwife toad (Alytes obstetricans) carries the eggs around with him attached to his hind legs. He keeps them damp in dry weather by immersing himself in a pond, and prevents them from getting too wet in soggy vegetation by raising his hindquarters. After three to six weeks, he travels to a pond and the eggs hatch into tadpoles.[177] The tungara frog (Physalaemus pustulosus) builds a floating nest from foam to protect its eggs from predation. The foam is made from proteins and lectins, and seems to have antimicrobial properties.[178] Several pairs of frogs may form a colonial nest on a previously built raft. The eggs are laid in the centre, followed by alternate layers of foam and eggs, finishing with a foam capping.[179]
Some frogs protect their offspring inside their own bodies. Both male and female pouched frogs (Assa darlingtoni) guard their eggs, which are laid on the ground. When the eggs hatch, the male lubricates his body with the jelly surrounding them and immerses himself in the egg mass. The tadpoles wriggle into skin pouches on his side, where they develop until they metamorphose into juvenile frogs.[180] The female gastric-brooding frog (Rheobatrachus sp.) from Australia, now probably extinct, swallows her fertilized eggs, which then develop inside her stomach. She ceases to feed and stops secreting stomach acid. The tadpoles rely on the yolks of the eggs for nourishment. After six or seven weeks, they are ready for metamorphosis. The mother regurgitates the tiny frogs, which hop away from her mouth.[181] The female Darwin's frog (Rhinoderma darwinii) from Chile lays up to 40 eggs on the ground, where they are guarded by the male. When the tadpoles are about to hatch, they are engulfed by the male, which carries them around inside his much-enlarged vocal sac. Here they are immersed in a frothy, viscous liquid that contains some nourishment to supplement what they obtain from the yolks of the eggs. They remain in the sac for seven to ten weeks before undergoing metamorphosis, after which they move into the male's mouth and emerge.[182]


At first sight, frogs seem rather defenceless because of their small size, slow movement, thin skin, and lack of defensive structures, such as spines, claws or teeth. Many use camouflage to avoid detection, the skin often being spotted or streaked in neutral colours that allow a stationary frog to merge into its surroundings. Some can make prodigious leaps, often into water, that help them to evade potential attackers, while many have other defensive adaptations and strategies.[127]
The skin of many frogs contains mild toxic substances called bufotoxins to make them unpalatable to potential predators. Most toads and some frogs have large poison glands, the parotoid glands, located on the sides of their heads behind the eyes and other glands elsewhere on their bodies. These glands secrete mucus and a range of toxins that make frogs slippery to hold and distasteful or poisonous. If the noxious effect is immediate, the predator may cease its action and the frog may escape. If the effect develops more slowly, the predator may learn to avoid that species in future.[183] Poisonous frogs tend to advertise their toxicity with bright colours, an adaptive strategy known as aposematism. The poison dart frogs in the family Dendrobatidae do this. They are typically red, orange, or yellow, often with contrasting black markings on their bodies. Allobates zaparo is not poisonous, but mimics the appearance of two different toxic species with which it shares a common range in an effort to deceive predators.[184] Other species, such as the European fire-bellied toad (Bombina bombina), have their warning colour underneath. They "flash" this when attacked, adopting a pose that exposes the vivid colouring on their bellies.[4]
Some frogs, such as the poison dart frogs, are especially toxic. The native peoples of South America extract poison from these frogs to apply to their weapons for hunting,[185] although few species are toxic enough to be used for this purpose. At least two non-poisonous frog species in tropical America (Eleutherodactylus gaigei and Lithodytes lineatus) mimic the colouration of dart poison frogs for self-protection.[186][187] Some frogs obtain poisons from the ants and other arthropods they eat.[188] Others, such as the Australian corroboree frogs (Pseudophryne corroboree and Pseudophryne pengilleyi), can synthesize the alkaloids themselves.[189] The chemicals involved may be irritants, hallucinogens, convulsants, nerve poisons or vasoconstrictors. Many predators of frogs have become adapted to tolerate high levels of these poisons, but other creatures, including humans who handle the frogs, may be severely affected.[190]
Some frogs use bluff or deception. The European common toad (Bufo bufo) adopts a characteristic stance when attacked, inflating its body and standing with its hindquarters raised and its head lowered.[191] The bullfrog (Rana catesbeiana) crouches down with eyes closed and head tipped forward when threatened. This places the parotoid glands in the most effective position, the other glands on its back begin to ooze noxious secretions and the most vulnerable parts of its body are protected.[127] Another tactic used by some frogs is to "scream", the sudden loud noise tending to startle the predator. The gray tree frog (Hyla versicolor) makes an explosive sound that sometimes repels the shrew Blarina brevicauda.[127] Although toads are avoided by many predators, the common garter snake (Thamnophis sirtalis) regularly feeds on them. The strategy employed by juvenile American toads (Bufo americanus) on being approached by a snake is to crouch down and remain immobile. This is usually successful, with the snake passing by and the toad remaining undetected. If it is encountered by the snake's head, however, the toad hops away before crouching defensively.[192]

Frogs live on all the continents except Antarctica, but they are not present on certain islands, especially those far away from continental land masses.[193][194] Many species are isolated in restricted ranges by changes of climate or inhospitable territory, such as stretches of sea, mountain ridges, deserts, forest clearance, road construction, or other man-made barriers.[195] Usually, a greater diversity of frogs occurs in tropical areas than in temperate regions, such as Europe.[196] Some frogs inhabit arid areas, such as deserts, and rely on specific adaptations to survive. Members of the Australian genus Cyclorana bury themselves underground where they create a water-impervious cocoon in which to aestivate during dry periods. Once it rains, they emerge, find a temporary pool, and breed. Egg and tadpole development is very fast in comparison to those of most other frogs, so breeding can be completed before the pond dries up.[197] Some frog species are adapted to a cold environment. The wood frog (Rana sylvatica), whose habitat extends into the Arctic Circle, buries itself in the ground during winter. Although much of its body freezes during this time, it maintains a high concentration of glucose in its vital organs, which protects them from damage.[51]

In 2006, of 4,035 species of amphibians that depend on water during some lifecycle stage, 1,356 (33.6%) were considered to be threatened. This is likely to be an underestimate because it excludes 1,427 species for which evidence was insufficient to assess their status.[198] Frog populations have declined dramatically since the 1950s. More than one-third of frog species are considered to be threatened with extinction, and more than 120 species are believed to have become extinct since the 1980s.[199] Among these species are the gastric-brooding frogs of Australia and the golden toad of Costa Rica. The latter is of particular concern to scientists because it inhabited the pristine Monteverde Cloud Forest Reserve and its population crashed in 1987, along with about 20 other frog species in the area. This could not be linked directly to human activities, such as deforestation, and was outside the range of normal fluctuations in population size.[200] Elsewhere, habitat loss is a significant cause of frog population decline, as are pollutants, climate change, increased UVB radiation, and the introduction of non-native predators and competitors.[201] A Canadian study conducted in 2006 suggested heavy traffic in their environment was a larger threat to frog populations than was habitat loss.[202] Emerging infectious diseases, including chytridiomycosis and ranavirus, are also devastating populations.[203][204]
Many environmental scientists believe amphibians, including frogs, are good biological indicators of broader ecosystem health because of their intermediate positions in food chains, their permeable skins, and typically biphasic lives (aquatic larvae and terrestrial adults).[205] It appears that species with both aquatic eggs and larvae are most affected by the decline, while those with direct development are the most resistant.[206]

Frog mutations and genetic defects have increased since the 1990s. These often include missing legs or extra legs. Various causes have been identified or hypothesized, including an increase in ultraviolet radiation affecting the spawn on the surface of ponds, chemical contamination from pesticides and fertilizers, and parasites such as the trematode Ribeiroia ondatrae. Probably all these are involved in a complex way as stressors, environmental factors contributing to rates of disease, and vulnerability to attack by parasites. Malformations impair mobility and the individuals may not survive to adulthood. An increase in the number of frogs eaten by birds may actually increase the likelihood of parasitism of other frogs, because the trematode's complex lifecycle includes the ramshorn snail and several intermediate hosts such as birds.[207][208]
In a few cases, captive breeding programs have been established and have largely been successful.[209][210] The World Association of Zoos and Aquariums named 2008 as the "Year of the Frog" in order to draw attention to the conservation issues faced by them.[211]
The cane toad (Bufo marinus) is a very adaptable species native to South and Central America. In the 1930s, it was introduced into Puerto Rico, and later various other islands in the Pacific and Caribbean region, as a biological pest control agent.[212] In 1935, 3000 toads were liberated in the sugar cane fields of Queensland, Australia, in an attempt to control cane beetles such as Dermolepida albohirtum, the larvae of which damage and kill the canes. Initial results in many of these countries were positive, but it later became apparent that the toads upset the ecological balance in their new environments. They bred freely, competed with native frog species, ate bees and other harmless native invertebrates, had few predators in their adopted habitats, and poisoned pets, carnivorous birds, and mammals. In many of these countries, they are now regarded both as pests and invasive species, and scientists are looking for a biological method to control them.[213]
Frog legs are eaten by humans in many parts of the world. Indonesia is the world's largest exporter of frog meat, exporting more than 5,000 tonnes of frog meat each year, mostly to France, Belgium and Luxembourg.[214] Originally, they were supplied from local wild populations, but overexploitation led to a diminution in the supply. This resulted in the development of frog farming and a global trade in frogs. The main importing countries are France, Belgium, Luxembourg, and the United States, while the chief exporting nations are Indonesia and China.[215] The annual global trade in the American bullfrog (Rana catesbeiana), mostly farmed in China, varies between 1200 and 2400 tonnes.[216]
The mountain chicken frog, so-called as it tastes of chicken, is now endangered, in part due to human consumption, and was a major food choice of the Dominicans.[217] Coon, possum, partridges, prairie hen, and frogs were among the fare Mark Twain recorded as part of American cuisine.[218]
In November, 1970, NASA sent two bullfrogs into space for six days during the Orbiting Frog Otolith mission to test weightlessness.
Frogs are used for dissections in high school and university anatomy classes, often first being injected with coloured substances to enhance contrasts among the biological systems. This practice is declining due to animal welfare concerns, and "digital frogs" are now available for virtual dissection.[219]
Frogs have served as experimental animals throughout the history of science. Eighteenth-century biologist Luigi Galvani discovered the link between electricity and the nervous system by studying frogs. He created one of the first tools for measuring electric current out of a frog leg.[220] In 1852, H. F. Stannius used a frog's heart in a procedure called a Stannius ligature to demonstrate the ventricle and atria beat independently of each other and at different rates.[221] The African clawed frog or platanna (Xenopus laevis) was first widely used in laboratories in pregnancy tests in the first half of the 20th century. A sample of urine from a pregnant woman injected into a female frog induces it to lay eggs, a discovery made by English zoologist Lancelot Hogben. This is because a hormone, human chorionic gonadotropin, is present in substantial quantities in the urine of women during pregnancy.[222] In 1952, Robert Briggs and Thomas J. King cloned a frog by somatic cell nuclear transfer. This same technique was later used to create Dolly the sheep, and their experiment was the first time a successful nuclear transplantation had been accomplished in higher animals.[223]
Frogs are used in cloning research and other branches of embryology. Although alternative pregnancy tests have been developed, biologists continue to use Xenopus as a model organism in developmental biology because their embryos are large and easy to manipulate, they are readily obtainable, and can easily be kept in the laboratory.[224] Xenopus laevis is increasingly being displaced by its smaller relative, Xenopus tropicalis, which reaches its reproductive age in five months rather than the one to two years for X. laevis,[225] thus facilitating faster studies across generations.
Genomes of Xenopus laevis, X. tropicalis, Rana catesbeiana, Rhinella marina, and Nanorana parkeri have been sequenced and deposited in the NCBI Genome database.[226]
Due to being inexpensive and relatively easy to care for, many species of frogs and toads have become popular as exotic pets. They are undemanding and require low maintenance. Both frogs and toads can be housed in paludariums, terrariums and aquariums.

Because frog toxins are extraordinarily diverse, they have raised the interest of biochemists as a "natural pharmacy". The alkaloid epibatidine, a painkiller 200 times more potent than morphine, is made by some species of poison dart frogs. Other chemicals isolated from the skins of frogs may offer resistance to HIV infection.[227] Dart poisons are under active investigation for their potential as therapeutic drugs.[228]
It has long been suspected that pre-Columbian Mesoamericans used a toxic secretion produced by the cane toad as a hallucinogen, but more likely they used substances secreted by the Colorado River toad (Bufo alvarius). These contain bufotenin (5-MeO-DMT), a psychoactive compound that has been used in modern times as a recreational drug. Typically, the skin secretions are dried and then smoked.[229] Illicit drug use by licking the skin of a toad has been reported in the media, but this may be an urban myth.[230]
Exudations from the skin of the golden poison frog (Phyllobates terribilis) are traditionally used by native Colombians to poison the darts they use for hunting. The tip of the projectile is rubbed over the back of the frog and the dart is launched from a blowgun. The combination of the two alkaloid toxins batrachotoxin and homobatrachotoxin is so powerful, one frog contains enough poison to kill an estimated 22,000 mice.[231] Two other species, the Kokoe poison dart frog (Phyllobates aurotaenia) and the black-legged dart frog (Phyllobates bicolor) are also used for this purpose. These are less toxic and less abundant than the golden poison frog. They are impaled on pointed sticks and may be heated over a fire to maximise the quantity of poison that can be transferred to the dart.[231]

Frogs have been featured in mythology, fairy tales and popular culture. In traditional Chinese myths, the world rests on a giant frog, who would try to swallow the moon, causing the lunar eclipse. Frogs have been featured in religion, folklore, and popular culture. The ancient Egyptians depicted the god Heqet, protector of newborns, with the head of a frog. For the Mayans, frogs represented water, crops, fertility and birth and were associated with the god Chaac. In the Bible, Moses unleashes a plague of frogs on the Egyptians. Medieval Europeans associated frogs and toads with evil and witchcraft.[232] The Brothers Grimm fairy tale The Frog Prince features a princess taking in a frog and it turning into a handsome prince.[233] In modern culture, frogs may take a comedic or hapless role, such as Mr. Toad of the 1908 novel The Wind in the Willows, Michigan J. Frog of Warner Bros. Cartoons, the Muppet Kermit the Frog and in the game Frogger.[234]
 Variegated golden frog (Mantella baroni) in the Ranomafana National Park of Madagascar
Variegated golden frog (Mantella baroni) in the Ranomafana National Park of Madagascar A frog is any member of a diverse and largely carnivorous group of short-bodied, tailless amphibians composing the order Anura (ανοὐρά, literally without tail in Ancient Greek). The oldest fossil "proto-frog" Triadobatrachus is known from the Early Triassic of Madagascar, but molecular clock dating suggests their split from other amphibians may extend further back to the Permian, 265 million years ago. Frogs are widely distributed, ranging from the tropics to subarctic regions, but the greatest concentration of species diversity is in tropical rainforest. Frogs account for around 88% of extant amphibian species. They are also one of the five most diverse vertebrate orders. Warty frog species tend to be called toads, but the distinction between frogs and toads is informal, not from taxonomy or evolutionary history.
An adult frog has a stout body, protruding eyes, anteriorly-attached tongue, limbs folded underneath, and no tail (the tail of tailed frogs is an extension of the male cloaca). Frogs have glandular skin, with secretions ranging from distasteful to toxic. Their skin varies in colour from well-camouflaged dappled brown, grey and green to vivid patterns of bright red or yellow and black to show toxicity and ward off predators. Adult frogs live in fresh water and on dry land; some species are adapted for living underground or in trees.
Frogs typically lay their eggs in water. The eggs hatch into aquatic larvae called tadpoles that have tails and internal gills. They have highly specialized rasping mouth parts suitable for herbivorous, omnivorous or planktivorous diets. The life cycle is completed when they metamorphose into adults. A few species deposit eggs on land or bypass the tadpole stage. Adult frogs generally have a carnivorous diet consisting of small invertebrates, but omnivorous species exist and a few feed on plant matter. Frog skin has a rich microbiome which is important to their health. Frogs are extremely efficient at converting what they eat into body mass. They are an important food source for predators and part of the food web dynamics of many of the world's ecosystems. The skin is semi-permeable, making them susceptible to dehydration, so they either live in moist places or have special adaptations to deal with dry habitats. Frogs produce a wide range of vocalizations, particularly in their breeding season, and exhibit many different kinds of complex behaviors to attract mates, to fend off predators and to generally survive.
Frogs are valued as food by humans and also have many cultural roles in literature, symbolism and religion. They are also seen as environmental bellwethers, with declines in frog populations often viewed as early warning signs of environmental damage. Frog populations have declined significantly since the 1950s. More than one third of species are considered to be threatened with extinction and over 120 are believed to have become extinct since the 1980s. The number of malformations among frogs is on the rise and an emerging fungal disease, chytridiomycosis, has spread around the world. Conservation biologists are working to understand the causes of these problems and to resolve them.
Anuroj[1] (science: Anura el antikva greka an-, sen + oura, vosto, aŭ senvostaj amfibioj) estas la biologia ordo de karnovoraj mallongkorpaj senvostaj bestoj en la klaso amfibioj kiu inkluzivas ranojn kaj bufojn. Tamen, ne estas klara scienca distingo inter ranoj kaj bufoj. Unu familio de anuroj la diskolanguloj, havas ecojn de ambaŭ ranoj kaj bufoj.
La plej antikva fosilia "pra-rano" nome Triadobatrachus aperis en la komenco de Triaso de Madagaskaro, sed datado per molekula horloĝo sugestas ke ties originoj povas etendi plue reen al Permio, antaŭ 265 milionoj da jaroj. Ranoj estas amplekse distribuataj, game el tropikoj al ĉearktaj regionoj, sed la plej granda koncentro de specidiverseco estas en tropikaj pluvarbaroj. Estas proksimume 4 800 registritaj specioj, ĉirkaŭkalkule 85% el vivantaj amfibiaj specioj. Ili estas ankaŭ unu el la kvin plej diversaj ordoj de vertebruloj.
La korpokonsisto de plenkreska rano estas ĝenerale karakterizata de fortika korpo, elstaregaj okuloj, fenda lango, membroj falditaj suben, kaj foresto de vosto ĉe plenkreskuloj. Krom vivi en nesala akvo kaj sur seka tero, la plenkreskuloj de kelkaj specioj estas adaptitaj al loĝado subtera aŭ en arboj. La haŭto de ranoj estas glandenhava, kun sekrecioj gamaj el malbongustegaj al venenaj. Verukenhavaj specioj de ranoj tendencas esti nomataj bufoj sed la distingo inter ranoj kaj bufoj estas bazita sur neformalaj nomigaj konvencioj koncentrataj al la verukoj pli ol al taksonomio aŭ al evolua historio; kelkaj bufoj estas pli proksime rilataj al ranoj ol aliaj bufoj. La haŭto de ranoj varias en koloro el bone-kamuflitaj makulecaj bruna, griza kaj verda al tre koloraj modeloj de bril-ruĝa aŭ -flava kaj nigra por averti pri veneneco kaj predantoforigo.
Ranoj tipe demetas siajn ovojn en akvo. El la ovoj eliras larvoj nomataj ranidoj kiuj havas vostojn kaj internajn brankojn. Ili havas tre specializitajn asprajn buŝopartojn taŭgajn por herbovoraj, ĉiomanĝantaj aŭ planktonvorulaj dietoj. La vivociklo estas kompletita kiam ili metamorfozas al plenkreskuloj. Kelkaj specioj demetas ovojn surteren aŭ rekte eksteriras al stadio de ranido. Plenkreskaj ranoj ĝenerale havas karnovoran dieton konsistantan el malgrandaj senvertebruloj, sed ekzistas ankaŭ ĉiomanĝantaj specioj kaj kelkaj manĝas fruktojn. Ranoj estas tre efikaj je konverto de tio kion ili manĝas al korpomaso. Ili krome estas tre grava manĝofonto por predantoj kaj parto de la dinamiko de manĝoreto de multaj el la ekosistemoj de la mondo. La haŭto estas duontralasebla, kio faras ilin vundeblaj pro senakviĝo, kaj tiele ili ĉu vivas en humidaj lokoj aŭ havas specialajn adaptaĵojn por elteni sekajn habitatojn. Ranoj produktas ampleksan gamon de voĉoj, ĉefe dum la reprodukta sezono, kaj montras multajn diferencajn tipojn de kompleksaj kutimoj por allogi partnerojn, por forigi predantojn kaj ĝenerale por survivi.
Ranoj estas valoraj kiel manĝo de homoj kaj ankaŭ havas multajn kulturajn rolojn en literaturo, simbolismo kaj religio. Ranaj populacioj malpliiĝis grave el la 1950-aj jaroj. Pli ol unu triono da specioj estas konsiderataj minacataj de formorto kaj ĉirkaŭ cent dudek ŝajne iĝis formortintaj ekde la 1980-aj jaroj.[2] La nombro de disformaĵoj inter ranoj estas malpliiĝanta kaj ĵuse konata funga malsano, nome Ĥitridjomikozo, disvastiĝis tra la tuta mondo. Konservobiologoj laboras por kompreni la kaŭzojn de tiuj problemoj kaj por solvi ilin.
Ĉirkaŭ 88% el la specioj de amfibioj estas klasitaj en la ordo Anura.[3] Tio inkludas ĉirkaŭ 4,810 speciojn en 33 familioj, el kiuj la Leptodaktiledoj (1,100 specioj), Hiledoj (800 specioj) kaj Ranedoj (750 specioj) estas la plej riĉaj en specioj.[3]
La uzado de komunaj nomoj "rano" kaj "bufo" ne havas taksonomian justigon. El klasiga vidpunkto, ĉiuj membroj de la ordo Anura estas ranoj, sed nur membroj de la familio Bufonedoj estas konsiderataj "veraj bufoj". La uzado de la termino "rano" en komunaj nomoj kutime referencas al specioj kiuj estas akvaj aŭ duon-akvaj kaj havas mildajn, malsekajn haŭtojn; la termino "bufo" ĝenerale referencas al specioj kiuj estas surteraj kun sekaj, verukhavaj haŭtoj.[4][5] Estas nombraj esceptoj al tiu ordigo. La Eŭropa fajrzona bufo (Bombina bombina) havas iom verukhavan haŭton kaj preferas akvecan habitaton[6] dum la Panama ora rano (Atelopus zeteki) estas en la bufa familio Bufonedoj kaj havas mildan haŭton.[7]
La grupo de Anura inkludas ĉiujn modernajn ranojn kaj ajnajn fosiliajn speciojn kiuj kongruas ene de la anura difino. La karakteroj de anuraj plenkreskuloj inkludas: 9 aŭ malmultajn antaŭsakrajn vertebrojn, la esto de urostilaj formitaj aŭ fuziitaj vertebroj, sen vosto, longa kaj antaŭendekliva ilio, pli mallongaj antaŭaj membroj ol malantaŭaj, radiuso kaj ulno fuziitaj, tibio kaj fibulo fuziitaj, longecaj taloj, foresto de antaŭfronta osto, esto de hioida plato, malsupra makzelo sendenta (kun la escepto de Gastrotheca guentheri) konsistanta el tri paroj de ostoj (angulospleniaj, dentaj, kaj mentomekeliaj, el kiuj tiu lasta paro forestas ĉe la klado Pipoidea),[8] nesubtenita lango, limfaj spacoj subhaŭtaj, kaj muskolo, nome protractor lentis, ligita al la lenso de la okulo.[9] La anuraj larvoj aŭ ranidoj havas unusolan centran spiran spirtruon kaj buŝopartojn konsistantaj el keratinecaj bekoj kaj dentaĵoj.[9]

Ranoj kaj bufoj estas ĝenerale klasitaj en tri subordojn: Malnovbatrakoj, kiuj inkludas kvar familiojn de praranoj; Mezbatrakoj, kiuj inkludas kvin familiojn de pli evoluciitaj intermezaj ranoj; kaj Novbatrakoj, laŭ multe la plej granda grupo, kiu enhavas la ceterajn 24 familiojn de modernaj ranoj, inkludante plej oftajn speciojn tra la tuta mondo. La subordo de Novbatrakoj estas siavice dividita en du superfamilioj nome Hyloidea kaj Ranoidea.[10] Tiu klasigo estas bazita sur trajtoj de morfologio kiaj la nombro de vertebroj, la strukturo de la brusta skapolo, kaj la morfologio de ranidoj. Kvankam tiu klasigo estas tre malferme akceptita, la rilataro inter familioj de ranoj estas ankoraŭ studota.[11]
Kelkaj specioj de anuroj pretas hibridiĝi. Por ekzemplo, la manĝebla rano (Pelophylax esculentus) estas hibrido inter la lagorano (P. lessonae) kaj la ridorano (P. ridibundus).[12] La fajrventraj bufoj Bombina bombina kaj la B. variegata estas similaj laŭ inklino al hibridiĝo. Tiuj estas malpli fekundaj ol ties gepatroj, kio kondukas al hibrida zono kie la hibridoj estas hegemoniaj.[13]
Estas proksimume 5 000 specioj nune konataj de anuroj. La vivantaj anuroj estas ofte dividitaj al tri subordoj.

Ranoj ne havas voston, escepte kiam larvoj, kaj plej havas longajn malantaŭajn krurojn, longajn maleolajn ostojn, membranhavajn fingrojn, senungajn, grandajn okulojn, kaj mildan aŭ verukhavan haŭtaĵon. Ili havas mallongajn vertebrarojn, kun ne pli ol 10 liberaj vertebroj kaj fuziitaj vostostoj.[14] Kiel ĉe aliaj amfibioj, oksigeno povas pasi tra ties tre trapaseblaj haŭtoj. Tiu unika trajto permesas ilin resti en lokoj sen aliro al la aero, spirante tra siaj haŭtoj.[15] La ripoj estas malbone disvolvigitaj, kaj tiele la pulmoj estas plenigitaj per la buŝa pumpado kaj rano senigita el siaj pulmoj povas elteni siajn korpofunkciojn sen ili.[15] Por ke la haŭto utilas kiel spira organo, ĝi devas resti humida. Tio faras ke ranoj tuŝeblas de variaj substancoj kiujn ili povas traafi en la medio, kelkaj el kiuj povas esti venenaj kaj povas dissolviĝi en akvofilmo kaj povas pasi al ties sangofluon. Tio povas esti unu el la kaŭzoj de la tutmonda malpliiĝo en ranopopulacioj.[16][17][18][19]
Ranoj gamas laŭgrande el la ĵus malkovrita 7.7 mm Paedophryne amauensis de Papuo-Nov-Gvineo[20] al la 300 mm goliata rano (Conraua goliath) de Kameruno. La haŭto pendas malfikse sur la korpo pro la manko de malfiksa konektohisto. Ranoj havas tri okul-harajn membranojn: unu estas travidebla por protekti la okulojn subakve, kaj du varias el travideblaj al netravideblaj. Ili havas timpanon en ĉiu flanko de ties kapoj kiu utilas al aŭdado kaj, en kelkaj specioj, estas kovrataj de haŭtaĵo. Veraj bufoj tute ne havas dentojn, sed plej ranoj havas ilin, specife pedicelajn dentojn en kiuj la krono estas separata el la radiko per fibra histo. Tiuj estas ĉe la bordo de supra makzelo kaj ankaŭ estas vomeraj dentoj sur la palato de ties buŝoj. Ne estas dentoj en la malsupra makzelo kaj ranoj kutime englutas sian manĝon kiel tuto. La dentoj estas ĉefe uzataj por kapti la predon kaj teni ĝin surloke ĝis engluto, procezo helpata de la retirigo de la okuloj en la kapo.[21] La afrika taŭrorano (Pyxicephalus), kiu predas relative grandajn animalojn kiaj musoj kaj aliaj ranoj, havas konusformajn ostoprojekciojn nomitajn odontoidaj procezoj ĉe la antaŭo de la malsupra makzelo kio funkcias kiel dentoj.[3]
La strukturo de la piedoj kaj kruroj ege varias inter ranospecioj, dependante parte ĉu ili loĝas ĉefe surgrunde, en akvo, en arboj aŭ en nestotruoj. Ranoj devas kapabli moviĝi rapide tra sia medio por kapti predojn kaj fuĝi el predantoj, kaj nombraj adaptoj helpas ilin fari tion. Plej ranoj estas bonaj saltantoj aŭ posteuloj de prauloj kiuj estis tio, kaj multo de muskol-skeleta morfologio modifiĝis tiucele. La tibio, fibulo, kaj tarsoj fuziiĝis en unusola, forta osto, ĉar havas la radiuson kaj la ulnon en la antaŭaj kruroj (kiuj povas absorbi la frapon de surteriĝo). La metatarsoj plilongiĝis por aldoni al la kruro longon kaj permesi al la rano peliĝi kontraŭ la grundo dum pli longa tempoperiodo en la eksalto. La ilio plilongiĝis kaj formis movevlan artikon kun la sakro kiu, ĉe specialistaj saltantoj kiaj ranedoj kaj hiledoj, funkcias kiel aldona krurartiko por havi plian povon en la saltoj. La vostovertebroj fuziiĝis en urostilo kiu estas retirita ene de la pelvo. Tio permesas ke la forto estu transpasata el la kruroj al la korpo dum salto.[14]
La muskola sistemo simile modifiĝis. La malantaŭaj kruroj de praranoj supozeble enhavis parojn de muskoloj kiuj estus agintaj male (unu muskolo por faldi la genuon, alia muskolo por etendigi ĝin), kiel estas vidata en plej el aliaj krurhavaj animaloj. Tamen, ĉe modernaj ranoj, preskaŭ ĉiuj muskoloj estis modifitaj por kontribui al la agado salti, kun nur kelkaj malgrandaj muskoloj restantaj por revenigi la kruron reen al la starta loko kaj elteni la sintenon. Ankaŭ la muskoloj estis ege pligrandigitaj, kaj la ĉefaj krurojmuskoloj respondecas pro ĉirkaŭ 17% el la totala amaso de la rano.[22]
Multaj ranoj havas membranhavajn piedojn kaj la grado de membraneco estas rekte proporcia al la kvanto de tempo kiun la specio pasas en akvo.[23] La komplete akvoloĝanta Afrika nana rano (specioj de genro Hymenochirus) havas tute membranhavajn fingrojn, dum tiuj de la arborano de White (Litoria caerulea), nome arboloĝanta specio, estas nur kvarone aŭ duone membranhavaj.[24]
La arboranoj havas kusenetojn en la finoj de siaj fingrojn por helpi alkroĉado al vertikalaj surfacoj. Tiuj ne estas suĉokusenetoj, anstataŭe la surfaco konsistas el kolonaj ĉeloj kun ebenaj pintoj kun malgrandaj malplenaĵoj inter ili lubrikitaj de mukaj glandoj. Kiam la ranoj aplikas premon, la ĉeloj algluiĝas al la malregulaĵoj de la surfaco kaj la alkroĉo estas tenita pere de surfaca tensio. Tio permesas la ranon grimpi sur mildaj surfacoj, sed la sistemo ne funkcias efike kiam la kusenetoj estas tro malsekaj.[25]
En multaj arboranoj, malgranda "intermetita strukturo" en ĉiu fingro pliigas la surfacan areon tuŝantan la subtavolon. Krome, ĉar saltado tra arboj povas esti danĝera, multaj arboranoj havas taliajn artikojn kiuj permesas kaj saltadon kaj piediradon. Kelkaj ranoj kiuj loĝas alte en arboj eĉ posedas prilaboratan gradon de membraneco inter siaj fingroj. Tio permesas ke la ranoj "paraŝutas" aŭ faras kontrolatan glitadon el unu loko en la kanopeo al alia.[26]
Grundoloĝantaj ranoj ĝenerale ne havas la adaptaĵojn de akvoloĝantaj kaj arboremaj ranoj. Plej havas pli malgrandajn fingrokusenojn, se estas io tia, kaj malmultan membranecon. Kelkaj nestotruaj ranoj kiaj la Kouĉa skafiopo (Scaphiopus couchii) havas klapecan fingretendaĵon ĉe malantaŭaj piedoj, nome tuberaĵon el keratino ofte referencata kiel ŝpato, kio helpas ili nestotrui.[27]
Foje dum la stadio de ranidoj, unu el la disvolviĝantaj malantaŭaj kruroj estas manĝata de predanto kiel ekzemple libela nimfo. En kelkaj okazoj, plena kruro ankoraŭ kreskas, sed en aliaj ne, kvankam la rano povas ankoraŭ vivi sian normalan vivodaŭron kun nur tri kruroj. Foje, parazita platvermo (Ribeiroia ondatrae) elfosas en la malantaŭo de ranido, kio kaŭzas rearanĝon de la kruraj ĝermoĉeloj kaj la rano povas disvolvigi kroman kruron aŭ eĉ du.[28]
La haŭto de rano estas protekta, havas spiran funkcion, povas absorbi akvon kaj helpas kontrolon la korpotemperaturon. Ĝi havas multajn glandojn, partikularle sur la kapo kaj la dorso, kiuj ofte eksudas malbongustajn kaj venenajn substancojn. La sekrecio estas ofte glueca kaj helpas teni la haŭton malseka, protektas kontraŭ la eniro de ŝimoj kaj bakterioj, kaj faras la animalon glitiga kaj pli kapabla fuĝi el predantoj.[29] La haŭto estas mudo|mudata post kelkaj semajnoj. Ĝi kutime elŝiriĝas en la mezo de la dorso kaj tra la ventro, kaj la rano eligas siajn brakojn kaj krurojn. La mudata haŭtaĵo estas poste movigita al la kapo kie ĝi estas rapide manĝata.[30]
Estante malvarmsangaj, ranoj adoptas taŭgajn kondutajn modelojn por reguligi sian temperaturon. Por plivarmiĝi, ili povas moviĝi al la suno aŭ al varma surfaco; se ili trovarmiĝas, ili povas moviĝi en la ombro aŭ adoptante sintenon kiu eksponas la minimuman areon de haŭto al la aero. Tiu sinteno estas uzata ankaŭ por eviti akvoperdon kaj inkludas ke la rano kaŭras ĉe la subtavolo kun siaj manoj kaj piedoj metitajn sub siaj mentono kaj korpo.[31] La koloro de la haŭto de rano estas uzata por termoregulado. En malvarmetaj marĉokondiĉoj, la koloro estos pli malhela ol dum varma seka tago. La griza saŭmonesta arborano (Chiromantis xerampelina) kapablas eĉ turniĝi blanka por minimumi la ŝancon trovarmiĝi.[32]
Multaj ranoj kapablas absorbi akvon kaj oksigenon rekte tra la haŭto, speciale ĉirkaŭ la pelva areo, sed la permeableco de la rana haŭto povas rezulti ankaŭ en akvoperdo. Glandoj situas sur la tuta korpo eksudas mukon kiu helpas teni la haŭton malseka kaj malpliigas vaporigon. Kelkaj glandoj en la manoj kaj brusto de maskloj estas specializitaj en produktado de gluecaj sekrecioj por helpi en ampleksumo. Similaj glandoj en arboranoj produktas gluecan substancon sur la gluigaj diskoj de la piedoj. Kelkaj arboranoj malpliigas akvoperdon per havado de akvimuna tavolo de haŭto, kaj kelkaj sudamerikaj specioj kovras sian haŭton per vakseca sekrecio. Aliaj ranoj havas adoptitajn kutimojn por konservi akvon, inklude eston noktula kaj ripozado en akvo-konserva situacio. Kelkaj ranoj povas ankaŭ ripozi en grandaj grupoj el kiu ĉiu rano premiĝas kontraŭ siaj najbaroj. Tio malpliigas la kvanton de haŭto eksponita al la aero aŭ al seka surfaco, kaj tiele malpliigas la akvoperdon.[31] La Vudhaŭsa bufo (Bufo woodhousii), se havas aliron al akvo post estado en seka loko, sidas en malprofundaĵo por reakviĝi.[33] La masklo de harrano aŭ triĥobatraĥo (Trichobatrachus robustus) havas dermajn papilojn projekciantaj el ties malsupra dorso kaj femuroj, kio havigas al ĝi krispan aspekton. Ili enhavas sangotubetojn kaj oni supozas ke ili pliigas la areon de haŭto disponebla por spirado.[34]
Kelkaj specioj havas ostecajn platojn enmetitajn en sia haŭto, nome trajto kiu ŝajne evoluis sendepende kelkajn fojojn.[35] En kelkaj aliaj specioj, la haŭto ĉe la pinto de la kapo estas kompaktigitaj kaj la konekta histo de la dermo estas kun-ostigita kun la ostoj de la kranio (eksostozo).[36][37]
Kamuflado estas ofta defenda mekanismo ĉe ranoj. Plej kamuflaj ranoj estas noktemaj; dumtage ili serĉas sintenon kie ili povas miksiĝi en la fono kaj resti sendetekte. Kelkaj ranoj havas kapablon ŝanĝi koloron, sed tio estas kutim limigita al malgranda gamo de koloroj. Por ekzemplo, la arborano de White (Litoria caerulea) varias inter helverda kaj bruneca laŭ la temperaturo, kaj la Pacifika arborano (Pseudacris regilla) havas verdajn kaj brunajn morfojn, senmakule aŭ makule, kaj ŝanĝas koloron depende el la jarepoko kaj ĝenerala fonkoloro.[38] Trajtoj kiaj verukoj kaj haŭtofaldoj estas kutime ĉe grundoloĝantaj ranoj, ĉe kiuj milda haŭto ne havigas tiom efikan kamufladon. Kelkaj ranoj ŝanĝas koloron inter nokto kaj tago, ĉar lumo kaj malsekeco stimulas la pigmentoĉelojn kaj faras ke ili etendiĝu aŭ kuntiriĝu.[15]
La haŭto de rano estas permeabla al oksigeno kaj al karbona duoksido, same kiel al akvo. Estas sangotubetoj ĉe la surfaco de la haŭto kaj kiam rano estas subakvo, oksigeno disiĝas rekte en la sango. Kiam ne subakve, rano spiras per procezo konata kiel buŝa pumpado. Ties pulmoj estas similaj al tiuj de homoj, sed la brustomuskoloj ne intervenas en spirado, kaj ne ekzistas ripoj aŭ diafragmo kiu helpu movigu la aeron enen kaj eksteren. Anstataŭe, ĝi ŝvelas sian gorĝon kaj enmetas aeron tra la naztruoj, kio en multaj specioj povas fermiĝi per valvoj. Kiam la suba muŝo estas kumpremita, aero estas pelita en la pulmoj.[39] La tute akva KAlimanta barburulo (Barbourula kalimantanensis) estas la unua rano konata kiu tute ne havas pulmojn.[40]
Ranoj havas tri-ĉambrajn korojn, trajto kiun ili kunhavas kun lacertoj.[41] Oksigenenhava sango el pulmoj kaj sen-oksigena sango el la histoj de spirado eniras en la koron tra separataj aŭrikloj. Kiam tiuj ĉambroj kuntiriĝas, la du sangorojoj pasas en komunan ventriklon antaŭ esti pumpita tra spirala valvo al la taŭga tubeto, nome aorto por oksigenenhava sango kaj pulmarterio por sen-oksigena sango. La ventriklo estas parte dividita en mallarĝaj kavaĵoj kiuj malgrandigas la mikson de la du sangotipoj. Tiuj trajtoj permesas al ranoj havi pli altan metabolan proporcion kaj esti pli aktivaj ol alimaniere estus ebla.[41]
Kelkaj specioj de ranoj havas adaptaĵojn kiuj permesas ilin survivi en oksigenmanka akvo. La rano de la Lago Titikaka (Telmatobius culeus) estas unu tia specio kaj havas faldecan haŭton kiu pliigas sian surfacan areon por faciligi la gasan interŝanĝon. Ĝi normale ne faras uzadon de siaj rudimentaj pulmoj sed ĝi foje plialtigas kaj malaltigas sian korporitmon en la lagofundo por pliigi la fluadon de akvo ĉirkaŭ ĝi.[42]
Ranoj havas makzelajn dentojn laŭlonge de siaj supraj makzeloj kiuj estas uzataj por teni manĝaĵon antaŭ engluti ĝin. Tiuj dentoj estas tre malfortaj, kaj ne povas esti uzataj por maĉado aŭ kaptado kaj damaĝo de lertaj predoj. Anstataŭe, la rano uzas sian gluecan, fendan langon por kapti muŝojn kaj aliajn malgrandajn moviĝantajn predojn. La lango normale kuŝas volvita en la buŝo, libera ĉe la dorso kaj ligita al la makzelo frunte. Ĝi povas esti elpafita kaj retirita je granda rapido.[23] Kelkaj ranoj ne havas langon kaj metas manĝaĵon en siaj buŝoj nur per siaj manoj.[23] La okuloj helpas en la englutado de manĝaĵoj ĉar ili povas esti retiritaj tra truoj en la kranion kaj helpas peli manĝaĵojn suben al la gorĝo.[23] La manĝaĵo poste moviĝas tra la ezofago en la stomakon kie la digestaj enzimoj estas aldonitaj kaj ĝi estas kirlita. Ĝi poste sekvas al la malgranda intesto (duodeno kaj ileo) kie plej de la digesto okazas. Pankreata suko el la pankreato, kaj la galo, produktita de la hepato kaj stokita en la gal-veziko, estas sekreciataj en la malgranda intesto, kie la fluaĵoj digestigas la manĝaĵon kaj la nutraĵoj estas absorbitaj. La manĝoruboj pasas al la granda intesto kie la troa akvo estas forigita kaj la restaĵoj estas pasataj tra la kloako.[43]
Kvankam adaptitaj al la sutera vivo, ranoj similas al la nesalakvaj fiŝoj en sia nekapablo konservi la korpakvon efektive. Kiam ili estas surtere, multa akvo perdiĝas pro evaporado tra la haŭto. La ekskrecia sistemo estas simila al tiu de mamuloj kaj estas du renoj kiuj forigas nitrogenajn produktojn el la sango. Ranoj produktas grandajn kvantojn de dissolvita urino por forigi la venenajn produktojn el la renaj tubetoj.[44] La nitrogeno estas ekskreciata kiel amoniako fare de ranidoj kaj akvaj ranoj sed ĉefe kiel ureo, malpli venena produkto, fare de plej surteraj plenkreskuloj. Kelkaj specioj de arborano kun malmulta aliro al akvo ekskrecias la eĉ malpli venenan ureatan acidon.[44] La urino passs laŭlonge de paraj ureteroj al la urina veziko el kiu ĝi estas forigita periode al la kloako. Ĉiuj korporubaĵoj eliras el la korpo tra la kloako kiu finas en kloaka elirejo.[45]
Ĉe la maskla rano, la du testikoj estas ligitaj al la renoj kaj spermo pasas al la renoj tra fajnaj tuboj nome spermo-duktoj aŭ eferentaj duktoj. Ĝi poste vetura tra la ureteroj, kiuj estas logike konataj kiel urinogenitaj duktoj. Ne estas peniso, kaj la spermo estas eligita el la kloako rekte sur la ovojn kiam la ino demetas ilin. La ovarioj de la ranino estas apud la renoj kaj la ovoj pasas laŭ paro de ovoduktoj kaj tra la kloako al la ekstero.[45]
Kiam la ranoj pariĝas, la masklo grimpas surdorse de la ino kaj per siaj antaŭaj kruroj ĉirkaŭas ŝian korpon, ĉu malantaŭ ŝiaj antaŭaj kruroj aŭ ĝuste antaŭ ŝiaj malantaŭaj kruroj. Tiu sinteno estas nomita ampleksumo kaj povas pludaŭri eĉ dum kelkaj tagoj.[46] La maskla rano havas kelkajn hormon-dependajn duarangajn seksajn karakterojn. Tiuj povas esti la disvolvigo de specialaj kusenetoj sur siaj dikfingroj en la reprodukta sezono, por doni al li firman kaptokapablon.[47] La brakumo de la maskla rano dum la ampleksumo stimulas la inon ovodemeti, kutime volvita en gelateno, kiel frajo.[45] En multaj specioj la masklo estas pli malgranda kaj svelta ol la ino. Maskloj havas voĉajn kordojn kaj faras gamon de kvakoj, partikulare en la reprodukta sezono, kaj en kelkaj specioj ili havas ankaŭ voĉosakojn por amplifi la sonon.[45]
La ranoj havas tre disvolvigitan nervosistemon kiu konsistas el cerbo, spina kordo kaj nervoj. Multaj partoj de la rana cerbo korespondas kun tiuj de homoj. Ĝi konsistas el du flarloboj, du cerbaj hemisferoj, pineala glando, du vidloboj, cerbeto kaj mjela plilongigo. Muskolara kunordigo kaj sinteno estas kontrolata de la cerbeto, kaj la mjela plilongigo regulas spiradon, digeston kaj aliajn aŭtomatajn funkciojn.[45] La relativa grando de la cerbeto en ranoj estas multe pli malgranda ol ĝi estas en homoj. Ranoj havas dek parojn de cerbaj nervoj kiuj pasas informaron el la ekstero rekte al la cerbo, kaj dek parojn de spinaj nervoj kiuj pasas informaron el la pintoj de la cerbo tra la spina kordo.[45] Kontraste, ĉiuj amniotoj (mamuloj, birdoj kaj reptilioj) havas dekdu parojn de kraniaj nervoj.[48]
La okuloj de plej ranoj estas situaj ĉe ĉiu flanko de la kapo ĉe la pinto kaj projekcias eksteren kiel duonsferaj elstaraĵoj. Ili havigas duokulan vidkapablon al kampo de 100° antaŭe kaj al totala vidkampo de preskaŭ 360°.[49] Ili povas estis la nura parto de por la cetero enakva rano kiu estas eksterakve. Ĉiu okulo havas fermeblajn suprajn kaj malsuprajn palpebrojn kaj niktiton kiu havigas plian protekton, speciale kiam la rano naĝas.[50] Membroj de la akva familio de Pipedoj havas la okulojn situaj ĉe la kapopinto, loko pli bone taŭga por detektado de predo en la supra akvo.[49] La irisoj montras gamon de koloroj kaj la pupiloj gamon de formoj. La komuna bufo (Bufo bufo) havas orkolorajn irisojn kaj horizontalajn fendecajn pupilojn, la ruĝokula arborano (Agalychnis callidryas) havas vertikalajn fendopupilojn, la venenaj sagetranoj havas malhelajn irisojn, la fajrventraj bufoj (specioj de la genro Bombina) havas triangulajn pupilojn kaj la tomatoranoj (specioj de la genro Dyscophus) havas cirklajn pupilojn. La irisoj de la suda bufo (Anaxyrus terrestris) havas bildomodelon kiu celas miksiĝi kun la ĉirkaŭa kamufla haŭto.[50]
La aldistanca vidkapablo de rano estas pli bone ol ties deproksima vidkapablo. Alvokantaj ranoj tuj silentiĝos kima ili vidas entrudulon aŭ eĉ nur moviĝantan ombron, sed ju pli proksima esta objekto, malplej facile ĝi estas vidata.[50] Kiam rano pafas sian langon por kapti insekton ĝi estas reagante al malgranda moviĝanta objekton kiun ĝi ne povas vidi bone kaj ĝi devas bone lokigi antaŭfare precize ĉar iliaj okuloj fermiĝas kiam la lango estas etendita.[23] Ĉu rano vidas kolore estas debatata sed oni montris ke ĝi respondas pozitive al la blua lumo, eble ĉar tiu koloro estas asocia kun akvejoj kiuj povas havigi rifuĝon kiam la rano sentas sin minacita.[51]
Ranoj povas aŭdi kaj en aero kaj sub akvo. Ili ne havas eksterajn orelojn; la orel-membranoj estas rekte eksponitaj aŭ povas esti kovrataj per tavolo de haŭto kaj estas videblaj kiel cirkla areo ĝuste malantaŭ la okulo. La grando kaj distanco el la orelmembranoj rilatas al la frekvenco kaj ondolongo je kiu la rano alvokas. En kelkaj specioj kiaj la taŭrorano, la grando de la membrano indikas la sekson de la rano; maskloj havas membranojn kiuj estas pli grandaj ol ties okuloj dum ĉe inoj, la okuloj kaj membranoj estas multe samgrandaj.[52] Bruo kaŭzas ke la membrano vibras kaj la sono estas transigita al la meza kaj interna orelo. La meza orelo enhavas duoncirklajn kanalojn kiuj helpas kontroli ekvilibron kaj orientadon. En la interna orelo, la aŭdoharaj ĉeloj estas aranĝitaj en du areoj de la koĥleo, nome la bazaj papiloj kaj la amfibiaj papiloj. La unuaj detektas altajn frekvencojn kaj la lasta malaltajn frekvencojn.[53] Ĉar la koĥleo estas mallonga, ranoj uzas elektran mekanismon por etendi siajn kampojn de aŭdeblajn frekvencojn kaj helpi diskriminacii diferencajn sonojn.[54] Tiu aranĝo ebligas la detektadon de teritoriaj kaj reproduktaj alvokoj de la samspecianoj. En kelkaj specioj kiuj loĝas en aridaj regionoj, la sono de ŝtormo aŭ forta pluvo povas eligi ilin el dormanta stato.[53] Rano povas esti alarmita pro neatendita bruo sed ĝi kutime faras nenian agon ĝis ĝi lokigis la fonton de la sono pervide.[52]
La alvoko aŭ kvako de rano estas unika de ĝia specio. Ranoj kreas tiun sonon per pasado de aero tra la laringo en la gorĝon. En plej el la ranalvokoj, la sono estas amplifita de unu aŭ pliaj voĉosakoj, membranoj de haŭto sub la gorĝo aŭ ĉe la angulo de la buŝo, kiuj etendas dum la amplifado de la alvoko. Kelkaj ranalvokoj estas tiom laŭtaj ke ili povas esti aŭdataj ĝis el unu mejlon for.[55]
Ranoj de la genroj Heleioporus kaj Neobatrachus ne havas voĉosakojn sed povas tamen produkti laŭtan alvokon. Ties buŝa kavaĵo estas pligrandigita kaj kupolforma, kaj funkcias kiel resonejo kiu amplifas la sonon. Specioj de ranoj kiuj ne havas voĉosakojn kaj kiuj ne havas laŭtan alvokon tendencas loĝi en areoj ĉe konstanta bruo, fluanta akvo. Ili bezonas uzi alternativajn rimedojn por komuniki. La marborda vostorano (Ascaphus truei) loĝas en montorojoj de Nordameriko kaj ne havas voĉon.[56]
La ĉefa tialo por alvoko estas ebligi ke la masklaj ranoj allogu partneron. Maskloj povas alvoki individue aŭ povas esti ĥoro de sonoj kie nombraj maskloj koincidas en reproduktejoj. Inoj de multaj ranospecioj, kiaj la ordinara arborano (Polypedates leucomystax), respondas al la masklalvokoj, kio funkcias por plifortigi la reproduktan aktivecon en reprodukta kolonio.[57] Raninoj preferas masklojn kiuj produktas sonojn de pli granda intenseco kaj pli malalta frekvenco, atributoj kiuj elstaras el ranaro. La tialo por tio ŝajne estas montri la propran forton, la masklo montras sian bonfarton por produkti pli bonkvalitajn idarojn.[58]
Diferenca alvoko estas elsendata de masklo aŭ nericevema ino kiam ŝi estas rajdata de masklo. Tiu estas distinga ĉirpada sono kaj estas akompanata de vibrado de la korpo.[59] Arboranoj kaj kelkaj ne-akvaj specioj havas pluvalvokon kiun ili faras surbaze de humideco antaŭ pluvo.[59] Multaj specioj havas ankaŭ teritorian alvokon kiu estas uzata por forigi aliajn masklojn. Ĉiuj el tiuj alvokoj estas elsendataj havante fermitan buŝon.[59] Danĝeralvoko, elsendata de kelkaj ranoj kiam ili estas en danĝero, estas produktita havante malfermitan buŝon rezulte en pli altatona alvoko. Ĝi estas tipe uzata kiam la rano estas kaptata de predanto kaj povas utili por forigi aŭ disorientigi la atakanton tiele ke ĝi liberigas la ranon.[59]
Multaj specioj de ranoj havas profundajn alvokojn. La kveko de la amerika Taŭra rano (Rana catesbiana) estas foje srkibita anglalingve kiel "jug o' rum".[60] La Pacifika arborano (Pseudacris regilla) produktas la onomatopean "ribbit" ofte aŭdata en filmoj.[61] Aliaj literumadoj de ranalvokoj estas "brekekekex koax koax", nome alvoko de Ridorano (Pelophylax ridibundus) en La ranoj, de antikva greka komedia dramo de Aristofano.[62]
Dum tre malfacilaj vivkondiĉoj, kelkaj ranoj eniras al stato de letargio kaj restas neaktivaj dum monatoj. En pli malvarmaj regionoj, multaj specioj de ranoj vintrodormas vintre. Tiuj kiuj loĝas surtere kiel la Amerika bufo (Bufo americanus) elfosas truon kaj faras vintrumejon en kiu kuŝas dormetanta. Alia, malpli efika elfosanto, trovas fendon aŭ enterigas sin en sekaj folioj. Akvaj specioj kiaj la Taŭra rano (Rana catesbeiana) normale sinkas en la fundo de flako kie ili kuŝas, duonenmetitaj en koto sed ankoraŭ kapablas aliri al la oksigeno dissolvita en akvo. Ties metabolo malrapidiĝas kaj ili vivas el siaj energirezervoj. Kelkaj ranoj povas eĉ survivi frostigitaj. Glacikristaloj formiĝas sub la haŭto kaj en la korpokavaĵo sed la esencaj organoj estas protektataj el frostado per alta koncentrado de glukozo. Ŝajne senviva, frostigitarano povas re-ekspiradi kaj la koro povas restarti kiam la kondiĉoj revarmiĝas.[63]
Aliflanke, la stria truorano (Cyclorana alboguttata) regule letargie somerumas dum la varma, seka sezono en Aŭstralio, survivante en dormanta stato sen aliro al manĝo aŭ akvo dum naŭ aŭ dek monatoj de la jaro. Ĝi nestotruas subgrunde kaj buliĝas ene de protekta kokono formata de sia eligita haŭtaĵo. Esploristoj de la Universitato de Kvinslando troviĝis ke dum tiu letargia somerumado, la metabolo de la rano estas ŝanĝita kaj la operacia efikeco de la mitokondrio pliiĝas. Tio signifas ke la limigita kvanto de energio disponebla por la komateca rano estas uzata en pli efika maniero. Tiu surviva mekanismo estas utila nur por animaloj kiuj restas komplete nekonsciaj dum etenda tempoperiodo kaj kies energiaj postuloj estas malaltaj ĉar ili estas malvarmsangaj kaj ne bezonas generi varmon.[64] Alia esplorado montris ke, por havigi tiujn energiajn postulojn, muskoloj atrofias, sed la muskoloj de la antaŭaj kruroj prefere ne estas tuŝitaj de tio.[65] Oni trovis ranojn kiuj havas suprajn kritikajn temperaturojn de ĉirkaŭ 41 gradojn Celsius.[66]
Anuroj (science: Anura el antikva greka an-, sen + oura, vosto, aŭ senvostaj amfibioj) estas la biologia ordo de karnovoraj mallongkorpaj senvostaj bestoj en la klaso amfibioj kiu inkluzivas ranojn kaj bufojn. Tamen, ne estas klara scienca distingo inter ranoj kaj bufoj. Unu familio de anuroj la diskolanguloj, havas ecojn de ambaŭ ranoj kaj bufoj.
La plej antikva fosilia "pra-rano" nome Triadobatrachus aperis en la komenco de Triaso de Madagaskaro, sed datado per molekula horloĝo sugestas ke ties originoj povas etendi plue reen al Permio, antaŭ 265 milionoj da jaroj. Ranoj estas amplekse distribuataj, game el tropikoj al ĉearktaj regionoj, sed la plej granda koncentro de specidiverseco estas en tropikaj pluvarbaroj. Estas proksimume 4 800 registritaj specioj, ĉirkaŭkalkule 85% el vivantaj amfibiaj specioj. Ili estas ankaŭ unu el la kvin plej diversaj ordoj de vertebruloj.
La korpokonsisto de plenkreska rano estas ĝenerale karakterizata de fortika korpo, elstaregaj okuloj, fenda lango, membroj falditaj suben, kaj foresto de vosto ĉe plenkreskuloj. Krom vivi en nesala akvo kaj sur seka tero, la plenkreskuloj de kelkaj specioj estas adaptitaj al loĝado subtera aŭ en arboj. La haŭto de ranoj estas glandenhava, kun sekrecioj gamaj el malbongustegaj al venenaj. Verukenhavaj specioj de ranoj tendencas esti nomataj bufoj sed la distingo inter ranoj kaj bufoj estas bazita sur neformalaj nomigaj konvencioj koncentrataj al la verukoj pli ol al taksonomio aŭ al evolua historio; kelkaj bufoj estas pli proksime rilataj al ranoj ol aliaj bufoj. La haŭto de ranoj varias en koloro el bone-kamuflitaj makulecaj bruna, griza kaj verda al tre koloraj modeloj de bril-ruĝa aŭ -flava kaj nigra por averti pri veneneco kaj predantoforigo.
Ranoj tipe demetas siajn ovojn en akvo. El la ovoj eliras larvoj nomataj ranidoj kiuj havas vostojn kaj internajn brankojn. Ili havas tre specializitajn asprajn buŝopartojn taŭgajn por herbovoraj, ĉiomanĝantaj aŭ planktonvorulaj dietoj. La vivociklo estas kompletita kiam ili metamorfozas al plenkreskuloj. Kelkaj specioj demetas ovojn surteren aŭ rekte eksteriras al stadio de ranido. Plenkreskaj ranoj ĝenerale havas karnovoran dieton konsistantan el malgrandaj senvertebruloj, sed ekzistas ankaŭ ĉiomanĝantaj specioj kaj kelkaj manĝas fruktojn. Ranoj estas tre efikaj je konverto de tio kion ili manĝas al korpomaso. Ili krome estas tre grava manĝofonto por predantoj kaj parto de la dinamiko de manĝoreto de multaj el la ekosistemoj de la mondo. La haŭto estas duontralasebla, kio faras ilin vundeblaj pro senakviĝo, kaj tiele ili ĉu vivas en humidaj lokoj aŭ havas specialajn adaptaĵojn por elteni sekajn habitatojn. Ranoj produktas ampleksan gamon de voĉoj, ĉefe dum la reprodukta sezono, kaj montras multajn diferencajn tipojn de kompleksaj kutimoj por allogi partnerojn, por forigi predantojn kaj ĝenerale por survivi.
Ranoj estas valoraj kiel manĝo de homoj kaj ankaŭ havas multajn kulturajn rolojn en literaturo, simbolismo kaj religio. Ranaj populacioj malpliiĝis grave el la 1950-aj jaroj. Pli ol unu triono da specioj estas konsiderataj minacataj de formorto kaj ĉirkaŭ cent dudek ŝajne iĝis formortintaj ekde la 1980-aj jaroj. La nombro de disformaĵoj inter ranoj estas malpliiĝanta kaj ĵuse konata funga malsano, nome Ĥitridjomikozo, disvastiĝis tra la tuta mondo. Konservobiologoj laboras por kompreni la kaŭzojn de tiuj problemoj kaj por solvi ilin.
La Arkeobatrakoj (Archaeobatrachia) estas subordo de Anura kiu enhavas variajn primitivajn ranojn kaj bufojn. Kiel la nomo laŭvorte sugestas, tiuj estas la plej primitivaj ranoj. Multaj el la specioj (28 totale) montras certajn fiziologiajn karakterojn kiuj forestas en aliaj ranoj kaj bufoj, tiele okazigante tiun grupon. Ili troviĝas amplekse en Eŭrazio, Novzelando, Filipinoj, kaj Borneo, kaj estas karaktere malgrandaj. Aldone, la familio Askafedoj troviĝas en la Pacifika Nordokcidento kaj norda Roka Montaro de Usono, kaj estas reprezentata nur de du specioj.
La Arkeobatrakoj (Archaeobatrachia) estas subordo de Anura kiu enhavas variajn primitivajn ranojn kaj bufojn. Kiel la nomo laŭvorte sugestas, tiuj estas la plej primitivaj ranoj. Multaj el la specioj (28 totale) montras certajn fiziologiajn karakterojn kiuj forestas en aliaj ranoj kaj bufoj, tiele okazigante tiun grupon. Ili troviĝas amplekse en Eŭrazio, Novzelando, Filipinoj, kaj Borneo, kaj estas karaktere malgrandaj. Aldone, la familio Askafedoj troviĝas en la Pacifika Nordokcidento kaj norda Roka Montaro de Usono, kaj estas reprezentata nur de du specioj.
Mezobatrakoj, Mezobatraĥoj aŭ laŭ latina scienca nomo Mesobatrachia, estas la dua plej granda el la ranaj subordoj de amfibioj. Fine de 2016, ĝi enhavis 3 superfamiliojn (nome Pelobatoidea, Pelodytoidea kaj Pipoidea), 6 familiojn, 16 genrojn, kaj 244 speciojn. Agnoskita kiel grupo en 1993, la nomo (meso- "mezo" batrachia "ranoj") kontrastas kun la primitivaj Arkeobatrakoj kaj kun la pli diversa kaj antaŭenirita Novbatrakoj.
La Mezobatrakoj enhavas kvin trunestajn familiojn, kiaj la ŝpatokruraj ranoj de Eŭropo, Nordameriko, kaj Orienta Azio, la Peloditedoj, kaj la Meksika nestotrua bufo, same kiel unu deviga akvoloĝanta familio, nome la Pipedoj de Afriko kaj Sudameriko.
La Mezobatrakoj estas relative nova grupo, kiu estis identigita nur en 1993.
Mezobatrakoj, Mezobatraĥoj aŭ laŭ latina scienca nomo Mesobatrachia, estas la dua plej granda el la ranaj subordoj de amfibioj. Fine de 2016, ĝi enhavis 3 superfamiliojn (nome Pelobatoidea, Pelodytoidea kaj Pipoidea), 6 familiojn, 16 genrojn, kaj 244 speciojn. Agnoskita kiel grupo en 1993, la nomo (meso- "mezo" batrachia "ranoj") kontrastas kun la primitivaj Arkeobatrakoj kaj kun la pli diversa kaj antaŭenirita Novbatrakoj.
La Mezobatrakoj enhavas kvin trunestajn familiojn, kiaj la ŝpatokruraj ranoj de Eŭropo, Nordameriko, kaj Orienta Azio, la Peloditedoj, kaj la Meksika nestotrua bufo, same kiel unu deviga akvoloĝanta familio, nome la Pipedoj de Afriko kaj Sudameriko.
La Mezobatrakoj estas relative nova grupo, kiu estis identigita nur en 1993.
Novbatrakoj, Novbatraĥoj aŭ laŭ latina scienca nomo Neobatrachia, estas unu el la tri ranaj subordoj de amfibioj, nome la ordo de ranoj kaj bufoj.
Tiu subordo estas la plej antaŭenira kaj apomorfa el la tri anuraj ordoj vivantaj nuntempe, kaj de tie la nomo, kiu laŭvorte signifas "novajn ranojn" (el la grekaj vortoj neo, signife "nova" kaj batrachia, signife "ranoj"). Ĝi estas ankaŭ multe la plej granda el la tri; ties pli ol 5,000 diferencaj specioj faras ke ĝi enhavas ĉirkaŭ 96% el ĉiuj vivantaj anuroj.
La diferenco inter Arkeobatrakoj, Mezobatrakoj, kaj Novbatrakoj estas bazata ĉefe sur diferencoj en anatomio, ĉefe en la strukturo de la skeleto, same kiel pro kelkaj videblaj karakteroj kaj kondutaroj.
La familioj nuntempe akceptitaj en Novbatrakoj fare de plej fakuloj estas la jenaj:
Novbatrakoj, Novbatraĥoj aŭ laŭ latina scienca nomo Neobatrachia, estas unu el la tri ranaj subordoj de amfibioj, nome la ordo de ranoj kaj bufoj.
Tiu subordo estas la plej antaŭenira kaj apomorfa el la tri anuraj ordoj vivantaj nuntempe, kaj de tie la nomo, kiu laŭvorte signifas "novajn ranojn" (el la grekaj vortoj neo, signife "nova" kaj batrachia, signife "ranoj"). Ĝi estas ankaŭ multe la plej granda el la tri; ties pli ol 5,000 diferencaj specioj faras ke ĝi enhavas ĉirkaŭ 96% el ĉiuj vivantaj anuroj.
La diferenco inter Arkeobatrakoj, Mezobatrakoj, kaj Novbatrakoj estas bazata ĉefe sur diferencoj en anatomio, ĉefe en la strukturo de la skeleto, same kiel pro kelkaj videblaj karakteroj kaj kondutaroj.
Listo de familiojLa familioj nuntempe akceptitaj en Novbatrakoj fare de plej fakuloj estas la jenaj:
Amfignatodontedoj – marsupiaj ranoj (foje en Hemifraktedoj) Aromobatedoj – (foje en Dendrobatedoj) Artroleptedoj – Braĥicefaledoj – Bufonedoj – veraj bufoj Kaliptocefaleledoj (foje en Bufonedoj) Centrolenedoj – vitroranoj (inklude Alofrinedoj) Ceratofriedoj Kraŭgastoredoj Hedges, Duellmann & Heinicke, 2008 (iam en Braĥicefaledoj) Dendrobatedoj – venenaj ranoj Eleŭterodaktiledoj Lutz, 1954 (iam en Braĥicefaledoj) Heleofrinedoj – fantomaj ranoj Hemifraktedoj Hemisotedoj – padevelnazaj ranoj Hiledoj – veraj arboranoj kaj parencoj (inklude Kriptobatraĥedoj, Hemifraktedoj) Hilodedoj Hiperoliedoj – Leiuperedoj (foje en Leptodactylidae) Leptodaktiledoj – sudaj ranoj, tropikaj ranoj (inklude Cikloramfedoj) Mantelledoj – Malagasaj ranoj Mikrohiledoj – mallarĝbuŝaj ranoj (inklude Brevicipitedoj) Miobatraĥedoj (inklude Limnodinastedoj, Reobatrahedoj) Petropedetedoj Pseŭdedoj Piksicefaledoj Ranedoj – veraj ranoj (inklude Ceratobatraĥedoj, Dikroglosedoj, Mikriksaledoj, Niktibatraĥedoj, Petropedetedoj, Frinobatraĥedoj, Ptikadenedoj, Piksicefaledoj) Raniksaledoj (foje en Ranedoj) Rakoforedoj – arbustaj ranoj, "arbustaj ranoj", "muskaj ranoj" Rinodermatedoj – Darvinaj ranoj (foje en Cikloramfedoj) Sooglosedoj – Sejŝelaj ranoj kaj purpura rano (inklude Nasikabatraĥedoj) Strabomantedoj Hedges, Duellmann & Heinicke, 2008 (kelkaj iam en Braĥicefaledoj)La Salientuloj aŭ laŭ la latina scienca nomo Salientia (el latina salere (salio), "salti") estas totala grupo de amfibioj kiu inkludas la ordon de Anuroj, nome ranoj kaj bufoj, kaj variajn formortintajn pra-ranojn kiuj estas pli proksime rilataj al la ranoj ol al la Urodeloj, nome salamandroj kaj trituroj.[1] La plej malnova fosilia "pra-rano" aperis en la komenca Triaso de Madagaskaro, sed la informo el la molekula horloĝo sugestas ke ties originoj povus etendiĝi reen al la Permio, antaŭ 265 milionoj da jaroj.
Oni trovis malmultajn fosiliojn de la komencaj salientuloj, kio malfaciligas difini la karakterojn de la grupo kaj de ties taksonomia rilataro. La aranĝo de brustaj elementoj kaj la nombro de vertebroj estas kelkaj helpiloj, sed la grado de vertebra artikado kaj la aranĝo de la ostoj en la kruroj ne montriĝis fidindaj indikiloj. La fruaj pra-ranoj disvolviĝis el temnospondiledaj prauloj en kiuj kelkaj el la elementoj de ties vertebroj restis separataj. La strukturo de la salientula pelvo kaj de malantaŭaj kruroj probable disvolviĝis el naĝado pli ol el saltado. El la strukturo de la vertebroj, la grupo ŝajne ne estas monofiletika. La evolucio de salientuloj ŝajnis esti rapida kaj radia. La esencaj trajtoj de la ĵusaj grupigadoj ŝajne establiĝis dum la Mesozoiko aŭ komenca Terciaro. La familioj Alitedoj, Pipedoj, kaj Pelobatedoj estas ekologie izolataj, kaj la Atelopoj, limigitaj al novtropika teritorio en Centra kaj Suda Ameriko, kaj la Ranedoj kaj Bufonedoj probable radiis el tropikaj regionoj de Afriko kaj Azio.[2]
La Salientuloj aŭ laŭ la latina scienca nomo Salientia (el latina salere (salio), "salti") estas totala grupo de amfibioj kiu inkludas la ordon de Anuroj, nome ranoj kaj bufoj, kaj variajn formortintajn pra-ranojn kiuj estas pli proksime rilataj al la ranoj ol al la Urodeloj, nome salamandroj kaj trituroj. La plej malnova fosilia "pra-rano" aperis en la komenca Triaso de Madagaskaro, sed la informo el la molekula horloĝo sugestas ke ties originoj povus etendiĝi reen al la Permio, antaŭ 265 milionoj da jaroj.
Los anuros (Anura, del griego antiguo ἀ(ν-) a(n-) (negación) y οὐρά ourá 'cola', que significa "sin cola") son un grupo de anfibios, con rango taxonómico de orden, conocidos coloquialmente como ranas y sapos. Los adultos se caracterizan por carecer de cola, por presentar un cuerpo corto y muy ensanchado, y unas patas posteriores muy desarrolladas y adaptadas para el salto. Los anuros son el grupo más numeroso de anfibios; se estima que existen unas 6608 especies, repartidas en 54 familias.[1] La mayoría pasa su vida en el agua o en su proximidad. Su tamaño puede variar desde unos escasos 8,5 mm, como es el caso de las especies del género Eleutherodactylus,[2] hasta tallas que superan los 30 cm, destacándose la rana goliat, el anuro más grande del mundo.[3]
Los nombres «rana» y «sapo» se referían en un principio a los dos tipos de anuros que aparecen en la península ibérica (y en general en Europa): las ranas típicas (las del género Rana y posterior género Pelophylax), y los sapos típicos (los del género Bufo); pero en la actualidad se usan para otros grupos de forma indiscriminada y arbitraria. «Rana» suele referirse a las especies más gráciles, de piel húmeda y lisa, buenas saltadoras, y de hábitos trepadores o acuáticos. «Sapo» hace referencia a las especies de piel más seca y rugosa, más robustas, marchadoras, menos ágiles y que suelen habitar en el suelo húmedo excavando galerías. Por tanto, esta distinción entre ranas y sapos no es una discriminación que tenga validez taxonómica.[4]
Los anuros presentan una boca muy ancha, con dientes diminutos o sin ellos, dependiendo de las especies, y con una lengua protráctil. Los ojos están provistos de párpados y los oídos no tienen pabellones externos, diferenciándose únicamente una membrana timpánica superficial.[5][6][7] El cráneo tiene un número reducido de huesos, con un esfenoetmoides, un otoccipital (exoccipital fusionado al proótico), paraesfenoides, columela auris, nasal, premaxilar, septomaxilar, maxilar, palatino (que está ausente en algunos taxones), pterigodes, cuadrado, cuadradoyugal (puede faltar), escamosal, frontoparietal, prevomer, mentomeckeliano, dentario, anguloesplenial y el aparato hioideo.[5] Los anuros presentan dos tipos de cintura pectoral dependiendo de la disposición de los elementos centrales. La más común llamada "cintura arcífera" presenta los cartílagos epicoracoides con el desarrollo de cuernos porteriores que articulan con el esternón. Los cartílagos epicoracoides generalmente se encuentran fusionados entre las clavículas pero se encuentran libres y usualmente se solapan en la zona posterior. La otra cintura, la "cintura firmisterna" no presenta estos "cuerpos" y se caracteriza porque el esternón está fusionado al arco pectoral y los cartílagos epicoracoides están fusionados entre sí. La zona media es más corta que en la cintura arcífera pero la parte anterior y posterior (llamadas prezonal y postzonal) se encuentran mucho más desarrolladas. Esta última cintura es característica de Ranidae, Microhylidae y Dendrobatidae. Algunos anfibios poseen estructuras intermedias llamadas pseudofirmisternas o pseudoarcíferas.[5]
Los dos pares de patas son muy diferentes entre sí, adquiriendo un mayor desarrollo y robustez el par posterior, que, además, se encuentra adaptado al salto. Las patas anteriores terminan en cuatro dedos, mientras que las posteriores lo hacen en cinco. La membrana que tienen entre sus dedos se llama membrana interdigital. Otra característica que favorece el salto es la presencia de la zona caudal de la columna vertebral reducida y fusionada en una estructura rígida llamada urostilo.[8] Los renacuajos (fase larvaria) llevan una vida acuática, mientras que los adultos son terrestres o de hábitos semiacuáticos.
Los anuros en estado larvario (los renacuajos) a menudo se alimentan normalmente de algas, por lo que son considerados animales herbívoros en esa fase. No obstante, existen algunas especies concretas de anuros, cuyos renacuajos también comen insectos acuáticos o peces de pequeño tamaño, siendo así omnívoras.[9]
Los anuros adultos se alimentan principalmente de diversos invertebrados, tanto acuáticos como terrestres, ya sea insectos, crustáceos, arácnidos y en algunos casos, de pequeños vertebrados como ratones y pequeñas lagartijas. En ocasiones, los anuros pueden recurrir al canibalismo alimentándose de larvas de su propia especie e incluso de otros anuros de menor tamaño.
Su técnica de alimentación es: cuando la presa se está acercando, la observan en silencio. Una vez que la presa este lo suficientemente cerca sacarán su lengua en la cual la presa quedará pegada y será absorbida por la boca rápidamente.[10]
Tienen una fecundación externa que se efectúa en el agua. El amplexo (forma de aparearse de los anuros) puede ser axilar o inguinal. Los huevos son puestos en el agua, en cordones, como hacen los sapos o en paquetes como lo hacen las ranas y presentan dimensiones y formas diferentes según la familia o especie.
Las primeras ranas verdaderas conocidas datan del Jurásico Inferior, Vieraella, y del Jurásico Medio, Notobatrachus. En España han aparecido especímenes de Costata del género Iberobatrachus y de Xenoanura del género Gracilibatrachus, datados en el Cretácico Inferior.[11]
Las relaciones filogenéticas de Anura y las secuencias de las primeras divergencias de este clado han sido materia de un gran número de debates. La mayor parte de esta polémica se centra en la posición filogenética de los clados alguna vez asignados a Archeobatrachia (grupo parafilético compuesto por Leiopelmatidae y Ascaphidae[12]) con respecto a los clados de Neobatrachia. Este último grupo, en el cual están presentes más de 2/3 de las especies de anfibios, está formado por Heleophrynidae y un clado conformado por los grupos Hyloides y Ranoides.
Anura Archaeobatrachia Pipanura Mesobatrachia Bombianura Costata Acosmanura Anomocoela Pelobatoidea Neobatrachia PhthanobatrachiaHyloides
Ranoides
Ranoides Allodapanura Afrobatrachia Xenosyneunitanura Laurentobatrachia Natatanura Victoranura Telmatobatrachia Ametrobatrachia Africanura Saukrobatrachia Aglaioanura Hyloides Sooglossoidea Notogaeanura Australobatrachia Nobleoanura Meridianura Terrarana Cladophrynia Tinctanura Athesphatanura Leptodactyliformes Chthonobatrachia Hesticobatrachia Agastorophrynia NobleobatiaLos cladogramas están basados en Frost et al. (2006) y Heinicke et al. (2009).[13][14]
Se reconocen las siguientes:[1]
Además, se incluyen los siguientes géneros como incertae sedis:
Y la siguiente especie como incertae sedis: Bufo pustulosus Laurenti, 1768
En 2016 se ha propuesto una reestructuración de la familia Hylidae que no se ha tenido en cuenta aquí.[16]
Los anuros (Anura, del griego antiguo ἀ(ν-) a(n-) (negación) y οὐρά ourá 'cola', que significa "sin cola") son un grupo de anfibios, con rango taxonómico de orden, conocidos coloquialmente como ranas y sapos. Los adultos se caracterizan por carecer de cola, por presentar un cuerpo corto y muy ensanchado, y unas patas posteriores muy desarrolladas y adaptadas para el salto. Los anuros son el grupo más numeroso de anfibios; se estima que existen unas 6608 especies, repartidas en 54 familias. La mayoría pasa su vida en el agua o en su proximidad. Su tamaño puede variar desde unos escasos 8,5 mm, como es el caso de las especies del género Eleutherodactylus, hasta tallas que superan los 30 cm, destacándose la rana goliat, el anuro más grande del mundo.
Päriskonnalised ehk anuurid (Anura) on kahepaiksete klassi kuuluv selts.
Sõna "anuurid" tähendab kreeka keeles 'sabatud' (αν + ουρα 'saba'). Tõepoolest, üksnes mõnel päriskonnalisel on täiskasvanuna lühike saba, enamikul liikidel puudub see täielikult. Siiski on päriskonnaliste kullestel pikk saba, mis näitab, et päriskonnalised põlvnevad sabaga esivanematest.
Päriskonnalisi nimetatakse sageli lihtsalt konnadeks (laiemas mõttes, kitsamas mõttes peetakse konnade all silmas perekonda konn (Rana)).
Päriskonnaliste selts jaguneb kolme alamseltsi: Archaeobatrachia, Mesobatrachia ja Neobatrachia.
"Loomade elu" jagab päriskonnalised viide alamseltsi, lähtudes selgroolülide liigestumise iseärasustest: kaksilohulised (Amphicoela), tagalohulised (Opisthocoela), erilohulised (Anomocoela), eeslohulised (Procoela) ja võõriklohulised (Diplasiocoela). Raamat eristab 19 sugukonda ja 176 perekonda. [1]
Päriskonnalised on levinud kõigis maailmajagudes peale Antarktise. Nad puuduvad üksnes Põhja-Jäämere saartel ja rannikul ning mõnel ookeanisaarel, näiteks Uus-Meremaa Lõunasaarel. Nad vajavad eluks niiskust, mistõttu neid ei ela ka Saharas ega Araabia poolsaare põhja- ja keskosas, kus on nende jaoks liiga kuiv.
Ürgseimate päriskonnaliste jäänused on leitud Põhja-Madagaskari alamtriiase ladestikust. Need kuulusid konnale Protobatrachus massinoti, kes oli umbes 10 cm pikk ja 16 selgroolüliga. Sealjuures olid kõik kerepiirkonna lülid peale esimese roietega (näiteks eeslohulistel ja võõriklohulistel puuduvad roided üldse). 3 sabalüli paiknesid lühikeste niudeluude vahel. Küünar- ja kodarluu, samuti sääre- ja pindluu polnud veel omavahel kokku kasvanud. [1]
Täiskasvanud konni iseloomustavad pikad tagajalad, lühike keha, varvastevahelised ujunahad, esiletulevad (enamasti suhteliselt suured) silmad ja saba puudumine, mis on olemas sabakonnalistel (Caudata).
Enamik konni on poolveelise eluviisiga, maapinnal suudavad nad kergelt liikuda kas hüpates või ronides.
Tavaliselt arenevad nende munad, mis moodustavad klimpja olluse (kudu), vees. Nende vastsed, kes arenevad vees, hingavad lõpustega. Viimaseid kutsutakse (konna)kullesteks.
Konnad on karnivoorid: nad söövad lülijalgseid, rõngusse ja tigusid.
Konnade üks iseäralikumaid tunnusjooni on eriomased häälitsused (krooksumine), mida võib kuulda nii päeval kui ka öösel, eriti aga kudemisperioodil.
Konnade omapärast paaritusasendit kopulatsioonil nimetatakse ampleksiks.
Päriskonnalised ehk anuurid (Anura) on kahepaiksete klassi kuuluv selts.
Sõna "anuurid" tähendab kreeka keeles 'sabatud' (αν + ουρα 'saba'). Tõepoolest, üksnes mõnel päriskonnalisel on täiskasvanuna lühike saba, enamikul liikidel puudub see täielikult. Siiski on päriskonnaliste kullestel pikk saba, mis näitab, et päriskonnalised põlvnevad sabaga esivanematest.
Päriskonnalisi nimetatakse sageli lihtsalt konnadeks (laiemas mõttes, kitsamas mõttes peetakse konnade all silmas perekonda konn (Rana)).
Päriskonnaliste selts jaguneb kolme alamseltsi: Archaeobatrachia, Mesobatrachia ja Neobatrachia.
"Loomade elu" jagab päriskonnalised viide alamseltsi, lähtudes selgroolülide liigestumise iseärasustest: kaksilohulised (Amphicoela), tagalohulised (Opisthocoela), erilohulised (Anomocoela), eeslohulised (Procoela) ja võõriklohulised (Diplasiocoela). Raamat eristab 19 sugukonda ja 176 perekonda.
Päriskonnalised on levinud kõigis maailmajagudes peale Antarktise. Nad puuduvad üksnes Põhja-Jäämere saartel ja rannikul ning mõnel ookeanisaarel, näiteks Uus-Meremaa Lõunasaarel. Nad vajavad eluks niiskust, mistõttu neid ei ela ka Saharas ega Araabia poolsaare põhja- ja keskosas, kus on nende jaoks liiga kuiv.
Ürgseimate päriskonnaliste jäänused on leitud Põhja-Madagaskari alamtriiase ladestikust. Need kuulusid konnale Protobatrachus massinoti, kes oli umbes 10 cm pikk ja 16 selgroolüliga. Sealjuures olid kõik kerepiirkonna lülid peale esimese roietega (näiteks eeslohulistel ja võõriklohulistel puuduvad roided üldse). 3 sabalüli paiknesid lühikeste niudeluude vahel. Küünar- ja kodarluu, samuti sääre- ja pindluu polnud veel omavahel kokku kasvanud.
Anura (grezieratik, a-, ez, eta ourá, isatsa) anfibio klado bat da, gehienean igel eta apo deitutakoak. Ez dute isatsik, gorputza laburra eta zabala dute eta atzeko hankak jauzi egiteko prestaturik daude. Anura da anfibioen artean talderik handiena, uste denez 5.000 bat espezie dira, 48 familiatan banatuak. Bizirauteko, ura behar dute eta horregatik ez dira bertatik asko urruntzen, orokorrean. Txikienak bi milimetro inguru luze dira (Eleutherodactylus) eta handienak, Goliat igela, 30 zentimetro arte.
Harreman filogenetikoak ezartzeak eztabaida sortu du askotan. Polemikaren nondik norakoak Archeobatrachia klado parafiletikoan zeuden igelak Neobatrachian txertatzeko garaian sortzen dira, batez ere. Azken talde horretan anfibioen bi herenak sartzen dira eta Heleophrynidae eta Hyloides eta Ranoides kladoak sartzen dira.
AnuraHyloides
Ranoides
Anura (grezieratik, a-, ez, eta ourá, isatsa) anfibio klado bat da, gehienean igel eta apo deitutakoak. Ez dute isatsik, gorputza laburra eta zabala dute eta atzeko hankak jauzi egiteko prestaturik daude. Anura da anfibioen artean talderik handiena, uste denez 5.000 bat espezie dira, 48 familiatan banatuak. Bizirauteko, ura behar dute eta horregatik ez dira bertatik asko urruntzen, orokorrean. Txikienak bi milimetro inguru luze dira (Eleutherodactylus) eta handienak, Goliat igela, 30 zentimetro arte.
Mesobatrachia Anuraren barruan dagoen bigarren azpiordenik handiena da. Archaeobatrachia eta Neobatrachiaren artean daude ebolutiboki.
Mesobatrachia Anuraren barruan dagoen bigarren azpiordenik handiena da. Archaeobatrachia eta Neobatrachiaren artean daude ebolutiboki.
Neobatrachia Anuraren barruan sailkatzen diren hiru azpiordenetako bat da. Azpiordena hau da hiru taldeen artean ezaugarri apomorfiko gehien dituena eta, beraz, ebolutiboki berriena. Gainera hiruetan handiena da, 5.000 bat espezierekin eta Anuraren barruan dauden espezieen %96arekin.
Neobatrachia Anuraren barruan sailkatzen diren hiru azpiordenetako bat da. Azpiordena hau da hiru taldeen artean ezaugarri apomorfiko gehien dituena eta, beraz, ebolutiboki berriena. Gainera hiruetan handiena da, 5.000 bat espezierekin eta Anuraren barruan dauden espezieen %96arekin.
Sammakot eli pyrstöttömät sammakot eli varsinaiset sammakot (Anura, ennen myös Salientia) on yksi sammakkoeläinten kolmesta lahkosta.
Sammakkojen tuntomerkkeihin kuuluu aina lyhyt ruumis sekä täysikasvuisilta yksilöiltä puuttuva häntä. Raajat, varsinkin takaraajat, ovat hyvin kehittyneet. Yleensä sammakot liikkuvatkin loikkimalla. Sammakkojen kallo taas on harvinaisuus selkärankaisten keskuudessa, sillä se koostuu hyvin harvoista osista. Sammakkojen selkärangassa on enintään yhdeksän nikamaa.
Sammakkojen lahko Anura on sammakkoeläinten kolmesta nykyään elävästä lahkosta lajimäärältään ylivoimaisesti suurin. Tästä lahkosta on joskus käytetty myös nimitystä "sammakot ja konnat", mikä on kuitenkin tarpeetonta, sillä biologisen määritelmän mukaan konnatkin ovat sammakoita. Sammakot eroavat selvästi sammakkoeläinten kahdesta muusta lahkosta, matosammakoista ja pyrstösammakoista (salamanterit).
Täysin kehittyneillä sammakoilla on tyypillisesti lyhyt ja leveä pää, jossa laajahko suu ja suuret ja ulkonevat silmät. Varsinainen vartalo on lyhyt mutta raajat pitkät, yhteinen ominaisuus on myös pyrstön eli hännän puuttuminen. Iho on löyhä ja sisältää nesteonteloita. Arkikielessä joskus tehtävä ero sammakoiden ja konnien (esimerkiksi rupikonna) välillä perustuu edellisten kosteaan ja jälkimmäisten kuivaan ihoon, mutta tällä ei varsinaisesti ole luokittelullisia perusteita, sillä vaikka eräs sammakoihin kuuluvista heimoista onkin nimeltään konnat (Bufonidae), nimitetään konniksi myös monia muihin heimoihin lukeutuvia lajeja. Sammakoiden lahkon merkittävin heimo on myös nimeltään sammakot eli aitosammakot (Ranidae), jossa on yli 600 lajia.
Sammakkojen lahkosta tunnetaan runsaaseen kolmeenkymmeneen heimoon jakautuneena jo yli 6 000 lajia, joista lähes kaikki ovat trooppisten sademetsien eläimistöä. Sammakot ovat kuitenkin levittäytyneet lähes kaikkialle maailmaan Etelämannerta lukuun ottamatta. Lajirunsaudessa onkin paljon vaihtelua: pieni kuubansammakko on alle 2 cm pitkä, kun taas goljatsammakko on 25-senttinen ja suurimmillaan yli viisikiloinen. Kaikki munivat veteen, ja siinä kun munien lukumäärä jää kuubansammakolla yhteen, nousee se agakonnalla kymmeniin tuhansiin. Tropiikin ulkopuolella sammakkolajeja on vähemmän, Euroopassa runsaat 20 lajia. Suomessa esiintyy vakinaisesti kolme lajia: sammakko, viitasammakko ja rupikonna.[1] Satunnaisina on tavattu mölysammakko, syötäväsammakko, lessonansammakko ja viherkonna.[2]
Sammakot eli pyrstöttömät sammakot eli varsinaiset sammakot (Anura, ennen myös Salientia) on yksi sammakkoeläinten kolmesta lahkosta.
Sammakkojen tuntomerkkeihin kuuluu aina lyhyt ruumis sekä täysikasvuisilta yksilöiltä puuttuva häntä. Raajat, varsinkin takaraajat, ovat hyvin kehittyneet. Yleensä sammakot liikkuvatkin loikkimalla. Sammakkojen kallo taas on harvinaisuus selkärankaisten keskuudessa, sillä se koostuu hyvin harvoista osista. Sammakkojen selkärangassa on enintään yhdeksän nikamaa.
Sammakkojen lahko Anura on sammakkoeläinten kolmesta nykyään elävästä lahkosta lajimäärältään ylivoimaisesti suurin. Tästä lahkosta on joskus käytetty myös nimitystä "sammakot ja konnat", mikä on kuitenkin tarpeetonta, sillä biologisen määritelmän mukaan konnatkin ovat sammakoita. Sammakot eroavat selvästi sammakkoeläinten kahdesta muusta lahkosta, matosammakoista ja pyrstösammakoista (salamanterit).
Täysin kehittyneillä sammakoilla on tyypillisesti lyhyt ja leveä pää, jossa laajahko suu ja suuret ja ulkonevat silmät. Varsinainen vartalo on lyhyt mutta raajat pitkät, yhteinen ominaisuus on myös pyrstön eli hännän puuttuminen. Iho on löyhä ja sisältää nesteonteloita. Arkikielessä joskus tehtävä ero sammakoiden ja konnien (esimerkiksi rupikonna) välillä perustuu edellisten kosteaan ja jälkimmäisten kuivaan ihoon, mutta tällä ei varsinaisesti ole luokittelullisia perusteita, sillä vaikka eräs sammakoihin kuuluvista heimoista onkin nimeltään konnat (Bufonidae), nimitetään konniksi myös monia muihin heimoihin lukeutuvia lajeja. Sammakoiden lahkon merkittävin heimo on myös nimeltään sammakot eli aitosammakot (Ranidae), jossa on yli 600 lajia.
Sammakkojen lahkosta tunnetaan runsaaseen kolmeenkymmeneen heimoon jakautuneena jo yli 6 000 lajia, joista lähes kaikki ovat trooppisten sademetsien eläimistöä. Sammakot ovat kuitenkin levittäytyneet lähes kaikkialle maailmaan Etelämannerta lukuun ottamatta. Lajirunsaudessa onkin paljon vaihtelua: pieni kuubansammakko on alle 2 cm pitkä, kun taas goljatsammakko on 25-senttinen ja suurimmillaan yli viisikiloinen. Kaikki munivat veteen, ja siinä kun munien lukumäärä jää kuubansammakolla yhteen, nousee se agakonnalla kymmeniin tuhansiin. Tropiikin ulkopuolella sammakkolajeja on vähemmän, Euroopassa runsaat 20 lajia. Suomessa esiintyy vakinaisesti kolme lajia: sammakko, viitasammakko ja rupikonna. Satunnaisina on tavattu mölysammakko, syötäväsammakko, lessonansammakko ja viherkonna.
Anura
Les anoures, Anura, sont un ordre d'amphibiens. C'est un groupe, diversifié et principalement carnivore, d'amphibiens sans queue comportant notamment des grenouilles et des crapauds. Le plus ancien fossile de « proto-grenouille » a été daté du début du Trias à Madagascar, mais la datation moléculaire suggère que leur origine pourrait remonter au Permien, il y a 265 Ma. Les anoures sont largement distribués dans le monde, des tropiques jusqu'aux régions subarctiques, mais la plus grande concentration d'espèces se trouve dans les forêts tropicales. Il y a environ 4 800 espèces d'anoures recensées, représentant plus de 85 % des espèces d'amphibiens existantes. Il est l'un des cinq ordres de vertébrés les plus diversifiés.
L'anoure adulte a communément un corps robuste et sans queue, des yeux exorbités, une langue bifide, des membres repliés sous le reste du corps, prêts pour des bonds à bonne distance. Vivant ordinairement en eau douce et sur le sol, certaines espèces vivent, au stade adulte, sous terre ou dans les arbres. La peau des grenouilles est glandulaire, avec des sécrétions lui donnant un mauvais goût ou la rendant toxique. Certaines espèces, appelées par convention crapauds, ont une peau dite verruqueuse dont les renflements contiennent des toxines glandulaires ; mais par la taxinomie et la phylogénie, certains crapauds sont plus proches des grenouilles que des autres crapauds. La couleur de la peau des grenouilles varie du marron tacheté, gris et vert, propices au mimétisme, à des motifs vifs de rouge ou jaune et noir signalant aux prédateurs leur toxicité.
Les œufs que ces amphibiens pondent dans l'eau, donnent des larves aquatiques appelées têtards possédant des pièces buccales adaptées à un régime herbivore, omnivore ou planctonophage. Quelques espèces déposent leurs œufs sur terre ou n'ont pas de stade larvaire. Les grenouilles adultes ont généralement un régime carnivore à base de petits invertébrés, mais il existe des espèces omnivores et certaines mangent des fruits. Les grenouilles sont extrêmement efficaces pour convertir ce qu'elles mangent en biomasse formant une ressource alimentaire majeure pour des prédateurs secondaires, leur donnant ainsi le rôle de clé de voûte du réseau trophique d'un grand nombre d'écosystèmes de la planète.
Leur peau semi-perméable les rendant sensibles à la déshydratation, leur habitat est le plus souvent humide, mais certains ont connu une profonde adaptation à des habitats secs. Les grenouilles ont une riche gamme de cris et chants, en particulier à l'époque de la reproduction, ainsi qu'une large palette de comportements sophistiqués pour communiquer entre eux ou se débarrasser d'un prédateur.
Les populations de grenouilles ont considérablement diminué partout dans le monde depuis les années 1950. Plus d'un tiers des espèces sont considérées comme menacées d'extinction et plus de 120 sont soupçonnées d'avoir disparu depuis les années 1980. Le nombre de malformations chez les grenouilles est à la hausse et une maladie fongique émergente, la chytridiomycose, s'est propagée dans le monde entier. Les spécialistes de la conservation des espèces cherchent les causes de ces problèmes. Les grenouilles sont consommées par les humains et ont aussi une place notable dans la culture à travers la littérature, le symbolisme et la religion.


Le nom anoure vient du grec οὐρά (oura), signifiant « queue », et du préfixe privatif a signifiant « sans », soit « sans queue »[1],[2], car chez ces animaux la queue ne persiste pas après la métamorphose de passage à l'âge adulte, contrairement par exemple aux urodèles.
L'utilisation des termes « grenouilles » et « crapaud » n'a pas de justification taxonomique. Le terme « grenouille » se réfère généralement à des espèces aquatiques ou semi-aquatiques à la peau lisse et humide, tandis que l'on désigne par le terme « crapaud » des espèces terrestres à la peau sèche et verruqueuse[3],[4]. Cependant il y a de nombreuses exceptions à cette règle. Ainsi, le Crapaud sonneur à ventre de feu (Bombina bombina) n'a une peau que très légèrement verruqueuse et préfère les habitats aquatiques[5], tandis que la Grenouille dorée (Atelopus zeteki) est placée dans la famille des Bufonidae, qui rassemble les « vrais crapauds », et a une peau lisse[6].

Les anoures n'ont pas de queue, excepté sous leur forme larvaire, et la plupart ont de longues pattes arrière, des os des chevilles allongés, des orteils palmés et démunis de griffes, de grands yeux et une peau lisse ou verruqueuse. Le crâne est élargi, et les arcs de la mâchoire supérieure délimitent de grandes orbites sans plancher[7]. Ils ont une colonne vertébrale courte, avec pas plus de 10 vertèbres libres et se terminant par une vertèbre sacrée unique sur laquelle s'articule un urostyle issu de la fusion des vertèbres postérieures[8],[9]. Comme d'autres amphibiens, ils peuvent respirer à travers leur peau qui est perméable à l'oxygène. Cette caractéristique unique leur permet de rester dans l'eau, sans accès à l'air libre, en respirant par la peau[10]. Les côtes sont peu développées, généralement limitées à deux à trois paires[8], et les poumons sont remplis par pompe buccale. Il a été prouvé qu'une grenouille privée de ses poumons pouvait tout de même maintenir ses fonctions vitales[10]. Pour que la peau puisse servir d'organe de respiration, elle doit rester humide. Les anoures sont donc sensibles à diverses substances toxiques présentent dans l'environnement qui les entoure, qui peuvent se dissoudre dans le film d'eau qui recouvre leur peau et s'infiltrer dans leur sang. Ce pourrait être une des causes du déclin global de leurs populations[11],[12],[13],[14].
Les anoures peuvent varier en taille entre 7,7 mm pour la récemment découverte Paedophryne amauensis de Papouasie-Nouvelle-Guinée[15],[16] et 300 mm pour la Grenouille goliath (Conraua goliath) au Cameroun. Leur peau est lâche car démunie de tissu conjonctif. Les grenouilles ont trois paupières : une transparente qui protège les yeux sous l'eau, et deux autres qui sont translucides ou opaques. Ils présentent un tympan de chaque côté de la tête qui joue un rôle dans leur audition, et qui peut être couvert de peau chez certaines espèces. Les « vrais crapauds » sont totalement démunis de dents mais la plupart des grenouilles ont des dents pédicellées avec une couronne séparée de la racine par du tissu fibreux[7], placées dans les coins de la mâchoire supérieure. Elles ont également des dents vomériennes en haut de la bouche. Les anoures ne présentent en revanche jamais de dents sur la mâchoire inférieure, et avalent généralement leur nourriture entière. Les dents ont principalement comme fonction de maintenir leur proie le temps qu'ils l'avalent[17]. Les Pyxicephalus, qui se nourrissent de proies de grande taille comme les souris ou d'autres grenouilles, ont des processus osseux coniques appelés odontoïdes au niveau de la mâchoire inférieure, qui jouent le rôle de dents[18].

La structure des membres et des pattes varie fortement d'une espèce à l'autre, et dépend notamment de l'environnement dans lequel l'espèce évolue : sur le sol, dans l'eau, dans les arbres ou dans des terriers. Les anoures doivent être capables de se déplacer rapidement dans leur environnement pour échapper à leurs prédateurs et attraper leurs proies, et de nombreuses adaptations morphologiques les aident dans ce sens. La plupart des espèces sont bien adaptées au saut, ou du moins leurs ancêtres l'étaient, et leur morphologie y est bien adaptée. Ainsi, les différents segments du membre postérieur sont très allongés et disposés en Z, tel un ressort[19]. Le tibia, le fibula et le tarse sont fusionnés pour former un os solide, et il en est de même pour le radius et l'ulna au niveau des membres antérieurs, qui doivent absorber l'impact à la réception du saut. Le métatarse est allongé pour que les pattes postérieures soient plus longues et permettent à l'animal d'appuyer sur le sol plus longtemps. L'ilium est allongé et a une articulation mobile avec le sacrum qui, chez les sauteurs spécialisés comme les ranidés et les hylidés, participe à donner de la puissance à l'animal au moment du saut. Les vertèbres de la queue sont fusionnées pour former un urostyle qui est compris dans le pelvis. Cela permet à la force d'être transmise des pattes vers le corps durant un saut[9]. Les membres antérieurs constituent la ceinture scapulaire, rattachée à la colonne vertébrale par des muscles. Elle est également constituée de deux petits os dermiques, la clavicule et le cleithrum, ainsi que de constituants enchondraux plus importants, la scapula et le coracoïde[19].

Les adaptations au saut sont également visibles au niveau des muscles. Ainsi les pattes postérieures des grenouilles primitives présentaient une paire de muscles antagonistes (l'un permettait de plier le genou, l'autre de l'étendre), comme chez la plupart des animaux munis de membres. Toutefois, chez les grenouilles modernes, tous les muscles participent à l'action de sauter, et seuls quelques petits muscles ont la charge de ramener la patte dans sa position de départ et maintenir cette posture. Les muscles sont également beaucoup plus gros, et les principaux muscles des pattes postérieures représentent 17 % du poids total d'une grenouille[20].
De nombreux anoures ont des pieds palmés, et le degré de palmure dépend généralement de la proportion de temps passé par la grenouille dans l'eau[21]. Les Hymenochirus, complètement aquatiques, ont des orteils totalement palmés, tandis que ceux de Rainette de White (Litoria caerulea), une espèce arboricole, sont seulement palmés au quart ou à moitié de leur longueur[22].
Les grenouilles arboricoles ont des disques adhésifs situés à l'extrémité de leurs orteils pour les aider à se maintenir à des surfaces verticales. Il ne s'agit pas de ventouses, mais de disques pourvus de très nombreuses cellules au sommet plat et avec de petits interstices entre chacune, lubrifiées par des glandes à mucus. Quand la grenouille fait pression avec ses pattes, les cellules adhèrent aux irrégularités de la surface et l'animal se tient au support par capillarité. Cela lui permet de grimper sur des surfaces lisses, mais cette méthode fonctionne mal si les ventouses sont trop humides[23].
Chez plusieurs grenouilles arboricoles, une « structure intercalaire » sur chaque orteil augmente la surface adhérant au substrat. Par ailleurs, comme il est dangereux de sauter dans la canopée, certaines grenouilles arboricoles ont des articulations de la hanche leur permettant à la fois de sauter et de marcher. Certaines grenouilles qui vivent en haut des arbres possèdent également une importante palmure entre les orteils. Cela permet aux grenouilles de se « parachuter » ou de planer d'un point à l'autre à travers la canopée[24].
Les grenouilles vivant sous terre ne présentent généralement pas les adaptations des grenouilles aquatiques ou arboricoles. La plupart ont de plus petites ventouses, si elles en sont pourvues, et une très légère palmure. Certains de ces animaux comme Scaphiopus couchii ont un tubercule kératinisé à l'extrémité des orteils des pattes postérieures, qui les aide à creuser[25].
Parfois, durant le stade larvaire, un des membres en développement du têtard est mangé par un prédateur tel qu'une larve de libellule. Dans certains cas, le membre parvient à se développer complètement, mais ce n'est pas toujours le cas, et certains anoures vivent ensuite avec seulement trois membres. Occasionnellement un plathelminthe parasite (Ribeiroia ondatrae) s'installe dans le train arrière du têtard, ce qui provoque un réarrangement des cellules à l'origine des membres, et l'animal peut ensuite développer une ou deux pattes supplémentaires[26].
La peau des anoures, en plus de les protéger, joue un rôle dans leur respiration[27], peut absorber de l'eau et les aide à maîtriser leur température corporelle. Elle présente de nombreuses glandes, en particulier sur la tête et le dos, qui produisent généralement des substances désagréables et toxiques. La sécrétion de la peau est souvent poisseuse et contribue à garder la peau humide, protège l'animal des bactéries et le rend glissant et donc difficile à saisir pour les prédateurs[28]. La peau se régénère régulièrement, au bout de quelques semaines. L'ancienne peau se détache au milieu du dos et sous le ventre, et l'animal peut libérer ses membres de cette vieille enveloppe, qu'il consomme aussitôt[29].
Les anoures sont des animaux à sang froid, et doivent adopter un comportement adéquat pour réguler leur température. Pour se réchauffer, ils se placent au soleil ou sur une surface chaude, et s'ils ont trop chaud ils s'abritent à l'ombre ou adoptent une posture leur permettant d'exposer le moins de surface possible à l'air. Cette posture est également utilisée pour éviter de se déshydrater. L'animal est plaqué près du sol et les pattes sont rentrées sous son corps[30]. La coloration de la peau de l'anoure joue un rôle dans la thermorégulation, et l'animal peut légèrement la faire varier pour s'adapter à la température. Ainsi dans des conditions froides et humides la peau sera plus sombre que lors d'une journée chaude et sèche. Chiromantis xerampelina est même capable de devenir blanche pour limiter au maximum les risques de chaleur excessive[31].
Plusieurs grenouilles sont capables d'absorber de l'eau et de l'oxygène directement à travers leur peau, notamment au niveau de la région pelvique, mais la perméabilité de la peau des grenouilles accroît également les risques de déshydratation. Les glandes situées partout sur le corps sécrètent un mucus qui permet à la peau de rester constamment humide et de limiter l'évaporation. Certaines glandes sur les pattes avant et la poitrine des mâles sont spécialisées dans la production de substances poisseuses qui jouent un rôle au moment de l'amplexus. Des glandes similaires chez les grenouilles arboricoles produisent une substance collante au niveau des ventouses de leurs pattes. Certaines grenouilles arboricoles réduisent leurs pertes d'eau grâce à une couche de peau étanche, et plusieurs espèces sud-américaines ont la peau recouverte d'une sécrétion cireuse. D'autres grenouilles adaptent leur comportement pour ne pas se déshydrater : elles sont nocturnes et se reposent dans une posture limitant l'évapotranspiration. Certaines espèces se reposent en groupe comprenant un grand nombre d'individus qui se serrent les uns contre les autres. Cela limite la surface de peau exposée à l'air et donc la déshydratation[30]. Le Crapaud de Woodhouse (Bufo woodhousii), si on lui donne un accès à l'eau après qu'il a demeuré dans un endroit sec, s'assied dans l'eau peu profonde pour se réhydrater[32]. Le mâle Trichobatrachus robustus a une papille dermale proéminente à la base du dos et des cuisses, ce qui lui donne un aspect hérissé. Elle contient des vaisseaux sanguins et on pense qu'elle permet d'accroître la surface de peau disponible pour la respiration cutanée[33].
Le camouflage est une stratégie de défense commune chez les anoures. Les grenouilles les mieux camouflées sont nocturnes. Durant la journée, elles cherchent une position où elles peuvent se fondre dans le décor et y restent sans se faire repérer. Certaines grenouilles ont la capacité de changer de coloration, mais la palette de couleurs est alors restreinte. Par exemple, Litoria caerulea a une couleur qui varie entre le vert pâle et le chamoisé suivant la température, et la Rainette du Pacifique (Pseudacris regilla) peut aller du vert au brun, uni ou tacheté, suivant la période de l'année et la couleur de l'environnement proche[34]. Des caractéristiques comme des verrues ou des plis de peau sont fréquentes chez les anoures souterrains, où une peau lisse ne permet pas un camouflage efficace. Certaines grenouilles changent de couleur selon que l'on est le jour ou la nuit, la lumière et l'humidité stimulent les cellules pigmentaires et les font s'étendre ou se contracter[10].

La peau des anoures est perméable à l'oxygène et au dioxyde de carbone, ainsi qu'à l'eau. Ils possèdent des vaisseaux sanguins près de la surface de la peau et quand une grenouille est sous l'eau, l'oxygène passe directement dans le sang. À l'air libre, les anoures respirent par pompe buccale. Leurs poumons sont similaires à ceux des humains mais les muscles de la poitrine ne jouent aucun rôle dans la respiration, et ils n'ont pas de côtes ni de diaphragme pour participer à l'entrée et la sortie de l'air. Ils gonflent leur gorge et aspirent l'air par leurs narines. Chez certaines espèces les narines sont obturées par des valves[35]. Barbourula kalimantanensis a été découverte dans une zone isolée de l'Indonésie en 2007. Elle est entièrement aquatique et est la première espèce de grenouille connue à vivre sans poumons[36],[37].
Les anoures ont un cœur à trois chambres, caractéristique qu'ils partagent avec les lézards[38]. Le sang oxygéné des poumons et le sang désoxygéné revenant des tissus arrivent dans deux oreillettes différentes. Quand ces chambres se contractent, les deux afflux de sang arrivent dans le ventricule commun avant qu'il ne soit pompé via une valve spiralée vers le vaisseau approprié, l'aorte pour le sang oxygéné et l'artère pulmonaire pour le sang désoxygéné. Le ventricule est partiellement divisé en cavités étroites qui minimisent le mélange des deux types de sang[39]. Cette caractéristique permet aux anoures d'avoir un métabolisme plus élevé[38].
Certaines espèces de grenouilles disposent d'adaptations qui leur permettent de survivre dans des eaux pauvres en oxygène. La grenouille du lac Titicaca (Telmatobius culeus) fait partie de ces espèces, et elle a une peau ridée qui augmente sa surface de contact pour faire des échanges de gaz avec le milieu environnant. Elle n'utilise généralement pas ses poumons rudimentaires, mais il lui arrive de se lever et se coucher successivement au fond du lac pour accroître le flux d'eau autour d'elle[40].
Les anoures ont des dents maxillaires sur la mâchoire supérieure qui sont utilisées pour retenir la nourriture tandis qu'ils l'avalent. Ces dents sont fragiles et ne peuvent être utilisées pour mâcher ou attraper des proies rapides. C'est pourquoi les grenouilles utilisent plutôt leur longue langue gluante pour attraper les insectes et autres petites proies rapides. La langue est normalement enroulée dans la bouche, libre à l'arrière et fixée à la mandibule à l'avant. Elle peut être lancée et rétractée à grande vitesse[21]. Certaines grenouilles n'ont pas de langue et amènent les aliments dans leur bouche avec leurs mains[21]. Les yeux aident à avaler la nourriture car ils peuvent être escamotés par des trous dans le crâne et participent à pousser la nourriture dans la gorge[21]. La nourriture traverse ensuite l'œsophage pour arriver dans l'estomac où elle est mise en contact avec les enzymes digestives. Le tube digestif se poursuit avec l'intestin grêle qui comprend le duodénum et l'iléon où se passe en grande partie la digestion. Les enzymes produites par le pancréas, et la bile produite par le foie et stockée dans la vésicule biliaire, sont sécrétées dans l'intestin grêle, où les aliments sont digérés et les nutriments absorbés. Le résidu de nourriture passe dans le gros intestin où l'excès d'eau est réabsorbé et les déchets sont évacués à travers le cloaque[41].
Bien adaptées à la vie terrestre, les grenouilles ressemblent à des poissons d'eau douce dans leur incapacité à conserver l'eau du corps efficacement. Quand ils sont sur terre, beaucoup d'eau est perdue par évaporation à travers la peau. Le système excréteur est similaire à celui des mammifères et ils disposent de deux reins qui capturent et excrètent les déchets azotés contenus dans le sang. Les grenouilles produisent de grandes quantités d'urine diluée afin d'évacuer les produits toxiques des tubules rénaux[42]. L'azote est excrété sous forme d'ammoniaque par les têtards et les grenouilles aquatiques, mais principalement sous forme d'urée, un produit moins toxique, par la plupart des adultes terrestres. Quelques espèces de grenouille arboricoles ayant moins souvent accès à l'eau excrètent de l'acide urique, encore moins toxique[42]. L'urine passe le long des uretères jumelés pour se diriger vers la vessie à partir de laquelle elle est évacuée périodiquement dans le cloaque. Tous les déchets corporels quittent le corps par le cloaque[43].
Chez les anoures mâles, les deux testicules sont attachés aux reins et la semence passe dans les reins à travers de fins tubes appelés canaux efférents. Elle passe ensuite par les uretères, qui sont des conduits urogénitaux. Il n'y a pas de pénis et le sperme est éjecté via le cloaque directement sur les œufs quand la femelle les a pondus. Les ovaires de la femelle sont derrière les reins et les œufs passent à travers une paire d'oviductes puis par le cloaque[43].
Quand la grenouille copule, le mâle monte sur le dos de la femelle et la saisit avec ses pattes avant soit au niveau des pattes avant soit au niveau des pattes arrière, voire dans le cas de Epipedobates tricolor autour du cou. Cette position est appelée amplexus et les deux partenaires peuvent la conserver pendant plusieurs jours[44]. Le mâle présente un certain nombre de caractères sexuels secondaires comme la présence de callosités rugueuses sur ses pattes en période de reproduction, lui permettant d'avoir une prise ferme[45]. L'étreinte exercée par le mâle durant l'amplexus stimule la femelle à pondre ses œufs, généralement enveloppés de gel[43]. Chez plusieurs espèces, le mâle est plus petit que la femelle. Les mâles ont des cordes vocales et peuvent émettre une grande variété de croassement, notamment pendant la période de reproduction, et certaines espèces disposent d'un sac vocal pour amplifier le son[43].
Les anoures ont un système nerveux bien développé constitué d'un cerveau, d'une moelle épinière et de nerfs. Plusieurs parties du cerveau des grenouilles sont semblables à celles que l'on observe dans le cerveau humain. On rencontre en effet deux lobes olfactifs bien développés, deux hémisphères cérébraux, une glande pinéale, deux lobes optiques, un cervelet et une medulla oblongata. La coordination musculaire et les postures sont contrôlées par le cervelet, et la medulla oblongata contrôle la respiration, la digestion et d'autres fonctions automatiques[43]. Le cervelet des grenouilles est en proportion plus petit que celui de l'Homme. La moelle épinière est tubulaire et semblable à celle des autres vertébrés. Elle est courte et se prolonge dans l'urostyle uniquement par un phylum terminal[7]. Sa structure est fondamentalement tubulaire. Les anoures ont dix paires de nerfs crâniens qui transmettent les informations recueillies dans le milieu extérieur directement au cerveau, et dix paires de nerfs spinaux qui transmettent les informations venues du cerveau au reste du corps en passant par la colonne vertébrale[43],[7]. Tous les autres amniotes (mammifères, oiseaux et reptiles) ont douze paires de nerfs crâniens[46].
Les yeux de la plupart des anoures sont situés de chaque côté de la tête près de son sommet et sont bien proéminents. Ils procurent à l'animal une vision binoculaire sur un champ de 100° devant et une vision totale à presque 360°[47]. Parfois ils constituent l'unique partie submergée d'une grenouille cachée dans l'eau. Chaque œil a des paupières situées au-dessus et au-dessous et une membrane nictitante qui procure une protection supplémentaire, notamment lorsque la grenouille est en train de nager[48]. Les membres de la famille des Pipidae, qui vivent majoritairement dans l'eau, ont les yeux situés au sommet de la tête, une position plus adaptée pour repérer les proies au-dessus d'eux quand ces animaux sont partiellement immergés[47]. L'iris peut prendre diverses colorations et la pupille adopte différentes formes. Ainsi, le Crapaud commun (Bufo bufo) a des iris dorés et des pupilles fines et horizontales, la Grenouille aux yeux rouges (Agalychnis callidryas) a des pupilles verticales, Phyllobates a des iris sombres, les Crapauds sonneurs (Bombina) ont des pupilles triangulaires et le Crapaud rouge de Madagascar (Dyscophus antongilii) en a des circulaires. Les iris d'Anaxyrus terrestris sont modelés de façon à se fondre avec la peau du reste du corps[48].
La vision distante d'un anoure est meilleure que sa vision proche. Les grenouilles en train de chanter deviennent rapidement silencieuses quand elles voient un intrus, ou rien qu'une ombre, mais plus proche est l'intrus et moins bien il sera détecté[48]. Quand une grenouille lance sa langue pour attraper un insecte elle réagit au mouvement d'un petit objet qu'elle distingue mal et dont elle doit anticiper la trajectoire car elle ferme les yeux au moment où la langue est étendue[21]. La vision des couleurs par les anoures est sujet à débat, mais on a montré qu'ils réagissaient positivement à la lumière bleue, peut-être parce qu'ils l'associent aux points d'eau qui leur procurent un abri en cas de danger[49].
Les anoures peuvent entendre à l'air libre comme dans l'eau. Ils n'ont pas d'oreilles externes, leurs tympans sont directement exposés ou simplement couverts d'une couche de peau. Ils sont visibles et forment une zone circulaire juste derrière les yeux. La taille et la distance séparant les tympans dépendent de la fréquence des cris de ces animaux. Chez certaines espèces comme les Ouaouarons, la taille des tympans permet de déterminer le sexe de l'animal, car les mâles ont des tympans plus grands que leurs yeux tandis que les yeux et les tympans des femelles sont à peu près de la même taille[50]. Les bruits font vibrer le tympan et le son est transmis à l'oreille interne. L'oreille interne comprend également des canaux semi-circulaires qui jouent un rôle dans l'équilibre et l'orientation de l'animal. Les cellules ciliées qui permettent l'audition sont localisées dans deux zones de la cochlée : la papille basilaire et la papille amphibienne. La première détecte les hautes fréquences et la seconde les basses fréquences[51]. Du fait de la cochlée très courte, la grenouille utilise le réglage électrique (en) pour étendre la gamme de fréquences qu'elle peut entendre et l'aider à différencier certains sons[52]. Cet arrangement rend possible la détection des appels territoriaux de leurs congénères. Chez certaines espèces qui vivent dans les régions arides, le son de la foudre ou d'une forte pluie peut sortir les animaux de leur état de dormance[51]. Une grenouille peut être effrayée par un bruit inattendu, mais elle ne va généralement pas réagir tant que la source du bruit n'est pas repérée par la vue[50]. La morphologie particulière de leur canal auditif montre qu'il y a des composants ultrasoniques dans leurs vocalisations et que, comme certaines aloses, les anoures peuvent détecter ces ultrasons[53]. Dans le cas des grenouilles, les mâles utilisent cette capacité pour jauger leur rivaux et moduler leur comportement territorial et leur agressivité, engendrant des ajustements, triggering acoustiques complexes[54].
Pour l'odorat, les anoures disposent d'un sac nasal qui s'ouvre vers l'extérieur de chaque côté du nez par une narine externe, et s'ouvre sur la cavité buccale par un orifice en avant de la voûte buccale. Les anoures disposent également d'un organe de Jacobson, pour capter les odeurs venant de la qualité buccale[7]. Les capteurs sensoriels du goût se limitent à la face dorsale de la langue, et sont regroupés chez les anoures à l'extrémité distale de papilles fongiformes[7]. Les larves, ainsi que certains adultes aquatiques et primitifs comme les xénopes, possèdent une ligne latérale, organe sensoriel spécifique aux animaux aquatiques. Elle est constituée d'alignements céphaliques et troncaux, de neuromastes toujours superficiels, reliés à une paire de neurones bulbaires[7].
Le cri ou coassement des anoures est spécifique à ces espèces. Les anoures créent ce son en faisant passer l'air à travers leur larynx. Chez la plupart des grenouilles qui coassent, ce cri est amplifié par un ou plusieurs sacs vocaux, des membranes de peau placées sous la gorge ou dans le coin de la bouche, qui se détendent au cours du cri. Certains coassements sont si bruyants qu'ils peuvent être entendus à plus d'un kilomètre[55].
Les grenouilles des genres Heleioporus et Neobatrachus n'ont pas de sac vocal mais sont tout de même capables d'émettre un cri puissant. Leur bouche est élargie et à la forme d'un dôme, et agit comme une caisse de résonance qui amplifie le son. Les espèces de grenouilles qui n'ont pas de coassement bruyant sont généralement celles qui vivent dans les zones proches d'eau coulant en provoquant un bruit continu. Elles ont besoin d'utiliser d'autres stratégies pour communiquer. La Grenouille-à-queue côtière (Ascaphus truei) vit dans les ruisseaux de montagne en Amérique du Nord et n'émet pas de chant[56].
Le but du coassement est d'attirer une partenaire pour les mâles. Ils peuvent chanter seuls ou en groupe lorsque de nombreux mâles ont convergé vers un même site de reproduction. Les femelles de plusieurs espèces de grenouilles, comme Polypedates leucomystax, répondent aux cris du mâle, ce qui renforce l'activité reproductive dans une colonie[57]. Les femelles grenouilles préfèrent les mâles qui produisent des sons de grande intensité et de basse fréquence, des caractéristiques qui les font sortir du lot dans un chœur[58].
Un cri différent est émis par une grenouille mâle ou une femelle non réceptive lorsqu'un autre mâle tente de la chevaucher. Il s'agit d'un gazouillis caractéristique qui est accompagné d'une vibration du corps[59]. Les grenouilles arboricoles et certaines espèces non-aquatiques ont un chant particulier qu'elles entonnent avant une pluie, qu'elles anticipent sur la base de l'humidité de l'air ambiant[59]. Certaines espèces ont également un chant territorial qui permet de chasser les autres mâles. Les anoures émettent ces chants avec la bouche fermée[59]. Un appel de détresse, émis par certaines grenouilles quand elles sont en danger, est produit avec la gueule ouverte, ce qui permet un cri un peu plus fort. Il est généralement utilisé lorsque la grenouille est attrapée par un prédateur, et peut servir pour faire diversion et déconcerter le prédateur afin qu'il relâche sa proie[59].
Plusieurs espèces de grenouilles ont un cri profond. Le coassement du ouaouaron (Lithobates catesbeianus) est parfois décrit comme un « jug o' rum »[60]. La Rainette du Pacifique (Pseudacris regilla) émet un onomatopéique « ribbit » que l'on écoute souvent dans les films[61]. D'autres chants sont décrits comme un « brekekekex koax koax », le cri de la Grenouille rieuse (Pelophylax ridibundus) dans Les Grenouilles, un ancien drame comique grec d'Aristophane[62].
Lors de conditions extrêmes, certaines grenouilles entrent dans un état de torpeur, et restent inactives pendant des mois. Dans les régions les plus froides, plusieurs espèces de grenouilles hibernent en hiver. Celles qui vivent sur terre comme le Crapaud d'Amérique (Bufo americanus) creusent un terrier et bâtissent un hibernaculum où elles peuvent entrer en dormance. D'autres, moins efficaces pour creuser, trouvent une crevasse ou s'enterrent dans les feuilles mortes. Des espèces aquatiques comme la Grenouille taureau (Rana catesbeiana) coulent au fond de la mare ou de l'étang dans lequel ils vivent, moitié ensevelis dans la vase mais toujours capables d'absorber l'oxygène dissout dans l'eau. Leur métabolisme se ralentit et ils vivent sur leurs réserves énergétiques. Certaines grenouilles peuvent même survivre à la congélation. Des cristaux de glace se forment sous leur peau et dans la cavité de leur corps mais les organes essentiels sont protégés des dégâts de la congélation par leur forte concentration en glucose. Une grenouille apparemment sans vie, congelée, peut reprendre sa respiration et voir son cœur repartir quand la température remonte[63].
À l'autre extrême, Cyclorana alboguttata entre en estivation régulièrement durant la saison chaude et sèche en Australie, survivant dans un état de dormance sans accès à la nourriture et à l'eau pendant neuf à dix mois de l'année. Elle s'enterre sous le sol et s'enferme dans un cocon protecteur formé par sa mue. Les chercheurs de l'Université du Queensland ont établi que durant l'estivation, le métabolisme de la grenouille est modifié et l'efficacité opérationnelle des mitochondries est améliorée. Cela signifie que les quantités limitées d'énergie disponible pour la grenouille en torpeur sont utilisées de manière plus efficace. Ce mécanisme de survie est seulement utile aux animaux qui restent complètement inconscients pendant une très longue période de temps et dont les besoins en énergie sont faibles car ils sont à sang froid et n'ont pas besoin de générer de chaleur[64]. D'autres recherches ont montré que, pour pourvoir à ces besoins énergétiques, les muscles s'atrophiaient, mais que les muscles des pattes postérieures étaient souvent épargnés par ce phénomène[65].
Les différentes espèces de grenouilles utilisent diverses méthodes de locomotion comme le saut, la course, la marche, la nage, et peuvent aussi creuser des tunnels, grimper et planer.
Les grenouilles sont généralement reconnues comme étant bien adaptées au saut, et sont dans ce sens les vertébrés qui sautent le plus loin par rapport à leur taille[66]. Litoria nasuta peut sauter à plus de 2 m, une distance qui représente plus de 50 fois la longueur de son corps, qui est de 5,5 cm[67]. Il y a de grandes différences d'une espèce à l'autre quant à leurs aptitudes au saut. Au sein d'une même espèce, plus l'animal est grand et plus il saute loin, mais le rapport entre la distance sautée et la longueur diminue. Euphlyctis cyanophlyctis a la capacité de sauter en dehors de l'eau à partir d'une position flottante à la surface[68]. La toute petite Rainette grillon (Acris crepitans) peut traverser une mare avec une série de courts sauts rapides sur sa surface[69].
Le visionnage de ce mouvement au ralenti montre que les muscles ont une certaine flexibilité. Ils sont d'abord étendus quand la grenouille est en position accroupie, puis ils sont contractés avant d'être étendus à nouveau pour permettre à la grenouille de se lancer dans l'air. Les pattes antérieures sont repliées contre la poitrine et les pattes postérieures restent dans la position étendue pendant le saut[20]. Chez certaines espèces particulièrement bien adaptées au saut, comme la Rainette de Cuba (Osteopilus septentrionalis) et la Grenouille léopard (Rana pipiens), la puissance produite durant un saut peut dépasser celle que le muscle peut théoriquement produire. Lorsque le muscle se contracte, l'énergie est tout d'abord transférée vers le tendon étiré qui entoure l'os de la cheville. Ensuite, les muscles s'étirent à nouveau tandis que dans le même temps le tendon libère son énergie telle une catapulte afin de produire une puissance d'accélération dépassant les limites du muscle[70]. Un mécanisme similaire est connu chez les locustes et les sauterelles[71].
Les anoures de la famille des Bufonidae, des Rhinophrynidae et des Microhylidae ont de courtes pattes postérieures et sont plus enclins à marcher qu'à sauter[72]. Quand ils essaient de se déplacer plus rapidement, ils accélèrent la vitesse des mouvements de leurs membres ou adoptent une démarche sautillante. La démarche de Gastrophryne olivacea a été décrite comme une « combinaison entre de la course et de petits bonds de deux à cinq centimètres de long »[73]. Dans une expérimentation, un Bufo fowleri était placé sur un ergomètre tournant à différentes vitesses. En mesurant la quantité d'oxygène consommée par le crapaud on s'est rendu compte que ce sautillement utilisait de manière inefficace l'énergie lors de longs trajets, mais était une stratégie payante lors de courtes périodes d'activité intense[74].
Kassina maculata a de courtes et frêles pattes postérieures mal adaptées au saut. Elle peut se déplacer rapidement en « courant » en utilisant ses deux pattes alternativement. Au ralenti, on s'en rend compte qu'à la différence d'un cheval qui peut trotter ou galoper, la démarche de cette grenouille est strictement identique quelle que soit sa vitesse d'avancement[75]. Cette espèce peut également grimper dans des arbres et des arbustes, ce qu'elle fait souvent la nuit à la recherche d'insectes[76]. Euphlyctis cyanophlyctis a de larges pattes et peut courir à la surface de l'eau sur quelques mètres[69].

Les anoures qui vivent ou vont parfois dans l'eau disposent d'adaptations pour améliorer leur faculté à nager. Les pattes postérieures ont notamment une forte musculature, et les orteils sont intégralement palmés, ce qui augmente la surface des pattes et aide l'animal à se propulser dans l'eau. Les membres de la famille des Pipidae sont totalement aquatiques et sont les plus spécialisés dans ce domaine. Ils ont une colonne vertébrale très peu flexible, un corps aplati, un système de ligne latérale et de puissantes pattes postérieures aux orteils palmés[77]. Les têtards ont une grande nageoire caudale qui leur permet d'avancer en remuant la queue d'un côté à l'autre[78].
Certains anoures se sont adaptés à la vie dans des galeries souterraines et peuvent creuser. Ils ont généralement un corps arrondi, de courts membres, une petite tête aux yeux renflés et des pattes de derrière adaptées pour creuser. Un exemple extrême est Nasikabatrachus sahyadrensis qui vit dans le sud de l'Inde et se nourrit de termites, et qui passe presque l'intégralité de sa vie sous la surface du sol. Elle en émerge brièvement durant la mousson pour se reproduire dans des mares temporaires. Elle a une minuscule tête avec un museau pointu et un corps globuleux. Du fait de son existence souterraine, elle a été décrite scientifiquement pour la première fois en 2003, et n'était connue auparavant que par la population locale[79].
Les Scaphiopodidae d'Amérique du Nord sont également bien adaptés à la vie souterraine. Le Crapaud des Plaines (Spea bombifrons) en est un exemple typique avec un volet d'os kératinisé relié à l'un des métatarses qui est utilisé pour creuser en reculant. Quand il creuse, le crapaud tortille ses hanches d'un côté à l'autre pour s'enfoncer dans le sol. Il dispose ainsi d'un terrier peu profond en été duquel il émerge la nuit pour aller se nourrir. En hiver il creuse plus profondément et on l'a retrouvé jusqu'à 4,5 m de profond[80]. Le tunnel est rempli de terre et le crapaud hiverne dans une petite chambre située à son extrémité. Pendant ce temps, l'urée s'accumule dans les tissus et l'eau du sol est absorbée par le crapaud par osmose pour subvenir à ses besoins[80]. Les Scaphiopodidae se reproduisent en masse. Ils émergent tous de leurs terriers au même moment et se dirigent vers des mares temporaires, attirés par le chant du premier mâle à trouver une telle opportunité pour se reproduire[81].
Les grenouilles australiennes vivant sous le sol ont un mode de vie semblable. Heleioporus albopunctatus creuse un terrier à côté d'une rivière ou dans le lit d'un ruisseau temporairement à sec, et en émerge régulièrement pour se nourrir. L'accouplement a lieu et les œufs sont pondus dans nid d'écume dans le terrier. Les œufs se développent partiellement ici mais n'éclosent pas tant qu'ils ne sont pas immergés par de fortes précipitations. Les têtards se dirigent alors vers l'étendue d'eau la plus proche et terminent rapidement leur développement[82]. Certaines espèces de Madagascar s'enterrent généralement simplement dans la litière de feuille. Parmi elles Scaphiophryne marmorata a une tête aplatie, un museau court et des tubercules bien développés au niveau du métatarse, en faisant un animal bien adapté pour creuser. Par ailleurs ses orteils des pattes antérieures se terminent par des disques qui lui permettent de grimper dans les buissons[83]. Elle se reproduit dans des points d'eau temporaires après la pluie[84].
Les grenouilles arboricoles vivent haut dans la canopée, où elles naviguent entre les branches, les brindilles et les feuilles, parfois ne descendant jamais à terre. Les grenouilles de la famille des Hylidae sont un exemple typique de grenouilles arboricoles, mais certaines autres espèces ont développé un mode de vie similaire, comme les Centrolenidae, les Hyperoliidae, certaines Microhylidae et les Rhacophoridae[72]. La plupart des grenouilles arboricoles mesurent moins de 10 cm de long, avec de longues pattes arrière et de longs orteils équipés de ventouses à leur extrémité. La surface de ces ventouses est constituée d'une couche de cellules épidermiques à sommet plat hexagonales, très rapprochées et seulement séparées par des sillons au sein desquels des glandes sécrètent du mucus. Ces ventouses, maintenues humides par le mucus, permettent à ces animaux de s'agripper à des surfaces sèches comme mouillées, y compris du verre. Elles utilisent la force de tension superficielle et la viscosité[85]. Certaines grenouilles sont très acrobatiques et peuvent attraper des insectes tandis qu'elles se tiennent à une brindille par un orteil ou qu'elles serrent la tige d'un roseau balayé par le vent[86]. Certains membres de la sous-famille des Phyllomedusinae ont des orteils en position opposés. La Phyllomedusa ayeaye a un doigt opposé sur chacune de ces pattes avant et deux doigts opposés sur ses pattes arrière. Cela lui permet de saisir les tiges des plantes quand elle se déplace en grimpant dans la végétation en bord de rivière[87].
Durant l'histoire évolutive de la grenouille, différents groupes ont développé un déplacement par la voie des airs[88]. Certaines grenouilles dans la forêt tropicale sont bien adaptées pour planer d'arbres en arbres ou pour retomber sur le sol de la forêt. La Grenouille volante de Wallace (Rhacophorus nigropalmatus) en est un exemple typique que l'on trouve en Malaisie et à Bornéo. Elle a de larges pattes avec l'extrémité des doigts formant de larges disques adhésifs et une palmure complète. Les membres sont bordés de bandes de peau libre. En écartant les doigts, étendant les membres et déployant ses bandes de peau, la grenouille peut planer sur des distances considérables[89]. Elle peut changer sa direction pendant qu'elle plane et naviguer ainsi entre les arbres sur des distances pouvant atteindre 15 m[90].
Principalement deux types de reproduction sont utilisés par les anoures : la reproduction prolongée et la reproduction explosive. Dans le premier cas, les adultes se rassemblent certaines périodes de l'année dans les étangs, lacs ou ruisseaux pour se reproduire. La plupart des animaux retournent vers le lieu où ils sont nés et ont grandi. Il en résulte d'importantes migrations de centaines d'individus. Dans l'autre cas, les grenouilles adultes arrivent aux points de reproduction en réponse à certains facteurs, comme des averses dans les régions extrêmement arides. Chez les espèces concernées, la copulation et la ponte ont lieu très rapidement après l'arrivée des animaux sur le site de reproduction, et les têtards se développent très rapidement afin d'utiliser les points d'eau temporaires avant qu'ils ne s'assèchent à nouveau[91].
Chez les espèces qui se rassemblent saisonnièrement, les mâles arrivent généralement les premiers sur les sites de reproduction, et y restent quelque temps avant l'arrivée des femelles, ces dernières quittant le site rapidement après la ponte. Cela implique que les mâles sont plus nombreux que les femelles à un instant donné, et ils défendent un territoire duquel ils excluent les autres mâles. Ils indiquent leur présence en coassant, alternant souvent leurs appels avec les coassements des animaux voisins. Les grenouilles les plus grosses et les plus fortes émettent les coassements les plus profonds, et elles peuvent garder les meilleurs territoires. Les femelles choisissent leur partenaire en partie sur la profondeur de leur chant[92]. Chez certaines espèces certains mâles n'ont pas de territoire et ne chantent pas. Ils interceptent des femelles qui se dirigent vers des mâles coassant ou prennent un territoire lorsqu'il devient vacant. Le chant est une activité qui demande beaucoup d'énergie. Parfois il y a des échanges de rôle, et un mâle disposant d'un territoire le laisse pour graviter librement autour de celui des autres[91].
Chez les espèces adeptes d'une reproduction explosive, le premier mâle qui trouve un lieu approprié pour se reproduire appelle d'un coassement bruyant, attirant ses congénères des deux sexes. Les animaux chantent ensuite à l'unisson, formant un chœur que l'on peut entendre de très loin. Les Scaphiopus d'Amérique du Nord entrent dans cette catégorie. La sélection du partenaire et la cour n'ont que peu d'importance par rapport à la rapidité avec laquelle les animaux s'accouplent. Certaines années, les conditions favorables ne se produisent pas et les animaux peuvent rester deux années ou plus sans se reproduire[91]. Certaines femelles Spea multiplicata pondent uniquement la moitié de leurs œufs à la fois, peut-être pour en conserver si une meilleure opportunité pour se reproduire se produisait ultérieurement[93].
Sur le site de reproduction, le mâle monte sur la femelle et s'accroche solidement sur son corps. Typiquement, l'amplexus a lieu dans l'eau, la femelle relâchant ses œufs et le mâle les couvrant avec son sperme : la fécondation est donc externe. Chez certaines espèces comme le Crapaud des steppes (Bufo cognatus), le mâle retient les œufs avec ses pattes arrière, les gardant en place pendant environ trois minutes[91]. Les membres du genre Nimbaphrynoides que l'on trouve en Afrique de l'Ouest sont uniques parmi les anoures du fait de leur viviparité. Les membres du genre tanzanien Nectophrynoides sont les seuls anoures ovovivipares. Dans les deux cas, la fertilisation est interne et les femelles donnent naissance à de jeunes grenouilles complètement développées[94],[95].
Comme d'autres amphibiens, le cycle de vie de la grenouille commence dans l'eau avec un œuf qui éclos pour donner une larve sans membres munie de branchies, que l'on appelle têtard. Après une période de croissance, durant laquelle le têtard développe des membres et des poumons, il se métamorphose et son aspect général et l'arrangement de ses organes internes sont modifiés. Il peut quitter l'eau sous la forme d'une grenouille miniature.
Les embryons des anoures sont généralement entourés de plusieurs couches d'une substance gélatineuse. La gélatine protège l'œuf tout en permettant le passage de l'oxygène, du dioxyde de carbone et de l'ammoniac. Elle absorbe l'humidité et gonfle en contact avec l'eau. Après la fertilisation, la portion la plus interne se liquéfie pour permettre les libres mouvements de l'embryon en développement. Chez certaines espèces, comme la Grenouille à pattes rouges (Rana aurora) et la Grenouille des bois (Rana sylvatica), une algue verte unicellulaire symbiotique est présente dans la gélatine. On pense qu'elle est utile à l'embryon en développement en lui pourvoyant de l'oxygène supplémentaire à travers la photosynthèse[96]. Les œufs sont noirs ou marron foncé, et ont l'avantage d'absorber la chaleur du soleil qui est retenue par la capsule. L'intérieur des amas d'œufs de la Grenouille des bois (Rana sylvatica) est 6 °C plus chaud que l'eau environnante et cela accélère le développement de la larve[97].
La forme et la taille des œufs sont caractéristiques de l'espèce concernée. Les ranidés produisent des amas d'œufs globulaires comprenant un grand nombre d'œufs, tandis que les bufonidés produisent des amas d'œufs formant de longues chaînes cylindriques. La minuscule Eleutherodactylus limbatus pond des œufs isolés, les enterrant dans le sol humide[98]. Leptodactylus pentadactylus fait un nid de mousse dans un arbre creux. Les œufs éclosent lorsque le nid est inondé, ou les têtards terminent leur développement dans la mousse s'il n'y a jamais d'arrivée d'eau[99]. La Grenouille aux yeux rouges (Agalychnis callidryas) dépose ses œufs sur une feuille au-dessus d'un point d'eau et quand elles éclosent les larves tombent dans l'eau en dessous[100]. Les larves en développement dans les œufs peuvent détecter les vibrations causées par des guêpes ou serpents prédateurs, et peuvent éclore plus précocement pour éviter d'être mangés[101]. En général, la longueur d'incubation dépend de l'espèce et des conditions environnementales. Les œufs aquatiques éclosent généralement au bout d'une semaine, quand la capsule se fend sous l'action d'une enzyme relâchée par la larve en développement[102].
Les larves qui émergent des œufs, que l'on connaît sous le nom de têtards, ont généralement un corps ovale allongé, avec une queue aplatie verticalement. En règle générale, les têtards sont totalement aquatiques, mais au moins une espèce, Nannophrys ceylonensis, a des têtards semi-aquatiques qui peuvent vivre sur des rochers humides[103],[104]. Les têtards n'ont pas de paupière et ont des squelettes cartilagineux, une ligne latérale, des branchies pour assurer leur respiration (branchies externes dans un premier temps puis branchies internes) et une queue aplatie verticalement qu'ils utilisent pour nager[78].
Au début de son développement, le têtard possède une poche branchiale qui recouvre ses branchies et ses pattes avant. Les poumons commencent rapidement à se développer et sont utilisés de manière complémentaire pour la respiration. Certaines espèces réalisent leur métamorphose dans l'œuf et éclosent directement sous la forme de grenouilles miniatures. Les têtards sont dépourvus de vraies dents, mais les mâchoires supérieures de certaines espèces présentent deux rangées parallèles de structures kératinisées. Les mâchoires inférieures portent généralement trois rangées de ces dents entourées d'un bec corné, mais le nombre de rangées peut varier et l'agencement exact de la bouche constitue un moyen d'identification des espèces[102]. Chez les Pipidae, à l'exception de Hymenochirus, les têtards ont une pare de barbillons antérieurs, qui les font ressembler à des poissons-chats[77]. Leurs queues sont raidies par une chorde, mais ne contiennent aucun élément osseux ou cartilagineux, excepté quelques vertèbres à la base qui forme l'urostyle durant la métamorphose. On pense qu'il s'agit d'une adaptation à leur mode de vie. Comme leur transformation en grenouilles arrive très rapidement, la queue est uniquement constituée de tissu mou, car l'os et le cartilage prennent plus de temps à être absorbés. La nageoire caudale et l'extrémité de la queue sont fragiles et se déchirent rapidement, ce qui est vu comme une adaptation pour échapper à des prédateurs qui tentent de les attraper par la queue[105].
Les têtards sont principalement herbivores, se nourrissant majoritairement d'algues comme les diatomées qu'il filtre dans l'eau à travers ses branchies. Certaines espèces sont carnivores au stade têtard, mangeant des insectes, de plus petits têtards et des poissons. La Rainette de Cuba (Osteopilus septentrionalis) fait partie des espèces chez lesquelles les têtards peuvent être cannibales. Les têtards qui développent leurs membres le plus rapidement peuvent être mangés par les autres, et ce sont donc les animaux qui ont le développement le plus long qui sont avantagés[106].
Les têtards sont très vulnérables aux poissons, aux tritons, aux dytiques et aux oiseaux tels que les martins-pêcheurs qui s'en nourrissent. Certains têtards, comme ceux du Crapaud buffle (Rhinella marina), sont poisons. Le stade têtard peut durer seulement une semaine chez des espèces à la reproduction rapide ou peut laisser l'animal passer un ou deux hivers avant qu'il ne se métamorphose au printemps[107].
À la fin du stade têtard, la grenouille se métamorphose et son corps se transforme rapidement en celui d'un adulte. Cette métamorphose dure seulement 24 heures, et est initiée par la production d'une hormone, la thyroxine. Cela conduit différents tissus à se développer de différentes façons. Les principaux changements sont le développement de poumons et la disparition des branchies et des poches branchiales, laissant les pattes avant visibles. La mâchoire inférieure devient la grande mandibule de l'adulte carnivore, et le long intestin spiralé du têtard herbivore est remplacé par un intestin court typique d'un prédateur[102]. Le système nerveux devient bien adapté à l'audition et la vision stéréoscopique, et pour de nouvelles méthodes de locomotion et d'alimentation[102]. Les yeux sont repositionnés plus haut sur la tête et les paupières et glandes associées apparaissent. Le tympan, l'oreille moyenne et l'oreille interne se développent. La peau devient plus épaisse et plus dure, la ligne latérale disparaît et les glandes de la peau apparaissent[102]. La dernière étape est la disparition de la queue, mais elle a lieu plus tard, le tissu étant utilisé pour accélérer la croissance des membres[108]. C'est lors de leur métamorphose que les anoures sont les plus sensibles aux prédateurs. En effet, les grenouilles ont tout juste perdu leur queue et leurs membres commencent tout juste à être utilisés pour la locomotion[72].
Après la métamorphose, les jeunes adultes se dispersent dans leur nouvel habitat terrestre ou continuent à vivre dans l'eau. Presque tous les anoures sont carnivores au stade adulte, se nourrissant d'invertébrés, comme des arthropodes, des annélides, des gastéropodes, et des limaces[109]. Quelques-unes des plus grosses espèces peuvent manger d'autres grenouilles, des petits mammifères et des poissons. Certaines grenouilles utilisent leur langue gluante pour attraper des proies rapides[110], tandis que d'autres poussent la nourriture dans leur bouche avec leurs pattes. La grenouille arboricole Xenohyla truncata est une exception car en partie herbivore, son alimentation comprenant une grande proportion de fruit[111]. Les grenouilles adultes sont elles-mêmes les proies de différents prédateurs. La Grenouille léopard (Rana pipiens) est par exemple consommée par les hérons, les faucons, les poissons, les grandes salamandres, les serpents, les ratons laveurs, les moufettes, les visons, les grenouilles-taureaux et d'autres animaux[112].
Les anoures sont des prédateurs primaires et un maillon important de la chaîne alimentaire. Étant hétérotherme, ils font une utilisation efficace de leur alimentation en dépensant peu d'énergie pour les processus métaboliques, tandis que le reste est transformé en biomasse. Ils sont eux-mêmes consommés par les prédateurs secondaires et sont les principaux consommateurs terrestres d'invertébrés, la plupart attrapés sur des plantes. En réduisant la population d'herbivore, ils jouent un rôle dans la croissance des plantes et participent à l'équilibre des écosystèmes[113].
On sait peu de choses sur la longévité des anoures à l'état sauvage. La squelettochronologie est une méthode permettant d'évaluer l'âge des animaux à partir du squelette. Cette méthode a été utilisée pour étudier la Grenouille des montagnes à pattes jaunes (Rana muscosa), dont les phalanges des orteils présentaient des lignes de croissance saisonnière avec ralentissement de la croissance en hiver. La plus vieille grenouille avait dix lignes, et on estimait donc son âge à 14 ans, en comptant les quatre ans de stade têtard[114]. Certains animaux détenus en captivité ont vécu jusqu'à 40 ans, record obtenu pour un Crapaud commun (Bufo bufo). Le Crapaud buffle (Bufo marinus) peut vivre 24 ans en captivité, et la Grenouille-taureau (Rana catesbeiana) 14 ans[115]. Les grenouilles des climats tempérés hibernent durant l'hiver, et quatre espèces sont connues pour pouvoir supporter de geler durant cette période, dont la Grenouille des bois (Rana sylvatica)[116].
Bien que les soins apportés à la progéniture soient mal étudiés chez les grenouilles, près de 20 % pourrait s'occuper d'une manière ou d'une autre de l'avenir de leur progéniture[117]. L'évolution des soins parentaux chez les grenouilles est dirigée principalement par la taille de l'étendue d'eau dans lequel elles se reproduisent. Les espèces qui se reproduisent dans de petits points d'eau ont généralement des comportements parentaux plus complexes[118]. Du fait de la prédation importante des œufs et des larves dans les points d'eau de plus grande taille, un grand nombre d'espèces pondent leurs œufs sur la terre. Un des deux parents doit alors s'assurer que les œufs ne se dessèchent pas en maintenant une certaine humidité pour assurer leur survie[119]. Par ailleurs les parents doivent ensuite assurer le transport des têtards juste éclos vers un point d'eau[118].
Dans les petits points d'eau, les prédateurs sont la plupart du temps absents et la compétition entre les têtards est la principale limite à leur survie. Certaines espèces de grenouilles évitent cette concurrence en utilisant de petits phytotelmes (axiles de feuilles remplis d'eau ou cavité dans du bois) comme sites pour déposer quelques têtards[120]. Si ces sites permettent aux têtards de ne pas être en compétition, ils manquent également de nutriments pour survivre sans aide de leurs parents. Les espèces ayant adopté cette stratégie laissent à leurs têtards des œufs remplis de substances nutritives mais non fécondés[118]. La femelle Grenouille des fraises (Oophaga pumilio) pond ses œufs sur le sol de la forêt tropical. Le mâle les protège des prédateurs et leur apporte de l'eau via son cloaque pour les garder humides. Quand ils éclosent, la femelle emmène les têtards sur son dos pour rejoindre une broméliacée remplie d'eau ou autre point d'eau similaire, en déposant seulement un œuf à chaque endroit. Elle les visite régulièrement et les nourrit en pondant un ou deux œufs non fertilisés dans le phytotelma, et ce jusqu'à ce que le têtard atteigne le stade de la métamorphose[121]. Oophaga granulifera s'occupe de ses têtards d'une manière similaire[122].
Diverses autres formes de soins parentaux peuvent être observées chez les grenouilles. Le petit mâle Colostethus subpunctatus garde les œufs pondus par sa femelle, sous une pierre ou un morceau de bois. Quand les œufs éclosent, il transporte les têtards sur son dos jusqu'à une mare temporaire, où il s'immerge en partie pour laisser tomber un ou quelques têtards, avant de se diriger vers un autre point d'eau et recommencer l'opération[123]. Le mâle Alyte accoucheur (Alytes obstetricans) porte les œufs avec lui, attachés sur ses pattes arrière. Il les conserve humide en s'immergeant régulièrement dans l'eau et leur évite de devenir trop humide en élevant ses quartiers arrière. Après trois à six semaines, il se dirige vers un point d'eau et les œufs éclosent[124]. Engystomops pustulosus construit un nid flottant fait de mousse pour protéger ses œufs de la prédation. Cette mousse est faite de protéines et de lectines et semble avoir des propriétés antimicrobiennes[125]. Plusieurs couples de grenouilles peuvent construire un nid de ce type en commun, à partir d'un radeau préexistant. Les œufs sont pondus au centre, suivis de couches alternatives de mousse et d'œufs, le tout recouvert de mousse[126].
Certaines grenouilles protègent leur descendance dans leur propre corps. Les mâles et les femelles Assa darlingtoni gardent leurs œufs, qui sont pondus sur le sol. Une fois éclos, le mâle lubrifie son corps avec le gel les entourant, et s'immerge dans la masse d'œufs éclos. Les têtards se dirigent alors vers des poches de peau qu'il possède sur ses flancs, où ils vont se développer jusqu'à la métamorphose[127]. Les femelles du genre Rheobatrachus, présent en Australie et probablement éteinte aujourd'hui, avalent les œufs fertilisés, qui se développent dans leur estomac. Elles cessent alors de se nourrir et de sécréter des sucs gastriques. Les têtards utilisent le vitellus des œufs pour se nourrir. Après 6 ou 7 semaines, ils sont prêts à se métamorphoser. La mère régurgite les petites grenouilles, qui s'échappent de sa bouche[128]. La femelle Rhinoderma darwinii du Chili pond jusqu'à 40 œufs sur le sol, où ils sont gardés par le mâle. Quand les têtards sont prêts à éclore, ils sont gobés par le mâle, qui les garde dans son sac vocal particulièrement grand. Ils sont immergés dans un liquide visqueux et mousseux qui contient des matières nutritives supplémentaires à celle du vitellus. Ils y restent 7 à 10 semaines avant de se métamorphoser, après quoi ils sortent de la bouche du mâle[129].
Les anoures ont de nombreux prédateurs potentiels (dont d'autres amphibiens tels que les salamandres) [130]. À première vue, les anoures semblent sans défense avec leur petite taille, leur peau fine et l'absence de défenses telles que des épines, des griffes ou des dents. Plusieurs utilisent le camouflage pour éviter d'être vue par certains prédateurs (Une peau tachetée ou rayée de couleurs identiques à celles de son environnement permettent à l'animal d'être difficile à percevoir, il existe des anoures qui ont la couleur, mais aussi la forme d'une feuille morte). Certaines espèces peuvent faire de grands bonds, généralement vers l'eau, pour échapper à leurs prédateurs, tandis que d'autres ont développé d'autres méthodes de défense[91].
La peau de plusieurs anoures contient des substances toxiques appelées bufotoxines qui les rendent immangeables pour les prédateurs. La plupart des crapauds et certaines grenouilles ont de grandes glandes productrices de poison, les glandes parotoïdes, situées sur les côtés de leurs têtes derrière les yeux, ainsi que d'autres glandes un peu partout sur le corps. Des glandes sécrètent aussi un mucus et des substances rendant les animaux glissants et donc difficiles à saisir. Si les effets nocifs du poison ou de molécules répulsives sont immédiats, le prédateur stoppe son agression et l'anoure peut s'échapper. Si les effets sont plus tardifs, le prédateur va apprendre à éviter cette espèce à l'avenir[131]. Les grenouilles toxiques indiquent leur toxicité en se parant de couleurs vives, une stratégie adaptative connue comme l'aposématisme. C'est le cas notamment des grenouilles de la famille des Dendrobatidae. Elles sont généralement rouges, orange ou jaunes, souvent avec des marques noires qui font contraste. Allobates zaparo n'est pas toxique, mais mime l'apparence de deux espèces toxiques qui partagent son aire de répartition pour se prémunir des prédateurs[132]. D'autres espèces, comme le Sonneur à ventre de feu (Bombina bombina), ont leurs couleurs dissuasives sous le corps. Elles les exhibent alors lorsqu'elles sont attaquées, adoptant une pose pour montrer leur ventre[5].
Certaines grenouilles, comme les Dendrobatidae, sont particulièrement toxiques. Les indigènes d'Amérique du Sud extraient le poison de ces grenouilles pour en recouvrir leurs armes pour la chasse[133], bien que peu d'espèces soient suffisamment toxiques pour être utilisées de la sorte. Au moins deux espèces non toxiques d'Amérique tropicale (Pristimantis gaigei et Lithodytes lineatus) miment l'apparence des Dendrobatidae pour se protéger elles-mêmes[134],[135]. Certaines grenouilles obtiennent leur poison grâce aux fourmis et autres arthropodes qu'elles consomment[136]. D'autres, comme les Pseudophryne d'Australie (Pseudophryne corroboree et Pseudophryne pengilleyi), synthétisent leurs alcaloïdes elles-mêmes[137]. Les substances produites par les anoures peuvent être irritantes, hallucinogènes, neurotoxiques, vasoconstrictrices ou provoquer des convulsions. De nombreux prédateurs se sont adaptés et peuvent tolérer un degré d'empoisonnement fort avec ces substances, mais d'autres créatures, y compris les hommes qui attrapent les anoures, peuvent être fortement touchées[138].
Certains anoures se défendent en intimidant leurs prédateurs. Le Crapaud commun (Bufo bufo) adopte une posture particulière lorsqu'on l'attaque, gonflant son corps et se tenant dressé sur ses pattes de devant avec la tête baissée[139]. La Grenouille-taureau (Rana catesbeiana) se tapit au sol avec ses yeux fermés et la tête penchée vers l'avant quand elle est menacée. De cette façon les glandes parotoïdes sont dans leur position la plus efficace, les autres glandes sur son dos commencent à suinter des sécrétions toxiques et les parties de son corps les plus vulnérables sont protégées[91]. Certaines grenouilles « crient » pour surprendre le prédateur. La Rainette versicolore (Hyla versicolor) produit un bruit lourd qui rappelle parfois la Grande musaraigne Blarina brevicauda[91]. Bien que les crapauds soient évités par de nombreux prédateurs, la Couleuvre rayée (Thamnophis sirtalis) en consomme régulièrement. Les jeunes Crapauds d'Amérique (Bufo americanus) lorsqu'ils sont approchés par ce serpent font le mort : ils se couchent et restent immobiles, tactique souvent fructueuse, le serpent passant à côté du crapaud sans le détecter[140].
Les anoures sont présents sur tous les continents à l'exception de l'Antarctique, mais ne sont pas présents sur diverses îles, notamment sur celles qui sont éloignées des continents[141],[142]. De nombreuses espèces sont restreintes à des zones géographiques limitées du fait de changements de climat ou de territoires inhospitaliers comme les étendues de mer, les chaînes montagneuses, les déserts, les forêts coupées à blanc, les routes ou diverses autres constructions humaines qui constituent des barrières infranchissables pour ces animaux[143]. Généralement, on rencontre une plus grande diversité d'anoures dans les zones tropicales que dans les zones tempérées comme l'Europe[144]. Certaines grenouilles vivent dans des habitats arides, comme les déserts, grâce à des adaptations adéquates. Ainsi les membres du genre australien Cyclorana creusent eux-mêmes des galeries souterraines un cocon imperméable à l'eau dans lequel ils peuvent estiver durant les périodes sèches. Une fois qu'il pleut, les animaux émergent et se reproduisent dès qu'elles ont trouvé une mare temporaire. Le développement des œufs et des têtards est alors très rapide en comparaison des autres espèces, ceci afin que la reproduction puisse se terminer avant que la mare temporaire ne tarisse[145]. Certaines grenouilles sont adaptées aux environnements froids. La Grenouille des bois (Rana sylvatica), dont l'habitat s'étend dans le cercle Arctique, creuse dans le sol en hiver. Bien que la plupart de son corps gèle à ce moment, elle protège ses organes vitaux des dommages grâce à la très forte concentration de glucose en leur sein[21].
Environ 88 % des espèces d'amphibiens sont classées dans l'ordre des anoures[18]. Cet ordre comprend environ 4 810 espèces appartenant à 33 familles[146], parmi lesquelles les Leptodactylidae (1100 espèces), les Hylidae (800 espèces) et les Ranidae (750 espèces) sont les plus importantes[18]. Les anoures comprennent toutes les grenouilles modernes et diverses espèces fossiles. Les caractéristiques des anoures adultes comprennent neuf vertèbres présacrales ou moins, un long ilium incliné vers l'avant, la présence d'un urostyle, l'absence de queue, des membres avant plus courts que les membres arrière, le radius et l'ulna fusionnés, tout comme le tibia et le fibula, des os de la cheville allongés, l'absence d'un os préfrontal, la présence d'un os hyoïde, une mâchoire inférieure dépourvue de dents, une langue sans support, des espaces lymphatiques en dessous de la peau et un muscle, le protractor lentis, attaché au cristallin[147]. La larve des anoures, le têtard, a un unique stigmate pour respirer et sa bouche est pourvue d'un bec corné et de denticules[147]
Les grenouilles et les crapauds sont classés en trois sous-ordres : celui des Archaeobatrachia, qui inclut quatre familles de grenouilles "primitives" ; celui des Mesobatrachia, qui comprend cinq familles de grenouilles un peu plus "évoluées" ; et celui des Neobatrachia, de loin le plus répandu, qui contient les 24 autres familles d'anoures "modernes", dont les espèces les plus communes présentes à travers le monde. Le sous-ordre des Neobatrachia est lui-même divisé en deux superfamilles, les Hyloidea et les Ranoidea[148]. Cette classification s'appuie sur des caractéristiques morphologiques comme le nombre de vertèbres, la structure de la ceinture scapulaire et la morphologie des têtards. Alors que cette classification est largement acceptée, les liens entre les différentes familles d'anoures restent débattus[149].
Certaines espèces d'anoures s'hybrident communément. Par exemple, la Grenouille verte d'Europe (Pelophylax kl. esculentus) est un hybride entre la Petite grenouille verte (Pelophylax lessonae) et la Grenouille rieuse (Pelophylax ridibundus)[150]. Le Sonneur à ventre de feu (Bombina bombina) et le Sonneur à ventre jaune Bombina variegata sont également très proches et peuvent s'hybrider. Les hybrides sont moins fertiles que leurs parents, et on trouve une zone d'hybridation où ils sont très répandus[151].
Selon Amphibian Species of the World (17 septembre 2014)[152] :
Les origines et les relations évolutives entre les trois principaux groupes d'amphibiens sont sujets à controverses. La phylogénie moléculaire s'appuyant sur l'analyse de l'ADN ribosomique réalisée en 2005 suggère que les salamandres et les cécilies sont plus proches entre eux qu'ils le sont des anoures, et que la divergence entre les trois groupes date du Paléozoïque ou du début du Mésozoïque, avant la séparation du supercontinent Pangée et peu après leur divergence d'avec les sarcoptérygiens[153]. Une autre analyse moléculaire phylogénétique a conclu que les lissamphibiens sont apparus pour la première fois il y a environ 330 millions d'années et que l'hypothèse selon laquelle les anoures dérivaient des Temnospondyli est la théorie la plus crédible. Les Neobatrachia semblent être originaires d'Afrique et d'Inde, les salamandres d'Asie de l'Est et les cécilies de la Pangée tropicale[154]. D'autres chercheurs, bien qu'ils acceptent les principaux points de cette théorie, pensent que la divergence des lissamphibiens a eu lieu au Permien, il y a moins de 300 millions d'années, une date qui est plus en rapport avec les découvertes paléontologiques[155]. Une étude complémentaire menée en 2011 sur des taxons éteints et existants étudiés du point de vue de leur morphologie et également de leur analyse moléculaire a conclu que Lissamphibia est un groupe monophylétique et qu'il devait être placé dans les Lepospondyli plutôt que parmi les Temnospondyli. L'étude postule que Lissamphibia n'est pas apparu avant la fin du Carbonifère, il y a entre 290 et 305 millions d'années. La séparation entre les anoures et les Caudata est estimée avoir eu lieu il y a 292 millions d'années, bien plus tard que la plupart des études moléculaires ne le suggèrent, et les cécilies auraient quant à eux divergé il y a 239 millions d'années[156].
En 2008, Gerobatrachus hottoni, un temnospondyle partageant à la fois des caractéristiques des grenouilles et des salamandres, est découvert au Texas. Il est daté de 290 millions d'années avant notre ère, et considéré comme un chaînon manquant, proche de l'ancêtre commun des grenouilles et des salamandres, ce qui est cohérent avec l'idée largement acceptée suivant laquelle les grenouilles et les salamandres sont plus fortement apparentées (formant un clade appelé Batrachia) qu'elles le sont avec les cécilies[157],[158]. Le premier Salientia connu (voir ci-dessous), plus proche des grenouilles existantes que des salamandres existantes, est Triadobatrachus massinoti, vivant au début du Trias à Madagascar (il y a environ 250 millions d'années), et des fragments de Czatkobatrachus polonicus vivant à la même période en Pologne[159]. Le crâne de Triadobatrachus ressemble à celui d'une grenouille, large avec de grandes orbites oculaires, mais les fossiles ont des caractéristiques qui divergent clairement des grenouilles actuelles, notamment un corps plus long avec plus de vertèbres. La queue a des vertèbres séparées qui diffèrent du coccyx fusionné des grenouilles actuelles. Le tibia et le fibula sont également séparés, et Triadobatrachus n'était donc vraisemblablement pas un bon sauteur[159].
Salientia (du latin (la) (salio), « sauter ») est un groupe comprenant les grenouilles modernes dans l'ordre des anoures et les fossiles qui leur sont fortement apparentés (comme Triadobatrachus et Czatkobatrachus). Les principales caractéristiques de ces « proto-grenouilles » de l'ordre des Salientia incluent les 14 vertèbres présacrées (les grenouilles modernes en ont 8 ou 9), un long ilium tourné vers l'avant au niveau du pelvis, la présence d'un os pariétal et d'une mâchoire inférieure dépourvue de dents. La première grenouille fossile que l'on place dans la lignée des anoures proprement dits est Prosalirus bitis, qui vivait au début du Jurassique[3],[160]. Elle a été découverte en 1995 dans la formation de Kayenta en Arizona, et date du début du Jurassique (entre 199,6 et 175 millions d'années avant notre ère), faisant de Prosalirus un groupe plus récent que Triadobatrachus[161]. Comme ces descendants, Prosalirus ne présente pas les pattes fortement agrandies mais possède la structure pelvique typique des grenouilles modernes. À la différence de Triadobatrachus, Prosalirus a déjà perdu presque toute sa queue[162] et était bien adapté au saut[163].
La première véritable grenouille connue est Vieraella herbstii, qui vivait au début du Jurassique. On connaît cet animal uniquement à partir des impressions fossilisées du dos et du ventre d'un animal unique, dont la taille était d'environ 33 mm. Notobatrachus degiustoi datant du milieu du Jurassique est plus jeune et date d'il y a entre 155 et 170 millions d'années. Les principales évolutions visibles sur cette espèce est le raccourcissement du corps et la perte de la queue. On pense que l'évolution des anoures modernes s'est achevée à la fin du Jurassique. Depuis, les évolutions au niveau du nombre de chromosomes ont été environ 20 fois plus rapides chez les mammifères que chez les grenouilles, indiquant que le phénomène de spéciation était plus rapide chez les mammifères[164].
Des fossiles de grenouilles ont été retrouvés sur tous les continents à l'exception de l'Antarctique mais des preuves biogéographiques suggèrent qu'ils ont également vécu en Antarctique dans une ère précédente quand le climat y était plus chaud[165].
Phylogénie des ordres d'amphibiens modernes d'après Marjanovic & Laurin (2007)[166] :
LissamphibiaApoda (cécilies)
Urodela (salamandres...)
Anura (grenouilles et crapauds)
Phylogénie des familles basales de l'ordre Anura, d'après Pyron et Wiens (2011)[167] ainsi que Frost et al. (2006)[168] et Heinicke et al. (2009)[169] pour les noms de clades :
AnuraEn 2006, parmi les 4 035 espèces d'amphibiens dépendant de l'eau au cours de leur cycle de vie, 1 356 (33,6 %) étaient considérés comme menacés. Il se pourrait même que ce chiffre soit sous-estimé car pour 1 427 on ne dispose pas de suffisamment d'éléments pour établir leur statut de sauvegarde[170]. Les populations d'anoures ont décliné fortement depuis les années 1950. Plus d'un tiers des espèces sont considérées comme menacées d'extinction, et plus de 120 espèces semblent s'être éteintes depuis les années 1980[171]. Parmi ces espèces disparues on compte notamment les Rheobatrachus d'Australie et le Crapaud doré du Costa Rica. La disparition de ce dernier a une importance particulière pour les scientifiques car il vivait dans la réserve de la forêt de nuages de Monteverde et a souffert d'un crash de sa population en 1987, comme 20 autres espèces d'anoures que l'on trouve dans cette région. Cet effondrement de la population, au-delà de la normale, ne peut pas être directement relié aux activités humaines telles que la déforestation[172]. Ailleurs, la disparition de leur habitat est la principale cause de déclin des populations d'anoures, avec la pollution, le changement climatique, l'accroissement des radiations UV et l'introduction d'espèces prédatrices ou entrant en compétition avec les espèces locales[173]. Une étude canadienne conduite en 2006 a estimé que l'augmentation du trafic routier était une cause de déclin plus importante que la disparition d'habitats[174]. Des maladies infectieuses émergentes, comme la chytridiomycose et le ranavirus, dévastent également certaines populations[175],[176].
Plusieurs spécialistes pensent que les amphibiens, dont les anoures, sont de très bons indicateurs de la bonne santé d'un écosystème du fait de leur position intermédiaire dans la chaîne alimentaire, leur peau perméable et leur vie à la fois aquatique et terrestre[177]. Il apparaît d'ailleurs que les espèces avec des œufs et des larves aquatiques sont plus sujettes au déclin que celles qui ont un développement direct sans stade larvaire[178].
Les mutations chez les grenouilles ont augmenté depuis les années 1990. Ces déformations comprennent notamment des pattes manquantes ou supplémentaires. Diverses causes sont identifiées ou considérées comme possibles, comme l'augmentation de la radiation ultraviolette qui pourrait affecter la ponte à la surface des mares, la contamination de l'eau par des pesticides et des engrais et la présence de parasites comme le trématode Ribeiroia ondatrae. Probablement que tous ces éléments contribuent d'une manière complexe à stresser les animaux, les rendant plus sensibles aux maladies et plus vulnérables aux attaques de parasites. Les malformations limitent la mobilité des animaux qui aurait donc du mal à atteindre l'âge adulte. L'augmentation du nombre de grenouilles capturées par des oiseaux risque au bout du compte d'augmenter la probabilité que les autres grenouilles soient parasitées, car le cycle des trématodes qui parasitent ces animaux est complexe et comprend des escargots de la famille des Planorbidae et les oiseaux comme hôtes intermédiaires[179],[180].
Dans quelques rares cas, des programmes d'élevage en captivité ont été menés avec succès[181],[182]. En 2007, l'application d'une bactérie probiotique s'est révélée pour enrayer la chytridiomycose[183]. Un projet mené actuellement, le Panama Amphibian Rescue and Conservation Project, a été développé à la suite de cette découverte pour secourir les espèces menacées par cette maladie à l'Est du Panama, et pour faire avancer la recherche sur la thérapie par les probiotiques[184],[185]. L'Association mondiale des zoos et des aquariums a déclaré 2008 l'« Année de la grenouille » pour attirer l'attention sur les problèmes de conservation qui menacent ces animaux[186].
Le Crapaud buffle (Bufo marinus) est une espèce originaire d'Amérique du Sud et d'Amérique centrale, et capable de s'adapter facilement à d'autres environnements. Dans les années 1930 il a été introduit à Porto Rico et dans diverses autres îles des Caraïbes pour réguler les insectes nuisibles dans les champs cultivés[187]. En 1935, 3000 Crapauds buffles sont relâchés dans les plantations de canne à sucre du Queensland, en Australie, pour lutter contre des insectes ravageurs tels que Dermolepida albohirtum, dont les larves font énormément de dégâts dans les cannes. Les premiers résultats sont positifs, mais il devient par la suite clair que le crapaud se développe et perturbe l'équilibre de l'écosystème local. Ils se reproduisent librement, se multiplient et entrent en compétition avec les grenouilles locales, mangent les abeilles et d'autres invertébrés non nuisibles. Ils ont peu de prédateurs dans ce nouvel habitat, et empoisonnent les animaux domestiques, les oiseaux carnivores et les mammifères qui cherchent à les consommer. Dans plusieurs de ces pays il est maintenant considéré comme une espèce invasive nuisible, et les scientifiques cherchent un moyen de contrôler sa population[188].
Les cuisses de grenouilles sont consommées par l'Homme dans diverses parties du monde. Elles provenaient de petites populations sauvages, mais la surexploitation a conduit à la raréfaction de cette ressource. C'est pourquoi s'est développé l'élevage des grenouilles et un marché mondial en la matière[189]. Les principaux pays importateurs sont la France, la Belgique, le Luxembourg, et les États-Unis, tandis que les pays exportateurs sont l'Indonésie et la Chine[189]. Chaque année, entre 1 200 et 2 400 tonnes de Grenouille-taureau (Rana catesbeiana), principalement produites en Chine, sont vendues sur le marché mondial[190].
La consommation de grenouilles peut toutefois présenter des risques. Elles peuvent avoir bioaccumulé des toxines environnementales ou radionucléides (à la suite de la catastrophe de Tchernobyl par exemple). Certaines espèces ont une peau qui produit des toxines. La grenouille léopard du lac Saint-Pierre (Canada) s'est avérée contenir des PCB et du Mirex (mais en quantité à ce jour considérée comme non dangereuse pour les consommateurs). Les grenouilles peuvent transmettre divers pathogènes. Elles sont considérées avec d'autres animaux comme un des réservoirs de salmonelles (Sur la peau et les intestins), y compris des souches endémiques rares chez l'homme mais pouvant poser problème. Cette souche également trouvée dans les poulaillers et effluents d'élevages de bovins et de volailles et en aval de stations d'épuration. Ces effluents pourraient contaminer les zones humides et faire des amphibiens des réservoirs de telles souches[191].
Les grenouilles véhiculent aussi des bactéries comme Aeromonas hydrophila, responsable de la maladie des pattes rouges dont les symptômes sont des ulcères cutanés, un gonflement du ventre, une rougeur des pattes arrière et du bas-ventre. Cette bactérie est responsable de gastro-entérites et d'infections de plaies cutanées chez l'Homme[192].
Les grenouilles sont parfois utilisées pour réaliser des dissections en cours d'anatomie dans les lycées et les universités, souvent après qu'on leur eut injecté des substances colorées pour mieux voir certaines organes. Cette pratique tend à se réduire avec les préoccupations croissantes concernant le bien-être, et des « grenouilles virtuelles » sont aujourd'hui disponibles pour des dissections[193].
Les grenouilles ont souvent servi pour des expérimentations animales au fil de l'histoire de la science. Le biologiste du XVIIIe siècle Luigi Galvani a découvert le lien entre l'électricité et le système nerveux via ses études sur des grenouilles[194]. En 1852, H. F. Stannius utilise un cœur de grenouille dans une procédure appelée ligature de Stannius pour démontrer que le ventricule et l'oreillette battent indépendamment l'un de l'autre et à des vitesses différentes[195]. La Xénope lisse (Xenopus laevis) était très utilisée dans les laboratoires dans la première moitié du XXe siècle pour réaliser des tests de grossesse. Un échantillon d'urine venant d'une femme enceinte injecté dans une grenouille femelle provoque en effet sa ponte, comme l'a observé le zoologiste anglais Lancelot Hogben. Ceci est du a une hormone, l'hormone gonadotrophine chorionique, présente en grande quantité dans l'urine d'une femme durant sa grossesse[196]. En 1952, Robert Briggs et Thomas J. King clonent une grenouille à partir de cellules somatiques. La même technique est plus tard utilisée pour créer la brebis Dolly, et leur expérience constitue la première transplantation nucléaire réussie pour un animal supérieur[197].
Les grenouilles sont utilisées pour les recherches sur le clonage et d'autres branches de l'embryologie. Bien que d'autres méthodes soient aujourd'hui disponibles pour réaliser des tests de grossesse, les biologistes continuent à utiliser Xenopus comme un organisme modèle dans la biologie du développement car ses embryons sont gros et faciles à manipuler, elles peuvent être obtenues facilement et elles sont faciles à élever en laboratoire[198]. Xenopus laevis est tout de même de plus en plus souvent remplacée par une grenouille qui lui est apparentée, Xenopus tropicalis, plus petite et qui a l'avantage d'atteindre sa maturité sexuelle à cinq mois plutôt qu'un ou deux ans pour X. laevis[199], ce qui permet d'étudiant plus facilement les évolutions entre les générations. Le génome de X. tropicalis est séquencé[200].
Comme les toxines produites par les anoures sont extraordinairement diverses, elles intéressent fortement les biochimistes qui y voient une « pharmacie naturelle ». L'alcaloïde épibatidine, un analgésique 200 fois plus puissant que la morphine, est par exemple rencontré chez une espèce de Dendrobatidae. D'autres substances isolées sur la peau des grenouilles pourraient apporter une résistance aux infections par le VIH[201]. Les Dendrobatidae sont l'objet de recherches pour évaluer leur potentiel thérapeutique[202].
On a longtemps pensé que les Mésoaméricains pré-colombiens utilisaient les sécrétions toxiques du crapaud-buffle comme hallucinogène, mais ils utilisaient plus probablement les substances produites par Bufo alvarius. Celles-ci comprennent la bufoténine (5-MeO-DMT), un psychotrope utilisé aujourd'hui comme stupéfiant. Généralement, les sécrétions de la peau étaient séchées et fumées[203]. La prise illicite de drogue en léchant un crapaud a été rapportée par les médias mais il pourrait s'agir d'une légende urbaine[204].
Les exsudats provenant de la peau du Phyllobate terrible (Phyllobates terribilis) étaient traditionnellement utilisés par les indigènes pour empoisonner les flèches qu'ils utilisaient pour la chasse. L'extrémité du projectile était frottée sur le dos d'une grenouille et la flèche était ensuite lancée via une sarbacane. La combinaison des deux alcaloïdes toxiques que sont la batrachotoxine et la homobatrachotoxine est extrêmement puissante, et une grenouille peut fournir suffisamment de poison pour tuer 22 000 souris[205]. Deux autres espèces, le Phyllobate à bande dorée (Phyllobates aurotaenia) et le phyllobate bicolore (Phyllobates bicolor), étaient utilisées de la même manière. Elles sont toutefois moins toxiques et moins abondantes que le Phyllobate terrible. Ces grenouilles étaient empalées à la pointe d'un bâton et chauffée au-dessus d'un effet pour en extraire le maximum de poison pour recouvrir les flèches[205].
Les grenouilles et crapauds tiennent une place importante dans le folklore, les contes de fées et la culture populaire. Ils tendent à être dépeints comme laids et maladroits, mais avec des talents cachés. Les exemples sont nombreux, parmi lesquels le personnage du Roi Grenouille ou Henri de Fer, Michigan J. Frog ou Kermit la grenouille. Le dessin animé One Froggy Evening de la Warner Brothers met en scène Michigan J. Frog, qui ne fera que danser et chanter pour le travailleur de démolition qui ouvre la capsule de temps, mais ne fait rien en public[206]. Le Roi grenouille est un conte de fées des frères Grimm sur une grenouille qui se transforme en un beau prince après avoir sauvé la balle d'or de la princesse, et l'avoir suivi dans son palais[207]. Kermit la grenouille est un personnage consciencieux et discipliné du Muppet Show et de 1, rue Sésame (Sesame Street), dans lequel il est ouvertement amical et très talentueux[208].
Les crapauds ont une réputation plus sinistre. Ils sont associés dans le folklore européen aux sorcières, et on pensait qu'ils avaient des pouvoirs magiques. Les sécrétions toxiques de leur peau étaient utilisées dans des potions maléfiques, mais ont également été mises à profit pour créer des remèdes magiques pour les maladies humaines et animales. Ils ont été associés au diable ; dans Le Paradis perdu de John Milton, Satan est ainsi représenté sous la forme d'un crapaud qui verse du poison dans l'oreille d'Eve[209]. Dans la Bible, la deuxième des dix plaies d'Égypte est l'invasion des terres par des milliers de ces batraciens. D'après les scientifiques qui se sont penchés sur cet évènement, le phénomène pourrait s'expliquer par une sécheresse ou par l'empoisonnement des eaux du Nil. En effet, dans des situations de stress, ces animaux sont capables d'accélérer leur développement pour fuir plus vite leur milieu, d'où une explosion de leur nombre.
Les Moche, ancien peuple du Pérou, adoraient les animaux, et les grenouilles étaient souvent représentées dans leur art[210]. Au Panama, une légende locale raconte que la bonne fortune viendrait à la personne qui trouverait une grenouille dorée. Certains croyaient que lorsque l'une de ces grenouilles mourrait, elle se transformait en un talisman d'or connue sous le nom de Huaca. Aujourd'hui, en dépit de l'extinction de l'espèce à l'état sauvage, les grenouilles dorées du Panama demeure un symbole culturel important et sont représentées sur des molas en tissu décoratif faits par le peuple Kuna[211].
Anura
Les anoures, Anura, sont un ordre d'amphibiens. C'est un groupe, diversifié et principalement carnivore, d'amphibiens sans queue comportant notamment des grenouilles et des crapauds. Le plus ancien fossile de « proto-grenouille » a été daté du début du Trias à Madagascar, mais la datation moléculaire suggère que leur origine pourrait remonter au Permien, il y a 265 Ma. Les anoures sont largement distribués dans le monde, des tropiques jusqu'aux régions subarctiques, mais la plus grande concentration d'espèces se trouve dans les forêts tropicales. Il y a environ 4 800 espèces d'anoures recensées, représentant plus de 85 % des espèces d'amphibiens existantes. Il est l'un des cinq ordres de vertébrés les plus diversifiés.
L'anoure adulte a communément un corps robuste et sans queue, des yeux exorbités, une langue bifide, des membres repliés sous le reste du corps, prêts pour des bonds à bonne distance. Vivant ordinairement en eau douce et sur le sol, certaines espèces vivent, au stade adulte, sous terre ou dans les arbres. La peau des grenouilles est glandulaire, avec des sécrétions lui donnant un mauvais goût ou la rendant toxique. Certaines espèces, appelées par convention crapauds, ont une peau dite verruqueuse dont les renflements contiennent des toxines glandulaires ; mais par la taxinomie et la phylogénie, certains crapauds sont plus proches des grenouilles que des autres crapauds. La couleur de la peau des grenouilles varie du marron tacheté, gris et vert, propices au mimétisme, à des motifs vifs de rouge ou jaune et noir signalant aux prédateurs leur toxicité.
Les œufs que ces amphibiens pondent dans l'eau, donnent des larves aquatiques appelées têtards possédant des pièces buccales adaptées à un régime herbivore, omnivore ou planctonophage. Quelques espèces déposent leurs œufs sur terre ou n'ont pas de stade larvaire. Les grenouilles adultes ont généralement un régime carnivore à base de petits invertébrés, mais il existe des espèces omnivores et certaines mangent des fruits. Les grenouilles sont extrêmement efficaces pour convertir ce qu'elles mangent en biomasse formant une ressource alimentaire majeure pour des prédateurs secondaires, leur donnant ainsi le rôle de clé de voûte du réseau trophique d'un grand nombre d'écosystèmes de la planète.
Leur peau semi-perméable les rendant sensibles à la déshydratation, leur habitat est le plus souvent humide, mais certains ont connu une profonde adaptation à des habitats secs. Les grenouilles ont une riche gamme de cris et chants, en particulier à l'époque de la reproduction, ainsi qu'une large palette de comportements sophistiqués pour communiquer entre eux ou se débarrasser d'un prédateur.
Les populations de grenouilles ont considérablement diminué partout dans le monde depuis les années 1950. Plus d'un tiers des espèces sont considérées comme menacées d'extinction et plus de 120 sont soupçonnées d'avoir disparu depuis les années 1980. Le nombre de malformations chez les grenouilles est à la hausse et une maladie fongique émergente, la chytridiomycose, s'est propagée dans le monde entier. Les spécialistes de la conservation des espèces cherchent les causes de ces problèmes. Les grenouilles sont consommées par les humains et ont aussi une place notable dans la culture à travers la littérature, le symbolisme et la religion.
Os anuros (Anura do grego antigo ἀ(ν-) a(n-) (negación) e οὐρά ourá 'cola') son unha orde de anfibios, coñecidos vulgarmente como ras e sapos. Caracterízanse por carecer de cola, por presentar un corpo curto e moi ensanchado, e unhas patas posteriores moi desenvolvidas e adaptadas para o salto. Os anuros son o grupo máis numeroso de anfibios; estímase que existen más de 5.000 especies, repartidas en 48 familias.[1] A maioría pasa a súa vida dentro ou preto da auga. O seu tamaño pode variar dende uns escasos 8,5 milímetros, como é o caso das especies do xénero Eleutherodactylus,[2] ata tallas que superan os 30 centímetros, destacando a Conraua goliath, o anuro máis grande do mundo.[3]
Os nomes «ra» e «sapo» referíanse nun principio ós dous tipos de anuros que aparecen na Península Ibérica: as ras típicas (as do xénero Ra), e os sapos típicos (os do xénero Bufo); pero na actualidade úsanse para outros grupos de forma indiscriminada e arbitraria. «Ra» adoita referirse ás especies máis gráciles, de pel húmida e lisa, boas saltadoras, e de hábitos acuáticos. «Sapo» fai referencia ás especies de pel máis seca e rugosa, máis robustas, menos áxiles e que acostuman habitar no chan húmido escavando galerías. Polo tanto, esta distinción entre ras e sapos non é unha discriminación que teña validez taxonómica.[4]
A súa alimentación baséase en invertebrados, tanto acuáticos como terrestres.
Teñen unha fecundación externa que se efectúa na auga. O amplexus (forma de aparearse dos anuros) pode ser axilar ou inguinal. Os ovos son postos na auga, en cordóns, como fan os sapos, ou en paquetes como fan as ras e presentan dimensións e formas diferentes segundo a familia ou especie.
As primeiras ras verdadeiras coñecidas datan do Xurásico Inferior, Vieraella, e do Xurásico Medio,
.[5]
Pódense distinguir pola ausencia de cola e por presentaren un corpo curto e moi ensanchado. Os dous pares de patas son moi diferentes entre si, adquirindo un maior desenvolvemento e robustez o par posterior, que, ademais, se encontra adaptado ao salto. As patas anteriores rematan en catro dedos, mentres que as posteriores fano en cinco.
Existen máis de 5 200 especies de anuros, repartidos en 33 familias. Os anuros son o grupo máis numeroso de anfibios. A maioría pasa a súa vida dentro ou cerca da auga. O seu tamaño é variable. Entre os máis pequenos atopamos á ra coqui, mentres que a maior ra é a Conraua goliath.
O nome común "ra" pódese referir a calquera membro da orde Anura (anfibios sen cola) exceptuando as especies que teñen pel rugosa no dorso, e que son menos acuáticas cand adultas, coñecidas como "sapos".
Así a todo, a diferenza entre as denominacións ra e sapo non ten fundamento taxonómico. Os diferentes usos da palabra ra e sapo débense á discrepancia entre a clasificación vernácula e a clasificación científica do grupo Anura. Ademais, a maioría das especies de anuros viven en países tropicais, onde a diversidade de familias é moito máis grande que en zonas temperadas. Ao se orixinar nun país temperado, o idioma galego non dispón de termos adecuados para denominar a maioría das formas de anuros.
A boca é moi ancha, con dentes diminutos ou sen eles, dependendo das especies, e cunha lingua protráctil. Os ollos están provistos de pálpebras, e os oídos non levan pavillóns externos, diferenciándose unicamente unha membrana timpánica superficial.
Os cágados ou cabezolos (fase larvaria) levan unha vida acuática, con respiración branquial, mentres que os adultos son terrestres, de respiración pulmonar (e cutánea); a reprodución, incluso nos sapos, faise sempre na auga.
Exemplos representativos de anfibios anuros son a ra común, a ra de Santo Antón (pequena, de cor verde brillante e que vive oculta entre as pólas das árbores), o sapo común, o sapo parteiro (o macho transporta os ovos da posta ata que nacen os cágados) e a pipa americana (que incuba os ovos en ocos da pel do dorso).
Listaxe das familias de Anura, seguindo as subordes:
Algunhas especies de anuros pertencentes a diferentes familias:
Os anuros (Anura do grego antigo ἀ(ν-) a(n-) (negación) e οὐρά ourá 'cola') son unha orde de anfibios, coñecidos vulgarmente como ras e sapos. Caracterízanse por carecer de cola, por presentar un corpo curto e moi ensanchado, e unhas patas posteriores moi desenvolvidas e adaptadas para o salto. Os anuros son o grupo máis numeroso de anfibios; estímase que existen más de 5.000 especies, repartidas en 48 familias. A maioría pasa a súa vida dentro ou preto da auga. O seu tamaño pode variar dende uns escasos 8,5 milímetros, como é o caso das especies do xénero Eleutherodactylus, ata tallas que superan os 30 centímetros, destacando a Conraua goliath, o anuro máis grande do mundo.
Salientia é un clado de anfibios que inclúe ás ras e os sapos modernos (anuros) e a todas as formas fósiles relacionadas, sendo Triadobatrachus, do triásico inferior de Madagascar, o representate máis antigo do grupo.[1]
Salientia é o grupo irmán de píntegas e tritóns (urodelos ou caudados) cos que forma o clado Batrachia] (batracios).[2]
Cladograma baseado en Marjanović & Laurin (2007).[2]
SalientiaCzatkobatrachus †
Notobatrachus †
Yizhoubatrachus †
Vieraella †
Mesophryne †
Salientia é un clado de anfibios que inclúe ás ras e os sapos modernos (anuros) e a todas as formas fósiles relacionadas, sendo Triadobatrachus, do triásico inferior de Madagascar, o representate máis antigo do grupo.
Salientia é o grupo irmán de píntegas e tritóns (urodelos ou caudados) cos que forma o clado Batrachia] (batracios).
Žabe ili bezrepci pripadaju vodozemcima, a razlikuju se od drugih vodozemaca po tome što nemaju rep. Tijelo im je zdepasto, pokriveno glatkom, golom i mekanom kožom. Žabe su rasprostranjene na svim kontinentima osim Antartike. Najmanja je vrsta Paedophryne amaneuensis, veličine samo 7,7 mm, a najveća je zapadnoafrička žaba, ponekad veća od 30 cm i teška oko 3 kg.
Mužjaci nekih vrsta imaju sa strane usta zvučne mjehure (rezonatore) za pojačavanje glasa.
Kralježnica žaba sastoji se od 9 kralježaka i koštanoga prutića trtične kosti (urostila). Rebara nemaju. Stražnje su im noge prilagođene za skakanje i plivanje, te su mnogo dulje i snažnije od prednjih. Četiri prsta na prednjim nogama su slobodna, a pet prstiju stražnjih nogu spojeno je plivaćom kožicom. Otrovne žabe su živih boja. Otrov može usmrtiti manjeg grabežljivca ako je pojede, a neke žabe sadržavaju toliko otrova da čak mogu usmrtiti čovjeka. Indijanci su se služili njihovim otrovom za koplja i strelice.
Najveći broj žaba polaže tisuće jaja u vodi, gdje se uglavnom jaja i oplođuju jer žabe nemaju organe za parenje. U vodi žive i završavaju metamorfozu ličinke zvane punoglavci. Preobrazba iz punoglavca u odraslu žabu traje 2 do 4 mjeseca. Hrane se mušicama, komarcima, i drugim kukcima, njihovim ličinkama i crvolikim beskralježnjacima. Žive u vodi ili u samoj njezinoj blizini, a neke vrste po vlažnim livadama i listopadnim šumama. Hladno i suho doba godine provode zakopane u mulju. [1]
Žlijezde u koži žabe nalaze se u epidermalonom sloju koji se naziva usmina. Usmina je ispunjena vezivnim tkivom, a u njoj se nalaze kromatofori, mišićna vlakna i žlijezde. Dvije vrste žlijezda se nalaze kod "prave žabe" (Rana species), a to su sluzne (mukozne) i zrnate žlijezde.
Pigmentne stanice kod žabe nazivaju se kromatofori. Oni sadrže razna pigmentna zrnca, različitih boja: žute, crvene, smeđe. Zbog tih raznih boja kromatofori se zajednički nazivaju alanofori.
Nemaju unutarnje ni vanjske škrge. One se nalaze isključivo u postembrionalnom razvoju, u stadiju punoglavca, na vanjskoj strani životinje, kao privjesci, a služe kao opskrba krvlju s kisikom. Krv pritom iz srca ulazi u škrge, koje se sastoje od mnogo krvnih žilica, tu se vrši izmjena plinova te se kisik veže na respiratorne pigmente (hemocijanin) u krvi i tako prenosi tijelom.
Najpoznatije su vrste: žuti mukač (Bomina variegata), crveni mukač (Bomina bombina), češnjača (Pelobates fuscus), obična krastača (Bufo bufo), zelena krastača (Bufo viridis), gatalinka (Hyla arborea)[2], grčka žaba (Rana graeca), močvarna smeđa žaba (Rana arvalis).
Animalia → Chordata → Amphibia → Lissamphibia → Salientia
Žabe ili bezrepci pripadaju vodozemcima, a razlikuju se od drugih vodozemaca po tome što nemaju rep. Tijelo im je zdepasto, pokriveno glatkom, golom i mekanom kožom. Žabe su rasprostranjene na svim kontinentima osim Antartike. Najmanja je vrsta Paedophryne amaneuensis, veličine samo 7,7 mm, a najveća je zapadnoafrička žaba, ponekad veća od 30 cm i teška oko 3 kg.
Katak (bahasa Inggris: frog) adalah binatang amfibi pemakan serangga yang hidup di air tawar atau di daratan, berkulit licin, berwarna hijau atau merah kecokelat-cokelatan, kaki belakang lebih panjang, pandai melompat dan berenang;[1] sedangkan kodok, nama lain dari bangkong (bahasa Inggris: toad), memiliki kulit yang kasar dan berbintil-bintil atau berbingkul-bingkul, kerap kali kering, dan kaki belakangnya sering pendek saja, sehingga kebanyakan bangsa kodok kurang pandai melompat jauh.[butuh rujukan]
Kodok dan katak mengawali hidupnya sebagai telur yang diletakkan induknya di air, di sarang busa, atau di tempat-tempat basah lainnya. Beberapa jenis kodok pegunungan menyimpan telurnya di antara lumut-lumut yang basah di pepohonan. Sementara jenis kodok hutan yang lain menitipkan telurnya di punggung kodok jantan yang lembap, yang akan selalu menjaga dan membawanya hingga menetas bahkan hingga menjadi kodok kecil.Sekali bertelur katak bisa menghasilkan 5000-20000 telur, tergantung dari kualitas induk dan berlangsung sebanyak tiga kali dalam setahun.
Telur-telur kodok dan katak menetas menjadi berudu atau kecebong (b. Inggris: tadpole), yang bertubuh mirip ikan gendut, bernapas dengan insang dan selama beberapa lama hidup di air. Perlahan-lahan akan tumbuh kaki belakang, yang kemudian diikuti dengan tumbuhnya kaki depan, menghilangnya ekor dan bergantinya insang dengan paru-paru. Setelah masanya, berudu ini akan melompat ke darat sebagai kodok atau katak kecil.
Kodok dan katak kawin pada waktu-waktu tertentu, misalnya pada saat bulan mati atau pada ketika menjelang hujan. Pada saat itu kodok-kodok jantan akan berbunyi-bunyi untuk memanggil betinanya, dari tepian atau tengah perairan. Beberapa jenisnya, seperti kodok tegalan (Fejervarya limnocharis) dan kintel lekat alias belentung (Kaloula baleata), kerap membentuk ‘grup nyanyi’, di mana beberapa hewan jantan berkumpul berdekatan dan berbunyi bersahut-sahutan. Suara keras kodok dihasilkan oleh kantung suara yang terletak di sekitar lehernya, yang akan menggembung besar manakala digunakan.
Pembuahan pada kodok dilakukan di luar tubuh. Kodok jantan akan melekat di punggung betinanya dan memeluk erat ketiak si betina dari belakang. Sambil berenang di air, kaki belakang kodok jantan akan memijat perut kodok betina dan merangsang pengeluaran telur. Pada saat yang bersamaan kodok jantan akan melepaskan spermanya ke air, sehingga bisa membuahi telur-telur yang dikeluarkan si betina.
Kodok tegalan dewasa
Seekor katak hijau di gunung Cyclops, Jayapura, Papua
Kodok dan katak hidup menyebar luas, terutama di daerah tropis yang berhawa panas. Makin dingin tempatnya, seperti di atas gunung atau di daerah bermusim empat (temperate), jumlah jenis kodok cenderung semakin sedikit. Salah satunya ialah karena kodok termasuk hewan berdarah dingin, yang membutuhkan panas dari lingkungannya untuk mempertahankan hidupnya dan menjaga metabolisme tubuhnya.
Hewan ini dapat ditemui mulai dari hutan rimba, padang pasir, tepi-tepi sungai dan rawa, perkebunan dan sawah, hingga ke lingkungan permukiman manusia. Bangkong kolong, misalnya, merupakan salah satu jenis katak yang kerap ditemui di pojok-pojok rumah atau di balik pot di halaman. Katak pohon menghuni pohon-pohon rendah dan semak belukar, terutama di sekitar saluran air atau kolam.
Kodok memangsa berbagai jenis serangga yang ditemuinya. Kodok kerap ditemui berkerumun di bawah cahaya lampu jalan atau taman, menangkapi serangga-serangga yang tertarik oleh cahaya lampu tersebut.
Sebaliknya, kodok juga dimangsa oleh berbagai jenis makhluk yang lain: ular, kadal, burung-burung, seperti bangau,elang, garangan, linsang, dan juga dikonsumsi manusia.
Kodok membela diri dengan melompat jauh, mengeluarkan lendir dan racun dari kelenjar di kulitnya; dan bahkan ada yang menghasilkan semacam lendir pekat yang lengket, sehingga mulut pemangsanya akan melekat erat dan susah dibuka.
Pada saat bereproduksi katak dewasa akan mencari lingkungan yang berair. Disana mereka meletakkan telurnya untuk dibuahi secara eksternal. Telur tersebut berkembang menjadi larva dan mencari nutrisi yang dibutuhkan dari lingkungannya, kemudian berkembang menjadi dewasa dengan bentuk tubuh yang memungkinkannya hidup di darat, sebuah proses yang dikenal dengan metamorfosis. Tidak seperti telur reptil dan burung, telur katak tidak memiliki cangkang dan selaput embrio. Sebaliknya telur katak hanya dilindungi oleh kapsul mukoid yang sangat permeabel sehingga telur katak harus berkembang di lingkungan yang sangat lembap atau berair.
Sudah sejak lama kodok dikenal manusia sebagai salah satu makanan lezat. Di rumah-rumah makan Tionghoa, masakan kodok terkenal dengan nama swie kee. Disebut 'ayam air' (swie: air, kee: ayam) demikian karena paha kodok yang gurih dan berdaging putih mengingatkan pada paha ayam. Selain itu, di beberapa tempat di Jawa Timur, telur-telur kodok tertentu juga dimasak dan dihidangkan dalam rupa pepes telur kodok.
Katak berperan sangat penting sebagai indikator pencemaran lingkungan. Tingkat pencemaran lingkungan pada suatu daerah dapat dilihat dari jumlah populasi katak yang dapat ditemukan di daerah tersebut. Latar belakang penggunaan katak sebagai indikator lingkungan karena katak merupakan salah satu mahluk purba yang telah ada sejah ribuan tahun lalu. Jadi katak tetap hidup dengan perubahan iklim bumi. Tentunya hanya pengaruh manusialah yang mungkin menyebabkan terancamnya populasi katak. Salah satunya adalah pembuangan limbah berbahaya oleh manusia ke alam. Limbah berbahaya inilah yang bisa mengancam keberadaan katak pada daerah yang tercemar. Selain itu, karena pentingnya kedudukan katak dalam rantai makanan, maka pengurangan jumlah katak akan menyebabkan terganggunya dinamika pertumbuhan predator katak. Bahkan terganggunya populasi katak dapat berakibat langsung dengan punahnya predator katak.
Akan tetapi yang lebih mengancam kehidupan kodok sebenarnya adalah kegiatan manusia yang banyak merusak habitat alami kodok, seperti hutan-hutan, sungai dan rawa-rawa. Apalagi kini penggunaan pestisida yang meluas di sawah-sawah juga merusak telur-telur dan berudu katak, serta mengakibatkan cacat pada generasi kodok yang berikutnya.
Beberapa jenis kodok yang umum didapatkan di Indonesia, di antaranya adalah
Kodok hutan:
Berikut adalah beberapa jenis kodok yang berstatus kritis dan terancam di Indonesia.
Katak (bahasa Inggris: frog) adalah binatang amfibi pemakan serangga yang hidup di air tawar atau di daratan, berkulit licin, berwarna hijau atau merah kecokelat-cokelatan, kaki belakang lebih panjang, pandai melompat dan berenang; sedangkan kodok, nama lain dari bangkong (bahasa Inggris: toad), memiliki kulit yang kasar dan berbintil-bintil atau berbingkul-bingkul, kerap kali kering, dan kaki belakangnya sering pendek saja, sehingga kebanyakan bangsa kodok kurang pandai melompat jauh.[butuh rujukan]
Froskar (fræðiheiti: Anura) eru ættbálkur seildýra í froskdýraflokknum sem inniheldur froska og körtur, þó hægt sé að greina milli froska og karta hefur sú aðgreining enga vísindalega stöðu.
Froskungi nefnist halakarta og er fótalaus með hala og ytri tálkn í fyrstu.
Til eru um 5.070 ættir froska sem venja er að skipta í þrjá undirættbálka:
Froskar (fræðiheiti: Anura) eru ættbálkur seildýra í froskdýraflokknum sem inniheldur froska og körtur, þó hægt sé að greina milli froska og karta hefur sú aðgreining enga vísindalega stöðu.
Froskungi nefnist halakarta og er fótalaus með hala og ytri tálkn í fyrstu.
Gli anuri (Anura Waldheim, 1813) sono un ordine di anfibi cui appartengono oltre 7.300 specie, comunemente definite rane, rospi e raganelle[3].
Talvolta questo taxon è anche indicato come Salienti (Salientia [Laurenti, 1768]), dal participio presente del verbo latino salire, che significa saltare.
La lunghezza media degli Anuri si attesta dai 35 ai 75 millimetri, ma ne esistono di molto più piccoli come di molto più grandi. Tra gli esemplari di misura più ridotta troviamo la Psyllophryne didactyla e la Eleutherodactylus iberia, rispettivamente della misura di circa 10mm e 10mm e mezzo. Mentre tra le specie più grandi di questo ordine troviamo senza dubbio il Conraua goliath, una enorme rana lunga 32 cm[4] che può arrivare, con le gambe distese, fino a 70 – 80 cm.
Sono anfibi che hanno zampe posteriori molto lunghe e adattate al salto grazie alla presenza di un segmento osseo in più; si tratta infatti di un prolungamento delle due ossa (l'astragalo ed il calcagno) costituenti la "caviglia" di questi animali[4]. Hanno un corpo tozzo e compatto, una testa larga e ampia e di solito arti anteriori più piccoli rispetto a quelli posteriori. La maggior parte delle specie possiede occhi grandi e sporgenti e un grande timpano su ciascun lato della testa. La bocca è ampia e molte specie hanno una lingua appiccicosa che viene protesa velocemente per catturare le prede. La colonna vertebrale risulta corta e composta di solito da otto vertebre presacrali; queste ultime sono fissate saldamente tra di loro per concedere solo delle leggere flessioni in senso laterale e dorsoventrale, mentre quelle post - sacrali sono fuse a formare l'urostilo (il coccige)[4].
La femmina è di solito più grande del maschio, ma il maschio a volte presenta arti posteriori più grossi e robusti. Spesso emettono segnali vocali importanti comprimendo i polmoni. Sono privi di coda, da cui il nome scientifico di Anura.
Molte specie di rane tropicali sono tossiche o velenose. Queste specie spesso esibiscono sulla pelle dei colori molto evidenti e dal forte contrasto (rosso, giallo, blu, accompagnato da varie macchiettature nere) allo scopo di avvertire i potenziali predatori della pericolosità della loro preda (fenomeno dell'aposematismo).
Tutti i rospi e le rane sono carnivori e si nutrono di prede vive (insetti e altri invertebrati acquatici e terricoli). Si cibano di prede vive, perché la loro vista è sensibile al movimento; una preda immobile non è appetibile. Incapaci di masticare o frantumare il cibo in bocca, ingoiano le prede intere. Si nutrono talvolta anche di girini.
Depongono le uova in acqua e hanno un accoppiamento con fecondazione esterna. Dall'uovo esce il girino (in genere sono tra i 100 e 200, ma pochi ne sopravvivono), che compie il proprio ciclo vitale in tempi variabili tra 1,5 e 3 mesi. Alla fine della metamorfosi il girino sviluppa le zampe atte a saltare, polmoni per respirare fuori dall'acqua, perde la coda e cambia regime alimentare, passando da detritivoro a carnivoro. Dopodiché la rana adulta continua la sua vita nel ciclo vitale. I maschi della rana per attirare le femmine gracidano, emettono cioè un verso gonfiando dei sacchetti d'aria nelle guance. In genere le femmine cercano il maschio che produce il gracidio più potente per accoppiarsi e deporre le uova.
Le rane utilizzano una strategia comunicativa simile a quella delle emittenti radio, dato che ognuna trasmette suoni in una banda di frequenze diversa, per evitare sovrapposizioni e per riconoscersi più facilmente. Inoltre vi è una differenziazione a seconda delle dimensioni, infatti le rane più grandi emettono grida dai suoni bassi, profondi e più diradati, mentre quelle piccole effettuano richiami più acuti e più ravvicinati.[5]
Altre specie di rane, non adatte alla competizione dal punto di vista sonoro, hanno elaborato strategie diverse atte alla comunicazione: ad esempio i maschi di "L. albilabris", quando gridano, immergono una parte di essi nel fango e quindi generano un'onda che fa vibrare il terreno, oppure le femmine della raganella malaysiana per richiamare i maschi tamburellano con le zampe posteriori su una canna.
In passato l'ordine degli Anura veniva suddiviso, in base a caratteristiche morfologiche, in 6 sottordini: Amphicoela, Aglossa, Opisthocoela, Amonocoela, Dispasiocoela e Procoela[6]. Più recentemente è stata proposta una suddivisione, basata su criteri morfologico-evolutivi, in tre sottordini, Archaeobatrachia, Mesobatrachia e Neobatrachia[7]. Tali raggruppamenti tuttavia non hanno retto al vaglio dell'analisi filogenetica, risultando polifiletici[8].
L'ordine Anura comprende 7394 specie, raggruppate in 56 famiglie:[3]
Gli anuri (Anura Waldheim, 1813) sono un ordine di anfibi cui appartengono oltre 7.300 specie, comunemente definite rane, rospi e raganelle.
Talvolta questo taxon è anche indicato come Salienti (Salientia [Laurenti, 1768]), dal participio presente del verbo latino salire, che significa saltare.
Anura (Graece an- 'sine' + oura 'cauda') sunt varius et plerumque carnivorus Amphibiorum corporis brevis sine cauda ordo taxinomicus, inter quem insigniter ranae et bufones, animalia familiarissima. Priscum "protoanurum" fossile Triassico novo in Madagascaria apparuit, sed horologium moleculare subicit origines ordinis fortasse retro ad Permianum, abhinc annorum 265 millionum, extendisse. Anuris est latissima distributio geographica, a tropicis ad regiones subarcticas, sed maxima diversitas specierum in silvis pluvialibus tropicis fit. Quia sunt circa 4800 specierum descriptarum, Anura inter diversissimos vertebratorum greges numerantur. Saliendi moris causa, ea Salientia olim appellata sunt.
Anura (Graece an- 'sine' + oura 'cauda') sunt varius et plerumque carnivorus Amphibiorum corporis brevis sine cauda ordo taxinomicus, inter quem insigniter ranae et bufones, animalia familiarissima. Priscum "protoanurum" fossile Triassico novo in Madagascaria apparuit, sed horologium moleculare subicit origines ordinis fortasse retro ad Permianum, abhinc annorum 265 millionum, extendisse. Anuris est latissima distributio geographica, a tropicis ad regiones subarcticas, sed maxima diversitas specierum in silvis pluvialibus tropicis fit. Quia sunt circa 4800 specierum descriptarum, Anura inter diversissimos vertebratorum greges numerantur. Saliendi moris causa, ea Salientia olim appellata sunt.
Beuodegiai varliagyviai, arba šokuojančiosios, amfibijos (Anura) – varliagyvių (Amphibia) klasės būrys. Varliagyviai neturi uodegos (išskyrus buožgalvius), užpakalinės kojos ilgesnės už priekines. Liemuo trumpas ir platus. Kaklas neryškus. Juda šokuodami.
Apvaisinimas išorinis. Kiaušinius išneršia į vandenį, kur juos patinas apvaisina. Tik ką iš kiaušinio išsiritusios lervos – buožgalviai yra su išorinėmis, vėliau su vidinėmis žiaunomis. Buožgalvio metamorfozė trunka 40-100 dienų.
Lietuvoje gyvena šios beuodegių varliagyvių šeimos:
Būryje 30 šeimų, apie 4800 rūšių
Beuodegiai varliagyviai, arba šokuojančiosios, amfibijos (Anura) – varliagyvių (Amphibia) klasės būrys. Varliagyviai neturi uodegos (išskyrus buožgalvius), užpakalinės kojos ilgesnės už priekines. Liemuo trumpas ir platus. Kaklas neryškus. Juda šokuodami.
Apvaisinimas išorinis. Kiaušinius išneršia į vandenį, kur juos patinas apvaisina. Tik ką iš kiaušinio išsiritusios lervos – buožgalviai yra su išorinėmis, vėliau su vidinėmis žiaunomis. Buožgalvio metamorfozė trunka 40-100 dienų.
Lietuvoje gyvena šios beuodegių varliagyvių šeimos:
Medvarlinės (Hylidae) Rupūžės (Bufonidae) Diskaliežuvės (Discoglossidae) Kūmutės (Bombinatoridae) Česnakės (Pelobatidae) Varlės (Ranidae)Bezastainie abinieki (Anura) ir lielākā un plašākā abinieku klases (Amphibia) kārta, kas apvieno apmēram 88% no visiem abiniekiem, vairāk kā 5000 mūsdienās dzīvojošas varžu un krupju sugas.[1] Tā ir viena no piecām lielākajām mugurkaulnieku kārtām, kas tiek iedalīta 3 apakškārtās. Vardēm un krupjiem ir ļoti plaša izplatība, sākot ar tropiem un beidzot ar subarktiskajiem reģioniem, tomēr lielākā sugu dažādība sastopama tropu lietus mežos. Senākās aizvēsturiskās vardes fosilijas ir atrastas Madagaskarā. Tās ir saglabājušās no triasa perioda sākuma un ir apmēram 250 miljonus gadu vecas. Toties molekulārie pētījumi liecina, ka vardes ir izveidojušās perma periodā pirms 265 miljoniem gadu.
Savulaik šīs kārtas zinātniskais nosaukums bija Salientia (no latīņu valodas saltare nozīmē "lēkt"). Mūsdienu zinātniskais nosaukums Anura ir divu grieķu vārdu saliktenis (an — "bez", oura — "aste"). Vardes dzīvo gan uz sauszemes, gan ūdenī, bet ne tikai. Dažas sugas piemērojušās dzīvei pazemē vai kokos. Ādu sedz dziedzeri, kas izdala vai nu nekaitīgu, vai indīgu sekrētu. Kārpainas un grumbuļainas ādas vardes mēdz saukt par krupjiem, un šim iedalījumam nav taksonomiska nozīme. Plašākās un lielākās apakškārtas dzimtas ir Amerikas dienvidvaržu dzimta (Leptodactylidae), kurā ir apmēram 1100 sugas, kokvaržu dzimta (Hylidae), kurā ir apmēram 950 sugas, un krupju dzimta (Bufonidae) ar 580 sugām.[1][2]
Latvijā sastopamas 5 bezastaino abinieku dzimtas: ugunskrupju dzimta (Bombinatoridae), varžkrupju dzimta (Pelobatidae), krupju dzimta (Bufonidae), kokvaržu dzimta (Hylidae) un varžu dzimta (Ranidae). Kopumā tās ir 11 sugas: sarkanvēdera ugunskrupis (Bombina bombina), brūnais varžkrupis (Pelobates fuscus), parastais krupis (Bufo bufo), smilšu krupis (Epidalea calamita),[3] zaļais krupis (Bufotes viridis),[4] parastā kokvarde (Hyla arborea), parastā varde (Rana temporaria), purva varde (Rana arvalis), ezera varde (Pelophylax ridibundus), dīķa varde (Pelophylax lessonae) un zaļā varde (Pelophylax kl. esculentus).[5]
Latvijā visbiežāk sastopamās sugas ir parastā varde un parastais krupis. Toties parastā kokvarde jau tika uzskatīta par zudušu Latvijas faunai. Tomēr 20. gadsimtā 90. gados tika uzsākta sekmīga kokvaržu aklimatizācija, tās mākslīgi inkubējot un pēc paaudzēšanas izlaižot piemērotos biotopos.[5]
Tipiskai pieaugušai vardei ir raksturīgs plats ķermenis ar resnu vēderu, izvalbītas, lielas acis, sekli šķelta mēle, garas kājas, īpaši pakaļkājas, kas salocītas zem ķermeņa, kā arī tām nav aste. Pirkstiem nav nagu, turklāt pakaļkājas pirkstus savieno peldplēve. Vardēm āda var būt gluda vai kārpaina. Tās krāsa var būt ļoti dažāda, sākot ar dažādiem maskējošiem un brūnganiem toņiem un beidzot ar košām, spilgtām krāsām, piemēram, koši dzeltenu, zilu, sarkanu vai melnu. Košās vardes parasti ir indīgas, tādējādi to ārējais izskats brīdina par to indīgumu. Vardei ir trīs plakstiņi, no kuriem viens ir pilnīgi caurspīdīgs, jo tas aizsargā acis, kamēr dzīvnieks atrodas zem ūdens.
Kā visi abinieki arī bezastainie abinieki elpo ne tikai ar plaušām, bet arī caur ādu. Pateicoties šai īpašībai, tie spēj izdzīvot vietās bez svaiga gaisa apmaiņas.[6] Ribas attīstītas ļoti vāji, tādēļ vardes un krupji elpo, pumpējot gaisu ar vaigiem.[6] Lai āda pildītu elpošanas funkciju, tai ir jābūt mitrai.
Bezastainie abinieki var būt ļoti dažādos augumos. Vismazākā ir Papua-Jaungvinejā dzīvojošā Amau vardīte (Paedophryne amauensis), kas ir ne tikai mazākā varde bezastaino abinieku kārtā, bet tā ir arī vismazākais mugurkaulnieks pasaulē.[7] Mazās vardītes garums ir tikai 7,7 mm.[8] Lielākā šajā grupā ir Kamerūnā dzīvojošā goliātvarde (Conraua goliath), kura var izaugt 32 cm liela un svērt 3,3 kg.[9]
Dažādām varžu un krupju sugām ir atšķirīga pārvietošanās motorika. Tā var būt lēkšana, skriešana, iešana, peldēšana, rakšanās, rāpšanās un planēšana.
Vardes pirmkārt asocējas ar lēkšanu. Tās ir labākās lēcējas no visiem mugurkaulniekiem, salīdzinot ar to lielumu.[10] Piemēram, kokvardes spēj aizlēkt attālumā, kas salīdzināms ar 150 pašas vardes augumiem,[10] vai svītrainā litorija (Litoria nasuta), kuras ķermenis ir 5,5 cm, lec 2 metru tālumā (pārsniedzot vairāk kā 50 ķermeņu attālumu).[11] Tomēr ne visas sugas ir izcilas lēcējas. Kopumā, jo lielāka varde, jo lēciens centimetros ir tālāks, bet, jo mazāka ir varde, jo lielāks ir relatīvais lēciens (salīdzinot ar pašas vardes augumu). Dažas sugas spēj lēkt arī peldēšanas brīdī, piemēram, Indijas lēcējvarde (Euphlyctis cyanophlyctis).[12] Toties mazā Ziemeļamerikas circeņvarde (Acris crepitans) spēj veikt īsu, ātru lēcienu sēriju pa ūdens virsmu.[13]
Krupju dzimtas, Meksikas smilšu krupju dzimtas un šaurmutvaržu dzimtas sugām ir salīdzinoši īsas kājas, tādēļ tās pārvietojas ejot, nevis lecot.[14] Ja tām nepieciešama ātrāka pārvietošanās, tad tās paātrina iešanas ātrumu, kas atgādina neveiklu lēkšanu. Piemēram, rietumkrasta šaurmutes krupis (Gastrophryne olivacea) ātri pārvietojas, kombinējot skriešanu ar īsiem lēcieniem, kas ir 2–4 cm gari.[15]
Lielākā daļa varžu sugu ļoti labi peld. To pakaļkājas ir spēcīgas, labi attīstītiem muskuļiem, kas nodrošina ne tikai spēju lēkt, bet arī labi peldēt. Pakaļkāju pirkstus savieno peldplēve, kas palielina pēdas atsperšanās virsmu pret ūdeni. Dažas sugas mājo ūdenī, piemēram, bezmēles varžu dzimtas (Pipidae) vardes, kurām mugurkauls ir nekustīgs, ķermenis saplacināts, maksimāli piemērots peldēšanai un pakaļkājas ļoti spēcīgas ar platām, lielām pēdām.[16]
Dažas sugas piemērojušās dzīvei zem zemes un spēj ierakties mīkstā un irdenā augsnē. Šīm sugām ir noapaļoti ķermeņi, īsas kājas, mazas galvas ar lielām acīm un to pakaļkājas piemērotas, lai ieraktos zemē. Piemēram, Indijas cūkšņukura varde (Nasikabatrachus sahyadrensis) barojas ar termītiem un lielāko daļu sava mūža pavada zem zemes. Virszemē tā iznāk tikai lietus sezonas laikā, lai pārotos un vairotos. Šai vardei ir sīka galva ar purnu, kas atgādina cūkas šņukuru, un apaļš, ļumīgs ķermenis. Sugas slēptā dzīves veida dēļ rietumu zinātnieki to atklāja tikai 2003. gadā.[17]
Kokuvardes spēj rāpties kokos, un lietus mežu džungļos tās var atrast lapotnes pašā augšā. Reizēm tās nekad nenonāk lejā uz zemes. Dzīvei kokos piemērojušās vairāku dzimtu sugas, no kurām vispazīstamākās ir kokvardes (Hylidae). Koku zaros dzīvo arī stiklavardes (Centrolenidae), Madagaskaras kokvardes (Hyperoliidae), dažas šaurmutvaržu (Microhylidae) sugas un krūmvardes (Rhacophoridae).[14] Lielākā daļa kokos rāpojošo varžu ir mazākas par 10 cm. Tām ir garas kājas un gari pirksti, kuriem apakšā ir lipīgi spilventiņi. Spilventiņi ir rievoti, rievās no dziedzeriem izdalās īpašs sekrēts, kas nodrošina vardes spēju pielipt pie jebkuras virsmas, stiklu ieskaitot. Koku vardes ir ļoti veiklas un akrobātiskas. Tās spēj ķert kukaiņus, karājoties tikai vienā no pirkstiem.[18]
Dažas varžu sugas, kas dzīvo tropiskajos lietus mežos, apguvušas gaisa telpu, spējot planēt no koka uz koku vai nolēkt lejup līdz zemei kā ar izpletni,[19] piemēram, Malaizijā dzīvojošā melnpēdu lidojošā varde (Rhacophorus nigropalmatus). Tai ir lielas pēdas, un tā spēj plati izplest pirkstus, starp kuriem ir pilnībā attīstījušās peldplēves. Arī starp pakaļkājām (astes zonā) ir plata ādas kroka. Izplešot kājas un pirkstus, un ādas kroku, šī varde spēj planēt ievērojamā attālumā, līdz 15 metriem no koka līdz kokam.[20]
Kā visiem abiniekiem, arī bezastainajiem abiniekiem dzīves cikls iesākas ūdenī, mātītei ūdenī nēršot ikrus. No ikriem izšķiļas kāpuri, kurus bezastainajiem abiniekiem sauc par kurkuļiem. Kurkuļi dzīvo ūdenī, līdz attīstās par uz sauszemes dzīvojošiem abiniekiem. Attīstība turpinās arī uz sauszemes, mazajām vardītēm izaugot par pieaugušiem īpatņiem.
Vardēm izšķir divus vairošanās veidus: ikgadējā vairošanās un eksplozijas veida vairošanās. Lielākajai daļai sugu, uzsākoties vairošanās sezonai (kas atkarībā no sugas un izplatības reģiona var būt dažādos laikos), pieaugušie, dzimumbriedumu sasniegušie īpatņi dodas uz ūdenstilpi, lai vairotos. Tās pamatā atgriežas savā dzimtajā ūdenstilpē, kurā īpatņi paši ir dzīvojuši kā kurkuļi. Ļoti bieži šādas ikgadējās migrācijas kļūst par iespaidīgiem ceļojumiem, vienlaicīgi uz ūdenstilpi dodoties vairākiem tūkstošiem varžu. Pirmie vairošanās ūdenstilpēs ierodas tēviņi, kuri tur kādu laiku uzturas. Mātītes ierodas vēlāk, sapārojas, iznērš ikrus un drīz vien pamet ūdenstilpi. Tēviņi ierodas ātrāk, lai katrs ieņemtu zināmu teritoriju ūdenstilpes krastā. Teritoriju cītīgi apsargā citi tēviņi. Mātīti tie vilina ar skaļu kurkstēšanu. Lielākiem un spēcīgākiem tēviņiem sauciens ir skaļāks un dziļāks, to ieņemtās teritorijas ir vispiemērotākās ikru nēršanai. Mātīte partneri izvēlas pēc kurkstēšanas.[21] Dažām sugām ir tā saucamie satelīttēviņi, kuriem nav teritorijas un kuri nekurkst, bet cenšas pārtvert tuvojošos mātīti. Spēcīgāki tēviņi var arī pārņemt noskatītu teritoriju, pat, ja tā jau ir aizņemta, vājāko tēviņu padzenot.[22]
Eksplozijas rakstura vairošanās raksturīga sugām, kas mājo reģionos, kuros ilgstošu sausuma periodu pēkšņi nomaina lietus periods. Līdzko sākas lieti, sākas vairošanās sezona, vardēm dodoties uz tuvāko ūdenstilpi, arī kurkuļi attīstās ļoti ātri, jo tiem jāpaspēj attīstīties par sauszemes īpatņiem, pirms ūdenstilpes ir izžuvušas.[22] Pirmais tēviņš, kurš atrod kādu ūdenstilpi, sāk skaļi kurkstēt, un uz tā saucieniem sanāk gan mātītes, gan citi tēviņi. Eksplozīvās vairošanās gadījumos tēviņi mēdz dziedāt unisonā, veidojot kopējo skaņu īpaši skaļu. Šīm sugām daudz svarīga par partnera izvēli ir sapārošanās ātrums. Reizēm sausums ir vairākus gadus un vardes līdz ar to nevairojas.[22] Ir sugas, kurām mātītes nērš tikai pusi no ikriem, otru pusi pietaupot iespējai, ka varbūt var sekot vēl viens, daudz labāks lietus periods.[23]
Vardes ikri ir caurspīdīga, vairāku kārtu želejveida oliņa, kuras centrā atrodas embrijs. Ikri tiek nērsti nelielās porcijās, ikru pikās. Želejveida masa aizsargā embriju, bet vienlaicīgi laiž cauri skābekli, ogļskābo gāzi un amonjaku. Ikri uzsūc mitrumu un ūdenī uzbriest. Daudzām sugām ikri ir tumšā krāsā, tādējādi tie absorbē saules siltumu un embriji ātrāk attīstās. Ikru temperatūra var būt līdz 6 °C augstāka kā apkārtējam ūdenim.[24]
No ikra izšķiļas varžu kāpurs — kurkulis. Tam ir ovāls ķermenis ar garu, laterāli saspiestu asti, kas ir kurkuļa vienīgais pārvietošanās orgāns, jo kāju tam nav. Tie elpo ar žaunām (iesākumā tiem ir ārējās žaunas, vēlāk attīstās iekšējās žaunas), ūdens kustību uztver ar sānu līniju, acīm nav plakstiņu.[14] Kurkulim augot, izzūd aste, žaunas, sānu līnijas orgāni, attīstās plaušu elpošana un ekstremitātes. Gan priekškājas, gan pakaļkājas sāk attīstīties apmēram vienlaicīgi, taču uz āru priekškājas parādās vēlāk, jo ilgāku laiku tās ir paslēptas zem dzīvnieka ādas. Drīz vien pēc priekškāju parādīšanās aizvelkas žaunu spraugas un izveidojas plaušas.[25] Ar laiku uzsūcas aste un kurkuļa metamorfoze noslēdzas, tam kļūstot par mazu vardīti, kas dzīvo uz sauszemes.
Dažas sugas metamorfozi iziet, kamēr embrijs atrodas ikrā. No ikriem uzreiz izšķiļas mazas vardītes. Toties bezmēles varžu dzimtas kurkuļiem, izņemot Āfrikas pundurvardes (Hymenochirus), ir pāris taustekļu. Tādējādi tie atgādina mazus samiņus.[16] Dažas kurkuļu sugas ir indīgas. Kurkuļi parasti barojas ar dažādām augu daļām un aļģēm. Dažas sugas ir plēsīgas un barojas ar sīkiem kukaiņiem, mazākiem kurkuļiem un nelielām zivtiņām. Kurkuļus medī un ar tiem barojas zivis, tritoni, plēsīgas vaboles un putni. Eksplozijas rakstura attīstībai raksturīgs, ka kurkulis attīstās ļoti ātri, dažu nedēļu laikā, bet ikgadējās vairošanās sugām kurkuļi aug lēnāk un var paiet viena vai divas ziemas, līdz mazās vardītes pavasarī iznāk uz sauszemes.[26]
Lai arī ne visas sugas rūpējas par saviem pēcnācējiem, tomēr to vairāk vai mazāk dara apmēram 20% no visām bezastaino abinieku sugām.[27] Šī īpašība ir cieši saistīta ar ūdenstilpes lielumu, kurā vardes vairojas. Jo sugām šaurāki apstākļi, kuros tās vairojas, jo komplicētāka kļūst jaunās paaudzes aprūpe.[28]
Dažas sugas, lai aizsargātu pēcnācējus, sākušas nērst ikrus uz sauszemes, jo ūdenstilpē lielākā daļa kļūst par citu dzīvnieku barību. Abi vecāki rūpējas, lai uzturētu ikrus mitrus.[29] Sekojošā kurkuļu nogādāšana uz ūdenstilpi kļūst par vēl komplicētāku darbību.[28] Nelielās ūdenstilpēs parasti nav citu dzīvnieku, kas barojas ar ikriem un kurkuļiem, tādēļ daļa varžu sugu izvēlas šādas, lai arī mazas, bet drošas vietas. Šādās nelielās ar ūdeni pildītās iedobēs vietas pietiek tikai dažiem kurkuļiem, lai attīstītos.[30] Turklāt šādās nelielās vietās trūkst barības vielu, lai kurkuļi spētu izdzīvot bez vecāku palīdzības. Šo mazo ūdentilpju varžu mātītes kurkuļu barošanai katru dienu nērš iedobē dažus neapaugļotus, bet ar barības vielām piesātinātus ikrus.[28]
Dažas sugas aizsargā savus pēcnācējus savā ķermenī. Piemēram, somainajām vardēm (Amphignathodontidae) gan tēviņi, gan mātītes apsargā ikrus, kuri tiek nērsti uz zemes. Kad no tiem izšķiļas kurkuļi, tēviņa ķermenis sintezē īpašu želejveida masu, kas apņem visu tā ķermeni, pēc tam tēviņš ienirst ikru masā. Mazie kurkulīši sapeld tēviņa ādas somās, kur noslēpjas, līdz tie ir attīstījušies par mazām vardītēm.[31]
Bezastainie abinieki (Anura) ir lielākā un plašākā abinieku klases (Amphibia) kārta, kas apvieno apmēram 88% no visiem abiniekiem, vairāk kā 5000 mūsdienās dzīvojošas varžu un krupju sugas. Tā ir viena no piecām lielākajām mugurkaulnieku kārtām, kas tiek iedalīta 3 apakškārtās. Vardēm un krupjiem ir ļoti plaša izplatība, sākot ar tropiem un beidzot ar subarktiskajiem reģioniem, tomēr lielākā sugu dažādība sastopama tropu lietus mežos. Senākās aizvēsturiskās vardes fosilijas ir atrastas Madagaskarā. Tās ir saglabājušās no triasa perioda sākuma un ir apmēram 250 miljonus gadu vecas. Toties molekulārie pētījumi liecina, ka vardes ir izveidojušās perma periodā pirms 265 miljoniem gadu.
Savulaik šīs kārtas zinātniskais nosaukums bija Salientia (no latīņu valodas saltare nozīmē "lēkt"). Mūsdienu zinātniskais nosaukums Anura ir divu grieķu vārdu saliktenis (an — "bez", oura — "aste"). Vardes dzīvo gan uz sauszemes, gan ūdenī, bet ne tikai. Dažas sugas piemērojušās dzīvei pazemē vai kokos. Ādu sedz dziedzeri, kas izdala vai nu nekaitīgu, vai indīgu sekrētu. Kārpainas un grumbuļainas ādas vardes mēdz saukt par krupjiem, un šim iedalījumam nav taksonomiska nozīme. Plašākās un lielākās apakškārtas dzimtas ir Amerikas dienvidvaržu dzimta (Leptodactylidae), kurā ir apmēram 1100 sugas, kokvaržu dzimta (Hylidae), kurā ir apmēram 950 sugas, un krupju dzimta (Bufonidae) ar 580 sugām.
Jauno varžu apakškārta (Neobatrachia) ir bezastaino abinieku (Anura) apakškārta, kas apvieno 96% no visiem bezastainajiem abiniekiem, vairāk kā 5000 mūsdienās dzīvojošas varžu un krupju sugas.[1] Tās zinātniskais nosaukums Neobatrachia sastāv no diviem vārdiem un latviski nozīmē "jaunā varde" (neo — jaunais, batrachia — varde), tādējādi atspoguļojot šīs grupas pozīciju evolūcijas gaitā. Šīs apakškārtas vardes ir attīstītākas nekā abas pārējās bezastaino abinieku apakškārtas: primitīvo varžu apakškārtas (Archaeobatrachia) un vidējo varžu apakškārtas (Mesobatrachia) vardes.[2]
Galvenā atšķirība jauno varžu apakškārtas vardēm no pārējām vardēm ir to labi attīstītā anatomija, īpaši skeleta uzbūve, kā arī tām ir atšķirīgas uzvedības modelis un dzīves veids.[3]
Šīs apakškārtas dzimtas parasti tiek iedalītas 5 virsdzimtās, tomēr šis iedalījums ir strīdīgs un pretrunīgs, tā kā atšķirīgi autori apakškārtai piederošās dzimtas sistematizē atšķirīgās virsdzimtās. Turklāt jaunākajos ģenētiskajos pētījumos ir noskaidrots, ka vairākas dzimtas ir parafilētiskas.[2]
Latvijā sastopamas 3 jauno varžu apakškārtas dzimtas: krupju dzimta (Bufonidae), kokvaržu dzimta (Hylidae) un varžu dzimta (Ranidae). Kopumā tās ir 9 sugas: parastais krupis (Bufo bufo), smilšu krupis (Epidalea calamita), zaļais krupis (Bufotes viridis),[4][5] parastā kokvarde (Hyla arborea), parastā varde (Rana temporaria), purva varde (Rana arvalis), ezera varde (Pelophylax ridibundus), dīķa varde (Pelophylax lessonae) un zaļā varde (Pelophylax kl. esculentus).[6]
Latvijā visbiežāk sastopamās sugas ir parastā varde un parastais krupis. Toties parastā kokvarde jau tika uzskatīta par zudušu Latvijas faunai. Tomēr 20. gadsimta 90. gados tika uzsākta sekmīga kokvaržu aklimatizācija, tās mākslīgi inkubējot un pēc paaudzēšanas izlaižot piemērotos biotopos.[6]
Jauno varžu apakškārta (Neobatrachia) ir bezastaino abinieku (Anura) apakškārta, kas apvieno 96% no visiem bezastainajiem abiniekiem, vairāk kā 5000 mūsdienās dzīvojošas varžu un krupju sugas. Tās zinātniskais nosaukums Neobatrachia sastāv no diviem vārdiem un latviski nozīmē "jaunā varde" (neo — jaunais, batrachia — varde), tādējādi atspoguļojot šīs grupas pozīciju evolūcijas gaitā. Šīs apakškārtas vardes ir attīstītākas nekā abas pārējās bezastaino abinieku apakškārtas: primitīvo varžu apakškārtas (Archaeobatrachia) un vidējo varžu apakškārtas (Mesobatrachia) vardes.
Galvenā atšķirība jauno varžu apakškārtas vardēm no pārējām vardēm ir to labi attīstītā anatomija, īpaši skeleta uzbūve, kā arī tām ir atšķirīgas uzvedības modelis un dzīves veids.
Primitīvo varžu apakškārta (Archaeobatrachia) ir viena no bezastaino abinieku (Anura) apakškārtām, kas apvieno 28 mūsdienās dzīvojošas varžu un krupju sugas un kas tiek iedalītas 6 ģintīs un 4 dzimtās.[1] Lielākā sugu dažādība sastopama Eirāzijā, Filipīnās, Borneo un Jaunzēlandē.[1] Latvijā sastopama viena primitīvo varžu apakškārtas dzimta — ugunskrupju dzimta (Bombinatoridae), kuru pārstāv sarkanvēdera ugunskrupis (Bombina bombina).[2]
Kā jau apakškārtas nosaukums norāda, tās visas ir ļoti primitīvas sugas. Daudzām šīs grupas sugām ir īpašas fizioloģikas iezīmes, kādas nav attīstītākajām varžu sugām.[1] Šīs apakškārtas sugas ir neliela auguma un tām visām ir kopīga īpašība — to ribu savienojums ar mugurkaulu ir kustīgs. Salīdzinoši, pārējām varžu sugām ribas ir nekustīgi savienotas ar mugurkaulu.[3]
Nesenā pagātnē apaļmēles krupju dzimtā (Alytidae) tika sistematizēti arī ugunskrupji (Bombina) un plakangalvas krupji (Barbourula), kuri mūsdienās izdalīti atsevišķā ugunskrupju dzimtā (Bombinatoridae).[4][5]
Primitīvo varžu apakškārta (Archaeobatrachia) ir viena no bezastaino abinieku (Anura) apakškārtām, kas apvieno 28 mūsdienās dzīvojošas varžu un krupju sugas un kas tiek iedalītas 6 ģintīs un 4 dzimtās. Lielākā sugu dažādība sastopama Eirāzijā, Filipīnās, Borneo un Jaunzēlandē. Latvijā sastopama viena primitīvo varžu apakškārtas dzimta — ugunskrupju dzimta (Bombinatoridae), kuru pārstāv sarkanvēdera ugunskrupis (Bombina bombina).
Vidējo varžu apakškārta (Mesobatrachia) ir viena no bezastaino abinieku (Anura) apakškārtām, kas apvieno 168 mūsdienās dzīvojošas varžu un krupju sugas un kas tiek iedalītas 20 ģintīs un 6 dzimtās. Apakškārta ir relatīvi jauna un kā taksonomiskā vienība izveidota 1993. gadā.[1] Tās zinātniskais nosaukums Mesobatrachia sastāv no diviem vārdiem un latviski nozīmē "vidējā varde" (meso — vidējais, batrachia — varde), tādējādi atspoguļojot šīs grupas pozīciju evolūcijas gaitā. Šīs apakškārtas vardes ir attīstītākas nekā primitīvo varžu apakškārtas (Archaeobatrachia) sugas, tomēr tās nav tik advancētas, kā jauno varžu apakškārtas (Neobatrachia) vardes.[1]
Vidējo varžu apakškārtā piecu dzimtu sugas dzīvo zem zemes. Izņēmums ir bezmēles varžu dzimta (Pipidae), kurā apvienotas ūdenī dzīvojošas varžu sugas. Apakškārtas sugas sastopamas Eirāzijā, Āfrikā, Ziemeļamerikā un Dienvidamerikā. Latvijā sastopama viena vidējo varžu apakškārtas dzimta — varžkrupju dzimta (Pelobatidae), kuru pārstāv brūnais varžkrupis (Pelobatidae fuscus).[2]
Šīs apakškārtas zem zemes dzīvojošās vardes un krupjus var iedalīt divās lielās grupās: sugās, kas dzīvo tikai Ziemeļamerikā, un sugās, kas dzīvo Eiropā, Āzijas rietumos un Ziemeļāfrikā. Šīs sugas ir ļoti reti redzamas un novērojamas, tā kā dienas laikā mēdz ierakties zemē vai slēpties zemes alās. Atšķirībā no citām varžu sugām, tās spēj dzīvot sausos reģionos, tuksnešus ieskaitot, jo lielāko daļu dzīves pavada zem zemes.[3]
Šīm vardēm un krupjiem ir raksturīgas spēcīgas, platas priekškāju pēdas, ar kurām tās ierokas zemē. Pazemē tās var atrasties vairākas nedēļas. Virszemē tās mēdz iznākt nakts laikā, pēc spēcīgiem lietiem, kad gaiss ir ļoti mitrs. Tad šīs vardes barojas.[3] Šīs vardes ir visēdājas, tomēr, kamēr tās attīstās un aug, tās galvenokārt barojas ar veģetāru barību, bet, pieaugot un nobriestot, tās sāk baroties ar dažādiem bezmugurkaulniekiem, piemēram, gliemežiem, sienāžiem un tauriņu kāpuriem. Paēdušas vardes atkal ierokas zemē līdz nākamajam lielajam lietum.[3]
Latvijā sastopama viena vidējo varžu apakškārtas dzimta — varžkrupju dzimta (Pelobatidae), kuru pārstāv brūnais varžkrupis (Pelobates fuscus).[2]
Vidējo varžu apakškārta (Mesobatrachia) ir viena no bezastaino abinieku (Anura) apakškārtām, kas apvieno 168 mūsdienās dzīvojošas varžu un krupju sugas un kas tiek iedalītas 20 ģintīs un 6 dzimtās. Apakškārta ir relatīvi jauna un kā taksonomiskā vienība izveidota 1993. gadā. Tās zinātniskais nosaukums Mesobatrachia sastāv no diviem vārdiem un latviski nozīmē "vidējā varde" (meso — vidējais, batrachia — varde), tādējādi atspoguļojot šīs grupas pozīciju evolūcijas gaitā. Šīs apakškārtas vardes ir attīstītākas nekā primitīvo varžu apakškārtas (Archaeobatrachia) sugas, tomēr tās nav tik advancētas, kā jauno varžu apakškārtas (Neobatrachia) vardes.
Vidējo varžu apakškārtā piecu dzimtu sugas dzīvo zem zemes. Izņēmums ir bezmēles varžu dzimta (Pipidae), kurā apvienotas ūdenī dzīvojošas varžu sugas. Apakškārtas sugas sastopamas Eirāzijā, Āfrikā, Ziemeļamerikā un Dienvidamerikā. Latvijā sastopama viena vidējo varžu apakškārtas dzimta — varžkrupju dzimta (Pelobatidae), kuru pārstāv brūnais varžkrupis (Pelobatidae fuscus).
Koncek adolah kalompok gadang baragam hewan amfibi karnivora nan batubuah pendek dan indak baikua, nan tamasuak dalam ordo Anura (Yunani Kuno: an-, indak punyo + oura, ikua). Fosil tatuo "proto-koncek" ditamuan pado maso Trias Awa di Madagaskar, namun panantuan jam molekuler mampakiroan baso asa-usua mareka labiah jauah lai inggo ka maso Perm, yaitu 265 juta taun nan silam.
Koncek taseba sacaro laweh di mano-mano, mulai dari wilayah tropika inggo subartik; walau baitu konsentrasi tagadang kaanekaragaman spesiesnyo tadapek di rimbo-rimbo ujan tropika. Tacatat ado sakita 4.800 spesies koncek, nan marupoan labiah dari 85% dari spesies amfibi nan masih iduik. Koncek adolah salah satu dari limo ordo vertebrata nan palaing baragam.
Labiah dari sapertigo spesies nan ado kini ko dianggok dalam kondisi taancam punah, dan labiah dari saratuih duo puluah spesies dipakiroan lah sabana punah sajak taun 1980-an.[1]
Koncek adolah kalompok gadang baragam hewan amfibi karnivora nan batubuah pendek dan indak baikua, nan tamasuak dalam ordo Anura (Yunani Kuno: an-, indak punyo + oura, ikua). Fosil tatuo "proto-koncek" ditamuan pado maso Trias Awa di Madagaskar, namun panantuan jam molekuler mampakiroan baso asa-usua mareka labiah jauah lai inggo ka maso Perm, yaitu 265 juta taun nan silam.
Koncek taseba sacaro laweh di mano-mano, mulai dari wilayah tropika inggo subartik; walau baitu konsentrasi tagadang kaanekaragaman spesiesnyo tadapek di rimbo-rimbo ujan tropika. Tacatat ado sakita 4.800 spesies koncek, nan marupoan labiah dari 85% dari spesies amfibi nan masih iduik. Koncek adolah salah satu dari limo ordo vertebrata nan palaing baragam.
Labiah dari sapertigo spesies nan ado kini ko dianggok dalam kondisi taancam punah, dan labiah dari saratuih duo puluah spesies dipakiroan lah sabana punah sajak taun 1980-an.
Katak ialah sejenis haiwan amfibia dalam susunan Anura (bermaksud "tidak berekor", dari bahasa Greek: an-, tanpa + oura, ekor), dahulunya digelar Salientia (bahasa Latin saltare, "melompat"). Katak dewasa bercirikan kaki belakang yang panjang, badan yang pendek, jari berselaput, mata jongang dan ketiadaan ekor. Kebanyakan katak menjalani hidup mata jongang, tetapi juga mudah bergerak di daratan dengan melompat atau memanjat. Katak biasanya bertelur di lopak, kolam atau tasik; dan larvanya, iaitu berudu, berinsang dan bertumbuh dalam air. Katak dewasa merupakan haiwan maging yang gemar memakan haiwan artropod (terutamanya serangga), annelid dan gastropod. Katak paling dikenali dengan bunyi menguaknya yang boleh kedengaran tanpa kira siang atau malam, terutamanya ketika musim mengawan.
Katak wujud dalam pelbagai jenis dan kebanyakannya kumpulan pemangsa sebahagian besarnya amfibia berbadan pendek gemuk, tanpa ekor yang terdiri dari order Anura (perkataan Yunani an-, tampa + oura, ekor). Fosil tertua "katak-proto" muncul pada awal Triassic di Madagascar, tetapi pentarikhan jam molekul mencadangkan asal mereka menjurus kebelakang sehingga Permian, 265 juta tahun dahulu. Katak tersebar luas, dari wilayah tropika sehingga subartik, tetapi pemusatan terbesar kepelbagaian spesies terdapat di hutan hujan tropika. Terdapat sekitar 4,800 spesies direkod, menyumbang pada 85% keseluruhan spesies afimbia. Mereka juga merupakan satu dari lima aturan vertebrata yang paling pelbagai.
Bentuk katak dewasa biasanya mempunyai ciri-ciri satu badan gempal, mata menonjol, celah lidah, tangan dan kaki dilipat di bawah, dan ketiadaan ekor di kalangan katak dewasa. Selain daripada tinggal di air tawar dan di tempat kering, katak dewasa beberapa spesies disesuaikan untuk hidup di bawah tanah atau di pokok. Kulit katak adalah berkelenjar, dengan rembesan yang terdiri daripada toksik yang tidak disukai. Spesies katak puru cenderung untuk dipanggil kodok tetapi perbezaan antara katak dan kodok adalah berdasarkan konvensyen penamaan rasmi tumpuan pada ketuat dan bukan pada taksonomi atau sejarah evolusi; beberapa kodok lebih berkait rapat dengan katak berbanding dengan kodok lain. Kulit katak 'berbeza dari segi warna dari samaran yang baik perang berbalam, kelabu dan hijau sehingga pada corak yang jelas merah terang atau kuning dan hitam untuk mengiklan ketoksikan dan memberi amaran kepada pemangsa.
Katak biasanya bertelur di dalam air. Telur-telur mereka menetas menjadi larva akuatik yang dipanggil berudu yang mempunyai ekor dan insang dalaman. Mereka memiliki bahagian mulut mengikis yang khusus bagi diet herbivor, maserba atau plankton. Kitaran hidup sempurna apabila mereka berubah bentuknya menjadi katak dewasa. Beberapa spesies bertelur di atas tanah atau mengabaikan bentuk berudu. Katak dewasa umumnya mempunyai diet karnivor yang terdiri daripada invertebrata kecil, tetapi spesies maserba wujud dengan sebilangan kecil makan buah-buahan. Katak amat cekap menukarkan apa yang mereka makan menjadi jisim badan. Mereka merupakan sumber makanan yang penting bagi pemangsa dan sebahagian daripada jaringan makanan dinamik bagi kebanyakan ekosistem di dunia. Kulit katak adalah separa telap, menjadikan mereka mudah terdedah kepada kekeringan, dengan itu mereka sama ada tinggal di tempat-tempat yang lembap atau mempunyai penyesuaian khas untuk menangani habitat kering. Katak menghasilkan pelbagai bunyi, terutamanya semasa musim pembiakan mereka, dan mempamerkan pelbagai jenis tingkah laku kompleks untuk menarik pasangan, untuk menangkis pemangsa dan secara amnya untuk terus hidup.
Populasi katak telah menurun dengan ketara sejak tahun 1950-an. Lebih daripada satu pertiga daripada spesies dianggap sebagai terancam dengan kepupusan dan lebih seratus dua puluh dipercayai telah pupus sejak 1980-an.[1] Bilangan kecacatan dikalangan katak semakin meningkat dan ancaman yang baru muncul adalah penyakit kulat, chytridiomycosis, yang telah merebak di seluruh dunia. Biologi pemuliharaan sedang berusaha untuk memahami punca-punca masalah ini dan untuk menyelesaikannya. Katak dinilai sebagai makanan oleh manusia dan juga mempunyai banyak peranan budaya dalam kesusasteraan, simbolisme dan agama.
Katak boleh didapati dari kawasan tropika ke subartik, tetapi kebanyakan spesis katak terdapat di hutan hujan tropika. Katak merupakan antara kumpulan vertebrata yang paling banyak kepelbagaian, merangkumi lebih 5,000 spesis yang dikenali. Namun begitu, populasi spesis katak tertentu kian merosot.
Katak dan kodok sering dibezakan berdasarkan wajahnya yang disebabkan penyesuaian yang tertumpu kepada persekitaran kering di kalangan haiwan yang bergelar kodok; bagaimanapun, pembezaan ini tiada dasar taksonominya. Satu-satunya famili yang diberi nama am "kodok" secara eksklusif ialah Bufonidae, tetapi banyak spesis dari famili lain turut dipanggil "kodok," dan spesis di bawah genus kodok Atelopus digelar "katak badut" (harlequin frogs).
Anura merupakan orde dari alam amfibia dan terbahagi kepada beberapa famili seperti berikut:-
Katak ialah sejenis haiwan amfibia dalam susunan Anura (bermaksud "tidak berekor", dari bahasa Greek: an-, tanpa + oura, ekor), dahulunya digelar Salientia (bahasa Latin saltare, "melompat"). Katak dewasa bercirikan kaki belakang yang panjang, badan yang pendek, jari berselaput, mata jongang dan ketiadaan ekor. Kebanyakan katak menjalani hidup mata jongang, tetapi juga mudah bergerak di daratan dengan melompat atau memanjat. Katak biasanya bertelur di lopak, kolam atau tasik; dan larvanya, iaitu berudu, berinsang dan bertumbuh dalam air. Katak dewasa merupakan haiwan maging yang gemar memakan haiwan artropod (terutamanya serangga), annelid dan gastropod. Katak paling dikenali dengan bunyi menguaknya yang boleh kedengaran tanpa kira siang atau malam, terutamanya ketika musim mengawan.
Katak wujud dalam pelbagai jenis dan kebanyakannya kumpulan pemangsa sebahagian besarnya amfibia berbadan pendek gemuk, tanpa ekor yang terdiri dari order Anura (perkataan Yunani an-, tampa + oura, ekor). Fosil tertua "katak-proto" muncul pada awal Triassic di Madagascar, tetapi pentarikhan jam molekul mencadangkan asal mereka menjurus kebelakang sehingga Permian, 265 juta tahun dahulu. Katak tersebar luas, dari wilayah tropika sehingga subartik, tetapi pemusatan terbesar kepelbagaian spesies terdapat di hutan hujan tropika. Terdapat sekitar 4,800 spesies direkod, menyumbang pada 85% keseluruhan spesies afimbia. Mereka juga merupakan satu dari lima aturan vertebrata yang paling pelbagai.
Bentuk katak dewasa biasanya mempunyai ciri-ciri satu badan gempal, mata menonjol, celah lidah, tangan dan kaki dilipat di bawah, dan ketiadaan ekor di kalangan katak dewasa. Selain daripada tinggal di air tawar dan di tempat kering, katak dewasa beberapa spesies disesuaikan untuk hidup di bawah tanah atau di pokok. Kulit katak adalah berkelenjar, dengan rembesan yang terdiri daripada toksik yang tidak disukai. Spesies katak puru cenderung untuk dipanggil kodok tetapi perbezaan antara katak dan kodok adalah berdasarkan konvensyen penamaan rasmi tumpuan pada ketuat dan bukan pada taksonomi atau sejarah evolusi; beberapa kodok lebih berkait rapat dengan katak berbanding dengan kodok lain. Kulit katak 'berbeza dari segi warna dari samaran yang baik perang berbalam, kelabu dan hijau sehingga pada corak yang jelas merah terang atau kuning dan hitam untuk mengiklan ketoksikan dan memberi amaran kepada pemangsa.
Katak biasanya bertelur di dalam air. Telur-telur mereka menetas menjadi larva akuatik yang dipanggil berudu yang mempunyai ekor dan insang dalaman. Mereka memiliki bahagian mulut mengikis yang khusus bagi diet herbivor, maserba atau plankton. Kitaran hidup sempurna apabila mereka berubah bentuknya menjadi katak dewasa. Beberapa spesies bertelur di atas tanah atau mengabaikan bentuk berudu. Katak dewasa umumnya mempunyai diet karnivor yang terdiri daripada invertebrata kecil, tetapi spesies maserba wujud dengan sebilangan kecil makan buah-buahan. Katak amat cekap menukarkan apa yang mereka makan menjadi jisim badan. Mereka merupakan sumber makanan yang penting bagi pemangsa dan sebahagian daripada jaringan makanan dinamik bagi kebanyakan ekosistem di dunia. Kulit katak adalah separa telap, menjadikan mereka mudah terdedah kepada kekeringan, dengan itu mereka sama ada tinggal di tempat-tempat yang lembap atau mempunyai penyesuaian khas untuk menangani habitat kering. Katak menghasilkan pelbagai bunyi, terutamanya semasa musim pembiakan mereka, dan mempamerkan pelbagai jenis tingkah laku kompleks untuk menarik pasangan, untuk menangkis pemangsa dan secara amnya untuk terus hidup.
Populasi katak telah menurun dengan ketara sejak tahun 1950-an. Lebih daripada satu pertiga daripada spesies dianggap sebagai terancam dengan kepupusan dan lebih seratus dua puluh dipercayai telah pupus sejak 1980-an. Bilangan kecacatan dikalangan katak semakin meningkat dan ancaman yang baru muncul adalah penyakit kulat, chytridiomycosis, yang telah merebak di seluruh dunia. Biologi pemuliharaan sedang berusaha untuk memahami punca-punca masalah ini dan untuk menyelesaikannya. Katak dinilai sebagai makanan oleh manusia dan juga mempunyai banyak peranan budaya dalam kesusasteraan, simbolisme dan agama.
Katak boleh didapati dari kawasan tropika ke subartik, tetapi kebanyakan spesis katak terdapat di hutan hujan tropika. Katak merupakan antara kumpulan vertebrata yang paling banyak kepelbagaian, merangkumi lebih 5,000 spesis yang dikenali. Namun begitu, populasi spesis katak tertentu kian merosot.
Katak dan kodok sering dibezakan berdasarkan wajahnya yang disebabkan penyesuaian yang tertumpu kepada persekitaran kering di kalangan haiwan yang bergelar kodok; bagaimanapun, pembezaan ini tiada dasar taksonominya. Satu-satunya famili yang diberi nama am "kodok" secara eksklusif ialah Bufonidae, tetapi banyak spesis dari famili lain turut dipanggil "kodok," dan spesis di bawah genus kodok Atelopus digelar "katak badut" (harlequin frogs).

Kikkers (Anura) zijn een van de drie groepen van amfibieën, naast de salamanders (Caudata) en de wormsalamanders (Gymnophiona).[2] Kikkers zijn hiervan verreweg de grootste groep; van de ongeveer 7790 soorten amfibieën behoort grofweg 88% tot de kikkers. Er zijn tegenwoordig ruim 6860 verschillende soorten kikkers beschreven.[3] Kikkers hebben een vrijwel wereldwijde verspreiding en leven in sterk uiteenlopende habitats.
Kikkers behoren tot de gewervelde dieren, ze hebben vier poten maar geen staart en verschillen hiermee van de meeste andere amfibieën. Alle kikkers hebben een afgeplat, peervormig lichaam en uitpuilende ogen. De kop en bek zijn breed, de lange achterpoten zijn sterk gespierd en goed ontwikkeld. Kikkers zijn de enige dieren die een kwaakblaas hebben en hiermee soortspecifieke geluiden maken om elkaar te lokken. Net als andere amfibieën zijn kikkers koudbloedig, hierop is zowel de bloedsomloop als de ademhaling aangepast. Een aantal soorten houdt een zomerrust of winterslaap om erg warme respectievelijk koude jaargetijden te doorstaan.
De ontwikkeling van de larve tot volwassen kikker is uniek binnen de gewervelden. Kikkers doorlopen een volledige metamorfose waarbij de larve er totaal anders uitziet dan de volwassen kikker.
Kikkers eten een breed scala aan prooien, meestal kleine dieren als insecten en andere ongewervelden. De grotere soorten eten soms kleine gewervelden. Kikkers hebben daarnaast vele natuurlijke vijanden zoals vissen, vogels, zoogdieren en reptielen. Veel soorten worden direct of indirect bedreigd door de mens, een aantal soorten is hierdoor sterk bedreigd of uitgestorven.
Sinds 1985 is het aantal beschreven amfibieën met meer dan een derde toegenomen, dit geldt met name voor de kikkers. De indeling van de kikkers is door deze constante aanvoer van nieuwe inzichten sterk aan verandering onderhevig. Het feit dat sommige soorten pad worden genoemd is hier een voorbeeld van, dit heeft tegenwoordig geen wetenschappelijke basis meer.[4] In dit artikel worden alle soorten daarom verder met kikker aangeduid.
De wetenschappelijke naam Anura betekent letterlijk zonder (ἀ- a-) staart (οὐρά oura). Dit is het grootste verschil met de andere groepen van amfibieën die wel een staart hebben. Kikkers ontwikkelen overigens net als andere groepen van amfibieën wel een staart maar deze gaat weer verloren tijdens de metamorfose.
De verouderde wetenschappelijke naam Salientia is afgeleid van het Latijnse salire, dat 'springen' betekent. De Latijnse namen voor kikker (rana) en pad (bufo) en de Griekse naam voor kikkers (βάτραχος batrachos) worden vaak gebruikt in termen die slaan op aan kikkers verwante zaken, zoals bufotoxine voor het gif van padden. Daarnaast dragen sommige andere dieren en planten de naam -kikker of -pad, al slaat de naam niet altijd op de diergroep. De term kikkererwt (ook wel keker) bijvoorbeeld heeft niets met kikkers te maken maar is afgeleid van de wetenschappelijke naam van het plantengeslacht erwt (Cicer). Veel dieren die enigszins op een kikker of pad lijken worden benoemd naar kikkers zoals de padhagedissen en verschillende soorten vissen. Voorbeelden zijn de paddenvis (Batrachus grunniens) en de vorskwab (Raniceps raninus), waarbij de wetenschappelijke naam twee keer verwijst naar rana. De vorskwab lijkt niet op een volwassen kikker maar lijkt op een groot uitgevallen kikkervisje met zijn brede en bolle kop en zwarte kleur.
De slakken behorend tot de familie Bursidae worden padden- of kikkerhorens genoemd wat waarschijnlijk slaat op de ruwe structuur en de vlekkerige kleur van de schelp.
De herkomst van de Nederlandse naam kikker of kikvors is onzeker, maar hij wordt meestal als klanknabootsend beschouwd. De oudere naam vors of vorse is hetzelfde als het Duitse Frosch en ook verwant met het Engelse frog; de verdere herkomst van deze Germaanse woorden is eveneens niet duidelijk. Binnen de Nederlandse taal zijn er verschillende dialecten die een groot aantal verschillende woorden voor 'kikker' kunnen hebben. Een voorbeeld is het Limburgs, waar de kikker, afhankelijk van de regio, onder andere bekendstaat als kwakker, kwakvors, paddenmoek, vros, kikmauw en kruts.[5] In andere dialecten komt men onder meer ook wel puit, pudde en work tegen.[6]
Van alle amfibieën hebben de kikkers het grootste verspreidingsgebied, zo komen in Australië geen salamanders voor, de kikkers zijn hier juist sterk vertegenwoordigd. Kikkers komen vrijwel wereldwijd voor, zowel in tropische, subtropische als gematigde gebieden, maar zelfs in zeer koude gebieden zoals dicht bij de Noordpool komen enkele soorten voor.
In Noord- en Zuid-Amerika komen kikkers voor van noordelijk Canada (met uitzondering van het uiterste oosten) tot Chili. Slechts in een deel van het Andesgebergte in het westen van Chili en op Vuurland komen geen soorten voor. In Afrika hebben de kikkers zich over het gehele continent verspreid, op de Saharawoestijn na. Op het Arabisch Schiereiland ontbreken de kikkers alleen in het centrale deel en in Azië ontbreken ze alleen in een noordelijke strook dicht bij de Noordpool. Europa is het enige continent waar de soorten overal voorkomen, tot in het noorden van Scandinavië. De gewone pad (Bufo bufo) heeft de noordelijkste verspreiding en komt voor tot het noorden van Noorwegen.
Het verspreidingsgebied dekt ook bijna het gehele vasteland en grotere eilanden van Oceanië. Op Zuidereiland, dat tot Nieuw-Zeeland behoort, ontbreken de kikkers evenals op vele geïsoleerde oceanische eilandjes. Kikkers komen tegenwoordig niet voor op Antarctica, er zijn hier echter wel fossiele resten van kikkers gevonden.[7]
Het verspreidingsgebied verschilt vaak per familie; zo zijn de echte kikkers vrijwel kosmopolitisch, de schuimnestboomkikkers komen alleen voor in Europa, Azië en Afrika. Kleinere families hebben door het lage soortenaantal in de regel een meer geïsoleerde verspreiding, zo leven de Australische fluitkikkers alleen in Australië en Nieuw-Guinea, de staartkikkers zijn endemisch in Nieuw-Zeeland.
In de Antillen, Suriname, Nederland en België komen ongeveer 125 verschillende soorten kikkers voor die vanwege de geografische variatie en daarmee gepaard gaande sterke verschillen in begroeiing, luchtvochtigheid en temperatuur tot verschillende families behoren en een grote vormenrijkdom kennen.
In Europa leven ongeveer 50 soorten waarvan er een aantal ook in Nederland en België voorkomt. In gematigde streken zoals West-Europa komen relatief minder soorten voor dan in subtropische streken. Vrijwel alle soorten die in de Benelux voorkomen zijn hier vrij zeldzaam tot sterk bedreigd. Alle soorten zijn beschermd en vele staan op de rode lijst. Voor veel soorten geldt echter dat ze in andere delen van Europa nog algemeen voorkomen. Met een aantal soorten gaat het in Nederland de laatste tijd beter, omdat natuurbeheer en verbeterde waterkwaliteit zijn vruchten af begint te werpen.[8] Een voorbeeld hiervan is de boomkikker (Hyla arborea) hoewel alleen plaatselijke successen zijn geboekt. In Nederland en België komen 11 soorten inheemse kikvorsachtigen voor die tot verschillende families behoren. De Amerikaanse stierkikker is een exoot uit Amerika.
Op de Nederlandse Antillen (ABC-eilanden) komen oorspronkelijk geen kikkers voor, de eilanden zijn geografisch gezien te geïsoleerd. Wel zijn enkele soorten geïntroduceerd, zoals de fluitkikker Eleutherodactylus johnstonei (familie Eleutherodactylidae) op Curaçao en Pleurodema brachyops (familie fluitkikkers) op Aruba[9]
In Suriname komen iets meer dan 100 soorten kikkers voor uit 12 verschillende families. De soorten behoren tot de families Aromobatidae (5), Brachycephalidae (7), padden (6), glaskikkers (5), pijlgifkikkers (3), fluitkikkers (22), smalbekkikkers (8), tongloze kikkers (3), echte kikkers (1) en ten slotte de boomkikkers, waartoe de meeste soorten behoren (42). Het geslacht Leptodactylus (Leptodactylidae) is met 18 soorten het rijkst vertegenwoordigd. Van sommige soorten wordt vermoed dat ze in Suriname voorkomen maar dit is niet zeker, zoals de eerder vermelde soort Eleutherodactylus johnstonei.[2]
Kikkers kunnen in vrijwel alle habitats overleven dankzij hun goed ontwikkelde aanpassingsvermogen. De enige plaats waar ze niet kunnen leven is de zee. Veel soorten kunnen slecht tegen zout water, al is er bij enkele soorten enige tolerantie, zelfs bij kikkerlarven. De meeste soorten leven in tropische regenwouden, op de bodem of in bomen. Ook in moerassen, bossen, heiden, graslanden, ondergelopen weilanden, mangroven en zelfs in woestijnen en berggebieden kunnen ze overleven. Veel soorten zijn aangepast op een specifiek habitat maar velen kunnen ook in andere omgevingen overleven, zodat ze zich ook kunnen handhaven als de omstandigheden drastisch veranderen.
Kikkers zijn wat betreft hun levenswijze op verschillende manieren in te delen zoals de hoogte waarop ze leven en de afhankelijkheid van water. Sommige soorten leven op de bodem in de strooisellaag tussen de bladeren of klimmen weleens in lage struiken. Een aantal soorten is strikt boombewonend en leeft in bomen tussen de bladeren. Deze verdeling heeft overigens geen enkele relatie met de familie waartoe een soort behoort.
Vrijwel alle kikkers leven weliswaar in vochtige omstandigheden maar betreden alleen in de voortplantingstijd het water om de eieren af te zetten. Ze zijn daarom vaak te vinden bij het water maar veel van deze soorten zijn voornamelijk landbewonend. Ze betreden het water buiten de voortplantingstijd alleen bij gevaar om te ontsnappen aan vijanden. Sommige kikkers zetten echter ook de eieren op het land af en komen nooit in het water. Deze soorten leven vaak wel in zeer vochtige omstandigheden. Andere soorten zijn juist zo sterk aan het water gebonden dat ze nooit aan land komen. De tongloze kikkers bijvoorbeeld kunnen zich op het land moeilijk voortbewegen en kunnen er niet lang overleven. Dergelijke soorten hebben vaak sterke specialisaties op het water die bij andere soorten minder zijn ontwikkeld. Voorbeelden zijn grote zwemvliezen tussen de tenen en een afgeplat lichaam om sneller te kunnen zwemmen.
Een aantal soorten kikkers heeft zich gevestigd in gebieden waar ze eigenlijk niet thuis horen. Dergelijke soorten ontwikkelen zich soms tot een invasieve soort en worden als plaag beschouwd. Dit betekent dat ze zich niet alleen kunnen handhaven en voortplanten in andere gebieden maar ook de inheemse soorten benadelen. Voorbeelden zijn de brulkikker in Europa (onder andere in Nederland en België) en de agapad in Australië. Beide soorten worden wat groter waardoor ook andere kikkers op het menu staan. Met name de agapad draagt daarnaast een grote gifvoorraad zodat de natuurlijke vijanden in het door de kikker gekoloniseerde gebied niet zijn aangepast op het gif van het dier en kunnen sterven als ze een exemplaar verorberen.
Alle kikkers hebben eenzelfde bouwplan, waardoor ze van alle andere dieren en amfibieën te onderscheiden zijn. Ook soorten met de meest bizarre vormen zijn herkenbaar als kikker.[10] Kikkers hebben een peervormig, enigszins afgeplat lichaam met een niet door een hals ingesnoerde kop, wat de bewegingsvrijheid van de kop beperkt, en een brede bek. Er zijn enkele uitzonderingen. De tongloze kikkers (Pipidae) hebben een extreem afgeplat lichaam en wijken hiermee af van alle andere families. De trommelvliezen of tympanen zijn bij veel soorten goed te zien. De ogen puilen uit en staan aan de bovenkant van de kop, maar zijn vanaf de bovenzijde niet te zien en bedekt door de oogleden. Alleen bij soorten die meer in het water leven zijn de ogen wat naar boven geplaatst.
Kikkers zijn er in vele vormen en maten. Met name de lengte kan variëren. De kleinste soorten bereiken een lengte van ongeveer een centimeter en een gewicht van een paar gram. De grootste worden tientallen centimeters lang en bereiken een gewicht tot meer dan een kilo. Drie van de grootste soorten ter wereld zijn de reuzenpad (Chaunus marinus, 17 tot 23 centimeter), de goliathkikker (Conraua goliath, 17 tot 32 cm) en de reuzenfluitkikker (Leptodactylus pentadactylus, tot 18,5 cm).
De poten dragen lange tenen, al dan niet met zwemvliezen of hechtschijven. Kikkers hebben relatief veel grotere achterpoten dan voorpoten. Dit komt ook voor bij de salamanders, de enige andere amfibieën met poten. De achterpoten van kikkers zijn grotendeels onder het lichaam gevouwen in rust, waarbij de voorpoten ondanks hun geringere lengte vaak beter zichtbaar zijn. Bij veel soorten die een camouflagekleur dragen als groen, bruin of grijs, is de binnenzijde van de dijen felgeel of rood, wat dient om vijanden af te schrikken. Zie ook onder het kopje verdediging.
Kikkers en padden werden lange tijd beschouwd als twee aparte groepen binnen de Anura. Soorten met een gladde huid en een gespierd lichaam die meer bij het water leven en goed kunnen springen door de langere achterpoten werden kikker genoemd. Soorten met een ruwe huid en een gedrongen lichaam die meer op het land leven en slecht kunnen springen door de kortere achterpoten werden pad genoemd. Dit was ook terug te voeren op de taxonomische indeling; alle soorten met een ruwe huid behoorden tot de familie padden (Bufonidae) en alle andere soorten behoorden tot families die kikkers werden genoemd.
Tegenwoordig is bekend dat een ruwe of een gladde huid, langere of kortere achterpoten en het bezit of ontbreken van het vermogen om te springen weliswaar belangrijke verschillen zijn maar niets te maken hebben met de afstamming van de kikkers. Soorten met een ruwe huid zijn soms ontstaan uit soorten met een gladde huid en vice versa; er zijn ook soorten met een gladde huid die verwant zijn aan soorten met een ruwe huid. Hetzelfde geldt voor de op het land of juist op het water aangepaste levenswijze, de lengte van de achterpoten en het vermogen om te springen. Een voorbeeld van een dergelijke mengvorm is de geelbuikvuurpad die een ruwe huid heeft maar niet op het land leeft en juist sterk op een leven in het water is aangepast. Bij de boomkikkers, een familie waarvan de meeste soorten boombewonend zijn en een gladde huid hebben, komen soorten voor die een ruwe huid hebben en meer op de bodem actief zijn en niet in bomen leven. Al deze kenmerken hebben – zo weet men tegenwoordig – niets te maken met een gemeenschappelijke voorouder maar komen verspreid voor binnen de gehele orde van de kikvorsachtigen en zijn een vorm van convergente evolutie.
De familie Bufonidae (die in het Nederlands werd aangeduid met de padden) kreeg een engere definitie: alleen soorten die in het bezit zijn van een ontwikkeld orgaan van Bidder werden tot de groep van echte padden gerekend. Het orgaan van Bidder is een voortplantingsorgaan dat bij alle kikkers in aanleg aanwezig is maar al snel degenereert; alleen bij de padden kan het zich volledig ontwikkelen. Het orgaan is bijzonder omdat het mannetjes eicellen kan laten aanmaken en zo als het ware mannetjes in vrouwtjes kan veranderen. Een ander verschil tussen de soorten uit de familie Bufonidae en andere groepen is het ontbreken van tanden, die soorten uit andere families meestal wel hebben. Alle padachtige soorten die het orgaan van Bidder niet hebben zijn ondergebracht in andere families en worden niet langer tot de Bufonidae gerekend. De Nederlandse namen van deze soorten, met als bekendste de vuurbuikpad en de knoflookpad zijn echter niet mee veranderd. Hierdoor draagt een kikker soms de naam -pad maar wordt beschouwd als padachtige kikker en wordt met kikker aangeduid. Andersom gaat het ook op; de klompvoetkikkers dragen door hun gladde huid de naam -kikker maar behoren tot de familie echte padden. Hierdoor is het idee om sommige kikkers 'pad' te noemen geheel verlaten en worden alle soorten met 'kikker' aangeduid.
De kop is niet duidelijk afgesnoerd van de rest van het lijf maar de meeste soorten hebben brede kaken waardoor goed te zien is waar de schedel eindigt en het lichaam begint. Achter de ogen zijn aan de bovenzijde vaak twee vergrote en langwerpige bobbels aanwezig, die bij een aantal soorten nauwelijks zichtbaar zijn maar bij andere soorten juist opvallen, een voorbeeld is de agapad. Dit zijn de parotoïden of oorklieren, de gifklieren die als de pad wordt verstoord of wordt opgegeten een irriterende tot soms zelfs giftige substantie uitscheiden. Zie ook onder het kopje verdediging.
Bij strikt in het water levende soorten zijn de ogen meer aan de bovenzijde van de kop gepositioneerd. Deze soorten struinen vaak de bodem van het water af op zoek naar voedsel. Gevaar, zoals watervogels en vissen, komt altijd van boven waardoor deze aanpassing een voordeel is. Ze kunnen zo ook tijdens de ademhaling aan de oppervlakte onder water blijven terwijl alleen de ogen en neusgaten boven water uitsteken. Dit is een typische specialisatie van aquatische dieren en komt ook voor bij onder andere de krokodilachtigen.
Kikkers die veel op het land leven hebben hier niet zoveel aan en hebben ogen die meer aan de zijkanten of voorzijde van de kop zitten. De oogleden zijn onbeweeglijk, een kikker kan de ogen dus niet sluiten maar trekt met spieren de oogbal letterlijk in de oogkas.
De ogen van kikkers zijn net als veel reptielen en zoogdieren voorzien van een knipvlies, dat als beweegbaar ooglid functioneert. De kikker kan dit half doorzichtige vlies sluiten zodat het oog beschermd is maar het dier nog wel kan zien. Het wordt gebruikt tijdens het zwemmen zodat de ogen niet beschadigd raken door objecten onder water. De ogen worden niet centraal aangestuurd maar kunnen onafhankelijk bewegen dankzij spieren rond het oog.
Kikkers hebben een reflecterend laagje op het netvlies dat tapetum lucidum wordt genoemd en tapijt van licht betekent. Dit laagje zorgt ervoor dat kikkers beter kunnen zien in het donker wat bij vrijwel alle soorten van pas komt vanwege de nachtactieve levenswijze. Het tapetum lucidum is echter niet uniek voor kikkers en komt ook voor bij reptielen als krokodilachtigen en veel nachtactieve zoogdieren zoals katachtigen.
De iris is vaak bruin of groen van kleur maar kan veel verschillende kleuren hebben zoals zilverkleurig, goudkleurig, bronskleurig, geel of helderrood. Een voorbeeld van een kikker met bloedrode ogen is de Duellmanohyla uranochroa. De pupil kan verschillende vormen hebben, soorten die overdag actief zijn hebben vaak een horizontale of ronde pupil, nachtactieve kikkers hebben vaak een verticale pupil. Er zijn echter ook tussenvormen waarbij een druppelvormige, hartvormige, driehoekige en zelfs een stervormige pupil kan voorkomen.
Direct achter de ogen zijn vaak twee ronde, afwijkend gekleurde platte schijven aanwezig, dit zijn de tympana of trommelvliezen. Deze zijn niet bij alle soorten goed te zien omdat ze soms zeer klein zijn.
Kikkers hebben geen gebit zoals mensen en omdat een echte onderkaak ontbreekt hebben ze alleen kegelvormige, in de bovenkaak gepositioneerde tanden (maxillaire tanden). Enkele soorten hebben ook tanden in het verhemelte, vomerine tanden genoemd.[11] De tanden zijn niet geschikt om prooien te vermalen en dienen slechts om deze vast te houden terwijl de prooi met de tong, ogen en poten naar binnen wordt gewerkt.
De soorten uit de familie padden hebben geen tanden wat een belangrijk onderscheid is met andere kikkers.
Een kikker heeft een relatief slecht gezichtsvermogen vanwege de onbeweeglijke lens zodat het oog niet kan focussen. Het beeld is niet scherp en het is onduidelijk of kikkers kleuren kunnen zien. Kikkers kunnen daarnaast alleen bewegende beelden waarnemen; als een vijand of prooi stilstaat kan een kikker deze niet meer onderscheiden. Dit heeft niets met de ogen te maken maar met de signaalverwerking in de hersenen.[12] Ten slotte heeft een kikker geen nek waardoor de kop niet gedraaid kan worden. Als een kikker een mogelijke prooi of vijand nader wil onderzoeken moet het gehele lichaam worden gedraaid wat de positie van het dier kan verraden.
Kikkers kunnen niet zo goed horen als veel andere gewervelden maar ze kunnen wel geluiden waarnemen en zo vijanden opmerken of kwakende soortgenoten lokaliseren. Naast het gehoor hebben soorten die veel in het water leven zintuiglijke cellen aan de zijkanten van het lichaam, die gevoelig zijn voor drukverschillen en dienen om prooien en vijanden waar te nemen in het water. Deze organen zijn vergelijkbaar met de zijlijn van vissen. Een voorbeeld is de klauwkikker waarbij de tastzintuiglijke organen zichtbaar zijn als kleine 'stikseltjes' aan weerszijden van het lichaam.
Kikkers zijn in staat om naar hun oorspronkelijke voortplantingswater terug te keren. Kikkers, maar ook salamanders, kennen dus een vorm van navigatie maar het mechanisme hierachter is niet precies bekend.
Kikkers hebben altijd lange poten en vijf tenen en vier vingers, de meeste soorten hebben zwemvliezen aan de achterpoten die bij de voorpoten ontbreken. Aan iedere hand en voet is een rudimentaire teen of vinger aanwezig, die zeer klein is en alleen te zien bij het skelet. De poten van kikkers zijn van alle lichaamskenmerken het sterkst aangepast op de leefomgeving. De aanwezigheid of het juist ontbreken van verschillende kenmerken aan de poten geven vaak een indruk van de levenswijze of zelfs tot welke groep een soort behoort. Kikkers hebben bijvoorbeeld nooit nagels of klauwen, met als uitzondering de klauwkikkers. Soorten die veel in het water leven hebben goed ontwikkelde zwemvliezen die tot de punten van de tenen reiken. Soorten die minder aangepast zijn op het water hebben zwemvliezen die tot het midden van de tenen zijn vergroeid of de vliezen ontbreken volledig. De vliezen tussen de tenen dienen echter niet altijd om te zwemmen want ook boombewonende soorten hebben vaak huidvliezen tussen de tenen. Ze dienen bij deze soorten om het hechtoppervlak van de poot te vergroten zodat ze beter blijven plakken. Er zijn zelfs soorten, zoals de vliegende kikkers uit het geslacht Rhacophorus, die de vliezen gebruiken om stukjes van boom tot boom te zweven. Na een sprong worden de poten gespreid waarbij de vliezen voor een maximale luchtweerstand zorgen waardoor de kikker niet naar beneden valt. Er wordt een glijdende beweging door de lucht gemaakt waarbij een afstand van 15 meter kan worden afgelegd.[13]
Kikkers kunnen meestal goed springen, er zijn soorten die meer dan 20 keer hun eigen lichaamslengte kunnen overbruggen in een enkele sprong.[14] Hierbij worden de ogen gesloten om pas vlak voor de landing weer te worden geopend. Sommige landbewonende soorten hebben een meer huppende voortbeweging of kunnen snel kruipen. Bij het zwemmen worden de voorpoten tegen het lichaam gedrukt en met de achterpoten gezwommen, dit lijkt nog het meest op de schoolslag. Door de zwemvliezen is een grotere voortstuwing mogelijk en kan de kikker snel wegzwemmen.
Gravende kikkers hebben vaak korte maar gespierde poten en een goed ontwikkelde metatarsusknobbel of voetwortelknobbel, een verharde structuur aan de achtervoet. Veel terrestrische soorten zoals de knoflookpad kunnen zich hierdoor razendsnel ingraven. Het bijzondere is dat ze zich niet zoals vrijwel alle gravende dieren met de voorpoten ingraven, maar achterwaarts met de achterpoten. Soorten uit de familie Scaphiopodidae (scaphio = spade, poda = poot)[bron?] hebben hiertoe zelfs een schoffelachtige, verhoornde rand aan de metatarsusknobbel.
Veel kikkers zijn boombewonend en zijn behendige klimmers zoals de boomkikkers, de schuimnestboomkikkers en de glaskikkers. Klimmende soorten hebben zogenaamde hechtschijfjes wat een sterke specialisatie is die bij geen enkele andere diergroep voorkomt. De hechtschijven hebben de vorm van een zuignap maar de werking is wezenlijk anders. De hechtschijf bestaat uit vele kleine, 5- tot 6-hoekige groepjes cellen, gescheiden door microscopisch kleine kanaaltjes. Op het oppervlak is een door speciale klieren uitgescheiden laagje slijm aanwezig, dat een iets hogere viscositeit heeft dan water. Zodra de hechtschijf op de ondergrond wordt geplaatst, wordt de vloeistof de kanaaltjes ingedreven. Het contactoppervlak blijft zo droog zodat de teen niet kan wegslippen en de 5- of 6-hoekige structuren kunnen zich goed hechten aan de kleinste onregelmatigheden. Dit mechanisme wordt onderzocht omdat het mogelijke toepassingen biedt als antislipmateriaal.[15]
Mannetjes en vrouwtjes zijn niet zelden aan de poten van elkaar te onderscheiden, de mannetjes hebben in de paartijd dikkere poten wat veroorzaakt wordt door een ophoping van lymfevocht. Daarnaast hebben ze zogenaamde copulatieborstels, die dienen om het vrouwtje beter vast te kunnen houden tijdens de amplexus of paargreep.
De huid van alle amfibieën dient niet zozeer ter bescherming van het lichaam, in tegenstelling tot de reptielen waarvan de huid schubben of hoornplaten draagt. De huid is stug maar kwetsbaar en speelt een grote rol bij zowel de ademhaling als de waterhuishouding en is hiertoe erg dun, sterk doorbloed en waterdoorlatend. Kikkers hoeven in tegenstelling tot reptielen geen water op te nemen met de bek, ze nemen het op door de huid middels osmose. Vooral het gebied rond de dijen dat het vaakst contact maakt met water is hierop aangepast. Een nadeel is dat veel soorten in permanent vochtige omgevingen moeten verblijven omdat ze anders snel uitdrogen. Vanwege de dunne, permeabele huid zijn kikkers gevoelig voor vervuiling en andere veranderingen binnen een ecosysteem. Hierdoor wordt de aanwezigheid van kikkers door biologen als een belangrijke indicator gezien voor een gezond milieu.
Verschillende trucjes worden gebruikt om zo min mogelijk water te verliezen zoals het in groepen verblijven waarbij de dieren huidcontact maken. Hierdoor wordt het aan de buitenlucht blootgestelde huidoppervlak per kikker kleiner wat voordelig is. Dit komt vooral voor bij kikkers die op enige hoogte leven, in de relatief droge bomen en struiken. Andere soorten, zoals de Australische koraalteenboomkikker, hebben een waterafstotend, wasachtig laagje op de huid.[16] De belangrijkste aanpassing van de kikkers om waterverlies tegen te gaan is echter terug te vinden in het gedrag. Kikkers vermijden zonlicht en trekken zich overdag terug. De gevoeligheid voor droogte is een van de belangrijkste redenen van de nachtactieve levenswijze van de kikkers.
Naast water wordt ook zuurstof voor een belangrijk deel opgenomen door de huid en koolstofdioxide wordt afgegeven aan de buitenlucht. Kikkers zijn hierop niet zo goed aangepast als andere amfibieën, zoals de meeste salamanders die helemaal geen longen meer hebben en volledig afhankelijk zijn van keel- en huidademhaling. Een aantal kikkers kan gedurende de winterslaap maandenlang overleven op de bodem van een sloot, ze zijn dan echter niet actief en de stofwisseling staat vrijwel stil.
De huid zit niet strak om het lichaam maar hangt enigszins los en bij sommige soorten is het huidoppervlak veel groter dan het lichaamsoppervlak. Een extreem voorbeeld is Telmatobius culeus die het water nooit verlaat. Zowel de huid als de aquatische levenswijze zijn aanpassingen op de geografische verspreiding van het dier dat endemisch is in het Titicacameer in Zuid-Amerika op bijna 4000 meter boven zeeniveau. Hier is het zeer koud en het water heeft een lage zuurstofconcentratie. Daarnaast is er een verhoogde uv-straling door de hooggelegen ligging van het meer waardoor de kikker niet op het land kan leven.[17]
Net als alle reptielen en amfibieën moeten kikkers regelmatig vervellen, wat met een meer wetenschappelijk woord ecdysis wordt genoemd. Hierbij wordt de huid volledig vernieuwd, wat belangrijk is omdat een kikker de huid niet alleen gebruikt om het lichaam te scheiden van de buitenwereld, maar ook door de huid ademt en water opneemt. Bij de vervelling moet een kikker zich uit de oude huid werken door deze open te scheuren. Dit is te zien doordat ongebruikelijke bewegingen worden gemaakt zoals het overdreven opensperren van de bek of het langs het lichaam schuren van de poten om de huid af te stropen.
Veel kikkers eten de afgeworpen huid op zodat deze niet verloren gaat en wordt hergebruikt.
Kikkers kunnen van huidskleur veranderen doordat ze de verdeling van pigmenten in de cellen van de huid (chromatoforen) kunnen herverdelen. Als ze opeengepakt zitten in de cel heeft de huid een lichte kleur, als ze zich verspreiden door de cel krijgt de huid een donkere kleur. Kikkers hebben hier in tegenstelling tot sommige reptielen zoals kameleons echter geen controle over. Onder normale omstandigheden heeft de huid de normale basiskleur en bij slechte omstandigheden als stress, bedreiging of ziekte kleurt de huid donkerder. De huidskleur hangt verder af van de omgevingstemperatuur, de luchtvochtigheid en de intensiteit van het licht. De kleuromslag is niet erg groot: van een heldere, lichtere kleur als het dier zich in de ideale omstandigheden bevindt en een donkere, grauwe kleur bij slechte weersomstandigheden. In vroegere tijden werden verschillende soorten boomkikkers wel gebruikt om het weer te voorspellen maar enig bewijs dat deze methode van 'weersvoorspelling' enige wetenschappelijke waarde heeft is nooit geleverd, zie ook het kopje Fabeltjes over kikkers.
Van enkele soorten is bekend dat de huidskleur drastisch kan veranderen tijdens de paartijd onder invloed van hormonen, zoals de ook in Nederland en België levende bruine kikker en de heikikker. Dit gebeurt alleen bij de mannetjes en deze kleur is maar tijdelijk, een paardracht is hoogst uitzonderlijk bij amfibieën. Soms komen ook blauwe exemplaren voor van soorten die normaal gesproken een groene kleur hebben, dit is echter een genetische afwijking waarbij het dier geen gele pigmenten kan aanmaken waardoor de groene kleur blauw wordt.[18] Dit wordt cyanisme (blauwheid) genoemd en is blijvend, cyanisme heeft een negatieve invloed omdat de kikker erg opvalt voor vijanden. De huid van groene kikkers kleurt ook blauw onder invloed van chemicaliën zoals conserveringsvloeistoffen. De koraalteenboomkikker bijvoorbeeld is groen van kleur maar heeft de wetenschappelijke soortnaam caerulea gekregen wat 'blauw' betekent. Dit misverstand werd veroorzaakt doordat de ontdekker van de eerste exemplaren de dieren conserveerde en vervolgens verzond naar de beschrijver van de soort.
De schedel is compact, relatief licht en grotendeels afgeplat, veel schedelbeenderen zijn gefuseerd en de oogkassen zijn relatief groot. De hersenen worden beschermd door een brug tussen de ogen, dit deel van de schedel is verhoogd.
Kikkers hebben een uniek skelet waarin ze sterk verschillen van alle andere dieren, zelfs alle andere amfibieën. De drie belangrijkste verschillen zijn het ontbreken van een staart in de volwassen vorm, de verkorte, samengedrukte wervelkolom en het driedelige, gevorkte bekken. Kikkers hebben vijf tot negen wervels vóór het heiligbeen, meestal acht. Daarachter zijn drie tot vier wervels aanwezig die gefuseerd zijn tot een staafvormig stuitbeentje of urostyl, dat eveneens ontbreekt bij andere amfibieën. Naast deze kenmerken hebben kikkers vele andere aanpassingen om beter te kunnen springen, zoals enkele gefuseerde botten, verlengde voetbeentjes en zelfs gedegenereerde delen van het skelet, zoals de ribben.
Het gespecialiseerde skelet dient niet alleen om goed te kunnen springen maar ook om te zorgen dat het dier geen schade ondervindt als het na een sprong neerkomt op de ondergrond. De gevorkte en uit drie delen gevormde bekkengordel bestaat uit het dubbele darmbeen en het stuitbeen, wat uniek is in de dierenwereld. Het bekkengordel vangt de grootste klappen op, de schouder- en bekkengordel zijn goed ontwikkeld. De achterpoten zijn achter aan het lichaam aangehecht zodat het lichaam een betere balans heeft bij het springen. Veel soorten hebben slechts zeer kleine werveluitsteeksels, echte ribben ontbreken meestal. Soorten uit de families Dicroglossidae en Nieuw-Zeelandse oerkikkers hebben ribachtige werveluitsteeksels. De lange achterpoten zijn voorzien van flexibele botten die hun stevigheid ontlenen aan de gefuseerde beenderen. Het kuitbeen (fibula) en het scheenbeen (tibia) zijn met elkaar vergroeid tot een enkele structuur, het zogenaamde tibiofibula.[4] Hetzelfde geldt voor de beenderen van de onderarm, waarvan de ellepijp (ulna) en het spaakbeen (radius) het samengestelde radioulna vormen.[4]
Een ander typisch kenmerk van het skelet zijn het sterk verlengde sprongbeen (astragalus) en hielbeen (calcaneum). Bij zoogdieren als de mens zijn dit onooglijk kleine botjes in de voet. Bij kikkers worden deze sterk verlengde botten gebruikt als hefboomsysteem om nog beter te kunnen springen. Ze hebben morfologisch wel wat weg van een kuit- en scheenbeen maar zijn een onderdeel van de voet.
De botten van kikkers hebben groeiringen, die jaarlijks worden aangevuld en net als de jaarringen van bomen geteld kunnen worden. Hierdoor is uit het bot van een kikker af te leiden hoe oud het dier geworden is.
De organen van kikkers zijn gelegen in een enkele lichaamsholte en worden niet gescheiden door bijvoorbeeld een borstvlies zoals bij zoogdieren het geval is. Het spijsverteringsstelsel bestaat van voor naar achter uit de mondholte, de slokdarm, de J-vormige maag (8), de drielobbige lever (9) en de galblaas (10) waar gal wordt opgeslagen. Het laatste deel van de spijsvertering bestaat uit de dunne- (11) en dikke darm (5) en ten slotte de cloaca (12), het uitscheidingsorgaan. Het uitscheidingsapparaat bestaat uit de nieren, de urineleider, de urineblaas en de cloaca. De nieren, waarvan de bijnier zichtbaar is als een lichtgekleurde band op het midden van de nier, filteren giftige stoffen uit het bloed. Vervolgens worden de afvalstoffen door de urineleider naar de urineblaas getransporteerd en uitgescheiden door de cloaca. Daarnaast is de huid een belangrijk uitscheidingsorgaan.
De geslachtsorganen zijn uitwendig niet te zien, alleen bij autopsie zijn bij de mannetjes de testikels en zaadleiders waarneembaar. Bij de vrouwtjes zijn de eierstokken, de eventuele eicellen (4) en de spaghettiachtige eileiders duidelijk te onderscheiden. Zowel bij mannetjes als vrouwtjes zijn aan weerszijden van de geslachtsorganen vetlichamen aanwezig die een enigszins sterachtige vorm vertonen.
Het hart van een kikker wordt beschermd door het hartzakje of pericardium. Bij sommige soorten glaskikkers is dit te zien als een wit vlies. Het hart bestaat uit een linkerboezem (6) en een rechterboezem (1) en één kamer, het ventrikel (7). Bij zoogdieren als de mens heeft het hart twee kamers, zodat het bloed gescheiden blijft. De kamer heeft ook geen tussenschot zoals sommige reptielen, maar de indeling ervan zorgt ervoor dat het zuurstofarme en zuurstofrijke bloed zich niet goed mengen. De bloedstromen komen weliswaar bij elkaar in het ventrikel, maar het zuurstofarme bloed wordt onder in het ventrikel afgegeven terwijl het zuurstofrijke bloed in de bovenzijde wordt gepompt.
De ademhaling van kikkers is gecompliceerd; de gaswisseling waarbij koolstofdioxide wordt uitgescheiden en zuurstof wordt opgenomen kan plaatsvinden via de huid (huidademhaling) middels longen (longademhaling) en ook door zuurstofopnemend weefsel in de mond- en keelholte (keelademhaling).
Bij huidademhaling wordt zuurstof opgenomen uit het water of uit de lucht, maar in het laatste geval alleen bij vochtige omstandigheden, de huid moet namelijk vochtig zijn om te kunnen ademen. De huid is goed doorbloed en vaak erg dun voor een efficiënte opname van zuurstof.
De longen lijken op die van andere dieren, maar de borstspieren worden niet gebruikt bij de ademhaling. Een kikker heeft ook geen ribben die bij de meeste gewervelden een belangrijke rol spelen bij de longademhaling. De lucht wordt bij kikkers in de longen gebracht door de neusgaten te sluiten en de bek en mond of keelopening te vergroten. Vervolgens worden de neusgaten weer gesloten en de mondopening verkleind, wat de lucht de longen in drijft. Om de lucht uit te ademen wordt de mondopening weer vergroot en wordt de lucht uit de longen gezogen. Ten slotte worden de neusgaten geopend en de mondholte verkleind en stroomt de lucht naar buiten.
Bij keelademhaling wordt de lucht door de neusgaten opgezogen en langs de mondholte naar de keel geperst. Hier wordt zuurstof opgenomen door sterk doorbloed weefsel waardoor de ingeademde lucht de longen niet bereikt. Ook sommige andere waterdieren hebben dergelijke zuurstofopnemende weefsels, soms op de meest uiteenlopende plaatsen. Een voorbeeld is de fitzroyschildpad, die deels door weefsel in de cloaca ademt door er water in- en uit te pompen.
Tot zeer recentelijk werd aangenomen dat kikkers wellicht niet altijd gebruikmaken van longen, maar deze wel altijd hebben. Pas in 2008 werd ontdekt dat dit niet voor alle soorten geldt; de op Kalimantan levende Barbourula kalimantanensis is, althans voor zover bekend, de enige kikker die geen longen heeft. Deze soort haalt al de benodigde zuurstof volledig uit keel- en huidademhaling. Bij andere amfibieën als salamanders is dit vrij normaal maar een longloze kikker was nog niet eerder beschreven.
Kikkers spelen vanwege het soms massale voorkomen, vooral van de larven, een grote rol binnen het ecosysteem. De grote hoeveelheden larven dienen voornamelijk als voedsel voor waterinsecten en sommige vissen. De gemetamorfoseerde kikkers staan als kleine carnivore gewervelden midden tussen kleinere, ongewervelde dieren die gegeten worden en grotere, gewervelde dieren die leven van kikkers.
Kikkers kunnen zeer slecht tegen hoge temperaturen omdat ze dan snel uitdrogen. Tegen lage temperaturen zijn de meeste soorten veel beter bestand al verloopt bij lage temperatuur het metabolisme trager en kunnen ze zich maar langzaam voortbewegen. Het metabolisme is sterk afhankelijk van de omgevingstemperatuur. Dit heeft als voordeel dat bij een lage temperatuur de voedselbehoefte aanmerkelijk lager is maar bij een hogere temperatuur is de kikker actiever en kan meer voedsel zoeken.
In gebieden waar het in de zomer aanhoudend droog en warm is wordt een aestivatie of zomerslaap gehouden. Sommige kikkers hebben zich aangepast door in droge tijden een cocon te maken van slijm en afgeworpen huid, zodat ze hete zomers kunnen weerstaan, een voorbeeld is de Indische stierkikker (Kaloula pulchra). Andere voorbeelden zijn de Australische soorten uit het geslacht Litoria en de Afrikaanse kikkers die tot het geslacht Smilisca behoren. Deze soorten komen bij regen massaal uit hun schuilplaats en planten zich snel voort, ook de larven ontwikkelen zich snel. Zodra het warmer wordt en de oppervlaktewateren opdrogen hebben de larven zich volledig ontwikkeld tot kikkers. Deze graven zich in om pas het volgende jaar tevoorschijn te komen waarna de cyclus zich herhaalt.
Soorten die in streken leven waar weinig schuilmogelijkheden zijn en oppervlaktewater ontbreekt schuilen ondergronds. Dergelijke soorten kunnen zich snel ingraven en kunnen zo binnen korte tijd en op iedere plek een ondergronds, koel verblijf creëren. Ook in meer gematigde landen als Nederland en België wordt het soms te warm waardoor de kikker zich ingraaft, een voorbeeld is de knoflookpad.
In gebieden waar het vaak aanhoudend koud is, zoals gedurende de winters in de Lage Landen, schuilen kikkers maandenlang in een sluimertoestand onder boomstronken of zelf gegraven holletjes of soms in de modder van oppervlaktewateren, dit wordt de winterslaap genoemd.
Sommige kikkers zijn zo goed op koude aangepast dat ze temperaturen kunnen overleven onder het vriespunt waarbij delen van het lichaam bevriezen. De temperatuur kan hierbij dalen tot -6 graden Celsius waarbij 65% van het water in het lichaam bevriest. In het voorjaar ontdooit de kikker en komt weer tot leven, een voorbeeld is de boskikker (Lithobates sylvaticus), die tot boven de poolcirkel voorkomt. De kikker overleeft dergelijke lagere temperaturen door de suikers in het bloed als antivries te gebruiken.[14] De lever van het dier bevriest als laatste, dit orgaan maakt dan ook de suikers aan die de ijsvorming tegengaan. Deze opmerkelijke eigenschap is al lang bekend en werd al beschreven in 1747.
Sommige soorten landschildpadden kennen overigens hetzelfde trucje en ook kikkers in Nederland en België die een overwintering kennen maken gebruik van suikers die ervoor zorgen dat er geen grote ijskristallen worden gevormd en de lichaamscellen niet worden beschadigd, maar als ze bevriezen overleven ze dit niet.
Naast de voor de kikker zelf ongunstige weersomstandigheden in periodiek heel warme of koele gebieden, zoals uitdroging en oververhitting respectievelijk onderkoeling, is er gedurende een hete zomer of strenge winter weinig tot geen voedsel te vinden. Dergelijke soorten kunnen hierdoor niet het hele jaar actief zijn en een gevolg is dat ze zich minder snel kunnen ontwikkelen dan veel tropische soorten, die zich niet zelden het gehele jaar rond kunnen voortplanten.
De larven van kikkers leven voornamelijk van plantaardig materiaal zoals algen maar ook detritus als dode plantaardige en dierlijke delen in het water. De voedseldeeltjes worden verkleind met de rijen tandjes op de onder- en bovenlip. Er zijn ook soorten die micro-organismen eten of met de buisvormige bek kleine diertjes naar binnen zuigen. In stromend water levende kikkervisjes filteren voedseldeeltjes uit het water.
Van sommige kikkers is bekend dat er zeer veel eieren worden afgezet maar omdat de larven voornamelijk leven van elkaar hoeft het voortplantingswater geen voedsel te bevatten. Een voorbeeld is de soort Lepidobatrachus laevis, waarvan de larven net als de ouders een relatief brede bek hebben waarmee ze elkaar in één hap verorberen.[19]
Gemetamorfoseerde exemplaren zijn nog klein en eten kleine terrestrische diertjes als luizen en mijten, ze zijn net als volwassen kikkers carnivoor. Bij kikkers wordt regelmatig plantaardig materiaal in de maag aangetroffen, dit wordt vaak met het prooidier doorgeslikt en is onbedoelde bijvangst. Van slechts één kikker is bekend dat in hoofdzaak plantaardig materiaal gegeten wordt. Deze boomkikker, Xenohyla truncata, leeft voor een belangrijk deel van vruchten.[20]
Grotere kikkers leven van ongewervelden, meestal insecten en de larven, wormen, spinnen en (naakt)slakken. In principe pakken kikkers alles wat ze kunnen overmeesteren, dit heeft te maken met hun slechte gezichtsvermogen en het feit dat ze in een reflex toehappen. Alles wat een mogelijke prooi is wordt met de relatief brede bek opgeslokt. Grotere soorten eten daarom ook wel kleine knaagdieren, andere kikkers, vissen, jonge vogels of kleine reptielen, maar nooit als hoofdvoedsel. Enkele soorten hebben zich gespecialiseerd in een bepaalde groep prooidieren zoals muggen, kleine kreeftachtigen of mieren.
De prooi wordt vaak gevangen met behulp van een kleverige tong die snel en gericht kan worden weggeschoten en weer ingetrokken, net zoals bij kameleons. Als de prooi verder weg is kruipt of springt de kikker dichterbij. De tong grijpt de prooi en trekt deze in de bek in een tijdsbestek van minder dan een seconde. Uit videobeelden blijkt dat de kikker de prooi met gesloten ogen beschiet waardoor deze van tevoren moet worden gelokaliseerd. De tongloze kikkers moeten de prooi met de vingers naar binnen proppen. Andere soorten, zoals de schijftongkikkers, hebben wel een tong maar deze is vastgegroeid met de bek en kan niet worden uitgestoken.
Kikkers hebben vaak kleine tandjes in de bovenkaak die niet dienen om te snijden of malen, maar om de prooi vast te houden. Vanwege het ontbreken van malende tanden wordt de prooi altijd in één keer opgeslokt, soms terwijl deze nog tegenspartelt.[10] Bij het verzwelgen van de prooi worden de oogballen gebruikt; deze worden door spieren in de schedel naar beneden getrokken en drukken zo de prooi de keel in. Veel soorten die grotere prooien eten hebben een opvallend brede bek en krachtige kaakspieren zodat de prooi niet kan ontsnappen.
Veel kikkers eten grote hoeveelheden plaaginsecten als vliegen en muggen, krekels, slakken en kakkerlakken en ruimen grote hoeveelheden plaaginsecten op. Ze zijn daarom zeer nuttig voor de mens, maar enkele soorten hebben ook hun nadelen. Van Amerikaanse brulkikkers die leven bij viskwekerijen is bekend dat zo'n 30% van de dieren vis in de maag heeft.[21] Ook kunnen de kikkervisjes een belangrijke voedselconcurrent zijn voor jonge vissen.
Amfibieën onderscheiden zich voornamelijk van andere dieren in de voortplanting. Kikkers kennen in principe een uitwendige bevruchting en maken geen gebruik van een spermatofoor zoals veel salamanders. De bevruchting vertoont veel overeenkomsten met die van de vissen. Een ander typisch kenmerk van de amfibieën is het ontbreken van een embryonaal vlies en een eierschaal ter bescherming van het embryo.
Het larvale stadium is uniek binnen de gewervelden; kikkers kennen een volledige metamorfose waarbij de larve totaal niet lijkt op het volwassen dier. Herpetoloog Dr. Tyrone Hayes beschrijft de kikker als volgt: "...this is an animal that's really two animals in one. In one tiny little egg, it has the entire genome to make two completely different animals."[22] (Vertaling: "...dit is een dier dat wezenlijk twee dieren ineen is. In ėėn klein eitje, zit het complete genoom om twee totaal verschillende dieren voort te brengen.")
De mannetjes en de vrouwtjes zijn voornamelijk te onderscheiden aan de lengte; bij de meeste kikkers worden de vrouwtjes beduidend groter dan de mannetjes. Mannetjes hebben daarnaast verdikte paarkussentjes of copulatieborstels aan de voorpoot. Deze dienen om het vrouwtje beter vast te kunnen houden tijdens de amplexus. Slechts enkele soorten kennen een dusdanig sterk seksueel dimorfisme dat lange tijd gedacht werd dat de mannetjes en vrouwtjes tot verschillende soorten behoorden. Een voorbeeld is de rode pad (Ollotis periglenes), waarvan de mannetjes helder oranje van kleur zijn maar de vrouwtjes daarentegen hebben een bonte vlekkentekening op een donkere basiskleur.
Kikkers lokken elkaar niet met kleuren, geuren of bepaald gedrag, maar door paargeluiden die geproduceerd worden door lucht uit de longen langs het strottenhoofd te persen die de stembanden doen trillen.[10] Het geluid wordt versterkt door de zogenaamde kwaakblaas, die dient als klankkast en kan bestaan uit een enkele blaas onder de keel of een gepaarde blaas aan weerszijden van de kop. De lucht in de kwaakblaas ontsnapt niet via de neusgaten of mond maar wordt teruggevoerd in de longen om zo lucht en energie te sparen. Het kwaken is een relatief energieverslindende bezigheid voor de kikker, die zijn reserves bij alle andere activiteiten in zijn leven juist zo veel mogelijk spaart.[10] Rietkikkers en sommige boomkikkers en pijlgifkikkers maken gedurende de paartijd, die soms het hele jaar beslaat, zeer hoge en harde geluiden om de andere sekse te lokken. Het geluid dat ze produceren kan de menselijke pijngrens bereiken en de kikkers worden door de lokale bevolking als plaag gezien omdat ze mensen uit hun slaap houden.
Kikkers zijn de enige dieren die kunnen 'kwaken', de huid van de wangen of keel is sterk oprekbaar en dient als klankkast om geluiden voort te brengen. Kikkers die kwaken zijn in de regel de mannetjes en iedere soort heeft zijn eigen toonhoogte, frequentie en duur van de roep, hierdoor lokt een mannetje geen vrouwtjes van een andere soort.
Een sterk opgeblazen kwaakblaas is vaak bijna doorzichtig en sommige soorten kunnen de kwaakblaas zo ver opblazen dat deze bijna net zo groot is als de kikker zelf en het dier lijkt te ontploffen, een voorbeeld is de eikpad. De roep van deze soort staat bekend als een van de luidste uit de dierenwereld en het fluitende geluid doet pijn aan de oren. Andere soorten die zeer hard kunnen kwaken komen uit de familie Hyperoliidae, deze kikkers worden ook wel fluitkikkers genoemd. Sommige kikkers maken meer zagende, blaffende of knorrende geluiden. Een bijzondere soort is de knoflookpad, deze kikker kwaakt onder water om vrouwtjes te lokken. De Chinese soort Odorrana tormota heeft een bij amfibieën ongebruikelijke specialisatie die normaal gesproken alleen voorkomt bij vleermuizen en dolfijnen. Deze kikker kan ultrageluid produceren met de kwaakblaas en ook is het trommelvlies aangepast zodat de andere sekse het geluid kan horen. Het trommelvlies is hiertoe komvormig en is dicht bij het binnenoor gepositioneerd. Deze aanpassing dient waarschijnlijk om boven het geluid van klaterend water en andere dierengeluiden uit te komen.[23] Bij enkele soorten zoals de klauwkikker is het juist het vrouwtje dat kwaakt en zo aan de mannetjes laat weten dat ze paringsbereid is.
Bij een aantal soorten verdedigen de mannetjes hun territorium fel. Als ze het gekwaak van mannelijke soortgenoten horen gaan ze op zoek naar de concurrent en vechten net zo lang tot het andere mannetje vlucht of tot de dood erop volgt, een voorbeeld is de aardbeikikker (Oophaga pumilio). Bij andere soorten zoals Adelotus brevis hebben de mannetjes een paar opvallend grote, bijna slagtandachtige uitsteeksels in de bovenkaak die dienen om concurrenten te bevechten. Van de zogenaamde gladiatorkikkers (onder andere Hypsiboas boans en Hypsiboas faber) is bekend dat ze uitsteeksels aan de tenen hebben waarmee ze mannelijke concurrenten dodelijk kunnen verwonden.[10]
Omdat kikkers een uitwendige bevruchting kennen maken ze gebruik van een zogenaamde paargreep of amplexus waarbij het mannetje altijd bovenop zit. Tijdens deze reflex verkrampen de voorpoten van het mannetje waardoor hij goed vastgeklemd zit. Dergelijke wellustige mannetjes nemen het niet zo nauw en klampen soms een verkeerde soort aan, dit kan zelfs een totaal andere diersoort zijn zoals een salamander of een vis. Ook dode wijfjes die in staat van ontbinding verkeren en zelfs kluiten modder kunnen voor een geschikte partner worden aangezien. Bij de meeste soorten grijpt het mannetje bij de amplexus het vrouwtje bij de oksels wat amplexus axillaris wordt genoemd. Bij kikkers die elkaar bij de lendenen vastklemmen heet dit een amplexus lumbaris. Deze soorten behoren tot de meer primitieve families als de Pelodytidae en de knoflookpadden.
De eigenlijke bevruchting vindt in de regel onder water plaats. Hierbij kromt het vrouwtje haar rug wat een voorbode is van de afzet van eieren. Het mannetje herkent dit en loost vervolgens zijn sperma. De mannetjes mengen dus pas tijdens de afzet van de eieren hun sperma met de onbevruchte eieren van de vrouwtjes. Als de eieren uit het vrouwtje glijden worden ze opgevangen in de tot een soort kom gevouwen achterpoten van het mannetje waarna hij zijn zaad laat lopen, zodat zo veel mogelijk eieren worden bevrucht. Tijdens de ejaculatie nemen zowel het mannetje als het vrouwtje een sterk verkrampte houding aan. Hierbij is de rug van het vrouwtje is sterk gekromd en de ogen van het mannetje zijn gesloten. Er zijn maar enkele soorten waarvan bekend is dat ze een inwendige bevruchting kennen. Voorbeelden zijn de soorten uit het geslacht levendbarende padden (Nectophrynoides) en de staartkikker (Ascaphus truei). De mannetjes van deze laatste soort hebben een gespierde, staartachtige structuur aan de achterzijde die bij de paring wordt ingebracht bij het vrouwtje. Dit functioneel gezien op een penis lijkend orgaan is een aanpassing op de snel stromende beken waar de kikker in leeft. Het sperma zou bij een normale bevruchting snel wegspoelen.
De eiomhulsels van kikkers zijn meestal gelatineus en doorzichtig. De eieren worden afgezet in grote, ovale massa's, die wel kikkerdril worden genoemd. De eiermassa kan worden afgezet in grote of kleine klompen of in snoeren. Het aantal varieert van enkele tientallen tot honderden en kan oplopen tot duizenden eieren per legsel. De eieren hebben een dun, vliezig omhulsel dat wordt aangemaakt door de eileiders en opzwelt zodra het met water in contact komt. De eieren drijven vlak onder het wateroppervlak of worden aan ondergedoken planten bevestigd zodat de embryo's meer zuurstof verkrijgen. De eieren worden vaak in stilstaande wateren afgezet om te voorkomen dat de embryo's te veel door elkaar worden geschud, soorten die de eieren in stromende wateren afzetten bevestigen deze vaak aan of onder stenen zodat ze niet wegspoelen.
Afhankelijk van de soort bedraagt de incubatietijd ongeveer enkele dagen. Van sommige soorten, zoals Melanophryniscus stelzneri, is bekend dat de eieren binnen 24 uur uitkomen, wat uitzonderlijk snel is voor een embryonale ontwikkeling van een gewerveld dier. Tropische soorten zetten vaak gedurende het gehele jaar eieren af, soorten in gematigde streken produceren jaarlijks nageslacht of slaan een jaartje over om energie op te doen.
Soms zijn de eieren niet bevrucht of raken geïnfecteerd door schimmels waardoor ze sterven, ze worden dan wit van kleur.
Nadat het embryonale stadium is doorlopen komen de eieren uit en verschijnen de kikkervisjes, de nog pootloze maar van kieuwen voorziene larven leven de eerste dagen van de dooier. Het zijn eerst nog kleine pootloze, zwarte en wormachtige diertjes met kleine kieuwen. Kikkervisjes van sommige soorten maken geen pigment aan waardoor ze bijna doorzichtig zijn. Vlak na hun geboorte zijn de larven weinig mobiel maar ze ontwikkelen al snel een gespierde staart waardoor ze zich kunnen verspreiden en naar voedsel kunnen zoeken.
Na enige tijd ontwikkelen zich de achterpoten en later komen de voorpoten tevoorschijn. De voorpoten groeien net zo snel als de achterpoten maar zijn de eerste tijd niet zichtbaar omdat ze zich ontwikkelen in de kieuwzakken. Ze zijn dus niet te zien tot ze uiteindelijk 'doorbreken'. Later verdwijnen de kieuwen en staart, de bijna volledig ontwikkelde larven kruipen dan op het land en lijken uiterlijk al op een kikker, hoewel ze nog niet geslachtsrijp zijn. De meeste soorten doorlopen de embryonale en larvale ontwikkeling binnen enkele weken tot maanden. Sommige kikkers kennen een meerjarig larvaal stadium. Dit heeft te maken met een lage temperatuur tijdens de ontwikkeling: een voldoende hoge temperatuur is van grote invloed op de ontwikkelingsduur. De meeste kikkers zoeken slechts tijdens de paartijd het water op voor de afzet van eieren en leven de rest van het jaar op het land.
Er is bekend dat van veel soorten, waaronder in Nederland en België levende kikkers, de larven onder bepaalde omstandigheden erg groot kunnen worden, wat de reusvorm wordt genoemd. Na de metamorfose zijn de kikkers echter niet groter dan andere exemplaren. Een extreem voorbeeld is de paradoxale kikker (Pseudis paradoxa), waarvan het kikkervisje een lengte van 25 centimeter kan bereiken terwijl de kikker maximaal 5 cm meet.
Kikkers zijn vrijwel altijd eierleggend, alleen de soorten uit geslacht Nectophrynoides zijn, althans voor zover bekend, eierlevendbarend. De jongen komen levend ter wereld en zowel het embryonale als het larvale stadium worden volledig in het ei voltrokken. Ze kennen een ook een inwendige bevruchting wat eveneens uitzonderlijk is binnen de kikkers.
Er bestaan bij de kikkers ook veel hybriden, dit zijn vruchtbare kruisingen tussen verschillende soorten of ondersoorten. De determinatie van deze kikkers is vaak niet eenvoudig omdat kenmerken van de dieren kunnen overlappen met die van beide oudersoorten.
Er zijn er veel dieren die kikkers eten, vooral slangen, vogels, schildpadden, hagedissen, rovende zoogdieren en grote vissen. Voor veel dieren, zoals jonge krokodilachtigen, zijn kikkers een onmisbare bron van voedsel om te overleven. Veel soorten die eigenlijk andere prooien eten pakken soms ook wel een kikker, een voorbeeld is de egel, die voornamelijk van insecten leeft. In Nederland en België worden kikkers voornamelijk gegeten door vogels, zoals de kraai, de roerdomp en met name de blauwe reiger, die voornamelijk van kikkers leeft. Ook de ringslang eet vrijwel uitsluitend kikkers en struint de oevers af. In het water leven vijanden zoals de snoek en de otter, de kikker vlucht dan door naar de bodem te zwemmen met de gespierde achterpoten en zich in de modder te verschuilen. Andere vijanden in de Benelux zijn de marter en de bunzing.
Kikkers zijn kannibalistisch en eten als ze de kans krijgen kleinere kikkers, zelfs kleinere soortgenoten worden niet gespaard. Dit geldt overigens ook voor de larven die zich bij voedseltekort aan elkaar vergrijpen.
Kikkers hebben zoals alle dieren te lijden onder parasieten zoals de knutten, een groep van muggen uit het geslacht Corethrella die gespecialiseerd zijn in kikkers.
Sommige vliegen, zoals Lucilia bufonivora, leggen larven in de neusholte van kikkers. De maden vreten zich vervolgens een weg door de kop van de levende kikker, tot de dood erop volgt.
De parasitaire lintworm Spirometra mansonoides is een parasiet die onder andere kikkers aantast en een zeer complexe levenscyclus kent. De worm begint als microscopisch kleine larve die kleine dieren als kreeftachtigen en kikkervisjes infecteert. Deze krijgen na een infectie misvormingen zoals meer of juist minder poten. De volwassen worm leeft uiteindelijk in grotere zoogdieren als tijgers en andere katachtigen.[24] De worm tast ook andere amfibieën aan zoals salamanders.
De belangrijkste vorm van passieve verdediging is het aan de omgeving aangepaste uiterlijk. Veel kikkers zijn goed gecamoufleerd door een op de leefomgeving afgestemde kleur tot een op een blad lijkende lichaamsvorm.
Actieve verdediging bestaat meestal uit wegvluchten bij gevaar, veel soorten springen in het water en duiken een tijdje onder. Kikkers die in het nauw worden gedreven blijven meestal zitten en houden zich dood. Veel kikkers die wat groter worden kennen een breed scala aan bluf- of dreiggedrag. Met name landbewonende soorten kunnen zich vol met lucht blazen bij gevaar, zodat ze vast komen te zitten in het hol en een vijand ze er niet uit krijgt. Dit is overigens ook een verdedigingsstrategie bij veel hagedissen. Hetzelfde gedrag vertonen kikkers bij een confrontatie met slangen, naast een vergroot lichaamsvolume wordt een pose aangenomen die het dier nog groter doet lijken door hoog op te poten te staan. Zo lijkt de kikker groter en boller en is het voor de slang moeilijker de kikker op te eten. Slechts enkele soorten zullen een belager bespringen en soms kan een beet worden uitgedeeld. Een voorbeeld is de soort Lepidobatrachus laevis, die twee dolkachtige uitsteeksels in de bovenkaak heeft. Deze worden voornamelijk gebruikt om soortgenoten te bevechten in de paartijd, maar kunnen ook voor de verdediging worden ingezet en de huid van zoogdieren als de mens penetreren.[25]
Over de verschillende vormen van actieve verdediging is nog weinig bekend, van enkele soorten weten we dat de verdediging al begint in het ei. De larven van Duellmanohyla uranochroa bijvoorbeeld zijn in staat om voortijdig het ei te verlaten als ze worden aangevallen. De eieren worden onder een blad geplakt dat boven het water hangt, als slangen de eieren opeten herkennen de larven de trillingen als gevaar en verlaten het ei vroegtijdig waarna ze in het water vallen. Ze zijn dan nog niet helemaal ontwikkeld maar hebben zo wel een grotere overlevingskans[26] (video). Het is ook bekend dat de larven van deze soort zich heel snel ontwikkelen als er veel vijanden in het water leven, maar juist een langzame ontwikkeling kennen als er op de oever veel spinnen lopen.[27]
De meeste soorten kikkers hebben een groene, bruine of grijze kleur, vaak met grillige vlekken om minder goed zichtbaar te zijn voor vijanden. Sommige soorten hebben naast camouflagekleuren ook een aantal lichaamsaanpassingen die ze nog beter doen wegvallen tegen de achtergrond. Veel soorten hebben twee plooien aan weerszijden van de rug, die dorsolaterale lijsten worden genoemd. Vaak is de kleur tussen deze lijsten (op het midden van de rug) anders dan de kleur onder de lijsten (op de flanken). Hierdoor zijn kikkers vanuit de lucht moeilijker te zien, omdat het lichaam door deze schakering in drieën wordt verdeeld waardoor het dier beter wegvalt tegen de achtergrond.
De structuur van de huid ondersteunt de camouflage, soorten die in bomen leven plakken vaak aan bladeren en hebben een groene kleur en gladde huid om niet op te vallen. Soorten die op de bodem leven hebben over het algemeen een korrelige huid en een bruine kleur om aan de aandacht van vijanden te ontsnappen.
Enkele soorten hebben hoornachtige uitsteeksels boven de ogen, die echter niet verhard zijn maar bestaan uit zacht huidweefsel. Ze dienen dan ook niet ter verdediging maar om de lichaamsvorm grilliger te maken zodat de kikker minder opvalt. Sommige soorten hebben onregelmatige huidplooien op de rug en flanken die doen denken aan de nerven van een blad. Deze aanpassingen komen alleen voor bij soorten die op de bodem leven; ze vallen door het bladachtige uiterlijk vrijwel volledig weg tegen de achtergrond. Een voorbeeld van deze bladachtige kikkers vinden we bij het geslacht Ceratobatrachus. Een aantal soorten uit verschillende families heeft vele kleine stekelachtige structuren op de rug, die eveneens niet verhard zijn maar de kikker doen lijken op een pluk mos.
De glaskikkers danken hun naam aan de halfdoorzichtige huid maar dit varieert enigszins per soort. Met name aan de buikzijde zijn vrijwel alle organen zichtbaar. Bij veel soorten glaskikkers, maar ook bij boomkikkers uit de onderfamilie Phyllomedusinae is ontdekt dat de huid dezelfde golflengte infrarood licht weerkaatst als planten, wat waarschijnlijk een aanpassing is om niet op te vallen voor vijanden. Wetenschappers denken dat dit vooral dient om zich te camoufleren voor slangen. Slangen als boa's en pythons bezitten receptoren voor infrarood aan de voorzijde van de kop (de labiale groeven genoemd) waarmee prooien worden opgespoord.[28]
Een aantal kikkers heeft felle kleuren om aan te geven dat ze oneetbaar of giftig zijn of gebruiken schrikkleuren om vijanden af te schrikken. Het bekendst zijn de pijlgifkikkers, die alle kleuren van de regenboog kunnen hebben. Zo komen rode, blauwe, gele, felgroene, oranje en wit-met zwarte soorten voor. Naast pijlgifkikkers zijn er ook andere soorten die een opvallende kleur hebben. Voorbeelden zijn de tomaatkikker (Dyscophus antongilii) uit Madagaskar en de rode pad (Ollotis periglenes) uit Brazilië, die respectievelijk dieprood en helderoranje van kleur zijn.[29]
Een aantal soorten heeft onopvallende kleuren op de rugzijde, maar felle rode of gele kleuren aan de buikzijde en onderzijde van de poten. Het bekendst zijn de vuurbuikpadden die hier de naam aan te danken hebben, maar ook sommige andere kikkers hebben felle buikkleuren. Bij verstoring kromt de kikker de poten boven het lichaam, waardoor de schrikkleuren onder de poten zichtbaar worden. Dit onnatuurlijke gedrag, de buik is immers het kwetsbaarst, wordt ook wel het unkenreflex genoemd. Het unkenreflex is een kolderiek gezicht omdat het net lijkt of de kikker uit wanhoop zijn poten boven het hoofd houdt. Als een vijand de kikker omdraait, wordt ook de felle buik zichtbaar.
Een veel gebruikt trucje is de felle kleur aan de binnenzijde van de dijen die niet te zien is zolang de kikker stilzit. Pas als het dier wegspringt komt de schrikkleur tevoorschijn waardoor een vijand wordt afgeleid en de kikker kan ontsnappen. De vieroogkikker (Eupemphix nattereri) gaat nog verder, deze soort heeft oogvlekken aan de achterzijde van de dijen, die in rust verborgen zijn. Als een vijand nadert, gaat de kikker op de poten staan en laat zijn gevlekte achterkant zien, waarbij de ogen zichtbaar worden. Deze vorm van bluf komt ook bij andere dieren voor, zoals de dagpauwoog, een vlindersoort.
Er zijn ook soorten met daadwerkelijk fel gekleurde ogen zoals de roodoogmakikikker. Dergelijke soorten hebben, zoals de naam al aangeeft, helder rode ogen die in rust worden ingetrokken en niet goed zichtbaar zijn. Bij verstoring worden de ogen zichtbaar en komt de bloedrode kleur tevoorschijn.
Kikkers hebben gifklieren, waarvan de parotoïden vaak het duidelijkst zichtbaar zijn, deze zijn net achter de ogen gepositioneerd. De knoflookpadden en de vuurbuikpadden scheiden een stof af die ruikt naar knoflook of uien, bij de gewone pad doet de geur denken aan vanille. De uitscheiding smaakt zeer bitter en irriteert de slijmvliezen maar is niet gevaarlijk. Het kan ook irritaties aan de ogen veroorzaken als het bijvoorbeeld via de vingers wordt overgebracht.
Bij een aantal tropische soorten worden echter verschillende zeer toxische verbindingen uitgescheiden waarvan het effect varieert van hevige irritatie tot verlammingsverschijnselen, het gif kan bij sommige soorten fataal zijn. Het neurotoxine van de giftigste soort, de pijlgifkikker Phyllobates terribilis kan inname van slechts 2 microgram van het secreet dodelijk zijn voor de mens.[30] Natuurlijke vijanden zijn overigens niet zelden immuun voor de door kikkers uitgescheiden giftige verbindingen. Ze kunnen zo de giftigste kikkers eten zonder hier schade aan te ondervinden, een voorbeeld is de slang Liophis epinephelus. Het gif bevat vaak een sterke antibacteriële werking, waardoor de verbindingen onderzocht worden in de geneeskunde.
Giftige kikkers met felle kleuren behoren niet altijd tot de pijlgifkikkers, ook soorten uit het geslacht Mantella, behorend tot de familie Mantellidae zijn fel van kleur en erg giftig. Dit is echter een vorm van convergente evolutie omdat de groepen duizenden kilometer van elkaar verwijderd zijn en niet aan elkaar verwant lijken. Sommige onschuldige soorten imiteren giftige soorten zoals de niet-giftige Allobates zaparo, die zowel de giftige Ameerega bilinguis als de zeer giftige Ameerega parvula imiteert. Deze drie soorten zijn nauwelijks uit elkaar te houden.[31]
Giftige kikkers kunnen gevaarlijk zijn voor mensen en vooral voor huisdieren, die onbekend zijn met de lokale soorten omdat ze niet weten welke soorten ze beter kunnen ontwijken in tegenstelling tot inheemse diersoorten.
Kikkers zijn gevoelig voor vervuiling omdat ze vanwege de complexe ontwikkeling en metamorfose sterk afhankelijk zijn van hormonen. Dit zijn ontwikkelingsregulerende verbindingen die belangrijk zijn voor de ingrijpende transformatie van kikkervisje tot kikker. Door vervuiling kan de hormoonhuishouding verstoord raken en hierdoor ontstaan misvormingen en veranderingen in het uiterlijk, het gedrag en de voortplanting. Het is bekend dat kikkers bijvoorbeeld kleiner blijven, minder gaan eten of minder eieren produceren.
Bij een teveel aan meststoffen in het oppervlaktewater of de bodem wordt de habitat overwoekerd door vegetatie en trekken de dieren weg naar minder begroeide locaties. Vermesting leidt meestal tot verzuring, in een te zuur milieu kunnen kikkers en hun eieren en larven zich niet ontwikkelen.
De belangrijkste bedreiging is een infectie met de schimmel Batrachochytrium dendrobatidis, die de beruchte ziekte chytridiomycose veroorzaakt. De schimmel is wereldwijd verspreid door toedoen van de mens. Een aantal soorten, zoals de klauwkikker en de reuzenpad, werden in Zuid-Amerika, de Caraïben en Australië als zwangerschapstest gebruikt. Ook de internationale handel in exotische dieren speelt een rol omdat zo kikkers in nieuwe gebieden worden geïntroduceerd, waardoor geïnfecteerde exemplaren nieuwe gebieden kunnen besmetten.[32] Boven op de andere bedreigingen verzwakt de schimmel veel soorten nog verder. De toepassing van bepaalde probiotische bacteriën zou een positieve invloed kunnen hebben maar grootschalige resultaten zijn tot zover bekend uitgebleven.[33]
Door het droogleggen van gebieden voor de landbouw of irrigatie wordt de habitat te droog waardoor de kikkers verdwijnen, evenals het droogleggen van moerassen om van muggen af te komen. Hierdoor verandert het milieu drastisch en maken kikkers geen schijn van kans. Niet alleen droogt het voor de voortplanting en schuilmogelijkheden noodzakelijke oppervlaktewater op, ook prooidieren en de schaduw biedende vegetatie verdwijnen.
De kap van bossen verkleint het leefgebied van veel soorten. Dit is een wereldwijd probleem en geldt niet alleen voor de tropische bossen in Zuid-Amerika. Voorbeelden van Afrikaanse kikkers die hierdoor worden bedreigd zijn de levendbarende pad (Nectophrynoides viviparus) en Leptopelis parkeri.
Het verkeer eist jaarlijks vele slachtoffers, met name soorten die naar het voortplantingswater trekken (zie ook amfibieëntrek) en in gebieden waar zowel veel kikkers als een hoge verkeersdrukte is, zoals Nederland, worden jaarlijks vele dieren platgereden. In door de mens druk bezochte gebieden worden kikkers verstoord in hun levenswijze en vertrekken naar andere gebieden.
Het veranderen van de habitat is voor een deel toe te schrijven aan klimaatverandering, al is het bij veel soorten onbekend welke effecten deze veranderingen precies veroorzaken. Zo zou de opwarming van de aarde een rol spelen bij het verspreiden van de eerder genoemde Batrachochytrium -schimmel. Van een verhoogde ultraviolette straling wordt vermoed dat deze door de eieren van de kikkers wordt geabsorbeerd en beschadigingen veroorzaakt aan het DNA waardoor de kikkers misvormingen vertonen. Eenzelfde effect geeft vervuiling met een aantal chemicaliën.
In een aantal streken is de invoer van invasieve soorten de oorzaak van de achteruitgang van amfibieën waaronder kikkers. In Australië bijvoorbeeld worden steeds meer roofvissen uitgezet in de natuur, die de eieren en de larven van kikkers opeten. Daarnaast is er al vele tientallen jaren geleden de agapad uitgezet met als doel insecten te bestrijden. Helaas wordt deze exoot zo groot dat voornamelijk andere grotere dieren worden gegeten waaronder andere kikkers. In België en Nederland zijn sommige poelen door het uitzetten van zonnebaarzen ongeschikt geworden voor zeldzame en bedreigde soorten als de knoflookpad.
Een andere bedreiging is de handel in exotische dieren en andere handelingen waarbij de mens kikkers direct uit hun leefomgeving haalt. Veel soorten kikkers zijn populair in de dierenhandel en worden op grote schaal gevangen in het wild wat de natuurlijke populaties aantast. Dit geldt met name voor de bedreigde soorten omdat ze exclusief zijn en veel geld opleveren. Kikkers worden daarnaast gevangen en geconsumeerd, bekend zijn de kikkerbilletjes die als een delicatesse worden beschouwd en in de meer exclusieve restaurants op het menu staan.
Kikkers worden in achtergestelde landen door de plaatselijke bevolking gegeten en gezien als bush meat, een Engelse term voor dierlijk voedsel uit de natuur. Een voorbeeld is de oproep van de militaire junta van Myanmar na de catastrofale tyfoon in 2008 aan de bevolking om geen westers voedsel aan te nemen maar vooral gebruik te maken van de natuur door kikkers te vangen en op te eten.[34][35]
Sinds de jaren vijftig is een wereldwijde achteruitgang geconstateerd in het aantal en de verspreiding van de amfibieën. Officieel zijn er in de laatste 500 jaar 34 soorten verdwenen maar over een derde van alle soorten is vrijwel niets bekend, ook niet hoe het met ze gaat. In totaal zijn waarschijnlijk al veel meer soorten verdwenen maar onderzoek hiernaar is moeilijk. In landen als Zimbabwe en Myanmar bijvoorbeeld is vanwege de politieke situatie geen monitoring mogelijk. Enkele fascinerende soorten die worden beschouwd als uitgestorven zijn de knaloranje rode pad en alle soorten die tot de maagbroeders behoren. Bij vrijwel alle reptielen en amfibieën, zoals een aantal salamanders, zijn beschermingsprogramma's opgezet voor bedreigde soorten maar bij de kikkers is dit slechts op zeer beperkte schaal toegepast.
De cijfers over de situatie van de huidige amfibieën, waarvan het grootste deel kikkers, zijn alarmerend; ruim 7% (meer dan 400 soorten) staat op het punt van uitsterven, tegenover 1,8% van de vogels en 3,8% van de zoogdieren. In totaal gaat ruim 40% van alle amfibieën achteruit; de situatie van zo'n 400 soorten is kritiek waarvan bij 200 soorten de oorzaak onbekend is.[36]
Het jaar 2008 is door natuurbeschermingsorganisaties en dierentuinen uitgeroepen tot het jaar van de kikker, in de hoop wereldwijde aandacht te verkrijgen voor de bedreiging van de kikkers.
Over de mogelijke gevolgen voor de mens of de natuurlijke ecosystemen van een verdere achteruitgang of zelfs het uitsterven van een groot deel van de kikkers is nog weinig bekend. Het verdwijnen van de kikkers heeft mogelijk een negatieve impact op de ontwikkeling van toekomstige medicijnen. Daarnaast zullen dieren die voornamelijk van kikkers leven het zeer moeilijk krijgen of ook verdwijnen.
Net als alle amfibieën zijn kikkers niet erg aaibaar en voelen koud, nat en slijmerig aan. Veel mensen hebben een uitgesproken hekel aan kikkers en vinden ze vies of zijn bang voor kikkers omdat ze onverwachts wegspringen of giftig zouden zijn. Mensen die bang zijn voor kikkers lijden aan Ranidafobie, indien de angst zich toespitst op pad-achtige exemplaren wordt gesproken van Bufonofobie. De meeste kikkers scheiden stoffen uit die bij contact de ogen of de slijmvliezen van de mond of neus irriteert, maar zijn verder ongevaarlijk.
In het dagelijks leven spelen kikkers een bescheiden rol vanwege de verborgen levenswijze. Slechts af en toe komen ze in Nederland en België weleens in het nieuws omdat een bouwproject of evenement geannuleerd wordt na het aantreffen van een zeldzame soort.
Kikkers bereiken soms het nieuws, bijvoorbeeld omdat er een onbekende soort is ontdekt, zoals de in 2003 ontdekte neuskikker. In 2007 haalden Japanse wetenschappers het wereldnieuws door de introductie van een doorzichtige kikker.[37]
Over de kikkers bestaan verschillende fabeltjes, mythes en broodjeaapverhalen. Enkele bekendere zijn:
Bepaalde kikkers spelen een rol in de biologische of medische sector. Een aantal soorten wordt gebruikt in biologielessen waarbij ze worden opengesneden om de anatomie te bestuderen. Hiervoor worden soorten gebruikt die algemeen voorkomen zoals de luipaardkikkers in de Verenigde Staten.
De eicellen van verschillende soorten tongloze kikkers worden onderzocht in de genetica. Een recente ontwikkeling is het kweken van kikkers met een meer doorzichtige huid, zodat ze voor de bestudering van de ontwikkeling van de eieren niet meer gedood hoeven worden. In vroegere tijden werd de klauwkikker gebruikt in een zwangerschapstest. Als de urine van een zwangere vrouw wordt geïnjecteerd onder de huid, gaat de kikker eitjes leggen, wat een betrouwbaar resultaat gaf.[39]
De door de huid uitgescheiden verbindingen worden onderzocht op mogelijke medische toepassingen. Het gif van een Zuid-Amerikaanse soort bevat een verbinding die kan worden gebruikt als pijnstiller. De stof heeft een sterkere werking dan morfine maar is minder verslavend.[14]
Niet alleen de giftige stoffen worden onderzocht, ook de antivirale en antibacteriële verbindingen die worden uitgescheiden ter bescherming zijn mogelijk bruikbaar in de geneeskunde.
Ons koude kikkerlandje is een term die wel gebruikt wordt voor en door Nederlanders. Kikkers zijn onderwerp van een aantal spreekwoorden en gezegdes en komen ook terug in allerlei culturen.
Een kikker speelt bijvoorbeeld een rol in het sprookje van de kikkerkoning, waarin een prinses die zich over haar tegenzin heen zet en de 'smerige' kikker kust, waarna deze in een prins verandert. Andere bekende kikkers zijn Kermit de Kikker en Kikker uit de boekenserie van Max Velthuijs.
Enkele voorbeelden van spreekwoorden en gezegdes waarin kikkers een rol spelen zijn:
Een bekend kinderliedje over kikkers, Daar zaten zeven kikkertjes van J.P. Heije (1843), begint als volgt:
De eerste amfibieën ontstonden tijdens het laat-Devoon toen soorten leefden als Ichthyostega, een salamanderachtig amfibie dat 370 miljoen jaar geleden op het land kroop.[14] De belangrijkste veranderingen die de Anura hebben ondergaan is het korter worden van het lichaam en het verliezen van de staart. Fossiele kikkers zijn over de hele wereld gevonden inclusief gebieden waar de Anura tegenwoordig niet meer voorkomen zoals Antarctica.
Gerobatrachus hottoni is een vrij recent (2008) ontdekte soort die uiterlijk een kruising was tussen een kikker en een salamander. Deze soort leefde 250 miljoen jaar geleden en had een gehoor dat lijkt op dat van de moderne salamanders, maar daarnaast een brede schedel die overeenkomsten vertoont met die van de hedendaagse kikkers.
De oudst bekende vorm van een op een kikker gelijkend amfibie is de soort Triadobatrachus massinoti die komt uit het Onder-Trias en is gevonden op het Afrikaanse eiland Madagaskar. Deze soort is ongeveer 250 miljoen jaar oud en had nog niet alle kenmerken die tegenwoordig aan kikkers worden toegeschreven.[40] Zo leek de schedel al wel op die van een kikker, breed en met grote oogopeningen maar had het dier ook kenmerken die niet gevonden worden bij de moderne amfibieën. Zo was het lichaam langer en het had meer wervels en niet-gefuseerde staartwervels. Dit in tegenstelling tot de moderne kikkers, waarvan de staartwervels versmolten zijn. Ook waren scheen- en kuitbeen nog niet gefuseerd, wat doet vermoeden dat Triadobatrachus geen beste springer was. Het dier wordt daarom als een voorloper van de moderne kikkers beschouwd.
Een andere fossiele kikker van ongeveer dezelfde leeftijd is Prosalirus bitis, deze soort werd ontdekt in 1985 in Arizona. Net zoals Triadobatrachus had ook deze soort geen sterk vergrote achterpoten. Hij bezat al wel het typische, gevorkte bekken dat net als bij de moderne soorten uit drie delen bestond .
De oudste soort die echt tot de kikkers mag worden gerekend is Vieraella herbsti uit het Jura. Deze soort heeft een leeftijd van 188 tot 213 miljoen jaar en is alleen bekend van een afdruk van de rug- en de buikzijde, beide van hetzelfde exemplaar dat ongeveer 33 millimeter lang was.[41] De soort Notobatrachus degiustoi is met een leeftijd van 155 tot 170 miljoen jaar iets jonger. Biologen zijn er nog niet uit of deze kikker verwant is aan de primitieve Leiopelma- soorten, of dat het dier behoort tot een zustergroep van de Anura en daarmee strikt genomen toch niet tot de kikkers kan worden gerekend.
Alle kikkers behoren tot de orde Anura (Fischer von Waldheim, 1813), vroeger werd de groep aangeduid met de naam Salientia (Merrem, 1820).
Kikkers zijn, net als alle dieren en planten, verdeeld in verschillende groepen, zoals families, onderfamilies en geslachten. Sommige families en geslachten zijn bekender dan andere; voorbeelden van bekende geslachten zijn de schijftongkikkers (Discoglossus), mantella's (Mantella) en de in Europa levende groene kikkers (Pelophylax). Bekendere families zijn de echte kikkers (Ranidae), de pijlgifkikkers (Dendrobatidae), de padden (Bufonidae) en de boomkikkers (Hylidae).
Een complicerende factor is het voortschrijdend inzicht door nieuwe ontdekkingen, ieder jaar worden weer nieuwe soorten ontdekt. Recentelijk (2008) zijn vliegende kikkers ontdekt op Sumatra, zeer kleine soorten die werden aangetroffen onder bladeren op Cuba en in Venezuela is een soort ontdekt die een verschrikkelijke stank verspreidt bij verstoring.[29] Regelmatig wordt bij bekende soorten een eigenschap ontdekt die eigenlijk niet bij de als verwant beschouwde soorten past zodat de soort uiteindelijk wordt ingedeeld binnen een nieuwe groep. Het gaat voornamelijk om genetische verschillen maar ook anatomische verschillen kunnen leiden tot andere inzichten.
Enkele soorten, zoals Ranitomeya imitator kennen zo veel variaties die totaal niet op elkaar lijken, dat lange tijd werd gedacht dat de diverse kleurvariaties tot verschillende soorten behoorden.
Al deze nieuwe of afwijkende soorten zullen worden ingepast binnen de huidige indeling van de kikkers wat onvermijdelijk zal leiden tot nieuwe splitsingen en een andere indeling. Een voorbeeld zijn de kikkers uit het geslacht Atelopus, die enige tijd als een aparte familie werden gezien (Atelopodidae). Tegenwoordig wordt deze groep weer tot de padden gerekend.
De kikkers zijn anno 2017 verdeeld over 56 families exclusief de fossiele of meer recentelijk uitgestorven families zoals de Rheobatrachidae. Eerder was de groep verdeeld in ongeveer dertig families waarvan enkele families zijn afgesplitst. Ook werden de families in drie onderordes verdeeld maar deze worden niet meer algemeen erkend vanwege de parafyletische verwantschappen. De grootste familie is de Craugastoridae met meer dan 800 soorten, de kleinste familie is de Rhinophrynidae, die slechts één soort telt, dit wordt wel monotypisch genoemd. De genoemde soorten en familie- aantallen veranderen echter regelmatig. Veruit de meeste soorten en groepen van soorten hebben geen Nederlandse naam.
Onderstaand een lijst van alle families van kikkers. De onderfamilies zijn niet opgenomen. Zie voor een uitgebreider overzicht van de verschillende families de lijst van families van kikkers.
Wapen van een deelgemeente van het Franse departement Seine-Maritime.
Wapen van Baloži
Wapen van Altenmoor
Wapen van Soual
De blauwe pijlgifkikker stond model voor het logo van Vuze, een Java BitTorrent
Templo Mayor in Mexico-Stad. Altaar van de padden (1470), een symbool voor water.
een van de vier hoofdpersonages van De wind in de wilgen is Toad, een pad.
Otto Marseus van Schrieck, Blaue Winde, Kröte und Insekten (1660) toont een etende pad.
Onderstaand enkele externe links voor meer informatie over kikkers waarvan enkele in het Engels.
Referenties
Kikkers (Anura) zijn een van de drie groepen van amfibieën, naast de salamanders (Caudata) en de wormsalamanders (Gymnophiona). Kikkers zijn hiervan verreweg de grootste groep; van de ongeveer 7790 soorten amfibieën behoort grofweg 88% tot de kikkers. Er zijn tegenwoordig ruim 6860 verschillende soorten kikkers beschreven. Kikkers hebben een vrijwel wereldwijde verspreiding en leven in sterk uiteenlopende habitats.
Kikkers behoren tot de gewervelde dieren, ze hebben vier poten maar geen staart en verschillen hiermee van de meeste andere amfibieën. Alle kikkers hebben een afgeplat, peervormig lichaam en uitpuilende ogen. De kop en bek zijn breed, de lange achterpoten zijn sterk gespierd en goed ontwikkeld. Kikkers zijn de enige dieren die een kwaakblaas hebben en hiermee soortspecifieke geluiden maken om elkaar te lokken. Net als andere amfibieën zijn kikkers koudbloedig, hierop is zowel de bloedsomloop als de ademhaling aangepast. Een aantal soorten houdt een zomerrust of winterslaap om erg warme respectievelijk koude jaargetijden te doorstaan.
De ontwikkeling van de larve tot volwassen kikker is uniek binnen de gewervelden. Kikkers doorlopen een volledige metamorfose waarbij de larve er totaal anders uitziet dan de volwassen kikker.
Kikkers eten een breed scala aan prooien, meestal kleine dieren als insecten en andere ongewervelden. De grotere soorten eten soms kleine gewervelden. Kikkers hebben daarnaast vele natuurlijke vijanden zoals vissen, vogels, zoogdieren en reptielen. Veel soorten worden direct of indirect bedreigd door de mens, een aantal soorten is hierdoor sterk bedreigd of uitgestorven.
Sinds 1985 is het aantal beschreven amfibieën met meer dan een derde toegenomen, dit geldt met name voor de kikkers. De indeling van de kikkers is door deze constante aanvoer van nieuwe inzichten sterk aan verandering onderhevig. Het feit dat sommige soorten pad worden genoemd is hier een voorbeeld van, dit heeft tegenwoordig geen wetenschappelijke basis meer. In dit artikel worden alle soorten daarom verder met kikker aangeduid.
Halelause padder (Anura, 'utan hale') er ein biologisk orden av amfibium som omfattar rundt 5000 artar froskar og padder. Ordenen er også kjend som halelause amfibium eller springpadder, og hadde tidlegare det vitskaplege namnet Salientia ('hoppande').
Inndelinga i froskar og padder er tradisjonell, og har ikkje noko med slektskap å gjera. Som regel vil amfibium ein kallar padder vera tilpassa eit tørrare miljø enn det våtare miljøet til dei ein kallar froskar. Dei har fått liknande utsjånad på grunn av konvergerande evolusjon. Typiske padder har ein kortare, tjukkare kropp og kortare føter enn froskar, gjerne også tjukkare og meir vortete hud enn dei glattare, fuktigare froskane.
Halelause padder er kjenneteikna av ein kort kropp utan hale. Dei har eit høvesvis stort og breitt hovud med brei munn og utståande auge. Paddene har lange, kraftige bakføter og symjehud mellom fem tær. Framføtene er derimot korte og har fire tær. Dei har ti ryggvirvlar, der den siste, kalla urostyl, er forlenga og omforma. Dei har få eller ingen ribbein.
Huda er tynn og slimete, ofte med mange kjertlar. Tunga til dyra er kleimen og gjerne festa framme i munnen.
Dei ulike artane finst i svært ulike utformingar, tilpassa svært ulike levesett. Dei minste artane blir nokre centimeter lange, medan goliatfrosken kan bli opptil 32 cm. Ein utdøydd froskeart, Beelzebufo ampinga, kunne bli over 40 centimeter lang.
Ein finn halelause padder frå rundt ekvator til nær polane, men dei lever ikkje i arktisk klima. Flest artar finn ein i tropisk regnskog. Men talet på halelause padder minkar dramatisk, og det ser ut til at mange av dei kan døy ut.
Som andre amfibium lever dei fleste halelause paddene store delar av livet i ferskvatn. Dei går gjennom fire livsstadium: Egg, rumpetroll, metamorfose og vaksen. Befruktning utanfor kroppen til mora er vanleg, og egga blir som regel lagde i roleg vatn, som pyttar, dammar og sjøar. Larvane, kjend somrumpetroll, utviklar seg i vatn. Dei har først ytre og seinare indre gjeller, og har ikkje bein, men ein kraftig hale til å symja med. Denne forsvinn etter at dei har utvikla bakbein, frambein og lunger.
Vaksne dyr er kjøtetarar og lever hovudsakleg av leddyr (som insekt), leddormar og sniglar. Dei kan bruka dei kraftige bakbeina til å hoppa med, medan den klistrete tunga kan slyngast ut for å fanga insekt.
Paddene kan uttrykka seg gjennom ulike lydsignal. Særleg hannane bruker kvekking til å markera territorium og lokka til seg hoer. Hjå mange artar har hannen, men ikkje hoa, kvekkeposar på halsen til å forsterka lyden.
På Madagaskar er det gjort funn av fossile, froskeliknande amfibium som er minst 220 millionar år gamle, frå tidsepoken trias. Men dei første heilt sikre fossila av halelause padder er rundt 150 millionar år gamla. Dessa er kjende som Archaeobatrachia, som tyder 'gamle froskar'. For rundt 50 millionar år sidan levde Neobatrachia, eller 'nye froskar'. Truleg var desse opphavet til dagens halelause froskar.
Halelause padder (Anura, 'utan hale') er ein biologisk orden av amfibium som omfattar rundt 5000 artar froskar og padder. Ordenen er også kjend som halelause amfibium eller springpadder, og hadde tidlegare det vitskaplege namnet Salientia ('hoppande').
Inndelinga i froskar og padder er tradisjonell, og har ikkje noko med slektskap å gjera. Som regel vil amfibium ein kallar padder vera tilpassa eit tørrare miljø enn det våtare miljøet til dei ein kallar froskar. Dei har fått liknande utsjånad på grunn av konvergerande evolusjon. Typiske padder har ein kortare, tjukkare kropp og kortare føter enn froskar, gjerne også tjukkare og meir vortete hud enn dei glattare, fuktigare froskane.
Springpadder eller haleløse padder er en orden som består av de haleløse amfibiene (frosker og padder). Det vitenskapelige navnet «Anura» er gresk og betyr uten hale. Springpaddene er den mest artsrike greinen av amfibier, og er særlig tallrike i tropene.
Disse dyrene har et stort hode og en stor munn. Deres bakbein er meget store, og gjør dem til ypperlige svømmere. På land brukes bakbeina som springbein. Mange av dem kan hoppe meget langt, men noen går likevel mer enn de hopper. Forlemmene har fire fingre, med små rudimenter av en femte, og baklemmene har fem tær, med små rudimenter av en sjette. Hovedregelen er at de mangler ribbein, men det finnes et par unntak hos mer primitive springpadder. Beinplater i huden kan forekomme. Halevirvlene hos voksne individer er vokst sammen til en enkelt knokkel, som kalles urostyle. Skjelettet er i det hele tatt temmelig redusert, og flere knokler er gått tapt, eller er smeltet sammen. Kraniet har mistet flere av knoklene, og underkjeven består av bare to bein. Tenner finnes bare i overkjeven, men noen kan mangle tenner også her. Hos voksne individer kan antall virvellegemer være redusert til kun fem, det minste antall hos noe virveldyr.
Springpadder er de eneste nålevende amfibier med trommehinne og mellomøre. De to andre amfibiegruppene, salamandere og ormepadder, har indre øre, men mangler både ytre og mellomøre. Frosker og padder er derfor de eneste amfibier som har nytte av en stemme.
De fleste springpadder har ytre befruktning. Hannen befinner seg oppå hunnen mens han sprøyter kjønnssekretet over eggene som hun legger. Imidlertid har noen av dem en slags indre befruktning, hvor hannens og hunnens kloakkåpninger kommer nær hverandre.
Eggene er små, og omgitt av en gelélignende substans. Springpaddene gjennomgår en lang utvikling frem til de er ferdig utvokst. Ut av eggene kommer rumpetroll som har lang hale. Etter hvert blir lemmene tydeligere, og de mister halen. Likevel finnes det flere unntak fra denne regelen. Noen gjennomgår hele utviklingen inne i egget og kommer ut ferdig utviklet (med det resultat at enkelte har mistet gjellene), og noen få arter føder levende unger.
Det er oppstått et utall forskjellige typer yngelomsorg. Noen springpadder bærer eggene på kroppen. Mest bemerkelsesverdig er en art som finnes i Australia, og som svelger eggene og gulper opp ungene når de er utviklet.
Springpadder deles inn i 31 familier, fordelt på tre underordner, se liste over familier av springpadder
Springpadder eller haleløse padder er en orden som består av de haleløse amfibiene (frosker og padder). Det vitenskapelige navnet «Anura» er gresk og betyr uten hale. Springpaddene er den mest artsrike greinen av amfibier, og er særlig tallrike i tropene.
Płazy bezogonowe (Anura) – rząd płazów obejmujący zwierzęta przypominające żabę. Obejmuje cztery podrzędy, do których zalicza się ponad 50 rodzin, w tym również żyjące w Polsce: żabowate, ropuchowate, ropuszkowate, rzekotkowate i grzebiuszkowate.
Płazy bezogonowe odróżniają się od pozostałych przedstawicieli gromady brakiem ogona, sylwetką krępą, zwartą (brak form „wężopodobnych”) i silnymi skocznymi kończynami tylnymi. Głowa płazów bezogonowych jest zazwyczaj duża, zaopatrzona w bardzo szeroki otwór gębowy. Oczy są wypukłe, wystające; gałki oczne mogą być wciągane w głąb oczodołów. Oko płaza bezogonowego ma 3 powieki: górną przyrośnięta i nieruchomą, dolną i przejrzystą powiekę dolną, zwaną migotką. Kształt źrenicy jest cechą systematyczną gromady. Większość Anura ma źrenicę eliptyczną lub okrągłą. U niektórych źrenica może przyjmować kształt serca lub wąskiej pionowej szczeliny. Po bokach głowy samca występują rezonatory, uchyłki jamy gębowo-gardzielowej, które umożliwiają wydawanie dźwięków wabiących samice (granie, rechotanie).
Mimo że u większości płazów bezogonowych występuje zapłodnienie zewnętrzne, obserwuje się u nich akt kopulacji zwany ampleksusem. U większości Anura jest to pozycja niezbędna do złożenia jaj przez samicę i wyrzucenia nasienia do wody przez samca. Kształt „pakietów” skrzeku jest cechą charakterystyczną i ułatwia dość trudną identyfikację tych zwierząt.
Szkielet płazów bezogonowych składa się z kręgosłupa, szkieletu kończyn i szkieletu czaszki.
Kręgosłup składa się z dziewięciu kręgów i kości ogonowej. Pierwszy kręg nosi nazwę dźwigacza albo atlasu. Na kręgu tym osadzona jest czaszka. Dźwigacz ma z przodu specjalny wyrostek, który wchodzi między dwie wypukłości czaszki (kłykcie potyliczne). W każdym kręgu możemy wyróżnić trzon oraz łuk. Poza tym każdy kręg ma wyrostki. Między trzonem i łukiem znajduje się kanał kręgowy, przez który przechodzi część systemu nerwowego, zwana rdzeniem kręgowym.
Szkielet nóg przednich składa się: z kości ramieniowej, kości przedramieniowej, kilku kości nadgarstka, kilku kości dłoni i czterech kości palców. Szkielet nóg przednich połączony jest z kręgosłupem przy pomocy pasa barkowego. Pas barkowy składa się z kilku kości; jedną z większych jest łopatka. W okolicy pasa barkowego po dolnej stronie ciała znajduje się złożony z kilku kości mostek. Szkielet nóg tylnych składa się: z kości udowej, kości przedudzia, kości stępu, złożonej najwyraźniej z dwóch zrośniętych ze sobą kości, z kilku kości stopy i kości pięciu palców.
Szkielet nóg tylnych połączony jest z kręgosłupem poprzez pas miednicowy, który składa się z kości biodrowej, ogonowej i kulszowej. Szkielet kończyny składa się z kości udowej i piszczelowej oraz kości stopy.
Czaszka płazów bezogonowych składa się z kilku kości. W tyle czaszki znajduje się duży otwór potyliczny, przez który mózg łączy się z rdzeniem kręgowym. Otwór ten otoczony jest dwiema kośćmi potylicznymi. Ku przodowi od otworu potylicznego znajdują się dwie wielkie kości czołowociemieniowe, dalej kości nosowe, przedszczękowe, szczękowe i skrzydłowe.
Rodziny współcześnie żyjących płazów bezogonowych[2]:
Wymienione rodziny klasyfikuje się w podrzędach. Starsze klasyfikacje wyróżniają cztery:
a nowsze – trzy podrzędy:
Płazy bezogonowe (Anura) – rząd płazów obejmujący zwierzęta przypominające żabę. Obejmuje cztery podrzędy, do których zalicza się ponad 50 rodzin, w tym również żyjące w Polsce: żabowate, ropuchowate, ropuszkowate, rzekotkowate i grzebiuszkowate.
Płazy bezogonowe odróżniają się od pozostałych przedstawicieli gromady brakiem ogona, sylwetką krępą, zwartą (brak form „wężopodobnych”) i silnymi skocznymi kończynami tylnymi. Głowa płazów bezogonowych jest zazwyczaj duża, zaopatrzona w bardzo szeroki otwór gębowy. Oczy są wypukłe, wystające; gałki oczne mogą być wciągane w głąb oczodołów. Oko płaza bezogonowego ma 3 powieki: górną przyrośnięta i nieruchomą, dolną i przejrzystą powiekę dolną, zwaną migotką. Kształt źrenicy jest cechą systematyczną gromady. Większość Anura ma źrenicę eliptyczną lub okrągłą. U niektórych źrenica może przyjmować kształt serca lub wąskiej pionowej szczeliny. Po bokach głowy samca występują rezonatory, uchyłki jamy gębowo-gardzielowej, które umożliwiają wydawanie dźwięków wabiących samice (granie, rechotanie).
Mimo że u większości płazów bezogonowych występuje zapłodnienie zewnętrzne, obserwuje się u nich akt kopulacji zwany ampleksusem. U większości Anura jest to pozycja niezbędna do złożenia jaj przez samicę i wyrzucenia nasienia do wody przez samca. Kształt „pakietów” skrzeku jest cechą charakterystyczną i ułatwia dość trudną identyfikację tych zwierząt.
Um anuro é qualquer membro de um grupo diversificado e amplamente carnívoro de anfíbios que compõem a ordem Anura (literalmente "sem cauda" no grego antigo). A ordem inclui sapos, rãs e pererecas (ou relas). O mais antigo fóssil "proto-anuro" apareceu no início do Triássico de Madagascar, mas a datação do relógio molecular sugere que suas origens podem se estender ainda mais para o Permiano, há 265 milhões de anos.[1] A maioria dos anuros adultos são caracterizados por um corpo curto, olhos salientes, língua inserida anteriormente, membro posterior mais longo do que anterior e a ausência de cauda.
A maioria das rãs tem um estilo de vida semi-aquático, mas move-se facilmente em terra saltando ou escalando. Tipicamente, depositam os seus ovos em poças de água, charcos ou lagos, e as suas larvas, chamadas de girinos, têm guelras e desenvolvem-se na água. Rãs adultas seguem uma dieta carnívora, constituída principalmente de artrópodes, anelídeos e gastrópodes. Os anuros são reconhecíveis pelo seu chamamento (coaxo), que pode ser ouvido durante a noite ou dia, principalmente durante a sua época de reprodução e/ou em dias com alta umidade.
Os anuros são amplamente distribuídos, indo desde os trópicos até regiões subárcticas, mas a maior concentração de diversidade de espécies está em florestas tropicais. Existem mais de 6.300 espécies registradas, representando cerca de 88% das espécies de anfíbios existentes. Eles também são uma das cinco ordens de vertebrados mais diversas. No entanto, populações de certas espécies estão em declínio significativo.
É feita por vezes uma distinção entre rãs e sapos baseando-se na sua aparência, provocada por evolução convergente entre os chamados sapos a ambientes secos no entanto, a distinção não tem base taxonómica. A única família com o nome exclusivamente de "sapo" é a Bufonidae, mas muitas outras espécies de outras famílias são chamados também de "sapos", e espécies do género de sapos Atelopus são conhecidas com rã-arlequim.
Cerca de 88% das espécies de anfíbios são classificadas na ordem Anura.[2] Isso inclui mais de 7.200 espécies em 55 famílias, das quais Craugastoridae (868 spp.), Hylidae 734 spp.), Microhylidae (700 spp.), e Bufonidae (628 spp.) são as mais ricas em número de espécies.[3]
O uso dos nomes comuns "rã", "sapo" e "perereca" não tem base taxonómica. De uma perspectiva taxonómica, todos os membros da ordem Anura são rãs, mas apenas os membros da família Bufonidae são considerados "sapos verdadeiros". O uso do termo "rã" em nomes comuns refere-se normalmente a espécies que são aquáticas ou semi-aquáticas com peles macias e/ou úmidas, e o termo "sapo" refere-se normalmente a espécies tendencialmente terrestres com pele seca e rugosa. Uma excepção é o sapo-de-barriga-de-fogo (Bombina bombina): enquanto que a sua pele é ligeiramente rugosa, prefere habitats úmidos.[4] Enquanto isso, "perereca" comumente refere-se às espécies que possuem discos adesivos nos dedos, como é o caso de Hylidae.[5] Na maior parte desse artigo, o termo "rã" será utilizado para se referir aos anuros em geral.
A ordem Anura inclui todas as rãs modernas e qualquer espécie fóssil que se enquadre na definição de anuro. As características dos adultos anuros incluem: nove ou menos vértebras pré-sacrais, a presença de um urostilo formado por vértebras fundidas, ausência de cauda, um ílio longo e inclinado para frente, membros anteriores mais curtos do que membros posteriores, rádio e ulna fundidos, tíbia e fíbula fundidos, ossos do tornozelo alongados, ausência de um osso pré-frontal, presença de uma placa hioide, língua sem suporte esquelético intrínseco, espaços linfáticos subcutâneos, e dois músculos extensores fixados à lente do olho.[6]
Sapos e rãs são classificados basicamente em três subordens: Archaeobatrachia, que inclui quatro famílias de rãs primitivas; Mesobatrachia, que incluem cinco famílias de rãs evolutivamente mais intermédias; e Neobatrachia, de longe o maior grupo, que contém as restantes 24 famílias de rãs "modernas", incluindo as espécies mais comuns de todo o mundo. A subordem Neobatrachia é depois dividida em Hyloidea e Ranoidea.[7] Esta classificação é baseada em características morfológicas tais como o número de vértebras, a estrutura da cintura escapular, e a morfologia dos girinos. Enquanto que esta classificação é amplamente aceita, relações entre famílias de rãs ainda são debatidas.[8]
Algumas espécies de anuros hibridizam prontamente. Por exemplo, a Pelophylax esculenta é um híbrido entre P. lessonae e P. ridibunda.[9] Da mesma forma, Bombina bombina e B. variegata também formam híbridos, no entanto, estes são menos férteis que seus pais, dando origem a uma zona híbrida onde os híbridos são prevalentes.[10]
As origens e as relações evolutivas entre os três grupos principais de anfíbios são muito debatidas. Uma filogenia molecular baseada na análise de DNA ribossômico datada de 2005 sugere que salamandras e cecílias estão mais intimamente relacionadas entre si do que com rãs e a divergência dos três grupos ocorreu no Paleozoico ou no início do Mesozoico, antes da divisão do supercontinente Pangeia e logo após sua divergência dos peixes com nadadeiras lobadas. Isso ajudaria a explicar a relativa escassez de fósseis de anfíbios do período anterior à divisão dos grupos.[11] Outra análise filogenética molecular conduzida em 2005 concluiu que os lissanfíbios surgiram pela primeira vez há cerca de 330 milhões de anos e que a hipótese da origem da monofilia com os Temnospondyli é mais confiável do que outras teorias. A subordem Neobatrachia parece ter se originado na África ou na Índia, as salamandras no leste da Ásia e os cecilianos na Pangeia tropical.[12] Outros pesquisadores, embora concordem com o principal objetivo deste estudo, questionaram a escolha dos pontos de calibração usados para sincronizar os dados. Eles propuseram que a data de diversificação lissamphibiana deveria ser colocada no Permiano, há um pouco menos de 300 milhões de anos, uma data em melhor acordo com os dados paleontológicos.[13] Um estudo adicional em 2011 usando táxons extintos e vivos amostrados para dados morfológicos, bem como dados moleculares, chegou à conclusão de que Lissamphibia é monofilético e que deve ser aninhado em Lepospondyli em vez de dentro Temnospondyli. O estudo postulou que a Lissamphibia se originou não antes do final do Carbonífero, há cerca de 290 a 305 milhões de anos. A divisão entre Anura e Caudata foi estimada como tendo ocorrido há 292 milhões de anos, um pouco mais tarde do que a maioria dos estudos moleculares sugere, com os cecilianos dividindo-se há cerca de 239 milhões de anos.[14]
Em 2008, Gerobatrachus hottoni, um temnospôndilo um batráquio ancestral com muitas características semelhantes às de rãs e salamandras, foi descoberto no Texas. Ele datava de 290 milhões de anos e foi considerado um elo perdido, um grupo tronco batráquio próximo ao ancestral comum de sapos e salamandras, de acordo com a hipótese amplamente aceita de que sapos e salamandras estão mais intimamente relacionados entre si (formando um clado chamado Batrachia) do que com cecílias.[15][16] No entanto, outros sugeriram que Gerobatrachus hottoni não possuía relação considerável com os anfíbios existentes.[17]
Salientia (do latim salere (salio), "saltar") é o nome do grupo total que inclui rãs modernas da ordem Anura, bem como seus parentes fósseis próximos, as "proto-rãs" ou "rãs-caule". As características comuns possuídas por essas proto-rãs incluem 14 vértebras pré-sacrais (as rãs modernas têm 8 ou 9), um longo e inclinado para frente ílio na pelve, a presença de um osso frontoparietal e uma mandíbula sem dentes. Os primeiros anfíbios conhecidos que foram mais intimamente relacionados com rãs do que salamandras são Triadobatrachus massinoti, do início do período Triássico de Madagascar (há cerca de 250 milhões de anos), e Czatkobatrachus polonicus, do Triássico Inferior da Polônia (aproximadamente a mesma idade que Triadobatrachus).[18] O crânio de Triadobatrachus é semelhante a uma rã, sendo largo com grandes órbitas oculares, mas o fóssil tem características que divergem das rãs modernas. Isso inclui um corpo mais longo com mais vértebras. A cauda possui vértebras separadas, ao contrário do urostilo ou cóccix fundido nas rãs modernas. Os ossos da tíbia e da fíbula também estão separados, sendo provável que Triadobatrachus não tenha sido um saltador eficiente.[18]
As primeiras "rãs verdadeiras" conhecidas que se enquadram na linhagem de anuros propriamente dita viveram todos no início do período Jurássico.[19][20] Uma dessas primeiras espécies de rã, Prosalirus bitis, foi descoberta em 1995 na Formação Kayenta do Arizona e data o início do Jurássico, tornando Prosalirus um pouco mais recente do que Triadobatrachus.[21] Prosalirus não tinha pernas muito aumentadas, mas tinha a estrutura de três pontas pélvicas típica das rãs modernas, assim como Triadobatrachus. Ao contrário de Triadobatrachus, Prosalirus tinha perdido quase toda sua cauda[22] e estava bem adaptado para saltar.[23] Outra rã do início do Jurássico é Vieraella herbsti, sendo conhecida apenas a partir de uma impressão dorsal e ventral de um único animal e foi estimada que medisse 33 mm do focinho à cloaca. Notobatrachus degiustoi do Jurássico Médio, é ligeiramente mais jovem, cerca de 155 a 170 milhões de anos. As principais mudanças evolutivas nesta espécie envolveram o encurtamento do corpo e a perda da cauda. A evolução do Anura moderno provavelmente foi concluída no período Jurássico. Desde então, as mudanças evolutivas no número de cromossomos ocorreram cerca de 20 vezes mais rápido nos mamíferos do que nas rãs, o que significa que a especiação está ocorrendo mais rapidamente em mamíferos.[24]
De acordo com estudos genéticos, as famílias Hyloidea e Microhylidae e o clado Natatanura (compreendendo cerca de 88% das rãs vivas) diversificaram-se simultaneamente há cerca de 66 milhões de anos, logo após o Cretáceo, associado ao impacto de Chicxulub. Todas as origens da arborização (por exemplo, em Hyloidea e Natatanura) seguem a partir dessa época.[25][26] Fósseis de rãs foram encontrados em todos os continentes da Terra.[27][28] Em 2020, foi anunciado que fósseis de 40 milhões de anos de sapos-de-capacete (Calyptocephalellidae) foram descobertos por uma equipe de paleontólogos na Ilha Seymour, na Península Antártica, indicando que esta região era outrora lar de sapos aparentados com aqueles que agora vivem na América do Sul.[29][30] O mais antigo registo fóssil completo de uma rã moderno é de Liaobatrachus, que viveu há 125 milhões de anos[31] e tinha todas as características das rãs modernas, mas tinha 9 vértebras pré-sacrais em vez das 8 de sapos modernos.[32]
Um cladograma mostrando as relações das diferentes famílias de rãs no clado Anura pode ser visto na tabela abaixo. Este diagrama, na forma de uma árvore, mostra como cada família de sapos está relacionada a outras famílias, com cada nó representando um ponto de ancestralidade comum. É baseado em Frost et al. (2006),[33] Heinicke et al. (2009)[34] e Pyron e Wiens (2011).[35]
A morfologia das rãs é única entre os anfíbios. Algumas características não são partilhadas por todas as cerca de 7000 espécies descritas de rãs. Contudo, algumas características gerais distinguem-nas de outros anfíbios. As rãs são normalmente bem equipadas para saltar, com longas patas posteriores e ossos do calcanhar alongados. Têm uma coluna vertebral curta, com menos do que dez vértebras livres e por ossos da cauda fundidos (urostilo ou cóccix), tipicamente resultando num fenótipo sem cauda em adultos.[36]
Como outros anfíbios, suas peles são altamente permeáveis, permitindo a entrada de oxigênio. Esta característica única permite que eles respirem através da pele.[37] Geralmente, as costelas estão ausentes, de modo que os pulmões são preenchidos pelo bombeamento bucal e uma rã privada de seus pulmões pode manter suas funções corporais sem eles.[38] Para que a pele sirva como órgão respiratório, ela deve permanecer úmida; isto faz com que as rãs sejam susceptíveis a várias substâncias que podem encontrar no meio ambiente, algumas das quais podem ser tóxicas e podem dissolver-se na película de água e passar para a corrente sanguínea. Esta pode ser uma das causas do declínio mundial das populações de rãs.[39][40]
As rãs variam amplamente em tamanho, desde 7,7 mm de Paedophryne amauensis de Papua-Nova Guiné,[41] até 32 cm de Conraua goliath da África Central.[42] Existem espécies pré-históricas extintas que atingiram tamanhos ainda maiores.[43]
A pele fica solta no corpo devido à falta de tecido conjuntivo laxo. As rãs têm três membranas palpebrais: uma é transparente para proteger os olhos debaixo d'água, e duas variam de translúcidas a opacas. Possuem um tímpano em cada lado da cabeça, que está envolvido na audição e, em algumas espécies, é coberto por pele. Os sapos verdadeiros não têm dentes, mas a maioria das rãs os tem, especificamente os dentes pedicelados, nos quais a coroa é separada da raiz por tecido fibroso, localizados na borda da mandíbula superior e os dentes vomerianos também estão no céu da boca. Não há dentes na mandíbula inferior e as rãs geralmente engolem a comida inteira. Os dentes são usados principalmente para agarrar a presa e mantê-la no lugar até engolir, um processo auxiliado pela retração dos olhos na cabeça.[44][2]
A estrutura dos pés e das pernas varia muito entre as espécies de rãs, dependendo em parte onde vivem, se no solo, na água, nas árvores ou em tocas. As rãs devem ser capazes de se mexer rapidamente através do seu ambiente para apanhar presas e escapar aos predadores, tendo numerosas adaptações que os ajudam a fazê-lo. A maioria das rãs é proficiente em pular ou descende de ancestrais que o eram, com grande parte da morfologia musculoesquelética modificada para esse propósito.[45] A tíbia, a fíbula e os tarsais foram fundidos em um único osso forte, assim como o rádio e a ulna nos membros anteriores (que devem absorver o impacto na aterrissagem).[46] Os metatarsais tornaram-se alongados para aumentar o comprimento da perna e permitir que as rãs empurrem o solo por um período mais longo na decolagem. O ílio se alongou e formou uma articulação móvel com o sacro que, em saltadores especializados como ranídeos e hilídeos, funciona como uma articulação de membro adicional para impulsionar ainda mais os saltos. As vértebras da cauda se fundiram em um urostilo que é retraído para dentro da pelve, o que permite que a força seja transferida das pernas para o corpo durante um salto.[45]
O sistema muscular foi modificado de forma semelhante. Os membros posteriores das rãs ancestrais presumivelmente continham pares de músculos que atuariam em oposição (um músculo para flexionar o joelho, um músculo diferente para estendê-lo), como é visto na maioria dos outros animais com membros. No entanto, nas rãs modernas, quase todos os músculos foram modificados para contribuir com a ação de pular, restando apenas alguns pequenos músculos para trazer o membro de volta à posição inicial e manter a postura. Os músculos também foram bastante aumentados, com os principais músculos da perna respondendo por mais de 17% da massa total das rãs.[47]
Muitas rãs, especialmente as que vivem na água, têm dedos ligados por membranas. O grau a que os dedos dos pés estão ligados é directamente proporcional à quantidade de tempo que a espécie vive na água. Por exemplo, a espécie completamente aquática Hymenochirus sp. tem dedos totalmente ligados pela membrana, enquanto que os dedos dos pés da rã-arborícola-de-white (Litoria caerulea), uma espécie arbórea, tem membrana apenas até a um quarto ou metade do dedo.[48] Membros da família Leptodactylidae, apesar de serem aquáticas, não possuem essa membrana interdigital.
Rãs-arborícolas, ou pererecas, têm "ventosas" para ajudar a agarrar superfícies verticais. Estas ventosas, localizadas na ponta dos dedos, não funcionam por sucção. Ao invés disso, a superfície das ventosas consiste de células interligadas, com um pequeno espaço entre células adjacentes. Quando a rã aplica pressão, as células aderem a irregularidades na superfície e a aderência é mantida durante a tensão superficial. Isto permite que as rãs se agarrem a superfícies lisas, e não funciona quando as ventosas estão demasiado molhadas.[49]
Em muitas rãs-arborícolas, uma "estrutura intercalar" pequena em cada dedo do pé aumenta a área da superfície que toca no substrato. Além disso, uma vez que saltar em árvores pode ser perigoso, muitas rãs arborícolas tem ancas que permitem tanto saltar como andar. Algumas rãs que vivem alto nas árvores possuem membranas interdigitais entre os dedos das patas traseiras até certo grau, tal como as rãs aquáticas. Nestas rãs arbóreas, as membranas permitem que as rãs planem de uma posição na canópia até outra.[50]
Rãs terrestres geralmente não têm as adaptações das rãs aquáticas e arborícolas. A maioria tem tubérculos menores, e membranas pequenas ou ausentes. Algumas rãs subterrâneas tem uma extensão no dedo do pé — um tubérculo do metatarso — que os ajudam a escavar. As patas posteriores das espécies terrestres são mais musculadas que as de espécies aquáticas ou arbóreas.[51]
Por vezes, durante o estádio de girino, uma das patas traseiras do animal é comido por uma larva de libelinha. Em alguns destes casos, a perna inteira cresce de qualquer modo, enquanto que em outros casos, isso não acontece, apesar da rã conseguir viver o seu tempo de vida normal com apenas três pernas. Em outras ocasiões, um verme chamado Ribeiroia penetra num girino, onde rearranja a células precursoras dos membros, o que causa por vezes o surgimento de pernas extras.[52]
A pele da rã é protetora, tem função respiratória, pode absorver água e ajuda a controlar a temperatura corporal. A pele possui muitas glândulas, principalmente na cabeça e nas costas, que frequentemente exalam substâncias tóxicas e desagradáveis (glândulas granulares); estas secreções geralmente são pegajosas e ajudam a manter a pele úmida, protegem contra a entrada de fungos e bactérias e tornam o animal escorregadio e mais capaz de escapar de predadores.[53] A pele é trocada a cada poucas semanas. Geralmente se divide no meio das costas e na barriga, e a rã solta seus braços e pernas. A pele descascada é então trabalhada em direção à cabeça, onde é rapidamente comida.[54]
Por terem sangue frio, as rãs precisam adotar padrões de comportamento adequados para regular sua temperatura. Para se aquecer, eles podem se mover para o sol ou para uma superfície quente; se superaquecerem, podem se mover para a sombra ou adotar uma postura que exponha ao ar uma área mínima da pele. Essa postura também é usada para evitar a perda de água e envolve o sapo de cócoras próximo ao substrato, com as mãos e os pés enfiados sob o queixo e o corpo.[55] A cor da pele da rã é usada para termorregulação. Em condições frias e úmidas, a cor será mais escura do que em um dia quente e seco. Chiromantis xerampelina pode até ficar branca para minimizar a chance de superaquecimento.[56]
Muitas rãs são capazes de absorver água e oxigénio directamente através da pele, especialmente à volta da zona pélvica, contudo, a permeabilidade da pele de uma rã pode também resultar em perda de água. As glândulas localizadas por todo o corpo exalam muco que ajuda a manter a pele úmida e reduz a evaporação. Algumas glândulas nas mãos e no tórax dos machos são especializadas em produzir secreções pegajosas para ajudar no amplexo. Glândulas semelhantes em pererecas produzem uma substância semelhante a cola nos discos adesivos dos pés. Algumas rãs arbóreas reduzem a perda de água por terem uma camada de pele à prova d'água, e várias espécies da América do Sul revestem sua pele com uma secreção cerosa. Outras têm comportamentos adaptados à conservação de água, incluindo actividades nocturnas e descansar em posições que conservam água. Algumas espécies de rã também descansam em grupos grandes, tocando a pele de uma rã vizinha. Isto reduz a quantidade de pele exposta ao ar ou a uma superfície seca, e por isso reduz a perda de água.[55] Estas adaptações apenas reduzem a perda de água em quantidade suficiente para uma existência predominantemente arbórea, e não são suficientes para condições áridas.[57]
A camuflagem é um mecanismo de defesa comum entre as rãs. A maioria das rãs camufladas são noturnas, o que soma à sua capacidade de se esconderem. Rãs noturnas normalmente encontram a posição ideal para se camuflarem durante o dia para dormirem. Algumas rãs têm a capacidade de mudar de cor, mas isto é normalmente restringido a tons de uma ou duas cores. Por exemplo, a rã-arborícola-de-white varia em tons de verde e castanho. Características tais como verrugas e dobras de pele são usualmente encontradas em rãs terrestres, onde uma pele lisa não os conseguiria disfarçar efectivamente.[57][58] Algumas rãs mudam de cor entre a noite e o dia, pois a luz e umidade estimulam as células pigmentares e causam a sua expansão e contracção.[57]
A pele de uma rã é permeável ao oxigénio e dióxido de carbono, bem como à água. Existem vasos sanguíneos próximos à superfície da pele e, quando uma rã está debaixo d'água, o oxigênio se difunde diretamente para o sangue. Quando não submersa, a rã respira por um processo conhecido como bombeamento bucal. Seus pulmões são semelhantes aos dos humanos, mas os músculos do peito não estão envolvidos na respiração e não existem costelas ou diafragma para ajudar a mover o ar para dentro e para fora. Em vez disso, rãs respiram tomando ar pelas narinas, que em muitas espécies podem ser fechadas por válvulas, fazendo com que a garganta sopre para fora. Quando o assoalho da boca é comprimido, o ar é forçado para os pulmões.[59] A rã aquática Barbourula kalimantanensis é a primeira espécie de anuro conhecido por não ter pulmões.[60]
As rãs, como todos os anfíbios, têm coração de três câmaras, uma característica que compartilham com os répteis (exceto os crocodilos). O sangue oxigenado dos pulmões e o sangue não-oxigenado dos tecidos respiratórios entram no coração por meio de aurículas separadas. Quando essas câmaras se contraem, as duas correntes sanguíneas passam para um ventrículo comum, antes de serem bombeadas por uma válvula em espiral para o vaso apropriado - a aorta (para o sangue oxigenado), e a artéria pulmonar (para o sangue desoxigenado).[61] O ventrículo é parcialmente dividido em cavidades estreitas, o que minimiza a mistura dos dois tipos de sangue. Esta estrutura especial permite que as rãs tenham uma taxa metabólica mais alta e sejam mais activas.[62]
Algumas espécies de rãs têm adaptações que lhes permitem sobreviver em águas com pouco oxigénio. Telmatobius culeus é uma dessas espécies, e tem a pele enrugada que aumenta sua área de superfície para aumentar as trocas gasosas. Normalmente não faz uso de seus pulmões rudimentares, mas às vezes levanta e abaixa seu corpo ritmicamente enquanto está no leito do lago para aumentar o fluxo de água ao seu redor.[63]
Rãs têm dentes superiores ao longo da mandíbula superior, usados para segurar o alimento antes de engolir. Estes dentes são muito fracos, e não podem ser usado para mastigar, pegar e ferir presas ágeis. Em vez disso, a rã usa a sua língua pegajosa e fendida para apanhar moscas e outras pequenas presas em movimento. As rãs marsupiais de Gunther (Gastrotheca guentheri) são as únicas com dentes verdadeiros em ambas as mandíbulas.[64] A língua normalmente é inserida anteriormente, na parte da frente da boca. Algumas rãs não têm língua e apenas enfiam comida na boca com as mãos. O alimento capturado então move-se através do esófago até ao estômago. Os olhos auxiliam na deglutição dos alimentos, pois podem ser retraídos através de orifícios no crânio e ajudam a empurrar os alimentos pela garganta. A comida então se move através do esôfago para o estômago, onde as enzimas digestivas são adicionadas e são agitadas. Em seguida, segue para o intestino delgado (duodeno e íleo), onde ocorre a maior parte da digestão. O suco pancreático do pâncreas e a bile, produzida pelo fígado e armazenada na vesícula biliar, são secretados no intestino delgado, onde os fluidos digerem os alimentos e os nutrientes são absorvidos. Os resíduos alimentares passam para o intestino grosso, onde o excesso de água é removido e os resíduos são eliminados pela cloaca.[65]
Embora adaptadas à vida terrestre, as rãs se assemelham aos peixes de água doce em sua incapacidade de conservar a água corporal de forma eficaz. Quando estão em terra, muita água é perdida por evaporação da pele. O sistema excretor é semelhante ao dos mamíferos e existem dois rins que removem produtos nitrogenados do sangue. As rãs produzem grandes quantidades de urina diluída para eliminar os produtos tóxicos dos túbulos renais.[66] O nitrogênio é excretado como amônia por girinos e rãs aquáticas, mas principalmente como ureia, um produto menos tóxico, pela maioria dos adultos terrestres.[66] Em contraste, algumas espécies de pererecas com pouco acesso à água excretam o ainda menos tóxico ácido úrico.[67] A urina passa ao longo dos ureteres emparelhados para a bexiga urinária, de onde é liberada periodicamente para a cloaca. Todos os resíduos corporais saem do corpo através da cloaca que termina em uma abertura cloacal.[65]
O sapo tem um sistema nervoso altamente desenvolvido, que consiste em um cérebro, medula espinhal e nervos. Muitas partes do cérebro da rã correspondem às presentes nos seres humanos. É constituída por dois lobos olfativos, dois hemisférios cerebrais, um corpo pineal, dois lobos ópticos, um cerebelo e uma medula oblonga. A coordenação muscular e a postura são controladas pelo cerebelo e a medula oblonga regula a respiração, a digestão e outras funções automáticas. O tamanho relativo do cérebro em sapos é muito menor do que em humanos. As rãs têm dez pares de nervos cranianos que passam informações de fora diretamente para o cérebro, e dez pares de nervos espinhais que passam informações das extremidades para o cérebro através da medula espinhal.[65] Em contraste, todos os amniotas (mamíferos, pássaros e répteis) têm doze pares de nervos cranianos.[68]
Os olhos da maioria das rãs estão localizados em cada lado da cabeça perto do topo e se projetam para fora como protuberâncias hemisféricas. Eles fornecem visão binocular em um campo de 100° para a frente e um campo visual total de quase 360°.[69] Eles podem ser a única parte de uma rã submersa a se projetar da água. Cada olho tem pálpebras superiores e inferiores que podem ser fechadas e uma membrana nictitante que fornece proteção adicional, especialmente quando o sapo está nadando.[55] Membros da família aquática Pipidae têm os olhos localizados no topo da cabeça, uma posição mais adequada para detectar presas na água acima.[69] As íris vêm em uma variedade de cores e as pupilas em uma variedade de formas. O sapo-comum (Bufo bufo) tem íris douradas e pupilas em fenda horizontal, a rã de olhos vermelhos (Agalychnis callidryas) tem pupilas verticais, a rã venenosa tem íris escuras, o sapo-de-barriga-de-fogo (Bombina bombina) tem pupilas triangulares e o sapo-tomate (Dyscophus spp.) tem pupilas circulares. As íris do sapo-do-sul (Anaxyrus terrestris) são padronizadas de modo a se misturar com a pele camuflada circundante.[55] A visão distante de uma rã é melhor do que a visão próxima. Além disso, as rãs podem ver em cores, mesmo com luz muito baixa.[70]
O chamado ou coaxar de uma rã é exclusivo a sua espécie. As rãs criam esse som ao passar o ar pela laringe na garganta. Na maioria das rãs que vocaliza, o som é amplificado por um ou mais sacos vocais, membranas de pele sob a garganta ou no canto da boca, que se distendem durante a amplificação do chamado. Algumas vocalizações de sapos são tão altas que podem ser ouvidas a até um quilômetro de distância.[71] Além disso, algumas espécies utilizam estruturas feitas por humanos, como tubos de drenagem para amplificação artificial de sua chamada.[72]
As rãs dos géneros Heleioporus e Neobatrachus não possuem sacos vocais, mas ainda produzir um chamamento alto. Sua cavidade bucal é alargada e em forma de cúpula, atuando como uma câmara de ressonância que amplifica o som. Espécies de rã que não têm bolsas vocais e que não têm um chamado alto tendem a habitar áreas próximas a água corrente constantemente barulhenta, necessitando de um meio alternativo para a comunicação.
O principal motivo do chamado é permitir que os sapos machos atraiam uma parceira. Os machos podem chamar individualmente ou em grupo, formando um coro. As fêmeas de muitas espécies de rãs, como Polypedates leucomystax, respondem aos chamados dos machos, que atuam para reforçar a atividade reprodutiva em uma colônia de reprodução.[73] As rãs fêmeas preferem machos que produzem sons de maior intensidade e menor frequência, atributos que se destacam na multidão.
Rãs da espécie Atelopus franciscus apesar de não terem tímpanos ou sacos vocais emitem chamamentos específicos muito simples e conseguem discriminar o chamamento de interspecíficos a distãncias inferiores a 8 m.[74]
Um chamado diferente é emitido por uma rã (macho ou fêmea) não receptiva quando montada por outro macho. Este é um som distinto e é acompanhado por uma vibração do corpo. As pererecas e algumas espécies não aquáticas têm um chamado de chuva que fazem com base nos sinais de umidade antes de uma chuva. Muitas espécies também têm uma chamada territorial que é usada para afugentar outros machos.[75] Todas essas chamadas são emitidas com a boca da rã fechada.[76] Um chamado de socorro, emitido por algumas rãs quando estão em perigo, é produzido com a boca aberta, resultando em um chamado mais agudo. É normalmente usado quando o sapo foi agarrado por um predador e pode servir para distrair ou desorientar o atacante para que ele solte o sapo.[75] Muitas espécies de rãs têm coaxos profundos.
Diferentes espécies de rãs usam vários métodos de locomoção, incluindo saltar, correr, andar, planar e nadar.
Os anuros são geralmente reconhecidos como saltadores excepcionais e, em relação ao seu tamanho, os melhores saltadores de todos os vertebrados.[77] A rã australiana Litoria nasuta pode saltar 50 vezes o comprimento do seu corpo (5.5 cm), resultando em saltos de mais de dois metros. A aceleração do salto pode ir até duas vezes a força da gravidade.[78] Há diferenças brutais entre espécies em termos de capacidade de saltar, mas dentro de uma espécie, a distância dos saltos aumenta proporcionalmente ao aumento de tamanho do corpo, mas a distância relativa do salto (quantas vezes o salto ultrapassa o comprimento do corpo) diminui.[79]
Em alguns saltadores extremamente capazes, tais como a Osteopilus septentrionalis e Rana pipiens, o pico da potência exercida durante um salto pode exceder o que um músculo é teoricamente capaz de produzir. Quando os músculos se contraem, a energia é primeiro transferida para o tendão alongado, que envolve o osso do tornozelo. Em seguida, os músculos se alongam novamente ao mesmo tempo que o tendão libera sua energia como uma catapulta para produzir uma poderosa aceleração além dos limites da aceleração impulsionada pelos músculos.[80]
As rãs das famílias Bufonidae, Rhinophrynidae e Microhylidae têm patas traseiras curtas e tendem a andar em vez de pular.[81] Quando tentam se mover rapidamente, aceleram a taxa de movimento de seus membros ou recorrem a uma marcha desajeitada e saltitante. Phlyctimantis maculatus tem membros posteriores curtos e finos, inadequados para pular. Ele pode se mover rapidamente usando uma marcha em que as duas patas traseiras são usadas alternadamente. A fotografia em câmera lenta mostra que, ao contrário de um cavalo que pode trotar ou galopar, o andar do sapo permaneceu semelhante em velocidades lenta, média e rápida.[82] Esta espécie também pode subir em árvores e arbustos, e o faz à noite para pegar insetos.[83]
Algumas rãs se adaptaram para cavar e viver no subsolo. Eles tendem a ter corpos arredondados, membros curtos, cabeças pequenas com olhos salientes e patas traseiras adaptadas para escavação. Um exemplo extremo disso é o sapo roxo (Nasikabatrachus sahyadrensis) do sul da Índia, que se alimenta de cupins e passa quase toda a sua vida no subsolo. Ele surge brevemente durante a monção para acasalar e procriar em poças temporárias. Tem uma cabeça minúscula com um focinho pontudo e um corpo rechonchudo e arredondado.[84]
As rãs que vivem ou visitam a água têm adaptações que melhoram suas habilidades de natação. Os membros posteriores são fortemente musculosos e fortes. A membrana entre os dedos dos pés traseiros aumenta a área do pé e ajuda a impulsionar a rã com força na água. Os membros da família Pipidae são totalmente aquáticos e mostram a especialização mais marcada, com colunas vertebrais inflexíveis, corpos achatados e aerodinâmicos, sistemas de linha lateral e membros posteriores poderosos com grandes pés palmados.[85] A maioria dos girinos tem grandes nadadeiras de cauda que fornecem impulso quando a cauda é movida de um lado para o outro.[86]
Muitas pererecas vivem no alto de copas, onde se arrastam pelos galhos e folhas, às vezes nunca descendo à terra. As "verdadeiras" pererecas pertencem à família Hylidae, mas membros de outras famílias de rãs adotaram independentemente um hábito arbóreo, um caso de evolução convergente. Estes incluem os sapos-de-vidro (Centrolenidae), os sapos-do-mato (Hyperoliidae), alguns dos sapos de boca estreita (Microhylidae) e os Rhacophoridae.[81] A maioria das pererecas tem menos de 10 cm de comprimento, com pernas longas e dedos longos com almofadas adesivas nas pontas. A superfície das almofadas dos pés é formada por uma camada compacta de células hexagonais epidérmicas separadas por sulcos nos quais as glândulas secretam muco. Essas almofadas dos pés, umedecidas pelo muco, proporcionam aderência em qualquer superfície molhada ou seca, incluindo o vidro. As forças envolvidas incluem o limite de atrito da epiderme na superfície e também tensão superficial e viscosidade.[87] Alguns membros da subfamília Phyllomedusinae têm dedos opositores em seus pés. A perereca-de-folhagem-com-perna-reticulada (Phyllomedusa ayeaye) tem um único dedo opositor em cada pata dianteira e dois nas patas traseiras.[88]
Durante a história evolutiva das rãs, vários grupos diferentes independentemente se adaptaram para planar.[89] Algumas rãs que habitam florestas tropicais são especialmente adaptadas para planar de árvore em árvore ou saltar de "pára-quedas" no solo da floresta. Um exemplo é o sapo-voador-de-wallace (Rhacophorus nigropalmatus), uma das poucas espécies de anuros que são capazes de planar, graças as suas grandes membranas interdigitais.[90]
Como outros anfíbios, o ciclo de vida de uma rã normalmente começa na água, com um ovo que eclode em uma larva sem membros com guelras, comumente conhecida como girino. Após um crescimento adicional, durante o qual desenvolve membros e pulmões, o girino sofre metamorfose na qual sua aparência e órgãos internos são reorganizados. Depois disso, ele é capaz de sair da água como uma pequena rã que respira ar.
Dois tipos principais de reprodução ocorrem nas rãs, a reprodução prolongada e a reprodução explosiva. Na primeira, adotada pela maioria das espécies, as rãs adultas em certas épocas do ano se reúnem em um lago, brejo ou riacho para se reproduzir. Muitas rãs voltam aos mesmos corpos d'água nos quais se desenvolveram como girinos, o que geralmente resulta em migrações anuais envolvendo milhares de indivíduos. Na reprodução explosiva, que se estende por poucos dias, machos e fêmeas praticamente chegam juntos ao local de reprodução, formando um grande grupo de indivíduos reunidos. Geralmente essas espécies se acasalam após as primeiras chuvas fortes do ano.[91]
Na reprodução prolongada, os machos geralmente chegam primeiro ao local de reprodução e permanecem lá por algum tempo, enquanto as fêmeas tendem a chegar mais tarde e partem logo após a desova. A principal característica da reprodução prolongada é a escolha da fêmea. Os machos costumam sentar-se em territórios demarcados e usar vocalizações para atrair as fêmeas. As vocalizações que os machos emitem geralmente conferem algumas informações sobre suas características físicas;[92] as fêmeas selecionam seus companheiros, pelo menos em parte, com base na profundidade de sua voz.[93] Em algumas espécies, existem machos satélites que não têm território e não vocalizam. Eles podem interceptar mulheres que estão se aproximando de um macho vocalizador ou assumir um território desocupado. A vocalização é uma atividade que esgota a energia e, às vezes, os dois papéis se invertem e um macho que vocaliza abre mão de seu território e se torna um satélite.[94]
A reprodução explosiva é comum a muitos sapos, principalmente da família Bufonidae.[92] Neste tipo de reprodução, os adultos maduros chegam aos criadouros em resposta a certos fatores desencadeantes, como a ocorrência de chuvas em áreas áridas. O acasalamento e a desova ocorrem prontamente e a velocidade de crescimento larval é rápida para fazer uso das poças efêmeras antes que sequem.[94] A seleção do parceiro e o cortejo não são tão importantes quanto a velocidade na reprodução. Em alguns anos, as condições adequadas podem não ocorrer e as rãs podem ficar dois ou mais anos sem procriar.[94] Algumas fêmeas de Spea multiplicata só desovam metade dos ovos disponíveis de cada vez, talvez retendo alguns para o caso de uma oportunidade reprodutiva melhor surgir mais tarde.[95]
No local de reprodução, o macho monta na fêmea e a agarra com força em volta do corpo. Normalmente, o amplexo ocorre na água, a fêmea libera seus óvulos e o macho os cobre com esperma; a fertilização é externa. Em muitas espécies, como Bufo cognatus, o macho restringe os ovos com as patas traseiras, mantendo-os no lugar por cerca de três minutos.[94] Os membros do gênero Nimbaphrynoides da África Ocidental são únicos entre os sapos por serem vivíparos; Limnonectes larvaepartus, Eleutherodactylus jasperi e membros do gênero Nectophrynoides da Tanzânia são as únicas rãs conhecidas como ovovivíparas. Nessas espécies, a fertilização é interna e as fêmeas dão à luz rãs juvenis totalmente desenvolvidas, exceto L. larvaepartus, que dá à luz girinos.[96]
Embriões de rãs são tipicamente cercados por várias camadas de material gelatinoso, que fornece suporte e proteção ao permitir a passagem de oxigênio, dióxido de carbono e amônia, absorvendo a umidade e inchando em contato com a água. Após a fertilização, a porção mais interna se liquifica para permitir a livre movimentação do embrião em desenvolvimento. Em certas espécies, como a rã-de-perna-vermelha-do-norte (Rana aurora) e a rã-da-floresta (Rana sylvatica), algas verdes unicelulares simbióticas estão presentes no material gelatinoso. Acredita-se que eles possam beneficiar as larvas em desenvolvimento, fornecendo-lhes oxigênio extra por meio da fotossíntese.[97] Os ovos são majoritariamente pretos ou marrom escuro, o que os dá a vantagem de absorver o calor do sol, que é retido por uma cápsula isolante. O interior dos aglomerados de ovos globulares da rã-da-floresta (Rana sylvatica) pode ser até 6°C mais quente do que a água circundante, o que acelera o desenvolvimento das larvas.
A forma e o tamanho da massa de ovos são característicos da espécie. Os ranídeos tendem a produzir aglomerados globulares contendo um grande número de ovos, enquanto os bufonídeos produzem longas cordas cilíndricas. A pequena Eleutherodactylus limbatus põe os ovos individualmente, enterrando-os em solo úmido.[98] A rã-defumada-da-selva (Leptodactylus pentadactylus) faz um ninho de espuma em uma cavidade; os ovos eclodem quando o ninho é inundado, ou os girinos podem completar seu desenvolvimento nessa espuma se não ocorrer inundação.[99] A rã de olhos vermelhos (Agalychnis callidryas) deposita seus ovos em uma folha acima de um lago e, quando eclodem, as larvas caem na água abaixo.[100] As larvas que se desenvolvem nos ovos podem detectar vibrações causadas por vespas ou cobras predadoras próximas e eclodirão cedo para evitar serem comidas.[101] Em geral, o comprimento da fase de ovo depende da espécie e das condições ambientais. Os ovos aquáticos normalmente eclodem dentro de uma semana, quando a cápsula se divide como um resultado de enzimas liberadas pelas larvas em desenvolvimento.[94]
As larvas que emergem dos ovos, conhecidas como girinos, normalmente têm corpos ovais e caudas longas e achatadas verticalmente. Como regra geral, as larvas de vida livre são totalmente aquáticas, mas pelo menos uma espécie (Nannophrys ceylonensis) tem girinos semiterrestres que vivem entre rochas molhadas,[102][103] Os girinos não têm pálpebras e têm esqueletos cartilaginosos, sistemas de linha lateral, brânquias para a respiração (brânquias externas primeiro, brânquias internas depois) e caudas achatadas verticalmente que usam para nadar.[81]
Desde o início de seu desenvolvimento, uma bolsa de guelras cobre as guelras e as patas dianteiras do girino. Os pulmões logo começam a se desenvolver e são usados como um órgão respiratório acessório. Algumas espécies passam por metamorfose ainda dentro do ovo e eclodem diretamente em pequenas rãs. Os girinos não têm dentes verdadeiros, mas as mandíbulas na maioria das espécies têm duas fileiras paralelas e alongadas de pequenas estruturas queratinizadas chamadas queradontes em suas mandíbulas superiores. Suas mandíbulas inferiores geralmente têm três fileiras de queradontes rodeadas por um bico córneo, mas o número de fileiras pode variar e os arranjos exatos das partes da boca fornecem um meio de identificação da espécie.[94] Em Pipidae, com exceção de Hymenochirus, os girinos têm barbilhões anteriores emparelhados, o que os torna semelhantes a pequenos bagres.[85] Suas caudas são enrijecidas por um notocórdio, mas não contém quaisquer elementos ósseos ou cartilaginosos, exceto por algumas vértebras na base que formam o urostilo durante a metamorfose. Isso foi sugerido como uma adaptação a seus estilos de vida; como a transformação em sapos é muito rápida, a cauda é feita apenas de tecido mole, pois o osso e a cartilagem demoram muito mais para serem quebrados e absorvidos. A barbatana e a ponta da cauda são frágeis e rasgam facilmente, o que é visto como uma adaptação para escapar de predadores que tentam agarrá-los pela cauda.[104]
Os girinos são tipicamente herbívoros, alimentando-se principalmente de algas, incluindo diatomáceas filtradas da água pelas guelras. Algumas espécies são carnívoras no estágio de girino, comendo insetos, girinos menores e peixes. A perereca cubana (Osteopilus septentrionalis) é uma das várias espécies em que os girinos podem ser canibais. Os girinos que desenvolvem pernas precocemente podem ser comidos pelos outros, então desenvolvedores tardios podem ter melhores perspectivas de sobrevivência a longo prazo.[105]
No final da fase de girino, as rãs sofrem metamorfose, em que transitam para a forma adulta. Esta metamorfose geralmente dura apenas 24 horas e é iniciada pela produção do hormônio tiroxina. Isso faz com que diferentes tecidos se desenvolvam de maneiras diferentes. As principais mudanças que ocorrem incluem o desenvolvimento dos pulmões e o desaparecimento das guelras e da bolsa branquial, tornando visíveis as patas dianteiras. A mandíbula inferior se transforma na grande mandíbula do adulto carnívoro, e o intestino longo e espiral do girino herbívoro é substituído pelo intestino curto típico de um predador.[94] O sistema nervoso torna-se adaptado para audição e visão estereoscópica e para novos métodos de locomoção e alimentação.[94] Os olhos são reposicionados mais acima na cabeça e as pálpebras e as glândulas associadas são formadas. O tímpano, o ouvido médio e o ouvido interno são desenvolvidos. A pele fica mais espessa e rígida, o sistema da linha lateral é perdido e as glândulas cutâneas são desenvolvidas.[94] O estágio final é o desaparecimento da cauda, mas isso ocorre um pouco mais tarde, o tecido sendo usado para produzir um surto de crescimento nos membros. As rãs são mais vulneráveis aos predadores quando estão em metamorfose. Neste momento, a cauda está se perdendo e a locomoção por meio dos membros está apenas se estabelecendo.[81]
Após a metamorfose, os adultos jovens podem se dispersar em habitats terrestres ou continuar a viver no ambiente aquático. Quase todas as espécies de rãs são carnívoras quando adultas, predando invertebrados, incluindo artrópodes, vermes, caracóis e lesmas. Alguns dos maiores podem comer outras rãs, pequenos mamíferos e peixes. Algumas rãs usam suas línguas pegajosas para pegar presas que se movem rapidamente, enquanto outras colocam comida na boca com as mãos. Algumas espécies também comem matéria vegetal; a perereca Xenohyla truncata é parcialmente herbívora, sua dieta inclui uma grande proporção de frutas,.[106] e a folivoria ocorre em Euphlyctis hexadactylus, com plantas constituindo 79,5% do volume de sua dieta.[107] As rãs adultas são atacadas por muitos predadores. A rã-leopardo-do-norte (Lithobates pipiens) é comida por garças, falcões, peixes, salamandras grandes, cobras, guaxinins, gambás, visons, rãs-touro e outros animais.[108]
As rãs são predadores primários e uma parte importante da teia alimentar. Por serem de sangue frio, fazem uso eficiente dos alimentos que comem, com pouca energia sendo utilizada para processos metabólicos, enquanto o restante é transformado em biomassa. Eles próprios são comidos por predadores secundários e são os principais consumidores terrestres de invertebrados, a maioria dos quais se alimentam de plantas. Ao reduzir a herbivoria, eles desempenham um papel no aumento do crescimento das plantas e, portanto, fazem parte de um ecossistema delicadamente equilibrado.[109]
Pouco se sabe sobre a longevidade de rãs e sapos na natureza, mas alguns podem viver por muitos anos. Registos de rãs e sapos em cativeiro indicam longevidades até 40 anos.[110]
Embora o cuidado com a prole seja mal compreendido em sapos, cerca de 20% das espécies de anfíbios podem cuidar de seus filhotes de alguma forma.[111] A evolução do cuidado parental em rãs é impulsionada principalmente pelo tamanho do corpo d'água em que se reproduzem. Aqueles que se reproduzem em corpos d'água menores tendem a ter um comportamento de cuidado parental maior e mais complexo.[112] Como a predação de ovos e larvas é alta em grandes corpos d'água, algumas espécies de rãs começaram a colocar seus ovos na terra. Uma vez que isso aconteceu, o dessecante ambiente terrestre exige que um ou ambos os pais os mantenham úmidos para garantir sua sobrevivência.[113] A necessidade subsequente de transportar girinos nascidos para um corpo de água exigiu uma forma ainda mais intensa de cuidado parental.[112]
Em pequenos corpos d'água, predadores estão quase sempre ausentes e a competição entre girinos se torna a variável que restringe sua sobrevivência. Certas espécies de rãs evitam essa competição fazendo uso de pequenos fitotelmos como locais para depositar alguns girinos.[114] Embora esses locais de criação menores sejam livres de competição, eles também carecem de nutrientes suficientes para sustentar um girino sem a assistência dos pais. As espécies de rãs que mudaram do uso de fitotelmas maiores para menores desenvolveram uma estratégia de fornecer aos seus filhotes ovos nutritivos, mas não fertilizados.[112] A rela-morango (Oophaga pumilio) fêmea deposita seus ovos no chão de florestas. O macho os protege da predação e carrega água em sua cloaca para mantê-los úmidos. Quando eclodem, a fêmea move os girinos em suas costas para uma bromélia contendo água ou outro corpo d'água similar, depositando apenas um em cada local. Ela os visita regularmente e os alimenta colocando um ou dois ovos não fertilizados no fitotelmo, continuando a fazer isso até que os jovens estejam grandes o suficiente para sofrer metamorfose.[115]
Muitas outras formas diversas de cuidado parental são vistas em rãs. O macho de Colostethus subpunctatus fica de guarda sobre seu aglomerado de ovos, colocado sob uma pedra ou tronco. Quando os ovos eclodem, ele vocaliza e transporta os girinos nas costas para um corpo d'água temporário, onde mergulha parcialmente na água e um ou mais girinos caem. Ele então segue para outra piscina.[116] O sapo-parteiro-comum (Alytes obstetra) também é conhecido por seu cuidado parental, onde os machos prendem as massas de ovos ao corpo e as carregam até a eclosão dos ovos, quando liberam os girinos em corpos d'água.[117] A rã da espécie Physalaemus pustulosus constrói um ninho flutuante de espuma para proteger seus ovos da predação. A espuma é feita de proteínas e lectinas e aparenta ter propriedades antimicrobianas.[118] Vários pares de rãs podem formar um ninho colonial em uma jangada construída anteriormente. Os ovos são colocados no centro, seguidos por camadas alternadas de espuma e ovos, terminando com uma cobertura de espuma.[119]
Algumas rãs protegem seus filhotes dentro de seus próprios corpos. Machos e fêmeas da espécie Assa darlingtoni guardam seus ovos, que são postos no chão. Quando os ovos eclodem, o macho lubrifica seu corpo com a geleia que os envolve e mergulha na massa de ovos. Os girinos se contorcem em bolsas de pele em seu lado, onde se desenvolvem até que se metamorfoseiam em sapos juvenis.[120]
A rã Rheobatrachus sp. da Austrália, agora provavelmente extinta, engole seus ovos fertilizados, que então se desenvolvem dentro de seu estômago. Ela para de se alimentar e para a secreção de suco gástrico. Os girinos dependem das gemas dos ovos para se alimentarem. Depois de seis ou sete semanas, eles estão prontos para a metamorfose. A mãe regurgita os sapinhos, que saltam de sua boca.[121] A Rã de Darwin ( Rhinoderma darwinii ) do Chile põe até 40 ovos no chão, onde são guardados pelo macho. Quando os girinos estão prestes a eclodir, eles são engolfados pelo macho, que os carrega dentro de sua bolsa vocal muito dilatada, onde ficam imersos em um líquido espumoso e viscoso que contém alimento para complementar o que obtêm das gemas dos ovos. Eles permanecem na bolsa por sete a dez semanas antes de sofrer metamorfose, após o que eles se movem para a boca do macho e emergem.[122]
À primeira vista, as rãs parecem bastante indefesas devido ao seu tamanho pequeno, movimento lento, pele fina e falta de estruturas defensivas, como espinhos, garras ou dentes. Muitos usam camuflagem para evitar a detecção, a pele frequentemente sendo manchada ou listrada em cores neutras que permitem que um sapo estacionário se funda ao seu ambiente. Alguns podem dar saltos prodigiosos, muitas vezes na água, que os ajudam a escapar de potenciais atacantes, enquanto muitos têm outras adaptações e estratégias defensivas.[94]
A pele de muitas rãs contém substâncias tóxicas leves chamadas bufotoxinas, que as tornam intragáveis para predadores em potencial. A maioria dos sapos têm grandes glândulas venenosas, as glândulas parotoides — localizadas nas laterais da cabeça, atrás dos olhos — e outras glândulas em outras partes do corpo. Essas glândulas secretam muco e uma série de toxinas que tornam os sapos escorregadios, desagradáveis ou venenosos. Se o efeito nocivo for imediato, o predador pode cessar sua ação e a rã pode escapar. Se o efeito se desenvolver mais lentamente, o predador pode aprender a evitar essa espécie no futuro.[123] Algumas rãs venenosas tendem a anunciar sua toxicidade com cores vivas, uma estratégia adaptativa conhecida como aposematismo, como as rãs da família Dendrobatidae. São tipicamente vermelhas, laranja ou amarelas, muitas vezes com marcas pretas contrastantes em seus corpos. Já a rã Allobates zaparo não é venenosa, mas mimetiza a aparência de duas espécies tóxicas diferentes com as quais compartilha uma área comum no esforço de enganar predadores.[124]
Algumas rãs, tais como os membros da família Dendrobatidae, são especialmente tóxicos. Alguns povos nativos da América do Sul extraem veneno dessas espécies e aplicam-nos aos seus dardos para caçar,[125] embora poucas espécies sejam tóxicas o suficiente para serem usadas com este propósito. Pelo menos duas espécies não venenosas de rãs na América tropical (Eleutherodactylus gaigei e Lithodytes lineatus) mimetizam a coloração de rãs venenosas para autoproteção (mimetismo batesiano).[126][86] Algumas rãs obtêm venenos das formigas e outros artrópodes que comem.[127] Outros, como os Pseudophryne corroboree e Pseudophryne pengilleyi, podem sintetizar os próprios alcaloides.[128] A constituição química das toxinas das rãs variam de irritantes a alucinogénicos, convulsivos, neurotoxinas, e vasoconstritores. Muitos predadores de rãs adaptaram-se para tolerar níveis elevados destes venenos. Outros, incluindo humanos, podem ser severamente afectados.[129]
As rãs vivem em todos os continentes, exceto na Antártica e na maioria das ilhas oceânicas.[130][131] Geralmente, a maior diversidade de anfíbios ocorre em regiões tropicais, onde há maior disponibilidade de água. Algumas rãs habitam zonas áridas, como desertos, e contam com adaptações específicas para sobreviver. Membros do género australiano Cyclorana enterram-se no subsolo, onde criam um casulo impermeável para estivar durante os períodos de seca. Assim que chove, as rãs emergem, encontram um corpo d'água temporário e procriam. O desenvolvimento de ovos e girinos é muito rápido em comparação com a maioria das outras rãs, então a reprodução pode ser concluída antes que o tanque seque.[132] Algumas espécies de anuros estão adaptados a um ambiente frio, por exemplo, a rã-da-floresta (Rana sylvatica), cujo habitat se estende a norte do Círculo Polar Árctico, enterra-se no chão durante o inverno. Ainda que muito de seu corpo seja congelado, ela mantém uma alta concentração de glicose em seus órgãos vitais, o que os protege de danos.[133]
Em 2006, das 4.035 espécies de anfíbios que dependem da água em alguma etapa do ciclo de vida, 1.356 (33,6%) foram consideradas ameaçadas. É provável que seja uma sub-estimativa, visto que exclui 1.427 espécies para as quais os dados eram insuficientes.[134] As populações de rãs diminuíram drasticamente desde 1950. Mais de um terço das espécies de rãs são consideradas ameaçadas de extinção e acredita-se que mais de 120 espécies tenham se extinguido desde a década de 1980.[135] Entre essas espécies estão o Atelopus zeteki da Costa Rica e as Rheobatrachus da Austrália. A perda de habitat é uma importante causa de declínio populacional em rãs, tal como poluentes, alterações climáticas, a introdução de espécies não indígenas predadoras/competidoras, e doenças infecciosas emergentes, incluindo quitridiomicose. Muitos cientistas ambientais acreditam que os anfíbios, incluindo rãs, são excelentes indicadores biológicos da saúde do ecossistema mais ampla por causa de sua posição intermediária na cadeia alimentar, peles permeáveis e, pelo seu ciclo de vida normalmente bifásico (larvas aquáticas e adultos terrestre).[136] Parece que são as espécie com ovos assim como larvas aquáticas que são as mais afectadas pelo declínio, enquanto aquelas com desenvolvimento directo são as mais resistentes.[137] Um estudo canadense realizado em 2006, sugeriu que o tráfego pesado em seu ambiente era uma ameaça maior para as populações de rãs do que a perda de habitat.[138] Doenças infecciosas emergentes, incluindo quitridiomicose e ranavírus, também são devastadoras para as populações.[139]
Mutações em sapos e defeitos genéticos aumentaram desde a década de 1990. Isso geralmente inclui pernas ausentes ou pernas extras. Várias causas foram identificadas ou hipotetizadas, incluindo um aumento da radiação ultravioleta que afeta a desova na superfície dos tanques, contaminação química por pesticidas e fertilizantes e parasitas como o trematódeo do género Ribeiroia. Provavelmente, todos eles estão envolvidos de forma complexa como estressores, fatores ambientais que contribuem para as taxas de doenças e vulnerabilidade ao ataque de parasitas. As malformações prejudicam a mobilidade e os indivíduos podem não sobreviver até a idade adulta. Um aumento no número de rãs comidas por aves pode realmente aumentar a probabilidade de parasitismo de outras rãs, porque o complexo ciclo de vida do trematódeo inclui o caracol Planorbidae e vários hospedeiros intermediários.[140]
Em alguns casos, programas de reprodução em cativeiro foram estabelecidos e tiveram grande sucesso. A Associação Mundial de Zoológicos e Aquários nomeou 2008 como o "Ano do Sapo", a fim de chamar a atenção para os problemas de conservação enfrentados por eles.[141]
Pernas de rã são comidas por humanos em muitas partes do mundo. O prato francês cuisses de grenouille ou coxas de rã é um prato tradicional servido principalmente na região de Dombes. O prato também é comum nas partes de língua francesa da Louisiana, particularmente nas áreas Cajun do sul da Louisiana, bem como em Nova Orleans. Na Ásia, as pernas de rã são consumidas na China, Vietnã, Tailândia e Indonésia. Pernas de rã fazem parte da culinária chinesa de Sichuan e cantonesa. A Indonésia é o maior exportador mundial de carne de rã, exportando mais de 5.000 toneladas de carne de rã por ano, principalmente para França, Bélgica e Luxemburgo.[142]
Em algumas escolas e universidade, as rãs são usadas para dissecações em aulas de anatomia, muitas vezes recebendo primeiro a injeção de substâncias coloridas para aumentar os contrastes entre os sistemas biológicos. Esta prática está diminuindo devido a questões de bem-estar animal, e "sapos digitais" agora estão disponíveis para dissecação virtual.[143]
As rãs serviram como animais experimentais ao longo da história da ciência. O biólogo do século XVIII, Luigi Galvani, descobriu a ligação entre a eletricidade e o sistema nervoso estudando rãs.[144] Em 1852, H. F. Stannius usou o coração de uma rã em um procedimento denominado ligadura de Stannius para demonstrar que o ventrículo e os átrios batem independentemente um do outro e em taxas diferentes.[145] Na primeira metade do século XX, a espécie Xenopus laevis foi amplamente utilizada em laboratórios para testes de gravidez. Uma amostra de urina de uma mulher grávida injetada em uma rã fêmea a induz a botar ovos, uma descoberta feita pelo zoólogo inglês Lancelot Hogben. Isso ocorre porque a gonadotrofina coriônica humana está presente em quantidades substanciais na urina das mulheres durante a gravidez.[146] Em 1952, Robert Briggs e Thomas J. King clonaram uma rã por transferência nuclear de células somáticas. Esta mesma técnica foi usada mais tarde para criar a ovelha Dolly, e o experimento foi o primeiro transplante nuclear bem sucedido realizado em metazoários.[147]
As rãs são usadas na pesquisa de clonagem e em outros ramos da embriologia. Embora testes de gravidez alternativos tenham sido desenvolvidos, os biólogos continuam a usar o Xenopus como organismo modelo na biologia do desenvolvimento porque seus embriões são grandes e fáceis de manipular, sendo facilmente obtidos e mantidos no laboratório.[148] Xenopus laevis está cada vez mais sendo substituído por seu parente menor, Xenopus tropicalis, que atinge sua idade reprodutiva em cinco meses, em vez de um a dois anos, como em X. laevis,[149] facilitando assim estudos mais rápidos ao longo das gerações.
Os genomas de Xenopus laevis, X. tropicalis, Rana catesbeiana, Rhinella marina e Nanorana parkeri foram sequenciados e depositados no banco de dados de genomas do NCBI.[150]
Como as toxinas de rãs são extraordinariamente diversas, elas atraíram a atenção de bioquímicos como uma "farmácia natural". O alcaloide epibatidina, um analgésico 200 vezes mais potente que a morfina, é encontrado em algumas espécies de dendrobatídeos. Outros químicos isolados da pele de rãs podem oferecer resistência à infecção pelo VIH.[151] Venenos colocados em setas e dardos estão a ser investigados pelo seu potencial terapêutico.[152]
As secreções cutâneas de alguns sapos, como o Bufo alvarius e o sapo-cururu, possuem bufotoxinas, sendo que algumas, como a bufotenina, são psicoactivas, e têm por isso sido usadas como drogas recreativas. Tipicamente, as secreções da pele são secadas e fumadas. Lamber a pele de sapos é especialmente perigoso, e acreditar que basta lamber para ativar seus efeitos alucinógenos é um mito urbano.[153]
As rãs e os sapos têm um lugar de destaque no folclore, nos contos de fadas e na cultura popular. Eles tendem a ser retratados como benignos, feios e desajeitados, mas com talentos ocultos. Os exemplos incluem Michigan J. Frog, "O Príncipe Sapo" e Caco, o Sapo. O desenho animado da Warner Brothers, One Froggy Evening, apresenta o personagem Michigan J. Frog, que canta e dança para aquele que o encontrar, mas não se apresentará em público. "O Príncipe Sapo" é um conto de fadas sobre um sapo que se transforma em um belo príncipe depois de receber o beijo de uma princesa. Caco, o Sapo é um personagem consciencioso e disciplinado de Os Marretas e Rua Sésamo; embora abertamente amigável e muito talentoso, ele é frequentemente retratado como se encolhendo com o comportamento fantasioso de personagens mais extravagantes.[154]
O povo Moche do antigo Peru adorava animais e muitas vezes representava rãs na sua arte.[155] No Panamá, a lenda local afirmava que qualquer pessoa que visse uma rã-dourada-do-Pamaná teria sorte. Alguns acreditavam que, quando uma dessas rãs morresse, ela se transformaria em um talismã dourado conhecido como huaca. Hoje, apesar de estarem extintas na natureza,[156] as rãs douradas panamenhas continuam sendo um importante símbolo cultural e são ilustradas em molas de tecido decorativo feito pelo povo Kuna. Eles também aparecem como parte do design embutido em um novo viaduto na Cidade do Panamá, em camisetas e até mesmo em bilhetes de loteria.[157] O muiraquitã, presente em lendas indígenas brasileiras, é um artefato talhado em pedra ou madeira geralmente no formato de rã, considerado um amuleto poderoso contra toda tipo de malefício.[158]
Um anuro é qualquer membro de um grupo diversificado e amplamente carnívoro de anfíbios que compõem a ordem Anura (literalmente "sem cauda" no grego antigo). A ordem inclui sapos, rãs e pererecas (ou relas). O mais antigo fóssil "proto-anuro" apareceu no início do Triássico de Madagascar, mas a datação do relógio molecular sugere que suas origens podem se estender ainda mais para o Permiano, há 265 milhões de anos. A maioria dos anuros adultos são caracterizados por um corpo curto, olhos salientes, língua inserida anteriormente, membro posterior mais longo do que anterior e a ausência de cauda.
A maioria das rãs tem um estilo de vida semi-aquático, mas move-se facilmente em terra saltando ou escalando. Tipicamente, depositam os seus ovos em poças de água, charcos ou lagos, e as suas larvas, chamadas de girinos, têm guelras e desenvolvem-se na água. Rãs adultas seguem uma dieta carnívora, constituída principalmente de artrópodes, anelídeos e gastrópodes. Os anuros são reconhecíveis pelo seu chamamento (coaxo), que pode ser ouvido durante a noite ou dia, principalmente durante a sua época de reprodução e/ou em dias com alta umidade.
Os anuros são amplamente distribuídos, indo desde os trópicos até regiões subárcticas, mas a maior concentração de diversidade de espécies está em florestas tropicais. Existem mais de 6.300 espécies registradas, representando cerca de 88% das espécies de anfíbios existentes. Eles também são uma das cinco ordens de vertebrados mais diversas. No entanto, populações de certas espécies estão em declínio significativo.
É feita por vezes uma distinção entre rãs e sapos baseando-se na sua aparência, provocada por evolução convergente entre os chamados sapos a ambientes secos no entanto, a distinção não tem base taxonómica. A única família com o nome exclusivamente de "sapo" é a Bufonidae, mas muitas outras espécies de outras famílias são chamados também de "sapos", e espécies do género de sapos Atelopus são conhecidas com rã-arlequim.
Broască (Anura) este un ordin de animale amfibii tetrapode, fără coadă când sunt adulte (anure), cu picioarele dinapoi mai lungi, adaptate pentru sărit, cu gura largă și cu ochii bulbucați. Forma larvară, branhiată și înotătoare, prezentând o coadă care dispare la metamorfoză, este denumită mormoloc.
Broasca de baltă adultă trăiește atât în apă (unde se adăpostește și reproduce), cât și pe uscat (unde se hrănește). Nările de pe vârful botului se închid când se află în apă. Broaștele se înmulțesc prin ouă, care, neavând cochilie, sunt depuse în apă.
Broasca adultă se hrănește cu omizi, limacși, melci mici, insecte adulte, râme: tot ce se mișcă pe uscat și este suficient de mic pentru a îi intra în gură. Prinde prada sărind pe ea sau apropiindu-se și încleind-o cu limba, protractilă. Mormolocul este omnivor și se hrănește rozând alge, cadavre de insecte, pești, icre moarte, iar în caz de foamete, mormolocii se pot devora între ei recurgând la canibalism, cei mai mari atacându-i pe cei mai mici, accelerându-și metamorfoza și reușind astfel să perpetueze specia.
Broaștele și mormolocii lor sunt foarte sensibili la poluări, la viroze și la bolile provocate de ciuperci (mucegaiuri acvatice). Prezența lor denotă existența unui echilibru biologic în ecosistem, chiar dacă acesta conține macro-deșeuri (fiare vechi și alte gunoaie).
Are corpul format din: cap, trunchi și membre (broaștele sunt primele vertebrate tetrapode - cu patru membre).
Este de formă triunghiulară, are ochi mari aurii, capabili să distingă culorile, dar mai ales mișcarea. Ochii sunt ținuți bulbucați când animalul pândește, dar pot fi acoperiți printr-o pleoapă străvezie și chiar retractați în craniu sub apă, sau când broasca se sforțează să înghită o pradă mare. Nările se închid când intră în apă. Ea are două feluri de respirații:
-cutanee
-pulmonară
Urechea este mai evoluată decât la pești. Are o limbă subțire având glande care secretă o substanță cleioasă. Limba ei este ușor despicată la vârf.
Are o piele fără solzi cu glande ce secretă o substanță alunecoasă și bactericidă (mucus).
Membrele anterioare sunt mai scurte decât cele posterioare și au 4 degete terminate cu gheare. Locomoția- semiacvatica, adica este dublă : pe uscat, mergând sau sărind, iar prin apă, înotând cu puternicele labe posterioare, palmate.
Sistemul nervos mai dezvoltat decât la pești prefigurează dezvoltarea creierului animalelor terestre.
Legenda:
Broască (Anura) este un ordin de animale amfibii tetrapode, fără coadă când sunt adulte (anure), cu picioarele dinapoi mai lungi, adaptate pentru sărit, cu gura largă și cu ochii bulbucați. Forma larvară, branhiată și înotătoare, prezentând o coadă care dispare la metamorfoză, este denumită mormoloc.
Broasca de baltă adultă trăiește atât în apă (unde se adăpostește și reproduce), cât și pe uscat (unde se hrănește). Nările de pe vârful botului se închid când se află în apă. Broaștele se înmulțesc prin ouă, care, neavând cochilie, sunt depuse în apă.
Broasca adultă se hrănește cu omizi, limacși, melci mici, insecte adulte, râme: tot ce se mișcă pe uscat și este suficient de mic pentru a îi intra în gură. Prinde prada sărind pe ea sau apropiindu-se și încleind-o cu limba, protractilă. Mormolocul este omnivor și se hrănește rozând alge, cadavre de insecte, pești, icre moarte, iar în caz de foamete, mormolocii se pot devora între ei recurgând la canibalism, cei mai mari atacându-i pe cei mai mici, accelerându-și metamorfoza și reușind astfel să perpetueze specia.
Broaștele și mormolocii lor sunt foarte sensibili la poluări, la viroze și la bolile provocate de ciuperci (mucegaiuri acvatice). Prezența lor denotă existența unui echilibru biologic în ecosistem, chiar dacă acesta conține macro-deșeuri (fiare vechi și alte gunoaie).
Žabotvaré alebo žaby (lat. Anura, Ecaudata, Salientia) sú rad obojživelníkov. Žaba je v dospelosti bezchvostý obojživelník s krátkym telom, širokou hlavou, skákavými zadnými nohami. Chvost majú len žubrienky, ktorý im pri metamorfóze (vývoji) odpadáva. Ako obojživelníky môžu dýchať na vzduchu aj vo vode. Dospelé žaby dýchajú pľúcami, larvy (žubrienky) dýchajú žiabrami. Z vajíčok vzniknú žubrienky a z nich potom dospelé žaby. Často majú silne vyvinuté zadné končatiny, vďaka nim výborne skáču. Živia sa najčastejšie hmyzom.
Známych je asi vyše 5 000 druhov, u nás žije napríklad kunka obyčajná, ropucha obyčajná, skokan hnedý, rosnička zelená.
V starom Egypte bola žaba pre svoju rozmnožovaciu schopnosť a pravdepodobne aj viditeľnú premenu z vajíčka na žubrienku a z nej na štvornohého dospelého jedinca symbolom vznikajúceho a vždy znovu sa obnovujúceho života. Prabohov zrodených z bahna v starom Egypte neraz znázorňovali so žabou hlavou. Bohyňu zrodu Heket, v ľudovej viere dobrotivú pomocníčku, zobrazovali ako žabu.
Zatiaľ bolo popísaných 6 021 druhov žiab (k 31. máju 2011), ktoré sú rozdelené do 38 čeľadí. Z nich sú najpočetnejšie na druhy čeľade rosničkovité (Hylidae) s 901 druhmi a skokanovité (Ranidae) s 1 400 druhmi. Asi 88% obojživelníkov sú žaby (ďalej mloky 9% a červone 3%). Druhy žiab ale stále pribúdajú, pretože vedci stále objavujú nové druhy a to hlavne v trópoch. Napríklad v roku 2010 bolo objavených 205 nových druhov.
Žaby sú kvalifikované do troch podradov: Archeobatrachia – 4 čeľade primitívnych žiab, Mesobatrachia – 6 čeľadí vývojovo pokročilejších žiab a Neobatrachia – 28 čeľadí „moderných“ žiab, zďaleka najväčšia skupina. Neobatrachia sa ďalej delí na Hyloidea a Ranoidea.
Žaby sa živia živou potravou, a to prevážne hmyzom a inými bezstavovcami, niektoré väčšie druhy ale i malými stavovcami. Väčšina žiab potravu loví dlhým lepkavým jazykom, ktorý vymrští po obeti. Výnimkou je čeľaď vodných žiab pipovitých, ktoré potravu prijímajú normálne ústami. Počas prijímania potravy žaby žmurkajú, pretože dochádza počas prehĺtania k zaťahovaniu očných buliev, čo napomáha posúvaniu potravy do žalúdka.[1]. Žaby tiež nemajú žiadne zuby na spodnej čeľusti, a tak prijímajú potravu celú.
Žaba sa pohybuje po súši pomocou prískokov a skokov (výnimkou sú napríklad ropuchy, ktoré častejšie chodia a skáču len pri úteku pred predátorom), ktoré vykonávajú pomocou silných zadných nôh. Najdlhší zaznamenaný skok žaby na súši bol 5 metrov.[1] Vo vodnom prostredí žaba využíva plávaciu techniku zadných končatín, kedy ich postupne dáva k sebe a odťahuje podobne ako plavci typu prsia. Žaby pri skákaní vždy zatvárajú oči.
Pre žaby je typické zavalité telo bez chvosta (od toho názov bezchvosté obojživelníky) so štyrmi končatinami. Medzi druhmi žiab je veľký veľkostný rozdiel. Najmenšou žabou je 1 cm dlhá Brachycephalus didactylus z Brazílie a naopak najväčším druhom je 40 cm dlhý Conraua goliath z Kamerunu. Ešte väčšia bola praveká žaba rodu Beelzebufo, žijúca v dobe pred 70 miliónmi rokov na Madagaskare.
Kostra žiab je prevažne skostnatená. Strop ústnej dutiny tvorí spodina mozgovne (primárne podnebie). K jedinému krčnému stavcu je lebka pripojená dvoma kĺbovými hrboľmi. Počet stavcov je u žiab veľmi redukovaný (v bedrovej oblasti zrastajú v tzv. urostyl). Rebrá nie sú u žiab plne vyvinuté. U žiab sa po prvýkrát stretávame s dobre vyvinutou hrudnou kosťou. Stavba kostry končatín už odpovedá základnej schéme stavby u ostatných suchozemských stavovcov. Lopatka je u žiab spojená s hrudnou kosťou, panva sa napája na chrbticu.
Žaby majú na predných nohách 4 a na zadných nohách 5 prstov. Nohy a prsty majú žaby vyvinuté podľa prostredia, v ktorom žijú (či sú vodné, stromové alebo zemné). Plne vodné či čiastočne vodné žaby majú medzi prstami plávacie blany. Žaby žijúce na stromoch, najmä rosničky majú na prstoch prísavky, vďaka ktorým sa dokážu prichytiť aj na klzkých zvislých povrchoch. Väčšina stromových a zemných žiab majú dobre vyvinuté nohy pre skákanie.
Žaby majú väčšinou hladkú kožu, ale výnimkou sú ropuchy, ktoré majú kožu hrboľatú, ktorá menej vysychá. Koža žiab je priepustná na vodu (nemusí vôbec), kyslík a oxid uhličitý vo vode, preto sú žaby veľmi náchylné na zloženie a znečistenie vody. Koža je plná slizových žliaz, ktoré môžu byť premenené aj na žľazy jedové, je tiež dobre prekrvená – u žiab je výrazný podiel kožného dýchania. V spodnej vrstve škáry sú chromatofóry s pigmentom.
Niektoré druhy žiab dokážu vylučovať z kože mierne jedy. Napríklad všetky druhy ropúch majú za očami jedové žľazy. Tiež žaby z čeľade drevolezovité majú v koži jedy a domorodí obyvatelia Južnej Ameriky nimi namáčajú svoje šípy pre lov zveri. Žaby upozorňujú na jedovatosť pestrým sfarbením.
Iné žaby sa pri napadnutí nafukujú, aby pôsobili ako väčšie a predátora tak zastrašili alebo aby sa mu nevošli do papule. To je typické najmä pre ropuchy.
Posledný spôsob obrany je maskovanie. Žaby sú väčšinou sfarbené tak, aby čo najlepšie splývali s prostredím, v ktorom žijú. Maskovanie ale spočíva aj v tvare tela – výrastkoch na hlave, ktoré môžu pripomínať list.
Žaby sa dorozumievajú pomocou rezonančných mechúrikov, ktoré majú len samce. Sú umiestnené po dvoch po stranách hlavy, alebo majú len jeden veľký na hrdle (rosničky a ropuchy). Samce sťahovaním a rozťahovaním mechúrikov vydávajú zvuky, ktorými lákajú samičky k páreniu. Samičky ani žubrienky tieto mechúriky nemajú.
Žaby sú rozšírené po celom svete okrem Antarktídy, Arktídy a niektorých izolovaných ostrovov.[2][3] Ďalej nežijú v niektorých príliš suchých či studených oblastiach, najväčšej diverzity dosahujú v trópoch.
Žaby sa najčastejšie vyskytujú vo vlhkých oblastiach blízko vody. Niektoré žaby ale dokážu prežívať aj v suchých či chladných podmienkach.
Každá žaba žijúca v miernych oblastiach sa v priebehu života vyskytuje na dvoch odlišných lokalitách, prvá je zimovisko a druhá rozmnožovacie centrum. Zimovisko je pre každý druh žaby typické. Napr. skokan hnedý sa vyskytuje v poliach, rosnička zelená v lesoch.
Rozmnožovacím centrom rozumieme tôň alebo podobné vodné stanovisko, ktoré je zaplnené stojatou vodou. Najčastejší spôsob dopravy vody do tône je: zrážkami, podzemnými vodami, záplavami. Žaby sa vyskytujú aj v iných vodných centrách (rybníky, jazerá, potoky, rieky a riečky, kaluže, atď.)
Žaby sú dôležitou zložkou ekosystému. Nielen, že likvidujú hmyz, ale žaby samotné sú zložkou potravy pre vodné vtáctvo, ako je napr. bocian biely (Ciconia ciconia), volavka popolavá (Ardea cinerea) a podobne. Priama úmera pre vodné vtáctvo na rozšírenie zastupuje samozrejme aj hniezdne podmienky, ale tiež hojnosť potravy, a to predovšetkým žiab a rýb.
Poznáme skoro 5 000 druhov, z toho na území Slovenska žije 12 druhov, z ktorých jeden (skokan zelený) nie je pravým druhom ale medzidruhovým krížencom.[4]
skokan ostropyský – samec
Žabotvaré alebo žaby (lat. Anura, Ecaudata, Salientia) sú rad obojživelníkov. Žaba je v dospelosti bezchvostý obojživelník s krátkym telom, širokou hlavou, skákavými zadnými nohami. Chvost majú len žubrienky, ktorý im pri metamorfóze (vývoji) odpadáva. Ako obojživelníky môžu dýchať na vzduchu aj vo vode. Dospelé žaby dýchajú pľúcami, larvy (žubrienky) dýchajú žiabrami. Z vajíčok vzniknú žubrienky a z nich potom dospelé žaby. Často majú silne vyvinuté zadné končatiny, vďaka nim výborne skáču. Živia sa najčastejšie hmyzom.
Známych je asi vyše 5 000 druhov, u nás žije napríklad kunka obyčajná, ropucha obyčajná, skokan hnedý, rosnička zelená.
V starom Egypte bola žaba pre svoju rozmnožovaciu schopnosť a pravdepodobne aj viditeľnú premenu z vajíčka na žubrienku a z nej na štvornohého dospelého jedinca symbolom vznikajúceho a vždy znovu sa obnovujúceho života. Prabohov zrodených z bahna v starom Egypte neraz znázorňovali so žabou hlavou. Bohyňu zrodu Heket, v ľudovej viere dobrotivú pomocníčku, zobrazovali ako žabu.
Archaeobatrachia
Mesobatrachia
Neobatrachia
Žabe [ʒàːbɛ̀ː] (znanstveno ime Anura; imenovane tudi brezrepe dvoživke, brezrepi krkoni ali kratko brezrepci) so največja in najbolj znana skupina dvoživk. Anura izvira iz grščine in pomeni »brez repa« (an-, brez + oura, rep).
S strokovnega vidika je primerneje kot o žabah govoriti o brezrepih dvoživkah ali na kratko o brezrepcih. Ta izraz uporabljamo tudi v nadaljnjem besedilu. Izraz »žaba« se namreč nestrokovno uporablja za brezrepce, ki so vodne ali polvodne živali z gladko ali vlažno kožo. Za brezrepce s suho, bradavičasto kožo pa se uporablja izraz »krastača«. Posebnost so tudi urh (Bombina sp.) in njegovi sorodniki; čeprav imajo rahlo bradavičasto kožo, jim najbolj ustreza vodni habitat.
Pri mnogih vrstah so zadnje noge prilagojene za skakanje; so daljše in bolj mišičaste kot sprednje noge.
Žabe imajo tako kot ostale dvoživke razmeroma preprosto zgradbo, ki je prilagojena življenju v vodi in na kopnem. Imajo kratko telo s široko glavo. Pri večini vrst so sprednje noge manjše od zadnjih. Oči so velike in izbuljene in opazen bobnič. V ustih je lepljiv jezik. Samci so običajno manjši od samic.
Koža je zelo raznolika. Pri krastačah je lahko debela, pri žabah pa zelo tanka, da se skoznjo vidijo notranji organi.
Večina brezrepcev živi v vlažnih bivališčih, blizu mlak in vodotokov, v katerih se razmnožujejo, nekaj vrst pa živi na sušnih območjih. Največ vrst živi v tropih, posebno v deževnem gozdu.
Ličinke brezrepcev, znane kot paglavci, se hranijo z algami in drugimi rastlinami ter imajo značilno kroglasto telo z dolgim zavitim črevesjem za prebavo rastlinske hrane. Odrasle živali so brez repa, ki se pri ličinki (drugače kot pri drugih dvoživkah) med preobrazbo razgradi.
Red Anura vsebuje 5250 vrst v 33 družinah, med katerimi so po številu vrst najbogatejše Leptodactylidae (1100 vrst), Hylidae (800 vrst) in Ranidae (750 vrst). Brezrepci pomenijo okrog 88 % vrst dvoživk.
Brezrepe dvoživke v splošnem delimo v tri podredove: Archaeobatrachia, kamor spadajo štiri družine primitivnih brezrepcev; Mesobatrachia, ki vključuje pet družin brezrepcev na vmesni evolucijski stopnji; in Neobatrachia, daleč največja skupina, kamor spada preostalih 24 družin »sodobnih« brezrepcev, tudi večina najpogostejših vrst. Neobatrachia se dalje delijo v Hyloidea in Ranoidea[1]. Ta klasifikacija temelji na morfoloških značilnostih, kot npr. število vretenc, struktura medeničnega obroča in morfologija paglavcev. Čeprav je taka klasifikacija splošno uveljavljena, pa so razmerja med družinami še vedno nejasna. Pri nadaljnjem raziskovanju evolucijske povezanosti med družinami si veliko obetajo od molekularne genetike[2].
Nekatere vrste brezrepcev se lahko križajo. Tako je zelena žaba (Rana esculenta) hibrid pisane žabe (R. lessonae) in debeloglavke (R. ridibunda). Podobno se lahko križata nižinski (Bombina bombina) in hribski urh (Bombina variegata), vendar so njuni potomci manj plodni, zato se oblikuje hibridna cona.
Žabe [ʒàːbɛ̀ː] (znanstveno ime Anura; imenovane tudi brezrepe dvoživke, brezrepi krkoni ali kratko brezrepci) so največja in najbolj znana skupina dvoživk. Anura izvira iz grščine in pomeni »brez repa« (an-, brez + oura, rep).
S strokovnega vidika je primerneje kot o žabah govoriti o brezrepih dvoživkah ali na kratko o brezrepcih. Ta izraz uporabljamo tudi v nadaljnjem besedilu. Izraz »žaba« se namreč nestrokovno uporablja za brezrepce, ki so vodne ali polvodne živali z gladko ali vlažno kožo. Za brezrepce s suho, bradavičasto kožo pa se uporablja izraz »krastača«. Posebnost so tudi urh (Bombina sp.) in njegovi sorodniki; čeprav imajo rahlo bradavičasto kožo, jim najbolj ustreza vodni habitat.
Pri mnogih vrstah so zadnje noge prilagojene za skakanje; so daljše in bolj mišičaste kot sprednje noge.
Stjärtlösa groddjur (Anura) är en ordning av groddjur som omfattar drygt 5000 arter uppdelade i ett 50-tal familjer.
Som namnet antyder saknar de stjärtlösa groddjuren stjärt. De har kort kropp och obetydligt avsatt huvud, som är platt och brett och har stor mun. Vidare är bakbenen i regel kraftigare än frambenen. De karaktäriseras också av simhud mellan tårna och utstående ögon. De minsta arterna blir bara någon centimeter långa, medan Goliatgrodan, kan bli upp till 40 centimeter lång.
Stjärtlösa groddjur finns från ekvatorn till ganska nära polerna, men inte i de arktiska områdena. De allra flesta arterna finns i tropisk regnskog. De finns i många mycket olika former, anpassade till mycket olika levnadssätt. Men deras antal minskar snabbt och det tycks råda en överhängande risk att många arter helt dör ut.
De flesta arterna i Anura är amfibiska och lever en stor del av livscykeln i sötvatten. Men de rör sig också lätt på land genom att hoppa och klättra. Yttre befruktning dominerar, och äggen läggs vanligtvis i lugna vatten, till exempel pölar, dammar och sjöar. Larverna (grodyngel) har gälar och utvecklas i vattnet. De vuxna djuren är köttätare och lever framför allt av leddjur (till exempel insekter), ringmaskar och snäckor. Människorna märker dem framför allt genom de lockrop som hannarna utstöter under parningssäsongen.
De stjärtlösa groddjurens vetenskapliga namn Anura kommer från det grekiska ordet an, som betyder "utan" och oura, som betyder "svans". Det betyder följaktligen "utan svans".
I vardagligt tal omfattar ordningen grodor och paddor. Grodor och paddor är inte två taxonomiska grupper utan samlingsnamn för två tänkta grupper som särskiljs genom generella morfologiska likheter. Arterna inom dessa båda grupper behöver alltså inte vara mer eller mindre närbesläktade med varandra än med någon annan art inom gruppen. De arter som kallas paddor är mer anpassade till ett liv i torrare miljöer och likheterna dem emellan har uppstått genom så kallad konvergent evolution, vilket innebär att de anpassats till liknande ekologi oberoende av varandra och därmed fått vissa gemensamma egenskaper. Grodorna är i sin tur mer anpassade till fuktiga miljöer. Yttre skillnader mellan grodor och paddor är att paddorna oftast har en kortare och robustare kropp och kortare ben än grodorna. Paddor brukar också ha tjockare, mer körtellik och vårtig hud, än grodor, vilka oftast har slätare hud.
Fynd av fossila, groddliknande amfibier som är minst 220 miljoner år gamla har gjorts på Madagaskar, från tidsepoken trias. Men de första helt säkra fossilen av stjärtlösa groddjur är runt 150 miljoner år gamla. Dessa är kända som Archaeobatrachia, vilket betyder "gamla grodor". För cirka 50 miljoner år sedan levde Neobatrachia, eller "nya grodor", vilka troligen är förfäder till dagens stjärtlösa groddjursfamiljer.
Här nedan är ett kladogram över släktskapen mellan ordningens olika familjer baserat på Frost et al. (2006) [1] och Heinicke et al. (2009).[2]
AnuraPipagrodor (Pipidae)
Slamdykare (Pelodytidae)
Lökgrodor (.Pelobatidae)
Australtandpaddor (Myobatrachidae)
Lövgrodor (Hylidae)
Glasgrodor (Centrolenidae)
Tandpaddor (Leptodactylidae)
Äkta paddor (Bufonidae)
Pilgiftsgrodor (Dendrobatidae)
Trångmynta grodor (Microhylidae)
Gräsgrodor (Hyperoliidae)
Skivtungade grodor (Discoglossidae)
Äkta grodor (Ranidae)
Trädgrodor (Rhacophoridae)
Stjärtlösa groddjur (Anura) är en ordning av groddjur som omfattar drygt 5000 arter uppdelade i ett 50-tal familjer.
Kuyruksuz kurbağalar (Latince: Anura), Yunanca'daki "yokluk" ön eki olan ἀ(ν)- an- ile yine Yunancada "kuyruk" anlamına gelen οὐρά ourá sözcüklerinden sahte türetilmiş bir terimdir ve "kuyruksuz" demektir.
Erişkinlerinin uzun arka bacaklar, tıknaz gövde, araları zarlı parmaklar, çıkık gözler ve kuyruksuzluk gibi özellikleri bulunan kurbağaların büyük çoğunluğu yarı sucul bir yaşam sürer ama tırmanarak ya da zıplayarak karada da rahatça hareket edebilirler. Her memeli canlı gibi yumurta ile çoğalamazlar.
Özellikle çiftleşme döneminde belirginleşen ve halk arasında "vıraklama" olarak anılan seslenişleriyle dikkat çeken kurbağalar, ekvatordan subarktik bölgelere kadar olan, geniş bir yayılım alanında bulunurlar. Çoğunluğu tropik yağmur ormanlarında olmak üzere, toplam 33 familyaya dağılmış yaklaşık 5250 türü bulunan bu canlılar, çeşitliliği en fazla olan omurgalılardandır. Ancak, kimi kurbağa türlerinin giderek azalan sayıları da dikkat çekmektedir. Kurbağalar yazın toprağın altında kurur.
Türkiye'de kurbağaların 6 familyada (Bombinatoridae, Pelobatidae, Pelodytidae, Bufonidae, Hylidae, Ranidae) toplanan 17 türü bulunur.[1]
Kuyruksuz kurbağalar (Latince: Anura), Yunanca'daki "yokluk" ön eki olan ἀ(ν)- an- ile yine Yunancada "kuyruk" anlamına gelen οὐρά ourá sözcüklerinden sahte türetilmiş bir terimdir ve "kuyruksuz" demektir.
Erişkinlerinin uzun arka bacaklar, tıknaz gövde, araları zarlı parmaklar, çıkık gözler ve kuyruksuzluk gibi özellikleri bulunan kurbağaların büyük çoğunluğu yarı sucul bir yaşam sürer ama tırmanarak ya da zıplayarak karada da rahatça hareket edebilirler. Her memeli canlı gibi yumurta ile çoğalamazlar.
Özellikle çiftleşme döneminde belirginleşen ve halk arasında "vıraklama" olarak anılan seslenişleriyle dikkat çeken kurbağalar, ekvatordan subarktik bölgelere kadar olan, geniş bir yayılım alanında bulunurlar. Çoğunluğu tropik yağmur ormanlarında olmak üzere, toplam 33 familyaya dağılmış yaklaşık 5250 türü bulunan bu canlılar, çeşitliliği en fazla olan omurgalılardandır. Ancak, kimi kurbağa türlerinin giderek azalan sayıları da dikkat çekmektedir. Kurbağalar yazın toprağın altında kurur.
Безхво́сті (Anura, Salientia, Ecaudata) — ряд земноводних, який є найбільшим із сучасних, нараховуючи понад 6000[1] відомих науці видів. Личинку безхвостого земноводного називають пуголовком.
Знахідки викопних форм, дуже схожих з жабами, відомі з нижньої юри, однак не всі дослідники включають їх до даного ряду. Найдавніші безперечні представники безхвостих відомі починаючи з середньої юри. Серед найдавніших є Triadobatrachus massinoti. В теперішній час безхвості поширені по всій земній кулі, від тропіків до субарктичних регіонів, найбільше різноманіття видів спостерігається у тропічних дощових лісах.
Розміри дорослих безхвостих варіюють у межах від 7,7 мм (Paedophryne amauensis) до 320 мм (Conraua goliath). Представники ряду мають кремезний тулуб, випуклі очі, роздвоєний язик і зігнуті під тулубом кінцівки; хвіст відсутній (звідки й назва). Середовище проживання безхвостих на всіх стадіях розвитку включає прісні водойми, а для дорослих особин — додатково суходіл, крони дерев і підземні нори. Найбільш характерний спосіб пересування безхвостих — це стрибки, але різні види опанували додаткові способи, такі як ходіння і біг, плавання, лазіння по деревах і планерування.
Покрив безхвостих має багато залоз, шкіряні виділення деяких видів надзвичайно отруйні. Скупчення залоз у деяких видів створюють враження, що шкіра вкрита бородавками, багато інших видів мають гладеньку шкіру. Забарвлення безхвостих варіює від маскувального бурого, зеленуватого і сірого до найяскравіших червоних, жовтих і чорних кольорів, що зазвичай сигналізують про отруйність (або є мімікрією під неї). Шкіра безхвостих проникна для води, але різні адаптації дозволяють їм уникати надмірної втрати вологи при сухопутному способі життя.
Як правило, безхвості відкладають ікру у воді. З ікринок вилуплюються водні личинки, пуголовки, що мають зябра і хвости. Пуголовки проходять стадію метаморфозу, в кінці якої перетворюються у дорослих особин. У той же час, деякі види відкладають ікру на суходолі, а інші не проходять стадію пуголовка. Дорослі особини більшості видів є хижаками, але є й всеїдні види і навіть декілька видів, які харчуються фруктами. Безхвості здатні видавати широкий діапазон звукових сигналів, особливо під час шлюбного сезону. Спостереження за безхвостими виявили складні схеми поведінки у шлюбних ритуалах, при загрозі життю і в інших ситуаціях.
Багато видів безхвостих (за деякими даними, до третини від всіх видів земноводних) перебувають під загрозою вимирання[2].
Люди вживають безхвостих у їжу, утримують як домашніх тварин, крім того, безхвості слугують зручними модельними організмами для біологічних досліджень.
Походження безхвостих і їх еволюційні взаємозв'язки з іншими сучасними земноводними залишаються предметом дебатів[3][4].
Prosalirus bitis — одна з найдавніших тварин, що має багато ознак безхвостих. Скам'янілі рештки цього виду були вперше виявлені у 1995 році в Аризоні, у нижньоюрських відкладеннях формації Кайєнта (англ. Kayenta Formation) віком понад 180 мільйонів років[5]. Prosalirus ще не мав потужних задніх кінцівок, але його посадка (структура таза) нагадує сучасних жаб, він не мав хвоста[6][7] і був адаптований до пересування стрибками[8]. Інша ранньоюрська жаба описана під назвою Vieraella herbsti. Цей вид відомий лише за одиничною знахідкою — відтиском черевної і спинної сторони однієї особини. Припускають, що її розмір становив 33 мм.
Еволюційні лінії Prosalirus bitis, Vieraella herbsti та деяких інших викопних видів відокремились ще до того, як з'явився найближчий спільний предок сучасних жаб. Тому деякі автори не включають дані види до складу ряду безхвостих[9]. Найдавнішим відомим науці представником безхвостих у такому разі виявляється середньоюрський вид Eodiscoglossus oxoniensis, близький сучасним Bombinatoridae і Alytidae[3].
Викопні безхвості були виявлені на всіх континентах, за винятком Антарктиди, але наявні непрямі ознаки, що вказують не те, що коли клімат на Землі був теплішим безхвості мешкали й там[10].
Безхвості поширені практично по всьому суходолу. Винятками є великі піщані пустелі Сахара і Руб-Ель-Халі, найбільш холодні області — Гренландія, Таймир та інші високоширотні райони Арктики, Антарктида, а також Камчатський край і деякі острови, віддалені від континентів[11][12]. Крім того, природний ареал безхвостих раніше не включав острів Нової Зеландії, але невдовзі після спроб штучного заселення принаймні два види (Litoria raniformis і Litoria ewingii) утворили на ньому стійкі популяції[13]. Багато видів мають обмежене поширення через кліматичні і географічні бар'єри, наприклад, протоки, гірські хребти, пустелі; популяції можуть бути ізольовані також через перешкоди, створені людиною — автотраси, лісні просіки тощо[14]. В тропічних регіонах видове розмаїття, як правило, більше, ніж в районах з помірним кліматом[15]. Деякі види безхвостих адаптовані для виживання у негостинних умовах, наприклад, в пустелях[16] або холодному кліматі. Наприклад, Rana sylvatica, чий ареал частково лежить за північним полярним колом, на зиму закопується в землю. Незважаючи на глибоке промерзання ґрунту, висока концентрація глюкози в тканинах дозволяє цій жабі пережити зиму у стані анабіозу[17].
Фауна України налічує 13 видів безхвостих земноводних. Найбільш різноманітно представлений рід бурих жаб — це жаби трав'яна, гостроморда (болотяна), прудка, озерна, ставкова та їстівна. Поширені три види ропух: ропуха звичайна мешкає у лісах, садах і луках, у Кримських горах; ропуха зелена — по всій Україні; ропуха очеретяна — у західних областях. Зустрічаються два види кумок: кумка червоночерева — по всій території України, кумка жовточерева — в західних областях. Також в Україні поширені райка деревна з роду райок і часничниця звичайна з роду часничниць.
У дорослих амфібій є парні п'ятипалі кінцівки, типові для наземних хребетних тварин. Тіло широке, коротке і сплощене. Дорослі особин не мають хвоста (що й визначило назву ряду); хвостовий відділ хребта видозмінений у паличкоподібну кістку уростиль; ребра відсутні; хвіст втрачають під час метаморфозу. Мають добре розвинені кінцівки; задні кінцівки довші ніж передні, мають міцнішу мускулатуру і звичайно пристосовані до стрибання. Гола шкіра безхвостих проникна для води і газів, має багато залоз[18].
Скелет безхвостих, як і у інших наземних хребетних, включає череп, хребет, пояси кінцівок і скелет вільних кінцівок[19]. Череп сплощений, переважно хрящовий[20]. Бічні потиличні кістки утворюють парні потиличні виростки, що з'єднують череп з шийним хребцем.
Хребет безхвостих складається з чотирьох відділів — шийного, тулубного, крижового і хвостового. Шийний і крижовий включають лише по одному хребцю. У тулубному відділі 7 хребців. Всі хребці хвостового відділу зрослись в одну кістку — уростиль[20].
Пояс передніх кінцівок складається з парних лопаток, ключиць та коракоїдів і непарної грудини. Пояс задніх кінцівок складається з клубових і сідничних кісток. Сідничні кістки з'єднані лобковим хрящем[20].
Будова кінцівок безхвостих у різних видів варіюється і залежить від середовища проживання — наземного, водного чи деревного. Як правило, безхвості здатні робити різкі рухи, завдяки чому вони ловлять здобич і тікають від хижаків. Ефективні способи пересування забезпечуються декількома особливостями будови кінцівок:
Розвиток кінцівок може бути ускладнений у деяких випадках:
У багатьох видів безхвостих шкіра проникна для води (найбільш проникна ділянка — область очей). Ця особливість створює для безхвостих загрозу втрати рідини і пересихання. У деяких безхвостих, що ведуть деревний спосіб життя, присутня адаптація у вигляді додаткового водонепроникного шару шкіри. Інші безхвості мінімізують втрату води адаптаціями у поведінці: нічним способом життя, прибиранням поз, що зменшують площу стикання з повітрям[23], наприклад, вони відпочивають у групах і тісно притискаються один до одного[23].
Шкіра безхвостих допомагає їм маскуватися. Представники деяких видів здатні змінювати відтінок шкіри, щоб краще зливатися з навколишнім фоном[24]. Шкіра безхвостих, що ведуть нічний спосіб життя, часто покрита бородавками і зморшками (що дозволяє їм маскуватися під елементи ґрунту), тоді як у безхвостих, що ведуть деревний спосіб життя, шкіра, як правило, гладенька (ці види частіше мімікрують під елементи рослин)[24].
Деякі види безхвостих змінюють забарвлення в залежності від рівня освітлення і вологості навколишнього середовища. Цю здатність забезпечують спеціальні клітини, наповнені пігментом, розмір яких змінюється під впливом світла і вологості. Зміна забарвлення шкіри від світлішого до більш темного сприяє терморегуляції цих видів[25].
Багато безхвостих виробляють токсичні речовини, які слугують як для захисту від хижаків, так і для нападу. Наприклад, у ропух отруйні залози розташовані у верхній частині голови над очима[26]. Хімічний склад отрути безхвостих залежить від виду і може містити подразники шкіри, галюциногени, нервово-паралітичні токсини, вазоконстриктори, токсини, що викликають конвульсії, та інші. Хижаки, що спеціалізують на певних видах безхвостих, як правило, адаптовані до властивого цим видам типу отрути, але неспеціалізовані тварини, як і людина, можуть серйозно постраждати від контакту з отрутою безхвостих, що в деяких випадках призводить до летального результату[27].
Джерело отруйних речовин у безхвостих також неоднакове. Деякі безхвості генерують токсини самотужки[28], інші використовують токсини, отримані з їжею (частіше за все членистоногих)[29]. Як правило, безхвості сигналізують про свою отруйність за допомогою яскравого, насиченого, «попереджувального» забарвлення. Існують також неотруйні види безхвостих, які мімікрують під отруйні види своїм забарвленням, яке відлякує хижаків[30][31].
Шкіра безхвостих проникна для молекул кисню, вуглекислого газу і води. Кровоносні судини, розташовані прямо під шкірою, дозволяють їм дихати при повному зануренні у воду, оскільки кисень проходить з води крізь шкіру прямо в кров. На суходолі безхвості дихають за допомогою легень. У них відсутня система м'язів (черевних, діафрагми і міжреберних), яка забезпечує у ссавців механізм вдих-видих. Замість неї у безхвостих розтягується горло, повітря входить через ніздрі, а потім стиснення м'язів ротової порожнини вганяє повітря до легень[32]. У серпні 2007 року був відкритий вид жаб Barbourula kalimantanensis, що ведуть повністю водний спосіб життя. Це перший відкритий вид безхвостих, що не має легень[33].
Безхвості мають трьохкамерне серце, як і інші тетраподи (за винятком ссавців, птахів і крокодилів, у яких серце чотирикамерне). Насичена киснем кров з легень і збагачена вуглекислим газом кров з тканин надходить в серце через різні передсердя. Спеціальний клапан регулює подачу крові зі шлуночка серця в аорту чи в легеневу артерію, в залежності від типу крові. Цей механізм забезпечує мінімальне змішування крові з підвищеною концентрацією кисню і крові, насиченою вуглекислим газом, і, таким чином, сприяє більш активному обміну речовин[34].
Деякі види безхвостих адаптовані до виживання у воді з пониженою концентрацію кисню. Так, наприклад, жаба Telmatobius culeus, що мешкає у високогірному озері Тітікака, має зморшкувату шкіру зі збільшеною площею поверхні, що сприяє обміну газів. Як правило, ця жаба не використовує свої рудиментарні легені. Спостереження показали, що представники цього виду, перебуваючи на дні озера, час від часу здійснюють ритмічні рухи вверх-вниз, що збільшує течію води навколо них[35].
Зуби безхвостих, так звані педициллярні зуби, розташовані у верхній щелепі[19], з їх допомогою тварина утримує їжу пере тим, як її проковтнути. Ці зуби недостатньо міцні для укусів і піймання жертви. Свою їжу (мух та інших дрібних рухливих тварин) безхвості ловлять липким, роздвоєним язиком. У пасивному стані язик згорнутий у роті. Він прикріплений спереду до щелеп, і жаба може вистрілити ним вперед і повернути його назад з великою швидкістю[17]. У деяких жаб немає язика, і вони засовують їжу у рот передніми кінцівками[17]. У інших очі можуть втягуватись через отвори у черепі, надавлювати на їжу, що знаходиться у роті, і таким чином проштовхують її в горло[17]. Проковтнута їжа проходить через стравохід до шлунку, де оброблюється травними ензимами. Після цього вона надходить у тонкий кишечник, де триває її перетравлення. Секреція соку підшлункової залози і жовчі, яка виробляться в печінці і накопичується у жовчному міхурі, відбувається в тонкому кишечнику. Там також відбувається максимальна абсорбція нутрієнтів в організм. Відходи їжі переходять у товстий кишечник, звідки після абсорбування надлишків води переміщуються в клоаку.
Видільна система безхвостих схожа за структурою з системою ссавців. В її основі лежать дві нирки, що фільтрують сечовину та інші продукти життєдіяльності з крові. Отриманий фільтрат нирки концентрують у сечі, яка потім проходить через сечовід і накопичується у сечовому міхурі. З сечового міхура продукти життєдіяльності організму потрапляють в клоаку і звідти — назовні[36].
Репродуктивна система безхвостих, лише за деякими винятками, заснована на зовнішньому заплідненні. у багатьох видів безхвостих самці менші за самиць. У самців є голосові зв'язки, а у багатьох видів і горлові мішки, за допомогою яких вони видають гучне квакання під час шлюбного сезону. Два сім'яника прикріплені до нирок, сперма проходить через нирки, після чого протравляє у сечоводи, а звідти в клоаку. За відсутності пеніса сперма викидається з клоаки одразу на ікру, відкладену самицею під час амплексуса. У самиць є парні яєчники, розташовані біля нирок. Ікринки проходять через парні яйцепроводи назовні. Під час амплексуса хватка самця стимулює відкладання ікри, як правило, у оболонці, що нагадує желе[36].
Нервова система безхвостих складається з мозку, спинного мозку і нервів. Багато частин головного мозку безхвостих відповідають людському мозку. Мозок складається з двох нюхових долей, двох церебральних хемісфер, шишкоподібного тіла, мозочка і довгастого мозку. Мозочок контролює м'язову координацію і рівновагу, а довгастий мозок керує диханням, травленням та іншими автоматичними функціями організму[36]. Відносні розміри головного мозку безхвостого набагато менші ніж у людини. Вони мають лише 10 черепних нервів і 10 пар спінальних нервів, у порівнянні з ссавцями, птахами і рептиліями, які мають 12 черепних нервів[36]. У безхвостих немає зовнішнього вуха, а барабанні перетинки відкриті назовні. Як і в інших тетраподів, вуха безхвостих включають в себе вестибулярний апарат. Маючи відносно короткого вушного равлика, безхвості використовують для розпізнання звуків електричний апарат (на відміну від механічного у ссавців)[37].
Органи зору представлені парними очима. Жаби володіють унікальним серед хребетних зоровим апаратом. У ході досліджень було виявлено, що майже 95% інформації йде в середній відділ мозку, яка використовується лише для здійснення рефлексів. Жаби бачать лише рухомі предмети. Жаби також «фільтрують» рухомі предмети, помічаючи лише округлі. При цьому вони не звертають уваги на предмети, що рухаються ритмічно вправо і вліво.
Органи слуху складаються з середнього вуха (барабанна порожнина) та внутрішнього вуха (барабанна перетинка). Органи нюху мають численні складки слизової оболонки, що збільшує чутливу поверхню органа. Частина нюхового мішка відокремлюється у самостійний орган, характерний лише для наземних хребетних — якобсонів орган.
В екстремальних погодних умовах деякі види безхвостих впадають у стан анабіозу і можуть не проявляти ніякої активності протягом декількох місяців. В холодних областях безхвості взимку впадають в сплячку. Деякі наземні безхвості (наприклад, Anaxyrus americanus) риють собі на зиму нору і сплять в ній. Інші види, менш пристосовані до риття, ховаються в ущелинах або закопуються у сухе листя. Водні види (наприклад, жаба-бик), як правило, залягають на дні водойми, частково занурюючись у мул, але зберігаючи доступ до кисню. Їх метаболізм уповільнюється, і вони виживають за рахунок споживання внутрішніх енергетичних резервів. Багато безхвостих можуть вижити після замерзання. Незважаючи на те, що під їх шкірою і у порожнинах тіла утворюються кристали льоду, життєво важливі органи захищені від замерзання завдяки високій концентрації глюкози у тканинах. На вигляд нежива, замерзла жаба може почати дихати і відновити роботу серця, якщо її відігріти[38].
З іншої сторони, Cyclorana alboguttata під час пекучого сухого сезону в Австралії впадає в стан естивації (літньої сплячки), і обходиться без їжі і води 9-10 місяців на рік. Ця жаба заривається у землю і згортається у захисному коконі, який утворює її скинута шкіра. Дослідження показали, що під час естивації метаболізм змінюється так, що ККД мітохондрій збільшується, дозволяючи більш ефективно використовувати обмежену кількість енергетичних ресурсів, доступних жабі у стані сплячки. Намагаючись дати відповідь на питання, чому цей механізм не має широкого поширення серед тварин, дослідники дійшли висновку, що він корисний тільки для холоднокровних тварин, що перебувають у комі тривалий час і чиї енергетичні затрати вкрай низькі, оскільки у них немає необхідності постійно генерувати тепло[39]. Інше дослідження показало, що для задоволення мінімальних енергетичних потреб у жаби атрофується більшість м'язів (за винятком м'язів задніх кінцівок)[40].
До ряду безхвостих земноводних відносять всіх сучасних жаб і ропух, а також викопні види, які підходять за описом до безхвостих. Морфологічні характеристики дорослого безхвостого включають, серед іншого, 9 або менше передтазових хребців, довгу, направлену вперед клубову кістку, наявність уростиля і відсутність хвоста, вкорочені у порівнянні з задніми передні кінцівки, спаяні разом ліктьова і променева кістки передніх кінцівок, а також великогомілкову і малогомілкову кістки задніх кінцівок, подовжену щиколотку, беззубу нижню щелепу і підшкірні лімфатичні порожнини, розташовані між шкірою і м'язовим шаром[41]. Личинки безхвостих (пуголовки) мають один центральних дихальний отвір і ротові воронки з кератиновими зубчиками[41].
Безхвостих класифікують на три підряди: Archaeobatrachia, який включає чотири родини примітивних жаб; Mesobatrachia, який включає п'ять більш еволюційно просунутих; Neobatrachia — найбільший підряд, до якого входять решта родин сучасних жаб. Neobatrachia, в свою чергу, класифікують на дві надродини: Hyloidea і Ranoidea[42][43].
Деякі види безхвостих формують міжвидові гібриди. Наприклад їстівна жаба являє собою природний гібрид ставкової (Pelophylax lessonae) і озерної (P. ridibundus) жаб[44][45].
Для кожного виду безхвостих характерний свій тип квакання. Квакання — це звук, який виробляться при проходженні повітря через гортань. У багатьох видів є додаткові адаптації, що посилюють звук, — горлові мішки, що являють собою шкіряні мембрани, здатні до розтягування і розташовані під горлом чи по боках рота. У деяких представників безхвостих (наприклад, Heleioporus і необатрахусів) немає горлових мішків, але тим не менш вони здатні видавати гучне квакання, оскільки ротова порожнина у них має форму купола і достатньо великий об'єм, щоб виконувати функцію підсилювача. Квакання деяких видів безхвостих чутно далі ніж на кілометр[46]. Види безхвостих, що мешкають переважно вздовж проточної води, часто не мають адаптацій для посилання звуку, оскільки шумний фон робить звукову комунікацію неефективною[47]. Натомість ці види використовують візуальні способи спілкування («семафорять» один одному).
Спостереження показують, що основна доля комунікації безхвостих припадає на приваблювання самиць. Самці можуть квакати поодинці, а можуть створювати хор, коли багато самців збираються у зручних для парування місцях. Самиці багатьох видів безхвостих (наприклад, Polypedates leucomystax) також квакають у відповідь на заклики самців, що, можливо, підвищує локальну репродуктивну активність[48]. Самиці надають перевагу самцям, що видають найбільш гучні й низькі звуки, які вказують на здорового і міцного самця, здатного породжувати найкраще потомство[49].
Окремий клас звуків видають самці чи незацікавлені самиці, яких осідлав інший самець. Це характерне цвірінькання, яке супроводжується вібрацією тіла[50]. Деревні жаби і деякі види наземних безхвостих мають у своєму репертуарі звук-попередження про майбутню зливу, який вони видають при поєднанні певних кліматичних умов[50], а також специфічний звук, що відлякує чужих самців з зайнятої території. Всі ці звуки безхвості видають із зачиненим ротом[50].
Деякі безхвості в стані смертельної небезпеки видають сигнал лиха з відкритим ротом, отримуючи високий пронизливий звук. Як правило, його видає жаба, схоплена хижаком. Іноді дезорієнтований цим криком хижак випускає жабу, а іноді на крик збігаються інші хижаки, відволікаючи того, що зловив жертву, що дозволяє їй вирватися[50].
Безхвості пересуваються різними способами. В залежності від середовища проживання вони стрибають, бігають, ідуть ходою, плавають, риють нори, лазять по деревах і планерують.
Безхвості вважаються найкращими стрибунами серед всіх хребтових (за довжиною стрибка відносно розмірів тіла)[51]. Австралійська жаба Litoria nasuta може стрибати на відстань, яка перевищує довжину її тіла (5.5 см) у більш ніж 50 разів[52]. Прискорення у стрибку може досягати 20 м/с2. Види безхвостих сильно відрізняються один від одного за своїми здібностями у стрибках. Всередині виду існує позитивна кореляція між розміром особини і довжиною стрибка, але відносна довжина стрибка (довжина стрибка, поділена на довжину тіла) при цьому зменшується. Індійська жаба Euphlyctis cyanophlyctis має унікальну спроможність підстрибувати з води з позиції лежачи на поверхні[53]. Крихітні жаби Acris crepitans можуть «перебігати» по поверхні ставка короткими різкими стрибками[54].
Здатність до стрибків у безхвостих обумовлена тим, що більша частина їх опорно-рухового апарату модифікована для стрибків. Гомілка, фібула (?) і ступні поєднані в єдину міцну кістку, також поєднані променева і ліктьова кістки передніх кінцівок (вони гасять інерцію під час приземлення). Подовжені плесна збільшують дожину ноги, що дозволяє жабі відштовхуватись від землі протягом довшого часу, збільшуючи прискорення. Клубова кістка також подовжена і формує з крижовою кісткою рухомий суглоб, який у еволюційно просунутих безхвостих, таких як Ranidae і Hylidae, функціонує подібно додатковій кінцівці, підсилюючи силу стрибка. Хвостові хребці зрослись в уростиль, розташований всередині тазу. Він дозволяє ефективно передавати імпульс стрибка від ніг до тіла[55].
Подібним чином модифікована мускулатура безхвостих. Подібно іншим тваринам, що мають кінцівки, у давніх безхвостих їх рух регулювався парами м'язів — згиначами і розгиначами. У сучасних безхвостих м'язи, що сприяють стрибку, непропорційно розвинені (основні ножні м'язи складають понад 17% від загальної маси жаби), тоді як м'язи, що повертають кінцівки у початкову позицію, майже атрофовані. Уповільнена зйомка стрибка демонструє, що м'язи ніг можуть згинатись пасивно. Спершу вони розтягаються (при тому, що жаба продовжує сидіти), потім вони стискуються і одразу ж розгинаються знову, відправляючи жабу у повітря. Під час стрибка передні кінцівки притиснуті до грудей, а задній витягнуті у повну довжину[56]. У деяких безхвостих (наприклад, Osteopilus septentrionalis і Rana pipiens), максимальне зусилля, яке докладають м'язи під час стрибка, може перевищувати їх теоретичну потужність. Це відбувається за рахунок того, що після згинання і стискання м'язів першого разу отримана енергія переходить до натягнутого сухожилля, яке обертається навколо кістки щиколотки. При другому стисканні це сухожилля вивільнюється подібно катапульті і надає жабі прискорення, якого було б неможливо домогтися одними лише зусиллями м'язів[57]. Схожий механізм був виявлений у деякий коників, в тому числі сарани[58].
Безхвості з родин Bufonidae, Rhinophrynidae і Microhylidae мають короткі задні кінцівки і пересуваються крокуючи, а не стрибками[59]. Швидке пересування у представників цих родин забезпечують або прискорений рух кінцівок (швидке ходіння), або швидкі короткі стрибки. Метод пересування Gastrophryne olivacea описаний як «комбінація з бігу і коротких стрибків (лише декілька сантиметрі у довжину)»[60]. В одному з експериментів жаба Bufo fowleri була посаджена на бігову доріжку, яка оберталась з різною швидкістю. При замірюванні кількості кисню, яку витрачала жаба, було виявлено, що для цього виду пересування маленькими стрибками на довгі дистанції є енергетично неефективним, але може бути виправдане для швидкого пересування на короткі відстані[61].
Жаба Kassina maculata має короткі і тонкі кінцівки, не пристосовані для стрибання. Ця жаба може швидко бігати, пересуваючи по черзі задні ноги. Уповільнена зйомка показала, що алюр цієї жаби не змінюється в залежності від швидкості бігу (на відміну, наприклад, від коня, який біжить риссю на середніх швидкостях, а на високих переходить на галоп)[62]. Це вид також вміє залазити на дерева та кущах, чим активно користується уночі для ловлі комах[63]. Індійська жаба Euphlyctis cyanophlyctis має широкі ступні ніг і може пробігати декілька метрів за раз по поверхні води[54].
Безхвості, що мешкають у воді, адаптовані до плавання; для будови їх тіла характерні задні кінцівки і наявність плавальних перетинок між пальцями. Перетинки збільшують площу поверхні ступні (подібно ластам) і сприяють швидкому пересуванню жаб у воді. Представники родини Pipidae ведуть повністю водний спосіб життя і тому краще за всіх пристосовані до цього середовища проживання. Вони мають негнучкий хребет, тулуб плескатий і витягнутий, міцні задні кінцівки мають великі перетинки, для кращої орієнтації у воді наявний орган бічної лінії[64]. Пуголовки, як правило, мають великі хвостові плавці, які надають прискорення, направлене вперед, коли хвіст рухається з боку у бік. У воді безхвості найбільш безпорадні під час метаморфозу, коли хвіст вже атрофований, а ноги ще не повністю функціональні[59].
Деякі безхвості адаптувалися до життя під землею і, як наслідок, до риття нір. У цих видів безхвостих, як правило, округлий тулуб, короткі кінцівки, маленька голова з виряченими очима, а задні ноги адаптовані до риття. Прикладом високої спеціалізації в цьому напрямі є пурпурова жаба, південноіндійських вид. Вона харчується термітами і проводить під землею майже все своє життя. Вилазить вона на короткий період під час мусонів, коли в калюжах відбувається спарювання і розмноження. У цієї жаби крихітна голова з витягнутою мордою і округле тіло. Через свій підземний спосіб життя цей вид був вперше описаний лише в 2003 році, хоча місцевим жителям вона була знайома вже давно[65]
Представники родини Scaphiopodidae, що мешкають в Північній Америці, теж адаптовані до підземного життя. Типовий вид, жаба Spea bombifrons, має ороговілу ділянку на плеснах задніх ніг, яку вона використовує, щоб зариватися в землю. Копаючи, жаба крутить стегнами з боку в бік, занурюючись в пухку землю. Влітку вона задовольняється маленькою норою, з якої по ночах виходить на полювання, але взимку ця жаба заривається набагато глибше (до 4,5 метрів вглиб)[66]. Утворений тунель заповнює земля, а жаба впадає в зимову сплячку в дальньому кінці нори. Під час сплячки жаба отримує воду з навколишнього середовища шляхом осмосу, але, не маючи можливості позбуватися сечовини, накопичує її в організмі[66]. Навесні Scaphiopodidae залишають свої зимові нори практично одночасно і намагаються потрапити до калюж, де вони спарюються. Відповідне місце голосно «анонсується» першим самцем, що його знайшов[67].
Інший вид, австралійський Heleioporus albopunctatus, веде зовсім інший спосіб життя. Ця жаба риє нору на березі чи під дном ріки і регулярно вилазить за їжею. Парування і відкладення ікри відбувається в гнізді всередині нори. Ікринки розвиваються до певної стадії, але пуголовки не залишають їх допоки нору не заллє сильною зливою. Тільки тоді пуголовки випливають у відкриту воду, де швидко завершують свій розвиток[68]. Мадагаскарські жаби з роду Scaphiophryne зариваються у сухе листя. Один з представників цього роду, Scaphiophryne marmorata, має сплюснуту голову і добре розвинені плеснові нарости на задніх ногах, що допомагають йому закопуватися. На передніх ногах цієї жаби є збільшені пальцеві диски, які допомагають їй пробиратися крізь кущі[69]. Цей вид жаб розмножується у калюжах, що з'являються після дощів[70].
Деревні безхвості мешкають у кронах дерев, де вони лазять по гілках, голках і листю. Деякі з них взагалі ніколи не спускаються на землю. «Справжні» деревні жаби відносяться до родини Hylidae, але зустрічаються представники інших родин безхвостих, адаптовані до деревного способу життя.
Так, серед дереволазів зустрічаються представники родин скляних жаб, Hyperoliidae, Microhylidae і Rhacophoridae[59]. Більшість деревних безхвостих не більше 10 см у довжину і можуть упіймати комаху, повиснувши на гілці вниз головою на одному пальці, або сидячі на тростинці, що гойдається під вітром[71]. У деяких представників підродини Phyllomedusinae на ногах є проставлені пальці. Це дозволяє їм хапатися за стеблини прибережних рослин[72].
Протягом своєї еволюційної історії декілька не пов'язаних між собою видів безхвостих адаптувались до планерування[73]. Деякі види жаб у тропічних лісах спеціалізовані для планерування з дерева на дерево або мають можливість контрольовано стрибати з дерева на землю («парашутування»). Типовими представниками таких безхвостих є Rhacophorus nigropalmat, що мешкає в Малайзії і Борнео. У цього виду великі ступні, кінчики пальців розширені і мають клейкі подушечки, між пальців ніг є літальні перетинки, а вздовж кінцівок в області таза наявні додаткові складки шкіри. Розтягуючи пальці і кінцівки, ця жаба може планерувати на значні відстані (до 15 метрів) між дерев, змінюючи у міру необхідності напрям руху[74][75].
На перший погляд, безхвості виглядають досить беззахисними у світлі їх невеликих розмірів, повільного пересування, тонкої шкіри і відсутності захисного приладдя (наприклад, рогів, зубів і кігтів). Багато безхвостих мають забарвлення нейтральних кольорів, що дозволяє бути непомітними на тлі довкілля (поки жаба нерухома). Інші здатні робити великі стрибки з суходолу у воду, що дозволяє їм втікати від хижаків[76].
Багато безхвостих продукують токсичні речовини (буфотоксини), які роблять їх неїстівними для неспеціалізованих хижаків. Більшість ропух і деякі жаби мають великі паротоїдні залози, розташовані позаду очей, що виділяються слиз і токсини, які роблять безхвостих одночасно слизькими і отруйними, Якщо ефект отруєння відчувається моментально, хижак може випустити жабу. Якщо отрута має уповільнену дію, впійману жабу вона не врятує, але хижак (якщо вживе) у подальшому уникатиме представників даного виду[77].
Отруйні безхвості, як правило, сигналізують про свою токсичність за допомогою яскравого забарвлення шкіри (адаптивна стратегія, під назвою апосематизм). Деякі неотруйні види мімікрують під отруйних. Так, наприклад, жаба Allobates zaparo неотруйна, але мімікрує під два різних види, які мешкають на її території. У випадку присутності обох видів разом, Allobates zaparo копіює менш токсичну[78].
Деякі види поєднують маскувальну стратегію з апосематизмом. Так, кумка червоночерева має нейтральне забарвлення верхньої частини тіла і яскраві червоні чи жовті плями на череві. У разі небезпеки кума прибирає позу, що демонструє яскраві плями, і відлякує хижака[79].
Деякі безхвості у таких ситуаціях симулюють загрозу. Ропуха звичайна прибирає характерну стійку — роздувається, опускає голову і задирає зад[80]. Жаба-бик у небезпеці присідає, прикриває очі і схиляє голову вперед. Ця поза випинає партоїдні залози і закриває вразливі частини її тіла[76]. Деякі жаби у момент загрози видають гучний проникливий звук, який може відлякати хижака[76]. Незважаючи на те, що більшість хижаків уникає жаб, останні входять до раціону підв'язкових змій. Спостереження за поведінкою Anaxyrus americanus, які нещодавно пройшли метаморфоз, свідчать, що побачивши змію вони присідають і завмирають. Як правило, ця стратегія себе виправдовує — змія проповзає повз і не помічає жабу[81].
У безхвостих спостерігаються два тими шлюбної поведінки: сезонна і спонтанна. При першому типі, характерному для більшості видів безхвостих, в певні періоди року дорослі жаби збираються для розмноження в ставках, озерах або струмках. Багато безхвостих повертаються до тієї водойми, в якій вони розвивалися пуголовками. У результаті можна спостерігати сезонні міграції, в які залучені тисячі особин. При спонтанному типі розмноження дорослі жаби прибувають у місця розмноження під поштовхом якоїсь зовнішньої причини (наприклад, випадінням опадів в посушливій місцевості). В такому випадку розмноження і розвиток ікринок та пуголовків відбувається з максимальною швидкістю, до того, як недовговічні водойми (калюжі) встигнуть висохнути[76].
Самці видів безхвостих з сезонним типом шлюбної поведінки звичайно першими прибувають до місць розмноження і залишаються там тривалий час, вони закликають кваканням самиць і захищають свою територію від інших самців. Самиці з'являються пізніше лише на час парування і викидання ікри. В цій ситуації кількість самців біля поди завжди перевищує кількість самиць, тому серед самців існує жорстка конкуренція. Великі і сильні самці видають більш низькі звуки і захоплюють найпривабливіші для розмноження місця. Спостереження показали, що самиці віддають перевагу саме таким самцям[82]. У деяких видів самці можуть застосовувати техніку перехоплення. У них немає своєї території і вони не квакають, а перехоплюють самиць, що знаходять на шляху до самця, що кличе самиць. Оскільки квакання потребує великих затрат енергії, іноді ролі змінюються і самець, що кликав, залишає свою територію і стає перехоплювачем[76].
у видав зі спонтанним типом шлюбної поведінки (наприклад, роду лопатоногів Scaphiopus) основний упор робиться не на вибір партнер, а на швидкість розмноження. Відповідно змінюється й тактика. Самець, що першим знаходить придатне місце (калюжу) починає гучно кликати родичів, на його заклик збігаються всі навколишні представники обох статей, які одразу підхоплюють заклик, створюючи чутний здалеку хор. Іноді придатні умови відсутні роками, і, відповідно, ці види не розмножуються декілька років поспіль[76]. Самиці виду Spea multiplicata звичайно відкладають за один шлюбний сезон близько половини наявної в них ікри. Приускають, що ця стратегія розрахована на появу більш слушних умов для розмноження у майбутньому[83].
За винятком деяких представників роду дереволазів, що утворюють на час шлюбного сезону моногамні пари, всі безхвості полігамні[84].
Як правило, процес парування полягає у тому, що самець сідлає самицю у воді і обхоплює її тіло. Самиця відкладає ікру, а самець покриває її своєю спермою (зовнішнє запліднення). У деяких видів самці можуть затримувати ікринки задніми лапами на час, необхідний для запліднення[76]. у цьому плані унікальним серед безхвостих є види західноафриканського роду Nimbaphrynoides, які розмножуються живородінням, і види танзанійського роду Nectophrynoides, що практикують яйцеживородіння. В обох випадках має місце внутрішнє запліднення, а самиця народжує цілком розвинутих молодих жабенят (сеголеток), які обминають стадію пуголовка[85][86].
Жаб'яча ікра, як правило, запаковано у багатошаровий желатиновий матеріал, що забезпечує ікринкам певний захист і не перешкоджає проходженню (кисню, вуглекислого газі і аміаку). Ця захисна оболонка поглинає вологу і розбухає у воді. Після запліднення внутрішня частина ікринки розріджується, що забезпечує зародку свободу руху при розвитку. У деяких видів (наприклад, червоноокої жаби і Rana sylvatica) у желатиновому матеріалі наявні одноклітинні зелені водорості. Було висунуте припущення, що вони справлять позитивний вплив на розвиток зародка, підвищуючи концентрацію кисню, який утворюється у процесі фотосинтезу[87]. У більшості видів ікринки мають чорний або темно-коричневий колір, що дозволяє їм нагріватись під променями сонця сильніше навколишнього середовища. Так, наприклад, температура всередині кластера ікри Rana sylvatica була на 6 °C вище температури води, що сприяло швидкому розвитку зародків[88]
Розмір і форма аґломерату ікри характерна для кожного виду. Жаби родини Ranidae мають тенденцію до кулястих кластерів, а ропухові до довгих циліндричних кластерів. Крихітний кубинський свистун відкладає по одній ікринці і закопує їх у вологий грант[89]. Leptodactylus pentadactylus створює пінне гніздо у норі, відкладаючи у нього близько тисячі ікринок. Пуголовки з'являють на світ, коли вода заповнює нору, а іноді розвиток повністю проходить у гнізді[90]. Agalychnis callidryas з родини райкові відкладає ікринки на листя, розташоване над поверхнею водойми. Після вилуплення пуголовки падають з листя у воду[91].
У деяких видів на певній стадії розвитку зародки у ікринках можуть вловити вібрації, що спричинюються хижаками (осами, зміями), і вилупитися раніше часу, щоб дістати мобільність і уникнути гибелі[92]. Загалом, тривалість стадії розвитку зародків в ікрі залежить від конкретного виду і навколишніх умов. Як правило, пуголовки вилуплюються протягом тижня після того, як капсула ікринки розпадається під дією гормону, що виробляється зародком[93].
Личинки безхвостих, що з'являються з ікринок, відомі як «пуголовки». Вони ведуть повністю водний спосіб життя, але відоме один виняток — пуголовки виду Nannophrys ceylonensis напівсухопутні і мешкають серед мокрого каміння[94][95]. Тіло пуголовків, як правило, має овальну форму, хвіст довгий, сплющений по вертикалі, пристосований для плавання. У пуголовків хрящовий хребет, очі не мають повік, є орган бічної лінії, для дихання слугують зябра[96].
Спочатку у пуголовків з'являються зовнішні зябра, а пізніше внутрішні (зябровий мішок закриває зябра і передні ноги). Легені, що розвиваються, слугують додатковим дихальним органом. Деякі види проходять метаморфоз ще в ікринці і з'являються у світ вже жабенятами. У пуголовків немає справжніх зубів, але у багатьох видів щелепи вкриті паралельними рядами кератинових зубчиків (два ряди на верхній щелепі, три ряди на нижній і роговий дзьоб). Кількість рядів і точна морфологія варіюють у різних видів і можуть слугувати діагностичною ознакою[93]. Пуголовки родини пипові (за винятком роду Hymenochirus) мають перу передніх вусиків, що роблять їх схожими на невеликих сомиків[64].
Пуголовки, як правило травоїдні і харчуються водоростями, відфільтрованими з води через зябра. Деякі види є хижаками вже на стадії пуголовка і харчуються комахами; пуголовки (Osteopilus septentrionalis практикують канібалізм, а також поїдають маленьких риб. Пуголовки, що рано відростили ноги, можуть стати жертвою своїх співбратів[97].
На пуголовків полюють риби, саламандри, хижі жуки і птахи (наприклад, рибалочка). Деякі пуголовки, у тому числа личинки Bufo marinus, отруйні. У різних видів безхвоста стадія пуголовка триває від тижня до декількох місяців і залежить від стратегії розмноження[98].
Після завершення стадії пуголовка безхвості проходять процес метаморфозу, під час якого системи організму різко перебудовують у дорослу форму. Як правило метаморфоз триваю близько доби. Він починається з вироблення гормону тироксину, який впливає на розвиток тканин. Так, зміна органів дихання включає розвиток легенів паралельно зі зникненням забрів і зябрового мішку. Передні кінцівки стають видимими. Нижня щелепа набуває характерної для хижака форми, кишечник стає коротшим. Нервова система адаптується під стереоскопічні зір і слух, а також під нові способи пересування і харчування. Очі зсуваються вище, формуються повіки і пов'язані з ними залози. Утворюються органи слуху (слухова перетинка, середнє і внутрішнє вухо). Шкіра стає більш товстою і міцнішою, орган бічної лінії зникає (у більшості видів), формують шкіряні залози. На останньому етапі метаморфозу зникає хвіст, його тканини йдуть на розвиток кінцівок[99][100].
Личинка жаби Rana temporaria за день до метаморфозу.
Безхвості, що пройшли метаморфоз, переходять у характерне для свого виду середовище проживання. Практично всі види дорослих безхвостих — хижаки. Вони полюються на безхребетних, включно з членстоногими, червами і равликами. Існують великі види поїдають інших земноводних, невеликих ссавців і птахів. Одні безхвості ловлять свою жваву здобич клейким язиком, інші запихають їжу до рота передніми кінцівками. Деревна жаба Xenohyla truncata є винятком, оскільки харчується фруктами[101]. На безхвостих полють багато хижаків, у тому числі чаплі, яструби, риби, великі саламандри, змії, єноти, тхори та інші[102].
Безхвості є первинними хижаками, важливою складовою харчового ланцюжку. Ці холоднокровні тварини ефективно споживають їжу — витрачають лише невелику частину енергії на метаболічні процеси, а решту конвертують в біомасу. Вони слугують їжею вторинним хижакам, а самі харчуються членистоногими, здебільшого травоїдними. Таким чином, поїдаючи споживачів рослин, безхвості збільшують приріст біомаси рослин, що сприяє балансу екосистеми[103].
Тривалість життя безхвостих у природних умовах є маловивченою. З використанням методів хребтохронології тривалість життя жаби Rana muscosa була виміряна за сезонними змінами росту фаланг пальців. Отримані дані дозволяють зробити припущення, що максимальна тривалість життя дорослої особини становить 10 років, а враховуючи стадію пуголовка, яка у цього виду триває близько 4 років, тривалість життя цих жаб рівний 14 рокам[104]. У неволі зареєстрована тривалість життя безхвостих до 40 років, такого віку досягла ропуха звичайна. Жаба-ага жила у неволі 24 роки, а жаба-бик — 14 років[105].
Способи піклування про потомство у безхвостих вивчені недостатньо. Припускають, що близько 20% видів земноводних так чи інакше піклуються про дитинчат[106]. Існує зворотний зв'язок між розмірами водойми, що слугує для розмноження, і рівнем батьківської опіки, яку проявляють безхвості. Види безхвостих, що розмножуються в невеликих водоймах, демонструють більш складні рівні батьківського піклування[107]. У великих водоймах великий процент ікри і пуголовків поїдається хижаками. Та цьому тлі деякі види безхвостих адаптувались відкладати ікру на суходолі. Зокрема вони піклуються про те, щоб підтримувати ікру вологою в умовах суходолу[108]. Додаткова батьківська опіка проявляється при транспортуванні до водойм пуголовків, що вилупились на суходолі[107].
У невеликих водоймах хижаків менше і виживання пуголовків регулюється в основному внутрішньою конкуренцією. Деякі види жаб для уникнення цієї конкуренції переносять нових пуголовків у невеликі внутршньорослинні порожнини (лат. phytotelmata), заповнені водою[109]. Незважаючи на відсутність конкуренції, в таких порожнинах мало ресурсів, тому батькам доводиться годувати своїх пуголовків. Деякі види годують пуголовків незаплідненими клітинами[107]. Приміром, маленький дереволаз (Oophaga pumilio) відкладає ікру просто на землі у лісі. Самець охороняє ікру від хижаків і зволожує її з клоаки, щоб вона не пересохла. Коли пуголовки вилуплюються, самиця переносить їх на сині у порожнину якого-небудь представника родини бромелієвих, залишаючи у кожній рослині по одному пуголовку. Після цього самиця регулярно відвідує пуголовків, відкладаючи кожному по одній-двом незаплідненим ікринкам для споживання як їжі, і продовжує їх годувати до настання метаморфозу[110]. Подібним способом піклуються про своє потомство й представники виду Oophaga granulifera[111].
Форми батьківського піклування у безхвостих вельми різноманітні. Крихітний самець Colostethus subpunctatus охороняє свій кластер ікри, відкладений під каменем чи деревиною. Коли пуголовки вилуплюються, він переносить їх на спині (приклеєними слизовими виділеннями) у тимчасову водойму, де, частково занурюючись у воду, звільняє одного чи декількох пуголовків, після чого переходить на наступної водойми[112]. Самець жаби-повитухи носить ікринки з собою приклеєними до задніх кінцівок. У посушливу погоду він зволожує їх, занурюючись у ставок, а щоб вони занадто не намокнули у мокрій траві, підіймає задню частину тіла. Через три-шість тижнів він перестає виходити зі ставка, і за деякий час після цього з ікринок вилуплюються пуголовки[113]. Південноамериканська жаба Engystomops pustulosus споруджує з піни гніздо, в яке відкладає ікру. Піноматеріал складається з білків і лектинів і, можливо, має антибактеріальні властивості[114]. Декілька пар жаб можуть будувати спільне гніздо. У цьому випадку спершу будується «пліт», а потім жаби відкладають ікру в його центрі, при цьому чергуються відкладання ікри і формування піноматеріалу, а завершують процес створенням шару піни зверху ікри[115].
Деякі види безхвостих зберігають потомство всередині своїх тіл. Самець і самиця сумчастої жаби разом охороняють ікру, відкладену на землі. Коли настає час вилуплення пуголовків, самець змащує своє тіло слизовим матеріалом, що оточує ікринки, і занурюється в їх масу. Після вилуплення пуголовки влізають у шкіряні кишені самця, де залишаються до завершення метаморфозу[116]. Самиці реобатрахусів (можливо нещодавно вимерлі) проковтували свої запліднені ікринки, які розвивались у них в шлунку. На цей час жаби припиняли їсти і виділяти шлункові соки, а пуголовки харчувались жовтком з ікринок. Через шість-сім тижнів самиці широко розкривали рот і відригали пуголовків назовні[117].
Самиця виду рінодерма Дарвіна, що мешкає в Чилі, відкладає на землю 40 ікринок, які охороняють самцем. Коло пуголовки вилуплюються, самець заковтує їх і тримає їх у своєму збільшеному горловому мішку. Пуголовки занурені у в'язку пінисту рідину, яка додатково до жовтка постачає їх поживні речовини. Вони залишаться у мішку від семи до десяти тижнів, після чого проходять метаморфоз, перемірюються у ротову порожнину самця і виплигують назовні[118].
Як домашніх тварин любителі земноводних часто утримують безхвостих у тераріумах, акватераріумах і акваріумах[119]. Безхвостих також розводять і використовують як живий корм для деяких мешканців «домашніх зоопарків» або «живих кутків».
Жаб'ячі лапки в різних країнах уживають як їжу. Традиційний спосіб задоволення потреб місцевого ринку за рахунок локальних популяцій останніми рокам став неможливим через скорочення цих популяцій. В теперішній час існує розвинена міжнародна торгівля жаб'ячими лапками. Основні імпортери — Франція, Бельгія, Люксембург і США, основні експортери — Індонезія і Китай[120]. Річний обіг продажів американської жаби-бика (Rana catesbeiana), яку промислово розводять у Китаї, досягає 2,4 тисяч тон[121]. Розведення їстівних жаб останнім часом цікавляться й інші країни, наприклад, Білорусь[122].
Безхвостих широко використовували в наукових експериментах. У XVIII столітті біолог Луїджі Гальвані відкрив за допомогою експериментів з жабами зв'язок між електрикою і нервовою системою[123]. У 1852 році Г. Ф. Станніус використовував серце жаби в експерименті, названому його ім'ям, який довів, що шлуночки серця і передсердя мають незалежний один від одно ритм[124]. шпоркову жабу гладеньку широко використовували в першій половині XX століття в тесті на вагітність після того, як англійський зоолог Ланселот Хогбен відкрив, що в сечі вагітної жінки присутній гормон хоріонічний гонадотропін, який індукує цю жабу викидати ікру[125]. У 1952 році Роберт Бріггс і Джозеф Кінг клонували жабу методом пересадки ядер соматичних клітин (цим же методом пізніше була клонована вівця Доллі). Це був перший успішний експеримент з клонування вищих тварин шляхом ядерної трансплантації[126]. Жаб широко використовують в дослідженнях в галузі ембріології. Шпоркові жаби залишились модельними організмами в біології розвитку й після розроблення сучасніших тестів на вагітність, оскільки їх легко утримувати в лабораторних умовах, а їх ембріони достатньо великі для маніпулювання[127]. При цьому шпоркових жаб гладеньких частіше замінюють дрібнішим родичем, Xenopus tropicalis, який досягає статевої зрілості у 5 місяців (а не в рік або два, як шпоркова жаба гладенька)[128], і це прискорює дослідження, що потребують декількох поколінь жаб. Геном X. tropicalis станом на 2012 рік перебував у процесі секвенування[129].
Надзвичайна різноманітність токсинів, які виробляються безхвостими, викликала інтерес біохіміків до цієї «природної аптеки». Алкалоїд епібатидин, болезаспокійливе, у 200 разів більш потентне, ніж морфій, був виявлений у деяких видів роду листолазів. Зі шкіри безхвостих був виділений пептид, що можливо блокує ділення вірусу ВІЛ[130][131].
Жаб використовують на практичних заняттях з диссекції в школах та університетах. Як правило, їх попередньо обробляють пігментами для отримання контрасту між різними системами організму. На тлі руху за права тварин цю практику останнім часом заступає віртуальна диссекція оцифрованих жаб — комп'ютерні програми, що симулюють організм живої жаби[132].
Отруту безхвостих застосовують як галюциноген. Тривалий час вважалось, що у доколумбову добу жителі Мезоамерики використовували з цією метою отруту жаби-аги. Пізніші дослідження показали, що більш вірогідним кандидатом на цю роль є отрута жаби Bufo alvarius, що містить буфотенін (5-MeO-DMT), психоактивну речовину, яку й нині застосовують у рекреаційних цілях. Типовим способом вживання є куріння висушених шкіряних виділень жаби[133]. У ЗМІ з'являлись повідомлення про людей, котрі злизували наркотичну речовину просто зі шкіри жаби, але, можливо, це міська легенда[134].
Крім того, отруту безхвостих здавна застосовували для виготовлення отруйних стріл і дротиків. За допомогою шкіряних виділень жахливого листолаза південноамериканські індійці виготовляли отруйні стрілки. Наконечник натирали об спину жаби, стрілками стріляли з духової трубки на полюванні. Комбінація двох токсинів, наявних y цих виділеннях (батрахотоксин і гомобатрахотоксин), є настільки сильною, що отрути однієї жаби, як гадають, достатньо, щоб вбити 22 000 мишей[135]. Два інших види листолазів (Phyllobates aurotaenia і Phyllobates bicolor), також використовували як джерело отрути, але концентрація отрути в них менше, і для того, щоб вона почала виділятись, їх потрібно підігріти на вогні[136]. Ці отрути досліджують щодо можливості використання в медицині[137].
Дослідження, розпочаті у 1950-х роках, відмічають значне скорочення чисельності безхвостих. Більше третини видів перебувають під загрозою вимирання, понад 120 видів вважаються вимерлими в період з 1980 по 2004 рік[138]. Серед цих видів значиться й помаранчева жаба з Коста-Рики. Її зникнення викликало серйозне занепокоєння дослідників, пов'язане з тим, що ця жаба мешкала у заповіднику «Monteverde Cloud Forest Reserve» і її вимирання не могло бути викликане безпосередньо людським втручанням. В інших місцях зниження чисельності безхвостих зумовлене руйнуванням середовища проживання, полютантами, змінами клімату і поширенням чужорідних хижаків, паразитів і конкурентів. Особливо руйнівним для популяції безхвостих вважаються інфекційні хвороби хітридіомікоз і ранавірус[2][139][140].
Багато дослідників вважають, що підвищена чутливість земноводних і, зокрема, безхвостих, до забруднення довкілля пов'язана з такими факторами, як їх проміжна позиція в харчовому ланцюжку, проникна шкіра і життєвий цикл, що включає водну стадію (пуголовок) і наземний спосіб життя дорослої особини[141]. Ті нечисленні види безхвостих, у яких водний етап життя скорочений або зовсім відсутній, мають більшу опірність забрудненню ніж типові безхвості, що розвиваються у воді від стадії ікринки до кінця метаморфозу[142].
Кількість мутацій і генетичних дефектів, що спостерігаються у безхвостих, збільшилась за час спостережень з 1990-х по 2003 рік. Одним з розповсюджених дефектів є відсутні або зайві кінцівки. Серед різноманітних гіпотез з питання причин, що викликають ці дефекти, — збільшення ультрафіолетового випромінювання, що потрапляє на ікру, забруднення сільськогосподарськими отрутохімікатами і паразитичні захворювання, наприклад, зараження трематодами Ribeiroia ondatrae. Можливо, що всі ці фактори діють разом (радіаційний і хімічний стрес знижують опірність організмів паразитам). Дефекти кінцівок погіршують рухливість і, відповідно, шанси тварини дожити до статевої зрілості[143][144].
Дослідження, проведене в Канаді у 2006 році, показало, що висока щільність траспорту для безхвостих є більшою загрозою, ніж погіршення середовища проживання[145]. В деяких випадках були започатковані програми розмноження в неволі, які, здебільшого були успішними[146][147]. У 2007 році було опубліковане дослідження, яке виявило, що деякі пробіотичні бактерії можуть підвищувати опірність безхвостих летальним грибковим захворюванням[148]. Була розроблена програма «Панамський проект зі спасіння і збереження амфібій» (англ. The Panama Amphibian Rescue and Conservation Project) для збереження у східній Панамі деяких видів безхвостих, які гинуть від цих хвороб; програма включає розробку польових методів використання пробіотиків[149]. Світова асоціація зоопарків і акваріумів (англ. World Association of Zoos and Aquariums) оголосила 2008 рік роком жаби з метою привернення уваги суспільства до проблеми охорони безхвостих[150].
У багатьох народів світу жаби, і ще у більшому ступені ропухи, асоціювались з цілою низкою неприємних властивостей[151]. В китайській традиції жаба символізує «Їнь». Дух жаби Цін-ва Шен асоціюється з одужанням і удачею у справах. Символ «жаба в колодязі» відноситься до людини обмеженої[152]. У європейському фольклорі ропухи асоціювались з відьмами як фамільяри, джерела інгредієнтів для магічного зілля, а іноді мали власні магічні властивості[153]. В давньоперуанській культурі Моче безхвості були одним з тварин, яким віддавали шану, а також часто з'являлись у творах мистецтва[154]. За легендою Панами, удача супроводжує того, хто побачить панамську золоту жабу (Atelopus zeteki). У варіанті цієї легенди говориться, що, після смерті ці жаби перетворюються на золотий талісман вака[155].
В українській етнокультурі жаби фігурують в замовляннях і зашіптуваннях, відоме їх використання у народній медицині. З поведінкою жаб пов'язана низка народних прикмет, наприклад «багато жаб на стежках — на дощ», «жаби квакають — на дощ». У народній мові жаби часто виступали об'єктом негативної характеристики (наприклад, «Одступись, зелена жабо!»), а також прокльону. Іронізування й кепкування спричиняють відсутність у жаби хвоста («якби жабі хвоста, була б непроста»), великий рот («жаба і на вола рот роззявляє»), а також характерне надування і квакання («жаба дулася, дулася, та й лопнула»). З цими тваринами пов'язано багато народних прислів'їв (наприклад, «кожна жаба своє болото хвалить»), приказок («роздайся, море, жаба лізе»)[156].
Безхвості часто виступають як персонажі в літературі[157]. Найдавніший художній твір, в назві якого фігурують безхвості і що дійшов до нашого часу, — це комедія Аристофана «Жаби», вперше поставлена у 405 році до н. е. Як додаткові приклади можна навести:
Безхво́сті (Anura, Salientia, Ecaudata) — ряд земноводних, який є найбільшим із сучасних, нараховуючи понад 6000 відомих науці видів. Личинку безхвостого земноводного називають пуголовком.
Знахідки викопних форм, дуже схожих з жабами, відомі з нижньої юри, однак не всі дослідники включають їх до даного ряду. Найдавніші безперечні представники безхвостих відомі починаючи з середньої юри. Серед найдавніших є Triadobatrachus massinoti. В теперішній час безхвості поширені по всій земній кулі, від тропіків до субарктичних регіонів, найбільше різноманіття видів спостерігається у тропічних дощових лісах.
Розміри дорослих безхвостих варіюють у межах від 7,7 мм (Paedophryne amauensis) до 320 мм (Conraua goliath). Представники ряду мають кремезний тулуб, випуклі очі, роздвоєний язик і зігнуті під тулубом кінцівки; хвіст відсутній (звідки й назва). Середовище проживання безхвостих на всіх стадіях розвитку включає прісні водойми, а для дорослих особин — додатково суходіл, крони дерев і підземні нори. Найбільш характерний спосіб пересування безхвостих — це стрибки, але різні види опанували додаткові способи, такі як ходіння і біг, плавання, лазіння по деревах і планерування.
Покрив безхвостих має багато залоз, шкіряні виділення деяких видів надзвичайно отруйні. Скупчення залоз у деяких видів створюють враження, що шкіра вкрита бородавками, багато інших видів мають гладеньку шкіру. Забарвлення безхвостих варіює від маскувального бурого, зеленуватого і сірого до найяскравіших червоних, жовтих і чорних кольорів, що зазвичай сигналізують про отруйність (або є мімікрією під неї). Шкіра безхвостих проникна для води, але різні адаптації дозволяють їм уникати надмірної втрати вологи при сухопутному способі життя.
Як правило, безхвості відкладають ікру у воді. З ікринок вилуплюються водні личинки, пуголовки, що мають зябра і хвости. Пуголовки проходять стадію метаморфозу, в кінці якої перетворюються у дорослих особин. У той же час, деякі види відкладають ікру на суходолі, а інші не проходять стадію пуголовка. Дорослі особини більшості видів є хижаками, але є й всеїдні види і навіть декілька видів, які харчуються фруктами. Безхвості здатні видавати широкий діапазон звукових сигналів, особливо під час шлюбного сезону. Спостереження за безхвостими виявили складні схеми поведінки у шлюбних ритуалах, при загрозі життю і в інших ситуаціях.
Багато видів безхвостих (за деякими даними, до третини від всіх видів земноводних) перебувають під загрозою вимирання.
Люди вживають безхвостих у їжу, утримують як домашніх тварин, крім того, безхвості слугують зручними модельними організмами для біологічних досліджень.
Bộ Không đuôi là một nhóm động vật lưỡng cư đa dạng và phong phú, chúng có cơ thể ngắn, không đuôi, có danh pháp khoa học là Anura (tiếng Hy Lạp cổ đại an-, thiếu + oura, đuôi). Hóa thạch "tiền không đuôi" cổ nhất xuất hiện vào đầu kỷ Trias ở Madagascar, nhưng nghiên cứu đồng hồ nguyên tử gợi ý rằng nguồn gốc của chúng có thể kéo dài đến kỷ Permi, 265 triệu năm trước. Bộ Không đuôi có phạm vi phân bố rộng, từ miền nhiệt đới tới vùng cận bắc cực, nhưng nơi tập trung sự đa dạng loài nhất rừng mưa nhiệt đới. Hiện có khoảng 4.800 loài được ghi nhận, hơn 85% số loài lưỡng cư hiện đại. Đây cũng là bộ động vật có xương sống đa dạng thứ năm.
Quần thể các loài thuộc bộ này đã suy giảm đáng kể từ những năm 1950. Hơn một phần ba số loài được coi là bị đe dọa và có nguy cơ tuyệt chủng và hơn một trăm hai mươi được cho là đã bị tuyệt chủng từ những năm 1980.[1] Số lượng các cá thể ếch di tật đang tăng và loại bệnh nấm chytridiomycosis nổi lên, đã lan rộng trên toàn thế giới. Các nhà sinh học bảo tồn đang làm việc để tìm hiểu nguyên nhận của các vấn đề này và giải quyết chúng. Ếch có giá trị làm thức ăn cho con người và cũng có nhiều vai trò văn hóa trong văn học, biểu tượng và tôn giáo.
Từ "ếch" xuất phát từ tiếng Anh cổ frogga, viết tắt thành frox, forsc, và frosc, có lẽ lại xuất phát từ ngôn ngữ tiền Ấn-Âu preu = "để nhảy".[2] Khoảng 88% số loài lưỡng cư được phân loại trong bộ Anura.[3] Bao gồm khoảng 4.810 loài trong 33 họ, trong đó Leptodactylidae (1.100 loài), Hylidae (800 loài) và Ranidae (750 loài) là giàu số lượng loài nhất.[3]

Cách sử dụng các tên thông thường như "ếch" và "cóc" không được dùng trong phân loại. Thuật ngữ "ếch" thường được sử dụng cho các loài thủy sinh hay bán thủy sinh với da trơn, có nhất nhờn; thuât ngữ "cóc" dùng cho các loài có da khô, sần.[4][5] Có nhiều ngoại lệ trong quy tắc này. Cóc tía châu Âu (Bombina bombina) có da sần và thích sống nơi ẩm ướt[6] trong khi ếch vàng Panama (Atelopus zeteki) là một loài cóc trong họ Bufonidae (họ gồm các loài được xem là "cóc thực sự") và có da trơn.[7]
Bộ Anura gồm tất cả các loài ếch, nhái hiện đại và một vài hóa thạch phù hợp với định nghĩa bộ Không đuôi. Đặc điểm của cá thể trưởng thành trong bộ gồm: 9 đốt tiền xương cùng hay ít hơn, xương chậu dài và hơn nghiêng về phía trước, sự có mặt của xương cụt, không đuôi, chi trước ngắn hơn chi sau, xương quay và xương trụ hợp nhất, xương chày và xương mác hợp nhất, xương mắt cá nhân thuôn dài, thiếu xươn trán, có xương móng, hàm dưới thiếu răng (với ngoại lệ là Gastrotheca guentheri) gồm ba cặp xương (xương góc hàm, xương hàm, và xương cằm Merkel (Pipoidea không có xương cằm Merkel),[8] bạch huyết ngay dưới da.[9] Ấu trùng bộ Không đuôi (nòng nọc) có một lỗ thở đơn, phần miệng có mỏ keratin và răng nhỏ.[9]
Bộ Không đuôi được phân loại thành ba phân bộ và một chi đơn loài độc lập Aerugoamnis paulus[10]: Archaeobatrachia, bao gồm bốn họ không đuôi nguyên thủy; Mesobatrachia, bao gồm năm họ các loài ếch trung gian; và Neobatrachia, nhóm lớn nhất, bao gồm 24 họ không đuôi phát triển, bao gồm hầu hết các loài phổ biết được tìm thấy toàn thế giới. Phân bộ Neobatrachia lại được chia thành hai siêu họ Hyloidea và Ranoidea.[11] Phân loại này dựa trên hình thái học cùng với số lượng đốt sống, cấu trúc đai ngực, và hình thái nòng nọc. Mặc dù phân loại này được công nhận rộng rãi, mối quan hệ giữa các họ vẫn bị tranh cãi.[12]
Một vài loài không đuôi dễ dàng lai ghép. Ví dụ, Pelophylax esculentus là loài lai giữa Pelophylax lessonae và Pelophylax ridibundus.[13] Cóc tía châu Âu (Bombina bombina) và Cóc tía bụng vàng (B. variegata) tương tự trong việc tạo ra con lai. Các con lai này ít có khả năng sinh sản hơn bố mẹ chúng.[14]
Biểu đồ chỉ ra mối quan hệ giữa các họ không đuôi khác nhau trong nhánh Anura như thể hiện trong hình dưới đây. Biểu đồ này, dưới dạng cây phát sinh chủng loài, chỉ ra mối quan hệ giữa các họ, với mỗi nút đại diện cho điểm có tổ tiên chung. Biểu đồ dựa theo Frost et al. (2006)[15] và Heinicke et al. (2009).[16] và Pyron & Wiens (2011).[17]
Phân loại Bộ Không đuôiAnura
Costata
Xenoanura
Anomocoela
Sooglossoidea
Notogaeanura
Australobatrachia
Terrarana
Agastorophrynia
Diphyabatracea
Allodapanura
Xenosyneunitanura
Pyxicephaloidea
Ếch xuất hiện trong nhiều truyền thuyết, truyện cổ tích, và trong văn hóa đại chúng. Chúng có xu hướng được mô tả là những con vật tốt bụng, xấu xí, và vụng về, nhưng có tài năng tìm ẩn. Một vài ví dụ bao gồm Michigan J. Frog, "Hoàng tử ếch", và Kermit the Frog.
Cóc lại được mô tả chủ yếu về điều xấu. Trong những truyện cổ tích châu Âu, nó bị cho rằng là phụ tá của phù thủy và có sức mạnh ma thuật. Chất độc từ da chúng được sử dụng để chế biến thuốc độc, nhưng cũng được dùng để tạo ra thuốc trị các căn bệnh ma thuật cho con người và động vật. Cóc cũng liên kết với quỷ dữ, trong Thiên đường đã mất của John Milton, Satan đã sai một con cóc đổ chất độc vào tai Eve.[18]
Người Moche ở Peru cổ đại tôn thờ những động vật này, và thường mô tả chúng trong nghệ thuật của họ.[19] tại Panama,, truyền thuyết địa phương cho rằng may mắn sẽ đến với bất cứ ai phát hiện ra một con ếch vàng Panama. Vài người tin rằn khi một con ếch vàng Panama chết, nó sẽ biến thành một lá bùa được biết đến như huaca. Ngày nay, mặc dù đã tuyệt chủng hầu hết trong tự nhiên, ếch vàng Panama vẫn là một biểu tượng văn hóa quan trọng và có thể được tìm thấy trên vải trang trí Molas được thực hiện bởi người Kuna. Chúng cũng xuất hiện trên cầu vượt tại thành phố Panama, trên áo thun hay thận chí vé số.[20]
|date= (trợ giúp) Bộ Không đuôi là một nhóm động vật lưỡng cư đa dạng và phong phú, chúng có cơ thể ngắn, không đuôi, có danh pháp khoa học là Anura (tiếng Hy Lạp cổ đại an-, thiếu + oura, đuôi). Hóa thạch "tiền không đuôi" cổ nhất xuất hiện vào đầu kỷ Trias ở Madagascar, nhưng nghiên cứu đồng hồ nguyên tử gợi ý rằng nguồn gốc của chúng có thể kéo dài đến kỷ Permi, 265 triệu năm trước. Bộ Không đuôi có phạm vi phân bố rộng, từ miền nhiệt đới tới vùng cận bắc cực, nhưng nơi tập trung sự đa dạng loài nhất rừng mưa nhiệt đới. Hiện có khoảng 4.800 loài được ghi nhận, hơn 85% số loài lưỡng cư hiện đại. Đây cũng là bộ động vật có xương sống đa dạng thứ năm.
Quần thể các loài thuộc bộ này đã suy giảm đáng kể từ những năm 1950. Hơn một phần ba số loài được coi là bị đe dọa và có nguy cơ tuyệt chủng và hơn một trăm hai mươi được cho là đã bị tuyệt chủng từ những năm 1980. Số lượng các cá thể ếch di tật đang tăng và loại bệnh nấm chytridiomycosis nổi lên, đã lan rộng trên toàn thế giới. Các nhà sinh học bảo tồn đang làm việc để tìm hiểu nguyên nhận của các vấn đề này và giải quyết chúng. Ếch có giá trị làm thức ăn cho con người và cũng có nhiều vai trò văn hóa trong văn học, biểu tượng và tôn giáo.
Скелет бесхвостых, как и у других наземных позвоночных, включает череп, позвоночник, пояса конечностей и скелет свободных конечностей. Рёбра не соединены друг с другом[28].
Череп уплощённый, преимущественно хрящевой[29]. Боковые затылочные кости образуют парные затылочные мыщелки, соединяющие череп с шейным позвонком.
Позвоночник бесхвостых состоит из четырёх отделов — шейного, туловищного, крестцового и хвостового. Шейный и крестцовый отделы включают всего по одному позвонку. В туловищном отделе 7 позвонков. Все позвонки хвостового отдела срослись в единую кость — уростиль[29].
Пояс передних конечностей состоит из парных лопаток, ключиц и коракоидов и непарной грудины. Пояс задних конечностей состоит из подвздошных и седалищных костей. Седалищные кости соединены лобковым хрящом[29].
Строение конечностей бесхвостых варьирует от вида к виду и зависит от среды обитания — наземной, водной или древесной. Как правило, бесхвостые способны совершать резкие движения, что позволяет им ловить добычу и ускользать от хищников. Эффективные способы передвижения обеспечиваются несколькими особенностями строения конечностей:
Развитие конечностей может быть осложнено в некоторых ситуациях:
У многих видов бесхвостых кожа проницаема для воды (самый проницаемый участок кожи — область таза). Эта особенность создаёт для бесхвостых угрозу потери жидкости и пересыхания. У некоторых бесхвостых, ведущих древесный образ жизни, можно обнаружить адаптацию в виде дополнительного водонепроницаемого слоя кожи. Другие бесхвостые минимизируют потерю воды поведенческими адаптациями: ночным образом жизни, принятием поз, уменьшающих площадь соприкосновения кожи с воздухом[33], например, они отдыхают в группах тесно прижавшись друг к другу[33].
Кожа бесхвостых помогает им маскироваться. Представители некоторых видов способны менять оттенок кожи, чтобы лучше сливаться с окружающим фоном[34]. Кожа бесхвостых, ведущих наземный образ жизни, часто бывает покрыта бородавками и морщинами (что позволяет им мимикрировать под элементы почвы), тогда как у бесхвостых, ведущих древесный образ жизни, кожа, как правило, гладкая (эти виды чаще мимикрируют под элементы растений)[34].
Некоторые виды бесхвостых меняют окрас кожи в зависимости от уровня освещения и влажности окружающей среды. Эту способность обеспечивают специальные клетки, наполненные пигментом, размер которых меняется под влиянием света и влажности. Изменение окраса кожи от более светлого к более тёмному способствует терморегуляции этих видов[35].
Многие бесхвостые вырабатывают токсичные вещества, служащие им как для защиты от хищников, так и для нападения. Например, у жаб ядовитые железы расположены в верхней части головы над глазами[36]. Химический состав яда бесхвостых зависит от вида и может включать в себя раздражители кожи, галлюциногены, нервно-паралитические токсины, вазоконстрикторы, токсины, вызывающие конвульсии и другие. Хищники, специализирующиеся на определённых видах бесхвостых, как правило, адаптированы к присущему этим видам типу яда, но неспециализированные животные, как и человек, могут серьёзно пострадать от контакта с ядом бесхвостых, в некоторых случаях приводящего к летальному исходу[37].
Источник ядовитых веществ у бесхвостых тоже неодинаков. Некоторые бесхвостые генерируют токсины сами[38], другие же используют токсины, полученные с пищей (чаще всего от членистоногих)[39]. Как правило, бесхвостые сигнализируют о своей ядовитости с помощью яркой, насыщенной, «предупредительной» окраски. Существуют также неядовитые виды бесхвостых, мимикрирующих под ядовитые виды своей окраской, которая отпугивает хищников[40][41].
Кожа бесхвостых проницаема для молекул кислорода, углекислого газа и воды. Кровеносные сосуды, расположенные прямо под кожей, позволяют им дышать при полном погружении в воду, так как кислород проходит из воды через кожу прямо в кровь. На суше бесхвостые дышат с помощью лёгких. У них отсутствует система мышц (брюшных, диафрагмы и межрёберных), которая обеспечивает у млекопитающих механизм вдоха-выдоха . Вместо неё у бесхвостых растягивается горло, воздух входит через ноздри, а затем сжатие мышц ротовой полости загоняет воздух в лёгкие[42]. В августе 2007 года был открыт вид лягушек Barbourula kalimantanensis, ведущих полностью водный образ жизни. Это первый открытый вид бесхвостых, не имеющих лёгких[43].
Бесхвостые имеют трёхкамерное сердце, как и рептилии (за исключением крокодилов, у которых сердце четырёхкамерное). Насыщенная кислородом кровь из лёгких поступает в сердце через левое предсердие, а обогащённая углекислым газом кровь из тканей, а также насыщенная кислородом кровь из кожных вен — через правое [1]. Таким образом, в левом предсердии кровь у амфибий артериальная, а в правом - смешанная. Специальный клапан регулирует подачу крови из желудочка сердца в аорту или в лёгочную артерию, в зависимости от типа крови. Этот механизм обеспечивает минимальное смешивание крови с повышенной концентрацией кислорода и крови, насыщенной углекислым газом, и, таким образом, способствует более активному обмену веществ[44].
Некоторые виды бесхвостых адаптированы к выживанию в воде с пониженной концентрацией кислорода. Так, например, лягушка Telmatobius culeus, обитающая в высокогорном озере Титикака, имеет морщинистую кожу с увеличенной площадью поверхности, что способствует обмену газов. Как правило, эта лягушка не использует свои рудиментарные лёгкие. Наблюдения показали, что представители этого вида, находясь на дне озера, время от времени совершают ритмичные движения вверх-вниз, что увеличивает течение воды вокруг них[45].
Зубы бесхвостых, т. н. педицеллярные зубы, расположены в верхней челюсти[28], с их помощью животные удерживают пищу перед тем, как её проглотить. Эти зубы недостаточно крепки для укусов или поимки жертвы. Свою пищу (мух и других мелких движущихся животных) бесхвостые ловят липким, раздвоенным языком. В пассивном состоянии язык свёрнут во рту. Он прикреплён спереди к челюстям, и лягушка может «выстрелить» им вперёд и возвратить его назад с большой скоростью[12]. У некоторых бесхвостых нет языка, и они засовывают пищу в рот передними конечностями[12]. У других глаза могут втягиваться через отверстия в черепе и, надавливая на пищу, находящуюся во рту, проталкивать её в горло[12]. Проглоченная пища проходит через пищевод в желудок, где обрабатывается пищеварительными энзимами. После этого она поступает в тонкий кишечник, где продолжает перевариваться. Секреция сока поджелудочной железы и жёлчи, производимой печенью и накапливающейся в жёлчном пузыре, происходит в тонком кишечнике. Там же происходит максимальная абсорбция питательных веществ и нутриентов. Непереваренные остатки пищи поступают в толстый кишечник, откуда после абсорбирования излишков воды переходят в клоаку.
Выделительная система бесхвостых схожа по своей структуре с системой млекопитающих. В её основе лежат две почки (мезонефрос), фильтрующие мочевину и другие продукты жизнедеятельности из крови. Полученный фильтрат почки концентрируют в мочу, которая затем проходит через мочеточник и скапливается в мочевом пузыре. Из мочевого пузыря продукты жизнедеятельности организма попадают в клоаку и оттуда — наружу[46].
Репродуктивная система бесхвостых, за отдельными исключениями, основана на внешнем оплодотворении. У многих видов бесхвостых самцы меньше самок. У самцов есть голосовые связки, а у многих видов и горловые мешки, с помощью которых они издают громкое кваканье в брачный сезон. Два семенника прикреплены к почкам, сперма проходит через почки, после чего попадает в мочеточники, а оттуда в клоаку. В отсутствие пениса сперма выбрасывается из клоаки прямо на икру, отложенную самкой во время амплексуса.
У самок есть парные яичники, расположенные около почек. Икринки проходят через парные яйцеводы наружу. Во время амплексуса хватка самца стимулирует откладывание икры самкой. Икринки, как правило, покрыты оболочкой, по консистенции напоминающей желе[46].
Нервная система бесхвостых состоит из головного мозга, спинного мозга и нервов, а также периферических нервных ганглиев. Многие части головного мозга бесхвостых соответствуют частям человеческого мозга. Головной мозг состоит из двух обонятельных долей, двух церебральных хемисфер, шишковидного тела, двух зрительных долей, мозжечка и продолговатого мозга. Мозжечок контролирует мышечную координацию и равновесие, а продолговатый мозг управляет дыханием, пищеварением и прочими автоматическими функциями организма[46]. Относительные размеры головного мозга бесхвостых намного меньше, чем у человека. Они имеют всего 10 пар черепных нервов и 10 пар спинальных нервов, по сравнению с млекопитающими, птицами и рептилиями, которые имеют 12 пар черепных нервов[46]. У бесхвостых нет внешнего уха, а барабанные перепонки открыты наружу. Как и у прочих тетрапод, уши бесхвостых включают в себя вестибулярный аппарат. Имея относительно короткую ушную улитку, бесхвостые используют для распознавания звуков электрический аппарат (в отличие от механического у млекопитающих)[47].
Глаза бесхвостых расположены в верхней части головы и часто выдвинуты вперёд. Это обеспечивает бесхвостым широкое поле зрения; лягушка может полностью погрузиться в воду, оставив над поверхностью лишь глаза. Глаза защищены подвижными веками и дополнительно прозрачной неподвижной мембраной, предохраняющей глаза во время пребывания в воде. Цвет радужной оболочки и форма зрачка у разных видов отличаются[48].
Бесхвостые лучше видят дальние объекты, чем ближние. Квакающие лягушки немедленно умолкают при виде потенциальной угрозы и даже её тени, но чем ближе объект, тем хуже они его видят[48]. Когда лягушка выстреливает языком в сторону добычи, она реагирует на маленький движущийся объект, который плохо различим. Она прицеливается заранее, так как особенности анатомии вынуждают её закрывать глаза при вытягивании языка[12]. Вопрос о наличии у бесхвостых цветного зрения не решён. Опытами была доказана положительная реакция бесхвостых на голубой свет[49].
Лягушки обладают уникальным среди позвоночных зрительным аппаратом. В ходе исследований было обнаружено, что почти 95% информации поступает в рефлекторный отдел мозга. Это приводит к тому, что лягушка не видит, где она находится. Основной вывод — лягушки видят только движущиеся предметы[50].
Бесхвостые слышат как на земле, так и под водой. Внешнего уха у них нет, но, как правило[27], позади каждого глаза присутствует барабанная перепонка. Звук вызывает вибрацию перепонок, которые передают её в среднее и внутреннее ухо. Размер барабанных перепонок и дистанция между ними коррелируют с частотой звука, на которой квакает данная лягушка. У некоторых видов, например у лягушки-быка, размер перепонок относительно размера глаз указывает на половую принадлежность. У самцов перепонки больше глаз, а у самок они схожего размера. Как правило, бесхвостые не полагаются только на слух, и даже на резкий звук они не будут реагировать, пока не увидят его источник[51].
В экстремальных погодных условиях некоторые виды бесхвостых погружаются в состояние анабиоза и могут не проявлять никакой активности в течение нескольких месяцев. В холодных областях бесхвостые зимой впадают в спячку. Некоторые наземные бесхвостые (например, американская жаба) роют себе на зиму нору и спят в ней. Другие виды, менее приспособленные к рытью, прячутся в расщелинах или закапываются в сухие листья. Водные виды (например, лягушка-бык), как правило, залегают на дне водоёма, частично погружаясь в ил, но сохраняя, тем не менее, доступ к кислороду, растворённому в воде. Их метаболизм замедляется, и они выживают за счёт потребления внутренних энергетических резервов. Многие бесхвостые могут выжить после замерзания. Несмотря на то, что под их кожей и в полостях тела образуются кристаллы льда, жизненно важные органы защищены от замерзания вследствие высокой концентрации глюкозы в тканях. С виду безжизненная, замёрзшая лягушка может начать дышать и возобновить работу сердца, если её отогреть[52].
С другой стороны, Cyclorana alboguttata во время жаркого сухого сезона в Австралии впадает в состояние эстивации (летней спячки), обходясь без пищи и воды 9-10 месяцев в году. Эта лягушка зарывается в землю и сворачивается в защитном коконе, который образует её сброшенная кожа. Исследования показали, что во время эстивации метаболизм лягушки меняется так, что КПД митохондрий увеличивается, позволяя более эффективно использовать ограниченное количество энергетических ресурсов, доступных лягушке в состоянии спячки. Пытаясь ответить на вопрос, почему этот механизм не имеет широкого распространения в царстве животных, исследователи пришли к выводу, что он полезен только холоднокровным животным, находящимся в состоянии анабиоза в течение длительного периода, чьи энергетические затраты крайне низки, поскольку у них нет необходимости постоянно генерировать тепло[53]. Другое исследование показало, что для удовлетворения минимальных энергетических требований у лягушки атрофируется большинство мышц (за исключением мышц задних конечностей)[54].
Для каждого вида бесхвостых характерен свой тип кваканья. Кваканье — это звук, который производит проходящий через гортань воздух. У многих видов есть дополнительные адаптации, усиливающие издаваемый звук — горловые мешки, которые представляют собой растягивающиеся кожные мембраны, расположенные под горлом или по сторонам рта. У некоторых представителей бесхвостых (например, норниц и необатрахусов) нет горловых мешков, но тем не менее они способны издавать громкое кваканье, так как их ротовая полость имеет форму купола и достаточно большой объём, чтобы функционировать как усилитель. Кваканье некоторых видов бесхвостых слышно дальше чем за километр[55]. Виды бесхвостых, обитающие преимущественно вдоль проточной воды, часто не имеют адаптаций для усиления звука, так как шумный фон делает звуковую коммуникацию неэффективной[56]. Вместо неё эти виды используют визуальные способы общения («семафорят» друг другу).
Как показывают наблюдения, основная доля коммуникации бесхвостых приходится на привлечение самок. Самцы могут квакать в одиночестве, а могут создавать хор, когда много самцов собирается в удобных для спаривания местах. Самки многих видов бесхвостых (например, Polypedates leucomystax) также квакают в ответ на призывы самцов, что, возможно, повышает локальную репродуктивную активность[57]. Самки предпочитают самцов, издающих более громкие и низкие звуки, которые указывают на здорового и крепкого самца, способного производить наилучшее потомство[58].
Отдельный класс звуков издают самцы или незаинтересованные самки, осёдланные другим самцом. Это характерный чирикающий звук, который сопровождает вибрация тела[59]. Древесные лягушки и некоторые виды наземных бесхвостых имеют в своём репертуаре звук-предупреждение о надвигающемся ливне, который они издают при сочетании некоторых климатических условий[59], а также специфический звук, отгоняющий чужих самцов с удерживаемой территории. Все эти звуки бесхвостые издают с закрытым ртом[59].
Некоторые бесхвостые в состоянии смертельной опасности издают сигнал бедствия с открытым ртом, получая высокий пронзительный звук. Как правило, его издаёт лягушка, схваченная хищником. Иногда дезориентированный этим воплем хищник выпускает лягушку, а иногда на него сбегаются другие хищники, отвлекая поймавшего жертву, что позволяет ей вырваться[59].
Бесхвостые передвигаются различными способами. В зависимости от среды обитания они прыгают, бегают, ходят шагом, плавают, роют норы, лазают по деревьям или планируют.
Бесхвостые считаются лучшими прыгунами из всех позвоночных (по длине прыжка относительно размеров тела)[60]. Австралийская лягушка Litoria nasuta может прыгать на расстояние, превышающее длину её тела (5.5 см) более чем в 50 раз[61]. Ускорение в прыжке может достигать 20 м/с2. Виды бесхвостых сильно отличаются друг от друга по своим способностям к прыжкам. Внутри вида существует положительная корреляция между размером особи и длиной прыжка, но относительная длина прыжка (длина прыжка, поделённая на длину тела) при этом уменьшается. Индийская лягушка Euphlyctis cyanophlyctis имеет уникальную способность выпрыгивать из воды из позиции лёжа на поверхности[62]. Крошечные лягушки Acris crepitans могут «перебегать» по поверхности пруда короткими резкими прыжками[63].
Способность к прыжкам у бесхвостых обусловлена тем, что большая часть их опорно-двигательного аппарата модифицирована для прыжков. Голень, фибула и ступни слиты в единую, прочную кость, равно как и лучевая и локтевая кости передних конечностях (они гасят инерцию во время приземления). Плюсны вытянуты, увеличивая длину ноги, что позволяет лягушке отталкиваться от земли в течение более длительного времени, увеличивая ускорение. Подвздошная кость также вытянута и формирует с крестцом подвижный сустав, который у эволюционно продвинутых бесхвостых, таких как Ranidae и Hylidae, функционирует подобно дополнительному суставу конечности, увеличивая силу прыжка. Хвостовые позвонки срослись в уростиль, который расположен внутри таза. Он позволяет эффективно передавать импульс прыжка от ног к телу[64].
Подобным же образом модифицирована мускулатура бесхвостых. Подобно прочим животным, обладающим конечностями, у древних бесхвостых их движение регулировалось парами мышц — сгибателями и разгибателями. У современных бесхвостых мышцы, способствующие прыжку, непропорционально развиты (основные ножные мышцы составляют более 17% от общей массы лягушки), тогда как мышцы, возвращающие конечности в начальную позицию, практически атрофированы. Замедленная съёмка прыжка показывает, что мышцы ног могут сгибаться пассивно. Вначале они растягиваются (при том, что лягушка продолжает сидеть), затем они сжимаются и тут же разгибаются снова, отправляя лягушку в воздух. Во время прыжка передние конечности прижаты к груди, а задние вытянуты во всю длину[65]. У некоторых видов бесхвостых (например, Osteopilus septentrionalis и Rana pipiens), максимальное усилие, прикладываемое мышцами во время прыжка, может превышать их теоретическую мощность. Это происходит за счёт того, что после сгибания и сжимания мышцы в первый раз полученная энергия переходит к натянутому сухожилию, которое оборачивается вокруг кости лодыжки. При втором сжимании мышц это сухожилие высвобождается подобно катапульте, придавая лягушке ускорение, которого было бы невозможно добиться одним лишь мышечным усилием[66]. Похожий механизм был найден у некоторых кузнечиков, в том числе у саранчи[67].
Бесхвостые из семейств Bufonidae, Rhinophrynidae и Microhylidae имеют короткие задние конечности и передвигаются шагом, а не прыжками[68]. Быстрое передвижение у представителей этих семейств обеспечивают либо ускоренные движения конечностей (быстрая ходьба), либо быстрые короткие прыжки. Метод передвижения Gastrophryne olivacea описан как «комбинация из бега и коротких прыжков (всего несколько сантиметров в длину)»[69]. В одном из экспериментов жаба Bufo fowleri была посажена на беговую дорожку, которая вращалась с разной скоростью. При замере количества кислорода, используемого жабой, было обнаружено, что для этого вида передвижение маленькими прыжками на длинные дистанции является энергетически неэффективным, но может быть оправдано для быстрого перемещения на короткие расстояния[70].
Лягушка Kassina maculata имеет короткие и тонкие конечности, не приспособленные к прыганью. Эта лягушка может быстро бегать, поочерёдно передвигая задние ноги. Замедленная съёмка показала, что аллюр этой лягушки не меняется в зависимости от скорости бега (в отличие, например, от лошади, которая бежит рысью на средних скоростях, а на высоких переходит на галоп)[71]. Этот вид также умеет залезать на деревья и кусты, чем активно пользуется по ночам для ловли насекомых[72]. Индийская лягушка Euphlyctis cyanophlyctis имеет широкие ступни ног и может пробегать несколько метров разом по поверхности воды[63].
Бесхвостые, обитающие в воде, адаптированы к плаванию; для строения их тела характерны сильные задние конечности и наличие плавательных межпальцевых перепонок. Перепонки увеличивают площадь поверхности ступни (наподобие ласт) и способствуют быстрому передвижению лягушек в воде. Представители семейства Pipidae ведут полностью водный образ жизни и поэтому лучше всего приспособлены к этой среде обитания. У них негибкий позвоночник, туловище сплюснуто и вытянуто, мощные задние конечности снабжены большими перепонками, а для лучшей ориентации в воде имеется орган боковой линии[73]. Головастики, как правило, имеют большие хвостовые плавники, придающие ускорение, направленное вперёд, когда хвост движется из стороны в сторону. В воде бесхвостые наиболее беспомощны во время метаморфоза, когда хвост уже атрофирован, а ноги ещё не полностью функциональны[68]
Некоторые бесхвостые адаптировались к жизни под землёй и, как следствие, к рытью нор. У этих видов бесхвостых, как правило, округлое туловище, короткие конечности, маленькая голова с выпученными глазами, а задние ноги адаптированы к рытью. Примером высокой специализации в этом направлении служит Nasikabatrachus sahyadrensis, южноиндийский вид. Она питается термитами и проводит под землёй почти всю свою жизнь. Вылезает она на короткий период во время муссонов, когда в лужах происходит спаривание и размножение. У этой лягушки крошечная голова с вытянутой мордой и округлое тело. Из-за своего подземного образа жизни этот вид был впервые описан лишь в 2003 году, хотя местным жителям она была знакома уже давно[74]
Лопатоноги, обитающие в Северной Америке, тоже адаптированы к подземной жизни. Типичный вид, жаба Spea bombifrons, имеет ороговевший участок на плюснах задних ног, который она использует, чтобы зарываться в землю. Копая, жаба вращает бёдрами из стороны в сторону, погружаясь в рыхлую землю. Летом она удовлетворяется мелкой норой, из которой по ночам выходит на охоту, но зимой эта жаба зарывается гораздо глубже (до 4,5 метров вглубь)[75]. Образовавшийся туннель заполняет земля, а жаба впадает в зимнюю спячку в дальнем конце норы. Во время спячки жаба получает воду из окружающей среды путём осмоса, но, не имея возможности избавляться от мочевины, накапливает её в организме[75]. Весной лопатоноги покидают свои зимние норы практически одновременно и стремятся попасть в образовавшиеся лужи, где они спариваются. Подходящее место громко «анонсируется» первым нашедшим его самцом[76].
Другой роющий вид, австралийский Heleioporus albopunctatus, ведёт совсем иной образ жизни. Эта лягушка роет нору на берегу или под дном реки и регулярно вылезает за пропитанием. Спаривание и откладывание икры происходит в гнезде внутри норы. Икринки развиваются до определённой стадии, но головастики не покидают их до тех пор, пока нору не зальёт сильным ливнем. Только тогда головастики выплывают в открытую воду, где быстро завершают своё развитие[77]. Мадагаскарские лягушки из рода Scaphiophryne зарываются в сухие листья. Один из представителей этого рода, Scaphiophryne marmorata, имеет сплющенную голову и хорошо развитые плюсневые наросты на задних ногах, помогающие ему закапываться. На передних ногах этой лягушки есть увеличенные пальцевые диски, которые помогают ей пробираться через кусты[78]. Этот вид лягушек размножается в лужах, появляющихся после дождей[79].
Древесные бесхвостые обитают в кронах деревьев, где они лазают по веткам, иголкам и листьям. Некоторые из них вообще никогда не спускаются на землю. «Настоящие» древесные лягушки принадлежат к семейству квакши, или древесные лягушки, но встречаются представители других семейств бесхвостых, адаптированные к древесному образу жизни.
Так, среди древесных бесхвостых встречаются представители семейств древолазы, прыгуньи, стеклянные и веслоногие лягушки[68]. Большинство древесных бесхвостых не превышают 10 см в длину и обладают длинными ногами и длинными ступнями с клейкими подушечками на пальцах. Древесные лягушки обладают развитым аппаратом ориентации в пространстве и могут поймать насекомое, повиснув на ветке вниз головой на одном пальце, или же сидя на тростинке, раскачивающейся на ветру[80]. У некоторых представителей подсемейства Phyllomedusinae на ногах есть противопоставленные пальцы. Лягушка Phyllomedusa ayeaye имеет один противопоставленный палец на каждой передней конечности и по два противопоставленных пальца на задних конечностях. Это позволяет ей хвататься за стебли прибрежных растений[81].
На протяжение своей эволюционной истории несколько не связанных между собой видов бесхвостых адаптировались к планирующему полёту[82] Некоторые виды лягушек в тропических лесах специализированы для планирования с дерева на дерево или имеют возможность контролируемо прыгать с дерева на землю («парашютирование»). Типичным представителем таких бесхвостых является лягушка Rhacophorus nigropalmatus, обитающая в Малайзии и Борнео. У неё большие ступни, кончики пальцев расширены и оснащены клейкими подушечками, между пальцами есть летательные перепонки, а вдоль конечностей и области таза имеются дополнительные складки кожи. Растягивая пальцы и конечности, эта лягушка может планировать на значительные расстояния (до 15 метров) между деревьями, изменяя по мере надобности направление движения[83][84]
На первый взгляд, бесхвостые выглядят достаточно беззащитными в свете их небольших размеров, медленного передвижения, тонкой кожи и отсутствия защитных приспособлений (например, рогов, зубов и когтей). Многие бесхвостые имеют окраску нейтральных цветов, позволяющую им быть незаметными на фоне окружающей среды (пока лягушка неподвижна). Другие способны совершать большие прыжки с суши в воду, что позволяет им убежать от хищников[85].
Многие бесхвостые продуцируют токсичные вещества (буфотоксины), делающие их несъедобными для неспециализированных хищников. Большинство жаб и некоторые лягушки имеют большие паротоидные железы, расположенные позади глаз, выделяющие слизь и токсины, которые делают бесхвостых одновременно скользкими и ядовитыми. Если эффект отравления чувствуется моментально, хищник может выпустить лягушку. Если яд имеет замедленное действие, пойманную им лягушку он не спасёт, но хищник (если выживет) будет в дальнейшем избегать представителей данного вида[86].

Ядовитые бесхвостые, как правило, сигнализируют о своей токсичности с помощью яркого окраса кожи (адаптивная стратегия, называемая апосематизмом). Некоторые неядовитые виды мимикрируют под ядовитых. Так, например, лягушка Allobates zaparo неядовита, но мимикрирует под два разных вида, которые обитают на её территории. В случае присутствия обоих видов вместе, Allobates zaparo копирует менее токсичную[87]
Некоторые виды совмещают маскировочную стратегию с апосематизмом. Так, краснобрюхая жерлянка имеет нейтральный окрас верхней части тела и яркие красные или жёлтые пятна на брюхе. В случае опасности жерлянка принимает позу, демонстрирующую яркие пятна, и отпугивает хищника[88].
Некоторые бесхвостые в таких ситуациях симулируют угрозу. Обыкновенная жаба принимает характерную стойку, раздуваясь, опуская голову и задирая зад[89]. Лягушка-бык в опасности приседает, прикрывая глаза и наклоняя голову вперёд. Эта стойка выпячивает паротоидные железы и закрывает уязвимые части её тела[85]. Некоторые лягушки в момент опасности издают громкий пронзительный звук, который может отпугнуть хищника[85]. Несмотря на то, что большинство хищников избегает жаб, последние входят в рацион подвязочных змей . Наблюдения за поведением недавно прошедших метаморфоз американских жаб показали, что при виде змеи они приседают и замирают. Как правило, эта стратегия оправдывает себя — змея проползает мимо, не заметив жабу[90]
У бесхвостых наблюдаются два типа брачного поведения: сезонный и спонтанный. При первом типе, характерном для большинства видов бесхвостых, в определённые периоды года взрослые лягушки собираются для размножения в прудах, озёрах или ручьях. Многие бесхвостые возвращаются к тому водоёму, в котором они развивались головастиками. В результате можно наблюдать сезонные миграции, в которые вовлечены тысячи особей. При спонтанном типе размножения взрослые лягушки прибывают на места размножения, подталкиваемые некой внешней причиной (например, выпадением осадков в засушливой местности). В данном случае размножение и развитие икринок и головастиков происходит с максимальной скоростью, до того, как недолговечные водоёмы (лужи) успеют высохнут[85].
Самцы видов бесхвостых с сезонным типом брачного поведения обычно первыми прибывают в места размножения и остаются там продолжительное время, призывая кваканьем самок и защищая свою территорию от других самцов. Самки появляются позже лишь на время спаривания и икрометания. В этой ситуации количество самцов у кромки воды всегда превышает количество самок, поэтому среди самцов существует жёсткая конкуренция. Крупные и сильные самцы издают более низкие звуки и захватывают самые привлекательные для размножения места. Наблюдения показали, что самки предпочитают именно таких самцов[91]. У некоторых видов самцы могут применять технику перехвата. У них нет своей территории и они не квакают, а перехватывают самок, находящихся на пути к зовущему самцу. Поскольку кваканье требует больших затрат энергии, иногда роли меняются и зовущий самец оставляет свою территорию и становится перехватчиком[85].
У видов со спонтанным типом брачного поведения (например, рода лопатоногов Scaphiopus) основной упор делается не на выбор партнёра, а на скорость размножения. Соответственно меняется и тактика. Самец, первым обнаруживший подходящее место (лужу), начинает громко призывать сородичей, на его зов сбегаются все окрестные представители обоих полов, которые тут же подхватывают призыв, создавая хор, слышный издалека. Иногда подходящие условия отсутствуют годами, и, соответственно, эти виды не размножаются несколько лет подряд[85]. Самки вида Spea multiplicata обычно вымётывают за один брачный сезон около половины имеющейся у них в наличии икры. Предположительно, эта стратегия рассчитана на появление более подходящих условий для размножения в будущем[92].
За исключением некоторых представителей рода древолазов, образующих на время брачного сезона моногамные пары, все бесхвостые полигамны[93].
Как правило, процесс спаривания заключается в том, что самец осёдлывает самку в воде и обхватывает её туловище. Самка мечет икру, а самец покрывает её своей спермой (внешнее оплодотворение). У некоторых видов самцы могут задерживать икринки задними лапами на время, необходимое для оплодотворения[85]. В этом плане уникальными среди бесхвостых являются виды западноафриканского рода Nimbaphrynoides, которые размножаются живорождением, и виды танзанийского рода Nectophrynoides, практикующие яйцеживорождение. В обоих случаях имеет место внутреннее оплодотворение, а самка рожает полностью развитых молодых лягушек (сеголеток), которые минуют стадию головастика[94][95].
Лягушачья икра, как правило, запакована в многослойный желатиновый материал, предоставляющий икринкам некоторую защиту и не препятствующий прохождению кислорода, углекислого газа и аммиака. Эта защитная оболочка впитывает влагу и разбухает в воде. После оплодотворения внутренняя часть икринки разжижается, что обеспечивает развивающемуся зародышу свободу движений. У некоторых видов (например, красноногой лягушки и Rana sylvatica) в желатиновом материале присутствуют одноклеточные зелёные водоросли. Было выдвинуто предположение, что они положительно влияют на развитие зародыша, повышая концентрацию кислорода, образующегося в процессе фотосинтеза[96]. У большинства видов икринки чёрного или тёмно-коричневого цвета, что позволяет им нагреваться под лучами солнца сильнее окружающей среды. Так, например, температура внутри кластера икры Rana sylvatica была на 6 °C выше температуры воды, что способствовало быстрому развитию зародышей[97]
Размер и форма агломерата икры характерна для каждого вида. Лягушки семейства Ranidae имеют тенденцию к шарообразным кластерам, а жабы к длинным цилиндрическим кластерам. Крошечный кубинский свистун откладывает икринки по одной и зарывает их во влажную почву[98]. Leptodactylus pentadactylus создаёт пенное гнездо в норе, откладывая в него около тысячи икринок. Головастики появляются на свет, когда вода заполняет нору, а иногда развитие полностью происходит в гнезде[99]. Красноглазая квакша откладывает икринки на листья, расположенные над поверхностью водоёма. Вылупляясь, головастики падают с листьев в воду[100].
У некоторых видов на определённой стадии развития зародыши в икринках могут уловить вибрации, вызываемые хищниками (осами, змеями), и вылупиться раньше времени, чтобы приобрести мобильность и избежать гибели[101]. В общем, длительность стадии развития зародышей в икре зависит от конкретного вида и окружающих условий. Как правило, головастики вылупливаются в течение недели после того, как капсула икринки распадается под воздействием гормона, вырабатываемого зародышем[102].
Личинки бесхвостых, появляющиеся из икринок, известны как «головастики». Они ведут полностью водный образ жизни, но известно одно исключение — головастики вида Nannophrys ceylonensis полусухопутные и обитают среди мокрых камней[103][104]. Их тело, как правило, имеет овальную форму, хвост длинный, сплющенный по вертикали, приспособлен для плаванья. У головастиков хрящевой скелет, глаза лишены век, есть орган боковой линии, для дыхания служат жабры[105]. В начале у головастиков появляются внешние жабры, а позже внутренние (жаберный мешок закрывает жабры и передние ноги). Развивающиеся лёгкие служат дополнительным дыхательным органом. Некоторые виды проходят метаморфоз ещё в икринке, и из икринок вылупляются лягушата. У головастиков нет настоящих зубов, но у многих видов челюсти покрыты параллельными рядами кератиновых зубчиков (два ряда на верхней челюсти, три ряда на нижней и роговой клюв). Количество рядов и точная морфология рта варьируют у разных видов и могут служить диагностическим признаком[102]. Головастики семейства пиповые (за исключением рода Hymenochirus) имеют пару передних усиков, делающих их похожими на небольших сомиков[73]
Головастики, как правило, травоядны и питаются водорослями, отфильтрованными из воды через жабры. Некоторые виды являются хищниками уже на стадии головастика и питаются насекомыми; головастики (Osteopilus septentrionalis практикуют каннибализм), а также поедают мелких рыб. Головастики, рано отрастившие ноги, могут стать жертвой своих собратьев[106].
На головастиков охотятся рыбы, саламандры, хищные жуки и птицы (например, зимородок). Некоторые головастики, в том числе личинки Bufo marinus, ядовиты. У разных видов бесхвостых стадия головастика продолжается от недели до нескольких месяцев и зависит от стратегии размножения[107].
После завершения стадии головастика бесхвостые проходят процесс метаморфоза, во время которого системы организма резко перестраиваются во взрослую форму. Как правило, метаморфоз длится около суток. Он начинается с выработки гормона тироксина, который влияет на развитие тканей. Так, изменение органов дыхания включает в себя развитие лёгких параллельно с исчезновением жабр и жаберного мешка. Передние конечности становятся видимыми. Нижняя челюсть приобретает характерную для хищника форму, кишечник укорачивается. Нервная система адаптируется под стереоскопическое зрение и слух, а также под новые способы передвижения и питания. Глаза сдвигаются выше, формируются веки и связанные с ними железы. Модифицируются органы слуха (появляется слуховая перепонка и среднее ухо). Кожа становится толще и крепче, орган боковой линии исчезает (у большинства видов), формируются кожные железы. На последнем этапе метаморфоза исчезает хвост, ткани которого идут на развитие конечностей[108][109].
Личинка лягушки Rana temporaria за день до метаморфоза.
Бесхвостые, прошедшие метаморфоз, расселяются в характерной для своего вида среде обитания. Практически все виды взрослых бесхвостых хищные. Они охотятся на беспозвоночных, включая членистоногих, червей и улиток. Существуют крупные виды, которые поедают других земноводных, небольших млекопитающих и птиц. Одни бесхвостые ловят свою быстро двигающуюся добычу клейким языком, другие запихивают пищу в рот передними конечностями. Древесная лягушка Xenohyla truncata является исключением, поскольку она включает в свой рацион фрукты[110]. На бесхвостых охотятся многие хищники, в том числе цапли, ястребы, рыбы, крупные саламандры, змеи, еноты, скунсы, хорьки и другие[111].
Бесхвостые являются первичными хищниками, важной составляющей пищевой цепи. Будучи холоднокровными животными, они эффективно используют потребляемую пищу, затрачивая лишь небольшую часть энергии на метаболические процессы и конвертируя остальное в биомассу. Они служат пищей вторичным хищникам, а сами питаются наземными членистоногими, в основном травоядными. Таким образом, поедая потребителей растений, бесхвостые увеличивают прирост биомассы растений, что способствует балансу экосистемы[112].
Продолжительность жизни бесхвостых в естественных условиях мало изучена. С использованием методов скелетохронологии продолжительность жизни лягушки Rana muscosa была измерена по сезонным изменениям роста фаланг пальцев. Полученные данные позволяют предположить, что максимальная продолжительность жизни взрослой особи составляет 10 лет, а учитывая стадию головастика, которая у этого вида длится около 4 лет, срок жизни этих лягушек равен 14 годам[113]. В неволе зарегистрирована продолжительность жизни бесхвостых до 40 лет, этого возраста достигла обыкновенная жаба. Жаба-ага жила в неволе 24 года, а лягушка-бык — 14 лет[114]
Способы заботы о потомстве у бесхвостых изучены недостаточно. Предположительно около 20% видов земноводных так или иначе заботятся о детёнышах[115]. Существует обратная связь между размерами водоёма, служащего для размножения, и уровнем родительской заботы, проявляемой бесхвостыми. Виды бесхвостых, размножающиеся в небольших водоёмах, демонстрируют более сложные уровни родительской заботы[116]. В крупных водоёмах большой процент икры и головастиков поедается хищниками. В свете этого некоторые виды бесхвостых адаптировались откладывать икру на суше. В частности они заботятся о том, чтобы поддерживать икру влажной в условиях суши[117]. Дополнительная родительская забота проявляется в транспортировке к водоёмам вылупившихся на суше головастиков[116].
В небольших водоёмах хищников меньше и выживание головастиков регулируется в основном внутренней конкуренцией. Некоторые виды лягушек избегают этой конкуренции, перенося новых головастиков в небольшие внутрирастительные полости (лат. phytotelmata), заполненные водой[118]. Несмотря на отсутствие конкуренции, такие полости бедны ресурсами, поэтому родителям приходится кормить своих головастиков. Некоторые виды кормят головастиков неоплодотворёнными икринками[116]. Так, маленький древолаз (Oophaga pumilio) откладывает икру прямо на земле в лесу. Самец охраняет икру от хищников и смачивает её водой из клоаки, чтобы она не пересохла. Когда головастики вылупляются, самка переносит их на спине в полость какого-нибудь представителя семейства бромелиевых, оставляя в каждом растении по одному головастику. После этого самка регулярно навещает головастиков, откладывая каждому по одной-двум неоплодотворённым икринкам в качестве пропитания, и продолжает их кормить до наступления метаморфоза[119]. Подобным способом заботятся о своём потомстве и представители вида Oophaga granulifera[120].
Формы родительской заботы среди бесхвостых весьма разнообразны. Крошечный самец Colostethus subpunctatus охраняет свой кластер икры, отложенный под камнем или бревном. Когда головастики вылупляются, он переносит их на спине (приклеенными слизистыми выделениями) во временный водоём, где, частично погружаясь в воду, высвобождает одного или нескольких головастиков, после чего переходит к следующему водоёму[121]. Самец жабы-повитухи носит икринки с собой прикреплёнными к своим задним конечностям. В сухую погоду он увлажняет их, погружаясь в пруд, а чтобы они не слишком намокли в мокрой траве, поднимает заднюю часть тела. Спустя три—шесть недель он перестаёт выходить из пруда, и через некоторое время после этого из икринок вылупляются головастики[122]. Южноамериканская лягушка Engystomops pustulosus строит из пены гнездо, в которое она откладывает икру. Пеноматериал состоит из белков и лектинов и, возможно, имеет антибактериальные свойства[123]. Несколько пар лягушек могут строить совместное гнездо. В этом случае вначале строится «плот», а затем лягушки откладывают икру в его центре, чередуя откладывание икры и формирование пеноматериала, завершая процесс созданием пенного слоя поверх икры[124].
Некоторые виды бесхвостых сберегают потомство внутри своих тел. Самец и самка сумчатой жабы вместе охраняют икру, отложенную на земле. Когда приходит время вылупляться головастикам, самец смазывает своё тело слизистым материалом, окружающим икринки, и погружается в их массу. Вылупившиеся головастики влезают в кожные кармашки самца, где и остаются до прохождения ими метаморфоза[125]. Самки реобатрахусов (возможно, недавно вымершие) проглатывали свои оплодотворённые икринки, которые развивались у них в желудке. На это время лягушки переставали кормиться и выделять желудочные соки, а головастики питались желтком из икринок. Спустя шесть-семь недель самки широко раскрывали рты и отрыгивали головастиков наружу[126]. Самка вида ринодерма Дарвина, обитающего в Чили, откладывает на землю до 40 икринок, которые охраняются самцом. Когда головастики вылупляются, самец заглатывает их и держит в своём увеличенном горловом мешке. Головастики погружены в вязкую пенистую жидкость, которая дополнительно к желтку поставляет им питательные вещества. Они остаются в мешке от семи до десяти недель, после чего проходят метаморфоз, перемещаются в ротовую полость самца и выпрыгивают наружу[127].
В качестве домашних питомцев любители земноводных часто содержат бесхвостых в террариумах, акватеррариумах и аквариумах[128]. Популярны такие виды, как украшенная рогатка, голубая квакша, древолазы, шпорцевая лягушка, лягушка-водонос, жабовидная квакша.
Лягушачьи лапки в разных странах употребляют в пищу. Традиционный способ удовлетворения местного рынка за счёт локальных популяций лягушек стал в последние годы невозможен из-за уменьшения этих популяций. В настоящее время существует развитая международная торговля лягушачьими лапками. Основные импортёры — Франция, Бельгия, Люксембург и США, а основные экспортёры — Индонезия и Китай[129]. Годовой оборот продаж американской лягушки-быка (Rana catesbeiana), которую промышленно разводят в Китае, достигает 2,4 тысяч тонн[130]. Разведением съедобных лягушек в последнее время интересуются и другие страны, например, Белоруссия[131].
Бесхвостых широко использовали в научных экспериментах. В XVIII веке биолог Луиджи Гальвани открыл с помощью экспериментов с лягушками связь между электричеством и нервной системой[132]. В 1852 году Г. Ф. Станниус использовал сердце лягушки в эксперименте, названном его именем, который доказал, что в желудочках сердца и предсердиях клетки-пейсмекеры могут независимо генерировать разный ритм[133]. Гладкую шпорцевую лягушку широко использовали в первой половине XX века в тесте на беременность после того, как английский зоолог Ланселот Хогбен открыл тот факт, что в моче беременной женщины присутствует гормон хорионический гонадотропин, который индуцирует у этой лягушки икрометание[134]. В 1952 году Роберт Бриггс и Джозеф Кинг клонировали лягушку методом пересадки ядер соматических клеток (этим же методом позже была клонирована овечка Долли). Это был первый успешный эксперимент по клонированию позвоночных путём ядерной трансплантации[135]. Лягушек широко используют в исследованиях в области эмбриологии. Шпорцевые лягушки остались модельным организмом в биологии развития и после разработки более современных тестов на беременность, поскольку их легко содержать в лабораторных условиях, а их эмбрионы достаточно крупные для манипулирования[136]. При этом гладких шпорцевых лягушек всё чаще заменяют более мелким родственником, Xenopus tropicalis, который достигает половой зрелости в 5 месяцев (а не в год или два, как гладкая шпорцевая лягушка)[137], что ускоряет исследования, требующие нескольких поколений лягушек. Геном X. tropicalis по состоянию на 2012 год находится в процессе секвенирования[138].
Исключительное разнообразие токсинов, вырабатываемых бесхвостыми, вызвало интерес биохимиков к этой «природной аптеке». Алкалоид эпибатидин, болеутоляющее, в 200 раз более мощное, чем морфий, был обнаружен у некоторых видов рода листолазов. Из кожи бесхвостых был выделен пептид, предположительно блокирующий размножение вируса ВИЧ[139][140].
Лягушек используют на практических занятиях по диссекции в школах и университетах. Как правило, их предварительно обрабатывают пигментами для получения контраста между разными системами организма. В свете движения за права животных эту практику в последнее время заменяет виртуальная диссекция «оцифрованных» лягушек — компьютерные программы, симулирующие организм живой лягушки[141].
Яд бесхвостых применяют в качестве галлюциногена. В течение долгого времени считалось, что в доколумбову эпоху жители Мезоамерики использовали для этой цели яд жабы-аги. Более поздние исследования показали, что более вероятным кандидатом на эту роль является яд жабы Bufo alvarius, включающий в себя буфотенин и 5-MeO-DMT — психоактивные вещества, которые и сегодня применяют в рекреационных целях. Типичным способом употребления является курение высушенных кожных выделений жабы[142]. В СМИ появлялись сообщения о людях, которые слизывали наркотическое вещество прямо с кожи жабы, но, возможно, это городская легенда[143].
Кроме того, яд бесхвостых издревле применяли для производства отравленных стрел и дротиков. С помощью кожных выделений ужасного листолаза южноамериканские индейцы изготавливали отравленные стрелки. Наконечник натирали о спину лягушки, стрелками стреляли из духовой трубки на охоте. Комбинация двух токсинов, присутствующих в этих выделениях (батрахотоксин и гомобатрахотоксин), столь сильна, что яда одной лягушки, предположительно, достаточно, чтобы убить 22 000 мышей[144]. Два других вида бесхвостых, золотистополосый листолаз и двухцветный листолаз, также использовали как источники яда, но его концентрация в них меньше, и для того, чтобы яд начал выделяться, их необходимо подогреть на огне[145]. Эти яды исследуют на предмет их применения в медицине[146].
Исследования, начатые в 1950-х годах, указывают на значительное сокращение численности бесхвостых. Более трети видов находятся под угрозой вымирания, более 120 видов считаются вымершими в период с 1980 до 2004 года[147]. Среди этих видов числится и оранжевая жаба из Коста Рики. Её исчезновение вызвало серьёзную озабоченность исследователей, связанную с тем, что эта жаба обитала в заповеднике «Monteverde Cloud Forest Reserve» и её вымирание не могло быть вызвано напрямую человеческим вмешательством. В других местах снижение численности бесхвостых обусловлено разрушением среды обитания, поллютантами, климатическими изменениями и внедрением чужеродных хищников, паразитов и конкурентов. Особенно разрушительными для популяций бесхвостых считаются инфекционные заболевания хитридиомикоз и ранавирус[3][148][149].
Многие исследователи считают, что повышенная чувствительность земноводных вообще и бесхвостых в частности к загрязнению окружающей среды связана с такими факторами, как их промежуточная позиция в пищевой цепи, проницаемая кожа и жизненный цикл, включающий в себя водную стадию (головастик) и наземный образ жизни взрослой особи[150]. Те немногочисленные виды бесхвостых, у которых водный этап жизни сокращён или отсутствует вообще, обладают большей сопротивляемостью загрязнению нежели типичные бесхвостые, развивающиеся в воде со стадии икринки до конца метаморфоза[151].
Количество мутаций и генетических дефектов, наблюдаемых у бесхвостых возросло за время наблюдения с 1990-х по 2003 год. Одним из распространённых дефектов являются недостающие или лишние конечности. Различные гипотезы по поводу причин, вызывающих эти дефекты, включают в себя увеличение ультрафиолетового излучения, попадающего на икру, загрязнение сельскохозяйственными ядохимикатами и паразитические заболевания, как, например, заражение трематодами Ribeiroia ondatrae. Возможно, что все эти факторы действуют вместе (радиационный и химический стресс понижает сопротивление организмов паразитам). Дефекты конечностей ухудшают подвижность и, как следствие, шансы животного дожить до половой зрелости[152][153].
Исследование, проведённое в Канаде в 2006 году, показало, что высокая плотность транспорта является для бесхвостых большей угрозой, нежели ухудшение среды обитания[154]. В некоторых случаях были основаны программы размножения в неволе, которые, как правило, увенчивались успехом[155][156]. В 2007 году было опубликовано исследование, показавшее, что некоторые пробиотические бактерии могут повышать сопротивляемость бесхвостых летальным грибковым заболеваниям[157]. Была разработана программа «Панамский проект по спасению и сохранению амфибий» (англ. The Panama Amphibian Rescue and Conservation Project) для сохранения некоторых видов бесхвостых в восточной Панаме, гибнущих от этих заболеваний, включающая разработку полевых методов использования пробиотиков[158]. Всемирная ассоциация зоопарков и аквариумов (англ. World Association of Zoos and Aquariums) объявила 2008 год годом лягушки с целью привлечения внимания общественности к проблеме охраны бесхвостых[159].
У многих народов мира лягушки, а ещё в большей степени жабы, ассоциировались с целым рядом неприятных свойств[160]. В китайской традиции лягушка символизирует лунное «Инь». Дух лягушки Цин-ва Шэн ассоциируется с излечением и удачей в делах. Символ «лягушка в колодце» относится к человеку недалёкому[161]. В европейском фольклоре жабы ассоциировались с ведьмами как фамилиары, источники ингредиентов для магических зелий, а иногда имели собственные магические свойства[162]. В древнеперуанской культуре Моче бесхвостые были одними из почитаемых животных и часто появлялись в произведениях искусства[163]. Легенда Панамы гласит, что удача сопутствует тому, кто увидит панамскую золотую лягушку (Atelopus zeteki). В варианте этой легенды говорится, что, умирая, эти лягушки превращаются в золотой талисман уаку[164].
Бесхвостые часто выступают в качестве персонажей в литературе[165]. Первое дошедшее до нас художественное произведение, в названии которого фигурируют бесхвостые — это комедия Аристофана «Лягушки», впервые поставленная в 405 году до н. э.[166]. В качестве дополнительных примеров можно привести:
|chapter= пропущен (справка на английском) |coauthors= (справка) |coauthors= (справка) |coauthors= (справка) |coauthors= (справка) |pages= и |page= дублируют друг друга (справка) Скелет бесхвостых, как и у других наземных позвоночных, включает череп, позвоночник, пояса конечностей и скелет свободных конечностей. Рёбра не соединены друг с другом.
ЧерепЧереп уплощённый, преимущественно хрящевой. Боковые затылочные кости образуют парные затылочные мыщелки, соединяющие череп с шейным позвонком.
ПозвоночникПозвоночник бесхвостых состоит из четырёх отделов — шейного, туловищного, крестцового и хвостового. Шейный и крестцовый отделы включают всего по одному позвонку. В туловищном отделе 7 позвонков. Все позвонки хвостового отдела срослись в единую кость — уростиль.
Пояса конечностейПояс передних конечностей состоит из парных лопаток, ключиц и коракоидов и непарной грудины. Пояс задних конечностей состоит из подвздошных и седалищных костей. Седалищные кости соединены лобковым хрящом.
КонечностиСтроение конечностей бесхвостых варьирует от вида к виду и зависит от среды обитания — наземной, водной или древесной. Как правило, бесхвостые способны совершать резкие движения, что позволяет им ловить добычу и ускользать от хищников. Эффективные способы передвижения обеспечиваются несколькими особенностями строения конечностей:
У многих бесхвостых, обитающих в водной среде, имеются плавательные перепонки между пальцами. Существует корреляция между относительной площадью перепонок и долей времени, которое животное проводит в воде. Так, например, у африканской лягушки рода Hymenochirus, ведущей исключительно водный образ жизни, плавательные перепонки закрывают большую часть промежутка между пальцами, тогда как у австралийской лягушки Litoria caerulea, проводящей большую часть жизни на деревьях, перепонки покрывают от четверти до половины площади этих промежутков. У бесхвостых, ведущих древесный образ жизни, часто можно наблюдать особые подушечки на пальцах, позволяющие им держаться на вертикальных поверхностях. Хорошее сцепление с шершавыми поверхностями обеспечивается за счёт зубчатых микровыростов эпителия на поверхности этих подушечек. Кроме того, здесь расположены многочисленные слизистые железы, которые секретируют слизь в пространство между клетками подушечек, имеющее вид тонких канальцев. Слизь хорошо смачивает гладкие поверхности и позволяет бесхвостому удерживаться на них за счёт капиллярного притяжения. Многие древесные бесхвостые имеют характерную особенность строения бедренного сустава, которая позволяет им передвигаться не только прыжками (как прочие бесхвостые), но и шагом. У древесных бесхвостых, живущих на большой высоте, тоже можно обнаружить межпальцевые перепонки. У этих видов перепонки адаптированы для замедления падения, а у некоторых видов даже для планирования. У наземных бесхвостых вышеупомянутые адаптации отсутствуют. Их задние конечности, как правило, обладают более развитой мускулатурой, по сравнению с их водными и древесными собратьями. У некоторых наземных видов, роющих почву, можно обнаружить на кончиках пальцев небольшие мозоли, приспособленные для рытья.Развитие конечностей может быть осложнено в некоторых ситуациях:
Одна из зародышевых задних конечностей головастика может быть съедена хищником, например, личинкой стрекозы. В большинстве случаев это не препятствует регенерации полноценной конечности, но иногда она может оказаться изуродованной или не развиться вообще (тем не менее, животное может выжить и с тремя конечностями). Паразитический плоский червь из рода Ribeiroia, внедряясь в заднюю часть тела головастика, может изменять положение клеток зародышевых конечностей. Это иногда приводит к развитию одной или двух дополнительных конечностей. КожаУ многих видов бесхвостых кожа проницаема для воды (самый проницаемый участок кожи — область таза). Эта особенность создаёт для бесхвостых угрозу потери жидкости и пересыхания. У некоторых бесхвостых, ведущих древесный образ жизни, можно обнаружить адаптацию в виде дополнительного водонепроницаемого слоя кожи. Другие бесхвостые минимизируют потерю воды поведенческими адаптациями: ночным образом жизни, принятием поз, уменьшающих площадь соприкосновения кожи с воздухом, например, они отдыхают в группах тесно прижавшись друг к другу.
Кожа бесхвостых помогает им маскироваться. Представители некоторых видов способны менять оттенок кожи, чтобы лучше сливаться с окружающим фоном. Кожа бесхвостых, ведущих наземный образ жизни, часто бывает покрыта бородавками и морщинами (что позволяет им мимикрировать под элементы почвы), тогда как у бесхвостых, ведущих древесный образ жизни, кожа, как правило, гладкая (эти виды чаще мимикрируют под элементы растений).
Некоторые виды бесхвостых меняют окрас кожи в зависимости от уровня освещения и влажности окружающей среды. Эту способность обеспечивают специальные клетки, наполненные пигментом, размер которых меняется под влиянием света и влажности. Изменение окраса кожи от более светлого к более тёмному способствует терморегуляции этих видов.
ЯдовитостьМногие бесхвостые вырабатывают токсичные вещества, служащие им как для защиты от хищников, так и для нападения. Например, у жаб ядовитые железы расположены в верхней части головы над глазами. Химический состав яда бесхвостых зависит от вида и может включать в себя раздражители кожи, галлюциногены, нервно-паралитические токсины, вазоконстрикторы, токсины, вызывающие конвульсии и другие. Хищники, специализирующиеся на определённых видах бесхвостых, как правило, адаптированы к присущему этим видам типу яда, но неспециализированные животные, как и человек, могут серьёзно пострадать от контакта с ядом бесхвостых, в некоторых случаях приводящего к летальному исходу.
Источник ядовитых веществ у бесхвостых тоже неодинаков. Некоторые бесхвостые генерируют токсины сами, другие же используют токсины, полученные с пищей (чаще всего от членистоногих). Как правило, бесхвостые сигнализируют о своей ядовитости с помощью яркой, насыщенной, «предупредительной» окраски. Существуют также неядовитые виды бесхвостых, мимикрирующих под ядовитые виды своей окраской, которая отпугивает хищников.
Дыхательная система и кровообращениеКожа бесхвостых проницаема для молекул кислорода, углекислого газа и воды. Кровеносные сосуды, расположенные прямо под кожей, позволяют им дышать при полном погружении в воду, так как кислород проходит из воды через кожу прямо в кровь. На суше бесхвостые дышат с помощью лёгких. У них отсутствует система мышц (брюшных, диафрагмы и межрёберных), которая обеспечивает у млекопитающих механизм вдоха-выдоха . Вместо неё у бесхвостых растягивается горло, воздух входит через ноздри, а затем сжатие мышц ротовой полости загоняет воздух в лёгкие. В августе 2007 года был открыт вид лягушек Barbourula kalimantanensis, ведущих полностью водный образ жизни. Это первый открытый вид бесхвостых, не имеющих лёгких.
Бесхвостые имеют трёхкамерное сердце, как и рептилии (за исключением крокодилов, у которых сердце четырёхкамерное). Насыщенная кислородом кровь из лёгких поступает в сердце через левое предсердие, а обогащённая углекислым газом кровь из тканей, а также насыщенная кислородом кровь из кожных вен — через правое [1]. Таким образом, в левом предсердии кровь у амфибий артериальная, а в правом - смешанная. Специальный клапан регулирует подачу крови из желудочка сердца в аорту или в лёгочную артерию, в зависимости от типа крови. Этот механизм обеспечивает минимальное смешивание крови с повышенной концентрацией кислорода и крови, насыщенной углекислым газом, и, таким образом, способствует более активному обмену веществ.
Некоторые виды бесхвостых адаптированы к выживанию в воде с пониженной концентрацией кислорода. Так, например, лягушка Telmatobius culeus, обитающая в высокогорном озере Титикака, имеет морщинистую кожу с увеличенной площадью поверхности, что способствует обмену газов. Как правило, эта лягушка не использует свои рудиментарные лёгкие. Наблюдения показали, что представители этого вида, находясь на дне озера, время от времени совершают ритмичные движения вверх-вниз, что увеличивает течение воды вокруг них.
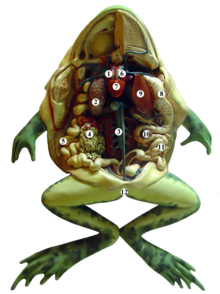 1 Правое предсердие, 2 лёгкие, 3 аорта, 4 икра, 5 толстая кишка, 6 левое предсердие, 7 желудочек сердца, 8 желудок, 9 печень, 10 жёлчный пузырь, 11 тонкий кишечник, 12 клоака Пищеварительная система
1 Правое предсердие, 2 лёгкие, 3 аорта, 4 икра, 5 толстая кишка, 6 левое предсердие, 7 желудочек сердца, 8 желудок, 9 печень, 10 жёлчный пузырь, 11 тонкий кишечник, 12 клоака Пищеварительная система Зубы бесхвостых, т. н. педицеллярные зубы, расположены в верхней челюсти, с их помощью животные удерживают пищу перед тем, как её проглотить. Эти зубы недостаточно крепки для укусов или поимки жертвы. Свою пищу (мух и других мелких движущихся животных) бесхвостые ловят липким, раздвоенным языком. В пассивном состоянии язык свёрнут во рту. Он прикреплён спереди к челюстям, и лягушка может «выстрелить» им вперёд и возвратить его назад с большой скоростью. У некоторых бесхвостых нет языка, и они засовывают пищу в рот передними конечностями. У других глаза могут втягиваться через отверстия в черепе и, надавливая на пищу, находящуюся во рту, проталкивать её в горло. Проглоченная пища проходит через пищевод в желудок, где обрабатывается пищеварительными энзимами. После этого она поступает в тонкий кишечник, где продолжает перевариваться. Секреция сока поджелудочной железы и жёлчи, производимой печенью и накапливающейся в жёлчном пузыре, происходит в тонком кишечнике. Там же происходит максимальная абсорбция питательных веществ и нутриентов. Непереваренные остатки пищи поступают в толстый кишечник, откуда после абсорбирования излишков воды переходят в клоаку.
Выделительная системаВыделительная система бесхвостых схожа по своей структуре с системой млекопитающих. В её основе лежат две почки (мезонефрос), фильтрующие мочевину и другие продукты жизнедеятельности из крови. Полученный фильтрат почки концентрируют в мочу, которая затем проходит через мочеточник и скапливается в мочевом пузыре. Из мочевого пузыря продукты жизнедеятельности организма попадают в клоаку и оттуда — наружу.
Репродуктивная системаРепродуктивная система бесхвостых, за отдельными исключениями, основана на внешнем оплодотворении. У многих видов бесхвостых самцы меньше самок. У самцов есть голосовые связки, а у многих видов и горловые мешки, с помощью которых они издают громкое кваканье в брачный сезон. Два семенника прикреплены к почкам, сперма проходит через почки, после чего попадает в мочеточники, а оттуда в клоаку. В отсутствие пениса сперма выбрасывается из клоаки прямо на икру, отложенную самкой во время амплексуса.
У самок есть парные яичники, расположенные около почек. Икринки проходят через парные яйцеводы наружу. Во время амплексуса хватка самца стимулирует откладывание икры самкой. Икринки, как правило, покрыты оболочкой, по консистенции напоминающей желе.
Нервная системаНервная система бесхвостых состоит из головного мозга, спинного мозга и нервов, а также периферических нервных ганглиев. Многие части головного мозга бесхвостых соответствуют частям человеческого мозга. Головной мозг состоит из двух обонятельных долей, двух церебральных хемисфер, шишковидного тела, двух зрительных долей, мозжечка и продолговатого мозга. Мозжечок контролирует мышечную координацию и равновесие, а продолговатый мозг управляет дыханием, пищеварением и прочими автоматическими функциями организма. Относительные размеры головного мозга бесхвостых намного меньше, чем у человека. Они имеют всего 10 пар черепных нервов и 10 пар спинальных нервов, по сравнению с млекопитающими, птицами и рептилиями, которые имеют 12 пар черепных нервов. У бесхвостых нет внешнего уха, а барабанные перепонки открыты наружу. Как и у прочих тетрапод, уши бесхвостых включают в себя вестибулярный аппарат. Имея относительно короткую ушную улитку, бесхвостые используют для распознавания звуков электрический аппарат (в отличие от механического у млекопитающих).
Органы зренияГлаза бесхвостых расположены в верхней части головы и часто выдвинуты вперёд. Это обеспечивает бесхвостым широкое поле зрения; лягушка может полностью погрузиться в воду, оставив над поверхностью лишь глаза. Глаза защищены подвижными веками и дополнительно прозрачной неподвижной мембраной, предохраняющей глаза во время пребывания в воде. Цвет радужной оболочки и форма зрачка у разных видов отличаются.
Бесхвостые лучше видят дальние объекты, чем ближние. Квакающие лягушки немедленно умолкают при виде потенциальной угрозы и даже её тени, но чем ближе объект, тем хуже они его видят. Когда лягушка выстреливает языком в сторону добычи, она реагирует на маленький движущийся объект, который плохо различим. Она прицеливается заранее, так как особенности анатомии вынуждают её закрывать глаза при вытягивании языка. Вопрос о наличии у бесхвостых цветного зрения не решён. Опытами была доказана положительная реакция бесхвостых на голубой свет.
Лягушки обладают уникальным среди позвоночных зрительным аппаратом. В ходе исследований было обнаружено, что почти 95% информации поступает в рефлекторный отдел мозга. Это приводит к тому, что лягушка не видит, где она находится. Основной вывод — лягушки видят только движущиеся предметы.
Бесхвостые слышат как на земле, так и под водой. Внешнего уха у них нет, но, как правило, позади каждого глаза присутствует барабанная перепонка. Звук вызывает вибрацию перепонок, которые передают её в среднее и внутреннее ухо. Размер барабанных перепонок и дистанция между ними коррелируют с частотой звука, на которой квакает данная лягушка. У некоторых видов, например у лягушки-быка, размер перепонок относительно размера глаз указывает на половую принадлежность. У самцов перепонки больше глаз, а у самок они схожего размера. Как правило, бесхвостые не полагаются только на слух, и даже на резкий звук они не будут реагировать, пока не увидят его источник.
АнабиозВ экстремальных погодных условиях некоторые виды бесхвостых погружаются в состояние анабиоза и могут не проявлять никакой активности в течение нескольких месяцев. В холодных областях бесхвостые зимой впадают в спячку. Некоторые наземные бесхвостые (например, американская жаба) роют себе на зиму нору и спят в ней. Другие виды, менее приспособленные к рытью, прячутся в расщелинах или закапываются в сухие листья. Водные виды (например, лягушка-бык), как правило, залегают на дне водоёма, частично погружаясь в ил, но сохраняя, тем не менее, доступ к кислороду, растворённому в воде. Их метаболизм замедляется, и они выживают за счёт потребления внутренних энергетических резервов. Многие бесхвостые могут выжить после замерзания. Несмотря на то, что под их кожей и в полостях тела образуются кристаллы льда, жизненно важные органы защищены от замерзания вследствие высокой концентрации глюкозы в тканях. С виду безжизненная, замёрзшая лягушка может начать дышать и возобновить работу сердца, если её отогреть.
С другой стороны, Cyclorana alboguttata во время жаркого сухого сезона в Австралии впадает в состояние эстивации (летней спячки), обходясь без пищи и воды 9-10 месяцев в году. Эта лягушка зарывается в землю и сворачивается в защитном коконе, который образует её сброшенная кожа. Исследования показали, что во время эстивации метаболизм лягушки меняется так, что КПД митохондрий увеличивается, позволяя более эффективно использовать ограниченное количество энергетических ресурсов, доступных лягушке в состоянии спячки. Пытаясь ответить на вопрос, почему этот механизм не имеет широкого распространения в царстве животных, исследователи пришли к выводу, что он полезен только холоднокровным животным, находящимся в состоянии анабиоза в течение длительного периода, чьи энергетические затраты крайне низки, поскольку у них нет необходимости постоянно генерировать тепло. Другое исследование показало, что для удовлетворения минимальных энергетических требований у лягушки атрофируется большинство мышц (за исключением мышц задних конечностей).
無尾目(学名:Anura)是两生纲的一個目,其下生物即蛙或蟾。該目的生物成体基本无尾,卵一般产于水中,孵化成蝌蚪,用鰓呼吸,经过变态,成体主要用肺呼吸,但多数皮肤也有部分呼吸功能。无尾目是生物从水中走上陆地的第一步,比其他两生纲生物要先进,虽然多数已经可以离开水生活,但繁殖仍然离不开水,卵需要在水中经过变态才能成长。因此不如爬行纲动物先进,爬行纲动物已经可以完全离开水生活。
蛙類,俗称水鸡、田鸡、石鸡,台語俗稱四腳仔、四腳魚仔或水雞[1],大約有4800種。 主要包括两类动物:青蛙和蟾蜍。这两类动物没有太严格的区别,有的一科中同时包括两种。一般来说,蟾蜍多在陆地生活,因此皮肤多粗糙;蛙体形较苗条,多善于游泳。两种体形相似,颈部不明显,无肋骨。前肢的尺骨与桡骨愈合,后肢的胫骨与腓骨愈合,因此爪不能灵活转动,但四肢肌肉发达。蛙類和蟾類很難絕對地區分開,有的科如盤舌蟾科就即包括蛙類也有蟾類。
青蛙又稱田雞,是因為味道鮮美之故,口感近似雞肉。人類很早就知道食用青蛙,《汉书》说:“鄠杜之间水多蛙,鱼人得不饥。”张华《博物志》说:“东南之人……食水产者,龟蚌螺蛤,以为珍味,不觉其腥。”唐末尉迟枢《南楚新闻》言:“百越人好食虾蟆,凡有筵会,斯为上味。”當時吃青蛙還是南方人的習俗,韓愈在《答柳柳州食虾蟆》诗说柳宗元“居然当鼎味,岂不辱钓罩”,責怪柳柳州不該把青蛙當美味。苏东坡在《闻子由瘦》诗中写道:“旧闻蜜唧尝呕吐,稍近虾蟆缘习俗。”
蟾蜍,俗称“癞蛤蟆”,大部分蟾蜍耳后有毒腺,分泌毒性分泌物,可以制作中药。
蟾蜍科的动物大约有250种,分布在除了澳大利亚和马达加斯加岛等海岛以外的全世界各地,目前澳大利亚也引入了蟾蜍。虽然大部分蟾类生活在陆地上,栖身地洞内,但也有必须生活在水中或树上的蟾类。墨西哥的异舌蟾以蚂蚁为食。
无尾目大约有5,070种,分为三个亚目:
角蟾科 (Megophryidae)
锄足蟾科 (Pelobatidae)
合附蟾科 (Pelodytidae)
负子蟾科 (Pipidae)
异舌蟾科 (Rhinophrynidae)
北美锄足蟾科 (Scaphiopodidae)
蛙類最小的只有30毫米,只相當一個人的大拇指長,大的有300毫米(一尺多長),瞳孔都是橫向的,皮膚光滑,舌尖分兩叉,舌跟在口的前部,倒著長回口中,能突然翻出捕捉蟲子。有三個眼瞼,其中一個是透明的,在水中保護眼睛用,另外兩個上下眼瞼是普通的。頭兩側有兩個聲囊,可以產生共鳴,放大叫聲。體形小的品種叫聲頻率較高。
蛙類的繁殖方式基本和蟾蜍類相似,也是以昆蟲為食,但大型蛙類可以捕食小魚甚至小鼠。基本在夜間捕食。絕大部分生活在水中,也有生活在雨林潮濕環境的樹上的。卵產於水中,也有的樹蛙僅僅利用樹洞中或植物葉根部積累殘餘的水窪就能使卵經過蝌蚪階段。2003年在印度西部新發現一種「紫蛙(Nasikabatrachus sahyadrensis)」,常年生活在地底的洞中,只有季風帶來雨水時才出洞生育。
第一眼看青蛙時可能會認為牠們缺乏防禦能力。其細小的身體、緩慢的動作、薄而缺乏如尖刺、利爪及牙齒的外型往往令人疏於防範。事實上牠們有豐富的防衛機制去保護牠們。首先不少物種都有良好的偽裝能力,其與附近環境十分接近的膚色令一動不動的牠們易於隱藏於環境之中。遇到危險時,其驚人的彈跳力令牠們迅速跳到水中,以避開獵食者的追捕[2]。
很多青蛙的表面都有輕度毒性的蟾毒素(bufotoxin),使牠們並不受獵食者的歡迎。而大部分蟾蜍則有較大的制毒腺體,稱作腮腺(parotoid gland),主要位於當中的兩側眼後的位置,或身體的其他部分。這些腺體能分泌不同的毒素或黏液,使牠們的皮膚變得滑溜而且並不可口。如果能產生即時的不快感覺,捕獵者多會終止牠們的捕獵行動而令牠們得以逃脫;如果效果需時甚久才有效果,也可減少捕獵者於下一次再度捕獵的機會[3]。而帶有劇毒的青蛙則多會披上鮮艷的顏色,以標示牠們並不適合作為食物,這種適應的的策略稱作警戒作用(Aposematism)。牠們身上的顏色多為鮮艷的紅色、橙色或黃色配以黑色。一些物種的警告色長在腹部上,如铃蟾属的物種。因此牠們在遇到攻擊時反而會將腹部朝上,並分泌毒液以趕退敵人。並有一些物種本身沒有毒性,如紅背異箭毒蛙,就會模擬在其地域中有毒的物種的膚色以嚇退獵食者[4]。
一些蛙類物種,例如箭毒蛙等的毒性特別強。南美洲的土著很久以前已懂得抽取這些箭毒蛙身上的毒液去製造飛鏢(Dart (missile))以作打獵之用[5],雖然只有少數物種適合此目的。此外,一些物種,紅背異箭毒蛙、卵齿蟾属(Eleutherodactylus)的一個物種(Eleutherodactylus gaigei)及细趾蟾属(Leptodactylus)的一個物種(Lithodytes lineatus)雖然本身沒有製造毒液,但牠們會透過模擬當區有毒的近親的膚色而達致保護自己的目的[6][7]。一些物種雖透過進食如螞蟻或節肢類動物等以吸收牠們的毒素[8],但亦有一些物種,如澳洲的科羅澳擬蟾則能夠自己合成這些有毒的生物鹼[9]。這些化合物,包括蛙毒素(batrachotoxin)及蟾毒素(bufotoxin)等,能令受體不適、產生幻覺、癲癇性痙攣(Epileptic seizure)、神經中毒及血管收縮。不少以蛙類為食的捕獵者已能適應高濃度的毒素,但其他物種,如人類則完全沒有抵抗力[10]。 一些蛙類則依靠虛張聲勢及小詭計去保護自己。像大蟾蜍獨有的站立姿態就是嘗試去嚇怕敵人。牠們會吸入空氣使身體脹大,並提高後半身及令頭部向下以製造一種雄偉的形態[11]。美國牛蛙受到威脅時會將頭部向前傾但合上眼睛。此姿態目的是要將帶毒的腮腺放置在最清晰的位置上,與此同時其他在背部上的腺體則開始滲出有毒的分泌物,並將身體最脆弱的部分加以覆蓋[2]。其他策略包括發出刺耳的聲音,並利用突如其來的巨響嚇走捕獵者。灰樹蛙能夠發出如爆破般的聲響,這聲響有時就能夠嚇退其天敵北短尾鼩鼱(Blarina brevicauda)[2]。蟾蜍類一般不甚受歡迎,但偶爾也會受到飢餓的蛇類如东部带蛇(Thamnophis sirtalis)的垂涎。年幼的美國蟾蜍如遇到對其感興趣的蛇時,就會蹲下身體並且一動不動。這種不動聲息的自保方法往往令蛇失去了牠們的蹤影而成功自保。但如牠們被蛇的頭部感應到時,就會毫不猶豫地放棄蹲下的姿態而迅速跳走[12]。
有的蛙類皮膚分泌毒液以防天敵,生活在亞馬遜河流域雨林中的一種樹蛙分泌物被當地印第安人用來製作箭毒,見血封喉。
蛙類分佈在除了加勒比海島嶼和太平洋島嶼以外的全世界。但目前在全世界迅速地減少,主要原因有環境污染、氣候變化、外來物種侵入、人類擴張而造成的棲息環境縮小等。
無尾目動物自古以來就在人類文化中佔有一定的地位,許多傳說和它們有關:
無尾目(学名:Anura)是两生纲的一個目,其下生物即蛙或蟾。該目的生物成体基本无尾,卵一般产于水中,孵化成蝌蚪,用鰓呼吸,经过变态,成体主要用肺呼吸,但多数皮肤也有部分呼吸功能。无尾目是生物从水中走上陆地的第一步,比其他两生纲生物要先进,虽然多数已经可以离开水生活,但繁殖仍然离不开水,卵需要在水中经过变态才能成长。因此不如爬行纲动物先进,爬行纲动物已经可以完全离开水生活。

蛙(かえる、英: Frog)とは、脊椎動物亜門・両生綱・無尾目(カエル目)に分類される動物の総称。古称としてかわず(旧かな表記では「かはづ」)などがある。
成体の頭は三角形で、目は上に飛び出している。胴体は丸っこく、尾はない。
後肢が特に発達しており、後肢でジャンプすることで、敵から逃げたり、エサを捕まえたりする。後肢の指の間に水掻きが発達するものが多く、これを使ってよく泳ぐ。ほとんどの種で肋骨がない。
前肢は人間の腕に似た形状をしているが、ジャンプからの着地の際に身体への衝撃を和らげるのが主な役目である。餌となる小動物に飛びついて両肢で押さえつけたり、冬眠などのために土砂を掘ったり、汚れ落としのために片肢で顔を拭いたりする動作も可能である。アオガエル科やアマガエル科などの樹上生活をする種の多くでは指先に吸盤が発達し、その補助で細い枝などに掴まることはできるが、人間や猿のように物を片肢ないし両肢で掴み取ることはできない。
幼生は四肢がなく、ひれのついた尾をもつ。成体とは違う姿をしていて、俗に「オタマジャクシ(お玉杓子)」と呼ばれる(食器のお玉杓子に似た形状から)。オタマジャクシはえら呼吸を行い、尾を使って泳ぐため、淡水中でないと生きることができない。オタマジャクシは変態することで、尾をもたず肺呼吸する、四肢をもった幼体(仔ガエル)となる。
なお、ごくわずかであるが、オタマジャクシの段階を経ず、そのままカエルの姿に成長する種類もいる[2]。
水辺で生活し、陸と水中の両方で生活する種類が多いが、ほとんど陸上だけを生活の主体にしているもの、樹上にまで進出しているものもある。完全に水中生活のものはそう多くない。
ほとんどが肉食性で、昆虫などを食べる。小型哺乳類まで食べる大型の種もある。陸上で採食するものは、舌を伸ばし、昆虫をそこにくっつけて口に引っ張り込む。口は非常に大きい。異物などを飲み込んだ時は胃袋を吐き出しそれを洗う行動をする。
呼吸の大部分を皮膚呼吸に頼っていて、皮膚がある程度湿っていないと生きていけない。わずかに肺呼吸も行っている。その際は口を膨らませ、それによって得た空気を肺に送り込んでいる。つまり、空気を「飲み込む」ような格好になる。これは気嚢や横隔膜といった呼吸機構を獲得しておらず、それら補助器官による自発呼吸ができないためである。ただし、Barbourula kalimantanensisは肺を持たず、皮膚呼吸のみで生きている。また、海水に入ると浸透圧により体から水分が出て死んでしまう。ただし、例外的に水から離れて生活したり、汽水域に棲む種類も知られる。
変温動物なので極端に暑い、寒い環境の際は土中などで休眠する。普通日本のカエルは成体で冬眠するが、ウシガエルやツチガエルなどは幼生が冬を越すこともある。また、アカガエル類やヒキガエル類は、他のカエルが冬眠している1月から3月頃に繁殖行動を行う。
産卵期には、様々な行動が見られる。最も一般的なものでは、雄は鳴き声で雌を呼び、雌が近づくと後ろから胸部を前足で抱きかかえるようにして産卵を促し、産卵と同時に放精して受精させる。集団で繁殖するものでは、俗に「かわず合戦」といい、産卵場所でオスがメスを奪い合って互いを押しのけたりする光景が見られる。卵は、水の中に産むものが普通であるが、水辺近くの植物の葉の上などに産むもの、泡巣を作るものなどもあり、背中や口の中などで卵や幼生を保護する習性を持つものも知られている。
また、ごくわずかであるが、体内受精をしてメスの体内で卵を育て、子ガエルやオタマジャクシを産む種類も存在する[2]。
蛙は良く鳴くことで有名である。特に配偶行動に関わって大きな鳴き声を上げるものが多くあり、世界各地で古くから注目された。
日本では水田が多い地方などでは、夜にたくさんの蛙が一斉に鳴き出し、「蛙の大合唱」といって夏から秋の風物詩となっている。夜、家の外から静かに響いてくる蛙の鳴き声の美しさは、多くの俳句や歌に詠まれている。
鳴嚢を膨らませることによって鳴き、鳴嚢はのどの前にある種類と、両側の頬にある種類とがある。
約6500種が知られており、そのほとんどが水辺で暮らしている。水のそばで生活しないものはわずかしか知られていない。
種数はamphibiawebによる[3]。
アマガエル上科
アカガエル上科
この系統樹はFrost et al. (2006)・Heinicke M. P. et al. (2009)・Alexander & Wiens (2011)に基づく。
国内には以下の6科43種(亜種を含む)が分布する。およそ半分が日本の固有種であり、本州・四国・九州・北海道及び周辺地域と南西諸島一帯で大きく相が異なっている。
大型の種類は、世界各地で食用にされる。日本で「食用蛙」といえば、普通ウシガエルのことを指す。肉は鶏肉のささみに似ており、淡白で美味である。中国をはじめ、欧州など世界的には、カエルを食べることは特別なことではない。ただし、欧州の蛙食の歴史に於いて先駆的であったフランス人は、後続の国々から「カエル喰い」と揶揄を込めて呼ばれていた。現在でも英語で frog eater (フロッグ・イーター)やJohnny Crapaud(ジョニー・クラポー。クラポーは仏語でカエル)はフランス人に対する蔑称であり、 frog だけでフランス人を指すこともある。現代フランス料理の祖といわれるオーギュスト・エスコフィエは、若き日の英国王エドワード7世に自慢のカエル料理を提供し賞賛を得たが、材料を問われて言葉につまり、「頭が三角になる思い」をしたという。後年、エスコフィエはロンドンの「カールトン・ホテル」で評判となった冷製料理「妖精・オーロラ風」がカエル料理だったことを明かし、イギリス食通のあいだに騒動を巻き起こした[4]。食べ方としてはソテーやパン粉焼きなどがある。もっぱら腿が用いられる。
中国においてもっとも一般的な食用蛙はアカガエルの一種で、中国語では「田鶏(ティエンジー)」と呼ばれる。冬に食べることが多かったが、現在は養殖されており年中食べることができる。またエジプトなどから大型のウシガエルも移入されて養殖されている。安徽省や福建省などでは渓流に住む「石鶏 (シージー、Rana spinosa)」も美味と珍重されている。食べ方としては手足の部分の唐揚げが最も一般的。上下を真っ二つに切って、内臓を取り出し、スープにする場合もある。また、華南では粥の具としても利用される。
なお、人へも寄生する広東住血線虫などが寄生している場合もあるので、生食や野生の捕獲喫食は危険である。
モデル生物としてカエルが利用されることも多い。発生生物学や生理学の部門での利用が有名である。特にアフリカツメガエルはよく実験目的で飼育される。脳を切除して脊髄反射を見る実験は「脊髄ガエル」という名がつけられている。 日本の理科教育においては次第に軽視される傾向だが、解剖の実習では蛙が定番である。
日本におけるカエルは、棲息に好適な水辺や水田が多かったことから、常に人にとって身近な存在となっている。古来より冬眠から覚めて活発に行動する春から夏にかけての景物とされ、『万葉集』以来、特に鳴き声を愛でて詩歌に詠む。 例えば山上憶良が「あまぐものむかぶすきはみ たにぐくのさわたるきはみ」(万葉集巻第五)と詠んだように、上代では谷間で聞かれる鳴き声から、ヒキガエルを「たにぐく(多爾具久・谷蟇)」と呼んだ[5]。 和歌での「かはづ」は、主に鳴き声が美しいことで知られるカジカガエルのことを指すが、この語は平安初期ごろから、混同されてカエル一般を指すようになった。俳諧においては、カエル一般を指すと思われる用例が増える。芭蕉の「古池や蛙飛び込む水の音」、一茶の「やせ蛙まけるな一茶これにあり」等の句は特に有名。「蛙」は春の季語で、これは初蛙のイメージから。「雨蛙(あまがへる)」「蟇/蟾蜍(ひきがへる)、蟾(ひき)、蝦蟇(がま)」「河鹿(かじか=カジカガエル)」は夏の季語である[注釈 1]。
鳥獣戯画(平安時代末期)にも、サルやウサギとともに、人間に擬せられたカエルの姿が、生き生きと描かれている。また、草双紙(江戸時代)では妖術使いの児雷也が大蝦蟇(おおがま=空想上の化け物)に乗って登場する等、様々な表現のモチーフとなっている。昭和40年代にはカエルを主人公とした漫画およびアニメーション『ど根性ガエル』や、着ぐるみ劇『ケロヨン』が人気を博した。
また、サンリオは『けろけろけろっぴ』という子供カエルのキャラクターを創造した。宮沢賢治は寓話『蛙のゴム靴』で、西洋から渡来のゴム長靴を晴れた日にも履き、得意になっている文明開化の明治紳士を風刺する中篇を書いている。21世紀にあっても、百田尚樹の風刺小説『カエルの楽園』のモチーフに使用されている。
貝原益軒の『大和本草』によれば、カエルの名は他の土地に移しても必ず元の所に帰るという性質に由来すると記述されている。
日本では、「お金が返る(カエル)」として、カエルのマスコットを財布の中に入れておく習慣がある。似たような扱いで、新しいものでは、1985年にNTTが出した「カエルコール」がある。帰るときに家に連絡を入れよう、というものだが、「今から、カエル」というテレビのコマーシャルが人気を呼んだ。
中国では道教の青蛙神信仰の影響から後ろ脚が一つのガマガエルが縁起物として飾られている場合がある。
南米のいくつかの地域では、カエルは幸運(特に金運)を招くものと考えられている。このため、カエルをペットのように飼ったり、カエルの置物を家に飾ったりすることがある。また、口を開けたカエルの置物に向かってコインを投げ、うまく口の中に入れることを競う遊びも行なわれている。
西洋においてもカエルはよく親しまれている。ギリシャ古喜劇の『蛙』では、カエルが船をこぐディオニューソスを半ば冷やかしながら歌い続けるシーンからそのタイトルをとっている。 日本語ではカエルという語はカエル目全般を指す総称だが、ヨーロッパ言語では愛すべき生き物としてのカエル(frog,frosh,grenouileなど)と、醜い生き物であるヒキガエル(toad,kröte,crapaudなど)やガマガエル(unke)を区別しており、後者はしばしば人に対する蔑称として使用される[5]。中世キリスト教ではカエルは死や吝嗇など不浄のシンボルとされたが、死後の世界では魂が水底と地上を循環するという民間伝承を持つドイツでは、水との親和性や冬眠することなどからカエルは人の魂のメタファーとされた。
ノーベル賞の授賞式では参加した学生と受賞者がカエルのようにジャンプする「蛙跳び」の儀式があり、これは受賞者のさらなる飛躍を願ってのことである由。受賞者の参加は自由意思によるが、参加した受賞者には「カエル勲章」が授けられる。またアメリカ合衆国では地域によってウシガエルの三段跳び競争が行われている。東洋においても、農業が盛んな一部の地域では信仰の対象として事実上の保護動物として扱う国々があり、一方でベトナムや東南アジアでは主に唐揚げとして酒の肴とする食用カエルが養育されている。その他熱帯雨林気候の地域では多種が生息する身近な動物である為、その国ごとのことわざにも登場する例が多い。
この他にも、世界の森林保全を目的に活動する国際NGO団体「レインフォレスト・アライアンス(RA)」が定めた、独自の基準を認証した農園で栽培された作物を使用した商品に対して付けられるマークにカエルを採用している。これはカエルが自然環境に敏感であり、環境が悪化すると他の動物よりも先に消えてしまうと言われているからである[7]。
カエルツボカビ症による両生類の絶滅が危惧されている。致死率は種類によっては90%にもなる。麻布大の宇根有美助教授(獣医病理学)は、「飼っている両生類に異変があれば、すぐに獣医師などに相談してほしい。水の管理が最も重要で、水槽の水を消毒せずに排水溝や野外に流さないでほしい」と訴えている[8]。日本産の両生類についても、その蔓延が危惧されたこともあり、実際に多くの地域で存在が確認されている。ただし、それによる被害の報告はない。むしろ、元々日本にも生息していたものらしいと考えられるに至っている。
自然界の食物連鎖の中でカエルは下位の昆虫類や節足動物類の捕食者としての位置づけだけでなく、上位の多くの生物に対する餌としてもカエルの占める位置は非常に重要でヘビ、鳥類、小動物の餌となり[注釈 2]、陸上における食物連鎖を支えている。特に日本に於いては、耕作農地面積の多くの部分が水田であり稲作の害虫となるウンカを始めとする昆虫類、様々な伝染病を媒介する蚊を含めた生物を大量に捕食し上位生物の餌となっている。水田の圃場整備をする際は、カエルの生息環境に考慮した工法が望まれる[9]。
개구리목[1] 또는 무미목(無尾目)은 양서류의 하위 분류로, 개구리, 두꺼비, 맹꽁이 등을 포함한다. 또한 개구리는 고대 트라이아스기 초반부터 살아 온 것으로 여겨진다.
몸이 굵고 짧으며, 목 부분에는 잘록한 부분이 없다. 성체에서는 꼬리가 없어지고 네 다리, 특히 뒷다리가 매우 발달되어 있다. 이들은 다시 선골·흉대·척추골의 형태상 차이, 앞발가락의 관절골 및 위턱뼈의 이빨 유무, 빨판이나 물갈퀴의 상태 등을 기준으로 분류되어 오늘날 약 3,000종 가량이 알려져 있다. 이 중 원시개구리는 꼬리가 없어졌음에도 불구하고 꼬리를 움직이는 근육이 남아 있다. 또한 물에서 살며 새끼를 돌보는 개구리류는 '무설류'라고도 불리는데, 좌우의 유스타키오관(이관)이 하나로 되어 인후부에 열려 있다.[2]
개구리 중에는 물 근처나 물 속에서 일생을 보내는 종류도 있고, 육지에서 주로 생활하다가 번식기에만 물 속으로 들어가는 종도 있다. 어떤 종은 짝짓기할 때에도 물 속으로 들어가지 않는다. 한편 많은 종이 나무에서 살거나 나무에 기어오른다. 그 밖의 어떤 종은 땅 속에 굴을 파고 살기도 한다.[3]
개구리는 보통 중성의 물 속에서 살며 pH 4.0 이하의 물 속에서 발생하거나 생존하는 경우가 적다.[4]
개구리는 겨울이 되면 땅속으로 들어가 겨울잠을 잔다. 주변 온도에 따라 체온이 변하는 변온동물이기 때문이다. 게다가 겨울이 되면 먹이가 되는 곤충들도 사라지기 때문에 겨울잠을 잘 수밖에 없다. 또, 개구리는 양서류 동물로서 피부호흡을 하기 때문에 겨울잠을 자야 한다. 양서류가 피부호흡을 하기 위해서는 물이 필요하다. 피부가 물기에 젖어야 피부호흡을 할 수 있는 것이다. 그런데 겨울이 되면 물이 얼어버리기 때문에 개구리의 피부는 건조해져서 피부호흡을 못하게 된다. 그래서 겨울잠을 자게 된다. 그런데 개구리는 겨울잠을 자는 동안 체온이 영하로 내려가도 얼어 죽지 않는다. 체내의 당분 농도가 높아서, 체액의 어는 점을 낮추기 때문에 그럴 수 있다. 겨울잠을 자는 개구리는 혈액 1리터 당 45그램의 당분을 지니며, 인간이 혈액 1리터 당 4그램의 당분만 초과해도 당뇨병에 걸리는 것에 비하면 높은 수치이다.[5]
한국에서는 3월에 개구리가 동면에서 깨어나 산란을 시작하는데, 산란은 연못·소택지·하천 등의 물 속에서 하는 것이 보통이다. 개구리는 거의 전세계에 분포하나 그 중에서도 송장개구리에 속하는 것의 분포도가 가장 넓으며, 가장 북방까지 분포하는 것은 북방산개구리로 그 분포도가 북극권까지 미치고 있다. 개구리는 수리부엉이, 뱀, 수달, 왜가리, 백로, 붉은배새매, 물총새, 물장군, 큰노랑테먼지벌레, 족제비, 담비, 밍크, 황새, 해오라기, 개구리매, 솔개, 가물치, 메기 같은 천적에게 잡아먹히고 파리, 모기, 각다귀, 메뚜기, 풀무치 등을 잡아먹는다. 개구리는 긴 혀로 먹이를 잡는데, 혀는 먹이의 움직임에 반응하여 입에서 쏘듯이 튀어나와 잡는다. 많은 개구리가 위턱에만 이가 있고, 두꺼비는 아예 이가 없다. 따라서 두꺼비와 개구리는 먹이를 통째로 삼킨다. 이렇게 통째로 삼키는 것을 쉽게 하기 위해 개구리의 눈은 두개골의 구멍 안쪽으로 들어가 있다. 먹이는 목구멍으로 밀려 들어가 소화된다. 개구리는 사람에게 여러 모로 이로운 동물이다. 나쁜 질병을 옮기는 수많은 곤충을 잡아먹으며, 또한 사람에게 단백질을 제공하는 음식으로 이용된다. 또 새로운 약을 시험하는 데 사용하며, 해부학 실험에도 이용된다. 사람들은 이런 용도로 쓸 개구리를 대부분 야생에서 잡고 있다. 오늘날 많은 개구리의 서식처가 파괴되고 물이 오염되어 생존을 위협받고 있다.[6]
대다수의 개구리는 물 속에서 교미를 한다. 영양 상태가 좋은 연못에서는 해를 거듭할수록 개구리 수가 크게 증가한다. 겨울잠을 잔 연못이 짝짓기 할 연못으로 적당하지 않을 경우에는 대개 짝짓기할 장소를 찾아 긴 여행을 떠난다. 겨울잠을 자는 데는 진흙 바닥만 있어도 적당하지만 짝짓기를 해서 새끼를 낳기 위해서는 조류(藻類)가 풍부한 연못이 좋다. 짝짓기는 보통 수컷이 먼저 물로 들어가 암컷을 유혹하는 울음소리를 낸다. 암컷이 물로 들어오면 수컷은 암컷의 등에 달라붙어 암컷을 붙잡는다. 이 자세에서 수컷은 암컷의 몸에서 떨어지는 알 위에 정액을 뿌려 수정시킨다. 알이 부화하는 데 걸리는 시간은 3-25일이다. 알의 크기·색깔·모양은 종에 따라 다른데 젤리 같은 물질이 알을 감싸고 보호한다. 이 알과 젤리의 덩어리를 난괴(알덩어리)라고 한다. 몇몇 개구리는 한 번에 수천 개의 알을 낳지만 이 중에서 극히 적은 수만이 개구리로 성장할 수 있다. 오리·물고기·곤충 등 수생생물이 많은 개구리 알을 먹어치우기 때문이다. 알이 부화하여 올챙이가 되더라도 보다 큰 수생동물에게 잡아먹힌다. 또한 연못이나 개울이 말라버려 올챙이가 죽기도 한다. 개구리는 전할을 하는 다른 동물에 비해 부등할을 하므로 동물극 쪽의 할구가 작다. 포배·낭배·신경배 등의 시기를 거쳐 오뚝이형의 배로 되며, 다음에 꼬리가 길어지면서 겉아가미가 생기고, 이 때쯤에 부화되어 수중을 헤엄쳐 나와 올챙이의 형태로 된다. 이 때 올챙이는 입이나 작은 빨판을 이용해서 물 속의 물체에 달라붙는다. 올챙이는 목이 없어 머리와 몸통은 원 모양에 가깝고, 긴 꼬리가 있으며, 작은 물고기처럼 보인다. 올챙이는 피부에 덮인 아가미가 있고 이 아가미로 호흡한다. 올챙이는 자라면서 점차 생김새가 변하는데, 꼬리가 커지면서 헤엄을 칠 수 있어서 먹이도 자유롭게 얻을 수 있다. 올챙이의 입은 수생식물인 조류를 뜯어먹기에 알맞게 되어 있다. 또 몇몇 종의 올챙이는 개구리의 알과 올챙이를 먹는다. 올챙이의 꼬리가 더 길어지면서 겉아가미는 없어지고 속아가미가 생기며, 그 바깥쪽은 호흡공(呼吸孔)으로 나고 피부로 둘러싸인다. 다음에 뒷다리가 나오고 이것이 크게 될 때쯤 피하에 발달되어 있던 앞다리가 바깥으로 나오며 꼬리의 퇴화가 시작된다. 이 때가 되면 속아가미도 퇴화하고 폐가 활동하게 된다. 개구리의 알은 크기가 2-3mm로 비교적 사육하기 쉽고 관찰하기에 편리한 점 등으로 발생학 연구에 필수적이다.[7]
개구리의 몸체는 머리·가슴·다리의 세 부분으로 되어 있다. 좌우대칭이며, 전후·등배도 잘 분화되어 있다. 머리는 편평하며 삼각형에 가깝고, 눈 위아래로 눈꺼풀이 있으나 위쪽 눈꺼풀은 움직이지 않는다. 눈의 뒤쪽에는 원형 또는 타원형의 고막이 있다. 입은 크고 입을 열면 위턱의 가장자리에 작은 턱니가 나란히 있다. 이빨은 먹이를 씹는 데 쓰지 않고 먹이를 놓치지 않도록 잡는 데 이용된다. 개구리는 길고 강한 뒷다리가 있어 뛰어오를 때 사용한다. 평평한 곳에서는 몸길이의 20배까지 뛸 수 있다. 개구리는 또한 긴 뒷다리로 수영을 하며 물에서 사는 종은 뒷발에 물갈퀴가 있다. 작은 앞다리는 개구리가 앉아 있을 때 몸을 지지해주고, 뛰어올랐다 떨어질 때 충격을 줄여 준다. 나무에 사는 개구리는 발가락 끝에 작은 빨판이 있어, 나무를 오를 때 나무 줄기에 매달릴 수 있다. 소화관은 식도·위·십이지장·대장·직장으로 나누어져 있고, 올챙이 시기에 비하면 장의 비율이 짧아진다. 호흡은 아가미·폐·피부로 하며, 폐의 구조는 간단하고, 심장은 2심방 1심실이다. 개구리의 피부는 얇고 물기에 젖어 있다. 많은 종이 피부에 독 분비선이 있어, 독을 피부 위로 분비해 자신을 보호한다. 적이 독 있는 개구리를 덮치면 독이 공격자의 입을 자극하여 그 사이에 개구리는 도망갈 수 있다. 대뇌와 소뇌는 그리 발달되지 않았으나 중뇌는 비교적 발달하여 있고 여기에서 큰 시신경이 나와 있다. 개구리의 암수는 서로 다른 구조를 하고 있다. 개구리의 수컷은 번식기에 암컷을 유인하기 위해 울음소리를 낸다. 대부분의 수컷은 울음주머니가 있는데, 소리를 낼 때는 크게 부풀어오른다. 울음주머니가 있는 종은 없는 종보다 더 큰 소리를 낼 수 있다. 몇몇 종의 수컷은 짝을 부를 때뿐만 아니라 자신의 텃세권을 알릴 때에도 소리를 낸다.[8]
어항에 씻은 강모래를 넣고 물풀을 심는다. 어항에 우물물이나 냇물, 또는 받아 놓은 지 2-3일 지난 수돗물을 넣는데, 물의 깊이는 5-10cm 정도가 좋다. 물은 2-3일에 한 번씩 갈아 주는데 반씩만 새 물로 갈아 준다. 어항은 햇빛이 드는 따뜻한 곳에 둔다.[9]
올챙이가 발이 나오기 시작하면 어항 바닥에 자갈을 깔거나 커다란 돌을 넣어 섬을 만들어 준다. 코가 가는 철망으로 뚜껑을 하여 도망가지 못하도록 해 놓고 먹이는 바퀴벌레·파리·메뚜기·귀뚜라미 같은 곤충이나 거미, 지렁이같이 살아 있는 것을 준다.[10]
10월 말부터 11월 무렵은 개구리가 겨울잠을 자기 시작하는 시기이다. 부드럽게 부수어 놓은 흙을 어항에 넣고, 그 위에 낙엽을 두껍게 깔아 개구리가 흙 속으로 파고들어갈 수 있도록 해 준다. 흙이 마르지 않도록 이따금 물뿌리개로 물을 뿌려 주고 공기가 통할 수 있도록 틈을 만들어 놓은 다음 유리로 뚜껑을 덮는다. 어항은 햇빛이 잘 비치는 툇마루 밑 같은 곳에 둔다. 기온이 10°C 이상이 되면 개구리는 봄이 된 줄 잘못 알고 겨울잠에서 깨어나와 버릴 수도 있다. 따라서 5°C 정도인 곳에 두도록 한다.[11]
개구리목에는 약 5,070 종이 속한다. 개구리목은 크게 3개 아목으로 나눈다.
개구리는 땅에서는 폴짝폴짝 뛰어다니고 물속에서는 헤엄쳐서 움직인다. 뒷다리에 물갈퀴가 있다. 뒷다리가 앞다리보다 더 길다. 긴 뒷다리를 이용해 힘차게 뻗어 뛰어오른다. 개구리는 땅에서는 폴짝폴짝 뛰어다니고 물속에서는 헤엄쳐서이동한다.