fr
noms dans le fil d’Ariane


The annual monarch migration is considered a "threatened phenomena" by the International Union for Conservation of Nature and Natural Resources. Steps have been taken by both the United States and Mexican governments along with numerous private individuals and organizations to protect the overwintering sites of these butterflies.
US Federal List: no special status
CITES: no special status
State of Michigan List: no special status
Small caterpillars hatch from eggs laid by female Monarchs. They grow, shedding their skin to get bigger. Eventually each caterpillar stops growing and forms a case around itself called a chrysalis. Inside the chrysalis it changes its body its body in a process called metamorphosis. When it is done it emerges as an adult butterfly.
Development - Life Cycle: metamorphosis
Many species of milkweed occurring in parts of the United States and Mexico are known to be poisonous to cattle ,and D. plexippus is considered beneficial because it helps reduce the abundance of these plants. Overwintering sites are of interest to tourists.
The larva feed on a wide range of milkweeds of the genus Asclepias. From these plants they acquire and store cardiac glycosides, secondary plant compounds that protect them from predation. The adults of the species forage for flower nectar.
Danaus plexippus ranges from North and South America and the Caribbean to Australia, New Zealand, the oceanic islands of the Pacific, Mauritius, the Canary Islands of the Atlantic, and, most recently, Western Europe.
D. plexippus is a predominantly open country, frost intolerant species whose range of breeding habitats is greatly dependent upon the presence of asclepiad flora (milkweeds). The monarch requires dense tree cover for overwintering, and the majority of the present sites in California are associated with Eucalyptus trees, specifically the blue gum, Eucalyptus globulus. These trees were introduced from Australia and have filled the role of native species that have been been reduced by logging.
Both male and female monarchs are bright orange with black borders and black veins. The veins on the female are thicker than those of the male. Male monarchs also have a swollen pouch on both of their hind wings.
Monarchs are poisonous to vertebrates. Their poison comes from the milkweed they feed on.
Monarchs also use their appearance to ward off predators. Orange is considered a warning color, which will warn predators that monarchs are poisonous, and not to attack them. From a distance, monarchs can blend into their surroundings. Sometimes, their spots will appear to be the eyes of a larger animal, and will ward off predators.
Range wingspan: 8.6 to 12.4 cm.
Other Physical Features: ectothermic ; bilateral symmetry ; poisonous
The mating period occurs in the spring, just prior to migration from the overwintering sites. The courtship of D. plexippus is fairly simple and less dependent on chemical pheromones in comparison with other species in its genus. Courtship is composed of two distinct stages, the aerial phase and the ground phase. During the aerial phase, the male pursues, nudges, and eventually takes down the female. Copulation occurs during the ground phase and involves the transfer of a spermatophore from the male to female. Along with sperm, the spermatophore is thought to provide the female with energy resources that aid her in carrying out reproduction and remigration.
Once they reach their breeding grounds, the females lay their eggs on milkweed host plants. The egg and larval period is temperature dependent and lasts about 2 weeks. At the end of this period, the larva enter a period of pupation, and after 9 to 15 days an adult butterfly emerges.
Breeding interval: Monarch butterflies mate in the spring before they migrate.
Key Reproductive Features: semelparous ; sexual ; fertilization (Internal ); oviparous
Journey North invites citizen scientists to track the monarch butterfly migration each fall and spring as the monarchs travel to and from Mexico. Report your own observations of migrating butterflies to real-time migration maps. Share data to help scientists understand how monarchs respond to climate and changing seasons. Explore monarch butterfly life cycle, ecology, habitat and conservation needs through a large collection of web-based educational and resouce materials.
Journey North invites citizen scientists to track the monarch butterfly migration each fall and spring as the monarchs travel to and from Mexico. Report your own observations of migrating butterflies to real-time migration maps. Share data to help scientists understand how monarchs respond to climate and changing seasons. Explore monarch butterfly life cycle, ecology, habitat and conservation needs through a large collection of web-based educational and resouce materials.
Every fall, a magical event takes place in the animal world. Perhaps traveling over your own head right now--or clustered by the hundreds in a nearby tree--the annual monarch butterfly migration to Mexico is underway.
Read more at Journey North
For monarch butterflies, the ability to migrate may rely on a single vital gene. Every year, millions of North American monarchs make a single migration to Mexico for winter — a seemingly grueling trip for the delicate-looking insects...
Shuai Zhan, Wei Zhang, Kristjan Niitepõld, Jeremy Hsu, Juan Fernández Haeger, Myron P. Zalucki, Sonia Altizer, Jacobus C. de Roode, Steven M. Reppert & Marcus R. Kronforst. 2014.The genetics of monarch butterfly migration and warning colouration. Nature. doi:10.1038/nature13812
San José: Est. Zurquí (1650 m) 10 03 30 N 84 00 40 W, Bajo de la Hondura (1260 m) 10 04 N 83 59 W, Patarrá (1170 m) 9 53 N 84 02 W, Hda. El Rodeo (800) 9 55 N 84 17 W, Alajuela: Zarcero (1700 m) 10 11 00 N 84 23 33 W, Laguna Hule (730 m) 10 18 N 84 13 W, Caño Negro (20 m) 10 50 10 N 84 50 02 W, Cartago: Vereh, Jicotea (802 m) 9 49 N 83 32 W, Heredia: Barva (2900 m) 10 08 N 84 06 W, Santo Domingo (1100 m) 9 58 25 N 84 05 39 W, Virgen del Socorro (900 m) 10 17 N 84 10 W, La Virgen (500 m) 10 20 00 N 84 05 00 W, Est. La Selva (50 m) 10 26 N 84 02 W, Puntarenas: Est. Pittier (1670 m) 9 01 38 N 82 51 56 W, Palmira (1400 m) 8 46 N 82 58 W, Las Alturas (1320 m) 8 57 N 82 50 W, Sirena (0 - 100 m) 8 27 50 N 83 35 00 W, Guanacaste: Cacao (1100 m) 10 55 00 N 85 28 00 W, El Hacha (617 m) 11 00 N 85 33 W, Santa Rosa (300 m) 10 50 15 N 85 37 40 W, Palo Verde (10 m) 10 21 N 85 21 W, Limón: Quebrada Molinete (400 m) 10 12 N 83 54 W, Hitoy Cerere (100 m) 9 40 30 N 83 01 20 W, Río Sardina (20 m) 10 38 38 N 83 44 10 W, Cuatro Esquinas (10 m) 10 30 10 N 83 32 10 W
Distribucion General: De Norte, Centro y Sur América, Antillas, Isla del Coco, Filipinas, Australia, Sulawesi, Molucas, Nueva Guinea y raras veces el oeste de Europa
Parasitoides: Hypantrophaga sp. (Tachinidae).
Larva en quinto estadio: cápsula de la cabeza de color verde con líneas a los lados y en la cara de color negro. Cuerpo de color verde-amarillo, con anillos de color negro entre segmento y segmento. Cada segmento presenta una franja en el medio de color blanco, dos tubérculos móviles largos en el tórax y dos más cortos en los últimos segmentos abdominales.
Pupa: de color verde claro, en forma de barril, con puntos dorados en los parches alares, cremaster de color negro.
Ala anterior de color negro con franja anaranjada ancha en el área basal, postbasal, submedia y media. Dos hileras de manchitas blancas del torno al ápice. En el área media y postmedia, cuatro manchas circulares amarillo naranja. Ala posterior de color anaranjada con área marginal de color negro con una hilera de manchitas blancas.
Monarx kəpənək, danaid-monarx (lat. Danaus plexippus) – danaus cinsinə aid cücü növü.
Subaldırğanı son dərəcə zəhərli bitkidir. Bir çox heyvan üçün öldürücü olmasına baxmayaraq, möcüzəvi bir şəkildə monarx kəpənəklərinin tırtılları zəhərli subaldırğanı bitkisi ilə qidalanırlar. Çünki tırtılların subaldırğanının zəhərinə qarşı immunitetləri var. Bir çox heyvan subaldırğanıdan uzaq durduğu zaman Monarx kəpənəkləri onun yarpaqların hamısını yeyə bilirlər. Bundan başqa, bu zəhərdən müdafiə vasitəsi olaraq da istifadə edirlər. Monarx tırtılları başqa kəpənəklərdən fərqli olaraq çox parlaq rənglərə sahibdirlər. Bu, onların düşmənləri üçün bir xəbərdarlıqdır və onlara tırtılların yeyilməyəcək xüsusiyyətə sahib olduğunu göstərir. Tırtıllar kəpənəklərə çevridikdə də bu zəhər molekulları dəyişmədən və çox güclü bir şəkildə bədənlərində qalır. Bu da monarxlara çox gözəl müdafiə təşkil edir.
Monarx kəpənək, danaid-monarx (lat. Danaus plexippus) – danaus cinsinə aid cücü növü.
Subaldırğanı son dərəcə zəhərli bitkidir. Bir çox heyvan üçün öldürücü olmasına baxmayaraq, möcüzəvi bir şəkildə monarx kəpənəklərinin tırtılları zəhərli subaldırğanı bitkisi ilə qidalanırlar. Çünki tırtılların subaldırğanının zəhərinə qarşı immunitetləri var. Bir çox heyvan subaldırğanıdan uzaq durduğu zaman Monarx kəpənəkləri onun yarpaqların hamısını yeyə bilirlər. Bundan başqa, bu zəhərdən müdafiə vasitəsi olaraq da istifadə edirlər. Monarx tırtılları başqa kəpənəklərdən fərqli olaraq çox parlaq rənglərə sahibdirlər. Bu, onların düşmənləri üçün bir xəbərdarlıqdır və onlara tırtılların yeyilməyəcək xüsusiyyətə sahib olduğunu göstərir. Tırtıllar kəpənəklərə çevridikdə də bu zəhər molekulları dəyişmədən və çox güclü bir şəkildə bədənlərində qalır. Bu da monarxlara çox gözəl müdafiə təşkil edir.
♂
♀
La monarca (Danaus plexippus)[3] és un lepidòpter de la família Nymphalidae. Segurament és la més coneguda de les papallones de l'Amèrica del Nord i durant el segle XIX va ser introduïda a Austràlia i Nova Zelanda.[4][5][6] A Europa és una espècie resident a les Açores i Madeira i ocasionalment migra a l'occident d'Europa. A l'Àfrica la trobem a les Illes Canàries.
La ingestió d'aquestes papallones resulta tòxica per als ocells i altres animals, ja que s'alimenten en part de plantes asclepiàcies que són verinoses per als depredadors i això els permet de sobreviure en gran nombre en les migracions que fan. Les papallones monarca són excepcionals per la llarga migració anual: a l'hivern van cap al sud i a la primavera tornen al nord. En aquest cicle anual s'esdevenen diverses generacions i, a més a més, són dels pocs insectes capaços de travessar el Golf de Mèxic.
A l'Amèrica del Nord les papallones monarca fan una massiva migració cap al sud que comença a l'agost i fineix quan hi ha les primeres glaçades. Després a la primavera tornen cap al nord. Les monarques són les úniques papallones que migren tant cap al nord com cap al sud, tal com fan els ocells. Les femelles dipositen ous a les plantes durant la migració.[7]
Cap a finals d'octubre la població de monarques que hi ha a llevant de les Muntanyes Rocalloses migren cap als estats mexicans de Michoacán i de Mèxic, a la reserva de la biosfera de la papallona monarca. La població situada a l'oest de les Muntanyes Rocalloses migra a diversos punts de la costa del sud de Califòrnia, especialment a Pacific Grove i Santa Cruz.
La duració d'aquests viatges excedeix la vida de la majoria d'aquestes papallones, que és d'uns dos mesos en les nascudes a principi d'estiu. La darrera generació de papallones de l'estiu entren en la fase no reproductiva de diapausa i així poden viure set mesos o més i durant aquest estadi volen als llocs d'hibernació.
La monarca (Danaus plexippus) és un lepidòpter de la família Nymphalidae. Segurament és la més coneguda de les papallones de l'Amèrica del Nord i durant el segle XIX va ser introduïda a Austràlia i Nova Zelanda. A Europa és una espècie resident a les Açores i Madeira i ocasionalment migra a l'occident d'Europa. A l'Àfrica la trobem a les Illes Canàries.
La ingestió d'aquestes papallones resulta tòxica per als ocells i altres animals, ja que s'alimenten en part de plantes asclepiàcies que són verinoses per als depredadors i això els permet de sobreviure en gran nombre en les migracions que fan. Les papallones monarca són excepcionals per la llarga migració anual: a l'hivern van cap al sud i a la primavera tornen al nord. En aquest cicle anual s'esdevenen diverses generacions i, a més a més, són dels pocs insectes capaços de travessar el Golf de Mèxic.
♂
♀
Glöyn byw sy'n perthyn i urdd y Lepidoptera yw glöyn y llaethlys, sy'n enw gwrywaidd; yr enw lluosog ydy gloynnod y llaethlys; yr enw Saesneg yw Monarch, a'r enw gwyddonol yw Danaus plexippus.[3]
Mae maint adenydd y gwryw rhwng 8.9–10.2 cm (3½–4 modf.).[4]
Dyma, efallai, yr enwocaf o holl loynnod byw Gogledd America. Ers y 19g fe'i gwelir hefyd yn Awstralia (ble gelwir ef yn "wanderer"[5] a Seland Newydd. Gwelir ef hefyd yn yr Ynysoedd Dedwydd, yr Azores, ac ar ynys Madeira. Ar adegau prin, mae'n ymweld â gorllewin Ewrop a hyd yn oed gwledydd Prydain.[6]
Gellir dosbarthu'r pryfaid (neu'r Insecta) sy'n perthyn i'r Urdd a elwir yn Lepidoptera yn ddwy ran: y gloynnod byw a'r gwyfynod. Mae'r dosbarthiad hwn yn cynnwys mwy na 180,000 o rywogaethau mewn tua 128 o deuluoedd.
Wedi deor o'i ŵy mae glöyn y llaethlys yn lindysyn sy'n bwyta llawer o ddail, ac wedyn mae'n troi i fod yn chwiler. Daw allan o'r chwiler ar ôl rhai wythnosau. Mae pedwar cyfnod yng nghylchred bywyd glöynnod byw a gwyfynod: ŵy, lindysyn, chwiler ac oedolyn.
|coauthors= ignored (help) |work= (help) Glöyn byw sy'n perthyn i urdd y Lepidoptera yw glöyn y llaethlys, sy'n enw gwrywaidd; yr enw lluosog ydy gloynnod y llaethlys; yr enw Saesneg yw Monarch, a'r enw gwyddonol yw Danaus plexippus.
Monarcha stěhovavý (Danaus plexippus) je denní motýl z čeledi babočkovitých. Je známý svou každoroční poutí do středního Mexika (přesněji Sierra Nevada) v obrovských hejnech, kde přežívá zimu. Protože trvá jejich cesta skoro 4000 km a po cestě na ně čeká mnoho překážek (např. sucho, hurikán...), ne všichni monarchové dosáhnou svého cíle. Na jaře se opět vrací do svých líhnišť v Severní Americe nebo v Kanadě. V Kanadě nebo v Severní Americe potom obrovská hejna sedají na stromy, na kameny a všude kolem. Stromy jsou celé obsypané motýly a je těžko rozeznat co je strom a co je motýl (pokud se motýli nijak zvlášť nepohybují). V Mexiku byla lokalita přezimování tohoto motýla vyhlášena biosferickou rezervací "Reserva de la Biosfera de la Mariposa Monarca". Rozkládá se na pomezí mexických států México a Michoacán, má rozlohu 56 000 ha a v roce 2008 byla zapsána na seznam světového dědictví.
Monarcha stěhovavý (Danaus plexippus) je denní motýl z čeledi babočkovitých. Je známý svou každoroční poutí do středního Mexika (přesněji Sierra Nevada) v obrovských hejnech, kde přežívá zimu. Protože trvá jejich cesta skoro 4000 km a po cestě na ně čeká mnoho překážek (např. sucho, hurikán...), ne všichni monarchové dosáhnou svého cíle. Na jaře se opět vrací do svých líhnišť v Severní Americe nebo v Kanadě. V Kanadě nebo v Severní Americe potom obrovská hejna sedají na stromy, na kameny a všude kolem. Stromy jsou celé obsypané motýly a je těžko rozeznat co je strom a co je motýl (pokud se motýli nijak zvlášť nepohybují). V Mexiku byla lokalita přezimování tohoto motýla vyhlášena biosferickou rezervací "Reserva de la Biosfera de la Mariposa Monarca". Rozkládá se na pomezí mexických států México a Michoacán, má rozlohu 56 000 ha a v roce 2008 byla zapsána na seznam světového dědictví.
Monark (Danaus plexippus) er en sommerfugl i takvingefamilien. Sommerfuglen er hjemmehørende i USA og Mexico, og den er kendt for at vandre langt. Disse vandringer kan føre den så langt som til New Zealand, Australien og Europa. I Europa har den nu slået sig ned i Spanien, de Kanariske øer (del af Spanien) og Portugal. Den ses meget sjældent i Danmark. Man har alene fundet nogle vingestumper i Thy i 1978 og et formentlig indslæbt eksemplar i 1987 i Hvalsø, Sjælland.
Arten blev videnskabeligt beskrevet af Carl von Linné i 1758.
Monarkens forvingelængde (fra rod til spids) er 37-50 millimeter. Den kan nemt kendes på de kraftige farver og tydelige mønstre. Kun den noget mindre Danaus chrysippus, der lever på de Kanariske øer minder lidt om monarken. Monarkens måde at bevæge sig på adskiller sig også tydeligt fra de andre danske sommerfugle. Monarken flyver med langsomme vingeslag og får derved en glidende flugt, i modsætning til de hjemlige arters mere flagrende flugt.
Monarkens larve anvender silkeplanter som foderplante. Fra værtsplanten optager larven en gift, hvilket den signalerer med sine kraftige farver. På den måde undgår sommerfuglen at blive spist. Det er dog kun nogle individer der optager nok gift til at være uspiselige, men da alle individer signalerer fare er det noget af en chance at tage for et rovdyr med monarker på menuen. Monarken har adskillige generationer i løbet af et år. Den tåler ikke frost, men kan migrere over meget lange afstande – over 3000 km.
Monarken er stadig stærkt udbredt i USA og Mexico, men der foregår en ivrig debat omkring, hvilke følger dyrkningen af den gensplejsede Bt-majs har for sommerfuglen.
Asclepias-planter (dyrkede eller indslæbte) eller andre slægter af Svalerodfamilien.
Monark (Danaus plexippus) er en sommerfugl i takvingefamilien. Sommerfuglen er hjemmehørende i USA og Mexico, og den er kendt for at vandre langt. Disse vandringer kan føre den så langt som til New Zealand, Australien og Europa. I Europa har den nu slået sig ned i Spanien, de Kanariske øer (del af Spanien) og Portugal. Den ses meget sjældent i Danmark. Man har alene fundet nogle vingestumper i Thy i 1978 og et formentlig indslæbt eksemplar i 1987 i Hvalsø, Sjælland.
Arten blev videnskabeligt beskrevet af Carl von Linné i 1758.
Der Monarchfalter (Danaus plexippus) oder Amerikanische Monarch ist ein auffällig orange und schwarz gezeichneter Schmetterling (Tagfalter) aus der Familie der Edelfalter (Nymphalidae). Er ist in Amerika weit verbreitet und hat sich im 18. Jahrhundert über den Südpazifik bis nach Australien ausgebreitet. Der Monarchfalter ist der am besten erforschte Schmetterling Nordamerikas und ein berühmter Wanderfalter. Einzelne Tiere legen bei Wanderungen im Herbst in Nordamerika bis zu 3600 Kilometer zurück. Die östliche Population in Nordamerika überwintert mit mehreren 100 Millionen Tieren auf wenigen Hektar in der mexikanischen Sierra Nevada.
In den Jahren ab etwa 2010 brachen die überwinternden Bestände drastisch ein, die in Anspruch genommene Fläche betrug ebenfalls nur noch einen Bruchteil; 2013/14 verzögerte sich die Ankunft der Falter in Mexiko zudem um drei Wochen.[1]
Eine deutlich kleinere westliche Population überwintert entlang der Pazifikküste in Kalifornien.
Die Monarchfalter haben Flügel mit oranger Grundfarbe und schwarz-weißer Zeichnung. Die Adern und Ränder der Flügel sind schwarz. An den schwarzen Flügelspitzen haben sie zwei Reihen weißer bis cremefarbener Punkte. Auf den schwarzen Binden am Flügelaußenrand verlaufen zwei Reihen kleiner weißer Punkte. Die Grundfarbe der Flügelunterseite ist heller, besonders auf den Hinterflügeln. Der schwarze Körper hat am Kopf und Thorax weiße Punkte und am Hinterleib drei bis vier dünne weiße Ringe. Die Größe der Falter variiert stark, die durchschnittliche Vorderflügellänge beträgt 47 bis 50 Millimeter.
Die Männchen sind in der Regel kleiner als die Weibchen und haben an der zweiten Ader der Hinterflügel eine schwarze, mit Duftschuppen gefüllte Tasche, die nach dem Schlupf aus der Puppe gebildet wird. An dieser Stelle ist der Flügel und die daneben verlaufende Flügelader angeschwollen. Die Männchen haben auffällige graue Haarbüschel am Abdomen. Diese spielen bei der Paarung eine wichtige Rolle und bestehen jeweils aus etwa 400 2,1 Millimeter langen und 10 Mikrometer dicken Härchen, die aus dem letzten Drittel der ausstülpbaren Haarbüschelschäfte sprießen. Die Haarbüschel, mit nur einem Typ Haare, und die Duftschuppentaschen, ein typisches Merkmal für die Tribus Danaini, sind gegenüber anderen Arten der Gattung und der Tribus stark reduziert.[2][3]
Die weiblichen Falter haben insgesamt eine hellere Grundfarbe, wobei die Ränder entlang der Adern breiter und beide dunkler gefärbt sind. Bei der sehr seltenen Form D. plexippus f. nivosus, die autosomal rezessiv vererbt wird, sind alle Flügelbereiche gräulich-weiß, die normalerweise orange sind. Die Form wurde schon überall gesichtet (Amerika, Australien, Indonesien) und ist bis auf Hawaii sehr selten. Auf der Hawaii-Insel Oʻahu werden bis zu 10 Prozent der Falter in dieser Form angetroffen.[4]
Die Flügel und der gesamte Körper einschließlich der Beine sind bis auf die Facettenaugen mit Schuppen bedeckt. 900.000 bis 1,5 Millionen Schuppen unterschiedlicher Form, die von schmalen Schuppen unterschiedlicher Länge mit bis zu zwei Zacken bis zu ovalen Formen mit bis zu drei Zacken reichen, bedecken die Flügel. Die schmalen und langen Schuppen am Flügelrand ähneln Haaren und bilden die Flügelfransen. An Kopf und Thorax sind Schuppen unterschiedlicher Form von Haaren durchsetzt. Auf den Beinen haben alle Schuppen die gleiche längliche Form mit zwei Zacken.[5]
Frisch gelegte Eier sind cremig-weiß, innerhalb von drei bis vier Tagen verfärben sie sich dunkelgrau. Ein Ei wiegt im Schnitt 0,54 Milligramm, ist circa 1,2 Millimeter lang und hat einen Durchmesser von etwa 0,87 Millimeter (Durchschnittswerte gemessen an 55 Eiern). Längs der Oberfläche verlaufen etwa 22, teils verzweigte, Rippen. Quer dazu laufen etwa 32 kleinere Rippen, die mit den Längsrippen kleine Zellen bilden. An den Enden des Eis werden die durch die Rippen gebildeten Zellen unregelmäßig und immer kleiner, um schließlich oben in die Mikropyle überzugehen, durch die später die Eiraupe schlüpft.[6]
Die Eiraupen haben einen schwarzen, glänzenden Kopf und einen hellen grau-weißen Körper. Nach der ersten Häutung nehmen die Raupen ihr typisches weiß – schwarz – gelbes Bandmuster aus Querstreifen an. Die Breite der einzelnen Farben kann je nach geografischer Region schwanken, auf den Antillen etwa sind die Raupen fast schwarz. Im zweiten Larvenstadium werden die für die Tribus Danani typischen fleischigen Fortsätze, zwei am Thorax (Segment 2) und zwei am Analsegment (Segment 11), sichtbar. Alle Larvenstadien können anhand von Merkmalen an Kopf und Metathorax unterschieden werden.
Die Raupe verpuppt sich in einer gedrungen wirkenden Stürzpuppe, die anfangs hellgrün ist und später dunkelgrün wird. Die Haut der Puppe, die leicht transparent erscheint, erinnert an Jade. Auf der Puppe befinden sich mehrere kleine und wenige größere goldene Punkte, am Abdomen bilden die Punkte ein durchgehendes Band, das nach unten von einem schwarzen Band begleitet wird. Selten kommen gelbliche oder weißliche Formen vor, die eine Anpassung an eine andere Umgebungsfarbe sind.[7]
Viele Arten der Gattung Danaus sind dem Monarchfalter ähnlich, mit einigen Arten bildet er Müllersche Mimikryringe. Müllersche und Bates’sche Mimikry sind auch zusammen mit Arten anderer Gattungen bekannt.
Die typischen Lebensräume des Monarchfalters sind offene Ödland- und Ruderalflächen, auf denen die Nahrungspflanzen der Raupen im Überfluss gedeihen. Die größte Populationsdichte hat der Monarchfalter in Nordamerika im Bereich der Großen Seen, wo sehr viele Seidenpflanzen (Asclepias) wachsen. Obwohl der Falter eher ein Bewohner der Täler ist, steigt er in Guyana bis 1500 Meter und in Mittelamerika bis auf 2000 Meter.[13]
Der Falter ist ursprünglich in Nordamerika und dem nördlichen Südamerika verbreitet. Die nördliche Verbreitung endet etwa am 50. Breitengrad im Süden Kanadas, das auch in etwa der nördlichen Verbreitungsgrenze der Seidenpflanzen entspricht. Die Verbreitung erstreckt sich durch die gesamten USA, Mexiko, die Karibik und Mittelamerika bis zum nördlichen Rand des Amazonas (Venezuela, Peru, Kolumbien, Ecuador einschließlich Galapagosinseln, Brasilien, Guyana, Surinam und Französisch-Guayana). Weiter südlich lebt die Art D. erippus, die früher als Unterart eingestuft wurde.
Im 18. Jahrhundert erweiterte der Falter sein Verbreitungsgebiet kontinuierlich und wurde 1840 auf Hawaii heimisch. In den folgenden drei Jahrzehnten verbreitete er sich über die Inseln des Südpazifiks (Karolinen (1857), Tahiti, Tonga (1868) und Samoa (1876)). 1870 wurde er auf der Lord-Howe-Insel gesehen, ein Jahr später auch in Australien (Queensland 1870, Melbourne 1872). In Ostaustralien ist der Monarchfalter häufig, in anderen Teilen des Kontinents und auf Tasmanien wird er gelegentlich beobachtet. Von den Inseln des Südpazifiks hat er sich nach Osten über die Salomonen, Neuguinea, Java, Borneo und Sumatra ausgebreitet.
Die ersten Sichtungen von Monarchfaltern in Neuseeland sollen 1840 stattgefunden haben, was aber erst 38 Jahre später dokumentiert wurde. Die damals angeblich gefangenen und präparierten Falter lassen sich heute nicht mehr auffinden. Damals glaubte man, dass die Falter endemisch in Neuseeland seien, da die Māori angeblich einen traditionellen Namen für die Falter haben (kâkãhu). Es wird heute jedoch vermutet, dass damit ein ähnlich aussehender Falter bezeichnet wurde. Die erste verlässliche Meldung von Monarchfaltern geht auf das Jahr 1868 zurück.[14]
Bis heute wurden in Asien und Ozeanien außerdem Neukaledonien (1881), Marquesas (1883) Fidschi, Mikronesien, Melanesien, Réunion, Polynesien, Sulawesi (1873, 1981) die Norfolkinsel, die Molukken, die Philippinen, Taiwan, das südliche China und Mauritius besiedelt, wobei er auf Borneo, den Philippinen und im südlichen China wieder verschwunden ist.[15]
Die Ausbreitung im pazifischen Raum wurde wahrscheinlich vom Menschen gefördert. Weiße Siedler haben Seidenpflanzen, besonders die Indianer-Seidenpflanze (Asclepias curassavica), auf die Inseln des Südpazifik gebracht, auf denen sie vorher nicht heimisch waren. Sie pflanzten sie in ihren Gärten an, und es gibt Berichte, dass Kissen und Matratzen mit getrockneten Seidenpflanzen gefüllt wurden. Daraus könnten einige Samen den Weg in die Natur gefunden haben. Nachdem die Nahrungspflanzen vorhanden waren, konnten die Tiere auf den Inseln überleben und sich ausbreiten. Ob die Tiere, die mehrere 1000 Kilometer weit fliegen können, sich an Bord von Schiffen befanden, oder selbst auf die Inseln flogen, ist nicht bekannt. In der Bucht von San Francisco ist es allerdings nicht unüblich, dass sich kleine Gruppen überwinternder Falter auf Schiffen versammeln. Ebenso wurde beobachtet, wie Falter auf fahrenden Schiffen landen. Die lange Diapause ermöglicht ebenfalls eine weite Verbreitung.
Inzwischen ist der Monarchfalter auch auf den Azoren, Madeira und den Kanaren heimisch. Erste Sichtungen auf den Azoren, wo die Falter „Feiticeiras“ (kleine Hexen) heißen, reichen bis 1864 (auf den Inseln Flores und Ilha do Faial) zurück. Die Falter tauchen immer wieder auf, meist nur für kurze Zeit im Jahr und sind stark abgeflogen, das heißt ausgeblichen und mit beschädigten Flügeln, was auf eine Einwanderung aus Nordamerika hindeutet. Einen nachweislichen Bruterfolg gab es erst 1999. Auf den Azoren dient die nur an wenigen Standorten und in kleiner Zahl vorkommende Art Gomphocarpus fruticosus als Nahrungspflanze, was – solange keine weiteren Pflanzen hinzukommen, wie etwa auf den Kanaren und Madeira – die Populationsgröße stark beschränkt. Das andere auf den Azoren vorkommende Seidenpflanzengewächs, Araujia sericifera, wurde bis jetzt nicht angenommen.[16] Auf den Kanaren sind die Inseln Teneriffa, Gran Canaria, La Palma, La Gomera, El Hierro, Lanzarote und Fuerteventura besiedelt. Die Raupe frisst hier hauptsächlich an Asclepias curassavica, aber zudem auch an Gomphocarpus fruticosus.[17]
In Europa war der Monarchfalter in den 1980er Jahren über mehrere Jahre hinweg im südlichen Spanien (Málaga) zusammen mit dem Afrikanischen Monarch (Danaus chrysippus) bodenständig. In den 1990er Jahren verschwand er wahrscheinlich aufgrund eines ungünstigen Klimas zusammen mit der verwandten Art. Seit 1997 ist der Monarchfalter entlang der Küste Andalusiens wieder bodenständig, oft an denselben Pflanzen wie der Afrikanische Monarch, der einige Jahre zuvor wieder bodenständig wurde.[18] Obwohl oft mehrere Eier beider Arten an einer Pflanze abgelegt werden, konnte keine Konkurrenz um die Nahrungspflanzen festgestellt werden.[7] In Portugal, Südfrankreich und Korsika tritt der Monarchfalter gelegentlich als Wanderfalter auf.
Wenn Monarchfalter mit starken Winden von Nordamerika verdriftet werden, sind sie manchmal an den Küsten der Britischen Inseln und Norwegens anzutreffen.[13][19] Von Stürmen über das Meer gewehte Falter werden immer wieder von Schiffen aus beobachtet, wie der folgende Bericht zeigt:[20]
I was a deck boy on the MV Laguna on a voyage from Liverpool to New York during September 1944. It was a convoy seven days out of Liverpool when order was given to scatter and make for New York without escort. This was due to the imminence of a hurricane in the path of the convoy. We encountered the edge of the hurricane and soon afterwards steamed into fair weather and blue skies. We were then 5 days or 1000 miles from New York when we ran through a massive swarm of monarch butterflies. I remember standing on deck watching this mass of colourful creatures fluttering around the ship's rigging. On arrival in New York I learned that the hurricane had turned westward, crossing Long Island, N.Y.
„Ich war Decksjunge auf der MV Laguna bei einer Reise von Liverpool nach New York im September 1944. Sieben Tage nach dem Auslaufen in Liverpool wurde der Konvoi angewiesen sich zu verteilen und alleine nach New York weiter zu fahren. Der Grund war ein riesiger Hurrikan auf der Route des Konvois. Wir begegneten dem Rand des Hurrikans und dampften bald danach in gutes Wetter mit blauem Himmel. Als wir dann auf einen riesigen Schwarm Monarchfalter stießen waren wir 5 Tage oder 1000 Meilen von New York entfernt. Ich erinnere mich, wie ich auf Deck stand und die Unmenge bunter Tiere beobachtet, die um die Takelage flogen. Bei der Ankunft in New York erfuhr ich, dass der Hurrikan sich westwärts gedreht hatte und über Long Island zog.“
Der Lepidopterologe Richard Irwin Vane-Wright veröffentlichte 1993 die Kolumbus-Hypothese, in der er vermutete, dass sich der Monarchfalter in Nordamerika erst nach der Besiedlung Amerikas durch die europäischen Siedler stark vermehrte und ausbreitete. Die starken Abholzungen sollen die Voraussetzungen für die Wanderbewegungen der Falter geschaffen haben, da viele gerodete Flächen entstanden, auf denen sich die Nahrungspflanzen der Raupen sehr stark ausbreiten konnten. Dies soll zu einem so starken Wachstum der Falterpopulation geführt haben, dass sich die Tiere in weiten Bereichen der gemäßigten Zonen ausgebreitet haben. Da die Falter in anderen Teilen der Welt nicht oder nur sehr wenig wandern, soll sich ihr Wanderverhalten erst nach der starken Ausbreitung über den Pazifik entwickelt haben. Außerdem führt er an, dass es keine Berichte über die Wanderungen aus der Zeit vor 1865 gibt.
Die Hypothese spielt heute in der Forschung keine Rolle mehr. Gegen sie spricht unter anderem, dass sich der Orientierungssinn anhand der Sonne und des Erdmagnetfelds innerhalb von 200 Jahren hätte entwickeln müssen, was äußerst unwahrscheinlich ist. Außerdem haben die Schmetterlingsforscher Zalucki und Clarke nachgewiesen, dass für die Ausbreitung im pazifischen Raum nur die Ansiedlung an drei Stellen notwendig war, damit sich der Monarchfalter über die Inselgruppen verbreiten konnte. Dies konnte leicht unbemerkt und unbeabsichtigt durch menschliche Aktivitäten geschehen.[21]
Vor dem Schlüpfen aus dem Ei wird der schwarze Kopf der Eiraupe hinter der halbtransparenten Eihülle sichtbar. Die Raupe beißt innerhalb weniger Stunden eine Öffnung in die Mikropyle. Dabei legt sie immer wieder Ruhepausen ein und verlässt die Eihülle, nachdem die Öffnung die Größe ihres Kopfes erreicht hat. Der größte Teil der Raupen frisst nur Teile der Eihülle, wenige fressen die komplette Eihülle auf oder knabbern nur die zum Schlüpfen nötige Öffnung ab und wendet sich direkt der Nahrungspflanze zu. Die kleinen Raupen ernähren sich als erstes von feinen Härchen, mit denen die Blätter der Seidenpflanzen überzogen sind. Danach krabbeln die Raupen umher, wobei die Härchen den Räupchen Probleme bereiten, um anschließend in die Nähe des Eis zurückzukehren und kleine Löcher in das Blatt zu fressen. Diese kleinen Löcher sind charakteristische Spuren der jungen Monarchfalterraupen. Nach der ersten Häutung wenden sich die Raupen den Blatträndern zu.
Wenn die Raupe auf ihrer Nahrungspflanze gestört wird, lässt sie sich zu Boden fallen, rollt sich zusammen und verharrt mehrere Minuten bewegungslos. Erfolgt die Störung mehrfach kurz hintereinander, dann verkürzt sich die Zeit der Bewegungslosigkeit auf etwa 50 Sekunden, bis sie sich schließlich nach etwa 15 Störungen nicht mehr tot stellt und gleich davon krabbelt. Wenn sich die Raupen von der Pflanze fallen lassen, müssen sie anschließend zu dieser oder einer anderen finden. Die Raupen sind nicht in der Lage, ihre Nahrungspflanzen zu riechen oder visuell von anderen Pflanzen zu unterscheiden. Deshalb krabbeln sie auf dem Boden in unregelmäßigen Wegen umher und suchen eine passende Pflanze. Mit Sinneszellen auf den Maxillarpalpen können die Raupen ertasten, ob es sich um eine geeignete Pflanze handelt. Wenn es nur wenige geeignete Pflanzen gibt, kann es passieren, dass sie keine findet und verhungert.
Die Warnfarbe der Raupen erlaubt es ihnen, auf der Oberseite der Nahrungspflanzen zu sitzen und sich ungestört zu sonnen.
Einige Monarchfalterraupen im letzten Larvenstadium nagen an den Blattstielen eine kleine Kerbe und krabbeln an die Blattspitze, um das Blatt abzuknicken. Danach krabbeln sie auf die Blattunterseite und fressen weiter. Die Zufuhr von Herzglykosiden und Milchsaft in das Blatt wird dadurch unterbrochen. Damit wird die Gefahr, dass die Raupe sich vergiftet oder ihre Mandibeln durch den Milchsaft verkleben, vermindert.
Bei der Zucht von vielen Raupen auf engem Raum kann es zu Kannibalismus kommen. Die angreifende Raupe beginnt, den gerade ausgeschiedenen Kot einer anderen Raupe zu fressen und geht dann dazu über, diese von hinten aufzufressen. In der freien Natur ist so ein Verhalten sehr unwahrscheinlich, da die Weibchen die Eier fast immer einzeln an Blätter der Nahrungspflanze ablegen und die Raupen somit nicht in großer Zahl zusammen leben. Die einzige Ausnahme sind Freilandbeobachtungen in Spanien, bei denen Puppen von Raupen angefressen wurden, als viele Raupen auf einer Pflanze lebten.[7]
Wandernde Falter sind an ihrem Flugverhalten zu erkennen, bei dem Hindernisse überflogen werden. Die Wanderungen der Falter werden stark vom Wind beeinflusst. Bei Rückenwind segeln die Falter oft und fliegen mehrere 100 Meter hoch, um den für sie günstigen Wind zu nutzen, während sie bei Gegenwind niedrig über dem Boden fliegen, wo der Wind am schwächsten ist. Bei den Wanderflügen legen die Falter immer wieder sogenannte „soziale Flüge“ ein, bei dem sich die Falter in etwa 30 Meter Höhe in einem großen Kreis verfolgen, wobei der Flug aus Flattern und Gleiten besteht. Oft werden sie dabei vom Wind weitergetragen, das Flugbild gleicht kreisenden Seevögeln an der Küste.
Nicht wandernde Falter, die umherfliegen, Blüten besuchen oder geeignete Pflanzen für die Eiablage suchen, haben einen eher ziellosen Flug und umfliegen Hindernisse. Männliche Falter fliegen höher im Gelände und besuchen auch Blüten auf Bäumen während die Weibchen meist dicht über der Bodenvegetation fliegen und geeignete Pflanzen für die Eiablage suchen. Bei diesem ziellosen Flug durchlaufen ihre Flügel beim Flügelschlag etwa 30 Bogengrad und die Flügelschläge werden von kurzen Gleitphasen unterbrochen. Die Falter erreichen dabei eine Geschwindigkeit von etwa 17 km/h. Wenn sich die Falter bedroht fühlen und fliehen, schlagen sie heftig mit den Flügeln, die dann 120° durchlaufen und senkrecht über ihrem Körper zusammenschlagen. Dabei erreichen die Falter eine Geschwindigkeit von über 30 km/h.[22][23] Bei Wanderflügen fliegen die Falter manchmal sehr hoch, sie wurden mit dem Fernglas bis zu 500 Meter hoch über dem Boden beobachtet und Drachenflieger-Piloten trafen sie bis in 1250 Meter über dem Grund an.[24]
Die Lebenserwartung der Falter liegt bei etwa einem Monat. Wenn die Falter wandern und eine Diapause einlegen, leben sie jedoch acht bis zehn Monate lang, wobei die Falter auch nur noch einen Monat leben, sobald sie fruchtbar geworden sind.[25][26]
Das Spektrum der Blütenpflanzen, die von den Faltern besucht werden, ist vielfältig. Es wurden Besuche an Blüten der folgenden Pflanzenfamilien beobachtet: Doldenblütler (Apiaceae), Seidenpflanzengewächse (Asclepiadaceae), Kreuzblütengewächse (Brassicaceae), Geißblattgewächse (Caprifoliaceae), Dickblattgewächse (Crassulaceae), Kardengewächse (Dipsacaceae), Heidekrautgewächse (Ericaceae), Wolfsmilchgewächse (Euphorbiaceae), Hülsenfrüchtler (Fabaceae), Hortensiengewächse (Hydrangeaceae) Malvengewächse (Malvaceae), Myrtengewächse (Myrtaceae), Wunderblumengewächse (Nyctaginaceae), Nachtkerzengewächse (Onagraceae), Orchideen (Orchidaceae); Rosengewächse (Rosaceae), Hahnenfußgewächse (Ranunculaceae), Weidengewächse (Salicaceae), Nachtschattengewächse (Solanaceae), Eisenkrautgewächse (Verbenaceae) und Grasbäume (Xanthorrhoeaceae) .
Die Falter nehmen von vertrockneten Pflanzen verschiedener Arten der Raublattgewächse (Boraginaceae), Korbblütler (Asteraceae) und Hülsenfrüchtler (Fabaceae) Pyrrolizidinalkaloide auf, die sie giftiger machen.[27] Die Männchen benötigen sie im Gegensatz zu anderen Arten der Danaini nicht für die Produktion von Pheromonen.[3]
Die Männchen zeigen ein Revierverhalten und patrouillieren in ihrem Gebiet auf der Suche nach Weibchen. Wird ein Männchen auf ein Weibchen aufmerksam, dann verfolgt es dieses mit schnellem Flug. Wenn das Weibchen nicht paarungsbereit ist, flieht es in einem schnellen Zick-Zack-Flug und weicht dem Männchen aus. Paarungsbereite Weibchen beginnen einen wendelförmigen Flug nach oben, bei dem sie vom Männchen verfolgt werden. Zwischendurch brechen sie aus und fliegen schnell davon. Dieses Schauspiel wiederholt sich mehrfach und das Männchen überholt das Weibchen und stülpt dabei seine Haarbüschel am Abdomen aus. Später setzen sich beide auf ein Blatt oder einen Zweig. Das Männchen fächelt mit sanften Flügelschlägen zum hinter ihm sitzenden Weibchen, das seine Flügel geschlossen hält. Danach zieht das Männchen seine Haarbüschel ein und biegt sein Abdomen zum Abdomen des Weibchens und beide vereinen sich. Anschließend fliegt das Männchen kurze Strecken mit dem an ihm heftenden Weibchen, das weiterhin seine Flügel geschlossen hält. Außer Sperma werden auch Nährstoffe und Herzglykoside übertragen. Die Nährstoffe nutzt das Weibchen bei der Eiproduktion, welche besonders nach der Überwinterung wichtig sind, wenn die Fettreserven fast verbraucht sind. Die Herzglykoside verstärken die Giftigkeit.
Im Gegensatz zu anderen Danaini sind die Haarbüschel für eine erfolgreiche Paarung beim Monarchfalter nicht erforderlich. Die Falter tauchen manchmal das Abdomen mit den Büscheln in die Flügeltaschen, übertragen aber keine Duftstoffe, da sie im Gegensatz zu anderen Arten der Gattung keine Pheromone produzieren. Dieses Verhalten scheint ein Relikt aus der Zeit zu sein, als Pheromone bei der Art noch eine wichtige Rolle bei der Paarung spielten. Statt um das Weibchen mit Düften im Flug zu werben, gibt es beim Monarchfalter oft eine rabiate Methode, um die Paarung zu erzwingen. Im Flug stürzt sich das Männchen von oben auf das Weibchen und hält sich an ihm mit seinen Beinen an Kopf, Thorax und Abdomen fest und zwingt sie in einem Gleitflug zur Landung. Dieses Verhalten ist nur vom Monarchfalter und dem Afrikanischen Monarch bekannt. Speziell geformte Tarsen helfen den Männchen sich an den Weibchen festzuhalten. Die weit verbreitete Partnerwahl durch weibliche Schmetterlinge gibt es damit beim Monarchfalter nicht. Dieses Verhalten veranlasste Miriam Rothschild 1978 zu folgender, oft zitierten, Äußerung:[3]
“The monarch butterfly could well be designated nature's prime example of the male chauvinistc pig.”
„Der Monarchfalter kann als bestes Beispiel der Natur für das männliche Chauvinisten-Schwein bezeichnet werden.“
In den Überwinterungskolonien werden die Weibchen bevorzugt von Männchen begattet, die kleiner und abgeflogener sind und den Rückflug nicht überstehen können. Größere Männchen in gutem Zustand treten den Rückflug an und paaren sich erst später nahe an den Eiablagestellen. Die Weibchen werden bis zu 11 Mal begattet und legen über einen Zeitraum von zwei bis fünf Wochen etwa 300 bis 400 Eier einzeln auf die Blattunterseite der Nahrungspflanze ab. Bei gezüchteten Faltern mit idealer Nahrungsversorgung werden etwa doppelt so viele Eier produziert, Spitzenwerte können sogar bei über 1000 Eiern liegen.[28]
Die Männchen verlieren bald nach der Paarung Gewicht in Form von Wasser und werden spröde, sie bleichen aus und sterben. Nach der Paarung entwickeln sich langsam die ersten Eier, deshalb legen die wandernden Weibchen gegen Ende ihrer Wanderung die meisten Eier ab. Danach ereilt sie dasselbe Schicksal wie die Männchen.
Die Monarchfalter orientieren sich bei ihren Wanderungen am Sonnenstand und korrigieren den Azimut während des Tages um den Kurs zu halten. Durch die Wahrnehmung polarisierter Ultraviolettstrahlung ist diese Navigation auch bei bedecktem Himmel möglich. Zusätzlich haben sie im Kopf Magnetit eingelagert und können sich dadurch mit Hilfe des Erdmagnetfelds und ihres Magnetsinns orientieren.[29] Bei ihren Wanderungen nutzen sie außerdem Landmarken wie etwa die Sierra Madre Oriental, der sie im Herbst entlang nach Süden mit leichter Ostausrichtung folgen, nachdem sie zuvor eine südwestliche Richtung durch Nordamerika flogen. Ebenso dienen Gewässer wie große Flüsse oder Seen und die Meeresküsten der Orientierung.[30][31]
Die Eiraupe schlüpft etwa vier bis fünf Tage nach der Eiablage. Die Entwicklungszeit verringert sich mit steigender Temperatur. Bei 17 °C dauert es gute 5 Tage, während sich die Entwicklungszeit ab 25,5 °C auf unter 4½ Tage verkürzt. Unter günstigen Bedingungen erreichen die Raupen nach etwa 16 Tagen das Vorpuppenstadium. In dieser Zeit häuten sie sich vier Mal; aus der 0,54 Milligramm leichten Eiraupe wird eine etwa 1,5 Gramm schwere und sechs Zentimeter lange Raupe. Die Gewichtszunahme über die Zeit ähnelt einer quadratischen Funktion. Die Entwicklungsgeschwindigkeit hängt stark von der Temperatur ab, bei feuchtem und kühlem Wetter kann die Entwicklung stark verzögert ablaufen, während höhere Temperaturen und Sonnenschein die Entwicklung beschleunigen. Vor jeder Häutung wird die Raupe träge, sie wandert umher und sucht einen ruhigen Platz, an dem sie innerhalb einiger Stunden die Häutung vollzieht. Dabei wirkt ihr Körper verkrampft, hin und wieder bewegt sie sich ruckartig vor und zurück oder schlägt nach links und rechts. Die alte Haut reißt hinter dem Kopf auf. Mit Kontraktionen wird sie nach hinten abgestoßen. Die Raupe ruht noch eine Weile bis die neue weiche Haut, besonders die Kopfkapsel und die Mundwerkzeuge, ausgehärtet sind.
Die Raupen ernähren sich hauptsächlich von verschiedenen Seidenpflanzen, in Nordamerika sind 27 Arten als Nahrungspflanzen nachgewiesen. Seltener werden Arten anderer Gattungen aus der Unterfamilie der Seidenpflanzengewächse angenommen. Die Eier für die erste Generation werden vorwiegend an Asclepias oenotheroides, Asclepias viridis und Asclepias asperula abgelegt, während die Eier für die zweite bevorzugt an Gewöhnlicher- (Asclepias syriaca) und Sumpf-Seidenpflanze (Asclepias incarnata) abgelegt werden. Sehr selten legen die Falter Eier an dem invasiven Neophyten Vincetoxicum rossicum ab, an dem sich die Raupen nicht entwickeln können.[32]
In neu besiedelten Gebieten haben die Raupen teilweise auf andere Pflanzenfamilien gewechselt. Auf den Kanaren und Madeira fressen sie an dem Wolfsmilchgewächs Euphorbia mauretanica und in Andalusien an dem zu den Hundsgiftgewächsen zählenden Cynanchum acutum.[7]
Die verpuppungsreife Raupe verlässt die Nahrungspflanze und sucht sich viele Meter weit entfernt einen geschützten, schattigen Platz für die Verpuppung. Wenn sie einen solchen gefunden hat spinnt sie ein kleines Polster aus Fäden, die Drüsen an ihrem Kopf produzieren. Danach spinnt sie in der Mitte der Matte einen Strang, der bis zu vier Millimeter lang sein kann. Beides dauert etwa drei Stunden. An dem Strang befestigt sie sich mit gebogenen Dornen, die ringförmig um die analen Bauchbeine angeordnet sind. Die hängende Raupe hat die Form eines „J“, der Kopf ist zum Thorax hochgezogen. Nach wenigen Minuten bricht die Raupenhaut hinter dem Kopf auf und die Haut der Stürzpuppe kommt zum Vorschein. Die Puppe ist anfangs weich und beweglich, sie härtet mit der Zeit aus. Nach 9 bis 12 Tagen Puppenruhe schlüpft der Schmetterling innerhalb von drei Minuten. Er pumpt Hämolymphe in die Flügel um sie zu entfalten und wartet, bis sie ausgehärtet sind.[34]
Auf Barbados gibt es ein bemerkenswertes Zusammenspiel mit Käfern der Seidenpflanzen. Die Monarchraupen ernähren sich auf der Insel hauptsächlich von Oscher (Calotropis procera), da die Indianer-Seidenpflanze (Asclepias curassavica) aufgrund der Topologie der Insel nur selten Fuß fassen kann. Siedelt sie sich jedoch einmal zusammen mit Wanzen der Gattung Oncopeltus an, so werden die Pflanzen von den Raupen so schnell kahl gefressen, dass die Wanzen verhungern.[35]
Die ausgedehntesten Wanderungen unternehmen die Falter der östlichen Population in Nordamerika, gefolgt von der westlichen Population. Die beiden Populationen sind durch die trennenden Rocky Mountains nicht ganz geographisch isoliert. In Tälern in Idaho und Montana, besonders an den Nebenflüssen des Snake River, ziehen die Falter beider Populationen umher und es findet Genfluss statt. In Australien und Neuseeland wandern die Falter nur über kurze Strecken.
Die östliche Population in Nordamerika lebt zwischen den östlichen Rocky Mountains und der Atlantikküste. Der Großteil der Population überwintert in einer Diapause in den Vulkanbergen der Sierra Nevada Mexikos auf etwa 3000 Höhenmetern. Nur ein sehr kleiner Teil überwintert im milden Süden Floridas und pflanzt sich teilweise auch im Winter fort. Im Frühjahr wandern die Falter von ihren Überwinterungsplätzen über mehrere Generationen nach Norden und Osten. Sie legen unterwegs immer wieder Eier ab, aus denen sich die nachfolgenden Generationen entwickeln.
Die letztjährigen Falter erreichen nach der Überwinterung in Mexiko bei ihrer Nordwanderung bis Ende April Texas, Oklahoma, Arkansas, Louisiana, Mississippi, Alabama, Georgia, South Carolina, North Carolina und den Süden von Missouri und Kansas. Es scheint, dass die Falter wieder zu dem Ort zurückkehren wollen, in dem sie als Raupe gelebt haben. Nur sehr wenige ziehen weiter nach Norden bis zu den Großen Seen, da nur wenige Tiere die Wanderungen in beide Richtungen über die große Entfernung überstehen.[36] Die Weibchen legen nur wenige Eier in Mexiko, die meisten legen sie gegen Ende ihrer Wanderung in den südlichen USA.[37] Die daraus entstehende erste Generation schlüpft Ende April bis Anfang Juni. Die wandernden Falter erreichen Ende Mai North Dakota, Minnesota und das Gebiet um die Großen Seen und legen in diesen Gebieten ebenfalls Eier ab. Die Falter dieser Generation sind von Südtexas und der Golfküste bis nördlich der Großen Seen anzutreffen. Da nur wenige Überwinterer aus Südflorida nach Norden ziehen und in Zentral- und Nord-Florida Eier ablegen, fliegen auch nur sehr wenige Falter der ersten und letztjährigen Generation östlich der Appalachen nach Norden.[24] Die Entwicklung ist aufgrund der oft niedrigen Temperaturen langsam und es dauert 40 bis 50 Tage, bis sich aus den Eiern Falter entwickelt haben.
Die Falter der zweiten Generation schlüpfen im Juni und Juli und wandern nur noch wenig weiter nach Norden und erreichen etwa am 50. Breitengrad die nördliche Verbreitungsgrenze im Süden Kanadas. Sie wandern stärker Richtung Nordosten und besiedeln den Raum zwischen Sankt-Lorenz-Strom und dem Atlantik und fliegen bis New Brunswick, Nova Scotia und dem Osten von Neufundland. Die Nahrungspflanzen im Süden der USA vertrocknen im Sommer. Deshalb wandern die dortigen Falter nach Norden und südlich des 33. Breitengrads sind danach fast keine Falter mehr anzutreffen.
Durch unterschiedlich schnelle Entwicklung in den verschiedenen Regionen fliegt Ende August/Anfang September eine dritte und vierte Generation gemeinsam und bildet die individuenstarke Spätsommerpopulation, die wenig später nach Süden wandert. Während die vorherigen Generationen wenige Tage nach dem Schlüpfen fruchtbar wurden, bleiben viele dieser Tiere bis nach der Diapause unfruchtbar. Einige Weibchen, die fruchtbar sind, legen auf dem Weg nach Süden weitere Eier und es kann stellenweise eine fünfte Generation entstehen.[38] Ausgelöst wird die Dormanz durch die kurzen Tage, die niedrigeren Temperaturen und die absterbenden Nahrungspflanzen.[39]
Die Tiere wandern aus ihrem über 100 Millionen Hektar großen Lebensraum von September bis November in die mexikanische Sierra Nevada und versammeln sich auf weniger als 20 Hektar. Auf ihrer Wanderung finden sie sich jährlich immer wieder an den gleichen Rastplätzen ein und bilden über die Nacht teilweise große Kolonien. Die Falter sitzen bei niedrigen Temperaturen und starkem Wind dichter beisammen und bilden noch größere Kolonien. Bei Temperaturen unter 10 °C können die Falter nicht fliegen und ruhen bei entsprechendem Wetter auch tagsüber. Bei Sonnenschein und über 13 °C können sie ihre Wanderung fortsetzen. Für die Wanderung von Kanada bis Mexiko benötigen die Falter acht bis zehn, aus den südlicheren Gebieten vier bis sechs Wochen. Durchschnittlich legen sie etwa 50 Kilometer am Tag zurück. Während der Wanderung sterben viele Falter in den Gewässern und auf den Straßen. An manchen Stellen sind die Ufer der großen Seen mit angeschwemmten toten Faltern übersät. Die Falter wandern in einer südwestlichen Richtung, starten östlich des Huronsees, dann erreichen sie in der Regel nicht direkt Mexiko, sondern stoßen auf den Golf von Mexiko und wandern in großen Schwärmen an der Küste entlang. Die Falter von der Ostküste wandern anfangs nach Süden und stoßen auf die Atlantikküste, an der sie entlang ziehen, bevor sie ihre Flugrichtung nach Westen zur Golfküste ändern.
Etwa im Oktober durchqueren sie Texas um in Mexiko der Sierra Madre Oriental nach Süden zu folgen, danach wenden sie sich nach Westen und erreichen die Vulkanberge der Sierra Nevada.
Die Herkunft der Falter spiegelt sich im Winterquartier nieder. Die Falter der Great Plains fliegen die westlichsten Plätze an, die der Großen Seen, die nicht die Golfküste erreichen, etwa die mittleren. Falter, die die Golfküste erreichen, besetzen die östlichen Plätze.
Ein kleiner Teil der östlichen Falter fliegt nach Florida, davon verbringt der größte Teil den Winter dort, oft ohne Diapause, und der Rest fliegt über Kuba nach Yucatán. Andere ziehen über Nordflorida, Jamaika und Kuba nach Yucatán. Aus Yucatán sind große Schlafkolonien wandernder Falter bekannt. Ob es sich hierbei nur um die Nominatform Danaus plexippus plexippus oder auch um die in der Karibik verbreitete Unterart Danaus plexippus megalippe handelt, ist nicht geklärt. Ein sehr kleiner Teil der Falter, der auf die Atlantikküste stößt, fliegt manchmal nach Bermuda.[40]
Die Überwinterungsquartiere befinden sich im Süden Mexikos in den Bundesstaaten México und Michoacán in der Sierra Nevada, einem Hochplateau vulkanischen Ursprungs. Die etwa 30 Überwinterungskolonien verteilen sich auf neun getrennte Vulkanmassive, die zwischen 70 und 170 Kilometer von Mexiko-Stadt entfernt sind. In den Bergen herrschen die Madrean Pine-Oak Woodlands vor, es wachsen hauptsächlich Eichen bis auf 2900 Meter, Kiefern zwischen 1500 und 3000 Meter und Tannen (Abies religiosa) zwischen 2400 und 3600 Meter über N.N. Weniger stark verbreitet sind Zypressenwälder (Cupressus lindleyi), die zwischen 2400 und 2600 Meter wachsen, Wacholderheiden und Grasflächen mit Fingerkräutern (Potentilla candicans). Stellenweise gibt es Agrarflächen und Buschland.[24][41]
Wenn die Falter in den Bergen angekommen sind, fliegen sie umher, beobachten die Windrichtung und suchen sich windgeschützte Stellen an Bäumen, bevorzugt auf Abies religiosa. Wenn sich die zuerst eingetroffenen Falter niedergelassen haben, gesellen sich die nachfolgenden ohne Beachtung der Windrichtung hinzu und es bilden sich dichte Trauben aus Faltern, die ganze Bäume bedecken können. Wenn sich der Wind dreht, sind die Falter, die sich vorher im Lee befanden, dem kalten Wind ausgesetzt. Da sie bei den niedrigen Temperaturen im Winter nicht fliegen können, fallen sie zu Boden, wenn sich die Bäume im Sturm mit Regen- oder Schneefall biegen, welche häufig Ende Dezember bis Anfang Januar auftreten. Ganze Trauben von Faltern werden dabei von den Baumspitzen geschüttelt und sterben am Boden. Mitte Januar und im Februar lösen sich die großen Trauben auf den Gipfeln auf und die Falter wandern talwärts und bilden kleinere und lockere Trauben. Die Falter verlassen dann immer wieder die Bäume um am Rand kleiner Pfützen und an Matsch zu saugen. Gegen Ende Februar, wenn es wieder wärmer wird, verlassen sie die Berge und wandern nach Norden. Nur ein sehr kleiner Teil bleibt in Mexiko zurück.[42]
Die westliche Population in Nordamerika lebt den Sommer über in den Tälern der westlichen Rocky Mountains und der Kaskadenkette. Sie macht etwa fünf Prozent der Gesamtpopulation aus und überwintert an der kalifornischen Küste auf Eukalyptusbäumen, Monterey-Kiefern (Pinus radiata) und Monterey-Zypressen (Cupressus macrocarpa). Auf Platanus racemosa überwinterten sie, bevor diese durch die weißen Siedler stark abgeholzt wurden.[43]
Auf den Kiefern bilden die Falter besonders dichte Trauben, wogegen sie auf den in den 1850er Jahren aus Australien eingeführten Eukalyptusbäumen lockerer beisammen sitzen. Die Eukalyptusbäume haben sich stark ausgebreitet und blühen im Winter, so dass sie den Faltern in dieser nektararmen Jahreszeit besonders wertvoll sind.[44] Die Tiere an den nördlichen Überwinterungsplätzen sind inaktiv und bleiben über den Winter am selben Ort. Die südlichen Falter sind oft aktiv und saugen zwischendurch Nektar. Manchmal wechseln sie den Überwinterungsplatz. Ab Mitte Februar werden die Tiere aktiver und ziehen wenige Wochen später nach Nordosten.
Die über 300 Überwinterungsplätze befinden sich fast ausschließlich in einem 1000 Kilometer langen Küstenstreifen von Marin County bis Ensenada, im Schnitt etwa 2,5 Kilometer von der Küste entfernt. Nur sechs Plätze im Landesinneren sind bekannt, wovon ein Überwinterungsplatz nördlich der Mojave-Wüste im trockenen Saline Valley, 320 Kilometer von der kalifornischen Küste entfernt, eine krasse Ausnahme darstellt. Die Ansammlungen der Falter erreichen nur selten mehr als 1000 Tiere, nur elf Orte sind bekannt, an denen die Ansammlungen über mehrere Jahre hinweg mehr als 50.000 Individuen hatten. Etwa 70 Prozent der gesamten westlichen Population überwintert zwischen Santa Cruz County und Santa Barbara County.
Besonders viele Falter überwintern bei Ventura, Carlsbad, Santa Cruz (Natural Bridges State Park), North Beach Campground in Pismo Beach (San Luis Obispo County) und der kleinen Stadt Pacific Grove im Monterey County.[45]
Es gibt Anzeichen, dass einige Falter aus dem Großen Becken südöstlich über Arizona nach Sonora wandern. Ob es sich hier um eine wirkliche Migration oder nur um die Verkleinerung des Verbreitungsgebietes über den Winter handelt, ist noch nicht geklärt.[39]
Seit den 1870er Jahren hat der Monarchfalter weite Teile des östlichen Australien und einen kleinen Teil im Westen besiedelt. Die saisonbedingte Ausbreitung hängt mit dem Vorhandensein von Seidenpflanzengewächsen zusammen, die empfindlich auf Trockenheit und Frost reagieren. In Queensland brütet der Großteil der Population das ganze Jahr über. Im Herbst ziehen sich die Falter aus New South Wales und dem südlichen Queensland zurück und wandern nach Norden. Regelmäßige Langstreckenwanderungen werden nicht beobachtet, obwohl die längste gemessene Wanderung eines Falters fast 400 Kilometer beträgt. Die Falter konzentrieren sich in drei Gebieten, einem Küstenstreifen im nördlichen New South Wales und südlichen Queensland, im Sydneybecken und Hunter Valley und in der Umgebung von Adelaide. Südlich des 34. südlichen Breitengrades sind die Tiere in der Regel ab Herbst nicht fruchtbar, wogegen ein Teil der Population in der Region von Sydney immer fruchtbar ist. Das Verhältnis von fruchtbaren zu unfruchtbaren Tieren hängt von der Temperatur ab.[46]
In Neuseeland wird das Wander- und Überwinterungsverhalten des Monarchfalters etwa seit 1980 erforscht, Berichte über überwinternde Falter gehen bis in die 1950er Jahre zurück. Die Falter legen auf Neuseeland nur kurze Strecken zurück um zusammen zu überwintern, sehr selten sind es mehr als 20 Kilometer. Die Anzahl der Überwinterer schwankt wetterbedingt ebenso stark wie die Populationen in Neuseeland insgesamt.
Einige 100 Überwinterer wurden 1959 erstmals auf der Nordinsel in Northland, Hawke’s Bay und Nelson beobachtet, in den darauf folgenden Jahren ging ihre Anzahl teilweise auf einige Dutzend zurück und erreichte 1962 wieder über 100 Tiere. Kolonien mit einigen 1000 Tieren wurden auf der Nordinsel auf Stephenson’s Island, in der Bucht von Tauranga und im Norden von Auckland im Mai und Juni 1964 beobachtet.
Die Falter werden immer wieder in den Regionen Canterbury und Otago und gelegentlich in der Region Southland gesichtet. In Christchurch, an der Ostküste der Südinsel, versammeln sich die Falter in Parks und Gärten und sind damit zur Touristenattraktion geworden, eine größere Anzahl Überwinterer hat sich zum Beispiel 2003 versammelt. Nach einem Schneeeinbruch 1992 brach die Population auf der Südinsel stark ein.[14][47]
Von den abgelegten Eiern entstehen aus etwa 90 Prozent keine Falter. Umweltbedingungen und besonders natürliche Feinde wie Ameisen und Parasitoide reduzieren die Population in jedem Stadium. Bis zu zehn Prozent der Raupen erreichen das Falterstadium durch Probleme bei der Häutung, bakterielle, virale oder fungizaile Infektion, Vergiftung durch die Herzglykoside und verklebte Mundwerkzeuge durch den Milchsaft der Nahrungspflanze nicht. Temperaturen über 35 °C sind für die Raupen, ebenso wie längere Frostperioden für alle Stadien tödlich. Geringe Luftfeuchtigkeit und längere Trockenheit, bei der die Nahrungspflanzen vertrocknen, wirken sich ebenfalls negativ aus.
Die Falter sind sehr frostempfindlich, schon wenige Grade unter Null lassen viele Tiere sterben. Werden die Tiere vor dem Frost angefeuchtet, etwa durch Nebel oder Regen, verringert sich ihre Frosthärte stark. Experimente zeigten, dass bei trockenen Bedingungen die Hälfte der Tiere −8,1 °C überlebten, bei −15 °C starben alle. Von befeuchteten Tieren starb die Hälfte schon bei −4,4 °C und bei −7,8 °C starben alle. Außerdem beschleunigt Feuchtigkeit das Erfrieren, bei −4 °C dauert es bei angefeuchteten Faltern nur drei Stunden, während trockene Falter auch nach 24 Stunden noch nicht erfroren sind.[48]
Die Stärke der westlichen Population unterliegt viel stärkeren Schwankungen als die östliche, da die Nahrungspflanzen weniger stark verbreitet sind und durch das an vielen Orten trockene Klima nicht jedes Jahr gut gedeihen. Die Populationsstärke korreliert stark mit dem Grad der Trockenheit eines Jahres. So wurden 1997 etwa über 1,2 Millionen Tiere gezählt und nach mehreren trockenen Jahren waren es 2002 nicht einmal mehr 100.000. Viele Überwinterungsplätze blieben 2002 verwaist, obwohl diese die gleichen Bedingungen boten, wie die Jahre zuvor. Es gab weder Abholzungen noch Baumaßnahmen.[49]
Die mehreren 100 Millionen Falter der östlichen Population, die sich je nach Jahr im Sommer entwickelt, erleidet bei ihren langen Migrationsflügen erste starke Verluste etwa durch Wettereinflüsse und den Straßenverkehr. Weitere kommen über die lange Diapause durch das kalte Wetter und Prädatoren hinzu. Die Wettereinflüsse in der Sierra Nevada treffen die Tiere seit einigen Jahrzehnten durch illegalen Holzeinschlag stärker. Schon der Einschlag weniger Bäume kann dazu führen, dass mehr Falter absterben, da sie einerseits leichter nass werden und stärker kalten Winden in der Nacht ausgesetzt sind, sodass die frostempfindlichen Tiere sterben. Andererseits sind sie am Tag stärkerer Sonneneinstrahlung ausgesetzt, was zu einem höheren Energieverbrauch führt und sie damit ihre Fettreserven aufzehren. Kälteeinbrüche töten immer wieder Millionen Tiere, wie etwa 1981 als circa 2,7 Millionen Falter starben. Der längste beobachtete Sturm 1981 dauerte vom 12. bis 23. Januar und tötete etwa 42 Prozent der Population. Im Januar 1992 tötete lang anhaltendes kaltes und feuchtes Wetter 90 Prozent der Falter in der Kolonie Sierra Herrada, die auf 3164 Metern liegt. Ein verheerender Kälteeinbruch und Sturm vom 12. bis 16. Januar 2002, bei dem die Falter vorher durch Regen nass wurden, tötete mit etwa 500 Millionen Tieren 75 Prozent der Population. An den Überwinterungsstellen wurden etwa 5000 tote Falter pro Quadratmeter gezählt.[48] Zwei Jahre später töteten zwei Stürme am 18. und 31. Januar etwa 70 Prozent der Falter. Der folgende Sommer war der kühlste seit 1992 und die Sommerpopulation hatte nur ein geringes Wachstum. Im darauffolgenden Winter 2004/2005 wurde die bis dahin geringste Zahl überwinternder Monarchfalter in Mexiko registriert. Die Kolonien beanspruchten nur 2,2 ha, der niedrigste Wert seit mindestens 12 Jahren, wahrscheinlich sogar seit Beginn der Beobachtungen der Plätze Ende der 1970er Jahre. Die größte Ausdehnung hatten die Kolonien 1996/1997 mit fast 22 ha. In den folgenden Jahren gab es eine leichte Erholung, jedoch haben die Bestände in den folgenden Jahren wieder abgenommen und im Winter 2013/14 einen neuen Tiefstand mit nur 0,67 ha erreicht.[50] Als Hauptursachen für die Rückgänge der letzten Jahre gilt neben Wetterextremen der starke Rückgang an geeigneten Nahrungspflanzen in den USA und Kanada durch den Anbau von pestizidresistenten Pflanzen in großen Maßstab und die Verdrängung der Nahrungspflanzen durch eingeschleppte Pflanzen.[51]
Das Bakterium Micrococcus flaccidifex danai tötet die Raupen vor der Verpuppung. Micrococcus flaccidifex ist als biologische Schädlingsbekämpfung patentiert.[52][53]
Das Protozoon Ophryocystis elektroscirrha parasitiert die Falter in ihrem gesamten Verbreitungsgebiet. Der Parasit schwächt die Falter, die infizierten Tiere fliegen langsamer und können nicht so weite Flüge zurücklegen. Dadurch wird die Ausbreitung des Parasiten bei besonders weit wandernden Populationen stark gehemmt, da nur nicht bis schwach infizierte Tiere die weiten Strecken bis zu den Winterquartieren zurücklegen können. Der Parasitierungsgrad der östlichen Population ist im Westen (östlich der Rocky Mountains bis zu den Appalachen) geringer als bei Faltern im Osten des Verbreitungsgebiets, nahe der Atlantikküste. Die nach Florida ziehenden Falter oder die ortstreuen Falter in Florida haben einen geringeren Selektionsdruck, dagegen begünstigt die weite Wanderung nach Mexiko resistente Tiere. Unterschiede bei Flügelgröße und -form haben dagegen auf die Geschwindigkeit und Gesamtdistanzen keinen nennenswerten Einfluss.[54] Die Sporen von Ophryocystis elektroscirrhas werden von den Raupen gefressen, sodass sich die Art in ihrem Körper erst ungeschlechtlich und später geschlechtlich vermehren kann. In den letzten Tagen des Puppenstadiums werden neue Sporen gebildet, die sich beim Schlupf auf den Schuppen der Flügel wiederfinden. Die Sporen lagern sich auf den Nahrungspflanzen ab oder werden bei der Eiablage durch die Falter auf die Oberfläche der Eier gebracht. Die Eiraupen fressen die Sporen auf der Eihülle oder die Raupen nehmen die Sporen über die Nahrungspflanze auf und der Kreislauf beginnt von neuem. Bei der Paarung können die Sporen vom Männchen auf das Weibchen übertragen werden und dieses kann wiederum die Eier infizieren. Die Übertragung von Falter zu Falter ist ebenfalls möglich, wenn sich die Tiere nahe beieinander befinden, was häufig bei der Überwinterung in den großen Kolonien auftritt. Wie die Infektionsrate der Nachkommen dadurch beeinflusst wird, ist noch nicht erforscht. Bei sehr starker Infektion bekommt die Puppe graue Flecken und der Schlupf der Falter wird so stark erschwert, dass sie manchmal die Puppenhülle nicht ganz verlassen können.[55]
Es sind über 20 verschiedene Parasitoide des Monarchfalters bekannt. In Nordamerika werden durchschnittlich 13 Prozent der Raupen parasitiert, fast ausschließlich von Fliegen der Art Lespesia archippivora. Die Rate schwankt stark von Jahr zu Jahr und von Region zu Region, so dass in einzelnen Fällen bis zu 90 Prozent parasitiert sind. Die Raupen werden in allen Stadien parasitiert, wobei Raupen im späten zweiten bis zum vierten Stadium bevorzugt werden. In den fortgeschrittenen Stadien kommt es vereinzelt zu Superparasitierung, das bedeutet, dass mehr als ein Fliegenweibchen seine Eier in eine Raupe legt. Im letzten Stadium geht die Rate zurück, da diese Raupen in der Lage sind, die Fliegen abzuschütteln. Aus den parasitierten Raupen entwickeln sich bis zu zehn Fliegen, wobei sich bei etwa 35 Prozent nur eine, und bei jeweils etwa 15 Prozent zwei bis drei Fliegen entwickeln.
Lespesia archippivora ist nicht auf den Monarchfalter spezialisiert und parasitiert mindestens 25 Schmetterlingsarten aus 14 Familien und einen Hautflügler. Die Dosis der durch die Nahrungspflanze aufgenommenen Cardenolide hat keinen Einfluss auf den Parasitierungsgrad. Lespesia archippivora wird von einer Erzwespen-Art aus der Familie der Perilampidae parasitiert. Deren Weibchen heften ihre Eier an Blätter. Nachdem die Larven geschlüpft sind, dringen sie in den Körper des Hauptwirts ein und suchen die Larve des Hauptparasiten. Sie entwickeln sich erst weiter, wenn sich dieser verpuppt.[56]
Weitere bekannte Parasitoide des Monarchfaltes sind:
Zu den Prädatoren der Eier und Raupen gehören Käfer, wie etwa Marienkäfer, die die Eier fressen, die räuberische Wanzenart Cermatulus nasalis, die die Raupen aussaugt und Florfliegen (Chrysopidae), die die jungen Raupen fressen.[47]
Ameisen schleppen die Eier in ihren Bau und töten die Raupen.[52] Die in den südlichen USA eingeschleppte Rote Feuerameise (Solenopsis invicta) stellt eine große Bedrohung für die Eier und Raupen dar und trägt zu einer recht geringen Populationsdichte und lückenhaften Verbreitung in den südlichen Staaten bei. Die Feuerameise verdrängt jedoch auch einheimische Ameisenarten, durch die es ebenfalls zu großen Verlusten bei den Eiern und den Raupen kommt, sodass sich die Verluste der Falter wahrscheinlich in der Waage halten.[57]
In Neuseeland verhindern Ameisen der Art Technornyrmex albipes die Ansiedlung von Monarchfalterraupen auf den Nahrungspflanzen. Ebenfalls in Neuseeland sind Cermatulus nasalis und Oechalia schellenbergii aus der Familie der Baumwanzen (Pentatomidae), Polistes chinensis und Polistes humilis humilis aus der Familie Faltenwespen (Vespidae) in der Unterfamilie der Feldwespen (Polistinae) und die Fangschrecke Miomantis caffra als Prädatoren nachgewiesen.[58] Ein weiterer bedeutender Feind des Monarchfalters ist die ursprünglich in Ostasien heimische und in den nordöstlichen Teilen der Vereinigten Staaten eingeführte sowie ebenfalls zu den Fangschrecken zählende Große Chinesen-Mantis (Tenodera sinensis), die sich sowohl von dem Glykosiden der ausgewachsenen Falter nicht abschrecken lässt und die von den Raupen aufgenommenen Giftstoffe umgeht, indem sie die Magenregion der Raupe aufbeißt und die Verdauungsorgane aus der Raupe während des Fressvorgangs rausfallen lässt.
Durch die Herzglykoside, die die Mehrzahl der Monarchfalter für Wirbeltiere ungenießbar macht, ist der Jagddruck durch Echsen, Frösche, Mäuse und Vögel relativ gering. Einige Vögel haben sich dennoch angepasst und können giftige Raupen und Falter fressen. Der Cayenne-Tyrann (Myiarchus tyrannulus), der zur Familie der Tyrannen zählt, frisst überwinternde Falter in Mexiko. Er reißt die Flügel ab, bevor er die Falter frisst.[59] Icterus galbula abeillei aus der Gattung der Trupiale und der Schwarzkopf-Kernknacker (Pheucticus melanocephalus) aus der Gattung der Kernknacker (Familie der Kardinäle) fressen eine bedeutende Menge Falter am Tag, so dass ihnen bei einer durchschnittlichen Überwinterungsdauer von 135 Tagen, etwa neun Prozent der Population zum Opfer fallen. Daneben fressen noch der Diademhäher (Cyanocitta stelleri) und der Scott-Trupial (Icterus parisorum) eine geringere Anzahl Falter. Ungeklärt ist, ob die Vögel männliche Tiere ihres geringen Giftgehalts oder größeren Fettgehalts wegen bevorzugt fressen.[60][61]
Auf Neuseeland sind etwa der Bronzekuckuck (Chrysococcyx lucidus lucidus), der Falter frisst, und der Glanzfleckdrongo (Dicrurus hottentottus), der Raupen frisst, als Feinde nachgewiesen.[52]
Auf der Hawaii-Insel Oʻahu fressen der Rotohrbülbül (Pycnonotus jacosus) und Rotsteißbülbül (Pycnonotus cafer) verstärkt die nur schwach giftigen, normal gefärbten Falter, was die weiße Form nivosus begünstigt und deren starkes Auftreten dort erklärt.
Mäuse sind in den mexikanischen Überwinterungsquartieren neben den Vögeln weitere bedeutende Jäger der Falter, denen etwa fünf Prozent zum Opfer fallen. Die Hirschmaus (Peromyscus maniculatus), Peromyscus spicilegus und die Mexikanische Wühlmaus (Microtus mexicanus) nehmen die Gifte durch ihren Magen und Darm nur schwach auf und können dadurch jede Nacht zusammen tausende Monarchfalter fressen.[62]
Die Raupen können über ihre Nahrungspflanzen Herzglykoside, etwa Calactin, Calotropin und Eriocarpa, aufnehmen, die sie und die späteren Puppen und Falter für Wirbeltiere ungenießbar machen. Die auffällige Färbung von Raupen und Faltern darf also als Warntracht, als Aposematismus gedeutet werden. Vögel, die mit Herzglykosiden angereicherte Falter verzehren, erbrechen sich. Dieses Verhalten wurde beim Star (Sturnus vulgaris) und Blauhäher (Cyanocitta cristata bromia) beobachtet, der für etwa eine halbe Stunde ernsthaft krank wurde. Besonders viele Herzglykoside werden etwa über Asclepias curassavica (Calactin und Calotropin) und A. humistrata aufgenommen. Dagegen enthält Gonolobus rostratus keine Glykoside und die Falter sind für die Vögel genießbar, ebenso wie Falter deren Raupen an A. syriaca, A. tuberosa und A. incarnata fraßen, obwohl diese Pflanzen Glykoside enthalten. Die Raupen reichern einige der Glykoside, etwa Calactin, Calotropin und Eriocarpa, in ihrem Körper an und die Konzentration übersteigt die der Pflanzen deutlich. Dagegen werden die bedeutenden Glykoside Labriformadin und Labriformin von A. eriocarpa und Uscharidin von A. curassavica nicht angereichert, wobei Letzteres in Calactin und Calotropin umgewandelt wird.
Insgesamt reichern weibliche Falter mehr Glykoside an als männliche und die Konzentration nimmt von Süden nach Norden innerhalb der östlichen Sommerpopulation zu. Die Falter der westlichen Population weisen einen höheren Anteil genießbarer Falter auf als die der östlichen, sie erreichen aber höhere Spitzenwerte an Glykosiden.[63]
1857 beschrieb der britische Naturforscher William Stewart Mitchell d’Urban, der zeitweise in Kanada lebte, zum ersten Mal wandernde Monarchfalter im Mississippital „such vast numbers as to darken the air by the clouds of them“ (in so großer Anzahl, dass sich die Luft durch ihre Wolken zu verdunkeln schien). Zehn Jahre später wurden zum ersten Mal große Ansammlungen auf Bäumen ruhender Monarchfalter beschrieben. Das Schauspiel in der Prärie des südwestlichen Iowa wurde von Allen mit den folgenden Worten beschrieben: „in such vast numbers, on the lee sides of trees, and particularly on the lower branches, as almost to hide the foliage, and give to the trees their own peculiar color“ (in so gewaltigen Mengen auf der Leeseite der Bäume, besonders auf den unteren Ästen, als ob sie das Laub verbergen und den Bäumen ihre eigene auffällige Farbe geben wollten). Dieses Verhalten wurde schon damals als Schutz vor dem Präriewind interpretiert und auch als Teil einer Südwanderung im Herbst.
Die US-amerikanischen Entomologen Benjamin Dann Walsh und Charles Valentine Riley veröffentlichten 1868 die ersten Beweise für die massiven Wanderungen der Monarchfalter. Riley beschrieb drei Jahre später die Biologie und Lebensweise des Monarchfalters und dessen Mimikry mit Limenitis archippus und begründete damit die Forschung über den Monarchfalter.
1881 wurden die Überwinterungsplätze der westlichen Population in Kalifornien entdeckt, die der Östlichen blieben noch fast 100 Jahre unentdeckt. Anfangs wurde vermutet, dass sie an der Golfküste überwintern, aber schon bald regten sich Zweifel. Heute steht fest, dass sie dort, aufgrund ihrer Frostempfindlichkeit bei den immer wieder auftretenden harten Frosten, nicht überleben können. Dies hatte der Amateur-Entomologe und Sekretär der Entomological Society of Ontario John Alston Moffat schon um die vorherige Jahrhundertwende richtig gefolgert.
Edward Bagnall Poulton, 1903–1904 Präsident der Royal Entomological Society of London, vermutete 1909, dass die Raupen des Monarchfalters sich von giftigen Seidenpflanzen ernähren, um sich damit vor Jägern zu schützen. Dies wurde erst 1965 von Parsons bestätigt, als er herausfand, dass die Cardenolide die Raupen und Falter giftig und bitter schmeckend machen.
Das Buch The Migration of Butterflies (1930) des britischen Entomologen Carrington Bonsor Williams spornte den Kanadier Frederick Urquhart an und 1937 markierte dieser die ersten Falter um mehr über ihre Wanderungen zu erfahren. Damals wurde vermutet, dass auch die Falter östlich der Rocky Mountains in Kalifornien überwintern, was er aber bezweifelte, da ihm deren Anzahl in Kalifornien zu gering erschien. Der Erfolg blieb zuerst aus. Er forschte weiter an verschiedenen Markierungsmethoden, bis er schließlich durch den Hinweis eines Freundes eine einfache und wetterbeständige Methode gefunden hatte. Die als Alar tag, vom lateinischen Alar für Flügel, bezeichneten, etwa 6 mal 12 Millimeter großen Aufkleber, waren ein Durchbruch für die Markierung von Schmetterlingen. Sie trugen die Aufschrift „Send to Zoology University of Toronto Canada“.
Seine Frau, mit der er zusammen ein Leben lang die Monarchfalter erforschte, schrieb 1952 einen Artikel über markierte Monarchfalter für ein Magazin. Dieser Beitrag enthielt einen Aufruf an Freiwillige, sie bei der Arbeit zu unterstützen. 12 Menschen antworteten und gründeten die International Migration Association. Die Urquharts lieferten die Materialien für die Kennzeichnung und schulten die Freiwilligen, 20 Jahre später zählte die Vereinigung schon über 600 Mitglieder mit tausenden Helfern. Diese markierten hunderttausende Falter und damit gelang es den Urquharts neue Erkenntnisse über diese zu erlangen. Es stellte sich heraus, dass die Falter an einem Tag bis zu 130 Kilometer weit flogen, aber nur bei Tageslicht, und dass sie Wind und offene Gewässer mieden. Die Flugrichtung der Falter ging vom Nordosten nach Südwesten und die Urquharts reisten nach Kalifornien und zum Golf von Mexiko, ohne jedoch die Überwinterungsquartiere zu finden.
1972 schrieb Nora mexikanische Zeitungen an und rief zur Mitarbeit bei der Suche nach den Faltern auf. Der amerikanische Ingenieur Ken Brugger aus Mexiko-Stadt fuhr daraufhin die nächsten Jahre in Mexiko auf der Suche nach Faltern umher. 1974 heiratete er Cathy und die beiden Schmetterlingsliebhaber suchten weiter. Sie fanden immer wieder tote Tiere und kamen den Überwinterungsquartieren immer näher. 1975 zeigten sie Holzfällern tote Tiere und diese zeigten ihnen schließlich den Weg zu den Quartieren der Monarchfalter am Cerro Pelón, 120 Kilometer westlich von Mexiko-Stadt. Danach riefen sie die Urquharts an und teilten ihnen mit, dass sie Millionen Falter gefunden hatten. Im folgenden Jahr reisten die Urquharts selbst nach Mexiko und besichtigten den Fundort. Der Boden war bedeckt mit Faltern und die Bäume hingen voll von ihnen. Ein Ast brach unter ihrem Gewicht ab, darunter befand sich ein Falter, der in Minnesota markiert wurde. Im selben Jahr veröffentlichte Frederick Urquhart einen Artikel im National Geographic und beschrieb die phänomenale Ansammlung überwinternder Monarchfalter.
Urquhart bezweifelte, dass die Falter den Flug über den Atlantik von Amerika nach Europa überleben könnten, da sie nur am Tag fliegen, nicht auf dem Wasser ruhen können, wie er nachwies, und die Strecke nicht an einem Tag bewältigt werden könnte. Er vermutete, dass die Falter, die immer wieder an Europas Küsten auftreten, als Raupen oder Puppen auf Schiffe kamen und in die Nähe der Küsten das Schiff verließen.[64] Es hat sich aber die Ansicht durchgesetzt, dass die Falter bei starken Stürmen tatsächlich über den Atlantik verdriftet werden können, da oft auch nordamerikanische Zugvögel zusammen mit den Faltern nach starken Stürmen an den europäischen Küsten gesichtet wurden.
Falter zu markieren ist sehr aufwendig und nur etwa ein Promille wird später gemeldet und ist über 100 Kilometer weit geflogen. Der US-amerikanische Zoologe Lincoln Pierson Brower untersuchte deshalb Anfang der 1980er Jahre Menge und Muster der Herzglykoside in den Faltern, die sie als Raupen aufgenommen hatten. Damit konnte er die Brutgebiete der Falter eingrenzen, da unterschiedliche Seidenpflanzengewächse durch verschiedene Glykoside in bestimmten Verhältnissen einen „Fingerabdruck“ haben und die Verbreitungsgebiete der einzelnen Arten unterschiedlich sind.[24]
Andere Forscher untersuchten den Orientierungssinn der Falter anhand des ihnen eigenen Sonnenkompasses und ihres Magnetsinns.[65]
Zahlreiche Initiativen zeichnen Daten über wandernde Monarchfalter auf, um noch mehr über ihre Lebensweise zu erfahren. Teilweise markieren sie Falter, wie etwa Monarch Watch (University of Kansas) und das Monarch Monitoring Project in New Jersey. Journey North beobachtet wandernde Tiere in Nordamerika, darunter auch den Monarchfalter.
Nach der Erstbeschreibung 1758 als Papilio plexippus durch Linné anhand eines Falter aus Kendall, New York, USA, hat der Monarchfalter viele verschiedene taxonomische Einordnungen und Umgruppierungen erfahren. Dies führte zu einer Reihe von Gattungsnamen und Art … .Seitz ordnete ihn 1908 der Gattung Danais zu. Zwei Jahre später wurde er von Fruhstorfer Danaida (Anosia) archippux (Fabricius) genannt, während der Name plexippus lange für die heute als Danaus genutia benannte Art verwendet wurde. Zu dieser Zeit ist der Monarchfalter oft als archippus in der Literatur zu finden. 1939 ordnete Forbes den Falter der Gattung Danaus als D. (Danaus) erippus menippe (Hübner) und D. (Danaus) erippus megalippe (Hübner) zu, während im selben Jahr d’Almeida ihn als Diogas curassavicae (Fabricius) einordnete. Talbot verkürzte zwei Jahre später Talbots den Namen auf Danaus menippe (Hübner). Seit 1971 wird der noch heute gültige Name Danaus plexippus (L.) verwendet.[13]
Das Artepitheton leitet sich von Plexippos dem Sohn des Phineus und der Kleopatra ab und der Gattungsname kommt von Danaos (lateinisch Danaus), König von Argos im Peloponnes, der Vater der 50 Danaiden. Beide sind Teil der griechischen Mythologie.
Neben der wandernden Nominatform Danaus plexippus plexippus sind die folgenden Unterarten beschrieben:
Auf den Antillen kommen drei Unterarten vor:
Der Status der Unterarten ist nicht geklärt, teilweise leben sie in den gleichen Gebieten. Von keiner der Unterarten ist ein Wanderverhalten oder die Bildung von Kolonien bekannt.
Die Raupen sind primär an Seidenpflanzengewächse und davon besonders an die Gattung Seidenpflanzen als Nahrungsquelle gebunden. Wenn diese bekämpft werden, hat dies negative Auswirkungen auf die Populationsstärke. In den USA und Kanada werden die Seidenpflanzen teilweise als Unkraut betrachtet und mit Herbiziden, etwa am Straßenrand und auf landwirtschaftlichen Flächen, bekämpft. Für den Erhalt der natürlichen Vorkommen der Seidenpflanzen in Kanada und den USA setzte sich Fred Urquhart zusammen mit seiner Frau über viele Jahre ein, in einigen kanadischen Provinzen und den USA wurden und werden die Seidenpflanzen von Behörden noch immer als gesundheitsschädlich eingestuft. Trotzdem werden in vielen Blumengärten die Pflanzen wegen ihres Aussehens und Dufts angepflanzt.
In Mexiko und der Karibik gibt es teilweise den Aberglauben, dass Kühe durch Seidenpflanzen vergiftet werden. In Trinidad und Tobago werden die Seidenpflanzen deshalb als beklopptes Kraut bezeichnet. Tatsächlich ignorieren die Kühe die Pflanzen auf den Weiden und nehmen keinen Schaden. Trotzdem werden sie stellenweise bekämpft.[66]
Die Weltnaturschutzunion (IUCN) hat den Monarchfalter in ihr Wirbellosen-Rotbuch aufgenommen. Allerdings nicht als gefährdete Tierart, sondern als bedrohtes Naturphänomen – eine eigens hierfür geschaffene Kategorie.[67] Auch wenn noch viele Millionen Monarchfalter im östlichen Nordamerika leben, dienen die Schutzmaßnahmen dem Ziel, einen weiteren Verlust einer wandernden Tierart in Nordamerika zu verhindern, nachdem die Wandertaube (Ectopistes migratorius) und die Felsengebirgsschrecke (Melanoplus spretus) seit über 100 Jahren ausgestorben sind.[50]
Der Monarchfalter steht in Kanada unter dem Schutz des Federal Species at Risk Act (SARA) und The Committee on the Status of Endangered Wildlife in Canada (COSEWIC), jeweils in der Kategorie Special Concern. Long Point und Prince Edward Point im Prince Edward County (Ontario) und der Point-Pelee-Nationalpark in Essex County, Ontario, sind als Schutzgebiete des Monarchfalters ausgezeichnet, Letzteres ist außerdem seit 1995 durch den Canada National Parks Act geschützt.[68]
Einige Überwinterungsplätze in Kalifornien sind durch den Landverbrauch gefährdet, andere im Staat, den Countys und öffentlichen Parks sind geschützt. In Pacific Grove etwa schon seit 1938. Der Parasit Ophryocystis elektroscirrhas wurde erst bei Versuchen mit Faltern aus dem Osten in die westliche Population eingeschleppt und stellt eine relativ neue Bedrohung dar.
Die Gefahr, die von Transgenem Mais ausgeht, ist entgegen ersten Befürchtungen sehr gering. Ab 1000 Pollen/cm² setzt eine toxische Wirkung bei den Raupen ein. Die Pollenkonzentration auf den Seidenpflanzen liegt selbst zur Hauptblütezeit des Getreides in unmittelbarer Nähe der Felder nur zwischen 50 und 170 Pollen/cm².[69]
Eine große Gefahr stellt eine Umstellung der Landwirtschaft von Getreide zu Soja, die die Bedingungen für die Seidenpflanzen verschlechtert. Der Einsatz von Herbiziden vernichtet im Frühjahr die jungen Seidenpflanzen in den Hauptbrutgebieten am Rand der Felder. Zusätzlich werden Nektarquellen für die Falter vernichtet.[50]
Die Organisationen, die Daten über Monarchfalter sammeln, setzen sich auch für seinen Schutz ein. Die Xerces Society, die keine Daten über die Wanderungen sammelt, setzt sich besonders für den Schutz der westlichen Population ein.
2016 gab der WWF bekannt, dass sich die Population des amerikanischen Monarchfalters „spürbar erholt“ habe. Im Winterquartier in Zentralmexiko seien fast vier Mal so viele Schmetterlinge wie im Jahr zuvor angekommen. Allerdings zeige der Trend für den Monarchfalter global trotzdem nach unten.[70]
Besonders gefährdet ist der Falter durch die Konzentration der östlichen nordamerikanischen Population während der Wintermonate auf wenige Hektar in Mexiko.[71] Diese Überwinterungsgebiete sind durch illegalen Holzeinschlag stark bedroht. In Mexiko wurden 1980 alle Überwinterungsstellen per präsidialem Erlass geschützt, ohne jedoch die Gebiete zu definieren. 1986 wurde ein über 16.000 Hektar großes Schutzgebiet ausgewiesen. Ende 2000 wurde das Monarch Butterfly Biosphere Reserve (MBBR) auf über 56.000 Hektar vergrößert, wovon über 13.000 Hektar auf den Kernbereich entfallen. Das Land im Schutzgebiet gehört 59 Ejidos, 13 indigenen Gemeinden und 21 Privatbesitzern. Die von der Vergrößerung betroffenen Gemeinden werden durch den im selben Jahr gegründeten Monarch Butterfly Conservation Fund (MBCF) wirtschaftlich unterstützt, für entfallene Holzeinschlagrechte werden Entschädigungen gezahlt. Der Fund wird von privaten Spenden aus den USA, durch die mexikanische Bundesregierung und die Regierungen der Bundesstaaten México und Michoacán finanziert. Der World Wildlife Fund und der Mexican Fund for Nature Conservancy verwalten den MBCF zusammen. Die größte Gefahr für das MBBR ist die illegale Abholzung, allein zwischen 2001 und 2003 wurden 370 Hektar in der Pufferzone (Francisco Serrato y Emiliano Zapata ejido) und 140 Hektar im Kernbereich gefällt. Von staatlicher Seite erfahren die vom illegalen Holzeinschlag betroffenen Gemeinden fast keine Unterstützung. Sie versuchen in Eigeninitiative Gräben auszuheben, um den Abtransport von Holz zu verhindern, wobei nur mit schwerem Gerät angelegte große Gräben mit mehreren Metern Breite und Tiefe eine etwas längerfristige Wirkung zeigen. Kleine Gräben, die mit Hacke und Schaufel angelegt werden, sind bald wieder zugeschüttet.
Das Schutzgebiet umfasst den Cerro Altamirano (3320 Meter über N.N.), den Cerro Pelón (3500 m), die Sierra Chincua und die Sierra el Campanario (3640 m) und den Cerros Chivatí-Huacal (3180 m) in der Sierra Chivati in Michoacán. Außerhalb des Schutzgebiets befinden sich Palomas, Piedra Herrada und San Francisco Oxtotilpan im Bundesstaat México und San Andres, Pizcuaro, Puerto Morillo und Puerto Bermeo in Michoacán. In Chivatí-Huacal überwintern seit den starken Abholzungen Ende der 1980er Jahre keine Monarchfalter mehr, am Cerro Pelón wurden alle Hänge bis auf einige Südhänge innerhalb von zehn Jahren so stark abgeholzt, dass nur noch wenige Falter überwintern.[41][72]
Anfang 2020 wurden innert weniger Tage zwei Umweltschützer ermordet, welche sich für die Monarchen-Schutzgebiete engagiert hatten.[73]
Eine weitere Gefahr für die Falter ergibt sich durch den zunehmenden Straßenverkehr. Untersuchungen an den mexikanischen Autobahnen Mex-057 und Mex-40D, über die die Wanderroute der Falter führt, ergaben eine große Anzahl an toten Exemplaren am Straßenrand. Nach Hochrechnungen im Herbst 2018 sind dort 196.500 Falter dem Verkehr zum Opfer gefallen. Da die wandernden Falter etliche weitere Straßen passieren und bei schlechter Wetterlage sehr niedrig fliegen, dürfte die Todesrate dann weiter ansteigen.[74]
Die Ankunft der Monarchfalter in Michoacán fällt mit dem Día de Muertos (Tag der Toten) zusammen, an dem traditionell in Mexiko der Verstorbenen gedacht wird. Schon vor der Ankunft der Europäer in Amerika symbolisierten die in Massen auftretenden Falter für die Ureinwohner die Rückkehr der Seelen ihrer Vorfahren.[75]
Der Monarchfalter wurde im 17. Jahrhundert nach Wilhelm III. (1650–1702), König von England, Schottland und Irland benannt. Dieser war gebürtiger Prinz des Fürstentum Orange in Frankreich. Die frühen Siedler nannten den Falter King Billy. Er hatte im Laufe der Zeit noch viele andere Namen, etwa Milkweed Butterfly, Storm King und The Wanderer, Letzterer ist in Australien heute noch gebräuchlich.
Der Monarch ist Staatsinsekt in Alabama, Idaho, Illinois, und Texas, und der Staatsschmetterling von Minnesota, Vermont und West Virginia. 1989 war er für das nationale Insekt der Vereinigten Staaten von Amerika nominiert und er ist das nationale Insekt von Kanada.
An den Überwinterungsplätzen in Kalifornien und deutlich später in Mexiko hat sich der Tourismus entwickelt. In Kalifornien gibt es Motels mit Namen wie etwa Butterfly Trees Lodge und Monarch Lodge. Souvenirs mit Schmetterlingen, etwa Broschen und Anstecknadeln, ebenso wie präparierte Falter, werden angeboten. In Pacific Grove gibt es zur Ankunft der Falter im Herbst ein Fest mit einem Umzug mit Kindern in bunten Kostümen, die Schmetterlinge symbolisieren sollen. Der touristisch erschlossene Überwinterungsplatz Rosario in der Sierra Campanario leidet unter dem illegalen Holzeinschlag in seiner Umgebung. Das Gebiet war 2001/202 nur schwach besucht und 2003/2004 und 2004/2005 ganz verlassen.[50]
Neben zahlreichen Initiativen zur Beobachtung und zum Schutz der Falter gibt es etwa das Monarch Lab der University of Minnesota, das Schüler und Lehrer mit ihrer Initiative Monarchs in the Classroom (Monarchfalter im Klassenzimmer) anspricht. Es versucht Wissen über die Ökologie, die Lebensweise und die Entwicklung der Monarchfalter zu vermitteln und Schüler für das Thema zu begeistern.
Francisco „Vico“ Gutiérrez begleitete im Jahr 2005 72 Tage lang Monarchfalter auf ihrem Zug von Kanada nach Mexiko mit seinem Ultraleichtflugzeug Papalotzin (von Nahuatl (Aztekisch) Papalotl für Schmetterling und tzin für königlich). Auf seinem 4375 Meilen langen Flug wurde er von Fotografen und Filmemachern begleitet. Sie filmten die gesamte vom World Wildlife Fund, Telcel und dem Bundesstaat Michoacán finanzierte Reise und planten daraus eine einstündige Dokumentation zu machen. Auf der Reise machten sie immer wieder Halt und sprachen mit bekannten Lepidopterologen und Biologen über die Gefahren für die Monarchfalter.[76] Der Film ist 2007 unter dem Titel Papalotzin – The Journey of The Monarch Butterfly auf DVD in englischer und spanischer Sprache erschienen.[77][78]
Über den Monarchfalter wurden viele populärwissenschaftliche Bücher veröffentlicht und er ist auch das Thema zahlreicher Kinderbücher, wie etwa das zweisprachige Buch (englisch und spanisch) Madalynn the Monarch Butterfly and Her Quest to Michoacan / Madalynn La Mariposa Monarca y Su Aventura Por Michoacan oder Hurry and the Monarch, ein Kinderbuch mit einer Schildkröte, die sich in Texas mit einem Monarchfalter anfreundet und mehr über dessen Leben erfährt.
Der Film Son of Monarchs (2020) schildert einen mit dem Monarch befassten Entomologen.
Der Monarchfalter (Danaus plexippus) oder Amerikanische Monarch ist ein auffällig orange und schwarz gezeichneter Schmetterling (Tagfalter) aus der Familie der Edelfalter (Nymphalidae). Er ist in Amerika weit verbreitet und hat sich im 18. Jahrhundert über den Südpazifik bis nach Australien ausgebreitet. Der Monarchfalter ist der am besten erforschte Schmetterling Nordamerikas und ein berühmter Wanderfalter. Einzelne Tiere legen bei Wanderungen im Herbst in Nordamerika bis zu 3600 Kilometer zurück. Die östliche Population in Nordamerika überwintert mit mehreren 100 Millionen Tieren auf wenigen Hektar in der mexikanischen Sierra Nevada.
In den Jahren ab etwa 2010 brachen die überwinternden Bestände drastisch ein, die in Anspruch genommene Fläche betrug ebenfalls nur noch einen Bruchteil; 2013/14 verzögerte sich die Ankunft der Falter in Mexiko zudem um drei Wochen.
Eine deutlich kleinere westliche Population überwintert entlang der Pazifikküste in Kalifornien.
Ang paruparong monarch (Danaus plexippus) ay isang kilalang paruparo sa Hilagang Amerika. Madaling makilala ito sa pakpak na kahel at itim. Itong kulay sa pakpak ay isang babala na malason ito.
Ang paruparong monarch ay dumadaan mula sa taas ng Estados Unidos papuntang timog s Mexico.
Ang viceroy ay madaling pagkamalan na isang monarch kaya lang ang pagkakaiba nila na ang viceroy ay may maskaunting puting batik sa pakpak at wala itong lason.
Ang paruparong monarch (Danaus plexippus) ay isang kilalang paruparo sa Hilagang Amerika. Madaling makilala ito sa pakpak na kahel at itim. Itong kulay sa pakpak ay isang babala na malason ito.
♂
♀
De Monarchflinter (Danaus plexippus) is in soarte yn it skaai fan de Danaus.
De monarchflinter hat mar in pear populaasjes yn it suden fan Jeropa. Hy is ferneamd wurden om syn trekneigingen en kin as seldsume gast yn de kuststreken fan noardwest-Jeropa sjoen wurde. De populaasjes lizze op waarme oant tige waarme drûge plakken lykas eroazjslinken. De flinter komt ek wol foar yn tunen en parken. De populaasjes binne lyts en lizze temidden fan lânbougebieten. Se wurde mei útstjerren bedrige troch it gebrûk fan herbisiden en insektisiden, brânen en it stoarten fan ôffal.
De flinter fleant fan begjin april oant ein septimber. Se fleane yn ferskillende generaasjes.
Yn Spanje wurde aaikes ôfsetten op de Ascepias curassavica, op de Kanaryske Eilannen ek op de Gomphocarpus fruticosus. De flinters plantsje harren yn meardere generaasje fuort.
De Monarchflinter (Danaus plexippus) is in soarte yn it skaai fan de Danaus.
மொனார்க் (Monarch butterfly, Danaus plexippus) கண்கவர் செம்மஞ்சள் மற்றும் கறுப்பு நிறம் கலந்த வண்ணத்துப் பூச்சியாகும். இவை ஒவ்வொரு மாரி காலத்திலும் கனடாவிலிருந்து மெக்சிக்கோ மற்றும் கலிபோர்னியா வரை 4000 மைல் தூரம் வரை பறந்து செல்கின்றன. ஒரு திசையில் மட்டும் பறக்கக்கூடிய இவையால் மீண்டும் கனடா திரும்ப வாய்ப்பு கிடைப்பதில்லை. இவற்றின் குஞ்சுகள் மீண்டும் கனடாவுக்குள் பிரவேசிக்கின்றன. இதன் பிறப்பிடம் முக்கியமாக வட அமெரிக்கா என்றாலும் இது மெக்ஸிகோ, கியூபா, ஆஸ்திரேலியா, நியூஸிலாந்து, பசிபிக் தீவுகள், கலிபோர்னியா, ஃப்ளோரிடா போன்ற நாடுகளிலும் காணப் படுகிறது. இதன் செம்மஞ்சள் வண்ணம் அதனை உண்ணும் எதிரிகளுக்கு ஒரு எச்சரிக்கை என்னை உண்ணாதே என்பதுதான். இவைகள் ஒரு நாளைக்கு 250 கி.மீ தொலைவு பறக்கக் கூடியவை. இவைகளின் எதிரிகள் இவைகளைத் துரத்தும் போது ஒரு நிமிடத்திற்கு 120 தடவை சிறகுகளை அடிக்கக் கூடியவை. இதன் மற்ற பொதுப் பெயர்கள் மில்க் வீட், (எருக்கஞ் செடியில் இருப்பதால்), காமன் டைகர் ( புலி போன்ற வடிவம் கொண்டுள்ளதால்), வாண்ட்ரர் (வலசைப் போவதால்) ஆகும். இந்த வண்ணத்துப் பூச்சியின் வலசைப் போதல் நிகழ்வு இதனை மற்ற பூச்சிகளிடமிருந்து வேறு படுத்திக் காட்டுகிறது. .[1]
இவ்வண்ணத்துப் பூச்சிகளின் வலசைப் போதல் என்பது இவ்வுலகின் மிகவும் இயற்கையான கண்கவர் நிகழ்வு என்று ஆர்வலர்கள் விவரிக்கின்றனர். வட அமெரிக்காவின் அதிகப் படியான குளிரைத் தாங்க முடியாத இவைகள் தங்கள் பயணத்தை தெற்கு பாகத்தில் உள்ள மெக்ஸிகோ மற்றும் ஃப்ளோரிடா நோக்கித் துவங்குகின்றன. ஆனால் திரும்பி வருவது நான்காவது சந்ததிதான். இவைகளின் இப்பயணத்தில் இவைகள் 3000 கி.மீ பயணிக்கின்றன. இவைகள் திரும்பி வரும்போது அவற்றின் பெற்றோர் எந்த மரத்தில் தங்கி இளைப்பாறியதோ அதே மரத்தில் பின் சந்ததி தங்குவது ஒரு ஆச்சரியமே.செப்டம்பர் அல்லது அக்டோபரில் இவை தங்கள் பயணத்தைத் துவக்கி நவம்பரில் அங்கு சென்று சேரும். திரும்பி வர தங்கள் பயணத்தை மார்ச்சில் துவக்கி ஜூலையில் முடிக்கும். ஆஸ்திரேலியா அல்லது நியூஸிலாந்தில் உள்ள வண்ணத்துப் பூச்சிகள் சிறு சிறு வலசை மேற்கொள்ளும்
மொனார்க் (Monarch butterfly, Danaus plexippus) கண்கவர் செம்மஞ்சள் மற்றும் கறுப்பு நிறம் கலந்த வண்ணத்துப் பூச்சியாகும். இவை ஒவ்வொரு மாரி காலத்திலும் கனடாவிலிருந்து மெக்சிக்கோ மற்றும் கலிபோர்னியா வரை 4000 மைல் தூரம் வரை பறந்து செல்கின்றன. ஒரு திசையில் மட்டும் பறக்கக்கூடிய இவையால் மீண்டும் கனடா திரும்ப வாய்ப்பு கிடைப்பதில்லை. இவற்றின் குஞ்சுகள் மீண்டும் கனடாவுக்குள் பிரவேசிக்கின்றன. இதன் பிறப்பிடம் முக்கியமாக வட அமெரிக்கா என்றாலும் இது மெக்ஸிகோ, கியூபா, ஆஸ்திரேலியா, நியூஸிலாந்து, பசிபிக் தீவுகள், கலிபோர்னியா, ஃப்ளோரிடா போன்ற நாடுகளிலும் காணப் படுகிறது. இதன் செம்மஞ்சள் வண்ணம் அதனை உண்ணும் எதிரிகளுக்கு ஒரு எச்சரிக்கை என்னை உண்ணாதே என்பதுதான். இவைகள் ஒரு நாளைக்கு 250 கி.மீ தொலைவு பறக்கக் கூடியவை. இவைகளின் எதிரிகள் இவைகளைத் துரத்தும் போது ஒரு நிமிடத்திற்கு 120 தடவை சிறகுகளை அடிக்கக் கூடியவை. இதன் மற்ற பொதுப் பெயர்கள் மில்க் வீட், (எருக்கஞ் செடியில் இருப்பதால்), காமன் டைகர் ( புலி போன்ற வடிவம் கொண்டுள்ளதால்), வாண்ட்ரர் (வலசைப் போவதால்) ஆகும். இந்த வண்ணத்துப் பூச்சியின் வலசைப் போதல் நிகழ்வு இதனை மற்ற பூச்சிகளிடமிருந்து வேறு படுத்திக் காட்டுகிறது. .
మోనార్క్ సీతాకోకచిలుక ఉత్తర అమెరికా సీతాకోకచిలుక దీని రెక్కలు తేలికగా నలుపు, నారింజ, తెలుపు రంగులో కలిగి ఉంటాయి.ఇది చాలా చిన్నదిగా ఉంటుంది.ఈ సీతాకోక చిలుకలు రెక్కలు విప్పితే పది సెంటీమీటర్ల వెడల్పు ఉంటుంది.[1]
మెనార్క సీతాకోకచిలుక జీవిత కాలం ఐదు నెలలు జీవిస్తాయి. భారతదేశం , ఆస్ట్రేలియా , కెనడా , మెక్సికో , అమెరికాల్లో కూడా ఇవి అరుదుగా కనిపిస్తాయి.ఇవి ఎక్కువగా అమెరికాలో ఉన్న మిల్క్వీడ్ చెట్ల ఆకులను ఆహారంగా తీసుకుంటాయి.
సంతానోత్పత్తి అమెరికాలో జరిపి శీతాకాలంలో రక్షణ కోసం దాదాపు 3వేల కిలోమీటర్లు ప్రయాణించి మెక్సికో, కాలిఫోర్నియా ప్రాంతాలకు వలస వెళ్లతాయి.
వేసవి నెలలలో పాలుపట్టిన మొక్కల ఆకు అడుగున గుడ్లు ఒక్కొక్కటిగా పెడతాయి. గుడ్లు లేత ఆకుపచ్చ రంగులో ఉంటాయి. గుడ్లు బరువు 0.5 కలిగి ఉంటాయి. గుడ్లు పెట్టేందుకు తిరిగి ఆడ మోనార్క్ సీతాకోక చిలుకలు ఉత్తర అమెరికా, కెనడాలకు తిరిగి వెళతాయి. ఇలా ఏటా దాదాపు వంద కోట్ల మోనార్క్ సీతాకోక చిలుకలు ప్రయాణిస్తాయని అంచనా.
పక్షల మాదిరిగానే ప్రతి ఏటా శీతాకాలంలో కెనడ నుండి మెక్సికోకు వలస వెళ్ళాతాయి. వేసవికాలం మళ్లీ తిరుగు పయనం అవుతాయి. మెక్సికోలోని పర్వత ప్రాంతాల్లో ఉన్న పైన్ వృక్షాలు, ఒయామిల్ ఫిర్ చెట్లును అంటిపెట్టుకోని ఉంటాయి. ప్రతి ఏటా లక్షల సీతాకోకచిలుకలు ఆశ్రయం పొందుతున్నయి. సుమారు 19,200 నుంచి 44,800 వేల కి.మీ ప్రయణిస్తాయి.
1937 లో కెనడాకు చెందిన జువాలజిస్ట్ ఉర్క్ హర్ట్ సీతాకోకచిలుక ఎక్కడికి వెళ్ళుతున్నయి అని పరిశోధనలు నిర్వహించారు. కొన్ని వేలమంది వాలంటీర్లు సహాయంతో 38 సంవత్సరాల తరువాత అవి ఎక్కడికి వెళ్ళుతున్నయి అని కనుక్కున్నారు. మెక్సికో దేశంలో సీతాకోకచిలుక వలస వెళుతున్న ప్రాంతాన్ని మోనార్క్ బట్టర్ ఫ్లై బయోస్ఫియర్ రిజర్వు గా గుర్తించారు. ఇలాంటి ప్రాంతాలు మెక్సికోలో పది ప్రాంతాలు ఉన్నాయి.
భూతాపం పెరగడం, గాలుల తీవ్రత ఎక్కువగా ఉండటం వాటి వలసకు ఆటంకం ఏర్పడిందని శాస్తవ్రేత్తలు భావిస్తున్నారు. నవంబర్ ఒకటవ తేదీకల్లా మెక్సికో, కాలిఫోర్నియా ప్రాంతాలకు ఇవి వలస వెళ్లాల్సి ఉంది. అయితే కెనడా, అమెరికాల్లోని తమ నివాస ప్రాంతాల నుంచి అవి లక్షల సంఖ్యలో బయలుదేరినప్పటికీ మధ్యదారిలోనే అవి ఆగిపోయాయి. సముద్ర తీరాల్లోని చెట్లపై ఉండిపోయాయి. వాటిలో కొన్ని ఎగరే ప్రయత్నం చేస్తూ గాలుల తీవ్రతతో నీటిలో పడి మరణిస్తున్నాయి. వేల సంఖ్యలో సీతాకోక చిలుకలు దారితప్పిపోవడం జరిగింది.
ಮೊನಾರ್ಕ್ ಚಿಟ್ಟೆಗಳು ( ಡನಾಸ್ ಪ್ಲೆಕ್ಸಿಪ್ಪಸ್) ಹಾಲ್ರಸದ ಸಸ್ಯಗಳ ಮೇಲೆ ಮೊಟ್ಟೆಯಿಡುವ ಒಂದು ಬಗೆಯ ಚಿಟ್ಟೆಗಳಾಗಿವೆ. ಉತ್ತರ ಅಮೆರಿಕಾದ ಚಿಟ್ಟೆಗಳಲ್ಲೆಲ್ಲ ಇವು ಅತ್ಯಂತ ಹೆಚ್ಚು ಪ್ರಸಿದ್ಧವಾಗಿವೆ. ಇವುಗಳು ಆಸ್ಟ್ರೇಲಿಯಾ, ನ್ಯೂ ಜೀಲ್ಯಾಂಡ್ ಹಾಗೂ ಯೂರೋಪ್ ನ ಕೆಲವು ಭಾಗಗಳಲ್ಲಿ ಕಂಡುಬರುತ್ತವೆ. ಇವುಗಳ ರೆಕ್ಕೆಗಳು ಸುಲಭವಾಗಿ ಗುರುತಿಸಲು ಸಾಧ್ಯವಾಗುವ ಕೇಸರಿ ಹಾಗೂ ಕಪ್ಪು ಬಣ್ಣದ ಚಿತ್ತಾರಗಳಿಂದ ಕೂಡಿದ, ೮.೯-೧೦.೨ ಸೆಂ.ಮೀ ಗಳಷ್ಟು ಅಗಲವಾದ ರೆಕ್ಕೆಗಳಿಂದ ಕೂಡಿವೆ(ವೈಸ್ ರಾಯ್ ಚಿಟ್ಟೆಗಳು ಇಷ್ಟೇ ಅಗಲವಾದ ಹಾಗೂ ಇದೇ ಬಣ್ಣದ ರೆಕ್ಕೆಗಳನ್ನು ಹೊಂದಿದ್ದರೂ, ಹಿಂದಿನ ರೆಕ್ಕೆಯ ಮೇಲಿನ ಒಂದು ವಿಶೇಷವಾದ ಚಿತ್ತಾರದಿಂದ ಅವುಗಳನ್ನು ಪ್ರತ್ಯೇಕವಾಗಿ ಗುರುತಿಸಬಹುದಾಗಿದೆ). ಹೆಣ್ಣು ಚಿಟ್ಟೆಗಳ ರೆಕ್ಕೆಗಳ ಮೇಲಿನ ಗೆರೆಗಳು ಕಡುಗಪ್ಪಾಗಿರುವುದರಿಂದಲೂ, ಗಂಡು ಚಿಟ್ಟೆಗಳ ಹಿಂದಿನ ರೆಕ್ಕೆಗಳ ನಡುವಿನಲ್ಲಿರುವ ಆಂಡ್ರೋಕೋನಿಯಂ ಎಂದು ಕರೆಯಲ್ಪಡುವ ಕಪ್ಪು ಚುಕ್ಕೆಗಳಿಂದಲೂ ಗುರುತಿಸಬಹುದಾಗಿದೆ. ಹಾಗೆಯೇ ಗಂಡು ಚಿಟ್ಟೆಗಳು ಗಾತ್ರದಲ್ಲಿ ಹೆಣ್ಣು ಚಿಟ್ಟೆಗಳಿಗಿಂತ ದೊಡ್ಡದಾಗಿರುತ್ತವೆ. ಮೊನಾರ್ಕ್ ಚಿಟ್ಟೆಗಳು ಅವುಗಳ ವಲಸೆಗಾಗಿ ಪ್ರಸಿದ್ಧಿಯನ್ನು ಹೊಂದಿವೆ. ಈ ವಲಸೆಯನ್ನು ಮುಗಿಸುವಷ್ಟರಲ್ಲಿ ಅವುಗಳ ಅನೇಕ ತಲೆಮಾರುಗಳೇ ಕಳೆದು ಹೋಗಿರುತ್ತವೆ.
ಮೊನಾರ್ಕ್ ಗಳ ರೆಕ್ಕೆಗಳು ೮.೯-೧೦.೨ ಸೆಂ.ಮೀ ಗಳಷ್ಟು ಅಗಲವಾಗಿವೆ. ರೆಕ್ಕೆಗಳ ಮೇಲ್ಭಾಗ ಕಂದು ಮಿಶ್ರಿತ ಕೇಸರಿ ಬಣ್ಣದಿಂದ ಕೂಡಿದೆ. ರೆಕ್ಕೆಗಳ ಅಂಚು ಹಾಗೂ ರೆಕ್ಕೆಯಲ್ಲಿರುವ ಗೆರೆಗಳು ಕಡುಗಪ್ಪು ಬಣ್ಣದಿಂದ ಕೂಡಿವೆ. ರೆಕ್ಕೆಗಳ ಅಂಚಿನಲ್ಲಿ ಎರಡು ಸಾಲು ಬಿಳಿ ಚುಕ್ಕಿಗಳಿವೆ. ರೆಕ್ಕೆಗಳ ಕೆಳಬದಿಯೂ ಅಂಚು ಹಳದಿಯಾಗಿದ್ದು ಚುಕ್ಕೆಗಳು ದೊಡ್ಡದಾಗಿರುವುದನ್ನು ಹೊರತುಪಡಿಸಿದರೆ ಸರಿಸುಮಾರು ಮೇಲ್ಬದಿಯಂತೆಯೇ ಇದೆ. ೧೯ನೇ ಶತಮಾನದ ಆದಿಯಲ್ಲಿ ಆಸ್ಟ್ರೇಲಿಯಾ, ನ್ಯೂಜಿಲ್ಯಾಂಡ್, ಇಂಡೋನೇಷಿಯಾ ಮುಂತಾದೆಡೆಗಳಲ್ಲಿ ಇವುಗಳ ವರ್ಣವೈವಿಧ್ಯತೆಯನ್ನೂ ಗುರುತಿಸಲಾಗಿದೆ. ಆದರೆ ಇದು ಅತ್ಯಂತ ಕಡಿಮೆ ಸಂಖ್ಯೆಯದ್ದಾಗಿದೆ. ಉಳಿದೆಲ್ಲಾ ಕೀಟಗಳಂತೆ ಮೊನಾರ್ಕ್ ಗಳು ೬ ಕಾಲುಗಳನ್ನು ಹೊಂದಿದ್ದರೂ, ಕೇವಲ ೪ ಕಾಲುಗಳನ್ನು ಬಳಸುತ್ತವೆ. ಇವುಗಳ ಮೊಟ್ಟೆಗಳು ಕ್ರೀಂ ಬಣ್ಣದಿಂದ ಕೂಡಿದ ಬಿಳಿಯಾಗಿದ್ದು ಕ್ರಮೇಣ ನಸುಹಳದಿಗೆ ತಿರುಗುತ್ತವೆ. ಒಂದು ಮೊಟ್ಟೆಯು ಸರಿಸುಮಾರು ೦.೪೬ ಮಿಲಿ ಗ್ರಾಂ ಗಳಷ್ಟು ತೂಗುತ್ತದೆ. ೧.೨ ಮಿ.ಮೀ ಗಳಷ್ಟು ಉದ್ದವಾಗಿದ್ದು, ೦.೯ ಮಿ.ಮೀ ನಷ್ಟು ಅಗಲವಾಗಿದೆ. ಇವುಗಳ ಮರಿ ಹುಳಗಳು ಹಳದಿ, ಕಪ್ಪು ಹಾಗೂ ಬಿಳಿ ಬಣ್ಣಗಳ ಪಟ್ಟಿಗಳನ್ನು ಹೊಂದಿವೆ. ಇವುಗಳ ದೇಹದ ಎರಡೂ ತುದಿಯಲ್ಲಿ ಸಣ್ಣ ಕಡ್ಡಿಯ ರೀತಿಯ ರಚನೆಗಳಿವೆ. ಕಂಬಳಿಹುಳಗಳು ಸುಮಾರು ೫ ಸೆಂ.ಮೀ ಗಳಷ್ಟು ಉದ್ದಕ್ಕೆ ಬೆಳೆಯುತ್ತವೆ.
ಮೊನಾರ್ಕ್ ಚಿಟ್ಟೆಗಳು ಅಮೇರಿಕಾ ಖಂಡದಲ್ಲಿ ದಕ್ಷಿಣ ಕೆನಡಾ, ದಕ್ಷಿಣ ಅಮೇರಿಕಾದ ಉತ್ತರ ಭಾಗಗಳಲ್ಲಿ ಕಂಡು ಬರುತ್ತವೆ. ಅತ್ಯಂತ ವಿರಳವಾಗಿ ಪಶ್ಚಿಮ ಯೂರೋಪ್ ನಲ್ಲೂ ಕಂಡುಬರುತವೆ. ಹಾಗೆಯೇ ಬರ್ಮುಡಾ, ಹವಾಯಿ, ಸೊಲೋಮನ್ಸ್, ನ್ಯೂ ಕ್ಯಾಲೆಡೋನಿಯಾ, ನ್ಯೂ ಜೀಲ್ಯಾಂಡ್, ಆಸ್ಟ್ರೇಲಿಯಾ, ನ್ಯೂ ಗಿನಿಯಾ, ಸಿಲೋನ್, ಭಾರತ, ಅಝೋರ್ಸ್ ಹಾಗೂ ಕ್ಯಾನರಿ ದ್ವೀಪಗಳಲ್ಲೂ ಕಂಡುಬರುತ್ತವೆ.
ಮೊನಾರ್ಕ್ ಗಳು ಅವುಗಳ ಅತೀ ದೀರ್ಘವಾದ ವಾರ್ಷಿಕ ವಲಸೆಗಾಗಿ ಅತ್ಯಂತ ಪ್ರಸಿದ್ಧವಾಗಿವೆ. ಉತ್ತರ ಅಮೇರಿಕಾದಲ್ಲಿ ಅವು ಅಗೋಸ್ತು ತಿಂಗಳಲ್ಲಿ ಮೊದಲುಗೊಂಡು ಅತ್ಯಂತ ಹೆಚ್ಚಿನ ಸಂಖ್ಯೆಯಲ್ಲಿ ದಕ್ಷಿಣಾಭಿಮುಖವಾದ ವಲಸೆಯನ್ನು ಕೈಗೊಳ್ಳುತ್ತವೆ. ಹಾಗೆಯೇ ವಸಂತ ಋತುವಿನಲ್ಲಿ ಉತ್ತರಾಭಿಮುಖವಾಗಿ ವಲಸೆಯನ್ನು ಕೈಗೊಳ್ಳುತ್ತವೆ. ಮೊನಾರ್ಕ್ ಚಿಟ್ಟೆಗಳು ಪಕ್ಷಿಗಳಂತೆ ಉತ್ತರ ಹಾಗೂ ದಕ್ಷಿಣಾಭಿಮುಖವಾಗಿ ನಿಯಮಿತವಾದ ವಲಸೆಯನ್ನು ಕೈಗೊಳ್ಳುವ ಏಕೈಕ ಜಾತಿಯ ಚಿಟ್ಟೆಗಳಾಗಿವೆ. ಆದರೆ ಕಡಿಮೆ ಜೀವಿತಾವಧಿಯ ಕಾರಣ ಒಂದೇ ಚಿಟ್ಟೆಯು ಪೂರ್ಣ ವಲಸೆಯ ಹಾದಿಯನ್ನು ಕ್ರಮಿಸಲಾರದು. ಹೆಣ್ಣು ಚಿಟ್ಟೆಗಳು ಈ ವಲಸೆಯ ಅವಧಿಯಲ್ಲಿಯೇ ಮೊಟ್ಟೆಗಳನ್ನಿಡುತ್ತವೆ. ಈ ವಲಸೆಯ ಅವಧಿಯು ಬೇಸಿಗೆಯ ಆದಿ ಭಾಗದಲ್ಲಿ ಜನಿಸಿದ ಸಾಮಾನ್ಯ ಮೊನಾರ್ಕ್ ಗಳ ಜೀವಿತಾವಧಿಗಿಂತ (೧-೨ ತಿಂಗಳು) ಹೆಚ್ಚಿರುತ್ತದೆ. ವಲಸೆಯ ಅವಧಿಯ ಕೊನೆಯ ಪೀಳಿಗೆಯ ಚಿಟ್ಟೆಗಳು ಮಾತ್ರ ಡಯಾಪಾಸ್ ಎಂಬ ವಿಶಿಷ್ಟ ಸ್ಥಿತಿಯನ್ನು ತಲುಪುತ್ತವೆ. ಈ ಸ್ಥಿತಿಯಲ್ಲಿ ಅವು ಸುಮಾರು ೭ ತಿಂಗಳುಗಳ ಕಾಲ ಬದುಕುತ್ತವೆ. ಈ ಅವಸ್ಥೆಯಲ್ಲಿ ಅವು ಯಾವುದಾದರೊಂದು ಚಳಿಗಾಲವನ್ನು ಕಳೆಯುವ ತಾಣಗಳಿಗೆ ಹಾರಿ ಹೋಗುತ್ತವೆ. ಈ ಸ್ಥಿತಿಯಲ್ಲಿ ಅವು ಚಳಿಗಾಲ ಮುಗಿಯುವವರೆಗೂ ಸಂತಾನೋತ್ಪತ್ತಿ ಮಾಡದೆ ಇರುತ್ತವೆ. ಒಮ್ಮೆ ವಲಸೆಯನ್ನು ಕೈಗೊಂಡರೆ ಸುಮಾರು ೩-೪ ನೆಯ ಪೀಳಿಗೆಯ ಚಿಟ್ಟೆಗಳು ತಮ್ಮ ಮೂಲ ಆವಾಸಸ್ಥಾನಕ್ಕೆ ಮರಳುತ್ತವೆ. ಅವುಗಳು ತಮ್ಮ ಈ ಸುದೀರ್ಘ ವಲಸೆಗೆ ತಮ್ಮ ಪೂರ್ವಜರು ಬಳಸಿದ ದಾರಿಯನ್ನೇ ಬಳಸುತ್ತವೆ. ಅವುಗಳು ಈ ದಾರಿಯನ್ನು ಪತ್ತೆಹಚ್ಚುವ ಬಗೆ ಮಾತ್ರ ಇನ್ನೂ ಸಂಶೋಧನೆಗೆ ವಸ್ತುವಾಗಿದೆ. ಅವು ದಿಕ್ಕನ್ನು ತಿಳಿಯಲು ಸೂರ್ಯನನ್ನು ಬಳಸಿಕೊಳ್ಳುತ್ತವೆ. ಇತ್ತೀಚೆಗಿನ ಸಂಶೋಧನೆಯ ಪ್ರಕಾರ ಅವುಗಳು ದಿಕ್ಕಿಗಾಗಿ ಭೂಮಿಯ ಕಾಂತವಲಯವನ್ನೂ ಬಳಸಿಕೊಳ್ಳಬಲ್ಲವು. ಹುಳವಾಗಿದ್ದಾಗ ತಿನ್ನುವ ಹಾಲ್ರಸದ ಸಸ್ಯಗಳಿಂದಾಗಿ ಅವುಗಳು ಹೆಚ್ಚಿನ ಪ್ರಾಣಿ-ಪಕ್ಷಿಗಳಿಗೆ ವಿಷಕರವಾಗಿವೆ. ಈಮೂಲಕ ಅವು ಶತ್ರುಗಳಿಂದ ತಮ್ಮನ್ನು ತಾವು ರಕ್ಷಿಸಿಕೊಳ್ಳುತ್ತವೆ.
ಮೊನಾರ್ಕ್ ಚಿಟ್ಟೆಗಳು ( ಡನಾಸ್ ಪ್ಲೆಕ್ಸಿಪ್ಪಸ್) ಹಾಲ್ರಸದ ಸಸ್ಯಗಳ ಮೇಲೆ ಮೊಟ್ಟೆಯಿಡುವ ಒಂದು ಬಗೆಯ ಚಿಟ್ಟೆಗಳಾಗಿವೆ. ಉತ್ತರ ಅಮೆರಿಕಾದ ಚಿಟ್ಟೆಗಳಲ್ಲೆಲ್ಲ ಇವು ಅತ್ಯಂತ ಹೆಚ್ಚು ಪ್ರಸಿದ್ಧವಾಗಿವೆ. ಇವುಗಳು ಆಸ್ಟ್ರೇಲಿಯಾ, ನ್ಯೂ ಜೀಲ್ಯಾಂಡ್ ಹಾಗೂ ಯೂರೋಪ್ ನ ಕೆಲವು ಭಾಗಗಳಲ್ಲಿ ಕಂಡುಬರುತ್ತವೆ. ಇವುಗಳ ರೆಕ್ಕೆಗಳು ಸುಲಭವಾಗಿ ಗುರುತಿಸಲು ಸಾಧ್ಯವಾಗುವ ಕೇಸರಿ ಹಾಗೂ ಕಪ್ಪು ಬಣ್ಣದ ಚಿತ್ತಾರಗಳಿಂದ ಕೂಡಿದ, ೮.೯-೧೦.೨ ಸೆಂ.ಮೀ ಗಳಷ್ಟು ಅಗಲವಾದ ರೆಕ್ಕೆಗಳಿಂದ ಕೂಡಿವೆ(ವೈಸ್ ರಾಯ್ ಚಿಟ್ಟೆಗಳು ಇಷ್ಟೇ ಅಗಲವಾದ ಹಾಗೂ ಇದೇ ಬಣ್ಣದ ರೆಕ್ಕೆಗಳನ್ನು ಹೊಂದಿದ್ದರೂ, ಹಿಂದಿನ ರೆಕ್ಕೆಯ ಮೇಲಿನ ಒಂದು ವಿಶೇಷವಾದ ಚಿತ್ತಾರದಿಂದ ಅವುಗಳನ್ನು ಪ್ರತ್ಯೇಕವಾಗಿ ಗುರುತಿಸಬಹುದಾಗಿದೆ). ಹೆಣ್ಣು ಚಿಟ್ಟೆಗಳ ರೆಕ್ಕೆಗಳ ಮೇಲಿನ ಗೆರೆಗಳು ಕಡುಗಪ್ಪಾಗಿರುವುದರಿಂದಲೂ, ಗಂಡು ಚಿಟ್ಟೆಗಳ ಹಿಂದಿನ ರೆಕ್ಕೆಗಳ ನಡುವಿನಲ್ಲಿರುವ ಆಂಡ್ರೋಕೋನಿಯಂ ಎಂದು ಕರೆಯಲ್ಪಡುವ ಕಪ್ಪು ಚುಕ್ಕೆಗಳಿಂದಲೂ ಗುರುತಿಸಬಹುದಾಗಿದೆ. ಹಾಗೆಯೇ ಗಂಡು ಚಿಟ್ಟೆಗಳು ಗಾತ್ರದಲ್ಲಿ ಹೆಣ್ಣು ಚಿಟ್ಟೆಗಳಿಗಿಂತ ದೊಡ್ಡದಾಗಿರುತ್ತವೆ. ಮೊನಾರ್ಕ್ ಚಿಟ್ಟೆಗಳು ಅವುಗಳ ವಲಸೆಗಾಗಿ ಪ್ರಸಿದ್ಧಿಯನ್ನು ಹೊಂದಿವೆ. ಈ ವಲಸೆಯನ್ನು ಮುಗಿಸುವಷ್ಟರಲ್ಲಿ ಅವುಗಳ ಅನೇಕ ತಲೆಮಾರುಗಳೇ ಕಳೆದು ಹೋಗಿರುತ್ತವೆ.
The monarch butterfly or simply monarch (Danaus plexippus) is a milkweed butterfly (subfamily Danainae) in the family Nymphalidae.[5] Other common names, depending on region, include milkweed, common tiger, wanderer, and black-veined brown.[6] It is amongst the most familiar of North American butterflies and an iconic pollinator,[7] although it is not an especially effective pollinator of milkweeds.[8][9] Its wings feature an easily recognizable black, orange, and white pattern, with a wingspan of 8.9–10.2 cm (3.5–4.0 in).[10] A Müllerian mimic, the viceroy butterfly, is similar in color and pattern, but is markedly smaller and has an extra black stripe across each hindwing.
The eastern North American monarch population is notable for its annual southward late-summer/autumn instinctive migration from the northern and central United States and southern Canada to Florida and Mexico.[5] During the fall migration, monarchs cover thousands of miles, with a corresponding multigenerational return north in spring. The western North American population of monarchs west of the Rocky Mountains often migrates to sites in southern California, but individuals have been found in overwintering Mexican sites, as well.[11][12] In 2009, monarchs were reared on the International Space Station, successfully emerging from pupae located in the station's Commercial Generic Bioprocessing Apparatus.[13]
The name "monarch" is believed to have been given in honor of King William III of England, as the butterfly's main color is that of the king's secondary title, Prince of Orange.[14] The monarch was originally described by Carl Linnaeus in his Systema Naturae of 1758 and placed in the genus Papilio.[15] In 1780, Jan Krzysztof Kluk used the monarch as the type species for a new genus, Danaus.
Danaus (Ancient Greek Δαναός), a great-grandson of Zeus, was a mythical king in Egypt or Libya, who founded Argos; Plexippus (Πλήξιππος) was one of the 50 sons of Aegyptus, the twin brother of Danaus. In Homeric Greek, his name means "one who urges on horses", i.e., "rider" or "charioteer".[16] In the tenth edition of Systema Naturae, at the bottom of page 467,[17] Linnaeus wrote that the names of the Danai festivi, the division of the genus to which Papilio plexippus belonged, were derived from the sons of Aegyptus. Linnaeus divided his large genus Papilio, containing all known butterfly species, into what we would now call subgenera. The Danai festivi formed one of the "subgenera", containing colorful species, as opposed to the Danai candidi, containing species with bright white wings. Linnaeus wrote: "Danaorum Candidorum nomina a filiabus Danai Aegypti, Festivorum a filiis mutuatus sunt." (English: "The names of the Danai candidi have been derived from the daughters of Danaus, those of the Danai festivi from the sons of Aegyptus.").
Robert Michael Pyle suggested Danaus is a masculinized version of Danaë (Greek Δανάη), Danaus's great-great-granddaughter, to whom Zeus came as a shower of gold, which seemed to him a more appropriate source for the name of this butterfly.[18]

Monarchs belong in the subfamily Danainae of the family Nymphalidae. Danainae was formerly considered a separately family Danaidae.[19] The three species of monarch butterflies are:
Six subspecies and two color morphs of D. plexippus have been identified:[6]
The population level of the white morph in Oahu is nearing 10%. On other Hawaiian islands, the white morph occurs at a relatively low frequency. White monarchs (D. p. p. "form nivosus") have been found throughout the world, including Australia, New Zealand, Indonesia, and the United States.[21] However, some taxonomists disagree on these classifications.[20][23]
The monarch was the first butterfly to have its genome sequenced.[24]: 12 The 273-million-base pair draft sequence includes a set of 16,866 protein-coding genes. The genome provides researchers insights into migratory behavior, the circadian clock, juvenile hormone pathways, and microRNAs that are differentially expressed between summer and migratory monarchs.[25][26][27] More recently, the genetic basis of monarch migration and warning coloration has been described.[28]
No genetic differentiation exists between the migratory populations of eastern and western North America.[24]: 16 Recent research has identified the specific areas in the genome of the monarch that regulate migration. No genetic difference is seen between a migrating and nonmigrating monarch, but the gene is expressed in migrating monarchs, but not expressed in nonmigrating monarchs.[29]
A 2015 publication identified genes from wasp bracoviruses in the genome of the North American monarch[30] leading to articles about monarch butterflies being genetically modified organisms.[31][32]
Like all Lepidoptera, monarchs undergo complete metamorphosis; their life cycle has four phases: egg, larva, pupa, and adult. Monarchs transition from eggs to adults during warm summer temperatures in as little as 25 days, extending to as many as seven weeks during cool spring conditions. During their development, both larvae and their milkweed hosts are vulnerable to weather extremes, predators, parasites, and diseases; commonly fewer than 10% of monarch eggs and caterpillars survive.[24]: 21–22
The egg is derived from materials ingested as a larva and from the spermatophores received from males during mating.[33] Female monarchs lay eggs singly, most often on the underside of a young leaf of a milkweed plant during the spring and summer.[34] Females secrete a small amount of glue to attach their eggs directly to the plant. They typically lay 300 to 500 eggs over a two- to five-week period.[35]
Eggs are cream colored or light green, ovate to conical in shape, and about 1.2 mm × 0.9 mm (0.047 in × 0.035 in) in size. The eggs weigh less than 0.5 mg (0.0077 gr) each and have raised ridges that form longitudinally from the point to apex to the base. Although each egg is 1⁄1000 the mass of the female, she may lay up to her own mass in eggs. Females lay smaller eggs as they age. Larger females lay larger eggs.[33] The number of eggs laid by a female, which may mate several times, can reach 1,180.[36]
Eggs take three to eight days to develop and hatch into larvae or caterpillars.[24]: 21 The offspring's consumption of milkweed benefits health and helps defend them against predators.[37][38] Monarchs lay eggs along the southern migration route.[39]

The larva (caterpillar) has five stages (instars), molting at the end of each instar. Instars last about 3 to 5 days, depending on factors such as temperature and food availability.[5][40]
The first-instar caterpillar that emerges from the egg is pale green or grayish-white, shiny, and almost translucent, with a large, black head. It lacks banding coloration or tentacles. The larvae or caterpillar eats its egg case and begins to feed on milkweed with a circular motion, often leaving a characteristic, arc-shaped hole in the leaf. Older first-instar larvae have dark stripes on a greenish background and develop small bumps that later become front tentacles. The first instar is usually between 2 and 6 mm (0.079 and 0.236 in) long.[40]
The second-instar larva develops a characteristic pattern of white, yellow, and black transverse bands. The larva has a yellow triangle on the head and two sets of yellow bands around this central triangle. It is no longer translucent, and is covered in short setae. Pairs of black tentacles begin to grow, a larger pair on the thorax and a smaller pair on the abdomen. The second instar is usually between 6 mm (0.24 in) and 1 cm (0.39 in) long.[40]
The third-instar larva has more distinct bands and the two pairs of tentacles become longer. Legs on the thorax differentiate into a smaller pair near the head and larger pairs further back. Third-instar larvae usually feed using a cutting motion on leaf edges. The third instar is usually between 1 and 1.5 cm (0.39 and 0.59 in) long.[40]
The fourth-instar larva has a different banding pattern. It develops white spots on the prolegs near its back, and is usually between 1.5 and 2.5 cm (0.59 and 0.98 in) long.[40]
The fifth-instar larva has a more complex banding pattern and white dots on the prolegs, with front legs that are small and very close to the head. Fifth-instar larvae often chew a shallow notch in the petiole of the leaf they are eating, which causes the leaf to fall into a vertical position. Its length ranges from 2.5 to 4.5 cm (0.98 to 1.77 in).[5][40]
As the caterpillar completes its growth, it is 4.5 cm (1.8 in) long (large specimens can reach 5 cm (2.0 in)) and 7 to 8 mm (0.28 to 0.31 in) wide, and weighs about 1.5 g (0.053 oz), compared to the first instar, which is 2 to 6 mm (0.079 to 0.236 in) long and 0.5 to 1.5 mm (0.020 to 0.059 in) wide. Fifth-instar larvae greatly increase in size and weight. They then stop feeding and are often found far from milkweed plants as they seek a site for pupating.[40]
In a laboratory setting, the fourth- and fifth-instar stages of the caterpillar showed signs of aggressive behavior with lower food availability. Attacked caterpillars were found to be attacked when it was feeding on milkweed leaves, and the caterpillars attacked when foraging for milkweed.[41] This demonstrates the aggressive behavior of monarch caterpillars due to the availability of milkweed.
To prepare for the pupal or chrysalis stage, the caterpillar chooses a safe place for pupation, where it spins a silk pad on a downward-facing horizontal surface. At this point, it turns around and securely latches on with its last pair of hind legs and hangs upside down, in the form of the letter J. After "J-hanging" for about 12–16 hours, it soon straightens out its body and goes into peristalsis some seconds before its skin splits behind its head. It then sheds its skin over a period of a few minutes, revealing a green chrysalis. At first, the chrysalis is long, soft, and somewhat amorphous, but over a few hours, it compacts into its distinct shape – an opaque, pale-green chrysalis with small golden dots near the bottom, and a gold-and-black rim around the dorsal side near the top.[42] At first, its exoskeleton is soft and fragile, but it hardens and becomes more durable within about a day. At this point, it is about 2.5 cm (0.98 in) long and 10–12 mm (0.39–0.47 in) wide, weighing about 1.2 g (0.042 oz). At normal summer temperatures, it matures in 8–15 days (usually 11–12 days). During this pupal stage, the adult butterfly forms inside. A day or so before emerging, the exoskeleton first becomes translucent and the chrysalis more bluish. Finally, within 12 hours or so, it becomes transparent, revealing the black and orange colors of the butterfly inside before it ecloses (emerges).[43][44]
The adult emerges from its chrysalis after about two weeks of pupation. The emergent adult hangs upside down for several hours while it pumps fluids and air into its wings, which expand, dry, and stiffen. The butterfly then extends and retracts its wings. Once conditions allow, it flies and feeds on a variety of nectar plants. During the breeding season, adults reach sexual maturity in 4–5 days. However, the migrating generation does not reach maturity until overwintering is complete.[45]
The adult's wingspan ranges from 8.9 to 10.2 centimetres (3.5 to 4.0 in).[10] The upper sides of the wings are tawny orange, the veins and margins are black, and two series of small white spots occur in the margins. Monarch forewings also have a few orange spots near their tips. Wing undersides are similar, but the tips of forewings and hindwings are yellow brown instead of tawny orange and the white spots are larger.[46] The shape and color of the wings change at the beginning of the migration and appear redder and more elongated than later migrants.[47] Wings size and shape differ between migratory and nonmigratory monarchs. Monarchs from eastern North America have larger and more angular forewings than those in the western population.[24]
In eastern North American populations, overall wing size in the physical dimensions of wings varies. Males tend to have larger wings than females, and are typically heavier than females. Both males and females have similar thoracic dimensions. Female monarchs tended to have thicker wings, which is thought to convey greater tensile strength and reduce the likelihood of being damaged during migration. Additionally, females had lower wing loading than males, which would mean females require less energy to fly.[48]
Adults are sexually dimorphic. Males are slightly larger than females and have a black spot on a vein on each hindwing. The spots contain scales that produce pheromones that many Lepidoptera use during courtship. Females are often darker than males and have wider veins on their wings. The ends of the abdomens of males and females differ in shape.[46][49][24][50][51][52]
The adult's thorax has six legs, but as in all of the Nymphalidae, the forelegs are small and held against the body. The butterfly uses only its middle and hindlegs when walking and clinging.[53]
Adults typically live for 2–5 weeks during their breeding season.[24]: 22–23 Larvae growing in high densities are smaller, have lower survival, and weigh less as adults compared with those growing in lower densities.[54]
Physiological experiments suggest that monarch butterflies view the world through a tetrachromatic system.[55] Like humans, their retina contain three types of opsin proteins, expressed in distinct photoreceptor cells, each of which absorbs light at a different wavelength. Unlike humans, one of those types of photoreceptor cells corresponds to a wavelength in the ultraviolet range; the other two correspond to blue and green.[56]
In addition to these three photoreceptors cells in the main retina, monarch butterfly eyes contain orange filtering pigments that filter the light reaching some green-absorbing opsins, thereby making a fourth photoreceptor cell sensitive to longer-wavelength light.[55] The combination of filtered and unfiltered green opsins permits the butterflies to distinguish yellow from orange colors.[55] The ultraviolet opsin protein has also been detected in the dorsal rim region of monarch eyes. One study suggests that this allows the butterflies the ability to detect ultraviolet polarized skylight to orient themselves with the sun for their long migratory flight.[57]
These butterflies are capable of distinguishing colors based on their wavelength only, and not based on intensity; this phenomenon is termed "true color vision". This is important for many butterfly behaviors, including seeking nectar for nourishment, choosing a mate, and finding milkweed on which to lay eggs. One study found that floral color is more easily recognized at a distance by butterflies searching for nectar than floral shape. This may be because flowers have highly contrasting colors to the green background of a vegetative landscape.[58] On the other hand, leaf shape is important for oviposition so that the butterflies can ensure their eggs are being laid on milkweed.
Beyond the perception of color, the ability to remember certain colors is essential in the life of monarch butterflies. These insects can easily learn to associate color, and to a lesser extent, shape, with sugary food rewards. When searching for nectar, color is the first cue that draws the insect's attention toward a potential food source, and shape is a secondary characteristic that promotes the process. When searching for a place to lay its eggs, the roles of color and shape are switched. Also, a difference may exist between male and female butterflies from other species in terms of the ability to learn certain colors; however, no differences is noted between the sexes for monarch butterflies.[58]
Monarch courtship occurs in two phases. During the aerial phase, a male pursues and often forces a female to the ground. During the ground phase, the butterflies copulate and remain attached for about 30 to 60 minutes.[59] Only 30% of mating attempts end in copulation, suggesting that females may be able to avoid mating, though some have more success than others.[60][61] During copulation, a male transfers his spermatophore to a female. Along with sperm, the spermatophore provides a female with nutrition, which aids her in laying eggs. An increase in spermatophore size increases the fecundity of female monarchs. Males that produce larger spermatophores also fertilize more females' eggs.[62]
Females and males typically mate more than once. Females that mate several times lay more eggs.[63] Mating for the overwintering populations occurs in the spring, prior to dispersion. Mating is less dependent on pheromones than in other species in its genus.[64] Male search and capture strategies may influence copulatory success, and human-induced changes to the habitat can influence monarch mating activity at overwintering sites.[65]

The range of the western and eastern populations of D. p. plexippus expands and contracts depending upon the season. The range differs between breeding areas, migration routes, and winter roosts.[24]: 18 However, no genetic differences between the western and eastern monarch populations exist;[29] reproductive isolation has not led to subspeciation of these populations, as it has elsewhere within the species' range.[24]: 19
In the Americas, the monarch ranges from southern Canada through northern South America.[5] It is also found in Bermuda, Cook Islands,[66] Hawaii,[67][68] Cuba,[69] and other Caribbean islands[24]: 18 the Solomons, New Caledonia, New Zealand,[70] Papua New Guinea,[71] Australia, the Azores, the Canary Islands, Madeira, continental Portugal, Gibraltar,[72] the Philippines, and Morocco.[73] It appears in the UK in some years as an accidental migrant.[74]
Overwintering populations of D. p. plexippus are found in Mexico, California, along the Gulf Coast of the United States, year-round in Florida, and in Arizona where the habitat has the specific conditions necessary for their survival.[75][76] On the East Coast of the United States, they have overwintered as far north as Lago Mar, Virginia Beach, Virginia.[77] Their wintering habitat typically provides access to streams, plenty of sunlight (enabling body temperatures that allow flight), and appropriate roosting vegetation, and is relatively free of predators.
Overwintering, roosting butterflies have been seen on basswoods, elms, sumacs, locusts, oaks, osage-oranges, mulberries, pecans, willows, cottonwoods, and mesquites.[78] While breeding, monarch habitats can be found in agricultural fields, pasture land, prairie remnants, urban and suburban residential areas, gardens, trees, and roadsides – anywhere where there is access to larval host plants.[79]
The host plants used by the monarch caterpillar include:

Asclepias curassavica, or tropical milkweed, is often planted as an ornamental in butterfly gardens. Year-round plantings in the USA are controversial and criticised, as they may be the cause of new overwintering sites along the U.S. Gulf Coast, leading to year-round breeding of monarchs.[98] This is thought to adversely affect migration patterns, and to cause a dramatic buildup of the dangerous parasite, Ophryocystis elektroscirrha.[99] New research also has shown that monarch larvae reared on tropical milkweed show reduced migratory development (reproductive diapause), and when migratory adults are exposed to tropical milkweed, it stimulates reproductive tissue growth.[100]

Although larvae eat only milkweed, adult monarchs feed on the nectar of many plants, including:[101]
Monarchs obtain moisture and minerals from damp soil and wet gravel, a behavior known as mud-puddling. The monarch has also been noticed puddling at an oil stain on pavement.[76]

In North America, monarchs migrate both north and south on an annual basis, in a long-distance journey that is fraught with risks.[5] This is a multi-generational migration, with individual monarchs only making part of the full journey.[102] The population east of the Rocky Mountains attempts to migrate to the sanctuaries of the Mariposa Monarca Biosphere Reserve in the Mexican state of Michoacán and parts of Florida. The western population tries to reach overwintering destinations in various coastal sites in central and southern California. The overwintered population of those east of the Rockies may reach as far north as Texas and Oklahoma during the spring migration. The second, third, and fourth generations return to their northern locations in the United States and Canada in the spring.[103]
Captive-raised monarchs appear capable of migrating to overwintering sites in Mexico,[104] though they have a much lower migratory success rate than do wild monarchs (see section on captive-rearing below).[105] Monarch overwintering sites have been discovered recently in Arizona.[106] Monarchs from the eastern US generally migrate longer distances than monarchs from the western US.[107]
Since the 1800s, monarchs have spread throughout the world, and there are now many non-migratory populations globally.[108]
Flight speeds of adults are around 9 km/h (6 mph).[109]
In both caterpillar and butterfly form, monarchs are aposematic, warding off predators with a bright display of contrasting colors to warn potential predators of their undesirable taste and poisonous characteristics. One monarch researcher emphasizes that predation on eggs, larvae or adults is natural, since monarchs are part of the food chain, thus people should not take steps to kill predators of monarchs.[110]
Larvae feed exclusively on milkweed and consume protective cardiac glycosides. Toxin levels in Asclepias species vary. Not all monarchs are unpalatable, but exhibit Batesian or automimics. Cardiac glycosides levels are higher in the abdomen and wings. Some predators can differentiate between these parts and consume the most palatable ones.[111]
Butterfly weed (A. tuberosa) lacks significant amounts of cardiac glycosides (cardenolides), but instead contains other types of toxic glycosides, including pregnanes.[112][113][114] This difference may reduce the toxicity of monarchs whose larvae feed on that milkweed species, as a naturalist and others have reported that monarch caterpillars do not favor the plant.[115] Some other milkweeds have similar characteristics.[116]
While monarchs have a wide range of natural predators, none of these is suspected of causing harm to the overall population, or are the cause of the long-term declines in winter colony sizes.
Several species of birds have acquired methods that allow them to ingest monarchs without experiencing the ill effects associated with the cardiac glycosides (cardenolides). The black-backed oriole is able to eat the monarch through an exaptation of its feeding behavior that gives it the ability to identify cardenolides by taste and reject them.[117] The black-headed grosbeak, though, has developed an insensitivity to secondary plant poisons that allows it to ingest monarchs without vomiting.[118] As a result, these orioles and grosbeaks periodically have high levels of cardenolides in their bodies, and they are forced to go on periods of reduced monarch consumption. This cycle effectively reduces potential predation of monarchs by 50% and indicates that monarch aposematism has a legitimate purpose.[117] The black-headed grosbeak has also evolved resistance mutations in the molecular target of the heart poisons, the sodium pump. The specific mutations that evolved in one of the grosbeak's four copies of the sodium pump gene are the same as those found in other milkweed butterflies like the common crow that also evolved to resist cardiac glycosides.[119] Other bird predators include brown thrashers, grackles, robins, cardinals, sparrows, scrub jays, and pinyon jays.[111]
The monarch's white morph appeared in Oahu after the 1965–1966 introduction of two bulbul bird species, Pycnonotus cafer and Pycnonotus jocosus. These are now the most common avian insectivores in Hawaii, and probably the only ones that eat insects as large as monarchs. Although Hawaiian monarchs have low cardiac glycoside levels, the birds may also be tolerant of that toxin. The two species hunt the larvae and some pupae from the branches and undersides of leaves in milkweed bushes. The bulbuls also eat resting and ovipositing adults, but rarely flying ones. Because of its color, the white morph has a higher survival rate than the orange one. This is either because of apostatic selection (i.e., the birds have learned the orange monarchs can be eaten), because of camouflage (the white morph matches the white pubescence of milkweed or the patches of light shining through foliage), or because the white morph does not fit the bird's search image of a typical monarch, so is thus avoided.[120]
Some mice, particularly the black-eared mouse (Peromyscus melanotis), are, like all rodents, able to tolerate large doses of cardenolides and are able to eat monarchs.[121] Overwintering adults become less toxic over time making them more vulnerable to predators. In Mexico, about 14% of the overwintering monarchs are eaten by birds and mice and black-eared mice can eat up to 40 monarchs per night.[75][121]
In North America, eggs and first-instar larvae of the monarch are eaten by larvae and adults of the introduced Asian lady beetle (Harmonia axyridis).[122] The Chinese mantis (Tenodera sinensis) will consume the larvae once the gut is removed thus avoiding cardenolides.[123] Predatory wasps commonly consume larvae,[124] though large larvae may avoid wasp predation by dropping from the plant or by jerking their bodies.[125]
Monarchs are toxic and foul-tasting because of the presence of cardenolides in their bodies, which the caterpillars ingest as they feed on milkweed.[64] Monarchs and other cardenolide-resistant insects rely on a resistant form of the Na+/ K+-ATPase enzyme to tolerate significantly higher concentrations of cardenolides than nonresistant species.[126] By ingesting a large amount of plants in the genus Asclepias, primarily milkweed, monarch caterpillars are able to sequester cardiac glycosides, or more specifically cardenolides, which are steroids that act in heart-arresting ways similar to digitalis.[127] It has been found that monarchs are able to sequester cardenolides most effectively from plants of intermediate cardenolide content rather than those of high or low content.[128] Three mutations that evolved in the monarch's Na+/ K+-ATPase were found to be sufficient together to confer resistance to dietary cardiac glycosides.[126] This was tested by swapping these mutations into the same gene in the fruit fly Drosophila melanogaster using CRISPR-Cas9 genome editing. These fruit flies-turned monarch flies[129] were completely resistant to dietary ouabain, a cardiac glycoside found in Apocynaceae, and even sequestered some through metamorphosis, like the monarch.[126]
Different species of milkweed have different effects on growth, virulence, and transmission of parasites.[130] One species, Asclepias curassavica, appears to reduce the symptoms of Ophryocystis elektroscirrha (OE) infection. The two possible explanations for this include that it promotes overall monarch health to boost the monarch's immune system or that chemicals from the plant have a direct negative effect on the OE parasites.[130] A. curassavica does not cure or prevent the infection with OE; it merely allows infected monarchs to live longer, and this would allow infected monarchs to spread the OE spores for longer periods. For the average home butterfly garden, this scenario only adds more OE to the local population.[131]
After the caterpillar becomes a butterfly, the toxins shift to different parts of the body. Since many birds attack the wings of the butterfly, having three times the cardiac glycosides in the wings leaves predators with a very foul taste and may prevent them from ever ingesting the body of the butterfly.[127] To combat predators that remove the wings only to ingest the abdomen, monarchs keep the most potent cardiac glycosides in their abdomens.[132]

Monarchs share the defense of noxious taste with the similar-appearing viceroy butterfly in what is perhaps one of the most well-known examples of mimicry. Though long purported to be an example of Batesian mimicry, the viceroy is actually reportedly more unpalatable than the monarch, making this a case of Müllerian mimicry.[133]
The monarch is the state insect of Alabama,[134] Idaho,[135] Illinois,[136] Minnesota,[137] Texas,[138] Vermont,[139] and West Virginia.[140] Legislation was introduced to make it the national insect of the United States,[141] but this failed in 1989[142] and again in 1991.[143]
Homeowners are increasingly establishing butterfly gardens; monarchs can be attracted by cultivating a butterfly garden with specific milkweed species and nectar plants. Efforts are underway to establish these monarch waystations. [144]
An IMAX film, Flight of the Butterflies, describes the story of the Urquharts, Brugger, and Trail to document the then-unknown monarch migration to Mexican overwintering areas.[145]
Sanctuaries and reserves have been created at overwintering locations in Mexico and California to limit habitat destruction. These sites can generate significant tourism revenue.[146] However, with less tourism, monarch butterflies will have a higher survival rate because they show more protein content and a higher value of immune response and oxidative defense.[147]
Organizations and individuals participate in tagging programs. Tagging information is used to study migration patterns.[148]
The 2012 novel by Barbara Kingsolver, Flight Behavior, deals with the fictional appearance of a large population in the Appalachians.[149]
Humans interact with monarchs when rearing them in captivity, which has become increasingly popular. However, risks occur in this controversial activity. On one hand, captive rearing has many positive aspects. Monarchs are bred in schools and used for butterfly releases at hospices, memorial events, and weddings.[150] Memorial services for the September 11 attacks include the release of captive-bred monarchs.[151][152][153] Monarchs are used in schools and nature centers for educational purposes.[154] Many homeowners raise monarchs in captivity as a hobby and for educational purposes.[155]
On the other hand, this practice becomes problematic when monarchs are "mass-reared". Stories in the Huffington Post in 2015 and Discover magazine in 2016 have summarized the controversy around this issue.[156][157]
The frequent media reports of monarch declines have encouraged many homeowners to attempt to rear as many monarchs as possible in their homes and then release them to the wild in an effort to "boost the monarch population". Some individuals, such as one in Linn County, Iowa, have reared thousands of monarchs at the same time.[158]
Some monarch scientists do not condone the practice of rearing "large" numbers of monarchs in captivity for release into the wild because of the risks of genetic issues and disease spread.[159] One of the biggest concerns of mass rearing is the potential for spreading the monarch parasite, Ophryocystis elektroscirrha, into the wild. This parasite can rapidly build up in captive monarchs, especially if they are housed together. The spores of the parasite also can quickly contaminate all housing equipment, so that all subsequent monarchs reared in the same containers then become infected. One researcher stated that rearing more than 100 monarchs constitutes "mass rearing" and should not be done.[160]
In addition to the disease risks, researchers believe these captive-reared monarchs are not as fit as wild ones, owing to the unnatural conditions in which they are raised. Homeowners often raise monarchs in plastic or glass containers in their kitchens, basements, porches, etc., and under artificial lighting and controlled temperatures. Such conditions would not mimic what the monarchs are used to in the wild, and may result in adults that are unsuited for the realities of their wild existence. In support of this, a recent study by a citizen scientist found that captive-reared monarchs have a lower migration success rate than wild monarchs do.[105]
A 2019 study shed light on the fitness of captive-reared monarchs, by testing reared and wild monarchs on a tethered flight apparatus that assessed navigational ability.[161] In that study, monarchs that were reared to adulthood in artificial conditions showed a reduction in navigational ability. This happened even with monarchs that were brought into captivity from the wild for a few days. A few captive-reared monarchs did show proper navigation. This study revealed the fragility of monarch development; if the conditions are not suitable, their ability to properly migrate could be impaired. The same study also examined the genetics of a collection of reared monarchs purchased from a butterfly breeder, and found they were dramatically different from wild monarchs, so much so that the lead author described them as "franken-monarchs".[162]
An unpublished study in 2019 compared behavior of captive-reared versus wild monarch larvae.[163] The study showed that reared larvae exhibited more defensive behavior than wild larvae. The reason for this is unknown, but it could relate to the fact that reared larvae are frequently handled and/or disturbed.
In February 2015, the U.S. Fish and Wildlife Service reported a study that showed that nearly a billion monarchs had vanished from the butterfly's overwintering sites since 1990. The agency attributed the monarch's decline in part to a loss of milkweed caused by herbicides that farmers and homeowners had used.[164]
Based on a 2014 20-year comparison, the overwintering numbers west of the Rocky Mountains have dropped more than 50% since 1997 and the overwintering numbers east of the Rockies have declined by more than 90% since 1995. According to the Xerces Society, the monarch population in California decreased 86% in 2018, going from millions of butterflies to tens of thousands of butterflies.[165]
The society's annual 2020–2021 winter count showed a significant decline in the California population. One Pacific Grove site did not have a single monarch butterfly. A primary explanation for this was the destruction of the butterfly's milkweed habitats.[24][166] This particular population is believed to comprise less than 2000 individuals, as of 2022.[167]
A 2016 publication attributed the previous decade's 90% decline in overwintering numbers of the eastern monarch population to the loss of breeding habitat and milkweed. The publication's authors stated that an 11%–57% probability existed that this population will go almost extinct over the next 20 years.[168]
Chip Taylor, the director of Monarch Watch at the University of Kansas, has stated that the Midwest milkweed habitat "is virtually gone" with 120–150 million acres lost.[169][170] To help fight this problem, Monarch Watch encourages the planting of "Monarch Waystations".[155]
Declines in milkweed abundance and monarch populations between 1999 and 2010 are correlated with the adoption of herbicide-tolerant genetically modified (GM) corn and soybeans, which now constitute 89% and 94% of these crops, respectively, in the U.S.[168] GM corn and soybeans are resistant to the effect of the herbicide glyphosate. Some conservationists attribute the disappearance of milkweed to agricultural practices in the Midwest, where GM seeds are bred to resist herbicides that farmers use to kill unwanted plants that grow near their rows of food crops.[171][172]
In 2015, the Natural Resources Defense Council filed a suit against the United States Environmental Protection Agency (EPA). The Council argued that the agency ignored warnings about the dangers of glyphosate usage for monarchs.[173] However, a 2018 study has suggested that the decline in milkweed predates the arrival of GM crops.[174]

Eastern and midwestern monarchs are apparently experiencing problems reaching Mexico. A number of monarch researchers have cited recent evidence obtained from long-term citizen science data that show that the number of breeding (adult) monarchs has not declined in the last two decades.[175][176][177]
The lack of long-term declines in the numbers of breeding and migratory monarchs, yet the clear declines in overwintering numbers, suggests a growing disconnect exists between these life stages. One researcher has suggested that mortality from car strikes constitutes an increasing threat to migrating monarchs.[178] A study of road mortality in northern Mexico, published in 2019, showed very high mortality from just two "hotspots" each year, amounting to 200,000 monarchs killed.[179]
The area of Mexican forest to which eastern and midwestern monarchs migrate reached its lowest level in two decades in 2013. The decline was expected to increase during the 2013–2014 season. Mexican environmental authorities continue to monitor illegal logging of the oyamel trees. The oyamel is a major species of evergreen on which the overwintering butterflies spend a significant time during their winter diapause, or suspended development.[180]
A 2014 study acknowledged that while "the protection of overwintering habitat has no doubt gone a long way towards conserving monarchs that breed throughout eastern North America", their research indicates that habitat loss on breeding grounds in the United States is the main cause of both recent and projected population declines.[181]
Western monarch populations have rebounded slightly since 2014 with the Western Monarch Thanksgiving Count [182]tallying 335,479 monarchs in 2022. The population still has much to go for a full recovery.

Parasites include the tachinid flies Sturmia convergens[183] and Lespesia archippivora. Lesperia-parasitized butterfly larvae suspend, but die prior to pupation. The fly's maggot lowers itself to the ground, forms a brown puparium and then emerges as an adult.[184]
Pteromalid wasps, specifically Pteromalus cassotis, parasitize monarch pupae.[185] These wasps lay their eggs in the pupae while the chrysalis is still soft. Up to 400 adults emerge from the chrysalis after 14–20 days,[185] killing the monarch.
The bacterium Micrococcus flacidifex danai also infects larvae. Just before pupation, the larvae migrate to a horizontal surface and die a few hours later, attached only by one pair of prolegs, with the thorax and abdomen hanging limp. The body turns black shortly thereafter. The bacterium Pseudomonas aeruginosa has no invasive powers, but causes secondary infections in weakened insects. It is a common cause of death in laboratory-reared insects.[184]
Ophryocystis elektroscirrha is another parasite of the monarch. It infects the subcutaneous tissues and propagates by spores formed during the pupal stage. The spores are found over all of the body of infected butterflies, with the greatest number on the abdomen. These spores are passed, from female to caterpillar, when spores rub off during egg laying and are then ingested by caterpillars. Severely infected individuals are weak, unable to expand their wings, or unable to eclose, and have shortened lifespans, but parasite levels vary in populations. This is not the case in laboratory rearing, where after a few generations, all individuals can be infected.[186]
Infection with O. elektroscirrha creates an effect known as culling, whereby migrating monarchs that are infected are less likely to complete the migration. This results in overwintering populations with lower parasite loads.[187] Owners of commercial butterfly-breeding operations claim that they take steps to control this parasite in their practices,[188] although this claim is doubted by many scientists who study monarchs.[189]
The black swallow-wort (Cynanchum louiseae) and pale swallow-wort (Cynanchum rossicum) plants are problematic for monarchs in North America. Monarchs lay their eggs on these relatives of native vining milkweed (Cynanchum laeve) because they produce stimuli similar to milkweed. Once the eggs hatch, the caterpillars are poisoned by the toxicity of this invasive plant from Europe.[190]
Climate variations during the fall and summer affect butterfly reproduction. Rainfall and freezing temperatures affect milkweed growth. Omar Vidal, director general of WWF-Mexico, said, "The monarch's lifecycle depends on the climatic conditions in the places where they breed. Eggs, larvae, and pupae develop more quickly in milder conditions. Temperatures above 35 °C (95 °F) can be lethal for larvae, and eggs dry out in hot, arid conditions, causing a drastic decrease in hatch rate."[191] If a monarch's body temperatures is below 30 °C (86 °F), a monarch cannot fly. To warm up, they sit in the sun or rapidly shiver their wings to warm themselves.[192]
Climate change may dramatically affect the monarch migration. A study from 2015 examined the impact of warming temperatures on the breeding range of the monarch, and showed that in the next 50 years the monarch host plant will expand its range further north into Canada, and that the monarchs will follow this.[193] While this will expand the breeding locations of the monarch, it will also have the effect of increasing the distance that monarchs must travel to reach their overwintering destination in Mexico, which could result in greater mortality during the migration.[194]
Milkweeds grown at increased temperatures have been shown to contain higher cardenolide concentrations, making the leaves too toxic for the monarch caterpillars. However, these increased concentrations are likely in response to increased insect herbivory, which is also caused by the increased temperatures. Whether increased temperatures make milkweed too toxic for monarch caterpillars when other factors are not present is unknown.[195] Additionally, milkweed grown at carbon dioxide levels of 760 parts per million was found to produce a different mix of the toxic cardenolides, one of which was less effective against monarch parasites.[196]
On July 20, 2022, the International Union for Conservation of Nature added the migratory monarch butterfly (the subspecies common in North America) to its red list of endangered species.[197][2]
The monarch butterfly is not currently listed under the Convention on International Trade in Endangered Species of Wild Fauna and Flora or protected specifically under U.S. domestic laws.[198]
On August 14, 2014, the Center for Biological Diversity and the Center for Food Safety filed a legal petition requesting Endangered Species Act protection for the monarch and its habitat,[24] based largely on the long-term trends observed at overwintering sites. The U.S. Fish and Wildlife Service (FWS) initiated a status review of the monarch butterfly under the Endangered Species Act with a due date for information submission of March 3, 2015, later extended to 2020. On December 15, 2020, the FWS ruled that adding the butterfly to the list of threatened and endangered species was "warranted-but-precluded" because it needed to devote its resources to 161 higher-priority species.[199]
The number of monarchs overwintering in Mexico has shown a long-term downward trend. Since 1995, coverage numbers have been as high as 18 hectares (44 acres) during the winter of 1996–1997, but on average about 6 hectares (15 acres). Coverage declined to its lowest point to date (0.67 hectares (1.66 acres)) during the winter of 2013–2014, but rebounded to 4.01 hectares (10 acres) in 2015–2016. The average population of monarchs in 2016 was estimated at 200 million. Historically, on average there are 300 million monarchs. The 2016 increase was attributed to favorable breeding conditions in the summer of 2015. However, coverage declined by 27% to 2.91 hectares (7.19 acres) during the winter of 2016–2017. Some believe this was because of a storm that had occurred during March 2016 in the monarchs' previous overwintering season,[200][201][202] though this seems unlikely since most current research shows that the overwintering colony sizes do not predict the size of the next summer breeding population.[203]
In Ontario, Canada, the monarch butterfly is listed as a species of special concern.[204] In fall 2016, the Committee on the Status of Endangered Wildlife in Canada proposed that the monarch be listed as endangered in Canada, as opposed to its current listing as a "species of concern" in that country. This move, once enacted, would protect critical monarch habitat in Canada, such as major fall accumulation areas in southern Ontario, but it would also have implications for citizen scientists who work with monarchs, and for classroom activities. If the monarch were federally protected in Canada, these activities could be limited, or require federal permits.[205]
In Nova Scotia, the monarch is listed as endangered at the provincial level, as of 2017. This decision (as well as the Ontario decision) apparently is based on a presumption that the overwintering colony declines in Mexico create declines in the breeding range in Canada.[206] Two recent studies have been conducted examining long-term trends in monarch abundance in Canada, using either butterfly atlas records[207] or citizen science butterfly surveys,[208] and neither shows evidence of a population decline in Canada.
Although numbers of breeding monarchs in eastern North America have apparently not decreased, reports of declining numbers of overwintering butterflies have inspired efforts to conserve the species.[175][176][177]
On June 20, 2014, President Barack Obama issued a presidential memorandum entitled "Creating a Federal Strategy to Promote the Health of Honey Bees and Other Pollinators". The memorandum established a Pollinator Health Task Force, to be co-chaired by the Secretary of Agriculture and the Administrator of the Environmental Protection Agency, and stated:
The number of migrating Monarch butterflies sank to the lowest recorded population level in 2013–14, and there is an imminent risk of failed migration.[209]
In May 2015, the Pollinator Health Task Force issued a "National Strategy to Promote the Health of Honey Bees and Other Pollinators". The strategy laid out federal actions to achieve three goals, two of which were:
- Monarch Butterflies: Increase the Eastern population of the monarch butterfly to 225 million butterflies occupying an area of approximately 15 acres (6 hectares) in the overwintering grounds in Mexico, through domestic/international actions and public-private partnerships, by 2020.
- Pollinator Habitat Acreage: Restore or enhance 7 million acres of land for pollinators over the next 5 years through Federal actions and public/private partnerships.[210]
Many of the priority projects that the national strategy identified focused on the I-35 corridor, which extends for 1,500 miles (2,400 km) from Texas to Minnesota. The area through which that highway travels provides spring and summer breeding habitats in the United States' key monarch migration corridor.[210]
The U.S. General Services Administration (GSA) publishes sets of landscape performance requirements in its P100 documents, which mandate standards for the GSA's Public Buildings Service. Beginning in March 2015, those performance requirements and their updates have included four primary aspects for planting designs that are intended to provide adequate on-site foraging opportunities for targeted pollinators. The targeted pollinators include bees, butterflies, and other beneficial insects.[211][212][213]
On December 4, 2015, President Obama signed into law the Fixing America's Surface Transportation (FAST) Act (Pub. L. 114-94).[214] The FAST Act placed a new emphasis on efforts to support pollinators. To accomplish this, the FAST Act amended Title 23 (Highways) of the United States Code. The amendment directed the United States Secretary of Transportation, when carrying out programs under that title in conjunction with willing states, to:
The FAST Act also stated that activities to establish and improve pollinator habitat, forage, and migratory way stations may be eligible for Federal funding if related to transportation projects funded under Title 23.[215]
The United States Department of Agriculture's Farm Service Agency helps increase U.S. populations of monarch butterfly and other pollinators through its Conservation Reserve Program's State Acres for Wildlife Enhancement (SAFE) Initiative. The SAFE Initiative provides an annual rental payment to farmers who agree to remove environmentally sensitive land from agricultural production and who plant species that will improve environmental health and quality. Among other things, the initiative encourages landowners to establish wetlands, grasses, and trees to create habitats for species that the FWS has designated to be threatened or endangered.[216][217][218][219]
Agriculture companies and other organizations are being asked to set aside areas that remain unsprayed to allow monarchs to breed. In addition, national and local initiatives are underway to help establish and maintain pollinator habitats along corridors containing power lines and roadways. The Federal Highway Administration, state governments, and local jurisdictions are encouraging highway departments and others to limit their use of herbicides, to reduce mowing, to help milkweed to grow and to encourage monarchs to reproduce within their right-of-ways.[172][220]
In 2020, the National Cooperative Highway Research Program (NCRHP) of the Transportation Research Board issued a 208-page report that described a project that had examined the potential for roadway corridors to provide habitat for monarch butterflies. A part of the project developed tools for roadside managers to optimize potential habitat for monarch butterflies in their road rights-of-way.[221][222]
Such efforts are controversial because the risk of butterfly mortality near roads is high. Several studies have shown that motor vehicles kill millions of monarchs and other butterflies every year.[178] Also, some evidence indicates that monarch larvae living near roads experience physiological stress conditions, as evidenced by elevations in their heart rate.[223]
The NCRHP report acknowledged that, among other hazards, roads present a danger of traffic collisions for monarchs, stating that these effects appear to be more concentrated in particular funnel areas during migration.[224] Nevertheless, the report concluded:
In summary, threats along roadway corridors exist for monarchs and other pollinators, but in the context of the amount of habitat needed for recovery of sustainable populations, roadsides are of vital importance.[224]

While scientific studies on the subject have been reported, the practice of butterfly gardening and creating "monarch waystations" is commonly thought to increase the populations of butterflies.[225][226][227][228][229][230][231] Efforts to restore falling monarch populations by establishing butterfly gardens and monarch waystations require particular attention to the butterfly's food preferences and population cycles, as well to the conditions needed to propagate and maintain milkweed.[232][233]
For example, in the Washington, DC, area and elsewhere in the northeastern United States, monarchs prefer to reproduce on common milkweed (A. syriaca), especially when its foliage is soft and fresh. Because monarch reproduction in that area peaks in late summer when milkweed foliage is old and tough, A. syriaca needs to be mowed or cut back in June through August to assure that it will be regrowing rapidly when monarch reproduction reaches its peak. Similar conditions exist for showy milkweed (A. speciosa) in Michigan and for green antelopehorn milkweed (A. viridis), where it grows in the Southern Great Plains and the Western United States.[80][234][235][236][237][238] In addition, the seeds of A. syriaca and some other milkweeds need periods of cold treatment (cold stratification) before they will germinate.[239][240][241][242][243][244]
To protect seeds from washing away during heavy rains and from seed–eating birds, one can cover the seeds with a light fabric or with an 0.5-inch (13 mm) layer of straw mulch.[245][246] However, mulch acts as an insulator. Thicker layers of mulch can prevent seeds from germinating if they prevent soil temperatures from rising enough when winter ends. Further, few seedlings can push through a thick layer of mulch.[247]
Although monarch caterpillars will feed on butterfly weed (A. tuberosa) in butterfly gardens, the plant has rough leaves and is typically not a heavily used host plant for the species.[248] The plant's low levels of cardenolides may also make the plant unattractive to egg-laying monarchs.[115] While A. tuberosa's colorful flowers provide nectar for many adult butterflies, the plant may be less suitable for use in butterfly gardens and monarch waystations than are other milkweed species.[248]
Breeding monarchs prefer to lay eggs on swamp milkweed (A. incarnata).[249][250][251][252][253][254] However, A. incarnata is an early successional plant that usually grows at the margins of wetlands and in seasonally flooded areas. The plant is slow to spread via seeds, does not spread by runners and tends to disappear as vegetative densities increase and habitats dry out.[254][255] Although A. incarnata plants can survive for up to 20 years, most live only two-five years in gardens. The species is not shade-tolerant and is not a good vegetative competitor.[255]
 D. p. plexippus
D. p. plexippusThe monarch butterfly or simply monarch (Danaus plexippus) is a milkweed butterfly (subfamily Danainae) in the family Nymphalidae. Other common names, depending on region, include milkweed, common tiger, wanderer, and black-veined brown. It is amongst the most familiar of North American butterflies and an iconic pollinator, although it is not an especially effective pollinator of milkweeds. Its wings feature an easily recognizable black, orange, and white pattern, with a wingspan of 8.9–10.2 cm (3.5–4.0 in). A Müllerian mimic, the viceroy butterfly, is similar in color and pattern, but is markedly smaller and has an extra black stripe across each hindwing.
The eastern North American monarch population is notable for its annual southward late-summer/autumn instinctive migration from the northern and central United States and southern Canada to Florida and Mexico. During the fall migration, monarchs cover thousands of miles, with a corresponding multigenerational return north in spring. The western North American population of monarchs west of the Rocky Mountains often migrates to sites in southern California, but individuals have been found in overwintering Mexican sites, as well. In 2009, monarchs were reared on the International Space Station, successfully emerging from pupae located in the station's Commercial Generic Bioprocessing Apparatus.
La mariposa monarca (Danaus plexippus) es una especie de lepidóptero ditrisio de la familia Nymphalidae, superfamilia Papilionoidea. Es quizás la más conocida de todas las mariposas de América del Norte. Desde el siglo XIX ha sido introducida en Nueva Zelanda y en Australia.[4][5][6] En el Atlántico es residente en las Islas Canarias, Azores, Madeira y Andalucía, y se encuentra como una ocasional migrante en Europa Occidental.
La subespecie D. plexippus plexippus lleva a cabo una de las migraciones más extensas y abundantes de insectos. La generación invernal "matusalén", que emigra hacia el sur en el otoño, es mucho más longeva que las otras.[7] Otros lepidópteros con migraciones notables son: la esfinge colibrí (Macroglossum stellatarum), el almirante rojo (Vanessa atalanta) y la vanesa de los cardos (Vanessa cardui).
Sus alas son de color naranja con líneas negras y es fácilmente reconocible. La generación de otoño posee una gran resistencia y la longevidad de hasta nueve meses, mientras que otras generaciones pueden vivir hasta 24 días. Gracias a estas características puede viajar hasta 4000 kilómetros desde Canadá y el norte de Estados Unidos hasta los bosques de oyamel en el centro de México y de regreso.
D. plexippus es una de doce especies del género Danaus según algunos autores. Hay 6 subespecies (aunque también hay un poco de desacuerdo sobre esto). La subespecie más conocida es D. plexippus plexippus, que emigra desde México y California del sur hasta Canadá. Las restantes subespecies están distribuidas en América Central, el Caribe y el norte de Sudamérica, llegando hasta el Amazonas. Estas subespecies no participan del fenómeno migratorio descrito en otras secciones de este artículo.[8]
La monarca fue una de las muchas especies originalmente descritas por Carlos Linneo en su Systema naturæ de 1758 y fue primeramente incluida en el género Papilio.[9] En 1780, Jan Krzysztof Kluk usa a la monarca como especie tipo para el nuevo género Danaus. Como la gramática del latín requiere que el epíteto específico y el nombre genérico concuerden, no está claro si el género Danaus proviene de Dánao (griego Δαναός), un mítico rey de Egipto y bisnieto de Zeus o si es una versión masculinizada de Dánae (griego Δανάη), tataranieta de Dánao. El nombre de la especie: plexippus, se refiere a Plexipo, uno de los 50 hijos de Egipto, y hermano mellizo de Dánao.[10][11] En griego Homérico δαναος πληξιππος (danaos plexippos) también significa «un griego que doma caballos», es decir «auriga griego».
El nombre común «monarca» fue publicado en 1874 por el entomólogo y paleontólogo estadounidense Samuel Hubbard Scudder debido a que, en su opinión, «es una de las más grandes de nuestras mariposas, y cubre un vasto dominio».[10] Su nombre también lo fue en honor del rey Guillermo III de Inglaterra.[12]
En México se le conoce también como mariposa "cosechadora" ya que llega al centro del país durante la época de cosecha, y como "paloma".[13]
La mariposa monarca tiene una envergadura de entre 8,9 y 10,2 cm.[14] La hembra monarca tiene venas negras, gruesas en sus alas;[14] las del macho, además de ser más delgadas tienen una mancha oscura en el centro de una vena de cada ala posterior; es una glándula que produce feromonas,[15] y además, es ligeramente más grande. Los adultos pesan alrededor de medio gramo.
En general la mariposa monarca vive 4 días como huevo, 2 semanas como oruga, 10 días como crisálida y de 2 a 6 semanas como adulto o imago. Se reproduce principalmente en zonas abiertas, pastizales, campos de cultivo, etc., en donde crecen las asclepias (o algodoncillos) que necesita para el desarrollo de la larva.
Su ciclo de vida se inicia como un huevecillo que no mide más de 1 a 2 mm, depositado sobre una de estas asclepias. Esta fase dura de 3 a 8 días aproximadamente. De estos huevos surge una larva que comienza devorando los restos de su huevo para luego alimentarse de la planta sobre la que se realizó la puesta. Conforme se alimenta se convierte en una oruga robusta con el patrón rayado característico. La larva pasa por cinco estadios antes de convertirse en pupa.
Al finalizar la fase de larva, se forma una pupa para poder realizar la metamorfosis. De ella emerge el imago convertido en una mariposa coloreada en negro y naranja (raramente blanco), coloración aposemática que advierte a los depredadores de su sabor desagradable. Lo que le permite disuadirlos.
La duración de cada una de las etapas depende de varios factores, entre los cuales la temperatura es muy importante.
Lo realmente sorprendente de esta especie es que las mariposas nacidas a finales de verano y principios de otoño componen una generación especial (generación "matusalén"), que vive hasta 9 meses y realiza un ciclo completo de migración (ida y vuelta) desde Canadá hasta México siguiendo la ruta trazada por generaciones anteriores.[13] Durante esta migración las mariposas se van reuniendo en grandes grupos, llegando millones de ellas a los lugares de invernada.[7]
La subespecie D. plexippus plexippus de mariposa monarca es especialmente conocida por su larga migración anual. Realiza migraciones masivas hacia el sur, de agosto a octubre, mientras que migra hacia el norte en primavera.[16][17]
La población al este de las Montañas Rocosas, que incluye a más del 95 % de la población norteamericana, hiberna en los estados de México y Michoacán, México. La mayoría de los sitios de hibernación han sido incluidos en la Reserva de la Biosfera de la Mariposa Monarca. Estos santuarios fueron declarados en 2008 como Patrimonio Natural de la Humanidad por la UNESCO.
La población al oeste de las Montañas Rocosas, de mucho menor tamaño (menos del 5 %) que la población oriental, hiberna en varios lugares de la zona costera central de California, Estados Unidos, principalmente en Pacific Grove, y Santa Cruz. La generación que efectúa la migración es muy distinta a las otras generaciones. Los adultos de la generación migratoria viven hasta ocho o nueve meses. La manera en que la especie es capaz de volver a los mismos sitios de hibernación tras varias generaciones aún se investiga; los patrones de vuelo son heredados, basados en una mezcla de ritmos circadianos y la posición del sol en el cielo[18][19] que están basados en sus antenas.[20][21]
Es uno de los pocos insectos que logra realizar travesías transatlánticas. Unas cuantas mariposas monarca llegan al suroeste de Gran Bretaña y a España en los años de vientos favorables, e incluso se han instalado de forma permanente en las Islas Canarias desde 1804, en Tenerife y en los parques naturales del Estrecho y Los Alcornocales, en las provincias de Cádiz y Málaga, gracias al clima cálido y a la existencia de las plantas que necesitan para sobrevivir, introducidas por el hombre: la adelfilla, que debió llegar desde América Central durante el siglo XVI, y la mata de la seda, que vino de África en el XVIII.[22][23]
En el otoño (septiembre y octubre), las mariposas monarca de occidente realizan su viaje de migración desde Canadá a la costa de California en Estados Unidos para pasar el invierno en pequeños bosques de eucalipto, y las mariposas monarca de oriente viajan al centro de México para pasar el invierno en los bosques de oyamel y de pino, por arriba de los 3000 m, en los estados de México y Michoacán. En esta migración, las mariposas monarca viajan alrededor de 5000 km para pasar el invierno en México, donde permanecen aproximadamente cinco meses (noviembre a marzo). En la primavera, se inicia el apareamiento de las mariposas en México y su regreso hacia el norte a mediados de marzo. Esta generación migratoria, conocida como "matusalén" hace el viaje completo de norte a sur y parte del viaje de sur a norte.[cita requerida]
También existen poblaciones residentes de mariposas monarca que viven todo el tiempo en México sin ser parte de la migración, además de las otras subespecies distribuidas en el Caribe, América Central y norte de Sudamérica.[24][25]
La tala cerca de las áreas de anidación de las mariposas se suspendió. El 10 de noviembre de 2000, se creó, por decreto presidencial, la Reserva de la Biosfera Mariposa Monarca (el decreto de 2000), con lo que se amplió la reserva a 56 259 hectáreas (13 552 hectáreas de zonas núcleo y 42 707 hectáreas de zonas de amortiguamiento).[cita requerida]
Los colores amarillo y negro de la oruga y naranja y negro del adulto previenen a la mayoría de los depredadores sobre su contenido tóxico. Esta estrategia evolutiva funciona porque la mayoría de los depredadores asocia colores chillones (especialmente naranja, amarillo y negro), con veneno y otras propiedades desagradables. A este fenómeno se le llama aposematismo o coloración de aviso.
La mariposa monarca contiene glucósidos cardíacos en su cuerpo, tomados de las plantas de algodoncillo que las orugas comen; las integran en sus tejidos y resultan venenosas para los depredadores. Aunque la mayoría de los depredadores las evitan existen algunas especies que las comen. Por ejemplo, las monarcas que pasan el invierno en México son a menudo presas del picogrueso tigrillo que es inmune a la toxina. Otras aves como las calandrias han aprendido a comer sólo los músculos del tórax y el contenido del abdomen debido a que estos contienen menos veneno que el resto del cuerpo.[26] Algunos ratones son capaces de soportar grandes dosis de veneno. Con el tiempo, las monarcas adultas que pasan el invierno son menos tóxicas, lo que las hace más vulnerables a los depredadores. En México, alrededor del 14 % de las monarcas que hibernan son comidas por aves y ratones.[27]
Las monarcas comparten una defensa por su apariencia muy similar con la mariposa virrey (no venenosa, aunque recientemente se ha comprobado que tiene mal gusto para los depredadores), en un ejemplo de mimetismo mülleriano, aunque ambas especies pertenecen a subfamilias diferentes.[28]
En la isla de Oahu en Hawái, las monarcas se introdujeron en 1965 y 1966. Algunas aves insectívoras comunes de la familia Pycnonotidae como Pycnonotus cafer y el bulbul orfeo son las únicas que se aprovechan de los insectos grandes como la monarca. Se sabe que estas mariposas tienen bajos niveles de toxina a base de glucósidos cardíacos y esas aves pueden ser tolerantes a estas sustancias químicas. Una vez asentada en el archipiélago la monarca de Hawái adoptó un importante polimorfismo genético en menos de 40 años al adoptar el color blanco para aumentar su tasa de supervivencia, mayor que las monarcas de tonalidades naranjas. Esto se debe a la selección apostática (depredación selectiva que se ejerce preferentemente sobre el genotipo más abundante, en este caso, la mariposa de color naranja, dando como resultado una distribución genotípica más equilibrada en la población), ya que las aves han aprendido que las monarcas de color naranja son comestibles.[29]
En 1975 el mundo científico descubrió los sitios de hibernación de la migración de la Mariposa Monarca en el centro de México. El trabajo del zoólogo canadiense Fred Urquhart y su esposa Nora R. Urquhart se inició en 1937 culminando en 1975 con uno de los descubrimientos más asombrosos de ese siglo. Fred y Nora Urquhart reunieron a miles de voluntarios para poner minúsculas etiquetas en las alas de las mariposas monarca y así poder documentar su ruta migratoria. Su historia se describe en la reciente película "Flight of the Butterflies".[6]
Ken Brugger y su esposa Catalina Aguado residentes de la Ciudad de México se unieron al proyecto de Fred y Nora Urquhart en 1973 para buscar los sitios de hibernación. Los encontraron en 1975 en el Cerro Pelón.[9]
La mariposa monarca ha sido parte de la ciencia ciudadana desde el trabajo de Fred Urquhart quien reunió alrededor de 6000 voluntarios. En Estados Unidos Journey North[11] ha documentado su migración a través de ciencia ciudadana y en México "el correo real" lo ha hecho desde los años 80.[12]
Posteriormente, en 1996, los científicos Leonard Wassenaar y Keith Hobson estudiaron la ruta completa de la mariposa mediante una técnica de estudio del deuterio, isótopo del hidrógeno del agua presente en las alas de las mariposas. El método les permite estudiar la migración de las mariposas sin necesidad de ponerles marcas, ni de tener que capturarlas de nuevo.[16]
Desde entonces, los investigadores profesionales estudian a la mariposa monarca con ese método.[19]
El área ocupada por las colonias en México ha ido disminuyendo paulatinamente. Durante los años 90 el promedio de ocupación era de alrededor de 6 hectáreas. Durante los pasados cuatro años el promedio de ocupación ha sido de 2 hectáreas. Las causas que afectan a las mariposas Monarca son distintas en el continente. En Estados Unidos y Canadá las principales causas son la pérdida de algodoncillo por los herbicidas, la pérdida de hábitat por el desarrollo urbano y suburbano y el uso de insecticidas. En México, las principales causas son el deterioro del hábitat de hibernación debido a su transformación en áreas de cultivo y a la tala ilegal.
Existen programas por parte del gobierno (SEMARNAT) para evitar la tala clandestina en las reservas que utiliza la mariposa, así como acciones para preservar las regiones y fomentar el turismo responsable.[34]
Las deforestaciones cometidas a finales del siglo XX y comienzos de la primera década del siglo XXI en las zonas de hibernación de la monarca contribuyeron a una drástica reducción en la población de mariposas. Se promovió su declaración de especie protegida y la restauración de su hábitat.
Por otro lado, los organismos genéticamente modificados (OGM) del tipo «Bt» le son fatales.[35] Sin embargo, es importante remarcar que ese estudio solo se basa en ensayos en laboratorio, y es fuertemente cuestionado por carecer de experiencias de campo.[36]
|coautores= (ayuda) |coautores= (ayuda) La mariposa monarca (Danaus plexippus) es una especie de lepidóptero ditrisio de la familia Nymphalidae, superfamilia Papilionoidea. Es quizás la más conocida de todas las mariposas de América del Norte. Desde el siglo XIX ha sido introducida en Nueva Zelanda y en Australia. En el Atlántico es residente en las Islas Canarias, Azores, Madeira y Andalucía, y se encuentra como una ocasional migrante en Europa Occidental.
La subespecie D. plexippus plexippus lleva a cabo una de las migraciones más extensas y abundantes de insectos. La generación invernal "matusalén", que emigra hacia el sur en el otoño, es mucho más longeva que las otras. Otros lepidópteros con migraciones notables son: la esfinge colibrí (Macroglossum stellatarum), el almirante rojo (Vanessa atalanta) y la vanesa de los cardos (Vanessa cardui).
Sus alas son de color naranja con líneas negras y es fácilmente reconocible. La generación de otoño posee una gran resistencia y la longevidad de hasta nueve meses, mientras que otras generaciones pueden vivir hasta 24 días. Gracias a estas características puede viajar hasta 4000 kilómetros desde Canadá y el norte de Estados Unidos hasta los bosques de oyamel en el centro de México y de regreso.
Monarhliblikas (Danaus plexippus) on koerlibliklaste sugukonda kuuluv liblikas.
Monarhliblikad teevad pikki rändeid.
Nad elavad Kesk- ja Põhja-Ameerikas.
Monarka-tximeleta (Danaus plexippus) tximeleta espezie bat da, Nymphalidae familian sailkatuta dagoena. Ipar Amerikako tximeletarik ezagunenetariko bat da.
Monarka-tximeleta (Danaus plexippus) tximeleta espezie bat da, Nymphalidae familian sailkatuta dagoena. Ipar Amerikako tximeletarik ezagunenetariko bat da.
Monarkkiperhonen (Danaus plexippus) on täpläperhosten (Nymphalidae) heimoon kuuluva suurikokoinen päiväperhonen. Monarkkiperhosen alalaji Danaus plexippus plexippus vaeltaa Pohjois-Amerikassa vuosittain pitkiä matkoja Suurten järvien ja Meksikon välillä, alalaji Danaus plexippus megalippe ei vaella ja se esiintyy Yhdysvaltain Georgiasta ja Floridasta Länsi-Intian saarille ja sieltä Keski-Amerikan kautta Amazonasin alueelle.
Monarkkiperhosen siipien kärkiväli on noin 8,5–12,5 cm. Koiraan siipien yläpuolen pääväri on kastanjanruskea. Siipien suonien kohdat ja reunat ovat mustat. Reunassa on kaksi riviä valkeita täpliä. Koiraalla on takasiipien yläpinnalla koirastäplä, joka tuottaa feromoneja. Siipien alapinnan pääväri on vaaleampi kuin yläpinnan. Naaraan siipien pääväri on vaaleampi kuin koiraalla ja siipisuonet tummempia.
Monarkkiperhosen alkuperäiseen levinneisyysalueeseen kuuluu Amerikassa alue Kanadan eteläosista Amazonasin alueelle. Laji on levinnyt 1800-luvulla uusille alueille sopeuduttuaan uusiin ravintokasveihin. Sitä tavataan myös Australiassa ja Uudessa-Seelannissa. Atlantin itäpuolella sen esiintymisalueeseen kuuluvat Kanariansaaret Lanzarotea lukuun ottamatta, Azorit ja Madeira. Monarkkiperhonen puuttuu Aasian, Afrikan ja Euroopan mantereilta, mutta on satunnaisena vaeltajana tavattu monissa Atlantin rannikon maissa Euroopassa. Lentoaika on ympäri vuoden useina sukupolvina, ensimmäinen sukupolvi huhtikuusta alkaen.
Monarkkiperhonen elää monenlaisissa ympäristöissä. Se muuttaa Pohjois-Amerikassa sankoin joukoin etelään elokuusta alkaen. Itäinen kanta muuttaa Meksikon keskiosiin, läntinen talvehtii Kalifornian rannikon keskiosissa. Talvehtinut kanta alkaa yleensä lisääntyä vasta sen jälkeen, kun se jättää talvehtimispaikkansa helmi-maaliskuussa. Itäinen kanta muuttaa keväällä suunnilleen Yhdysvaltojen Teksasiin ja Oklahomaan. Vasta seuraavat sukupolvet muuttavat pohjoisemmaksi Yhdysvalloissa ja Kanadaan.
Toukan ravintokasveja ovat alkuperäisillä esiintymisalueilla monet Asclepias-suvun lajit, Kanariansaarilla Gossypium arboreum ja Euphorbia mauretanica.
Monarkkiperhonen (Danaus plexippus) on täpläperhosten (Nymphalidae) heimoon kuuluva suurikokoinen päiväperhonen. Monarkkiperhosen alalaji Danaus plexippus plexippus vaeltaa Pohjois-Amerikassa vuosittain pitkiä matkoja Suurten järvien ja Meksikon välillä, alalaji Danaus plexippus megalippe ei vaella ja se esiintyy Yhdysvaltain Georgiasta ja Floridasta Länsi-Intian saarille ja sieltä Keski-Amerikan kautta Amazonasin alueelle.
Danaus plexippus
Le Monarque (Danaus plexippus) est une espèce principalement américaine de lépidoptères de la famille des Nymphalidae et de la sous-famille des Danainae.
Ce grand papillon est célèbre pour ses migrations de grande ampleur en Amérique, où il se déplace par groupes de millions d'individus sur des distances pouvant atteindre 4 000 km[1], deux fois par an, d'août à octobre vers le sud (surtout au Mexique), et au printemps vers le nord.
L'imago du Monarque est un grand papillon, dont l'envergure varie de 8,6 à 12,4 cm[5], pour une masse d'environ 0,5 g[6]. Les ailes et le corps sont légèrement plus petits au sein des populations qui ne migrent pas[7]. Ses motifs alaires consistent en un fond orangé, veiné (les nervures étant surlignées de noir) et bordé de noir, l'apex et la bordure des ailes étant ornés d'une double rangée de points blancs. L'apex des ailes antérieures est noir, avec des taches blanches et orange. Le dessous des ailes est similaire, mais avec l’apex jaune brunâtre, les taches blanches plus grandes pour les ailes antérieures, et une couleur de fond plus pâle pour les ailes postérieures. Les pattes antérieures noires ne sont pas adaptées à la marche. La tête et le thorax sont eux aussi noirs, pointillés de blanc[8].
Au stade adulte, le Monarque présente un dimorphisme sexuel. Les mâles sont plus grands que les femelles, mais leurs ailes sont plus minces[9]. Ils présentent une teinte orangée plus éclatante. Sur la face dorsale de leurs ailes postérieures, les mâles portent une androconie, une tache sur la nervure centrale. Les femelles n'ont pas cette tache, mais présentent une nervure plus large[10].
Il existe une forme rare de monarques qui sont blancs au lieu d'être orange. Ce phénotype, appelé nivosus, a été observé en Australie, en Nouvelle-Zélande, en Indonésie et aux États-Unis. Il représente généralement seulement 1 % des individus, à l'exception d'Oahu, une île de Hawaï, où le phénotype nivosus a déjà représenté près de 10 % des individus[11]. Cette coloration est due à une homozygotie pour un allèle récessif[12] d'un gène impliqué dans la production de la myosine[13].
Le Vice-roi (Limenitis archippus) a des motifs similaires au Monarque, mais il est plus petit (envergure de 5,3 à 8,1 cm) et ses ailes postérieures portent une bande transversale noire (voir image ci-contre). Pendant plus de cent ans, on a supposé que cette similitude était un cas de mimétisme batésien, c'est-à-dire que le Vice-roi était évité par les prédateurs parce qu'il ressemble à une espèce indigeste, en l'occurrence le Monarque. Toutefois, une analyse rigoureuse a montré qu'il s'agit en fait d'un cas de mimétisme mullérien, dans lequel les deux espèces sont indigestes, leur ressemblance renforçant ainsi leur protection contre la prédation[14].
Le Papillon-Reine (Danaus gilippus), congénère du Monarque, ressemble aussi à ce dernier, surtout par sa face ventrale. Les deux espèces peuvent être confondues là où leurs aires de répartition se chevauchent, c'est-à-dire en Amérique centrale, dans le Nord de l'Amérique du Sud et le Sud de l'Amérique du Nord.
Enfin, certaines vanesses ressemblent très superficiellement au Monarque : c'est le cas de la Belle-Dame (Vanessa cardui), dont la face dorsale présente les mêmes couleurs mais des motifs différents, et qui est de taille nettement inférieure.
La chenille du Monarque passe par cinq stades, séparés par des mues, avant de former une chrysalide. À chaque stade, la chenille est plus grosse qu'au précédent. En sortant de l'œuf, la jeune chenille est vert pâle et translucide. Elle ne porte pas de motif ni de filament. Elle mesure de 2 à 6 mm de long et 0,5 à 1,5 mm de large. C'est après avoir mué une première fois que la chenille arbore le motif typique de bandes noires, blanches et jaunes. Une paire de filaments noirs apparait à chaque extrémité du corps. Après la deuxième mue, les bandes colorées sont plus distinctes et les filaments sont plus longs. Les pattes se différencient en une petite paire près de la tête et deux autres paires plus grosses à l'arrière du thorax. Après la troisième mue, la chenille porte des taches blanches sur les fausses pattes arrière. Au dernier stade de la chenille, qui vient après la quatrième mue, les motifs sont plus complexes, les taches blanches sur les fausses pattes sont toujours présents et les pattes avant sont très près de la tête. À ce stade, la chenille mesure de 2,5 à 4,5 cm de long et de 5 à 8 mm de large.
Œufs sous les feuilles d'un arbre à ballon (Asclepias physocarpa)
Les couleurs vives de cette espèce, tant au stade larvaire (chenille) qu'au stade adulte (imago), sont supposées être un signal d'avertissement pour d'éventuels prédateurs, phénomène appelé aposématisme. Les œufs sont pondus sur des plants d'asclépiades, qui contiennent des alcaloïdes et des cardénolides toxiques pour de nombreux animaux mais pas pour le Monarque. La résistance du Monarque au glucoside produit par les asclépiades, qui bloque la pompe sodium-potassium (une enzyme responsable du retour ou du maintien au repos des cellules excitables) chez la plupart des animaux, est due à des mutations de cette enzyme qui présente alors une très faible affinité pour le glucoside[15]. À la suite de l'éclosion de son œuf, la chenille consomme les feuilles d'asclépiade, séquestre et emmagasine les cardénolides (un stéroïde), ce qui la rend indigeste pour ses prédateurs vertébrés, les oiseaux principalement.
Malgré ce poison, le Monarque est consommé par divers prédateurs tels que certaines guêpes (dont Trichogramma pretiosum (sv)), certains oiseaux (notamment le Cardinal à tête noire, l'Oriole d'Abeillé et certains gros-becs), des mammifères comme la Souris à oreilles noires et même un nématode (Steinernema carpocapsae (en))[15]. Les orioles, après avoir mangé le papillon, vomissent le poison[16], mais la plupart des autres prédateurs sont immunisés, par un mécanisme analogue à celui qui induit la résistance du Monarque (des mutations sur différents sites de la pompe sodium-potassium)[15].
Multivoltin, le Monarque produit plusieurs générations par an, dont les imagos successifs sont principalement visibles d'avril à octobre, et observe une diapause de la fin de l'automne au printemps.
Début de l'émergence (sortie de la chrysalide).
La chenille accepte de très nombreuses plantes-hôtes, surtout des asclépiades (Asclepias amplexicaulis, A. cordifolia, A. curassavica, A. eriocarpa, A. exaltata, A. fascicularis, A. fruticosa, A. grandiflora, A. humistrata, A. incarnata, A. lanceolatum, A. mexicana, A. nitida, A. nivea, A. phytolaccoides, A. purpurascens, A. rotundifolia, A. rubra, A. semilunata, A. speciosa, A. sullivanti, A. syriaca, A. tomentosa, A. tuberosa, A. verticillata), mais aussi des Araujia (Araujia hortorum, A. sericifera), Cynanchum dalhousieae, Ceropegia intermedia, Stephanotis floribunda, Raphistemma pulchellum, Calotropis gigantea, Calotropis procera, des Gomphocarpus (Gomphocarpus arborescens, G. fruticosus, G. physocarpus), Gonolobus laevis, Gonolobus rostratus, des Marsednia, Matelea reticulata, Oxypetalum coeruleum, Stapelia variegata et Stapelia grandiflora[4].
Espèce ubiquiste, le Monarque est présent dans une grande partie de l'Amérique du Nord (atteignant au nord le 50e parallèle), aux Antilles, en Amérique centrale et dans le Nord de l'Amérique du Sud (il est remplacé plus au sud par Danaus erippus), mais aussi dans plusieurs îles éloignées de l'Amérique, par exemple aux îles Canaries, à Hawaï, en Australie, en Nouvelle-Zélande, en Nouvelle-Guinée, en Nouvelle-Calédonie et jusqu'aux Mascareignes[4],[17].
En Europe, il est observé en tant que migrateur occasionnel aux Açores et au Portugal, et il est un migrateur exceptionnel en France, en Grande-Bretagne et en Irlande[18].
Ses biotopes sont divers, suivant les saisons. Il se plaît dans toute l'Amérique, mais passe l'hiver dans des forêts de sapins sacrés de l'État de Michoacán, au Mexique.
Les papillons monarques migrent de septembre à novembre à partir de leur habitat de plus de 100 millions d'hectares en Amérique du Nord et partent vers la Sierra Nevada mexicaine, où ils se rassemblent sur moins de 20 hectares dans les hautes forêts de l'État du Michoacán pour passer l'hiver[19]. Lors de leur migration, ils se retrouvent chaque année aux mêmes lieux de repos et forment de grandes colonies pendant la nuit. Lorsque les températures sont basses et les vents forts, les papillons de nuit se rapprochent et forment des colonies encore plus grandes. Les papillons sont tellement nombreux qu'il est possible de les entendre voler[19]. Lorsque la température est inférieure à 10 °C, les papillons de nuit ne peuvent pas voler et, si le temps n'est pas favorable, ils se reposent également pendant la journée. En cas d'ensoleillement et au-dessus de 13 °C, ils peuvent poursuivre leur migration. Pour la migration du Canada vers le Mexique, les papillons de nuit ont besoin de huit à dix semaines, ceux des régions plus méridionales de quatre à six semaines. En moyenne, ils parcourent environ 80 à 120 kilomètres par jour[20]. Au cours de leur migration, de nombreux papillons de nuit meurent. À certains endroits, les rives des grands lacs sont jonchées de papillons morts. En tout les papillons vont parcourir en moyenne 4 000 kilomètres[19].
L'un des aspects les plus curieux de la migration des monarques est que leur voyage du Sud au Nord se fait en plusieurs générations[19], alors que le voyage du Nord au Sud se fait en une seule. Les monarques naissant en automne entrent dans une phase de diapause, ce qui leur permet de survivre toute la durée de l'hiver. Cela leur permettra de migrer de la région des grands lacs et du sud de la Californie vers l'état du Michoacán au Mexique, où ils vivront à l'état d'inactivité dans des forêts de sapins sacrés (ou oyamel). Les monarques y sont présents en nombre si important qu'on ne peut parfois même plus distinguer la moindre parcelle d'écorce où ils se posent. Les monarques se regroupent en essaims la nuit et prennent leur envol le jour, si la température est suffisamment élevée.
Arrivés au Mexique, les papillons pondent leurs œufs sur des aslépiades et meurent[21]. Leurs descendants reprennent alors la migration, cette fois vers le nord et les générations successives remontent progressivement le continent jusqu'à l'automne[21].
Tout ce cycle est nécessaire pour que les monarques prennent des forces pour la reproduction qui aura lieu en mars, juste avant de prendre leur envol pour le Nord. Le voyage vers le Nord prendra plusieurs générations. La durée de vie normale d'un monarque est d'environ deux mois l'été, et de plus de sept mois pour la forme hivernale[22].
Les raisons de cette migration et comment les papillons retrouvent le même lieu que leurs prédécesseurs après plusieurs générations demeurent partiellement énigmatiques. On sait que le Monarque utilise un genre de compas solaire situé dans son cerveau moyen, et des horloges circadiennes localisées dans leurs antennes[20],[23]. Des chercheurs ont montré qu'une légère baisse de température est le signal pour entamer la migration vers le nord[24].
L'espèce Danaus plexippus a été décrite en 1758 par l'entomologiste suédois Carl von Linné[25], sous le nom initial de Papilio plexippus, et avec pour localité type Kendall, dans l’État de New York aux États-Unis. Elle est l'espèce type du genre Danaus Kluk, 1780.
Plusieurs sous-espèces ont été décrites[4],[26] :
Étant donné la diminution importante des populations de monarques observée au Mexique[27] et en Californie[28] depuis les années 1990, la situation de l'espèce préoccupe plusieurs groupes environnementaux et gouvernements. Au Canada, le Monarque est une espèce en voie de disparition[29]. Aux États-Unis, l'espèce est en évaluation pour déterminer si elle sera inscrite à l'Endangered Species Act[30].
L'agriculture industrielle et la pollution générale de l'environnement par les insecticides, mais surtout l'usage des désherbants qui élimine ou fait fortement reculer l'asclépiade des zones d'élevages et/ou cultivées constituent quelques causes de sa régression. La surface d'hivernage (approximation de la population) des monarques a été divisée par 3 entre les décennies 1993-2003 et 2004-2013 [27]. Le déboisement des forêts, l’érosion des sols menacent aussi les forêts mexicaines du Michoacán, où le Monarque a l'habitude d'hiverner.
D'après une étude de 1999, les OGM de type Bt pourraient ralentir la croissance et augmenter le taux de mortalité des chenilles[31]. Cette étude ne se fondait cependant que sur des essais en laboratoire, au cours desquelles des chenilles du Monarque ont reçu des feuilles d'asclépiades saupoudrées de pollen de maïs OGM, l'espèce ne consommant pas les plantes cultivées OGM directement. Elle a été fortement remise en question à la suite d'essais au champ qui ont montré que les dépôts de pollen étaient trop limités pour reproduire les effets observés en laboratoire[32]. En revanche le meilleur désherbage des champs et des abords permis par l'utilisation des OGM Roundup Ready a réduit la quantité de nourriture disponible pour les larves de 20 % et pourrait expliquer le déclin des populations de Monarque[33], auquel s'ajouterait une réduction des surfaces de plante hôte en milieu naturel du fait de l'augmentation des surfaces forestières et urbaines. Les asclépiades étant toxiques pour les vertébrés, elles sont souvent détruites quand elles se développent à l'intérieur et en marge de pâture. Les auteurs conseillent de réaliser des plantations d'asclépiades dans le Midwest, en dehors des zones agricoles, par exemple au bord des routes, pour compenser cette réduction du biotope.
Parmi les autres hypothèses avancées, il y a le changement du ratio mâle/femelle. En effet, la proportion de femelles décline depuis 30 ans[34]. D'après les auteurs, il s'agirait d'un parasite, Ophryocystis elektroscirrha, dont l'impact négatif affecterait plus les femelles que les mâles. Un projet de science citoyenne, MonarchHealth, a été mis sur pied pour mieux comprendre l'incidence de ce parasite sur le Monarque.
En tant qu'espèce emblématique, le Monarque bénéficie des programmes spécifiques et d’un plan stratégique de protection, au nord (protection d'habitats abritant des asclépiades, sensibilisation de la population invitée à suivre la migration[35]), et au sud (avec notamment la promotion d'un écotourisme local à proximité des zones de reproduction). Le Jardin des papillons de Saint-Pierre (Martinique) participe à la protection de plusieurs espèces de papillons dont le Monarque.
Depuis les années 2000, la population de monarques a chuté de 80%. Mais en 2019, les scientifiques annoncent que les monarques sont presque deux fois plus nombreux que l'année précédente dans leurs colonies hivernales (Mexique). Un rapport récent du WWF confirme que leur déclin semble enrayé[réf. souhaitée].
La réserve de biosphère du papillon Monarque est une aire protégée de 56 259 ha située au Mexique, dans le Michoacán et l'État de México, et qui vise à protéger sept importantes zones d'hivernage du Monarque. Cette réserve a été inscrite au patrimoine de l'humanité en 2008[16],[36].
L'imago du Monarque figure sur un timbre de Nouvelle-Calédonie de 1967[37], sur un timbre du Vanuatu[38], sur un timbre de Cuba de 1991[39], sur un timbre du Canada de 1995[40] et sur une émission commune du Mexique et de la Jamaïque de 2016[41].
La chenille figure sur un timbre du Canada de 2009.
Danaus plexippus
Le Monarque (Danaus plexippus) est une espèce principalement américaine de lépidoptères de la famille des Nymphalidae et de la sous-famille des Danainae.
Ce grand papillon est célèbre pour ses migrations de grande ampleur en Amérique, où il se déplace par groupes de millions d'individus sur des distances pouvant atteindre 4 000 km, deux fois par an, d'août à octobre vers le sud (surtout au Mexique), et au printemps vers le nord.
Féileacán mór ildathach. Na sciatháin scothdhonn flannbhuí, marcáilte le patrúin dhubha. Eitlíonn sé go mall, ach déanann imirce thar fhaid ollmhóra ó Mheicsiceo go Ceanada.
Leptir Monarh (Danaus plexippus) veliki je leptir (raspon krila od 89 do 102 mm) iz porodice šarenaca, osnovna boja krila je narančasta. Stražnja krila su nešto svjetlija pa se na njima ističu tamna rebra. Ženke imaju tamnije "vene" na svojim krilima, dok mužjaci imaju tamnu točku na središtu stražnjih krila, tzv. androconium, iz kojega se otpuštaju feromoni. Mužjaci su također i nešto krupniji.
Leptir Monarh je leptir selac, te je najpoznatiji po svojoj osmomjesečnoj seobi na sjever Stjenjaka u istočnoj Kanadi i natrag prema jugu u meksička zimovališta, udaljena oko 4.000 km[1]. Kako pronađu svoj put do zimilišta i natrag u svom epskom putovanju, pri kojemu se smijene četiri gereracije leptira, njihova krila stvore zvuk koji podsjeća na padanje kiše, a mnoge grane u rezervatu se oboje u narančasto i doslovno saviju pod težinom velikih skupina leptira, još uvijek ostaje tajnom. Zbog toga je Rezervat biosfere leptira Monarha u Meksiku upisan na UNESCO-v popis mjesta svjetske baštine u Amerikama 2008. godine[2].
Leptir Monarh je od 1871. godine zabilježen i u Australiji i Novom Zelandu, gdje ga zovu "Lutalica" (en. Wanderer). Također je udomaćen na Azorima i Madeiri, a ponekad se može pronaći i u Zapadnoj Europi, te ga u Ujedinjenom Kraljevstvu zovu "Mliječni-korov" (Milkweed) po biljki kojom se hrani iz porodice Svilenica.
![]() Nedovršeni članak Monarh (leptir) koji govori o biologiji treba dopuniti. Dopunite ga prema pravilima Wikipedije.
Nedovršeni članak Monarh (leptir) koji govori o biologiji treba dopuniti. Dopunite ga prema pravilima Wikipedije.
Leptir Monarh (Danaus plexippus) veliki je leptir (raspon krila od 89 do 102 mm) iz porodice šarenaca, osnovna boja krila je narančasta. Stražnja krila su nešto svjetlija pa se na njima ističu tamna rebra. Ženke imaju tamnije "vene" na svojim krilima, dok mužjaci imaju tamnu točku na središtu stražnjih krila, tzv. androconium, iz kojega se otpuštaju feromoni. Mužjaci su također i nešto krupniji.
Kupu-kupu Raja adalah jenis kupu-kupu yang termasuk ke dalam famili Danaidae.[3] Kupu-kupu ini memakan tanaman perdu tahunan, Asclepias L. yang merupakan tanaman beracun pada sebagian hewan.[3] Senyawa kimia dari tanaman tersebut akan terakumulasi hingga kupu-kupu mencapai fase dewasa dan menjadi pertahanan dirinya.[3] Predator, seperti burung akan menghindari kupu-kupu Raja karena rasanya yang tidak enak untuk dimakan.[3] Kupu-kupu ini memiliki sayap berwarna coklat terang dengan batas garis hitam dan titik-titik putih.[3] Setiap tahunnya, kupu-kupu ini dapat bermigrasi dari wilayah Kanada ke Meksiko yang berjarak tempuh 4.500 km dengan jarak tempuh 80 km per hari.[4] Populasi kupu-kupu ini akan tiba di Meksiko pada awal November dan tinggal di daerah hutan cemara Michoacan hingga bulan Februari.[4]
|coauthors= yang tidak diketahui mengabaikan (|author= yang disarankan) (bantuan); line feed character di |coauthors= pada posisi 47 (bantuan) Kupu-kupu Raja adalah jenis kupu-kupu yang termasuk ke dalam famili Danaidae. Kupu-kupu ini memakan tanaman perdu tahunan, Asclepias L. yang merupakan tanaman beracun pada sebagian hewan. Senyawa kimia dari tanaman tersebut akan terakumulasi hingga kupu-kupu mencapai fase dewasa dan menjadi pertahanan dirinya. Predator, seperti burung akan menghindari kupu-kupu Raja karena rasanya yang tidak enak untuk dimakan. Kupu-kupu ini memiliki sayap berwarna coklat terang dengan batas garis hitam dan titik-titik putih. Setiap tahunnya, kupu-kupu ini dapat bermigrasi dari wilayah Kanada ke Meksiko yang berjarak tempuh 4.500 km dengan jarak tempuh 80 km per hari. Populasi kupu-kupu ini akan tiba di Meksiko pada awal November dan tinggal di daerah hutan cemara Michoacan hingga bulan Februari.
♂
♀
La monarca (Danaus plexippus (Linnaeus, 1758)) è una farfalla della famiglia Nymphalidae, nativa dell'America. È probabilmente la farfalla più conosciuta di tutto il Nord America. La Monarca è l'“insetto nazionale” degli stati dell'Alabama, Idaho, Illinois e Texas, e la “farfalla nazionale” del Minnesota, Vermont e Virginia Occidentale. Nel 1989 è stata nominata "insetto nazionale" degli Stati Uniti d'America.
Ha una vivace livrea arancione con nervature costali dai contorni neri e due serie di macchie bianche lungo il bordo delle ali. L'apertura alare varia dai 7,5 ai 10 cm.
Il bruco è a strisce nere, gialle e bianche.
Le larve si sviluppano su piante del genere Asclepias e su altre Asclepiadaceae. Lo sviluppo, dall'uovo all'adulto, si completa in circa 30 giorni.
Il numero delle generazioni annue varia a seconda delle condizioni climatiche.
Larva del 2º stadio e uovo
Bruco che si nutre di fiori di Asclepias curassavica
Larva matura
Ha una notevole resistenza al volo il che le consente di compiere lunghe migrazioni.
Eccezionalmente un individuo di questa specie ha volato per 2112 km in 46 giorni. Questo favorisce la dispersione della specie, che occasionalmente è stata rinvenuta anche in zone molto lontane dall'areale originario.
Le popolazioni del Nord America compiono invece migrazioni periodiche tra le regioni più settentrionali, dove è presente solo nella stagione estiva, e le zone di svernamento , orientandosi con uno speciale senso chiamato "magnetoricezione". In autunno le farfalle volano verso sud, formando gruppi di migliaia di individui. Quelle degli Stati Uniti occidentali raggiungono alcune zone montuose della California tra San Francisco e Los Angeles, dove trascorrono l'inverno in uno stato di semi-ibernazione aggrappate a decine di migliaia ai tronchi e ai rami degli alberi. Quelle del Canada meridionale e degli Stati Uniti centrali e orientali raggiungono una piccola valle situata in Messico a 3000 m s.l.m. di altitudine, dove durante l'inverno si concentrano oltre 14 milioni di farfalle in un ettaro e mezzo di superficie. Nella primavera successiva, dopo gli accoppiamenti, gli individui di entrambi i sessi iniziano il viaggio di ritorno, durante il quale alcune femmine si fermano a deporre le uova; in alcuni casi è la generazione successiva a completare il viaggio ricolonizzando le regioni più settentrionali. Le migrazioni a Nord verso il Canada, avvengono in 3 generazioni, il ritorno in Messico avviene invece in un'unica generazione: questo è un raro caso di migrazione in più generazioni.
Sia le larve che gli adulti presentano vivaci colorazioni aposematiche, che li difendono dai predatori vertebrati, avvertendoli della presenza di sostanze tossiche (cardenolidi) che li rendono inappetibili. Queste sostanze vengono assimilate durante lo sviluppo larvale dalle specie di Asclepias di cui il bruco si nutre.
È distribuita in quasi tutta l'America, dal Canada meridionale al Rio delle Amazzoni. A partire dal diciannovesimo secolo è stata trovata anche in Indonesia, in Nuova Zelanda e in Australia, dove è conosciuta come farfalla migratrice. In Europa è residente nelle isole Canarie e a Madera, mentre nelle Azzorre, in Portogallo e in Spagna compaiono occasionalmente individui migranti.
Secondo la revisione di Smith et al. (2005) si distinguono due sottospecie:
La monarca (Danaus plexippus (Linnaeus, 1758)) è una farfalla della famiglia Nymphalidae, nativa dell'America. È probabilmente la farfalla più conosciuta di tutto il Nord America. La Monarca è l'“insetto nazionale” degli stati dell'Alabama, Idaho, Illinois e Texas, e la “farfalla nazionale” del Minnesota, Vermont e Virginia Occidentale. Nel 1989 è stata nominata "insetto nazionale" degli Stati Uniti d'America.
Kupu-kupu Monarch (Danaus plexippus) ialah satus spesies kupu-kupu yang tergolong dalam subkeluarga Danainae dalam keluarga Nymphalidae. Ia boleh dikatakan sebagai kupu-kupu yang paling terkenal di seluruh Amerika Utara. Sejak abad ke-19, ia turut ditemui di New Zealand, dan juga Australia sejak tahun 1871 dengan jolokan Wanderer (kelana).[3][4][5] Ia juga mendiami Kepulauan Canary, Azores, dan Madeira, dan adakalanya berpindah ke Eropah Barat dan jarang sekali United Kingdom.[6] Kupu-kupu Monarch terkenal dengan corak jingga hitam yang menonjol pada kepaknya yang lebarnya 8.9–10.2 centimetres (3½–4 in).[7] (Kupu-kupu Viceroy serupa saiz, warna, dan coraknya, tetapi boleh dibezakan dengan satu jalur hitam tambahan pada kepak belakangnya.) Monarch yang betina lebih gelap urat pada kepaknya, sementara yang jantan mempunyai bintik androconium yang merembeskan feromon di pusat setiap kepak belakang[8]. Yang jantun juga lebih besar sedikit berbanding yang betina.
Kupu-kupu Monarch terkenal kerana tabiat berpindah-randah secara berulang-alih mengikut musim dari Kanada ke Mexico dan Baja California yang mengambil masa hayat tiga atau empat keturunan kupu-kupu berkenaan.
|coauthors= tidak diketahui diabaikan (guna |author=) (bantuan) |work= (bantuan) |publisher=, |work= (bantuan) Kupu-kupu Monarch (Danaus plexippus) ialah satus spesies kupu-kupu yang tergolong dalam subkeluarga Danainae dalam keluarga Nymphalidae. Ia boleh dikatakan sebagai kupu-kupu yang paling terkenal di seluruh Amerika Utara. Sejak abad ke-19, ia turut ditemui di New Zealand, dan juga Australia sejak tahun 1871 dengan jolokan Wanderer (kelana). Ia juga mendiami Kepulauan Canary, Azores, dan Madeira, dan adakalanya berpindah ke Eropah Barat dan jarang sekali United Kingdom. Kupu-kupu Monarch terkenal dengan corak jingga hitam yang menonjol pada kepaknya yang lebarnya 8.9–10.2 centimetres (3½–4 in). (Kupu-kupu Viceroy serupa saiz, warna, dan coraknya, tetapi boleh dibezakan dengan satu jalur hitam tambahan pada kepak belakangnya.) Monarch yang betina lebih gelap urat pada kepaknya, sementara yang jantan mempunyai bintik androconium yang merembeskan feromon di pusat setiap kepak belakang. Yang jantun juga lebih besar sedikit berbanding yang betina.
Kupu-kupu Monarch terkenal kerana tabiat berpindah-randah secara berulang-alih mengikut musim dari Kanada ke Mexico dan Baja California yang mengambil masa hayat tiga atau empat keturunan kupu-kupu berkenaan.
De monarchvlinder[1] (Danaus plexippus), ook wel monarch of Amerikaanse monarch,[2] is een vlinder uit de familie Nymphalidae.
De monarchvlinder is een van de bekendste vlindersoorten van Noord-Amerika. De Noord-Amerikaanse populaties trekken in de lente in grote aantallen naar het noorden, waarbij zich verschillende generaties ontwikkelen, en keren in de herfst weer terug naar het zuiden, waar de soort in enorme groepen overwintert. De monarchvlinder is een vrij grote vlinder. De totale lichaamslengte is ongeveer 5 centimeter en de spanwijdte bedraagt tot 10 centimeter. De vleugels zijn opvallend gekleurd, waarbij de hoofdkleur oranje is. Het vleugeloppervlak wordt door de zwarte vleugeladering verdeeld in cellen. De vleugelrand heeft een brede zwarte zoom met daarin vele kleine witte vlekjes.
De monarchvlinder komt van oorsprong voor in Noord- en Zuid-Amerika en kent verschillende populaties. De ondersoort megalippe trekt niet en komt vooral op eilanden in het Caribisch Gebied voor. De ondersoort nigrippus komt voor in Midden-Amerika ten zuiden van Nicaragua, en in het noorden van Zuid-Amerika, en is eveneens geen trekker. De ondersoort plexippus, de nominaatvorm, komt voor in Noord-Amerika, en bestaat uit twee, door de Rocky Mountains van elkaar gescheiden populaties: een kleinere in het westen en een veel grotere in het oosten. Deze beide populaties hebben gemeen dat ze in de lente uit hun overwinteringsplaatsen komen om in de zomer naar het oosten en noorden te trekken. Tijdens deze trek zetten de vrouwtjes eitjes af en ontwikkelt zich een tweede generatie die verder noordwaarts vliegt. Dit proces herhaalt zich vervolgens een aantal keer. De vlinders volgen hierbij de zich noordwaarts verplaatsende groei van de plantensoorten die als voedsel voor de larven dienen. De rupsen kunnen zich namelijk enkel ontwikkelen op geschikte waardplanten.
De vertegenwoordigers van de oostelijke populatie kunnen door hun trekgedrag in grote delen van de wereld worden aangetroffen. De monarchvlinder komt oostwaarts voor tot delen van noordelijk Afrika en in delen van Europa. Westelijk heeft de monarchvlinder Australië en grote delen van Azië bereikt. De monarchvlinder is niet de enige migrerende soort, maar spant wat betreft de afgelegde afstanden de kroon. De vlinder legt afstanden af tot 4500 kilometer van de geboortegrond.[3] De uiteindelijke nakomelingen van hun nakomelingen trekken in de herfst van het noorden van de Verenigde Staten weer terug naar het zuiden van Mexico om te overwinteren. Hier verzamelen ze zich in reusachtige groepen; sommige van dergelijke groepen kunnen meer dan 20 miljoen exemplaren bevatten. De volwassen monarchvlinder leeft ongeveer twee tot vijf weken, de wintergeneratie kan echter een leeftijd van wel acht tot negen maanden bereiken.[4]
De rupsen eten de bladeren van verschillende soorten zijdeplanten uit het geslacht Asclepias. Deze planten zijn giftig en de rupsen maken hier gebruik van door de giftige verbindingen in het lichaam op te slaan. Hierdoor worden ze zelf ook giftig zonder daar last van te hebben. Het lichaam van de volwassen vlinder behoudt de als rups bij elkaar gegeten gifstoffen. Zowel de rups als de vlinder worden hierdoor gemeden door veel insecteneters.
De wetenschappelijke naam van de soort werd als Papilio plexippus in 1758 door Carl Linnaeus gepubliceerd in de 10e druk van Systema naturae.[5] Linnaeus geeft daar naast het binomen ook een nomen specificum legitimum,[6] waaronder geen verdere beschrijving te vinden is maar alleen vier referenties naar eerdere publicaties over de soort. De eerste is van James Petiver, auteur van Musei Petiveriani, dat tussen 1695 en 1703 verscheen. In deel 6–7, uitgegeven in 1699, is op pagina 52,[7] bij het door Linnaeus geciteerde nummer 527, een korte Latijnse beschrijvende naam te vinden, en het commentaar dat de chirurg dokter Robert Rutherford deze soort, en de volgende (nummer 528), voor hem uit Carolina (toen nog één provincie) had meegebracht.[8] Dit is voor zover bekend de eerst gepubliceerde, nogal summiere, vermelding van de soort. De tweede referentie is Historia insectorum van John Ray, dat in 1710 postuum verscheen. Linnaeus verwijst naar de 3e soort van pagina 138 van dat werk, waar naast een beschrijvende naam en een referentie naar Petiver, ook de eerste uitgebreide beschrijving, in het Latijn, van (de vleugels van) de soort te vinden is.[9] De derde referentie is A voyage to the islands Madera, Barbadoes, Nieves, St. Christophers, and Jamaica, deel 2, van Hans Sloane, dat in 1725 verscheen. Op pagina 214 zijn twee Latijnse namen te vinden, dezelfde als die eerder al door Ray en Petiver waren gepubliceerd, met uiteraard referenties naar die twee auteurs.[10] Van de laatste wordt niet alleen nummer 527 genoemd maar ook zijn twee voorgaande nummers worden door Sloane als mogelijk dezelfde soort opgevoerd.[11] Vervolgens geeft hij nog een beknopte Engelse beschrijving van de kop, het borststuk en de vleugels. De volgende soort die Sloane noemt is nummer 528 van Petiver, die daarover oorspronkelijk opmerkte dat dit wellicht de andere sekse van dezelfde soort betrof. Sloane merkt alleen op dat de tweede soort vaak met de eerste samen wordt gezien. De laatste auteur die door Linnaeus aangehaald wordt is Mark Catesby. Catesby's The Natural History of Carolina deel 2, waarvan de platen 81 t/m 100 voor het eerst in 1743 verschenen, bevat een korte beschrijving in het Engels en Frans maar vooral een duidelijke plaat, in kleur: T. 88.[12]
De soort werd in 1780 door Jan Krzysztof Kluk in het geslacht Danaus (spreek uit: dana-us) geplaatst.[13] Het geslacht Papilio, dat bij Linnaeus' eerste publicatie ervan nog alle "dagvlinders" omvatte, heeft sindsdien een veel nauwere omschrijving gekregen en is nu beperkt tot soorten uit de familie Papilionidae, waartoe alle grote pages behoren. De monarchvlinder wordt nu in de onderfamilie Danainae van de familie Nymphalidae geplaatst, een heel andere familie. Het kenmerk van de vertegenwoordigers van deze familie is dat ze sterk verkleinde voorpootjes hebben, die voornamelijk als poetspoten gebruikt worden.
De wetenschappelijke geslachtsnaam Danaus is afgeleid van Danaos. Dit was een figuur uit de Griekse mythologie, koning van Libië, die met zijn vijftig dochters, de Danaïden, van Libië naar Argos vluchtte om de meisjes te redden van een gedwongen huwelijk met de vijftig zonen van Aigyptos, zijn tweelingbroer. Het epitheton plexippus is eveneens afkomstig uit de Griekse mythologie, en verwijst naar Plexippus, een van de vijftig zonen van Aigyptos. Deze Plexippus trouwde (uiteindelijk toch) met Amphicomone, een van de vijftig dochters van Danaos (en werd door haar in de huwelijksnacht gedood).[14]
De Nederlandstalige naam monarchvlinder betekent koningsvlinder en deze naam wordt ook in andere talen gebruikt. De naam komt van de Nederlandse Willem III van Oranje die ook koning van Engeland was. Europese protestanten, die naar Amerika emigreerden om aan vervolging door de katholieken te ontkomen, gaven de vlinder de naam vanwege de oranje kleur. Regionaal heeft de vlinder andere namen, in Australië wordt de naam wanderer gebruikt, wat zwerver betekent.
De namen in de volgende lijst zijn synoniemen in de zin dat ze dezelfde soort vertegenwoordigen. Enkele zijn wél een ander taxon omdat ze een andere ondersoort of vorm zijn.
De familie Nymphalidae waarin de monarchvlinder wordt geplaatst, herbergt onder andere de dagpauwoog (Aglais io) en de gehakkelde aurelia (Polygonia c-album).
In de onderfamilie Danainae worden verschillende geslachten geplaatst van vlinders die voornamelijk voorkomen in de tropen. In de Engelse taal wordt de groep milkweed butterflies genoemd, wat vertaald kan worden met zijdeplant-vlinders, en verwijst naar de planten waarop de rupsen leven (planten uit het geslacht Asclepias). Een Nederlandstalige naam voor deze onderfamilie is er (nog) niet, al wordt de naam 'monarchvlinders' wel gebruikt.
Er zijn meerdere soorten binnen de Danainae die trekken en grote afstanden kunnen afleggen, maar de monarchvlinder spant de kroon en is de enige soort die – althans in Amerika – zijn voedselplant volgt in een serie van meerdere generaties en over afstanden van duizenden kilometers.
De geslachtsnaam Danaus deelt deze soort met nog elf andere soorten.[15] De verschillende soorten lijken enigszins op elkaar maar zijn in de regel niet moeilijk uit elkaar te houden, zie ook onder onderscheid met andere soorten. Het geslacht werd door de entomologen Philip Avery en Dick Vane-Right verdeeld in drie ondergeslachten: Danaus, Salatura en Anosia. De monarchvlinder, het type van het geslacht, valt uiteraard in de eerste groep. Smith et al., die het geslacht onderwierpen aan een revisie, gebaseerd op moleculair werk, kwamen in 2005 tot de slotsom dat de drie ondergeslachten niet langer houdbaar zijn en dat het geslacht niet zinvol in ondergeslachten is in te delen.[16]
Er worden zes ondersoorten onderscheiden:[17]
Volgens Smith et al. (2005),[16] in hun revisie van het geslacht, moeten er twee ondersoorten worden onderscheiden: de nominaatvorm, die trekt, en de ondersoort megalippe, die niet trekt. De hier vermelde 'ondersoorten' leucogyne, portoricensis en tobagi zouden volgens Smith et al. vormen (formae) van de ondersoort megalippe zijn. Het taxon nigrippus maakte geen deel uit van deze studie. Dit taxon is een niet-trekkende variant (ondersoort of vorm) uit het noorden van Zuid-Amerika, die in 2007 door Hay-Roe et al. nog als ondersoort van Danaus plexippus werd onderscheiden, en waarvan het verspreidingsgebied min of meer aansluit op dat van de nauw verwante soort Danaus erippus (Cramer, 1775).[21]
De monarchvlinder heeft een typisch insectachtige bouw; het lichaam bestaat uit een kop of cephalon (A), een borststuk of thorax (B) en een achterlijf of abdomen (C). Het borststuk draagt drie paar poten aan de onderzijde en twee paar vleugels aan de bovenzijde. De voorvleugel (I) kan een lengte bereiken tot 5 centimeter, de spanwijdte of vlucht kan oplopen tot 10 centimeter. De achtervleugel (II) is breder maar minder lang. De vleugels zijn aan de bovenzijde overwegend oranje van kleur, met een zwarte vleugeladering en een bredere zwarte vleugelzoom waarin zich witte vlekken bevinden. Andere duidelijk te herkennen lichaamsdelen zijn de ogen (1), de witgekleurde monddelen of labia (2) en de antennes (3).
Het uiterlijk van de monarchvlinder kent geen seizoensvariatie; de exemplaren van de verschillende generaties zien er hetzelfde uit. Er zijn wel afwijkende vormen beschreven maar deze zijn zeer zeldzaam. Bij andere trekvlinders, zoals de soort Catopsilia pomona verschillen de opeenvolgende generaties in uiterlijk juist wél sterk van elkaar.
De meest afwijkende kleurvariatie is gevonden bij populaties op het eiland Hawaï. Deze vlinders hebben een witte vleugelkleur. Er zijn verschillende theorieën over het ontstaan en de functie van de witte vleugels. Waarschijnlijk overleeft de witte vorm beter omdat de vlinder door potentiële predatoren niet herkend wordt als lekker hapje. Op de Hawaïeilanden komen vogels voor die immuun zijn voor het gif dat de monarchvlinder bij zich draagt. Hierdoor kunnen ze grote hoeveelheden vlinders eten zonder last te ondervinden van het gif. De oranje monarchvlinders zijn door de vogels gemakkelijk te herkennen aan hun specifieke kleur, maar omdat de witte vorm er anders uitziet zouden de vogels deze exemplaren mijden.[22]
De kop van de monarchvlinder is gemakkelijk te onderscheiden van de rest van het lichaam door de aanwezigheid van de antennes en de relatief grote ogen. Aan de voorzijde van de kop zijn de monddelen gelegen, die vooral een zintuiglijke functie hebben. Andere monddelen hebben een mechanische functie of zijn gedegenereerd en hebben geen echte functie meer maar zijn nog rudimentair aanwezig.
De ogen zijn ovaal van vorm en bestaan uit vele kleine individuele oogjes. Zulke samengestelde ogen worden "facetogen" genoemd en de daarin aanwezige individuele oogjes worden met ommatidiën aangeduid.[4] De ogen hebben een zwarte kleur en zijn omgeven door witte vlekjes. De monarchvlinder heeft een relatief goed gezichtsvermogen en kan kleuren onderscheiden, waaronder ook ultraviolet. Net als andere vlinders kan de monarchvlinder met de facetogen verschillende kleuren waarnemen zodat de voedselbron -de bloemen van bloeiende planten- kan worden opgezocht. De vlinder ziet niet het UV-licht dat wordt uitgezonden door de zon maar de weerkaatsing ervan door de plant. Het kunnen waarnemen van verschillende eigenschappen van licht, zoals de richting ervan, dient tevens om te kunnen navigeren en zo de lange trektochten af te leggen.[23]
Aan de voorzijde van de kop zitten de labiale palpen. Bij veel vlinders zijn de palpen goed zichtbaar. Bij de monarchvlinder zijn ze zwart van kleur en dicht behaard met een zwarte beharing, met uitzondering van de buitenkanten, die een streep witte beharing hebben. De palpen bevatten zintuiglijke cellen, zogenaamde chemosensorische receptoren die geuren kunnen waarnemen en onderscheiden.
Aan de bovenzijde van de kop zitten de antennes, die een belangrijke zintuiglijke functie hebben. De antennes zijn zwart van kleur en zijn draadvormig of filiform. De antennes zijn relatief lang en dun, ze eindigen in naar buiten gerichte verdikkingen zodat ze iets weg hebben van een lange hockeystick.
De monddelen van de vlinder zijn klein. Goed zichtbaar is de roltong. Dit orgaan, ook wel proboscis genoemd, is in feite geen echte tong maar een lange buis die bestaat uit twee sterk verlengde, gefuseerde monddelen. De structuur heeft dezelfde vorm en functie als een rietje.[24] De lange roltong wordt in rust opgerold zodat deze niet in de weg zit. Met de roltong wordt nectar opgezogen uit bloemen. De roltong wordt tevens gebruikt om in regenplasjes, rottend fruit en dierlijke resten water op te zuigen. Dit dient overigens niet alleen om aan het vocht te komen maar vooral om het lichaam van de benodigde mineralen te voorzien; zie onder het kopje voedsel.
Het borststuk bestaat net als bij andere insecten uit drie delen die met elkaar zijn vergroeid tot een enkel deel. De drie delen zijn nog wel af te leiden uit de positie van de vleugels en poten. Ieder deel draagt een paar poten aan de onderzijde en de achterste twee delen dragen elk een paar vleugels aan de bovenzijde. Het borststuk is zwart van kleur en is voorzien van heldere witte vlekjes. De vlekken zijn klein en rond van vorm. Aan de bovenzijde zitten twee grotere vlekken en aan de voorzijde twee kleinere.
De poten zijn zwart en dragen een dichte lange beharing. Vlinders hebben altijd drie paar poten. Bij de soorten uit de familie Nymphalidae is het voorste potenpaar gedegenereerd en veel kleiner, en heeft het een andere functie gekregen. De voorpoten van deze soorten worden gebruikt als poetsorgaan om de antennes schoon te houden.[25]
De twee andere potenparen zijn veel groter en worden gebruikt om zich vast te houden aan de ondergrond. Deze poten eindigen in twee haakachtige klauwtjes. Net als andere vlinders heeft de monarchvlinder zintuiglijke organen aan de poten die geuren kunnen waarnemen. Zodra de vlinder ergens op landt wordt hierdoor direct de ondergrond geproefd. Zo weet de vlinder of de ondergrond voedsel bevat en kunnen de vrouwtjes vaststellen of een plant waarop ze zitten al dan niet geschikt is als voedsel voor de larven. Het voorste potenpaar van een vrouwtje wijkt af van dat van een mannetje. Bij een vrouwtje eindigt de tarsus of klauw in een verdikking die kleine stekeltjes draagt.[26]
De monarchvlinder is een relatief grote soort en de voorvleugels kunnen een lengte van 43 tot 50 millimeter bereiken.[27] De grote vleugels dienen niet alleen om te vliegen maar hebben nog verschillende andere functies. De felle kleuren waarschuwen potentiële predatoren voor de giftigheid. Een groot vleugeloppervlak zorgt tevens voor een efficiëntere thermoregulatie: het regelen van de lichaamstemperatuur. Door de grote vleugels warmt de vlinder sneller op en koelt hij minder snel af als de dieren in groepen tegen elkaar zitten tijdens de winterslaap. De vlinder kan het lichaam opwarmen door met de vleugelspieren trillende bewegingen te maken. Als het in de zon te warm wordt, neemt de vlinder een positie aan waarbij de vleugels met de voorzijde naar de zon staan. Zo wordt een zo klein mogelijk vleugeloppervlak blootgesteld aan de zon waardoor de vlinder minder snel opwarmt.
De voorvleugel is veel langer dan de achtervleugel en is driehoekig van vorm. De bovenzijde van de voorvleugel is in het midden oranje, de randen zijn donkerbruin tot zwart. De vleugelpunt is geheel donker, met hier en daar witte vlekken. In het donkere vlak zijn vaak drie lichte, naar de oranje basiskleur neigende vale vlekken te zien. De witte vlekken kunnen soms naar oranje neigen. De vleugeladering is zwart. De aders zelf zijn, door de donkere schubben aan beide zijden ervan, slecht te zien. Op het oranje deel verdeelt de adering de vleugel in vier cellen: één langwerpige aan de voorzijde, parallel aan de vleugelrand of costa, daarachter liggen dan drie vlakken die, van de binnen naar buiten, steeds kleiner worden. De onderzijde van de voorvleugel is duidelijk lichter van kleur; de oranje cellen zijn helderder en de donkere vleugelrand neigt meer naar zwart.
De achtervleugel is korter maar breder dan de voorvleugel en heeft een rondere vorm. Het grootste deel van de vleugel is oranje, alleen de vleugelrand is zwart met kleine witte, ronde vlekjes. De vleugeladering verdeelt de vleugel ook hier in langwerpige cellen. De onderzijde van de achtervleugel is roze-wit tot witgeel van kleur en wijkt hierbij af van de onderzijde van de voorvleugel die oranje van kleur is.
De vleugelkleur van vrouwtjes is iets bleker dan die van de mannetjes.[28] Mannetjes worden daarnaast iets groter dan de vrouwtjes. Bij mannetjes is de donkere zoom om de vleugeladers relatief dun, bij de vrouwtjes is deze juist breed en lijken de aderen daardoor groter. Daarnaast hebben mannetjes een zwarte vlek op de achtervleugel die geursporen verspreidt: deze is op de afbeelding hiernaast geel omcirkeld.
De monarchvlinder heeft dankzij de grote vleugels in combinatie met het lichte lichaam een relatief grote draagkracht of lift. De vlinder maakt tijdens het vliegen - in vergelijking met andere vlinders - weinig vleugelslagen en zweeft het grootste deel van de tijd. Met zulke grote vleugels vormt een beschadiging, zoals een door een vogel toegebrachte hap uit de vleugel, niet snel een belemmering om verder te vliegen. De grote vleugels zijn relatief flexibel: in hogesnelheidsbeelden van een vliegend exemplaar is te zien dat de vlinder tijdens het vliegen de lucht als het ware vangt door de steeds veranderende vleugelvorm.
Het achterlijf of abdomen is donkerbruin tot zwart en draagt een pluizige, dichte beharing. De lichaamskleur komt hierdoor overeen met die van de vleugelranden, waardoor het lichaam bijna wegvalt tegen de vleugels. Het achterlijf van de monarchvlinder wordt ongeveer drie centimeter lang en bestaat uit tien segmenten. De laatste twee daarvan zijn samengegroeid en vormen de geslachtsorganen, waardoor het achterlijf op het eerste gezicht maar negen segmenten lijkt te hebben. De uitwendige geslachtsorganen zitten aan het uiteinde van het achterlijf als achterlijfsaanhangsels. Deze zijn zichtbaar als twee kleine uitsteeksels. Aan weerszijden van het achterlijf zitten kleine, ovale openingen, die met het blote oog moeilijk te zien zijn maar onder vergroting van een loep zijn ze duidelijk waarneembaar. Deze openingen zijn de spiracula, de ademopeningen waardoor zuurstof het tracheeënstelsel in kan, en afvalstoffen zoals koolstofdioxide eruit. Het achterlijf bevat de meeste complexe organen, zoals het spijsverteringskanaal, het ademhalingsapparaat en de geslachtsorganen.
De monarchvlinder lijkt op verschillende andere soorten vlinders. Een aantal van deze soorten behoort eveneens tot het geslacht Danaus, een aantal soorten is evolutionair niet verwant maar bootst het uiterlijk van de (giftige) monarchvlinder na. De zeer sterk verwante soort Danaus erippus uit Zuid-Amerika, tot 2005 meestal als een ondersoort van de monarchvlinder beschouwd, lijkt sterk op zijn nauwe verwant maar doorgaans is de achterrand van de achtervleugel bleker, waar die bij de monarchvlinder zwart is.[16][21] De veel minder nauw verwante Danaus gilippus is overwegend roodoranje van kleur en heeft ronde witte vlekjes verspreid over het vleugeloppervlak. Ook andere Danaus-soorten zijn op het eerste gezicht te verwarren maar hebben een overwegend rode kleur, zoals Danaus genutia. Een aantal soorten heeft een duidelijk ander kleurpatroon en is hierdoor makkelijker te onderscheiden. Voorbeelden zijn Danaus affinis, waarvan de vleugels hoofdzakelijk zwart zijn, met witte vlekken, en Danaus chrysippus, uit Zuid-Europa, Afrika en Zuid-Azië, waarbij het achterlijf en de vleugeladers oranje zijn, en niet donker zoals bij de monarchvlinder. De niet-verwante maar sterk gelijkende soort Limenitis archippus heeft veel minder witte vlekken die echter wel groter zijn op een achtergrond van donkere vleugzomen. Het patroon van de vleugeladering in de achtervleugels wijkt duidelijk af in vergelijking met de monarchvlinder.
De rupsen van de andere Danaus-soorten zijn in de regel gemakkelijk te onderscheiden van die van de monarchvlinder. De gele dwarsbanden van de rupsen van de monarchvlinder omringen het gehele lichaam en zijn niet onderbroken. Bij de gelijkende rupsen van de kleine monarchvlinder (Danaus chrysippus) en de soorten Danaus eresimus en Danaus gilippus zijn de banden wel onderbroken en zitten ze bovendien meer aan de bovenzijde van het lichaam. Een nog duidelijker verschil is het aantal lichaamsuitsteeksels van de rupsen: de monarchvlinder draagt aan de voor- en achterzijde een paar zwarte uitsteeksels, bij de andere drie genoemde soorten zit er nog een derde paar op ongeveer het midden van de rugzijde.
De monarchvlinder is door het gif dat de rups uit de voedselplant opneemt zeer giftig, en de meeste insecteneters die weleens vlinders buitmaken leren al snel dat de vlinder beter gemeden kan worden. Er zijn verschillende giftige vlinders die sterk op de monarchvlinder lijken, wat tot verwarring leidt waar ze profijt van hebben. Zelfs soorten die niet giftig zijn maar slechts oppervlakkig op de monarchvlinder lijken, worden door veel dieren gemeden. Dit verschijnsel waarbij twee soorten op elkaar lijken wordt nabootsing of mimicry genoemd. Bij de monarchvlinder zijn drie soorten mimicry waargenomen, waarbij soms andere soorten profiteren en soms de monarchvlinder zelf.
Een aantal vlinders lijkt op de monarchvlinder omdat ze sterk verwant zijn. Voorbeelden zijn de eerder genoemde soorten Danaus gilippus en Danaus genutia. Deze soorten hebben ongeveer dezelfde kleuren en patronen. Omdat ze zelf ook giftig zijn, lijken ze hier geen voordeel bij te hebben. Als groep echter hebben alle soorten hier profijt van omdat vijanden de kleuren van de op elkaar lijkende soorten associëren met de giftigheid. Deze vorm van mimicry, waarbij verschillende giftige soorten op elkaar lijken, wordt mimicry van Müller genoemd.[29]
Er zijn ook soorten die zelf niet giftig zijn maar sterk op de monarchvlinder lijken, zodat ze vaker met rust worden gelaten door potentiële predatoren. Een voorbeeld is de Noord-Amerikaanse soort Limenitis archippus. Omdat ze niet giftig zijn, hebben de rups en de pop een goede camouflage: de rups lijkt op een vogelpoepje en de pop ziet eruit als een verdord blaadje. De volwassen vlinder lijkt sterk op de monarchvlinder en is daarvan moeilijk te onderscheiden.[30] Om de efficiëntie van deze vorm van nabootsing te testen, werd een aantal vlinders gevoerd aan een groep blauwe gaaien die in gevangenschap waren opgegroeid en nog nooit een vlinder hadden gezien. De vogels aten de vlinders zonder problemen op. Toen de gaaien later in het experiment monarchvlinders kregen aangeboden werden ook deze in eerste instantie gegeten maar later weer uitgebraakt. De vogels weigerden na enkele ervaringen vervolgens nog een monarchvlinder te eten. Daarnaast werden exemplaren van Limenitis archippus verder volkomen genegeerd.[31] Van de gaai is waargenomen dat die braakneigingen vertoont als hij een op een monarchvlinder gelijkende soort ziet.[32] Deze vorm van nabootsing waarbij soorten die zelf geen gif dragen een andere, giftige soort imiteren om aan vijanden te ontkomen, wordt mimicry van Bates genoemd.[29]
Bij de monarchvlinder doet zich ook een derde vorm van mimicry voor. Deze variant is verwant aan de mimicry van Bates en hier zijn het de minder toxinen bevattende exemplaren van de monarchvlinder die door hun giftige soortgenoten indirect beschermd worden. Niet alle monarchvlinders zijn namelijk even giftig. Een van de waardplanten van de rupsen is de weinig giftige zijdeplant (Asclepias syriaca). Monarchvlinders die zich als rups met deze plant hebben gevoed zijn aanzienlijk minder giftig dan exemplaren die van veel giftiger waardplanten als Asclepias asperula en Asclepias viridis hebben gegeten. Deze variatie in toxiciteit wordt wel automimicry (zelf-nabootsing) genoemd.
De monarchvlinder behoort tot de Endopterygota en ondergaat een volledige gedaanteverwisseling. De vlinder komt ter wereld uit een ei, en de larve of rups ondergaat eerst een aantal juveniele stadia. De larve van de monarchvlinder doorloopt vijf groeistadia of instar, voordat de rups volledig is ontwikkeld. Vervolgens vindt de verpopping plaats, waarbij de rups in het lethargische popstadium treedt. Uit de pop komt na enige tijd de vlinder tevoorschijn, die zich vervolgens voortplant, waarna de cyclus opnieuw begint. Net als alle dieren maken vlinders een koude periode in de winter mee of een hete periode in de zomer. Ze kunnen die doorstaan of ontvluchten en er zijn maar weinig vlinders die voor het laatste kiezen. De meeste soorten overwinteren of overzomeren in het ei-, rups- of popstadium. Er zijn ook wel soorten die als volwassen vlinder een schuilplaats opzoeken, zoals de dagpauwoog. De soorten die als volwassen vlinders overwinteren, zoeken vaak lokale schuilplaatsen op. De monarchvlinder echter trekt over grote afstanden en volgt de groeiperiode van de waardplanten van de rupsen, die verder noordwaarts steeds later in het voorjaar valt. Zie ook onder migratie.
Zodra de vlinders in het begin van de lente uit hun winterslaap ontwaken, vangt de voortplantingstijd aan. De mannetjes lokken de vrouwtjes met geurstoffen die vrouwtjes seksueel prikkelen. Deze stoffen worden feromonen genoemd.
Van veel vlinders is bekend dat feromonen een grote rol spelen bij de voortplanting, maar bij de monarchvlinder spelen ze waarschijnlijk een minder grote rol.[4] In vergelijking met andere vlinders vinden de mannetjes en vrouwtjes elkaar meer op zicht en in mindere mate door gebruik te maken van feromonen.[33] De mannetjes van de monarchvlinder gebruiken pyrrolizidine-alkaloïden als grondstof voor hun feromonen en onttrekken deze stof uit de nectar van planten. De mannetjes slaan de feromonen op in kleine zakjes aan de bovenzijde van de achtervleugel, die te zien zijn als ovale zwarte vlekjes. Aan het achterlijf bevinden zich uitstulpbare borsteltjes die in het zakje worden 'gedoopt' zodat de vlinder efficiënter geursporen afgeeft.
De paring van de monarchvlinder vangt aan in de vlucht; vaak plukt een mannetje simpelweg een vrouwtje uit de lucht waarna de vlinders op de grond vallen. De mannetjes zijn zeer dominant; bij een bereidwillig vrouwtje neemt een mannetje haar mee naar een hoger gelegen plant of struik waar de paring wordt voortgezet.[3] Tijdens de paring geeft het mannetje een zaadpakketje af aan het vrouwtje; dit wordt de spermatofoor genoemd. Naast de zaadcellen bevat het pakketje ook voedingsstoffen in de vorm van proteïnen. Hierdoor krijgt het vrouwtje extra bouwstoffen die ze gebruikt voor de ontwikkeling van haar eieren.[33] De paring van de monarchvlinder kan tot 16 uur duren.[4]
Bij de meeste vlinders worden de vrouwtjes groter dan de mannetjes. Zij moeten de eitjes dragen en hiertoe is een groter lichaam geschikter. Bij de monarchvlinder is dit echter andersom en omdat de mannetjes groter worden, lukt het ze meestal wel om een kleiner vrouwtje overmeesteren. De mannetjes zien echter regelmatig de kleinere mannelijke exemplaren aan voor vrouwtjes en de grotere mannetjes kunnen ze dan tot een paring dwingen. Bij de monarchvlinder zijn paarpogingen tussen mannetjes onderling hierdoor niet ongewoon.[3]
Een ei van de monarchvlinder is rond op dwarsdoorsnee, en langgerekt ovaal in lengtedoorsnede. Het ei is smaller aan de bovenzijde dan aan de basis. De basis van het ei wordt door het vrouwtje aan het blad gekleefd. Het ei heeft een hoogte van ongeveer 1,2 millimeter en een breedte van ongeveer 0,9 mm.[34] Het ei is wit tot groen van kleur. De verharde buitenzijde van het ei wordt het chorion genoemd. Het oppervlak vertoont een complex patroon van opstaande randen die van top tot basis lopen, en hiertussen zijn rijen putjes aanwezig. Het gehele ei is voorzien van een dun laagje was, zodat het minder snel uitdroogt.[35] Aan de bovenzijde van ieder ei zit een zeer klein gaatje: de micropyle. Door dit gaatje komt een zaadcel het ei binnen zodat het bevrucht wordt. Net als bij andere vlinders wordt eerst de schaal van het ei gevormd en vindt daarna pas de fertilisatie plaats.[35] Als het embryonale stadium bijna is voltooid en het ei op uitkomen staat, kleurt het grijs en zijn de ogen en de lichaamsdelen van het embryo al te zien.
Het aantal eitjes varieert; dit hangt zowel samen met de lichaamsgrootte van een vrouwtje als met haar levensduur. Gemiddeld zet een vrouwtje ongeveer 700 eitjes af in twee tot vijf weken, maar het aantal eitjes kan ook aanzienlijk lager liggen. Een vrouwtje dat in een laboratorium werd bestudeerd produceerde in totaal 1179 eitjes, wat als record geldt.[35]
De eitjes worden niet in groepjes afgezet, zoals bij veel andere vlinders het geval is, maar worden individueel tegen een blad geplakt. De eitjes worden op bladeren in het bovenste deel van de plant afgezet, meestal op zijdeplanten die behoren tot het geslacht Asclepias.[36] Het ei wordt meestal op de onderzijde van een uitschieter afgezet, dus een fris blad waaraan de larve zich meteen na het uitkomen tegoed kan doen. De embryonale ontwikkeling duurt ongeveer drie tot acht dagen, afhankelijk van de omgevingstemperatuur. Hoe hoger de temperatuur, hoe sneller het embryo zich zal ontwikkelen. Als de larve het ei verlaat, eet ze eerst de eierschaal op.
De rups is een opvallende verschijning door de zwarte basiskleur met heldere witte en gele dwarsbanden, die over het gehele lichaam, inclusief de kop, aanwezig zijn. De rups bezit een zacht exoskelet; het lichaam is flexibel en biedt weinig bescherming. Het lichaam van de rups bestaat uit een kop met daarachter drie borststuksegmenten die elk aan de onderzijde één paar gesegmenteerde pootjes dragen. Hierachter liggen elf achterlijfssegmenten. Doordat de laatste drie segmenten met elkaar zijn vergroeid, vallen er maar negen te onderscheiden.[37] Van de achterlijfssegmenten dragen het derde, vierde, vijfde en zesde segment, gezien vanaf de voorzijde, steeds een paar pseudopoten. Die pseudopoten zijn niet geleed en flexibel, ze verdwijnen tijdens het popstadium. De pseudopoten verankeren het lichaam van de rups, terwijl de voorste drie poten dienen om zich voort te slepen. De voorste poten dienen ook om voedsel naar de kaken te brengen. Helemaal achteraan het lichaam is een paar naschuivers aanwezig die het lichaam voortduwen.
Het lichaam van de rups draagt aan de bovenzijde twee paar zwarte, vlezige uitsteeksels: het eerste paar op het tweede borststuksegment en het tweede op het achtste achterlijfssegment, gezien vanaf de kop. Andere soorten monarchvlinders hebben nog een derde paar op ongeveer het midden van het lichaam, waardoor ze makkelijk zijn te onderscheiden. De uitsteeksels aan de voorzijde zijn langer dan die aan de achterzijde. Ze dienen om vijanden te verwarren: door de uitsteeksels aan beide lichaamsuiteinden is moeilijker in te schatten aan welke kant de voorzijde van de rups zit. Predatoren zoals vogels vallen het liefst de voorzijde aan om de prooi snel te doden. De kop van de rups is het enige harde deel. Dit wordt beschermd door twee chitineuze kopplaten.[37] Aan de onderzijde van iedere kopplaat zit een rij enkelvoudige oogjes, die de ocelli worden genoemd. Iedere zijde van de kop heeft zes paar oogjes, maar desondanks ziet de rups bijzonder slecht (zie onder zintuigen). Aan de kop zitten twee kaken, de mandibels. Onder de kaken staan de antennes, die onooglijk klein en nauwelijks te zien zijn. Daar weer onder bevinden zich twee paar monddelen: de palpen.[37] Aan de onderzijde van de kop ligt in het midden een spinselklier. Het spinsel dient alleen voor de verpopping; de rupsen gebruiken de draden niet om zich tijdens hun ontwikkeling te verankeren aan een plant en ze maken geen nest van spinsel, zoals de rupsen van sommige andere vlinders wel doen.
Als de larve uit het ei kruipt, is het lichaam maar enkele millimeters lang. Een volwassen rups kan een lengte bereiken van ongeveer 5 centimeter. Het totale gewicht van de rups is aan het einde van zijn ontwikkeling met factor 3000 toegenomen.[3] De rups groeit net als alle rupsen in stapjes door regelmatig te vervellen. De periode tussen twee vervellingen wordt een instar genoemd. In totaal doorloopt de rups vijf instar. Als de rups uit het ei kruipt, bevindt deze zich in het eerste instar. Als de rups volledig ontwikkeld is, vindt de verpopping plaats. Dit gebeurt altijd aan het einde van het vijfde instar. De verschillende rupsstadia lijken op elkaar. De jonge rupsen zien er al net zo uit als de oudere exemplaren al zijn ze nog kleiner, minder sterk gekleurd, en zijn ook de zwarte lichaamsuitsteeksels kleiner.
Ieder nieuw instar wordt voorafgegaan door een vervelling. Hierbij laat de oude huid los. Daaronder zit al een nieuwe huid. De huid van de kopschilden laat het eerst los, daarna stroopt de rups zijn oude huid als een sok af.[37] De eerste tijd is de nieuwe huid nog zacht en kan nog oprekken om groei toe te laten. De rups is dan kwetsbaarder. Na iedere vervelling wordt de oude huid opgegeten zodat vervellingshuiden zelden te zien zijn.
De duur van het rupsstadium hangt af van het voedselaanbod en de omgevingstemperatuur. Een rups die genoeg te eten heeft en zich onder ideale omstandigheden ontwikkelt, kan zich al na tien tot veertien dagen verpoppen. Als de omgevingstemperatuur rond de 10 °C ligt, verloopt de ontwikkeling veel trager, doordat het metabolisme van de rups veel langzamer wordt. De duur van het rupsstadium kan dan oplopen tot wel 40 dagen. Om sneller te kunnen groeien, zoeken de rupsen het zonlicht op. Door te zonnen kan de rups zijn lichaamstemperatuur tot acht graden boven die van de omgevingstemperatuur brengen, wat het metabolisme en daarmee de lichaamsgroei versnelt.
Vlak voor de verpopping zoekt de rups een beschutte plek op, bijvoorbeeld onder een blad of tegen een tak. De rupsen van de monarchvlinder hebben een spinselklier aan de onderzijde van de kop. Deze wordt alleen gebruikt als de rups zich volledig heeft ontwikkeld. Met de spinselklier produceert de rups een dotje spinsel op het substraat, waarna de achterste poten, de naschuivers, het spinsel vastgrijpen.[38] De rups hangt verder volledig vrij en blijft zo enige tijd hangen en neemt een karakteristieke J-vormige houding aan. Dit wordt de prepupatie genoemd; de rups vertoont gedurende deze tijd geen activiteit, maar is nog niet aan het verpoppen. Ten slotte werpt de rups zijn laatste larvenhuid af, waarna de pop tevoorschijn komt. Omdat de pop loskomt van de larvenhuid, moet de pop die vasthouden om niet te vallen. Hiertoe wordt een plooi tussen het derde en vierde achterlijfssegment gebruikt. Terwijl de pop zich met de pophuid aan de lavenhuid vasthoudt, wordt met de achterlijfspunt of cremaster gezocht naast het spinsel dat de oude larvenhuid vasthield. Aan het uiteinde van de cremaster bevinden zich kleine haakjes, die door bewegingen van de rups in het spinsel blijven klitten.[38] Zodra de pop aan het spinsel vastzit, hardt de pop uit en krijgt zijn typische, eikelachtige vorm. Het popstadium is net als het eistadium lethargisch; het dier is immobiel en kan zich niet bewegen. De pop van de monarchvlinder heeft geen cocon, een door de spinselklieren van de rups gemaakt omhulsel dat dient ter bescherming van de pop en bij veel andere vlinders wel gemaakt wordt.[38]
De pop van de monarchvlinder wordt net als bij andere vlinders chrysalis genoemd. De chrysalis is in eerste instantie groen en kleurt later donkerder. De kleur van de poppen vertoont nauwelijks variatie: deze is altijd groen. De pop is te herkennen aan een geribbelde rand aan de bovenzijde, die een gouden kleur vertoont. Ook zijn enkele goudkleurige vlekken op de pop aanwezig. De opvallende gouden vlekken dienen waarschijnlijk om vijanden af te schrikken. Omdat de vlekken lichtdoorlatend zijn, is wel geopperd dat ze pigmentvorming in de vleugels stimuleren. Het gif dat de rups heeft gegeten, blijft tijdens de verpopping behouden, zodat ook de pop giftig is. De giftige verbindingen worden opgeslagen in het achterlijf.
De duur van het popstadium hangt af van de omgevingstemperatuur en is gemiddeld tien tot veertien dagen. Als de chrysalis vrijwel volledig is ontwikkeld, kleurt de pop naar bijna zwart, wordt de pophuid doorzichtig en zijn de oranje kleuren van de vleugels al te zien. De vlinder zal binnen enkele uren lucht naar binnen zuigen, zodat de pophuid openbarst en de vlinder die kan verlaten. Uit de pop verschijnt de volwassen vlinder.[38]
Aan de pop kan men al zien of het een mannetje of een vrouwtje betreft door met een loep te kijken naar de achterlijfssegmenten. Bij een vrouwtje heeft het eerste segment een kleine inkeping in de eerste achterlijfsring, die bij een mannelijke pop ontbreekt.[39]
De vleugels van een pas uitgeslopen vlinder zijn nog sterk opgevouwen en zien eruit als kleine propjes. Zodra de vlinder de pop heeft verlaten, worden lichaamssappen vanuit het achterlijf naar de vleugeladeren gepompt. Het achterlijf wordt hierbij kleiner, terwijl de vleugels zich uitvouwen en juist groter worden. Pas na enkele uren zijn ze volledig uitgevouwen.
De roltong of proboscis van de vlinder is bij het uitsluipen nog niet gefuseerd: de roltong bestaat uit twee lange uitsteeksels die aan de onderzijde van de kop zitten. Ieder deel heeft een 'U'- vorm in doorsnede waarbij de 'pootjes' rijen kleine klittenband-achtige haakjes bevatten. Deze worden tegen elkaar gebracht waarna de haakjes in elkaar klitten en de buisvormige tong ontstaat.
Een bijzonderheid van de monarchvlinder is de veel langere levensduur van de laatste generatie ten opzichte van de eerdere generaties. De eerste generaties trekken langzaam van zuid naar noord en planten zich onderwijl voort. De laatste generatie plant zich echter pas voort nadat ze naar het zuiden zijn getrokken en hebben overwinterd. De exemplaren van eerdere generaties leven ongeveer een tot twee maanden, terwijl de vlinders van de laatste generatie een leeftijd van acht tot negen maanden kunnen bereiken, wat relatief oud is in vergelijking met andere vlinders.[4]
De waardplanten voor de rups van de monarchvlinder zijn planten uit de maagdenpalmfamilie. Net als alle vlinders kunnen de rupsen zich slechts op een beperkt aantal soorten ontwikkelen. Met name de soorten uit het geslacht zijdeplant (Asclepias) worden gegeten.
In de lijst hieronder zijn de bekendere waardplanten van de rups weergegeven:
Af en toe worden nieuwe voedselplanten van de monarchvlinder ontdekt, zoals in 2006 op het Iberisch Schiereiland, waar overwinterende exemplaren soms worden aangetroffen. Uit onderzoek bleek dat de rups zich kan ontwikkelen op de giftige plant Cynanchum acutum, die verwant is aan de soorten uit het geslacht engbloem (Vincetoxicum).[40]
De volwassen vlinder leeft van nectar uit bloemen van planten die behoren tot uiteenlopende families. De monarchvlinder is in staat deze suikerrijke vloeistof als een vetachtige stof in het lichaam op te slaan. Met name de exemplaren die de lange reis naar het overwinteringsgebied vliegen, hebben de vetten nodig als energiebron voor de lange vlucht; zie ook onder migratie naar het zuiden. Het kunnen omzetten van suikers naar vetten heeft als voordeel dat het volume en gewicht ervan afnemen, wat voor een vliegend insect van veel belang is.
De monarchvlinder drinkt regelmatig. Vaak worden hiervoor kleine plasjes opgezocht zoals plassen regenwater. De vlinder onttrekt ook vocht van rottend fruit, de ontlasting van dieren en aan kadavers. Uit het opgezogen vocht worden de benodigde mineralen gehaald. De opname van water reguleert het lichaamsgewicht; het vocht dient zo als 'ballastwater'.[3]
Uit laboratoriumproeven is gebleken dat de vlinders kunnen leren welke kleuren met hun favoriete voedsel te maken hebben. De vlinder kan zich zo aanpassen aan een veranderend voedselaanbod.[23]
De monarchvlinder beschikt over een sterke passieve verdediging doordat de vlinder in de meeste stadia giftig is. De monarchvlinder is het kwetsbaarst tijdens het ruststadium gedurende de winter. De vlinders houden zich dan op in bomen, op enige afstand van de bodem. Zo zijn de vlinders minder goed bereikbaar voor op de bodem jagende gewervelde dieren, zoals muizen en reptielen.
Als een rups door een grotere predator wordt aangeraakt worden de draad-achtige aanhangsels boven het lichaam heen- en weer bewogen om af te schrikken. De rups kan hier niet mee steken. Als dit niet helpt rolt de rups het lichaam op en laat zich op de bodem vallen. Een opgerolde rups die wordt lastiggevallen laat een schuim-achtig goedje uit de kop lopen, dat verschillende gifstoffen bevat.
Doordat de rupsen van giftige planten eten en ze het milde gif dat in de bladeren zit niet verteren maar opnemen in het weefsel waar het zich ophoopt,[41] zijn ze oneetbaar voor de meeste soorten vogels, en aangezien ze door de opvallende kleuren erg herkenbaar zijn worden ze meestal met rust gelaten. Hoe ouder de rups is, hoe meer gif wordt opgeslagen, en de rups wordt dus giftiger naarmate hij ouder wordt.
Het eten van giftige planten heeft nog een ander voordeel: de rupsen vallen niet ten prooi aan grazers, die dergelijke planten mijden. Rupsen die van niet-giftige planten leven - zoals grassen - worden soms per ongeluk met plant en al opgegeten door grote herbivoren zoals koeien en paarden.[42]
De soorten uit het geslacht Asclepias zijn allemaal in meerdere of mindere mate giftig. De toxische verbindingen bestaan uit alkaloïden en glycosiden die op het zenuwstelsel van zoogdieren werken. Sommige soorten zijn niet giftig en van andere soorten zijn alleen bepaalde delen giftig zoals de bast en het sap. Er zijn soorten die zo giftig zijn dat de rups onmiddellijk vergiftigd wordt als hij ervan eet.
Van veel planten is beschreven dat bij insectenvraat het speeksel van het insect een afweerreactie bij de plant oproept. Die reactie bestaat eruit dat de plant extra plantentoxine door de vaatbundels naar het aangevreten deel brengt. De tabaksplant bijvoorbeeld stuurt extra nicotine naar de boosdoener, wat giftig is voor insecten. De rupsen van de monarchvlinder zijn bestand tegen het milde gif dat normaal gesproken in de bladeren voorkomt, maar zullen proberen te voorkomen dat het blad door de plant nog giftiger wordt gemaakt. De rupsen knagen hiertoe eerst de bladnerven door en beginnen dan pas het blad op te eten. De plant kan hierdoor geen sappen meer naar dat deel van het blad toevoeren.[41] Naast gifstoffen bevat het plantensap van de zijdeplant een latex-achtig goedje dat snel stolt. Het dient om beschadigingen aan het blad te bedekken en af te sluiten, maar heeft ook tot gevolg dat de kaakdelen van de rupsen aan elkaar gelijmd worden. Door de hoofdnerven door te bijten wordt voorkomen dat de monddelen van de rups aan elkaar blijven plakken.
De kleuren van de rups zijn aposematisch, wat betekent dat ze dienen om vijanden af te schrikken. De meeste rupsen hebben camouflagekleuren en verstoppen zich het liefst, de rupsen van de monarchvlinder daarentegen laten zich juist zo veel mogelijk zien. Om de zichtbaarheid te vergroten zijn de rupsen positief fototactisch en negatief geotactisch, wat wil zeggen dat ze naar het licht toe (positieve fototaxie) en van de bodem af kruipen (negatieve geotaxie), dus hoger in de plant komen. Zo zijn de rupsen goed zichtbaar waardoor vijanden sneller leren om ze te mijden.
De toxische verbinding is chemisch gezien een glycoside die behoort tot de groep cardenoliden en wordt wel een cardioglycoside genoemd. Het voorvoegsel cardio betekent 'hart' en slaat op een van de effecten van het gif. Net als andere cardioglycosiden werkt het gif voornamelijk op het hart.[43] Als een vogel de rups toch eet, werkt het gif direct op de maag en de vogel spuugt zijn prooi meestal korte tijd later weer uit. De vogel zal in het vervolg vermijden een rups of vlinder op te eten, als de confrontatie tenminste overleefd wordt.[42]
De monarchvlinder kent vele vijanden. Zowel natuurlijke omstandigheden als dieren die op de rupsen of de volwassen vlinder jagen kunnen de populaties drukken.
Zowel de rups als de vlinder worden ondanks hun giftigheid buitgemaakt en gegeten door een breed scala aan insecteneters. Voorbeelden zijn verschillende geleedpotigen, reptielen, kleine zoogdieren als muizen, en vogels. Ook de eieren worden gegeten door dieren als roofmijten en kleine insecten.
De monarchvlinder wordt net als alle vlinders voornamelijk gegeten door vogels. De meeste vogels leren al snel dat de vlinder oneetbaar is door simpelweg een hap van de vlinder te nemen. Sommige exemplaren overleven dit niet, maar vanwege het leereffect door de vogels, heeft het grootste deel van de monarchvlinders op die manier weinig te vrezen van vijanden.[42]
De monarchvlinder heeft in vergelijking met andere vlinders een zeer bestendig exoskelet dat niet zozeer hard maar enigszins leerachtig is. De meeste vlinders kunnen door vogels eenvoudig worden gedood door in het borststuk te pikken, wat direct fataal is. De monarchvlinder heeft een dusdanig sterk omhulsel dat het vrijwel onmogelijk is om de vlinder op die manier te doden. Een vogel zal de vlinder na enkele pogingen vaak weer loslaten, zodat de monarchvlinder kan ontsnappen. In de meeste gevallen komt de vlinder er zonder beschadigingen vanaf.[42]
Slechts enkele vogels zijn immuun voor het gif van de planten waarvan de rups eet. Voorbeelden zijn de zwartstuittroepiaal (Icterus abeillei) en de zwartkopbisschop (Pheucticus melanocephalus). In gebieden waar deze vogelsoorten algemeen voorkomen worden veel monarchvlinders gegeten. Andere vogels zijn niet immuun voor het gif maar eten slechts af en toe een monarchvlinder of ze eten alleen de niet-giftige delen. Voorbeelden zijn enkele soorten uit de familie wielewalen (Oriolidae).[44]
Knaagdieren die de vlinder eten zijn onder andere verschillende vertegenwoordigers van de echte muizen, de woelmuizen en de spitsmuizen. Muizen eten alle stadia, vooral de rups en de volwassen vlinder vallen ten prooi. De monarchvlinder overwintert in hogere delen van bomen en niet op de bodem, waarschijnlijk door de sterke predatie van knaagdieren. Van andere verwante tropische vlinders die tot het geslacht Danaus behoren is bekend dat de migrerende soorten vooral gegeten worden door muizen als ze in groepen de winterslaap doorbrengen.
Reptielen zoals slangen en hagedissen vormen geen groot gevaar voor de monarchvlinder. Hoewel reptielen uitgesproken insecteneters zijn, komen ze relatief weinig voor in de bergstreken waar de monarchvlinders overwinteren.[3] Ook in het noordelijke verspreidingsgebied van de oostelijke populatie zijn reptielen betrekkelijk zeldzaam in vergelijking met andere delen van Midden- en Noord-Amerika.
Er zijn verschillende ongewervelden die jagen op diverse stadia van de monarchvlinder. Het gif van de vlinder werkt sterk irriterend op gewervelde dieren maar werkt niet altijd op ongewervelden. De jongere rupsen bijvoorbeeld zijn voor vrijwel alle roofinsecten goed eetbaar omdat ze nog weinig gif bevatten. De oudere rupsen en volwassen vlinders worden echter belaagd door verschillende carnivore insecten zoals wespen, roofkevers, mieren en verschillende soorten wantsen, zoals soorten uit het geslacht Zelus. Wespen die de rups doden eten deze niet zelf op maar voeren de rups aan de wespenlarven in het nest. De giftige verbindingen in het lichaam van de rups kunnen echter zorgen voor een verstoorde voortplanting en schade aan het nest.
Vrijwel geen van de genoemde insecten is echter in staat om de volwassen monarchvlinder te grijpen, vanwege de grootte van de dieren. Een uitzondering vormen enkele soorten libellen, die een stuk groter worden en zowel behendige vliegers als felle rovers zijn.
De rups wordt belaagd door een aantal parasitaire insecten, die als parasitoïde aan te merken zijn. Ze parasiteren dus niet alleen maar leiden uiteindelijk tot de dood van de rups. Het betreft verschillende sluipvliegen (Tachinidae) en sluipwespen (Ichneumonidae).[45] Zowel sluipvliegen als sluipwespen sporen insectenlarven op en zetten hierin een of meerdere eieren af. De vliegen- en wespenlarven eten de rups van de monarchvlinder van binnenuit op. De parasietenlarven eten eerst de reserves op, de vitale organen van de rups komen als laatste aan de beurt, vlak voor de verpopping. Zo voorkomen ze, dat de rups sterft voordat de parasietenlarven zijn ontwikkeld, ze kunnen namelijk niet leven van dood, rottend weefsel. Nadat de rups is gedood kruipen de parasietenlarven enige tijd later naar buiten. De larven van sluipvliegen verlaten het lichaam door zich naar de bodem te laten zakken aan een slijmdraad.[44] Hierdoor is een door een sluipvlieg gedode pop als zodanig te herkennen. De vliegenlarven boren zich vervolgens in de grond, waar ze verpoppen. Sluipwespen verpoppen in of op de rups zelf en kunnen zich in grotere aantallen ontwikkelen. Er is een geval beschreven waarbij uit een enkele dode rups 32 kleine wespjes tevoorschijn kwamen.[45]
Sommige vijanden van de vlinder komen in het natuurlijke verspreidingsgebied niet voor, maar kunnen de giftige rupsen van de monarchvlinder toch eten. Een voorbeeld is de roofwants Cermatulus nasalis, die voorkomt in Australië en Nieuw-Zeeland. Deze wants steekt zijn naald-achtige zuigsnuit in de rups en zuigt hem leeg.[46]
Naast direct vijandige insecten die de rups opeten hebben de rupsen ook te lijden onder voedselconcurrenten die tot de insecten behoren. Een bekend voorbeeld is de kever Tetraopes tetrophthalmus, die leeft van verschillende soorten zijdeplanten.
Naast insecten wordt de monarchvlinder belaagd door verschillende spinnen. Het zijn met name de webproducerende spinnen die de volwassen vlinders in hun web vangen. Een aantal soorten spint een in het web verstrikt geraakte monarchvlinder in om deze leeg te zuigen. Er zijn echter spinnen die de vlinder als oneetbaar beschouwen. In dit laatste geval knipt de spin de vlinder uit het web.[3]
Alle stadia van de monarchvlinder kunnen worden geïnfecteerd door de eencellige parasiet Ophryocystis elektroscirrha, die behoort tot de familie Ophryocystidae. De meeste soorten uit deze familie besmetten kevers, maar Ophryocystis elektroscirrha is bekend van enkele vlinders zoals de monarchvlinder.[47] De parasiet tast de huid- en voortplantingsweefsels aan van zowel de rupsen als de vlinders. Vaak manifesteert de parasiet zich in eierleggende vrouwtjes, waardoor een afgezet ei is omringd met sporen. Zodra de rups uitkomt wordt van het blad gegeten en vindt de besmetting plaats. Onder normale omstandigheden richt de parasiet de vlinder niet te gronde, maar houdt zich slechts in leven door de vlinders steeds te besmetten.[3] Bij monarchvlinders is aangetoond dat ze hun nageslacht kunnen "genezen" van Ophryocystis elektroscirrha. De vrouwtjes zetten hun (besmette) eitjes bij voorkeur af op bepaalde soorten uit het plantengeslacht Asclepias. Die soorten verkleinen de infectie.[48]
Bepaalde virussen ontwikkelen zich in de rups en kunnen grote groepen rupsen besmetten. Vooral kernpolyedervirussen zijn bekend. Deze doden de rupsen van een groot aantal vlinders.[49] Het virus ontwikkelt zich in het darmstelsel van de rups en richt uiteindelijk bijna 100% van de besmette rupsen te gronde. De rups vertoont uiterlijk geen symptomen maar stopt uiteindelijk met eten, waarna het lichaam steeds slapper wordt. De geïnfecteerde rups of pop kleurt uiteindelijk zwart en de inwendige organen lossen op. Vaak barst de huid uiteindelijk open, waarbij een slijmerig goedje tevoorschijn komt.[44] De virussen tasten alleen insecten aan en vormen geen gevaar voor de mens. Hierdoor worden kernpolyedervirussen op grote schaal als biologisch bestrijdingsmiddel ingezet.[49]
De monarchvlinder heeft binnen zijn verspreidingsgebied te lijden onder dieren en planten die daar oorspronkelijk niet voorkwamen. Dergelijke organismen worden exoten genoemd en de soorten die kunnen overleven en schade aanrichten staan bekend invasieve soort. Sommige van dergelijke invasieve soorten kunnen de populaties van de monarchvlinder decimeren. De vuurmieren uit het geslacht Solenopsis zijn hiervan een voorbeeld. In het zuiden van de Verenigde Staten komen deze vijanden van veel andere insecten soms algemeen voor en het gif dat de rupsen van de monarchvlinder bij zich dragen beschermt ze niet tegen andere insecten. Dit kan desastreuze gevolgen hebben voor de vlinder. Met name de soort Solenopsis invicta, die in de jaren 20 uit Zuid-Amerika is geïntroduceerd en alle ongewervelden, hagedissen en bodembewonende vogels die op zijn pad komen vernietigt, is een bedreiging. Op plaatsen waar de mier voorkomt, wordt bijna 100 procent van alle eieren en rupsen van de monarchvlinder opgegeten.[3] Een andere vuurmier die, in tegenstelling tot Solenopsis invicta, van nature in het verspreidingsgebied van de vlinder voorkomt is Solenopsis geminata. Deze vuurmier heeft een veel beperktere negatieve invloed op de monarchvlinder.
Sommige planten vormen indirect een bedreiging voor de vlinder. Een voorbeeld is de zwarte engbloem (Vincetoxicum nigrum). Deze soort behoort net als de waardplanten van de rups tot de maagdenpalmfamilie. De plant is eveneens giftig. Desondanks is de zwarte engbloem ongeschikt als voedsel voor de rups, aangezien de plant zo giftig is dat de rups het niet overleeft. Uit studies blijkt dat de eitjes die op de plant worden afgezet meestal niet tot ontwikkeling komen. De zwarte engbloem is in de Verenigde Staten een zeer beruchte invasieve soort, die binnen korte tijd hele velden kan overwoekeren waardoor andere planten geen kans maken. Niet alleen op landbouwgrond vormt de plant een plaag, maar ook in bermen en op braakliggende delen komt de soort voor en overwoekert onder andere de zijdeplanten.[3] De zwarte engbloem is oorspronkelijk een Europese soort, die gedurende de Tweede Wereldoorlog naar de Verenigde Staten werd gebracht. De snelgroeiende plant zou erg geschikt zijn om latex te produceren, waar een schrijnend tekort aan was. Latex was nodig voor de fabricage van rubber voor pakkingen, afsluitringen en andere technische onderdelen. De plant bleek ongeschikt voor de grootschalige productie van latex, maar wist zich in de natuur te handhaven en te verspreiden. Omdat de plant in Amerika geen concurrenten kent en pathogenen als schimmels en bacteriën, en aan de plant knagende herbivoren zoals insecten van nature niet voorkomen, kon de soort zich in hoog tempo verspreiden. Tegenwoordig komt de zwarte engbloem voor in grote delen van het verspreidingsgebied van de monarchvlinder.
De monarchvlinder komt oorspronkelijk voor in Amerika, met name in Midden- en Noord-Amerika. De monarchvlinder kent in Noord- en Midden-Amerika twee populaties: een oostelijke populatie en een westelijke populatie. De twee populaties worden gescheiden door een voor veel dieren onneembare barrière: de Rocky Mountains. Deze bergketen is gelegen aan de westkant van de Verenigde Staten en strekt zich uit van het noorden tot het zuiden van het land. De Rocky Mountains is een hooggebergte dat zelfs voor mensen moeilijk is over te komen. Er zijn echter aanwijzingen dat er in warme jaren toch een uitwisseling tussen beide populaties plaatsvindt. Vroeger werd gedacht dat deze vermenging gevaarlijk zou zijn voor met name de kleinere westelijke populatie. De exemplaren uit de oostelijke populatie zouden ziekteverwekkers als schimmels en parasieten kunnen verspreiden. Tegenwoordig wordt ook wel de theorie geopperd dat de oostelijke populatie regelmatig de westelijke heeft aangevuld in warme jaren.
De westelijke populatie is de kleinste. Deze vlinders leven ten westen van de Rocky Mountains. Ze houden hun winterslaap in het uiterste zuidwesten en trekken naar het noorden in de lente en zomer. Het aantal per overwinteringsplaats kan oplopen tot honderdduizend exemplaren.
De oostelijke populatie is veruit de grootste. Er zijn kolonies bekend met 20 tot 30 miljoen monarchvlinders. De oostelijke populatie overwintert in zuidelijk Mexico.
Naast het verschil in aantallen zijn er nog andere verschillen tussen de twee populaties. De westelijke populatie heeft een aanzienlijk kleiner verspreidingsgebied dan de oostelijke. Ten slotte verspreiden de exemplaren van de westelijke populatie zich diffuus, de vlinders van de oostelijke populatie trekken meer in groepen naar het noorden.
Wat beide populaties gemeen hebben is dat ze in de lente uit hun winterschuilplaatsen komen om gedurende de zomer naar het oosten en noorden te trekken. Tijdens de trek zetten de vrouwtjes eitjes af en ontwikkelt zich een tweede generatie. Dit herhaalt zich vervolgens een aantal keer. Aan het eind van de zomer vliegt de laatste generatie in één beweging terug naar het zuiden om te overwinteren. Na de winterslaap begint deze cyclus opnieuw.
Veel Amerikanen komen de vlinders twee keer per jaar tegen, eenmaal in de lente als ze noordwaarts trekken en eenmaal in de herfst als ze naar het zuiden terugkeren. Vooral in de Amerikaanse staat Texas is dit het geval, aangezien Texas een soort 'bottleneck' vormt bij de migratie van de monarchvlinder. Texas speelt hierdoor een belangrijke rol bij de trek van de monarchvlinder. Bij de exemplaren die uit hun winterslaap komen en naar het noorden vliegen, is Texas het belangrijkste afzetgebied van de eerste eitjes van de vrouwtjes. Vrijwel de gehele eerste generatie van het jaar is daarom afkomstig uit deze staat. Als de vlinders van volgende generaties in de herfst massaal naar het zuiden trekken is Texas de laatste stop voordat het winterkwartier wordt bereikt.
Buiten het natuurlijke verspreidingsgebied komt de vlinder inmiddels voor in verschillende werelddelen. In delen van het totale verspreidingsgebied komt de vlinder slechts voor als dwaalgast, zoals in delen van Europa. In andere delen, zoals Azië, komt de vlinder het gehele jaar door voor. Ook op de Canarische Eilanden heeft de vlinder zich permanent gevestigd.
In Europa komt de vlinder soms voor als Amerikaanse zwermen de Atlantische Oceaan oversteken. Voorbeelden van landen waar de monarchvlinder is aangetroffen zijn Engeland, Frankrijk, Portugal en Spanje.[50]
De verspreiding van de monarchvlinder naar Australië en delen van Azië is een apart verhaal. De vlinder was hier namelijk nog nooit waargenomen tot ze in 1870 voor het eerst in Australië werd gezien.
De monarchvlinder heeft een haast iconische status als trekvlinder; de jaarlijkse trek van vele miljoenen exemplaren is een van 's werelds bekendste fenomenen uit de natuur.[51] Er zijn wel meer soorten vlinders die trekken en in grote groepen overwinteren, zoals de Amerikaanse Anetia briarea, maar de afstanden die de monarchvlinder aflegt en de aantallen waarmee ze dat doen zijn ongekend in de insectenwereld. De vlinder is hierdoor een van de bekendste Amerikaanse insecten en de groepen van monarchvlinders zijn in vele documentaires en boeken vastgelegd.
Als de vlinders in het voorjaar ontwaken vindt de paring plaats, en begint een trek naar het noorden. De trek is op verschillende manieren bijzonder. Ten eerste de hoeveelheden vlinders; ze vliegen in aantallen van vele miljoenen tegelijk. Daarnaast is de trek van de vlinders opmerkelijk omdat de exemplaren die de trek in gang zetten al na enkele weken sterven; het zijn de twee volgende generaties die de trek noordwaarts voortzetten en een vierde generatie die zich vol eet om voldoende reserves aan te leggen om de trek naar het zuiden te kunnen maken en daar in grote groepen van soms tientallen miljoenen exemplaren te overwinteren. In de volgende lente worden de vlinders weer actief en begint de voortplantingstijd opnieuw.
De migratie bestaat dus uit twee delen: een noordwaartse trek in de lente en zomer waarbij de dieren zich voortplanten en de aantallen steeds groter worden en een zuidelijke trek waarbij de vlinders zich meestal niet voortplanten maar direct doorvliegen naar bepaalde berggebieden in Mexico.
Over het hoe en waarom de van de trek van zuid naar noord is inmiddels veel bekend. De rups van de vlinder leeft van planten die alleen groeien gedurende een bepaald seizoen. In het noorden van Noord-Amerika is het in de winter te koud en te droog voor deze planten en in het zuiden is het in de zomer te heet. In het zuiden groeien de planten alleen in de lente en in het noorden sterven de planten als de winter aanvangt. De vlinder volgt deze zich noordwaarts bewegende 'band' van zijdeplanten waarbij ze gebruikmaken van de zon als kompas.
Het is de trek naar het zuiden die nog steeds met raadsels is omgeven. De vlinders die van zuid naar noord trekken zijn al lange tijd dood voordat de exemplaren van de laatste (noordelijkste) generatie de lange tocht naar het zuiden aanvangen. Deze migrerende vlinders bewegen zich in een richting tegengesteld aan die van de (groot)ouderdieren en het mechanisme hierachter is nog niet begrepen. Ze kunnen niet geleerd hebben dat ze naar het zuiden moeten trekken en tevens moet de reden voor de uitgestelde voortplanting nog worden vastgesteld.
De totale oostelijke populatie van de monarchvlinder strekt zich uit van zuidwestelijk Mexico, waar de dieren overwinteren, tot boven de grens met Canada. De populatie wordt begrensd door de vegetatiegroei; als er geen zijdeplanten zijn kunnen de rupsen zich niet ontwikkelen. Er zijn echter ook vlinders aangetroffen die ver buiten dit gebied zijn geraakt, zoals op open zee.
De eerste vlinders die te zien zijn, zijn feitelijk de overwinterde exemplaren van het vorige jaar. De monarchvlinder overwintert in grote groepen en de enorme clusters van vlinders vallen in februari tot maart uiteen, waarbij de vlinders in grote oranje wolken zwermen en vaak een paring plaatsvindt. Ze trekken dan naar het noorden waarbij ze zich voortplanten. De vrouwtjes van met name deze exemplaren hebben vaak moeite een geschikte voedselplant te vinden voor de rupsen. De rupsen eten alleen zijdeplanten, die soms nog niet ontkiemd zijn als de vrouwtjes eitjes proberen af te zetten. De vrouwtjes vliegen zover mogelijk naar het noorden voor ze hun eitjes afzetten. De reden hiervoor is dat de weinige geschikte zijdeplanten in Mexico al snel voorzien zijn van eieren door de eerst aangekomen vrouwtjes. Een zijdeplant is door de vraatzucht van de rupsen slechts geschikt voor de ontwikkeling van enkele exemplaren. Een vrouwtje zal proberen haar eieren op een 'lege' plant af te zetten omdat dit de kansen van de larven vergroot.
De eerste generatie vlinders wordt grotendeels geboren in de staat Texas. De vrouwtjes uit de generatie van het vorige jaar zijn aangetroffen tot in de staat New York maar dit zijn zeldzame uitzonderingen. De exemplaren die tot de eerste generatie behoren leven in de lente en vliegen tot in de staten Alabama, Florida, Louisiana, Mississippi en met name Texas.[3] De vlinders die als eerste uit het ei komen ontwikkelen zich als de omstandigheden meezitten snel. Binnen een maand zijn ze volwassen en kunnen direct met elkaar paren. De eitjes die hieruit voortkomen vormen de tweede generatie.
De vlinders van de tweede generatie leven gedurende de vroege zomer en trekken langzaam verder noordwaarts, waarbij ze onderweg paren. Een vrouwtje kan vier tot vijf keer paren gedurende haar leven. De tweede generatie komt meestal niet verder dan de staten in het centrale deel van de VS, de zogenaamde Corn Belt, met de staten Arkansas, Georgia, Illinois, Indiana, Kansas, Kentucky, Missouri, North Carolina, Oklahoma, South Carolina, Tennessee en Virginia. Het centrale deel van de Verenigde Staten wordt gekenmerkt door grootschalige akkerbouw, waar voldoende zijdeplanten te vinden zijn.
De derde, en soms ook nog een vierde, generatie van de vlinder, bereikt aan het eind van de zomer het noordelijkste deel van het verspreidingsgebied, de grens tussen de Verenigde Staten en Canada. De waardplanten van de rupsen, de zijdeplanten, kunnen niet tegen koude, en de noordgrens van hun verspreiding ligt bij de 50e tot 52e breedtegraad. De grens loopt westwaarts van de zuidelijke prairies van Canada in de provincies Nova Scotia, New Brunswick, Ontario en Quebec, tot oostwaarts langs de kust van het Bovenmeer. De vlinders vliegen soms hun doel voorbij en kunnen veel noordelijker worden aangetroffen. Ze kunnen hier echter geen voedselplanten vinden voor de larven. De monarchvlinder is aangetroffen tot in de laaglanden rond de Hudsonbaai en de Jamesbaai. Er is zelfs een waarneming van de vlinder in de Northwest Territories in het noorden van Canada. In het oosten wordt de vlinder gevonden op het eiland Newfoundland, terwijl hier geen zijdeplanten voorkomen.
De derde en vierde generatie vlinders ontwikkelen zich aan het einde van de zomer in het noorden van de Verenigde Staten en het zuiden van Canada. Deze generaties hebben het noordelijkste deel van het verspreidingsgebied bereikt en trekken niet verder. De vlinders die aan het einde van de zomer worden geboren wijken af van de eerdere generaties en zijn nog niet vruchtbaar. Ze kunnen zich hierdoor nog niet voortplanten en steken hun tijd in het verzamelen van zo veel mogelijk voedsel. De vetreserve van de vlinder wordt zo aangevuld voor de lange tocht naar het zuiden en de daaropvolgende overwintering. Heel soms worden vruchtbare vlinders geboren, die op hun weg terug naar Mexico voor een vijfde generatie zorgen.
Aan het eind van de zomer bevindt de laatste generatie van de monarch zich in het noorden van het verspreidingsgebied. Bloeiende planten waaruit de volwassen vlinders nectar drinken worden steeds zeldzamer. Rond die tijd zijn de dagen korter, daalt de temperatuur, en zijn er te weinig voedselplanten voor de rupsen om zich nog volledig te kunnen ontwikkelen.[52] Bovendien zou die ontwikkeling door de dalende temperatuur langer duren. Daarom wordt de voortplanting uitgesteld; zo hoeven de vlinders geen tijd en energie in de paring en het zoeken naar geschikte planten voor het nageslacht te steken. In plaats van zich voort te planten, vreet de vlinder zich vol, waarna de trek kan beginnen.
De uitgestelde voorplanting wordt veroorzaakt door hormonale veranderingen in de rups van de wintergeneratie. De ontwikkeling van de pop verloopt iets anders dan bij de vlinders van de vorige generatie. De vlinder heeft hierdoor beter ontwikkelde vliegspieren, en de vetlichamen van de vlinder zijn groter wat de lange tocht naar het zuiden mogelijk maakt.[3] De wintergeneratie heeft niet alleen grotere maar ook meer vetlichamen en neemt meer nectar op om reserves op te bouwen. Het zwaardere lichaam verhoogt het glijgetal aanzienlijk wat de glijvluchten makkelijker maakt, zodat ze grotere afstanden kunnen afleggen.
De migratie naar het zuiden vangt aan rond augustus, heeft een piek in het midden van september, en kan tot oktober aanhouden. De vlinders trekken niet in groepen naar het zuiden - zoals bij vogels voorkomt - maar vliegen individueel.
De geslachtsorganen van de wintergeneratie zijn onderontwikkeld als de migratie aanvangt, de vlinders zijn hierdoor niet geïnteresseerd in de voortplanting. Pas na de tocht naar het zuiden en de overwintering in Mexico komen de geslachtsorganen tot volledige ontwikkeling en paren de vlinders voor het eerst. Ze zijn dan al vier tot vijf maanden oud.
De monarchvlinder gedraagt zich tijdens de zuidelijk migratie heel anders dan de generaties die eerder in het jaar naar het noorden zijn getrokken. De eerste generaties planten zich voort en de vrouwtjes moeten vervolgens naar voedselplanten zoeken om de eitjes op af te zetten. Hierdoor moeten de vlinders dicht bij de bodem blijven om geschikte partners en planten op te sporen. Bij dit zoeken vliegt de vlinder zowel fladderend als zwevend. Een fladderende beweging kost meer energie dan wanneer de vlinder zich met de wind laat meevoeren en glijvluchten maakt. De generatie die naar het zuiden terugkeert maakt voornamelijk glijvluchten om energie te sparen, bovendien bevinden de vlinders zich op een veel grotere hoogte bij de trek naar het zuiden. Uit onderzoek blijkt dat de monarchvlinder tot op een hoogte van 1200 meter kan worden aangetroffen. De snelheid waarmee de dieren vliegen is tot 18 kilometer per uur.[3]
Tijdens de trek naar het zuiden vinden de vlinders de weg ook als het bewolkt is, wat aannemelijk maakt dat ze voor het navigeren niet de zon hoeven te zien. Waarschijnlijk gebruiken ze de ultraviolette straling van de zon. Van de monarchvlinder is bekend dat het samengesteld oog zintuiglijke cellen bevat die UV-licht kunnen waarnemen. Deze cellen zijn gelegen in de bovenste rand van het oog.[23]
De vlinder moet dagelijks rusten en eten. Ook dient de watervoorraad regelmatig aan te worden gevuld. De vlinders kiezen vaak plasjes regenwater of rottend fruit om aan water te komen. Hierbij kunnen ze soms in grote groepen worden aangetroffen. Als de vlinders aan het eind van de herfst de staat Texas naderen, kunnen ze in groepen vliegen. Texas vormt een flessenhals waar alle vlinders langs komen. Omdat ze in grote aantallen aankomen maar niet alle plaatsen geschikt zijn om te rusten, overnachten vaak veel exemplaren in dezelfde boom. Uit onderzoek door Urquhart blijkt dat ze daarbij de lijzijde van de boom uitkiezen, dus uit de wind. Zo worden ze beter beschermd tegen koude en uitdroging. Hoe dichter de vlinders hun eindbestemming naderen, hoe groter de concentraties vlinders worden. Als de vlinders hun bestemming in Mexico bijna hebben bereikt kunnen ze in enorme oranje wolken worden aangetroffen.
Dat de monarchvlinder overwintert als volwassen vlinder was onder wetenschappers al sinds lange tijd bekend omdat er nooit overwinterende eieren, rupsen of poppen zijn aangetroffen. De westelijke populaties waren al goed beschreven omdat ze in kuststreken overwinterden ten westen van de Rocky Mountains en enkele van de overwinteringsgebieden beschreven waren. Waar de vlinders van de oostelijke populaties zich ophielden gedurende de winter was echter lange tijd een groot mysterie. Pas in 1976 (!) ontdekte de Canadese zoöloog Fred Urquhart de populaties in Mexico. Urquhart schreef er een onder lepidopterologen beroemd artikel over in National Geographic Magazine.[53] Urquhart beschreef ook zijn gevoelens bij het aantreffen van de reusachtige hoeveelheden vlinders:
Until now, no one had known. But here before me, on scarcely twenty acres of lofty wooded slope in central Mexico, the monarchs crowded by the millions to while away midwinter months in semidormancy.
Vertaling: Tot op dit moment had niemand er weet van. Maar hier voor me, op nauwelijks 20 acres [8 hectare] indrukwekkend beboste berghelling in midden Mexico, dromden de monarchvlinders bij miljoenen samen om de tijd van de wintermaanden in halfslaap te verdrijven.
De gebieden waar de vlinders overwinteren liggen in de bergen van de aan de westkust gelegen staten Mexico en Michoacán. Het hier gelegen gebergte wordt de Trans-Mexicaanse Vulkanengordel genoemd, en bestaat uit vulkanen. De locaties zijn moeilijk toegankelijk en relatief hooggelegen. De vlinders overwinteren op een gemiddelde hoogte van 2500 tot 3650 meter boven zeeniveau.[3] De begroeiing bestaat uit heilige zilverspar (Abies religiosa, ook wel oyamel-den genoemd). Deze bomen kunnen 25 tot 50 meter hoog worden. Ook niet-inheemse bomen kunnen worden gebruikt, zoals de blauwe gomboom (Eucalyptus globulus).
In de zomer, als de vlinders aan het trekken zijn in Noord-Amerika, zijn dergelijke bossen zogenaamde nevelbossen. In de winter, als de vlinders overwinteren, bieden deze bergbossen de ideale habitat voor de vlinders. Het is er koel maar niet te koud wat dodelijk kan zijn en het warmt overdag genoeg op om enige beweging toe te laten. Net als alle insecten kunnen vlinders pas bewegen boven een bepaalde minimumtemperatuur.
De minimumtemperatuur is ongeveer 6 tot 9 graden en de maximumtemperatuur is 13 tot 15 graden. De bodemtemperatuur onder de bomen van de heilige zilverspar is ongeveer 2 tot 5 graden Celsius hoger dan die in andere delen van het bos. Het wordt niet zo warm dat de vlinders erg actief worden zodat ze niet te veel energie kunnen verbruiken. De luchtvochtigheid is hier hoog zodat er niet snel bosbranden uitbreken. De hoge luchtvochtigheid zorgt er tevens voor dat de vlinders niet uitdrogen. De monarchvlinder kan zich in de bomen verplaatsen al naargelang de temperatuur. In het begin van de winter zijn de kolonies vooral te vinden in de boomtoppen maar als het hartje winter kouder wordt verplaatsen de vlinders zich naar lager in de boom waar het warmer is. De monarchvlinder kan een korte periode van bevriezing overleven als de luchtvochtigheid laag is. Als de temperaturen lager worden verliezen de vlinders het vermogen om te vliegen. Ze zijn dan kwetsbaar voor vijanden omdat vlinders niet snel weg kunnen rennen en ze kunnen zich niet in kleine openingen verstoppen zoals andere insecten. In het noordelijke deel van het verspreidingsgebied is het geen uitzondering dat de temperatuur beneden het activiteitsniveau van de vlinder daalt. Om hun lichaamstemperatuur te verhogen, zoeken de vlinders elkaar op. Dit gebeurt altijd in hoge bomen. De vlinders kruipen in enorme groepen op elkaar, zodat hun vleugels meerdere lagen vormen die de warmte goed vasthouden.
Over het totale aantal vlinders bestaat nog enige speculatie. Het aantal kan bovendien sterk verschillen per jaar. In een succesvol seizoen wordt het aantal geschat op meer dan 100 miljoen overwinterende vlinders. In het seizoen 2001-2002 bijvoorbeeld waren naar schatting 120 miljoen vlinders aanwezig, verspreid over de verschillende kolonies.[3]
Als de lente nadert bevinden de vlinders zich inmiddels zo'n vier tot vijf maanden in de kolonie. Ze worden aan het begin van de lente steeds actiever omdat ze grotendeels door hun reserves heen zijn. De vlinders komen regelmatig naar de bodem om van plasjes water en nectar van planten te drinken. De vlinders doen volgens bioloog Phil Schappert denken aan 'oranje sneeuw' vanwege de enorme aantallen omhoog en omlaag fladderende exemplaren. Rond februari en maart verlaten de vlinders de kolonies. Als het warmer wordt rijpen de geslachtsorganen van de vlinders en zijn ze in staat om te paren.
De westelijke populatie is aanmerkelijk kleiner dan de oostelijke, zowel wat betreft de grootte van het leefgebied als de aantallen vlinders. Geschat wordt dat 10% van de monarchvlinders in het westelijke deel leeft en 90% in het oostelijke deel van de VS. De westelijke populatie leeft langs de westkust van het zuiden en midden van de Verenigde Staten, grofweg van San Francisco tot San Diego. Het leefgebied van de populatie wordt in het westen begrensd door de Stille Oceaan en in het oosten door de Rocky Mountains. De vlinders steken deze bergketen voor zover bekend zelden over.
De dieren van westelijke populatie zijn identiek aan die van de oostelijke populatie; het vele onderzoek naar de soort heeft laten zien dat ze niet als verschillende ondersoorten of variaties kunnen worden opgevat. Er wordt vermoed dat sommige groepen van vlinders uit de oostelijke populatie soms hun weg vinden door het gebergte en zich bij de westelijke populatie aansluiten.
De monarchvlinder heeft zich in 1870 gevestigd in Australië. In 1871 werd de soort gesignaleerd rond Sydney. Pas toen de voedselplanten van de vlinder werden geïntroduceerd kon de monarch zich handhaven en verspreiden. Omdat zijdeplanten vooral rond door de mens bewoonde gebieden zijn te vinden, worden de vlinders voornamelijk in en rond steden gevonden.
Hoe de vlinders erin geslaagd is Australië te bereiken is nog steeds niet geheel bekend. Aangezien de vlinders enorme afstanden afleggen zouden ze er op eigen kracht gekomen kunnen zijn, maar het is aannemelijker dat de mens hier een rol bij gespeeld. Eén theorie is dat de zuidwaarts migrerende vlinders op een boot zijn geland en zo naar Australië zijn gebracht. Een andere theorie is dat de vlinder zich eerst vestigde op de ten oosten van Australië gelegen eilandengroep Nieuw-Caledonië en van hieruit het continent heeft gekoloniseerd. Het zou ook kunnen dat de in Australië voorkomende cyclonen een rol hebben gespeeld. Van cyclonen is bekend dat ze zelfs vogels van het ene naar het andere eiland hebben gevoerd. De kust van de staat Queensland werd in het jaar 1870 drie keer bezocht door een dergelijke cycloon.[54]
In Australië komt de monarchvlinder voor in de deelstaten Queensland, Nieuw-Zuid-Wales, Victoria en Zuid-Australië, alle in het oosten. In het uiterste zuidwesten komen populaties voor bij de stad Perth in de deelstaat West-Australië. De monarchvlinder vertoont ook in Australië trekgedrag. De vlinders die meer landinwaarts leven trekken aan het eind van de zomer terug naar de kust, waar ze overwinteren. Net als hun soortgenoten in Amerika vormen ze hierbij grote groepen in bomen. Dergelijk clusters kunnen honderdduizenden exemplaren bevatten.[55]
De meeste dieren in Australië weten zich geen raad met de giftige rupsen en vlinders en laten ze met rust. Alleen van sommige Australische vogels zoals de klauwierkraaien uit het geslacht Strepera is bekend dat ze de volwassen vlinders eten. Sommige wantsen zuigen de rupsen leeg.
Van Nieuw Zeeland wordt verondersteld dat de vlinder er voorkomt sinds 1840 maar die waarnemingen werden pas 38 jaar later gerapporteerd en er zijn geen collecties van bekend. De eerste betrouwbare wetenschappelijke publicaties over de monarchvlinder in Nieuw Zeeland dateren van 1868 en 1873.[56] Dat de vlinders ook in Nieuw Zeeland overwinteringsgedrag vertonen waarbij ze in grote clusters te vinden zijn, is pas sinds 1959 bekend. Een krantenartikel in 2003 met een vraag aan het publiek om clusters te rapporteren, bracht aan het licht dat ze in elk geval vanaf 1980 in de voorsteden van de stad Christchurch overwinteren.[56]
De monarchvlinder heeft zich gedurende de negentiende eeuw verspreid over delen van Zuidoost-Azië. De monarchvlinder is te vinden van uiterst zuidelijk China inclusief Taiwan en de vele eilanden van de Indische Archipel ten zuiden hiervan, zoals Maleisië, Indonesië, Papoea-Nieuw-Guinea en de Filipijnen, en op de daaraan aansluitende eilandengroepen in de Grote Oceaan, zoals de Salomonseilanden, Vanuatu, Fiji en Samoa, en het veel noordelijker gelegen Hawaï.
De belangrijkste bedreiging van de monarchvlinder is de mens. De natuurlijke omstandigheden zoals weer en klimaat kunnen de vlinder eveneens ernstige schade toebrengen. De grootste natuurlijke bedreiging van de vlinder vormt het klimaat van hun leefgebied in Noord-Amerika. De weersomstandigheden kunnen behoorlijk onstuimig zijn door bijvoorbeeld cyclonen, wat de populaties in extreme gevallen kan decimeren. Zowel de vlinders in winterslaap als de trekkende exemplaren staan bloot aan dergelijke grillen van de natuur. Als de winter doorzet of als er gedurende de winter krachtige stormen woeden, kunnen populaties zware schade oplopen. Er is gerapporteerd dat door een zware storm naar schatting tachtig procent van de exemplaren in twee kolonies in zuidelijk Mexico werden gedood. Na een strenge, koude winter komt de plantengroei langzamer op gang dan na een zachte winter. Na een zachte winter vinden de vrouwtjes een ruim voedselaanbod voor de larven. Na een strenge winter komen de vrouwtjes massaal naar gebieden waar nog geen sprietje groeit, waardoor ze hun eitjes niet af kunnen zetten. Zo'n scenario voltrok zich in de jaren 1995 en 1996 en later in 1998 en 2000 in de Amerikaanse staat Texas. In het jaar 2000 werd de vlinder hard getroffen en werden er slechts 30 miljoen overwinterende exemplaren geteld, tegenover 120 miljoen in het jaar 2001, dat juist bijzonder gunstig was.[3]
Ook droogte kan de aantallen monarchvlinders drukken. Als het gedurende langere tijd erg droog is, blijven de voedselplanten kleiner, soms te klein om de rups van voldoende voedsel te voorzien om de gehele ontwikkeling te doorlopen. Het gevolg is dat de rupsen langzamer worden en vatbaarder voor ziektes.[3]
De belangrijkste menselijke activiteit die de monarchvlinder bedreigt is ontbossing in de berggebieden in Mexico waar de vlinder overwintert. De lokale bevolking kapt bomen om brandhout voor de winter in te slaan. Hierdoor wordt het potentiële overwinteringsgebied ieder jaar kleiner. Niet alleen heeft het kappen van bomen als direct gevolg dat een boom niet meer gebruikt kan worden als overwinteringsplaats, ook zijn er verschillende indirecte gevolgen. Als er in de buurt van dergelijke locaties bomen worden gekapt ontstaan open plekken in het bladerdek waardoor warmte minder goed wordt vastgehouden door het bos. Roofdieren zoals vogels die normaal gesproken niet in dichte bossen leven, kunnen via open plekken de kolonies beter benaderen. Ten slotte kunnen weersinvloeden als regen en wind meer schade aanrichten in een bos met open plekken dan in het dichte woud.
Andere menselijke activiteiten, zoals het verkeer, doden jaarlijks vele vlinders. Uit een studie naar het door het verkeer gedode aantal vlinders in de Amerikaanse staat Illinois kwam naar voren dat per week meer dan 20 miljoen vlinders werden doodgereden, waarvan naar schatting 500.000 monarchvlinders. Het totale aantal monarchvlinders dat in het gehele verspreidingsgebied door het verkeer wordt aangereden moet dan in de miljoenen lopen.[3]
De opwarming van de Aarde kan mogelijk voor problemen zorgen. Voor de vlinders die van het zuiden naar het noorden trekken zal deze opwarming waarschijnlijk geen grote veranderingen teweegbrengen maar voor de overwinterende exemplaren ligt dit anders. Er zijn aanwijzingen dat de vlinders hun winterkwartier steeds vroeger verlaten omdat de temperaturen hoger worden. Dat gaat alleen goed als ook de voedselplanten, synchroon met de stijgende temperatuur, eerder uitlopen en groeien. Zo niet, dan duurt het voor de vlinders langer voordat er voldoende voedsel beschikbaar is voor de rupsen.
Bij een stijgende temperatuur kan een deel van het bos ongeschikt worden als overwinteringsgebied. De huidige overwinteringsplaatsen liggen in bergstreken van verschillende hoogtes. Deze bossen zijn koel maar niet te koud, en hebben in de winter een stabiele temperatuur waardoor de vlinders in rust kunnen blijven. Als de temperaturen stijgen verliezen de lager gelegen delen van het bos deze functie als temperatuurbuffer en zijn niet meer geschikt als overwinteringsplaats.[3]
Een ander mogelijk gevolg van het opwarmen van de aarde is het veranderen van het verspreidingsgebied van de planten waarvan de vlinder eet als rups. In het noorden zullen de planten meer voorkomen, maar de zuidgrens van het verspreidingsgebied zal zich noordwaarts verplaatsen. Hierdoor wordt de afstand tussen de overwinteringsplaatsen en de voedselplanten groter, zodat de vlinders verder moeten vliegen om hun eitjes af te zetten.
In Noord-Amerika komen soms extreme weersomstandigheden voor als gevolg van de klimaatfenomenen El Niño en La Niña. Door de opwarming van het zeewater kan het weerpatroon gedurende enige jaren drastisch veranderen en droogte of juist extreme neerslag brengen.[3]
Niet alle menselijke activiteiten zijn echter schadelijk voor de monarchvlinder. Door het kappen van enorme hoeveelheden bos in de Canadese staat Ontario vanaf de jaren 40 tot in de jaren 90 werd het voedselgebied van de vlinder groter. Doordat het landschap open werd, kreeg de zijdeplant Asclepias syriaca de kans zich naar het noorden te verspreiden, van de 43e breedtegraad tot de 47e.[3]
De monarchvlinder wordt soms onbedoeld slachtoffer van pesticiden. De vlinder zelf wordt niet bestreden maar komt in contact met insecticiden die bedoeld zijn tegen plaaginsecten. Een voorbeeld is het gebruik van permetrine zoals is beschreven in het Amerikaanse dorp Gaylord in de staat Minnesota. Hier werden grote hoeveelheden gif gebruikt om muggen uit te roeien maar de bewoners zagen ook stervende vlinders. Achteraf bleek dat ze inderdaad waren vergiftigd door permetrine. De monarchvlinder kan de opname van dergelijke vergiften overleven, maar er zijn wel negatieve effecten op de levensduur en voortplantingscapaciteit.[3]
Bestrijdingsmiddelen als herbiciden worden gebruikt om planten te verdelgen en hebben geen direct effect op de vlinder maar zijn wel indirect verantwoordelijk voor schade aan de populaties. Herbiciden worden in de Verenigde Staten op grote schaal ingezet om wegbermen vrij te houden van grote struiken, wat de verkeersveiligheid bevordert. In de landbouw worden herbiciden op grote schaal ingezet. De zijdeplanten waarvan de rups leeft zijn giftig tot zeer giftig, en worden door veehouders gezien als onkruid. Als het vee grassen eet waar per ongeluk een zijdeplant tussen zit, kan een dier ziek worden wat tot economische schade leidt. In de praktijk komt dit zelden voor omdat de zijdeplanten allemaal een struikachtige groeiwijze hebben. Zijdeplanten worden vaak groter dan andere planten en hebben andere kleuren dan de grassen die in de wei staan. Zijdeplanten vallen dus goed op en grazers als koeien, schapen en paarden mijden zijdeplanten. Desondanks worden de planten in Noord-Amerika bestreden. Tussen 1995 en 2013 zou zo'n 21 procent van de zijdeplanten in de Verenigde Staten verdwenen zijn.[57] Het uitroeien van de voedselplanten voor de rups heeft uiteraard een negatieve invloed op de vlinder.[3]
Uit een onderzoek uit 1999 van de Cornell-universiteit zou blijken dat genetisch aangepaste mais mogelijk schade zou toebrengen aan de monarchvlinder. In de planten zit een voor planteneters giftig gen afkomstig van de bacterie Bacillus thuringiensis, en het gen zou middels het stuifmeel ook naar andere planten verspreid worden. Als de rups vervolgens bladeren eet waar het stuifmeel op terecht is gekomen, zou deze een grotere kans hebben op sterfte.[58] Vrouwtjes zouden zijdeplanten waarop het stuifmeel terecht was gekomen negeren in plaats van er eitjes op af te zetten. Het onderzoek werd wereldwijd breed uitgemeten in de pers omdat het zou aantonen dat de mens niet 'voor God' zou moeten spelen. Na vervolgonderzoek bleek echter geen significant negatief effect aantoonbaar. Ten slotte zou het soort stuifmeel van eerdere onderzoeken veel giftiger zijn dan de soorten die in de landbouw worden gebruikt. Het stuifmeel van mais bleek daarnaast minder ver door de wind te worden meegevoerd dan werd aangenomen. Dat vrouwtjes de door maisstuifmeel bedekte planten zouden negeren bleek in het geheel niet waar.[59]
Het intensieve onderzoek naar de monarchvlinder in maisvelden met betrekking tot de relatie met insecticiden bleek echter niet voor niets: het leverde veel gegevens op over de verspreiding van zijdeplanten in de buurt van maisvelden, en de hiermee gerelateerd verspreiding van de monarchvlinder.[3]
Ook in andere door de mens geteelde gewassen, zoals de katoenplant, worden insecticiden ingebouwd om rupsen te weren. De bij katoen gebruikte verbinding is een eiwit met de naam Cry1F, dat behoort tot de delta-endotoxinen. Het tast de ionenuitwisseling in de darmen van veel rupsen aan, waardoor de insecten inactief worden en sterven. De katoenplant die dergelijke voor insecten giftige stoffen produceert wordt aangeduid met het nummer 281-24-236.[60] De rupsen van de monarchvlinder komen zelden in contact met de katoenplant, omdat ze alleen zijdeplanten eten. De volwassen vlinders die van de nectar drinken hebben weinig last van de giftige verbindingen, doordat de concentraties te laag zijn. Het eiwit CRY1F heeft geen schadelijke werking op andere insecten zoals bijen.[60]
De monarchvlinder zelf wordt niet beschermd en heeft door de internationale natuurbeschermingsorganisatie IUCN de status "niet geëvalueerd" (Not Evaluated of NE) gekregen. De migratieroutes van de vlinders zijn echter wel deels beschermd. Enkele locaties waarvan bekend is dat de vlinders er in grote groepen overwinteren zijn tot "resting area" verklaard.[61] De monarchvlinder wordt beschouwd als bedreigd fenomeen.
In landen waar de vlinder voorkomt wordt met borden gewaarschuwd op te passen voor de vlinders om de dieren niet te verstoren. Een aantal overwinteringsgebieden is als beschermd gebied aangemerkt. De Mexicaanse regering verklaarde in 1986 een bergstreek van 16.000 hectare tot beschermd gebied om de monarchvlinder te beschermen. In het jaar 2000 werd dit gebied uitgebreid tot 56.000 hectare.[3]
De monarchvlinder geniet wereldwijd een grote bekendheid en wordt wel gebruikt als symbool, onder andere door de Noord-Amerikaanse Vrijhandelsovereenkomst (NAFTA), omdat het dier in alle drie de landen van deze organisatie voorkomt.
De vlinder staat model voor het logo van de Commission for Environmental Cooperation (CEC).[62]
De monarchvlinder trekt ieder jaar veel toeristen die de vlinder willen zien naar de rustgebieden. Het toerisme brengt geld in het laatje voor de lokale bevolking maar er wordt ook geopperd dat het toerisme een extra belasting betekent voor het bos.
De Monarch Award is een jaarlijkse prijs om kleuterscholen te stimuleren om kinderen te leren lezen. De naam monarch is gekozen om de overgang van niet-lezende kinderen naar zelfstandig lezende kinderen te symboliseren.[63]
De lokale bevolking beschouwt de vlinders als heilig. In de periode dat de vlinders in enorme aantallen als grote oranje wolken hun overwinteringsplaatsen verlaten, viert de bevolking de Dia de los Muertos ('Dag van de Doden'), een heilig feest waarbij gevierd wordt dat de zielen van de overledenen naar de Hemel keren.[24] De vlinders zijn hierbij een metafoor voor de zielen die opstijgen naar de hemel.
De vlinders worden door studenten wel gebruikt om elkaar boodschappen te zenden. Deze worden aan de vleugels geplakt zodat studenten in noordelijker gelegen gebieden ze kunnen lezen.[24]
De monarchvlinder wordt door zijn grootte en kleuren beschouwd als erg sierlijk. De vlinders worden wel opgeprikt en in fotolijstjes verkocht. Een aantal bedrijven in onder andere Australië kweekt de vlinders in kassen om ze bij speciale gelegenheden vrij te laten. Men kan bijvoorbeeld vlinders bestellen om een bruiloft op te luisteren.[64]
De monarchvlinder (Danaus plexippus), ook wel monarch of Amerikaanse monarch, is een vlinder uit de familie Nymphalidae.
De monarchvlinder is een van de bekendste vlindersoorten van Noord-Amerika. De Noord-Amerikaanse populaties trekken in de lente in grote aantallen naar het noorden, waarbij zich verschillende generaties ontwikkelen, en keren in de herfst weer terug naar het zuiden, waar de soort in enorme groepen overwintert. De monarchvlinder is een vrij grote vlinder. De totale lichaamslengte is ongeveer 5 centimeter en de spanwijdte bedraagt tot 10 centimeter. De vleugels zijn opvallend gekleurd, waarbij de hoofdkleur oranje is. Het vleugeloppervlak wordt door de zwarte vleugeladering verdeeld in cellen. De vleugelrand heeft een brede zwarte zoom met daarin vele kleine witte vlekjes.
De monarchvlinder komt van oorsprong voor in Noord- en Zuid-Amerika en kent verschillende populaties. De ondersoort megalippe trekt niet en komt vooral op eilanden in het Caribisch Gebied voor. De ondersoort nigrippus komt voor in Midden-Amerika ten zuiden van Nicaragua, en in het noorden van Zuid-Amerika, en is eveneens geen trekker. De ondersoort plexippus, de nominaatvorm, komt voor in Noord-Amerika, en bestaat uit twee, door de Rocky Mountains van elkaar gescheiden populaties: een kleinere in het westen en een veel grotere in het oosten. Deze beide populaties hebben gemeen dat ze in de lente uit hun overwinteringsplaatsen komen om in de zomer naar het oosten en noorden te trekken. Tijdens deze trek zetten de vrouwtjes eitjes af en ontwikkelt zich een tweede generatie die verder noordwaarts vliegt. Dit proces herhaalt zich vervolgens een aantal keer. De vlinders volgen hierbij de zich noordwaarts verplaatsende groei van de plantensoorten die als voedsel voor de larven dienen. De rupsen kunnen zich namelijk enkel ontwikkelen op geschikte waardplanten.
De vertegenwoordigers van de oostelijke populatie kunnen door hun trekgedrag in grote delen van de wereld worden aangetroffen. De monarchvlinder komt oostwaarts voor tot delen van noordelijk Afrika en in delen van Europa. Westelijk heeft de monarchvlinder Australië en grote delen van Azië bereikt. De monarchvlinder is niet de enige migrerende soort, maar spant wat betreft de afgelegde afstanden de kroon. De vlinder legt afstanden af tot 4500 kilometer van de geboortegrond. De uiteindelijke nakomelingen van hun nakomelingen trekken in de herfst van het noorden van de Verenigde Staten weer terug naar het zuiden van Mexico om te overwinteren. Hier verzamelen ze zich in reusachtige groepen; sommige van dergelijke groepen kunnen meer dan 20 miljoen exemplaren bevatten. De volwassen monarchvlinder leeft ongeveer twee tot vijf weken, de wintergeneratie kan echter een leeftijd van wel acht tot negen maanden bereiken.
De rupsen eten de bladeren van verschillende soorten zijdeplanten uit het geslacht Asclepias. Deze planten zijn giftig en de rupsen maken hier gebruik van door de giftige verbindingen in het lichaam op te slaan. Hierdoor worden ze zelf ook giftig zonder daar last van te hebben. Het lichaam van de volwassen vlinder behoudt de als rups bij elkaar gegeten gifstoffen. Zowel de rups als de vlinder worden hierdoor gemeden door veel insecteneters.
Monarksommerfugl eller monark (Danaus plexippus), er en sommerfugl som tilhører underfamilien Danainae i den store familien flikvinger (Nymphalidae). Denne nordamerikanske arten er særlig kjent for sine lange vandringer. Nylig har noen krysset Atlanterhavet og etablert bestander i Afrika og det sørlige Europa.
En stor, slank sommerfugl med store vinger. Grunnfargen er gulbrun og brunrød med brede, svarte striper langs vingeårene og hvite flekker langs vingekantene. Kroppen er svart med hvite flekker. Den nakne larven er tverrstripet i hvitt, gult og svart, med et pat lange, svarte utvekster fra ryggsiden av det første kroppsleddet.
Monarken har larver på Asclepias i gravmyrtfamilien. De flyr nordover om våren og kan da nå så langt nord som Alaska, men de kan ikke overleve en kald vinter. Derfor trekker sommerfuglene sør igjen om høsten, til en av bare to kjente overvintringssteder: i Michoacán i Mexico for den østlige bestanden og i California for den vestlige. Begge overvintringsområdene er ganske små, bare noen hektar store. Sommerfuglene sitter tett i tett i noen store bartrær. Monarken kan gå gjennom flere generasjoner på en sommer, så det er ikke de samme individene som trekker sørover om høsten som trakk nordover om våren.
Larven tar opp giftstoffer fra de ganske giftige næringsplantene, og lagrer disse. De sterke fargene til både larver og voksne signaliserer at de er giftige, noe som gjelder for de alle fleste medlemmene av gruppen Danainae. Andre sommerfugler, blant annet falsk monark (Limenitis archippus, Limenitidinae) etterligner disse mønstrene og oppnår dermed beskyttelse ved at fugler som en gang har forsøkt å spise en monark, ikke senere vil angripe noe som ligner på den.
Monarksommerfugl eller monark (Danaus plexippus), er en sommerfugl som tilhører underfamilien Danainae i den store familien flikvinger (Nymphalidae). Denne nordamerikanske arten er særlig kjent for sine lange vandringer. Nylig har noen krysset Atlanterhavet og etablert bestander i Afrika og det sørlige Europa.
♂
♀
Danaus plexippus – wędrowny motyl z rodziny Nymphalidae nazywany danaidem wędrownym, monarchem lub monarchą. Występuje na obszarze od Kanady po Argentynę, a także na Hawajach, w Indonezji, Australii i Europie. Długość od głowy do końca odwłoka: do 3 cm. Rozpiętość skrzydeł: maksymalnie 10 cm. Długość życia: 3–4 tygodnie, u pokolenia zimującego: 7–8 miesięcy.
Zaloty następują w dwóch fazach - powietrznej i naziemnej. Podczas fazy powietrznej samiec ściga samicę, co często kończy się zaciągnięciem jej na ziemię. Podczas fazy ziemnej motyle kopulują, pozostając złączone przez 30 do 60 minut[2].
Samice składają jaja przede wszystkim na roślinach z rodziny trojeściowatych, a szczególnie z rodzaju Asclepias. Ich liście są pokarmem dla larw monarchy, które w swoich powłokach ciała odkładają pobrane z pokarmem trucizny znajdujące się w niektórych trojeściowatych. W ten sposób gąsienice same stają się trujące dla drapieżników. Samice składają jaja na liściach, a z jaj tych wykluwają się larwy, czyli gąsienice. Rosnące larwy muszą przejść pięć linień, zanim staną się poczwarkami, a później dojrzałą dorosłą formą motyla.
Zjawisko migracji monarchów z Ameryki Północnej do Meksyku zostało odkryte przez małżeństwo kanadyjskich zoologów z University of Toronto, Freda i Norah Urquhartów Fred był kustoszem wystawy owadów w Royal Ontario Museum i obserwatorem pojedynczych motyli tego gatunku od roku 1937. W latach 40. i 50. XX wieku małżeństwo prowadziło w domu hodowlę i badania tysięcy monarchów, a następnie opracowało metodę znakowania tych owadów, umożliwiającą rozpoczęcie w roku 1952 międzynarodowych obserwacji szlaków jesiennych wędrówek całej populacji. Początkowo chwytaniem i znakowaniem (przyklejaniem etykiet z prośbą o wysłanie znalezionego lub złowionego owada do Uniwersytetu w Toronto) zajmowała się grupa licząca 12 ochotników; w latach 60. i 70. do Międzynarodowego Stowarzyszenia ds. Migracji zgłaszały się co roku setki i tysiące członków. Na podstawie licznych otrzymywanych przesyłek Urquhatrowie potwierdzili, że monarchy wędrują z NE w kierunku SW. Na pierwsze zimowisko milionów hibernujących monarchów natrafiono 9 stycznia 1975 roku. Odkryli je Ken i Cathy Brugger, z pomocą meksykańskich drwali. Znajdowało się ok. 390 km od stolicy Meksyku, na jednej z pokrytych lasem sosnowo-jodłowym gór Płaskowyżu Neovolcanic (Kordyliera Wulkaniczna) – na terytorium prekolumbijskich Azteków, uważających motyle za powracające dusze zmarłych (nazywali je „odwiecznymi tancerzami słońca”). W następnym roku Urquhatrowie znaleźli, wśród owadów zimujących na „Górze Motyli”, monarchę z etykietką przyklejoną przez ochotnika z Minnesoty, co ostatecznie potwierdziło, że jeden owad może przemierzyć trasę ponad 3 tys. kilometrów. W następnych latach odkryto 13 zimowisk na innych pięciu górach Kordyliery[3].
Miarą liczebności populacji migrujących motyli jest powierzchnia zajmowana przez meksykańskie kolonie. Według WWF największą liczebność zaobserwowano w roku 1995 (21,6 ha). W okresie niecałych 10 lat zmniejszyła się około dziesięciokrotnie (2,19 ha w roku 2004 i 1,92 ha w roku 2015). Problem jest przedmiotem intensywnych badań, prowadzonych w ramach międzynarodowych programów. m.in. „Monarch Watch” (dyrektor – Chip Taylor, University of Kansas)[4]. Stwierdzono m.in. bezspornie, że główną przyczyną spadku liczebności jest upowszechnienie technik intensywnego rolnictwa, w tym herbicydów, wykluczających możliwość rozwoju trojeści, najsilniejszego atraktanta monarchów. Ochroną z użyciem herbicydów objęto nawet uprawy kukurydzy i soi, co stało się możliwe w końcu XX wieku, po wprowadzeniu odmian odpornych na te środki. Ich wprowadzenie pociągnęło za sobą równoczesne zmniejszenie się liczebności trojeści i monarchów[3].
Drugą z wymienianych przyczyn jest wyrąb meksykańskich lasów, uznanych za rezerwaty ekologiczne. Ten nielegalny proceder w znacznym stopniu zahamowano (w latach 2007–2015 o ok. 50%), przekonując ludność chronionego obszaru (50 tys. ha), że znacznie więcej korzyści niż pozyskiwane drewno przynoszą im motyle – wielka atrakcja turystyczna[3].
Mimo realizacji kosztownych programów ratowania Danaus plexippus nadal istnieje obawa o zanik unikalnego zjawiska migracji (w wielu krajach występują liczne populacje monarchy, jednak motyle te nie migrują).
Danaus plexippus – wędrowny motyl z rodziny Nymphalidae nazywany danaidem wędrownym, monarchem lub monarchą. Występuje na obszarze od Kanady po Argentynę, a także na Hawajach, w Indonezji, Australii i Europie. Długość od głowy do końca odwłoka: do 3 cm. Rozpiętość skrzydeł: maksymalnie 10 cm. Długość życia: 3–4 tygodnie, u pokolenia zimującego: 7–8 miesięcy.
A borboleta-monarca (Danaus plexippus) é uma borboleta da família dos ninfalídeos, da subfamília dos danaíneos. Têm cerca de setenta milímetros de envergadura, asas laranjas com listras pretas e marcas brancas.
As suas populações são naturais da América do Norte e são conhecidas por realizarem a mais longa migração realizada por um invertebrado numa única geração, a quarta geração.
Os indivíduos desta geração eclodem dos seus ovos no Canadá e atingem o estado adulto em Setembro, altura em que voam em grandes grupos, num espetáculo ímpar, cerca de 4000 km até chegarem ao México onde passam o Inverno em grandes aglomerações.
Infelizmente, devido à destruição dos habitats onde hibernam, estas populações estão muito ameaçadas com declínios de mais de 80% nos últimos 25 anos.
Com grande potencial de voo e de dispersão, as monarcas também colonizaram nos últimos 200 anos a Europa, Norte de África e a Austrália.
Em Portugal, temos populações residentes no Algarve e no Alentejo litoral, em locais onde existe a sua planta hospedeira, o algodoeiro-falso (Gomphocarpus fruticosus).
Tal como nos restantes locais colonizados recentemente as populações portuguesas de monarca não são migradoras[1].
A borboleta monarca começa a sua vida como um ovo posto por uma fêmea adulta numa folha de planta de serralha. É do tamanho da cabeça de um alfinete e quando choca, três a doze dias depois, nasce a pequena lagarta com riscas brancas, amarelas e pretas, com oito pares de pernas curtas para trepar e partes da boca desenhada para mastigar folhas. Mas somente folhas das plantas de serralha tem uma seiva branca e pegajosa que é altamente tóxica para os outros animais, mas não afetam em nada a lagarta, apenas tornando seu corpo altamente tóxico para os predadores, como pássaros. Três mutações genéticas são a chave para esse inseto se tornar imune à sua dieta venenosa.[2]
A borboleta-monarca (Danaus plexippus) é uma borboleta da família dos ninfalídeos, da subfamília dos danaíneos. Têm cerca de setenta milímetros de envergadura, asas laranjas com listras pretas e marcas brancas.
As suas populações são naturais da América do Norte e são conhecidas por realizarem a mais longa migração realizada por um invertebrado numa única geração, a quarta geração.
Os indivíduos desta geração eclodem dos seus ovos no Canadá e atingem o estado adulto em Setembro, altura em que voam em grandes grupos, num espetáculo ímpar, cerca de 4000 km até chegarem ao México onde passam o Inverno em grandes aglomerações.
Infelizmente, devido à destruição dos habitats onde hibernam, estas populações estão muito ameaçadas com declínios de mais de 80% nos últimos 25 anos.
Com grande potencial de voo e de dispersão, as monarcas também colonizaram nos últimos 200 anos a Europa, Norte de África e a Austrália.
Em Portugal, temos populações residentes no Algarve e no Alentejo litoral, em locais onde existe a sua planta hospedeira, o algodoeiro-falso (Gomphocarpus fruticosus).
Tal como nos restantes locais colonizados recentemente as populações portuguesas de monarca não são migradoras.
A borboleta monarca começa a sua vida como um ovo posto por uma fêmea adulta numa folha de planta de serralha. É do tamanho da cabeça de um alfinete e quando choca, três a doze dias depois, nasce a pequena lagarta com riscas brancas, amarelas e pretas, com oito pares de pernas curtas para trepar e partes da boca desenhada para mastigar folhas. Mas somente folhas das plantas de serralha tem uma seiva branca e pegajosa que é altamente tóxica para os outros animais, mas não afetam em nada a lagarta, apenas tornando seu corpo altamente tóxico para os predadores, como pássaros. Três mutações genéticas são a chave para esse inseto se tornar imune à sua dieta venenosa.
Fluturele Monarh (Danaus plexippus) este un fluture din familia Nymphalidae.
Fluturele Monarh are aripile de culoare brun-roșcată cu nervuri de culoare neagră, pe marginea aripilor sunt două rânduri de puncte albe. Fluturele cu aripile dechise atinge 10 cm lățime. Masculul se poate deosebi de femelă prin curbura aripilor, masculul are aripile arcuite în sus, pe când femela în jos. O specie asemănătoare de fluture este „Monarhul african” (Danaus chrysippus).
Fluturele Monarh, care generația din toamnă și primăvară, este un fluture migrator, care zboară ca. 4000 de km, (70 km/zi) în timp de 8 săptămâni din America de Nord (SUA de la granița canadiană) până în Mexic. Pe timpul zborului se hrănește cu nectarul florilor de câmp și din smârcuri, care din păcate prin agricultura extensivă, devin tot mai rari. Migrația fluturelui Monarh este o problemă nerezolvată în biologie.[1]
6t7gfhu76gt
Fluturele Monarh (Danaus plexippus) este un fluture din familia Nymphalidae.
Monark (Danaus plexippus)[2] är en brunsvartmönstrad orange fjärilsart som först beskrevs av Linnaeus 1758. Monarken ingår i släktet Danaus, och familjen praktfjärilar.[2][3][4] Arten förekommer tillfälligt i Sverige, men reproducerar sig inte i landet.[4] Inga underarter finns listade.[2]
Monarken förekommer framför allt i Amerika. Den är en uthållig fjäril som kan flyga mycket långt och kan om hösten flyga från Kanada till Mexiko för att övervintra. Detta sker då inte av en individ, utan under tre till fyra generationer.
Den har spridit sig utanför Amerika och är numera även bofast i bland annat Australien. Larverna äter mestadels giftiga växter och giftet lagras i deras kroppar och finns också kvar när de blir fullvuxna fjärilar. Det gör att de smakar illa och är ett sätt att undvika att bli uppäten av till exempel fåglar. Fenomenet är en form av mimikry som kallas Browers mimikry och innebär en skyddande likhet inom arten.[5]
Ett synonymt svenskt namn är monarkfjäril.[6]
Monarkens vingspann är ungefär 10 centimeter och hanen och honan är ganska lika varandra till utseendet. Ovansidan är orange och mönstrad med mörka brunsvarta vingribbor. Längs ytterkanten finns ett brett brunsvart band med små vita fläckar. I framhörnet och längs framkanten på framvingen är grundfärgen något mörkare och här finns några ljusare orange och vita fläckar. Undersidan är lik ovansidan men bakvingen och framhörnet på framvingen är här gulbrun istället för orange. Kroppen är på undersidan mörkt brunsvart med små vita prickar.[6][7] För ett otränat öga kan den förväxlas med Danaus eresimus, som har ett liknande mönster på vingarna, men är mörkare till färgen. Den kan också förväxlas med Danaus gilippus och Limenitis archippus.
Larven blir upp till 50 millimeter lång och den är tvärrandig i svart, vitt och ljusgult. Både framtill och baktill har den två långa antennliknande utskott.[7] Larven omvandlas senare till en puppa som är grön med små guldfärgade prickar och med ett guldfärgat band tvärs över bakkroppen.[6]
Under hösten flyttar fjärilen för att övervintra. I Nordamerika övervintrar de som förekommer väster om Klippiga bergen i Kalifornien och övriga i Mexiko. I mer än ett århundrade har man känt till monarkens övervintringsplatser i Kalifornien och dessa omfattar en mycket liten yta där stora mängder fjärilar samlas. Övervintringsplatserna i Mexiko upptäcktes däremot inte förrän 1975. De omfattar ett trettiotal små platser i ett bergsområde, Transmexikanska vulkanbältet, ungefär 100 kilometer nordväst om Mexico City. Där växer ädelgranen Abies religiosa. På ungefär 3000 meters höjd tillbringar fjärilarna vintern i jättelika samlingar i ädelgranarna.[8]
Under övervintringstiden har de ofta parat sig och när de återvänder norrut på våren lägger honan äggen längs vägen. Ur ägget kläcks larven. Värdväxter, de växter larven lever på och äter av, är framför allt olika arter i sidenörtssläktet. Nästan alla växter larven äter är giftiga, men skadar den inte utan lagras i kroppen och stannar även kvar i den fullbildade fjärilen. Detta gör att de blir giftiga och smakar illa för fåglar och andra djur som vill äta dem.[9]
Larven har vuxit färdigt efter tre veckor och då förpuppas den. Efter två veckor kläcks den fullbildade fjärilen ur puppan.[6] I exempelvis Kanada hinner monarken föröka sig i två eller tre generationer på sommaren innan fjärilarna åter flyttar söderut på hösten.[8] I tropiska områden flyttar de inte några längre sträckor och där pågår flygtiden och förökningen året runt.[9]
Monarkens habitat, den miljö den lever i, är öppna marker så som ängar och vägkanter. De fullvuxna fjärilarna dricker nektar från olika blommor i till exempel sidenörtssläktet, syrensläktet, eldkronesläktet, vernoniasläktet och gullrissläktet.[9]
Monarkens utbredningsområde sträcker sig från södra Kanada och söderut genom USA, Centralamerika och Sydamerika.[9] Den har funnits i Australien sedan slutet av 1800-talet.[10] Under 1800-talet började monarken spridas över världen och finns numera bofast och reproducerande i delar av Asien, på öar i Stilla havet och i sydvästligaste Europa. I Norden har den påträffats några enstaka gånger i Sverige och Danmark, men dessa kan vara odlade fjärilar från exempelvis fjärilshus.[6]
Monarkens biosfärreservat är ett drygt 56 000 hektar stort område i bergen ungefär 100 kilometer nordväst om Mexico City. I detta område övervintrar ungefär 70 procent av de monarker som migrerar till Mexiko, och genom att göra det till ett biosfärreservat kan det finnas större möjligheter att skydda skogen mot avverkning och andra hot. Reservatet upptogs som Unescos världsarv 2008.[11]
Monark (Danaus plexippus) är en brunsvartmönstrad orange fjärilsart som först beskrevs av Linnaeus 1758. Monarken ingår i släktet Danaus, och familjen praktfjärilar. Arten förekommer tillfälligt i Sverige, men reproducerar sig inte i landet. Inga underarter finns listade.
Monarken förekommer framför allt i Amerika. Den är en uthållig fjäril som kan flyga mycket långt och kan om hösten flyga från Kanada till Mexiko för att övervintra. Detta sker då inte av en individ, utan under tre till fyra generationer.
Den har spridit sig utanför Amerika och är numera även bofast i bland annat Australien. Larverna äter mestadels giftiga växter och giftet lagras i deras kroppar och finns också kvar när de blir fullvuxna fjärilar. Det gör att de smakar illa och är ett sätt att undvika att bli uppäten av till exempel fåglar. Fenomenet är en form av mimikry som kallas Browers mimikry och innebär en skyddande likhet inom arten.
Ett synonymt svenskt namn är monarkfjäril.
Kral kelebeği, (Danaus plexippus) Nymphalidae ailesinde sınıflandırılan göçmen bir kelebek türüdür. Kral kelebekleri Kanada, Amerika Birleşik Devletleri, Yeni Zelanda, Avustralya, Kanarya Adaları, Azor Adaları ve Batı Avrupa'da yaşar. Geniş bir kanat açıklığı vardır ve kanatlarının üzerinde bulunan turuncu siyah ve beyaz çizgilerden oluşan desenleri sayesinde kolayca tanınabilir. Erkekler dişilere oranla biraz daha büyüktür. Kral kelebeklerinin aynı yıl içinde sadece dört nesli oluşmaktadır. Diğer kelebeklerden oldukça uzun bir ömre sahiptir.[1]
Kral kelebeklerinin kanat açıklığı 8.9 ila 10,2 cm arasındadır.
Kanatlarının üst taraflarında kahverengi ve turuncu renklerinin etrafında siyah renkler ve üzerinde beyaz lekeler bulunur.[2] Erkeklerin kanatlarının üzerinde bulunan damarlar dişilere göre kalındır. Tüm kelebeklerde olduğu gibi altı ayağa sahiptir.
Genelde Kuzey Amerika'da ve Meksika'da bulunmalarına rağmen Bermuda , Hawaii, Solomon, Yeni Kaledonya , Yeni Zelanda, Avustralya, Yeni Gine, Seylan, Hindistan , Azor Adaları, Kanarya Adaları ve Batı Avrupa'da da görünmektedirler.
Kral kelebekleri, her yıl düzenli olarak sürüler halinde Kuzey Amerika ve Meksika arasında göç eder. Kuzey Amerika'nın ağustos ayında başlayan soğuk havalarından kaçarak Meksika'nın ılıman ikliminde bulunan bir dağ ormanındaki ağaçta toplanarak kış uykusuna yatarlar. Kış uykusu dört ay sürer ve kelebekler bu sürede hiçbir şey yemezler. Bu uykunun ardından kelebekler mart ayının sonlarına doğru başlayan ilkbahar ile tekrar Kanada'ya doğru yola çıkarlar. Kelebeklerin Meksika'dan Kanada'ya ulaşması 4 ay ve 3 nesil alır.
Diğer kelebek türlerinden oldukça uzun bir yaşama sahip olan kral kelebekleri bir yılda 4 nesil olarak yaşam sürdürürler. Bu nesillerden yalnızca 3 tanesi ilkbahar ve yaz aylarında yaşamaktadır. 1. 2. ve 3. nesiller 6 hafta 4. nesil 6 ay yaşamaktadır.
Meksika'daki dağ ormanlarında kış uykusuna yatarlar, ilkbahar geldiğinde çiftleşerek Kuzey Amerika'ya doğru yola çıkarlar. Birinci nesil Amerika'nın güney kıyılarında yumurtlarlar ve hayatlarını kaybederler.
Amerika'nın güneyinde doğarlar ve kısa süre içerisinde göçü tamamlamak için Kanada'ya doğru yola çıkarlar. Amerika'nın kuzeyinde ve Kanada'nın güneyine yumurtlarlar ve hayatlarını kaybederler.
Amerika'nın kuzeyinde ve Kanada'nın güneyinde doğarlar ve göçün zirve noktası olan Kanada'nın kuzeyine doğru yollarına devam ederler. Temmuz ayının sonunda yumurtarlar ve hayatlarını kaybederler.
Süper nesil olarak adlandırılan dördüncü nesil göçün zirve noktası olan Kanada'nın kuzeyinde doğar. Üreme organları gelişmeden doğdukları için diğer nesillerden fazla olarak 6 ay yaşamaktadırlar. Ağustos ayında kendilerinden önce yapılan göç mesafesini tek seferde yaparlar ve Ekim ayının sonlarına doğru Meksika'da bulunan dağ ormanında 4 ay sürecek kış uykusuna yatarlar.[3]
Kral kelebeği, (Danaus plexippus) Nymphalidae ailesinde sınıflandırılan göçmen bir kelebek türüdür. Kral kelebekleri Kanada, Amerika Birleşik Devletleri, Yeni Zelanda, Avustralya, Kanarya Adaları, Azor Adaları ve Batı Avrupa'da yaşar. Geniş bir kanat açıklığı vardır ve kanatlarının üzerinde bulunan turuncu siyah ve beyaz çizgilerden oluşan desenleri sayesinde kolayca tanınabilir. Erkekler dişilere oranla biraz daha büyüktür. Kral kelebeklerinin aynı yıl içinde sadece dört nesli oluşmaktadır. Diğer kelebeklerden oldukça uzun bir ömre sahiptir.
Данаїда монарх[3] (лат. Danaus plexippus) — вид метеликів з родини сонцевиків (Nymphalidae). Один з найвідоміших метеликів Північної Америки. У XIX столітті представників цього виду знайшли в Новій Зеландії та Австралії. У Європі ці метелики поширені на Канарських островах та архіпелазі Мадейра. Під час міграцій їх помічають в Росії, на Азорських островах, у Швеції та Іспанії. Можна їх зустріти також на півночі Африки.
Імаго данаїди монарха легко розпізнати за характерним малюнком на крилах: чорні смуги на рудому тлі. По краях крил є широка чорна облямівка з білими плямами. Розмах крил — 8,9 — 10,2 см. Данаїда монарх подібний за розміром і забарвленням до метеликів іншого виду — Limenitis archippus, але ті мають додаткову темну облямівку на задній парі крил.
Самиці відрізняються від самців темнішим забарвленням крил вздовж жилок та меншим розміром. У самців в центрі задніх крил є ділянки, в яких виділяються феромони.
Загальновживану назву «монарх» вперше використав американський ентомолог Семюел Скаддер у 1874 році: «Цей метелик — один з найбільших, і володарює над обширними угіддями»[4]. Згідно з іншими даними, таку назву могли дати на честь Вільгельма III Оранського, штатгальтера Нідерландів і короля Англії та Шотландії[5].
Назва роду Danaus, ймовірно, походить від імен персонажів давньогрецької міфології Даная (сина єгипетського царя) або його праправнучки Данаї. Видовий епітет plexippus пов'язаний з ім'ям Плексіппа, одного з 50 синів Єгипту, брата-близнюка Даная.
Вид описав у 1758 році під назвою Papilio plexippus Карл Лінней у своїй «Системі природи». У 1780 році польський натураліст Ян Кшиштоф Клюк відніс його до іншого роду — Danaus.
Данаїда монарх має близьку спорідненість з двома дуже подібними видами — Danaus cleophile та Danaus erippus, яких до 2005 року об'єднували в підрід Danaus. Обидва ці види заселяють Новий Світ: Danaus cleophile — Ямайку та острів Гаїті, Danaus erippus — території на південь від річки Амазонка. Морфологічні відмінності данаїди-монарха і південного монарха відомі тільки на стадії лялечки, тому часто їх розглядають як один вид, але дані про первинну структуру мітохондріальної та ядерної ДНК свідчать про їх окремішність. Імовірний час розходження цих видів — близько 2 мільйонів років тому (кінець пліоцену — початок плейстоцену)[6].
У дослідженні Девіда Сміта і його співавторів (2005 рік) виділяють 2 підвиди[6]:
Крила темно-помаранчеві, прожилки крил чорні, краї крил чорні з двома рядами невеликих білих плям. На кінцях передніх крил є великі помаранчеві плями.
Яйця данаїди монарха вершково-білі, деколи блідо-жовті. Вони мають неправильну конічну форму, у кожного є приблизно по 23 поздовжні хребти і величезна кількість малопомітних швів. Маса яйця — близько 0,46 міліграм, довжина — 1,2 мм, а ширина — 0,9 мм.
Дорослий метелик харчується нектаром великої кількості рослин, наприклад:
Гусениця ж харчується листям таких рослин:
Монархи — метелики тропічного походження. Хоча влітку вони й живуть у помірних широтах, вони не можуть витримати тамтешні зими, і кожної осені мають повертатися назад. На сході Північної Америки більшість монархів долає шлях більше 2500 км — із півдня Канади до центру Мексики. Це єдиний вид метеликів із міграціями на такі відстані. В інших місцевостях монархи мігрують на меншу відстань (наприклад, на заході Північної Америки та в Австралії) або не мігрують взагалі (популяції Мексики, Південної Америки, Карибських та Гавайських островів)[10].
У Північній Америці на зимівлю летять ті метелики, що виходять із лялечки в кінці літа та на початку осені. Монархи з величезної площі на сході континента (більше 100 млн га) злітаються на 12 невеликих ділянок загальною площею менше 20 га у Трансмексиканському вулканічному поясі, переважно в межах біосферного заповідника метелика Монарх (штати Мічоакан та Мехіко). Там вони з листопада до березня зимують у щільних скупченнях на деревах, іноді вилітаючи напитися води. Весною вони відправляються на північ і відкладають яйця в північній частині Мексиці та на півдні США. Особини, що виходять із цих яєць, заселяють північну частину ареала. Літа вистачає ще на два покоління. Особини цих поколінь живуть у дорослому стані 2—5 тижнів, тоді як мігранти — 7—9 місяців[10][11].
Метеликам вдається повернутися туди, де зимували їхні предки, за допомогою сонячного «сенсора», який сприймає розташування Сонця, і «магнітного компаса», що сприймає нахилення магнітного поля Землі. Для магніторецепції монархам, як і деяким іншим тваринам, потрібне світло (принаймні синє та ультрафіолетове). Цей спосіб орієнтування може бути особливо важливим, коли Сонця не видно (відомо, що метелики здатні зберігати правильний напрямок польоту навіть за щільного хмарного покриву)[12][13].
Данаїда монарх — одна з небагатьох комах, які здатні перелітати через Атлантичний океан. Вона набуває все більшого поширення через те, що ваточник все частіше використовують як декоративну та садову рослину. Монархи, які народились на Бермудських островах та в деяких інших місцях, залишаються там цілий рік, бо там клімат м'який і стабільний.
Монархів можна зустріти також на крайньому південному заході Великої Британії, в Бенінгтоні, на Далекому Сході, у Новій Зеландії, Північній Африці та на Гавайських островах.
Для птахів монархи є отруйними й огидними на смак через ваточник, який їдять гусениці. Вони зберігають отруту рослини, а їх яскравий колір попереджує про отруйність. Колонії метеликів, які перебувають в анабіозі, виживають тому, що голодні птахи надають перевагу менш отруйним метеликам.
Парування данаїди монарха відбувається навесні, незадовго до міграції з місць зимової сплячки. Залицяння досить просте і, на відміну від інших видів цього роду, в ньому задіяні феромони. Залицяння складається з двох фаз: повітряної та наземної. Під час повітряної фази самець переслідує самку і злегка штовхає її крилами, манячи вниз. Спарювання відбувається під час наземної фази, коли самець передає самці мішечок зі спермою. Цей мішечок також дає самиці енергію, що допомагає їй класти яйця і під час зворотної міграції. Розвиток данаїди має чотири стадії:
Данаїда монарх живе від двох до восьми тижнів в саду, де є квіти ваточника з достатньою кількістю нектару.
Монарх є комахою-символом штатів США Алабами, Айдахо, Іллінойса, Міннесоти, Вермонта та Західної Вірджинії. Його було номіновано на звання національної комахи США у 1990 році поряд з медоносною бджолою, але він не отримав схвалення законодавців.
Багато людей приваблюють монарха відповідними рослинами у свої сади або й розводять його. Інші його колекціонують або досліджують. В місцях зимівлі зграй, які мігрують, створено заповідники. Туризм із використанням цих метеликів дає великі прибутки.
Багато шкіл дають дітям гусінь для вирощування метеликів. Коли метелик досягає зрілого віку, його відпускають.
Вирубування лісів у місцях зимівлі монарха призвело до різкого скорочення його чисельності. Монарх як вид перебуває під охороною.
У Каліфорнії (США) зникають метелики виду данаїда монарх. За даними американських екологів, всього за 2017-2018 роки їх число знизилося відразу на 86%, якщо ситуація буде продовжуватися в тому ж ключі, метелики даного виду зникнуть менш ніж за десять років[джерело?].
Данаїда монарх (лат. Danaus plexippus) — вид метеликів з родини сонцевиків (Nymphalidae). Один з найвідоміших метеликів Північної Америки. У XIX столітті представників цього виду знайшли в Новій Зеландії та Австралії. У Європі ці метелики поширені на Канарських островах та архіпелазі Мадейра. Під час міграцій їх помічають в Росії, на Азорських островах, у Швеції та Іспанії. Можна їх зустріти також на півночі Африки.
Імаго данаїди монарха легко розпізнати за характерним малюнком на крилах: чорні смуги на рудому тлі. По краях крил є широка чорна облямівка з білими плямами. Розмах крил — 8,9 — 10,2 см. Данаїда монарх подібний за розміром і забарвленням до метеликів іншого виду — Limenitis archippus, але ті мають додаткову темну облямівку на задній парі крил.
Самиці відрізняються від самців темнішим забарвленням крил вздовж жилок та меншим розміром. У самців в центрі задніх крил є ділянки, в яких виділяються феромони.
Bướm vua hay bướm chúa (danh pháp hai phần: Danaus plexippus), là một loài bướm thuộc phân họ Danainae, trong họ Nymphalidae. Có lẽ là loài bướm được biết đến nhiều nhất trên toàn Bắc Mĩ. Vào thế kỷ 19, nó cũng được tìm thấy ở New Zealand và cũng được biết ở Úc từ năm 1871.[3][4]
Bướm vua là một trong số các loài được Linnaeus mô tả trong cuốn Systema Naturae (Hệ thống Tự nhiên) năm 1758. Ban đầu loài này được xếp trong chi Papilio.[5] Năm 1780, Jan Krzysztof Kluk xếp bướm vua vào chi mới Danaus và coi đây là loài điển hình của chi này.
Bướm vua rất giống hai loài khác, trước đây cùng thuộc phân chi Danaus (Danaus): Danaus cleophile phân bố ở Jamaica, Hispaniola và Danaus erippus phân bố ở phía nam của Nam Mỹ, khu vực sông Amazone. Nhộng của bướm vua có khác đôi chút so với nhộng của D. erippus, nhưng bướm trưởng thành gần như không thể phân biệt với nhau, do đó D. erippus thường được coi là một phân loài của bướm vua. Nhưng các phân tích về hình thái học, mtDNA 12S rRNA, nhiễm sắc thể c oxidase phân nhóm I, nuclear DNA 18S rRNA và chuỗi EF1 α do Smith et al. thực hiện năm 2005 đã chứng minh chúng là hai loài riêng biệt. Sự phân chia hai loài này mới xảy ra gần đây. Tổ tiên của D. erippus tách khỏi quần thể D. plexippus vào thế Pliocen. Lúc này, mực nước biển dâng cao và toàn bộ vùng thấp của đồng bằng Amazon không còn thích hợp cho bướm sinh sống.[6]
Theo Smith et al. (2005), hai phân loài sau đây đã được công nhận:[6]
Smith et al. không xem xét Danaus plexippus nigrippus trong nghiên cứu của ông. Theo Hay-Roe et al. (2007), đây cũng là một phân loài:[7]
Danaus (Greek Δαναός) là chắt của thần Zeus, trong thần thoại là vua của Ai Cập hoặc Libya, đã lập nên Argos; Plexippus là một trong 50 con trai của Aegyptus, anh em sinh đôi với Danaus.
Trong tiếng Hy Lạp, plexippos (πληξιππος) nghĩa là "nài ngựa". Tại lần xuất bản thứ 10 của Systema Naturae, cuối trang 467,[8] Linnaeus viết rằng cái tên Danai festivi, được chuyển sang từ chi cũ với tên Papilio plexippus, xuất phát từ tên các con trai của Aegyptus.[9]
Cánh của bướm chúa có hoa văn màu cam và đen dễ nhận ra, với sải cánh khoảng 8,9 cm đến 10,2 cm (Loài bướm phó vương giống kích thước, màu sắc, hoa văn, nhưng có thể phân biệt bằng một cái vằn đen ngang qua cánh sau). Bướm cái có vân đậm hơn trên cánh, bướm đực có đốm ở giữa mỗi cánh sau[10] là nơi pheromon được tiết ra. Con đực lớn hơn một chút so với con cái.
Giống như các loài côn trùng khác, bướm vua có sáu chân nhưng nó thường chỉ đi bằng bốn chân sau vì hai chân trước áp sát vào thân.[11]
Trứng bướm vua ban đầu có màu trắng ngà, sau chuyển sang màu vàng nhạt, hình bán côn, dài, với khoảng 23 đường gờ chạy dọc..[12] Mỗi quả trứng nặng khoảng 0,46 mg, cao 1,2 mm và rộng 0,9 mm.[13][14]
Sâu bướm có các sọc vàng, đen và trắng. Đầu chúng cũng có sọc màu vàng và đen. Chúng có hai cặp râu nằm ở hai phía thân. Sâu bướm đạt đến chiều dài 5 cm.[15]
Nhộng có màu xanh với một dải màu đen và vàng ở cuối bụng. Trên ngực, cánh và trên mắt cũng có những chấm vàng.[16]
Tại Bắc Mỹ, bướm vua phân bố từ nam Canada đến bắc phần Nam Mỹ. Thỉnh thoảng chúng cũng sang đến Tây Âu theo đường vận chuyển hàng hải hoặc khi có điều kiện thời tiết và hướng gió phù hợp. Bướm vua cũng có mặt ở Bermuda, Hawaii, Solomon, New Caledonia, New Zealand, Úc, New Guinea, Sri Lanka, Ấn Độ, Azores và quần đảo Canary.[16]
Từ tháng 8, bướm vua từ Bắc Mỹ di cư xuống phương nam. Chúng quay về phương bắc vào mùa xuân.[17]
Bướm vua là loài bướm duy nhất di cư theo cả hai hướng Bắc – Nam và Nam - Bắc như các loài chim[18]. Tuy nhiên, do vòng đời của nó ngắn nên trong quá trình di cư không có cá thể nào trong đàn bướm sống sót.[19][20] Chúng đẻ trứng trên suốt hành trình di cư[19].
Thời gian của mỗi hành trình vượt xa tuổi thọ bình quân của hầu hết các cá thể bướm vua. Bướm vua sinh ra vào đầu mùa hè có tuổi thọ ít hơn hai tháng. Thế hệ cuối cùng sinh ra trong mùa hè sẽ có một giai đoạn không sinh sản (giai đoạn đình sản), có thể kéo dài bảy tháng hoặc lâu hơn.[10] Trong giai đoạn đình sản, bướm vua sẽ bay đến một địa điểm trú đông. Chúng không sinh sản cho đến khi rời điểm trú đông vào tháng hai hoặc tháng ba.
Để hoàn thành một chặng đường di cư, chúng phải trải qua 3 đến 4 đời. Bướm vua cũng là một trong số ít loài côn trùng có thể vượt qua Đại Tây Dương.[20]
Bướm vua phân bố tại nhiều dạng môi trường sống, chẳng hạn như trên cánh đồng, đồng cỏ, công viên, các khu vườn, cây xanh và lề đường. Chúng trú đông trong các lùm cây lá kim.[21][22]
Bướm vua trưởng thành thường hút mật của các loài sau:
Bướm đực cũng thường đậu trên đất ẩm, sỏi ướt để hấp thụ ẩm và chất khoáng, tập tính này được gọi là "tắm bùn". Chúng thậm chí còn thực hiện hành vi này trên các vết dầu ở vỉa hè.[22]
Bướm vua đẻ trứng trên cây Asclepias curassavica
Bướm trưởng thành trên hoa Zinnia
Cây chủ của bướm vua:
Châu Mỹ:
Châu Phi:
Châu Au:
|coauthors= bị phản đối (trợ giúp) |coauthors= bị phản đối (trợ giúp) |coauthors= bị phản đối (trợ giúp) Bướm vua hay bướm chúa (danh pháp hai phần: Danaus plexippus), là một loài bướm thuộc phân họ Danainae, trong họ Nymphalidae. Có lẽ là loài bướm được biết đến nhiều nhất trên toàn Bắc Mĩ. Vào thế kỷ 19, nó cũng được tìm thấy ở New Zealand và cũng được biết ở Úc từ năm 1871.
Спаривание данаиды монарха происходит весной, незадолго до миграции из мест зимней спячки. Ухаживание довольно простое и, в отличие от других видов этого рода, в нём задействованы феромоны. Ухаживание состоит из двух фаз: воздушной и наземной. Во время воздушной фазы самец преследует самку и слегка толкает крыльями самку, манит её вниз. Спаривание происходит во время наземной фазы, когда самец передаёт самке мешочек со спермой. Это мешочек также даёт самке энергию, что помогает ей в кладке яиц и в процессе обратной миграции. Развитие данаиды состоит из четырёх стадий:
Данаида монарх живёт от двух до восьми недель в саду, где есть цветы ваточника с достаточным количеством нектара.
Монарх является насекомым-символом штатов США Алабамы, Айдахо, Иллинойса, Миннесоты (Техас), Вермонта и Западной Виргинии. Он был номинирован на звание национального насекомого США в 1990 году наряду с медоносной пчёлой, но не получил одобрения законодателей.
Многие люди хотели сделать монарха садовой бабочкой для отдельных видов ваточника. Другие пользуют их в коллекциях или для изучения. Для мигрирующих стай были созданы заповедники в их любимых местах зимовки. Таким образом туризм по ним даёт большой доход.
Многие школы дают детям гусеницу для её выращивания. Когда бабочка достигает зрелого возраста, её отпускают.
Вырубка лесов в местах зимовки монарха привела к резкому сокращению его численности. Монарх является охраняемым видом.
Спаривание данаиды монарха происходит весной, незадолго до миграции из мест зимней спячки. Ухаживание довольно простое и, в отличие от других видов этого рода, в нём задействованы феромоны. Ухаживание состоит из двух фаз: воздушной и наземной. Во время воздушной фазы самец преследует самку и слегка толкает крыльями самку, манит её вниз. Спаривание происходит во время наземной фазы, когда самец передаёт самке мешочек со спермой. Это мешочек также даёт самке энергию, что помогает ей в кладке яиц и в процессе обратной миграции. Развитие данаиды состоит из четырёх стадий:
Яйцо откладывается самкой весной или летом. Гусеница вылупляется через четыре дня после кладки. Гусеница съедает сначала остатки яичной оболочки, а затем приступает к поеданию листьев ваточника, содержащих вещества, называемые карденолидами, типа сердечных гликозидов. На этом этапе монарх накапливает энергию в виде жира и питательных веществ для перехода в стадию куколки. Стадия гусеницы длится около двух недель. Куколка — гусеница обволакивает шёлком веточку, листик и т. п. и повисает головой в форме буквы «J». Затем гусеница линяет, вследствие чего сбрасывается наружная зелёная оболочка. Данный момент является метаморфозом. Накануне вылупления куколка темнеет, фактически становится прозрачной, появляются рыжие крылья. Зрелая особь появляется из кокона примерно через две недели. Бабочка зависает над остатками куколки на несколько часов, чтобы расправить сухие крылья (чаще всего это происходит в первой половине дня). Крылья наполняются жидкостью, которая распрямляет складки до тех пор, пока крылья не станут полными и жёсткими. Иногда при наполнении крыльев жидкость (микония) начинает капать. И, в конце концов, во второй половине дня крылья оказываются полностью расправлены. Затем, убедившись, что крылья стали достаточно прочными, бабочки отправляются на поиски источников питания и энергии: цветов ваточника, красного клевера и золотарника (солидаго — Solidago).Данаида монарх живёт от двух до восьми недель в саду, где есть цветы ваточника с достаточным количеством нектара.
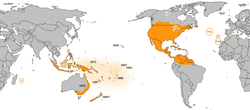
君主斑蝶(学名:Danaus plexippus),又名黑脉金斑蝶,大樺斑蝶,是一種斑蝶。牠們可能是北美洲最廣為人知的蝴蝶。自19世紀,牠們就在新西蘭被發現,並於1871年在澳洲發現[4][5]。牠們分佈在歐洲的加那利群島及馬德拉,並有一些遷徙至俄羅斯、亞速爾群島、瑞典及西班牙。翅膀上有顯眼的橙色及黑色斑紋,翅膀闊8.9-10.2厘米[6]。雌蝶的翅脈更為深色,雄蝶的後翅中央有一斑點可以釋放信息素[7]。雄蝶較雌蝶為大。
君主斑蝶,是由塞繆爾·斯卡德(Samuel Hubbard Scudder)於1874年所取的,原因是「牠們是最大的蝴蝶之一,並統管眾多」[8]。但其實這個名稱是為紀念奧蘭治親王威廉[9]。君主斑蝶的學名由卡爾·林奈於1758年的《自然系統》內確定。牠最初被分類在鳳蝶屬中[10]。於1780年,Jan Krzysztof Kluk成立了斑蝶屬,並以君主斑蝶為其模式種。由於拉丁語語法要求種加詞與性別名稱相符,故並不清楚斑蝶屬的學名是來自希臘傳說的埃及國王及宙斯的曾孫達那俄斯,或是來自達那俄斯的玄孫女達那埃的雄性化版本。種小名是來自達那俄斯的雙生兄弟埃古普托斯的50個兒子之一的Plexippus[8][11]。
君主斑蝶與兩個相似的近親物種於2005年前同屬於斑蝶亞屬。這兩個物種是牙買加及伊斯帕尼奧拉島的Danaus cleophile,及南美洲阿瑪遜河的南大樺斑蝶。Danaus erippus差不多與君主斑蝶完全一樣,但是蛹卻有所不同,故曾一度被認為是君主斑蝶的亞種。不過根據形態學、線粒體DNA 12S 核糖體RNA、胞色素氧化酶第一次單元序列、nDNA 18S rRNA及EF-1α的分析,發現牠們應該與君主斑蝶是不同的物種。有指南大樺斑蝶的祖先與君主斑蝶的祖先在於200萬年前的上新世末期分裂。當時海平面較為高,而整個亞馬遜低地都是汽水沼澤,並不適合蝴蝶生活[12]。
現時君主斑蝶其下有兩個亞種:[12]
分佈於北美洲、南美洲及西南太平洋,包括西印度群島、加拉巴哥群島、索羅門群島、澳大利亞、紐西蘭、新幾內亞、摩鹿加群島、菲律賓、台灣、香港、模里西斯、印度、亞速爾群島、馬德拉、加那利群島、葡萄牙南部、西班牙南部,並偶見於英國、愛爾蘭及法國南部[13]。
台灣的族群在1930年代後逐漸減少。Vane-Wright在1993年提出哥倫布假說 (The Columbus hypothesis),認為Danaus plexippus在19世紀中進行了一次全球性大擴張,從北美洲本土分別往大西洋及太平洋方向大規模擴張,1840年代第一次在夏威夷被記錄、1850-1860年代在南太平洋島嶼擴張、1870年代抵達澳大利亞[14]。20世紀起各地的族群則開始陷入衰退,台灣族群的消失只是這波大衰退的一部份。
君主斑蝶的翅膀闊8.9-10.2厘米[6]。翅膀上面呈黃褐橙色,翅脈及邊緣黑色,邊緣有兩串細白點。前翅近端位有一些橙點。翅膀下面很相似,但前翅及後翅端呈黃褐色,而白點較大[15]。
雄蝶的後翅上有黑色的性徵鱗片,而翅脈較雌蝶的窄。雄蝶較雌蝶為大[15]。
君主斑蝶的卵呈奶白色,期後會轉變為淡黃色。卵較長及稍有棱角,約有23節及很多橫線[15]。一個卵約重0.46毫克,高1.2毫米及闊0.9毫米[16][17]。
君主斑蝶最特別的地方是會每年進行遷徙。在北美洲,牠們會於8月至初霜向南遷徙,並於春天向北回歸。在澳洲,牠們會作有限度的遷徙[4]。雌蝶會在遷徙時產卵。到了10月,洛磯山脈的群族會遷徙到墨西哥米卻肯州的神殿內。西方的群族會在美國加利福尼亞州南部過冬。
於初夏出生的君主斑蝶壽命只有少於兩個月,但牠們遷徙的時間卻遠遠超過這個時間。在夏天最後出生的一代會進入一個滯育期,並會活超過7個月[7]。在滯育期,牠們會遷徙至其中一個過冬的地方。過冬的一代一般都不會繁殖,直至牠們於2-3月離開時才會繁殖。相信洛磯山脈群族春天時會向北遷徙至德克薩斯州及奧克拉荷馬州。回到美國及加拿大原住地方的已經是第二、三或四代的君主斑蝶。牠們是如何隔幾代後仍能回到相同的過冬地點則有待研究。似乎牠們是從其生理節奏及太陽的位置而遺傳了遷徙的路線[18]。
君主斑蝶是很少會橫渡大西洋的昆蟲之一。在百慕達由於多以乳草為觀賞植物,故君主斑蝶在當地十分普遍。由於百慕達的溫和氣候,當地出生的君主斑蝶會全年留在島內。
視乎風向,只有少數的君主斑蝶會在英國的西南部出現,最東的曾在Long Bennington出現。在新西蘭亦有見到君主斑蝶。在夏威夷亦有出沒,但卻沒有遷徙的情況。
君主斑蝶會在春天離開過冬位點時交配。牠們的求愛過程非常簡單,且較少依賴信息素[19]。求愛涉及兩個階段,即空中及地上的階段。在空中時,雄蝶會追求、輕推及擒下雌蝶。在地上時才會交尾,雄蝶會將精囊傳遞至雌蝶中。精囊及精子相信可以提供雌蝶能量來幫助繁殖及遷徙。過冬的群族最北可以回歸至發現生長初期的乳草,對於東方群族而言這是在德克薩斯州南部。君主斑蝶的生命週期是完全變態的,涉及四個不同的階段:
君主斑蝶很難吃,加上因卡烯內酯牠們的身體是有毒的[19]。牠們鮮艷的顏色及翅膀的高同比都顯示牠們是不適口的。這種現象稱為警戒作用。
Limenitis archippus與君主斑蝶有相同的保護機制,稱為「貝氏擬態」。
君主斑蝶是阿拉巴馬州[20]、愛達荷州[21]、伊利諾州[22]、明尼蘇達州[23]及德克薩斯州[24]的州昆蟲,且是佛蒙特州[25]及西維珍尼亞州[26]的州蝴蝶。於1990年,君主斑蝶與西方蜜蜂一同被提名為美國的國昆蟲[27],但最終卻不獲通過[28]。
很多人很種植蝴蝶園來吸引蝴蝶。其他的則會為了喜好及教育來飼養君主斑蝶。在一些君主斑蝶遷徙的位點會建立庇護區[29],而旅遊業亦因此應運而生。
很多學校都會由毛蟲開始養殖君主斑蝶。當成蟲後就會被放生野外[30]。
君主斑蝶過冬的地方被非法砍伐導致牠們的數量大幅下降。現時正努力將牠們列為受保護動物及恢復其棲息地。墨西哥估計於2005年至2006年間,君主斑蝶的數量會有明顯增長。
雖然君主斑蝶是吃乳草的,但是不同種類、不同植物或不同部位的乳草有不同的卡烯內酯含量,這亦反映在君主斑蝶體內毒素的含量。所以君主斑蝶未必一定是不可吃的,而是进行了自擬態。一些君主斑蝶的掠食者懂得量度牠們的毒素,並吐出高卡烯內酯含量的昆蟲。
卡烯內酯是積聚在君主斑蝶的腹部及翅膀。一些掠食者亦會將這些部位撕開,去吃其他的部份[31]。鳥類掠食者包括褐噪鶇、白頭翁、美洲鶇、美洲雀科、麻雀、叢鴉屬及藍頭松鴉。[31]在北美洲,異色瓢蟲的幼蟲或成蟲會吃君主斑蝶的卵或初出生的幼蟲[32]。
在歐胡島,有一種白色形態的君主斑蝶。這是由於在1965年及1966年引入了黑喉紅臀鵯及Pycnonotus jacosus。牠們是最普遍的吃昆蟲鳥類,也可能是唯一會吃君主斑蝶的鳥類。在夏威夷的君主斑蝶只有低含量的卡烯內酯,而這些鳥類亦可以忍受這種毒素。這兩種鳥會吃君主斑蝶的幼蟲及蛹,也會吃正在休息的成蟲,但很少吃飛行中的成蟲。所以白色君主斑蝶比橙色的有較高的生存率。這可能是因異類選擇或偽裝[33]。
君主斑蝶的寄生蟲是寄生蠅Lesperia archippivora。被寄生的幼蟲會繼續脫毛及懸掛自己,但卻於成蛹前死亡。此時一種白色的蛆會從幼蟲中出來及被絲線懸掛。蛆會在地上形成褐色的蛹[34]。
一種微球菌屬的Micrococcus flacidifex danai亦會影響幼蟲及導致死亡。君主斑蝶幼蟲在成蛹前會如常的走到水平面上,但於幾小時後死亡,屍體仍然以後腹腳懸掛。該屍體會在很短時間變為黑色。另外,綠膿桿菌雖沒有入侵能力,但卻會引發繼發感染。這些都是在實驗室飼養的君主斑蝶死亡的原因[34]。
一種稱為Ophryocystis elektroscirrha的原生動物是君主斑蝶的另一種寄生蟲。牠會感染皮下組織,並以在蛹時期長成的孢子傳播。孢子會在受感染的整隻君主斑蝶身體,而大部份集中在腹部。這些孢子會在雌蝶產卵時被擦掉,而出生後的毛蟲則會吃下並受感柒染。嚴重感染的身體會變得虛弱,不能展開翅膀及壽命較短。經過幾代後仍會有感染的情況[35]。
|coauthors=值左起第47位存在換行符 (帮助) |publisher= (帮助) |title=值左起第19位存在換行符 (帮助) |accessdate=需要含有|url= (帮助) |accessdate=需要含有|url= (帮助) 君主斑蝶(学名:Danaus plexippus),又名黑脉金斑蝶,大樺斑蝶,是一種斑蝶。牠們可能是北美洲最廣為人知的蝴蝶。自19世紀,牠們就在新西蘭被發現,並於1871年在澳洲發現。牠們分佈在歐洲的加那利群島及馬德拉,並有一些遷徙至俄羅斯、亞速爾群島、瑞典及西班牙。翅膀上有顯眼的橙色及黑色斑紋,翅膀闊8.9-10.2厘米。雌蝶的翅脈更為深色,雄蝶的後翅中央有一斑點可以釋放信息素。雄蝶較雌蝶為大。

オオカバマダラ(大樺斑・学名Danaus plexippus )は、チョウ目・タテハチョウ科・マダラチョウ亜科に分類されるチョウの一種。北アメリカでは渡り鳥のように渡りをするチョウとして有名。
成虫の前翅長は5cmほど。翅は橙色で翅脈と縁が黒い。黒の縁取りの上には小さな白い斑点がある。オスとメスを比較すると、オスは後翅の腹部に近い部分に黒い斑点がある。メスにはこの黒い斑点がなく、黒い翅脈がオスよりも太い。ゆっくりと飛ぶが飛行能力にはすぐれていて、あまり羽ばたかずに気流に乗って遠距離を飛び続けることができる。
おもに北アメリカのカナダ南部から南アメリカ北部にかけて分布するが、西インド諸島、太平洋諸島(オーストラリアとニュージーランドなど)、カナリア諸島とマデイラ諸島にも分布する。日本では小笠原諸島や南西諸島で発見された記録があるが、これらは定着しておらず、季節風や台風などに乗って日本へやってきた「迷蝶」とみられる。なお、ロシア、アゾレス諸島、イギリス、スウェーデン、スペインでも、迷蝶としてしばしば記録される。
メスを見つけたオスは尾部から毛の束を出し、この毛の束からフェロモンを放出しながらメスの周囲を飛び回る。交尾の終わったメスは幼虫の食草であるトウワタなどのガガイモ科植物の上に産卵する。幼虫は白黒の横しま模様で、頭部付近と尾部付近に黒い突起を持つ。また、蛹は青緑色で、羽化間近になると金属光沢のある灰黒色となる。
幼虫はトウワタの葉を食べることによって、トウワタのもつアルカロイドを体内に蓄えて毒化する。この毒は蛹や成虫も持ち続けているので、鳥などがオオカバマダラを捕食すると間もなく苦しみはじめ、ついには吐き出してしまう。オオカバマダラは幼虫、蛹、成虫どれも鮮やかな体色をしているが、これは捕食者に毒を持っていることを知らせる警戒色といえる。カバイロイチモンジ (Viceroy、Limenitis archippus)など、 オオカバマダラの翅色に似せた擬態(ベイツ型擬態)をすることで身を守るチョウも知られている。また、分布域の南部では同属の他のチョウと分布が重なるため、ミューラー型擬態も起こっている。
北アメリカに分布する基亜種D. p. plexippusは、南北3500kmほどに及ぶ分布域内で、1年のうちに北上と南下を行うことが知られている。ただし南下は1世代で行われるが、北上は3世代から4世代にかけて行われるので、同じ個体が移動する渡り鳥のおこなう渡りとは厳密には異なる。
春にはカリフォルニア州からメキシコにかけてで見られる。これらは世代交代を繰り返しながら徐々に北上し、夏になると北アメリカ中部まで達する。そして8月頃、北アメリカ中部で羽化した個体が南下をはじめる。この世代は多くの花から蜜を吸い、体内に脂肪を大量に蓄える。この脂肪をエネルギーにして、春に移動が始まったカリフォルニアからメキシコにかけての地域を目指す。ロッキー山脈から東ではメキシコのミチョアカン州で越冬し、西ではカリフォルニア州の中部から南部で越冬する。10月頃にはこの地域の森林地帯で、木の枝に鈴なり状態となったオオカバマダラがみられる。このような木ではチョウの重みで枝が折れることもある。
南下する世代は、北上する世代よりも寿命が長い。この大移動にまつわる報告・研究も数多いが、大移動の理由の一つとしては「幼虫の食草を枯渇させないため」が挙げられる。
米国フロリダ州からカリブ海、アマゾン川流域に分布するD. p. megalippe亜種は渡りをしない。
越冬地となる森林が多く伐採されたこともあり、オオカバマダラは近年個体数を大幅に減らしている。そのため北アメリカ諸国では越冬地を保護区とするといった保護活動が行われている。カナダ政府は、本種を特別懸念(Special Concern)に指定している[1] 。
その目をひく姿と興味深い生態から、アングロアメリカでは広く愛されている。アラバマ州、アイダホ州、イリノイ州、テキサス州の州の昆虫[2]およびミネソタ州、バーモント州、ウェストバージニア州の州のチョウ[3]に指定されている。カナダの国虫であり、1989年にはアメリカ合衆国の国虫にノミネートされた。
ペットとして、また教材として飼育されることもあり、結婚式で成虫を大量に放つことも人気がある。昆虫学者は愛蝶家の協力により北アメリカ各地で秋に捕獲した成虫の翅に標識シールを貼って放し、渡りの生態を調査している。
カリフォルニア州とメキシコでは、越冬地をエコツーリズムに役立てている例もある。
大移動とメキシコでの保護活動を紹介する仏加共同制作のテレビ番組が2007年にNHKで放映されて、その後2013年5月2日に再放送された。 そして、同年10月24日NHK BSプレミアムでハイビジョン フロンティア特集「神秘のチョウ 驚異の大冒険」として再々放送された。 カナダやアメリカ北部から5千㎞を越えて、オオカバマダラが飛来するメキシコ・ミチョアカン州では、死者が家族の元に帰るものとして賑やかな祭りが催され観光化している。 また、渡りの際に様々な環境の変化によって年々その数が減ってきていると警鐘している。
제왕나비 또는 군주나비(Monarch butterfly)는 캐나다 남부, 미국 대륙, 중앙아메리카에 주로 분포하는 왕나비류의 일종이다. 지역에 따라서 milkweed, 별선두리왕나비, wanderer 및 black veined brown으로 불린다. 가장 친숙한 북미 대륙의 나비이며 상징적인 꽃가루 매개종으로 여겨진다.