tr
kırıntılardaki isimler


Procavia capensis occurs throughout most of Africa and the Arabian Peninsula with the exception of the Congo basin and Madagascar. It is the most arid-adapted of hyrax species, and its range includes dry mountainous regions in the Namib, Sahara, and Arabian deserts.
Biogeographic Regions: ethiopian (Native )
The word “hyrax” means “shrewmouse” in Greek. The Hebrew word for Procavia capensis, “Shaphan”, roughly translates into “the hidden one.” In Biblical times, hyraxes were known as “conies”. They are also referred to as dassies or rock dassies in Southern Africa.
All of the senses of rock hyraxes are well-developed, although their near-vision is thought to be relatively poor. Hyraxes have a variety of vocal calls. Territorial calls are distinct and genus-specific. In rock hyraxes, territorial calls are loud and repetitious and increase in volume and duration towards the end of the sequence before ending in a series of guttural noises. Adults also emit twittering or whinnying calls and striking alarm calls, which are made when a potential predator is identified. When threatened, they may growl or grind their molars. Infants make only five of the twenty-one sounds used by adults; three of these are vocal, including mewing calls given when they are lost or begging, and two are non-vocal. Between 2 to 15 months of age, young develop all vocal sounds except five; four of which are exclusive to adult females and one is characteristic of adult males.
Rock hyraxes urinate on the sides of rocks near colony sites. Crystallized calcium carbonate present in the excretion makes a white stain used in visual communication. Hyraxes also deposit their droppings and urine in a common latrine, but it is unknown whether this serves any role in olfactory communication. The dorsal gland and hair surrounding it are important for communication among conspecifics. Pheromone production from the dorsal gland increases with increased stimuli. In an aggressive context, pheromone production is accompanied by a slight curling of the upper lip and piloerection of the neck hairs. During territorial calls, males crouch and raise their head with their jaws slightly agape. Hyraxes show submission by presenting their hindquarters, backing away, closing their dorsal gland, and/or flattening their ears. Submissive behaviors are very important, as simple interactions such as approaching or directly staring at another adult might be seen as a threat and the tusks can inflict fatal wounds. To avoid antagonizing other individuals, feeding or huddling individuals usually face away from each other.
Communication Channels: visual ; acoustic ; chemical
Other Communication Modes: pheromones ; scent marks
Perception Channels: visual ; tactile ; acoustic ; chemical
Although Procavia capensis is classified as a species of least concern on the IUCN's Red List of Threatened Species, current population trends are unknown. While it is hunted for its meat throughout its geographic range and has experienced local extirpations, there are no major threats to the long-term persistence of this species.
IUCN Red List of Threatened Species: least concern
In areas where humans are prevalent, especially South Africa, rock hyraxes are sometimes considered pests, as they inhabit road culverts and/or crevices in stone walls. Agricultural plots that have been recently cleared are often bordered by rocks that were removed during clearing, thus providing prime habitat for rock hyraxes. Fields such as these are often used for cultivating fruit trees, upon which hyraxes browse and cause considerable damage. In addition, rock hyraxes are a known reservoir for Leishmania tropica, a flagellate parasite that infects rodents and humans.
Negative Impacts: injures humans (carries human disease); crop pest
Members of Procavia capensis colonies urinate and defecate in designated areas called latrines. As time goes on and more material accumulates, this matter eventually congeals into a large, sticky solid. This substance has been used in a number of applications, including a medicine called hyraceum that has been used to treat epilepsy, convulsions, and a number of female-specific diseases. Procavia capensis is hunted for its meat throughout its geographic range.
Positive Impacts: food ; source of medicine or drug
Rock hyraxes are the dominant herbivores in rocky areas throughout their geographic range. They are preyed upon by a number of different vertebrate species and are known to host up to 25 species of lice.
Commensal/Parasitic Species:
Rock hyraxes are primarily grazers and forage on many different plant species per foraging bought; however, regional preferences have been documented. For example, giant lobelia and certain daisy species are preferred on the west slope of Mt. Kenya, swampy vegetation is eaten close to the bottoms of valleys, and lowland forage includes new shoots, fruits, berries, and figs. Grasses make up 78% of the diet during the wet season, but only 57% during the dry season. When conditions are moist, either during the wet season or after a rainfall, rock hyraxes show a preference for new shoots, buds, and leaves. During drought, they may eat coarse material such as bark, lichens, and liverworts. Daily food consumption varies with body weight, and plant water content has a significant influence on the amount of food that is ingested. Rock hyraxes may travel up to 60 m from their burrows to forage but may travel further during a drought. When grazing, individuals maintain their spacing and remaining vigilant for potential predators.
The feeding habits of rock hyraxes are comparable to those of ungulates. Giraffes and elephants are their most likley competitors for food. Hyraxes can feed very rapidly and entire colonies may spend less than one hour per day feeding. Most feeding is concentrated in two feeding periods of about twenty minutes: one about three hours after sunrise and the other about two hours before sunset. Rock hyraxes do not manipulate or carry their food, and they use their feet only to reach or hold twigs. While foraging, they often hold their head at a 90˚ angle to best utilize their wide gape, and they bite off large amounts of vegetation. By eating large amounts of food quickly, and spending most of their time resting, rock hyraxes are able to survive on resources too sparse or nutrient-poor to support more active mammals of a comparable size.
Plant Foods: leaves; wood, bark, or stems; fruit; bryophytes
Primary Diet: herbivore (Folivore )
Procavia capensis is commonly found in arid land habitat including deserts, savannas and scrub forests. It lives in rocky areas with moderate vegetative cover and many rock crevices and cavities, the latter of which are used as shelter. Although it does not burrow, it does inhabit abandoned burrows, including those of aardvarks and meerkats. Even when traveling between suitable habitats, rock hyraxes do not normally stray from areas with some form of cover or refuge.
Habitat Regions: tropical ; terrestrial
Terrestrial Biomes: desert or dune ; savanna or grassland ; scrub forest
Other Habitat Features: agricultural
Little information is available regarding the average lifespan of Procavia capensis, however, evidence suggests it can live for up to 12 years in the wild.
Range lifespan
Status: wild: 12 (high) years.
Average lifespan
Status: wild: 8.5 years.
Average lifespan
Status: captivity: 11.0 years.
Average lifespan
Status: wild: 14.0 years.
Hyraxes are the smallest of the subungulate mammals and are similar in appearance to woodchucks. Members of this species have a single pair of long, strong, tusk-like incisors, and their molars are similar to the cheek teeth of rhinoceroses. Total length for adults ranges from 305 to 550 mm, and tail length ranges from 11 to 24 mm. Hindfoot length ranges from 65 to 76mm, and ear length ranges from 27 to 38 mm. These hyraxes are heavily built for their size, weighing as much as 4.3 kg. Males (4 kg) are slightly larger than females (3.6 kg) and have blunter features and thinner bodies with thicker necks than females. The tusks of males are larger and sharper than those of females. Males also have a larger larynx and larger guttural pouches, which help to amplify their territorial calls. Hyrax eyes contain a special membrane called the umbraculum that is thought to shield the eye from the sun.
The forefeet of Procavia capensis have four toes and are plantigrade, while the hindfeet have three toes and are semi-digitigrade. All of the toes have rounded nails resembling hooves, except the inside rear toe, which is equipped with a claw that is used in grooming. Procavia capensis has mesaxonic feet in which the plane of symmetry passes through the third digit. The soles of the feet have large, black pads that are moistened by sweat glands, increasing their cohesion to rocky substrates.
The coat of Procavia capensis is dense and rough, with a thick undercoat and long guard hairs scattered throughout. Long, black vibrissae, used as haptic receptors, are found on the back and around the mouth. Pelage color is highly variable among subspecies, ranging from gray, to yellow-brown, to dark brown. The dorsum is usually darker than the flanks, and the venter tends to be a paler cream-color. In the cape region of Africa, pelage color corresponds with environmental moisture; animals living in wetter areas have darker coats, and those living in more arid regions have paler coats. A patch on the dorsum is surrounded by longer hairs in a contrasting color that may be black, yellow, or orange. Underneath this patch is a bare spot containing a dorsal gland specific to hyraxes that secretes pheromones, which are likely used to mark rocks and help young imprint on their mother. Pheromone production is most pronounced during mating season.
Range mass: 4.3 (high) kg.
Average mass: 3.8 kg.
Range length: 305 to 550 mm.
Other Physical Features: endothermic ; homoiothermic; bilateral symmetry
Sexual Dimorphism: male larger; sexes shaped differently; ornamentation
Average basal metabolic rate: 4.954 W.
Except in high mountainous areas, leopards are the main predator of Procavia capensis. Hyraxes may also be preyed upon by snakes (e.g., Egyptian cobras and puff adders), eagles (e.g., Verreaux’s eagles and martial eagles), owls, jackals, African wild dogs, and various cat species (e.g., servals, caracals and lions). Neonates are sometimes preyed upon by mongooses. Procavia capensis evades predators by staying alert and remaining close to cover while foraging. Individuals immediately respond to the alarm calls of territorial males and to the calls of other species such as bush hyraxes and some birds. Hyraxes also avoid predators by using burrows that are smaller in diameter than most predators in their habitat. They have been known to escape predation by playing dead, or by working together to scare off smaller predators from the safety of a burrow.
Known Predators:
Rock hyraxes are polygynous, and a single territorial male can control a harem of 3 to 7 females in a territory of less than 4000 square meters. Prior to copulation, the male usually calls and then approaches a receptive female with his penis and dorsal spot erected while weaving his head. Although there are no visible signs of estrous, the quantity or quality of dorsal-gland secretions may change as a function of estrous. Mating females may attack their mates when they approaching if females are not willing to copulate. A willing female backs into the male and presses her anogenital region against his flank and breast. The male then grasps her with his forelegs for a moment while copulation occurs. Territorial males preferentially mate with mature females. Peripheral males are usually only successful in mating with subadult or young adult females that are under 28 months of age. The structure of the male penis differs between the different genera of hyraxes, thus contributing to reproductive isolation where sympatry occurs.
Mating System: polygynous
Procavia capensis breeds seasonally (e.g., August to November in Kenya) with births synchronized to occur during the rainy season. During the breeding season, there is a significant increase in territoriality evident through dramatically higher rates of calling and aggression in males; these behaviors correspond with an increase in testicle size. Testicles can become more than 20 times larger than their normal size during breeding season. Outside of the breeding season, spermatogenesis does not occur. Gestation lasts from 6 to 8 months, which is unusually long for a mammal of such small size. Extended gestation in P. capensis is thought to reflect the fact that its ancestors were much larger in body size. Females become increasingly aggressive as parturition approaches and temporarily form isolated nursing groups with other pregnant females. Birth takes place in the dark and females make hoarse squeaking noises in time with their contractions. Litter size ranges from 1 to 6, with an average of 2.4, which represents 10.8% of the mother’s weight. Newborns are large and well-developed at birth. They have both eyes fully opened, a complete coat of hair, and weigh 170 to 240 grams. Young can jump by two days old, and by the third or fourth day, they begin to eat food. Newborns are capable of eating solid food by two weeks of age. Weaning is usually complete by three months after birth. Reproductive maturity is achieved at 16 months of age, but young do not reach adult size and weight until three years of age.
Breeding interval: Rock hyraxes breed once yearly
Breeding season: In Kenya, rock hyraxes breed from August to November.
Range number of offspring: 1 to 4.
Average number of offspring: 2.4.
Range gestation period: 6 to 8 months.
Average weaning age: 3 months.
Average age at sexual or reproductive maturity (female): 16 months.
Average age at sexual or reproductive maturity (male): 16 months.
Key Reproductive Features: iteroparous ; seasonal breeding ; gonochoric/gonochoristic/dioecious (sexes separate); sexual ; viviparous
Average birth mass: 205 g.
Average number of offspring: 3.
Average age at sexual or reproductive maturity (male)
Sex: male: 500 days.
Average age at sexual or reproductive maturity (female)
Sex: female: 500 days.
After birth, neonates are licked clean before they climb onto the back of the mother where they rest on her dorsal gland. This is thought to promote imprinting and keeps young warm and out of the way of other adults. Females have three pairs of mammae, one pectoral and two inguinal, all of which are used in nursing. Nursing may occur inside a burrow or outside on the rocks and occurs at roughly 1.5 h intervals during the first couple of days after birth. There is no information available regarding paternal care in this species.
Parental Investment: precocial ; female parental care ; pre-fertilization (Provisioning, Protecting: Female); pre-hatching/birth (Provisioning: Female, Protecting: Female); pre-weaning/fledging (Provisioning: Female, Protecting: Female); pre-independence (Provisioning: Female, Protecting: Female)
Rock hyraxes(Procavia capensis)are found throughout sub-Saharan and north-east Africa, and prefer – as their name suggests – rocky outcrops and cliffs, inhabiting abandoned burrows and crevices they use as shelter.
Despite looking like rodents, rock dassies are actually more closely related to the elephant – based on similarities with their primitive ungulate ancestors from the Eocene era, like teeth and bone structure. Regardless, it is so unique that it’s classified in an order of its own, along with its other subspecies.
Rock dassies look like oversized guinea pigs without tails and rounder ears, with thick brown/grey fur and weigh around 4 kilograms. They have short legs with three toes on their back feet and four on the front. On the bottom of their feet, they have thick, rubbery pads, making it easier to move over rocky substrates. The have long, tusk-like incisors, used for biting off large quantities of vegetation. The iris of hyraxes slightly protrudes over the pupil of their eyes, which decreases the amount of sunlight to their eye.
Rocky hyraxes live in colonies of about 50, with territorial males dominating over harems of a few related females and their offspring. These males are constantly on the lookout for predators and rivals.
These dassies have unusually long pregnancies for animals of their size, and have a gestation period of seven or eight months, new-borns being so developed that they are able to jump and run only two days after birth! They bear between two or three infants at a time.
Procavia capensisis listed as Least Concern on the IUCN Red List of mammals, but do occur in many protected areas across its range.
Interesting fact:
Rock hyraxes have designated areas they use as ‘latrines’, and as time goes by, these urine deposits accumulates and eventually congeals into a large, sticky solid. –Seehow scientists are using these deposits to investigate past climate change!
For more information on MammalMAP, visit the MammalMAPvirtual museumorblog.
Die klipdassie (Procavia capensis) is 'n dassie wat dwarsoor Suid-Afrika voorkom. Hulle staan ook bekend as die klipdas.
Die klipdassie (Procavia capensis) is die bekendste verteenwoordiger van die dassiefamilie (Procaviidae), waarvan die voorlopers aan olifante, renosters en tapirs verwant was. Klipdassies is klein, maar fris geboude, bruinerige diere met kort ore en merkwaardige pote met hoewe.
Die hoewe, asook die kiestande, stem ooreen met die van renosters. Die diere kom in Afrika, die Nabye Ooste en Arabië voor en leef in groot kolonies in klipperige gebiede. Hulle is planteters wat min water drink, wat meebring dat die urinekonsentraat baie hoog is. Die neerslag wat oorbly nadat die water uit die urine verdamp hel, staan as klipsweet bekend.
Die klipdassie se Afrikaanse naam dateer uit die vroeë Suid-Afrikaanse geskiedenis. In 1601 het 'n Nederlander, kaptein Joris van Spilbergen, op die huidige Dasseneiland (in die Atlantiese Oseaan, wes van Yzerfontein) aan land gegaan en na sy vertrek geskryf oor onder meer 'n aantal diere wat volgens hom soos die "steendasch" (die Europese ratel) gelyk het. Die diere waarvan hy gepraat het, was Procavia capensis, hoewel hulle glad nie soos die betrokke ratels lyk nie.
Die "steendasch" het later "klipdassie" geword. Van Spilbergen het ook gevind dat die vleis van klipdassies baie smaaklik is. Dit het glo soos lams - of skaapvleis geproe, en om die tekort aan vars vleis aan die Kaap te verlig, het hy klipdassies op Dasseneiland laat vang en hulle op Robbeneiland vrygelaat om aan te teeI. Ook Jan van Riebeeck het van klipdassievleis gehou, en hy het jagpartye na Dasseneiland onderneem om klipdassies te jag.
Hy was ook baie begaan oor die welstand van die klipdassies wat op Robbeneiland vrygelaat is, en in 1653 het hy beveel dat soveel moontlik van die diere op die eiland geplaas moet word. 'n Jaar later het hy selfs die jag op klipdassies verbied sodat hulle kon aanteel.
Hul kleur wissel van grysbruin tot vaalbruin met 'n geel of rooi skynsel en fyn swart spikkeltjies. Op die rug is daar 'n langwerpige kol swart hare wat by ander soorte dassies wit of geel is. Die soogdier het nie 'n stert nie, hulle lyk amper soos marmotte. Die mannetjie (3,2 – 4,7 kg) is effens swaarder as die wyfie (2,5 – 4,2 kg).
Die klipdassie (Procavia capensis) is 'n klein, bruinerige dier wat soos 'n marmot of 'n konyn met baie kort ore lyk. Klipdassies en ander dassies, wat hoofsaaklik in kleur en leefwyse verskil, vorm die familie Procaviidae en was vroeër in die orde van die hoefdiere (Ungulata) ingedeel, maar word tans in 'n eie orde, Hyracoidea, geklassifiseer.
Die pote van hierdie diere is baie eienaardig. Daar is 5 tone (waarvan een rudimenter is) aan die voorpote, en 3 aan die agterpote. Die binnekantste toon van elke agterpoot eindig in 'n gekromde klou, terwyl die ander tone almal in kort naels of hoewe eindig wat net in grootte van die van renosters verskil.
Die pote is van soolkussings voorsien. Wanneer die dier tussen rotse beweeg, word die kussings op so ʼn wyse teen die rotse gedruk dat ʼn lugleegte ontstaan wat meebring dat die sool vassuig. Klierafskeiding hou die sole voortdurend klam. Die bokaak dra een paar snytande wat goed ontwikkel is en net soos die van knaagdiere geboe is.
Dit groei ook weer namate dit afgeslyt word. In die onderkaak kom 2 paar snytande voor. Daar is 'n oop ruimte tussen die snytande en die maaltande, wat soos die van 'n renoster lyk. 'n Ander kenmerk van die klipdassie is die klier wat op 'n haarlose deel van die vel bo-op die rug voorkom. Die kleur van die langerige haarklossies wat daaromheen groei en dit bedek, is altyd ligter as die van die dier se pels. Daar word aangeneem dat dassies 'n baie ou dieregroep is wat uit hoefdiere ontstaan het. Hoewel daar 'n enorme verskil in grootte is, is hierdie diertjies aan olifante, renosters en tapirs verwant.
Fossiele van byna 40 miljoen jaar gelede wat gevind is, dui egter daarop dat die vroeë voorgangers baie groter was en selfs so groot soos perde kon gewees het.
Hulle verkies om op rotse, kranse of klipkoppies met 'n bedekking van bosse of bome te bly. Hulle eet gras, struike en kruide. Die dier is daglewend. Hulle bly in kolonies wat wissel van vier tot 'n paar honderd met 'n geordende hiërargie. Hulle kan goed boomklim en sit eers in die son om warm te word voor hulle begin wei. Een tot ses kleintjies word na 'n dratyd van ±7½ maande gebore; tussen September en Oktober in die winterreënvalgebiede en Maart en April in die somerreënvalgebiede.
Hule het baie natuurlike vyande: bruin hiëna, luiperd, breëkoparend, witkruisarend en die Afrikaanse jagarend. lipdassies kom in klipperige gebiede in Afrika, die Nabye Ooste en Arabië voor. Hulle is baie sosiaal en leef in groot kolonies van tot 60 diere saam. Die kolonies word gevorm deur afsonderlike families wat uit een volwasse mannetjie, ʼn aantal wyfies en hul kleintjies bestaan. Hulle is by uitstek dagdiere wat baie lief is om bo-op die rotse in die son te sit en bak.
As die diere hul skuilings in rotssplete of tussen klippe verlaat, hou 'n aantal mannetjies altyd wag en waarsku hulle die res as daar gevaar dreig. Hul gehoor- en gesigsvermoë is baie skerp en hulle beskik oor ʼn aantal verskillende geluide waarmee hul kan kommunikeer. Klipdassies is planteters wat hoofsaaklik van blare, gras, bessies en boombas leef. Hulle drink selde en hul maaginhoud is dan ook in vergelyking met die van ander diere baie droog, met die gevolg dat die urinekonsentraat bale hoog is.
Sodra die water uit die uitgeskeide urine verdamp het, bly daar 'n witterige neerslag van verskillende soute oor. Dit staan bekend as klipsweet (hyraceum), wat volgens boererate in poeiervorm vir blaasaandoenings en sekere vrouesiektes gebruik kan word. Klipsweet word ook vir die bereiding van parfuum gebruik. Die versameling van klipsweet word vergemaklik deurdat klipdassies die gewoonte het om almal op dieselfde plek te urineer. 'n Klipdassiewyfie is 7 maande dragtig en gewoonlik word 2 of 3 kleintjies in 'n skuilplek tussen ratse gebore. Soms word tot 6 kleintjies op 'n keer gebore. Hulle kan reeds by geboorte sien en is binne 'n kort tyd selfstandig. Klipdassies se natuurlike vyande is luiperds, wildehonde, rooi- en wildekatte, roofvoëls en muishonde, maar omdat hierdie jagdiere deur die mens uitgeroei word, het klipdassies in sekere gebiede 'n plaag geword wat die weiding van kleinvee vernietig.
Die ander verteenwoordigers van die familie Procaviidae word in 2 genera ingedeel, naamlik Heterohyrax en Dendrohyrax. Eersgenoemde is so nou aan die klipdassie verwant dat sommige dierkundiges hulle ook onder die genus Procavia klassifiseer. Die bekendste spesie van die genus is die geelkoldas (Heterohyrax brucei), wat in Namibië, Noord Gauteng en verder noordoos aangetref word. 'n Ander spesie, Heterohyrax syriaca, kom in Sirië en ander Midde-Oosterse lande voor.
Dit is die dasse waarvan daar in die Bybel in Ps 1 04:1 8 melding gemaak word. Die leefwyse en voorkoms van die geelkoldas verskil feitlik glad nie van die van die klipdassie nie. Opvallend is egter dat die hare oor die rugklier wit is. Die meeste spesies boomdasse, ook genoem bosdasse (genus Dendrohyrax) is boomlewend en kom in die woudstreke van Afrika voor. Een spesie, Dendrohyrax arboreus, word ook langs die Natalse ooskus aangetref.
Hulle woon in hol boomstamme of in digte loof en is nagdiere. Die draagtyd en gewoonte om op dieselfde plek te urineer, stem met die van klipdassies ooreen, maar die wit hare oor die rugklier is langer en kan orent staan wanneer die dier opgewonde is.
* Wêreldspektrum, 1982, ISBN 0908409567 band
Die klipdassie (Procavia capensis) is 'n dassie wat dwarsoor Suid-Afrika voorkom. Hulle staan ook bekend as die klipdas.
Die klipdassie (Procavia capensis) is die bekendste verteenwoordiger van die dassiefamilie (Procaviidae), waarvan die voorlopers aan olifante, renosters en tapirs verwant was. Klipdassies is klein, maar fris geboude, bruinerige diere met kort ore en merkwaardige pote met hoewe.
Die hoewe, asook die kiestande, stem ooreen met die van renosters. Die diere kom in Afrika, die Nabye Ooste en Arabië voor en leef in groot kolonies in klipperige gebiede. Hulle is planteters wat min water drink, wat meebring dat die urinekonsentraat baie hoog is. Die neerslag wat oorbly nadat die water uit die urine verdamp hel, staan as klipsweet bekend.
El damà roquer del Cap (Procavia capensis) és una espècie de damà. Com tots els damans, té una semblança superficial a un conill porquí amb orelles curtes i una cua. Viu a gran part d'Àfrica i a parts de l'Orient Pròxim.
Daman skalní, též daman kapský nebo daman jihoafrický (Procavia capensis) je větší druh damana, savec připomínající králíka nebo morče, nicméně příbuzný spíše sirénám a slonům. V Jihoafrické republice ho nazývají dassie, což znamená jezevec.
Daman skalní připomíná králíka s krátkým ocasem a ušima. Samci jsou o něco větší než samice, srst je hnědé barvy.
V ostatních ohledech se damani od králíků nebo hlodavců výrazně liší. Prsty jsou zakončené nehtovitými kopýtky, na předních končetinách mají prsty čtyři a našlapují na celou plochu chodidla, na pánevních končetinách jsou prsty jen tři a chodidlo se země nedotýká (poloprstochodci). Na kopýtka našlapují pouze v běhu, jinak se pohybují po měkkých polštářcích na chodidlech, kam ústí žlázy vylučující lepkavý sekret, který jim umožňuje snadný pohyb po skalách.
Další zvláštností je pár stále dorůstajících řezáků, které tvoří jakési kly, a stoličky, které připomínají stoličky nosorožce.
Daman skalní je běžným druhem etiopské oblasti, žije v Africe na jih od Sahary, na většině území subsaharské Afriky, v jihovýchodní i jižní Africe. Mimo toto území obývá také izolované horské masivy v Libyi a Alžírsku a vyskytuje se rovněž v Sýrii.
Je přizpůsobený životu ve skalnatých suchých oblastech, obývá skalní převisy a opuštěné nory hrabáčů nebo surikat.
Damani jsou aktivní ve dne, kdy hledají potravu nebo se vyhřívají na slunci. Mají poměrně špatnou schopnost termoregulace, slunění proto zabírá značnou část jejich dne. Žijí ve velkých stádech čítajících až 80 damanů, které se dále skládá ze skupin tvořených několika rodinami vedených dospělým samcem.
Daman skalní je býložravec, jeho trávení je podobné trávení koně. Stejně jako on má objemné tlusté střevo osídlené symbiotickou mikroflórou, která mu umožňuje trávit celulózu. Krmí se hlavně bylinami, jako je Lobelia deckenii a rostliny rodu Senecio, tedy starčeky, které ovšem v areálu damanů rostou také jako stromy. Jejich nejoblíbenější potravou jsou mladé výhonky a ovoce, v období sucha však 75% jejich potravy tvoří trávy.
Období páření začíná v srpnu a trvá 1-2 měsíce. Březost trvá 202-245 dní, poté se rodí 1-6 mláďat, která jsou už osrstěná a dobře vidí. Už po dvou týdnech mohou konzumovat pevnou stravu, nicméně samice je kojí po dobu 3-6 měsíců.
Mláďata pohlavně dospívají v 16 měsících a plné velikosti dosahují ve třech letech. Mohou se dožít 9-14 let.
Daman skalní tvoří mnoho poddruhů, z nichž některé se občas popisují jako samostatné druhy:
V Evropě je daman skalní chován ve více než třech desítkách zoo.[2] V Česku se jednalo na konci roku 2017 o čtyři zoo:[3]
Dříve byli damani skalní chování také v dalších českých zoo:[2]
Daman skalní, též daman kapský nebo daman jihoafrický (Procavia capensis) je větší druh damana, savec připomínající králíka nebo morče, nicméně příbuzný spíše sirénám a slonům. V Jihoafrické republice ho nazývají dassie, což znamená jezevec.
Der Klippschliefer (Procavia capensis), mitunter auch Wüstenschliefer oder Klippdachs genannt, ist eine Art in der Ordnung der Schliefer (Hyracoidea). Sein Körperbau erinnert an Meerschweinchen. Die Gliedmaßen sind kurz und kräftig, ein Schwanz fehlt. Am Rücken besteht ein auffallender farbiger Fleck, der eine Drüse umgibt. Markant sind auch die zahlreichen Tasthaare, die das Fell durchsetzen. Von allen heutigen Schliefern hat der Klippschliefer das größte Verbreitungsgebiet. Dieses ist nicht geschlossen, ein Verbreitungsschwerpunkt findet sich im südlichen Afrika, ein weiterer nördlich des Kongobeckens und südlich der Sahara. Von hier zieht das Vorkommen über den nordöstlichen Teil des Kontinents nach Vorderasien. Die bewohnten Lebensräume bestehen aus Wüsten und felsigen Landschaften, zudem aus Offenlandgebieten und Wäldern. Die Tiere sind sowohl im Flachland wie auch in hohen Gebirgslagen anzutreffen. In weiten Teilen Afrikas tritt der Klippschliefer gemeinsam mit dem Buschschliefer auf.
Die Lebensweise des Klippschliefers ist gut erforscht. Er bewohnt Felsspalten und Höhlen und tritt vorwiegend tagaktiv auf. Als Hauptnahrung dienen Pflanzen, ihre Zusammensetzung ist abhängig von Jahreszeit und Angebot: in der Trockenzeit bevorzugen die Tiere weiche Pflanzennahrung, in der Regenzeit dagegen härtere. Sie leben gesellig in Kolonien, das Sozialgefüge ist komplex. Eine Gruppe besteht meist aus einem dominanten Männchen, den fortpflanzungsfähigen Weibchen und dem Nachwuchs. Daneben treten noch einzeln lebende Männchen auf. Die Gruppe geht gemeinsam auf Nahrungssuche. Den Großteil des Tages verbringt der Klippschliefer vor allem einzeln oder in Gruppen ruhend, was auf die wenig beständige Körpertemperatur und den niedrigen Stoffwechsel zurückzuführen ist. Das besetzte Territorium wird gegen Eindringlinge verteidigt. Das dominante Männchen stößt zudem markante Rufe aus, die sehr komplex sind. Daneben verfügt der Klippschliefer über eine vielfältige Sozialkommunikation. Nachwuchs kommt einmal jährlich zur Welt, die Weibchen einer Gruppe gebären häufig in kurzen Zeitabständen. Die Jungen sind bei der Geburt weit entwickelt und nach 16 bis 29 Monaten geschlechtsreif. Die jungen Männchen verlassen dann die Kolonie. Bedeutendste Fressfeinde stellen verschiedene Greifvögel und Raubtiere dar.
Zu den frühesten Erwähnungen des Klippschliefers gehören jene aus dem Alten Testament. Modernere Berichte reichen bis in das 17. Jahrhundert zurück. Die wissenschaftliche Erstbeschreibung datiert in das Jahr 1766, vor allem im Verlauf des 19. Jahrhunderts wurde der Klippschliefer in der Gattung Hyrax geführt. Anfänglich galten die Tiere als nahe verwandt mit den Nagetieren, später sah man sie eher in einer engeren Beziehung mit anderen Huftieren. Bis in die 1970er Jahre waren zudem mehrere Arten anerkannt. Daneben bestehen noch einige fossile Vertreter, der älteste Nachweis datiert in das Pliozän vor etwa 5 Millionen Jahren. Der heutige Bestand des Klippschliefers wird als ungefährdet eingestuft.
Der Klippschliefer ist der bekannteste Vertreter der Schliefer. In der Körpergröße entspricht er einem Kaninchen. Mehr als 60 untersuchte Individuen aus der Serengeti wiesen eine Gesamtlänge von 39,5 bis 57,8 cm und ein Körpergewicht von 1,8 bis 5,4 kg auf. Weitere 30 vermessene Exemplare aus Südafrika variierten in ihrer Körperlänge von 37,6 bis 62,8 cm bei einem Körpergewicht von 1,5 bis 4,3 kg.[1] Einzelne Individuen werden bis 76,2 cm lang.[2] Männliche und weibliche Tiere sind etwa gleich groß gebaut. Bezüglich der Körpergröße lassen sich Variationen im gesamten Verbreitungsgebiet feststellen. Diese hängen teilweise von der Umgebungstemperatur ab, so dass der Klippschliefer offensichtlich der Bergmannschen Regel unterliegt.[3] Es gibt niederschlagsbezogene Unterschiede in der Körpergröße. So nimmt in der Regel die Körpermaße in Gegenden mit bis zu 700 mm Jahresniederschlag kontinuierlich zu und fällt dann bei höheren Niederschlägen wieder ab.[4][5][6][1]
Allgemein handelt es sich um äußerlich dem Meerschweinchen oder dem Pfeifhasen ähnelnde Tiere mit einem kompakten Körperbau. Die Beine sind kurz, der Schwanz fehlt. Das Fell ist dicht und besteht aus rund 25 mm langen Haaren, die Unterwolle hat eine dichte, weiche Textur und ist kurz. Die Rückenfärbung reicht von gelblich-bräunlich bis dunkel bräunlich. Häufig wirkt das Fell gesprenkelt, was durch die Einzelhaare mit dunklen Basen und Spitzen sowie einem helleren, unterschiedlich breiten Band am Schaft hervorgerufen wird. Am hinteren Rücken markiert ein abweichend gefärbter Fleck eine etwa 15 mm lange Drüse. Die Färbung des Flecks unterscheidet sich geographisch und kann cremig-gelblich bis bräunlich oder schwärzlich sein. Die Haare des Flecks sind aufrichtbar. Zumeist erscheint die Körperunterseite heller als die Oberseite, die Haare hier werden länger und weisen keine zusätzlichen Schaftbänder auf. Gelegentlich wurden albinotische Tiere beobachtet.[7] Das Fell ist darüber hinaus von 60 bis 70 mm langen, dunklen Tasthaaren durchsetzt. Weitere Vibrissen treten im Gesicht auf, so oberhalb der Augen, an der Oberlippe und am Kinn, ihre Länge beträgt bis zu 100 mm. Die Stirn ist häufig dunkler als der restliche Körper, während über den Augen und am Kinn auch hellere Flecken auftreten. Die Ohrlänge beträgt 27 bis 38 mm, die Pupille des Auges weist eine eiförmige Gestalt auf. Bei starker Sonneneinstrahlung schiebt sich vom oberen Teil der Iris ein zusätzliches Schild hervor, das umbraculum („Schirm“) genannt wird und der Pupille damit eine nierenartige Form verleiht.[8][9] Die Hände verfügen über vier, die Füße über drei Strahlen. Lediglich an der inneren Zehe des Hinterfußes ist eine gebogene Kralle ausgebildet, alle anderen Zehen und Finger tragen platte, hufartige Nägel. Die Sohlen sind dunkel und nackt sowie mit einem ledrigen Hautpolster überzogen, das von zahlreichen Drüsen durchsetzt ist.[4][5][6][1]
Bei Männchen befindet sich der Penis etwa 35 mm vor dem Anus, was eine doppelt so große Distanz gegenüber den Baumschliefern (Dendrohyrax) ist, aber etwa nur der Hälfte des Zwischenraumes beim Buschschliefer (Heterohyrax) entspricht. Der Penis ist einfach gebaut mit einem ovalen Querschnitt.[10] Weibchen verfügen über drei Zitzenpaare, von denen zwei in der Leistengegend liegen, das dritte sich aber im Brustbereich befindet.[4][5][6][1]
Die größte Länge des Schädels variiert von 80 bis 104,2 mm, die größte Breite von 41,7 bis 64,9 mm. Bezüglich der Schädellänge treten nur wenige Unterschiede zwischen den Geschlechtern auf, die Schädelbreite ist bei Männchen aber deutlich größer, da diese einen stärkeren Jochbogen mit einer massiveren Kaumuskulatur entwickeln.[3] Das Rostrum ist allgemein relativ kurz, die Stirnlinie verläuft gerade, das Hinterhauptsbein steht senkrecht und ist breit. Die Orbita liegen weit auseinander und sind nach vorn gerichtet, sie haben eine ovale Form. Das Os interparietale (ein Schädelknochen zwischen dem Hinterhauptsbein und den Scheitelbeinen) wird zumeist von den Scheitelbeinen überwachsen. Die Temporalleisten liegen eng beieinander und formen teilweise einen Scheitelkamm. Der Postorbitalbogen ist zumeist nicht geschlossen. An der Schädelbasis fällt der lange und spitze Processus paroccipitalis auf, der tiefer reicht als die nur flache Paukenblase. Der Unterkiefer wirkt massiv, der aufsteigende Ast ist sehr breit. Der Winkelfortsatz verbreitert sich nach hinten in eine kleine Platte. Der Kronenfortsatz ragt nur wenig über den Gelenkfortsatz auf. Er ist kurz und leicht nach hinten gebogen. Das Foramen mentale öffnet sich unterhalb des dritten Prämolaren.[11][4][5][12]
Das Gebiss besteht aus 32 Zähnen und bildet folgende Zahnformel: 1.0.4.3 2.0.3.3 {displaystyle {frac {1.0.4.3}{2.0.3.3}}} 
Der Klippschliefer kommt in weiten Teilen Afrikas und in Westasien vor, sein Verbreitungsgebiet ist aber nicht geschlossen. Ein nördlicher Verbreitungsschwerpunkt beschränkt sich auf das Afrika südlich der Sahara und nördlich des Kongobeckens. Es reicht im Westen vom Senegal und dem Süden von Mauretanien nach Osten bis nach Uganda, Kenia und dem Norden von Tansania. Nach Norden zieht es sich dann entlang der östlichen Nilseite über den Sinai nach Israel und den Libanon weiter über die gebirgige Westküste der Arabischen Halbinsel mit Saudi-Arabien, Jemen und Oman. Das Auftreten der Tiere in Syrien und in der Türkei ist unbestätigt. Die Nordgrenze in Afrika ist nicht genau bekannt, es sind einzelne Inselpopulationen aus Algerien und Libyen belegt, so im Akkakus-Gebirge, auf dem Ahaggar-Plateau[13] und im Tibesti. Das südliche Verbreitungsgebiet umfasst das südliche Afrika und schließt weiter nördlich den Osten von Botswana, den Süden von Simbabwe und den Südosten von Sambia ein ebenso wie die Küstenregionen von Namibia und Angola.[5][6][1]
Die Tiere bewohnen eine Vielzahl von Landschaften bestehend aus Wüsten, Savannen und tropischen Regenwäldern. Sie bevorzugen Habitate mit Kopjes, Geröllfeldern oder steilen Kliffs, die zahlreiche Hohlräume und Verstecke als Unterschlupf bieten. Teilweise hat der Klippschliefer Erosionsflächen wie die Karoo erschlossen. In Gebieten mit einer starken Überpopulation weicht er auch in Erdhöhlen des Erdferkels oder von Erdmännchen aus. Die Tiere dringen unter Umständen bis in die Bereiche menschlicher Siedlungen vor, wenn dort zum Beispiel durch städtebauliche Begleitumstände geeignete Unterschlüpfe entstanden sind.[14] Die Höhenverbreitung reicht vom Meeresspiegelniveau bis auf etwa 4300 m wie am Mount Kenya[15] oder 4130 m wie in den Bale Mountains in Äthiopien.[16] In vielen Gebieten Afrikas kommt der Klippschliefer sympatrisch mit dem Buschschliefer vor, beide Arten bewohnen mitunter die gleichen Kopjes. In der Serengeti variiert die Populationsdichte zwischen 5 und 56 Tieren je Hektar Kopje. Die Gruppendichte schwankt über die Zeit wie eine 17-jährige Untersuchung aufzeigt. Dabei nahm an einem 3600 m² großen Kopje die Individuenanzahl kontinuierlich von 2 Tieren im Jahr 1971 auf 18 Tiere im Jahr 1988 zu. An einem weiteren, 2000 m² großen Kopje stieg sie zwischen 1971 und 1976 von 5 auf zunächst 21 Tiere an, fiel dann bis 1984 auf 10 ab und betrug 1988 wieder 11. Lokale Ereignisse können auch zum Aussterben einzelner Gruppen führen, wie 1975 an einem 2500 m² großen Kopje beobachtet.[17][18] Vergleichbare Schwankungen ließen sich während einer 13-jährigen Forschung im Matobo-Nationalpark in Simbabwe ermitteln. Zwischen 1992 und 1996 betrug die Individuendichte 0,73 bis 0,94 Tiere je Hektar, was einer Gesamtpopulation im Schutzgebiet von etwa 31.100 bis 40.000 Tieren entsprach.[19][20] Bis 1998 stieg die Dichte auf rund 1,4 Individuen je Hektar an mit entsprechend geschätzten 59.200 Einzeltieren,[21] reduzierte sich aber bis 2005 wieder auf rund 0,8 Individuen je Hektar. Allerdings gab es im Jahr 2003 noch einmal ein Hoch, das fast bei dem Wert von 1998 lag. Allein von 2003 auf 2004 schrumpfte die Population um 43 %. Die an 28 untersuchten Fundstellen tatsächlich beobachtete Individuenanzahl der beiden Jahre belief sich auf 663 beziehungsweise 378 Tiere.[7][22] Dabei korrelierte ein jeweiliger Anstieg der Population im Untersuchungszeitraum mit regenreichen Perioden und einer erhöhten Anzahl an Nachwuchs. Offensichtlich stellt der Niederschlag einen beeinflussenden Faktor dar.[23] Vergleichbare Zahlen sind auch für die Bale Mountains dokumentiert. Hier wurden in einem Untersuchungszeitraum von 2010 bis 2013 an neun Lokalitäten auf rund 50,3 km² Fläche durchschnittlich bis zu 30.000 Individuen gezählt. Die Populationsdichte reichte gebietsweise von 25 bis 1700 Tieren je Quadratkilometer. Die Anzahl und Dichte der Individuen zeigte signifikante Unterschiede zwischen der Regen- und Trockenzeit, mit jeweils höheren Werten im feuchten Jahresabschnitt.[16][6][1]
Der Klippschliefer lebt in Kolonien von bis zu 80 Tieren in zerklüfteten, felsigen Landstrichen oder in Regionen mit Kopjes. Hierbei handelt es sich um mehrere Tausend Quadratmeter große Felsformationen, die als „Inselberge“ bis zu 40 m hoch aufragen.[24] Die Kolonien bestehen aus einem dominanten Männchen und mehreren miteinander verwandten Weibchen sowie den Jungtieren. Je nach Ausdehnung der Kopjes sind die Kolonien unterschiedlich groß. In der Serengeti bestand eine in den 1970er Jahren untersuchte Gruppe an einem 2500 m² großen Kopje aus durchschnittlich 9,9 und maximal 15 Individuen. Eine weitere Gruppe auf einem 10.050 m² großen Kopje umfasste durchschnittlich 26 Individuen, sie kam hier gemeinsam mit einer Kolonie von Buschschliefern vor.[17][25] Im En-Gedi-Nationalpark in Israel variierte die Gruppengröße während einer zehnjährigen Dokumentation zwischen 5 und 18, 6 und 10 sowie 7 und 21 Individuen.[26] Entsprechende Zahlen für die Bale Mountains in Äthiopien schwanken zwischen 4 und 86 Individuen je Kolonie bei insgesamt 63 dokumentierten Kolonien. In der Regenzeit besteht hier die Gruppe aus durchschnittlich 49, in der Trockenzeit aus durchschnittlich 38 Individuen. Auch die Anzahl der Kolonien ist jahreszeitabhängig.[16] Kleinere Kopjes werden zumeist von einer Gruppe bewohnt, die das gesamte Areal nutzt. Auf größeren sind auch mehrere Kolonien ansässig, jede der Gruppe besetzt dann ein eigenes Territorium.[6][1]
Innerhalb einer Klippschliefer-Population treten verschiedene Rangstufen von Männchen auf. Das dominante oder territoriale Männchen okkupiert eine weibliche Gruppe und verteidigt diese gegen Rivalen. Es verpaart sich mit den geschlechtsbereiten, ausgewachsenen Weibchen der Gruppe. Auf größeren Kopjes mit mehreren Kolonien treten zusätzlich noch „Randmännchen“ auf. Diese haben keine eigene Gruppe, sondern besiedeln einzelgängerisch die Randgebiete von Kolonien, wo sie eher mit jüngeren Weibchen kopulieren. Unter den einzelnen „Randmännchen“ liegt eine Hierarchie vor, so dass das ranghöchste beim Verschwinden eines territorialen Männchens die Gruppe übernimmt. Darüber hinaus kommen frühe und späte Auswanderer vor. Hierbei handelt es sich überwiegend um junge, ausgewachsene Männchen, die ihre angestammte Familiengruppe verlassen haben und umherwandern. Sie werden zu „Randmännchen“ oder wechseln die Kopjes und gründen neue Familiengruppen.[25][27] Ob unter den Weibchen innerhalb einer Gruppe Rangunterschiede bestehen, ist nicht eindeutig. Häufig führen aber ausgewachsene Weibchen die Gruppe auf ihren Wanderungen zu den Nahrungsplätzen an. Sie verhalten sich auch anfänglich aggressiv gegen fremde Weibchen.[25] Studien an Tieren aus Israel zeigen, dass sich Weibchen einer Gruppe offensichtlich im Testosteron-Spiegel unterscheiden, der unter Umständen den des Männchens erreichen kann. Es ist bisher unklar, ob dieser tatsächlich eine soziale Rangstufe anzeigt.[28] Im südlichen Afrika wurde beobachtet, dass die ausgewachsenen Weibchen und das territoriale Männchen eher die zentralen Bereiche eines Kopjes einnehmen, die Jungtiere sich dagegen mehr peripher verteilen.[27][6][1]
Neben den jungen Männchen verlassen auch vereinzelt Weibchen die ursprüngliche Familiengruppe und schließen sich einer neuen an. Sowohl die wandernden Männchen als auch die wandernden Weibchen bilden wohl die Basis der neuen Kolonien. Die dabei zurückgelegten Distanzen variieren je nach Landschaft und liegen in der Serengeti bei rund 2 km und mehr, im südwestlichen Afrika bei 250 bis 500 m.[17][27] Das Überwinden größere Entfernungen in den entsprechenden Gebieten ist mit dem Durchqueren offener Landschaften und daher mit der Gefahr verbunden, durch Fressfeinde erbeutet zu werden oder erhöhtem Stress durch Witterung beziehungsweise Nahrungsmangel ausgesetzt zu sein. Auch würden weiter entfernte Kopjes den Genfluss zwischen den einzelnen Kolonien erschweren. Allerdings zeigen genetische Untersuchungen, dass die Variabilität beim Klippschliefer sehr gering ist und in einzelnen Familiengruppen eine gewisse Inzucht vorliegt.[29][6][1]
Der Klippschliefer ist tagaktiv. Er bewegt sich in dem felsigen Habitat behände fort. Seine Füße sind nicht an das Graben angepasst, dafür an das Klettern an Steilstufen, glatten Felsoberflächen und auf Bäumen. Dies bewirken unter anderem die stark zusammenziehbaren, ledrigen Fußsohlen. Die dort ausgebildeten Drüsen sondern ein Sekret ab, das die Grifffestigkeit erhöht. In den Felslandschaften und Kopjes nutzt der Klippschliefer Höhlen und Felsspalten als Unterschlupf. Die Eingangshöhen liegen bei rund 14 bis 15 cm, dies entspricht etwa der doppelten Schädelhöhe. Dadurch kann der Klippschliefer sicher in die Höhlen kriechen, mögliche größere Beutegreifer werden aber ferngehalten. Die Höhlen müssen außerdem eine Familiengruppe beherbergen können, was rund 1 m² Grundfläche bedingt. In der Regel siedelt sich der Klippschliefer in Felsformationen mit mehreren Höhlen in unmittelbarer Nähe zueinander an. Die einzelnen Eingänge sind oberirdisch mit Pfaden verbunden. Die Höhlen weisen ein ausgeglicheneres Klima auf, als es die unmittelbare Umgebung bietet. In den ostafrikanischen Tieflandgebieten schwankt die Temperatur innerhalb der Unterschlüpfe je nach Region zwischen 14 und 32 °C, während sie in der Umgebung auch auf bis über 40 °C ansteigen kann. In den Hochgebirgsregionen bewahren sie zusätzlich vor frostigen Bedingungen. Gleiches trifft auf die Luftfeuchtigkeit zu, die in den Höhlen und Felsspalten eine geringere Spanne aufweist als in der unmittelbaren Umgebung.[24][30] Die Körpertemperatur des Klippschliefers ist instabil und variiert, zumeist fällt sie nachts um mehrere Grad ab.[31][32][33] Die Maximalwerte reichen von 33,5 am frühen Morgen bis 40,5 °C am späten Nachmittag. In den wärmeren Jahreszeiten liegt die durchschnittliche Körpertemperatur höher als in der kühleren, sie schwankt im Sommer auch signifikanter als im Winter. Ähnlich verhält es sich mit Tag und Nacht. So sind die Schwankungsbereiche der Körpertemperatur im Sommer tagsüber doppelt so hoch wie nachts, im Winter nähern sie sich stärker an. Auffallend ist, dass die Änderungen der Körpertemperatur nicht unbedingt mit den täglichen Änderungen der Umgebungstemperatur einhergehen. Die thermoneutrale Zone liegt bei 20 bis 30 °C, der Wert wird in der warmen Jahreszeit meist von den Außentemperaturen überschritten, in der kühlen Jahreszeit nicht immer erreicht.[34][35] Verbunden mit der variierenden Körpertemperatur ist auch eine niedrige Stoffwechselrate, die 30 % niedriger liegt als bei einem gleich großen Tier zu erwarten wäre. Beides ist gewichtsbezogen und nimmt bei steigendem Körpergewicht zu. Der Klippschliefer spart durch die labile Körpertemperatur und den niedrigen Metabolismus Energie, ist aber von ausgleichenden Unterschlüpfen abhängig.[36][5][6][1]
Der niedrige Metabolismus und die labile Körpertemperatur wirken sich auch auf die Tagesaktivität des Klippschliefers aus. Die Schlafphase dauert durchschnittlich 6 Stunden und 50 Minuten, was mehr als ein Viertel des Tages entspricht.[37] Mit Ausnahme der täglichen Fressphasen oder die Paarungszeit verbringen ungestörte Tiere den Tag überwiegend ruhend. Dies findet innerhalb oder außerhalb der Unterschlüpfe statt und nimmt mehr als 90 % der täglich verfügbaren Zeit ein. Die Tiere formieren dabei häufig während kühlerer Tages- und Jahreszeiten Gruppen, in denen sie entweder dicht beieinander oder teilweise auch übereinander liegen, die Köpfe der einzelnen Individuen zeigen dabei immer nach außen. Bei letzterem erklimmen meist Jungtiere die oberen Positionen. Derartige Gruppenbildungen sind vorwiegend am frühen Morgen anzutreffen, wenn die Tiere ihre Verstecke verlassen, Teile der Kopjes sich aber noch im Schatten befinden. Bei höherem Stand der Sonne zerfallen die Gruppen und die Tiere ruhen dann einzeln. Sie liegen parallel gegenständig oder in einer gleichgerichteten, leicht radialen Position zueinander mit den Köpfen etwas weiter voneinander entfernt. In der Regel werden die Beine abgewinkelt und nach hinten gestreckt, die Sohlen sind nach oben gerichtet. Je nach Sonnenintensität wechseln sie häufig ihre Position, um andere Körperteile bescheinen zu lassen. Das frühmorgendliche Gruppenbilden beeinflusst die Körpertemperatur und dient dem Aufwärmen nach der kühlen Nächten, das einzelne Sonnenbaden unterstützt vor allem tagsüber die Energiespeicherung. In den heißen Tagesphasen zieht sich der Klippschliefer in den Schatten zurück, möglicherweise um einem stärkeren Wasserverlust durch Transpiration zu entgehen.[32][38] Einen Teil der Ruhephasen beansprucht die Körper- und Fellpflege. Für beides werden sowohl die Kralle des Hinterfußes als auch die unteren Schneidezähne eingesetzt. Neben den Sonnenbädern kommen auch Sand- oder Staubbäder vor, die wohl eher der Beseitigung von äußeren Parasiten dienlich sind.[5][6][1]
Als sozial lebendes Tier besitzt der Klippschliefer verschiedene Kommunikationsformen. Das Zusammenhäufen bei kühleren Temperaturen hat nicht nur den Effekt der Stabilisierung der Körpertemperatur, es bewirkt auch eine bessere Erkennung von Fressfeinden. Außerdem unterstützt es eine stärkere soziale Verbundenheit und mindert das Aggressionspotential. Ähnliches gilt wahrscheinlich für die fächerförmige oder gegenständige Position verschiedener Tiere beim einzelnen Sonnenbaden. Generell sind Kopf-zu-Kopf-Begegnungen als antagonistisches Verhalten beim Klippschliefer aufzufassen.[32] Aggressives Verhalten findet hauptsächlich zwischen männlichen Tieren in der Paarungszeit statt. Bei Erregung richtet ein Tier die Haare des Rückenflecks auf. Der Winkel, in dem die Haare aufstehen, gibt Aufschluss über die Art der Erregung. So wird ein Winkel von 45° als Alarmzeichen interpretiert, ein senkrechtes Aufrichten aber als Bedrohung. Zusätzlich zieht das Tier dann die Oberlippe zurück und präsentieren die langen oberen Schneidezähne. Dem gegenüber zeigt ein Männchen in der Paarungszeit einem Weibchen mit voll aufgestellten Haaren seine Erregung an.[39][27] Neben diesen eindeutigen visuellen Zeichen hat auch der Geruchssinn eine hohe Bedeutung. Hier kommen unter anderem die Sekrete der Rückendrüse zum Einsatz, die etwa zur Etablierung von Mutter-Jungtier-Beziehungen dienen. Sie werden aber nicht zur Markierung des Territoriums eingesetzt.[39] Eine wichtige Rolle spielen die Latrinen, in die die Tiere einer Kolonie defäzieren. Während der Paarungszeit suchen Männchen Latrinen auf, um empfangsbereite Weibchen aufzuspüren. In den Latrinen verbinden sich der Kot und das mit Salz angereicherte Urin miteinander und bilden eine zähe Masse, die teilweise den Felsen hinabfließt. Die Masse verfestigt sich im Laufe der Zeit und bleicht aus. Sie wird als „Hyraceum“ bezeichnet.[24][40][6][1]
Vor allem die Lautkommunikation ist sehr variantenreich beim Klippschliefer. Es sind wenigstens 21 verschiedene Laute dokumentiert. Es überwiegen dabei verschiedene Grunz-, Brumm-, Quiek-, Knurr-, Schnaub- und Belllaute, die in unterschiedlichen Situationen ausgestoßen werden und zumeist Aggression, Befriedung oder Rückzug ausdrücken. So grunzt das dominante Männchen, wenn beim Fressen ein anderes Individuum zu nahe kommt, bei fortwährender Konfrontation knurrt es und geht in eine Beißattacke über. Einer zeitlich länger anhaltenden Bedrohung begegnet der Klippschliefer mit einem jammer- oder raspelartigen Laut oder mit einem kurzen Aufschrei. Markant ist ein bellender Warnruf, den ein Wächtertier bei einer eventuellen Bedrohung von sich gibt. Typisch für Weibchen sind weinende oder gurrende Töne nach der Geburt des Nachwuchses, die auch teilweise als Rufe nach den Jungen eingesetzt werden. Jungtiere, die Milch saugen wollen, lassen einen Zwitscherlaut ertönen. Ein Pfeifen und Zwitschern markiert eine friedliche Begegnung, erklingt aber auch bei Jungen bei Zufriedenheit, etwa nach dem Saugen. Allerdings bedeutet ein hartes Zwitschern zusätzlich Aggression. Die verschiedenen bekannten Lautäußerungen des Klippschliefers können auch mit steigender Intensität ineinander übergehen. Daneben sind einige nicht-vokale Laute bekannt, hierzu gehört das Zähneknirschen, Hecheln, Schnaufen und Niesen, deren Funktion teilweise unklar ist. Ersteres tritt häufig in Gefahren- oder Stresssituationen auf, bei denen ein Tier mit ihm unbekannten Faktoren konfrontiert ist. Die dabei mit dem Maul ausgeführten mahlenden Bewegungen erzeugen das Geräusch und erinnern optisch an wiederkäuende Huftiere, ohne dass dabei Nahrung verarbeitet wird.[41][42][6][1]
Herausragend ist der territoriale Ruf des Männchens, der eine hohe Lautstärke erreicht und über weite Strecken, bis hin zu 500 m, getragen wird. In der Regel werden die Rufe von den dominanten Männchen getätigt, seltener von „Randmännchen“. Dies zeigen auch Analysen zum Hormonhaushalt, bei denen dominante Rufer zumeist auch einen höheren Cortisol-Spiegel haben.[43] Der Ruf besteht aus einer Folge von Bell- oder Klacklauten, die zum Ende hin lauter und länger anhaltend werden und in eine Aneinanderreihung von Gurrlauten übergehen. Der Abschluss wirkt durch die beständige Steigerung Crescendo-artig. Die Serie wird nach kurzer Pause mehrfach wiederholt, so dass der Ruf insgesamt bis zu fünf Minuten anhalten kann.[10][44] Der territoriale Ruf ertönt das ganze Jahr über, die Intensität nimmt zur Paarungszeit hin zu. Häufig animiert ein Männchen damit benachbarte Männchen ebenfalls zu rufen.[25] Dominante Männchen starten dann in der Regel ein „Gegenrufen“ unabhängig vom Rang des Erstrufers, „Randmännchen“ dagegen antworten selten und akzeptieren das Territorium des dominanten Tiers. Allerdings lassen gelegentlich sehr niederrangige „Randmännchen“ ein „Gegenrufen“ vernehmen, was sich in der allgemeinen Toleranz der hochrangigen Individuen gegenüber jungen, nicht direkt konkurrierenden Männchen begründet. Außerdem antworten Männchen auf die Rufe bekannter Nachbarn häufiger als auf solche von unbekannten Individuen.[45] Die Komplexität der Rufe der Männchen kann mit fortschreitendem Lebensalter zu- oder abnehmen. In der Regel erhöht sich diese bei „Randmännchen“, die in ihrem Sozialstatus aufsteigen. Bei dominanten Männchen zeichnet sich dagegen teilweise ein Rückgang ab. Dies kann mit gesteigerter Konkurrenz sowie Einbindung in Territorialkämpfe zusammenhängen und allgemein eine Schwächung der Wettbewerbsfähigkeit ausdrücken. Daneben ist aber auch ein strategischer Wechsel im Konkurrenzverhalten denkbar.[46]
In ihrer individuellen Abfolge sind die Rufe recht unterschiedlich und lassen sich einzelnen Tieren zuordnen. Untersuchungen an Klippschliefern aus Israel zeigen, dass zudem zwischen einzelnen geographischen Regionen markante Variationen bestehen. Diese Unterschiede könnten als „syntaktische Dialekte“ aufgefasst werden, wobei ihre regionale Ausprägung auf die nur kurzen Ausbreitungsdistanzen der Tiere zurückzuführen sind; demnach werden die „syntaktische Dialekte“ von den lokalen Populationen erlernt.[47] Innerhalb des individuell variablen Rufes überträgt der Rufer offenbar wichtige Informationen, die das Körpergewicht, die Größe, den allgemeinen Zustand sowie den Sozial- und den Hormonstatus betreffen. Dies erfolgt durch unterschiedliche Lautstärken und Ruflängen, über die Anzahl der Wiederholungen beziehungsweise über die Hinzufügung oder Auslassung einzelner Rufelemente sowie über die Frequenz.[48][49] Für das Körpergewicht und den Sozialstatus dienen dabei Schnaublaute als Informationsträger. Diese werden zumeist von höherrangigen Tieren genutzt und sind, da eher selten, ein möglicherweise schwer zu erzeugendes Lautelement. Dadurch treten sie meist relativ spät im Ruf auf. Häufig haben Schnaublaute schwerer Tiere einen weichen Ton, die von sozial hochgestellten hingegen einen harten Klang, letzteres ist wahrscheinlich auf soziale Konkurrenz und damit verbundene Aggressivität zurückzuführen. Zudem kommt es teilweise während des Rufens zu einer Zunahme der Härte der Schnaublaute. Auch hier kann einerseits eine sich aufbauende Aggressivität oder Erregung des Rufers eine Rolle spielen, denkbar ist andererseits auch, dass die Steigerung auf die Befähigung hinweisen soll, schwierige Laute modulieren zu können. Dass die Schnaublaute mit ihrer komplexen Erzeugung zu den wichtigsten Rufelementen gehören, wird durch die verhältnismäßig häufige Stimulierung anderer Männchen zu Gegenrufen unterstrichen.[50][51][52]
Der typische Aufbau eines Rufs mit seinem Crescendo-artigen Ausklang dient möglicherweise dazu, die Aufmerksamkeit eines potentiellen Zuhörers zu erlangen. Dadurch kann angenommen werden, dass sich die wichtigsten Informationen am Ende eines Rufes befinden.[44] Die Intensität und Komplexität der Rufe nimmt außerdem bei bestimmten Ereignissen zu, etwa nach Alarmrufen, Rivalenkämpfen zwischen Männchen oder in Anwesenheit von Beutegreifern. Hierbei werden die Rufe länger, ihr Rhythmus steigert sich, ebenso wie sich die Anzahl der Klack- und Schnaublaute erhöht. Längere und schnellere Rufe mit einem hohen Wechsel an Lautelementen erfordern eine stärkere Muskelkontrolle des rufenden Tiers. Offensichtlich investiert ein Individuum in den Situationen mehr Energie in seine Rufe, in denen durch aufmerksamkeitsbindende Ereignisse eine größere Anzahl an Zuhörerschaft zur Verfügung steht.[53] Übereinstimmend hiermit ist der Effekt, dass dominante Initialrufer häufig härter modulieren als ihre Gegenrufer. Dadurch sind sozial hochstehende männliche Klippschliefer durchaus befähigt, in unterschiedlichen Varianten zu rufen, wählen einen melodischeren und weicheren Ruf aber nur bei erkennbarem Vorteil.[54]
Der Klippschliefer ist ein Pflanzenfresser. Er vertilgt unter anderem Gräser, Kräuter, Knospen, Sprossen, Früchte und Beeren. Nach Untersuchungen in der Serengeti ernähren sich die Tiere dort von insgesamt 79 verschiedenen Pflanzenarten. Abweichend von Buschschliefer zeigt der Klippschliefer eine starke jahreszeitliche Variabilität bezüglich der aufgenommenen Nahrung. In der Trockenzeit überwiegen weichere Pflanzenteile mit 57 %, spezielle Nahrungspflanzen stellen etwa Kordien, Hibiskus, Feigen, Nachtschatten und Sternbüsche sowie Vachellia, Iboza und Hoslundia dar. Dagegen steigt der Grasanteil in der Regenzeit auf 78 % an. Hier bevorzugt der Klippschliefer zwei Dutzend verschiedene Grasarten, so unter anderem Rispenhirsen, Lampenputzergräser und Themeda-Süßgräser. Die einzelnen Familiengruppen zeigen eine jeweilige Spezialisierung auf die Pflanzen in der direkten Umgebung der Kopjes, die Zusammensetzung der Nahrung unterscheidet sich daher zwischen den Kolonien.[24][55] Ein ähnliches Verhalten konnte auch in der Kapregion im südlichen Afrika beobachtet werden. Auch hier ist ein weites Spektrum an Nahrungspflanzen dokumentiert, jedoch überwiegen dabei etwa zehn Pflanzenarten, die rund 80 % der Nahrung ausmachen. Von hoher Bedeutung sind die Schwarzdorn-Akazie und die Gattung Ziziphus, aber auch Vertreter der Ölbäume, Kapastern, Waldreben und Bocksdorne. Im Übergang von der heißen Trockenzeit zur Regenzeit steigt dann der Grasanteil erheblich an und erreicht mehr als die Hälfte der aufgenommenen Pflanzen. Hier stellen Süßgräser wie Enneapogon oder Aristida, aber auch Hundszahngräser, Liebesgräser beziehungsweise Federgräser wichtige Nahrungsquellen dar. Vor allem die verschiedenen Arten von Enneapogon machen dann bis zu 40 % der Nahrungsmenge aus.[56][5] In Hochgebirgslagen wie am Mount Kenya wird das Angebot an Nahrungspflanzen durch die spärliche Vegetation stärker eingeschränkt. Hier bilden Lobelien und Tussock-Gräser einen wichtigen Nahrungsbestandteil, darüber hinaus auch Fetthennen und Baldriane.[57][58] Nach Analysen von Mageninhalten setzt sich die Nahrung teilweise zu über 90 % aus Gräsern zusammen.[15] Von einer Kolonie aus dem westlichen Kenia am Ostwall des Ostafrikanischen Grabens wurde der Verzehr der giftigen Kermesbeeren berichtet,[59] andere Pflanzen wie Ruchgräser meiden die Tiere aber häufig.[15] Der Klippschliefer nimmt seinen Flüssigkeitsbedarf über die Nahrung auf, er verfügt über effiziente Nieren und kann Urin hoch konzentrieren.[33] Bei Vorhandensein von Wasser trinkt er dieses aber regelmäßig.[4][6][1]
Überwiegend geht der Klippschliefer am frühen Morgen zwischen 08.00 und 11.00 Uhr und am späten Nachmittag zwischen 15.00 und 19.00 Uhr auf Nahrungssuche. Gelegentlich sieht man den Klippschliefer auch nachts fressen. In kalten Perioden beschränkt sich die Nahrungsaufnahme auch auf nur eine Aktivitätsperiode. Prinzipiell ist aber die Zeit der Nahrungsaufnahme nicht temperaturabhängig, sondern wird vom Tageslicht gesteuert.[57][58] Die Nahrungsaufnahme ist in einzelne Fressperioden unterteilt, die im Durchschnitt 20 Minuten andauern und selten länger als 35 Minuten währen. In dieser kurzen Zeit kann ein Tier große Mengen an Pflanzen aufnehmen. Dadurch beträgt die tägliche Fresszeit insgesamt nur eins bis zwei Stunden, was außerordentlich gering ist für einen Pflanzenfresser. Die gesamte tägliche aufgenommene Nahrung beläuft sich auf rund 111 g Trockenmasse für ein rund 3,3 kg schweres Tier, was gut 33,6 g je Kilogramm Körpergewicht entspricht. Bei der Nahrungsaufnahme hält der Klippschliefer den Kopf seitlich im 90°-Winkel zum Körper und beißt die Pflanze mit den Mahlzähnen ab, die Vorderfüße oder die Schneidezähne werden nicht eingesetzt. Auch transportiert der Klippschliefer seine Nahrung nicht in seinen Unterschlupf. Vielmehr wird die Nahrung vor Ort mit seitlichen Kaubewegungen zerkleinert. Wasser nimmt der Klippschliefer mit den Lippen auf, die er ausgestreckt an die Wasseroberfläche führt und dann die Flüssigkeit einschlürft.[58][42][55] In der Regel geht die Gruppe gemeinsam auf Nahrungssuche, die Tiere verteilen sich dabei fächerförmig mit dem Rücken zum Kopje. Teilweise beobachtet ein Individuum die Gruppe von einer erhöhten Position und gibt gegebenenfalls Warnrufe ab. Die Gruppe entfernt sich meist nur 15 bis 20 m vom Kopje. Im Karoo-Nationalpark wurden täglich zurückgelegte Entfernungen bei der Nahrungssuche von 169 bis 572 m festgestellt. Nur sporadisch gehen einzelne Tiere allein auf Nahrungssuche. In Gebieten mit dem gleichzeitigen Auftreten des Buschschliefers sieht man häufig beide Gruppen gemischt fressen. Dies beschränkt sich auf die Trockenzeit, wenn beide Arten sich von weichen Pflanzen ernähren. In der Regenzeit sind beide Arten getrennt, da der Klippschliefer größere Distanzen zu den Grasgebieten überwinden muss. Die abgegrasten Flächen sind zwischen 83 und 180 m² ausgedehnt, ihre Größe ist abhängig von der Niederschlagsmenge.[55][4][6][1]
Die Paarung findet einmal im Jahr statt, während der sowohl Männchen als auch Weibchen kurzfristig sexuell aktiv werden.[60] Im Mountain-Zebra-Nationalpark im südlichen Afrika liegt die Hauptsaison im Zeitraum vom Februar bis zum Mai mit einem Höhepunkt im April.[61] Nach Norden hin in wärmere Klimazonen verschiebt sich die Paarungszeit etwas und dehnt sich zeitlich aus, sie kann dann auch erst im Juni/Juli stattfinden,[60] was auch für das eher äquatoriale Serengeti-Gebiet festgestellt wurde.[17] Der Östrus der Weibchen dauert etwa 13 Tage und wiederholt sich in einem Zeitraum von sieben Wochen mehrmals.[25] Bei Männchen schwellen die Hoden extrem an, teilweise um mehr als das Zehnfache an Gewicht (von durchschnittlich 6,2 auf 80,7 g).[61] Während der Paarungszeit sind Männchen sehr lautgeberisch, außerdem nutzen sie ihre Rückendrüse zur Abgabe von Duftmarken. Weibchen signalisieren ihre Bereitschaft, indem sie die Haare ihres Rückenfells aufstellen, den Geschlechtsbereich der Männchen beschnüffeln und ihr Hinterteil präsentieren. Eine bemerkenswerte Eigenschaft während der Paarung findet sich in einem gegensätzlichen Testosteronhaushalt zwischen Männchen und Weibchen. Während der Testosteronspiegel bei ersteren ansteigt, fällt er bei letzteren merklich ab. Außerdem begleiten männliche Tiere mit hohem Hormonspiegel häufiger weibliche mit niedrigem. Es kann sich hierbei um eine Antiaggressionsstrategie bei der Paarung handeln, auch nehmen Weibchen mit niedrigem Testosteronspiegel einen höheren Rang ein und sind dadurch erfolgreicher in der Fortpflanzung als solche mit hohem Testosteronanteil.[62] Zur Einleitung des Geschlechtsaktes gibt das Männchen einen Ruf von sich und das Weibchen presst sich an dessen Seite.[10][27] Die Begattung selbst erfolgt relativ schnell.[4][6][1]
Die Tragzeit beträgt 210 bis 240 Tage oder 7 bis 8 Monate, was ausgesprochen lang ist für ein Tier dieser Größe.[63][64][60] Entsprechend liegt die Geburt des Nachwuchses im Zeitraum vom September bis Mai. Die Weibchen einer Kolonie gebären dabei ihre Jungen synchronisiert in einem Zeitraum von drei Wochen. Etwa rund die Hälfte aller Weibchen ist daran beteiligt.[17][65] Die Wurfgröße variiert regional, liegt aber insgesamt zwischen einem und fünf Jungen. In der Serengeti beträgt sie durchschnittlich 2,4, im Mountain-Zebra-Nationalpark 2,7 und im Matobo-Nationalpark ebenfalls 2,4.[61][65] Bemerkenswert ist, dass die Größe eines Wurfes mit dem Lebensalter eines Weibchens zunimmt. So brachten nach Untersuchungen im Mountain-Zebra-Nationalpark junge Weibchen durchschnittlich 2,0 bis 2,1 Jungen zur Welt, bei drei bis achtjährigen Tieren waren es durchschnittlich 3,0 bis 3,4 Jungen. Im weiteren Alter nahm die Wurfgröße dann wieder ab.[60][61] Die Jungen wiegen zwischen 110 und 310 g mit einem Durchschnitt von 195 g. Das Gesamtgewicht eines Wurfes kann dadurch zwischen 560 und 875 g variieren, was einem signifikanten Teil des Normalgewichts des Muttertiers ausmacht (2500 bis 3600 g).[66][6][1]
Die Neugeborenen werden im Unterschlupf zur Welt gebracht. Sie sind sehr weit entwickelt und kommen mit offenen Augen sowie vollständig behaart zur Welt. Ebenso können sie sofort umherlaufen. Bereits gut eine Stunde nach der Geburt saugt ein Junges erstmals, was etwa sieben Minuten in Anspruch nimmt und nach gut anderthalb Stunden wiederholt wird. Später reduziert sich die Saugzeit auf etwa drei Minuten. Häufig wird das Saugen von einem zwitschernden Geräusch begleitet. Nach zwei bis vier Tagen knabbert das Jungtier erstmals an pflanzlicher Nahrung. Zu diesem Zeitpunkt kann es auch schon rund 40 bis 50 cm hoch springen. In der zweiten Lebenswoche nimmt das Junge dann regelmäßig feste Nahrung zu sich. Die Entwöhnung findet nach einem bis vier Monaten statt. Die Jungtiere kommen in Gruppen zusammen und spielen intensiv miteinander, die gemeinsamen Aktivitäten bestehen aus Kneifen und Beißen, Klettern, Verfolgen, Kämpfen oder Drücken. Beim gemeinsamen Auftreten mit dem Buschschliefer sind auch gemischte Jungengruppen zu beobachten.[67] Nach rund 16 Monaten tritt bei Weibchen die sexuelle Reife ein, bei Männchen dauert dies bis 29 Monate.[66][61] Das Gewicht ausgewachsener Individuen wird aber erst nach rund drei Jahren erreicht.[68] Die Lebensdauer von Weibchen in freier Wildbahn kann bis zu elf Jahren betragen, die der Männchen in isolierten Kolonien bis zu 8,5.[18] In Gefangenschaft wurden einzelne Individuen bis zu 14 Jahre alt.[4][6][1]
Der bedeutendste Fressfeind des Klippschliefers ist der Klippenadler. Nach Untersuchungen von 73 Nistplätzen in drei unterschiedlichen Biotopen in der Kapregion des südlichen Afrikas bildet der Klippschliefer den Hauptbestandteil der Nahrung des Greifvogels. Von 5748 Beuteindividuen gehörten allein 4.429 zur Schlieferart. Darunter befanden sich, abhängig vom Biotop, zwischen 11 und 33 % Jungtiere.[69] Zu einem ähnlichen Ergebnis kam eine Studie im Matobo-Nationalpark an 40 Nestern. Hier konnten von rund 1550 Beuteresten des Kaffernadlers etwas über 600 dem Klippschliefer zugewiesen werden. Weitere Studien zeigten, dass etwa 68 % der erbeuteten Individuen ausgewachsene Tiere repräsentieren. Der Klipp- und der hier ebenfalls vorkommende Buschschliefer stellen insgesamt 98 % der Beute des Kaffernadlers.[70][20][71] Dadurch besteht ein hoher Jagddruck auf den Klippschliefer, es wird geschätzt, dass rund 60 bis 76 % der Jungtiere das erste Lebensjahr nicht erreichen.[19] Als weiterer wichtiger Jäger tritt der Kronenadler in Erscheinung. Nach Studien von rund 1600 erbeuteten Individuen im südöstlichen Afrika gehörten mehr als 780 zum Klippschliefer.[72] Ebenso sind der Kampfadler und der Raubadler zu nennen. Unter den Säugetieren können vor allem der Leopard, der Löwe, der Karakal, die Tüpfelhyäne und verschiedene Schakale als einflussreiche Prädatoren hervorgehoben werden, allein ersterer bezieht im Matobo-Nationalpark zwischen 32 und 50 % seiner Beute von Schliefern.[73][74] In der Regel versucht ein bedrohtes Tier in das nächste Versteck zu fliehen.[4][6][1]
Für den Klippschliefer ist eine hohe Bandbreite an inneren und äußeren Parasiten dokumentiert. Äußere finden sich in Form von Zecken, darunter unter anderem die Gattungen Amblysomma, Haemaphysalis, Ixodes und Rhipicephalus. Des Weiteren sind rund zwei Dutzend verschiedene Arten an Läusen bekannt, die am Klippschliefer parasitieren. Zu den nachgewiesenen Gattungen gehören Dasyonyx, Procavicola, Procaviphilus und Prolinognathus. Darüber hinaus kommen Milben und Flöhe vor, bei letzteren etwa Procaviopsylla. Einige der äußeren Parasiten sind auch auf Haustiere übertragbar. Auffällig ist, dass Weibchen durchschnittlich häufiger von Ektoparasiten befallen werden als Männchen, was besonders auf die warme Jahreszeit zutrifft. Dies wird mit dem stärkeren sozialen Zusammenhalt der Weibchen und der dadurch kürzeren Übertragungswege erklärt. Zudem tragen Weibchen dann auch ihren Nachwuchs aus und zeigen allgemein eine schlechtere Kondition. Innere Parasiten stellen unter anderem Fadenwürmer wie Crossophorus, Trichuris beziehungsweise Theileria und Bandwürmer wie Inermicapsifer dar.[75] In der Serengeti wurde das lokale Aussterben eine Kolonie durch Räude beobachtet,[17] infizierte Tiere traten auch am Mount Kenya auf.[15] Außerdem ist der Klippschliefer Träger der Leishmaniose.[76][4][6][1]
Procavia
Der Klippschliefer ist eine Art aus der Gattung Procavia, er stellt den einzigen rezenten Vertreter der Gattung dar. Art und Gattung bilden wiederum einen Teil der Familie der Schliefer (Procaviidae) innerhalb der im Deutschen gleichnamigen Ordnung der Schliefer (Hyracoidea). Die Ordnung umfasst heute insgesamt drei Gattungen. In ihrer stammesgeschichtlichen Vergangenheit, vor allem im Paläogen und im frühen Neogen, waren die Schliefer noch äußerst formenreich und schlossen sowohl kleine als auch riesige Tiere ein. Diese besetzten die unterschiedlichsten ökologischen Nischen, die Verbreitung reichte über weite Teile Eurasiens und Afrikas. Heute sind die Schliefer auf meerschweinchenartige Formen beschränkt, die hauptsächlich in Afrika vorkommen. Lediglich der Klippschliefer ist als einzige Form zusätzlich noch in Vorderasien belegt. In seiner sozialen Lebensweise und seiner Tagesaktivität ähnelt der Klippschliefer dem Buschschliefer. Zwischen beiden Arten gibt es neben einzelnen anatomischen Unterschieden auch serologische Abweichungen wie etwa in der Mobilität der Amylasen.[78] Zu den Baumschliefern bestehen größere Unterschiede.[79][80]
Meistens werden heute alle Klippschliefer zu einer Art mit einem großen Verbreitungsgebiet zusammengefasst. Innerhalb der Art sind bis zu 17 Unterarten anerkannt:[4][81][6][1]
Insgesamt werden für den Klippschliefer 65 Synonyme aufgelistet. Im Jahr 1932 beschrieben Henri Heim de Balsac und Max Bégouen mit Procavia (Heterohyrax) antineae eine Form aus Algerien, die sie dem Buschschliefer zuwiesen.[82] Ihre Stellung innerhalb der Form war lange Zeit unsicher,[11][4] im Jahr 2008 wurde sie dann dem Klippschliefer zugeordnet und als synonym zu P. c. ruficeps betrachtet.[13]
Inwiefern alle aufgelisteten Unterarten tatsächlich bestehen, ist nicht geklärt. Der Klippschliefer zeigt starke morphologische Schwankungen über das Verbreitungsgebiet. Dadurch waren zu Beginn des 20. Jahrhunderts deutlich mehr eigenständige Arten anerkannt. So entwarf August Brauer in einem unveröffentlichten Entwurf eine Gliederung der Gattung Procavia in 38 Arten und 14 Unterarten. Herbert Hahn überarbeitete 1934 in seiner umfassenden Revision der Schliefer diese Systematik gründlich und reduzierte die Zahl der Arten auf vier.[11][83] Später wurde noch eine weitere Art hinzugefügt, so dass in den 1960er Jahren folgende Gliederung bestand:[2]
In den 1970er Jahren wurde erstmals vorgeschlagen, alle Arten des Klippschliefers in einer zu vereinigen.[84] Die Idee setzte sich Anfang der 1980er Jahre durch[4] und ist heute allgemein akzeptiert. Allen Klippschliefern gemein ist ein Chromosomensatz mit der Formel 2n=54. Er setzt sich aus 21 acrozentrischen, 2 submetazentrischen und 3 metazentrischen Chromosomenpaaren zusammen. Das X-Chromosom ist das größte Chromosom und besitzt ein submetazentrisches Zentromer, das Y-Chromosom stellt ein kleines acrozentrischs Chromosom dar.[85][86] Molekulargenetische Studien an südafrikanischen Tieren zeigen aber, dass sich dort wenigstens eine südliche und eine nördliche Klade unterscheiden lassen. Zwischen diesen besteht ein geringer Genfluss, die Trennung voneinander vollzog sich aber bereits im Miozän.[87][88][77] Die Wissenschaftler gehen davon aus, dass nach intensiveren DNA-Untersuchungen die Gattung Procavia wahrscheinlich wieder in mehrere Arten aufgespalten werden muss.[6][1]
Neben dem heutigen Klippschliefer sind noch mehrere ausgestorbene Arten bekannt:[12][89]
Zwei weitere Formen, Procavia obermeyerae und Procavia robertsi, wurden ebenfalls von Robert Broom in den Jahren 1937 beziehungsweise 1948 eingeführt.[90][91] Erstere gilt heute als synonym zu Procavia transvaalensis, letztere als zu Procavia antiqua.[92] Gelegentlich wird auch Procavia antiqua als identisch mit Procavia capensis aufgefasst.[93][12][89] Eine als Procavia tertiaria angesprochene Form[92] stammt aus dem Unteren Miozän von Namibia und gehört heute zu Prohyrax, einer älteren Entwicklungslinie der Schliefer.[12]
In Vorderasien und Afrika war der Klippschliefer den Menschen schon seit mehreren tausend Jahren bekannt. Die Hebräer belegten ihn mit der Bezeichnung šāfān oder saphan (שפן), was soviel wie „der sich Verbergende“ bedeutet. Der saphan fand auch Einzug in das Alte Testament, wo er insgesamt viermal erwähnt wird. So beschreibt Psalm 104 im Buch der Psalmen ihn als Tier, das in den Felsen Zuflucht sucht. In den Zahlensprüchen schildert das Buch der Sprichwörter den saphan als machtloses, schwaches Tier, das aber aufgrund seiner Weisheit trotzdem seine Wohnungen im Felsen baut. Des Weiteren wird im Buch Levitikus ausgesagt, dass der saphan wiederkäue, aber keine gespaltenen Hufe habe, weshalb er als unrein anzusehen sei. Eine ähnliche Aussage gibt auch die Parallelstelle im Buch Deuteronomium wieder.[94] Frühe Bibelübersetzungen interpretierten den saphan unterschiedlich. So legten einige griechische Versionen das Tier als Kaninchen aus (χοιρογρύλλιον (choirogrýllion), abgeleitet von χοιρογρύλλος (choirogrýllos) für „Stachelschwein“), einige lateinische wiederum als Igel (erinacius). Notker Labeo vom Kloster St. Gallen sah um das Jahr 1000 die größte Ähnlichkeit mit dem Murmeltier.[95] In seiner Gesamtausgabe der Bibel von 1534 hatte Martin Luther den hebräischen saphan mit „Caninchen“ übersetzt. Es wird angenommen, dass die jeweiligen Bearbeiter einschließlich Luther für das unbekannte saphan ein allgemein vertrautes Tier aussuchten (entsprechend lautet die Übersetzung in der englischen Ausgabe der Bibel coney, was ebenfalls „Kaninchen“ bedeutet).[11][83]
Die häufige Gleichsetzung des saphan mit einem Kaninchen wurde in der Folgezeit kritisch beurteilt. So vermutete Samuel Bochart im Jahr 1663 in seinem Werk Hierozoicon, dass der saphan mit den dreizehigen Springmäusen oder Jerboas gleichzusetzen sei. Dem widersprach aber der englische Kleriker und Reisende Thomas Shaw 1738. Er berichtete ausführlich vom daman Israel aus der Levante, einem harmlosen, in Felsenklüften lebenden Tier von der Größe eines Kaninchens, aber dunkler gefärbt. Shaw bezog den daman auf den biblischen saphan.[96] Dabei berief er sich auf ein Werk zur ägyptischen Naturgeschichte von Prospero Alpini aus dem Ende des 16. Jahrhunderts, das erst 1735 veröffentlicht wurde und in dem von kleinen Tieren die Rede ist, die Alpinus mit agnus filiorum Israel bezeichnete („Lamm der Kinder Israels“).[97] Auch Peter Simon Pallas beschäftigte sich 1778 in einer Abhandlung über die Nager (Glires) mit dem Klippschliefer. Wie zuvor bei Shaw entsprach der saphan seiner Meinung nach dem Klippschliefer.[98] Die gleiche Ansicht wurde im Jahr 1790 von James Bruce geteilt, der auf seinen Reisen durch das damalige Abessinien auf Schliefer traf und den Buschschliefer so erstmals erwähnte. Bruce vermerkte in seinen Beschreibungen auch das Auftreten ähnlicher Tiere in Vorderasien, außerdem behauptete er, der Schliefer würde wiederkäuen, eine Meinung, die (neben der Bibelpassage) teilweise bis in das 20. Jahrhundert vertreten wurde (das Wiederkäuen lässt der einfacher gebaute Magen der Schliefer nicht zu[42]).[99] Nur wenig später pflichtete Johann Christian von Schreber in seinem Werk Die Säugthiere in Abbildungen nach der Natur mit Beschreibungen der Interpretation des Klippschliefers als saphan bei.[100] Heute wird dies kaum noch abgelehnt, in modernen deutschsprachigen Bibelübersetzungen ab 1912 wurde das „Kaninchen“ daher durch den „Klippdachs“ ausgetauscht (im Englischen entsprechend durch badger). „Klippdachs“ wird teilweise ebenso als unpassend erachtet, da der Name anderweitige Verwandtschaftsverhältnisse annehmen lässt.[11][83]
Ebenfalls im Verlauf des 17. und 18. Jahrhunderts erreichten erste Berichte von Klippschliefern aus der südafrikanischen Region Europa. Reisende wie Jodocus Hondius 1652 oder Augustin de Beaulieu 1664 hoben verschiedentlich die dassen oder marmots hervor. Auch Simon van der Stel, der ab 1790 der erste Gouverneur der niederländischen Kapkolonie wurde, notierte in seinem Tagebuch vom 14. September 1685 das häufige Auftreten von dassen am Heerenlogementsberg im südwestlichen Kapgebiet. Peter Kolb wiederum beschrieb auf seiner Afrikareise 1719 „Murmeltiere“, die die Einwohner seiner Meinung nach fälschlicherweise als „Dachse“ bezeichneten.[101] In der Regel werden diese Erwähnungen mit dem Klippschliefer assoziiert. Im heutigen Afrikaans bezeichnet dassie einen Schliefer allgemein. Der Name ist eine Ableitung vom niederländischen Wort das, welches „Dachs“ bedeutet.[4][79] Ähnlich wie bei den Beschreibungen der Tiere aus Vorderasien und den unterschiedlichen Bibelübersetzern neigten demnach auch die Autoren der Berichte aus dem südlichen Afrika dazu, die ihnen unbekannten Lebewesen mit solchen aus ihrer Heimat in Beziehung zu setzen. Zu diesem Zeitpunkt kam es auch noch nicht zu einem Vergleich der vorderasiatischen und der südafrikanischen Tiere.[102][103]
Die ersten Klippschliefer wurden Mitte des 18. Jahrhunderts nach Europa gebracht, häufig stammten sie ursprünglich aus den niederländischen Kolonien des südlichen Afrika. So sandte in den 1760er Jahren der damalige Gouverneur der Kapkolonie Ryk Tulbagh ein weibliches Tier in Alkohol eingelegt an Wilhelm V., Statthalter der Niederlande. Ein weiteres männliches Tier gelangte in die Menagerie Blauw-Jan in Amsterdam, später, in den 1770er Jahren, beherbergte diese auch lebende Individuen. Die beiden erstgenannten Exemplare wurden von Arnout Vosmaer aus Den Haag eingesehen und von ihm 1767 in einen kurzen Aufsatz als „Bastard-Murmeltier“ vorgestellt.[104] Eines der Tiere hatte Vosmaer zuvor an Peter Simon Pallas übergeben, der sich zu diesem Zeitpunkt auf seiner Reise durch die Niederlande befand. Pallas veröffentlichte dann 1766 in seinem Werk Miscellanea zoologica die ausführliche wissenschaftliche Erstbeschreibung des Klippschliefers. Darin wählte er den Namen Cavia capensis und gab die Kapregion als Typusgebiet aus. Mit der Gattungsbezeichnung Cavia verwies Pallas den Klippschliefer zu den südamerikanischen Meerschweinchen, er selbst verglich den Klippschliefer in seiner Miscellanea zoologica mit den Agutis und den Capybaras. Übergeordnet stellte er sie in die damalige Gruppe der Nager (die im Sinne von Linnaeus auch die Nashörner und Fledermäuse einschlossen).[105] Den Namen Cavia hatte Pallas von Jacob Theodor Klein übernommen, der die Gattungsbezeichnung bereits 1751 für die südamerikanischen Meerschweinchen gebrauchte.[106] Allerdings lehnte Georges-Louis Leclerc de Buffon im Jahr 1776 in dem von ihm herausgegebenen mehrbändigen Werk Histoire naturelle, générale et particulière den Verweis zu Cavia ab und argumentierte unter anderem mit Unterschieden in der geographischen Verbreitung und mit der abweichenden Lebensweise des Klippschliefers und der Meerschweinchen.[107] Vor allem die afrikanische Verbreitung bewog Gottlieb Conrad Christian Storr im Jahr 1780 den Namen Procavia für den Klippschliefer einzuführen. Die lateinische Vorsilbe pro- („vor“ oder „für“) stellte dabei einen unmittelbaren Bezug zu Cavia her, da auch Storr den Klippschliefer systematisch in der Nähe der Meerschweinchen sah. Somit behielt auch Storr die Einordnung in die Nager bei (die er allerdings unter der Bezeichnung Rosores führte).[108][102][103]
Drei Jahre nach Storr vertrat Johann Hermann eine andere Meinung. In seiner Tabula affinitatum animalium kreierte er in Anbetracht einer abweichenden Zahnmorphologie die Gattungsbezeichnung Hyrax für den Klippschliefer. Der Name ist griechischen Ursprungs (ὕραξ hýrax) und bedeutet so viel wie „Spitzmaus“.[109] Bis zum Ende des 19. Jahrhunderts fand der Gattungsname Hyrax fast ausschließlich Verwendung, während Procavia meist ignoriert wurde. Hyrax wurde dabei auf alle Vertreter der Schliefer bezogen, erst 1868 führte John Edward Gray die Bezeichnungen Heterohyrax für den Buschschliefer und Dendrohyrax für die Baumschliefer ein und untergliederte so die Gruppe stärker. Dies betrifft auch die heute nicht mehr anerkannte Gattung Euhyrax, mit der Gray die Formen aus dem nordöstlichen Afrika belegte. Zur Unterscheidung von Hyrax hob er einige abweichende Schädelmerkmale hervor, etwa einen eher durchlaufenden Scheitelkamm und ein längeres Nasenbein.[110] Im Jahr 1886 wies Fernand Lataste auf die drei Jahre ältere Urheberschaft von Storrs Procavia gegenüber Hermanns Hyrax hin.[111] Dies führte Oldfield Thomas 1892 weiter aus und bestätigte so die Priorität des älteren Namens als Gattungsbezeichnung.[112] Teilweise wurde dies bedauert und Hyrax gegenüber Procavia als der geeigneterer Name empfunden, heute gelten beide aufgrund abweichender Verwandtschaftsverhältnisse als unpassend. Ungeachtet dessen hat sich „Hyrax“ vor allem im englischen Sprachraum als Trivialname für die Schliefer durchgesetzt.[5][79]
Pallas und Storr sahen den Klippschliefer als Vertreter der Nagetiere an. Die genaue Stellung war aber lange Zeit umstritten. Buffons ablehnende Haltung zu Cavia capensis wurde etwa im Jahr 1780 auch von August Wilhelm von Mellin in seiner Schrift Der Klipdas wiedergegeben. In dieser stellte Mellin den Klippschliefer ausführlich in deutscher Sprache vor.[113] Félix Vicq d’Azyr verschob den Klippschliefer 1792 zu den Spitzmäusen und begründete dies mit dem Bau des vorderen Gebisses, speziell der oberen Schneidezähne.[114] Auch Christian Rudolph Wilhelm Wiedemann widersprach bei einer ausführlichen Beschreibung eines Schädels der Stellung des Klippschliefers innerhalb der Nagetiere, gab aber keine genaue alternative Position an.[115] Von Bedeutung ist hier ein Schädel eines Klippschliefers aus dem Libanon, der sich im Cabinet du roi von Paris befand, dem späteren Muséum national d’histoire naturelle. Der Schädel wurde bereits 1767 von Louis Jean-Marie Daubenton in einem Band über lebendgebärende Tiere innerhalb von Buffons Histoire naturelle vorgestellt. Dabei erkannte Daubenton die wahre Natur des Schädels nicht, sein nur wenige Zeilen umfassender Aufsatz ist aber relativ exakt und gibt die anatomischen Merkmale ausdrücklich wieder. Pallas verwies 1776 Daubentons Schädel zum Klippschliefer.[116] Trotz dieser Erkenntnis zeichnete ihn eine Abbildungstafel im siebenten Zusatzband der Histoire naturelle aus dem Jahr 1789 als Bengalischen Plumplori aus (unabhängig von der Schädelbeschreibung enthält die Histoire naturelle mehrere weitere Vermerke auf den Klippschliefer: im dritten Zusatzband aus dem Jahr 1776 ist die bereits erwähnte kritische Auseinandersetzung Buffons mit Pallas' Cavia capensis abgedruckt, in Anlehnung an Vosmaers „Bastard-Murmeltier“ nennt Buffon hier den südafrikanischen Klippschliefer marmotte du Cap, im sechsten Zusatzband aus dem Jahr 1782 findet sich eine Gegenüberstellung des südafrikanischen Klippschliefers als daman du Cap und des vorderasiatischen Klippschliefers als daman Israel).[107] Fünfzehn Jahre später nutzte Georges Cuvier den gleichen Schädel, um den Klippschliefer in seine Gruppe der Pachydermata („Dickhäuter“) einzugliedern.[117] In dem heute nicht mehr gültigen Taxon gruppierte er die Gattung Hyrax zusammen mit anderen Huftieren wie den Nashörnern, Tapiren, Elefanten, Flusspferden, Echten Schweinen und den Pekaris. Den Klippschliefer sah Cuvier aufgrund des Zahnbaus in einer Vermittlerrolle zwischen Nashörnern und Tapiren.[118][103] Der Ausschluss aus den Nagetieren und der Verweis zu anderen Huftieren hatte weitreichende Folgen. Bis weit in das 20. Jahrhundert wurde dem Klippschliefer zusammen mit den anderen Schliefern aus anatomischen Erwägungen wahlweise eine Nahverwandtschaft mit den Unpaarhufern oder mit den Paenungulata („Fast-Huftiere“) zugesprochen.[119] Der Konflikt löste sich erst im Übergang vom 20. zum 21. Jahrhundert mit der Einführung von biochemischen und molekulargenetischen Untersuchungsmethoden zugunsten der Paenungulata auf.[120][121]
Fossil treten die Vorfahren der heutigen Schliefer erstmals im Miozän auf. Der erste Nachweis der Gattung Procavia datiert aber in das Untere Pliozän vor rund 5 Millionen Jahren. Es handelt sich um die Reste der Art Procavia pliocenica, sie wurden an der Fundstelle Langebaanweg im südwestlichen Südafrika gefunden. Die Funde umfassen zahlreiche Gebissteile und einzelne isolierte Zähne. Sie lassen auf ein Tier schließen, das den heutigen Klippschliefer um etwa 20 % an Körpergröße übertraf. Der Unterkiefer teilt die relative Robustizität mit dem der rezenten Vertreter des Klippschliefers, die Mahlzähne sind aber eher niederkronig gebaut. als Besonderheit kann die Ausbildung des ersten unteren Prämolaren genannt werden, der bei den heutigen südafrikanischen Populationen generell fehlt. Dadurch wirkt Procavia pliocenica deutlich ursprünglicher als der heutige Klippschliefer.[12]
Im Pliozän und im Übergang zum Pleistozän erschien dann Procavia antiqua, das etwa die Größe des heutigen Klippschliefers erreichte, allerdings einen leichter gebauten Schädel und weniger hochkronige Zähne besaß. Zuerst aus der bedeutenden Fundstelle von Taung im zentralen Südafrika anhand eines heute verschollenen Schädels beschrieben,[122] ist die Art darüber hinaus auch aus Sterkfontein im nordöstlichen Südafrika bekannt.[91][92] Aus zeitgleichen Schichten liegen Reste von Procavia transvaalensis vor. Die Art wurde etwa anderthalb mal größer als ein heutiger Klippschliefer und besaß eine Schädellänge von 125 mm. Sie stellt damit den größten Vertreter der Gattung dar. In ihren Körperausmaßen übertraf sie unter allen procaviiden Schliefern nur noch Gigantohyrax. Die Erstbeschreibung erfolgte anhand eines Unterkiefers und eines zerquetschten Schädels aus Sterkfontein.[123] Weitere Funde kamen unter anderem aus den nahe gelegenen Fundstellen von Swartkrans und Kromdraai sowie aus Makapansgat und Taung zu Tage. Sterkfontein barg auch einige Reste der Vorderbeine. Es wird angenommen, dass Procavia transvaalensis stärker an steppenartige Landschafte angepasst war.[92][124][12]
Vor allem im Pleistozän ist dann der heutige Klippschliefer belegbar, etwa aus der Sibudu-Höhle im Südosten Südafrikas.[125] Exzeptionell sind die Funde aus der Blombos-Höhle in der Kapregion Südafrika. Die mehrere Tausend Fossilfunde, die in den Beginn der letzten Kaltzeit datieren, setzen sich zu mehr als ein Viertel aus Resten des Klippschliefers zusammen, darunter zum größeren Teil Jungtiere. Taphonomische Untersuchungen lassen an eine Erbeutung durch Jäger-Sammler-Gruppen des frühen Menschen denken.[126] Ebenfalls in der gleichen geologischen Serie erscheint der Klippschliefer in Vorderasien. So sind Funde aus dem frühen Mittelpleistozän von Gesher Benot Ya’aqov und im Übergang zum Jungpleistozän aus der Höhle Rantis dokumentiert, beide liegen in Israel.[127][128]
Größere Bedrohungen für den Bestand des Klippschliefers sind nicht bekannt. In einigen afrikanischen Ländern werden die Tiere wegen ihres Fleisches und Felles gejagt, in Saudi-Arabien auch zu Sportzwecken. Des Weiteren gibt es die Ansicht, das Blut und das Fleisch des Klippschliefers hätten eine potenzsteigernde Wirkung.[129] Im Jemen zähmen Familien aus ärmlichen Verhältnissen manchmal einzelne Tiere und verkaufen sie auf lokalen Märkten.[130] Das kann teilweise einen großen Einfluss auf lokale Populationen haben. In KwaZulu-Natal ist der Klippschliefer Anfang des 21. Jahrhunderts lokal ausgestorben, Wiedereinführungen sind bisher gescheitert.[131] Mitunter wurde der Klippschliefer als Schädling angesehen, so unter anderem in den Kapprovinzen Südafrikas. In Israel, wo die Art nur wenige natürliche Feinde hat, richten die Tiere teilweise beträchtlichen Schaden in kultivierten Flächen an. Die IUCN stuft den Gesamtbestand des Klippschliefers als „nicht gefährdet“ (least concern) ein und erwartet keinen signifikanten Populationsrückgang. Er kommt in zahlreichen Naturschutzgebieten vor. Vor allem sind aber Untersuchungen zu seiner tatsächlichen Verbreitung notwendig.[132][6]
Die als „Hyraceum“ bezeichneten Ausscheidungen des Klippschliefers finden teils pulverisiert Anwendung in der traditionellen Afrikanischen Medizin, so unter anderem zur Behandlung von Infektionen der Atem- oder Harnwege, aber auch bei Masern und Diabetes. Als Tee verabreicht soll es Frauenkrankheiten lindern, kann in größeren Dosen angeblich aber auch zum Schwangerschaftsabbruch führen. Des Weiteren wird die Substanz teilweise Giften beigefügt und dient als Fixativ in der Parfümindustrie.[40][133]
Der Klippschliefer (Procavia capensis), mitunter auch Wüstenschliefer oder Klippdachs genannt, ist eine Art in der Ordnung der Schliefer (Hyracoidea). Sein Körperbau erinnert an Meerschweinchen. Die Gliedmaßen sind kurz und kräftig, ein Schwanz fehlt. Am Rücken besteht ein auffallender farbiger Fleck, der eine Drüse umgibt. Markant sind auch die zahlreichen Tasthaare, die das Fell durchsetzen. Von allen heutigen Schliefern hat der Klippschliefer das größte Verbreitungsgebiet. Dieses ist nicht geschlossen, ein Verbreitungsschwerpunkt findet sich im südlichen Afrika, ein weiterer nördlich des Kongobeckens und südlich der Sahara. Von hier zieht das Vorkommen über den nordöstlichen Teil des Kontinents nach Vorderasien. Die bewohnten Lebensräume bestehen aus Wüsten und felsigen Landschaften, zudem aus Offenlandgebieten und Wäldern. Die Tiere sind sowohl im Flachland wie auch in hohen Gebirgslagen anzutreffen. In weiten Teilen Afrikas tritt der Klippschliefer gemeinsam mit dem Buschschliefer auf.
Die Lebensweise des Klippschliefers ist gut erforscht. Er bewohnt Felsspalten und Höhlen und tritt vorwiegend tagaktiv auf. Als Hauptnahrung dienen Pflanzen, ihre Zusammensetzung ist abhängig von Jahreszeit und Angebot: in der Trockenzeit bevorzugen die Tiere weiche Pflanzennahrung, in der Regenzeit dagegen härtere. Sie leben gesellig in Kolonien, das Sozialgefüge ist komplex. Eine Gruppe besteht meist aus einem dominanten Männchen, den fortpflanzungsfähigen Weibchen und dem Nachwuchs. Daneben treten noch einzeln lebende Männchen auf. Die Gruppe geht gemeinsam auf Nahrungssuche. Den Großteil des Tages verbringt der Klippschliefer vor allem einzeln oder in Gruppen ruhend, was auf die wenig beständige Körpertemperatur und den niedrigen Stoffwechsel zurückzuführen ist. Das besetzte Territorium wird gegen Eindringlinge verteidigt. Das dominante Männchen stößt zudem markante Rufe aus, die sehr komplex sind. Daneben verfügt der Klippschliefer über eine vielfältige Sozialkommunikation. Nachwuchs kommt einmal jährlich zur Welt, die Weibchen einer Gruppe gebären häufig in kurzen Zeitabständen. Die Jungen sind bei der Geburt weit entwickelt und nach 16 bis 29 Monaten geschlechtsreif. Die jungen Männchen verlassen dann die Kolonie. Bedeutendste Fressfeinde stellen verschiedene Greifvögel und Raubtiere dar.
Zu den frühesten Erwähnungen des Klippschliefers gehören jene aus dem Alten Testament. Modernere Berichte reichen bis in das 17. Jahrhundert zurück. Die wissenschaftliche Erstbeschreibung datiert in das Jahr 1766, vor allem im Verlauf des 19. Jahrhunderts wurde der Klippschliefer in der Gattung Hyrax geführt. Anfänglich galten die Tiere als nahe verwandt mit den Nagetieren, später sah man sie eher in einer engeren Beziehung mit anderen Huftieren. Bis in die 1970er Jahre waren zudem mehrere Arten anerkannt. Daneben bestehen noch einige fossile Vertreter, der älteste Nachweis datiert in das Pliozän vor etwa 5 Millionen Jahren. Der heutige Bestand des Klippschliefers wird als ungefährdet eingestuft.
Să-huăng (唦噃, Ĭng-ngṳ̄: Rock Hyrax, Cape hyrax) sê Dà̤-tó-sṳ̆k mì-ék gì siŏh ciáh cṳ̄ng, gâe̤ng sū-iū Dà̤-tó-mŭk gì Dông-ŭk siŏh iông, ĭ ô duāng-siēu gì Ngê gâe̤ng muōi-bă. Să-huăng diŏh nàng hĭ iâ hô̤ lā̤ Dassie. Să-huăng diŏh Iù-tái-gáu Gô-iók Séng-gĭng sê "Mâ̤ Táh-gáik gì Dông-ŭk".
The rock hyrax (/ˈhaɪ.ræks/; Procavia capensis), also called dassie, Cape hyrax, rock rabbit, and (from some[3] interpretations of a word used in the King James Bible) coney, is a medium-sized terrestrial mammal native to Africa and the Middle East. Commonly referred to in South Africa as the dassie (IPA: [dasiː]; Afrikaans: klipdassie),[4] it is one of the five living species of the order Hyracoidea, and the only one in the genus Procavia.[1] Rock hyraxes weigh 4–5 kg (8.8–11.0 lb) and have short ears.[4]
Rock hyraxes are found at elevations up to 4,200 m (13,800 ft) above sea level[5] in habitats with rock crevices, allowing them to escape from predators.[5][6] They are the only extant terrestrial afrotherians in the Middle East.[note 1] Hyraxes typically live in groups of 10–80 animals, and forage as a group. They have been reported to use sentries to warn of the approach of predators. Having incomplete thermoregulation, they are most active in the morning and evening, although their activity pattern varies substantially with season and climate.
Over most of its range, the rock hyrax is not endangered, and in some areas is considered a minor pest. In Ethiopia, Israel, and Jordan, it is a reservoir of the leishmaniasis parasite.
Along with other hyrax species and the sirenians, this species is the most closely related to the elephant.[7] An unrelated, convergently evolved mammal of similar habits and appearance is the rock cavy of Brazil.
Rock hyraxes are squat and heavily built, with adults reaching a length of 50 cm (20 in) and weighing around 4 kg (8.8 lb), with a slight sexual dimorphism, males being about 10% heavier than females. Their fur is thick and grey-brown, although this varies strongly between different environments, from dark brown in wetter habitats, to light gray in desert-living individuals.[8] Hyrax size (as measured by skull length and humerus diameter) is correlated to precipitation, probably because of the effect on preferred hyrax forage.[9]
Prominent in and apparently unique to hyraxes is the dorsal gland, which excretes an odour used for social communication and territorial marking. The gland is most clearly visible in dominant males.[10]
The rock hyrax has a pointed head, short neck, and rounded ears. It has long, black whiskers on its muzzle.[11] The rock hyrax has a prominent pair of long, pointed tusk-like upper incisors, which are reminiscent of the elephant, to which the hyrax is distantly related. The fore feet are plantigrade, and the hind feet are semi-digitigrade. The soles of the feet have large, soft pads that are kept moist with sweat-like secretions. In males, the testes are permanently abdominal, another anatomical feature that hyraxes share with elephants and sirenians.[10]
Thermoregulation in rock hyraxes has been subject to much research, as their body temperature varies with a diurnal rhythm. Animals kept in constant environmental conditions also display such variation,[10] and this internal mechanism may be related to water balance regulation.[12]
The unusual incisors
The rock hyrax occurs widely across sub-Saharan Africa in disjunct northern and southern populations; it is absent from the Congo Basin and Madagascar. The distribution encompasses southern Algeria, Libya, Egypt, and the Middle East, with populations in Israel, Jordan, Lebanon, and the Arabian Peninsula.[2] The northern subspecies was introduced to Jebel Hafeet, which is on the border of Oman and the United Arab Emirates.[13]
The shade of their pelts varies individually and regionally.[14] In particular, the dorsal patches (present in both sexes) of the central populations are very variable, ranging from yellow to black, or flecked. In outlying populations, these are more constant in colour, black in P. c. capensis, cream in P. c. welwitschii, and orange in P. c. ruficeps.[14] A larger, longer-haired population is abundant in the moraines in the alpine zone of Mount Kenya.[15][16]
The subspecies, which are sometimes elevated to full species, are:[14]
Rock hyraxes build dwelling holes in any type of rock with suitable cavities, such as sedimentary rocks and soil.[17] In Mount Kenya, rock hyraxes live in colonies comprising an adult male, several adult females, and immatures. They are active during the day, and sometimes during moonlit nights.[18] The dominant male defends and watches over the group. The male also marks his territory.
In Africa, hyraxes are preyed on by leopards, Egyptian cobras, puff adders, rock pythons, caracals, wild dogs, hawks, and owls.[19] Verreaux's eagle in particular is a specialist hunter of hyraxes.[20][21] In Israel, the rock hyrax is reportedly rarely preyed upon by terrestrial predators, as their system of sentries and reliable refuges provide considerable protection. Hyrax remains are almost absent from the droppings of wolves in the Judean Desert.[22]
Hyraxes feed on a wide variety of plant species, including Lobelia[18] and broad-leafed plants.[23] They also have been reported to eat insects and grubs.[11] They forage for food up to about 50 m from their refuge, usually feeding as a group and with one or more acting as sentries from a prominent lookout position. On the approach of danger, the sentries give an alarm call, and the animals quickly retreat to their refuge.[24]
They are able to go for many days without water due to the moisture they obtain through their food, but quickly dehydrate under direct sunlight.[25] Despite their seemingly clumsy build, they are able to climb trees (although not as readily as Heterohyrax), and readily enter residential gardens to feed on the leaves of citrus and other trees.
The rock hyrax also makes a loud, grunting sound while moving its jaws as if chewing, and this behaviour may be a sign of aggression. Some authors have proposed that observation of this behavior by ancient Israelites gave rise to the misconception given in Leviticus 11:4–8 that the hyrax chews the cud,[26] but the hyrax is not a ruminant.[10]
Rock hyraxes give birth to two to four young after a gestation period of 6–7 months (long, for their size). The young are well developed at birth with fully opened eyes and complete pelage. Young can ingest solid food after two weeks and are weaned at 10 weeks. After 16 months, they become sexually mature, they reach adult size at 3 years, and they typically live about 10 years.[10] During seasonal changes, the weight of the male reproductive organs (testes, seminal vesicles) changes due to sexual activity. Between May and January in Cape Province, South Africa, the males are inactive sexually. From February onward, the weight of these organs increases dramatically and the males are able to copulate.[27]
Hyraxes that live in more "egalitarian" groups, in which social associations are spread more evenly among group members, survive longer.[28] In addition, hyraxes are the first nonhuman species in which structural balance was described. They follow "the friend of my friend is my friend" rule, and avoid unbalanced social configurations.[29] The balance of social interactions within a group is positively correlated to individual longevity, meaning that "it is not the number or strength of associations that an adult individual has (i.e. centrality) that is important, but the overall configuration of social relationships within the group."[30] The reason for such a balanced group configuration, rather than one that is centrally dominated by a few individual hyraxes, was suggested to have to do with the fact that information flow to all members is important in a fragmented habitat as that of the hyrax, making a dominance hierarchy a liability for the survival of the group at large.[30]
Captive rock hyraxes make more than 20 different noises and vocal signals.[18] The most familiar one is a high trill, given in response to perceived danger.[11] Rock hyrax calls can provide important biological information, such as size, age, social status, body weight, condition, and hormonal state of the caller, as determined by measuring their call length, patterns, complexity, and frequency.[31] More recently, researchers have found rich syntactic structure and geographical variations in the calls of rock hyraxes, a first in the vocalization of mammalian taxa other than primates, cetaceans, and bats.[32] Higher-ranked males tend to sing more often, and the energetic cost of singing is relatively low.[33] A recent study found that snorts, a rare aspect of male hyrax songs, play an important signalling role as well, with increasing snort harshness being associated with "the progression of inner excitement or aggression". It is also positively associated with the singing animal's social status and testosterone levels.[34] Singing has also been shown to be a marker of an individual hyrax's unique identity, where identity is expressed by unique vocal signatures "that are not condition dependent and are stable over years in singers that did not alter their spatial position."[35]
The rock hyrax spends roughly 95% of its time resting.[10] During this time, it can often be seen basking in the sun, which sometimes involves "heaping", where several animals pile on top of each other. This is thought to be an element of its complex thermoregulation.[36]
Male hyraxes have been categorised into four classes: territorial, peripheral, early dispersers, and late dispersers. The territorial males are dominant. Peripheral males are more solitary and sometimes take over a group when the dominant male is missing. Early-dispersing males are juveniles that leave the birth site around 16 to 24 months of age. Late dispersers are also juvenile males, but they leave the birth site much later, around 30 or more months of age.[37]
The species is known as klipdas in Afrikaans (etymology: cliff + badger), while most people just call them "dassies" (the plural of dassie) or "rock rabbits" in South Africa. The Swahili names for them are pimbi, pelele, and wibari, though the latter two names are nowadays reserved for the tree hyraxes.[38] This species has many subspecies, many of which are also known as rock or Cape hyrax, although the former usually refers to African varieties.
In Arabic, the rock hyrax is called الوبر الصخري (Alwabr alsakhri) or طبسون (tabsoun). In Hebrew, the rock hyrax is called שפן סלע (shafan sela), meaning rock shafan, where the meaning of shafan is obscure, but is colloquially used as a synonym for rabbit in modern Hebrew.[26] According to Gerald Durrell, local people in Bafut, Cameroon, call the rock hyrax the n'eer.[39]
Rock hyraxes produce large quantities of hyraceum, a sticky mass of dung and urine that has been employed as a South African folk remedy in the treatment of several medical disorders, including epilepsy and convulsions.[40] Hyraceum is now being used by perfumers, who tincture it in alcohol to yield a natural animal musk.[41]
The rock hyrax is classified as treif (not kosher; unclean) according to kashrut – Jewish food hygiene rules – due to statements in the Old Testament in Leviticus 11:5: "And the coney, because he cheweth the cud, but divideth not the hoof; he is unclean unto you".[42] Hyraxes are also mentioned in Proverbs 30:26 as one of a number of remarkable animals for being small but exceedingly wise, in this case because "the conies are a people not mighty, yet they make their homes in the cliffs".[43]
In Joy Adamson's books and the film Born Free, a rock hyrax called Pati-Pati was her companion for six years before Elsa and her siblings came along; Pati-Pati reportedly took the role of nanny and watched over them with great care.[44]
The 2013 animated film Khumba features a number of rock hyraxes that sacrifice one of their own to a white Verreaux's eagle.
Basking on Table Mountain, South Africa
Klipdassie in Betty's Bay Betty's_Bay, South Africa
A colony of hyraxes in northern Israel
Rock hyrax in the botanical garden of Pretoria, South Africa
Collar-tagged rock hyrax, Ein Gedi, Israel
Animated skull, Namibia
Rock hyrax, Katzrin, Golan Heights
Rock hyrax (dassie) at the Cape of Good Hope, South Africa
Dassie with young in Hermanus, South Africa
Rock hyrax showing incisors and tongue, at Ein Gedi, Israel
The rock hyrax (/ˈhaɪ.ræks/; Procavia capensis), also called dassie, Cape hyrax, rock rabbit, and (from some interpretations of a word used in the King James Bible) coney, is a medium-sized terrestrial mammal native to Africa and the Middle East. Commonly referred to in South Africa as the dassie (IPA: [dasiː]; Afrikaans: klipdassie), it is one of the five living species of the order Hyracoidea, and the only one in the genus Procavia. Rock hyraxes weigh 4–5 kg (8.8–11.0 lb) and have short ears.
Rock hyraxes are found at elevations up to 4,200 m (13,800 ft) above sea level in habitats with rock crevices, allowing them to escape from predators. They are the only extant terrestrial afrotherians in the Middle East. Hyraxes typically live in groups of 10–80 animals, and forage as a group. They have been reported to use sentries to warn of the approach of predators. Having incomplete thermoregulation, they are most active in the morning and evening, although their activity pattern varies substantially with season and climate.
Over most of its range, the rock hyrax is not endangered, and in some areas is considered a minor pest. In Ethiopia, Israel, and Jordan, it is a reservoir of the leishmaniasis parasite.
Along with other hyrax species and the sirenians, this species is the most closely related to the elephant. An unrelated, convergently evolved mammal of similar habits and appearance is the rock cavy of Brazil.
La Rokhirako (Procavia capensis) aŭ Kabo-klifmelo estas unu el la kvar vivantaj specioj de la ordo Hyracoidea (klifmeloj, hirakoj), kaj la nuraj vivantaj specioj en la genro Procavia. Kiel ĉiuj klifmeloj, ĝi estas mezgranda (4-kg) surtere loĝanta mamulo, supraĵe simila al kobajo, kun mallongaj oreloj kaj vosto. La plej proksimaj vivantaj parencoj al klifmeloj estas la nuntempaj elefantoj kaj manatoj. La Rokhirako troviĝas en tuta Afriko kaj Proksima Oriento, en vivejoj kun rokfendetoj por eskapi predantojn. Klifmeloj tipe vivas en grupoj de 10-80 bestoj, kaj manĝas kiel grupo. Ilia plej frapa konduto estas la uzo de gardostarantoj: unu aŭ pluraj bestoj poziciiĝas en panoramejo kaj alarmkrias se alproksimiĝas predantoj.
La rokhirakoj havas nekompletan termoreguladon, kaj estas plej aktivaj en la mateno kaj vespero, kvankam ilia aktiveca modelo varias sufiĉe laŭ sezono kaj klimato.
En la plej granda parto de sia teritorio, la Tokhirako ne estas endanĝerigita, kaj en kelkaj lokoj estas konsiderita negrava plago. En Etiopio, Israelo kaj Jordanio, ili pruviĝis esti rezervujo de la parazito de la lejŝmaniozo.
La Rokhirako estas dikbaza kaj peztorsa, kaj plenkreskuloj atingas longon de 50 cm, pezantaj proksimume 4 kg, kun iometa seksa duformismo; kaj maskloj estas ĉirkaŭ 10% pli pezaj ol inoj. Ilia felo estas dika kaj grizbruna, kvankam tio varias multe inter malsamaj medioj; de malhelbruna en pli malsekaj vivejoj, al helgriza en dezertovivantaj individuoj.[2] Rokmela grandeco (krania longo kaj humera diametro) estas rilata al precipitaĵo, verŝajne pro la efiko al preferata klifmela furaĝo.[3]
Elstara en kaj ŝajne unika al klifmeloj estas la dorsglando, kiu sekrecias odoron uzatan por socia komunikado kaj teritoria markado. La glando estas plej klare videbla en dominaj maskloj.[4]
La kapo de Rokhirako estas pinta, kun mallonga kolo kaj rondetaj oreloj. Ili havas longajn nigrajn buŝharojn sur siaj muzeloj.[5] La Rokhirako havas elstaran paron de longaj, pintaj supraj incizivoj kiuj estas rememorigaj pri la dentegoj de elefanto, al kiu la klifmelo estas fore rilata (vidu malsupre). La antaŭpiedoj estas plandoiraj, kaj la postpiedoj duonfingroiraj. La plandoj de la piedoj havas grandajn, molajn kusenetojn kiuj estas konservataj humidaj danke al ŝvit-similaj sekrecioj. Ĉe maskloj, la testikoj estas permanente abdomenaj, alia anatomia trajto kiun klifmeloj dividas kun siaj parencoj, nome elefantoj kaj manatoj.[4]
Temperatura regulado ĉe rokhirakoj estis temo de multa esplorado, ĉar ilia korpa temperaturo varias laŭ tagnokta ritmo. Tamen, bestoj tenitaj en konstantaj mediaj cirkonstancoj ankaŭ elmontras tian varion[4] kaj tiu interna mekanismo povas esti rilata al reguligo de la korpakva ekvilibro.[6]
Rokhirakoj troveblas trans subsahara Afriko, kun la escepto de la Kongo-baseno kaj Madagaskaro. Pli granda, pli longhara subspecio estas abunda en la glaciepokaj morenoj en la alpa zono de Monto Kenjo. La distribuo daŭriĝas en nordan Alĝerion, Libion kaj Egiptujon, kaj al Proksima Oriento, kun populacioj en Israelo, Jordanio, Sirio, la araba duoninsulo kaj orienta Turkio.[4]
Klifmeloj vivas en gregoj de ĝis 80 individuoj. Tiuj gregoj estas subdividitaj en pli malgrandaj grupoj konsistantaj el kelkaj familioj. Tiuj familioj konsistas el 3 ĝis 15 parencaj plenkreskaj inoj, domina masklo, kaj pluraj idoj. La domina masklo defendas kaj protektas la grupon. La masklo ankaŭ markas sian teritorion por eviti iujn ajn kverelojn.[7]
En Afriko, klifmeloj estas predataj fare de leopardoj, egiptaj kobroj, pufvipuroj, karakaloj, likaonoj, kaj agloj. [8] La Veroksia aglo[9] aparte estas specialista ĉasisto de klifmeloj.[10][11] En Israelo, la rokhirako estas laŭdire malofte predita de surteraj predantoj, ĉar ilia sistemo de gardostarantoj kaj iliaj fidindaj rifuĝoj disponigas konsiderindan protekton. Klifmelaj restaĵoj estas preskaŭ forestantaj de la fekaĵoj de lupoj en la Judea Dezerto.[12]
Klifmeloj nutriĝas el vasta gamo de malsamaj plantoj, inkluzive de kaj herboj[7] kaj dukotiledonaj plantoj.[13] Oni raportis, ke ili manĝas ankaŭ insektojn kaj larvojn.[5] La rokhirakoj furaĝas por manĝaĵo ĝis proksimume 50 metroj for de sia rifuĝejo, kutime manĝante kiel grupo kaj kun unu aŭ pluraj el ili gardostarantaj. Kaze de danĝero, la gardostarantoj alarmsignas, kaj la bestoj rapide retiriĝas al sia rifuĝejo.[14] Ili povas vivi dum multaj tagoj sen akvo pro la humido kiun ili akiras tra sia manĝaĵo.[15] Malgraŭ ilia ŝajne mallerta korpokonstruo, ili povas surgrimpi arbojn, kaj volonte eniras loĝejajn ĝardenojn por manĝi la foliojn de citrusoj kaj aliaj arboj.
Rokhirakoj naskas du aŭ tri idojn post graveda periodo de 6-7 monatoj. La ido estas tre evoluinta ĉe naskiĝo kun plene malfermitaj okuloj kaj kompleta feliĝo. Idoj povas konsumi solidan manĝaĵon post du semajnoj kaj estas elmamigitaj en aĝo de dek semajnoj. Post 16 monatoj, rokhirakoj iĝas seksmaturaj, kaj ili atingas plenkreskan grandecon je tri jaroj. Ili tipe vivas proksimume dek jarojn.[4] Dum laŭsezonaj ŝanĝoj, la pezo de la masklaj generiloj (testiko, spermvezikoj) ŝanĝiĝas pro seksa agado. Studo montris ke inter majo kaj januaro, la maskloj estis sekse neaktivaj. De februaro pluen, okazas drasta kresko en la pezo de tiuj organoj, kaj la maskloj povas kopulacii.[16]
Rokhirakoj estas tre bruemaj kaj komunikemaj.[7] Plenkreskuloj faras uzadon de almenaŭ 21 malsamaj voĉaj signaloj. La plej konata signalo estas alta trilo, donita en respondo al perceptita danĝero.[5] La krioj de rokhirakoj estas referitaj kiel "kantoj". Klifmelaj voĉoj povas disponigi gravajn biologiajn informojn pri ekzemple grandeco, aĝo, socia statuso, korpopezo, kondiĉo, kaj hormona stato de la kantisto, depende de kantolongo, padronoj, komplekseco, kaj tonalteco.[17] Pli lastatempe, esploristoj trovis riĉan sintaksan strukturon kaj geografiajn variojn en la voĉoj de rokhiraksoj, unikaĵo en la vokaligo de mamulaj, krom primatoj, balenoj, kaj vespertoj.[18]
La Rokhirako ankaŭ faras laŭtan gruntsonon dum ĝi movas siajn makzelojn kvazaŭ maĉante, kaj tiu konduto povas esti signo de agresemo. Kelkaj verkintoj[19] proponis ke observado de tiu konduto fare de antikvaj hebreoj kaŭzis la miskompreniĝon donitan en Tria Libro de Moseo 11:4-8, ke la klifmelo maĉas remaĉaĵon; sed fakte, klifmeloj ne estas remaĉuloj.[4]
La Rokhirako foruzas ĉirkaŭ 95% da sia tempo por ripozado.[4] Dum tiu tempo, ili ofte povas esti vidataj ripozantaj ĉe la suno, kio supozeble estas elemento de ilia kompleksa temperatura reguligo.
Maskloj estis kategoriigitaj en kvar klasojn: teritoriaj, periferiaj, fruaj, kaj malfruaj disvastiĝuloj. La teritoriaj maskloj estas la plej dominaj. Periferiaj maskloj estas pli izolaj kaj foje transprenas grupon kiam la domina masklo mankas. Fruaj periferiaj maskloj estas junaj kiuj forlasas la naskiĝejon en aĝo de proksimume 16 ĝis 24 monatoj. Malfruaj disvastiĝantoj ankaŭ estas junulaj maskloj, sed ili forlasas la naskiĝejon multe pli poste; proksimume en aĝo de 30 aŭ pli da monatoj.[20]
Ili estas konataj kiel dassies en Sudafriko, kaj foje rokkunikloj (rock rabbits). La svahilaj nomoj por ili estas pimbi, pelele kaj ŭibari, kvankam ĉi-lastaj du nomoj estas nuntempe rezervitaj por la arbohirakoj. La nederlanda nomo estas klipda'oj. La specio havas multajn subspeciojn, multaj el kiuj estas ankaŭ konataj kiel Rokhirako aŭ Kabo-klifmelo, kvankam la unua kutime rilatas al afrikaj specoj. En la araba, la rokhirakoj estas nomitaj الوبر ("ŭabr") aŭ طبسون ("tabsun"). En la hebrea, la rokoklifmelo estas nomita שפן סלע (ŝafan sela), signifanta rok-"ŝhafan", kie la signifo de ŝafan estas obskura, sed estas en familiara lingvaĵo utiligita kiel sinonimo por kuniklo en la moderna hebrea lingvo. [19] [21]
Rokhirakoj produktas grandajn kvantojn de hiraceumo - gluiĝeca amaso el feko kaj urino kiu estis utiligita kiel sudafrika homokuracilo en la terapio de pluraj medicinaj malsanoj, inkluzive de epilepsio kaj konvulsioj. Hiraceumo[22] nun estas "retrovita" fare de eksperimentemaj parfumistoj kiuj tinkturas ĝin en alkoholo por krei naturan bestan moskon.[23]
Rokhirakoj estas klasifikitaj kiel nekoŝeraj en la malnovtestamenta/juda Torao.[24] Tamen, ili ankaŭ estas inkluditaj en Proverboj 30:26 kiel unu el kelkaj rimarkindaj bestoj por esti malgrandaj sed treege saĝaj, en tiu kazo ĉar "la rokmeloj estas popoloj ne potencaj, tamen ili faras siajn hejmojn en la klifoj".[25]
Ripozantaj sur Tablo-Monto
Kolonio de klifmeloj en norda Israelo
Kolumetikedigita rokhirako, En-Gedi
La Rokhirako (Procavia capensis) aŭ Kabo-klifmelo estas unu el la kvar vivantaj specioj de la ordo Hyracoidea (klifmeloj, hirakoj), kaj la nuraj vivantaj specioj en la genro Procavia. Kiel ĉiuj klifmeloj, ĝi estas mezgranda (4-kg) surtere loĝanta mamulo, supraĵe simila al kobajo, kun mallongaj oreloj kaj vosto. La plej proksimaj vivantaj parencoj al klifmeloj estas la nuntempaj elefantoj kaj manatoj. La Rokhirako troviĝas en tuta Afriko kaj Proksima Oriento, en vivejoj kun rokfendetoj por eskapi predantojn. Klifmeloj tipe vivas en grupoj de 10-80 bestoj, kaj manĝas kiel grupo. Ilia plej frapa konduto estas la uzo de gardostarantoj: unu aŭ pluraj bestoj poziciiĝas en panoramejo kaj alarmkrias se alproksimiĝas predantoj.
La rokhirakoj havas nekompletan termoreguladon, kaj estas plej aktivaj en la mateno kaj vespero, kvankam ilia aktiveca modelo varias sufiĉe laŭ sezono kaj klimato.
En la plej granda parto de sia teritorio, la Tokhirako ne estas endanĝerigita, kaj en kelkaj lokoj estas konsiderita negrava plago. En Etiopio, Israelo kaj Jordanio, ili pruviĝis esti rezervujo de la parazito de la lejŝmaniozo.
El damán de El Cabo o damán roquero (Procavia capensis) es una especie de mamífero hiracoideo de la familia Procaviidae. Es uno de los damanes más extendidos por toda África. Habita entre peñascos.[1] En apariencia, se asemeja a un marmota grande o a un conejo de Indias con sus orejas y cola corta. Es llamado dassie en Sudáfrica y pimba en swahili.
Del tamaño de una liebre, tiene un par de largos incisivos (tipo de defensas) y molares que se asemejan a los del rinoceronte. Tiene cuatro dedos en las patas delanteras (plantígrado) y tres en las patas traseras (semidigitígrado). Tienen las plantas de las patas grandes, con almohadillas que se mantienen húmedas mediante secreciones similares al sudor. Los machos son ligeramente más grandes que las hembras.
La hembra da a luz a dos o tres crías después de un largo período de gestación (6-7 meses). Los jóvenes están bien desarrollados al nacer con los ojos totalmente abiertos y un pelaje completo. Los jóvenes pueden ingerir alimentos sólidos después de dos semanas y son destetados a las diez semanas. Son sexualmente maduros después de 16 meses, alcanzan el tamaño adulto en tres años, y en general pueden llegar a vivir una década.
Viven en grupos de hasta 80 individuos. Estos grupos se dividen en grupos más pequeños de unas pocas familias a cargo de un adulto de sexo masculino. Pasan la mayor parte de su tiempo descansando o tomando el sol. Este comportamiento sirve probablemente para ayudar a regular su temperatura corporal, que varía con la temperatura ambiente ( no son estrictamente homeotermos ).
Producen una gran cantidad de hyraceum (masa pegajosa, mezcla de heces y orina) que fue utilizado en el tratamiento tradicional de varias enfermedades, como la epilepsia y las convulsiones, y sigue usándose en perfumería. El polen atrapado en hyraceum fosilizado se utiliza en el estudio de la paleobotánica.
Han sido considerados siempre como los parientes vivos más cercanos de los elefantes. Pero no todos los científicos comparten esta opinión. Los recientes estudios morfológicos y moleculares indican que los sirenios son los parientes vivos más cercanos de los elefantes, mientras que los damanes, aunque están estrechamente relacionados, son un grupo separado de los elefantes y los sirénidos y próximos a los géneros fósiles como Embrithopoda y Desmostylia.
Se han descrito las siguientes subespecies:[2]
El damán de El Cabo o damán roquero (Procavia capensis) es una especie de mamífero hiracoideo de la familia Procaviidae. Es uno de los damanes más extendidos por toda África. Habita entre peñascos. En apariencia, se asemeja a un marmota grande o a un conejo de Indias con sus orejas y cola corta. Es llamado dassie en Sudáfrica y pimba en swahili.
Procavia capensis Procavia generoko animalia da. Hyracoidea ordenaren barruko ugaztuna da. Procaviidae familian sailkatuta dago.
Bere genero monotipikoaren espezie bakarra da. Hegoaldeko Afrikan bizi dira.[3]
Procavia capensis Procavia generoko animalia da. Hyracoidea ordenaren barruko ugaztuna da. Procaviidae familian sailkatuta dago.
Bere genero monotipikoaren espezie bakarra da. Hegoaldeko Afrikan bizi dira.
Kalliotamaani eli kapintamaani (Procavia capensis) on tamaanien lahkoon kuuluva nisäkäs, joka elää Saharan eteläpuolisessa Afrikassa. Se on tamaanilajeista laajimmalle levinnyt. Kalliotamaani on erinomainen kiipeilijä erikoisrakenteisen jalkapohjansa ansiosta. Se selviytyy kallionseinämistä nousemalla pystyhalkeamia pitkin tukien samalla selkäänsä vastaseinämään.
Kalliotamaani kasvaa 30–60 senttimetrin mittaiseksi ja painaa noin neljä kiloa. Kalliotamaani on siis hieman isompi kuin puu- ja kivitamaanit. Sen turkki on ruskeanharmaata, mutta selän hajurauhasen ympärillä se on keltaista ja mustaa. Sen häntä on mitättömän lyhyt. Vanhojen yksilöiden kulmahampaat pistävät esiin suusta. Sen pää on pyöreämpi ja nenä tylpempi kuin muilla tamaanilajeilla.
Kalliotamaani käyttää ravintonaan heiniä, ruohoa ja jäkäliä. Se on liikkeellä päivisin.
Kalliotamaanin suvun Procavia systematiikka on ollut kiistanalainen. Se on aiemmin jaettu 4–5 erilliseen lajiin, mutta yleisemmin sen nykyään katsotaan käsittävän vain yhden lajin Procavia capensis, joka koostuu lukuisista alalajeista.[1][2] Kokonaislevinneisyysalue kattaa Saharan eteläpuolisen ja koillisen Afrikan ja osan Lähi-itää (Libanon, Israel, Arabian niemimaa). Eristyneitä populaatioita on Libyan ja Algerian vuorilla.[1] Nimialalaji kapintamaani Procavia capensis capensis elää eteläisimmässä Afrikassa.
Naaran kantoaika on noin 7,5 kuukautta, jonka jälkeen se synnyttää tavallisesti kaksi poikasta. Poikaset kasvavat nopeasti ja painavat puolivuotiaina jo 1,5 kg. Naaras kanta jälkikasvuaan varsin pitkään selässään.
Kalliotamaani eli kapintamaani (Procavia capensis) on tamaanien lahkoon kuuluva nisäkäs, joka elää Saharan eteläpuolisessa Afrikassa. Se on tamaanilajeista laajimmalle levinnyt. Kalliotamaani on erinomainen kiipeilijä erikoisrakenteisen jalkapohjansa ansiosta. Se selviytyy kallionseinämistä nousemalla pystyhalkeamia pitkin tukien samalla selkäänsä vastaseinämään.
Le Daman du Cap (Procavia capensis) aussi appelé Daman des rochers, est une espèce de mammifère de l'ordre des Hyracoidea. Superficiellement, il ressemble à une marmotte ou un gros cochon d'Inde avec ses oreilles et sa queue courte. Il est appelé dassie en Afrique du Sud et pimbi en swahili.
De la taille d'un lièvre, il possède une paire de longues incisives (sortes de défenses) et des molaires qui ressemblent à celles des rhinocéros. Il possède quatre doigts aux pattes antérieures (plantigrade), et trois aux pattes postérieures (semi-digitigrade). Ils ont de grandes soles plantaires avec des coussinets qui sont gardés humides par des sécrétions un peu analogues à de la sueur. Les mâles sont légèrement plus grands que les femelles.
Ils vivent en groupes pouvant compter jusqu'à 80 individus. Ces groupes sont répartis en petits sous-groupes de quelques familles dirigés par un mâle adulte. Principalement diurnes, ils passent le plus clair de leur temps à se reposer en grandes bandes ou à lézarder seuls au soleil. Ce comportement sert probablement à les aider à réguler leur température corporelle qui varie avec la température ambiante (ils ne sont pas strictement homéothermes).
Les damans se nourrissent au sol d'herbes variées et dans les arbres de feuillages qu'ils atteignent en grimpant. Ils sont capables de digérer des plantes toxiques pour d'autres espèces. En cas de famine, ils se contentent d'écorces d'arbres auxquels ils peuvent causer des dégâts[1].
La femelle donne naissance à deux ou trois jeunes, après une longue (6 à 7 mois) période de gestation. Les jeunes sont bien développés à la naissance avec les yeux complètement ouverts et un pelage complet. Les jeunes peuvent ingérer des aliments solides après deux semaines et sont sevrés à dix semaines. Les jeunes sont sexuellement matures après 16 mois, atteignent leur taille adulte à trois ans, et vivent généralement une dizaine d'années.
Il produit de grandes quantités d'hyraceum (masse collante, mélange d'excréments et d'urine) qui a été employé dans le traitement traditionnel de plusieurs maladies comme l'épilepsie et les convulsions. Il a été employé en parfumerie comme note de fond de matière première animale proche du castoréum (AuParfum [1] , AbsesSalaam Attar Parfums [2]).
On les a longtemps considérés comme les plus proches parents vivants des éléphants. Mais tous les scientifiques ne partagent pas ce point de vue. Les études morphologiques et moléculaires récentes révèlent que les siréniens sont les plus proches parents vivants des éléphants, tandis que les damans, même s'ils sont étroitement apparentés, constituent un groupe à part de celui des éléphants et des siréniens, et proches de genres fossiles comme Embrithopoda et Desmostylia.
La Bible mentionne les damans qui vivent en communauté dans les rochers - voir Proverbes 30:26 (Proverbes a été écrit vers le VIIIe siècle av. J.-C.)
Le Daman du Cap (Procavia capensis) aussi appelé Daman des rochers, est une espèce de mammifère de l'ordre des Hyracoidea. Superficiellement, il ressemble à une marmotte ou un gros cochon d'Inde avec ses oreilles et sa queue courte. Il est appelé dassie en Afrique du Sud et pimbi en swahili.
Procavia capensis (Pallas, 1766), é unha especie de mamífero da orde dos hiracoideos, o tipo da familia dos procavíidos e única especie actual do xénero Procavia.[2]
É un dos damáns máis estendidos por toda África, chegando tamén ao oeste da península Arábiga. Habitante dos rochedos, en aparencia aseméllase a unha marmota común ou a un coello de Indias, coas súas curtas orellas e cola.
Procavia capensis é un damán de cosntitución pesada, de tamaño aproximado ao dunha lebre, xa que mide entre os 43 e os 57 cm; a súa altura na cruz oscila entre os 20 e os 30 cm, e os seu peso, entre os 2,5 e os 5 kg.[3][4]
Na súa forma corporal parécense á marmota común (Marmota marmota, da familia dos esciúridos, os esquíos), pero coa cola e as patas moi curtas.[5]
Os machos son lixeiramente máis grandes que as femias.
A súa pelaxe é curta e áspera, de cor que pode variar da parda amarelada á agrisada, con algúns pelos dispersos máis ou menos negros, e os flancos máis claros; as partes inferiores son de cvior amarela apagada.[3]
Ademais das típicas glándulas dispersas pola pel, teñen unha área glandular espida na parte central do lombo, rodeada de pelos eréctiles de cor diferente (que varía desde o negro, en África meridional, até a amarelada, en África oriental e occidental), cuxas secrecións utilizan para marcar o seu territorio.[3][5]
No seu esqueleto destacan as órbitas pechadas e a mandíbula maciza; no maxilar superior ten un par de longos incisivos (tipo de defensas), e crecen continuamente, como nos roedores.
Os inferiores son menores e de crecemento limitado, e están aplanados e serrados nos bordos.
Os molares aseméllanse aos dos rinocerontes.
Os membros son mesoanxónicos, e o seu eixe pasa polo terceiro dedo.
O fémur presenta un pequeno terceiro trocánter.
A estrutura do carpo é moi primitiva, cos ósos dispostos en serie.[5]
Son plantígrados, e as plantas dos seus pés están cubertas de almofadas elásticas. Teñen catro dedos nas extremidades anteriores, e tres nas posteriores; os dedos rematan en pequenos pezuños primitivos, e só o dedo interno das patas traseiras ten unha pequena garra afiada, que utilizan para rascárense, e que está fixada nunha falanxe bífida.
Carecen de clavícula.[5]
Procavia capensis distribúese por África, agás o Atlas, o Sáhara Occidental, as selvas tropicais do oeste e o centro do continente, o norte de Malaui, Zambia e gran parte de Botsuana. A súa área de dispersión tamén inclúe as illas Dassen e Robben, na baía de Table, no cabo da Boa Esperanza. O chamado damán do Sinaí (subespecie Procavia procavia syriacus, considerada por algúns autores como especie independente), no Sinaí, Palestina e a península Arábiga.[3][4] (Véxase o mapa de distribución no cadro de clasificación científica, arriba á dereita).
O seu hábitat constitúeno os piares e ladeiras rochosos, os kopjes (palabra que en lingua afrikaans significa "cabezo", e que son altos e arredondados afloramentos rochosos graníticos illados en sabanas e chairas),[6][7] montañas con abas de pedra, kloofs (en afrikáner "desfiladeiros rochosos"), ás veces en paraxes moi secos, nunca nas delvas densas. No monte Kenya chegan até a zona alpina, entre os 4.000 e os 5.500 m de altitude.[3][4]
Extermadamenre sociábeis, os damáns do Cabo viven en colonias de até 60 individuos, establecidas en promontorios rochosos, ou entre penas. Estas colonias están formadas pola unión de varias unidades familiares constituídas por un só macho adulto, e varias femias e crías. Estes damáns gabean polas rochas con gran facilidade, grazas ás almofadas elásticas dos seus pés, e poden saltar dunhas rochas a outras. De hábitos diúrnos (aínda que tamén saen en noites de claro luar) pasan a maior parte do seu tempo amoreados entre si, descansando e tomando o sol enriba das rochas, comportamento que serve para axudar a regular a súa temperatura corporal, que varía coa temperatura ambiente entre os 35 e os 37 °C, xa que estes animais desenvolveron mal a regulación da súa temperatura interna, é dicir, non son estritamente homeotermos.[3][4]
Algúns individuos (aparentemente machos vellos) vixían e avisan aos outros da aproximación dalgún inimigo potencial. Cando e alarman, lánzanse ao interior dunha fenda entre as rochas ou refúxianse debaixo duna pena. Os sentidos da vista e o oído están ben desenvolvidos, así como o do olfacto (xa que o olor é a base da súa orientación). Para intercomunicárense dispoñen dunha ampla gama de sons, que comprende unha gran variedade de gritos de alarma e alerta; a voz máis corrente é unha nota miañante de ton elevado, audíbel a gran distancia.[3]
Os seus principais depredadores son o leopardo, o serval (Leptailurus serval = Felis serval), o caracal (Caracal caracal = Lynx caracal), o gato silvestre africano, os chacais de lombo negro e dourado, a civeta africana, as aguias e as grandes cobras.[4]
Exclusivamene fitófagos, aliméntane principalmente de herba, pero tamén bagas e e outros pequnos froitos, cascas de árbores e arbustos, follas e liques. Comen en zonas moi próximas ás súas goridas, pero cando a vexetación se fai escasa poden aventurarse máis lonxe, pero nunca demasiado separados de rochas onde poder agocharse en caso de perigo. Beben moi pouco, aínda que os que viven en zonas moi secas poden perorrer distancias de até 600 m en busca de auga.[3]
Os damáns do Cabo defecan e urinan en determinados lugares específicos, latrinas comúns onde se acumulan os seus excrementos, coñecidos como Hyraceum.[3][8] (Ver máis abaixo).
Os machos vólvense agresivos na época de apareamento, defendendendo o seu territorio mediante gritos e trabadas a outros machos rivais. Despois dun período de xestación de 7 a 8 meses (anormalmente longo para un animal do seu tamaño), as femias paren, nun refuxio baixo as rochas, dunha a seis crías (usualmente, dúas ou tres). As crías nacen ben desenvolvidas, cos ollos totalmente abertos e a pelaxe completa, polo que son activas pouco despois e nacer; son coidadas por toda a colonia.[3][4]
Os xuvenís poden inxerir alimentos sólidos despois de dúas semanas, e son destetados ás dez semanas. Alcanzan a madurez sexual aos 16 ou 17 meses, e o tamaño adulto aos 3 anos. En xeral, poden chegar a vivir 9 anos, en ocasións até os 10.[3][4]
A familia dos Procaviidae creouna en 1892 o zoólogo británico Oldfield Thomas, en Proc. Zool. Soc. Lond., 51.[9]
Ao longo do tempo, esta familia coñeceuse tamén polos seguintes sinónimos:[9]
Notas:
1. De todos estes nomes, só Hyracidae Gray, 1821 corresponde ao dunha familia.
2. Hyracidae Gray, 1821 é un nome baseado no xénero Hyrax Hermann, 1783. Revisado por Hahn (1934) e Roche (1972) a familia conservou soamente os xéneros Procavia e Dendrohyrax (cambiando consecuentemente o seu nome), e Hoeck (1978) e Meester et al. (1986) consideran a Procavia, Heterohyrax e Dendrohyrax como xéneros separados. Unha clave dos xéneros moderna foi desenvolvida por Meester et al. en 1986.[9]
O xénero Procavia foi fundado en 1780 polo médico e naturalista alemán Gottlieb Conrad Christian Storr, e publicado en Prodr. Meth. Mamm.: 40.[10]
Ademais de por este nome coñeceuse polos seguites sinónimos:[10]
A especie Procavia capensis foi descrita por primeira vez en 1766 polo naturalista alemán Peter Simon Pallas, na súa obra Miscellanea zoologica, quibus novæ imprimis atque obscuræ animalum species describuntur et observationibus iconibusque illustrantur,[11] baixo o nome de Cavia capensis.[12]
Ademais do nome orixinario ue lle adxuidcou Pallas, e do actualmente válido, e especie coñeceuse tamén polo sinónimo Heterohyrax antineae Heim de Balsac & Bégouen, 1932.[12]
O nome da familia, Procaviidae, fórmase, como é normal, sobre a raíz do nome do seu xénero tipo, Procavia, coa desinencia do latín científico ´-idae, propia dos nomes das familias de animais, e tomada do latín clásico ´-idae, plural de ´-ides, sufixo patronímico masculino derivado do grego antigo -ιδαι -idai, plural de -ιδης -idēs, "de aspecto de", "semellante a", derivado de εἴδος eídos, "aspecto", "aparencia", "forma".
Este nome, Procavia, está formado polo elemento do latín pro-, derivado da preposisión prō, "diante de" e o xénero Cavia, o tipo da familia dos Caviidae, roedores suramericanos cuxa especie máis coñecida é o coello de Indias ou cobaia (Cavia porcellus).
Na actualidade recoñécense na familia os seguintes xéneros, especies e subespecies viventes:[2]
Familia Procaviidae
As dexeccións e a urina dos damáns do Cabo, depositadas nunha latrina común das súas colonias, producen gran cantidade dunha masa pegañenta, mestura de feces e urina que, seca e reducida a pó, foi moi utilizada na farmacopea europea durante os séculos XVIII e XIX, baixo o nome de Hyraceum, para combater determiandas doenzas xinecolóxicas.[8] e outras, como a epilepsia e as convulsións, a aínda segue a ser utilizada en perfumaría.[Cómpre referencia]
Os damáns mostran moitas características primitivas e, ao mesmo tempo, numeross peculiaridades anatómicas propias. Debido a isto, os zoólogos intentaron encontrar relacións de parentesco entre os membros deste grupo e os doutras varias ordes de mamíferos fósiles e actuais. Parece fóra de toda clase de dúbidas que as especies da orde dos hiracoideos son unha rama lateral antiga de ungulados primitivos. A súa anatomía recorda máis estreitamente á dos proboscídeos e os sirenios. Son moi parecidos aos pequenos ungulados primitivos do terciario dos que evolucionou a superorde dos penungulados (Paenungulata), plantígrados, con catro dedos diante e tres nos membros posteriores, con pezuños e unha uña no dedo interno empregada para rascarse, polo que frecuentemente se agrupan con eles nesta superorde.
A evolución dos hiracoideos tivo lugar en África. Tamén se encotraron fósiles en Europa, pero só no plioceno, e hoxe se presentan tamén no Oriente Medio. No oligoceno inferior esta orde era moi rica en especies, e estaba enormemente diversificada. As especies de aqueles tempos aínda tiñan unha dentición completa e unhas órbitas abertas. Ao mesmo tempo, porén, a estrutura dentaria estaba xa enormemente diferenciada: os dentes podían ser bunodontes, selenodontes ou lofodontes. Algúns alcanzaron un tamaño bastante grande (como o dunha ovella).[13]
Suxeriuse que os parentes máis próximos aos hiracoideos son os tetiterios, pero este debate non está aínda totalmente pechado. Xunto con este taxon os proboscídeos e outros extinguidos, os tetiterios forman o clado dos penungulados que, segundo os datos xenéticos moleculares queda clasificado dentro da superorde dos afroterios.[Cómpre referencia]
As relacións represéntanse neste cladograma:[14]
Penungulados TetiteriosEn 2006 a Unión Internacional para a Conservación da Natureza e dos Recursos Naturais (UICN) cualificou o status da especie como LC (pouco preocuante), cualificación que mantén en 2015, debido á súa ampla área de distribución, a ampla gama de hábitats que ocupa, nas que se presume que presenta grandes poboacións, e que vive nun gran número de grandes áreas protexidas, sendo pouco probábel que as poboaciónse estean declinando, como para situala nunha categoría de maior ameaza.[12]
Procavia capensis (Pallas, 1766), é unha especie de mamífero da orde dos hiracoideos, o tipo da familia dos procavíidos e única especie actual do xénero Procavia.
É un dos damáns máis estendidos por toda África, chegando tamén ao oeste da península Arábiga. Habitante dos rochedos, en aparencia aseméllase a unha marmota común ou a un coello de Indias, coas súas curtas orellas e cola.
Hiraks batu (Procavia capensis), dalam bahasa Inggris Afrika Selatan dijuluki dassie, adalah salah satu dari empat spesies yang tergolong ke dalam ordo Hyracoidea dan satu-satunya spesies di dalam genus Procavia.[2] Seperti hiraks lainnya, hewan ini merupakan mamalia darat berukuran sedang (~4 kg) dengan telinga dan ekor yang pendek.
Hewan yang memiliki hubungan kekerabatan terdekat dengan hiraks adalah gajah dan sirenia. Hiraks batu dapat ditemui di Afrika dan Timur Tengah dengan habitat di celah-celah batu dengan tujuan untuk bersembunyi dari predatornya. Hewan ini merupakan satu-satunya afroteria darat yang masih ada di Timur Tengah. Hiraks biasanya hidup berkelompok bersama 10-80 hiraks lainnya. Kelompok ini memiliki satu atau beberapa penjaga yang akan mengeluarkan bunyi peringatan untuk yang lain jika ada predator yang mendekat.
Hiraks batu memiliki sistem termoregulasi yang tidak sempurna dan biasanya aktif pada pagi dan sore hari, walaupun aktivitasnya tergantung pada musim dan iklim.
Hewan ini tidak terancam punah di wilayah persebarannya, dan di beberapa tempat dianggap sebagai hama. Di Etiopia, Israel dan Yordania, hewan ini dijangkiti oleh parasit leishmaniasis.
Hiraks batu (Procavia capensis), dalam bahasa Inggris Afrika Selatan dijuluki dassie, adalah salah satu dari empat spesies yang tergolong ke dalam ordo Hyracoidea dan satu-satunya spesies di dalam genus Procavia. Seperti hiraks lainnya, hewan ini merupakan mamalia darat berukuran sedang (~4 kg) dengan telinga dan ekor yang pendek.
Hewan yang memiliki hubungan kekerabatan terdekat dengan hiraks adalah gajah dan sirenia. Hiraks batu dapat ditemui di Afrika dan Timur Tengah dengan habitat di celah-celah batu dengan tujuan untuk bersembunyi dari predatornya. Hewan ini merupakan satu-satunya afroteria darat yang masih ada di Timur Tengah. Hiraks biasanya hidup berkelompok bersama 10-80 hiraks lainnya. Kelompok ini memiliki satu atau beberapa penjaga yang akan mengeluarkan bunyi peringatan untuk yang lain jika ada predator yang mendekat.
Hiraks batu memiliki sistem termoregulasi yang tidak sempurna dan biasanya aktif pada pagi dan sore hari, walaupun aktivitasnya tergantung pada musim dan iklim.
Hewan ini tidak terancam punah di wilayah persebarannya, dan di beberapa tempat dianggap sebagai hama. Di Etiopia, Israel dan Yordania, hewan ini dijangkiti oleh parasit leishmaniasis.
L'irace del Capo (Procavia capensis Pallas, 1766), chiamato anche procavia delle rocce è una delle quattro specie di iraci esistenti, e l'unica del genere Procavia Storr, 1780.[2]
Il nome swahili è Pelele o Wibari. Nel Sudafrica gli iraci sono chiamati dassies, che letteralmente significherebbe tasso.
Hanno un aspetto generale che li fa assomigliare a conigli con orecchie e coda accorciati; tuttavia non sono Lagomorfi.
Il corpo degli iraci del Capo ha una lunghezza complessiva di 40–50 cm, con una coda di 1–2 cm. Hanno forti incisivi e molari simili a quelli dei rinoceronti. Le zampe anteriori sono plantigrade, e quelle posteriori semi-digitigrade. Il palmo delle zampe ha un cuscinetto costantemente umidificato da una secrezione simile a sudore. I maschi sono leggermente più grandi delle femmine (circa 4 kg i maschi, 3,5 kg le femmine).
Sono erbivori. Vivono in branchi numerosi fino a ottanta individui; ogni branco è suddiviso in sottogruppi composti da poche famiglie e guidati da un maschio adulto. Hanno una gestazione di sei o sette mesi al termine della quale partoriscono due o tre cuccioli. I piccoli alla nascita sono ben sviluppati, con occhi aperti e pelliccia completa; dopo due settimane possono ingerire cibi solidi e sono svezzati a dieci settimate di età. I giovani diventano sessualmente attivi dopo sedici mesi; a tre anni sono adulti, e possono vivere fino a circa dieci anni.
L'irace del Capo vive in gruppi familiari composti anche da 25 individui, dominati da un maschio e comprendenti 3-7 femmine imparentate tra loro e accompagnate dalla prole. Il maschio è territoriale ma in una stessa zona possono coesistere parecchi territori. Di solito il maschio dominante sorveglia il gruppo mentre si ciba e se avvista un potenziale predatore emette un segnale di allarme che spinge tutti a cercare riparo. Nel Serengeti, in Tanzania, l'irace delle rocce vive in gruppi misti con l'irace della savana. I membri delle due specie trascorrono la notte nella stessa tana. La convivenza è possibile perché non esiste alcuna competizione per il cibo: l'irace della savana si nutre di foglie, ramoscelli e frutti di acacia.[3]
L'Irace del Capo si nutre entro un raggio di 50-100 m dal nascondiglio. Di solito dedica alla ricerca del cibo un'ora nella prima mattinata e un tempo più lungo nel tardo pomeriggio, ma può nutrirsi in qualunque momento purché si sia prima ben riscaldato. Le erbe dure e resistenti sono parte essenziale della sua dieta e a volte include anche le foglie dei cespugli. L'irace ha uno stomaco complesso, con tre cavità separate contenenti microrganismi capaci di digerire le dure fibre vegetali.[3]
La femmina è sessualmente ricettiva una sola volta all'anno; il periodo varia a seconda dell'habitat, ma le nascite segnano un incremento durante e dopo la stagione delle piogge. Tutte le femmine di un gruppo partoriscono quasi contemporaneamente e la cucciolata, di 2-3 piccoli, nasce in un nascondiglio sicuro tra le rocce. Il parto ha luogo 7-8 mesi dopo l'accoppiamento. Il piccolo nasce con gli occhi aperti, ricoperto di pelo e viene subito allattato; poiché impara presto a muoversi, a 4 giorni di vita è già in grado di nutrirsi di erba, sebbene continui a succhiare il latte per circa 5 mesi.[3]
L'irace del Capo vive nelle zone dalla Siria all'Africa nordorientale e in tutta l'Africa subsahariana. Gli iraci del Capo si trovano soprattutto nella savana o nella prateria. È un mammifero primitivo che dipende dall'ambiente esterno per mantenere costante la temperatura corporea; tende perciò ad abitare in luoghi soleggiati dove può riscaldarsi all'inizio di ogni giornata. Alcune popolazioni vivono a considerevoli altitudini, per esempio sulle pendici del monte Kenya, dove le fenditure tra i massi forniscono un caldo riparo. Le crepe tra le rocce sono spesso fonte di umidità e facilitano la crescita delle erbe di cui l'animale si ciba. I soffici cuscinetti sulle piante dei piedi consentono all'irace di scorrazzare con sicurezza sulle superfici scivolose e, in caso di pericolo, di scappare rapidamente tra le fenditure in cerca di riparo; esso può anche scavare delle piccole tane nel terreno più soffice per utilizzarle come ulteriori nascondigli.[3]
Nel 2008 si è cercato di reintrodurre due volte P. capensis nella riserva della provincia di KwaZulu-Natal in Sudafrica, dove si era estinta, ma ambedue i tentativi sono falliti.[4]
Per il genere Procavia sono stati riportati i seguenti sinonimi:[2]
Non sono stati invece indicati sinonimi per P. capensis.[2]
Sono state identificate le seguenti sottospecie:[2]
Gli escrementi e l'urina degli iraci hanno proprietà farmacologiche utili; sono stati usati nella cura dell'epilessia e delle convulsioni.[5]
L'irace appare nel film di animazione Uno zoo in fuga.
Nei film Nata libera e Khumba (2013) e nella serie TV animata The Lion Guard (2016).
L'irace del Capo (Procavia capensis Pallas, 1766), chiamato anche procavia delle rocce è una delle quattro specie di iraci esistenti, e l'unica del genere Procavia Storr, 1780.
Il nome swahili è Pelele o Wibari. Nel Sudafrica gli iraci sono chiamati dassies, che letteralmente significherebbe tasso.
De Kaapse klipdas of dassie of rotsklipdas (Procavia capensis) is de meest algemene soort klipdas. Het is de enige nog levende soort uit het geslacht de rotsklipdassen (Procavia), alhoewel vier ondersoorten vaak als aparte soort worden beschouwd.
De Kaapse klipdas is een gedrongen diertje met een korte, dichte vacht. De kop is stomp met kleine, afgeronde oren. De vacht verschilt per regio en ondersoort, maar is meestal grijzig licht- tot donkerbruin van kleur. Op de rug zit een gele, zwarte of egaal gekleurde rugvlek. De onderzijde is bleker. Hij wordt 30 tot 58 centimeter lang[2] en 1,8 tot 5,4 kilogram zwaar. De staart is 20 tot 31 millimeter lang.
De Kaapse klipdas leeft in groepen van vier tot vijftig dieren, bestaande uit één dominant mannetje, vrouwtjes met hun jongen en enkele onvolwassen mannetjes. Mannetjes zijn territoriaal en dulden zelden andere volwassen mannetjes in de buurt van de kolonie. Tussen de rotsen bouwen ze een grasnest. De vrouwtjes en jongen zijn meestal aan elkaar verwant, zoeken vaak elkaars gezelschap op en kruipen dicht tegen elkaar aan.
Verspreid over de rots heeft de kolonie enkele latrines. Op vlakke, beschutte plekken worden mest en urine achtergelaten. De sterke geur daarvan is kenmerkend voor een bepaalde kolonie. Urine laten ze meestal lopen op opvallende, uitstekende rotsen. Het calciumcarbonaat in de urine blijft achter als lichtgekleurde strepen op de rotsen.
De Kaapse klipdas eet voornamelijk ruwe grassen en kruiden, aangevuld met bladeren van lage struiken en afgevallen vruchten. Enkele van deze planten kunnen giftig zijn voor andere diersoorten. Soms klimmen ze ook in bomen en struiken om te eten. Vocht halen ze gewoonlijk uit het voedsel; ze drinken slechts bij hoge uitzondering uit een plas. De Kaapse klipdas is voornamelijk overdag actief; in woestijnen komt hij ook op zomernachten tevoorschijn. Eten zoekt hij voornamelijk vroeg in de ochtend en in de middag. Terwijl de andere dieren eten, houden enkele klipdassen de wacht. Als er gevaar dreigt (bijvoorbeeld van een arend, gier of baviaan), slaken deze bewakers enkele kreetjes en vlucht de hele groep in holen tussen de rotsen.
In de paartijd wordt het mannetje zeer luidruchtig. Hij schudt het hoofd als hij een vrouwtje nadert, terwijl de klier op zijn rug een sterke geur verspreidt. De Kaapse klipdas heeft een draagtijd van 214 tot 240 dagen. Meestal krijgt een vrouwtje één tot twee jongen per worp, maar er zijn worpen van tot wel zes jongen bekend. De jongen kunnen bij de geboorte al zien en binnen een paar uren kunnen ze lopen. Na drie dagen eten ze hun eerste vast voedsel. Ze klimmen vaak op de moeders rug, om warm te worden. Ook nemen ze de lichaamsgeur van de moeder op, die wordt afgescheiden door de rugklier. Na vijftien tot zestien maanden zijn ze volgroeid. De Kaapse klipdas wordt negen tot twaalf jaar oud.
Op sommige plaatsen, zoals in Tanzania en Zimbabwe, leven Kaapse klipdassen in gemengde groepen met steppeklipdassen (Heterohyrax brucei). Alhoewel de twee dieren samenleven, synchrone paartijden hebben, dezelfde latrines gebruiken en bij elkaar kruipen om warm te worden, komen er geen kruisingen tussen de twee soorten voor. Dit komt onder andere doordat de voortplantingsorganen anders gebouwd zijn: de penis van een Kaaps klipdasmannetje is veel korter en simpeler dan die van een steppenklipdasmannetje.
De Kaapse klipdas komt voornamelijk voor op rotsachtig terrein, zoals berghellingen en kopjes (losstaande rotspartijen in savannen). Ze leven in Zuidwest- en Noordoost-Afrika en in het midden-oosten van de Sinaï tot Syrië en Libanon, in Jemen en in het zuidoosten van het Arabische schiereiland. Ze kunnen worden aangetroffen tot op een hoogte van 4300 meter op Mount Kenya.
Er worden meerdere ondersoorten onderscheiden. Vaak worden vijf ondersoorten als aparte soorten beschouwd. Deze ondersoorten zijn:
De Kaapse klipdas of dassie of rotsklipdas (Procavia capensis) is de meest algemene soort klipdas. Het is de enige nog levende soort uit het geslacht de rotsklipdassen (Procavia), alhoewel vier ondersoorten vaak als aparte soort worden beschouwd.
Góralek skalny[4] (Procavia capensis) – gatunek ssaka z rodziny góralkowatych (Procaviidae) zamieszkujący kontynent afrykański, Półwysep Arabski, Bliski Wschód, aż po Turcję. Prowadzi osiadły tryb życia. Jak wszystkie góralkowce przypomina kawię domową (świnkę morską). Jest od niej jednak znacznie większy; dorosły osobnik mierzy 40–60 cm. Posiada niewielki ogon i krótkie uszy. Żyje w stadach[3]. Nie kopie nor, ale chętnie wykorzystuje wykopane przez inne zwierzęta, takie jak mrówniki afrykańskie czy surykatki.
Zwierzę to żyje na terenie wielu krajów afrykańskich i azjatyckich. W związku z tym jest różnorako nazywane. Biblia hebrajska nazywa góralka שָּׁפָן szaphan. Europejczycy, niemający kontaktów z krajami Bliskiego Wschodu, szczególnie po podbojach islamskich, nie wiedzieli jak tłumaczyć nazwę tego zwierzęcia z hebrajskiego na języki narodowe, nie wiedzieli, o jakie zwierzę chodzi. Występujące aż cztery razy w Starym Testamencie słowo szaphan było tłumaczone jako jeż (Biblia Wujka), królik (Biblia brzeska), a nawet borsuk. Od fenickiego, zlatynizowanego później i-szphan-im – ziemia góralków – wzięła swą nazwę Hiszpania, łac. Hispania.
Arabowie – zwierzę występuje w Syrii, Libanie, Jordanii, Palestynie i innych krajach arabskich – nazywają góralka ghenam, Palestyńczycy nusnus.
W Południowej Afryce góralek nazywany jest dassie lub rock rabbit. W języku niderlandzkim, którego używali przybywający z Europy osadnicy z okolic Kapsztadu, słowo dassie oznacza borsuka. Również w języku afrykanerskim nazywa się góralka dassie, w swahili pelele lub łibari. Borsuki jednak należą do łasicowatych, zaś góralki do góralkowatych.
Góralek przylądkowy jest zwierzęciem bardzo szczególnym, przede wszystkim ze względu na budowę anatomiczną swego ciała. Mózg góralka przylądkowego przypomina budową mózg słonia. Jego żołądek ma budowę podobną do budowy żołądka konia. Struktura tylnych kończyn zbliżona jest do struktury tylnych kończyn tapira. Górne siekacze Procavia capensis przypominają siekacze gryzoni, górne uzębienie jako takie jest podobne do górnego uzębienia nosorożca, dolne przypomina uzębienie hipopotama. Kły tego ssaka przypominają kły słonia. Zoologowie porównują ogólną budowę ciała góralka do budowy ciała słonia lub konia. Podobnie jak słonie mają doskonałą pamięć.
Czaszka góralka wyposażona jest w parę długich kłowatych zębów siecznych oraz w zęby trzonowe, które przypominają trzonowce nosorożca. Jego przednie kończyny są stopochodne, tylne zaś palcochodne (jak u psa czy konia). Spody stóp mają szeroką i miękką poduszkę, której wilgotność utrzymywana jest dzięki specjalnej wydostającej się z gruczołów wydzielinie. Samce są nieznacznie większe od samic.
Góralki wydają od dwóch do trzech młodych po 7-miesięcznej ciąży. Młode rodzą się w pełni ukształtowane, z otwartymi oczami i okryte futrem. Przestają być karmione przez matki po dziesięciu tygodniach, przy czym zaczynają się odżywiać jak dorosłe osobniki już po dwóch tygodniach. Góralki osiągają dojrzałość płciową po szesnastu miesiącach. Rozmiary dorosłego osobnika mają w wieku trzech lat. Przeciętnie góralki żyją około 10 lat, w niewoli 7.
Zwierzęta te żyją w hordach, dochodzących do 26 sztuk[5]. Hordy te składają się z mniejszych stad, które z kolei złożone są z kilku grup rodzinnych. Na czele takiej grupy stoi dorosły samiec. Większość czasu góralki spędzają wypoczywając w grupie lub wygrzewając się na słońcu. Pomaga to im w utrzymaniu regularnej temperatury ciała. Ssaki te nie są w pełni zwierzętami stałocieplnymi[6].
Na góralka polują lamparty, likaony, szakale, mangusty, dzienne ptaki drapieżne, pytony oraz człowiek.
Góralek zjada trawy, zioła, młode pędy i owoce. Nie gardzi larwami i insektami. Potrafi przybrać na wadze do 75% w czasie pory suchej[7].
Góralki jak wszystkie z rodzaju Procavia produkują dużą ilość substancji zwanej hyraceum, która zalega wokół ich siedlisk (mieszanina uryny i odchodów). Robią tak zapewne ze względu na jej właściwości zapachowe. Hyraceum działa jak feromon – funkcja socjalna. Służy również do oznaczania terytorium okupowanego przez hordę. Tysiące lat mieszkańcy Afryki i Bliskiego Wschodu używali hyraceum jako antidotum na epilepsię, konwulsje i problemy hormonalne u kobiet. Wierzono również, iż hyraceum przeciwdziała efektowi prowokowanemu przez jad żmii. Hyraceum nazywano czarnym kamieniem[8].
Gatunek Procavia capensis dzieli się na 17 podgatunków. Oto niektóre z nich wraz z miejscem występowania:
Góralek skalny (Procavia capensis) – gatunek ssaka z rodziny góralkowatych (Procaviidae) zamieszkujący kontynent afrykański, Półwysep Arabski, Bliski Wschód, aż po Turcję. Prowadzi osiadły tryb życia. Jak wszystkie góralkowce przypomina kawię domową (świnkę morską). Jest od niej jednak znacznie większy; dorosły osobnik mierzy 40–60 cm. Posiada niewielki ogon i krótkie uszy. Żyje w stadach. Nie kopie nor, ale chętnie wykorzystuje wykopane przez inne zwierzęta, takie jak mrówniki afrykańskie czy surykatki.
O damão-do-cabo (Procavia capensis), é membro da ordem Hyracoidea. Pode ser encontrada na maior parte da África e em partes do Sudoeste Asiático (oeste da península Arábica e porções do Levante). Os fenícios chamavam a Espanha "terra dos damões", pois haviam confundido o coelho-europeu com o damão-do-cabo, já que são muito semelhantes em tamanho e aparência.
É encontrado na Arábia ocidental, e em toda a África continental, exceto o Magrebe setentrional, na República Democrática do Congo ocidental. É encontrado em matagais, e savanas arborizadas, nas regiões do Saara meridional ele também pode ser encontrado em estepes.
O damão-do-cabo (Procavia capensis), é membro da ordem Hyracoidea. Pode ser encontrada na maior parte da África e em partes do Sudoeste Asiático (oeste da península Arábica e porções do Levante). Os fenícios chamavam a Espanha "terra dos damões", pois haviam confundido o coelho-europeu com o damão-do-cabo, já que são muito semelhantes em tamanho e aparência.
Damanul de stâncă (Procavia capensis) este un mamifer din ordinul hiracoideelor (Hyracoidea) întâlnit în sud-vestul și nord-estul Africii și Orientul Mijlociu. Corpul este îndesat, cu o lungimea de 30-58 cm și o greutatea de 1,8–5,4 kg, coada este foarte scurtă. Blana are o culoare maronie închisă sau cenușie-maronie, mai deschisă pe abdomen. Damanul de stâncă trăiește în colonii de 4-40 de indivizi, alcătuite dintr-un mascul dominant, mai multe femele adulte și pui. Trăiește de obicei în regiuni stâncoase, la altitudini foarte diverse - de la nivelul mării, pînă în zone de munte de până la 4.000 m altitudine. Își construiește un cuib căptușit cu iarbă printre bolovani. Este un animal erbivor și se hrănește cu frunze, ramuri, fructe și scoarță de copac. Are o longevitate de 9-12 ani.
Damanul de stâncă (Procavia capensis) este un mamifer din ordinul hiracoideelor (Hyracoidea) întâlnit în sud-vestul și nord-estul Africii și Orientul Mijlociu. Corpul este îndesat, cu o lungimea de 30-58 cm și o greutatea de 1,8–5,4 kg, coada este foarte scurtă. Blana are o culoare maronie închisă sau cenușie-maronie, mai deschisă pe abdomen. Damanul de stâncă trăiește în colonii de 4-40 de indivizi, alcătuite dintr-un mascul dominant, mai multe femele adulte și pui. Trăiește de obicei în regiuni stâncoase, la altitudini foarte diverse - de la nivelul mării, pînă în zone de munte de până la 4.000 m altitudine. Își construiește un cuib căptușit cu iarbă printre bolovani. Este un animal erbivor și se hrănește cu frunze, ramuri, fructe și scoarță de copac. Are o longevitate de 9-12 ani.
Klipphyrax (Procavia capensis) är en däggdjursart i familjen hyraxar och den enda arten i släktet Procavia. Tidigare har den kallats klippdasse och klippgrävling.
Klipphyraxen är ungefär lika stor som en tamkanin. Den når en kroppslängd av 40 till 58 cm.[2] Vikten för vuxna individer ligger mellan 1,8 och 5,4 kilogram.[2] Pälsens färg varierar i olika nyanser av brunt och grått.[2] Dess kroppsbyggnad kan jämföras med pipharar eller murmeldjur men de är inte närmare släkt med varandra.[3] Anatomin visar alla kännetecken som är typiska för hyraxar. De främre extremiteternas har fyra tår med platta naglar som påminner om hovar.[3] De bakre fötterna har tre tår, varav den mellersta är utrustad med en klo, medan de andra två har hovliknande naglar.[3] Den har en körtel på ryggen som täcks av päls i annan färg (oftast svart, orange eller gul).[2] Det lilla djurets närmsta levande släktingar är elefanter och sjökor, vilket morfologisk tydligast framgår av de två framtänderna i övre käken som kontinuerligt växer.[3] Dessa tänder är böjda i en halvcirkel. Tandformeln för vuxna djur är I 1/2 C 0/0 P 4/4 M 3/3, alltså 34 tänder.[3] Klipphyraxens har svanskotor men ingen synlig svans.[3]
Klipphyraxen förekommer i torra och klippiga områden över stora delar av Afrika och i västra Asien (se karta).[1]
De flesta auktoriteter kategoriserar alla populationer av klipphyrax som samma art.[4] Men det finns även andra uppfattningar. Till exempel skiljer Meester och Setzer i verket The Mammals of Africa från 1977 på fem arter:
En molekylärgenetisk undersökning från 1991 av klipphyraxen visade att enbart den sydafrikanska populationen uppvisade två väl avgränsade klader, en nordvästlig och en sydcentral, vilket indikerar att det kan röra sig om vå arter.[5] I samband med Mammalian Genome Project blev artens genom kartlagt och offentliggjort.[6]
Klipphyraxen lever i familjer som ibland bildar större kolonier med upp till 100 individer.[3] Den är vanligtvis dagaktiv och kan snabbt röra sig på klippor. Ibland observeras de under varma nätter med fullmåne.[2] Vid fara söker djuret skydd i bergssprickor eller andra gömställen. Vid kyligt väder eller regn stannar de vanligen i sina bon.[2] Under natten sänks kroppstemperaturen ungefär 4 °C för att spara energi. Därför börjar de dagen med att solbada innan andra uppgifter.[3]
Klipphyraxen är en växtätare och klättrar ibland upp i träd för att hämta föda. Födan utgörs främst av färskt gräs, växtskott och färska löv. Dessutom äter arten kvistar, frukter och bär.[2] Sitt vätskebehov tillfredsställer de vanligen med vattnet som finns i födan men de dricker även ur pölar där det finns. I motsats till flera andra växtätare behöver de inte mycket tid för att smälta födan.[3]
Kolonierna består av en eller flera familjer med omkring 10 medlemmar (2 till 25) vilka leds av en hanne. Till familjen hör ibland en underordnad hanne och annars bara honor och deras ungar.[3] Familjerna har nästan ingen kontakt med varandra trots att de lever tätt bredvid varandra. Om en könsmogen hanne skulle råka komma in i reviret av en annan familj jagas den oftast bort av alfadjuret. Dessutom blir unga hannar som nått könsmognad bortjagad av fadern. Honor har inga avgränsade territorier och byter därför ibland grupp. I varje familj finns en eller flera individer som håller vakt och som varnar gruppen för fiender. Vid slutet av 1900-talet var ungefär 20 olika läten kända.[3] Könsmogna hannar som inte etablerat en egen familj lever vanligen ensamma.[3]
Fortplantningen sker i de norra delarna av utbredningsområdet i augusti/september och i sydliga regioner mellan augusti och november. Efter dräktigheten, som varar 200 till 245 dagar, föder honan en till sex ungar. Nyfödda ungar väger cirka 200 gram, har öppna ögon och uppträder redan efter första dagen utanför boet.[3] De börjar efter ungefär två veckor med fast föda men dias vanligen under en till fem månader. Könsmognaden infaller efter ett år och 4 till 5 månader. Djur i fångenskap har uppnått en ålder av 11 år.[2][3]
Till klipphyraxens fiender räknas bland annat leoparder, schakaler, manguster, vesslor och rovfåglar. Om klipphyraxen inte lyckas att undkomma biter den mot fienden för att freda sig.[3]
I vissa afrikanska stater som Egypten jagas klipphyraxar för köttets och pälsens skull. I vissa områden jagas den eftersom den anses vara en konkurrent med får och andra boskapsdjur. Den utpekas och bekämpas regionalt som skadedjur på odlade växter.[2] Djurrättsaktivister menar däremot att denna konkurrens utmålas överdriven.
Beståndets utveckling är inte känt men IUCN listar klipphyrax som livskraftig (LC) på grund av det stora utbredningsområdet och då arten lever i flera skyddade regioner.[1]
Klipphyraxen, eller klippdassen, omnämns på inte mindre än fyra ställen i 1917 års version av Bibeln, alla i Gamla testamentet:
Klippdassen är en rollfigur i Mumindalen, en varelse som avsätter klibbiga spår efter sina tassar och gnager på vad han kommer åt. Det finska namnet på denna figur är "Tahmatassu", vilket översatt till svenska betyder "klibbtass".[7]
Ett känt exempel är den tama klipphyrax, Pati-Pati, som viltvårdaren, konstnären och författaren Joy Adamson hade i Kenya på 1950-talet. Adamson är mest känd för sitt mycket svåra, men framgångsrika, försök att återföra ett tamt lejon (Elsa) till ett liv i det vilda.[8]
Klipphyrax (Procavia capensis) är en däggdjursart i familjen hyraxar och den enda arten i släktet Procavia. Tidigare har den kallats klippdasse och klippgrävling.
Зовні, особливо здалеку, нагадують великих пискух або коротковухих кроликів. Довжина тіла 30-58 см, вага — 1,4-4 кг. Самці трохи більші за самок. Хвіст зовні непомітний. Волосяний покрив короткий і досить грубий; зверху забарвлений в коричнево-сірий колір, на боках яснішає, низ тіла кремовий, але забарвлення сильно різниться між підвидами. Дослідження в капських областях (південь ПАР) показали, що в вологіших місцях проживання волосяний покрив темніший. По центру спини, на стику грудного й поперекового відділів, розміщена незвичайна залоза відома тільки в даманових. Залоза позначена голим клаптем різного кольору й овальної форми, близько 15 мм у дорослих особин. Залоза оточена довгими волосками жовтого, помаранчевого, коричневого або чорного кольору. Залоза виробляє характерний для виду запах і, схоже, виконує соціальні функції за допомогою маркування каменів. Залози найактивніші під час шлюбного періоду. На писку чорні вібриси завдовжки до 18 см. Передні кінцівки — стопоходячі, задні — напівпальцеходячі. Підошви завжди вологі через сильне потовиділення, що допомагає даманам лазити по каменях, — своєрідний пристрій стоп примушує їх діяти як присоски. Зубна формула постійних зубів: I 1/2, C 0/0, P 4/4, M 3/3 = 34.
До 1995 р. в роді даман виділяли ще кілька видів: лат. Procavia habessinica, лат. Procavia johnstoni, лат. Procavia ruficeps і ін., які в наш час[коли?] включені в лат. Procavia capensis як підвиди.
Поширений від Сирії, Ізраїлю і Північно-східної Африки до ПАР. На південь від Сахари мешкає майже повсюди. Ізольовані популяції є в горах Лівії і Алжиру.
Капські дамани населяють скелі, крупно каменисті розсипи, останці або кам'янисті чагарникові пустелі. Притулок знаходять серед камнів або в порожніх норах інших тварин (трубкозубів, сурікат). Живуть колоніями від 5-6 до 80 особин. Крупні колонії діляться на сімейні групи, очолювані дорослим самцем. Капські і гірські дамани (лат. Heterocxyrax) іноді живуть змішаними групами, займаючи одні і ті ж притулки. Активні в світлу частину доби, особливо вранці і ввечері, але іноді виходять на поверхню і в теплі місячні ночі. Велику частину дня проводять, відпочиваючи і гріючись на сонці — слабо розвинена терморегуляція примушує температуру тіла даманів коливатися протягом дня. Годуються переважно травою, плодами, і корою чагарників; рідше поїдають тваринну їжу (сарану). Незважаючи на незграбний вигляд, ці звіри дуже рухомі, легко лазять по прямовисних скелях.
Тимчасові рамки шлюбного сезону залежать від місцепроживання. Так, в Кенії він наступає в серпні-листопаді, але може тривати і до січня; а в Сирії — в серпні-вересні. Вагітність продовжується 6-7 місяців. Самки зазвичай приносять потомство в червні-липні, після сезону дощів. У виводку 2, рідше 3 дитинчати, іноді до 6. Дитинчата народяться зрячими і вкритими шерстю; через кілька годин вони залишають виводкове гніздо. Тверду їжу починають споживати в 2 тижні, самостійними стають в 10 тижнів. Статевої зрілості молоді дамани досягають в 16 місяців; у віці 16-24 місяців молоді самці розселяються, самки зазвичай залишаються зі своєю сімейною групою.
Основні вороги дамана — леопард, каракал, шакали, плямиста гієна і хижі птахи. Орел Верро (лат. Aquila verreauxi) харчується майже виключно даманами. При нападі ворога даман не тільки приймає захисну позу, піднімаючи дибки шерсть над спинною залозою, але і захищається своїми довгими, сильними зубами. Звичайна тривалість життя в природі — 10 років. Самки живуть помітно довше за самців.
Диплоїдна кількість хромосом, 2n=54: 21 пара акроцентричних, 2 пари відносно великих субметацентричних і три пари малих метацентричних аутосом; X-хромосома є найбільшою хромосомою, Y-хромосома дуже мала, акроцентрична.[1]
М'ясо дамана їстівне; є думка, що «зайці», що згадуються в Біблії (зокрема, в Левиті), як некошерні тварини, насправді — дамани. Інше місце де в Біблії можливо згадуються дамани — це Повторення закону (14:7,8). Деякі південноафриканські племена використовують сечу даманів (лат. hyraceum), що кристалізувалася, як лікарський засіб при судомах і епілепсії. Молоді дамани в неволі приручаються, дорослі тварини залишаються злими і агресивними.
Даман на Столовій горі, Кейптаун
Даман на горі, Національний Парк, Південна Африка
Колонія даманів в північному Ізраїлі
Procavia capensis là một trong bốn loài chuột còn sống của bộ Hyracoidea, và loài duy nhất còn sống của chi Procavia. Nó có trọng lượng khoảng gần 4 kg, bên ngoài giống chuột lang nhà với tai và đuôi ngắn. Loài này được tìm thấy khắp châu Phi và Trung Đông trong môi trường sống với các khe đá để thoát khỏi các kẻ thù. Chúng thường sống trong các nhóm của 10-80 cá thể, và đi kiếm ăn theo nhóm. Hành vi của họ nổi bật nhất là việc sử dụng lính gác: một hoặc nhiều cá thể đứng ở trên một điểm thuận lợi và báo động bằng tiếng kêu khi thấy loài săn mồi.
Chúng hoạt động nhiều nhất vào buổi sáng và buổi tối, mặc dù mô hình hoạt động của chúng thay đổi đáng kể với mùa và khí hậu. Loài này có thân dài đến 50 cm (20 in) và cân nặng khoảng 4 kg (8,8 lb), và một chút dị hình giới tính; con đực nặng hơn khoảng 10% so với con cái. Bộ lông dày và màu nâu xám dù màu lông khác nhau nhiều theo môi trường sinh sống.[4]
Loài này hiện diện ở châu Phi hạ Sahara, ngoài trừ lưu vực Congo và Madagascar. Một phân loài lớn hơn với lông dài hơn có nhiều ở A larger, longer-haired subspecies có nhiều trong các trầm tích băng ở vùng núi cao của núi Kenya [cần dẫn nguồn]. Phân bố tiếp tục vào miền Bắc Algeria, Libya và Ai Cập, Trung Đông, với quần thể ở Israel, Jordan, Syria, bán đảo Ả Rập và đông Thổ Nhĩ Kỳ.[5] Kẻ săn mồi của loài này là báo, rắn hổ mang Ai Cập, Bitis arietans, caracal, chó hoang, và đại bàng.[6] Đại bàng Verreaux đặc biệt là loài chuyên săn loài này.[7][8]
Procavia capensis là một trong bốn loài chuột còn sống của bộ Hyracoidea, và loài duy nhất còn sống của chi Procavia. Nó có trọng lượng khoảng gần 4 kg, bên ngoài giống chuột lang nhà với tai và đuôi ngắn. Loài này được tìm thấy khắp châu Phi và Trung Đông trong môi trường sống với các khe đá để thoát khỏi các kẻ thù. Chúng thường sống trong các nhóm của 10-80 cá thể, và đi kiếm ăn theo nhóm. Hành vi của họ nổi bật nhất là việc sử dụng lính gác: một hoặc nhiều cá thể đứng ở trên một điểm thuận lợi và báo động bằng tiếng kêu khi thấy loài săn mồi.
Chúng hoạt động nhiều nhất vào buổi sáng và buổi tối, mặc dù mô hình hoạt động của chúng thay đổi đáng kể với mùa và khí hậu. Loài này có thân dài đến 50 cm (20 in) và cân nặng khoảng 4 kg (8,8 lb), và một chút dị hình giới tính; con đực nặng hơn khoảng 10% so với con cái. Bộ lông dày và màu nâu xám dù màu lông khác nhau nhiều theo môi trường sinh sống.
Loài này hiện diện ở châu Phi hạ Sahara, ngoài trừ lưu vực Congo và Madagascar. Một phân loài lớn hơn với lông dài hơn có nhiều ở A larger, longer-haired subspecies có nhiều trong các trầm tích băng ở vùng núi cao của núi Kenya [cần dẫn nguồn]. Phân bố tiếp tục vào miền Bắc Algeria, Libya và Ai Cập, Trung Đông, với quần thể ở Israel, Jordan, Syria, bán đảo Ả Rập và đông Thổ Nhĩ Kỳ. Kẻ săn mồi của loài này là báo, rắn hổ mang Ai Cập, Bitis arietans, caracal, chó hoang, và đại bàng. Đại bàng Verreaux đặc biệt là loài chuyên săn loài này.
Капский даман[1] (лат. Procavia capensis) — вид афроазиатских млекопитающих, имеющий поверхностное сходство с кроликом. Имеют короткие уши и хвост. Живут в областях саванн или в травяных угодьях. Часто живут в скалистых областях и также их можно обнаружить в норах других животных.
Внешне, особенно издалека, напоминают больших пищух или короткоухих кроликов. Длина тела 30-58 см, масса — 1,4-4 кг. Самцы чуть крупнее самок. Хвост снаружи неразличим. Волосяной покров короткий и довольно грубый; сверху окрашен в коричнево-серый цвет, на боках светлеет, низ тела кремовый. Окраска волос на спинной железе чёрная, реже — бледно-жёлтая или оранжевая. На морде чёрные вибриссы длиной до 18 см. Передние конечности — стопоходящие, задние — полу-пальцеходящие. Подошвы всегда влажные из-за сильного потоотделения, что помогает даманам лазать по камням и стволам деревьев, — своеобразное устройство стоп заставляет их действовать как присоски. При этом специальные мышцы оттягивают резиноподобную поверхность подошвы совершая всасывающее движение. Это позволяет им быстро двигаться как вверх, так и вниз головой по вертикальным поверхностям.[2][3]
До 1995 г. в роде скалистых даманов выделяли ещё несколько видов: Procavia habessinica, Procavia johnstoni, Procavia ruficeps и др., которые в настоящее время включены в Procavia capensis в качестве подвидов.
Распространён от Сирии, Израиля и Северо-Восточной Африки до ЮАР. Южнее Сахары обитает почти повсеместно. Изолированные популяции имеются в горах Ливии и Алжира.
Капские даманы населяют скалы, крупнокаменистые россыпи, останцы или каменистые кустарниковые пустыни. Убежище находят среди камней или в пустующих норах других животных (трубкозубов, сурикат). Живут колониями от 5-6 до 80 особей. Крупные колонии делятся на семейные группы, возглавляемые взрослым самцом. Капские и горные даманы иногда живут смешанными группами, занимая одни и те же убежища. Активны в светлую часть суток, особенно утром и вечером, но иногда выходят на поверхность и в тёплые лунные ночи. Большую часть дня проводят, отдыхая и греясь на солнце, — слабо развитая терморегуляция заставляет температуру тела даманов колебаться в течение дня. Кормятся преимущественно травой, плодами, побегами и корой кустарников; реже поедают животную пищу (саранчовых). Несмотря на неуклюжий вид, эти зверьки очень подвижны, легко лазают по отвесным скалам.
Временные рамки брачного сезона зависят от местообитания. Так, в Кении он наступает в августе-ноябре, но может длиться и до января; а в Сирии — в августе-сентябре. Беременность продолжается 6-7 месяцев. Самки обычно приносят потомство в июне — июле, после сезона дождей. В помёте 2, реже 3 детёныша, иногда до 6. Детёныши рождаются зрячими и покрытыми шерстью; через несколько часов они покидают выводковое гнездо. Твёрдую пищу начинают потреблять в 2 недели, самостоятельными становятся в 10 недель. Половой зрелости молодые даманы достигают в 16 месяцев; в возрасте 16-24 месяцев молодые самцы расселяются, самки обычно остаются со своей семейной группой.
Основные враги дамана — леопард, каракал, шакалы, пятнистая гиена и хищные птицы. Кафрский орёл (Aquila verreauxii) питается почти исключительно даманами. При нападении врага даман не только принимает защитную позу, поднимая дыбом шерсть над спинной железой, но и защищается своими длинными, сильными зубами. Обычная продолжительность жизни в природе — 10 лет. Самки живут заметно дольше самцов.
Мясо дамана съедобно; есть мнение, что «зайцы», упоминаемые в Библии (в частности, в Левите), как некошерные животные, на деле являются даманами. Некоторые южноафриканские племена используют кристаллизировавшуюся мочу даманов (hyraceum) как лекарственное средство при судорогах и эпилепсии. Молодые даманы в неволе приручаются, взрослые животные остаются злобны и агрессивны.
Окаменевшие фекалии дамана, известные как «золотой камень», используются в парфюмерии (в частности, в парфюме Montecristo Masque) в качестве фиксатора аромата, при этом «золотой камень» придаёт аромату «анималистичное звучание».
Капский даман (лат. Procavia capensis) — вид афроазиатских млекопитающих, имеющий поверхностное сходство с кроликом. Имеют короткие уши и хвост. Живут в областях саванн или в травяных угодьях. Часто живут в скалистых областях и также их можно обнаружить в норах других животных.

蹄兔(学名 Procavia capensis)是蹄兔属下唯一的一个种。与所有蹄兔目的动物一样,它具有短小的耳朵和尾巴。蹄兔产于南非。
 保全状況評価 LEAST CONCERN
保全状況評価 LEAST CONCERN 分類 界 : 動物界 Animalia 門 : 脊索動物門 Chordata 亜門 : 脊椎動物亜門 Vertebrata 綱 : 哺乳綱 Mammalia 目 : イワダヌキ目 Hyracoidea 科 : イワダヌキ科 Procaviidae 属 : ハイラックス属 Procavia 種 : ケープハイラックス P. capensis 学名 Procavia Storr, 1780
分類 界 : 動物界 Animalia 門 : 脊索動物門 Chordata 亜門 : 脊椎動物亜門 Vertebrata 綱 : 哺乳綱 Mammalia 目 : イワダヌキ目 Hyracoidea 科 : イワダヌキ科 Procaviidae 属 : ハイラックス属 Procavia 種 : ケープハイラックス P. capensis 学名 Procavia Storr, 1780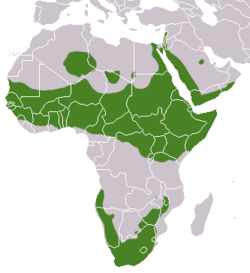
ケープハイラックス又はロックハイラックス(Cape Hyrax, Rock Hyrax, Procavia capensis)はイワダヌキ目イワダヌキ科ハイラックス属の1種で、ハイラックス属唯一の現生種である。
他のハイラックスと同様、短い耳と尻尾の様子がモルモットに似ているが、別の目であり、原始的な特徴をもった有蹄動物である。
南アフリカではダシー (dassies)、スワヒリ語では「ピンビ (pimbi)」「ペレレ (pelele)」「ウィバリ (wibari)」と呼ばれる。ピンビ、ペレレは、今ではハイラックス全部を指す。ケープハイラックスには多くの亜種がある。ロックハイラックスは、アフリカに住む亜種を指すことが多い。
ヘブライ語では שפן סלע (shafan sela) あるいは Rock Shafan と呼ばれるが、Shafan の語源は「隠れる」である[1]。
ケープハイラックスは1対の長い牙を持ち、切歯と大臼歯はサイに似ている。前足は足裏を地に付けており (plantigrade) 、後ろ足はほぼ、踵を付けずに歩く (semi-digitigrade) 。足裏は長く、柔らかく、汗に似た分泌物が出ている。オスはメスよりもやや大きい。
地面や低い木の草・葉を食べる。
ケープハイラックスは生後2年か3年で妊娠 (gestation) し、6〜7ヶ月で出産する。新生児は十分生育しており、目も完全に開いており、毛も生え揃っている。生後2週間で固いエサを食べられるようになり、10週間で離乳する。生後16ヶ月で大人となり、3年で大人と同じ大きさになり、寿命は10年ほどである。
ハイラックスは80匹ぐらいまでの群れを作る。群れはいくつかのグループに分かれており、1グループは1匹のオスが率い、数家族から成る。ハイラックスはほとんどの時間、数匹が群れて、あるいは1匹でひなたぼっこをしていることが多い。これはハイラックスの体温が周囲の気温の影響を受けやすい、つまり恒温動物として未発達であるためとも言われている。
ケープハイラックスの尿などからはヒラセウム (hyraceum) という薬ができ、てんかんや痙攣発作 (convulsions) に効くとされる[誰?]。
ケープハイラックス又はロックハイラックス(Cape Hyrax, Rock Hyrax, Procavia capensis)はイワダヌキ目イワダヌキ科ハイラックス属の1種で、ハイラックス属唯一の現生種である。
他のハイラックスと同様、短い耳と尻尾の様子がモルモットに似ているが、別の目であり、原始的な特徴をもった有蹄動物である。
南アフリカではダシー (dassies)、スワヒリ語では「ピンビ (pimbi)」「ペレレ (pelele)」「ウィバリ (wibari)」と呼ばれる。ピンビ、ペレレは、今ではハイラックス全部を指す。ケープハイラックスには多くの亜種がある。ロックハイラックスは、アフリカに住む亜種を指すことが多い。
ヘブライ語では שפן סלע (shafan sela) あるいは Rock Shafan と呼ばれるが、Shafan の語源は「隠れる」である。
바위너구리(학명: Procavia capensis)는 바위너구리과에 속하는 포유류이며, 케이프바위너구리라고도 일컫는다. 성경에서는 사반이라고 일컫는 동물이다. 바위너구리목에 속한 종 중 현존하는 4종 가운데 하나로,[2] 바위너구리속(학명: Procavia)의 유일종이기도 하다. 매너티와 더불어 현생 코끼리 무리와 유전적으로 가장 가까운 동물이다.[3] 몸길이 약 50cm, 몸무게 약 4kg이다. 털이 짧고 거칠며 밤색 바탕에 흰색 무늬가 있다. 다리·귀·꼬리가 짧다.[4] 수컷이 암컷보다 약간 더 크고 중량이 나가는 편이다. 발에는 불룩한 부분이 있고, 발가락에는 넓적한 발톱이 있다. 바위너구리의 크기는 강수량과 깊은 연관이 있는데, 성장에 영향을 미치는 부분이 있기 때문이다.
대체로 10-80마리가 집단을 이루며 생활하며, 천적의 손아귀로부터 안전하기 위해 바위가 많고 해발고도가 4,200m를 넘어가는 산악 지대에서 산다.[5][6] 경계심이 강하고, 체온 조절이 불안정한 탓에 아침과 저녁에 주로 활동하면서 식물의 뿌리나 줄기를 즐겨 먹으며, 계절과 기후에 따라 행동 양식이 조금씩 차이를 보인다. 수직으로 된 바위를 재빠르게 오르며 점프도 잘 한다. 갓 낳은 새끼는 털이 있고 눈을 떴으며, 낳은 지 수 시간 후에는 뛰어다닌다. 등 중앙에 냄새샘이 있어서 텃세권을 표시하는 데 사용한다. 천적은 비단뱀·표범·독수리 등이다.
각지 개체군이 대개 안정되어 있어 멸종 위기에 처할 우려가 적고, 에티오피아·요르단·이스라엘 등 일부 지역에서는 농업적으로 피해를 끼치고 리슈만편모충증을 옮기는 유해조수이다. 짐바브웨에서 동부 아프리카와 오만 등 일부 아라비아 반도 지역에 걸쳐 분포한다. 현재 중동 지역에서 유일하게 서식하는 아프로테리아상목 동물이다.
바위너구리(학명: Procavia capensis)는 바위너구리과에 속하는 포유류이며, 케이프바위너구리라고도 일컫는다. 성경에서는 사반이라고 일컫는 동물이다. 바위너구리목에 속한 종 중 현존하는 4종 가운데 하나로, 바위너구리속(학명: Procavia)의 유일종이기도 하다. 매너티와 더불어 현생 코끼리 무리와 유전적으로 가장 가까운 동물이다. 몸길이 약 50cm, 몸무게 약 4kg이다. 털이 짧고 거칠며 밤색 바탕에 흰색 무늬가 있다. 다리·귀·꼬리가 짧다. 수컷이 암컷보다 약간 더 크고 중량이 나가는 편이다. 발에는 불룩한 부분이 있고, 발가락에는 넓적한 발톱이 있다. 바위너구리의 크기는 강수량과 깊은 연관이 있는데, 성장에 영향을 미치는 부분이 있기 때문이다.
대체로 10-80마리가 집단을 이루며 생활하며, 천적의 손아귀로부터 안전하기 위해 바위가 많고 해발고도가 4,200m를 넘어가는 산악 지대에서 산다. 경계심이 강하고, 체온 조절이 불안정한 탓에 아침과 저녁에 주로 활동하면서 식물의 뿌리나 줄기를 즐겨 먹으며, 계절과 기후에 따라 행동 양식이 조금씩 차이를 보인다. 수직으로 된 바위를 재빠르게 오르며 점프도 잘 한다. 갓 낳은 새끼는 털이 있고 눈을 떴으며, 낳은 지 수 시간 후에는 뛰어다닌다. 등 중앙에 냄새샘이 있어서 텃세권을 표시하는 데 사용한다. 천적은 비단뱀·표범·독수리 등이다.
각지 개체군이 대개 안정되어 있어 멸종 위기에 처할 우려가 적고, 에티오피아·요르단·이스라엘 등 일부 지역에서는 농업적으로 피해를 끼치고 리슈만편모충증을 옮기는 유해조수이다. 짐바브웨에서 동부 아프리카와 오만 등 일부 아라비아 반도 지역에 걸쳐 분포한다. 현재 중동 지역에서 유일하게 서식하는 아프로테리아상목 동물이다.