en
names in breadcrumbs


As a result of high predation rates, especially of eggs and young, red-winged blackbirds have developed a number of anti-predator adaptations. Group nesting is one such trait which reduces the risk of individual predation by increasing the number of alert parents. Nesting over water reduces the likelihood of predation as do alarm calls. Nests, in particular, offer a strategic advantage over predators in that they are often well concealed in thick, waterside reeds and positioned at a height of one to two meters. Males often act as sentinels, employing a variety of calls to denote the kind and severity of danger. Mobbing, especially by males, is also used to scare off unwanted predators, although mobbing often targets large animals and man-made devices by mistake. The brownish coloration of the female may also serve as an anti-predator trait in that it may provide camouflage for her and her nest (while she is incubating).
Known predators include: racoons, American mink, black-billed magpies, marsh wrens, owls (family Strigidae) and hawks (order Falconiformes).
Known Predators:
Anti-predator Adaptations: aposematic ; cryptic
Despite their consumption of the seeds of unwanted weed pests, red-wing blackbirds have been known to cause great agricultural damage due to their colonial roosting habits and taste for agricultural products. Red-winged blackbirds often open the husks of developing corn stalks to feed on corn kernels. They are also known to feed on rice paddies and sunflower seeds. This consumption of ripening crops has lead many agriculturalists to employ extremely effective and often inhumane tactics in battling red-winged blackbird populations. These tactics include the frequent use of traps, poisons, and Avitol, a chemical agent that causes birds to behave in abnormal ways. Surfactants, or wetting agents, have also caused considerable damage to red-winged blackbirds. These detergents break down the waterproofing properties of the blackbird's feathers making them extremely vulnerable to low temperatures. Because of the long history of human-blackbird conflict and their continued threat to agricultural initiatives many of these techniques are used to this day. Less harmful methods of red-winged blackbird control include the use of noisemakers and the reduction of post-harvest crop waste, which attracts hungry red-winged blackbirds to farmland.
Negative Impacts: crop pest
Red-winged blackbirds have been known to feed on the seeds of numerous weeds that are detrimental to agricultural production. They also control insect populations, which can devastate agricultural yields.
Positive Impacts: controls pest population
As highly generalized foragers and predators, red-winged blackbirds can have a great and lasting impact on their environment. By controlling insect populations through predation and weed populations through the consumption of seeds, red-winged blackbirds allow larger plants and crops to flourish. Paradoxically, red-winged blackbirds can also devastate plant growth and crop yields by feeding on the very plants their predation protects. As one of the most numerous species of birds on the continent, red-winged blackbirds also play key roles in the dispersal of other species. Because red-winged blackbirds tend to flock and roost in such large numbers the survival of other species of birds that encroach upon their territory must surely be affected by their presence. Large roosting habitats can also greatly affect the physical terrain. In short, red-winged blackbirds are so numerous and active that their presence and natural behavior alone is enough to impact an ecosystem in a very visible way.
Ecosystem Impact: disperses seeds
Red-winged blackbirds tend to be generalized feeders, consuming a greater amount of plant tissue in the non-breeding season and a greater amount of animal material in the breeding season. Red-winged blackbirds will feed on almost any plant material they can consume, preferring seeds and agricultural products, such as corn and rice. Adult red-winged blackbirds will consume a wide variety of foods including snails, frogs, fledgling birds, eggs, carrion, worms and a wide array of arthropods. Insects, especially Odonata (dragonflies and damselflies), Lepidoptera (butterflies and moths), and Diptera (true flies) are preferred, although arachnids and other insect and non-insect arthropods are consumed. For the most part, red-winged blackbirds feed on whatever they can find, picking insects out of plants and feeding on seeds and plant material. At times, red-winged blackbirds will hunt using their beaks for gaping (opening up of crevices in plant material with the beak). Red-winged blackbirds will also catch insects in flight.
Animal Foods: birds; amphibians; reptiles; eggs; carrion ; insects; terrestrial non-insect arthropods; terrestrial worms
Plant Foods: roots and tubers; wood, bark, or stems; seeds, grains, and nuts
Primary Diet: omnivore
As one of the most common, widespread, and numerous birds in North America, little is done to protect red-winged blackbirds from the effects of habitat loss and urbanization. Because they can survive in a wide array of habitats, many populations can overcome losses of natural terrain. Nonetheless, red-winged blackbirds thrive in wetland areas and with the loss of natural wetlands it is likely that this species will suffer. This species is a migratory bird, and is protected under the U.S. Migratory Bird Treaty Act.
US Migratory Bird Act: protected
US Federal List: no special status
CITES: no special status
State of Michigan List: no special status
IUCN Red List of Threatened Species: least concern
The range of red-winged blackbirds extends from southern Alaska at its northern most point, to the Yucatan peninsula in the south and covers the greater part of the continent reaching from the Pacific coast of California and Canada to the eastern seaboard. Winter ranges for red-winged blackbirds vary by geographic location. Northern populations migrate south to the southern United States and Central America beginning in September or October (or occasionally as early as August). Most western and middle American populations are non-migratory.
Biogeographic Regions: nearctic (Native ); neotropical (Native )
Red-winged blackbirds roost and breed in a variety of habitats, but tend to prefer wetlands. They have been known to live in fresh and saltwater marshes. On drier ground, red-winged blackbirds gravitate towards open fields (often in agricultural areas) and lightly wooded deciduous forests. In winter red-winged blackbirds are most often found in open fields and croplands.
Habitat Regions: temperate ; tropical ; terrestrial
Terrestrial Biomes: savanna or grassland
Aquatic Biomes: brackish water
Wetlands: marsh ; swamp
Other Habitat Features: suburban ; agricultural ; riparian ; estuarine
In the wild, red-winged blackbirds live 2.14 years, on average. The olded recorded red-winged blackbird in the wild lived 15 years and 9 months.
Range lifespan
Status: wild: 20 (high) years.
Average lifespan
Status: wild: 2.14 years.
Average lifespan
Status: wild: 189 months.
Easily distinguished by their glossy black feathers and red and yellow epaulets at the shoulder, males are the more brightly colored of the two sexes. Females tend to be dusty or brownish in color with dark stripes on their undersides. Females resemble large sparrows and are often recognized by their off-white eyebrow markings. Both males and females have dark legs and claws. The beak of male red-winged blackbirds tends to be totally black, whereas the beak of female red-winged blackbirds is dark brown on top with lighter brown on the underside. Both males and females have sharply pointed beaks.
Both male and female adult red-winged blackbirds are approximately 22 cm long, weigh 41.6 to 70.5 g and have a wingspan of 30 to 37 cm. Young males and females resemble adult females in coloration. Males undergo a transitional stage in which red epaulets appear orange in color before reaching their adult coloration. Olson (1994) showed that the average basal metabolic rate for adults in his experiments was 656 cm cubed/oxygen per minute and that the rate for three-day-old birds was 296 cm cubed/oxygen per minute.
Range mass: 41.6 to 70.5 g.
Range length: 18 to 24 cm.
Average length: 22 cm.
Range wingspan: 30 to 37 cm.
Other Physical Features: endothermic ; homoiothermic; bilateral symmetry
Sexual Dimorphism: male larger; sexes colored or patterned differently; male more colorful
Males learn songs from other males. Both males and females have a variety of calls, some of which are the same. Only the males produce flight calls, which signal their exit from the territory. Both males and females employ distress and alarm calls which differ with the nature of the threat. Specific calls seem to communicate the presence of specific predators, such as raccoons or American crows. Short contact calls are also quite common, especially between a territorial male and the females in his territory. Threat calls are used to ward off predators, other birds and other red-winged blackbirds. Courtship calls vary little between males and females and are used only in the breeding season. Male songs are used to announce territorial boundaries and to attract mates. Female songs occur in the early breeding season and are most common before the incubation period.
Male red-winged blackbirds utter their familiar territorial and mate attraction song of "oak-a-lee" or "konkeree" in the spring. The last syllable is given more emphasis as a scratchy or buzzy trill. The common call used by both males and females is a "check" call. Males may utter a whistled "cheer" or "peet" call if alarmed. Other calls made by the male include a "seet," a "chuck," or a "cut." Females may utter a short chatter or sharp scream. A pre-mating call, "ti-ti-ti," may be uttered by both sexes.
Visual displays are also a key form of communication, especial before and during mating. Males often use visual displays in order to attract females to their territories and to defend their territories and mates. An example is the "song spread" display. Males fluff their plumage, raise their shoulders, and spread their tail as they sing. As the display becomes more intense, the wings are more arched with the shoulders showing more prominently. Females will also engage in a "song spread" display directed at each other early in the breeding season. One possibility is that a female will defend a sub-territory within the male's territory. Females will engage in a "wing flip" display when a disturbance prevents them from returning to the nest.
Communication Channels: visual ; acoustic
Perception Channels: visual ; tactile ; acoustic ; chemical
Red-winged blackbirds are extremely polygynous with as many as 15 females nesting in the territory of a single male. On average, a single male has roughly 5 females. Although copulation occurs mostly between the sovereign male and those females that inhabit his territory, roaming males are known to mate with the females on other territories. These behaviors seem to increase the chances of successful reproduction within a given mating season, compensating for broods and individuals lost to nest-predation and nest parasitism.
Mating rituals begin with the song of the male. Females often do not return songs until they have established themselves in the territory of a male. Male pre-coital displays include vocalization in a crouched position with rapid and highly conspicuous fluttering of the wings. The female responds with a similar crouch and vocalization. Mating occurs in the egg-laying period or just prior and is characterized by a brief contact between the cloacal vents of the male and the female.
Mating System: polygynous ; polygynandrous (promiscuous)
Breeding begins in the early spring and continues until mid-summer. Females may raise as many as three broods in a single season, although the average is 1.7 broods per season. Females choose nesting sites most often in wetland or agricultural areas (although a wide variety of nesting habitats are know to be exploited) and males perform a nesting display, which constitutes his main involvement in the nest building process. Nest building begins between March and May. Usually, the further south you go, the earlier the nest is built. After a female accepts the male and his site, the nest is built in or near marshland or moist, grassy areas. Plant materials, such as cattail stalks, are woven together to form a basket above water level, and soft materials are used to line the nest. Three to five pale greenish-blue, black or purple streaked eggs are laid per clutch. Each egg is approximately 2.5 by 1.8 cm. Nests can be completed in as little as a single day, especially if no mud-lining is constructed.
Clutch size is from 3 to 7 eggs and the eggs are incubated for 3 to 11 days. Chicks fledge in 10 to 14 days and are independent in 2 to 3 weeks. Juveniles usually reach sexual maturity in 2 to 3 years.
Breeding interval: Females may raise as many as three broods in a single season, although the average is 1.7 broods per season.
Breeding season: Breeding begins in the early spring and continues until mid-summer.
Range eggs per season: 3 to 7.
Average eggs per season: 4.
Range time to hatching: 11 to 13 days.
Average time to hatching: 11 days.
Range fledging age: 14 to 10 days.
Average fledging age: 14 days.
Range time to independence: 2 to 3 weeks.
Average time to independence: 2 weeks.
Range age at sexual or reproductive maturity (female): 2 to 2 years.
Range age at sexual or reproductive maturity (male): 2 to 4 years.
Key Reproductive Features: iteroparous ; seasonal breeding ; gonochoric/gonochoristic/dioecious (sexes separate); sexual ; fertilization ; oviparous
Average eggs per season: 4.
Incubation is the sole responsibility of females. Red-winged blackbird eggs tend to hatch at different times and the mother will continue to incubate until the last egg has hatched. Nestlings are fed almost immediately after hatching. Parents often begin with smaller portions and increase food amounts progressively. Young red-winged blackbirds are fed small arthropods, especially Odonata (dragonflies and damselflies), Lepidoptera (moths and butterflies), and Diptera (true flies). The nestlings are fed primarily by the female although the male will, at times, take part in the feeding process. In cases in which the mother is absent, males are known to take over feeding responsibilities for the brood. Fledglings leave the nest after 14 days and are fed by the female and, to a lesser degree, the male for two to three weeks before joining a flock of females. Within a year most red-winged blackbirds have joined mixed flocks.
Parental Investment: no parental involvement; altricial ; pre-fertilization (Protecting: Female); pre-hatching/birth (Protecting: Female); pre-weaning/fledging (Provisioning: Male, Female, Protecting: Male, Female); pre-independence (Provisioning: Male, Female, Protecting: Male, Female)
A small (7-9 ½ inches) blackbird, the male Red-winged Blackbird is most easily identified by its small size, black body, and red-and-yellow “shoulder” patches visible as part of the male’s display. Female Red-winged Blackbirds are streaked brown overall with faint tan eye-stripes. Males are unmistakable when their bright patches are visible, and no other female blackbird in North America is so heavily streaked. The Red-winged Blackbird breeds primarily from Alaska and northwestern Canada south to northern Central America. In winter, northerly-breeding populations migrate south to the southern U.S. Populations breeding further south are generally non-migratory. Red-winged Blackbirds breed in wetland habitats, including freshwater and saltwater marshes, damp grasslands, and flooded fields where rice is grown. Birds that migrate utilize similar habitats in the winter as in summer. Red-winged Blackbirds primarily eat insects during the summer, switching to a diet composed of seeds and grains in the winter. In appropriate habitat, Red-winged Blackbirds are most easily seen while foraging for food on the stalks and leaves of marsh grasses. During the breeding season, males may be observed displaying their “shoulder” patches from prominent perches in the grass while singing this species’ buzzing “konk-la-ree” song. Red-winged Blackbirds are primarily active during the day.
A small (7-9 ½ inches) blackbird, the male Red-winged Blackbird is most easily identified by its small size, black body, and red-and-yellow “shoulder” patches visible as part of the male’s display. Female Red-winged Blackbirds are streaked brown overall with faint tan eye-stripes. Males are unmistakable when their bright patches are visible, and no other female blackbird in North America is so heavily streaked. The Red-winged Blackbird breeds primarily from Alaska and northwestern Canada south to northern Central America. In winter, northerly-breeding populations migrate south to the southern U.S. Populations breeding further south are generally non-migratory. Red-winged Blackbirds breed in wetland habitats, including freshwater and saltwater marshes, damp grasslands, and flooded fields where rice is grown. Birds that migrate utilize similar habitats in the winter as in summer. Red-winged Blackbirds primarily eat insects during the summer, switching to a diet composed of seeds and grains in the winter. In appropriate habitat, Red-winged Blackbirds are most easily seen while foraging for food on the stalks and leaves of marsh grasses. During the breeding season, males may be observed displaying their “shoulder” patches from prominent perches in the grass while singing this species’ buzzing “konk-la-ree” song. Red-winged Blackbirds are primarily active during the day.
La merla ala-roja[1] (Agelaius phoeniceus) és un ocell de la família dels ictèrids (Icteridae) que habita zones palustres i terres de conreu d'Amèrica del Nord i Central, des de l'est d'Alaska cap al sud, a través de Canadà, Estats Units i Mèxic fins al nord de Costa Rica i les Bahames.
La merla ala-roja (Agelaius phoeniceus) és un ocell de la família dels ictèrids (Icteridae) que habita zones palustres i terres de conreu d'Amèrica del Nord i Central, des de l'est d'Alaska cap al sud, a través de Canadà, Estats Units i Mèxic fins al nord de Costa Rica i les Bahames.
Aderyn a rhywogaeth o adar yw Tresglen adeingoch (sy'n enw benywaidd; enw lluosog: tresglod adeingoch) a adnabyddir hefyd gyda'i enw gwyddonol Agelaius phoeniceus; yr enw Saesneg arno yw Red-winged blackbird. Mae'n perthyn i deulu'r Tresglod (Lladin: Icteridae) sydd yn urdd y Passeriformes.[1]
Talfyrir yr enw Lladin yn aml yn A. phoeniceus, sef enw'r rhywogaeth.[2] Mae'r rhywogaeth hon i'w chanfod yng Ngogledd America.
Mae'r tresglen adeingoch yn perthyn i deulu'r Tresglod (Lladin: Icteridae). Dyma rai o aelodau eraill y teulu:
Rhestr Wicidata:
rhywogaeth enw tacson delwedd Casig Para Psarocolius bifasciatus Gregl y Gorllewin Quiscalus nigerAderyn a rhywogaeth o adar yw Tresglen adeingoch (sy'n enw benywaidd; enw lluosog: tresglod adeingoch) a adnabyddir hefyd gyda'i enw gwyddonol Agelaius phoeniceus; yr enw Saesneg arno yw Red-winged blackbird. Mae'n perthyn i deulu'r Tresglod (Lladin: Icteridae) sydd yn urdd y Passeriformes.
Talfyrir yr enw Lladin yn aml yn A. phoeniceus, sef enw'r rhywogaeth. Mae'r rhywogaeth hon i'w chanfod yng Ngogledd America.
Vlhovec červenokřídlý (Agelaius phoeniceus) je středně velký druh pěvce z čeledi vlhovcovitých (Icteridae).
Samice dorůstají 17–18 cm a váží 36 g, samci jsou 22–24 cm dlouzí a jejich průměrná hmotnost činí 64 g.[2]
Je sexuálně dimorfní; samci jsou celí černí s velkou červenou skvrnou na křídlech, z jedné strany ohraničenou silným žlutým pruhem. Samice jsou převážně hnědé se světlou, hustě černě pruhovanou spodinou těla.
Vlhovec červenokřídlý je široce rozšířen na většině severoamerického kontinentu. Hnízdí v rozmezí od Aljašky a Newfoundlandu jižně až po Floridu, Mexiko a Guatemalu, izolované populace se vyskytují také na západě El Salvadoru, na severozápadě Hondurasu a v severozápadní Kostarice. Severní populace jsou tažné se zimovišti na jihu Spojených států a v Mexiku, zatímco ptáci ze západní části severoamerického kontinentu a ze Střední Ameriky na svých hnízdištích setrvávají po celý rok. Obývá otevřené travnaté krajiny. Preferuje přitom mokřiny, a to jak se sladkou, tak i se slanou vodou. Dále se vyskytuje také v suchých náhorních oblastech, kde obývá louky, prérie a neudržovaná pole.[3]
Vlhovec červenokřídlý bývá při obraně svého teritoria velmi agresivní. Dokáže přitom napadnout i mnohem větší ptáky, než je on sám, např. vrány, havrany, straky, dravce či volavky.[4]
Je všežravý. Živí se zejména semeny a hmyzem, ale požírá také žáby, ptačí vejce, mršiny, červy, pavouky a měkkýše.[5]
Je polygamní, jeden samec obhajuje teritorium až s 10 samicemi. Na 3-6 denní stavbě miskovitého hnízda z travin a mechu, zpevněného hlínou a připevněného nejčastěji k rákosovým stéblům, se podílí samotná samice. V jedné snůšce bývají 3-4, zřídka i 5 zeleno-modrých, tmavě skvrnitých vajec. Na jejich 11-12 denní inkubaci se opět podílí pouze samice. Mláďata se líhnou slepá a neopeřená a hnízdo opouští po 11-14 dnech.[2]
V tomto článku byl použit překlad textu z článku Red-winged Blackbird na anglické Wikipedii.
Vlhovec červenokřídlý (Agelaius phoeniceus) je středně velký druh pěvce z čeledi vlhovcovitých (Icteridae).
Der Rotflügelstärling (Agelaius phoeniceus), früher auch rotschulteriger Star oder Sumpfhordenvogel genannt[1], ist ein Vogel aus der Familie der Stärlinge (Icteridae). Er ist einer der bestuntersuchten Singvögel in Nordamerika.
Die erste Zeichnung eines Rotflügelstärlings wurde von Mark Catesby angefertigt. Anhand seiner Zeichnung beschrieb Carl von Linné 1766 den Vogel wissenschaftlich.
Das Männchen hat ein unverwechselbares schwarzes Gefieder mit roten Flügelflecken, die von kleinen gelben oder weißen Streifen eingefasst sind. Das Weibchen und die Jungvögel haben ein gestreiftes, schwarzbraunes bis braunes Gefieder. Die Körpergröße beträgt zwischen 18 und 24 Zentimeter bei einer Flügelspannweite von 30 bis 37 Zentimeter. Der Schnabel ist spitz und scharf und an den kräftigen Beinen befinden sich an den Füßen vier Zehen; eine nach hinten und drei nach vorne. Der Geruchssinn ist schwach entwickelt, jedoch sehen und hören sie gut. Durch Markierung wilder Rotflügelstärlinge mit einem Band wurde ein Höchstalter von 15 Jahren und 9 Monaten festgestellt.
Charakteristisch ist der ständige trillernde Ruf des Männchens. Beim Singen spreizt das Männchen die Flügel und stellt die roten Flügelflecken zur Schau, um seinen Territorialanspruch gegenüber anderen Männchen oder dem stilleren Weibchen geltend zu machen. Mit seinen Rufen lockt er während der Paarungszeit auch die Weibchen an.
Der Rotflügelstärling ernährt sich im Sommer von Spinnen, Samen, Körner, Käfern, Schmetterlingen und anderen Insekten. Auch von Früchten wie Blaubeeren und Brombeeren. Die Insekten werden in der Luft gefangen oder am Boden. Im Winter ernähren sie sich überwiegend von Samen und Körnern. Sehr gerne werden reife Sonnenblumenkerne gefressen.
Bei den Rotflügelstärlingen gibt es keine festen Partnerschaften. Während die Männchen normalerweise einige Jahre hintereinander dieselbe Gegend aufsuchen, wechseln die Weibchen jedes Jahr das Brutgebiet. Die Fortpflanzung findet zwischen Februar und August statt. Nachdem die Männchen in den Brutgebieten eingetroffen sind, sucht sich jedes ein eigenes Brutrevier. Nach etwa zehn Tagen treffen die Weibchen in den Brutgebieten ein.
Die tiefen Nester bestehen aus Gräsern, Sumpfgras oder Schilf und werden alleine vom Weibchen über Wasser im Sumpfgras oder in Büschen erbaut. Das Männchen beteiligt sich weder am Nestbau noch am Ausbrüten der Eier. In das beutelförmige Nest werden vier bis fünf hellblaue, braun gefleckte Eier gelegt. Nach etwa 12 Tagen schlüpfen die blinden und nackten Jungen. Beide Altvögel beteiligen sich an der Aufzucht der Jungen. Die Küken werden am Anfang mit Insekten gefüttert. Im späteren Verlauf werden von den Altvögeln Körner gereicht. Mit 14 Tagen sind die Jungen flügge.
In einer Brutperiode werden zwei- bis dreimal Junge aufgezogen. Für jedes Gelege wird ein neues Nest gebaut.
Der Rotflügelstärling wird unter anderem von Füchsen, Eulen oder Habichten gejagt. Die Jungvögel und Eier werden von Würgern und Krähen erbeutet. Im Wasser lauern Wasserschlangen, Fische und Frösche auf herabfallende Jungvögel. Im nordwestlichen Verbreitungsgebiet wird der Rotflügelstärling häufig von dem größeren Gelbkopf-Schwarzstärling (Xanthocephalus xanthocephalus) in der Brutzeit näher an das Ufer gedrängt, wo er durch räuberische Landtiere stärker gefährdet ist.
Um die Bedrohung durch Fressfeinde frühzeitig zu sichten, sitzen die männlichen Rotflügelstärlinge häufig auf der Spitze der Schilfpflanzen über den Nestern oder in der Nähe der Nester. Bei den Krähen zum Beispiel, die eine Gefahr für die Eier und Jungvögel stellen, fliegt der männliche Rotflügelstärling sofort auf, wenn er die Krähe sichtet, um sie nicht auf das Nest aufmerksam zu machen. Durch dieses Verhalten macht er auch die Altvögel in der Nachbarschaft auf die drohende Gefahr aufmerksam und schützt somit deren Brut. Eine frühzeitige Sichtung wird an Sümpfen durch fehlende Bäume ermöglicht, die nicht die Sicht versperren.
Der anpassungsfähige Rotflügelstärling ist ein häufiger Bewohner der flussnahen Sumpfgebiete, nasstrockenen Wiesen, Weiden oder Felder in Nordamerika. Als Zugvogel verbringt er den Winter in Mittel- und Südnordamerika. Von Baja California bis zu Florida. Weitere Vorkommen gibt es in Costa Rica, Kuba und den Bahamas. Im Frühjahr zieht er in großen Schwärmen in die Brutgebiete in den Norden von Nordamerika; unter anderem südöstliches Alaska und Kanada.
Der gesellige Rotflügelstärling sammelt sich außerhalb der Brutzeit, meist nachdem die letzte Brut flügge ist, in großen Gruppen. Einerseits vertilgen sie große Mengen von schädlichen Insekten, auf der anderen Seite richten sie zum Ärger vieler Landwirte beträchtliche Schäden an Obstplantagen oder Getreidefeldern an. Viele Rotflügelstärlinge werden von den Landwirten mit vergiftetem Reis getötet. Die Vögel sterben nach zwei bis drei Tagen an der Zerstörung der Nieren.
Trotz dieser Bekämpfungsmaßnahme hat sich die Anzahl der Rotflügelstärlinge ständig erhöht. Die Landwirte bauten mehr Getreide an, sodass die Vögel die rauen Winter überleben konnten. Ein weiterer Grund ist die Häufigkeit von milden Wintern. In South Dakota hat sich die Anzahl der Sumpfpflanzen vergrößert, sodass mehr Gelege ausgebrütet wurden. Eine Studie in North- und South Dakota kam zum Ergebnis, dass der Bestand sich dort zwischen 1996 und 1999 um 33 % erhöht hat.
Eine gewisse Bekanntheit erreichte die Art, weil es im Winter 2010–2011 in den USA zu einem rätselhaften Vogelsterben kam. Rund 500 Kilometer nördlich von Pointe Coupee fielen nach der Silvesternacht am 1. Januar 2011 massenhaft Vögel vom Himmel und wurden tot aufgesammelt. Experten rätselten, warum dort tausende Vögel über dem Städtchen Beebe vom Himmel stürzten. Es handelte sich zumeist um Rotflügelstärlinge. Tiermediziner der staatlichen Veterinärkommission schlossen in ihrem vorläufigen Bericht aus, dass Krankheiten oder Viren für den massenhaften Tod verantwortlich seien. Alle wichtigen Organe seien gesund gewesen. Die Vögel könnten durch Silvesterböller aufgeschreckt worden und in der Nacht umhergeflogen sein, was sie sonst nicht tun, da sie im Dunkeln schlecht sehen können. Eine Ornithologin, die für eine staatliche Behörde arbeitet, sagte, die Rotflügelstärlinge hätten Anzeichen eines physischen Traumas aufgewiesen. Möglich sei auch, dass der Schwarm von einem Blitz oder Hagel in großer Höhe getroffen worden sei.[2] Mindestens ein Teil der Vögel wurden durch vom US-Landwirtschaftsministerium ausgelegtes Gift getötet. Sie hatten durch Fraß und Kot Schäden an Futterstellen verursacht.[3]
Es sind zweiundzwanzig Unterarten bekannt:[4]
Zu dem Rotflügelstärling gibt es überwiegend nur englische Literatur:
Der Rotflügelstärling (Agelaius phoeniceus), früher auch rotschulteriger Star oder Sumpfhordenvogel genannt, ist ein Vogel aus der Familie der Stärlinge (Icteridae). Er ist einer der bestuntersuchten Singvögel in Nordamerika.
Die erste Zeichnung eines Rotflügelstärlings wurde von Mark Catesby angefertigt. Anhand seiner Zeichnung beschrieb Carl von Linné 1766 den Vogel wissenschaftlich.
Çûkreşê çengsor yan baskesor (Agelaius phoeniceus), cureyekî fîkaran e ku li pir waran li parzemîna Amerîkaya Bakur û navîn dijî ye.[2]
Çûkreşê çengsor yan baskesor (Agelaius phoeniceus), cureyekî fîkaran e ku li pir waran li parzemîna Amerîkaya Bakur û navîn dijî ye.
Bergeha paşî ya A. p. gubernator
Çûkreşê çengsor ê mê
Çûkreşa çengsor
The red-winged blackbird (Agelaius phoeniceus) is a passerine bird of the family Icteridae found in most of North America and much of Central America. It breeds from Alaska and Newfoundland south to Florida, the Gulf of Mexico, Mexico, and Guatemala, with isolated populations in western El Salvador, northwestern Honduras, and northwestern Costa Rica. It may winter as far north as Pennsylvania and British Columbia, but northern populations are generally migratory, moving south to Mexico and the Southern United States. Claims have been made that it is the most abundant living land bird in North America, as bird-counting censuses of wintering red-winged blackbirds sometimes show that loose flocks can number in excess of a million birds per flock and the full number of breeding pairs across North and Central America may exceed 250 million in peak years. It also ranks among the best-studied wild bird species in the world.[2][3][4][5][6] The red-winged blackbird is sexually dimorphic; the male is all black with a red shoulder and yellow wing bar, while the female is a nondescript dark brown. Seeds and insects make up the bulk of the red-winged blackbird's diet.
The red-winged blackbird is one of five species in the genus Agelaius and is included in the family Icteridae, which is made up of passerine birds found in North and South America.[7] The red-winged blackbird was formally described as Oriolus phoeniceus by Carl Linnaeus in 1766 in the twelfth edition of his Systema Naturae,[8] but was later moved with the other American blackbirds to the genus Agelaius by Louis Jean Pierre Vieillot in 1816.[9] Linnaeus specified the type location as "America" but this was restricted to Charleston, South Carolina in 1928.[10][11] The genus name is derived from Ancient Greek agelaios, meaning "gregarious". The specific epithet, phoeniceus, is Latin meaning "crimson" or "red".[12] The red-winged blackbird is a sister species to the red-shouldered blackbird (Agelaius assimilis) that is endemic to Cuba. These two species are together sister to the tricolored blackbird (Agelaius tricolor) that is found on the Pacific coast region of the California and upper Baja California in Mexico.[13][14]
Depending on the authority, between 20 and 24 subspecies are recognised which are mostly quite similar in appearance.[15][16] However, there are two isolated populations of bicolored blackbirds that are quite distinctive: A. p. californicus of California and A. p. gubernator of central Mexico. The taxonomy and relationships between these two populations and with red-winged blackbirds is still unclear.[17] Despite the similarities in most forms of the red-winged blackbird, in the subspecies of Mexican Plateau, A. p. gubernator, the female's veining is greatly reduced and restricted to the throat; the rest of the plumage is very dark brown,[18][19] and also in a different family from the European redwing and the Old World common blackbird, which are thrushes (Turdidae).[20] In the California subspecies, A. p. californicus and A. p. mailliardorum, the veining of the female specimens also covers a smaller surface and the plumage is dark brown, although not in the gubernator grade;[19] and also its superciliary list is absent or poorly developed.[18] The male subspecies mailliardorum, californicus, aciculatus, neutralis, and gubernator lack the yellow band on the wing that is present in most male members of the other subspecies.[18][16] The red-shouldered blackbird was formerly considered as a subspecies of red-winged blackbird. They were split by the American Ornithologists' Union in 1997.[21]
Listed below are the red-winged blackbird subspecies and groups of subspecies recognized as of January 2014 with their respective distribution areas and the location of their wintering quarters:[16]
The common name for the red-winged blackbird is taken from the mainly black adult male's distinctive red shoulder patches, or epaulets, which are visible when the bird is flying or displaying.[22] At rest, the male also shows a pale yellow wingbar. The spots of males less than one year old, generally subordinate, are smaller and more orange than those of adults.[23] The female is blackish-brown and paler below. The female is smaller than the male, at 17–18 cm (6.7–7.1 in) long and weighing 41.5 g (1.46 oz), against his length of 22–24 cm (8.7–9.4 in) and weight of 64 g (2.3 oz).[24] The smallest females may weigh as little as 29 g (1.0 oz) whereas the largest males can weigh up to 82 g (2.9 oz).[25] Each wing can range from 8.1–14.4 cm (3.2–5.7 in), the tail measures 6.1–10.9 cm (2.4–4.3 in), the culmen measures 1.3–3.2 cm (0.51–1.26 in) and the tarsus measures 2.1 cm (0.83 in).[17] The upper parts of the female are brown, while the lower parts are covered by an intense white and dark veining;[26] also presents a whitish superciliary list.[27][28] According to Crawford (1977), females exhibit a salmon-pink stain on the shoulders and a light pink color on the face and below this when they are a year old, while older females show a stain usually more crimson on the shoulders and a darker pink hue on and under the face.[29] Observations in females in captivity indicate that small amounts of yellow pigment are present on the shoulders of these after leaving the nest, that the concentration of the pigment increases with the first winter plumage after the change of the feathers and that the passage from yellow to orange generally takes place in the second summer with the acquisition of the second winter plumage, after which no further changes in feather color occur.[30] The colored area on the wing increases in surface with the age of the female,[31] and varies in intensity from brown to a bright red-orange similar to that of the males in their first year.[32]
Young birds resemble the female, but are paler below and have buff feather fringes. Both sexes have a sharply pointed bill. The tail is of medium length and is rounded. The eyes, bill, and feet are all black.[27] Unlike most North American passerines which develop their adult plumage in their first year of life so that the one-year-old and the oldest individual are indistinguishable in the breeding season, the red-winged blackbird does not. It acquires its adult plumage only after the breeding season of the year following its birth when it is between thirteen and fifteen months of age.[33] Young males go through a transition stage in which the wing spots have an orange coloration before acquiring the most intense tone typical of adults.[28]
The male measures between 22 and 24 cm (8.7 and 9.4 in) in length, while the female measures 17 or 18 cm (6.7 or 7.1 in).[18] Its wingspan is between 31 and 40 cm (12 and 16 in) approximately.[18] Both the peak male and the legs, the claws and the eyes are black;[34][28][35] in the female beak is dark brown and clear in the upper half at the bottom,[28] and the tail is medium in length and rounded.[27] As in other species polygyny exists, the red-winged blackbird exhibit considerable sexual dimorphism both in plumage and size, males weighing between 65 and 80g the females about 35g.[36] Males are 50% heavier than females, 20% larger in its linear dimensions,[37] and 20% larger compared to the length of their wings.[38] The trend towards greater dimorphism in the size of non-monogamous ichterid species indicates that the larger size of males has evolved due to sexual selection.[38]
The male is unmistakable except in the far west of the US, where the tricolored blackbird occurs. Males of that species have a darker red epaulet edged with white, not yellow. Females of tricolored, bicolored, red-shouldered and red-winged blackbirds can be difficult to identify in areas where more than one form occurs. In flight, when the field marks are not easily seen, the red-winged blackbird can be distinguished from less closely related icterids such as common grackle and brown-headed cowbird by its different silhouette and undulating flight.[17]
Two keto-carotenoids – carotenoid with a ketone group – reds synthesized by the birds themselves – namely astaxanthin and canthaxanthin – are responsible for the bright red color of the wing spots, but two yellow dietary precursor pigments – lutein and zeaxanthin – are also present in moderately high concentrations in red feathers. Astaxanthin is the carotenoid more abundant (35% of the total), followed by lutein (28%), canthaxanthin (23%) and zeaxanthin (12%). Such a balanced combination of dietary precursors and metabolic derivatives in colored feathers is quite unusual, not only within a species as a whole but also in individuals and particular feathers.[39]
After removing the carotenoids in an experiment, the red feathers acquired a deep brown coloration. This is because the feather barbles of the colored spot contain melanin pigments – mainly eumelanin, which was equivalent to 83% of all melanins, but also pheomelanin at a concentration approximately equal to that of carotenoids, which seems to be a rare trait for carotenoid-based ornamental plumage. On the other hand, the feathers of the yellow stripes of the males are devoid of carotenoids —except occasionally when they appear tinged with a pink coloration derived from small amounts of said pigments— and present high concentrations of pheomelanin —82% of all melanins. Melanin concentrations in the yellow band are even higher than in the red spot.[39]
These markings are vital in the defense of the territory.[40] Males with larger spots are more effective at chasing away their non-territorial rivals and are more successful in contests within aviaries.[41][42][43] When the red shoulder patches were dyed black as part of an experiment, 64% of males lost their territories, while only 8% of control subjects did. However, males whose wings had been dyed before they had mated could still attract females and successfully reproduce. In the red-winged blackbird, the spots on the wings are a sign of threat among males and have an unimportant role, if any, in intersex encounters. Therefore, the spots are likely to have evolved in response to pressures linked to intrasexual selection.[44] Additionally, neither the size nor the coloration of the same are linked to the reproductive success of the males with those females that are not their mates, that is, those with which they eventually mate.[40] It has been suggested that also in the case of females, the best explanation for the evolution of a variable coloration in the shoulder spots is that their intensity indicates their physical condition in aggressive encounters between them.[32]
The fact that female red-winged blackbirds do not appear to consistently use variability in the size and color of male wing spots when choosing a mate runs counter to the classic role of carotenoid pigmentation ornamental feathers, mostly used in the attraction of a couple. In turn, its use as a sign of aggressiveness and social status against rival males is not a common trait in carotenoid ornaments. On the other hand, ornaments with a preponderance of melanin do tend to have an important role as an indicator of status in avian populations, so the spots of red-winged blackbirds seem to work more as melanin ornaments than as carotenoids.[39]

The calls of the red-winged blackbird are a throaty check and a high slurred whistle, terrr-eeee. The male's song, accompanied by a display of his red shoulder patches, is a scratchy oak-a-lee,[45] except that in many western birds, including bicolored blackbirds, it is ooPREEEEEom.[46] The female also sings, typically a scolding chatter chit chit chit chit chit chit cheer teer teer teerr.[17]
The most critical period of feather molting runs from late August to early September. When viewed in flight, they have a misaligned or "moth-eaten" appearance and generally slower and more laborious travel. Their mobility is reduced due to the lack of several remiges or rectrices or these are not entirely renewed. Most of the red-winged blackbirds have moved almost entirely by October. By then, some birds have not completed the molt of the feathers of the capital region and the helmsmen of the center of the tail and the internal secondary sprouts have only partially emerged from the pod. Virtually all individuals have completed their molts by mid-October.[47]
Birds do not begin their migration to wintering quarters until the two outer primary sprouts and the two inner or central rectrices have completed at least two-thirds of their development. Therefore, there is a correlation between molting, particularly replacement of the remiges and rectrices, and fall migration in red-winged blackbirds.[47]
Despite the fact that the brown or white tips on the feathers of the males are larger just after the molt and that they wear out throughout the year, the individuals vary considerably regarding the size of these non-black tips on the feathers in spring.[49]
Complete replacement of wing feathers takes about eight weeks. However, birds in their first year frequently retain some of the under-wing coverts and juvenile tertiary remiges after post-juvenile moulting. Of seventy immature males examined during the last week of October, it retained 70% of older lower primary blankets. In most cases where partial replacement of the covert feathers occurs, it is the proximal coverts that the bird retains.[47]
Primary remiges are one of the first feathers to molt. The molt of these feathers proceeds regularly from the innermost primary—primary I—to the outermost—primary IX. By October 1, most birds have either acquired the three new external primaries—VII, VIII, and IX—or they are at some advanced stage of development. The average dates for completion of the development of the new primary springs are: August 15 for primary I; September 1, primary II-IV; September 15, primary V and VI; and October 1, primaries VII-IX.[47]
The molting of the secondary remiges begins with the most external—secondary I— and proceeds inward to secondary VI. The secondary I sheath appears around the same time that all the secondary covers have been replaced and rarely before mid-August. These feathers are not completely renewed until the beginning of October.[47]
The molt of the tertiary remiges begins more or less at the same time as that of the secondary ones. The middle tertiary falls first, followed by the internal tertiary. Both feathers are often well developed again before the outer tertiary leaves the sheath.[47]
The major primary blankets are changed along with their respective primary springs. Unlike the major primary coats, the major secondary coats molt earlier than the secondary spruces. The molting of these feathers is rapid, with several of them at the same stage of development simultaneously. The progression of the molt in these feathers is from the outside to the inside, as in the secondary remiges. Most birds has completed the change of the secondary coverts to August 15, more or less at the time is appreciable only secondary sheath remige I.[47]
The molting of the lesser coverts begins early, often being the first feathers to fall. The onset of molting in male juveniles is particularly noticeable because it involves the replacement of the minor covers and results in the appearance of the reddish or orange wing spot. The new wing spot contrasts sharply with the yellowish-brown juvenile plumage in this area of the wing. The move of the minor blankets has generally been completed by September 1.[47]
Alula feathers complete their development at about the same time as the last three primary sprouts. The marginal covers on the upper or outer surface of the forearm, located below the alula, shed at approximately the same time that the primary remix VI is being replaced.[47]
The first feathers under the wing to molt are the marginal coverts, under the forearm. The shedding of these feathers begins at about the same time that the primary remix IV falls and is followed by that of the lower middle primary and lower middle secondary coats. The progression of the molting of the lower middle secondary blankets is from the outside to the inside, while that of the lower middle primary mats seems to be irregular or almost simultaneous. The medial lower coverts molt before the primary remiges VIII and IX. The major lower primary coverts and major lower secondary coverts molt last. The progression of the molting of these last feathers is the same as in the primary and secondary sprouts, that is, from the inside out and from the outside in, respectively.[47]
The caudal feathers comprise the rudder or rectrix feathers and the upper and lower tail covers. The tail covers begin to shed before the rectrices. Generally, the upper tail covers begin to shed first. Certain birds lose some rectrices by the end of the third week of August. The helmsmen in the center of the queue are the last rectrices to be renovated.[47]
Molting in the capital region involves changing the feathers of the pileus and the sides of the head. It is one of the last parts of the body to begin feather replacement, but the renewal of most of the capital feathers is complete before that of the secondary feathers, tail feathers, and under-wing feathers. The beginning of the molt in this region coincides with the beginning of the development of the primary remige V or VI. Some individuals have already started replacing the capital feathers by mid-August. The molt begins at the pileus and the last areas of the capital region to complete it are the eye strip and the cheeks (malar region).[47]
In some birds, the first signs of molt in the ventral feathers appear during the last days of July, when the feathers of the anterior portion of the laterals begin to fall. From there, the molt progresses backward along the sides and forward toward the throat and chin. The last ventral feathers to be replaced are those towards the center of the abdomen. The molt of the dorsal feathers begins around the first week of August. It begins at the bladder, progresses to the upper back, and then to the cervical region.[47]
The earliest evidence of molting in the humeral plumes corresponds to the last days of July. The molt comes from the anterior region backwards. The change of the femoral feathers begins later than that of the humeral ones. However, the progression is similar. Replacement of feather feathers rarely begins before August 15. The progression is generally from the proximal end of the tibia to the tarsometatarsal region.[47]
The red-winged blackbird is widely spread throughout North America, except in the arid desert, high mountain ranges, and arctic or dense afforestation regions.[48] It breeds from central-eastern Alaska and Yukon in the northwest,[50] and Newfoundland in the northeast,[18] to northern Costa Rica in the south, and from the Atlantic to the Pacific.[50] Northern populations migrate to the southern United States, but those that breed there, in Mexico, and in Central America are sedentary.[16] Red-winged blackbirds in the northern reaches of the range are migratory, spending winters in the southern United States and Central America. Migration begins in September or October, but occasionally as early as August. In western and Central America, populations are generally non-migratory.[28]
The red-winged blackbird inhabits open grassy areas. It generally prefers wetlands, and inhabits both freshwater and saltwater marshes, particularly if cattail is present. It is also found in dry upland areas, where it inhabits meadows, prairies, and old fields.[28] In a large part of its distribution area, it constitutes the most abundant passerine bird in the swamps in which it nests.[50] It is also present in areas without much water, where it inhabits open fields – often agricultural areas – and sparse deciduous forests.[28]
In the winter of 1975–1976, near Milan in western Tennessee, red-winged blackbirds were observed resting in a mixed roost that came to house 11 million individuals in January and early February in a plantation of 4.5 hectares of yellow pine (Pinus taeda) with little undergrowth was seen in soybean fields during the day, being that these constituted only 21% of the habitat in the area and that the other bird species present in the roost were not commonly observed in these fields; they were also common in cornfields. the presences of the bird in feedlots has increased as winter progressed, but, accounting for less than 5% of the icterids and starlings recorded in both feedlots of cows and pigs, they were much rarer there than the brown-headed cowbird, common grackle and common starling.[51]
During the breeding season, the density of breeding adults is much higher in swamps than in highland fields.[43] Although the highest concentrations of nesting red-winged blackbird are found in swamps, most of them nest in upland habitats since they are much more abundant.[52][53][54] In a study conducted in the Wood County, Ohio between 1964 and 1968, the density of territorial males in wetland habitat was found to be 2.89 times those in upland habitat. But, because of the small amount of wetland habitat, the total estimated upland population of territorial males was 2.14 times the wetland population. Alfalfa (Medicago sativa) and other legume crops (hay) were the principal habitat for breeding redwings in the county. Despite the marked preference for wetland habitats, the greater population in uplands reflects wetlands' scarcity.[55]
In that same study, reproductive individuals in upland habitats demonstrated a slight preference for old and new grasses such as Phleum pratense, Dactylis glomerata, Poa spp., Festuca spp., and Bromus spp. In the early part of the breeding season and new non-graminoid herbaceous plants in the mid and late season. In wetlands, they consistently preferred old and new broadleaf monocotyledons, primarily Carex spp, broadleaf, and Typha spp, and consistently rejected old and new narrow-leaved monocots, primarily narrow-leaved Phalaris arundinacea and Calamagrostis canadensis, and non-graminoid herbaceous plants. Red-winged blackbirds breeding in the highlands favored older tall vegetation only in the early part of the breeding season on April to May, and higher new vegetation and dense vegetation throughout the breeding season. For their part, those who settled in wetlands seemed to have a slight predilection for taller old vegetation.[56] During the breeding season, this species is attracted to tall vegetation that restricts visibility.[56][57]
Early season preferences for old grassland in the highlands and old broadleaf monocotyledons in wetlands point to the importance of upright residual vegetation. Highland grasses and broadleaf monocots in wetlands stand partially vertically and are easily visible in early spring, unlike clovers, narrow-leaved monocotyledons in wetlands and most non-graminoid herbaceous plants. Old alfalfa plants are also partially upright in early spring, but they are not as consistently chosen a species as old grasses. The start of the territorial activity is earlier when the amount of residual vegetation is large. Vegetation structural strength also appears to be important for nesting as females tend to broadleaf monocotyledons in wetlands throughout the breeding season and new non-graminoid herbaceous plants in the mid to late season.[56]
In southwestern Michigan, the density of cattail stems in different ponds was positively related to the concentration of reproductive adults.[58] However, other studies detected a predilection for more scattered vegetation.[57][59] One found that red-winged blackbirds avoided the marsh wren (Pantaneros chivirenes), a predator common in nests of this species, reproducing among more dispersed vegetation, which was more easily defended from the chivirines; conversely, the chivirines seemed to prefer the denser vegetation, where they were more likely to avoid the aggressiveness of the red-winged blackbird; These differences in habitat selection between one species and another resulted in spatial segregation of their breeding areas.[59] On the other hand, red-winged blackbirds tend to opt for small lots of vegetation and plants with thick stems.[57]

The red-winged blackbird is territorial, polygynous, gregarious and a short-distance migratory bird. Its way of flying is characteristic, with rapid wing flaps punctuated by brief periods of gliding flight.[48] The behavior of males makes their presence easily perceived: they perch in high places[27] such as trees, bushes, fences, telephone lines, etc.[60] Females tend to stay low, prowling through the vegetation and building their nests. They can be found in home gardens, particularly during their migration, if seeds have been scattered on the ground.[27] The forest curtains serve as a resting place during the day.[61]
For several weeks after their first appearance in early spring, red-winged blackbirds are generally seen in flocks made up entirely of males. During those days, they are seldom seen at their breeding sites, except early morning and late afternoon. In most of the remaining hours of the day, they frequent open and often elevated agricultural land, where they feed mainly on grain stubble and grassy fields. When disturbed while eating, they fly to the nearest deciduous trees and immediately after landing they begin to sing.[48]
The red-winged blackbird is omnivorous. It feeds primarily on plant materials, including seeds from weeds and waste grain such as corn and rice, but about a quarter of its diet consists of insects and other small animals, and considerably more so during breeding season.[62] It prefers insects, such as dragonflies, damselflies, butterflies, moths, and flies, but also consumes snails, frogs, eggs, carrion, worms, spiders, mollusks. The red-winged blackbird forages for insects by picking them from plants, or by catching them in flight.[27] Sometimes insects are obtained by exploring the bases of aquatic plants with their small beaks, opening holes to reach the insects hidden inside.[27][28] Aquatic insects, particularly odonates emerging, are of great importance in the diet of red-winged blackbirds that breed in swamps. These birds typically capture the odonates when the larvae climb up the stem of a plant from the water, get rid of their exuviae, and cling to the vegetation while their exoskeletons harden.[58] The years of emergence of periodical cicadas, it provides an overabundant amount of food.[32] In season, they also eat blueberries, blackberries and other fruits.[18] According to Edward Howe Forbush, when they arrive north in the spring, they feed in the fields and meadows. Then, they follow the plows, collecting larvae, earthworms and caterpillars left exposed, and in case there is a plague of Paleacrita vernata caterpillars in a fruit orchard, these birds will fly a kilometer to get them for their chicks.[48]
In season, it eats blueberries, blackberries, and other fruit. These birds can be lured to backyard bird feeders by bread and seed mixtures and suet. In late summer and in autumn, the red-winged blackbird will feed in open fields, mixed with grackles, cowbirds, and starlings in flocks which can number in the thousands.[63] It feeds on corn while it is maturing; once the grain has hardened it is relatively safe from this bird, since its beak and digestive system are not adapted for the consumption of hard and whole corn grains, unlike the Common grackle, which has a longer and stronger beak.[53] Studies of the stomachs of individuals of both sexes reveal that males consume higher proportions of crop grains, while females ingest a relatively larger amount of herb seeds and animal matter.[30] In the winter of 1975–1976, near Milan, western Tennessee, corn and herb seeds were the main foods consumed by red-winged blackbird. Herbs whose seeds were commonly consumed were Sorghum halepense, Xanthium strumarium, Digitaria ischaemum, Sporobolus spp., Polygonum spp. and Amaranthus spp.[51]
The red-winged blackbird nests in loose colonies. The nest is built in cattails, rushes, grasses, sedge, or alder or willow bushes. The nest is constructed entirely by the female over the course of three to six days. It is a basket of grasses, sedge, and mosses, lined with mud, and bound to surrounding grasses or branches.[27] It is located 7.6 cm (3.0 in) to 4.3 m (14 ft) above water.[64]
A clutch consists of three or four, rarely five, eggs. Eggs are oval, smooth and slightly glossy, and measure 24.8 mm × 17.55 mm (0.976 in × 0.691 in).[64] They are pale bluish green, marked with brown, purple, and/or black, with most markings around the larger end of the egg. These are incubated by the female alone, and hatch in 11 to 12 days. Red-winged blackbirds are hatched blind and naked, but are ready to leave the nest 11 to 14 days after hatching.[24]
Red-winged blackbirds are polygynous, with territorial males defending up to 10 females. However, females frequently copulate with males other than their social mate and often lay clutches of mixed paternity. Pairs raise two or three clutches per season, in a new nest for each clutch.[24]
The reproductive season of the red-winged blackbird extends approximately from the end of April to the end of July.[65][66] On the other hand, in different states has been estimated that the period in which the active nests contained eggs lay between beginning in late April and early late August; and in northern Louisiana nests were found to harbor chicks from late April to late July. The peak of the nesting season (the time with the highest number of active nests) has been recorded between the first half of May and the beginning of June in different places.[67] A study in eastern Ontario found that although red-winged blackbirds began nesting earlier in years with warm springs, associated with low winter values in the North Atlantic Oscillation Index, egg laying dates remained unchanged.[68] Male testosterone levels peak in the early part of the breeding season, but remain high throughout the season.[49] Females reproduce for up to ten years.[69]
Many aspects of territorialism (for example, the number of male songs and displays, and the number of intrusions into foreign territories) peak before mating. After this, the frequency of many of the territorial behaviors decreases and the males are mainly concerned with defending the females, eggs, and chicks against predation. Experiments in the systematic removal of birds from their territories suggest that the extra population of males that is present in swamps before copulations disappears after copulation.[70]
Predation of eggs and nestlings is quite common. Nest predators include snakes, mink, raccoons, and other birds, even as small as marsh wrens. The red-winged blackbird is occasionally a victim of brood parasites, particularly brown-headed cowbirds.[63] Since nest predation is common, several adaptations have evolved in this species. Group nesting is one such trait which reduces the risk of individual predation by increasing the number of alert parents. Nesting over water reduces the likelihood of predation, as do alarm calls. Nests, in particular, offer a strategic advantage over predators in that they are often well concealed in thick, waterside reeds and positioned at a height of one to two meters.[71] Males often act as sentinels, employing a variety of calls to denote the kind and severity of danger. Mobbing, especially by males, is also used to scare off unwanted predators, although mobbing often targets large animals and man-made devices by mistake. The brownish coloration of the female may also serve as an anti-predator trait in that it may provide camouflage for her and her nest while she is incubating.[28]
Predators of red-winged blackbirds include such species as raccoons,[72] American mink,[73] long-tailed weasels,[74] black-billed magpies,[75] common grackles,[48] owls,[28] red-tailed hawks,[76] short-tailed hawks,[77] and snakes[78] (such as the northern water snake[48] and the plains garter snake[75]). Ravens and grazers such as marsh wrens feed on eggs (and even small chicks), if the nest is left unattended,[48] destroying the eggs, occasionally drinking from them, and pecking the nestlings to death.[79]
The relative importance of different nest predators varies by geographic region: the top predators in different regions include the marsh wren in British Columbia, the magpies in Washington, and the raccoons in Ontario.[75] The incidence of avian predation in red-winged blackbird nests is higher in western populations than in eastern populations.[80]
Due to high predation rates, especially of eggs and chicks, the red-winged blackbird has developed various adaptations to protect its nests. One of them consists of nesting in groups, which reduces the danger since there is a greater number of alert parents. Nesting over water also lowers the chances of an attack. Nests in particular offer a strategic advantage as they are often hidden among dense riparian reeds, at a height of one or two meters.[72] males often act as sentinels, using a repertoire of calls.[81] Males in particular hunt down potential predators to scare them away, even when dealing with much larger animals.[72] Aggressiveness of the red-winged blackbird towards the marsh wren, which also nests in swamps, causes a partial interspecies territorialism.[82] On the other hand, nocturnal predators such as raccoons and American mink are not attacked by adults.[75][83] Coloration of the female could serve to camouflage it, protecting it and its nest when it is incubated.[72]
The red-winged blackbird can accommodate ectoparasites such as various Phthiraptera, the Ischnocera Philopterus agelaii and Brueelia ornatissima,[84] and hematophagous mites, like Ornithonyssus sylviarum,[84] and endoparasites like Haemoproteus quiscalus, Leucocytozoon icteris, Plasmodium vaughani, nematodes,[84] flukes and tapeworms.[85]
The red-winged blackbird aggressively defends its territory from other animals, and will attack much larger birds.[63] During breeding season, males will swoop at humans who encroach upon their nesting territory.[86][87] Male red-winged blackbirds also exhibit important territorial behaviors, most of which provides them with the necessary fidelity for many years to come. A few important factors for male red-winged blackbirds’ adherence to territories include food, hiding spaces from predators, types of neighbors, and reactions towards predators. Additionally, a study was done on site fidelity and movement patterns by Les D. Beletsky and Gordon H. Orians in 1987 which explained much of the males’ territorial behaviors once migrated and settled onto a territory of their own. Sufficient evidence had shown that males are committed to staying in their territory over a long period of time and are not more likely to change territories at a younger age due to limited experience of knowledge for success. Studies also showed that most of the males that were first-time movers to a new territory were between two and three years old. The majority of males that moved were young and inexperienced. Later on they had moved towards more available territories. If males had chosen to leave their territory for reproductive success, as an example, they would do so within a short distance. Males who moved shorter distances were more successful in reproducing than those who moved longer distances. Further studies showed that when males moved further away from their territories there was a decrease in probability of successfully fledging.[88]
The maximum longevity of the red-winged blackbird in the wild is 15.8 years.[89]
Red-winged blackbirds that breed in the northern part of their range, i.e., Canada and border states in the United States, migrate south for the winter. However, populations near the Pacific and Gulf coasts of North America and those of Middle America are year-round resident.[2] Red-winged blackbirds live in both Northern U.S. and Canada, ranging from Yucatan Peninsula in the south to the southern part of Alaska.[2] These extensions account for the majority of the continent stretching from California's Pacific coast and Canada to the eastern seaboard. Much of the populations within Middle America are non-migratory.[28] During the fall, populations begin migrating towards Southern U.S. Movement of red-winged blackbirds can begin as early as August through October. Spring migration begins anywhere between mid-February to mid-May. Numerous birds from northern parts of the U.S., particularly the Great lakes, migrate nearly 1,200 km (750 mi) between their breeding season and winter[2] Winter territorial areas differ based on geographic location.[28] Other populations that migrate year-round include those located in Middle America or in the western U.S. and Gulf Coast. Females typically migrate longer distances than males. These female populations located near the Great Lakes migrate nearly 230 km (140 mi) farther. Yearly-traveled females also migrate further than adult males, while also moving roughly the same distance as other adult females. Red-winged blackbirds migrate primarily during daytime. In general, males’ migration flocks arrive prior to females in the spring and after females in the fall.[2]
According to the American ornithologist Arthur Cleveland Bent, in the northern regions of its range the eastern red-winged blackbird is almost completely beneficial from an economic perspective and there are comparatively few complaints of severe crop damage. Their diet consists almost entirely of insects, very few of which are useful species, and herb seeds. However, it causes certain damages to the grains that germinate in spring and to sweet corn in summer, while the grains are still soft, tearing the foliaceous covering of the ears and ruining them from a commercial point of view. It also attacks other grains in a limited way, but most of what it consumes is waste left in the ground. In the Midwest, where these birds are much more abundant and where cereals are grown more extensively than in the North, red-winged blackbirds and other ichterids, in late summer and fall, do great damage to grain fields, both while they are maturing as when they are harvested . However, it has been claimed that even there are beneficial because the larvae removed from corncobs and beet plants and can counteract pests of caterpillars. In the southern states, they seriously harm rice by plucking seedlings in spring and eating the still-soft grains as they mature, being in this sense almost as harmful as the Bobolink. On the other hand, they are of some use in consuming weed seeds that would otherwise devalue the product.[48]
Being one of the most numerous birds on the continent, it plays an important role in the dispersal of other species. Since red-winged blackbirds gather and rest in such large numbers, the survival of certain species that join their flocks is likely to be affected by their company.[28] They can also be an important source of food for animals such as raccoons and mink. Likewise, populations that nest and rest in swamps could cushion the effect of predation on duck species and other animals.[53] In summary, these birds are so numerous and active that their mere presence and natural behavior is enough to influence the environment in a visible way.[28]
Through the control of insect populations through predation and unwanted herbs with the consumption of their seeds, they allow the growth of larger plants and crops.[72][90] They also eat on Anthonomus grandis and Hypera postica, two species of weevils affecting cotton and alfalfa respectively, as well as harmful caterpillars of the European gypsy moth (Lymantria dispar) and of the genus Malacosoma.[48] In some areas of the southern United States, the seeds of the common plumber (Xanthium strumarium), a weed detrimental to soybeans and cotton, seems to be an important food source for the species.[53][51]
Beal (1900) stated: In summarizing the economic status of the red-winged blackbird, the main aspect to consider is the small percentage that grains represent in their annual diet, which apparently contradicts complaints about its destructive habits. Judging by stomach contents, the red-winged blackbird is decidedly a useful bird. The service it provides through the elimination of harmful insects and herb seeds far outweighs the damage caused by its consumption of grains. The havoc it sometimes causes must be entirely attributed to its excessive abundance in certain places.[48][91]
During the breeding season, the approximately 8 million red-winged blackbirds nesting in Ohio and their chicks probably consume more than 5.4 million kilograms (12,000,000 lb) of insects, an average of almost 53 kg/km2 (300 lb/sq mi). Many of these insects, such as the weevils (Hypera spp.), Come from alfalfa fields, pastures, oat fields and other crops. In cornfields, blackbirds often feed on corn worms (Helicoverpa zea) and beetles of the genus Diabrotica. In early spring, red-winged blackbirds consume corn borers (Ostrinia nubilalis) in fields with corn stubble.[53] However, Bendell et al. (1981) found that the economic benefit of pest control, such as larvae of that lepidopteran, by the red-winged blackbird only compensated for 20% of the damage to crops caused by this bird.[92][93]
The red-winged blackbirds can devastate farm fields. Despite the fact that they consume weed seeds, they are known to cause great damage to agriculture due to their habits of resting in massive groups and their taste for agricultural products.[28] may be also causes harm to plantings corn, rice, sunflower and sorghum,[28][61] particularly important near roosts.[61] Red-winged blackbird is the largest species of Icterid in North America and the most damaging to crops.[94][61][95] From 215 birds Neotropical migrants have been identified as causing, by a wide margin, the greatest economic loss.[92] In North America, the damage to corn crops by this species has increased since the late 1960s to early 1980s, perhaps because of the increase in the area for grain production,[96][97][98] and due to the reduction of small areas with stubble, hayfields and uncultivated land, which, in turn, accentuated the bird's dependence on corn to ensure its livelihood.[99]
Apparently, the male does more damage to this grain than the female. In some areas of Ohio, corn can account for up to 75% of the diet of males and only 6% of that of females in August and September. In South Dakota, in the late summer, the gizzards of the males studied contained 29% corn, while in the case of the female that number was limited to 9%.[53]
The red-winged blackbird is the dominant species in the large concentrations of blackbirds that feed on the fields of sunflower, corn and small grains maturing in late summer or early fall in the Dakotas. In the 1970s, losses to sunflower and corn crops caused by blackbirds in the Dakotas exceeded $3 million annually for each case.[100] In the northern part of the Great Plains, an area known as the Prairie Pothole Region, in red-winged blackbirds are very abundant in summer, they congregate in post-reproductive flocks that significantly harm crops, particularly sunflower plantations near their home sites. Most sunflower damage occurs between mid-August and early September, when the calorie content of immature seeds is low and birds must consume more of them to satiate themselves. During this initial stage of predation on sunflower crops in which more than 75% of the total damage is caused, the red-winged blackbird represent 80% of the blackbirds observed in the fields of this seed. This period predates the massive migration of birds and most of them are of local origin. Most remain within 200 km (120 mi) of their native sites until the molting of their feathers is complete or nearly complete in late August or early September. Damage can be quite serious in the center and southeast of North Dakota and Northeast South Dakota, areas of high concentration of sunflower production and abundant wetlands that attract red-winged blackbird during the breeding season.[101]
Investigations conducted between 1968 and 1979 revealed that blackbirds, notably the black-winged blackbird and the common grackle, annually destroyed less than 1% of corn crops in Ohio, amounting to a loss between 4 and 6 million dollars according to 1979 prices. [53]
All Ohio counties experience some degree of predation on their maize crops from blackbirds, but those most affected are a few counties where marshes that roost them still abound. The counties of Ottawa, Sandusky and Lucas, on the waters of Sandusky Bay and Lake Erie, were the hardest hit. These three counties, among the 19 studied between 1968 and 1976, contained 62% of the fields in which the losses exceeded 5% and 77% of those in which they exceeded 10%. Other counties with extensive localized damage were Erie, Ashtabula also located on the coasts of the mentioned water courses and Hamilton. Almost all the plantations with damages greater than 5% were within 8 km (5.0 mi) of some important roosting of blackbirds. In the 1968–1976 period, in northeast Sandusky County and northwest Ottawa, where large roosts of up to a million birds were discovered in late summer and fall, average losses exceeded 9% in fields 3 to 5 km (1.9 to 3.1 mi) from the roosts, but they were less than 5% at 8 km (5.0 mi) and less than 2% at 16 km (9.9 mi).[53] In southwestern Ontario, in the summer of 1964, it was found that the greatest damage to the cornfields by red-winged blackbird also occurred near roosts in swamps.[72]
The two main options that farmers can choose from to avoid the presence of birds once corn has entered the milky stage of its maturation process are the use of the chemical 4-aminopyridine and the implementation of mechanical devices to frighten birds away.[53] The time chosen to take measures to disperse the blackbirds is of great importance since once the birds have chosen a field to feed there they are likely to return for several days.[53][72] The longer be allowed to feed them unmolested, will become more difficult to scare them away.[53] Also, most of the damage is inflicted in just a few days, when the pimples are soft; consequently, control techniques will not be very useful if applied after this period.[53][102]
As early as 1667, Massachusetts Bay settlers had enacted laws to try to reduce blackbird populations and mitigate damage to corn. According to Henry David Thoreau, a law provided that each single man in a town must kill six of those birds and, as a punishment for not doing so, he could not marry until he had complied with the aforementioned design. Obviously, since blackbirds reproduce at a much higher speed than humans marry, this control strategy was a failure. Pioneers traveling west to the Great Lakes region faced similar problems. By 1749, blackbirds were so abundant around western Lake Erie that people took turns watching over the maturing grain crops.
At the beginning of the 20th century, in some places, when the reeds dried up, these circumstances were used to kill these birds in the following way. A crew approached a roost in silence, hidden in the darkness of the night, and simultaneously lit the reeds at various points, which were quickly enveloped by a single great flame. This caused a huge tumult among the red-winged blackbird, which, lit by fire, were shot down in large numbers as they hovered in midair and screamed all over the place. Sometimes straw was used for the same purpose, which was previously scattered near reeds and alder bushes (Alnus spp.) in which they gathered to rest, the burning of which caused great consternation among the birds. The gang returned the next day to collect the hunted prey.[48]
Arthur Cleveland Bent says that, before it was banned the sale of prey hunting in the market, red-winged blackbirds were massacred in large numbers in autumn and sold in markets. When they had put on weight on a diet of grains or rice, their small bodies were served as delicious snacks on the gourmet tables . Few could distinguish them from bobolinks (Dolichonyx oryzivorus).[48]
In 1926, when the US Biological Survey – predecessor of the United States Fish and Wildlife Service carried out its first compilation of roosts of undesirable ichterids, it was recorded in Ohio, with its large populations of these birds and the fifth largest area allocated to the cultivation of corn among the American states, a number of complaints higher than in any other state. During the 1950s, bird control committees were organized in some counties to deal with the damage to maize caused by blackbirds and the Ohio Agricultural Experiment Station now the Ohio Agricultural Research and Development Center and the Department of Zoology and Entomology of the state university began investigating the problem.[53]
Crop predation has led to the use of traps, poison and surfactants by farmers in an attempt to control populations of red-winged blackbirds;[28] these last properties suppress waterproof feathers, making them extremely vulnerable to the cold,[72][103] but their effectiveness depends on certain atmospheric conditions, namely low temperatures and rainfall.[103] Programs in which baits were used poisoned to reduce icteride concentrations in late summer have been unsuccessful. While thousands of birds have occasionally died, the effect on large roosting-associated flocks that sometimes contain more than a million individuals is small; In addition, specimens of other species frequently die. The use of large lure traps, which often catch hundreds of birds per day, is also ineffective against these large flocks.[53]
4-Aminopyridine is applied to one in one hundred particles of ground corn used as bait. Generally, corn is thrown into the fields from planes that release a load of about 3.4 kg (7.5 lb) of bait per hectare on one third of the land. Because that amount of ground corn contains around 205,000 particles, approximately 2050 toxic particles are distributed per hectare treated.[53] The ingestion of one or more of these particles by a blackbird causes erratic flight, calls for suffering and finally death; that behavior often leads the remaining birds in the flock to leave the field.[53][104][105] The chemical DRC-1327, which has proven useful in mitigating damage to maturing corn, operates in the same way: when a bird ingests kernels from a partially hand-peeled cob to which the chemical has been applied with a sprayer manual, his erratic flight and his pre-death calls for suffering, which span a space of between five and fifteen minutes, chase away flocks from the fields.[61]
The initial application of 4-aminopyridine should be carried out as soon as possible after the start of the milky stage of the grain ripening process. Two other booster applications five to seven days apart are generally recommended; Often just one is sufficient, but under conditions of prolonged bird activity more than three applications may be required at shorter intervals.[53] In Brown County (Northeast South Dakota), in 1965, hand-spread 4-aminopyridine baits at intervals of about one week reduced projected red-winged blackbird loss by maturing corn crops by 85%. The distressing behavior exhibited by the individuals affected by the chemical produced a marked fear response in other members of the flocks and the fields were free of red-winged blackbirds even when the estimated directly affected proportion was less than 1%.[106] It has even been suggested that the continued use of 4-aminopyridine over the years could cause a change in the pattern of migration to the south, as if birds were learning to avoid areas persistently treated with the chemical.[105]
In another experiment in the same county, the number of blackbirds making use of the treated area fell dramatically over a period of five days after treatment had begun and remained low for the remainder of the season of damage to cornfields. The results of this method were largely limited to icterides. Although common pheasant were abundant, there was no evidence that any were affected, and mortality among other bird species was negligible.[104]
The abundance of weeds should be considered as restricting the chances that birds will find bait particles scattered on the ground, so the use of this chemical must be accompanied by a weed control program. A less obvious problem is that of the insects that remove the bait. If Gryllus are detected in a field, ground corn is expected to disappear quickly. Crickets generally select untreated particles and leave the toxic ones behind; however, the rapid decrease in the total volume of ground corn on the ground decreases the attractiveness of ground-level feeding for blackbirds. Because cricket populations are difficult to control, more frequent applications or other bird control techniques may be desirable under these circumstances. A third problem is that of heavy rains, which cover the bait with soil or drag it into cracks in the ground.[53] Likewise, a low population density of ichterides can reduce the effectiveness of its control with 4-aminopyridine.[105]
A variety of devices to repel them, including electronic noise-making systems, helium balloons tied in the fields, radio-controlled aircraft, and various types of scarecrows are occasionally used in cornfields.[53] Methods such as scarecrows, pyrotechnics, and propane cannons, may help mitigate mild predation, but only work effectively if the duration of the damage period is less than that of the birds becoming accustomed to these methods. Red-winged blackbirds quickly become accustomed to them, particularly if the crop is a prime food source in an area with few alternative sources of livelihood.[101] Although harvesting as early as possible after the corn has dried sufficiently can limit damage by northern grazing flocks, adjusting the harvest date does not help farmers reduce losses by red-winged blackbirds during the milky stage.[53]
One approach that has been successful in controlling roosts in the highlands is dispersal of populations through habitat alteration or bird harassment. These procedures, carried out by biologists in cooperation with local citizens, have been successful in dispersing or displacing populations of up to one million individuals. Although this dispersion can sometimes move the problem from one place to another – especially when the area has been intensively cultivated with corn and alternative food sources are not abundant, it has often been effective in solving local problem situations. Because oats and wheat grains in already harvested fields constitute an important food for blackbirds in late summer, the postponement of plowing the land with small grain stubble can lessen the pressure exerted by the predation of these birds on the maturing corn. The natural existence or planting of plants such as millet, sorghum (Sorghum spp.), Polygons (Polygonum spp.) And various grasses for example, mohas (Setaria spp.) that could be beneficial. As a general ecological principle, diversity in the types of habitats that can be maintained in regions of intense agricultural activity is related to a greater probability that the damages caused by pests are restricted to economically tolerable levels.[53]
Studies in sweet corn fields indicate that blackbirds could often be initially attracted to maturing crops by insects.[53][102] Flocks can wander the land cultivated for about a week consuming insects and weed seeds before attacking the corn. Diabrotica beetles may be especially attractive during this period. Thus the birds become habituated to feeding in the fields and quickly move from insects to corn when it enters the vulnerable milky stage. Experiments in which insect populations in sweet corn crops were treated with insecticides during the week before the grain entered the milky phase, they showed that fewer birds visited these fields and less damage was recorded to the corn in the subsequent vulnerability period than in nearby untreated land. It is probable that the abundance of weeds in cornfields also increases their attractiveness to ichterids and their control would lead to a decrease in the losses produced by these birds.[53]
An alternative way to reduce populations of red-winged blackbird, and therefore the damage they cause to crops, involves implementing a program that is intended to interfere with their ability to reproduce, for example, through the use of sterilizing chemicals. Due to the polygynous nature of the species, it has been suggested that such a program could become more effective if directed at males. However, the incidence of promiscuity would imply that chemical sterilization of a certain fraction of males from a local population would not result in a proportional decrease in fertile clutches.[107]
The effects of this method would probably vary according to the type of habitat in which the treated males have established their territories. In general, there should be a higher proportion of fertile clutches in those densely populated habitats and with a greater number of renidifications (nest reconstructions). Renidifications are more common in swamps than in the highlands. In turn, individuals that reproduce in the highlands probably feed more often within their own territories than those that reproduce in swamps, which probably makes promiscuity difficult in the first type of habitat. Thus, chemical sterilization could be more effective among upland populations than among swamp populations.[107]
Sterilizing chemicals may reduce the number of chicks produced by a successful nest. Since renidification clutches are significantly fewer in number than the original, even if a female that first mated with a sterile male then renidified and mated with a fertile male, perhaps she would produce fewer chicks than she would have had if her first clutch would have been fertile.[107]
The number of fertile clutches in a male's territory may be limited through the sterilization of that male, but the degree to which that number decreases will depend on the disposition of the neighboring fertile territorial males and perhaps also on the number of fertile non-territorial males. in the population. Studies with artificial eggs suggest that incubation of sterile eggs would be prolonged, 98 since females normally incubate artificial eggs for around 20 days.[107][108] An extended incubation of unviable eggs would result in fewer renidification attempts and, therefore, it decreased the opportunities to find a fertile mate for a female who originally mated with a sterile male.[107]
Farmers have been known to use pesticides—such as parathion—in illegal attempts to control their populations.[109] In the United States, such efforts are illegal because no pesticide can be used on non-target organisms, or for any use not explicitly listed on the pesticide's label. However, the USDA has deliberately poisoned this species in the past: in 2009, the Animal and Plant Health Inspection Service reported poisoning over 950,000 red-winged blackbirds in Texas and Louisiana.[110] This poisoning has been implicated as a potential cause of the decline of the rusty blackbird, a once abundant species that has declined 99% since the 1960s and has been recently listed as Threatened on the IUCN Red List.[111]
In the Anishinaabe languages, an indigenous language group spoken throughout much of the bird's northeastern range, this bird's names are diverse. In the Oji-Cree language, the northernmost of the Anishinaabe languages, it is called jachakanoob, while the Ojibwa language spoken in Northwestern Ontario and into Manitoba ranging immediately south of the Oji-Cree's range, the bird is called jachakanoo (with the cognates cahcahkaniw (Swampy Cree), cahcahkaluw (coastal Southern East Cree), cahcahkayuw (inland Southern East Cree), cahcahkayow (Plains Cree); the northern Algonquian languages classify the red-winged blackbird as a type of a junco or grackle, deriving the bird's name from their word for "spotted" or "marked". In the vast majority of the other Ojibwa language dialects, the bird is called memiskondinimaanganeshiinh, literally meaning "a bird with a very red damn-little shoulder-blade". However, in the Odawa language, an Anishinaabe language in southwestern Ontario and in Michigan, the bird is instead called either memeskoniinisi ("bird with a red [patch on its wing]") or memiskonigwiigaans ("[bird with a] wing of small and very red [patch]").[112] In N'syilxcn (Colville-Okanagan, Interior Salish language) the bird is known as ƛ̓kƛ̓aʕkək.[113] In the Hoocąk language they are known as cooxją́ aporošucra, which describes the round red spot on its wing as well as identifying it as a blackbird.[114]
In the Great Plains, the Lakota language, another Indigenous language spoken throughout much of the bird's range, the bird is called wabloša ("wings of red"). Its songs are described in Lakota as tōke, mat'ā nī ("oh! that I might die"), as nakun miyē ("...and me"), as miš eyā ("me too!"), and as cap'cehlī ("a beaver's running sore").[115]
It is a species of least-concern.[1][27] Being one of the largest and most widely distributed birds in North America, little has been done to protect it from the effects of habitat destruction and urbanization. It can survive in a wide range of environments, many populations manage to overcome the loss of natural habitats. However, red-winged blackbirds thrive in wetland areas and with the destruction of natural wetlands their population is likely to shrink.[28] The species is protected under the Migratory Bird Treaty Act 1918, a formal treaty between the United States and Canada that was later expanded to include Mexico. This law gives them legal protection in the United States, but they can be killed "when they are found preying or about to prey on ornamental trees or trees planted for shade, crops, livestock or wildlife."[53]
A study in Illinois indicated that red-winged blackbird populations doubled between 1908 and 1958. It had traditionally reproduced in wetlands, with Ohio primarily inhabiting swamps associated with lakes and rivers.[53] During the 20th century, however, it adapted to man-made habitat changes and now often nests in hayfields, along roads and ditches, and elsewhere in the highlands.[53][54]
Despite its successful adaptation to changes in practices related to land use, populations of red-winged blackbird have reduced the width of its range during the second half of the twentieth century,[101][53] and Changes in the abundance and adequacy of grasslands have been implicated in this.[101] In Ohio, the red-winged blackbird was negatively affected between 1966 and 1996 by the decrease in hay production, the earlier harvest of hay and the increase in crops planted in furrows, a situation homologous to that suffered by other species of birds from less numerous grasslands. Although the negative effect of the increased efficiency and the diminishing diversity of modern agricultural practices on the populations of red-winged blackbird in this state may be perceived as a positive event by the producers of corn and sunflower, the agricultural practices that have precipitated the numerical decline of this species may have caused more severe repercussions for birds from less common grasslands, such as the upland sandpiper and the Grasshopper sparrow.[53]
In the late 1970s, Ohio hosted the highest density of blackbirds during the breeding season among all US states and Canadian provinces,[53] However, between 1966 and 1996, the reproductive populations in this state showed a marked decrease. Decreasing the area under hay other than alfalfa between those same years was likely to reduce the availability of quality nesting habitats. Likewise, corn even though it attracts insects that red-winged blackbirds consume and despite the fact that their grains represent in themselves an energy source and soybeans which do not constitute a food source for the species, which together made up 1966 to 1996, an average of 70% of the cultivated area in Ohio, do not provide adequate nesting habitat. In turn, the large annual fluctuations in the area cultivated with hay, both from one year to the next and within the same year of a certain reproductive season,[53] Similarly, in Ontario between 1974 and 1995, the average size of harems in a given year was positively related to hay production from the previous year, although the percentage variation in the size of harems from one season to the next the following was not linearly related to the annual percentage change in hay production; Hay production declined during this period and the size of the harems decreased from approximately three females per male to 1.6 females.[54]
In addition in Ontario, a negative relationship was found between the North Atlantic Oscillation Index (NAO) in the six months prior to a certain reproductive season and the size of the harems. If winter mortality contributes to the decrease in the size of the harems, the annual variations in their size should be related to the annual changes in the rates of return of marked territorial males. Variations in the size of harems and male return rates per year were indeed found to be positively correlated. Although not as pronounced, the relationship between male return rates and winter NAO values was similar to that between changes in harem size and NAO.[54]
On the other hand, in southwestern Quebec, red-winged blackbird populations doubled between 1966 and 1981, apparently in response to the development of maize production. The increased availability of residual grains in spring and summer. the reproductive season will probably play a fundamental role in the growth of this bird's population.[97] Likewise, in the mid-1990s, the reproductive population of North Dakota which at least between 1994 and 2002 was at the forefront among all the American states and Canadian provinces in terms of population density of this species began to increase rapidly.[101]
A red-winged blackbird clutching a rush in Point Pelee National Park.
The red-winged blackbird (Agelaius phoeniceus) is a passerine bird of the family Icteridae found in most of North America and much of Central America. It breeds from Alaska and Newfoundland south to Florida, the Gulf of Mexico, Mexico, and Guatemala, with isolated populations in western El Salvador, northwestern Honduras, and northwestern Costa Rica. It may winter as far north as Pennsylvania and British Columbia, but northern populations are generally migratory, moving south to Mexico and the Southern United States. Claims have been made that it is the most abundant living land bird in North America, as bird-counting censuses of wintering red-winged blackbirds sometimes show that loose flocks can number in excess of a million birds per flock and the full number of breeding pairs across North and Central America may exceed 250 million in peak years. It also ranks among the best-studied wild bird species in the world. The red-winged blackbird is sexually dimorphic; the male is all black with a red shoulder and yellow wing bar, while the female is a nondescript dark brown. Seeds and insects make up the bulk of the red-winged blackbird's diet.
La Ruĝaflugila agelajo (Agelaius phoeniceus) estas specio de birdo de la familio de Ikteredoj kaj genro de Agelajoj kiu enhavas nigrecajn speciojn kiuj havas kolorajn markojn en kapo aŭ ŝultroj.
Ĝi troviĝas en plejparto de Nordameriko kaj multe de Centrameriko. Ili reproduktiĝas el Alasko kaj Novlando suden al Florido, Golfo de Meksikio, Meksiko kaj Gvatemalo, kun izolaj populacioj en okcidenta Salvadoro, nordokcidenta Honduro kaj nordokcidenta Kostariko. Ili povas vintrumi tiom norde kiom ĝis Pensilvanio kaj Brita Kolumbio, sed nordaj populacioj estas ĝenerale migrantaj, kiuj moviĝas suden al Meksikio kaj suda Usono. La Ruĝaflugila agelajo estas kazo de seksa dimorfismo; la masklo estas tute nigra kun ruĝa ŝultro kaj flava flugilstrio, dum ino estas malhelbruna. Semoj kaj insektoj formas la kernon de la dieto de la Ruĝaflugila agelajo.
La Ruĝaflugila agelajo estas unu el 11 specioj de la genro Agelaius inkludita en la familio Ikteredoj, de paserinaj birdoj troviĝantaj en Norda kaj Suda Amerikoj.[1] La Ruĝaflugila agelajo estis origine priskribata kiel Oriolus phoeniceus fare de Linnaeus en sia verko de la 18a jarcento, Systema Naturae.[2] sed ĝi estis movita poste kun aliaj amerikaj specioj al la genro Agelaius (Vieillot, 1816.[3] La nomo de la genro estas latina devena el antikva greka, agelaios, signife "apartenanta al aro". La nomo de la specio, phoeniceus, estas latina vorto signife "tre ruĝa" de sama deveno kiel la vorto “fenicoj”.[4]
Estas nombroj de subspecioj, kelkaj el dubinda statuso, kiuj estas tre similaj laŭ aspekto, sed la 'Dukolora agelajo' A. p. gubernator de Kalifornio kaj centra Meksiko estas distinga. La masklo ne havas la flavan flugilstrion de la nomiga raso, kaj la ino estas multe pli malhela ol la ino de la nomiga. La taksonomio de tiu formo estas ankoraŭ netute konata, kun la rilatoj inter la du izolataj populacioj de Dukolora agelajo, kaj inter tiuj kaj la Ruĝaflugila agelajo neklaraj.[5] Spite la similaj nomoj, la Ruĝaflugila agelajo (Red-winged Blackbird en angla) rilatas nek al la eŭropa Ruĝaksela turdo (Redwing) nek al la Merlo (Common Blackbird, komuna nigra birdo, en angla), kiuj estas birdoj de la familio de Turdedoj.[1]
La komuna nomo de la Ruĝaflugila agelajo (Red-winged Blackbird) devenas el ĉefe nigra masklo kaj distingaj ruĝaj ŝultromakuloj kiuj videblas dum flugo aŭ memmontrado.[6] Krome la masklo montras ankaŭ palflavan flugilstrion kiel suba bordo de la ruĝa makulo. La ino estas ĝenerale nigrecbruna kaj pli pala sube. La ino estas konsiderinde pli malgranda ol la masklo, nur 17–18 cm longa kaj 36 g peza, antaŭ masklaj 22–24 cm kaj 64 g.[7]
Junuloj similas al inoj, sed estas pli palaj sube kaj havas sablokolorajn plumobordojn. Ambaŭ seksoj havas pintakrajn bekojn. La vosto estas mezlonga kaj rondoforma. La okuloj, beko kaj piedoj estas ĉiuj nigraj.[8]
La masklo estas nekonfuzebla escepte en pleja okcidento de Usono, kie loĝas ankaŭ la Trikolora agelajo. Maskloj de tiu specio havas pli malhelruĝan ŝultromakulon kun bordo blanka kaj ne flava. Inoj de Trikolora, Dukolora, Ruĝaŝultra kaj Ruĝaflugila agelajoj povas esti malfacile identigeblaj en areoj kie loĝas pli da unu formo. Dumfluge kiam la markoj ne facile videblas la Ruĝaŝultra agelajo povas esti distingebla el malpli proksime rilataj ikteredoj kiaj la Kviskaloj kaj la Brunkapa molotro pro sia diferenca konturo kaj ondeca flugo.[5]
Cong-a-lee! call Unu el kelkaj alvokoj sendataj de maskloLa alvoko de la Ruĝaflugila agelajo estas gorĝeca ĉek kaj altatona trenata fajfo, terrr-iii. La maskla kanto estas kraĉa ŭaklii, akompana de memmontrado de la ruĝaj ŝultromakuloj.[9] Ankaŭ la ino kantas, tipe skoldeman babiladon ĉit ĉit ĉit ĉit ĉit ĉit ĉiar tiar tiar tiarr.[5]
La teritorio de la Ruĝaflugila agelajo etendas el suda Alasko al Jukatano sude, kaj el okcidenta marbordo de Kalifornio kaj Kanado al la orienta marbordo de la kontinento. Ruĝaflugilaj agelajoj de la nordaj partoj de la teritorio estas migrantaj, kaj vintrumas en suda Usono kaj Centrameriko. Migrado ekas septembre aŭ oktobre, sed foje tiom frue kiom ĝis aŭguste. En okcidenta kaj meza Usono, populacioj estas ĝenerale nemigrantaj. [10]
La Ruĝaflugila agelajo loĝas en malfermaj herbejaj areoj. Ĝi ĝenerale preferas humidejojn, kaj loĝas kaj ĉe nesalaj kaj ĉe salaj marĉoj, ĉefe de Typha (tifao). Ĝi troviĝas en sekaj areoj de altaj teroj, kie ĝi loĝas en herbejoj, prerioj, kaj malnovaj kampoj.[10]
La Ruĝaflugila agelajo povas esti agresema dum defendo de sia teritorio el aliaj animaloj kaj birdoj. Ili atakas multe pli grandajn birdojn, kiaj korvoj, korakoj, pigoj, rabobirdoj kaj ardeoj se ili venas.[11] Nur en tre bone dokumentataj okazoj oni scias ke ili atakis homojn kiuj eniris en siaj teritorioj dum pariĝado.[12]
La Ruĝaflugila agelajo estas ĉiomanĝanta. Ili manĝas ĉefe plantomaterialon, inklude semojn el herboj kaj greno kia maizo kaj rizo, sed ĉirkaŭ kvarono de ties dieto konsistas el insektoj kaj aliaj malgrandaj animaloj, kaj konsiderinde plie dum la reprodukta sezono.[13] Ili preferas insektojn, kiaj libeloj, zigopteroj, papilioj, tineoj kaj muŝoj, sed konsumas ankaŭ helikojn, ranojn, ovojn, kadavraĵojn, vermojn, araneojn, moluskojn. La Ruĝaflugila agelajo manĝas insektojn per plukado el plantoj, aŭ per kaptado dumfluge.[8] Laŭsezone ili manĝas vakciniojn, rubusojn, kaj aliajn fruktojn. Tiuj birdoj povas esti allogataj al kortaj birdomanĝejoj per pano kaj semomiksoj kaj graso. Fine de somero kaj aŭtune, la Ruĝaflugila agelajo manĝas en malfermaj kampoj, mikse kun kviskaloj, molotroj kaj sturnoj en miksitaj kunmanĝantaroj kiuj povas atingi nombron de miloj.[11]
La Ruĝaflugila agelajo nestumas en izolaj kolonioj. La nesto estas konstruita en tifaejoj, kanejoj, herbejoj, heĝoj aŭ en arbustoj de alno aŭ salikoj. La nesto estas konstruata entute de la ino dum tri al ses tagoj. Temas pri korbaĵo de herboj kaj muskoj, kovritaj el koto, kaj ligita al ĉirkaŭaj herboj aŭ branĉoj.[8] Ĝi situas je 7.6 cm al 4.3 m super akvo.[14]
La ovaro konsistas el 3 aŭ 4, rare 5, ovoj, kiuj estas ovoformaj, mildaj kaj iom brilaj, kaj grandas 24.8 x 17.55 mm[14]. Ili estas palbluecverdaj, markitaj je bruna, purpura aŭ nigra, kun plej parto de markoj je la plej larĝa pinto de la ovo. Nur la ino kovas, kaj eloviĝo okazas post 11 al 12 tagoj. Ruĝaflugilaj agelajoj elnestiĝas blindaj kaj nudaj, sed pretas por elnestiĝo 11–14 tagojn post eloviĝo.[7]
Ruĝaflugilaj agelajoj estas poliginiaj, kun teritoriaj maskloj defendantaj ĝis 10 inojn. Tamen inoj ofte seksumadas kun maskloj krom la partnero kaj ofte demetas ovaron de miksita patreco. Paroj zorgas 2 aŭ 3 ovodemetadojn sezone, en nova nesto por ĉiu ovaro.[7]
Predado de ovoj kaj idoj estas tre komuna. Nestopredantoj estas serpentoj, vizono, lavursoj kaj aliaj birdoj, eĉ malgrandaj kiaj marĉotrogloditoj. La Ruĝaflugila agelajo estas foje viktimo de nestoparazitoj, ĉefe de la Brunkapa molotro.[11] Ĉar nestopredado estas komuna, evoluis kelkaj adaptoj en tiu specio. Grupa nestumado estas unu el tiaj trajtoj kiuj malpliigas la riskon de individua predado per plinombrigo de viglaj parencoj. Nestumado super akvo malpliigas eblojn de predado, same kiel alarmalvokoj. Nestoj krome havigas strategian avantaĝon super predantoj ĉar ili estas ofte bone kaŝitaj en densaj ĉeakvaj kanejoj kaj situaj je alto de 1 al 2 metroj. Maskloj ofte agas kiel sentineloj, uzante varion de alvokoj por komuniki tipon kaj gravon de danĝeroj. Ĉikanado ĉefe fare de maskloj estas uzata ankaŭ por timigi predantojn, kvankam ĉikanado ofte celas grandajn animalojn kaj homfaritajn aĵojn erare. Ankaŭ la bruneca koloro de la ino povas utili kiel kontraŭpredanta trajto ĉar havigas kamuflon por ŝi kaj por ŝia nesto (dum ŝi kovas).[10]
Vintre tiu specio manĝas for de marĉoj, kaj prenas semojn kaj grenon en malfermaj kampoj kaj agrikulturaj areoj. Pro tio ĝi estas konsiderata plago por rikoltoj.[5]
La Ruĝaflugila agelajo (Agelaius phoeniceus) estas specio de birdo de la familio de Ikteredoj kaj genro de Agelajoj kiu enhavas nigrecajn speciojn kiuj havas kolorajn markojn en kapo aŭ ŝultroj.
Ĝi troviĝas en plejparto de Nordameriko kaj multe de Centrameriko. Ili reproduktiĝas el Alasko kaj Novlando suden al Florido, Golfo de Meksikio, Meksiko kaj Gvatemalo, kun izolaj populacioj en okcidenta Salvadoro, nordokcidenta Honduro kaj nordokcidenta Kostariko. Ili povas vintrumi tiom norde kiom ĝis Pensilvanio kaj Brita Kolumbio, sed nordaj populacioj estas ĝenerale migrantaj, kiuj moviĝas suden al Meksikio kaj suda Usono. La Ruĝaflugila agelajo estas kazo de seksa dimorfismo; la masklo estas tute nigra kun ruĝa ŝultro kaj flava flugilstrio, dum ino estas malhelbruna. Semoj kaj insektoj formas la kernon de la dieto de la Ruĝaflugila agelajo.
El tordo sargento[2][3] (Agelaius phoeniceus), también conocido como sargento alirrojo,[4] tordo alirrojo,[5] tordo capitán[5] o turpial alirrojo,[6] es una especie de ave paseriforme de la familia Icteridae.[6] Es un pájaro de hábitos migratorios que habita en zonas húmedas y terrenos de cultivo de América del Norte y Central.[6] Presenta un marcado dimorfismo sexual vinculado a una sensible diferencia en su tamaño y al color del plumaje,[7][8] que se manifiesta a temprana edad.[9] Las hembras son principalmente marrones con un intenso veteado ventral y los machos, predominantemente negros con un par de manchas rojas bordeadas por una banda amarilla sobre las alas.[5][6] Los insectos y las semillas constituyen la mayor parte de su dieta.[5][6][10] Es considerado una plaga para la agricultura.[10][11][12] Quizá sea el ave nativa más abundante de América del Norte,[5] con una población estimada de ciento noventa millones de individuos para 1974 solo en Estados Unidos,[13] por lo que ha sido clasificado como especie bajo preocupación menor.[1][5] Sus poblaciones crecieron enormemente a mediados del siglo XX.[5] El tordo sargento ha sido extensivamente estudiado debido a su sistema de emparejamiento poligínico.[9][14] También se destaca por su alto grado de territorialismo[15] durante la época reproductora.[11]

El tordo sargento es una de las once especies tradicionalmente clasificadas dentro del género Agelaius,[10][16] y una de las cinco que siguen siendo consideradas parte de este desde la reclasificación del Congreso Ornitológico Internacional de 2010.[16] Pertenece a la familia de los ictéridos, la cual comprende a aves paseriformes oriundas de América del Norte y del Sur.[2][10] Carlos Linneo lo describió bajo el nombre de Oriolus phoeniceus en su obra Systema naturae en el siglo XVIII,[10][17] pero en 1816 Louis Jean Pierre Vieillot lo reclasificó dentro del género Agelaius junto con otras aves.[2][10][17][18] Este nombre es una latinización del griego agelaios, «perteneciente a una bandada». El nombre de la especie, phoeniceus, es una palabra latina que significa «rojo intenso».[10]
Importantes diferenciaciones morfológicas entre distintas poblaciones han surgido aparentemente en un contexto de relativamente escasa divergencia filogénica. Cabe destacar que si bien los tordos sargento adultos exhiben una considerable variabilidad en su morfología entre distintas regiones, experimentos de trasplante de huevos entre nidos demuestran que una proporción significativa de las diferencias regionales en el desarrollo de los polluelos no está relacionada con la genética. Es probable que la reducida diferenciación filogeográfica en esta especie en comparación a otros vertebrados estudiados se deba a niveles de flujo genético históricamente elevados, posibles gracias a su gran capacidad de dispersión mediada por la habilidad de volar. Comparado con otros vertebrados, tales como el ratón ciervo (Peromyscus maniculatus), el tordo sargento es una especie altamente interconectada desde un punto de vista genético, sin grandes subdivisiones filogénicas. Aunque la mayoría de los tordos sargento —alrededor del 88%— se reproduce dentro de unos 100 kilómetros de su lugar de nacimiento, el resto se dispersa más allá de esa distancia, e incluso migraciones de larga distancia ocasionales podrían bastar para impedir una diferenciación genética sustancial a través de la deriva genética.[19]
Existen diversas subespecies, las cuales son bastante similares en apariencia.[10][20] La subespecie típica (A. p. phoeniceus) habita desde Ontario centro-septentrional al norte de Florida y desde el río Mississipi al océano Atlántico.[21] A pesar de las similitudes en la mayor parte de las formas de tordo sargento, en la subespecie de la Mesa Central Mexicana, A. p. gubernator, el veteado de la hembra está muy reducido y se restringe a la garganta; el resto del plumaje es marrón muy oscuro.[10][22] En las subespecies californianas, A. p. californicus y A. p. mailliardorum, el veteado de los ejemplares femeninos también cubre una menor superficie y el plumaje es marrón oscuro, aunque no en el grado de gubernator;[22] asimismo su lista superciliar está ausente o poco desarrollada.[20] Los machos de las subespecies mailliardorum, californicus, aciculatus, neutralis y gubernator carecen de la banda amarilla en el ala presente en la mayoría de los miembros masculinos de la especie.[10][20][23] El mayito de la ciénaga (Agelaius assimilis), endémico de Cuba, era considerado antiguamente una subespecie de tordo sargento, pero luego se lo reconoció como una especie distinta.[24]
A continuación, se listan las subespecies y grupos de subespecies de tordo sargento reconocidos a la fecha de enero de 2014 con sus respectivas áreas de distribución y la ubicación de sus cuarteles de invernada:


La coloración del plumaje del macho es negra, a excepción de las plumas cobertoras alares menores —las que cubren los hombros—, que son escarlata,[3] y pueden apreciarse cuando el ave está en vuelo o exhibiéndose.[10] También muestra una banda amarilla pálido más pequeña debajo de las manchas rojas, la cual se vuelve visible en reposo,[10] y se corresponde con las plumas medianas.[3] Las manchas de los machos de menos de un año de edad, generalmente subordinados, son más pequeñas y anaranjadas que las de los adultos.[25]
Las partes superiores de la hembra son de color marrón, mientras que las inferiores están cubiertas por un intenso veteado blanco y oscuro;[6] presenta asimismo una lista superciliar blanquecina.[5][26] Las hembras de un año exhiben una mancha rosada o salmón sobre los hombros y una coloración rosada clara en el rostro y debajo de este, mientras que las de mayor edad muestran una mancha por lo general más carmesí sobre los hombros y una tonalidad rosada oscura en el rostro y debajo del mismo.[27] Observaciones en hembras en cautividad indican que pequeñas cantidades de pigmento amarillo están presentes en los hombros de estas tras abandonar el nido, que la concentración del pigmento aumenta con el primer plumaje de invierno tras la muda de las plumas y que el pasaje de amarillo a naranja tiene lugar generalmente en el segundo verano con la adquisición del segundo plumaje de invierno, después de lo cual ya no se producen nuevos cambios en el color de las plumas.[28] El área coloreada en el ala aumenta en superficie con la edad de la hembra,[9] y varía en intensidad de marrón a un rojo-anaranjado brillante similar al de los machos en su primer año.[29]
Los juveniles son similares a las hembras adultas, pero presentan una coloración abdominal más pálida y bordes beiges en las plumas.[10] A diferencia de la mayor parte de los paseriformes norteamericanos, que desarrollan su plumaje adulto en su primer año de vida, de modo que el individuo de un año y el de más edad son indistinguibles en la temporada reproductiva, el tordo sargento no lo adquiere sino hasta después de la época de reproducción del año siguiente a su nacimiento, cuando tiene entre trece y quince meses de edad.[30] Los machos jóvenes atraviesan una etapa de transición en la que las manchas alares presentan una coloración anaranjada antes de adquirir el tono más intenso típico de los adultos.[26]
El macho mide entre 22 y 24 cm de longitud, mientras que la hembra, 17 o 18 cm.[10] Su envergadura es de entre 31 y 40 cm aproximadamente.[nota 2][5] El pico en ambos sexos es largo, delgado y puntiagudo.[6][26][31] Tanto el pico del macho como las patas, las garras y los ojos son negros;[6][26][32] en la hembra el pico es marrón oscuro en la mitad superior y claro en la inferior.[26] La cola es de longitud media y redondeada.[5][10] Así como en otras especies poligínicas, existe en el tordo sargento un considerable dimorfismo sexual tanto en el plumaje como en el tamaño, pesando los machos entre 65 y 80 g y las hembras alrededor de 35 g.[11][33] Los machos son un 50% más pesados que las hembras,[nota 3] un 20% más grandes en sus dimensiones lineares,[7] y un 20% más grandes respecto de la longitud de sus alas.[8] La tendencia hacia un mayor dimorfismo en el tamaño de las especies de ictéridos no monógamas indica que el mayor tamaño de los machos ha evolucionado a causa de la selección sexual.[8]
El macho es inconfundible a lo largo de la mayor parte de su área de distribución, excepto en California y algunas áreas aledañas, en donde cohabita con el tordo tricolor (Agelaius tricolor), de aspecto similar.[5][10] Sin embargo, el macho de esa especie presenta manchas alares de un color rojo más intenso, bordeadas de blanco en vez de amarillo.[5][10] En vuelo, es posible discriminar entre estos e ictéridos menos emparentados —tales como el zanate norteño (Quiscalus quiscula) y el tordo cabecicafé (Molothrus ater)— por su particular silueta y su movimiento ondulante.[10]
Dos ketocarotenoides —carotenoides con un grupo cetona— rojos sintetizados por las propias aves —a saber, la astaxantina y la cantaxantina— son responsables del brillante color rojo de las manchas alares, pero dos pigmentos precursores dietarios amarillos —la luteína y la zeaxantina— también están presentes en concentraciones moderadamente altas en las plumas rojas. La astaxantina es el carotenoide más abundante (35% del total), seguida por la luteína (28%), la cantaxantina (23%) y la zeaxantina (12%). Una combinación tan balanceada de precursores dietarios y derivados metabólicos en las plumas de color es bastante inusual, no solo dentro de una especie en su conjunto sino también en individuos y plumas particulares.[34]
Después de extraer los carotenoides en un experimento, las plumas rojas adquirían una coloración marrón profundo. Esto se debe a que las bárbulas de las plumas de la mancha coloreada contienen pigmentos melanínicos —principalmente eumelanina, que equivalía al 83% del total de las melaninas, pero también feomelanina— en una concentración aproximadamente igual a la de los carotenoides, lo cual parece ser un rasgo poco común para un plumaje ornamental de base carotenoidea. Por otro lado, las plumas de las franjas amarillas de los machos están desprovistas de carotenoides —excepto ocasionalmente cuando aparecen teñidas de una coloración rosada derivada de pequeñas cantidades de dichos pigmentos— y presentan altas concentraciones de feomelanina —82% del total de las melaninas—. Las concentraciones de melanina en la banda amarilla son aún más altas que en la mancha roja.[34]
Estas manchas son vitales en la defensa del territorio.[35] Los machos con las manchas más grandes son más efectivos al ahuyentar a sus rivales no territoriales y tienen mayor éxito en contiendas dentro de aviarios.[36][37][38] Al teñirlas de negro como parte de un experimento, el 64% de los machos perdió sus territorios, mientras que solo el 8% de los individuos de control lo hizo. Sin embargo, los machos cuyas alas habían sido teñidas antes de que hubieran conseguido pareja aún podían atraer hembras y reproducirse exitosamente. En el tordo sargento, las manchas sobre las alas constituyen una señal de amenaza entre los machos y tienen un rol poco importante, si es que acaso tienen alguno, en encuentros intersexuales. Por lo tanto, es probable que las manchas hayan evolucionado en respuesta a las presiones vinculadas a la selección intrasexual.[39] Adicionalmente, ni el tamaño ni la coloración de las mismas están vinculados al éxito reproductivo de los machos con aquellas hembras que no son compañeras suyas, es decir, aquellas con las que copulan eventualmente.[35] Se ha sugerido que también en el caso de las hembras la mejor explicación para la evolución de una coloración variable en las manchas de los hombros es que su intensidad indique la condición física de estas en encuentros agresivos entre las mismas.[29]
El hecho de que las hembras de tordo sargento no parezcan utilizar consistentemente la variabilidad en el tamaño y color de las manchas alares de los machos a la hora de elegir compañero va en contra de la función clásica de las plumas ornamentales de pigmentación carotenoidea, mayormente empleadas en la atracción de pareja. A su vez, su uso como señal de agresividad y estatus social frente a machos rivales no es un rasgo común en los ornamentos carotenoideos. Por otro lado, los ornamentos con preponderancia de melanina sí suelen tener un rol importante como indicador de estatus en las poblaciones aviares, por lo que las manchas de los tordos sargento parecerían funcionar más como ornamentos melanínicos que como carotenoideos.[34]
El período más crítico de la muda de las plumas se extiende entre fines de agosto y comienzos de septiembre. Cuando se los observa en vuelo, presentan una apariencia desalineada o «apolillada» y, por lo general, un desplazamiento más lento y trabajoso. Su movilidad se ve reducida debido a que les faltan varias rémiges o rectrices o estas no están enteramente renovadas. La mayor parte de los tordos sargento ha mudado casi por completo para el 1 de octubre. Para entonces, algunas aves no han concluido la muda de las plumas de la región capital y las plumas timoneras del centro de la cola y las rémiges secundarias internas han emergido solo parcialmente de la vaina. Virtualmente todos los individuos han finalizado sus mudas para mediados de octubre.[40]
Las aves no comienzan su migración a los cuarteles de invernada hasta que las dos rémiges primarias externas y las dos rectrices internas o centrales hayan completado al menos dos tercios de su desarrollo. Por lo tanto, existe una correlación entre la muda, particularmente el reemplazo de las rémiges y rectrices, y la migración de otoño en los tordos sargento.[40]
A pesar de que las puntas marrones o blancas en las plumas de los machos sean más grandes justo después de la muda y de que se desgasten a lo largo del año, los individuos varían considerablemente en cuanto al tamaño de esas puntas no negras en las plumas en primavera.[42]
El reemplazo completo de las plumas alares requiere unas ocho semanas. Sin embargo, las aves en su primer año de edad frecuentemente retienen algunas de las cobertoras de debajo del ala y rémiges terciarias juveniles después de la muda postjuvenil. De setenta machos inmaduros examinados durante la última semana de octubre, el 70% conservaba algunas cobertoras primarias inferiores mayores. En la mayoría de los casos en los que se produce un reemplazo parcial de las plumas cobertoras, son las cobertoras proximales las que el ave retiene.[40]
Las rémiges primarias son unas de las primeras plumas en mudar. La muda de estas plumas procede regularmente desde la primaria más interna —primaria I— hasta la más externa —primaria IX—. Para el 1 de octubre, la mayoría de las aves ya ha adquirido las tres nuevas primarias externas —VII, VIII y IX— o estas se encuentran en alguna etapa avanzada de desarrollo. Las fechas promedio para la compleción del desarrollo de las nuevas rémiges primarias son: 15 de agosto para la primaria I; 1 de septiembre, primarias II-IV; 15 de septiembre, primarias V y VI; y 1 de octubre, primarias VII-IX.[40]
La muda de las rémiges secundarias comienza con la más externa —secundaria I— y procede hacia adentro hasta la secundaria VI. La vaina de la secundaria I aparece más o menos al mismo tiempo en que todas las cobertoras secundarias han sido remplazadas y rara vez antes de mediados de agosto. Estas plumas no se renuevan totalmente sino hasta comienzos de octubre.[40]
La muda de las rémiges terciarias se inicia más o menos al mismo tiempo que la de las secundarias. La terciaria del medio cae primero, seguida de la terciaria interna. A menudo, ambas plumas se encuentran nuevamente bien desarrolladas antes de que la terciaria externa salga de la vaina.[40]
Las cobertoras primarias mayores son cambiadas junto con sus respectivas rémiges primarias. A diferencia de las cobertoras primarias mayores, las cobertoras secundarias mayores mudan antes que las rémiges secundarias. La muda de estas plumas es rápida, con varias de ellas en la misma etapa de desarrollo simultáneamente. La progresión de la muda en estas plumas es de afuera hacia adentro, como en las rémiges secundarias. La mayoría de las aves ha completado la muda de las cobertoras secundarias para el 15 de agosto, más o menos al tiempo en que solo es apreciable la vaina de la rémige secundaria I.[40]
La muda de las cobertoras menores comienza temprano, siendo con frecuencia las primeras plumas en caer. El inicio de la muda en los juveniles machos es particularmente notorio debido a que implica el reemplazo de las cobertoras menores y resulta en la aparición de la mancha alar rojiza o anaranjada. La nueva mancha alar contrasta marcadamente con el plumaje juvenil marrón amarillento en esta área del ala. La muda de las cobertoras menores generalmente ha concluido para el 1 de septiembre.[40]
Las plumas del álula completan su desarrollo más o menos al mismo tiempo que las últimas tres rémiges primarias. Las cobertoras marginales sobre la superficie superior o exterior del antebrazo, ubicadas debajo del álula, mudan aproximadamente al mismo tiempo en que la rémige primaria VI está siendo remplazada.[40]
Las primeras plumas de debajo del ala en mudar son las cobertoras marginales, debajo del antebrazo. La muda de estas plumas comienza más o menos al mismo tiempo en que la rémige primaria IV cae y es seguida por la de las cobertoras primarias inferiores medias y secundarias inferiores medias. La progresión de la muda de las cobertoras secundarias inferiores medias es de afuera hacia adentro, mientras que la de las cobertoras primarias inferiores medias parece ser irregular o casi simultánea. Las cobertoras inferiores medias mudan antes que las rémiges primarias VIII y IX. Las cobertoras primarias inferiores mayores y secundarias inferiores mayores mudan por último. La progresión de la muda de estas últimas plumas es la misma que en las rémiges primarias y secundarias, es decir, de adentro hacia afuera y de afuera hacia adentro, respectivamente. La muda se completa más o menos al mismo tiempo que la de las rémiges primarias y secundarias.[40]
Las plumas caudales comprenden las plumas timoneras o rectrices y las cobertoras superiores e inferiores de la cola. Las cobertoras de la cola comienzan a mudar antes que las rectrices. Generalmente, las cobertoras superiores de la cola empiezan a mudar primero. Ciertas aves pierden algunas rectrices para el final de la tercera semana de agosto. Las timoneras del centro de la cola son las últimas rectrices en ser renovadas.[40]
La muda en la región capital implica el cambio de las plumas del píleo y de los lados de la cabeza. Es una de las últimas partes del cuerpo en comenzar el reemplazo de las plumas, pero el renovamiento de la mayor parte de las plumas capitales está completo antes que el de las rémiges secundarias, plumas de la cola y de debajo del ala. El inicio de la muda en esta región coincide con el comienzo del desarrollo de la rémige primaria V o VI. Algunos individuos ya han empezado el reemplazo de las plumas capitales para mediados de agosto. La muda comienza en el píleo y las últimas zonas de la región capital en completarla son la franja del ojo y las mejillas (región malar).[40]
En algunas aves, los primeros signos de muda en las plumas ventrales aparecen durante los últimos días de julio, cuando las plumas de la porción anterior de los laterales comienzan a caer. Desde allí, la muda progresa hacia atrás a lo largo de los laterales y hacia adelante en dirección a la garganta y la barbilla. Las últimas plumas ventrales en ser remplazadas son aquellas hacia el centro del abdomen. La muda de las plumas dorsales se inicia alrededor de la primera semana de agosto. Empieza en el obispillo, avanza hacia la espalda alta y luego hacia la región cervical.[40]
La evidencia más temprana de muda en las plumas humerales corresponde a los últimos días de julio. La muda procede de la región anterior hacia atrás. El cambio de las plumas femorales comienza más tarde que el de las humerales. Sin embargo, la progresión es similar. El reemplazo de las plumas crurales rara vez se inicia antes del 15 de agosto. La progresión es generalmente del extremo proximal de la tibia a la región del tarsometatarso.[40]
El tordo sargento está muy diseminado por toda América del Norte, excepto en el desierto árido, las altas cadenas montañosas y las regiones árticas o de forestación densa.[41] Se reproduce desde Alaska centro-oriental y Yukón, en el noroeste,[11] y Terranova, en el noreste,[10] hasta el norte de Costa Rica, en el sur, y del Atlántico al Pacífico.[11] Las poblaciones septentrionales migran al sur de los Estados Unidos, pero las que se reproducen allí, en México y en Centroamérica son sedentarias.[23] El área de distribución invernal del tordo sargento oriental cubre gran parte de su área distribución reproductiva en los estados del sudeste y del sur. La mayor parte de las aves pasa el invierno al sur de los ríos Ohio y Delaware y desde el norte de Florida hasta el norte de Luisiana y noreste de Texas. Por otro lado, algunos pocos ejemplares podrán ser encontrados ocasionalmente en invierno bastante más al norte de esos límites, incluso tan al norte y al este como el sudeste de Massachusetts, de manera local y principalmente a lo largo de la costa.[41]
Habita en áreas abiertas con hierba y generalmente prefiere los humedales.[10] Se reproduce tanto en pantanos de agua dulce como de agua salada.[10][26] Los pantanos con extensos lotes de totoras (Typha spp.), ciperáceas y carrizos (Phragmites australis) son su hábitat reproductivo favorito, aunque también puede hallársele allí donde tipos similares de vegetación, o arbustos o pequeños árboles hidrófilos, crezcan en estanques, alrededor de lagos o a lo largo de las orillas de arroyos de escaso caudal.[41] En gran parte de su área de distribución, constituye el ave paseriforme más abundante en los pantanos en los que nidifica.[11] También se encuentra presente en áreas sin mucha agua, en donde habita en campo abierto —a menudo áreas agrícolas— y bosques caducifolios poco densos.[26]
En el invierno de 1975-1976, en las cercanías de Milan (oeste de Tennessee), el 36% de los tordos sargento observados —que descansaban en un dormidero mixto que llegó a albergar 11 millones de individuos en enero y a comienzos de febrero en una plantación de 4,5 hectáreas de pino amarillo (Pinus taeda) con escaso sotobosque—[nota 4] fue visto en campos de soja durante el día, siendo que estos constituían solo el 21% del hábitat en la zona y que las otras especies de aves presentes en el dormidero no eran comúnmente observadas en esos campos; también eran comunes en maizales. Su presencia en feedlots aumentó a medida que avanzaba el invierno, pero, representando menos del 5% de los ictéridos y estorninos registrados tanto en feedlots de vacas como de cerdos, eran mucho más escasos allí que los tordos cabecicafé (Molothrus ater), zanates norteños (Quiscalus quiscula) y estorninos pintos (Sturnus vulgaris).[43]
Durante la época de reproducción, la densidad de adultos reproductivos es mucho mayor en pantanos que en campos en tierras altas.[38] Aunque las mayores concentraciones de tordos sargento anidando se encuentren en pantanos, la mayoría de ellos nidifica en hábitats de tierras altas puesto que son mucho más abundantes.[44][45][46] En un estudio llevado a cabo en el condado de Wood (norte de Ohio) entre 1964 y 1968, se constató una densidad de machos territoriales en humedales —pantanos y zanjas— 2,89 veces superior a la registrada en los hábitats de tierras altas —principalmente henares de alfalfa (Medicago sativa) y otras legumbres— y una proporción de 2,14 territorios en tierras altas por cada territorio en humedales, lo cual refleja una marcada preferencia por estos últimos hábitats así como su escasez.[47]
En un estudio en Illinois central, las poblaciones de tordos sargento eran mucho mayores a lo largo de carreteras interestatales que a los lados de rutas de menor envergadura. Esto probablemente se deba a que las primeras se ubicaban en medio de amplias franjas dominadas por el pasto azul de Kentucky (Poa pratensis), a menudo en compañía de arbustos y pequeños árboles. Por otro lado, las pequeñas dimensiones del área no cultivada a los lados de las rutas de menor envergadura presumiblemente brindaran menos sustratos adecuados para la nidificación.[48]
Según un estudio en el condado de Washtenaw (sudeste de Míchigan), en las áreas agrícolas, los tordos sargento parecen exhibir marcadas preferencias por ciertos tipos de hábitats durante la temporada reproductiva. Aquellos hábitats con más vegetación vieja —campos agrícolas en desuso y humedales— son ocupados tempranamente en la época de reproducción. El establecimiento de las aves en otros hábitats favorecidos pero con vegetación inadecuada —henares viejos y nuevos y pasturas— es pospuesto hasta que se haya desarrollado una suficiente cantidad de vegetación nueva. Los hábitats favorecidos inexistentes el año anterior —henares nuevos— son los últimos en ser ocupados. Cuando los nuevos henares finalmente comienzan a ser utilizados, son ocupados muy rápidamente, probableblemente por adultos sin sitios de reproducción y machos territoriales no exitosos.[49]
En ese mismo estudio, los individuos reproductivos en hábitats de tierras altas demostraban una ligera preferencia por pastos viejos y nuevos —Phleum pratense, Dactylis glomerata, Poa spp., Festuca spp., Bromus spp.— en la primera parte de la época de reproducción y plantas herbáceas no graminoides nuevas a mediados y finales de la temporada.[nota 5] En humedales, preferían consistentemente monocotiledóneas viejas y nuevas de hoja ancha —principalmente Carex spp. de hoja ancha y Typha spp.— y rechazaban consistentemente las monocotiledóneas viejas y nuevas de hoja angosta —primordialmente Carex spp. de hoja angosta, Phalaris arundinacea y Calamagrostis canadensis— y plantas herbáceas no graminoides. Los tordos sargento que se reproducían en tierras altas se inclinaban por la vegetación vieja de mayor altura solo en la primera parte de la temporada reproductiva —abril y mayo— y por la vegetación nueva más alta y la vegetación densa durante toda la temporada reproductiva. Por su parte, los que se establecían en humedales parecían tener una ligera predilección por la vegetación vieja más alta.[49] Durante la época de reproducción, esta especie se siente atraída a la vegetación alta y que restrinja la visibilidad.[49][50]
Las preferencias de principios de la temporada por pastos viejos en las tierras altas y monocotiledóneas viejas de hoja ancha en los humedales señalan la importancia de la vegetación residual erguida. Los pastos de las tierras altas y las monocotiledóneas de hoja ancha de los humedales se yerguen de manera parcialmente vertical y son fácilmente visibles a principios de la primavera, a diferencia de los tréboles, las monocotiledóneas de hoja angosta en los humedales y la mayoría de las plantas herbáceas no graminoides. Las plantas viejas de alfalfa también se encuentran parcialmente erguidas a inicios de la primavera, pero no constituye una especie tan consistentemente escogida como los pastos viejos. El comienzo de la actividad territorial es más temprano cuando la cantidad de vegetación residual es grande. La fortaleza estructural de la vegetación también parece ser importante para la nidificación dado que las hembras se inclinan por monocotiledóneas de hoja ancha en los humedales a lo largo de la época de reproducción y plantas herbáceas no graminoides nuevas a mediados y finales de la temporada.[49]
En el sudoeste de Míchigan, la densidad de tallos de totoras en diferentes estanques estaba positivamente relacionada con la concentración de adultos reproductivos.[51] Sin embargo, otros estudios detectaron una predilección por la vegetación más esparcida.[50][52] Uno de ellos encontró que los tordos sargento evitaban a los chivirenes pantaneros (Cistothorus palustris), un depredador común en nidos de esta especie, reproduciéndose entre vegetación más dispersa, que era más fácilmente defendida de los chivirines; a la inversa, los chivirines parecían preferir la vegetación más densa, en donde eran más proclives a evitar la agresividad del tordo sargento; estas diferencias en la selección del hábitat entre una y otra especie resultaban en una segregación espacial de sus áreas de reproducción.[52] Por otro lado, los tordos sargento suelen optar por lotes de vegetación pequeños y las plantas con tallos gruesos.[50]
Quizá sea el ave nativa más abundante de América del Norte.[5] En el invierno de 1974-1975, el Servicio de Pesca y Vida Silvestre de los Estados Unidos estimó que en ese país, de once especies de aves —diez ictéridos y el estornino pinto (Sturnus vulgaris)— que se congregan en dormideros, el tordo sargento era por lejos la más abundante, representando el 37,8% del total —casi 190 millones de individuos—, habiendo ascendido considerablemente desde aproximadamente un 33% en 1963-1964. Cabe destacar que mientras que en los estados orientales constituía el 29,7% del total —alrededor de 111 millones—, en los occidentales componía el 61,4% —cerca de 79 millones—.[13] A pesar de representar allí un porcentaje mucho mayor sobre el total de ictéridos y estorninos, en el oeste del continente las poblaciones están más esparcidas que en el este.[53]
En el sudoeste de Míchigan, 1,78 polluelos por nidada lograron abandonar el nido, lo que implica una tasa de supervivencia del 54%.[51] En otro estudio en la misma población, por cada nidada de cuatro huevos en promedio eclosionaron 3,78 de ellos y 1,96 polluelos sobrevivieron hasta dejar el nido, lo que equivale a una tasa de mortalidad del 48% de los pequeños que conseguían romper el cascarón.[54] La cantidad promedio de polluelos por hembra que logran abandonar el nido cada temporada es de al menos 2,5. La tasa de supervivencia anual es de cerca del 60% para las aves adultas —de al menos un año de edad— y probablemente inferior al 40% para los individuos de menos de un año. El análisis de registros de aves marcadas indica que menos del 1% de los individuos identificados cuando eran polluelos logra superar los siete años de edad.[45] El ejemplar más longevo en estado salvaje del que se tenga registro vivió 15 años y 9 meses.[26]
En una población reproductiva en el condado de Brown (sur de Indiana), se descubrió que la proporción representada por cada sexo sobre el total de los polluelos que sobrevivía hasta dejar el nido variaba según la edad de la madre. Las hembras de más edad —5 años o más— producían una mayor cantidad de machos; las de mediana edad —3 o 4 años—, casi la misma proporción de hijos de ambos sexos, y las más jóvenes —1 o 2 años—, más hembras que machos. Más machos que hembras eclosionaban en los nidos de las madres de más edad, mientras que para las de mediana edad y las más jóvenes, la cantidad de recién nacidos de uno y otro sexo era más o menos equivalente. Los hijos de las hembras jóvenes morían de hambre más frecuentemente que los de las mayores y los pequeños fallecidos por esta causa eran generalmente machos, probablemente debido a que en el mismo intervalo de desarrollo estos alcanzan una masa corporal muy superior a la de las hembras y por lo tanto requieren un mayor suministro de energía, siendo más vulnerables ante un aprovisionamiento insuficiente. En el caso de las hembras de mediana edad, la proporción de polluelos machos y hembras al nacer estaba balanceada y no se alteraba luego por la mortalidad de estos. En la población en su conjunto, la cantidad de pequeños de ambos sexos estaba equilibrada.[9]
En un estudio en el este de Ontario, se encontró que, al nacer, la proporción de machos sobre hembras durante la época de reproducción en su conjunto era de 1 a 0,94. Sin embargo, las proporciones de individuos de uno y otro sexo sobre el total de los polluelos variaban conforme avanzaba la temporada: las nidadas iniciadas temprana y tardíamente —antes del 11 de mayo y después del 31 de mayo— producían más hembras y las de mediados de la temporada, más machos. Aunque dichas diferencias estacionales fueran pequeñas, el patrón descubierto en la proporción de pequeños de uno y otro sexo guardaba coherencia con el patrón de abundancia prevista de recursos, puesto que el mayor costo energético implicado en la crianza de machos en especies sexualmente dimórficas debería favorecer la producción de una mayor cantidad de polluelos de este sexo cuando el alimento abunda.[55]
Se trata de aves territoriales, poligínicas, gregarias y migratorias de corta distancia. Su manera de volar es característica, con raptos de rápido batimiento de alas, entre los cuales se producen pequeñas pausas intermitentes.[41] El comportamiento de los machos hace que su presencia sea fácilmente percibida: se posan en lugares altos[5] —árboles, arbustos, cercas, líneas de teléfono, etc.—[56] y cantan durante todo el día. Las hembras suelen quedarse en lo bajo, merodeando entre la vegetación y construyendo sus nidos. Puede encontrárseles en jardines hogareños, particularmente durante su migración, si se ha esparcido semillas sobre el suelo.[5] Las cortinas forestales les sirven de lugar de descanso durante el día.[57]
Durante varias semanas después de su primera aparición a comienzos de la primavera, los tordos sargento son vistos generalmente en bandadas compuestas íntegramente por machos. Por esos días, rara vez se los ve en sus sitios de reproducción, excepto temprano en la mañana y tarde en la tarde. En la mayoría de las restantes horas del día, frecuentan terrenos agrícolas abiertos y a menudo elevados, en donde se alimentan principalmente en rastrojos de granos y campos cubiertos con hierbas. Cuando son molestados mientras comen, vuelan a los árboles caducifolios más cercanos e inmediatamente después de posarse comienzan a cantar.[41]
Esta especie es omnívora.[10][26] Se alimenta principalmente de productos vegetales —particularmente en otoño e invierno—,[6] tales como semillas de hierbas y granos (maíz, arroz, trigo, girasol, etc.),[5][12] pero alrededor de un cuarto de su alimentación —y significativamente más durante la temporada de reproducción— consiste en insectos y otros animales pequeños.[10][26] Consume principalmente insectos como libélulas, caballitos del diablo, mariposas, polillas y otros insectos alados, pero también caracoles, ranas, huevos, carroña, lombrices y arácnidos.[10] Consigue sus presas entre las plantas o atrapándolas en vuelo.[10][26] A veces las obtiene explorando la base de plantas acuáticas con su pico delgado, abriendo orificios para llegar a los insectos escondidos adentro.[5][26] Los insectos acuáticos, particularmente los odonatos emergentes, son de gran importancia en la dieta de los tordos sargento que se reproducen en pantanos. Estas aves típicamente capturan a los odonatos cuando las larvas trepan desde el agua por el tallo de una planta, se deshacen de sus exuvias y se aferran a la vegetación mientras sus exoesqueletos se endurecen.[51] Los años de emergencia de las cigarras periódicas (Magicicada spp.) proporcionan una cantidad superabundante de alimento.[29] En temporada, come además arándanos, moras y otras frutas.[10] Según Edward Howe Forbush, cuando llegan al norte en la primavera, se alimentan en los campos y prados. Luego, siguen a los arados, recogiendo larvas, lombrices y orugas dejadas al descubierto, y en caso de haber una plaga de orugas de Paleacrita vernata en un huerto de frutales, estas aves volarán un kilómetro para conseguirlas para sus polluelos.[41]
Se alimenta de maíz mientras este se encuentra en proceso de maduración; una vez que el grano se ha endurecido está relativamente a salvo de esta ave, puesto que su pico y sistema digestivo no están adaptados para el consumo de granos de maíz duros y enteros, a diferencia de lo que sucede con el zanate norteño (Quiscalus quiscula), que tiene un pico más largo y fuerte.[45] Estudios de los estómagos de individuos de ambos sexos revelan que los machos consumen mayores proporciones de granos de cultivo, mientras que las hembras ingieren una cantidad relativamente mayor de semillas de hierbas y materia animal.[28] En el invierno de 1975-1976, en las cercanías de Milan (oeste de Tennessee), el maíz y las semillas de hierbas constituyeron los principales alimentos consumidos por los tordos sargento. Las hierbas cuyas semillas eran comúnmente consumidas eran Sorghum halepense, Xanthium strumarium, Digitaria ischaemum, Sporobolus spp., Polygonum spp. y Amaranthus spp.[43]
El tordo sargento se reproduce en la mayor parte de América del Norte tanto en humedales como en hábitats de tierras altas.[54] Los machos llegan a las áreas de reproducción dos o tres semanas antes que las hembras para establecer sus territorios;[58][59] luego las hembras se asientan dentro de los mismos.[60][61] Los machos arriban a los sitios reprductivos a mediados de marzo,[58] y las hembras, a principios de abril.[62] Las hembras de mayor edad llegan antes que las de un año.[63] Los machos comienzan a establecer sus territorios durante la primera semana de abril y empiezan a producir espermatozoides durante la segunda.[58] En un estudio en el condado de Washtenaw (sudeste de Míchigan), se encontró que la diferencia temporal entre el establecimiento de los territorios por parte de los machos y la aparición de las hembras en dichos territorios variaba en función del hábitat: al menos cuatro semanas en las pasturas, una a tres semanas en henares viejos, campos de cultivo en desuso y humedales y cero en henares nuevos.[49]
La temporada reproductiva del tordo sargento se extiende aproximadamente desde fines de abril a fines de julio.[53][64] Por otro lado, en diferentes estados se ha estimado que el período en el que los nidos activos contenían huevos se extendía entre comienzos a fines de abril y comienzos a fines de agosto; y en el norte de Luisiana, se constató que los nidos albergaban polluelos desde fines de abril hasta fines de julio. La cúspide de la temporada de nidificación (el momento con mayor cantidad de nidos activos) ha sido registrada entre la primera mitad de mayo e inicios de junio en distintos lugares.[65] Un estudio en el este de Ontario descubrió que aunque los tordos sargento comenzaban a nidificar más temprano en años con primaveras cálidas, asociadas a bajos valores invernales en el índice de oscilación del Atlántico Norte, las fechas de puesta de los huevos permanecían inalteradas.[66] Los niveles de testosterona en los machos alcanzan su punto culminante en la primera parte de la época de reproducción, pero se mantienen altos a lo largo de la temporada.[42] Las hembras se reproducen por hasta diez años.[63]
Para el momento en que se producen las cópulas, disminuyen significativamente la cantidad de canciones y exhibiciones de los machos y el número de intrusiones a territorios ajenos. Antes del apareamiento muchos aspectos del territorialismo llegan a su punto máximo. Después de este, la frecuencia de muchas de las conductas territoriales decrece y los machos territoriales se ocupan principalmente de la defensa de las hembras, los huevos y los polluelos de la depredación. Experimentos de remoción sistemática de las aves de sus territorios sugieren que la población extra de machos que se encuentra presente en los pantanos antes de las cópulas desaparece después de las mismas.[67]
El establecimiento de un territorio durante la temporada reproductiva es clave para los machos, pues aquellos que no consiguen uno son responsables de un bajo porcentaje de las fecundaciones. La intensidad de la competencia por las parcelas se ve reflejada en el alto número de intrusiones a los dominios de los machos propietarios, lo que los obliga a pasar buena parte de su tiempo alejando a invasores de sus territorios. Sin embargo, las disputas agresivas por las parcelas son infrecuentes. Los dominios de los machos pueden hallarse tanto aislados como contiguos, y sus límites están bien definidos y se mantienen a lo largo de la temporada. Su forma y tamaño son altamente variables y dependen del tipo de vegetación y hábitat, cercanía a árboles y densidad de población. Aunque suelen alimentarse fuera de sus territorios, durante el período de cópulas los machos pasan casi todo el día dentro de ellos.
La enorme mayoría de los individuos masculinos obtiene una parcela por primera vez al tomar posesión de los dominios de un macho territorial que no haya sobrevivido al invierno. Asimismo, pueden establecerse en espacios ya ocupados a través de un proceso gradual y persistente. En otras ocasiones, invaden territorios en presencia de sus dueños simplemente haciéndose presentes en el área y permaneciendo allí a pesar de los ataques recibidos. Empero, en ciertas oportunidades, demuestran dominancia inmediata sobre el residente. En los casos en los que dos machos con parcelas adyacentes regresan al mismo sitio un segundo año, los límites territoriales a menudo se ajustan a los del año anterior.
El tordo sargento se caracteriza por su sistema de emparejamiento poligínico. Su poliginia ha hecho de esta ave una especie extensivamente estudiada. Los machos territoriales pueden alcanzar las quince compañeras en algunos casos, aunque normalmente tienen dos o tres. El tamaño promedio del harén varía entre 1,6 y 6,2 hembras en distintas poblaciones. Tanto la calidad del macho como la de su territorio influyen en grados variables sobre el éxito reproductivo femenino y, en consecuencia, sobre la elección de pareja por parte de las hembras. Debido a que la calidad del macho guarda solo una débil relación con la de su parcela, es necesario considerar ambos parámetros por separado. A su vez, los dos componentes de la calidad parental masculina ―esfuerzo en la defensa del nido y alimentación de los polluelos― difieren entre los distintos individuos y no covarían. En algunas especies, particularmente en las poligínicas, un sistema de emparejamiento basado en la defensa de un recurso ―un territorio― está asociado a una considerable variabilidad en el éxito en la obtención de pareja de los machos, y este es el caso del tordo sargento.
Probablemente el hombre mate a más tordos sargento que cualquier depredador natural debido a que estos atacan los cultivos de cereales. Las colonias reproductivas son campos de caza fructíferos tanto para depredadores mamíferos como aviares.[41] Entre los depredadores conocidos de la especie, pueden mencionarse el mapache (Procyon lotor),[10][26][45][68][69][70] el visón americano (Neovison vison),[10][26][45][69][71] la comadreja de cola larga (Mustela frenata),[70] el chivirín pantanero (Cistothorus palustris),[10][14][26][41][68][72][73] el cuervo americano (Corvus brachyrhynchos),[41][69][70][73][74] la urraca (Pica pica),[26][73][75] el zanate norteño (Quiscalus quiscula),[41][73] los halcones,[26] los búhos,[26] el gavilán colirrojo (Buteo jamaicensis),[69] las serpientes[3][10][68] —como la serpiente de agua del norte (Nerodia sipedon)[41] y la culebra de las praderas (Thamnophis radix)—,[73] etc. Los cuervos y zanates se alimentan de los huevos, e incluso de polluelos pequeños, si el nido es dejado sin vigilancia. Los chivirines pantaneros picotean los huevos y luego beben su contenido; en ocasiones, después de algunos sorbos, toman el huevo roto con su pico y se lo llevan para continuar alimentándose en otro lado. Con frecuencia, se encuentran uno o más huevos en un nido con agujeros prolijos y circulares sobre un lado, tal como los que produce el pequeño y puntiagudo pico del chivirín.[41]
La importancia relativa de diferentes depredadores de nidos varía en función de la región geográfica: los principales depredadores en distintas regiones incluyen al chivirín pantanero en la Columbia Británica, las urracas en Washington y los mapaches en Ontario.[73] La incidencia de la depredación aviar en los nidos de tordo sargento es mayor en las poblaciones occidentales que en las orientales.[76]
Debido a las altas tasas de depredación, especialmente de los huevos y polluelos, el tordo sargento ha desarrollado diversas adaptaciones para proteger sus nidos. Una de ellas consiste en nidificar en grupos, lo cual reduce el peligro puesto que existe un mayor número de padres alerta. Anidar sobre el agua también disminuye las probabilidades de un ataque. Los nidos en particular ofrecen una ventaja estratégica ya que con frecuencia se hallan ocultos entre densos carrizos ribereños, a una altura de uno o dos metros.[10][26] Los machos a menudo hacen las veces de centinelas, empleando un repertorio de llamados.[10][77] En especial los machos persiguen a potenciales depredadores con el fin de ahuyentarlos, incluso cuando se trata de animales de dimensiones muy superiores.[10][26] La agresividad del tordo sargento hacia el chivirín pantanero, el cual también nidifica en pantanos, ocasiona un territorialismo interespecífico parcial.[78] Por otro lado, los depredadores nocturnos como el mapache y el visón americano no son atacados por los adultos.[73][75] La coloración apagada de la hembra podría servir para camuflarla, protegiéndola a ella y a su nido cuando está incubando.[10][26]
Asimismo, puede alojar ectoparásitos como distintas especies de ftirápteros —por ejemplo, los ischnóceros Philopterus agelaii y Brueelia ornatissima—[79] y ácaros hematófagos —como el macronísido Ornithonyssus sylviarum—[79] y endoparásitos como Haemoproteus quiscalus,[79] Leucocytozoon icteris,[79] Plasmodium vaughani,[79] nematodos,[79][80] trematodos[80] y cestodos.[80]
Según el ornitólogo estadounidense Arthur Cleveland Bent, en las regiones septentrionales de su área de distribución el tordo sargento oriental es casi completamente beneficioso desde una perspectiva económica y se registran comparativamente pocas quejas de daños severos a los cultivos. Allí su dieta consiste casi enteramente en insectos, muy pocos de los cuales son especies útiles, y semillas de hierbas. No obstante, provoca ciertos perjuicios a los granos que germinan en primavera y al maíz dulce en verano, mientras los granos son aún suaves, rasgando la cobertura foliácea de las mazorcas y arruinándolas desde un punto de vista comercial. También ataca otros granos de manera limitada, pero la mayor parte de los que consume son desperdicios que han quedado en el suelo. En el Medio Oeste, donde estas aves son mucho más abundantes y donde los cereales son cultivados más extensivamente que en el norte, los tordos sargento y otros ictéridos, a fines del verano y en otoño, causan gran daño a los campos de granos, tanto mientras están madurando como cuando son cosechados. Sin embargo, se ha afirmado que incluso allí resultan beneficiosos debido a las larvas perniciosas que eliminan de las mazorcas de maíz y de las plantas de remolacha, pudiendo contrarrestar plagas de orugas. En los estados sureños, perjudican gravemente al arroz arrancando los plantines en primavera y comiendo los granos aún suaves mientras maduran, siendo en este sentido casi tan dañinos como los charlatanes (Dolichonyx oryzivorus). Por otro lado, son de cierta utilidad al consumir las semillas de malezas que de otro modo devaluarían el producto.[41]
Al ser una de las aves más numerosas del continente, juega un rol importante en la dispersión de otras especies. Puesto que los tordos sargento se agrupan y descansan en cantidades tan grandes, la supervivencia de determinadas especies que se unen a sus bandadas seguramente se vea afectada por su compañía.[26] Pueden constituir además una importante fuente de alimento para animales tales como el mapache y el visón. Asimismo, las poblaciones que anidan y descansan en pantanos podrían amortiguar el efecto de la depredación sobre especies de anátidos y otros animales.[45] En síntesis, estas aves son tan numerosas y activas que su sola presencia y comportamiento natural es suficiente para influir sobre el medio ambiente de un modo visible.[26]
A través del control de las poblaciones de insectos por medio de la depredación y de las hierbas indeseadas con el consumo de sus semillas, permiten el crecimiento de plantas de mayores dimensiones y cultivos.[26][81] Se alimentan de Anthonomus grandis e Hypera postica, dos especies de curculiónidos que afectan el algodón y la alfalfa respectivamente, así como también de las orugas nocivas de la polilla gitana (Lymantria dispar) y de las del género Malacosoma.[41] En algunas áreas del sur de los Estados Unidos, las semillas del arrancamoños común (Xanthium strumarium), una maleza perjudicial para la soja y el algodón, parece constituir una importante fuente de alimento para la especie.[45][43] Beal (1900) afirmó:
Al resumir el estatus económico del tordo sargento, el principal aspecto a tener en cuenta es el pequeño porcentaje que representan los granos en su dieta anual, lo cual aparentemente contradice las quejas sobre sus hábitos destructivos. A juzgar por los contenidos estomacales, el tordo sargento es decididamente un ave útil. El servicio que brinda a través de la eliminación de insectos y semillas de hierbas nocivos supera ampliamente los daños que produce su consumo de granos. Los estragos que a veces provoca deben ser atribuidos enteramente a su excesiva abundancia en ciertos lugares.[41][82]
Durante la temporada reproductiva, los aproximadamente 8 millones de tordos sargento que anidan en Ohio y sus polluelos probablemente consuman más de 5,4 millones de kg de insectos, un promedio de casi 53 kg/km². Muchos de estos insectos, como los picudos (Hypera spp.), proceden de los campos de alfalfa, pasturas, campos de avena y otros cultivos. En los maizales, los ictéridos a menudo se alimentan de gusanos eloteros (Helicoverpa zea) y escarabajos del género Diabrotica. A comienzos de la primavera, los tordos sargento consumen taladros del maíz (Ostrinia nubilalis) en campos con rastrojo de maíz.[45] Sin embargo, Bendell y otros (1981) encontraron que el beneficio económico del control de plagas, tales como las larvas de ese lepidóptero, por parte del tordo sargento solo compensaba el 20% del daño a los cultivos ocasionados por esta ave.[83][84]
Los tordos sargento pueden devastar campos de cultivo. A pesar de que consumen semillas de malezas, son conocidos por provocar grandes daños a la agricultura a causa de sus hábitos de descansar en grupos masivos y su gusto por los productos agrícolas.[26] Pueden ser nocivos para las plantaciones de maíz, arroz, girasol y sorgo,[26][57][85] particularmente en las cercanías de dormideros importantes.[57] El tordo sargento es la especie de ictérido más numerosa de América del Norte y la que más perjudica los cultivos.[13][57][86] De 215 aves neotropicales migratorias, ha sido identificado como la que ocasionaba, por un amplio margen, la mayor pérdida económica.[83] En América del Norte, el daño a los cultivos de maíz por parte de esta especie aumentó desde finales de la década de 1960 a principios de la de 1980, quizá debido al incremento del área destinada a la producción de granos[83][87][88] y por la disminución de pequeñas áreas con rastrojo, henares y terrenos no cultivados, lo cual, a su vez, acentuó la dependencia del ave con respecto al maíz para asegurarse el sustento.[83][89]
Aparentemente el macho produce un mayor daño a dicho grano que la hembra. En algunas áreas de Ohio, el maíz puede representar hasta el 75% de la dieta de los machos y solo el 6% de la de las hembras en los meses de agosto y septiembre. En Dakota del Sur, a fines del verano, las mollejas de los machos estudiados contenían un 29% de maíz, mientras que en el caso de la hembra esa cifra se limitaba a un 9%.[45]
El tordo sargento constituye la especie dominante en las grandes concentraciones de ictéridos que se alimentan en los campos de girasol, maíz y granos pequeños en maduración a fines del verano o comienzos del otoño en las Dakotas. En la década de 1970, las pérdidas en los cultivos de girasol y maíz ocasionadas por los ictéridos en las Dakotas excedían los 3 millones de dólares anuales para cada caso.[90] En la parte norte de las Grandes Llanuras —un área conocida como Prairie Pothole Region—, en la que los tordos sargento son muy abundantes en verano, se congregan en bandadas posreproductivas que perjudican significativamente los cultivos, en particular las plantaciones de girasol cercanas a sus sitios natales. La mayor parte de los daños al girasol se produce entre mediados de agosto y comienzos de septiembre, cuando el contenido calórico de las semillas inmaduras es bajo y las aves deben consumir una mayor cantidad de ellas para saciarse. Durante esta etapa inicial de depredación de los cultivos de girasol en la que se provoca más del 75% del perjuicio total, los tordos sargento representan el 80% de los ictéridos observados en los campos de esta semilla. Este período es anterior a la migración masiva de las aves y la mayoría de ellas es de origen local. La mayor parte permanece dentro de los 200 km de sus sitios natales hasta que la muda de sus plumas esté completa —o casi completa— a fines de agosto o principios de septiembre. El daño puede ser bastante serio en el centro y sudeste de Dakota del Norte y noreste de Dakota del Sur, áreas de gran concentración de la producción de girasol y abundantes en humedales que atraen a los tordos sargento durante la temporada reproductiva.[91]
Investigaciones llevadas a cabo entre 1968 y 1979 revelaron que los ictéridos —entre los que se destacaban el tordo sargento y el zanate norteño (Quiscalus quiscula)— anualmente destruían menos del 1% de los cultivos de maíz en Ohio, lo que equivalía a una pérdida de entre 4 y 6 millones de dólares según los precios de 1979. Los insectos, las malezas, la enfermedades y los hongos probablemente causen pérdidas mayores al 20% de la cosecha potencial total de maíz en los estados del Medio Oeste y los procedimientos de cosecha a menudo dejan un 5% del maíz o más en los campos, lo cual revela que comparativamente el daño por parte de los ictéridos en Ohio no es grande. Sin embargo, el perjuicio promedio ocasionado por estas aves no es de tanta importancia económica como la distribución del mismo entre los productores. Mientras que el 97,5% de maizales estudiados en Ohio sufría una pérdida de menos del 5%, la cual constituía alrededor del 60% del daño total en el estado, el restante 2,5% a menudo incurría en pérdidas superiores al 5% y representaba aproximadamente el 40% del perjuicio total en Ohio.[45]
Todos los condados de Ohio sufren algún grado de depredación en sus cultivos de maíz a causa de los ictéridos, pero los más afectados son unos pocos condados en donde aún abundan los pantanos que les sirven de dormideros. Los condados de Ottawa, Sandusky y Lucas, sobre las aguas de la bahía de Sandusky y el lago Erie, fueron los más castigados. Estos tres condados, entre los 19 estudiados entre 1968 y 1976, contenían el 62% de los campos en los que las pérdidas excedieron el 5% y el 77% de aquellos en los que superaron el 10%. Otros condados con grandes daños localizados fueron Erie, Ashtabula —también ubicados sobre las costas de los mencionados cursos de agua— y Hamilton. Casi todas las plantaciones con perjuicios superiores al 5% se encontraban dentro de los 8 km de algún importante dormidero de ictéridos. En el período 1968-1976, en el noreste del condado de Sandusky y el noroeste del de Ottawa, donde grandes dormideros de hasta un millón de aves han sido descubiertos a fines del verano y en otoño, las pérdidas promedio superaban el 9% en campos a entre 3 y 5 km de los dormideros, pero eran menores al 5% a los 8 km e inferiores al 2% a los 16 km.[45] En el sudoeste de Ontario, en el verano de 1964, se comprobó que el mayor daño a los maizales por parte de tordos sargento también se producía cerca de dormideros en pantanos.[92]
Las dos principales opciones entre las que pueden elegir los agricultores para evitar la presencia de las aves una vez que el maíz ha ingresado en la etapa lechosa de su proceso de maduración consisten en la utilización del químico 4-aminopiridina y la implementación de dispositivos mecánicos de ahuyentado.[45] El momento escogido para tomar medidas que dispersen a los ictéridos es de gran importancia puesto que una vez que las aves han optado por un campo para alimentarse allí es probable que regresen durante varios días.[45][92] Cuanto más tiempo se les permita alimentarse sin ser molestadas, más difícil se volverá ahuyentarlas.[45] Asimismo, la mayor parte del daño es infligida en un lapso de solo unos pocos días, cuando los granos son suaves; en consecuencia, las técnicas de control no serán muy útiles si se aplican después de este período.[45][93]
Ya en 1667, los colonos de la bahía de Massachusetts habían establecido leyes para intentar reducir las poblaciones de ictéridos y mitigar los daños al maíz. Según Henry David Thoreau, una ley disponía que cada hombre soltero en un pueblo debía matar seis de esas aves y, como castigo por no hacerlo, no podría contraer matrimonio hasta que no hubiera cumplido con el mencionado designio. Obviamente, como los ictéridos se reproducen a una velocidad mucho mayor a la que los humanos se casan, esta estrategia de control fue un fracaso. Los pioneros que viajaban al oeste hacia la región de los Grandes Lagos enfrentaron problemas similares. Hacia 1749, los ictéridos eran tan abundantes alrededor del oeste del Lago Erie que las personas se turnaban para vigilar los cultivos de granos en maduración. Aparentemente los aborígenes habían utilizado esta técnica en la región durante siglos.[45]
A principios del siglo XX, en algunos lugares, cuando los carrizos se secaban, se aprovechaban dichas circunstancias para matar a estas aves de la siguiente manera. Una cuadrilla se acercaba en silencio a un dormidero, oculta en la oscuridad de la noche, y simultáneamente encendía en varios puntos los carrizos, los que eran rápidamente envueltos por una sola gran llama. Esto causaba un enorme tumulto entre los tordos sargento, que, iluminados por el fuego, eran derribados en grandes cantidades por los disparos mientras se mantenían suspendidos en el aire y gritaban por todo el lugar. A veces, se utilizaba paja para el mismo propósito, la cual era previamente esparcida cerca de los carrizos y de los arbustos de alisos (Alnus spp.) en los que se congregaban para descansar, cuya quema producía gran consternación entre las aves. La cuadrilla regresaba al día siguiente a recoger las presas cazadas.[41]
Arthur Cleveland Bent afirma que, antes de que fuera ilegalizada la venta de presas de caza en el mercado, los tordos sargento eran masacrados en grandes números en otoño y vendidos en los mercados. Cuando habían engordado sobre la base de una dieta de granos o arroz, sus pequeños cuerpos eran servidos como deliciosos bocadillos en las mesas de gastrónomos. Pocos podían distinguirlos de los charlatanes (Dolichonyx oryzivorus).[41]
En 1926, cuando el U. S. Biological Survey —predecesor del Servicio de Pesca y Vida Silvestre de los Estados Unidos— realizó su primera compilación de dormideros de ictéridos indeseables, se registró en Ohio, con sus cuantiosas poblaciones de esas aves y la quinta mayor superficie destinada al cultivo de maíz entre los estados americanos, un número de quejas superior al de cualquier otro estado. Durante la década de 1950, se organizaron comités de control de aves en algunos condados para lidiar con los perjuicios al maíz ocasionados por los ictéridos y la Ohio Agricultural Experiment Station —en la actualidad llamada Ohio Agricultural Research and Development Center— y el Departamento de Zoología y Entomología de la universidad estatal comenzaron a investigar el problema.[45]
La depredación de los cultivos ha llevado a la utilización de trampas, veneno y tensoactivos por parte de los agricultores en un intento por controlar las poblaciones de tordos sargento;[26] estos últimos suprimen las propiedades impermeables de las plumas, haciéndolos extremadamente vulnerables al frío,[26][94] pero su efectividad depende de ciertas condiciones atmosféricas, a saber: bajas temperaturas y precipitaciones.[94] Los programas en los que se utilizaron cebos envenenados para reducir las concentraciones de ictéridos a fines del verano han sido poco fructíferos. Mientras que miles de aves han muerto ocasionalmente, el efecto sobre bandadas numerosas asociadas a dormideros que a veces contienen más de un millón de individuos es pequeño; además, frecuentemente mueren ejemplares de otras especies. El uso de trampas de gran tamaño con señuelos, que a menudo capturan cientos de aves por día, también es inefectivo frente a estas bandadas de importantes dimensiones.[45]
El rocío de la solución detergente PA-14 en los dormideros durante la noche remueve la protección aceitosa de las plumas causando la muerte de las tordos sargento por la exposición a condiciones meteorológicas húmedas y frías. Varios millones de ictéridos —principalmente zanates norteños— han sido aniquilados con PA-14 en invierno en Tennessee y Kentucky; esta técnica, sin embargo, no es aplicable a los dormideros de fines del verano en los pantanos de Ohio porque temperatura ambiental es demasiado alta y porque el uso de PA-14 está restringido a lugares sobre tierras altas donde los problemas relacionados con la contaminación del agua o a riesgos sobre otras especies son improbables.[45] Asimismo, cabe destacar que la experiencia con la utilización de PA-14 en el sur de Estados Unidos indica que, incluso cuando grandes cantidades de aves son eliminadas, la disminución poblacional generalmente es solo a corto plazo, pues aves de las áreas circundantes pronto repueblan los dormideros:[45] tras la aplicación de dicho tensoactivo en un dormidero de zanates norteños, tordos sargento, estorninos pintos y tordos cabecicafé en las cercanías de Milan (oeste de Tennessee) en enero de 1977, más del 90% de los individuos murió, pero la población dentro de los 40 km del dormidero se recuperó en solo dos semanas.[88]
Los intentos por disminuir sus números a través de la disposición de arroz tratado con el avicida DRC-1339 en áreas de suelo desnudo no han tenido éxito por varias razones. En primer lugar, los tordos sargento se alimentaban casi exclusivamente sobre las cabezas de los girasoles y no bajaban a comer sobre el suelo. En segundo lugar, las precipitaciones hacían necesaria la renovación de los granos de arroz tratados. Por último, el riesgo de afectar a otras especies accidentalmente se incrementaba a lo largo del período de implementación del método a causa de la migración.[91]
Debido a que los tordos sargento que pasan el invierno en determinado lugar proceden de distintas áreas de reproducción, la aniquilación masiva de las aves en dormideros en el sur de Estados Unidos en esa estación probablemente no tenga un efecto demasiado significativo sobre el daño localizado que producen a fines del verano, ya que un decrecimiento poblacional a gran escala en algunos dormideros invernales no resultaría en una homóloga disminución en ninguna población reproductiva local en particular en el verano siguiente.[53][64]
La 4-aminopiridina se aplica a una de cada cien partículas de maíz molido utilizado como cebo. Generalmente el maíz es arrojado a los campos desde aviones que liberan una carga de unos 3,4 kg de cebo por hectárea sobre un tercio del terreno. Debido a que esa cantidad de maíz molido contiene alrededor de 205.000 partículas, aproximadamente 2050 partículas tóxicas son distribuidas por hectárea tratada.[45] La ingesta de una o más de estas partículas por parte de un ictérido provoca vuelo errático, llamados de sufrimiento y finalmente la muerte; ese comportamiento a menudo lleva a las restantes aves de la bandada a abandonar el campo.[45][95][96] El químico DRC-1327, que ha probado su utilidad mitigando el daño al maíz en maduración, opera de la misma manera: cuando un ave ingiere granos de una mazorca parcialmente pelada a mano a la que se le ha aplicado el químico con un rociador manual, su vuelo errático y sus llamados de sufrimiento previos a la muerte, que se extienden por un espacio de entre cinco y quince minutos, ahuyentan a las bandadas de los campos.[57]
La aplicación inicial de 4-aminopiridina debe efectuarse tan pronto como sea posible tras el comienzo de la etapa lechosa del proceso de maduración de los granos. Se recomiendan generalmente otras dos aplicaciones de refuerzo separadas por entre cinco y siete días; a menudo basta con solo una, pero bajo condiciones de actividad prolongada por parte de las aves pueden requerirse más de tres aplicaciones en intervalos más cortos.[45] En el condado de Brown (noreste de Dakota del Sur), en 1965, los cebos con 4-aminopiridina esparcidos a mano en intervalos de alrededor de una semana redujeron en un 85% la pérdida por tordos sargento proyectada en cultivos de maíz en maduración. El angustiante comportamiento exhibido por los individuos afectados por el químico produjo una marcada respuesta de espanto en otros miembros de las bandadas y los campos quedaron libres de tordos sargento incluso cuando la proporción directamente afectada estimada fue de menos del 1%.[97] Se ha sugerido incluso que el empleo constante de la 4-aminopiridina a lo largo de los años podría ocasionar un cambio en el patrón de migración al sur, como si las aves aprendieran a evitar las áreas persistentemente tratadas con el químico.[86]
En otro experimento en el mismo condado, el número de ictéridos que hacía uso del área tratada cayó drásticamente durante un período de cinco días después de que el tratamiento hubiera comenzado y se mantuvo en un nivel bajo por el resto de la temporada de daño a los maizales. Los resultados de este método se limitaron en gran medida a los ictéridos. A pesar de que abundaban los faisanes comunes (Phasianus colchicus), no hubo evidencia de que ninguno resultara afectado, y la mortalidad entre otras especies de aves fue insignificante.[95]
Debe considerarse que la abundancia de malezas restringe las posibilidades de que las aves encuentren las partículas del cebo esparcidas sobre el suelo, de modo que el empleo de este químico debe ir acompañado de un programa de control de malezas. Un problema menos obvio es el que representan los insectos que remueven el cebo. Si se detectan grillos (Gryllus spp.) en un campo, es esperable que el maíz molido desaparezca rápidamente. Los grillos seleccionan generalmente las partículas no tratadas y dejan las tóxicas; sin embargo, la rápida disminución en el volumen total del maíz molido sobre la tierra disminuye el atractivo de la alimentación a nivel del suelo para los ictéridos. Debido a que las poblaciones de grillos son difíciles de controlar, aplicaciones más frecuentes u otra técnica de control de aves podrían ser convenientes bajo estas circunstancias. Un tercer problema es el de las lluvias fuertes, que cubren el cebo con tierra o lo arrastran a grietas en el suelo.[45] Asimismo, una baja densidad poblacional de ictéridos puede reducir la efectividad de su control con 4-aminopiridina.[96]
Disparos con un arma de calibre .22 justo por encima del maíz a menudo alejan a las aves de un campo de hasta 16 hectáreas. Una variedad de dispositivos para repelerlas, incluyendo sistemas electrónicos que producen ruido, globos con helio atados en los campos, aviones a control remoto y diversos tipos de espantapájaros son ocasionalmente utilizados en los maizales.[45] Métodos tales como los espantapájaros, la pirotecnia y los cañones de propano ayudan a mitigar una depredación leve, pero solo funcionan efectivamente si la duración del período de daño es menor a la del acostumbramiento de las aves a dichos métodos. Los tordos sargento se habitúan rápidamente a los mismos, en particular si el cultivo es una fuente de alimento privilegiada en un área con pocas fuentes de sustento alternativas.[91] Si bien una cosecha lo más temprano posible después de que el maíz se haya secado lo suficiente puede limitar el daño por parte de las bandadas de zanates norteños, el ajustar la fecha de la cosecha no ayuda a los agricultores a reducir las pérdidas ocasionadas por tordos sargento durante la etapa lechosa.[45]
Un enfoque que ha tenido éxito en el control de los dormideros en tierras altas consiste en la dispersión de las poblaciones a través de la alteración del hábitat o el acoso a las aves. Estos procedimientos, llevados a cabo por biólogos en cooperación con ciudadanos locales, han sido exitosos en la dispersión o desplazamiento de poblaciones de hasta un millón de individuos. Aunque esta dispersión puede en ocasiones trasladar el problema de un lugar a otro —especialmente cuando el área ha sido cultivada con maíz de manera intensiva y no abundan las fuentes de alimento alternativas—, con frecuencia ha sido efectivo para solucionar situaciones problemáticas locales. Debido a que los granos de avenas y trigo en campos ya cosechados constituyen un alimento importante para los ictéridos a fines del verano, la postergación del arado de los terrenos con rastrojo de pequeños granos puede menguar la presión ejercida por la depredación de esas aves sobre el maíz en maduración. La existencia natural o la siembra de plantas como mijo, sorgo (Sorghum spp.), polígonos (Polygonum spp.) y varios pastos —por ejemplo, las mohas (Setaria spp.)— podría ser beneficiosa. Como principio ecológico general, la diversidad en los tipos de hábitats que puedan mantenerse en regiones de intensa actividad agrícola está relacionada con una mayor probabilidad de que los perjuicios ocasionados por las plagas se restrinjan a niveles económicamente tolerables.[45]
Estudios en campos de maíz dulce indican que los ictéridos a menudo podrían ser atraídos inicialmente a los cultivos en maduración por los insectos.[45][93] Las bandadas pueden deambular por los terrenos cultivados durante alrededor de una semana consumiendo insectos y semillas de hierbas antes de atacar el maíz. Los escarabajos del género Diabrotica podrían ser especialmente atractivos durante este período. Así las aves se habitúan a alimentarse en los campos y rápidamente pasan de los insectos al maíz cuando este ingresa en la vulnerable etapa lechosa. Experimentos en los que las poblaciones de insectos en cultivos de maíz dulce eran tratadas con insecticidas durante la semana previa a que el grano entrara en la fase lechosa mostraron que una menor cantidad de aves visitaba esos campos y se registraban menos daños al maíz en el subsecuente período de vulnerabilidad que en terrenos cercanos no tratados. Es probable que la abundancia de malezas en los maizales también incremente el atractivo de estos para los ictéridos y el control de las mismas propiciaría una disminución en las pérdidas producidas por estas aves.[45]
Una manera alternativa de reducir las poblaciones de tordos sargento, y por lo tanto el perjuicio que causan a los cultivos, supone la implementación de un programa que tenga por objeto interferir con su capacidad de reproducirse, por ejemplo, por medio del uso de químicos esterilizadores. Debido a la naturaleza poligínica de la especie, se ha sugerido que dicho programa podría llegar a ser más efectivo si es dirigido a los machos. Sin embargo, la incidencia de la promiscuidad implicaría que la esterilización química de una determinada fracción de los machos de una población local no resultaría en una disminución proporcional de las nidadas fértiles.[98]
Los efectos de este método probablemente variarían según el tipo de hábitat en el que los machos tratados hayan establecido sus territorios. En general, debería haber una mayor proporción de nidadas fértiles en aquellos hábitats más densamente poblados y con una mayor cantidad de renidificaciones. Las renidificaciones son más comunes en los pantanos que en las tierras altas. A su vez, los individuos que se reproducen en tierras altas probablemente se alimenten más a menudo dentro de sus propios territorios que los que lo hacen en pantanos, lo que probablemente dificulte la promiscuidad en el primer tipo de hábitat. Así, la esterilización química podría ser más efectiva entre poblaciones de tierras altas que entre aquellas de pantanos.[98]
Es posible que los químicos esterilizadores reduzcan en cierta medida la cantidad de polluelos producida por nido exitoso. Dado que las nidadas de renidificaciones son significativamente menos numerosas que las originales, incluso si una hembra que en un primer momento se apareó con un macho estéril luego renidificase y se emparejara con una macho fértil, quizá produciría menos polluelos de los que hubiese tenido si su primera nidada hubiera sido fértil.[98]
El número de nidadas fértiles en el territorio de un macho puede limitarse a través de la esterilización de aquel, pero el grado en que disminuya dicho número dependerá de la disposición de los machos territoriales fértiles aledaños y quizá también de la cantidad de machos no territoriales fértiles en la población. Estudios con huevos artificiales sugieren que la incubación de los huevos estériles sería prolongada,[98] puesto que las hembras normalmente incuban los huevos artificiales durante alrededor de 20 días.[98][99] Una incubación extendida de huevos inviables repercutiría en una menor cantidad de intentos de renidificación y, por lo tanto, en un decrecimiento de las oportunidades de encontrar un compañero fértil para una hembra que originalmente se apareó con un macho estéril.[98]
Se trata de una especie bajo preocupación menor.[1][5] Al ser una de las aves más numerosas y más ampliamente distribuidas de América del Norte, poco se ha hecho para protegerla de los efectos de la destrucción de su hábitat y la urbanización. Debido a que puede sobrevivir en una amplia gama de entornos, muchas poblaciones logran sobreponerse a la pérdida de hábitats naturales. Sin embargo, los tordos sargento prosperan en zonas de humedales y con la destrucción de los humedales naturales es probable que su población se reduzca.[26] La especie está protegida bajo el Migratory Bird Treaty Act de 1918, un tratado formal entre Estados Unidos y Canadá que luego fue ampliado para incluir a México. Esta ley le otorga protección legal en Estados Unidos, pero se les puede matar «cuando sean encontrados depredando o a punto de depredar árboles ornamentales o árboles plantados para que den sombra, cultivos, ganado o la vida silvestre.»[45]
Un estudio en Illinois indicó que las poblaciones de tordos sargento se duplicaron entre 1908 y 1958. Tradicionalmente se había reproducido en humedales, habitando en Ohio principalmente los pantanos asociados con lagos y ríos.[45] Durante el siglo XX, sin embargo, se adaptó a los cambios en el hábitat introducidos por el hombre y ahora a menudo anida en henares, a lo largo de carreteras y zanjas y en otros sitios ubicados en tierras altas.[45][46]
A pesar de su exitosa adaptación a los cambios en las prácticas relacionadas con el uso de la tierra, las poblaciones de tordos sargento se han reducido a lo ancho de su área de distribución durante la segunda mitad del siglo XX,[46][85] y los cambios en la abundancia y adecuación de los pastizales han estado implicados en ello.[46] En Ohio, el tordo sargento se vio negativamente afectado entre 1966 y 1996 por el decrecimiento de la producción de heno, la cosecha más temprana del mismo y el incremento de los cultivos sembrados en surcos, una situación homóloga a la que sufren otras especies de aves de los pastizales menos numerosas. Si bien efecto negativo de la creciente eficiencia y la menguante diversidad de las prácticas agrícolas modernas sobre las poblaciones de tordos sargento en dicho estado puede ser percibido como un acontecimiento positivo por parte de los productores de maíz y girasol, las prácticas agrícolas que han precipitado la declinación numérica de esta especie posiblemente hayan causado repercusiones más severas para aves de los pastizales menos comunes, tales como el correlimos batitú (Bartramia longicauda) y el gorrión sabanero pechileonado (Ammodramus savannarum).[85]
A finales de la década de 1970, Ohio acogía la mayor densidad de tordos sargento durante la temporada reproductiva entre todos los estados estadounidenses y provincias canadienses,[45][85] albergando un estimado de 8 millones de individuos.[45] Sin embargo, entre 1966 y 1996, las poblaciones reproductivas en dicho estado mostraron un marcado descenso. La disminución del área cultivada con heno que no fuera alfalfa entre esos mismos años probablemente redujera la disponibilidad de hábitats de nidificación de calidad. Asimismo, el maíz —aunque atraiga insectos que los tordos sargento consumen y pese a que sus granos representan en sí mismos una fuente de energía— y la soja —que no constituye una fuente de alimento para la especie—, los cuales en conjunto conformaron de 1966 a 1996 un promedio del 70% del área cultivada en Ohio, no proporcionan un hábitat adecuado para la anidación. A su vez, las grandes fluctuaciones anuales en el área cultivada con heno, tanto de un año a otro como dentro del mismo año de determinada temporada reproductiva, posiblemente perturbaran la nidificación y el subsecuente éxito reproductivo.[85] De manera similar, en Ontario entre 1974 y 1995, el tamaño medio de los harenes en un año dado estaba positivamente relacionado con la producción de heno del año previo, si bien la variación porcentual en el tamaño de los harenes de una temporada a la siguiente no se relacionaba de manera linear a la variación porcentual anual en la producción de heno; la producción de heno decayó en dicho período y el tamaño de los harenes disminuyó de aproximadamente tres hembras por macho a 1,6 hembras.[46]
Además, en Ontario se encontró una relación negativa entre el índice de oscilación del Atlántico Norte (NAO) en los seis meses previos a determinada época reproductiva y el tamaño de los harenes. Si la mortalidad durante el invierno contribuye al decrecimiento del tamaño de los harenes, las variaciones anuales en el tamaño de los mismos deberían estar relacionadas con los cambios anuales en las tasas de retorno de machos territoriales marcados. Se descubrió que efectivamente las variaciones en el tamaño de los harenes y las tasas de retorno de los machos por año estaban positivamente correlacionadas. Aunque no tan pronunciada, la relación entre las tasas de retorno de los machos y los valores de la NAO en el invierno era similar a aquella entre los cambios en el tamaño de los harenes y la NAO.[46]
Por otro lado, en el sudoeste de Quebec las poblaciones de tordos sargento se duplicaron con creces entre 1966 y 1981, aparentemente en respuesta al desarrollo de la producción de maíz. La mayor disponibilidad de granos residuales en primavera y verano —la temporada reproductiva— probablemente jugara un rol fundamental en el crecimiento de la población de esta ave.[87] Asimismo, a mediados de los años 1990, la población reproductiva de Dakota del Norte —que al menos entre 1994 y 2002 se encontraba a la cabeza entre todos los estados estadounidenses y provincias canadienses en lo que hace a la densidad poblacional de esta especie— comenzó a aumentar rápidamente.[91]
El tordo sargento (Agelaius phoeniceus), también conocido como sargento alirrojo, tordo alirrojo, tordo capitán o turpial alirrojo, es una especie de ave paseriforme de la familia Icteridae. Es un pájaro de hábitos migratorios que habita en zonas húmedas y terrenos de cultivo de América del Norte y Central. Presenta un marcado dimorfismo sexual vinculado a una sensible diferencia en su tamaño y al color del plumaje, que se manifiesta a temprana edad. Las hembras son principalmente marrones con un intenso veteado ventral y los machos, predominantemente negros con un par de manchas rojas bordeadas por una banda amarilla sobre las alas. Los insectos y las semillas constituyen la mayor parte de su dieta. Es considerado una plaga para la agricultura. Quizá sea el ave nativa más abundante de América del Norte, con una población estimada de ciento noventa millones de individuos para 1974 solo en Estados Unidos, por lo que ha sido clasificado como especie bajo preocupación menor. Sus poblaciones crecieron enormemente a mediados del siglo XX. El tordo sargento ha sido extensivamente estudiado debido a su sistema de emparejamiento poligínico. También se destaca por su alto grado de territorialismo durante la época reproductora.
Agelaius phoeniceus Agelaius generoko animalia da. Hegaztien barruko Icteridae familian sailkatua dago.
Agelaius phoeniceus Agelaius generoko animalia da. Hegaztien barruko Icteridae familian sailkatua dago.
Punaolkaturpiaali (Agelaius phoeniceus) lienee Amerikan runsaslukuisin lintulaji. Yksistään USA:ssa on arvioitu asustavan kaksi punaolkaturpiaalia jokaista ihmistä kohtaan. Laji sopeutuu muuttuviin oloihin helposti. Talvella turpiaalit kerääntyvät suunnattomiksi, jopa miljoonien yksilöiden jättiparviksi. Niitä pidetään pahoina tuholaisina viljapelloilla. Silloin unohtuu helposti se, että punaolkaturpiaalit myös auttavat pitämään kurissa tuhohyönteisten kantoja.
Aikuinen naaras sekä nuoret yksilöt sukupuolesta riippumatta ovat päältä ruskeita ja alta ruskea- ja ruskeankeltajuovaisia. Koiraalla höyhenpuku on kokonaan musta, lukuun ottamatta hartioiden punaista höyhenpeitettä jolla on merkitystä soidinmenoissa ja reviirikäyttäytymisessä.
Punaolkaturpiaalin pituus on 18-24 cm, siipiväli 33 cm ja paino 52 g.
Punaolkaturpiaali pesii suuressa osassa Pohjois- ja Keski-Amerikkaa. Kanadassa ja USA:n pohjoisosassa pesivät linnut liittyvät syksyllä etelämpänä pesivien lajitoveriensa joukkoon.
Kosteikot, ruohomaat ja suot.
Punaolkaturpiaalinaaraat saapuvat pesimäpaikoille noin viikon verran koiraita myöhemmin. Koiraat kosiskelevat naaraita laulullaan ja siipiään esitellen. Suotuisassa suoympäristössä koiras voi onnistua saamaan kumppanikseen jopa 15 naarasta. Vaikka koiras pariutuukin kaikkien niiden kanssa, se ei välttämättä ole kaikkien poikasten isä. Mikäli sen tarkkaavaisuus herpaantuu, muut koiraat voivat onnistua livahtamaan parittelemaan naaraiden kanssa. Naaras punoo pesämaljan, usein turvalliseen paikkaan veden ylle. Se munii 3-5 munaa. Poikaset kuoriutuvat 12 vrk kestävän haudonnan päätteeksi.
Osassa USA:ta levisi 1970-luvulla suoranainen hysteria syksyisten turpiaaliparvien tuhotessa satoja. Lisäksi hengityselinsairautta aiheuttavan sienen havaittiin viihtyvän lintujen ulosteessa. Tämän vuoksi lepäileviä parvia myrkytettiin. Yletön vaino ei kokonaiskantaan kuitenkaan vaikuttanut.
Punaolkaturpiaali (Agelaius phoeniceus) lienee Amerikan runsaslukuisin lintulaji. Yksistään USA:ssa on arvioitu asustavan kaksi punaolkaturpiaalia jokaista ihmistä kohtaan. Laji sopeutuu muuttuviin oloihin helposti. Talvella turpiaalit kerääntyvät suunnattomiksi, jopa miljoonien yksilöiden jättiparviksi. Niitä pidetään pahoina tuholaisina viljapelloilla. Silloin unohtuu helposti se, että punaolkaturpiaalit myös auttavat pitämään kurissa tuhohyönteisten kantoja.
Agelaius phoeniceus
Le Carouge à épaulettes (Agelaius phoeniceus) est une espèce de passereaux appartenant à la famille des Icteridae. Son nom commun vient de deux taches rouges qui prennent la forme d'épaulettes quand l'oiseau prend une attitude d'intimidation.
Les deux sexes ont un bec très pointu. La queue est de longueur moyenne et arrondie[1]. Les yeux, le bec, et les pattes sont noirs[1]. Les jeunes oiseaux ressemblent aux femelles, mais plus pâles en dessous et avec les franges des plumes de couleur chamois[1].
Le carouge à épaulettes présente un net dimorphisme sexuel : le mâle est noir (y compris le bec et les pattes) avec des épaulettes d'un rouge vif généralement souligné de jaune pâle. On ne voit pas toujours ses épaulettes rouges lorsqu'il est perché, et alors seule la fine bordure jaune dépasse. L'appartenance de la femelle à l'une ou l'autre des sous-espèces de carouges bicolores ou tricolores est difficile à établir. Toutes sont brun foncé, se fondant mieux dans la nature, et plus discrètes sur leur nid.
Le Carouge à épaulettes est un animal très territorial, qui défend son territoire contre d'autres animaux et oiseaux. Il attaque et intimide des oiseaux beaucoup plus grands que lui tel que corbeaux, pies, et même certains rapaces et hérons s'ils entrent dans leur territoire [2]. Les mâles peuvent attaquer l'homme s'il envahit son territoire pendant la nidification[3],[4].
La forme particulière du vol de cet oiseau permet de le distinguer d'autres espèces proches (les taches colorées ne sont pas visibles de dessous).
L'appel du carouge à épaulettes mâle allie un chant de gorge contrôlé et des sifflements de type'terrr-eeee. Dans ses comportements sociaux, le mâle chante souvent avec un mouvement de présentation de ses épaulettes rouges[5]. Le chant de la femelle évoque un chit chit chit chit chit chit cheer teer teer teerr[6].
Cet oiseau est omnivore[7]. Les graines de nombreuses plantes et/ou les insectes constituent l'essentiel de son alimentation, selon l'époque et la disponibilité en nourriture. Il a appris à collecter les restes de récolte ou débris de blé, maïs ou riz après la moisson.
Un quart au moins de son régime alimentaire se compose d'insectes et autres invertébrés, et considérablement plus lors de la saison de reproduction[8] Il montre une préférence pour les gros insectes tels que libellules, demoiselles, papillons et diptères, mais consomme également des escargots, amphibiens, œufs, charognes, vers, araignées et mollusques. Il fouille dans les feuillages et plantes pour trouver ses proies, ou les happe au vol[1].
En saison, il mange des bleuets (airelle voisine de la myrtille), des mûres et d'autres petits fruits.
Il peut aussi visiter les mangeoires à oiseaux et en fin d'été et d'automne, il se nourrit dans les zones d'openfield, avec d'autres espèces d'oiseaux (dont les étourneaux) en groupe qui peuvent atteindre plusieurs milliers d'oiseaux[2].
Le mâle adulte ressemble à l'Échenilleur à épaulettes rouges, une espèce africaine.
Mâle Échenilleur à épaulettes rouges (Campephaga phoenicea)
Le carouge à épaulettes apprécie les vastes zones herbeuses ouvertes (grande prairie, prairies humides, champs, jachères) mais plus encore les zones humides où il trouve de nombreux insectes. On le trouve sur les eaux douces, mais aussi sur les marais salés, notamment quand les Typha sont présents[9].
On le trouve dans la plus grande partie de l'Amérique du Nord et on le trouve jusqu'en Amérique centrale au niveau de la péninsule du Yucatan.
Il niche de l'Alaska à Terre-Neuve au sud de la Floride, au golfe du Mexique, au Mexique et au Guatemala, avec des populations isolées dans l'ouest du Salvador, au nord-ouest du Honduras et du Costa Rica.
Il peut hiverner au nord jusqu'en Pennsylvanie et en Colombie-Britannique, mais les populations nordiques sont généralement migratrices, se déplaçant vers le Mexique et le sud des États-Unis. La migration débute en septembre-octobre, mais occasionnellement plus tôt, en aout.
Dans l'ouest et le milieu de l'Amérique du Nord, les populations sont généralement sédentaires (non-migratrices)[9].
Le comportement de ces oiseaux est colonial, les nids, en forme de panier bien creux, plus ou moins groupés, sont construits dans les roselières, les herbes, carex, ou dans les buissons d'aulne ou saule, uniquement par la femelle, en 3 à 6 jours. Il est constitué de graminées, de carex et mousses, éventuellement cimentés avec de la boue, et lié aux branches ou herbes environnantes[1].
Il est situé de 7,6 cm à 4,3 m au-dessus de l'eau[10].
La portée compte trois ou quatre, rarement cinq, œufs. Les œufs sont ovales, lisse et légèrement brillant. Ils mesurent 24,8 x 17,55 mm[10]. Ils sont pâles vert bleuâtre, marqué de brun, violet, et/ou de noir, avec souvent des ponctuations autour de l'extrémité la plus large de l'œuf. Ces œufs sont couvés par la femelle seule, et éclosent au bout de 11 à 12 jours. Les Carouges à épaulettes éclosent aveugles et nus, mais grâce à une alimentation très riche en protéines (les parents s'alimentent presque exclusivement de gros insectes à cette époque) ils seront prêts à quitter le nid 11 à 14 jours après l'éclosion[11].
Les Carouges à épaulettes rouges sont polygames, avec des mâles territoriaux défendant jusqu'à 10 femelles. Cependant, les femelles copulent fréquemment avec d'autres mâles que leur partenaire social, et les pontes peuvent provenir de plusieurs "pères"). Deux, voire trois couvées sont possibles par saison, dans un nouveau nid à chaque fois[11].
La prédation des œufs et des oisillons est importante. Les prédateurs des nids sont des serpents (couleuvre), le vison, le raton laveur, et d'autres oiseaux, même aussi petit que le Troglodyte des marais. Le carouge à épaulettes est également parfois victime de parasites de la reproduction, en particulier de la part du Vacher à tête brune[2]. Probablement en réaction à la prédation des nids, plusieurs adaptations évolutives existent chez cette espèce, dont la nidification groupée (qui réduit le risque de prédation individuelles en augmentant le nombre de parents en alerte), la nidification au-dessus de l'eau (qui réduit la probabilité de prédation), de même que de puissants cris d'alarme. Les nids sont en outre souvent bien cachés dans les roselières épaisse à proximité de l'eau, et souvent à un à deux mètres de hauteur. Les mâles jouent souvent le rôle de sentinelles, disposant d'une variété de chants ou cris désignant un danger plus ou moins grand. Des postures d'intimidation et d'attaques réussissent à effrayer certains prédateurs. La coloration terne et brunâtre de la femelle joue probablement aussi un rôle de camouflage pour elle et son nid (quand elle couve)[9].
D'après Alan P. Peterson, il en existe 22 sous-espèces :
Avant les Anglais, les peuples autochtones amérindiens nommaient déjà l'oiseau selon ses caractéristiques physiques et colorées. Dans les langues Anishinaabees (groupe de langues autochtones parlées dans la majeure partie des régions fréquentées par cet oiseau), des noms variés ont été donnés à cet oiseau. Dans la langue oji-cri, la plus septentrionales des langues Anishinaabe, il est appelé jachakanoob, tandis que l'Ojibwa parlé au Nord-Ouest de l'Ontario et au Manitoba juste au sud de la zone où l'on parlait l'Anishinini, l'oiseau est appelé jachakanoo; ces deux langues associent le carouge à épaulettes au type Junco. Toutefois, dans la grande majorité des autres dialectes de langue Ojibwa, l'oiseau est appelé memiskondinimaanganeshiinh (nom qui évoque une épaule très rouge). Toutefois, la langue Odawa, une langue qui était parlée par les Anishinaabe du Sud-Ouest de l'Ontario et du Michigan, l'oiseau est plutôt appelé soit memeskoniinisi ("oiseau avec une tache rouge sur l'aile) ou comme memiskonigwiigaans ("Aile à la petite tache rouge")[12]
Bien qu'appréciée pour les couleurs vives du mâle et pour leur comportement insectivore, utile à certaines cultures et à la régulation des populations d'insectes, en hiver, cette espèce qui peut former des vols assez denses, devient volontiers insectivore et s'éloigne alors des zones humides en hiver, à la recherche de graines ou petits fruits. Elle peut alors se nourrir de restes de récoltes ou de semence de céréales dans les zones agricoles, ce qui fait qu'elle est parfois considérée comme ravageur des cultures par certains agriculteurs[6]
Dans les Grandes Plaines, la langue Lakota, cet oiseau est appelé wabloša ("ailes rouges"). Les chants de cet oiseau sont décrits par les lakotas comme toke, ni mat'ā ("oh! que je pourrais mourir"), ou comme nakun Miye ("... et moi "), ou encore mal eya ("moi aussi!") ou cap'cehlī ("une plaie de castor")[13].
Le 1er janvier 2011, un phénomène exceptionnel s'est produit dans et autour de la ville de Beebe (Arkansas). Les habitants ont découvert au petit matin des centaines de carouges à épaulettes morts ainsi que quelques étourneaux sansonnet. Vers 23h30 locales, la nuit de la Saint-Sylvestre, quatre à cinq mille de ces oiseaux se sont en effet abattus sur la ville en vol désordonné, de nombreux oiseaux se cognant entre eux et aux obstacles, avant de mourir subitement, ou dans le courant de la nuit.
Les causes de ces décès massifs sont encore inconnues, plusieurs spécialistes ayant des avis divergents quant aux éventuelles blessures observées. Les feux d'artifice de la nouvelle année sont une des explications évoquées ; ils auraient pu faire mourir de peur ces oiseaux. Une autre explication serait des chutes de grêle ou des coups de foudre à haute ou très haute altitude. Cet oiseau étant considéré comme « nuisible » par certains céréaliers (bien que par ailleurs utile en tant qu'insectivore partiel), plusieurs dizaines de détonations entendues par un témoin local[14] avant le phénomène ont fait évoquer l'utilisation possible d'arme à feu ou de matériel destiné à effrayer les oiseaux comme autre explication possible.
Des cadavres ont été envoyés à diverses autorités compétentes pour autopsies et étude afin d'obtenir de plus amples informations[15],[16],[17],[18], pour notamment vérifier qu'il ne s'agit pas d'une intoxication, car à environ 160 à 200 kilomètres de Beebe, 100 000 poissons (malachigans (Aplodinotus grunniens) essentiellement, ont été trouvés morts[19]. Selon les premiers résultats des tests et autopsies, faits par le National Wildlife Health Center Lab de Madison (Wisconsin), ces oiseaux sont morts des suites d'hémorragie interne, sans que les causes du comportement de ces oiseaux avant leur mort aient été identifiées. Scott Wright, responsable de l'enquête sur le terrain pense toujours que des feux d'artifice auraient pu déclencher un mouvement de panique chez ces oiseaux.
D'autres cas de mortalités massives ont été dans le passé enregistré aux États-Unis, avec un premier cas en 1996 sur le lac Shawano (nord du Wisconsin) mais dans des zones humides et non en ville puis deux fois aux abords du Mississippi à partir de l'automne 2002. Dans tous les cas les oiseaux (Petit Fuligule et Foulque d'Amérique en migration) étaient parasités par un trématode dont l'hôte intermédiaire est un escargot (espèce invasive importée d'Europe et Asie). Environ 25 000 oiseaux sont morts, la plupart sur le lac Onalaska.
Le 5 janvier 2011, en Louisiane, une nouvelle pluie de carouges à épaulettes et d'autres oiseaux a été enregistrée. Plus de 600 oiseaux morts ont été retrouvés, en grande partie sur le goudron d'une route nationale, là encore sans aucune explication. Jim Lacour, vétérinaire, pense qu'ils auraient pu avoir percuté une ligne à haute tension bordant la route nationale LA 1. Une cinquantaine d'oiseaux auraient été retrouvés près d'un poteau électrique, les autres sur la route dans un rayon d’un kilomètre, à proximité pour certains d'un grillage. Ils seraient morts dimanche soir, ou très tôt lundi matin[20].
En Suède, une mortalité de Choucas (entre 50 et 100 oiseaux) à Falköping (au sud-est de Skövde) semble liée à un feu d'artifice tiré dans la nuit de mardi 4 janvier 2010[20].
Les ornithologues privilégient la thèse de collisions en série dues à un mouvement de panique au sein des grands rassemblements hivernaux d'oiseaux dans les villes[21].
En Géorgie (États-Unis), en 2009, des décès par hémorragies de jaseurs d'Amérique (Bombycilla cedrorum) ont été en revanche attribués à un excès de consommation des baies de bambou sacré (Nandina domestica), seule nourriture disponible localement, mais dont l'acide cyanhydrique à haute dose devient toxique même pour les oiseaux[22].
Agelaius phoeniceus
Le Carouge à épaulettes (Agelaius phoeniceus) est une espèce de passereaux appartenant à la famille des Icteridae. Son nom commun vient de deux taches rouges qui prennent la forme d'épaulettes quand l'oiseau prend une attitude d'intimidation.
L'ittero alirosse o merlo dalle ali rosse o merlo ad ali rosse (Agelaius phoeniceus (Linnaeus, 1966)) è un uccello passeriforme della famiglia degli Itteridi diffuso in quasi tutto il Nordamerica e in gran parte dell'America Centrale.[2]
Nidifica dall'Alaska e da Terranova a nord fino alla Florida, al Golfo del Messico, al Messico e al Guatemala a sud; alcune popolazioni isolate si incontrano anche nelle regioni occidentali di El Salvador e in quelle nord-occidentali di Honduras e Costa Rica. Il limite settentrionale dell'areale di svernamento va dalla Pennsylvania alla Columbia Britannica, ma le popolazioni settentrionali sono generalmente migratrici e d'inverno si spostano a sud, in Messico e negli Stati Uniti meridionali. Presenta uno spiccato dimorfismo sessuale: il maschio è completamente nero con le spalle rosse e una fascia gialla sulle ali, mentre la femmina è marrone scuro. Gran parte della dieta di questo uccello è costituita da semi e insetti.
L'ittero alirosse deve il suo nome comune alle caratteristiche macchie rosse, o «spalline», che spiccano sul piumaggio interamente nero del maschio adulto, ben visibili quando l'uccello è in volo o effettua parate di corteggiamento[3]. Il maschio presenta inoltre una fascia giallo chiaro sulle ali. La femmina è marrone-nerastra sul dorso e più chiara sul ventre. Quest'ultima è molto più piccola del maschio: misura soltanto 17-18 cm e pesa 36 g, contro i 22–24 cm e 64 g del maschio[4].
Gli esemplari giovani somigliano alla femmina, ma hanno il ventre più chiaro e i margini delle penne marroncini. Entrambi i sessi sono dotati di un becco appuntito. La coda, arrotondata, è di media lunghezza. Gli occhi, il becco e le zampe sono tutti neri[5].
Il maschio è sempre ben identificabile, tranne che nelle regioni più occidentali degli Stati Uniti, dove può essere scambiato per un ittero tricolore. Anche i maschi di quest'ultima specie presentano una spallina color rosso scuro, ma la fascia sulle ali è bianca, non gialla. Le femmine di ittero tricolore, bicolore, spallerosse e alirosse sono molto difficili da distinguere nelle aree dove convive più di una di queste specie. In volo, quando i colori sulle ali si vedono meno facilmente, l'ittero alirosse si può distinguere da altri Itteridi meno imparentati con esso, come la gracula comune e il vaccaro testabruna, per la silhouette differente e il volo ondulato[6].
Il richiamo dell'ittero alirosse consiste in un check profondo e in una sorta di fischio, terrr-eeee. Il canto, invece, risuona come una sorta di oak-a-lee accompagnato dalla messa in mostra delle macchie rosse sulle spalle[7]. Anche la femmina canta, emettendo una sorta di chiacchiericcio, chit chit chit chit chit chit cheer teer teer teerr[6].
Quando deve difendere il suo territorio da altri animali e uccelli, l'ittero alirosse può divenire molto aggressivo. Attacca perfino uccelli molto più grandi di lui, come cornacchie, corvi, gazze, rapaci e aironi, se questi tentano di penetrare nel suo territorio[8]. Sono noti casi in cui dei maschi sono piombati in picchiata su esseri umani che si trovavano in vicinanza dei nidi durante la stagione riproduttiva[9][10].
L'ittero alirosse è onnivoro. Si nutre soprattutto di sostanze vegetali, compresi i semi di piante infestanti, e saccheggia i campi di cereali come frumento e riso, ma circa un quarto della sua dieta, o perfino di più durante la stagione riproduttiva, è costituito da insetti e altri piccoli animali[11]. Predilige gli insetti, come libellule, damigelle, farfalle, falene e mosche, ma consuma anche chiocciole, rane, uova, carogne, vermi, ragni e molluschi. Gli insetti vengono presi mentre sono posati sulle piante o catturati in volo[5]. Durante la loro stagione mangia anche mirtilli, more e altri frutti. Può essere attirato nei cortili mettendo in una mangiatoia un miscuglio di pane, semi e sego. Alla fine dell'estate e in inverno l'ittero alirosse si nutre sui campi aperti in compagnia di gracule, vaccari e storni, radunandosi in stormi che possono raggiungere migliaia di esemplari[8].
L'ittero alirosse nidifica in estese colonie. Il nido viene costruito tra le canne palustri, i giunchi, l'erba, i carici o nei boschetti di ontani e salici. Esso viene costruito interamente dalla femmina nel giro di tre-sei giorni. È costituito da un canestro di erba, carice e muschio tenuto insieme dal fango e foderato di erba o ramoscelli[5]. Generalmente è situato a 7,6 cm - 4–3 m sulla superficie dell'acqua[12].
Ogni covata è composta da tre o quattro uova, più raramente da cinque. Queste sono ovali, lisce e leggermente lucenti e misurano 24,8 x 17,55 mm[12]. Sono di colore verde bluastro chiaro macchiato di marrone, viola e/o nero; la maggior parte delle macchie sono situate intorno al polo più largo. Le uova sono covate solamente dalla femmina e si schiudono dopo 11 o 12 giorni. Alla nascita i pulcini sono ciechi e nudi, ma sono pronti a lasciare il nido già 11-14 giorni dopo la schiusa[4].
L'ittero alirosse è poliginico e nel loro territorio i maschi difendono fino a 10 femmine. Tuttavia, le femmine si accoppiano frequentemente con altri maschi e spesso i piccoli di una stessa covata hanno padri diversi. Ogni coppia può allevare due o tre covate per stagione, ospitate in nidi diversi[4].
La predazione a danno di uova e pulcini è abbastanza comune. Tra i razziatori dei nidi ricordiamo serpenti, moffette, procioni e altri uccelli, a volte molto piccoli, come lo scricciolo di palude. I nidi vengono ogni tanto visitati da uccelli parassiti, soprattutto dal vaccaro testabruna[8]. Dato che le razzie dei nidi sono così comuni, l'uccello ha sviluppato particolari adattamenti. Uno di questi è la nidificazione di gruppo, che riduce il rischio di predazioni individuali e aumenta le probabilità di avvistare in anticipo un predatore. Anche nidificare sopra la superficie dell'acqua riduce le probabilità che i predatori possano raggiungere il nido, così come i richiami d'allarme. I nidi, in particolare, offrono un vantaggio strategico contro i predatori in quanto sono costruiti nel fitto delle canne sulla riva e posizionati ad altezze di uno-due metri. I maschi spesso fanno da sentinelle, eseguendo tutta una varietà di richiami per denotare il tipo e la gravità del pericolo. In alcuni casi questi uccelli, soprattutto i maschi, effettuano anche il cosiddetto mobbing, cioè attaccano in gruppo l'aggressore; spesso, però, gli itteri rivolgono per sbaglio i loro attacchi verso grossi animali e perfino esseri umani. Anche la colorazione marroncina della femmina costituisce un adattamento anti-predatorio, dal momento che rende mimetica essa e il suo nido (nel caso stia covando)[13].
In inverno l'ittero alirosse va in cerca di cibo lontano dalle paludi, raccogliendo semi e granaglie nelle distese erbose e sui terreni agricoli. Così facendo viene talvolta considerato nocivo dagli agricoltori[6]. Nel tentativo di controllarne il numero è noto che i contadini utilizzano pesticidi come il parathion[14].
La mattina del 1º gennaio 2011, Beebe, una cittadina dell'Arkansas di poco più di 4000 abitanti, si è ritrovata tappezzata dai corpi di 3000 itteri alirosse morti nel corso della notte precedente. Tre giorni dopo, un fenomeno simile, ma di entità minore (500 esemplari tra itteri e storni), è stato registrato anche in Louisiana. Dopo le prime analisi effettuate gli studiosi hanno scartato l'ipotesi che gli uccelli fossero stati colpiti da una qualche forma di epidemia, dato che gli esemplari esaminati erano apparentemente sani. La presenza di traumi al petto, invece, ha fatto intuire che la probabile causa del decesso dei volatili di Beebe sia da imputare ai botti di Capodanno, che, oltre a colpire direttamente i volatili, avrebbero talmente impaurito gli itteri da farli volare a quote più basse, facendoli scontrare tra loro e con gli edifici. Gli esemplari della Louisiana, invece, sono risultati essere denutriti e molto probabilmente sono morti di freddo e malnutrizione[15].
L'areale dell'ittero alirosse si estende in latitudine dall'Alaska meridionale alla Penisola dello Yucatán e in longitudine dalle coste occidentali di California e Canada alle sponde orientali del continente. Gli uccelli che vivono nelle regioni settentrionali dell'areale sono migratori e trascorrono l'inverno negli Stati Uniti meridionali e in America Centrale. La migrazione inizia in settembre od ottobre, ma occasionalmente può cominciare anche in agosto. Nelle regioni occidentali e centrali degli Stati Uniti le popolazioni sono generalmente stanziali[13].
L'ittero alirosse vive nelle distese erbose aperte. Generalmente predilige le zone umide, come le paludi, sia di acqua dolce che salmastra, soprattutto nelle aree dove crescono le canne del genere Typha. Si incontra anche nelle regioni asciutte di pianura, ad esempio in prati, praterie e campi abbandonati[13].
L'ittero alirosse, una delle 5 specie del genere Agelaius, è un rappresentante degli Itteridi, una famiglia di uccelli passeriformi diffusi in Nord e Sudamerica[16]. Venne descritto per la prima volta, come Oriolus phoeniceus, nel XVIII secolo da Linneo nel suo Systema Naturae[17], ma successivamente venne inserito nel genere Agelaius (Vieillot, 1816) insieme agli altri itteri neri americani[18]. Il nome latino Agelaius deriva dal greco antico agelaios, che significa «appartenente a uno stormo». Il nome specifico phoeniceus è di origine latina e vuol dire «rosso intenso»[19].
Sono note le seguenti sottospecie:[2]
La più caratteristica tra queste è l'«ittero bicolore» (A. p. gubernator) della California e del Messico centrale. I maschi di questa sottospecie sono privi della fascia gialla sulle ali presente nella sottospecie nominale e le femmine sono molto più scure delle altre. La tassonomia di questa razza non è stata ancora compresa appieno e le relazioni tra le due popolazioni isolate di ittero bicolore e tra queste e le altre forme rimangono tuttora incerte[6]. Nonostante il nome inglese Red-winged Blackbird, l'ittero alirosse non è imparentato né con il tordo sassello europeo (in inglese Redwing) né con il merlo comune del Vecchio Mondo (in inglese Common Blackbird), che appartengono alla famiglia dei Turdidi[16].
L'ittero alirosse o merlo dalle ali rosse o merlo ad ali rosse (Agelaius phoeniceus (Linnaeus, 1966)) è un uccello passeriforme della famiglia degli Itteridi diffuso in quasi tutto il Nordamerica e in gran parte dell'America Centrale.
Nidifica dall'Alaska e da Terranova a nord fino alla Florida, al Golfo del Messico, al Messico e al Guatemala a sud; alcune popolazioni isolate si incontrano anche nelle regioni occidentali di El Salvador e in quelle nord-occidentali di Honduras e Costa Rica. Il limite settentrionale dell'areale di svernamento va dalla Pennsylvania alla Columbia Britannica, ma le popolazioni settentrionali sono generalmente migratrici e d'inverno si spostano a sud, in Messico e negli Stati Uniti meridionali. Presenta uno spiccato dimorfismo sessuale: il maschio è completamente nero con le spalle rosse e una fascia gialla sulle ali, mentre la femmina è marrone scuro. Gran parte della dieta di questo uccello è costituita da semi e insetti.
Raudonsparnis trupialas (lot. Agelaius phoeniceus, angl. Red-winged Blackbird, vok. Rotschulterstärling) – trupialinių (Icteridae) šeimos paukštis.
Kūnas iki 22 cm ilgio. Visas patino kūnas juodas, žvilgantis, su raudonomis sparnų dėmėmis. Jas jis išpučia demonstruodamasis ir giedodamas ant šakos.
Aptinkamas pelkėtose vietose didžiojoje Šiaurės Amerikos dalyje. Žiemą telkiasi dideliais būriais.
Raudonsparnis trupialas (lot. Agelaius phoeniceus, angl. Red-winged Blackbird, vok. Rotschulterstärling) – trupialinių (Icteridae) šeimos paukštis.
Kūnas iki 22 cm ilgio. Visas patino kūnas juodas, žvilgantis, su raudonomis sparnų dėmėmis. Jas jis išpučia demonstruodamasis ir giedodamas ant šakos.
Aptinkamas pelkėtose vietose didžiojoje Šiaurės Amerikos dalyje. Žiemą telkiasi dideliais būriais.
De epauletspreeuw (Agelaius phoeniceus) is een zangvogel uit de familie troepialen. Dit zijn alleen in de Nieuwe Wereld voorkomende vogelsoorten. Het is een zeer algemene en veel bestudeerde vogel in Noord-Amerika.
De epauletspreeuw heeft een glanzend zwart verenpak, daarom wordt in het Nederlands de vogel als spreeuw aangeduid. Bij een onzorgvuldige vertaling uit het Engels (w:en:Red-Winged Blackbird) wordt de vogel ook wel merel genoemd. De soort is echter helemaal niet verwant aan de spreeuwen of aan lijsters. De vogel komt uit een typisch Amerikaanse familie (Icteridae); deze familie staat het dichtst bij de ook in Europa voorkomende gorzen.[2]
Het mannetje heeft een zwart verenkleed met rode vleugelvlekken. Deze vlekken zijn omringd door kleine gele of witte strepen. De vrouwtjes en jonge vogels hebben een gestreept, zwartbruin tot bruin verenkleed. De vogel is 18-24 centimeter lang en heeft een spanwijdte van 30-37 centimeter. De snavel is puntig en scherp en de stevige poten hebben vier tenen aan de voet, een naar achteren en drie naar voren. Het mannetje spreidt zijn vleugels tijdens het zingen om zijn territorium af te bakenen en de aandacht van vrouwtjes op zich te vestigen. Hierbij zijn de vleugelvlekken opvallende goed zichtbaar.
's Zomers foerageren epauletspreeuwen op spinnen, zaden, granen, kevers, vlinders en andere insecten. Ook op vruchten, zoals bosbessen en bramen. De insecten worden gevangen in de lucht of op de grond. In de winter voeden zich voornamelijk met zaden en granen.
De soort telt 22 ondersoorten:
De epauletspreeuw is een veel voorkomende bewoner van rivierdalen in de buurt van moerassen, natte graslanden, weilanden of akkers in Noord-Amerika. Vogels in het noordelijk deel van het verspreidingsgebied zijn trekvogels die overwinteren in Midden- en Zuid-Amerika van Baja Califonia naar Florida. In het voorjaar trekken zij in grote groepen naar de broedgebieden in het noorden van Noord-Amerika en het zuidoosten van Alaska en Canada. De broedtijd is van februari tot augustus. Het mannetje blijft trouw aan de plaats van het nest, vrouwtjes kiezen elk jaar een andere broedplaats.
Epauletspreeuwen verzamelen zich buiten het broedseizoen in grote groepen. Tot ergernis van veel boeren veroorzaken zij daarbij aanzienlijke schade aan boomgaarden en graanvelden. Daarom wordt de vogel bestreden.
Deze vogelsoort kwam begin 2011 uitgebreid in het nieuws omdat in de Verenigde Staten op een snelweg bij Pointe Coupee Parish (Louisiana) en in Beebe (Arkansas) honderden epauletspreeuwen uit de lucht vielen en/of dood op straat lagen. Bij onderzoek bleek geen sprake van vergiftiging of een plotseling optredende ziekte. Deskundigen vermoedden dat het ging om aanvaringen. Grote, dichte groepen waren mogelijk 's nachts opgeschrikt door vuurwerk en in het donker snel weggevlogen en ergens tegenaan gebotst of hadden massaal een harde landing op het wegdek gemaakt.[3]
Bronnen, noten en/of referentiesDe epauletspreeuw (Agelaius phoeniceus) is een zangvogel uit de familie troepialen. Dit zijn alleen in de Nieuwe Wereld voorkomende vogelsoorten. Het is een zeer algemene en veel bestudeerde vogel in Noord-Amerika.
Rødvingetrupial (Agelaius phoeniceus) er en fugl i trupialfamilien. Den finnes i store deler av Nord- og Sentral-Amerika og den hekker i områder fra Alaska til New Foundland i nord til Florida, Mexicogulfen og Guatamala i sør. De nordligste populasjonene trekker sørover til Mexico og sydlige områder av USA for vinteren. Rødvingetrupialen er en av de vanligste og mest studerte fugleartene i Nord-Amerika[3]. Hannen er helsvart med et rødt og gult bånd på vingeskulderen mens hunnen er mørkebrun.
Det finnes 24 underarter av rødvingetrupial[4]:
Rødvingetrupial (Agelaius phoeniceus) er en fugl i trupialfamilien. Den finnes i store deler av Nord- og Sentral-Amerika og den hekker i områder fra Alaska til New Foundland i nord til Florida, Mexicogulfen og Guatamala i sør. De nordligste populasjonene trekker sørover til Mexico og sydlige områder av USA for vinteren. Rødvingetrupialen er en av de vanligste og mest studerte fugleartene i Nord-Amerika. Hannen er helsvart med et rødt og gult bånd på vingeskulderen mens hunnen er mørkebrun.
Epoletnik krasnoskrzydły[3] (Agelaius phoeniceus) – gatunek ptaka z rodziny kacykowatych (Icteridae).
Wyróżniono ponad dwadzieścia podgatunków A. phoeniceus[4][5][3]:
Długość ciała 19–24 cm, masa ciała 36g. Samiec czarny, ze szkarłatnymi, płowo obwiedzionymi epoletami; czasami rdzawymi. Samica mniejsza, ciemnobrązowa, wierzch ciała w płowe kreski, od spodu jasna, w gęste i ciemnobrązowe kreski. Brew i gardło płowe. Jednoroczny samiec ciemniejszy niż samica, o pomarańczowych epoletach w ciemne plamki, płowej brwi, jasnych policzkach i gardle. Młode ptaki podobne do samicy.
Zarośnięte tereny podmokłe Ameryki Północnej, poza obszarami najbardziej wysuniętymi na północ. Zimę spędza w środkowej oraz południowej części Ameryki Północnej.
Epoletnik krasnoskrzydły (Agelaius phoeniceus) – gatunek ptaka z rodziny kacykowatych (Icteridae).
O Tordo-sargento ou pássaro-preto-da-asa-vermelha (Agelaius phoeniceus) é uma ave que apresenta um grande dimorfismo sexual.[1]
O Tordo-sargento ou pássaro-preto-da-asa-vermelha (Agelaius phoeniceus) é uma ave que apresenta um grande dimorfismo sexual.
Rdečeperuti škorčevec (znanstveno ime Agelaius phoeniceus) je ptica pevka iz družine škorčevcev (Icteridae). Najdemo jo v večjem delu severne in srednje Amerike. Gnezdi od Aljaske in Nove Fundlandije na severu, na jugu pa do Floride, the Mehiškega zaliva, Mehike in Gvatemale, z izoliranimi populacijami v zahodnem Salvadorju, severozahodnem Hondurasu in severozahodni Kostariki.
Rdečeperuti škorčevec (znanstveno ime Agelaius phoeniceus) je ptica pevka iz družine škorčevcev (Icteridae). Najdemo jo v večjem delu severne in srednje Amerike. Gnezdi od Aljaske in Nove Fundlandije na severu, na jugu pa do Floride, the Mehiškega zaliva, Mehike in Gvatemale, z izoliranimi populacijami v zahodnem Salvadorju, severozahodnem Hondurasu in severozahodni Kostariki.
Rödvingetrupial[2] (Agelaius phoeniceus) är en mycket talrik nord- och centralamerikansk fågelart inom familjen trupialer.[3]
Rödvingetrupialen är en 17-23 centimeter lång rätt satt och bredvingad trupial med en tunn, konformad näbb och medellång stjärt. Hanen är lätt att känna igen med sin glansigt svarta dräkt och de röda skuldrorna som gett arten dess namn. Nedan för det röda syns även ett gult vingband. Honan är genomgående mörkbrun och kraftigt streckad, med blekare bröst, rostkantade ryggfjädrar, vitaktigt ögonbryn och gulaktig anstrykning runt näbben.[4]
Hanen hos underarterna i californicus-gruppen samt mexikanska gubernator saknar det gula vingbandet och honan är mörkare med helmörk buk och undre stjärttäckare. I Kalifornien finns risk för förväxling med närbesläktade arten kalifornisk trupial. Den har spetsigare vingar, mörkare röd skulderfläck och vitt istället för gult vingband hos hanen, medan honan är mörkt gråbrun utan rostfärgade inslag ovan.[5]
Rödvingetrupialens läten är ett tjockt tjeck och en ljus glidande vissling terr-eeee. Hanens sång som levereras samtidigt som han visar upp sina röda skulderfläckar är ett gnissligt och tjockt ok-a-lee,[6] hos västliga fåglar ooPREEEEEom.[7] Honan sjunger också, ett grälande tjatter: tjitt tjitt tjitt tjitt tjitt tjitt tjeer teer teer teerr.[8]
Rödvingetrupialen häckar från Alaska och Newfoundland söderut till Florida, Mexikanska golfen, Mexiko och Guatemala med isolerade populationer i västra El Salvador, nordvästra Honduras och nordvästra Costa Rica. Vintertid ses den så långt norrut som Pennsylvania och British Columbia, men nordliga populationer är generellt flyttfåglar som övervintrar söderut till Mexiko och södra USA.[9] Det finns hela 24 underarter av rödvingetrupialen med följande utbredning:[3]
Underarterna matudae och brevirostris inkluderas ofta i richmondi.[10] Underarten gubernator har föreslagits utgöra en egen art, ofta inkluderande californicus-gruppen.[11] Möjligen var den tidigare en isolerad population, men övergår numera i nelsoni.[12]
Rödvingetrupialen är en mycket sällsynt gäst i Europa med endast ett fynd: en hona upptäckt vid North Ronaldsay i Orkneyöarna 29 april 2017.[13]
Rödvingetrupialen bebor öppna gräsrika områden, helst i våtmarker, framför allt de med kaveldun. Den påträffas även i torrare områden där den bebor ängar, prärier och igenväxande fält.[9]
Rödvingetrupialen är en allätare. Den intar huvudsakligen vegetabilisk föda som ogräsfrön och säd, men en fjärdedel av födan är animalisk, än mer så under häckningssäsongen.[14] Den föredrar insekter som trollsländor, flicksländor och jungfrusländor, malar, flugor och fjärilar, men tar även sniglar, grodor, fågelägg, maskar, mollusker, spindlar och till och med as. Den äter även blåbär, björnbär och annan frukt när den finns tillgänglig. I slutet av sommaren och på hösten samlas stora mängder rödvingetrupialer på fält för att födosöka, ofta tillsammans med stare, brunhuvad kostare och mindre båtstjärt.[15]
Rödvingetrupialen häckar i lösa kolonier bland kaveldun, gräs, säv eller i al- eller pilsnår. Enbart honan bygger boet, en korg av gräs, säv och mossa, fodrad med lera och lägger två till fyra ägg däri. Äggen ruvas i elva till 13 dagar och ungarna är flygga elva till 14 dagar efter kläckning.[4][16]
Fågeln har ett polygynt häckningsbeteende, där hanar kan försvara upp till tio honor. Honor kan dock para sig med andra hanar och lägger ofta kullar där äggen har flera olika pappor. Den kan föda upp två till tre kullar per säsong, i ett nytt bo för varje kull.[17]
Predation av ägg och ungar är ganska vanligt, av ormar, mink, tvättbjörn och andra fåglar, till och med så små som kärrgärdsmygen. Ibland boparasiteras den även av brunhuvad kostare.Fågeln har utvecklat ett försvar mot predationen. Genom att häcka i kolonier, över vatten och ljuda varningsläten minskas risken.[18] Framför allt hanarna ägnar sig också åt att aggressivt jaga bort ovälkomna besökare och kan attackera inte bara större fåglar utan också människor.[15][19][20]
Utanför häckningstid söker sig rödvingetrupialen till jordbruksområden, där den kan betraktas som ett skadedjur.[8] Jordbrukare har använt besprutningsmedel som paration i olagliga försök att bli av med dem.[21] Till och med amerikanska jordbruksdepartementet USDA har avsiktligt olovligen förgiftat arten; 2009 rapporterade Animal and Plant Health Inspection Service att en knapp miljon individer hade förgiftats i Texas och Louisiana.[22] Vissa tror att detta kan vara en orsak till myrtrupialens försvinnande, en fågelart som minskat med 99% sedan 1960-talet.[23]
Rödvingetrupialen har ett mycket stort utbredningsområde, men minskar i antal, mellan 1966 och 2014 med 30%.[24] Fortfarande är den dock en av Nord- och Centralamerikas vanligaste tättingar med en uppskattad världspopulation på hela 130 miljoner individer.[25] Internationella naturvårdsunionen kategoriserar den som livskraftig.[1]
Svenskarna i Nya Sverige kallade arten majstjuvar eller mer specifikt rödvingade majstjuvar för namnet "majstjuv" användes även om mindre båtstjärten.[26] [27]
Rödvingetrupial (Agelaius phoeniceus) är en mycket talrik nord- och centralamerikansk fågelart inom familjen trupialer.
Agelaius phoeniceus là một loài chim trong họ Icteridae.[2]
Брачная песня самца — «механический» хриплый крик, сопровождаемый булькающе-трещащей руладой «гонг-ля -ррри». Во время песни птица часто демонстративно возвышается на открытом сухом стебле тростника, горбится, опускает и полурасправляет крылья, демонстрируя «эполеты»[2]. Голос самки — грубоватое чириканье «чит-чит-чит-чит-чит-чит-чиир-тиир-тиир-тиирр»[13].
В Северной Америке красноплечий трупиал встречается почти повсеместно, за исключением пустынных, высокогорных и приполярных областей. Основной участок ареала находится от Ньюфаундленда и южной Аляски к югу до Флориды, побережья Мексиканского залива до Юкатана, южной Мексики и Гватемалы. Кроме того, изолированно гнездится на западе Сальвадора, в северной части Гондураса и северо-западе Коста-Рики. Частично перелётный вид, зимует к югу до Мексики и южных штатов США. Всё же основная часть птиц к югу от Пенсильвании и Британской Колумбии ведёт оседлый образ жизни. Осенняя миграция обычно продолжается с середины октября по первую декаду декабря, весенняя — с конца февраля по конец апреля[14].
Наибольшой плотности поселений достигает в восточной части континента. Гнездится на хорошо увлажнённых, открытых травянистых пространствах, в том числе в городской черте. Часто селится на заболоченных участках с пресной либо солёной водой, отдавая предпочтение зарослям рогоза. На возвышенностях населяет осоковые луга, поля, засеянные люцерной и другими бобовыми культурами, а также находящиеся под паром. Реже устраивает гнёзда в лесистой местности по берегам рек. Зимой концентрируется в степных, пастбищных участках, в загонах скота, на засеянных зерновыми сельскохозяйственных угодьях[10][2].
Диапазон кормов широкий, при этом примерно на три четверти состоит из растительной пищи. Летом и осенью употребляет в пищу ягоды черники и ежевики, семена различных трав. Часто встречается на полях, где питается молодыми ещё мягкими зёрнами кукурузы, пшеницы, подсолнечника, риса (в отличие от обыкновенного гракла, пищеварительная система трупиала не адаптирована к усвоению крупных твёрдых зёрен и другой жёсткой пищи)[15]. В сезон размножения преобладают животные корма, в первую очередь летающие насекомые: стрекозы, бабочки, мухи, а также улитки, лягушки, черви, паукообразные, моллюски. Посещает птичьи кормушки с хлебом, семечками и салом. Изредка употребляет в пищу падаль. Корм обычно склёвывает с поверхности листьев либо схватывает на лету[16].
Сезон размножения с конца апреля по середину июля, две или реже три кладки[17][18]. Гнездится рассеянными колониями. Самцы занимают небольшие гнездовые участки и активно токуют с высоты сухого стебля травы, чтобы привлечь самок. Несколько самцов-соседей преследуют каждую самку, пролетающую через их участки, пока самка не сделает свой выбор[2]. Самцы строго территориальны, в светлое время суток больше четверти времени отводят на охрану территории. Они гоняют не только залётных птиц, но и заходящих на территорию наземных хищников, в том числе крупных. Известны случаи нападения трупиалов даже на лошадей и человека[10]. Среди красноплечих трупиалов высокий процент полигинии, в некоторых популяциях до 90 % самцов спариваются более чем с одной самкой. При этом в отдельных случаях на территории одного самца может гнездиться до 15 самок[10].
Гнездо сооружает одна самка. Оно представляет собой чашевидное образование, состоящее из травянистой растительности, гнилых кусочков древесины и мха, скреплённых илом. На заболоченном участке самка располагает его на заломе тростника или рогоза, возле воды либо прямо над ней. Если птица гнездится вдали от воды — на лугу или в поле, гнездо устраивается в высокой траве (часто золотарник, пшеница, ячмень, люцерна), между корней кустарниковой ольхи или ивы. Готовое гнездо имеет диаметр 10—17 см и глубину лотка 7—17 см[10]. Для каждой последующей кладки самка строит новое гнездо.
В кладке 2—4 яйца. Скорлупа яиц гладкая, блестящая, голубовато-зелёного или голубовато-серого цвета с тёмными пятнами и крапинами, более густыми со стороны тупого конца. Размеры яиц: (22—27) х (16—19) мм. Насиживает самка 11—14 дней[10]. Птенцы появляются на свет слепыми и беспомощными, покрытыми редким охристым пухом. Они редко покидают гнездо раньше 11—14 дней, когда приобретают способность к активному полёту[18].
В наблюдениям в Огайо, за месяц насиживания и выхаживания выживает около половины птенцов. Часть кладок погибает во время сенокоса, другую уничтожают хищники — змеи, еноты, американские норки и другие птицы — даже такие мелкие, как болотный крапивник (Cistothorus palustris)[17]. На гнёздах птиц иногда паразитирует другой представитель семейства — буроголовый коровий трупиал[19].
Список видов по версии многотомника «Handbook of the Birds of the World»[20]:
Брачная песня самца — «механический» хриплый крик, сопровождаемый булькающе-трещащей руладой «гонг-ля -ррри». Во время песни птица часто демонстративно возвышается на открытом сухом стебле тростника, горбится, опускает и полурасправляет крылья, демонстрируя «эполеты». Голос самки — грубоватое чириканье «чит-чит-чит-чит-чит-чит-чиир-тиир-тиир-тиирр».
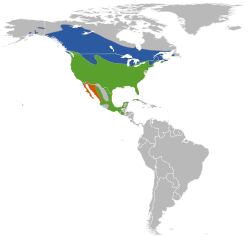
紅翅黑鸝(學名:Agelaius phoeniceus,英文名:red-winged blackbird),亦作紅翅烏鶇、美洲红翼鸫,是黑鸝屬的一種鳥類,主要分布於北美洲。分有多個族群,北部的族群在冬季飛往南部過冬,此外在薩爾瓦多西部、洪都拉斯西北部和哥斯達黎加西北部有獨立的族群。數量極多,是北美洲數量最多的陸禽,學者對這種鳥也有極為透徹的研究[2][3][4]。紅翅黑鸝的兩性異形特征十分明顯,雄性通體黑色、有紅色的肩部和黃色色帶,雌性通體深褐色,無其他明顯特征。紅翅黑鸝是雜食動物,以植物種子和昆蟲為食。
紅翅黑鸝是黑鸝屬(Agelaius)下的十一個種之一,而該屬所在的擬黃鸝科(Icteridae)下所有生物均只生活在南美洲和北美洲[5]。卡爾·林奈在《自然系統》中將其學名定爲Oriolus phoeniceus[6],但後來在1816年由路易·讓·皮埃爾·維埃洛特移入黑鸝屬[7]。其屬名來自古希臘語的拉丁轉寫詞agelaios,意思是“一羣中的”,種加詞phoeniceus來自拉丁語,意思是“深紅色”[8]。
紅翅黑鸝有多個亞種,大多數看起來極爲相似。只有加利福尼亞州和墨西哥中部的A. p. gubernator之間色彩區別明顯。實際上它們與紅翅黑鸝的關係還存疑[9]。
其常用名來自雄性的黑色羽毛和紅色肩部,後者無論是飛行中還是棲息时都很明顯[10]。除去有三色黑鸝的美國西部以外,紅翅黑鸝在大多數地區都很容易辨認[9]。雌性通體黑褐色,羽毛並不鮮豔。雌性比雄性小,雌性體長17~18厘米(6.7~7.1英寸)、重約41.5克(1.46盎司),雄性體長22~24厘米(8.7~9.4英寸)、重約64克(2.3盎司)[11]。最小的雌性個體體重低至29克(1.0盎司),最重的雄性可達82克(2.9盎司)[12]。翅膀長度8.1~14.4厘米(3.2~5.7英寸),尾巴長6.1~10.9厘米(2.4~4.3英寸),嘴峰長1.3~3.2厘米(0.51~1.26英寸),跗骨長2.1厘米(0.83英寸)[9]。兩性的喙都很尖銳,連同眼睛、跗蹠在內均是黑色的[13]。
幼鳥羽毛和成年雌性相似,但下半身更淺,且羽毛邊緣呈淺黃色[13]。紅翅黑鸝有多種聲音,一種是發音像是用喉音發出的“check”、一種是含糊的哨子樣的“terrr-eeee”。雄性在展示羽毛時會發出尖厲的“oak-a-lee”聲[14][15]。雌性也會歌唱,一般聲音類似“chit chit chit chit chit chit cheer teer teer teerr”[9]。
紅翅黑鸝自阿拉斯加南部到尤卡坦半島、加利福尼亞州沿海到加拿大東部都有分佈。加拿大等北部地區是繁殖區,這些地區的紅翅黑鸝都是候鳥,而南部則大多是留鳥。每年九月到十月間是遷徙季節,但有時八月也會出現紅翅黑鸝遷徙的跡象。[16]
紅翅黑鸝生活在開闊的草地上,尤其偏愛濕地,這其中又以生長香蒲之地為最。不過在草原和荒廢地上也常能找到它們。[16]
紅翅黑鸝(學名:Agelaius phoeniceus,英文名:red-winged blackbird),亦作紅翅烏鶇、美洲红翼鸫,是黑鸝屬的一種鳥類,主要分布於北美洲。分有多個族群,北部的族群在冬季飛往南部過冬,此外在薩爾瓦多西部、洪都拉斯西北部和哥斯達黎加西北部有獨立的族群。數量極多,是北美洲數量最多的陸禽,學者對這種鳥也有極為透徹的研究。紅翅黑鸝的兩性異形特征十分明顯,雄性通體黑色、有紅色的肩部和黃色色帶,雌性通體深褐色,無其他明顯特征。紅翅黑鸝是雜食動物,以植物種子和昆蟲為食。

ハゴロモガラス (学名:Agelaius phoeniceus) は、スズメ目ムクドリモドキ科に分類される鳥類の一種。
名前に「カラス」とあるがカラスの仲間ではない。
2010年12月31日夜、アメリカ南部アーカンソー州ピービで数千羽が死んでいるのが見つかった[1]。米メディアではアルフレッド・ヒッチコックの『鳥』さながらだと報じている。死んだ鳥の胸には内出血の跡があり、複雑骨折していた。原因は新年を迎える為にあげられた花火に驚き、鳥たちがお互いに衝突死した模様。[2]