mk
имиња во трошки

Bei Anaplasma phagocytophilum handelt es sich um ein Bakterium, das durch Zecken übertragen werden kann, und beim Menschen eine fieberhafte Erkrankung, die Humane Granulozytäre Anaplasmose, verursacht. Auch Tiere wie Hunde (Canine Anaplasmose), Katzen, Pferde und Wiederkäuer können infiziert werden.
Aufgrund von Genanalysen wurden die früheren Arten Ehrlichia phagocytophilum, Ehrlichia equi und das HGE-Agens zur neuen Art Anaplasma phagocytophilum zusammengefasst. Zunächst war die Art fälschlicherweise Anaplasma phagocytophila genannt worden. Die verursachte Krankheit wird daher heute auch nicht mehr als humane granulozytäre Ehrlichiose (HGE), sondern als humane granulozytäre Anaplasmose bezeichnet.
In der Tiermedizin ist der Krankheitserreger seit 1932 bekannt, über die erste Infektion beim Menschen wurde 1990 oder 1994 berichtet.[1][2]
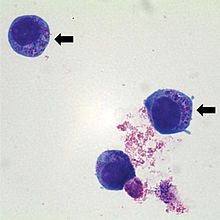
Das gramnegative Bakterium lebt obligat intrazellulär in Granulozyten, wo es sich in zytoplasmatischen Vakuolen vermehrt. Unter dem Mikroskop lassen sich nach Infektion charakteristische 2–5 µm große Einschlüsse erkennen, die wegen ihrer Ähnlichkeit zu Maulbeeren als Morulae bezeichnet werden.
Die Übertragung auf Menschen und Tiere erfolgt durch Zeckenbisse: Der häufigste Überträger in Europa ist der Holzbock (Ixodes ricinus), in Nordamerika vor allem Ixodes scapularis und Ixodes pacificus. Ein Schutz vor Zecken ist also zugleich Infektionsprophylaxe.
Bei Anaplasma phagocytophilum handelt es sich um ein Bakterium, das durch Zecken übertragen werden kann, und beim Menschen eine fieberhafte Erkrankung, die Humane Granulozytäre Anaplasmose, verursacht. Auch Tiere wie Hunde (Canine Anaplasmose), Katzen, Pferde und Wiederkäuer können infiziert werden.
Anaplasma phagocytophilum (formerly Ehrlichia phagocytophilum)[2] is a Gram-negative bacterium that is unusual in its tropism to neutrophils. It causes anaplasmosis in sheep and cattle, also known as tick-borne fever and pasture fever, and also causes the zoonotic disease human granulocytic anaplasmosis.[3]
A. phagocytophilum is a Gram-negative, obligate bacterium of neutrophils. It causes human granulocytic anaplasmosis, which is a tick-borne rickettsial disease. Because this bacterium invades neutrophils, it has a unique adaptation and pathogenetic mechanism.[4]
A. phagocytophilum is a small, obligate, intracellular bacterium with a Gram-negative cell wall. It is 0.2–1.0 μm and lacks a lipopolysaccharide biosynthetic machinery. The bacterium first resides in an early endosome, where it acquires nutrients for binary fission and grows into small groups called morulae. This bacterium prefers to grow within myeloid or granulocytic cells.[4]
Hosts include goat, cattle, horse and dog. Cattle infections had been suspected but were only first confirmed by Nieder et al. 2012.[5]
A. phagocytophilum causes human granulocytic anaplasmosis (HGA). This disease was first identified in 1990, although this pathogen was known to cause veterinary disease since 1932. Since 1990, incidence of HGA has increased, and it is now recognized in Europe. This disease was first identified due to a Wisconsin patient who died with a severe febrile illness two weeks after a tick bite. During the last stage of the infection, a group of small bacteria was seen within the neutrophils in the blood. Other symptoms include fever, headache, absence of skin rash, leucopenia, thrombocytopenia, and mild injury to the liver.[4]
The disease is multisystemic, but the most severe changes are anaemia and leukopenia. This organism causes lameness, which can be confused with symptoms of Lyme disease, another tick-borne illness. It is a vector-borne zoonotic disease whose morula can be visualized within neutrophils (a type of white blood cell) from the peripheral blood and synovial fluid. It can cause lethargy, ataxia, loss of appetite, and weak or painful limbs.[3]
A. phagocytophilum binds to fucosylated and sialylated scaffold proteins on neutrophil and granulocyte surfaces. A type IV secretion apparatus is known to help in the transfer of molecules between the bacterium and the host. The most studied ligand is PSGL-1 (CD162). The bacterium adheres to PSGL-1 (CD162) through the 44-kDa major surface protein-2 (Msp2). After the bacterium enters the cell, the endosome stops maturation and does not accumulate markers of late endosomes or phagolysosomes. Because of this, the vacuole does not become acidified or fused to lysosomes. A. phagocytophilum then divides until cell lysis or when the bacteria leave to infect other cells.[4]
This bacterium has the ability to affect neutrophils by altering their function. It can survive the first encounter with the host cell by detoxifying superoxide produced by neutrophil phagocyte oxidase assembly. It also disrupts normal neutrophil function, such as endothelial cell adhesion, transmigration, motility, degranulation, respiratory burst, and phagocytosis.[4] It causes an increase in the secretion of IL-8, a chemoattractant that increases the phagocytosis of neutrophils. The purpose of this is to increase bacterial dissemination into the neutrophil.[6]
These tests can be performed to determine an A. phagocytophilum infection:
Patients with HGA undergo doxycycline therapy, 100 mg twice daily until the patient's fever subsides for at least 3 days. This drug has been the most beneficial to those patients infected with the bacteria. Some other tetracycline drugs are also effective. In general, patients with symptoms of HGA and unexplained fever after a tick exposure should receive empiric doxycycline therapy while their diagnostic tests are pending, especially if they experience leukopenia and/or thrombocytopenia.[7]
In animals, antibiotics such as oxytetracycline, sulphamethazine, sulphadimidine, doxycycline, and trimethoprim-sulphonamides have been used.[3]
Anaplasma phagocytophilum (formerly Ehrlichia phagocytophilum) is a Gram-negative bacterium that is unusual in its tropism to neutrophils. It causes anaplasmosis in sheep and cattle, also known as tick-borne fever and pasture fever, and also causes the zoonotic disease human granulocytic anaplasmosis.
A. phagocytophilum is a Gram-negative, obligate bacterium of neutrophils. It causes human granulocytic anaplasmosis, which is a tick-borne rickettsial disease. Because this bacterium invades neutrophils, it has a unique adaptation and pathogenetic mechanism.
Anaplasma phagocytophilum on bakteriliik.[1]
Varem on seda bakterit nimetatud mitmeti: Anaplasma phagocytophila, Ehrlichia phagocytophilum ja Ehrlichia phagocytophila, ka Ehrlichia egui.[2][3]
2001. aastal muudeti geneetilise analüüsi tulemuste põhjal bakteri taksonoomilist kuuluvust.[4]
Oletatakse, et Anaplasma phagocytophilum elutsükkel organismis võib häirida neutrofiilide fagotsütoosi, samuti viibib apoptoos. Anaplasma phagocytophilum muudab rakkudevahelist suhtlust nii, et suureneks IL-1 ja IL-8 tsütokiinide osakaal, ning see omakorda signaliseerib neutrofiilide tõmmet Anaplasma phagocytophilumi sulundkehakestesse.
Bakter on obligatoorne rakusisene patogeen, mida levitavad puugid. Puugihammustuse kaudu organismi sattudes tungib see perifeerse vere granulotsüütidesse ja võib nii loomadel (sh madudel ja sisalikulistel[6]) kui ka inimestel (inimese granulotsütaarset anaplasmoosi) anaplasmoosi põhjustada.[7]
Selles artiklis on kasutatud saksakeelset artiklit de:Anaplasma phagocytophilum seisuga 22.01.2014.
Anaplasma phagocytophilum (anciennement Ehrlichia phagocytophilum)[1] est une bactérie à Gram négatif dotée d'une attirance (tropisme) inhabituelle pour les neutrophiles (elle ne peut se reproduire que dans les neutrophiles) et capable de déjouer le système immunitaire de son hôte grâce à un mécanisme d'adaptation et pathogénique unique[2].
Cette bactérie est l'agent des anaplasmoses ovine et bovine (transmise par des tiques), aussi dénommées « fièvre des pâturages », et elle provoque aussi la maladie zoonotique anaplasmose granulocytaire humaine[3].
A. phagocytophilum est une petite bactérie (intracellulaire obligatoire) à paroi cellulaire à Gram négatif.
Elle mesure 0,2–1,0 μm, et ne possède pas de mécanisme de biosynthèse des lipopolysaccharides.
La bactérie réside d'abord dans un endosome précoce, où elle acquiert des nutriments pour la fission binaire, et elle se développe en petits groupes (dits morulae).
Cette bactérie a une préférence marquée pour les cellules myéloïdes ou granulocytaires[2].
Bien que ce pathogène était connu comme agent de maladies vétérinaires depuis 1932, ce n'est qu'en 1990 qu' A. phagocytophilum a été reconnu comme agent d'une zoonose dénommée anaplasmose granulocytaire humaine (AGH ou HGA pour les anglophones). Cette maladie a été identifiée pour la première fois chez un patient du Wisconsin décédé d'une grave maladie fébrile deux semaines après une piqûre de tique. Au cours de la dernière étape de l'infection, un groupe de petites bactéries a été observé dans les polynucléaires neutrophiles de son sang.
Depuis 1990, l'incidence des HGA a augmenté et elle est maintenant reconnue dans toute l'Europe.
Les symptômes incluent fièvre, maux de tête, leucopénie, thrombocytopénie et légère lésion du foie ; sans éruption cutanée[2].
La maladie est multisystémique, avec comme changements les plus graves[3] :
La maladie est zoonotique (pouvant être transmise à l'Homme, a priori toujours via une transmission vectorielle) ; la morula peut être visualisée dans les neutrophiles infectés (le neutrophile est un type de globule blanc) dans le sang périphérique mais aussi dans le liquide synovial.
A. phagocytophilum se lie aux protéines d'échafaudage fucosylées et sialylées sur les surfaces des neutrophiles et des granulocytes. On sait qu'un appareil de sécrétion de type IV est aide au transfert de molécules entre la bactérie et l'hôte. Le ligand le plus étudié est PSGL-1 (CD162). La bactérie adhère à PSGL-1 (CD162) à travers une protéine de surface majeure de 44 kDa (Msp2).
Après l'entrée de la bactérie dans la cellule, l'endosome arrête la maturation et n'accumule pas de marqueurs d'endosomes ou de phagolysosomes tardifs. Pour cette raison, la vacuole ne s'acidifie pas ni ne fusionne aux lysosomes.
A. phagocytophilum se divise ensuite jusqu'à la lyse) des cellules ou quand les bactéries quittent la cellule infectée pour aller en infecter d'autres[2].
Cette bactérie peut modifier et détourner la fonction des neutrophiles à son avantage. Elle peut survivre à la première rencontre avec la cellule hôte en détoxifiant le superoxyde produit par l'assemblage des neutrophiles phagocytes oxydases. Elle perturbe notamment des fonctions normales des neutrophiles, telles que l'adhésion des cellules endothéliales, la transmigration, la motilité, la dégranulation, l'éclatement respiratoire et la phagocytose[2].
Elle provoque enfin une augmentation de la sécrétion de l'IL-8 (un chimioattracteur) qui augmente la phagocytose des neutrophiles, ici dans le but d'augmenter la dissémination bactérienne dans d'autres neutrophiles[4].
Ces tests permettent de confirmer l'infection à A. phagocytophilum[5] :
Le plus utilisé est le test d'immunofluorescence indirecte ; les échantillons de sérum prélevés en phase aiguë ou de convalescente peuvent ainsi être évalués pour rechercher un changement du titre d'anticorps pour A. phagocytophilum.
Les inclusions intracellulaires (morulae) peuvent être visualisées dans les granulocytes sur des frottis sanguins colorés par Wright ou Giemsa-.
Les tests de PCR (réaction en chaîne par polymérase) sont utilisés pour détecter la présence d'ADN d'A. Phagocytophilum.
Les patients victimes d'Anaplasmose sont généralement traités par la doxycycline (100 mg deux fois par jour jusqu'à ce que la fièvre du patient diminue pendant au moins 3 jours).
Ce médicament a été le plus bénéfique pour les patients infectés par la bactérie. D'autres médicaments, à base de tétracycline sont également efficaces.
Les patients présentant des symptômes d'HGA et de fièvre inexpliquée après une exposition aux tiques devraient recevoir un traitement empirique à la doxycycline pendant que leurs tests de diagnostic sont en attente, surtout s'ils présentent une leucopénie et/ou une thrombocytopénie[5].
Chez les animaux, d'autres antibiotiques ont été utilisés (oxytétracycline, sulfaméthazine, sulfhadimidine, doxycycline et triméthoprime-sulfonamides[3]9.
Anaplasma phagocytophilum (anciennement Ehrlichia phagocytophilum) est une bactérie à Gram négatif dotée d'une attirance (tropisme) inhabituelle pour les neutrophiles (elle ne peut se reproduire que dans les neutrophiles) et capable de déjouer le système immunitaire de son hôte grâce à un mécanisme d'adaptation et pathogénique unique.
Cette bactérie est l'agent des anaplasmoses ovine et bovine (transmise par des tiques), aussi dénommées « fièvre des pâturages », et elle provoque aussi la maladie zoonotique anaplasmose granulocytaire humaine.
Anaplasma phagocytophilum (dawniej Ehrlichia phagocytophila Foggie 1949) – obligatoryjny pasożyt wewnątrzkomórkowy zbliżony budową do riketsji, atakujący granulocyty. Gatunek występujący kosmopolitycznie.
Wywołuje przede wszystkim anaplazmozę zwierząt (AGA) u hodowlanych i dzikich przeżuwaczy, koniowatych i psowatych. U ludzi wywołuje anaplazmozę ludzką (HGA). Czynnikiem transmisyjnym są kleszcze z rodzajów Ixodes i Dermacentor. W Polsce niemal wyłącznie jest to kleszcz pospolity (Ixodes ricinus).
Anaplasma phagocytophilum (dawniej Ehrlichia phagocytophila Foggie 1949) – obligatoryjny pasożyt wewnątrzkomórkowy zbliżony budową do riketsji, atakujący granulocyty. Gatunek występujący kosmopolitycznie.
Wywołuje przede wszystkim anaplazmozę zwierząt (AGA) u hodowlanych i dzikich przeżuwaczy, koniowatych i psowatych. U ludzi wywołuje anaplazmozę ludzką (HGA). Czynnikiem transmisyjnym są kleszcze z rodzajów Ixodes i Dermacentor. W Polsce niemal wyłącznie jest to kleszcz pospolity (Ixodes ricinus).
Anaplasma phagocytophilum är en intracellulär bakterie som infekterar olika blodceller, främst de vita blodkropparna monocyter och granulocyter. Den är en fästingspridd bakterie som kan infektera bland annat människor, hästar, idisslare, gnagare, hundar, katter och rådjur. Den främsta vektorn är fästingar av släktet Ixodes.[1]
Folkbebodda områden som växer och blir allt mer tätbefolkade samt förändringar i jordbruk och landskap kan ge upphov till nya dominanta reservoarer för Anaplasma phagocytophilum. Detta ger bra förutsättning för bakteriens förmåga till infektion i naturen då den kräver tillräckligt långa perioder för utveckling och att det smittsamma djuret måste vara en näringsgivande värd för vektorn.[1]
Släktet Anaplasma inkluderar arterna Anaplasma bovis, Aanaplasma platys och Anaplasma phagocytophilum.[2] Anaplasma phagocytophilum omfattade tidigare arterna Ehrlichia phagocytophila, Ehrlichia equi, samt ett agens för den mänskliga formen av granulocytisk ehrlichios men fenotypiska och genetiska skillnader har lett till att de nu särskiljs i separata taxa.[3] [4]
Anaplasma phagocytophilum är en liten (0,5–1,5 μm), pleomorfisk, gramnegativ, obligat intracellulär bakterie. Den infekterar granulocyter hos en rad däggdjur, inklusive nötkreatur, får, hund, häst och katt[5] och kan ge upphov till olika sjukdomstillstånd. I infekterade celler återfinns bakterien framförallt i vakuoler och cytoplasma.
Cellmorfologin hos A. phagocytophilum skiljer sig mellan olika stadier i infektionscykeln. Infektionen börjar med att så kallade "elementära kroppar" (elementary bodies) tar sig igenom värdcellens cellmembran. Detta infektiösa stadium är reducerat till i princip bara en cellkärna utan mycket annat cellinnehåll. Väl inne i värdcellen börjar bakterien att reproducera sig i vakuolerna och utvecklas till en "initial kropp" (initial body). Bakterierna replikerar sig ända till dess att värdcellens membran spricker, varvid nya infektiösa elementära kroppar släpps fria och cykeln startar igen.[6]
Anaplasma phagocytophilum har en cirkulär kromosom bestående av ca 1,5 miljoner baspar. Olikt många andra bakerier har Anaplasma phagocytophilum inga kända plasmider.[7]
Arten har en stor geografisk spridning i Europa, USA och Asien, men alla hittills identifierade stammar visar relativt liten genetisk variation i exempelvis 16S rRNA, groESL, gltA, ank, och msp2 generna (44). Detta tyder också på en avsevärd serologisk korsreaktivitet mellan stammar.[8]
Membranproteinerna p44 och msp2 finns på ytan av membranet och spelar en huvudroll för bakteriens virulens. Till skillnad från de andra gramnegativa bakterier saknar Anaplasma phagocytophilum ett peptidoglykanlager i yttermembranet och de gener som är viktiga för biosyntesen av lipid A och peptidoglykan saknas i genomet. Sammantaget ger detta ömtåliga celler, som är mycket känsliga mot stress.[9]
Anaplasma phagocytophilum är en fästingburen smitta där fästningar av släktet Ixodes utgör vektorer. I Europa är Ixodes ricinus den främsta vektorn för Anaplasma phagocytophilum, medan det i Nordamerika är Ixodes scapularis på östkusten, och Ixodes pacificus på västkusten. I Asien tillhör Ixodes persulcatus och Ixodes ovatus de främsta vektorerna.[10] Anaplasma phagocytophilum kan troligen spridas av alla Ixodes-arter och skillnaderna i den geografiska spridningen är mer en konsekvens av att olika fästingar har olika utbredning i världen.
Anaplasma phagocytophilum ger upphov till två sjukdomar: mänsklig granulocytisk anaplasmosis, och den mer välkända fästingfebern.[1]
Människan är ingen reservoar för denne bakterie utan sjukdomen överförs från djur till människa, en så kallad zoonos. Infekterade patienter varierar i symptom, allt från att man tillfrisknar på egen hand till att den leder till döden.[1]
De kliniska tecknen inkluderar feber, huvudvärk, muskelsmärtor, anorexia och en känsla av köld oftast i sällskap med leukopeni i följd av bland annat framträdande av omogna celler, trombocytopeni och anemi. Febern är oftast det symtom som upptäcks först.[11]
För att få en initial diagnos på mänsklig granulocytisk anaplasmosis eller fästingfeber bör patienten, människa eller djur, ha en akut feber sjukdom och komma från ett geografiskt område som är endemiskt för just mänsklig granulocytisk anaplasmosis eller fästingfeber. För en klinisk bild görs utvärderingar av blodvärden, inklusive vita blodkroppar, och blodplättar räknas, och nivån på lever- transaminas fastställs. Bakterierna är oftast spridda och svåra att upptäcka, så även ett negativt cellprov från blodet utesluter inte en infektion med Anaplasma phagocytophilum.[1]
Doxycycline är en typ av antibiotika som kan användas på både djur och människor som en behandling mot infektionen orsakad av Anaplasma phagocytophilum. Det viktiga är att behandla infektionen så tidigt som möjligt, helst inom de första dagarna av infektionen. Människor ska gå på behandling mellan 7–14 dagar och djur behandlas vanligen i 3–5 dagar.[1] Kliniska undersökningar visar att febern upplöses inom två dagar, medan huvudvärk och muskelvärk tog tre dagar samt att en allmän försvagning och utmattning varade längst (Bakken et al. 1996).
I dagsläget finns inget vaccin tillgängligt varken för människor eller för veterinärt bruk. Bästa sättet att undvika en infektion är att undvika fästingdrabbade områden trots att det kan vara svårt. Om man varit utsatt för ett område som är fästing-drabbat är det viktigt att i efterhand granska sig själv noga och få bort möjliga fästingar på kroppen.
När det gäller djur finns det olika medel till att hålla fästingarna borta. Det kan vara olika saker som spray eller vätskeliknande som antingen avlivar fästingar eller stöter bort dem.[1]
Anaplasma phagocytophilum är en intracellulär bakterie som infekterar olika blodceller, främst de vita blodkropparna monocyter och granulocyter. Den är en fästingspridd bakterie som kan infektera bland annat människor, hästar, idisslare, gnagare, hundar, katter och rådjur. Den främsta vektorn är fästingar av släktet Ixodes.
Folkbebodda områden som växer och blir allt mer tätbefolkade samt förändringar i jordbruk och landskap kan ge upphov till nya dominanta reservoarer för Anaplasma phagocytophilum. Detta ger bra förutsättning för bakteriens förmåga till infektion i naturen då den kräver tillräckligt långa perioder för utveckling och att det smittsamma djuret måste vara en näringsgivande värd för vektorn.
Släktet Anaplasma inkluderar arterna Anaplasma bovis, Aanaplasma platys och Anaplasma phagocytophilum. Anaplasma phagocytophilum omfattade tidigare arterna Ehrlichia phagocytophila, Ehrlichia equi, samt ett agens för den mänskliga formen av granulocytisk ehrlichios men fenotypiska och genetiska skillnader har lett till att de nu särskiljs i separata taxa.