mk
имиња во трошки


Les serràties (Serratia) són un gènere d'eubacteris gramnegatius de la família de les enterobacteriàciesamb morfologia bacil·lar de petites dimensions de 0,5 a 0,8 micròmetres de diàmetre i de 0,9 a 2,0 micròmetres de llargària, que normalment són mòbils per flagel·lació peritrica. Des del punt de vista ecològic, són microorganismes cosmopolites, que poden viure en molts tipus d'ambients com ara el sòl o aigües dolces, o sobre plantes i insectes o en pacients hospitalitzats. L'espècie més comuna d'aquest gènere, S.marcescens és l'única patògena, provoca infeccions nosocomials.
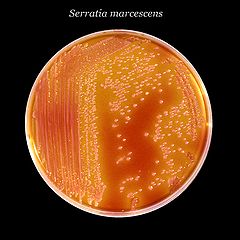
Una característica destacada d'aquest gènere és la capacitat que tenen algunes soques de produir un pigment vermell que recorda el color de la sang fresca. Això va fer pensar, quan creixien serràties sobre hòsties, pa o imatges sagrades, que les seves colònies eren taques de sang. El fet es considerava un miracle i per aquest motiu el pigment va rebre el nom de prodigiosina. Els membres d'aquest gènere també es diferencien dels altres gèneres de les enterobacteriàcies pels enzims que produeixen: DNAses, lipases i gelatinases.
Les serràties (Serratia) són un gènere d'eubacteris gramnegatius de la família de les enterobacteriàciesamb morfologia bacil·lar de petites dimensions de 0,5 a 0,8 micròmetres de diàmetre i de 0,9 a 2,0 micròmetres de llargària, que normalment són mòbils per flagel·lació peritrica. Des del punt de vista ecològic, són microorganismes cosmopolites, que poden viure en molts tipus d'ambients com ara el sòl o aigües dolces, o sobre plantes i insectes o en pacients hospitalitzats. L'espècie més comuna d'aquest gènere, S.marcescens és l'única patògena, provoca infeccions nosocomials.
Una característica destacada d'aquest gènere és la capacitat que tenen algunes soques de produir un pigment vermell que recorda el color de la sang fresca. Això va fer pensar, quan creixien serràties sobre hòsties, pa o imatges sagrades, que les seves colònies eren taques de sang. El fet es considerava un miracle i per aquest motiu el pigment va rebre el nom de prodigiosina. Els membres d'aquest gènere també es diferencien dels altres gèneres de les enterobacteriàcies pels enzims que produeixen: DNAses, lipases i gelatinases.
Bei Bakterien der Gattung Serratia handelt es sich um eine Gruppe gramnegativer, fakultativ anaerober Stäbchenbakterien aus der Familie der Enterobakterien (Enterobacteriaceae). Im Deutschen werden sie als Serratien bezeichnet. Eine bekannte Art aus der Gattung ist Serratia marcescens, deren Merkmal die rote Pigmentierung ist. Serratia-Arten kommen, wie auch andere Enterobakterien, im Darm vor, sie sind aber ebenso in anderen Lebensräumen ubiquitär verbreitet. Sie kommen im Wasser, im Boden, bei Tieren und auf Pflanzen vor. Sie können für manche Insekten pathogen sein, andererseits sind auch Fälle von Symbiosen bekannt. Viele Serratia-Arten sind für den Menschen apathogen oder nur selten als Krankheitserreger (etwa von Bakteriämien und Lungenentzündungen[1]) nachgewiesen worden. Es wurde jedoch vereinzelt über nosokomiale Infektionen in Kinderabteilungen und Intensivstationen berichtet. Die Systematik innerhalb der Gattung Serratia hat sich seit Beginn des 20. Jahrhunderts mehrfach verändert. In der Vergangenheit wurden oftmals Bakterien mit einer roten oder rosa Färbung der Kolonien als Serratia-Art klassifiziert. Aktuell (Stand 2014) sind 15 verschiedene Arten bekannt.
Die Zellen von Serratia-Arten sind stäbchenförmig und durch Flagellen aktiv beweglich (motil). Die Gram-Färbung verläuft negativ.[2] Auf festen Nährmedien gewachsene Kolonien zeichnen sich oft durch eine rote Pigmentierung aus.[3] Verantwortlich dafür ist das von den Bakterien gebildete Prodigiosin. Die Kolonien auf einem Nährmedium, aber auch auf Brot, Polenta oder Hostien erinnern an Blutstropfen[4] (vergleiche Blutwunder). Das Phänomen wurde zuerst bei Serratia marcescens beschrieben, aber auch andere Serratia-Arten (z. B. S. plymuthica und S. rubidaea) wachsen als rot bis rosafarbene Kolonien.[5] Daneben gibt es auch nicht-pigmentierte Bakterienstämme.[3]
Serratia-Arten nutzen verschiedene organische Verbindungen als Energiequelle und zum Aufbau zelleigener Strukturen, dies ist im oxidativem oder fermentativem Energiestoffwechsel möglich. Sie sind somit fakultativ anaerob und chemoorgano-heterotroph. Sie können verschiedene Kohlenhydrate unter Gas- und Säurebildung verwerten.[2] Bezüglich der Produkte, die bei der Gärung gebildet werden, gehören sie zu den Enterobacteriaceae, die eine 2,3-Butandiolgärung durchführen.[3] Die Substrate, die sie dabei verwenden, können zur Identifizierung von Serratia-Arten bzw. Unterscheidung von anderen Vertretern der Enterobacteriaceae verwendet werden (siehe Abschnitt Nachweise). Wie für Enterobacteriaceae typisch, verlaufen der Katalase-Test positiv und der Oxidase-Test negativ.[3] Der besondere Geruch, den S. odorifera, S. ficaria und einige Stämme von S. rubidaea verbreiten, wird durch von den Bakterien produzierte Alkyl-Methoxypyrazine (Derivate des Pyrazins) verursacht. Die Hauptkomponente ist 3-Isopropyl-2-methoxy-5-methylpyrazin.[5] Eine ähnliche Verbindung, 2-Isopropyl-3-methoxypyrazin, kommt in Kartoffeln vor, wo sie die „erdige“ Note im Geruch und Geschmack hervorruft. Auch der Geruch dieser Serratia-Arten wird als kartoffelartig beschrieben.[5]
Für die Kultivierung sind einfache Nährmedien geeignet, es sind keine besonderen Wachstumsfaktoren notwendig. Serratia-Arten sind mesophil, Wachstum erfolgt in einem Temperaturbereich von 20–37 °C, dabei sind nach eintägiger Inkubation bereits Kolonien sichtbar. Für biochemische Nachweisreaktionen wird die Inkubation bei 30 °C empfohlen, auch die Pigmentbildung erfolgt eher bei 30 °C als bei 37 °C. Einige Serratia-Arten sind psychrotolerant und wachsen auch noch bei 5 °C (z. B. S. ficaria, S. fonticola und S. odorifera). Andere Arten, wie S. entomophila und S. marcescens wachsen noch bei 40 °C. Ein Natriumchlorid-Gehalt bis zu 40 g/L im Nährmedium wird toleriert. Wachstum erfolgt bis zu einem pH-Wert von 9.[6]
Der GC-Gehalt, also der Anteil der Nukleinbasen Guanin und Cytosin in der Bakterien-DNA, liegt bei 52–60 Molprozent.[3] Bestandteile der Bakterienzelle wirken als Antigene, von diagnostischer Bedeutung sind die somatischen O-Antigene und die H-Antigene[7] (vergleiche das bei den Salmonellen angewendete Kauffmann-White-Schema). Die in den Membranlipiden vorkommenden Fettsäuren sind hauptsächlich Moleküle mit einer geraden Zahl von Kohlenstoffatomen und keiner Doppelbindung (gesättigte Fettsäuren), wie Myristinsäure (Tetradecansäure, C14:0), Palmitinsäure (Hexadecansäure, C16:0) und Stearinsäure (Octadecansäure, C18:0), auch eine Fettsäure mit Hydroxygruppe (3-Hydroxy-tetradecansäure) kommt vor.[5]
Viele Serratia-Arten sind apathogen oder nur selten als Krankheitserreger nachgewiesen worden. Nosokomiale Infektionen in Kinderabteilungen und Intensivstationen kamen jedoch vor, wobei Frühgeborene oder erwachsene Patienten mit eingeschränkter Immunabwehr betroffen waren.[8] Dabei handelt es sich v. a. um S. marcescens, deren Bedeutung als nosokomialer Erreger wächst.[9]
S. entomophila, S. ficaria, S. fonticola, S. odorifera, S. plymuthica, S. quinivorans und S. ureilytica sind apathogen und werden durch die Biostoffverordnung in Verbindung mit der TRBA (Technische Regeln für Biologische Arbeitsstoffe) 466 der Risikogruppe 1 zugeordnet.[10]
Zur Kultivierung von Serratia sind keine besonderen Wachstumsfaktoren notwendig, so dass einfache Nährmedien auf Pepton-Basis, wie Trypton-Soja-Agar geeignet sind. Es sind auch Minimalmedien definiert, die genau die chemischen Verbindungen enthalten, die für das Wachstum nötig sind. Außerdem sind Serratia-Arten, mit Ausnahme von S. fonticola, resistent gegenüber Thalliumsalzen. Für die Isolierung von Serratia-Arten aus Umweltproben wird daher das sogenannte CT-Medium empfohlen, ein Minimalmedium, das Caprylsäure als Energie- und Kohlenstoffquelle und Thallium(I)-sulfat enthält.[11] Biochemische Merkmale, wie beispielsweise die vorhandenen Enzyme und die daraus resultierenden Stoffwechseleigenschaften können in einer Bunten Reihe zur Identifizierung von Serratia-Arten bzw. Unterscheidung von anderen Vertretern der Enterobacteriaceae verwendet werden.
Zu den Kohlenhydraten, die sie verwerten können, gehören beispielsweise die Monosaccharide Fructose, Galactose, Glucose, Mannose und Ribose, die Disaccharide Maltose und Trehalose sowie die Zuckeralkohole Glycerin (Glycerol) und Mannitol.[6] In der Literatur wird Serratia meist als Lactose-negativ beschrieben,[2][3] bei den einzelnen Arten ergibt sich im Bezug auf die Lactoseverwertung kein einheitliches Bild. Bei mehreren Arten erfolgt die Angabe „variabel“, d. h., dass es sowohl Stämme gibt, die Lactose abbauen können, wie auch Stämme, die dies nicht können. Bei S. marcescens wird das unterschiedliche Verhalten zur Differenzierung der Biotypen genutzt. Im Allgemeinen sind lediglich S. rubidae und S. fonticola im Lactosenachweis durch Säurebildung positiv. Interessanterweise verläuft der ONPG-Test bei allen Serratia-Arten positiv.[6] Dieser biochemische Nachweis zeigt, dass sie über das Enzym β-Galactosidase verfügen, mit dem Lactose in die beiden Bestandteile Glucose und Galactose hydrolysiert wird. Tests, bei denen der Lactoseabbau über die Säurebildung detektiert wird, zeigen möglicherweise ein negatives Ergebnis, da zu wenig Säure produziert wird.
Das Enzym Urease ist nicht vorhanden,[2] lediglich S. ureilytica bildet eine Ausnahme und kann Harnstoff abbauen.[12] Serratia-Arten verfügen über Lipasen,[6] proteolytische Enzyme, mit denen beispielsweise Gelatine hydrolysiert wird[2] und das Enzym Desoxyribonuklease (DNase).[3] Einige Stämme von S. fonticola zeigen bei entsprechenden Tests jedoch negative Ergebnisse.[6] Es erfolgt keine Bildung von Schwefelwasserstoff (H2S).[6] Nitrat wird zu Nitrit reduziert.[3] Die Voges-Proskauer-Reaktion verläuft positiv, es wird Acetoin gebildet.[2] Hingegen verläuft der Indol-Test negativ,[2] lediglich S. odorifera ist in der Lage, Indol zu bilden.[6]
Um die einzelnen Serratia-Arten zu identifizieren, eignen sich Tests, die auf dem Abbau verschiedener organischer Verbindungen beruhen und dabei gebildete Stoffwechselprodukte anzeigen. Dafür sind miniaturisierte Testsysteme besser geeignet als der Oxidations-Fermentations-Test. Bei den dafür zweckdienlichen Verbindungen handelt es sich beispielsweise um Adonitol, L-Arabinose, D- und L-Arabitol, Dulcitol, D-Melibiose, L-Rhamnose und D-Sorbitol.[6]
Eine serologische Unterscheidung verschiedener Stämme von S. marcescens ist gebräuchlich. Dabei werden Antikörper gegen die somatischen O-Antigene und die durch die Flagellen begründeten H-Antigene verwendet. Mehrere Serotypen (z. B. O5:H2, O5:H3 u. a.) werden zu einem Biotyp (z. B. S. marcescens Biotyp A1a) zusammengefasst. Eine Biogruppe besteht aus mehreren Biotypen (z. B. S. marcescens Biogruppe A1).[7] Diese Typisierung wird beispielsweise bei nosokomialen Infektionen genutzt, um den Infektionsweg zu ergründen.[9] Auch bei S. ficaria, S. plymuthica, S. proteamaculans und S. rubidaea gibt es darauf basierende Einteilungen der Serotypen.[7]
Die Gattung Serratia zählt zu der Familie der Enterobacteriaceae (Enterobakterien) in der Ordnung der Enterobacteriales, die zur Klasse der Gammaproteobacteria gehört.[13] Die Enterobacteriaceae bilden eine große Gruppe gramnegativer Bakterien, zu denen u. a. die Gattungen Citrobacter, Enterobacter, Escherichia, Klebsiella, Proteus, Raoultella, Salmonella, Shigella und Yersinia gehören, von denen einige Vertreter als Krankheitserreger von Bedeutung sind. In der Vergangenheit wurde diskutiert, Serratia aufgrund phänotyper Ähnlichkeiten mit Klebsiella und weiteren Gattungen zum Tribus der Klebsielleae zu zählen.[14] Weitere Untersuchungen seit den 1970er Jahren zeigen jedoch, dass sich Serratia durchaus von diesen unterscheidet.[4] Die Rangstufe Tribus ist seit der Revision (1990) des International Code of Nomenclature of Bacteria (Bakteriologischer Code) nicht mehr üblich.
Bartolomeo Bizio beschrieb 1823 rot-pigmentierte Mikroorganismen, die er auf Polenta entdeckt hatte, und bezeichnete sie als Serratia marcescens.[4] Dies wird als Erstbeschreibung der Art und der Gattung angesehen.[13] Bizio wählte den Gattungsnamen zu Ehren von Serafino Serrati, einem italienischen Physiker.[13][15] Zu Beginn des 20. Jahrhunderts waren mehr als 70 unterschiedlich benannte Serratia-Arten bekannt. Dabei ließ sich zum damaligen Zeitpunkt nicht unterscheiden, ob es sich um Arten oder Synonyme einer Art handelt, ihr gemeinsames Merkmal war die rote oder rosa Farbe der Kolonien. Immerhin 23 Arten wurden in der Erstauflage des Bergey's Manual of Systematic Bacteriology von 1923 genannt. Die Anzahl der als gesichert geltenden Arten von Serratia nahm seitdem ab, in den 1960er und 1970er Jahren nahm man an, S. marcescens sei die einzige Art der Gattung.[4]
Mit Hilfe moderner Untersuchungsmethoden, wie der DNA-DNA-Hybridisierung, konnte jedoch gezeigt werden, dass sich verschiedene Bakterienstämme deutlich voneinander unterscheiden, so dass die Etablierung von verschiedenen Arten gerechtfertigt erscheint. In dieser Übergangsphase wurde auch eine numerische Taxonomie verwendet, z. B. die Bezeichnung als Serratia III, auch die Einordnung als Biotyp oder Biogruppe war gängige Praxis.[4] In der auf dem neu organisierten Bakteriologischen Code basierenden Approved Lists of Bacterial Names (engl. für „anerkannte Listen der Bakteriennamen“) von 1980 wurden schließlich acht Arten anerkannt: S. fonticola, S. liquefaciens, S. marcescens, S. marinorubra, S. odorifera, S. plymuthica, S. proteamaculans und S. rubidaea.[16]
Aktuell (Stand 2014) werden in der Gattung folgende Arten und Unterarten geführt, S. marcescens ist die Typusart.[13]
Die Frage, ob es sich bei S. marinorubra und S. rubidaea (beide sind auf der Approved Lists of Bacterial Names geführt) um zwei verschiedene Arten handelt, beschäftigte die Mikrobiologen über einen längeren Zeitraum. Auf der Liste war irrtümlich ein falscher Typusstamm für S. marinorubra angegeben worden, der identisch mit dem von S. rubidaea ist. Nach den Regeln des Bakteriologischen Codes sind beide homotypische Synonyme, wobei der Name S. marinorubra Priorität hat (er ist älter).[4][13] Auch S. liquefaciens und S. proteamaculans waren Gegenstand taxonomischer Debatten. Untersuchungen von Grimont & Grimont haben jedoch gezeigt, dass es sich um zwei verschiedene Spezies handelt.[22] Durch sie wurde 1983 außerdem eine Unterart von S. proteamaculans entdeckt, die jedoch 2002 als S. quinivorans in den Artstatus erhoben wurde.[25] Bei Serratia profundus handelt es sich um eine nicht anerkannte Art, deren Namen nicht gültig publiziert wurde.[28]
Serratia-Arten sind beinahe ubiquitär verbreitet. Sie kommen im Wasser, im Boden, bei Tieren und auf Pflanzen vor. Weniger häufig als andere Enterobacteriaceae besiedeln sie auch den menschlichen Darm.[29] Bezüglich der Habitate gibt es durchaus Unterschiede bei den Arten.
Süßwasser ist ein wichtiges Habitat von S. fonticola,[19] S. grimesii, S. liquefaciens, S. marcescens, S. plymuthica und S. rubidaea (bzw. als S. marinorubra bezeichnet).[4] S. ureilytica wurde im indischen Fluss Torsa entdeckt.[12] Serratia-Stämme, die Prodigiosin produzieren, sind toxisch für Protozoen, was einen Vorteil für die Bakterien bei der Besiedlung von Wasser und Boden darstellt. Weitere Untersuchungen haben ergeben, dass die pigmentierten Stämme eher in Brunnen- oder Quellwasser zu finden sind, während nicht-pigmentierte Stämme eher für belastetes Flusswasser typisch sind.[4]
Serratia-Arten sind häufig bei verschiedenen Insekten zu finden. Beispiele dafür gibt es in den Ordnungen der Heuschrecken (Orthoptera), Termiten (Isoptera), Käfer (Coleoptera), Schmetterlinge (Lepidoptera), Hautflügler (Hymenoptera) und Zweiflügler (Diptera). Hauptsächlich nachgewiesen wurden dabei S. liquefaciens, S. marcescens und S. plymuthica. Serratia-Arten können für manche Insekten pathogen sein, das von ihnen produzierte Enzym Chitinase wird als Virulenzfaktor angesehen. Allerdings werden Serratia-Arten auch bei gesunden Insekten, beispielsweise im Darm, gefunden.[30] Auch Symbiosen von Bakterien und Insekten sind bekannt. Bei der Entwicklung von Tetanops myopaeformis, einer Fliegenart, findet man die Larven (Maden) auf Zuckerrüben. In allen Entwicklungsstadien des Insekts sind S. liquefaciens und S. marcescens vorhanden. Man nimmt an, dass sie bei der Metamorphose durch Chitinabbau des Pupariums (Puppenhülle) mitwirken.[31]
S. symbiotica ist ein Endosymbiont der Schwarzen Bohnenlaus (Aphis fabae). Das Bakterium wird dabei nicht als obligater Symbiont angesehen, sondern als ein nicht unbedingt notwendiger (fakultativer bzw. sekundärer) Symbiont, der Nutzen aus der Lebensgemeinschaft zieht. S. symbiotica lässt sich auch in-vitro kultivieren, was bei Endosymbionten wegen der speziellen Anpassung ihres Stoffwechsels nicht immer möglich ist. Sie tritt bei mehreren Vertretern der Röhrenblattläuse (Aphididae) auf und ist im Cytoplasma bestimmter Zellen zu finden. Sie spielt eine Rolle beim Schutz gegen Parasiten.[27]
In Neuseeland ist Costelytra zealandica als Pflanzenschädling des Weidelandes von Bedeutung. Die Larven von Costelytra zealandica (grass grubs, „Grasmaden“) vermehren sich im Gras oder Klee und ernähren sich davon. Nach vier bis sechs Jahren nimmt ihre Population dramatisch ab, was auf eine als amber disease bezeichnete Erkrankung zurückgeführt wird. Untersuchungen haben gezeigt, dass S. entomophila und S. proteamaculans dafür verantwortlich sind, die den Darm der Larven besiedeln.[17] Suspensionen von S. entomophila werden auf den Weideflächen ausgebracht, um die Pflanzenschädlinge zu bekämpfen.[30]
S. glossinae wurde im Mitteldarm der Tsetsefliege Glossina palpalis gambiensis gefunden. Glossina-Arten sind Vektoren für Protozoen der Gattung Trypanosoma, die die Schlafkrankheit verursachen. Die mikrobiellen Flora von Glossina-Arten wird erforscht, um mit Hilfe der Bakterien die Übertragung der Protozoen zu verhindern oder die Tsetsefliege zu schädigen.[20] S. nematodiphila lebt in Symbiose mit der Fadenwurm-Art Heterorhabditidoides chongmingensis, die ihrerseits pathogen für Insekten ist.[23]
Auch bei den Wirbeltieren (Vertebrata) sind Serratia-Arten vertreten, manchmal wurde ein Zusammenhang mit Infektionskrankheiten hergestellt, oftmals sind sie apathogener Teil der mikrobiellen Flora.[32] Die Isolierung von kleineren Säugetieren und des sie umgebenden Territoriums – Pflanzen und Erdboden – gelang besonders häufig bei S. liquefaciens und S. proteamaculans.[4] Chronische Infektionen bei wechselwarmen Tieren werden manchmal mit Serratia in Verbindung gebracht. Serratia-Arten wurden jedoch auch bei gesunden Echten Schmuckschildkröten (Pseudemys scripta elegans), anderen Schildkröten und Geckos nachgewiesen. In einer systematischen Untersuchung von Kotproben europäischer Wildvögel wurde S. fonticola mehrfach gefunden. Bei Etwa 40 % der in Fallen gefangenen Nagetiere und Spitzmäuse wurden Stämme von Serratia im Darm gefunden, ohne dass die Obduktion der Tiere Anzeichen einer Infektion ergab.[32]
S. proteamaculans wurde 1919 auf der tropischen Pflanze Königs-Protea (Protea cynaroides) aus der Gattung der Zuckerbüsche (Protea) entdeckt und mit einer Blattkrankheit (englisch leaf spot disease) in Verbindung gebracht. Ähnliche Läsionen der Blätter von Protea, Tabakpflanzen (Gattung Nicotiana) und Bohnenpflanzen lassen sich auch durch S. marcescens und S. rubidaea erzeugen und werden als Hypersensitivitätsreaktion gedeutet. S. ficaria wurde bei der Echten Feige (Ficus carica) entdeckt.[18] Zusammen mit bestimmten Biotypen von S. marcescens ist sie Bestandteil der mikrobiellen Flora der Feigenwespe Blastophaga psenes (Feigengallwespe). Durch die komplexen Vorgänge bei der Bestäubung (neben der Feigengallwespe sind auch zwei Feigenvarietäten erforderlich, um essbare Früchte zu erhalten), lassen sich die beiden Serratia-Arten in dem Insekt, den gebildeten Gallen und der Frucht finden.[4]
S. rubidaea ist bei typischerweise bei Kokosnüssen zu finden, im Fruchtfleisch und daraus hergestellter Kokosmilch.[30] S. quinivorans wurde von Zuckerrüben und ihrer Rhizosphäre isoliert.[25] Mehrere Serratia-Arten (neben S. proteamaculans vor allem S. liquefaciens) wurden auch noch auf vielen anderen Pflanzen nachgewiesen, wo sie als Reduzenten (Destruenten) dazu beitragen, organisches Material abzubauen. So sind sie auch auf pflanzlichen Lebensmitteln zu finden, beispielsweise Kopfsalat, Blumenkohl und Rosenkohl. Eine mögliche Übertragung von pathogenen Serratia-Arten im Krankenhaus über die gereichte Rohkost wird diskutiert.[30]
Die Arten S. marcescens und S. liquefaciens sind von humanmedizinischer Bedeutung, S. marcescens vor allem im Zusammenhang mit nosokomialen Infektionen („Krankenhausinfektionen“). Sie gilt als opportunistischer Erreger, der bei Patienten mit geschwächtem Immunsystem Infektionen verursachen kann.[9] Dabei handelt es sich um Sepsis, Wundinfektionen, Endokarditis, Harnwegsinfekte und Infektionen des Respirationstraktes.[29] Zur antibiotischen Therapie kommen Imipenem, Meropenem, Ertapenem, Ciprofloxacin oder Levofloxacin zum Einsatz, alternativ auch Gentamicin und Amikacin.[33]
Geflügel und somit auch als Nahrungsmittel verwendetes Geflügelfleisch oder Eier können mit Serratia-Arten kontaminiert sein, so wurde beispielsweise S. marcescens im Verdauungstrakt von Hennen nachgewiesen, ohne dass die Tiere dadurch beeinträchtigt erschienen.[32] Außerdem spielt Serratia eine untergeordnete Rolle als Krankheitserreger der Mastitis bei Kühen. Verschiedene Untersuchungen ergaben, dass sie in 0,2–1,5 % der Fälle als Krankheitsursache diagnostiziert wurde. Auch in Milch, vor allem Rohmilch, oder in Milchprodukten wurden gelegentlich Serratia-Arten nachgewiesen, vor allem S. grimesii und S. liquefaciens.[32]
Bei Bakterien der Gattung Serratia handelt es sich um eine Gruppe gramnegativer, fakultativ anaerober Stäbchenbakterien aus der Familie der Enterobakterien (Enterobacteriaceae). Im Deutschen werden sie als Serratien bezeichnet. Eine bekannte Art aus der Gattung ist Serratia marcescens, deren Merkmal die rote Pigmentierung ist. Serratia-Arten kommen, wie auch andere Enterobakterien, im Darm vor, sie sind aber ebenso in anderen Lebensräumen ubiquitär verbreitet. Sie kommen im Wasser, im Boden, bei Tieren und auf Pflanzen vor. Sie können für manche Insekten pathogen sein, andererseits sind auch Fälle von Symbiosen bekannt. Viele Serratia-Arten sind für den Menschen apathogen oder nur selten als Krankheitserreger (etwa von Bakteriämien und Lungenentzündungen) nachgewiesen worden. Es wurde jedoch vereinzelt über nosokomiale Infektionen in Kinderabteilungen und Intensivstationen berichtet. Die Systematik innerhalb der Gattung Serratia hat sich seit Beginn des 20. Jahrhunderts mehrfach verändert. In der Vergangenheit wurden oftmals Bakterien mit einer roten oder rosa Färbung der Kolonien als Serratia-Art klassifiziert. Aktuell (Stand 2014) sind 15 verschiedene Arten bekannt.
Οι Σερράτιες (γένος Serratia spp) είναι μια ομάδα μικροοργανισμών που ανήκει στην ομάδα των βακτηρίων. Το γένος τους ανήκει στα εντεροβατηριακά και περιλαμβάνει πολλά είδη με γνωστότερα από αυτά τα S. marcescens, η S. liquefaciens και η S. odorifera. Ιδιαίτερη κλινική σημασία έχει η S. marcescens που είναι υπεύθυνη για συχνές ενδονοσοκομειακές λοιμώξεις.[1]Το γένος ονομάστηκε έτσι από τον Serafino Serrati έναν Ιταλό φυσικό.
Παλαιότερα πιστεύονταν ότι το είδος S. marcescens είναι μη παθογόνο βακτήριο. Λόγω της κόκκινης χρωστικής που παράγει χρησιμοποιούνταν ευρέως για τον εντοπισμό των μεταδιδόμενων βακτηρίων και τη μελέτη, την επίλυση και απόκλιση από τα βακτήρια σε ρεύματα αέρα. Το 1950 το πολεμικό ναυτικό των ΗΠΑ διεξήγαγε ένα μυστικό πείραμα που ονομάστηκε «Επιχείρηση Sea spray για τη μελέτη» των αερίων ρευμάτων που θα μπορούσαν να μεταφερθούν με βιολογικά όπλα. Για το λόγο αυτό φούσκωσαν μπαλόνια με S. marcescens και τα έκαψαν πάνω από το Σαν Φρανσίσκο. Λίγο αργότερα οι γιατροί παρατήρησαν στην ευρύτερη περιοχή δραματική αύξηση πνευμονίας και λοιμώξεων του ουροποιητικού συστήματος.
Η S. marcescens βρίσκεται στο φυσικό περιβάλλον. Απομονώνεται όμως έστω και σπάνια στα κόπρανα του γενικού πληθυσμού. Πρόκειται για χρωμογόνο στέλεχος που μπορεί να χρωματίσει τις τροφές και να δώσει την εντύπωση αίματος στα πτύελα ή τα κόπρανα. Προκαλεί ενδονοσοκομειακές λοιμώξεις και ιδιαίτερα ουρολοιμώξεις. Επίσης μπορεί να προκαλέσει σηψαιμία, ενδοκαρδίτιδα και μηνιγγίτιδα. [2] Η S. liquefaciens και S. odorifera περιστασιακά μόνο μπορούν να απομονωθούν από κλινικά δείγματα.
BIZIO 1823
Είναι gram αρνητικό βακτήριο, μικρότερο σε μέγεθος από τα άλλα εντεροβακτηριακά. Εμφανίζει πολυμορφισμό. Συχνά έχει τη μορφή κοκοβακτηρίου. Είναι περίτριχο μικρόβιο και συνήθως δεν έχει έλυτρο. Όταν όμως αναπτύσσεται σε θρεπτικά υλικά πτωχά σε άζωτο και φώσφορο αναπτύσσει έλυτρο.
Σε θρεπτικό άγαρ οι αποικίες είναι συνήθως ομογενείς και στο αιματούχο άγαρ περιβάλλονται από λεπτή ζώνη αιμολύσεως. Οι αποικίες του στο άγαρ Mac Conkey είναι μικρές και άχρωμες. Ορισμένα στελέχη παράγουν κόκκινη χρωστική που είναι διαλυτή στο νερό. Αυτό έχει ως αποτέλεσμα οι αποικίες του να εμφανίζουν στο κέντρο τους χρώμα που κυμαίνεται από ελαφρώς ρόδινο μέχρι ερυθρό ή πορτοκαλί. Ζυμώνουν την λακτόζη βραδέως ή και καθόλου.
Μερικά στελέχη της S. marcescens παράγουν μια κόκκινη χρωστική, την προδιγιοσίνη, παρουσία οξυγόνου και σε κατάλληλη θερμοκρασία. Η θερμοκρασία αυτή δεν είναι πάντα ίδια με τη θερμοκρασία ιδανικής ανάπτυξης του βακτηριδίου π.χ. πολλά στελέχη αναπτύσσονται καλύτερα στους 30-37˚C αλλά σχηματίζουν λίγη ή καθόλου χρωστική, ενώ σε χαμηλότερες θερμοκρασίες υστερούν στην ανάπτυξη αλλά ο σχηματισμός της χρωστικής είναι άφθονος. Η χρωστική ονομάζεται προδιγιοσίνη.
Τα στελέχη του γένους Serratia όπως και τα στελέχη του γένους Enterobacter είναι ανθεκτικά στις κεφαλοσπορίνες.
Έχουν περιγραφεί πολλά σωματικά αντιγόνα (Ο) και βλεφαριδικά αντιγόνα (Η).
Η Serratia είναι ένα μικρόβιο που βρίσκεται στο νερό, στο έδαφος, στις τροφές, στο σώμα των ανθρώπων και των ζώων. Τα χρωμογόνα στελέχη δημιουργούν την εντύπωση αιμόφυρτων πτυέλων ή αιματηρών κοπράνων. Στο νοσοκομείο είδη της Serratia τείνουν να αποικίζουν το αναπνευστικό και το ουροποιητικό σύστημα. Η Serratia είναι υπεύθυνη για περίπου το 20% των νοσοκομειακών λοιμώξεων από την κυκλοφορία του αίματος, ουροποιητικού συστήματος, χειρουργικά τραύματα και του δέρματος και των μαλακών μορίων σε ενήλικους ασθενείς. Λοίμωξη από Serratia έχει προκαλέσει ενδοκαρδίτιδα, οστεομυελίτιδα. Περιπτώσεις αρθρίτιδας από Serratia έχουν αναφερθεί σε εξωτερικούς ασθενείς που λαμβάνουν ενδοαρθρικές ενέσεις.
Τα στελέχη του γένους Serratia είναι ανθεκτικά στις κεφαλοσπορίνες. Στην αμπικιλλίνη και γενταμυκίνη η ευαισθησία διαφέρει στο στέλεχος σε στέλεχος. Σημαντικό ποσοστό ενδονοσοκομειακών λοιμώξεων εμφανίζουν αντοχή σε πολλά αντιβιοτικά.
Οι Σερράτιες (γένος Serratia spp) είναι μια ομάδα μικροοργανισμών που ανήκει στην ομάδα των βακτηρίων. Το γένος τους ανήκει στα εντεροβατηριακά και περιλαμβάνει πολλά είδη με γνωστότερα από αυτά τα S. marcescens, η S. liquefaciens και η S. odorifera. Ιδιαίτερη κλινική σημασία έχει η S. marcescens που είναι υπεύθυνη για συχνές ενδονοσοκομειακές λοιμώξεις.Το γένος ονομάστηκε έτσι από τον Serafino Serrati έναν Ιταλό φυσικό.
Serratia is a genus of Gram-negative, facultatively anaerobic, rod-shaped bacteria of the family Yersiniaceae.[5] According to the List of Prokaryotic names with Standing Nomenclature (LPSN), there are currently 19 species of Serratia that are credibly published with accurate names as of 2020: S. aquatilis, S. entomophila, S. ficaria, S. fonticola, S. grimesii, S. liquefaciens, S. marcescens, S. microhaemolytica, S. myotis, S. nematodiphila, S. odoriferae, S. oryzae, S. plymuthica, S. proteamaculans, S. quinivorans corrig, S. rubidaea, S. symbiotica, S. ureilytica, S. vespertilionis.[6] They are typically 1–5 μm in length, do not produce spores,[7] and can be found in water, soil, plants, and animals.[8] Some members of this genus produce a characteristic red pigment, prodigiosin, and can be distinguished from other members of the order Enterobacterales by their unique production of three enzymes: DNase (nucA), lipase, and gelatinase (serralysin).[5] Serratia was thought to be a harmless environmental bacteria until it was discovered that the most common species in the genus, S. marcescens, is an opportunistic pathogen of many animals, including humans.[5] In humans, S. marcescens is mostly associated with nosocomial, or hospital-acquired, infections, but can also cause urinary tract infections, pneumonia, and endocarditis.[9] S. marcescens is frequently found in showers, toilet bowls, and around wetted tiles as a pinkish to red biofilm but only causes disease in immunocompromised individuals. Aside from S marcescens, some rare strains of the Serratia species S. plymuthica, S. liquefaciens, S. rubidaea, and S. odoriferae have been shown to cause infection such as osteomyelitis and endocarditis.[10]
Various strains of Serratia occupy an eclectic range of habitats: soil, water, plants, insects, and others.[11]
Currently, four species of Serratia have been found in sea water: S. marcescens, S. liquefaciens, S. plymuthica, and S. marinorubra. S. marcescens is the most abundant, comprising approximately half of all strains found.[12] S. aquatilis is a novel species of Serratia found in drinking water.[13]
The plant types with highest Serratia prevalence are vegetables, mushrooms, mosses, grasses, and decaying plant material.[14] Serratia has been consistently found in figs and coconuts. S. marcescens and S. ficaria are often found in Calimyrna figs. Several species related to Serratia have also been identified on Smyrna figs and its fig wasps. Only one species of Serratia, S. marinorubra, have been identified on coconuts from various regions of the world, including California, France, and Brazil. Both S. marcescens and certain strains of Enterobacter were also identified in rhizospheres of coconut palms.[15]
Serratia are found in over 70 species of healthy, dead, and diseased insects. These include crickets, grasshoppers, bees, aphids, and fruit flies.[11] Most of them reside in insects as bacterial flora and some form mutualistic symbiotic relationships with their hosts. For example, in aphids, strains of S. symbiotica play a key nutritional role by providing the host with vitamins and amino acids.[16]
S. marcescens is the most characterized species in this genus. During the summer in Padura, Italy, the town people discovered that their polenta dish turned red. At first, the people believed that this incident was caused by the devil. A pharmacist named Bartolomeo Bizio was appointed to investigate the strange phenomenon.[17] After several experiments, Bizzo presented his results. S. marcescens was first documented as red-colored putrefaction of polenta by Bartolomeo Bizio in Padua.[17] The bacterium was later named in honor of Italian physicist Serafino Serrati.[17] In 1945, an experiment was designed to establish the pathogenicity of S. marcescens. Captain Tom Paine in the U.S army conducted an experiment at Camp Detrick, MD. In this experiment, he exposed four people to the bacteria in an enclosed space.[17] The individuals soon developed symptoms such as body aches, malaise, green sputum production. A few of the individuals developed fever and chills while others still had a fever after 24 hours.[17] Several other experiments were performed throughout the[17] 50s, 60s, and 70s to test the pathogenicity of S. marcescens, but it wasn't until the 1970s that S. marcescens was confirmed as a human pathogen.
S. liquefaciens is the second best characterized species after S. marcescens. S. liquefaciens was first classified as Aerobacter liquefaciens in the Enterobacter genus by Grimes and Hennerty.[17] The first documentation of S. liquefaciens was in 1971. Over 20 isolates of S. liquefaciens were recovered from different specimens such as urinary and respiratory. Out of the isolates, 6 of them were believed to cause infection in humans.[17] From the 70s to 80s, this species was the cause of several hospital outbreaks. However, the most well-known outbreak occurred in Colorado at a hemodialysis center. During this outbreak, there were 10 S. liquefaciens bloodstream infections.[17]
S. ficaria is another species that can be harmful to humans. S. ficaria is a part of the fig tree community. In 1979, S. ficaria was first isolated from a patient who had a respiratory infection.[17] The organism was isolated from the patient's sputum after she consumed a fig.[17] The organisms continued to be isolated from several humans over the years. The last documented infection caused by S. ficaria was in Greece. A healthy man was bitten by a dog, the dog bite turned into an abscess. This was the first infection that was in a healthy individual.S. fonticola species was first found in human specimens in 1985.[17] It is known to cause tissue infections following trauma to the area.[18] The first reported infection caused by S. fonticola species was in 1989. The organism caused a leg abscess in a woman in France. In 1991, S. fonticola was the cause of a hand infection in another French woman.[17] S. fonticola has been recovered from several other patients over the years.
There are not many reports of S. quinivoran causing infection in humans. A homeless man in France was admitted to the hospital with a mouth abscess. The man developed pneumonia and respiratory issues. S. quinivoran was recovered from a sample and was later identified as the cause of his organ failure and death.[17] S. rubidaea, S. odorifera, and S. plymuthica are other Serratia species that are human pathogens. However, not all Serratia species are human pathogens. S. entomophia and S. proteamaculans are insect and plant pathogens.
Species of Serratia have been isolated in a variety of environments, including soil, water, plants, animals and even air. Several methods can be used to study the epidemiology of S. marcescens. Usual enrichment strategies involve the use of media containing antibiotic and antifungal substances. A caprylate-thallous media seems to be highly preferred for the selective growth of genus Serratia, as it can use caprylic acid as a carbon source.
Serological typing and different types of polymerase chain reaction can be used to identify the Serratia. Biotyping, bacteriocin typing, phage typing, plasmid analysis, and ribotyping can also be used. Most strains of S. marcescens appear red on trypticase soy agar slants when grown at around 25 °C. S. marcescens and S. liquefaciens can be easily confused in the lab when using the analytical profile index system. They can both oxidise arabinose, but only S. liquefaciens can ferment arabinose in peptone water. The virulence of Serratia strains can also be identifiable by type 4 fimbriae, small hair-like projections.[19]
The average genome size of most Serratia species has not been documented except for that of S. marcescens, which is 3.57 * 109 Daltons. The range of G+C content of each species is as follows: S. marcescens 57.5 – 60.4%, S. liquefaciens 52.6-54.4%, S. plymuthica 53.3-56.3%, S. marinorubra 53.5-58.5%. S. macescens genome has the highest G+C content among all enterobacteria.[20]
Serratia secrete a host of virulence factors including prodigiosin, biosurfactants, DNAse, lipase, protease, gelatinase, hemolysin, chitinase, chloroperoxidase, and alkaline phosphatase. Prodigiosin, a growth pigment, is often used as a phenotypic identification marker of Serratia species due to its red colorization.[21] Biosurfactants have been isolated from Serratia marcescens, Serratia rubidaea and Serratia surfactantfaciens for their range of applications including emulsification, surface, antifouling, antitumor, and antimicrobial activity.[22][23] Endonucleases, such as DNAse, may aid in scavenging activity, allowing them to exploit the environment and maximize availability of nutrients.[24] Strains producing thermostable lipase,[25] alkaline protease and gelatinase[26] have been isolated from strains causing contact lens-related corneal ulcers in humans. Due to its short half-life and tendency to remain bound to cells upon secretion, hemolysin has scarcely been identified in Serratia. However, some studies employing more accurate detection techniques have evidenced hemolytic activity in almost all strains of Serratia.[27] Plant chitinases are used as defense mechanisms against plant pathogens with which Serratia shares their plant habitat.[28][29] Chloroperoxidase allows hydrolysis of phosphodiester bonds[30] while alkaline phosphatases are involved in cell signaling processes.
Serratia utilizes a metabolic enzyme ADP glucose pyrophosphorylase with distinct kinetic properties from those found in Enterobacteriaceae in that it is not greatly activated by fructose bisphosphate. ADP glucose pyrophosphorylase from strains of S. marcescens demonstrated optimal activity in buffer at pH 7.5 and 8.0, respectively. It is greatly activated by glycolysis intermediates such as phosphoenolpyruvate, 3-phosphoglycerate, fructose-6-phosphate, and 2-phosphoglycerate.[31]
Most Serratia species are nonpathogenic, but those that are pathogenic typically cause infection in immunocompromised individuals.[32] S. marcescens is the main pathogenic species, infecting animals and plants, but other species that have been reported to infect individuals includes Serratia plymuthica, Serratia liquefaciens, Serratia rubidaea, Serratia odorifera, and Serratia fonticola.
S. marcescens is thought to be transmitted through hand-to-hand transmission; in one hospital half of all tested personnels' hands were found to be positive for the pathogen. [33]
Serratia species tend to colonize the respiratory and urinary tracts, rather than the gastrointestinal tract. Serratia infection is responsible for about 2% of nosocomial infections of the bloodstream, lower respiratory tract, urinary tract, surgical wounds, and skin and soft tissues and other ailments that are commonly caused by other bacteria.[10] Outbreaks of S. marcescens meningitis, wound infections, and arthritis have occurred in pediatric wards.[34] Outbreaks of infective endocarditis in IV drug users have been reported.[35]
Cases of Serratia arthritis have been reported in outpatients receiving intra-articular injections.[36]
There have been cases of Serratia non-human animal infections. One case of a non-nosocomial infection in animals was found in one study, after S. marcescens was found to be correlated in early abortions of buffalos and cows. The pathogen was isolated in culture after researchers observed reddish vaginal discharge from the cows and the pathogen was also discovered to be in the semen of a bull, all of which were from the same strain.[37]
S. marcescens and S. proteamaculans are considered to be opportunistic plant pathogens. S. marcescens causes cucurbit yellow vine disease (CYVD).[38] CYVD was first detected in pumpkin and squash. CYVD infects the phloem tissue in plants and causes wilting, yellowing, phloem discoloration, plant decline, and eventually death.[38] CYVD mainly affects squash, cantaloupe, watermelon, etc. There have been studies that have shown that this disease is transmitted by insects.[38] S. proteamaculans is the only other species known to cause harm to plants. S. proteamaculans is associated with leaf spot disease. Leaf spot disease is usually caused by a fungus, but can also be caused by bacteria (e.g. S. proteamaculans). Leaf spot disease appears as brown or dark spots on leaves and can permanently damage plants. The sizes and colors of these spots can vary.
{{cite journal}}: Cite journal requires |journal= (help) Serratia is a genus of Gram-negative, facultatively anaerobic, rod-shaped bacteria of the family Yersiniaceae. According to the List of Prokaryotic names with Standing Nomenclature (LPSN), there are currently 19 species of Serratia that are credibly published with accurate names as of 2020: S. aquatilis, S. entomophila, S. ficaria, S. fonticola, S. grimesii, S. liquefaciens, S. marcescens, S. microhaemolytica, S. myotis, S. nematodiphila, S. odoriferae, S. oryzae, S. plymuthica, S. proteamaculans, S. quinivorans corrig, S. rubidaea, S. symbiotica, S. ureilytica, S. vespertilionis. They are typically 1–5 μm in length, do not produce spores, and can be found in water, soil, plants, and animals. Some members of this genus produce a characteristic red pigment, prodigiosin, and can be distinguished from other members of the order Enterobacterales by their unique production of three enzymes: DNase (nucA), lipase, and gelatinase (serralysin). Serratia was thought to be a harmless environmental bacteria until it was discovered that the most common species in the genus, S. marcescens, is an opportunistic pathogen of many animals, including humans. In humans, S. marcescens is mostly associated with nosocomial, or hospital-acquired, infections, but can also cause urinary tract infections, pneumonia, and endocarditis. S. marcescens is frequently found in showers, toilet bowls, and around wetted tiles as a pinkish to red biofilm but only causes disease in immunocompromised individuals. Aside from S marcescens, some rare strains of the Serratia species S. plymuthica, S. liquefaciens, S. rubidaea, and S. odoriferae have been shown to cause infection such as osteomyelitis and endocarditis.
Serratia es un género de bacterias gramnegativas, anaerobias facultativas y baciliformes de la familia Yersiniaceae. La especie más común en el género, la Serratia marcescens, normalmente es el único patógeno y comúnmente causa infección nosocomial. Sin embargo, las cepas de Serratia plymuthica, Serratia liquefaciens, Serratia rubidaea, y Serratia odoriferae raramente son causa de enfermedad por medio de infección.[1] Los miembros de este género producen un pigmento rojo característico, la prodigiosina, y pueden diferenciarse de los otros miembros de la familia Enterobacteriaceae por su única producción de tres enzimas: DNasa, lipasa, y gelatinasa.[2]
En el hospital, las especies de Serratia tienden a colonizar los tractos respiratorios y urinarios, y el tracto gastrointestinal en adultos.
La infección por Serratia es responsable del 2% de las infecciones nosocomiales del torrente sanguíneo, tracto respiratorio inferior, vías urinarias, heridas quirúrgicas, piel y tejidos blancos en pacientes adultos. Se han presentado brotes de meningitis por S. marcescens, infección de heridas, y artritis en pabellones de pediatría.
Las infecciones por Serratia han causado endocarditis y osteomielitis en personas adictas a la heroína.[3]
.
Se han reportado casos de artritis por Serratia en pacientes ambulatorios que reciben infiltraciones intraarticulares.
Serratia es un género de bacterias gramnegativas, anaerobias facultativas y baciliformes de la familia Yersiniaceae. La especie más común en el género, la Serratia marcescens, normalmente es el único patógeno y comúnmente causa infección nosocomial. Sin embargo, las cepas de Serratia plymuthica, Serratia liquefaciens, Serratia rubidaea, y Serratia odoriferae raramente son causa de enfermedad por medio de infección. Los miembros de este género producen un pigmento rojo característico, la prodigiosina, y pueden diferenciarse de los otros miembros de la familia Enterobacteriaceae por su única producción de tres enzimas: DNasa, lipasa, y gelatinasa.
En el hospital, las especies de Serratia tienden a colonizar los tractos respiratorios y urinarios, y el tracto gastrointestinal en adultos.
La infección por Serratia es responsable del 2% de las infecciones nosocomiales del torrente sanguíneo, tracto respiratorio inferior, vías urinarias, heridas quirúrgicas, piel y tejidos blancos en pacientes adultos. Se han presentado brotes de meningitis por S. marcescens, infección de heridas, y artritis en pabellones de pediatría.
Las infecciones por Serratia han causado endocarditis y osteomielitis en personas adictas a la heroína.
Basilio J. Anía, M.D. «Serratia». eMedicine. Consultado el 14 de marzo de 2007. «Serratia». University of Texas at Houston Medical School. Archivado desde el original el 28 de enero de 2007. Consultado el 14 de marzo de 2007. Greenberg, Leo (1978-11). «Serratia Marcescens in Human Affairs». Drug Intelligence & Clinical Pharmacy (en inglés) 12 (11): 674-679. ISSN 0012-6578. doi:10.1177/106002807801201106. Consultado el 17 de abril de 2022..
Se han reportado casos de artritis por Serratia en pacientes ambulatorios que reciben infiltraciones intraarticulares.
Serratia generoa bakterio Gram negatiboz osatua dago, Enterobacteriaceae familia barnean sailkatzen direnak. Anaerobio fakultatiboak dira eta mugikorrak. Bazilo txikiak dira eta ez dute esporarik sortzen.
Ekologiaren aldetik genero honetako bakterioak oso kosmopolitak dira: ingurune askotan daude (lurzoruan, uretan, landareetan, intsektuen erraietan...), eta baita gizakiarengan ere, patologia batzuk sortuz.
Genero honetako ezaugarri nagusiak honako hauek dira:
Genero honetan hainbat espezie daude, Serratia marcescens ezagunena izanik. Espezie honek berezko ezaugarria dauka, prodigiosina izeneko pigmentu gorri baten ekoizpena, hain zuzen ere. Prodigiosina horrek gorri kolorea ematen dio Serratia marcescens-en hazkuntzari (ikus irudia), eta garai bateko hainbat "mirari"ren atzean dago: bakterioa irinean hazten denez (almidoia erabiltzen baitu), "odoletan" zeuden ostien mirariaren atzean Serratiaren hazkuntza besterik ez zegoela esan daiteke egun.
Serratia marcescens ez da patogeno hertsia, oportunista baizik. Horrek esan nahi du patologia sortzen duela immunitate-sistema ahula duten pertsonengan soilik. Hori dela eta, ohikoa da klinika eta ospitaletan, bertako gaixoen artean infekzio nosokomialak sortuz.
Serratia generoa bakterio Gram negatiboz osatua dago, Enterobacteriaceae familia barnean sailkatzen direnak. Anaerobio fakultatiboak dira eta mugikorrak. Bazilo txikiak dira eta ez dute esporarik sortzen.
Ekologiaren aldetik genero honetako bakterioak oso kosmopolitak dira: ingurune askotan daude (lurzoruan, uretan, landareetan, intsektuen erraietan...), eta baita gizakiarengan ere, patologia batzuk sortuz.
Genero honetako ezaugarri nagusiak honako hauek dira:
anaerobio fakultatiboak, Enterobakterio guztien antzera oxidasa (-) katalasa (+) laktosaren hartzidura (-) urearen hidrolisia (-) gelatinaren hidrolisia (+)Genero honetan hainbat espezie daude, Serratia marcescens ezagunena izanik. Espezie honek berezko ezaugarria dauka, prodigiosina izeneko pigmentu gorri baten ekoizpena, hain zuzen ere. Prodigiosina horrek gorri kolorea ematen dio Serratia marcescens-en hazkuntzari (ikus irudia), eta garai bateko hainbat "mirari"ren atzean dago: bakterioa irinean hazten denez (almidoia erabiltzen baitu), "odoletan" zeuden ostien mirariaren atzean Serratiaren hazkuntza besterik ez zegoela esan daiteke egun.
Serratia marcescens ez da patogeno hertsia, oportunista baizik. Horrek esan nahi du patologia sortzen duela immunitate-sistema ahula duten pertsonengan soilik. Hori dela eta, ohikoa da klinika eta ospitaletan, bertako gaixoen artean infekzio nosokomialak sortuz.
(RLQ=window.RLQ||[]).push(function(){mw.log.warn("Gadget "ErrefAurrebista" was not loaded. Please migrate it to use ResourceLoader. See u003Chttps://eu.wikipedia.org/wiki/Berezi:Gadgetaku003E.");});Serratia est un genre de bactérie à coloration gram négatif appartenant à la famille des Enterobacteriaceae. A cause de son aspect volatile, il arrive qu'elle soit à l'origine de suspicion de miracles eucharistiques, sans pour autant toujours les expliquer.
D’une manière générale, les espèces du genre Serratia sont isolées des plantes (légumes, champignons, mousses), du tube digestif des rongeurs, des insectes, de l’eau et du sol.
Cette bactérie est rarement pathogène, mais elle est fréquemment présente dans l’environnement hospitalier et certaines souches sont responsables d'infections nosocomiales (infections urinaires, suppurations diverses, septicémies, endocardites...).
La plus connue de ces bactéries est Serratia marcescens (anciennement Bacillus prodigiosus) est isolée du sol, de l’eau, des aliments, de l’environnement hospitalier et d’échantillons cliniques. Certaines souches produisent un pigment rouge - brique non diffusible (= prodigiosine). Actuellement la plupart des souches rencontrées en milieu hospitalier ne sont pas pigmentées.
C’est un pathogène opportuniste pouvant provoquer des infections urinaires, des infections de blessures, des pneumonies, des septicémies et des infections nosocomiales.
En médecine vétérinaire, Serratia marcescens est un agent de mammites chez la vache laitière.
En 2010, des norvégiens[1] ont montré qu'une enzyme produite par S. marcescens permet la dissolution de la chitine, en agissant sur la surface de la chitine, et en favorisant ensuite l'action d'autres enzymes (chitinases), plus vite (en 2 heures environ) qu'avec la méthode la plus rapide (48 heures) mise au point 5 ans auparavant[réf. souhaitée]. Ils espèrent découvrir une enzyme faisant de même sur la cellullose, pour développer des agrocarburants de seconde génération[2].
En 2013, des chercheurs dirigés par l'astrobiologiste Andrew Schuerger ont soumis 36 souches de bactéries, représentant 22 espèces différentes, habituellement trouvées sur des vaisseaux spatiaux, en les incubant dans une chambre qui simule des facteurs biocides omniprésents sur Mars, c'est-à-dire des températures froides et une atmosphère à basse pression principalement composée de dioxyde de carbone[3]. Sur ces 36 souches, seule Serratia liquefacens a pu se multiplier et se développer. Selon Andrew Schuerger, il semblerait que lorsqu'elle est exposée à une basse pression, des gènes spécifiques activent un mécanisme biologique inconnu qui permet à l'organisme de continuer à croître ; son laboratoire a séquencé et publié le génome[4], et encourage la communauté de recherche à étudier ce phénomène[5].
Serratia est un genre de bactérie à coloration gram négatif appartenant à la famille des Enterobacteriaceae. A cause de son aspect volatile, il arrive qu'elle soit à l'origine de suspicion de miracles eucharistiques, sans pour autant toujours les expliquer.
Serratia é un xénero de bacterias gramnegativas, anaerobias facultativas, con forma de bacilo da familia das Enterobacteriaceae. A especie máis común do xénero é S. marcescens, que normalmente é a única patóxena e xeralmente causa infeccións nosocomiais (hospitalarias). Porén, hai raras cepas de S. plymuthica, S. liquefaciens, S. rubidaea, e S. odoriferae que poden causar enfermidades infecciosas.[2] Membros deste xénero producen un pigmento vermello característico chamado prodixiosina, e poden distinguirse doutros membros da familia Enterobacteriaceae pola súa característica produción de tres encimas: ADNase, lipase, e xelatinase.[3]
Antes pensábase que S. marcescens non era unha bacteria patóxena, ata que se descubriron as súas capacidades infecciosas. Debido ao pigmento vermello que produce, foi moi utilizada para rastrear a transmisión bacteriana e para estudar o asentamento e arrastre da bacteria polas correntes de aire.
Nos hospitais, as especies de Serratia tenden a colonizar nos adultos os tractos respiratorio e urinario, en vez do tracto gastrointestinal (a pesar de ser unha Enterobacteriaceae).
A infección por Serratia é responsable de aproximadamente o 2% das infeccións nosocomiais do sangue, tracto respiratorio superior e tracto urinario, feridas cirúrxicas, e pel e tecidos brandos en pacientes adultos. En salas de pediatría téñense informado de estalidos de infeccións de meninxite por S. marcescens, infeccións de feridas, e artrite.[4]
As infeccións por Serratia causaron endocardite e osteomielite en persoas adictas á heroína.[5]
Informouse de casos de artrite por Serratia en pacientes ambulatorios que recibiron inxeccións intraarticulares.
Serratia é un xénero de bacterias gramnegativas, anaerobias facultativas, con forma de bacilo da familia das Enterobacteriaceae. A especie máis común do xénero é S. marcescens, que normalmente é a única patóxena e xeralmente causa infeccións nosocomiais (hospitalarias). Porén, hai raras cepas de S. plymuthica, S. liquefaciens, S. rubidaea, e S. odoriferae que poden causar enfermidades infecciosas. Membros deste xénero producen un pigmento vermello característico chamado prodixiosina, e poden distinguirse doutros membros da familia Enterobacteriaceae pola súa característica produción de tres encimas: ADNase, lipase, e xelatinase.
Antes pensábase que S. marcescens non era unha bacteria patóxena, ata que se descubriron as súas capacidades infecciosas. Debido ao pigmento vermello que produce, foi moi utilizada para rastrear a transmisión bacteriana e para estudar o asentamento e arrastre da bacteria polas correntes de aire.
Serratia Bizio, 1823[2] è un genere di batteri Gram-negativi della famiglia Yersiniaceae. Di frequente presente nell'ambiente, soprattutto nel suolo, questi enterobatteri sviluppano di solito colonie di un colore rosso acceso. Sono patogeni opportunisti e sviluppano nell'uomo infezioni resistenti a molti antibiotici.
Alcuni ceppi di Serratia, in particolare il ceppo Serratia E-15, producono un particolare enzima dotato di attività proteolitica, serrapeptasi, che ha trovato impiego anche come farmaco.
Serratia Bizio, 1823 è un genere di batteri Gram-negativi della famiglia Yersiniaceae. Di frequente presente nell'ambiente, soprattutto nel suolo, questi enterobatteri sviluppano di solito colonie di un colore rosso acceso. Sono patogeni opportunisti e sviluppano nell'uomo infezioni resistenti a molti antibiotici.
Alcuni ceppi di Serratia, in particolare il ceppo Serratia E-15, producono un particolare enzima dotato di attività proteolitica, serrapeptasi, che ha trovato impiego anche come farmaco.
Serratia é um gênero de bactéria Gram-negativa, anaeróbia facultativa. É um bacilo da família Enterobacteriaceae cuja espécie mais comum é a S. marcescens, que normalmente causa infecção nosocomial. Porém, existem relatos de cepas de S. plymuthica, S. liquefaciens, S. rubidaea e S. odoriferae que causaram doenças.[1] Membros deste gênero produzem pigmento vermelho característico e podem ser distinguidos de outros gêneros pertencentes à família das Enterobacteriaceae pela produção de três enzimas: DNase, lipase e gelatinase.[2]
Em hospitais, espécies do gênero Serratia tendem a colonizar o trato respiratório e urinário ao invés do gastrointestinal, em adultos.
Infecções por Serratia são responsáveis por aproximadamente 2% das infecções nosocomiais no trato respiratório baixo, trato urinário, sangue, feridas cirúrgicas, pele e mucosas em pacientes adultos.
Serratia pode causar endocardite e osteomielite em vicíados em heroína.
O gênero Serratia pode ser encontrado em alimentos, água e plantas e sua patogenicidade é reconhecida desde os anos 60. A Serratia marcescens é a espécie isolada com maior freqüência, sendo a Serratia liquefaciens mais rara, encontrada em casos de infecção relacionada à lente de contato e transfusão de sangue contaminado. O presente resumo, relata surto de infecção por este agente, possivelmente relacionado à contaminação do esfigmomanômetro utilizado para calibração do sistema de monitorização hemodinâmica.
Os sistemas de monitorização de pressão intravascular são amplamente empregados na avaliação hemodinâmica de pacientes graves. Estes sistemas são constituídos de um cateter com fluido, conectado com o espaço intravascular do paciente e um transdutor eletrônico, que transforma a pressão do fluido em impulsos elétricos, captados por um monitor. Estes sistemas recebem infusão para prevenir a formação de coágulos e devem ser calibrados periodicamente. Surtos hospitalares foram relacionados à contaminação do líquido infundido, detergentes e desinfetantes empregados, gelo utilizado no resfriamento das seringas, artigos usados para sua calibração e aos próprios transdutores, descartáveis ou não.
De acordo com o Guia de Prevenção de Infecção Relacionada ao Acesso Vascular coordenado pelo CDC/HICPAC, são recomendadas as seguintes medidas preventivas: os transdutores devem ser substituídos rotineiramente a cada 96 horas ou 24 a 48 horas após o início de antibioticoterapia para sepse; uso de equipamentos estéreis, incluindo os transdutores e sistema de calibração; evitar utilização deste sistema para coleta de sangue; preferir sistemas fechados de infusão para prevenir formação de coágulo.
A equipe do Doutor Harnett descreveu um surto de infecção por Serratia liquefaciens, relacionada a contaminação do sistema de hemodinâmica, na UTI do Whiston Hospital, entre outubro e dezembro de 1999. Neste surto foram envolvidos 11 pacientes, sendo que em sete deles a bactéria foi isolada na corrente sangüínea, em dois pacientes foi identificada no acesso vascular e em três episódios, o isolamento ocorreu em ambas as topografias. Todas as cepas tinham perfil de sensibilidade semelhante e por biologia molecular, foram identificadas como tendo origem comum.
A investigação do surto iniciou por uma análise do período de internação dos pacientes envolvidos, concluindo-se que sempre houve concomitância de pelo menos dois casos internados, sugerindo a possibilidade de transmissão cruzada. A revisão das práticas de higiene e precaução pode identificar inúmeros pontos para correção: foi proibida a utilização de creme para higiene pessoal; soluções de múltiplas doses de heparina e de insulina, que eram compartilhadas por vários pacientes e ficavam abertas em temperatura ambiente, foram rotuladas, individualizadas e conservadas sob refrigeração. Embora seis pacientes evolvidos tivessem recebido NPP, ela não foi fator de risco significativo para o surto, pois nenhum caso foi observado fora da unidade, embora a NPP fosse empregada.
De acordo com os autores, o isolamento dos microrganismos apenas em corrente sangüínea ou acesso vascular, sugere que o sistema de monitorização hemodinâmica possa ser uma das fontes. Revisando as técnicas empregadas, eles observaram que os cateteres e transdutores eram descartáveis, a infusão do fluíido lubrificante era por um sistema contínuo e a calibração era realizada diariamente por técnicos de enfermagem usando um esfigmomanômetro conectado a uma seringa de 20 ml por uma torneirinha de três vias que permitia eventual contato do fluido do tubo conector com a seringa. Ela era deixada em temperatura ambiente, compartilhada por todos os pacientes e não havia controle quanto ao seu período de uso. Além disso, o profissional responsável pela calibração não lavava as mãos entre os procedimentos. Na unidade os cateteres e os transdutores eram trocados rotineiramente ou na presença de sinais indicativos de sepse.
Para identificação da fonte, foram coletadas amostras do creme; sabão presente no dispensador; torneira; heparina e insulina contida nos frascos multi-doses em uso; esfigmomanômetro utilizado para calibração; sistema de calibração do equipamento, principalmente da seringa, cateter que conectava a torneirinha à seringa e da própria torneirinha. AS. liquefaciens foi identificada em duas seringas empregadas em um paciente; em seis casos tanto na seringa como no tubo conector e em outros dois casos apenas no tubo conector. Não foi isolada em nenhuma das outras fontes pesquisadas, inclusive no esfigmomanômetro, no qual foram identificadas culturas de Acinetobacter. Este agente foi transferido para a seringa de calibração em sete pacientes em um único dia, embora nenhum caso de infecção tenha sido relatado, demonstrando o risco potencial desta fonte, segundo o autor. A aplicação de álcool no esfigmomanômetro bloqueou o crescimento do agente. A inoculação experimental de culturas de S. liquefaciens no esfigmomanômetro, demonstrou a sobrevivência do agente acima de cinco dias.
Segundo relato dos autores, estes dados tornam bastante provável o papel do esfigmomanômetro como fonte de contaminação cruzada, embora eles não possam excluir a contaminação das mãos da equipe durante a calibração. Os autores substituíram o metido manual de calibração por um transdutor pneumático que elimina a necessidade do contato de solução salina e o possível refluxo para seringa. Além disso, também foi instituída a desinfecção do tubo de conexão com álcool entre os exames. Os autores concluem que: "esta investigação do surto revelou várias falhas nas práticas de controle de infecção.... a investigação foi prejudicada por limitações nas técnicas e meios enriquecidos empregados para coleta de material, dando uma falsa segurança pelos resultados obtidos nas culturas".
Serratia é um gênero de bactéria Gram-negativa, anaeróbia facultativa. É um bacilo da família Enterobacteriaceae cuja espécie mais comum é a S. marcescens, que normalmente causa infecção nosocomial. Porém, existem relatos de cepas de S. plymuthica, S. liquefaciens, S. rubidaea e S. odoriferae que causaram doenças. Membros deste gênero produzem pigmento vermelho característico e podem ser distinguidos de outros gêneros pertencentes à família das Enterobacteriaceae pela produção de três enzimas: DNase, lipase e gelatinase.
Em hospitais, espécies do gênero Serratia tendem a colonizar o trato respiratório e urinário ao invés do gastrointestinal, em adultos.
Infecções por Serratia são responsáveis por aproximadamente 2% das infecções nosocomiais no trato respiratório baixo, trato urinário, sangue, feridas cirúrgicas, pele e mucosas em pacientes adultos.
Serratia pode causar endocardite e osteomielite em vicíados em heroína.
O gênero Serratia pode ser encontrado em alimentos, água e plantas e sua patogenicidade é reconhecida desde os anos 60. A Serratia marcescens é a espécie isolada com maior freqüência, sendo a Serratia liquefaciens mais rara, encontrada em casos de infecção relacionada à lente de contato e transfusão de sangue contaminado. O presente resumo, relata surto de infecção por este agente, possivelmente relacionado à contaminação do esfigmomanômetro utilizado para calibração do sistema de monitorização hemodinâmica.
Os sistemas de monitorização de pressão intravascular são amplamente empregados na avaliação hemodinâmica de pacientes graves. Estes sistemas são constituídos de um cateter com fluido, conectado com o espaço intravascular do paciente e um transdutor eletrônico, que transforma a pressão do fluido em impulsos elétricos, captados por um monitor. Estes sistemas recebem infusão para prevenir a formação de coágulos e devem ser calibrados periodicamente. Surtos hospitalares foram relacionados à contaminação do líquido infundido, detergentes e desinfetantes empregados, gelo utilizado no resfriamento das seringas, artigos usados para sua calibração e aos próprios transdutores, descartáveis ou não.
De acordo com o Guia de Prevenção de Infecção Relacionada ao Acesso Vascular coordenado pelo CDC/HICPAC, são recomendadas as seguintes medidas preventivas: os transdutores devem ser substituídos rotineiramente a cada 96 horas ou 24 a 48 horas após o início de antibioticoterapia para sepse; uso de equipamentos estéreis, incluindo os transdutores e sistema de calibração; evitar utilização deste sistema para coleta de sangue; preferir sistemas fechados de infusão para prevenir formação de coágulo.
A equipe do Doutor Harnett descreveu um surto de infecção por Serratia liquefaciens, relacionada a contaminação do sistema de hemodinâmica, na UTI do Whiston Hospital, entre outubro e dezembro de 1999. Neste surto foram envolvidos 11 pacientes, sendo que em sete deles a bactéria foi isolada na corrente sangüínea, em dois pacientes foi identificada no acesso vascular e em três episódios, o isolamento ocorreu em ambas as topografias. Todas as cepas tinham perfil de sensibilidade semelhante e por biologia molecular, foram identificadas como tendo origem comum.
A investigação do surto iniciou por uma análise do período de internação dos pacientes envolvidos, concluindo-se que sempre houve concomitância de pelo menos dois casos internados, sugerindo a possibilidade de transmissão cruzada. A revisão das práticas de higiene e precaução pode identificar inúmeros pontos para correção: foi proibida a utilização de creme para higiene pessoal; soluções de múltiplas doses de heparina e de insulina, que eram compartilhadas por vários pacientes e ficavam abertas em temperatura ambiente, foram rotuladas, individualizadas e conservadas sob refrigeração. Embora seis pacientes evolvidos tivessem recebido NPP, ela não foi fator de risco significativo para o surto, pois nenhum caso foi observado fora da unidade, embora a NPP fosse empregada.
De acordo com os autores, o isolamento dos microrganismos apenas em corrente sangüínea ou acesso vascular, sugere que o sistema de monitorização hemodinâmica possa ser uma das fontes. Revisando as técnicas empregadas, eles observaram que os cateteres e transdutores eram descartáveis, a infusão do fluíido lubrificante era por um sistema contínuo e a calibração era realizada diariamente por técnicos de enfermagem usando um esfigmomanômetro conectado a uma seringa de 20 ml por uma torneirinha de três vias que permitia eventual contato do fluido do tubo conector com a seringa. Ela era deixada em temperatura ambiente, compartilhada por todos os pacientes e não havia controle quanto ao seu período de uso. Além disso, o profissional responsável pela calibração não lavava as mãos entre os procedimentos. Na unidade os cateteres e os transdutores eram trocados rotineiramente ou na presença de sinais indicativos de sepse.
Para identificação da fonte, foram coletadas amostras do creme; sabão presente no dispensador; torneira; heparina e insulina contida nos frascos multi-doses em uso; esfigmomanômetro utilizado para calibração; sistema de calibração do equipamento, principalmente da seringa, cateter que conectava a torneirinha à seringa e da própria torneirinha. AS. liquefaciens foi identificada em duas seringas empregadas em um paciente; em seis casos tanto na seringa como no tubo conector e em outros dois casos apenas no tubo conector. Não foi isolada em nenhuma das outras fontes pesquisadas, inclusive no esfigmomanômetro, no qual foram identificadas culturas de Acinetobacter. Este agente foi transferido para a seringa de calibração em sete pacientes em um único dia, embora nenhum caso de infecção tenha sido relatado, demonstrando o risco potencial desta fonte, segundo o autor. A aplicação de álcool no esfigmomanômetro bloqueou o crescimento do agente. A inoculação experimental de culturas de S. liquefaciens no esfigmomanômetro, demonstrou a sobrevivência do agente acima de cinco dias.
Segundo relato dos autores, estes dados tornam bastante provável o papel do esfigmomanômetro como fonte de contaminação cruzada, embora eles não possam excluir a contaminação das mãos da equipe durante a calibração. Os autores substituíram o metido manual de calibração por um transdutor pneumático que elimina a necessidade do contato de solução salina e o possível refluxo para seringa. Além disso, também foi instituída a desinfecção do tubo de conexão com álcool entre os exames. Os autores concluem que: "esta investigação do surto revelou várias falhas nas práticas de controle de infecção.... a investigação foi prejudicada por limitações nas técnicas e meios enriquecidos empregados para coleta de material, dando uma falsa segurança pelos resultados obtidos nas culturas".
Serratia là một giống trực khuẩn Gram âm, kỵ khí tùy nghi, thuộc họ Enterobacteriaceae. Chủng phổ biến nhất, S. marcescens, đồng thời là mầm bệnh duy nhất thường gây ra những trường hợp nhiễm khuẩn bệnh viện. Tuy nhiên, một vài chủng hiếm như S. plymuthica, S. liquefaciens, S. rubidaea, và S. odoriferae cũng được ghi nhận trong vài trường hợp viêm nhiễm.[1] Những thành viên trong chủng Serratia có đặc tính sinh sắc tố đỏ, prodigiosin, và có thể phân biệt với cái giống thuộc họ Enterobacteriaceae bởi khả năng sinh ba enzyme duy nhất: DNase, lipase, và gelatinase.[2]
Trong bệnh viện, các chủng Serratia có xu hướng khu trú trong đường tiết niệu và hô hấp hơn là trong dạ dày và ruột của người trưởng thành.
Giống Serratia chịu trách nhiệm cho khoảng 2% số ca nhiễm trùng huyết, ít hơn ở đường hô hấp, đường tiết niệu, những vết thương phẫu thuật, da và mô mềm ở bệnh nhân trưởng thành. Chủng S. marcescens meningitis lại thường hay bộc phát trong bệnh viêm khớp và viêm nhiễm vết thương ở bệnh nhi.
Serratia cũng gây ra bệnh việm nội tâm mạc và viêm tủy xương đối với những người nghiện heroin.
Những trường hợp viêm khớp do Serratia ghi nhận ở những bệnh nhân ngoại trú nhận được tiêm trong khớp.
Serratia là một giống trực khuẩn Gram âm, kỵ khí tùy nghi, thuộc họ Enterobacteriaceae. Chủng phổ biến nhất, S. marcescens, đồng thời là mầm bệnh duy nhất thường gây ra những trường hợp nhiễm khuẩn bệnh viện. Tuy nhiên, một vài chủng hiếm như S. plymuthica, S. liquefaciens, S. rubidaea, và S. odoriferae cũng được ghi nhận trong vài trường hợp viêm nhiễm. Những thành viên trong chủng Serratia có đặc tính sinh sắc tố đỏ, prodigiosin, và có thể phân biệt với cái giống thuộc họ Enterobacteriaceae bởi khả năng sinh ba enzyme duy nhất: DNase, lipase, và gelatinase.
Trong bệnh viện, các chủng Serratia có xu hướng khu trú trong đường tiết niệu và hô hấp hơn là trong dạ dày và ruột của người trưởng thành.
Giống Serratia chịu trách nhiệm cho khoảng 2% số ca nhiễm trùng huyết, ít hơn ở đường hô hấp, đường tiết niệu, những vết thương phẫu thuật, da và mô mềm ở bệnh nhân trưởng thành. Chủng S. marcescens meningitis lại thường hay bộc phát trong bệnh viêm khớp và viêm nhiễm vết thương ở bệnh nhi.
Serratia cũng gây ra bệnh việm nội tâm mạc và viêm tủy xương đối với những người nghiện heroin.
Những trường hợp viêm khớp do Serratia ghi nhận ở những bệnh nhân ngoại trú nhận được tiêm trong khớp.
 分類 ドメ
分類 ドメセラチア属(Serratia Bizio)はグラム陰性の非芽胞形成通性嫌気性の桿菌で真正細菌の一属。名称はイタリアの科学者セラフィノ・セラティに因む。
土壌、水中、動植物中にみられる。ブタンジオール発酵を行い、フォーゲス・プロスカウエル(VP)テスト陽性である。オルニチンデカルボキシラーゼを持ち、ソルビトールを代謝できるが乳糖は利用できない。体温付近で最も増殖し、GC比は52から60。鞭毛を持ち運動性がある。エンテロバクター属、クラブシェラ属に遺伝的に近い。プロディジオシンと呼ばれる赤い色素を生産する特長を持つ。薬剤耐性を持つ株があり弱い毒性を持つ。院内感染の原因菌の一つ。
セラチア属(Serratia Bizio)はグラム陰性の非芽胞形成通性嫌気性の桿菌で真正細菌の一属。名称はイタリアの科学者セラフィノ・セラティに因む。
土壌、水中、動植物中にみられる。ブタンジオール発酵を行い、フォーゲス・プロスカウエル(VP)テスト陽性である。オルニチンデカルボキシラーゼを持ち、ソルビトールを代謝できるが乳糖は利用できない。体温付近で最も増殖し、GC比は52から60。鞭毛を持ち運動性がある。エンテロバクター属、クラブシェラ属に遺伝的に近い。プロディジオシンと呼ばれる赤い色素を生産する特長を持つ。薬剤耐性を持つ株があり弱い毒性を持つ。院内感染の原因菌の一つ。