mk
имиња во трошки


Eastern Poison-ivy (Toxicodendron radicans) is found throughout the eastern United States and adjacent Canada south to Guatemala. Poison-ivy and its close relatives are well-known for possessing skin-irritating oil (urushiol), which can cause severe allergic reactions in humans.
The taxonomy and nomenclature of North American Toxicodendron has been in flux for over a century, largely due to confusing within-species variation in growth form, leaf and leaflet shape, and other features (e.g., Gillis 1971; Gartner 1991). This has resulted in an abundance of synonyms, but five species are now generally recognized: Common Poison-ivy (T. radicans), Western Poison-ivy (T. rydbergii), Eastern Poison-oak (T. pubescens), Western Poison-oak (T. diversilobum), and Poison-sumac (T. vernix) (Senchina 2006). Eastern Poison-ivy is the only Toxicodendron species in eastern North America that is typically a climbing (or straggling) vine with aerial roots (Western Poison-ivy, Eastern Poison-oak, and Poison-sumac do not climb but are instead erect or suberect shrubs) (Gleason and Cronquist 1991). Older plants often develop thick, reddish brown stems that ascend tree trunks. For reasons that are not yet clear, Eastern Poison-ivy grows more abundantly on some tree species than on others (Talley et al. 1996). Eastern and Western Poison-ivy may intergrade to some extent, making identification less clear in some areas.
Toxicodendron radicans is supposedly also present in eastern Asia, with the North American form known as T. radicans radicans and the Asian form known as T. radicans hispidum. However, molecular phylogenetic analyses by Nie et al. (2009) suggest that these two taxa are not each other's closest relatives and that the Asian form is, instead, the sister group to a clade including all four trifoliate (three-leafleted) North American Toxicodendron (Poison-sumac has 7 to 13 leaflets per leaf and its apparent closest relative lives in eastern Asia). This would imply that what is currently known as T. r. hispidum should be treated as a distinct species.
Senchina (2008) reviewed the literature on animal and fungal associates of Toxicodendron in North America with a particular eye toward identifying potential biological control agents. Interest in finding new ways to control poison-ivy and its relatives may increase in coming years given data suggesting that these plants may become more abundant and more ‘‘toxic’’ in the future, potentially affecting global forest dynamics and human health (Mohan et al. 2006).
(Gillis 1971; Nie et al. 2009 and references therein)
Poison ivy is a ubiquitous species that thrives in a variety of habitats from woodlands, to fields, beaches, and gardens and on trees, telephone poles, signs, and fences. The plant has no strong soil preferences and, as long as there is sufficient water and sun, it will grow and flourish. Poison ivy is adaptable and variable, as it is pervasive. This plant shows a variety of growth habits depending on its environmental circumstances. It can appear as a low-growing herb, a vine that creeps along the ground, or a thick, hairy woody plant climbing up the trunk of a tree. Its leaves can vary from smooth and round to narrow and sharp. The leaves are often shiny reddish in color when they are young and in fall they turn yellow or deep red like other fall foliage.
This description covers characteristics that may be relevant to fire ecology and is not meant for identification. Keys for identification are available (e.g., [47,87,88,92,109,204,223,266,268,281]).
Form and architecture: Eastern poison-ivy is a rhizomatous plant that may be an erect, low shrub or a high-climbing or trailing liana that climbs via aerial roots [40,87,92,124,137,204,234,244,283]. Western poison-ivy is a rhizomatous, erect, low shrub that has no aerial roots, so it does not climb [47,87,92,109,133,156,214,234,266,268]. Eastern poison-ivy plants are much branched and woody throughout (see Image 1), whereas western poison-ivy plants are sparsely branched and woody only about 2 to 48 inches (5-122 cm) from the base (see Image 2) [47,87,92,156,214,223,266,275,275]. The stems of poison-ivies are thin-barked [32]. When a shrub, eastern poison-ivy may be 2 to 10 feet (0.5-3.0 m) tall [60,283]. When climbing, the main stem may be >160 feet (50 m) long [240,283] and up to 6 inches (15 cm) in diameter [60,88,234,240,266,283]. Western poison-ivy is typically <3 feet (1 m) tall but may be up to 10 feet (3 m) tall [47,83,87,92,109,214,234,245]. In Utah, western poison-ivy plants are rarely >1 foot (0.3 m) tall [275]. Aboveground stems of both species arise from much-branched rhizomes [83].
Leaves: Poison-ivies have alternate, deciduous, compound leaves. Each leaf has 3 leaflets [47,87,202,204,214,234,244,275]. Leaflets of both species vary greatly in shape and size [88,266]. Eastern poison-ivy leaflets are 2 to 8 inches (5-20 cm) long and 1 to 6 inches (2-16 cm) wide [87,88,204,240,244,283]. Western poison-ivy leaflets are 1 to 6 inches (2-15 cm) long and 1 to 4 inches (2-10 cm) wide [47,234,266,275].
Reproductive structures: Poison-ivy flowers have 5 petals and occur in loose clusters from the axils of the leaves [234,266]. The inflorescence of eastern poison-ivy usually has more than 25 flowers, whereas the inflorescence of western poison-ivy usually has fewer than 25 flowers [47,83,87]. Poison-ivy fruit is a small, dry, round drupe [87,92,202,266,275]. Drupes occur in dense, erect or ascending "grape-like" clusters [109,240]. Each drupe is 3 to 7 mm in diameter [47,87,88,92,204,234,240,245,266,275] and has a single, hard, 3- to 4-mm diameter seed [240,245].
Rhizomes and roots: Poison-ivies have creeping, underground rhizomes [47,87,92,109,156,245,283]. Rhizomes may be long. They may occur at the surface or be deep in the soil [144], although they tend to be shallow, extending only about 4 to 6 inches (10-15 cm) deep [108]. Poison-ivies have fibrous roots that grow from the rhizomes; the roots may be up to 12 feet (3.7 m) deep [188,261].
Eastern poison-ivy has abundant adventitious, aerial roots that adhere to supports [87,124,204,244,266]. Aerial roots are produced when a stem contacts a substrate [124,283].
Stand and age class structure: As a result of an extensive network of rhizomes, poison-ivies frequently form dense thickets [83,92,92,124,223,234]. These thickets may represent a single clone or several individuals [47,83,87]. Eastern poison-ivy density ranged from <0.1 stem/ha in white oak-red maple stands in northeastern Pennsylvania [57] to more than 290,000 stems/ha in logged loblolly pine stands in Texas [171]. In sandhills of northeastern Colorado, western poison-ivy occurred in patches from many square feet up to 1 acre (0.4 ha) in sandhill muhly (Muhlenbergia pungens) communities, especially on eastern slopes [206]. Poison-ivies may inhibit the growth of other vegetation [68]. See Impacts for more information.
Dense eastern poison-ivy in a clearcut on the Bessey Ranger District, Nebraska. Photo courtesy of the USDA Forest Service-Region 2-Rocky Mountain Region Archive, Bugwood.org.The longevity of poison-ivy plants was unknown as of this writing (2012). Gillis [84] reported that a 4.7-inch (12 cm) diameter eastern poison-ivy stem had 38 growth rings.
Eastern and western poison-ivy's geographic ranges overlap in the Midwest and Northeast. Together, they are native to every state except California, Alaska, and Hawaii and to every province except Nunavut, the Northwest Territories, and Newfoundland and Labrador. Eastern poison-ivy also occurs on Bermuda and the western Bahamas and in Mexico, Central America, Japan, China, Taiwan, and Russia [47,82,87,88]. It has been introduced in Africa, Europe, New Zealand, and Australia [83,166,283]. In the West, western poison-ivy occurs as far west as the eastern side of the Cascade Range in Washington, Oregon, and southern British Columbia. In the East, disjunct western poison-ivy populations occur at high elevations in the southern Appalachian Mountains in Pennsylvania, West Virginia, and Virginia [47,81,87,223,266].
Eastern poison-ivy:
States and provinces (as of 2012 [263]):
United States: AL, AR, AZ, CT, DC, DE, FL, GA, IA, IL, IN, KS, KY, LA, MA, MD, ME, MI, MN, MO, MS, NC, NE, NH, NJ, NY, OH, OK, PA, RI, SC, SD, TN, TX, VA, VT, WI, WV
Canada: NB, NS, ON, QC
Mexico [83,88,133,202,266,278]
Western poison-ivy:
States and provinces (as of 2012 [263]):
United States: AZ, CO, CT, IA, ID, IL, IN, KS, MA, MD, ME, MI, MN, MT, NC, ND, NE, NH, NM, NV, NY, OH, OK, OR, PA, RI, SD, TX, UT, VA, VT, WA, WI, WV, WY
Canada: AB, BC, MB, NB, NS, ON, PE, QC, SK, YT
To date (2012) there were few published recommendations for managing poison-ivies with fire. Because burning live or dead eastern or western poison-ivy plants creates contaminated smoke that, if inhaled, can cause fever, extreme respiratory problems, or even death [108], prescribed fire should be used cautiously in communities with these species. Nonetheless, prescribed fire is frequently applied in communities with poison-ivies (e.g., [3,10,11,68,119,122,126,142,212,277]).
Poison-ivies often occur in canopy openings (see Successional Status), so small, patchy fires may benefit poison-ivies by providing openings that allow them to spread vegetatively or establish from on- or off-site seed sources. Although poison-ivies often increase after prescribed fire, they may also decrease after fire, depending in part of fire timing, frequency, and severity (see Plant response to fire). Viable poison-ivy seeds have been found in the soil seed bank of some forest communities after fire (see IMMEDIATE FIRE EFFECT ON PLANT) [222]. Thus, poison-ivies may establish from the seed bank after prescribed fire. Prescribed fire may temporarily reduce poison-ivy seed production. However, on the Noxubee National Wildlife Refuge, eastern poison-ivy fruit was abundant 4 years after plants were top-killed by a March prescribed fire in loblolly pine-oak forest. The forest had been burned 7 other times during the previous 12 years [126].
Plant response to fire: Poison-ivies sprout from the root crown and/or from rhizomes after top-kill by fire [68]. Poison-ivies may also establish from the soil seed bank. A study in Arkansas found that at least some eastern poison-ivy seeds in the soil survived a prescribed fire [222], indicating the potential for on-site postfire establishment. Poison-ivies may also establish from off-site animal- or water-dispersed seed after fire. Eastern poison-ivy may establish from seed dispersed from lianas in tree crowns.
Occurrence of poison-ivies after wild and prescribed fires has been reported in a variety of plant communities. Poison-ivies have variable responses to fire; patterns with regard to season, frequency, and severity of fire are not evident, so studies are listed below according to fire response.
Many studies reported that poison-ivies increased soon after fire or within the first growing season [10,11,39,68,110,126]:
Table 3. Studies reporting increases in abundance of poison-ivies soon after fire Species Location Plant Community Fire description Observations eastern poison-ivy south-central Tennessee oak-hickory forest July prescribed fire increased on burned plots and decreased on control plots 1 year after fire compared to prefire levels (Table 5) [68] east-central Mississippi loblolly pine-oak forest early spring prescribed fire; forest had been burned 7 other times during the previous 12 years increased after fire and was most abundant during postfire year 4, when the study ended [126] north-central Florida longleaf pine-turkey oak (Pinus palustris-Quercus laevis) forest January prescribed fire "far greater" in abundance in burned areas than in unburned areas 3 months after fire [11] western poison-ivy southeastern Ontario xeric northern whitecedar-quaking aspen-balsam fir woodland severe June wildfire cover averaged 5.3% and frequency averaged 13.6% 100 days after fire [39] poison-ivies southwestern Illinois post oak/little bluestem barrens low-severity, March prescribed fire absent before fire but present 7 months later [110] northeastern Illinois closed-canopy oak woodland fall prescribed fire greater importance the 1st growing season after fire than before fire [10]Some studies reported that poison-ivies decreased after fire, exhibited little or no change after fire, or that fire had mixed effects on poison-ivies [3,122,142,185,186,212,251,267]:
Table 4. Studies reporting that poison-ivies decreased after fire, exhibited little or no change after fire, or that fire had mixed effects on poison-ivies Species Location Plant Community Fire description Observations eastern poison-ivy northeastern Illinois white oak savanna spring and fall prescribed fires applied 1 to 4 times in 7 years 7 years after fires, density was >3 times lower than before fires; at a nearby unburned control site, density was >4 times lower [142] central North Carolina loblolly pine forest mixed-severity wildfire density was higher on burned than unburned plots 9 years after fire but mean frequency was similar between treatments [186]; 20 years after fire, density had declined by ≥50% [185] poison-ivies northwestern Wisconsin upland jack pine (Pinus banksiana)-northern pin oak savanna March and April prescribed fires; sites were burned 1-4 times in approximately 13 years frequency was similar on burned and unburned control sites sampled 2-17 months after fires [267] Illinois oak-hickory barrens 2 mixed-severity prescribed fires; the 1st fire was applied in late November, the 2nd fire in mid-March 5 years later cover of poison-ivies was similar before and 1 growing season after fires [251] east-central Illinois 20-year-old herb-dominated old field with scattered trees and shrubs 2 successive March prescribed fires; the 1st fire was high-severity, the 2nd fire was low-severity frequency was similar before and 2 years after fires [122] Oklahoma indiangrass tallgrass prairie a summer prescribed fire and a "hotter" March prescribed fire not detected 1 year after fires [3] east-central Texas shortleaf pine-sweetgum-loblolly pine forest low-severity, February and March prescribed fires cover similar before and 1 year after fires [212]Although poison-ivies often increase after fire, the effect may be short term. In a southern Appalachian Virginia pine-shortleaf pine-scarlet oak (Quercus coccinea)-white oak forest, eastern poison-ivy occurred with 5.0% frequency and 0.2% cover 1 growing season after a March prescribed fire. The 2nd growing season, both measures had declined [65]. Two studies in the Black Hills, South Dakota, found that western poison-ivy increased after fire in the short term. The 1st growing season after an April low-severity (<5% top-kill of trees) prescribed fire in bur oak woodlands, western poison-ivy density was higher in burned (3.1 stems/m²) than unburned (0.8 stem/m²) plots (P=0.05). The 2nd growing season after fire, however, its density was similar in burned and unburned plots, which were both similar to prefire levels [227]. In a ponderosa pine-grassland ecotone, western poison-ivy densities were unchanged during the first 2 years after low-severity, April and May prescribed fires [26].
Other researchers reported increased abundance of poison-ivies after fire in the long term. In a 53-year study of postfire forest succession in northern Michigan, poison-ivies had the greatest frequency 38 and 51 years after fire [217].
The effect of fire on poison-ivies depends in part on the plant communities involved. To reduce fuels after Hurricane Hugo, prescribed fire was applied to loblolly pine stands and nonnative Chinese tallow (Triadica sebifera) stands. Burning was conducted in winter and was of low severity, with most of the duff layer remaining unburned. Two years after the prescribed fire, eastern poison-ivy density in loblolly pine stands was similar in burned (22,500 stems/ha) and unburned (25,000 stems/ha) stands. In Chinese tallow stands, however, eastern poison-ivy density was much higher in burned (30,001 stems/ha) than unburned (4,169 stems/ha) stands [231].
Prescribed fire is often used in conjunction with logging. Several studies reported greater abundance of poison-ivies on logged and burned sites than unburned (logged or unlogged) sites [33,125,226], but other studies reported lesser abundance on logged and burned sites than other sites [160,199]. On the Bankhead National Forest, Alabama, liana and vine cover—mostly eastern poison-ivy—on logged stands burned under prescription in fall or spring was twice (range: 11-15%) that of a logged but unburned stand (6%). The plant community was an upland oak-mixed hardwood forest [125]. At the Fort Benning Military Base, Georgia, midstories of longleaf pine-loblolly pine stands were masticated and burned under prescription in either December, May, or July. Eastern poison-ivy abundance in postfire year 1 was greater on treated than on control plots [33]. In southeastern Ontario, frequency of poison-ivies decreased on logged eastern white pine-paper birch-red pine forests 1 month after July prescribed fire, but it also increased on uncut and unburned controls. However, the difference was not significant, and the author concluded that logging and prescribed fire had no effect on frequency or biomass of poison-ivies [226]. In southeastern Virginia and northeastern North Carolina, eastern poison-ivy occurred in neither in an Atlantic white-cedar (Chamaecyparis thyoides) peat swamp that was burned in a wildfire 2 years previously nor an area that was logged and then burned. It was abundant, however, in an untreated area [160]. Three years after treatment in Clemson Experimental Forest, South Carolina, eastern poison-ivy increased on thinned plots and plots burned in a moderately severe April prescribed fire, but it declined on plots that were thinned and burned in a low-severity fire 1 year later. The authors suggested that eastern poison-ivy declined on the thinned and burned plots because of the repeated disturbance [199].
Fire timing, frequency, and severity may affect the response of poison-ivies to fire.
Fire timing: Fire season may affect poison-ivies' response to fire. The number of eastern poison-ivy growing points (defined as any foliage- and root-bearing horizontal stem section >3 inches (8 cm) long) in oak-hickory forest increased more on fall-burned plots than winter-burned plots 1 year after prescribed fires in Chickamauga and Chattanooga National Military Park. The authors suggested that a decrease in the number of eastern poison-ivy growing points on control plots was probably due to summer drought, while the increase in eastern poison-ivy growing points on burned plots was the result of postfire sprouting from surviving stems and underground reproductive structures. Although growing points increased, total biomass was apparently reduced [68].
Table 5. Mean number of eastern poison-ivy growing points/m² in a control and 2 treatments in Chickamauga and Chattanooga National Military Park, Tennessee [68] Treatment Count % change* Pretreatment Posttreatment Control 10.6 5.3 -49.8 a Fall prescribed fire 26.7 38 +42.6 b Winter prescribed fire 12.0 12.5 +4.6 c *Values having different postscripts were significantly different at P=0.05.Fire frequency: Poison-ivies occur on sites where fire is frequent and on sites where fire is infrequent. For example, in logged loblolly pine-shortleaf pine stands in southeastern Arkansas, cover of eastern poison-ivy was similar in stands with a variety of burn histories: 1 year after a fourth 3-year burn cycle (2.3% cover); 4 years after a second 6-year burn cycle (3.4% cover); 1 year after a second 9-year burn cycle (1.3% cover); and in an untreated control stand (1.2% cover). Stands were burned under prescription in December, January, or February [37]. Eastern poison-ivy was common in shortleaf pine stands in Arkansas that had been burned 1 to 5 times in 15 years [236,237]. Poison-ivies occurred in white oak-post oak barrens in east-central Illinois, 1 and 2 years after fall prescribed fire, and at a site burned under prescription 3 times in 10 years [159]. In Missouri, eastern poison-ivy was present in oak-hickory flatwoods burned annually in spring for 8 years [192].
Poison-ivies are often abundant after repeated annual or biennial fires. In a northern pin oak community in east-central Minnesota, poison-ivies were more frequent (12.7%) on a site that was burned prior to leaf-out every spring for 13 years than on an adjacent unburned control site (5.0%) [277]. Low-severity May prescribed fires were applied to 2 eastern white pine-red pine stands in Michigan. Cover of poison-ivies was greater on a stand 2 years after a single fire (1.4%) and a stand 1 year after a second biennial fire (1.3%) than on unburned control plots (0.7%) [180]. For more information, see the Research Project Summary of this study.
Poison-ivies are often common in communities burned at >5-year intervals. At the Teft Savanna Nature Preserve in Indiana, density of poison-ivies in white oak barrens did not change during 20 years despite mixed-severity spring prescribed fire used at an average of every 5.7 years [99]. In a southern Appalachian oak-hickory forest, Holzmueller and others [119] compared understory diversity and composition among oak-hickory stands in the Great Smoky Mountains that were burned 1 to 3 times during 20 years. Poison-ivies were most indicative of stands that were burned 2 times in 20 years (P=0.04) [119]. In Wisconsin, frequency of poison-ivies in a northern pin oak savanna subjected to 2 prescribed fires in 15 years was higher than in adjacent unburned savanna; they apparently established in burned sites after fire opened the canopy [20]. In northern Florida, 2nd-growth loblolly pine-shortleaf pine woodlands were burned under prescription during 75 years at frequencies ranging from 1 to 13 times in 13 years. However, eastern poison-ivy was less abundant on these burned plots than on plots that had not been burned during the 75 years (P<0.02) [163]. At the Cedar Creek Ecosystem Science Reserve, western poison-ivy was a dominant plant in a pin oak-bur oak/big bluestem savanna burned 3 times during 37 years [54].
Other researchers reported that abundance of poison-ivies was reduced on sites burned frequently (every 1 to 4 years) [113] or that poison-ivies were less abundant on sites burned frequently than on sites burned at intervals of 5 years or more [111,141,163]. In DuPage County, Illinois, mean cover of poison-ivies was lower in a northern red oak-white oak-bur oak forest subjected to annual low- to moderate-severity prescribed fire during fall or spring for 17 years (0.05%) than in unburned controls (1.8%) (see the Research Paper by Bowles and others) [31]. Annual spring prescribed fire for 3 years in a big bluestem-prairie dropseed prairie in southwestern Minnesota reduced western poison-ivy cover in the short term. Prior to the fires, western poison-ivy cover was 1.6%. The summer immediately following the 1st prescribed fire, its cover was 0.1%. The following spring, its cover increased slightly to 0.4%. After 2 annual prescribed fires, its cover was less than half of prefire levels (0.7%) [21]. In Escambia Experimental Forest in Alabama, eastern poison-ivy was absent from longleaf pine stands burned biennially in winter, spring, or summer during 22 years, but it had 1.2% cover in unburned control stands [141]. Poison-ivies decreased 81% in a tallgrass prairie in southeastern Michigan that was burned at 1- to 3-year-intervals in April or November over 16 years [113]. In big bluestem-indiangrass-little bluestem prairie in northeastern Nebraska, poison-ivies were absent on sites either burned under prescription annually in April or burned every 4 years in April. However, they were frequent (33%) on sites burned once in 18 years. Prior to the study, all sites were burned every 2 to 3 years, and poison-ivies were absent from all sites [111]. In a south-central Illinois oak-hickory forest, the number of plants of poison-ivies declined 31% after 4 prescribed fires during 8 years. Fires occurred in February and March [252].
Fire severity: Poison-ivies are reported after fire severities ranging from low to high. In Ontario, they were dominant understory plants in a quaking aspen stand 20 years after a severe wildfire [273]. In a Rocky Mountain juniper community in the Little Missouri Badlands, North Dakota, that sustained different levels of fire damage, western poison-ivy had the highest frequency (33%) in stands with upper crown damage. It had 20% frequency in stands with surface damage and in stands with lower crown damage [205].
Eastern poison-ivy may form fuel ladders. Fuel ladders formed by climbing eastern poison-ivy stems were reduced 1 year after a July prescribed fire in Chickamauga and Chattanooga National Military Park compared to prefire levels. Although all fine fuels present in these ladders were consumed by flare-ups, some large main stems remained. However, nearly all of the remaining stems were dead because the fire consumed them up to about 3 feet (1 m) from the ground, thus severing them from their roots. The authors concluded that because large ladder fuels were separated from the ground, the prescribed fire reduced the possibility of future surface fires becoming crown fires [68].
Although other fuel characteristics for poison-ivies were unknown as of this writing (2012), they are likely to differ substantially between eastern poison-ivy, which climbs and is woody throughout, and western poison-ivy, which does not climb and is woody only about 2 to 48 inches (5-122 cm) from the base (see Botanical description).
Poison-ivy seeds have a dormant embryo and a hard endocarp that inhibits germination. In a series of germination tests of eastern poison-ivy seeds, only seeds from Florida and Bermuda germinated without cold stratification to break dormancy [84].
Seed viability and germination rates may be high. In sand dunes along Lake Erie, all fruits collected from poison-ivies had viable seeds [285]. Mean germination reported in the literature ranged from 0% to 96% [84,139,218]. Seeds of poison-ivies remain viable for at least 6 years in the laboratory [84].
Typically, seeds of poison-ivies must be scarified and/or cold-stratified for long periods (3-4 months) for germination to occur [218]. In the laboratory, ≤1% of seeds of poison-ivies collected in December and February and planted in the laboratory germinated without scarification or stratification. Seeds scarified with sulfuric acid had better germination (63%) than unscarified seeds. Seeds collected in February and stratified had the best germination (90%-96%). The authors suggested that seeds picked in February had the highest germination rates because they experienced a longer period of cold stratification in the field prior to collection compared to seeds picked in December. Scarification of seeds prior to stratification did not improve germination (66%-72%) [218]. Germination of stratified eastern poison-ivy seeds from 14 locations throughout the species' range varied from 4% to 82%. Germination was 0% to 3% for western poison-ivy seeds from 5 locations. It was unclear why rates of western poison-ivy seed germination were so much lower than those of eastern poison-ivy [84].
In nature, poison-ivy seeds may be scarified by passing through an animal's digestive tract [171]. Western poison-ivy seeds that had passed through sharp-tailed grouse digestive tracts gave 86% germination after warm, then cold stratification [139]. However, no information on controls was provided in this study. In a bur oak-western poison-ivy grove in Manitoba, western poison-ivy seeds extracted from ruffed grouse feces and those taken directly from plants in February had similar germination rates [194].
Germination of poison-ivies in the wild may be high. In South Carolina, seedfall of eastern poison-ivy was positively associated with the number of germinants during 2 years (P<0.01), indicating that seedfall from the previous year strongly contributed to that germination [131].
The aboveground portions of poison-ivies are probably easily killed by fire. According to Bragg [32], the thin-barked stems are easily killed by even low-severity fire. However, poison-ivies may sprout from rhizomes or root crowns that are protected from fire by soil. Some studies reported sprouting of poison-ivies after fire (e.g., [68,126]). Most poison-ivy rhizomes extend only about 4 to 6 inches (10-15 cm) deep [108]. However, even the most severe fires rarely damage plant tissues below 2 inches (10 cm) in the soil [232]. Thus, many rhizomes are probably insulated from heat damage by soil and likely survive most fires. In Chickamauga and Chattanooga National Military Park, Tennessee, some aboveground horizontal stems of eastern poison-ivy survived a July prescribed fire. Many surviving aboveground horizontal stems sprouted after the fire, although a majority of postfire growth appeared to be from belowground reproductive structures [68].
The effect of fire on poison-ivy seeds in the seed bank was unclear as of this writing (2012). Prescribed fire was applied to 2 oak stands near Russellville, Arkansas, in February, and seeds were germinated in a greenhouse from soils taken from the upper 2 inches (5.0 cm) of soil immediately prior to and after the fire. In soils from one stand, the density of eastern poison-ivy germinants was 76% less in burned than in unburned soils. In the other stand, the density of germinants was 300% more in burned than in unburned soils [222].
Poison-ivies provide food for birds, small mammals, wild ungulates, and livestock.
Wildlife: At least 75 species of birds, particularly gallinaceous birds such as wild turkeys, northern bobwhites, ruffed grouse, and sharp-tailed grouse, eat the fruits and seeds of poison-ivies (e.g., [17,109,124,139,147,171,187,245,279]). Many mammals—including bears, mule deer, white-tailed deer, moose, foxes, woodchucks, muskrats, rabbits, squirrels, woodrats, and mice—consume the leaves, stems, and fruits of poison-ivies (e.g., [97,124,181,187,194,209,249,255]). In southern Indiana, eastern poison-ivy was 1 of the 7 most important plants consumed year-round by white-tailed deer. White-tailed deer ate the leaves with greater frequency in summer (81%) than in spring (67%) [235]. Poison-ivy fruits may be particularly important during winter [17,81] or during poor mast years [61,97] when other fruits are unavailable. In Maryland, ripe eastern poison-ivy fruits were available on plants in September, but birds did not begin harvesting them until late October [52].
Livestock: According to a fact sheet, livestock typically browse poison-ivies only sparsely [262]. However, heavy livestock browsing of poison-ivies may occur and sometimes reduces abundance of poison-ivies locally. See Control for more information on this topic.
Palatability and nutritional value: Wildlife and livestock can browse poison-ivies without ill effects to the animals [42,109,171,262]. Western poison-ivy palatability is generally low to good. It is "poor" to "good" forage for small mammals and birds; poor forage for pronghorn, elk, mule deer, and white-tailed deer; and poor to fair forage for cattle, domestic sheep, and horses. It is rated poor in both energy and protein value [55].
Cover value: According to Dittberner and Olson [55], western poison-ivy cover value for wildlife is "poor" to "fair". However, western poison-ivy was the most common understory plant in a riparian eastern cottonwood/willow community in Scotts Bluff National Monument, Nebraska, and this community provided important cover for more than 80 species of birds, mammals, reptiles, and amphibians [45].
In spring, eastern poison-ivy leaves appear on vertical stems that have overwintered [171]. In northeastern Colorado, new shoots appeared on western poison-ivy in mid-May [206]. In Canada, overwintering vertical stems of poison-ivies start growing in late May or early June. Horizontal "rootstocks" and new vertical shoots from the rootstocks are first produced in late June and reach their maximum development during July and August [171]. In Georgia, leaves were fully expanded in early March [76]. In Tennessee, eastern poison-ivy leafed out as early as mid-March, although leaf-out occurred in mid-April the spring after a July prescribed fire [68].
The timing of flowering and fruiting is related to latitude, with flowering dates progressively later toward the north [84]. In Canada, flower buds of poison-ivies, which form on new growth in late summer and early fall of the previous year, open in late May or early June [171]. According to Lakela [144], flowering occurs when leaves are about half open [144]. Mulligan and Junkins [171] stated that flowering does not occur until leaves are fully expanded. Generally, eastern poison-ivy flowers from March to July [40,168,244,281] and fruits from July to January [124,156,204,229,234,283]. Western poison-ivy flowers from April to June [19,47,55,92,133,245] and fruits from July to November (Table 1) [156,234]. On the Great Plains, western poison-ivy plants sometimes bloom twice in one season; first in May or June and again in August or September [92]. Eastern poison-ivy plants in southeastern Arizona may have 2 periods of maximum flowering, 1 in April and May and 1 in mid-August to early September [84]. In Canada, peak flowering of poison-ivies occurs in June, but some additional flowering occurs sporadically until early fall [171]. The length of time required for fruits to ripen varies by site. In southern Florida, eastern poison-ivy fruits ripen in 3 months; in northern Florida fruits ripen in 4 months; and in southern New England fruits ripen in 2 months [84]. Poison-ivy fruits often persist over winter and into early spring [92,140,171,234,240].
Table 1. General flowering dates for poison-ivies throughout their ranges in North America Species Location Flowering period Eastern poison-ivy Arkansas throughout May-July [124] Florida Florida panhandle March-April [40] northern Florida April-May [229] Illinois throughout May-July [168] Mississippi throughout April-October [63] Missouri throughout May-July [283] North and South Carolina throughout late April-May [204] Texas central mid-April to May [55] West Virginia throughout May-July [244] East Gulf and Atlantic coasts from Texas north to southern Nova Scotia March-June [60] Great Plains north-central late May [240] Northeast northeastern and north-central United States and adjacent Canada May-July [87] Southeast Blue Ridge Mountains May-June [281] Southwest southeastern Arizona and the Sierra Madre Occidental, Mexico March-June [83] Ontario throughout June-early July [234] Western poison-ivy Arizona throughout April-September [133] Colorado throughout May-June [55] Kansas throughout May-June [19] North Dakota throughout May-July [55,241] Utah throughout June-July [55] Wyoming throughout June-September [55] Great Plains throughout May-June [92,245], sometimes again August-September [92] Intermountain region throughout May-June [47] Ontario throughout June-early July [234]Poison-ivies' wide distributions suggest they are adapted to a wide range of climates [171]. They grow in semiarid [115,205,261], humid [213,269,272], subtropical, and tropical [269] regions of the United States. In coastal Maine, poison-ivies occurred in a perhumid climate with localized fog [165]. Poison-ivies occur in regions of the United States and Canada with average annual temperatures ranging from 39 °F (4 °C) (southern Quebec) [265] to 72 °F (22 °C) (central Florida) [1] and average annual rainfall ranging from 15.7 inches (400 mm) (southeastern Arizona) [211] to 61.9 inches (1572 mm) (southern Florida) [62]. The average number of frost-free days ranges from 0 days (southern Florida) [62] to 111 days (South Dakota) [205]. Poison-ivies appear intolerant of extreme cold. In Canada, sections of horizontal rootstocks and vertical stems of poison-ivies were often winter-killed [171].
Lianas, such as eastern poison-ivy, are hypothesized to benefit from warmer temperatures and elevated carbon dioxide levels predicted by global climate change [152,221]. Under experimentally elevated levels of atmospheric carbon dioxide, eastern poison-ivy increased photosynthesis, water-use efficiency, growth, and population biomass during 5 growing seasons. Plants exposed to elevated carbon dioxide also produced more urushiol. These results suggested that under elevated levels of carbon dioxide, eastern poison-ivy may grow larger and become more noxious [166]. However, in mixed-hardwood forests in Wisconsin, it decreased in abundance during 45 years despite increased atmospheric carbon dioxide levels and increased mean winter temperatures of 4.3 °F (2.4 °C). This suggested that eastern poison-ivy was limited by factors other than carbon dioxide levels and low winter temperatures, such as light availability [152]. See Schnitzer and others [221] and Mohan and others [167] for more information on possible effects of climate change on eastern poison-ivy.
Plant communities: Poison-ivies occur in a variety of plant communities from barrier-island sand dunes to subalpine sites [49,83,285]. They occur primarily in wetlands, floodplains, bottomlands, and riparian communities throughout their ranges, but they also occur frequently in upland hardwood, mixed hardwood-conifer, and conifer forests and woodlands (e.g., [49,71,83,174,233,250]). In forests, they often occur in canopy gaps and on edges (see Shade tolerance). They also occur in prairies and other grasslands (e.g., [3,21,111,113,130,134,172,204,240]) as well as on rocky fields, talus slopes, and cliffs [83,171]. See the Fire Regime Table for a list of plant communities in which poison-ivies may occur and information on the FIRE REGIMES associated with those communities.
In the West, western poison-ivy most often occurs, but is seldom predominant, in aspen and cottonwood (Populus spp.), ash, maple, and birch (Betula spp.) gallery forests and floodplain communities (e.g., [27,86,102,105,178,198]). Among shrublands, it is most common in western snowberry (Symphoricarpos occidentalis) [44,104,259], red-osier dogwood (Cornus sericea) [102,198], chokecherry (Prunus virginiana) [103,105,105,198], silver buffaloberry (Shepherdia argentea) [103,105], and willow (Salix spp.) [102,103,105] communities. Along the Little Missouri River in North Dakota, western poison-ivy was abundant in green ash/western snowberry communities [104], and it was common in eastern cottonwood/Rocky Mountain juniper (Populus deltoides/Juniperus scopulorum) communities [85]. In southern Idaho, western poison-ivy occurred with the greatest mean cover in quaking aspen (P. tremuloides)/red-osier dogwood communities, with less cover in red-osier dogwood, Utah juniper (J. osteosperma)/red-osier dogwood, black cottonwood (P. balsamifera subsp. trichocarpa), and willow communities [102]. In Montana, western poison-ivy had the greatest cover in eastern cottonwood/western snowberry, boxelder/chokecherry, and Rocky Mountain juniper/red-osier dogwood communities. It also occurred in a silver buffaloberry community where animal trampling had created gaps in the canopy [103,105]. In Alberta, western poison-ivy was the 4th most abundant shrub in eastern cottonwood/western snowberry communities on alluvial river bars, and it occurred in silver buffaloberry communities on alluvial floodplain terraces [259].
Poison-ivies are common and occasionally important or predominant in upland forests, particularly those with oak, hickory, maple, eastern redcedar (Juniperus virginiana), and pines (e.g., Virginia pine (Pinus virginiana), loblolly pine (P. taeda), shortleaf pine (P. echinata), and eastern white pine (P. strobus)) (e.g., [54,174,177,190,228,254,270]). They were among the most abundant species in Virginia pine forests in Virginia [190,254] and eastern redcedar woodlands in Pennsylvania, New Jersey, and Virginia [190,195]. Poison-ivies are especially common in upland oak forests and woodlands [138,174,190]. Bur oak (Q. macrocarpa), northern pin oak, black oak (Q. velutina), white oak, and post oak (Q. stellata) are typical overstory dominants [54,110,117,138,149,174,194]. In Indiana, eastern poison-ivy was a dominant species in a black oak/Carolina rose (Rosa carolina)-eastern poison-ivy savanna on an open valley site and in a black oak/eastern poison-ivy/woodland sunflower (Helianthus divaricatus) savanna on a south-facing slope [149]. In central Minnesota, western poison-ivy was dominant in a northern pin oak-bur oak/bluegrass (Poa spp.) community and a northern pin oak-bur oak/big bluestem savanna [54]. In Wisconsin, poison-ivies were understory dominants in a white oak-northern pin oak/leadplant community and were of secondary importance in a northern pin oak/wintergreen-New Jersey tea (Gaultheria procumbens-Ceanothus americanus) community and an eastern white pine/hog peanut (Amphicarpa bracteata) community [138]. Western poison-ivy dominated a bur oak-western poison-ivy grove in Manitoba [194].
In the West, western poison-ivy occasionally occurs in uplands, but it is rarely important or predominant (e.g., [70,85,103,117,148]). On upper slopes in North Dakota, it was abundant in quaking aspen/water birch communities [104], and it was less abundant in quaking aspen/chokecherry and quaking aspen/paper birch (Betula papyrifera) communities on upper slopes [85]. Western poison-ivy is a minor species in upland ponderosa pine (Pinus ponderosa) forests in Nevada [198], Montana [103,105], and Wyoming [117] and in Rocky Mountain juniper and Utah juniper woodlands in Idaho [102], Montana [103,105], and North Dakota [85]. In Fort Bayard, New Mexico, western poison-ivy was a dominant understory shrub in a Gambel oak (Q. gambelii)/western poison-ivy/bottlebrush squirreltail-mutton grass-pinyon ricegrass (Elymus elymoides subsp. hordeoides-Poa fendleriana-Piptochaetium fimbriatum) community type [162].
Shoreland communities: Along the Gulf and Atlantic coasts, poison-ivies are common in maritime hammocks and on sand dunes along shores and barrier islands [16,16,49,60,62,71,136,285]. When western poison-ivy occurs on sand dunes, it is usually missing from adjacent dune forests [83], whereas eastern poison-ivy is frequently reported in these forests [94,151]. Eastern poison-ivy was one of the most abundant species in the American holly (Ilex opaca) forest alliance on lee sides of sand dunes along the Atlantic coast from New Jersey to Massachusetts [136]. On sand dunes from Delaware north to central Maine, it was one of the most abundant species in the northern bayberry-beach plum (Prunus maritima) shrubland alliance on protected sand dunes. In coastal areas from southern New Hampshire to New Jersey, it was one of the most abundant species in the chokecherry-Canadian serviceberry-oak (Prunus serotina-Amelanchier canadensis-Quercus spp.) shrubland alliance on sheltered back dunes, bluffs, and interior coastal areas. It was a dominant species in the cat greenbrier (Smilax glauca)-eastern poison-ivy vine-shrubland alliance on sand dunes in New England south to Maryland [136,257].
Wetlands: Eastern poison-ivy is common and often important or predominant in a variety of wetlands including forested swamps, scrub-shrub wetlands, and tidal and nontidal marshes [71,137]. It was the 3rd most common understory plant in pondcypress heads in north-central Florida [169], and it was a common understory species in baldcypress swamps in Florida [62,169], Georgia [219], North Carolina [175,216], and Illinois [58]. On barrier islands along the North Carolina coast, eastern poison-ivy dominated red maple-swamp tupelo (Nyssa sylvatica var. biflora)/eastern poison-ivy maritime swamp forest [216]. In New York, it was a characteristic species in silver maple-ash swamps and was of secondary importance in freshwater tidal swamps dominated by ash, red maple, slippery elm (U. rubra), and American hornbeam (Carpinus caroliniana) [210]. Poison-ivies were among the most abundant species in a silky dogwood (Cornus amomum) palustrine shrubland in the Delaware Water Gap [195]. Eastern poison-ivy dominated a wax-myrtle (Myrica cerifera)-eastern poison-ivy/sand cordgrass (Spartina bakeri) tidal shrub swamp in Virginia [191], and it was common in the common reed tidal salt marsh herbaceous alliance along the Atlantic coast [136]. It was an important species in a common cattail (Typha latifolia) community in North Carolina [7]. Western poison-ivy was codominant with common reed (Phragmites australis) in riparian communities in Idaho [128].
Grasslands: Poison-ivies are common, but rarely important or predominant, in many grasslands [3,21,107,111,114,130,201]. They occurred in indiangrass (Sorghastrum nutans) tallgrass prairie in Oklahoma [3], in big bluestem-indiangrass-little bluestem (Schizachyrium scoparium var. scoparium) tallgrass prairie in northeastern Nebraska [111], and in big bluestem-prairie dropseed (Andropogon gerardii-Sporobolus heterolepis) prairie in southwestern Minnesota [21]. In North Dakota, western poison-ivy occurred in a little bluestem-creeping juniper (Juniperus horizontalis) community on rocky soils, a shrubby cinquefoil (Dasiphora fruticosa spp. floribunda)-little bluestem community on steep, upland slopes, and a big bluestem community in moist depressions [114]. It was a common species on prairie sandreed-needle-and-thread grass (Calamovilfa longifolia-Hesperostipa comata) sand dunes of the Niobrara Valley Preserve, Nebraska [107]. In southeastern Montana, western poison-ivy occurred on uplands in xeric western wheatgrass/blue grama (Pascopyrum smithii/Bouteloua gracilis) grasslands [130].
Rocky outcrops, talus slopes, and cliffs: Poison-ivies are common and often important or predominant on rocky outcrops, talus slopes, and cliffs (e.g., [116,174,176,195,247,258]). They were dominant in the poison-ivy-granite gooseberry-pawpaw (Ribes curvatum-Asimina triloba) shrub-vineland association on scree fields and talus slopes in the Ouachita Mountains, Oklahoma [116]. Eastern poison-ivy dominated the sparsely covered eastern poison-ivy/Cossatot Mountain leafcup (Polymnia cossatotensis) vegetation type on steep, unstable talus slopes on Tom, Blaylock, and Peter mountains, Arkansas [174]. On dry cliffs of Pisgah National Forest, North Carolina, eastern poison-ivy dominated the eastern poison-ivy/American alumroot (Heuchera americana) herbaceous vegetation association [176]. In Acadia National Park, Maine, western poison-ivy was a characteristic species of the rock polypody-Appalachian polypody (Polypodium virginianum-P. appalachianum) vegetation community on open talus slopes [154].Germination tests from soils suggest that poison-ivies may form a persistent seed bank [13,24,25,46,67,157]. Because seeds retained on the plant over winter are dormant, poison-ivies also have a temporary aboveground seed reserve [285].
Many researchers have reported poison-ivies in seed banks. In a maple bottomland swamp in western New York, where mean eastern poison-ivy cover was 3%, seedling emergence tests in a greenhouse indicated a mean density of 0.1 seed/120 cm² in the upper 2 inches (5 cm) of soil in April [25]. Using soil samples collected from eastern white pine, red pine (Pinus rubra), and Virginia pine plantations in southern Ohio, seedling emergence tests in a greenhouse indicated a mean density of 117 poison-ivy seeds/m² in the upper 4 inches (10 cm) of mineral soil [13]. In an old field (11 years since cultivation) in Prince George's County, Maryland, seedling emergence tests in a greenhouse indicated a mean volume of 11 poison-ivy seeds/1,000 cm³ in the upper 3 inches (8 cm) of soil in late November and early December [24]. In an upland oak-pine forest in New Jersey, seedling emergence tests in a greenhouse indicated a mean density of 10 poison-ivy seeds/m² in the upper 4 inches (10 cm) of soil collected in June and July [157]. In eastern Tennessee, 1,626 eastern poison-ivy seedlings/ha germinated from seeds in topsoil the first growing season after the topsoil was removed from mixed-hardwood stands and spread over surface mine soils [67].
In contrast, other researchers reported that seeds of poison-ivies either failed to germinate from or were sparse in soil samples despite abundance in the standing vegetation (e.g., [41,56,211]). Leicht-Young and others [149], observing that eastern poison-ivy was dominant in the aboveground vegetation in a black oak savanna but did not germinate from soil samples in a greenhouse, concluded that eastern poison-ivy does not commonly form a seed bank. Eastern poison-ivy was the most common understory plant in a midsuccessional sweetgum-loblolly pine-red maple forest in Virginia, with an average of 41% cover. However, seedling emergence tests in a greenhouse indicated a mean density of only 1 seedling/m² in the upper 3 inches (8 cm) of soil in November [177]. Although western poison-ivy relative abundance was 16% in the Garden Canyon floodplain in the Huachuca Mountains of Arizona, no western poison-ivy seedlings germinated in the laboratory from samples taken from the upper 2 inches (5 cm) of soil in March [211]. In a loblolly pine plantation in North Carolina, eastern poison-ivy was present in the aboveground vegetation, but no seedlings emerged during greenhouse germination tests from samples taken from the upper 4 inches (10 cm) of soil in August and May [41].
Because male and female flowers are on separate plants, not all poison-ivy plants bear fruit [215]. In sand dunes along Lake Erie, 47% of plants bore seeds, with an average of 131 seeds/shoot [285].
Poison-ivy fruit and seed production is often high. An eastern poison-ivy plant with a 3.5-inch (9 cm) diameter main stem had a 4.3-foot (1.3 m) long branch with 6,130 flowers [84]. In September in Maryland, before birds began harvesting seeds, poison-ivies had an average of 315 fruits/plant [52]. In sand dunes along Lake Erie, they had 2,165 fruits/m² in April [285]. In Manitoba, western poison-ivy plants averaged 26 fruits/plant in January and early February; 49 days later there was only an average of 1 fruit/plant because most were consumed by birds and squirrels [194].
Some researchers reported low seed production in poison-ivies. In hardwood forest on the Pisgah National Forest, North Carolina, poison-ivies never fruited in 5 years [93]. Although poison-ivies were abundant in both logged and unlogged shortleaf pine-mixed hardwood stands in west-central Arkansas and east-central Oklahoma, they produced few fruits [196].
Poison-ivies first produce seed at 3 years old [81].
Soils: Poison-ivies grow best in fertile, moist but well-drained soils, although they tolerate a wide range of fertility, moisture, and other conditions. They occur on soils ranging from xeric, shallow rocky soils with southern exposure, to mesic soils on northerly and sheltered exposures, to saturated soils in seeps [216]. Poison-ivies grow in talus and in crevices on steep cliffs as well as in deep soils (>3 feet (1 m)) [174].
Texture: Poison-ivies grows in soils of all textures, including clays, silts, loams, and sands (e.g., [10,33,44,75,80,85,98,130,234,240]). According to Mulligan and Junkins [171], western poison-ivy generally occurs on sandier soils than eastern poison-ivy. Poison-ivies also occur in areas dominated by boulders, stones, cobbles, and gravels [70,130,148,198,223,234,240,268], including talus slopes, cliffs, and rocky ridges [174,234].
pH and parent materials: Poison-ivies occur in extremely acidic to moderately alkaline soils. Eastern poison-ivy occurred in soils with pH ranging from 3.6 to 6.5 [13,80,83]. It increased as soil pH increased in pondcypress (Taxodium distichum var. imbricarium) domes in north-central Florida [169]. Western poison-ivy generally occurs in more alkaline soils than eastern poison-ivy [84,171]. It occurred in soils with pH ranging from 5.7 to 8.4 [75,85,130]. Poison-ivies occur in soils derived from most parent materials (e.g., [75,83,91,130,140,160,174,214,216]).
Nutrients: Poison-ivies occur in "rich" soils [84,133,240] as well as in nutrient-poor soils (e.g., [12,33,98]). They were dominant in the understory of a white oak-northern pin oak/leadplant (Quercus ellipsoidalis/Amorpha canescens) community in Wisconsin that had dry, fine sands with poor to medium nutrient content [138].
Poison-ivies appear to prefer soils with high calcium content. Eastern poison-ivy appears tolerant of high phosphorus levels. In the laboratory, seeds of poison-ivies in a calcium-poor solution germinated but seedlings died soon after [84]. Eastern poison-ivy increased with increased soil calcium in pondcypress heads in north-central Florida [169]. In Florida, eastern poison-ivy was an important component of 100-year-old baldcypress (Taxodium distichum var. distichum) stands with high phosphorus levels [179].
Moisture: Poison-ivies occur on very dry to very wet sites and on poorly drained to well-drained soils (e.g., [33,80,110,112,157,174,216,248]), but generally they prefer well-drained, mesic soils (e.g., [2,47,70,123,135,158,214,234,250,260]). For example, in mixed-mesophytic forest in Indiana, eastern poison-ivy occurred on some xeric sites but had highest cover on mesic sites [123]. In mixed-oak (Quercus spp.) forest in southern Ohio, poison-ivies occurred with lower frequency on xeric sites (10.3%) than on intermediate (16.9%) or mesic (15.1%) sites [127].
Throughout their ranges, poison-ivies commonly occur in wetlands [23,170,208]. They often occur in seasonally or intermittently flooded areas (e.g., [58,89,118,216]) as well as areas such as marshes and swamps that are flooded for long periods (e.g., [198,216]). On these sites, poison-ivies often occur on elevated microsites such as on hummocks or tree bases [73,174]. Eastern poison-ivy on north-central Florida pondcypress heads decreased in importance with increased flooding depth; most eastern poison-ivy plants were found on large, elevated peat mats around the bases of pondcypress trees [169]. In Piatt County, Illinois, poison-ivies were the most frequently occurring woody species on flood-prone sites in silver maple (Acer saccharinum) streamside forests; these sites were inundated more than 20% of the time during the historical record. However, poison-ivies also occurred in upland white oak (Quercus alba) forests that were never flooded [22]. On wet meadows and other riparian prairie communities along the Middle Loup and Loup rivers in central Nebraska, poison-ivies increased with increased groundwater depth [172].
Poison-ivies appear tolerant of flooding [73]. Observations at the Montezuma National Wildlife Refuge, New York, suggested that eastern poison-ivy density declined 1 year after controlled flooding of 2 red maple-green ash (Acer rubrum-Fraxinus pennsylvanica) wetland reservoirs. Two years after flooding, eastern poison-ivy density had increased but remained below that on control sites. Eighteen years after flooding, density on flooded sites exceeded that on the controls [53]. A bottomland hardwood forest along the Mississippi River in Louisiana was sampled before and after a 105-day flood. Submerged eastern poison-ivy plants were top-killed by the flooding, while those with leaves above water remained green. The lower portion of the stem sprouted "vigorously" after the flood water receded. Forty-three days after the flood, eastern poison-ivy cover was greater than that before the flood, although the difference was not statistically significant [183].
Poison-ivies appear intolerant of drought. Western poison-ivy in the prairies of eastern Nebraska, western Iowa, and Kansas was injured or killed by the severe drought of the 1930s [271]. In Tennessee, the number of eastern poison-ivy growing points was reduced by half during a severe drought in the 1980s [68]. In New Jersey, eastern poison-ivy cover varied in response to drought among 6 old fields. In one field, it was reduced by 58%, but in another field it increased 3%. Overall, eastern poison-ivy cover in the old fields declined during the drought. It returned to predrought levels in 2 years. The authors considered eastern poison-ivy a "drought-susceptible" species [284].
Salinity: Poison-ivies are tolerant of mildly saline water [60,62,73,136] and soils [130] and can tolerate light to moderate salt spray [94,173,216].
Poison-ivies tolerate both sun and shade. They are generally rated as moderately shade tolerant [140,143]. They are common from the first stages of plant succession to late succession [97], being most common in early to midsuccession (see Successional stage). Poison-ivies commonly occur on disturbed sites such as floodplains, sand dunes, and talus slopes (e.g., [60,83,95,156,156,204,268,283]) and often increase after disturbances that open the canopy, such as fire, windstorms, forest pathogen outbreaks, and logging. Because of poison-ivies' affinity for forest edges and canopy gaps, researchers suggested poison-ivies are likely to increase with forest fragmentation [34,120].
Shade tolerance: Poison-ivies occur in sunny to shaded sites. They are most abundant in moderately shady sites (e.g., [8,29,47,83,87,109,238]). Gillis [83] stated that western poison-ivy is seldom found in closed-canopy forests because it is likely to be shaded out. Eastern poison-ivy may be better able persist in closed-canopy forests than western poison-ivy because of its ability to climb into the forest canopy and access light [143]. Ladwig and Meiners [143] suggested that eastern poison-ivy employs a "sit-and-wait" strategy in late succession by persisting at low cover in the forest canopy until treefall gaps and other canopy-opening disturbances allow it to spread. In Minnesota, frequency of poison-ivies in northern pin oak-bur oak woodlands was about 15% when the canopy was 8% closed. Their frequency peaked at 55% when the canopy was 22% closed. As canopy closure increased, frequency of poison-ivies declined steadily. When the canopy was 75% closed, their frequency was as low as their frequency in the most open sites (15%). They persisted at very low frequency (2%) even when the canopy was 100% closed [197]. In maple-beech (Fagus spp.) "climax" forest in northern Minnesota, western poison-ivy was "suppressed and scattered" in dense shade but more abundant in areas with more light [238]. In southeastern Ohio, eastern poison-ivy frequency was greater in 2nd-growth oak forest than in old-growth forest, apparently due to relatively greater light availability in 2nd-growth oak forest [184]. Poison-ivies showed an affinity for open microsites in a 73-year-old northern mixed-mesophytic hardwood forest in Ithaca, New York [78]. Eastern poison-ivy decreased as canopy closure increased during 15 years in an old-growth oak-hickory forest in southwestern Illinois. The authors concluded that eastern poison-ivy was "intolerant of heavy shade" [225]. In contrast, its importance value increased 2.3-fold in a mixed pine-hardwood baygall in west-central Louisiana during 15 years. Because its abundance increased as the canopy closed, eastern poison-ivy was described as shade tolerant [6].
Abundance of poison-ivies is often higher on forest edges than in forest interiors (e.g., [34,74,120,152]). Londre and Schnitzer [152] hypothesized that the high abundance of eastern poison-ivy at forest edges may be due to increased temperature, decreased relative humidity, increased wind turbulence, and trellis availability near forest edges. Eastern poison-ivy may also colonize forest edges rapidly because of seed dispersal by avian frugivores, which generally spend more time consuming fruits and depositing seeds along edges than within interiors of temperate forests [152]. Hardin [106] observed that encroachment of poison-ivies into a southeastern Ohio prairie occurred mostly under overhanging tree limbs. Poison-ivies were among the most abundant species on oak forest edges on the Shawnee National Forest, Illinois. They were abundant up to 164 feet (50 m) from the forest edge into the forest interior but declined at greater distances [120]. In the Roanoke River basin, North Carolina, eastern poison-ivy occurred within 66 feet (20 m) of the edge of mixed-hardwood forests. It penetrated deeper into the forest on south-facing edges than north-facing edges [74]. In a hardwood forest in Massachusetts, trees near the edge of the forest supported more eastern poison-ivy stems than those in the forest interior, presumably because of greater light availability [34]. In Wisconsin, eastern poison-ivy density was 2 times greater at the forest edge than in the forest interior (P<0.05). Abundance decreased sharply at 16 feet (5 m) from the edge. Edge sites had the highest light availability and the lowest canopy density (P≤0.05 for both variables) [152]. A 50-year study examined eastern poison-ivy population expansion into an abandoned field in the Hutcheson Memorial Forest, New Jersey. Population expansion in years 10 to 25 was greatest near the edge of the bordering old-growth forest and decreased with increasing distance into the field. By years 30 to 40, the population near the edge of the old-growth forest was declining [143].
Poison-ivies often establish in forest gaps (e.g., [9,90,239]). In Madison County, New York, they were described as "gap species" in northern whitecedar-balsam fir (Thuja occidentalis-Abies balsamea) forest because they had a higher importance value in medium (650-910 feet ² (60-85 m²)) and large (1,290-2,050 feet² (120-190 m²)) canopy gaps than in closed-canopy forest (P<0.05) [9]. Eastern poison-ivy was an important species in old-growth shortleaf pine forest in Missouri, where canopy gaps (≤6 years old) constituted 4% of the total area and gap size averaged 2,260 feet² (210 m²) [239]. In contrast, in New London, Connecticut, frequency of poison-ivies in an eastern hemlock (Tsuga canadensis)-mixed hardwood forest did not change substantially (10%-17%) over 45 years despite tree mortality and opening of the forest overstory due to hemlock woolly adelgid [90].
Logging creates openings in the forest canopy that often benefit poison-ivies. On the Nantahala National Forest, North Carolina, poison-ivies were present in a northern red oak/flame azalea (Rhododendron calendulaceum) forest after hurricane windthrow and posthurricane logging had created 0.25- to 0.50-acre (0.1-0.2 ha) openings in the canopy; however, they were absent from an adjacent unlogged forest [64]. In the Tennessee National Wildlife Refuge, thinned oak-hickory stands had greater mean eastern poison-ivy cover than unthinned stands 4 years after logging [256]. Mean eastern poison-ivy density was higher in southern pine beetle-infested and logged loblolly pine stands (290,080 stems/ha) than in undisturbed stands (16,950 stems/ha) in Turkey Hill Wilderness, Texas (P<0.05) [171]. In contrast, mean eastern poison-ivy density was similar between southern pine beetle-infested and logged loblolly pine stands (24,720 stems/ha) and undisturbed stands (123,775 stems/ha) in Indian Mounds Wilderness, Texas [43].
Poison-ivies often increase substantially after windstorms that open the forest canopy. On Long Pine Key, Florida, eastern poison-ivy and other lianas and vines grew rapidly in maritime hammocks within 1 month after Hurricane Andrew, apparently in response to the canopy opening [153]. Eastern poison-ivy was "prolific" the first growing season after Hurricane Hugo removed much of the overstory of an old-growth maritime forest on Bull Island, South Carolina [231]. In a mixed-hardwood forest in Ottawa, Ontario, eastern poison-ivy seedlings were "more abundant" during the 4 years following an ice storm than before the storm [51]. Near Franklin, North Carolina, frequency, density, and cover of poison-ivies increased from 1 to 3 years after salvage logging of a high-elevation hickory-black oak-yellow-poplar (Liriodendron tulipifera) stand damaged by Hurricane Opal. Poison-ivies were not present in undisturbed stands [64].
The effect of windstorms on abundance of poison-ivies is influenced by the amount of canopy removed, although the effect is unclear. A study in Minnesota found that poison-ivies increased most in the most severely hurricane-damaged areas [189], whereas a study in South Carolina reported that eastern poison-ivy increased most in less severely damaged areas [5]. In Cedar Creek National Historical Park, Minnesota, eastern poison-ivy frequency in an eastern white pine forest increased 19% fourteen years after a windstorm caused high tree mortality, but in a northern pin oak forest, eastern poison-ivy frequency increased 14% during postdisturbance years 1 to 7, then declined to predisturbance levels. The authors suggested that eastern poison-ivy increased more in the eastern white pine forest because the storm damaged that forest more than it damaged the northern pin oak forest [189]. In an old-growth bottomland hardwood forest in Congaree National Park, South Carolina, eastern poison-ivy response to damage from Hurricane Hugo varied with damage severity. In the most severely damaged areas, density decreased 55% in the 1st year after the hurricane and remained low through year 5. Eight years after the hurricane, however, eastern poison-ivy density had nearly doubled, and by posthurricane year 12, it exceeded that before the hurricane. In areas with less severe damage, eastern poison-ivy density decreased initially, but only slightly. By year 5, density exceeded that before the hurricane, and it continued to increase through the end of the study in year 12 [5].
Successional stage: Poison-ivies occur in every stage of succession. However, they often increase after disturbance, and they are typically most common in early to midsuccession. They often persist into later stages of succession, but in lesser abundance [83,86]. In late-successional forests, they often persist in canopy gaps or along forest edges (see Shade tolerance). Because of its ability to access light in the forest canopy, eastern poison-ivy appears more common in late succession than western poison-ivy.
Although sometimes common in early succession, poison-ivies typically reach peak abundance during midsuccession. Studies of old-field succession reported that poison-ivies were often absent immediately after agricultural abandonment but increased soon after. For example, eastern poison-ivy was one of the earliest woody species to invade old fields in southeastern Ontario; it was observed within 3 years of abandonment [48]. Cover of poison-ivies typically peaks in midsuccession, from about 20 years to 60 years after abandonment, then declines in late succession, when poison-ivies often persist in forest gaps or along forest edges (e.g., [18,48,69,100,121,143,200,203,264]).
Table 2. Observations of poison-ivy abundance in old fields after agricultural abandonment Species Location Observations eastern poison-ivy southeastern Connecticut present in trace amounts 9 years after abandonment 28 years after abandonment, when the old field was a thicket of trees and shrubs 13-20 feet (4-6 m) tall, cover was 3% cover remained similar (2%-4%) 38 and 47 years after abandonment [69] New Jersey present 1 year after abandonment 4% cover 15 years after abandonment, when old fields were open and "park-like" and eastern redcedars were 7-8 feet (2-2.5 m) tall 8% cover 40 years after abandonment 30% cover 60 years after abandonment, when old fields were eastern redcedar groves with a thicket understory [18] present within 7 years of abandonment cover peaked 22 years after abandonment (15%), when young trees began to provide support cover decreased to about 5% by year 50 [143] southwestern Ohio absent 2 and 10 years after abandonment common 50 years after abandonment present only in disturbed areas 90 and >200 years after abandonment [264] central Tennessee absent from herb-dominated old fields, 1-12 years after abandonment present in shrub-herb thickets and young forests, 8-20 years after abandonment peak cover in elm and hackberry (Celtis spp.) forests, the oldest fields studied, 25 years after abandonment [203] poison-ivies central New Jersey absent from old fields in years 1-6 after abandonment present in low abundance 7 years after abandonment cover increased steadily until 20 years after abandonment when the study ended [200] southeastern Indiana absent 1 and 2 years after abandonment present 3 and 10 years after abandonment [121]Poison-ivies are common in infrequently to frequently disturbed floodplains and lakeshores [83]. On floodplain sites along the Little Missouri River in North Dakota, highest western poison-ivy cover (18%) occurred on the most recent alluvial deposits in eastern cottonwood communities. Its cover gradually declined as the overstory canopy closed. In a "climax" green ash/western snowberry community, its cover was only 4% [86]. In contrast, in South Dakota, eastern poison-ivy occurred in 35-year-old and 50-year-old eastern cottonwood stands in floodplains along the Missouri River but not in 10-, 14-, or 23-year-old stands [280]. Along the Yellowstone River in Wyoming, western poison-ivy was absent from seedling and sapling eastern cottonwood stands and had <1% cover in pole eastern cottonwood stands, but it had 12% cover in mature eastern cottonwood stands [27].
Poison-ivies often occur in postfire successional communities. For more information on this topic, see Plant response to fire.The genus name for poison-ivy is Toxicodendron Mill. (Anacardiaceae). This review summarizes information on the following poison-ivy taxa:
Toxicodendron radicans (L.) Kuntze, eastern poison-ivy [40,87,88,92,124,137,168,266,281,283].
Toxicodendron rydbergii (Small ex. Rydb.) Greene, western poison-ivy [29,38,47,83,132,156,240,263].
Nine subspecies of eastern poison ivy are recognized globally, 6 of which occur in the United States:
Toxicodendron radicans subsp. radicans (L.) Kuntze [55,88,132,156,247,283]
Toxicodendron radicans subsp. divaricatum (Greene) Gillis [83,263]
Toxicodendron radicans subsp. eximium (Greene) Gillis [55,132,202,263]
Toxicodendron radicans subsp. negundo (Greene) Gillis [55,92,132,240,263,268,283]
Toxicodendron radicans subsp. pubens (Engelm. ex Watson) [55,263,283]
Toxicodendron radicans subsp. verrucosum (Scheele) Gillis [55,83,92,132,263]
Eastern and western poison-ivy are morphologically plastic [81] and intergrade with one another [83,87,171]. They occasionally hybridize where their ranges overlap [47,83,92,268]. Eastern poison-ivy may hybridize with Atlantic poison-oak (T. pubescens), and western poison-ivy may hybridize with Pacific poison-oak (T. diversilobum) [83].
Older literature often does not distinguish between eastern and western poison-ivy, and because the 2 species' geographic distributions overlap, it is sometimes impossible to determine to which species older literature is referring. In this review, species are referred to by their common names, when possible, and "poison-ivies" refers to both species.
L'heura metzinosa, en anglès:Poison ivy (Toxicodendron radicans) amb els sinònims antics de Rhus toxicodendron i Rhus radicans),[1] és una planta metzinosa nativa d'Amèrica del Nord que produeix el compost químic urushiol, que es troba a la seva saba i que causa picor en la majoria de les persones que la toquen[2] Malgrat el seu nom comú no està relacionada amb l'heura (Hedera).
Pot ser una planta enfiladissa o bé un arbust. És una planta caducifòlia, les fulles són trifoliades. Els folíols fan de 3 a 12 cm de llarg. No té espines.[3] Desenvolupa arrels adventícies des d'un rizoma subterrani.
Es reprodueix per via vegetativa i sexual. Floreix de maig a juliol amb flors verdoses o groguenques. El fruit és una drupa i són aliment d'ocells i altres animals. Es dispersen pels animals (zoocòria).
L'heura metzinosa es troba a la major part d'Amèrica del nord incloent les províncies marítimes del Canadà, Quebec, Ontàrio, Manitoba, i tots els Estats dels Estats Units a l'est de les Muntanyes Rocalloses i també les zones muntanyenques de Mèxic fins a uns 1.500 metres d'altitud. (caquistle o caxuistle és el nom que rep en nàhuatl. Hi ha espècies similars com Toxicodendron diversilobum, i Toxicodendron rydbergii a l'oest d'Amèrica del Nord.
No necessita gaire humitat en el sòl però no es troba en deserts ni semideserts.
Ha esdevingut actualment més comuna que en els inicis de la colonització d'Amèrica.
L'urushiol produeix una dermatitis de contacte que és una reacció al·lèrgica. En casos extrems la reacció pot portar a anafilaxi. Al voltant d'un 15%-30% de les persones no tenen aquesta reacció al·lèrgica.[4][5] La majoria de les persones es sensibilitzen per la repetida o més concentrada exposició a l'urushiol.
Unes 350.000 persones cada any estan afectades per l'heura metzinosa als Estats Units.[6]
L'heura metzinosa, en anglès:Poison ivy (Toxicodendron radicans) amb els sinònims antics de Rhus toxicodendron i Rhus radicans), és una planta metzinosa nativa d'Amèrica del Nord que produeix el compost químic urushiol, que es troba a la seva saba i que causa picor en la majoria de les persones que la toquen Malgrat el seu nom comú no està relacionada amb l'heura (Hedera).
Jedovatec kořenující (Toxicodendron radicans), ve své domovině, USA a Kanadě, známý jako poison ivy, je popínavá dřevina z čeledi ledvinovníkovité. Vyskytuje se v Severní Americe od Kanady po Mexiko a ve východní Asii od ruského Dálného východu po Taiwan. Obsahuje těkavou silici, urushiol, která už v malém množství na pokožce většiny lidí způsobuje svědění a tvorbu puchýřů, které jsou těžko hojitelné.
Jedovatec kořenující se přirozeně vyskytuje v Severní Americe: v Kanadě a USA; v Mexiku, na Bahamách, Bermudách a v Guatemale, v Číně, na Tchaj-wanu, Kurilských ostrovech a na Sachalinu. V roce 2009 byl poprvé zaznamenán jeho výskyt v Bavorsku (Dachau)[1] a v roce 2016 poprvé v Rakousku (Graz).[2]
Jedovatec kořenující (Toxicodendron radicans), ve své domovině, USA a Kanadě, známý jako poison ivy, je popínavá dřevina z čeledi ledvinovníkovité. Vyskytuje se v Severní Americe od Kanady po Mexiko a ve východní Asii od ruského Dálného východu po Taiwan. Obsahuje těkavou silici, urushiol, která už v malém množství na pokožce většiny lidí způsobuje svědění a tvorbu puchýřů, které jsou těžko hojitelné.
Almindelig Giftsumak (Toxicodendron radicans) er den "giftige efeu" eller "giftige vedbend", som dækker skovbunden og kryber op ad stammerne i mange af løvskovene i det østlige USA og Canada. Planten er så giftig, at en let berøring kan give alvorlige, brandsårsagtige hudskader.
Tidligere hed arten: Rhus toxicodendron. Engelsk: Poison Ivy.
Almindelig Giftsumak (Toxicodendron radicans) er den "giftige efeu" eller "giftige vedbend", som dækker skovbunden og kryber op ad stammerne i mange af løvskovene i det østlige USA og Canada. Planten er så giftig, at en let berøring kan give alvorlige, brandsårsagtige hudskader.
Tidligere hed arten: Rhus toxicodendron. Engelsk: Poison Ivy.
Der Kletternde Giftsumach[1] (Toxicodendron radicans, häufiges Synonym: Rhus radicans) ist eine Pflanzenart in der Familie der Sumachgewächse (Anacardiaceae).
Der Kletternde Giftsumach (Toxicodendron radicans) wird im Englischen oft Poison Ivy („Giftefeu“) genannt, ist jedoch mit den echten Efeuarten der Gattung Hedera nicht näher verwandt. Er ist zudem zu unterscheiden vom Eichenblättrigen Giftsumach (Toxicodendron pubescens Mill., Syn.: Rhus toxicodendron L.), im Englischen oft Atlantic Poison Oak („Gifteiche“) genannt, sowie von der Gifteiche (Toxicodendron diversilobum, Syn.: Rhus diversiloba), im Englischen oft Pacific Poison Oak oder Western Poison Oak genannt; vor beiden wird oft undifferenziert zusammengefasst wie vor Poison Ivy gewarnt.
Der Kletternde Giftsumach ist ein laubabwerfender, am Boden kriechender bis aufrechter oder mit Haftwurzeln kletternder, giftiger Strauch mit spärlich behaarten oder kahlen Trieben. Die wechselständigen und gestielten Laubblätter sind dreizählig gefiedert. Die kürzer oder länger gestielten Blättchen sind eiförmig bis rhombisch, 5 bis 12 Zentimeter lang, spitz bis zugespitzt mit spitzer bis abgerundeter oder gestutzter Basis und ganzrandigem oder feiner oder gröber gesägtem bis gezähntem, seltener entfernt gekerbtem oder gebuchtetem, teils gelapptem bis seltener geteiltem Blattrand. Die Blattoberseite ist dunkelgrün, kahl und glänzend, die Unterseite ist mehr oder weniger behaart.[2]
Toxicodendron radicans ist zweihäusig diözisch. Die Blüten sind meist funktionell eingeschlechtlich. Die kleinen, grünlich-weißen bis grünlichen und kurz gestielten, fünfzähligen Blüten mit doppelter Blütenhülle wachsen in kurzen, 5 bis 6 Zentimeter langen, achselständigen, reichblütigen Rispen. Sie blühen im Juni und Juli. Die kleinen, weißlichen bis gelblichen-grünen oder gelb-baunen, feinrippigen Steinfrüchte sind kahl oder kurz borstig behaart.[2][3]
Die Chromosomenzahl beträgt 2n = 30.[4]
Der Kletternde Giftsumach enthält wie auch andere nordamerikanische Vertreter seiner Gattung Urushiole in seinem Harz, die sich mit Proteinen der Haut verbinden und damit eine allergische Reaktion auslösen können, die zu einer Entzündung mit Schmerzen, Erwärmung, Hautrötung und Schwellungen führen kann. Menschen reagieren sehr unterschiedlich auf die Inhaltsstoffe, doch nimmt die Empfindlichkeit mit dem Alter zu.[5]
Das natürliche Verbreitungsgebiet liegt in Mexiko und Mittelamerika sowie in den östlichen USA bis Kanada. Weiter auf den Bahamas, den Bermudas und in China, Taiwan und Japan sowie auf den Kurilen und auf Sachalin.[6] 2009 trat die Pflanze erstmals in Bayern (Dachau)[7] und 2016 erstmals in Österreich (Graz)[8] auf. In der Schweiz wurde die Pflanze aufgrund ihres Ausbreitungspotenzials und der Schäden in den Bereichen Biodiversität, Gesundheit bzw. Ökonomie in die Schwarze Liste der invasiven Neophyten aufgenommen.[9][10]
Der Kletternde Giftsumach wächst in Heide- und Dünenlandschaften, auf mäßig trockenen bis frischen, sauren bis schwach sauren, mäßig nährstoffreichen Böden an licht- bis halbschattigen, kühl gemäßigten Standorten. Die Art ist mäßig frosthart. Das Verbreitungsgebiet wird der Winterhärtezone 4 zugeordnet mit mittleren jährlichen Minimaltemperaturen von −34,4 bis −28,9 °C (−30 bis −20 °F).[2]
Der Kletternde Giftsumach (Toxicodendron radicans) ist eine Art aus der Gattung Toxicodendron in der Familie der Sumachgewächse (Anacardiaceae). Dort wird die Gattung der Unterfamilie Anacardioideae zugeordnet.[11] Die Vertreter der Gattung werden manchmal auch der Gattung Rhus zugeordnet.[6] Die Art wurde 1753 von Carl von Linné als Rhus radicans erstmals wissenschaftlich beschrieben.[12] Carl Ernst Otto Kuntze ordnete die Art der Gattung Toxicodendron zu.[6] Der Gattungsname Toxicodendron wird aus den beiden griechischen Ausdrücken toxicon für „Gift“ und dendron für „Baum“ zusammengesetzt.[13] Das Artepitheton radicans bedeutet „Wurzeln bildend“.[14]
Es werden mehrere Unterarten unterschieden, darunter:
Der Kletternde Giftsumach wird nur sehr selten verwendet.[2] Trotz der Giftigkeit der Art und der Wirkung auf die Haut wurde von verschiedenen Anwendungen der indigenen Bevölkerung berichtet, darunter die Herstellung von Körben und das Einfärben von Textilien.[5]
Der Kletternde Giftsumach (Toxicodendron radicans, häufiges Synonym: Rhus radicans) ist eine Pflanzenart in der Familie der Sumachgewächse (Anacardiaceae).
Der Kletternde Giftsumach (Toxicodendron radicans) wird im Englischen oft Poison Ivy („Giftefeu“) genannt, ist jedoch mit den echten Efeuarten der Gattung Hedera nicht näher verwandt. Er ist zudem zu unterscheiden vom Eichenblättrigen Giftsumach (Toxicodendron pubescens Mill., Syn.: Rhus toxicodendron L.), im Englischen oft Atlantic Poison Oak („Gifteiche“) genannt, sowie von der Gifteiche (Toxicodendron diversilobum, Syn.: Rhus diversiloba), im Englischen oft Pacific Poison Oak oder Western Poison Oak genannt; vor beiden wird oft undifferenziert zusammengefasst wie vor Poison Ivy gewarnt.
Ang kanipay (Ingles: poison ivy) ay isang uri ng halamang nakapagdurulot ng pangangati sa balat.[1]
![]() Ang lathalaing ito na tungkol sa Agham ay isang usbong. Makatutulong ka sa Wikipedia sa nito.
Ang lathalaing ito na tungkol sa Agham ay isang usbong. Makatutulong ka sa Wikipedia sa nito.
Ang kanipay (Ingles: poison ivy) ay isang uri ng halamang nakapagdurulot ng pangangati sa balat.
टॉक्सिकोडेंड्रोन रेडिकंस (पॉइज़न आइवी ; पुराने समानार्थक शब्द रुस टॉक्सिकोडेंड्रोन, रुस रेडिकंस[1]), ऐनाकार्डियासी परिवार का एक पौधा है। यह एक जंगली लता है जो युरुशियोल नामक एक त्वचा प्रदाहक उत्पन्न करने की अपनी क्षमता के लिए काफी मशहूर है जो अधिकांश लोगों में होने वाली एक खुजली वाली फुंसी का कारण है जिसे तकनीकी तौर पर युरुशियोल-प्रेरित संपर्क त्वचादाह के रूप में जाना जाता है लेकिन यह एक वास्तविक आइवी (हेडेरा) नहीं है।
पॉइज़न आइवी उत्तर अमेरिका के अधिकांश भाग में चारों तरफ पनपता है जिसमें कनाडा के समुद्री प्रान्त, क्यूबेक और ओंटारियो और संयुक्त राज्य अमेरिका में उत्तर डकोटा को छोड़कर रॉकीज़ के सभी पूर्वी भाग के साथ-साथ मैक्सिको के पहाड़ी क्षेत्रों 1,500 मी॰ (4,900 फीट) (कैक्विसल या कैक्स्विसल—नाहूआट्ल शब्द देखें) तक का क्षेत्र भी शामिल हैं और यह आम तौर पर जंगली क्षेत्रों, खास तौर पर किनारे के क्षेत्रों में पाया जाता है। यह अनावृत चट्टानी क्षेत्रों और खुले क्षेत्रों और अशांत क्षेत्रों में भी उगता है। यह जंगल के एक अंडरस्टोरी पौधे के रूप में भी पनपता है, हालांकि यह कुछ हद तक ही छाया सहिष्णु है।[1] यह पौधा न्यू इंग्लैंड, मध्य अटलांटिक और दक्षिण-पूर्वी संयुक्त राज्य अमेरिका के उपनगरीय और बाह्यनगरीय क्षेत्रों में बहुत आम है। इसी प्रकार की प्रजातियां, पॉइज़न-ओक और टॉक्सिकोडेंड्रोन राइडबर्गी पश्चिमी उत्तर अमेरिका में पाई जाती हैं। पॉइज़न आइवी शायद ही कभी 1,500 मी॰ (4,900 फीट) से अधिक ऊंचाई पर बढ़ता है, हालांकि विभिन्न स्थानों में ऊंचाई सीमा में अंतर होता है।[1] ये पौधे एक झाड़ी के रूप में लगभग 1.2 मीटर (3.9 फीट) लम्बे सकते हैं, एक ग्राउंडकवर के रूप में 10–25 से॰मी॰ (3.9–9.8 इंच) ऊंचे हो सकते हैं, या आरोही लता के रूप में अलग-अलग तरह की वस्तुओं का सहारा लेकर बढ़ सकते हैं। पर्याप्त सहारा मिलने पर पुरानी लताओं से कई पार्श्व शाखाएं निकलने लगती हैं जिन्हें शुरू में वृक्ष के अंग समझने की भूल हो सकती है।
यह विशेष रूप से मिट्टी की नमी के प्रति संवेदनशील नहीं है, लेकिन यह रेगिस्तान या शुष्क परिस्थितियों में नहीं बढ़ता है। यह विभिन्न प्रकार की मिट्टियों में पनपता है और इसके लिए मिट्टी में pH की मात्रा 6.0 (अम्लीय) से 7.9 (सामान्य क्षारीय) तक होती है। यह उन क्षेत्रों में पनप सकता है जो मौसमी बाढ़ या खारे पानी के अधीन है।[1]
यह उस समय की तुलना में अब अधिक आम है जब यूरोपीय लोगों ने पहली बार उत्तर अमेरिका में प्रवेश किया था। जंगली और अविकसित भूमि के निकट अचल संपत्ति के विकास ने "बढ़त प्रभाव" को जन्म दिया है और ऐसे स्थानों में विशाल और सघन उपनिवेशों के निर्माण में पॉइज़न आइवी को सक्षम बना दिया है। इसे संयुक्त राज्य अमेरिका के मिनेसोटा और मिशिगन राज्यों तथा कनाडा के ओंटारियो प्रांत में हानिकारक खरपतवार के रूप में सूचीबद्ध किया गया है।
पॉइज़न आइवी और इससे संबंधित लताएं यूरोप में लगभग अनजान हैं। कई यूरोपीय अमेरिका और कनाडा की यात्रा के दौरान यह देखकर काफी हैरान हो जाते हैं कि इस तरह का एक खतरनाक पौधा इस महाद्वीप पर इतने आमतौर पर मौजूद है।
पॉइज़न आइवी के पर्णपाती पत्ते, बादाम के आकार के तीन पत्रक युक्त त्रिपत्रधारी होते हैं।[1] पत्ते का रंग हल्का हरा (आम तौर पर युवा या नई पत्तियां) से लेकर गाढ़ा हरा (परिपक्व पत्तियां) होता है, जो पतझड़ में चमकीले लाल रंग में बदल जाते हैं; हालांकि अन्य सूत्रों का कहना है कि पत्तियां लालनुमा होती हैं जब ये बढ़ रही होती हैं, परिपक्व या परिपूर्ण रूप से बढ़ जाने पर हरे रंग की हो जाती हैं और उसके बाद पतझड़ में या इनके झड़ने के दौरान ये फिर से लाल, नारंगी, या पीले रंग में बदल जाती हैं। परिपक्व पत्तियों के पत्रक कुछ-कुछ चमकीले होते हैं। इनके पत्रक 3 से 12 सेमी. तक लम्बे होते हैं और शायद ही कभी ये 30 सेमी. तक लम्बे होते हैं। प्रत्येक पत्रक के किनारों पर दांतों की संख्या बहुत कम संख्या में या बिलकुल ही नहीं होती है। लताओं पर स्थित पत्रक समूह एकांतर क्रम में होते हैं और इस पौधे में कांटे बिलकुल ही नहीं होते हैं। पेड़ के तने पर बढ़नेवाली लताएं कई हवाई लाघुमूलों के माध्यम से काफी मजबूती से जुड़ जाती हैं।[2] लताएं अपस्थानिक जड़ों को विकसित करती हैं, या पौधे प्रकंदों या मूल शिखरों से फ़ैल सकते हैं। पॉइज़न आइवी का दूधिया रस हवा के संपर्क में आने के बाद काला हो जाता है।
पॉइज़न आइवी वानस्पतिक या लैंगिक दोनों रूप से फैलता है। पॉइज़न आइवी डाइऑइसियस होते हैं; इस पौधे में मई से जुलाई तक फूल लगते हैं। पीलानुमा- या हरानुमा-सफ़ेद फूल आम तौर पर अस्पष्ट होते हैं जो पतियों के ऊपर 8 सेमी. तक स्थित समूहों में अवस्थित होते हैं। इसका फल बेर जैसा और गुठलीदार होता है जो अगस्त से नवम्बर तक पक जाता हैं और पकने के बाद भूरापन लिए हुए सफ़ेद रंग का होता है।[1] इसका फल कुछ पक्षियों और अन्य पशुओं के लिए सर्दियों के मौसम का एक पसंदीदा भोजन है। इनके बीज मुख्य रूप से पशुओं द्वारा फैलते हैं और पाचक नली से होकर गुजरने के बाद भी इनमें जीवन की क्षमता होती है।
अधिकांश स्थितियों में पॉइज़न आइवी की पहचान के लिए निम्नलिखित तीन विशेषताएं पर्याप्त हैं: (a) तीन पत्रकों का समूह, (b) एकांतर पत्र व्यवस्था और (c) कांटों का अभाव. हालांकि असंख्य अन्य पौधे इस सरलीकृत वर्णन के अनुरूप होते हैं, लेकिन फिर भी इन मानदंडों वाले किसी भी पौधे से उन लोगों को अपने सहज ज्ञान का इस्तेमाल करके बचना चाहिए जो पॉइज़न आइवी की पहचान से अपरिचित हैं। पत्तियों के क्षतिग्रस्त होने, सर्दियों के मौसम में पत्तीरहित होने और पर्यावरण/या आनुवंशिक कारकों के कारण आसामान्य वृद्धि के दौरान अनुभवी लोगों द्वारा इसकी पहचान कर पाना अक्सर मुश्किल हो जाता है।
विभिन्न स्मरक काव्यात्मक पंक्तियां, पॉइज़न आइवी के अभिलाक्षणिक रूप का वर्णन करती हैं:[3]
!" पेड़ों पर पनपने वाली पॉइज़न आइवी की लताएं देखने में रोएंदार "चिथड़ेदार" होती हैं। यह काव्यपंक्ति पेड़ पर चढ़ने वालों को सावधान रहने की चेतावनी देता हैं।
पॉइज़न आइवी नामक इस युरुशियोल-प्रेरित संपर्क त्वचादाह के कारण होने वाली प्रतिक्रिया एक एलर्जी सम्बन्धी प्रतिक्रिया है। लगभग 15%[7] से 30%[8] लोगों में एलर्जी सम्बन्धी कोई प्रतिक्रिया नहीं होती है, लेकिन ज्यादातर लोग युरुशियोल के बार-बार या अत्यधिक संकेंद्रित अनावरण से सुग्राही बन जाएंगे. इन प्रतिक्रियाओं की प्रगति तीव्रग्राहिता तक हो सकती है।
युरुशियोल संपर्क स्थापित होने पर त्वचा को गर्म कर देता है जिससे भयंकर खुजली होने लगती है जो बढ़कर लाल रंग की तरह दिखने वाले सूजन या गैर-रंगीन फुंसियों का रूप धारण कर लेता है और उसके बाद छाला बन जाता है। कैलामाइन लोशन से इन घावों का इलाज़ किया जा सकता है, बेचैनी से राहत दिलाने के लिए बुरो के घोल से सेंकना या नहाना लाभप्रद हो सकता है,[9] हालांकि हाल के अध्ययनों से कुछ परंपरागत दवाइयां अप्रभावी साबित हुई हैं।[10][11] पॉइज़न आइवी के इलाज के लिए त्वचाविशेषज्ञों द्वारा अब खुजली से राहत दिलाने वाले ओवर-द-काउंटर (डॉ के परामर्श के बिना ख़रीदे या बेचे जाने वाले) उत्पादों—या सिर्फ दलिया स्नान और बेकिंग सोडा—के इस्तेमाल की सलाह दी जाती है।[12] गंभीर मामलों में, खुले छालेदार घावों और कॉर्टिकॉस्टेरॉयड से मवाद के रिसाव की समाप्ति आवश्यक इलाज़ है।
खुजलीदार छालों से निकाले गए रिसने वाले मवाद ज़हर नहीं फैलाते हैं।[13][14][15] बढ़ रहे दाने की आकृति यह दर्शाती है कि कुछ क्षेत्रों में ज़हर की अधिक मात्रा मौजूद थी जहां अन्य क्षेत्रों की तुलना में जल्दी प्रतिक्रिया हुई या यह भी दर्शाती है कि उन वस्तुओं के संपर्क से होने वाला संक्रमण अभी भी जारी है जिससे शुरू में ज़हर फैला था।[13] छाले और रिसाव, रक्त वाहिकाओं का ही नतीजा है जो रिक्त स्थान में वृद्धि कर देते हैं और त्वचा के माध्यम से तरल पदार्थ या मवाद को बहाने लगते हैं; यदि त्वचा को ठंडा कर दिया जाता है तो वाहिकाएं सिकुड़ जाती हैं और बहाव कम हो जाता है। अगर पॉइज़न आइवी को जला दिया जाए और इसके धुंए को सांस के माध्यम से अन्दर खींच लिया जाए तो ये दाने फेफड़ों की भीतरी सतह पर दिखाई देंगे, बेहद दर्द होने लगेगा और शायद घातक सांस की तकलीफ का कारण बनेगा.[16] अगर पॉइज़न आइवी को खा लिया जाए तो पाचक नली, वायुमार्ग, गुर्दा या अन्य अंग क्षतिग्रस्त हो सकते हैं। शारीर के किसी भी हिस्से में होने वाले पॉइज़न आइवी के दाने गंभीरता और इलाज़ के आधार पर एक से चार सप्ताह तक रह सकते हैं। शायद ही कभी किसी मामले में पॉइज़न आइवी की प्रतिक्रिया के लिए अस्पताल में भर्ती होने की आवश्यकता होती है।[13][17]
युरुशियोल तेल कई वर्षों तक सक्रिय रह सकता है इसलिए मृत पत्तियों या लताओं को हाथ लगाने से भी प्रतिक्रिया का सामना करना पड़ सकता है। इसके अलावा, पौधे से अन्य वस्तुओं (जैसे - पालतू फ़र) में हस्तांतरित तेल यदि त्वचा के संपर्क में आ जाए तो इससे भी दाने हो सकते हैं।[18][19] आगे के संचरण की रोकथाम करने के लिए तेल के संपर्क में आए कपड़ों, औज़ारों और अन्य वस्तुओं को धो लेना चाहिए. पॉइज़न आइवी के प्रति संवेदनशील लोगों को आमों से भी एक इसी तरह के दाने का सामना करना पड़ सकता है। पॉइज़न आइवी की तरह आम भी उसी परिवार (ऐनाकार्डियासी) का सदस्य है; आम के पेड़ का रस और आम की छाल का रासायनिक मिश्रण युरुशियोल की तरह ही होता है।[20]
कभी-कभार संबंधित फ्रैग्रंट स्यूमक (रुस एरोमेटिका) या जापानी लाख के पेड़ के संपर्क से होने वाली इसी तरह की प्रतिक्रियाओं की खबर मिलती रही है।
|title= में 27 स्थान पर line feed character (मदद) |accessdate= में तिथि प्राचल का मान जाँचें (मदद) टॉक्सिकोडेंड्रोन रेडिकंस (पॉइज़न आइवी ; पुराने समानार्थक शब्द रुस टॉक्सिकोडेंड्रोन, रुस रेडिकंस), ऐनाकार्डियासी परिवार का एक पौधा है। यह एक जंगली लता है जो युरुशियोल नामक एक त्वचा प्रदाहक उत्पन्न करने की अपनी क्षमता के लिए काफी मशहूर है जो अधिकांश लोगों में होने वाली एक खुजली वाली फुंसी का कारण है जिसे तकनीकी तौर पर युरुशियोल-प्रेरित संपर्क त्वचादाह के रूप में जाना जाता है लेकिन यह एक वास्तविक आइवी (हेडेरा) नहीं है।
டாக்ஸிகோடென்ட்ரான் ரேடிகான்ஸ் (பாய்சன் ஐவி எனும் நஞ்சுப் படர்க்கொடி; இதன் பண்டைய பெயர்கள் ரஸ் டாக்ஸிகோடென்ட்ரான் , ரஸ் ரேடிகான்ஸ்) [1] அனகார்ட்டிகே என்னும் குடும்பத்தைச் சார்ந்த ஒரு செடியாகும். இது பலருக்கும் சருமத்தில் அரிக்கும் ஒரு வெடிப்பை உருவாக்கும் உருஷியால் என்னும் ஒரு சரும எரிச்சலை ஏற்படுத்தும் எண்ணெய்ச் சுரப்பி என மிகுந்த அளவில் அறியப்படும் ஒரு காட்டுப் படர்க்கொடி வகையாகும்; இந்த நமைச்சல் உருஷியாலால்-தோற்றுவிக்கப்படும் தொற்றுத் தோல் அழற்சி என அறிவியற் சொல்லாக அறியப்படுகிறது. ஆனால் இந்தக்கொடி உண்மையான படர்க்கொடி (ஹெடெரா) அல்ல.
நஞ்சுப் படர்க்கொடி கனடாவின் கரையோர மாநிலங்கள், கியூபெக் மற்றும் ஆன்டாரியோ ஆகியவை உள்ளிட்ட வட அமெரிக்கா முழுவதும், மற்றும் வட டகோடாவைத் தவிர ராக்கீஸின் கிழக்கில் உள்ள அனைத்து ஐக்கிய மாநில நாடுகள், மற்றும் மெக்ஸிகோவின் மலை நிறைந்த பகுதிகள் மற்றும் அவற்றைச் சுற்றி1,500 m (4,900 ft) (காண்க: காகுவிஸ்டில் அல்லது காகிஸ்டில்- நஹாட்1 சொல்) வளர்கின்றன; இவை மரங்கள் நிறைந்த பகுதியில், குறிப்பாக விளிம்புப் பகுதிகளில் வழக்கமாகக் காணப்படுகின்றன. வெளிப்படையான கற்கள் நிறைந்த பகுதிகள் மற்றும் திறந்தவெளிகள், பாதிப்புக்குள்ளான பகுதிகள் ஆகியவற்றிலும் இவை வளர்கின்றன. இது சிறிதளவே நிழலில் வளரக்கூடிய தன்மையுடையது என்றாலும், காட்டில் கீழே படரும் ஒரு செடியாகவும் வளர்கிறது.[1] இந்தச் செடி, புதிய இங்கிலாந்து, மத்திய-அட்லாண்டிக் மற்றும் தென்கிழக்கு ஐக்கிய நாடுகளின் புறநகர் மற்றும் புறநகர் தாண்டிய பகுதிகளில் மிகச் சாதாரணமாக உள்ளது. இதை ஒத்த இனமான, பாய்ஸன்-ஓக் மற்றும் டாக்ஸிகோடென்ட்ரான் ரிட்பெர்கி ஆகியவை மேற்கு வட அமெரிக்காவில் காணப்படுகின்றன. நஞ்சுப் படர்க்கொடி வளரக் கூடிய இடங்களின் உயர வரம்பானது வெவ்வேறு இடங்களில் வேறுபட்டதாக இருப்பினும், இது1,500 m (4,900 ft)க்கு மேல் உயரமான இடங்களில் அரிதாகவே வளர்கிறது.[1] இந்தச் செடிகள் புதர் போல 1.2 மீட்டர்கள் (3.9 அடிகள்) உயரத்திற்கு, 10–25 cm (3.9–9.8 in) உயரத்திற்கு நிலப்படுகை போலவோ, அல்லது பல்வேறு ஆதாரங்களுடன் பற்றிக்கொண்டு ஏறும் கொடியாகவோ வளர்கின்றன. பழைய பற்றுக்கொடிகள் உறுதியான துணை வலுவுகளுடன், முதற்பார்வையில் மரத்தின் பெருங்கிளைகள் என தவறாக எண்ணக் கூடிய வண்ணம் பக்கவாட்டுக் கிளைகளை வெளியிடுகின்றன.
இது பாலைவனங்களிலும் உலர்ந்த நிலைகளிலும் வளர்வதில்லை என்றாலும், மண்ணின் ஈரத்தன்மைக்கு இது குறிப்பான மிகு உணர்வு கொண்டிருப்பதில்லை. இது பல்வகை மண் வகைகளிலும், மற்றும் மண்ணின் பிஹெச் 6.0 (அமிலத்தன்மை)யிலிருந்து 7.9 வரை (மிதமான காரத்தன்மை) இருப்பதிலும் வளர்கின்றது. இது, பருவகால வெள்ளங்கள் மற்றும் சற்றே உப்பு கொண்ட நீர் உள்ள இடங்களில் வளரக் கூடியது.[1]
இது ஐரோப்பியர்கள் முதலில் வட அமெரிக்காவிற்குள் வந்தபோது இருந்ததை விட தற்பொழுது மேலும் பொதுவானதாக உள்ளது. காடுகள் மற்றும் மேம்படுத்தாத நிலங்களுக்கு அருகில் முன்னேறி வரும் கட்டிடத் தொழிலானது "விளிம்பு சாயல்களை"த் தோற்றுவித்து, இத்தகைய இடங்களில் நஞ்சுப் படர்க்கொடி பரந்தகன்ற செழுமையான கொடிகளாய் வளர உதவுகிறது. இது ஐக்கிய நாடுகளின் மின்னெஸோட்டா மற்றும் மிச்சிகன் மற்றும் கனடாவின் மாநிலமான ஆன்டேரியோ ஆகிய இடங்களில் நச்சுத்தன்மை வாய்ந்த களைச்செடி எனப் பட்டியலிடப்பட்டுள்ளது.
நஞ்சுப் படர்க்கொடி செடியும் அதன் இனச் செடிகளும் ஐரோப்பாவில் ஏறத்தாழ அறியப்படாமலேயே உள்ளன. ஐக்கிய மாநிலங்கள் மற்றும் கனடாவிற்கு வருகை புரியும் பல ஐரோப்பியர்களும் இத்தகைய ஆபத்தான செடி இந்தக் கண்டத்தில் மிகச் சாதாரணமாகக் காணப்படுவதை அறிந்து வியப்படைகின்றனர்.
நஞ்சுப் படர்க்கொடிச் செடியின் உதிரக்கூடிய இலைகள் மூன்று வாதுமை-வடிவ சிற்றிலைகளுடன் முச்சிற்றிலை வடிவமாய் காணப்படுகின்றன.[1] இலையின் நிறம் இளம் பச்சையிலிருந்து (சாதாரணமாக இளம் இலைகள்) அடர்ந்த பச்சை வரை (முதிர்ந்த இலைகள்) உள்ளன. உதிரும் பொழுது அவை ஒளிரும் சிவப்பு நிறமாக மாறுகின்றன; எனினும் இலைகள் விரிவடையும் போது சிவப்பாகவும், முதிரும்போது பச்சையாக மாறியும், பின்னர் உதிரும்பொழுது மறுபடி சிவப்பாக, செம்மஞ்சள் அல்லது மஞ்சளாக மாறுவதாகவும் வேறு சில தோற்றுவாய்கள் உரைக்கின்றன. முதிர்ந்த இலைகளின் சிற்றிலைகள் சற்றே பளபளப்பாக இருக்கின்றன. இந்தச் சிற்றிலைகள் மூன்றிலிருந்து 12 செமி வரையிலும், அரிதாக 30செமி வரையிலும், நீளம் கொண்டுள்ளன. ஒவ்வொரு சிற்றிலையிலும் அதன் விளிம்புகளில் குறைந்த அளவு பற்களே உள்ளன; அல்லது அவை இல்லாமல் இதன் மேற்பரப்பானது வழவழப்பாக அமைந்துள்ளது. மேலே பற்றி எழும்பும் கொடியில் சிற்றிலைக் கொத்துக்கள் ஒன்று விட்டு ஒன்றாக இருக்கின்றன; மேலும் இந்தச் செடியில் முட்கள் இருப்பதில்லை. அடிமரத்தைப் பற்றி வளரும் கொடி வகைகள் உயர்ந்த வேர்க்கால்கள் மூலமாக அவற்றோடு இறுக ஒட்டியிருக்கின்றன.[2] இந்தக் கொடி வகைகள் வெளிப்புற வேர்களை உருவாக்குகின்றன, அல்லது இந்தச் செடி வேர்த்தண்டுக்கிழங்குகளிலிருந்து அல்லது வேர்த்தலைகளிலிருந்தும் பரவக்கூடும். நஞ்சுப் படர்க்கொடிச் செடியின் பால் போன்ற சாறானது காற்றில் வெளிப்பட்ட பின்பு கருமையடைகிறது.
நஞ்சுப் படர்க்கொடி தாவர மற்றும் பாலின ஆகிய இரு முறைகளிலும் பரவுகிறது. நஞ்சுப் படர்க்கொடி ஒரு இரு பால் செடியாகும்; இதில், மே மாதத்திலிருந்து ஜூலை மாதம் வரை மலர்கள் உருவாகின்றன. மஞ்சள் அல்லது பச்சையான-வெள்ளை மலர்கள் தெளிவாகப் புலப்படாதவையாகவும், இலைகளுக்கு மேல் எட்டு செமீ உயரத்தில் கொத்துக்களாகவும் அமைகின்றன. பெர்ரி கனியைப் போன்ற, ஆகஸ்ட் துவங்கி நவம்பர் மாதம் வரை முதிர்வதான இதன் உள்ளோட்டுச் சதைக்கனி, சாம்பல்-வெண்மை நிறத்தைக் கொண்டிருக்கும்.[1] இதன் கனிகள், சில பறவைகள் மற்றும் சில விலங்குகளுக்கு மிகவும் உவப்பான குளிர்கால உணவாகும். இதன் விதைகள் பெரும்பாலும் விலங்குகளால் பரப்பப்படுகின்றன; இவை அவற்றின் செரிமானப்பாதை வழியாக வெளிவந்த பின்னரும் வளரும் ஆற்றல் கொண்டுள்ளவையாகத் திகழ்கின்றன.
நஞ்சுப் படர்க்கொடி செடியைக் கண்டறிவதற்கு, பெரும்பாலான நேரங்களில் கீழ்க்காணும் மூன்று இயல்புகள் போதுமானவை: (அ)மூன்று சிற்றிலைகளின் கொத்து, (ஆ)ஒன்றை அடுத்து மற்றொன்றாக உள்ள இலையமைப்பு, மற்றும் (இ)முட்கள் இன்மை. இந்த எளிமையான விவரிப்பு வேறு பல செடிகளுக்கும் பொருந்தும் எனினும், நஞ்சுப் படர்க்கொடி செடியைப் பற்றிக் கண்டறிய இயலாதவர்கள் இத்தகைய இயல்புகள் உள்ள எந்தச் செடியையும் விழிப்புடன் தவிர்த்து விட வேண்டும். இலைகள் பழுதடைதல், குளிர் காலங்களில் இலைகள் இல்லாதிருத்தல் மற்றும் சுற்றுச் சூழல் மற்றும்/அல்லது மரபு முறைகள் ஆகியவற்றால் வழக்கத்திற்கு மாறான வளர்ச்சியமைப்புகள் போன்றனவற்றால், அனுபவம் நிறைந்தவர்களுக்கும் இந்தச் செடியைக் கண்டறிவது சில சமயங்களில் கடினமாக உள்ளது.
நினைவு கூரத்தக்க பல்வேறு பாடல்கள் நஞ்சுப் படர்க்கொடியின் குணாதிசயமான தோற்றத்தை விவரிக்கின்றன:[3]
!" மரத்திலுள்ள நஞ்சுப் படர்க்கொடியின் கொடிகள் ஒரு வித உரோமமுள்ள "கந்தலான" தோற்றம் கொண்டுள்ளன.
மரம் ஏறுபவர்கள் கவனத்துடன் இருக்குமாறு இந்தப் பாடல் எச்சரிக்கிறது.
நஞ்சுப் படர்க்கொடிச் செடியால் உருவாக்கப்படும் எதிர்விளைவான, உருஷியால்-தூண்டு தொற்று தோல் அழற்சி என்பது ஒரு ஒவ்வாமை எதிர்விளைவு. 15%[7] லிருந்து 30%[8] மக்கள் ஒவ்வாமைக்கான பதிலிறுப்பு கொண்டிருப்பதில்லை; எனினும் பலர், மீண்டும் அல்லது அதிக அளவில் செறிவுற்ற உருஷியாலுக்கு உட்படுத்தப்பட்டால் ஒவ்வமைக்கான மிகு உணர்ச்சியைக் கொள்வர். இத்தகைய எதிர்விளைவுகள் கடும் ஒவ்வாமை என்னும் நிலைக்குக் கொண்டு செல்லலாம்.
உருஷியால் என்பது தொட்டவுடன் தோலுடன் பிணைந்து கொண்டு பலத்த நமைச்சலை உருவாக்கும்; இதுவே சிவந்த நிறமுடன் வீக்கமடைந்து அல்லது நிறமற்ற தடிப்புகளாக மாறிப் பின்னர் கொப்புளங்கள் ஆகிறது. சில பாரம்பரிய மருந்துகள் இதன் மீது பயனற்றவை என்று அண்மையிலான ஆய்வுகள் உரைப்பினும், இந்தச் சிதைவுகள் காலமைன் என்னும் கழுவுநீர்மம் கொண்டு சிகிச்சையளிக்கப்படலாம்; பர்ரோவின் நீர்மம் இந்தப் புண்களை அமிழ்த்தியோ, கழுவியோ அசௌகரியத்திலிருந்து நிவாரணம் அளிக்கிறது[9].[10][11] நமைச்சலிலிருந்து நிவாரணம் அளிப்பதற்கு சாதாரணமாக கிடைக்கும் தயாரிப்புகள்-அல்லது எளிமையான புல்லரிசிக்கூழால் கழுவுதல் மற்றும் சமையல் சோடா-ஆகியவை நஞ்சுப் படர்க்கொடிச் செடியால் பாதிக்கப்பட்டவர்களுக்கு சிகிச்சையளிக்க தோல் மருத்துவர்களால் தற்பொழுது பரிந்துரைக்கப்படுகிறது.[12] தீவிரமான தருணங்களில், திறந்த கொப்புளங்களிலிருந்து தெளிவான திரவங்கள் சுரக்கும். இந்த நிலையில் புறணி இயக்க ஊக்கிகள் கொண்டு சிகிச்சை அளிப்பது தேவைப்படும்.
இவ்வாறு அரிப்பெடுக்கும் கொப்புளங்களிலிருந்து சுரக்கும் திரவங்கள் நச்சுத்தன்மையைப் பரப்புவதில்லை.[13][14][15] சில இடங்கள் அதிக அளவில் நச்சு கொண்டு மற்ற இடங்களை விட வேகமாக எதிர்விளைவுகளை ஏற்படுத்துகின்றன அல்லது முதலில் நச்சுத்தன்மை பரவிய பொருளோடு இன்னமும் இணைப்பு இருப்பதால் தொற்று பரவுகிறது என்பதையே பரவும் தோல் கரப்பான்கள் உணர்த்துகின்றன.[13] கொப்புளங்கள் மற்றும் திரவம் சுரப்பது என்பதானது ரத்த நாளங்களுக்குள் இடைவெளிகள் உண்டாகி அவையே சருமத்தின் வழியாக திரவமாக ஒழுகுவதால் விளைவதாகும்; சருமத்தைக் குளிரச் செய்து விட்டால், இந்த நாளங்கள் குறுகி திரவம் சுரப்பதும் குறைந்து விடும். நஞ்சுப் படர்க்கொடிச் செடியை எரித்து அதன் புகையை சுவாசித்தால், இந்தத் தடிப்பானது நுரையீரல்களின் ஓரங்களில் ஏற்படும். அதனால் மிகுந்த வலியும், சில வேளைகளில் உயிருக்கு ஆபத்து விளைவிக்கும் அளவிற்கு சுவாசத்தில் சிரமும் நிகழக்கூடும்.[16] இந்த நஞ்சுப் படர்க்கொடிச் செடியை உட்கொண்டால், செரிமான உறுப்புகள், சுவாசப் பாதை, சிறுநீரகங்கள் அல்லது வேறு உறுப்புகளும் பாதிக்கப்படலாம். நஞ்சுப் படர்க்கொடியால் விளைந்த தோல் கரப்பான், அதன் தீவிரம் மற்றும் சிகிச்சையைப் பொறுத்து, ஒன்றிலிருந்து நான்கு வாரங்கள் வரை நீடிக்கும். சில அரிதான சமயங்களில், நஞ்சுப் படர்க்கொடியின் எதிர்விளைவுகளின் காரணமாக மருத்துவமனையில் சேர்ப்பதும் அவசியமாகலாம்.[13][17]
உருஷியால் பல வருடங்களுக்கு எண்ணெய்ச் செயற்பாட்டுடன் இருக்கக்கூடும். எனவே காய்ந்து உதிர்ந்த இலைகள் மற்றும் கொடிகளைத் தொடுவதும் கூட எதிர்விளைவை ஏற்படுத்தலாம். மேலும், செடியிலிருந்து மற்ற பொருள்களுக்கு மாறிய எண்ணெய் (செல்லப்பிராணிகளின் ரோமம் போன்றவை) இந்தப் பொருள் தோலுடன் தொடர்புறும் போது தோல் கரப்பானை உருவாக்கலாம்.[18][19] இந்த எண்ணெய் பட்ட ஆடைகள், கருவிகள் மற்றும் இதர பொருட்கள் ஆகியவற்றை, இது மேலும் பரவுவதைத் தடுக்கும் வண்ணம், நன்கு கழுவ வேண்டும். நஞ்சுப் படர்க்கொடிச் செடிக்கு மிகு உணர்வு கொண்டவர்கள் இதே போன்ற ஒரு அனுபவத்தை மாங்காய்களிடத்தும் பெறக்கூடும். மாங்காய்களும் நஞ்சுப் படர்க்கொடி சார்ந்த அதே (அனகார்டிகே) குடும்பத்தையே சார்ந்தவை; மாமரத்தின் சாறு மற்றும் மாங்காய்களின் தோல் உருஷியால் போன்ற ஒரு ரசாயனக் கலவை கொண்டதாகும்.[20]
இதனுடன் தொடர்புடைய வாச மலர்கள் பூக்கும் செடியான ரஸ் அரோமாட்டிகா அல்லது ஜப்பானிய லேக்கர் மரம் ஆகியவற்றைத் தொடும்போதும், சில சமயங்களில், இதைப் போன்ற எதிர்விளைவுகள் உருவாவதாக அறிவிக்கப்பட்டுள்ளது.
நஞ்சுப் படர்க்கொடிச் செடி ஒன்று மாற்றி ஒன்றாக இலைகளைக் கொண்டிருக்கும். இதன் பொருள் மூன்று-சிற்றிலைகள் முக்கியக் கிளையை ஒட்டி ஒன்று மாற்றி மற்றொன்றாக இருக்கும் என்பதாகும். மேபிள் (பாக்ஸ்-எல்டர் இதன் ஒரு வகையாகும்) மரம் நேர் மாறான இலைகளைக் கொண்டிருக்கும்; அடுத்த இலைத் தண்டு நேர் மாறாக இருப்பது பாக்ஸ்-எல்டர் செடியின் ஒரு இயல்பாகும்.
வெர்ஜினியா படர்க்கொடி மற்றும் நஞ்சுப் படர்கொடி ஆகிய இரண்டுமே பொதுவாக ஒன்றாகவே வளர்வன; இவை ஒரே மரத்தில் கூட வளரலாம். நஞ்சுப் படர்க்கொடியிடம் எந்த ஒவ்வாமை-எதிர்விளைவும் இல்லாதவர்கள் கூட வெர்ஜினியா படர்க்கொடியின் சாறில் இருக்கும் ஆக்ஸலேட் படிகங்களுக்கு ஒவ்வாமை-எதிர்விளைவுகளைக் கொண்டிருக்கக்கூடும் என்பதை நினைவில் கொள்க.
நஞ்சுப் படர்க்கொடி தன் சூழலின் ஈரத்தன்மை மற்றும் ஒளித்தன்மை ஆகியவற்றைப் பொறுத்து ஒன்று படர்க்கொடியைப் போல் வளரும் அல்லது புதராக கருவாலி-வகையைப் போல் வளரும் என்பதே இதன் காரணமாகும். இந்தப் படர்க்கொடி வகை குறைந்த சூரிய வெளிச்சத்துடன் கூடிய நிழலுள்ள பகுதிகளை விரும்புகிறது. இது அடிமரத்தைப் பற்றிக்கொண்டு ஏற முனைகிறது மற்றும் இது தரையிலும் மிகுந்த விரைவில் பரவக்கூடியது.
டாக்ஸிகோடென்ட்ரான் ரேடிகான்ஸ் (பாய்சன் ஐவி எனும் நஞ்சுப் படர்க்கொடி; இதன் பண்டைய பெயர்கள் ரஸ் டாக்ஸிகோடென்ட்ரான் , ரஸ் ரேடிகான்ஸ்) அனகார்ட்டிகே என்னும் குடும்பத்தைச் சார்ந்த ஒரு செடியாகும். இது பலருக்கும் சருமத்தில் அரிக்கும் ஒரு வெடிப்பை உருவாக்கும் உருஷியால் என்னும் ஒரு சரும எரிச்சலை ஏற்படுத்தும் எண்ணெய்ச் சுரப்பி என மிகுந்த அளவில் அறியப்படும் ஒரு காட்டுப் படர்க்கொடி வகையாகும்; இந்த நமைச்சல் உருஷியாலால்-தோற்றுவிக்கப்படும் தொற்றுத் தோல் அழற்சி என அறிவியற் சொல்லாக அறியப்படுகிறது. ஆனால் இந்தக்கொடி உண்மையான படர்க்கொடி (ஹெடெரா) அல்ல.
ಇದು ಟಾಕ್ಷಿಕೊಡೆಂಡ್ರಾನ್ ಅಂದರೆ ಸಸ್ಯಶಾಸ್ತ್ರದಲ್ಲಿ ಇದನ್ನು ವಿಷಕಾರಿ ಹರಿದ್ವರ್ಣ ಸಸ್ಯ ಜಾತಿಗೆ ಸೇರಿದ ಪೊದೆಯುಳ್ಳ ಕಂಟಿ ಎನ್ನಲಾಗುತ್ತದೆ.ರುಸ್ ಟಾಕ್ಷಿಕೊಡೆಂಡ್ರಾನ್ ,[೧]ರುಸ್ ರಾಡಿಕನ್ಸ್ ಇದು ಅತ್ಯಂತ ವಿಷಯುಕ್ತ ಬಳ್ಳಿಯ ಜಾತಿಯಾಗಿದೆ.ಅನಾಕರ್ಡಿ ಅಕೇಶಿಯಾ ಎಂಬ ಸಸ್ಯ ವರ್ಗಕ್ಕೆ ಇದು ಸೇರಿದ್ದು ಎಂದೂ ಹೇಳಲಾಗುತ್ತದೆ. ಇದು ಪೊದೆಯುಳ್ಳ ಬಳ್ಳಿ ಒಂದು ವಿಚಿತ್ರ ಮತ್ತು ಹಾನಿಕಾರಕ ರಸ ಸೃವಿಸುವ ಸಾಮರ್ಥ್ಯ ಹೊಂದಿದೆ.ಇದರ ತಗಲುವಿಕೆಯು ಮನುಷ್ಯರ ಚರ್ಮದ ಮೇಲೆ ತುರಿಕೆ ಅಥವಾ ನವೆಯುಂಟಾಗಿ ಅಲ್ಲಿಚರ್ಮಕ್ಕೆ ಬಿರುಕು ಉಂಟಾಗುವ ಸಾಧ್ಯತೆ ಇದೆ.ತಂತ್ರಜ್ಞಾನದ ಪ್ರಕಾರ ಇದು ಯುರಿಶಿಯಲ್ ಸಂಪರ್ಕದಿಂದಾಗಿ ಮನುಷ್ಯನ ಚರ್ಮದ ಮೇಲ್ಪದರದ ಮೇಲೆ ಪರಿಣಾಮ ಬೀರುತ್ತದೆ.ಆದರೆ ಇದು ನಿಜವಾದ ಹಸಿರುಜಾತಿ ಹೆಡೆರಾ ಸಸ್ಯವಲ್ಲ.
ವಿಷಯುಕ್ತ ಹಸಿರು ಸಸ್ಯವು ಉತ್ತರ ಅಮೆರಿಕದಾದ್ಯಂತ,ಕೆನೆಡಿಯನ್ ಮೇರಿಟೈಮ್ ಪ್ರಾಂತ್ಯಗಳಾದ ಕ್ವುಬೆಕ್ ಮತ್ತು ಒಂಟಾರಿಯೊ,ಅಲ್ಲದೇ U.S.ನ ಎಲ್ಲಾ ರಾಜ್ಯಗಳು ಪೂರ್ವದ ಬಂಡೆಗಳು ಅಂದರೆ ಉತ್ತರ ಡಕೊಟಾ ಬಿಟ್ಟರೆ ಮತ್ತೆ ಮೆಕ್ಷಿಕೊ ಸುತ್ತಮುತ್ತ(1,500 m (4,900 ft)ಕ್ಯಾಕ್ವಿಸ್ಟಲೆ ಅಥವಾ ಕ್ಯಾಕ್ಷಿಸ್ಟಲ್ ನಹಾಯುತ್ ಪದ ನೋಡಿ),ಇದು ಸಾಮಾನ್ಯವಾಗಿ ಅರಣ್ಯ ಪ್ರದೇಶದ ಅಂಚಿನ ಭಾಗದಲ್ಲಿ ಬೆಳೆಯುತ್ತದೆ. ಇದು ಬಯಲು ತೆರೆದ ಬಂಡೆ ಪ್ರದೇಶಗಳು ಮತ್ತು ಬಯಲು ವಿಶಾಲ ಜಾಗೆ ಮತ್ತು ಫಲವತ್ತಾಗಿರದ ಜಮೀನಿನಲ್ಲಿ ಕಾಣಬರುತ್ತದೆ. ಇದನ್ನು ಅರಣ್ಯದ ಸಸ್ಯವೆಂದೂ ಬೆಳೆಸಲಾಗುತ್ತದೆ.ಮರಗಳ ನೆರಳಲ್ಲೂ ಇದು ಬೆಳೆಯುವ ಸಾಮರ್ಥ್ಯ [೧]ಪಡೆದಿದೆ. ಹೊಸ ಇಂಗ್ಲೆಂಡಿನ ಉಪಪ್ರಾಂತ್ಯ ಮತ್ತು ಸಾಮಾನ್ಯ ಭೂ ಪ್ರದೇಶ ಮಧ್ಯ ಅಟ್ಲಾಂಟಿಕ್ ಮತ್ತು ಯುನೈಟೆಡ್ ಸ್ಟೇಟ್ಸ್ ನ ವಾಯುವ್ಯ ಭಾಗಗಳಲ್ಲಿ ಯಥೇಚ್ಛವಾಗಿ ಬೆಳೆಯುತ್ತದೆ. ಇದೇ ತೆರನಾದ ಸಸ್ಯಜಾತಿಗಳು ವಿಷಯುಕ್ತ-ಯೋಕ್ ಮತ್ತು ಟಾಕ್ಷಿಕೊಡೆಂಡ್ರಾನ್ ರಿಡ್ ಬೆರ್ಗಿಲ್ ಸಸ್ಯ ಜಾತಿಯ ಬಳ್ಳಿಗಳು ಉತ್ತರ ಅಮೆರಿಕಾದ ಪಶ್ಚಿಮ ಭಾಗದಲ್ಲಿ ಕಂಡುಬರುತ್ತವೆ. ವಿಷಯುಕ್ತ ಹಸಿರು ಸಸ್ಯವು ಅಕ್ಷಾಂಶಗಳ 1,500 m (4,900 ft)ಮೇಲ್ಭಾಗದಲ್ಲಿ ಬೆಳೆಯುತ್ತದೆ,ಅಕ್ಷಾಂಶ ಮತ್ತು ರೇಖಾಂಶಗಳ ಎತ್ತರ ಪ್ರಮಾಣವು ಆಯಾ ಸ್ಥಳೀಯತೆಯನ್ನು ಆಧರಿಸಿ ವ್ಯತ್ಯಾಸ [೧]ಹೊಂದುತ್ತಿರುತ್ತದೆ. ಈ ಸಸ್ಯವು ಒಂದು ಪೊದೆ ಅಥವಾ ಕಂಟಿ ಬೇಲಿಯಷ್ಟು 1.2 metres (3.9 feet)ಎತ್ತರಕ್ಕೆ ಬೆಳೆದು ಹಬ್ಬಬಲ್ಲದು,ಇದರ ಬೆಳವಣಿಗೆಯಿಂದ ಕೆಳಭಾಗದ ಪ್ರದೇಶ ಕೂಡಾ ಕಾಣದಷ್ಟು ಇದು 10–25 cm (3.9–9.8 in)ಅಕ್ಕ ಪಕ್ಕದ ಆಸರೆಯೊಂದಿಗೆ ಪಸರಿಸುತ್ತದೆ. ಇದರ ಹಳೆಯ ಬಳ್ಳಿಯ ಕವಲುಗಳು ಹೇಗೆ ಹರಡಿಕೊಂಡಿರುತ್ತವೆ ಎಂದರೆ ಇದು ಸುತ್ತಿಕೊಂಡ ಮರವೇ ಇದಾಗಿದೆ ಎಂದು ಭಾಸವಾಗುತ್ತದೆ.
ಇದು ಮಣ್ಣಿನ ಆರ್ದ್ರತೆಗೆ ಅಷ್ಟಾಗಿ ಪ್ರತಿಕ್ರಿಯಿಸುದಿಲ್ಲವಾದರೂ ಇದು ಮರಭೂಮಿ ಅಥವಾ ಒಣ ಭೂಪ್ರದೇಶದಲ್ಲಿ ಹವಾಮಾನ ಪರಿಸ್ಥಿತಿಯಲ್ಲಿ ಬೆಳೆಯಲಾರದು. ಇದು ವಿಶಾಲ ಮತ್ತು ವಿಭಿನ್ನ ಜಾತಿಯಮಣ್ಣಿನ ಪ್ರದೇಶದಲ್ಲಿ ಬೆಳೆಯುತ್ತದೆ.ಮಣ್ಣುpH 6.0ಯಿಂದ (ಆಮ್ಲಿಕ) 7.9(ಸಾಮಾನ್ಯ ಅಲ್ಕಲೈನ್ ) ಆಗಾಗ ಪ್ರವಾಹಕ್ಕೀಡಾಗುವ ಪ್ರದೇಶ ಮತ್ತುಹಿನ್ನೀರಿನ ಜವಳು ಪ್ರದೇಶದಲ್ಲಿಯೂ ಇದು [೧]ಬೆಳೆಯುತ್ತದೆ.
.ಯುರೊಪಿಯನ್ ರು ಉತ್ತರ ಅಮೆರಿಕಾದಲ್ಲಿ ಮೊದಲು ಪ್ರವೇಶ ಮಾಡಿದಾಗಿನ ಅವಧಿಗಿಂತ ಇದು ಈಗ ಸಾಮಾನ್ಯವಾಗಿ ಹೆಚ್ಚಿನ ಪ್ರಮಾಣದಲ್ಲಿ ಬೆಳೆಯುತ್ತಿದೆ. ರಿಯಲ್ ಎಸ್ಟೇಟ್ ಉದ್ಯಮಿಗಳು ಯೋಜನಾ ಪ್ರದೇಶಕ್ಕೆ ಹೊಂದಿಕೊಂಡ ಜಾಗ,ಅಲ್ಲದೇ ಅಭಿವೃದ್ಧಿ ಕಾಣದ ಪ್ರದೇಶಗಳು ಇದರ ಬೆಳೆಯಿಂದ "ಅಪಾಯದ ಪರಿಣಾಮಗಳ ಅಂಚಿಗೆ" ಹೋಗಬಹುದು. ಯಾಕೆಂದರೆ ಈ ವಿಷಯುಕ್ತ ಹಸಿರು ಸಸ್ಯ ವಿಶಾಲವಾಗಿ ಬೆಳೆದು ಹಸಿರು ಪೊದೆಯನ್ನೇ ನಿರ್ಮಿಸುತ್ತವೆ. ಇದು U.Sನ ಮಿನ್ನೊಸ್ಟಾ ಮತ್ತು ಮಿಚಿಗೆನ್ ಮತ್ತು ಒಂಟಾರಿಯೊದ ಕೆನಡಿಯನ್ ಪ್ರದೇಶಗಳಲ್ಲಿ ಇದನ್ನು ಆರೋಗ್ಯಕ್ಕೆ ಹಾನಿಯನ್ನುಂಟು ಮಾಡುವ ಅಪಾಯಕಾರಿ ಕಸದ ಹುಲ್ಲು ಎನ್ನಲಾಗುತ್ತದೆ.
ವಿಷಯುಕ್ತ ಹಸಿರು ಸಸ್ಯ ಮತ್ತು ಅದಕ್ಕೆ ಸಮಾನ ಸಸ್ಯಗಳು ಯುರೋಪಿನಲ್ಲಿ ಅಪರಿಚಿತವಾಗಿಯೇ ಉಳಿದುಕೊಂಡಿವೆ. U.S ಮತ್ತು ಕೆನಡಾದಲ್ಲಿರುವ ಹಲವಾರು ಯುರೋಪಿಯನ್ ರು ಇಂತಹ ಆರೋಗ್ಯಕ್ಕೆ ಹಾನಿಕಾರಕ ಸಸ್ಯವೊಂದು ನಮ್ಮ ಭೂಖಂಡದಲ್ಲಿ ಇಷ್ಟೊಂದು ಸಾಮಾನ್ಯವಾಗಿ ಬೆಳೆಯುತ್ತದಯೇ ಎಂದು ಆಶ್ಚರ್ಯ ವ್ಯಕ್ತಪಡಿಸುತ್ತಾರೆ.
ಇದರ ಉದುರುವ ಎಲೆಗಳು ವಿಷಯುಕ್ತ ಹಸಿರು ಬಾದಾಮಿ ಆಕಾರದಮೂರು ಎಲೆಗಳನ್ನು ಪಡೆದಿದ್ದು ಇದು ಮೂರು ಅಂಚುಗಳಲ್ಲಿ ಬೆಳೆದು ತನ್ನ ಎಲೆ ಭಾಗಗಳನ್ನು [೧]ಚಾಚಿಕೊಂಡಿರುತ್ತದೆ. ಎಲೆಗಳ ಬಣ್ಣವು ಸಾಮಾನ್ಯವಾಗಿ ತಿಳಿ ಹಸಿರು(ಸಾಮಾನ್ಯವಾಗಿ ಎಳೆ ಎಲೆಗಳು) ವರ್ಣದಿಂದ ಕಪ್ಪು ಹಸಿರು(ಮಾಗಿದ ಎಲೆಗಳು),ಉದುರುವ ಹೊತ್ತಿಗೆ ಅವು ಕಡುಕಪ್ಪು ಬಣ್ಣದ್ದಾಗಿರುತ್ತವೆ;ಇನ್ನು ಕೆಲವು ಮೂಲಗಳ ಪ್ರಕಾರ ಎಲೆಗಳು ದೊಡ್ದದಾಗುವಾಗ ಕೆಂಪು,ಮಾಗುವ ಅವಧಿಯಲ್ಲಿ ಹಸಿರು ಮತ್ತೆ ಮರಳಿ ಕೆಂಪು ಮತ್ತು ಕಿತ್ತಳೆ ಅಥವಾ ಹಳದಿಯಾಗಿ ಬಿದ್ದು ಹೋಗುತ್ತವೆ. ಮಾಗಿದ ಎಲೆಗಳು ಕೊಂಚ ಮಿಂಚಿನ ಹೊಳಪನ್ನು ಹೊಂದಿರುತ್ತವೆ. ಸಾಮಾನ್ಯವಾಗಿ ಎಲೆಗಳು 3 ರಿಂದ 12 ಸೆಂಟಿ ಮೀಟರ್ ಉದ್ದ,ಅಪರೂಪವೆನ್ನುವಂತೆ 30 ಸೆಂಟಿಮೀಟರ್ ವರೆಗೂ ಉದ್ದವಾಗಿರುತ್ತವೆ. ಪ್ರತಿಯೊಂದು ಬಿಡಿ ಎಲೆ ಅಥವಾ ಚಿಗುರೆಲೆ ತನ್ನ ಅಂಚಿನಲ್ಲಿ ಒಂದೆರೆಡು ಹಲ್ಲಿನಂತಹ ಎಳೆ ಹೊಂದಿರುತ್ತದೆ,ಆದರೆ ಅದರ ಮೇಲ್ಭಾಗ ಮೆದುವಾಗಿರುತ್ತದೆ. ಬಿಡಿ ಎಲೆಗಳ ಸೂಡು ಅಥವಾ ಗುಂಪು ಪೊದೆ ಮೇಲೆ ಪರ್ಯಾಯವಾಗಿ ಪಸರಿಸಿರುತ್ತದೆ,ಆದರೆ ಇಲ್ಲಿ ಮುಳ್ಳು ಇರುವುದಿಲ್ಲ. ಮರದ ಕೊಂಬೆ ಮೇಲೆ ಬೆಳೆಯುವ ಬಳ್ಳಿಯು ತನ್ನ ಬೇರುಗಳನ್ನು ಬಿಗಿಯಾಗಿ ಚಾಚುವ ಮೂಲಕ ಸುತ್ತಮುತ್ತಲೂ [೨]ಹಬ್ಬಿರುತ್ತದೆ. ಈ ಬಳ್ಳಿಯು ಬೆಳವಣಿಗೆಗೆ ಅನುಕೂಲಕರವಾಗಿ ಬೇರುಗಳನ್ನು ಬಿಡುತ್ತದೆ,ಅಥವಾ ಈ ಸಸ್ಯವುಕಾಂಡದ ಬೇರುಗಳ ಮೂಲಕ ಕೆಳಗಿನಿಂದ ಬೇರುಗಳ ಕವಚವನ್ನು ಬೆಳೆಸುತ್ತದೆ. ಈ ಹಸಿರು ಸಸ್ಯದ ಹಾಲಿನಂತಹ ಗಟ್ಟಿ ವಿಷವು ಗಾಳಿಗೆ ತೆರೆದುಕೊಂಡ ನಂತರ ಕಪ್ಪು ಬಣ್ಣಕ್ಕೆ ತಿರುಗಿಕೊಳ್ಳುತ್ತದೆ.
ವಿಷಯುಕ್ತ ಹಸಿರು ಸಸ್ಯವು ಸಸ್ಯಜಾತಿಯಾಗಿ ಮತ್ತು ತನ್ನ ಸಂತತಿ ವೃದ್ಧಿಸಲು ನಿರಂತರವಾಗಿ ಹಬ್ಬುತ್ತಿರುತ್ತದೆ. ವಿಷಯುಕ್ತ ಹಸಿರು ಸಸ್ಯವು ವಿಭಿನ್ನ ಲಿಂಗಿಯಾಗಿದ್ದು,ಮೇ ತಿಂಗಳಿಂದ ಜುಲೈ ವರೆಗೆ ಹೂ ಬಿಡುವುದು ಮತ್ತು ಪರಾಗಸ್ಪರ್ಶಕ್ಕೆ ಅಣಿಯಾಗುತ್ತದೆ. ಹಳದಿ-ಅಥವಾ ಹಸಿರು ಮಿಶ್ರಿತ ಬಿಳಿ ಬಣ್ಣದಹೂವುಗಳು ಕಾಂತಿಹೀನವಾಗಿರುತ್ತವೆ.ಎಲೆಗಳ ಸೂಡಿನ ಮೇಲ್ಭಾಗದಲ್ಲಿ ಸುಮಾರು ಎಂಟು ಸೆಂಟಿಮೀಟರ್ ನಷ್ಟು ಮೇಲೆ ಚಾಚಿರುತ್ತವೆ. ಬೆರ್ರಿ ಹಣ್ಣಿನಂತಹ ಒಂದು ಗೊರಟೆ ಕಾಯಿ ಅಥವಾ ಓಟೆಯು ಆಗಷ್ಟ್ ನಿಂದ ನವೆಂಬರ್ ಹೊತ್ತಿಗೆ ನೇರಳೆ-ತಿಳಿ ಬಿಳುಪಿನ [೧]ಹಣ್ಣಾಗುತ್ತದೆ. ಇದರ ಹಣ್ಣುಗಳು ಚಳಿಗಾಲದಲ್ಲಿ ಹಲ್ವು ಪಕ್ಷಿ ಪ್ರಾಣಿಗಳ ನೆಚ್ಚಿನ ಆಹಾರವೆನಿಸಿವೆ. ಇದರ ಬೀಜಗಳು ಬಹುತೇಕವಾಗಿ ಪ್ರಾಣಿಗಳಿಂದ ಪಸರಿಸುತ್ತವೆ.ಪ್ರಾಣಿಗಳ ಜೀರ್ಣಕ್ರಿಯೆಯ ನಂತರ ಇವು ವಿವಿಧ ಜಾಗೆಗಳಲ್ಲಿ ಬೆಳೆಯಲು ಅನುಕೂಲವಾಗುತ್ತವೆ.
ಈ ಕೆಳಗಿನ ಮೂರು ಗುಣಲಕ್ಷಣಗಳ ಮೂಲಕ ಈ ವಿಷಯುಕ್ತ ಹಸಿರು ಸಸ್ಯವನ್ನು ಗುರ್ತಿಸಬಹುದಾಗಿದೆ: ಮೂರು ಎಲೆಗಳ ಸೂಡು,ಪರ್ಯಾಯ ಎಲೆಗಳ ವ್ಯವಸ್ಠೆ ಮತ್ತು ಮುಳ್ಳುಗಳಿಲ್ಲದಿರುವುದು. ಆದಾಗ್ಯೂ ಅಸಂಖ್ಯಾತ ಇತರ ಸಸ್ಯಗಳು ಇದೇ ತೆರನಾಗಿದ್ದುದು ಕಂಡು ಬರುತ್ತವೆ,ಇಂತಹದೇ ಗುಣಗಳಿರುವ ಸಸ್ಯ ಸಂಕುಲಗಳಿಗೆ ಹೆದರಿಕೊಳ್ಳಬೇಕಾಗುತ್ತದೆ.ಇದಕ್ಕಾಗಿ ಅಪರಿಚಿತ ಸಸ್ಯಗಳನ್ನು ಗುರ್ತಿಸಿ ವಿಷಯುಕ್ತ ಹಸಿರು ಸಸ್ಯಗಳ ಬಗ್ಗೆ ಎಚ್ಚರದಿಂದ ಇರಬೇಕಾಗುತ್ತದೆ. ಅನುಭವಸ್ಥ ಜನರು ಈ ಎಲೆಗಳಿಂದ ಹಾನಿಯಾಗುವುದನ್ನು ಹೇಳುತ್ತಾರೆ,ಚಳಿಗಾಲದಲ್ಲಿ ಎಲೆಗಳಿಲ್ಲದ ಈ ಸಸ್ಯವು ಬೋಳು ಬೋಳಾಗಿದ್ದರೂ ಮತ್ತೆ ಚಿಗುರಿಕೊಳ್ಳುತ್ತದೆ,ಪರಿಸರ ಮತ್ತು ಸಂತತಿ ವೃದ್ಧಿಗೆ ನೆರವಾಗುತ್ತದೆ.
ಹಲವಾರು ರಾಸಾಯನಿಕ ನಿಯಮಗಳು ವಿಶಯುಕ್ತ ಹಸಿರು ಸಸ್ಯದ ಗುಣಲಕ್ಷಣಗಳನ್ನು ಗೋಚರಿಸುವಿಕೆಯಿಂದಲೇ ಕಂಡು ಹಿಡಿದು [೩]ಬಿಡುತ್ತಾರೆ.
!" appearance.ವಿಷಯುಕ್ತ ಹಸಿರು ಸಸ್ಯದ ಬಳ್ಳಿಗಳು ಮರದ ಮೇಲೆ ಒಂದು ತೆರನಾದ "ಮಿಂಚನ್ನು" ಹೊಂದಿರುತ್ತವೆ. ಈ ಬಳ್ಳಿಯ ಸುತ್ತುವರಿಕೆಯು ಮರ ಹತ್ತುವವರಿಗೆ ಒಂದು ಎಚ್ಕರಿಕೆಯಾಗಿರುತ್ತದೆ.
ಈ ವಿಷಯುಕ್ತ ಹಸಿರು ಸಸ್ಯವು ಉರುಶಿಯೊಲ್ -ಸಂಪರ್ಕವು ಚರ್ಮದ ಒಳಭಾಗಕ್ಕೆ ಪ್ರವೇಶಿಸಿ ಅಲರ್ಜಿ ಪ್ರತಿಕ್ರಿಯೆಯನ್ನು ಉಂಟು ಮಾಡಬಹುದು. ಸುಮಾರು 15%[೮] ರಿಂದ 30%[೯]ರಷ್ಟು ಜನರು ಯಾವುದೇ ಅಲರ್ಜಿಗೆ ಒಳಗಾಗುವದಿಲ್ಲ, ಆದರೆ ಪದೇ ಪದೇ ಈ ಸಸ್ಯದ ಎಲೆಗಳೊಂದಿಗೆ ಸಂಪರ್ಕಕ್ಕೆ ಬರುವುದರಿಂದ ಅಥವಾ ಉರುಶಿಯೊಲ್ ನೊಂದಿಗೆ ಒಡ್ದಿಕೊಂಡರೆ ಇದು ಸಂವೇದನಾ ಶೀಲತೆಗೆ ಧಕ್ಕೆ ಯನ್ನುಂಟು ಮಾದಬಹುದು. Reactions can progress to ಇದರ ಪ್ರತಿಕ್ರಿಯೆಗಳು ಅಥವಾ ಅತಿ ಸಂವೇದನೆ ಶೀಲತೆಯಿಂದ ಊತಕ್ಕೆ ಕಾರಣವಾಗಬಹುದು.
ಇದರೊಳಗಿನ ಉರುಶಿಯೊಲ್ ಚರ್ಮದ ಸ6ಪರ್ಕಕ್ಕೆ ಬಂದ ನಂತರ ಅಲ್ಲಿ ತನ್ನ ಬಿಗಿಯನ್ನು ಸಾಧಿಸುತ್ತದೆ,ಇದರಿಂದಾಗಿ ನವೆಯ ವಿಪರೀತಗಳಿಂದಾಗಿ ಆ ಜಾಗೆಯಲ್ಲಿ ಕೆಂಪು ಬಣ್ಣದ ಚರ್ಮ ಉಂಟಾಗಿ ಉರಿತ ಅಥವಾ ಯಾವುದೇ ಬಣ್ಣ ಬರದಿದ್ದರೂ ಗುಳ್ಳೆ ಆಕಾರ ಪಡೆಯಬಹುದಾಗಿದೆ.ಇದು ಉಜ್ಜುವುದರಿಂದಾಗಿ ಒಂದು ಬೊಕ್ಕೆಗೆ ದಾರಿ ಮಾಡಿಕೊಡುತ್ತದೆ. ಇದನ್ನು ಕ್ಯಾಲಾಮೈನ್ ಮುಲಾಮಿನಿಂದ ಇದನ್ನು ಚಿಕಿತ್ಸೆ [೧೦]ಮಾಡಬಹುದಾಗಿದೆ.ಬುರೊಸ್ ಪರಿಹಾರಗಳು ಅಥವಾ ಸ್ನಾನ ಮಾಡುವುದರಿಂದ ಇದನ್ನು ಹೋಗಲಾಡಿಸುವ ಸಾಧ್ಯತೆ ಇದೆ.ಆದರೆ ಕೆಲವು ಸಂಪ್ರದಾಯಿಕ ಔಷಧಿಗಳು ಅಷ್ಟಾಗಿ [೧೧][೧೨]ಪರಿಣಾಮಕಾರಿಯಲ್ಲ. ಈ ವಿಷಯುಕ್ತ ಹಸಿರು ಸಸ್ಯದ ನವೆ ಮತ್ತು ದುಷ್ಪರಿಣಾಮಗಳಿಗೆ ವೈದ್ಯರು ನವೆ ನಿವಾರಣೆಗೆ ಸರಳವಾಗಿ ಅಂದರೆ ಒಟಾಮೀಲ್ ಸ್ನಾನ ಮತ್ತು ಅಡಿಗೆ ಸೋಡಾವನ್ನು ಬಳಸುವಂತೆ ಸಲಹೆ ಶಿಫಾರಸು [೧೩]ಮಾಡುತ್ತಾರೆ. ಹಲವಾರು ಗಂಭೀರ ಪ್ರಕರಣಗಳಲ್ಲಿ ಈ ಬಳ್ಳಿಯಿಂದ ಹೊರ ಭಾಗದಲ್ಲಿ ಸುರಿಯುತ್ತಿರುತ್ತದೆ.ಈ ಸಂದರ್ಭದಲ್ಲಿಸ್ಟಿರೊಯಿಡ್ ಅಥವಾ ಹಾರ್ಮೋನ್ ಗಳನ್ನು ಇದರ ಗುಣಮುಖ ಮಾಡಲು ಬಳಸಲಾಗುತ್ತದೆ.
ಇದರಿಂದ ಉತ್ಪತ್ತಿಯಾದ ದೃವವು ಗುಳ್ಳೆಗಳಿಗೆ ಕಾರಣವಾದರೂ ಇದು ವಿಶವನ್ನು [೧೪][೧೫][೧೬]ಪಸರಿಸುವುದಿಲ್ಲ. ಚರ್ಮದ ಮೇಲಿನ ಕೆಲವು ಸೂಕ್ಷ್ಮ ಜಾಗಗಳಲ್ಲಿ ಈ ದೃವವು ಅಂಟಿಕೊಂಡರೆ ಇದರ ವಿಷದ ತೀವ್ರತೆಯು ಅಧಿಕವಾಗಿರುತ್ತದೆ.ಬೇರೆ ಬೇರೆ ಜಾಗಗಳಲ್ಲಿ ಇದು ಅಂಟಿಕೊಂಡಿದ್ದರೂ ಮೂಲ ವಿಷಪ್ರಮಾಣದಷ್ಟು ಅಪಾಯಕಾರಿ [೧೪]ಎನಿಸದು. ಚರ್ಮದ ಗುಳ್ಳೆಗಳು ಉರಿ ಹಾಗು ಕೆಂಪಾದ ಚರ್ಮದ ರಾಶ್ ಕಾರಣವಾಗುತ್ತವೆ,ಇವುಗಳ ಮಧ್ಯ ಉಂಟಾದ ಜಾಗದಲ್ಲಿ ಸಣ್ಣಗೆ ದೃವ ಸೃವಿಸುತ್ತದೆ,ಇದು ಚರ್ಮದ ಮೂಲಕ ಸಂಪರ್ಕಕ್ಕೆ ಬರುವಾಗ ಉರಿತ ಬರುತ್ತದೆ ಇದನ್ನು ತಕ್ಷಣದಲ್ಲಿ ತಂಪುಗೊಳಿಸಿದರೆ ಇದು ಶಮನವಾಗುವುದು. ಈ ವಿಷಯುಕ್ತ ಹಸಿರು ಸಸ್ಯವನ್ನು ಸುಟ್ಟರೆ ಇದರ ಹೊಗೆಯಿಂದ ಉಂಟಾಗುವ ಮಾಲಿನ್ಯವು ಗಂಟಲೊಳಗೆ ಪ್ರವೇಶಿಸಿ ಶ್ವಾಸನಾಳದ ಮೇಲೆ ಪರಿಣಾಮ ಬೀರಬಹುದಾಗಿದೆ.ಇದರಿಂದ ಅತೀವ ನೋವು ಮತ್ತು ಗಂಭೀರ ಉಸಿರಾಟದ ತೊಂದರೆ [೧೭]ಕಾಣಿಸಿಕೊಳ್ಳಬಹುದು. ವಿಷಯುಕ್ತ ಹಸಿರು ಸಸ್ಯವನ್ನು ತಿಂದರೆ ಜೀರ್ಣಾಂಗ,ಉಸಿರಾಟದ ಮಾರ್ಗ,ಮೂತ್ರಕೋಶಗಳು ಅಥವಾ ಇನ್ನಿತರ ಅವಯವಗಳು ತೀವ್ರ ಹಾನಿಗೀಡಾಗುತ್ತವೆ. ವಿಷಯುಕ್ತ ಹಸಿರು ಸಸ್ಯದ ಚರ್ಮದ ಮೇಲಿನ ಇದರ ಪರಿಣಾಮವು ಒಂದು ವಾರದಿಂದ ನಾಲ್ಕು ವಾರಗಳ ಅವಧಿಯಲ್ಲಿ ಕಾಣಿಸಬಹುದಾಗಿದೆ.ಇದರ ಗಂಭೀರತೆಯನ್ನು ಪರಿಗಣಿಸಿ ಔಷಧೋಪಚಾರ ಮಾಡಬಹುದಾಗಿದೆ. ಕೆಲವು ಅಪರೂಪದ ಪ್ರಕರಣಗಳಲ್ಲಿ ವಿಷಯುಕ್ತ ಹಸಿರು ಸಸ್ಯದ ಪ್ರತಿಕ್ರಿಯೆಗಳು ಆಸ್ಪತ್ರೆಗೆ ದಾಖಲಿಸುವ ಪ್ರಸಂಗವೂ [೧೪][೧೮]ಬರಬಹುದು.
ಉರುಶಿಯೊಲ್ ಎಣ್ಣೆಯು ಹಲವಾರು ವರ್ಷಗಳ ಕಾಲ ಕ್ರಿಯಾತ್ಮಕವಾಗಿರುತ್ತದೆ.ಕಳಚಿದ ಎಲೆಗಳ ಅಥವಾ ಬಳ್ಳಿಯನ್ನು ಮುಟ್ಟುವುದರಿಂದ ವ್ಯತಿರಿಕ್ತ ಪರಿಣಾಮ ಉಂಟಾಗಬಹುದು. ಅದೂ ಅಲ್ಲದೇ ಪ್ರಾಣಿಗಳ ಮೂಲಕ ಪಸರಿಸುವ ಈ ವಿಷಯುಕ್ತ ದೃವವು ಚರ್ಮದ ಮೇಲೆ ಗೆರೆಯಂತಹ ಗುರುತುಗಳನ್ನು [೧೯][೨೦]ಮೂಡಿಸುತ್ತದೆ. ಬಟ್ಟೆ,ಸಲಕರಣೆಗಳು ಮತ್ತು ಇನ್ನಿತರ ವಸ್ತುಗಳು ಎಣ್ಣೆ ತಗಲುವುದರಿಂದ ಅಥವಾ ಅದಕ್ಕೆ ಒಡ್ದುವುದರಿಂದ ಇದು ದುಷ್ಪರಿಣಾಮ ಉಂಟು ಮಾಡುತ್ತದೆ.ಇದರ ಅವಘಡ ತಪ್ಪಿಸಲು ಮೊದಲೇ ಸ್ವಚ್ಚಗೊಳಿಸಿದರೆ ಉತ್ತಮ. ಈ ವಿಷಯುಕ್ತ ಹಸಿರು ಸಸ್ಯದ ಸಂವೇದನಾಶೀಲವು ಮಾವಿನ ಹಣ್ಣಿನಿಂದ ಉಂಟು ಮಾಡುವ ಪರಿಣಾಮವೇ ಇದರಿಂದ ಉಂಟಾಗುತ್ತದೆ. ಮಾವಿನ ಕಾಯಿಗಳು ಕೂಡಾ ಅನಕಾರ್ಡಿಎಸಿಯಾ ಜಾತಿಗೆ ಸೇರಿದ ಸಸ್ಯ ವರ್ಗವಾಗಿದೆ.ಉರೊಶಿಯೊಲ್ ನಂತಹ ರಾಸಾಯನಿಕ ಪರಿಣಾಮವನ್ನುಂಟು [೨೧]ಮಾಡುತ್ತದೆ.
ಸುಮ್ಯಾಕ್ ಸಸ್ಯದ ಸುವಾಸನಾಯುಕ್ತರುಸ್ ಅರೊಮ್ಯಾಟಿಕ್ ಅಥವಾ ಜಪಾನಿನ ಲ್ಯಾಕರ್ ಗಿಡದ ವಿಷಯುಕ್ತ ಹಸಿರು ಸಸ್ಯದ ಗುಣವನ್ನೇ ಹೋಲುತ್ತದೆ.ಇವುಗಳ ಸಂಪರ್ಕದಿಂದಲೂ ಚರ್ಮಕ್ಕೆ ಹಾನಿಯಾಗುವ ಸಾಧ್ಯತೆ ಇದೆ.
|title= at position 27 (help) |accessdate= (help) ಇದು ಟಾಕ್ಷಿಕೊಡೆಂಡ್ರಾನ್ ಅಂದರೆ ಸಸ್ಯಶಾಸ್ತ್ರದಲ್ಲಿ ಇದನ್ನು ವಿಷಕಾರಿ ಹರಿದ್ವರ್ಣ ಸಸ್ಯ ಜಾತಿಗೆ ಸೇರಿದ ಪೊದೆಯುಳ್ಳ ಕಂಟಿ ಎನ್ನಲಾಗುತ್ತದೆ.ರುಸ್ ಟಾಕ್ಷಿಕೊಡೆಂಡ್ರಾನ್ ,ರುಸ್ ರಾಡಿಕನ್ಸ್ ಇದು ಅತ್ಯಂತ ವಿಷಯುಕ್ತ ಬಳ್ಳಿಯ ಜಾತಿಯಾಗಿದೆ.ಅನಾಕರ್ಡಿ ಅಕೇಶಿಯಾ ಎಂಬ ಸಸ್ಯ ವರ್ಗಕ್ಕೆ ಇದು ಸೇರಿದ್ದು ಎಂದೂ ಹೇಳಲಾಗುತ್ತದೆ. ಇದು ಪೊದೆಯುಳ್ಳ ಬಳ್ಳಿ ಒಂದು ವಿಚಿತ್ರ ಮತ್ತು ಹಾನಿಕಾರಕ ರಸ ಸೃವಿಸುವ ಸಾಮರ್ಥ್ಯ ಹೊಂದಿದೆ.ಇದರ ತಗಲುವಿಕೆಯು ಮನುಷ್ಯರ ಚರ್ಮದ ಮೇಲೆ ತುರಿಕೆ ಅಥವಾ ನವೆಯುಂಟಾಗಿ ಅಲ್ಲಿಚರ್ಮಕ್ಕೆ ಬಿರುಕು ಉಂಟಾಗುವ ಸಾಧ್ಯತೆ ಇದೆ.ತಂತ್ರಜ್ಞಾನದ ಪ್ರಕಾರ ಇದು ಯುರಿಶಿಯಲ್ ಸಂಪರ್ಕದಿಂದಾಗಿ ಮನುಷ್ಯನ ಚರ್ಮದ ಮೇಲ್ಪದರದ ಮೇಲೆ ಪರಿಣಾಮ ಬೀರುತ್ತದೆ.ಆದರೆ ಇದು ನಿಜವಾದ ಹಸಿರುಜಾತಿ ಹೆಡೆರಾ ಸಸ್ಯವಲ್ಲ.
Toxicodendron radicans, commonly known as eastern poison ivy[1] or poison ivy, is an allergenic Asian and Eastern North American flowering plant in the genus Toxicodendron. The species is well known for causing urushiol-induced contact dermatitis, an itchy, irritating, and sometimes painful rash, in most people who touch it. The rash is caused by urushiol, a clear liquid compound in the plant's sap.[2] The species is variable in its appearance and habit, and despite its common name, it is not a true ivy (Hedera), but rather a member of the cashew and pistachio family (Anacardiaceae). T. radicans is commonly eaten by many animals and the seeds are consumed by birds,[3] but poison ivy is most often thought of as an unwelcome weed. It is a different species from western poison ivy, T. rydbergii, which has similar effects.
Numerous subspecies and/or varieties of T. radicans are known.[4] They can be found growing in any of the following forms, all having woody stems:
The deciduous leaves of T. radicans are trifoliate with three almond-shaped leaflets.[5] Leaf color ranges from light green (usually the younger leaves) to dark green (mature leaves), turning bright red in fall; though other sources say leaves are reddish when expanding, turn green through maturity, then back to red, orange, or yellow in the fall. The leaflets of mature leaves are somewhat shiny. The leaflets are 3–12 cm (1+1⁄4–4+3⁄4 in) long, rarely up to 30 cm (12 in). Each leaflet has a few or no teeth along its edge, and the leaf surface is smooth. Leaflet clusters are alternate on the vine, and the plant has no thorns. Vines growing on the trunk of a tree become firmly attached through numerous aerial rootlets.[6] The vines develop adventitious roots, or the plant can spread from rhizomes or root crowns. The milky sap of poison ivy darkens after exposure to the air.
T. radicans spreads either vegetatively or sexually. It is dioecious; flowering occurs from May to July. The yellowish- or greenish-white flowers are typically inconspicuous and are located in clusters up to 8 cm (3 in) above the leaves. The berry-like fruit, a drupe, mature by August to November with a grayish-white colour.[5]
T. radicans in Perrot State Park, Trempealeau County, Wisconsin
These four characteristics are sufficient to identify poison ivy in most situations: (a) clusters of three leaflets, (b) alternate leaf arrangement, (c) lack of thorns, and (d) each group of three leaflets grows on its own stem, which connects to the main vine, the middle stem is longer.[7] The appearance of poison ivy can vary greatly among environments, and even within a large area. Identification by experienced people is often made difficult by leaf damage, the plant's leafless condition during winter, and unusual growth forms due to environmental or genetic factors. Various mnemonic rhymes describe the characteristic appearance of poison ivy:[8]
Caquistle or caxuistle is the Nahuatl term for the species.
T. radicans grows throughout much of North America, including the Canadian Maritime provinces, Quebec, Ontario, and all US states east of the Rocky Mountains,[15] as well as in the mountainous areas of Mexico up to around 1,500 m (4,900 ft). It is normally found in wooded areas, especially along edge areas where the tree line breaks and allows sunshine to filter through. It also grows in exposed rocky areas, open fields, and disturbed areas.
It may grow as a forest understory plant, although it is only somewhat shade-tolerant.[5] The plant is extremely common in suburban and exurban areas of New England, the Mid-Atlantic, and the Southeastern United States. The similar species T. diversilobum (western poison oak) and T. rydbergii (western poison ivy) are found in western North America, and T. orientale in Taiwan, Japan, Korea and Sakhalin.
T. radicans rarely grows at altitudes above 1,500 m (4,900 ft), although the altitude limit varies in different locations.[5] The plants can grow as a shrub up to about 1.2 m (4 ft) tall, as a groundcover 10–25 cm (4–10 in) high, or as a climbing vine on various supports. Older vines on substantial supports send out lateral branches that may be mistaken for tree limbs at first glance.
It grows in a wide variety of soil types, and soil pH from 6.0 (acidic) to 7.9 (moderately alkaline). It is not particularly sensitive to soil moisture, although it does not grow in desert or arid conditions. It can grow in areas subject to seasonal flooding or brackish water.[5]
It is more common now than when Europeans first arrived in North America. The development of real estate adjacent to wild, undeveloped land has engendered "edge effects", enabling poison ivy to form vast, lush colonies in these areas. It is listed as a noxious weed in the US states of Minnesota and Michigan and in the Canadian province of Ontario.
Outside North America, T. radicans is also found in parts of China.[14]
Poison ivy is particularly sensitive to carbon dioxide levels, greatly benefiting from higher concentrations in the atmosphere. Higher carbon dioxide levels increase the rate of plant growth, and cause them to produce more unsaturated urushiol, which causes stronger reactions in humans.[16] Poison ivy's growth and potency has already doubled since the 1960s, and it could double again once carbon dioxide levels reach 560 ppm.[17]
The fruits are a favorite winter food of some birds and other animals, including wild turkeys.[18] Seeds are spread mainly by animals and remain viable after passing through the digestive tract. Birds may spread the seeds by regurgitation.[19]
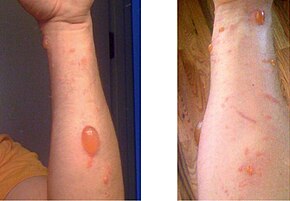
Urushiol-induced contact dermatitis is the allergic reaction caused by poison ivy. In extreme cases, a reaction can progress to anaphylaxis. Around 15 to 25 percent of people have no allergic reaction to urushiol, but most people have a greater reaction with repeated or more concentrated exposure.[20][21] Typically, the rash from the urushiol oil lasts about five to twelve days, but in extreme cases, it can last a month or more.[22]
Over 350,000 people are affected by urushiol annually in the United States.[23]
The pentadecyl catechols of the oleoresin within the sap of poison ivy and related plants causes the allergic reaction; the plants produce a mixture of pentadecylcatechols, which collectively is called urushiol. After injury, the sap leaks to the surface of the plant where the urushiol becomes a blackish lacquer after contact with oxygen.[2][24]
Urushiol binds to the skin on contact, where it causes severe itching that develops into reddish inflammation or uncoloured bumps, and then blistering. These lesions may be treated with Calamine lotion, Burow's solution compresses, dedicated commercial poison ivy itch creams, or baths to relieve discomfort,[25] though recent studies have shown some traditional medicines to be ineffective.[26][27] Over-the-counter products to ease itching—or simply oatmeal baths and baking soda—are now recommended by dermatologists for the treatment of poison ivy.[28]
A plant-based remedy cited to counter urushiol-induced contact dermatitis is jewelweed, though jewelweed extracts had no positive effect in clinical studies.[29][30][31][32] Others argue that prevention of lesions is easy if one practices effective washing, using plain soap, scrubbing with a washcloth, and rinsing three times within 2–8 hours of exposure.[33]
The oozing fluids released by scratching blisters do not spread the poison. The fluid in the blisters is produced by the body and it is not urushiol itself.[34] The appearance of a spreading rash indicates that some areas received more of the poison and reacted sooner than other areas or that contamination is still occurring from contact with objects to which the original poison was spread. Those affected can unknowingly spread the urushiol inside the house, on phones, doorknobs, couches, counters, desks, and so on, thus in fact repeatedly coming into contact with poison ivy and extending the length of time of the rash. If this has happened, wipe down the surfaces with bleach or a commercial urushiol removal agent. The blisters and oozing result from blood vessels that develop gaps and leak fluid through the skin; if the skin is cooled, the vessels constrict and leak less.[35] If plant material with urushiol is burned and the smoke then inhaled, this rash will appear on the lining of the lungs, causing extreme pain and possibly fatal respiratory difficulty.[34] If poison ivy is eaten, the mucus lining of the mouth and digestive tract can be damaged.[36] An urushiol rash usually develops within a week of exposure and can last 1–4 weeks, depending on severity and treatment. In rare cases, urushiol reactions may require hospitalization.[34]
Urushiol oil can remain active for several years, so handling dead leaves or vines can cause a reaction. In addition, oil transferred from the plant to other objects (such as pet fur) can cause the rash if it comes into contact with the skin.[37][34] Clothing, tools, and other objects that have been exposed to oil should be washed to prevent further reactions.[38]
People who are sensitive to urushiol can also experience a similar rash from mangoes. Mangoes are in the same family (Anacardiaceae) as poison ivy; the sap of the mango tree and skin of mangoes has a chemical compound similar to urushiol.[39] A related allergenic compound is present in the raw shells of cashews.[40] Similar reactions have been reported occasionally from contact with the related Fragrant Sumac (Rhus aromatica) and Japanese lacquer tree. These other plants are also in the family Anacardiaceae.
Immediate washing with soap and cold water or rubbing alcohol may help prevent a reaction.[41] During a reaction, Calamine lotion or diphenhydramine may help mitigate symptoms. Corticosteroids, either applied to the skin or taken by mouth, may be appropriate in extreme cases. An astringent containing aluminum acetate (such as Burow's solution) may also provide relief and soothe the uncomfortable symptoms of the rash.[42]
Toxicodendron radicans, commonly known as eastern poison ivy or poison ivy, is an allergenic Asian and Eastern North American flowering plant in the genus Toxicodendron. The species is well known for causing urushiol-induced contact dermatitis, an itchy, irritating, and sometimes painful rash, in most people who touch it. The rash is caused by urushiol, a clear liquid compound in the plant's sap. The species is variable in its appearance and habit, and despite its common name, it is not a true ivy (Hedera), but rather a member of the cashew and pistachio family (Anacardiaceae). T. radicans is commonly eaten by many animals and the seeds are consumed by birds, but poison ivy is most often thought of as an unwelcome weed. It is a different species from western poison ivy, T. rydbergii, which has similar effects.
El guan de México,[1] zumaque venenoso[1] o hiedra venenosa (Toxicodendron radicans) es una planta de la familia de las Anacardiaceae. No es realmente una verdadera hiedra o Hedera. Es más bien un tipo de trepadora, muy famosa por su capacidad de producir un irritante para la piel llamado urushiol, causante de dermatitis, inflamación y comezón. En casos extremos, se aplican corticoesteroides para tratar las molestias.
La hiedra venenosa crece especialmente en Norteamérica. Se desarrolla como un arbusto de unos 1,2 metros de alto, enredándose en cualquier soporte. Es aparentemente más común ahora, que anteriormente cuando la describieron por primera vez, hallándose en la actualidad en colonias que han sido superadas por las fronteras con las zonas pobladas. Raramente crecen en altitudes sobre los 1500 m.
La reacción causada por la hiedra venenosa (dermatitis inducida por contacto con urushiol) es alérgica. Por esta razón algunos individuos parecen no reaccionar al veneno. Sin embargo, la sensibilidad puede desarrollarse con el tiempo. Aquellos que son afectados por él, pueden sufrir erupciones cutáneas irritantes. Si la hiedra es quemada y el humo inhalado, puede irritar los pulmones, causando dolor extremo y posible dificultad para respirar, en ocasiones fatal. En el caso de ingestión, irrita el tracto digestivo y las vías respiratorias, también de manera posiblemente fatal. El aceite de urushiol puede permanecer activo dentro de la planta, aún muerta, por más de 5 años, manteniendo su concentración y potencia.
Las hojas están compuestas por tres elementos en forma de almendra. Los frutos (drupas) son de color grisáceo, siendo el alimento favorito de algunas aves en invierno. Las hojas van de un color verde claro (jóvenes) a un verde oscuro (hojas maduras), cambiando a un rojo cuando están por caer. Tienen de 3 a 12 cm de largo, —raramente llegando a los 30 cm— y detallan un borde levemente dentado con superficie suave. Comparadas con las hojas de la frambuesa y de la mora, difieren porque éstas tienen los bordes dentados y la superficie un tanto áspera, y tienen espinas.
Todas las partes de ésta planta contienen urushiol, causante de dermatitis severa en las personas sensibles. El riesgo de exposición se puede reducir al aprender a reconocer y evitar esta especie, usar ropa que cubra los brazos y piernas, y posteriormente lavar las prendas que hayan entrado en contacto con la misma.
Toxicodendron radicans fue descrito por (L.) Kuntze y publicado en Revisio Generum Plantarum 1: 153. 1891.[2]
Toxicodendron: nombre genérico que deriva de las palabras griegas: τοξικός (toxikos), que significa "veneno", y δένδρον (dendron), que significa "árbol".[3]
radicans: epíteto latín que significa "tallos con raíces".[4]
El guan de México, zumaque venenoso o hiedra venenosa (Toxicodendron radicans) es una planta de la familia de las Anacardiaceae. No es realmente una verdadera hiedra o Hedera. Es más bien un tipo de trepadora, muy famosa por su capacidad de producir un irritante para la piel llamado urushiol, causante de dermatitis, inflamación y comezón. En casos extremos, se aplican corticoesteroides para tratar las molestias.
Roniv mürgipuu (Toxicodendron radicans) on anakardiliste sugukonda mürgipuu perekonda kuuluv taimeliik.
Ronival mürgipuul klassifitseeritakse mitmeid alamliike.
Roniv mürgipuu on puitunud varrega ronitaim, millel on valged luuviljad.
Taim võib olenevalt kasvukohast kasvada 30–100 sentimeetri kõrguseks.
Roniva mürgipuu kolmetised munajad lehed on 5–15 cm pikkused. Lehed on terve servaga, harvemini kergelt saagjad. Lehed värvuvad sügisel kollaseks ja punaseks.
Taim paljuneb nii risoomi kaudu kui ka seemnetega.
Taim kasvab Põhja-Ameerikas. Kanadas peidub teda Quebeci, Ontario ja Manitoba ning Atlandi ookeani äärsetes provintsides. USA-s kasvab ta kõigis Kaljumäestikust itta jäävates osariikides. Ta kasvab ka Mehhiko mägedes kuni 1,5 km kõrgusel.
Roniv mürgipuu kasvab jõekallastel ja metsades. Eriti tüüpiline on ta metsaservades. USA ida-, kesk- ja lõunaosas kasvab ta valdavalt ronitaimena, põhja- ja lääneosas ning Kanadas maad mööda roomava taime (kõrgus 10–25 cm) või puhmana (kõrgus kuni 1,2 m). Päris varjus ta kasvada ei taha, aga valguseküllastes metsades kasvab meeleldi põõsarindes.
Ta ei ole pinnase niiskuse suhtes tundlik, ehkki kõrbes ta just ei kasva. Ta kasvab mitmesugusel pinnasel, eelistades mõõdukalt leeliselist mulda, mille pH on 6,0–7,9. Ta suudab kasvada ka nendel aladel, mida mõnel aastaajal üle ujutatakse, isegi kui seda ei tehta mageda, vaid riimveega.
Viimastel sajanditel on roniv mürgipuu märksa sagedasemaks muutunud. Euroopast tulnud valged inimesed on maastiku mosaiiksust märgatavalt suurendanud, kadunud on ronivale mürgipuule ebasobivad suured metsamassiivid ja asemele on tulnud talle märksa sobivam mitmekesine maastik.
Minnesota ja Michigani osariik ning Ontario provints on roniva mürgipuu kuulutanud mürgiseks invasiivseks liigiks, ehkki ta on selles piirkonnas juba aastatuhandeid kasvanud.
Mitmed imetajad toituvad roniva mürgipuu lehtedest, okstest ja viljadest.
Nii taime lehed, varred kui ka juured sisaldavad urušiooli, mis on tugeva nahka ärritava toimega toksiin.
See on mitmest orgaanilisest ühendist koosnev aine, mida on muu hulgas Hiinas ja Jaapanis kasutatud traditsiooniliste lakkide valmistamisel.
Roniv mürgipuu on inimeste suhtes mürktaimena liigitatav, valdavalt urušiooli tõttu mis kokkupuuet nahaga põhjustab allergilist kontaktdermatiiti (allergiline kontaktekseem).
Enamasti piisab nahapõletiku tekitamiseks ühest miljardikust grammist urušioolist. Igal aastal tekib ronivast mürgipuust tingitud allergiline reaktsioon kümnetel miljonitel inimestel. Arvatakse, et kuni 85% inimestest on roniva mürgipuu suhtes ülitundlikud. Osadel inimestel võib kokkupude taimega põhjustada anafülaktilist šokki.
Kokkupuutel taimega tekivad põletushaavaga sarnanevad valusad ja sügelevad punased triibud või vesivillid. Nende ilmnemiseks võib kuluda 1...2 päeva ning paranemine võib võtta üle nädala. Kiire veega loputamine esimeste minutite jooksul aitab reaktsiooni oluliselt leevendada. Urušiooli lahustab alkohol.
Tihti esimesel kokkupuutel reaktsiooni ei teki, tundlikkus väheneb ka vanusega ja mõnikord rohkete kokkupuudetega. Enamasti piisab ka kokkupuutest lemmiklooma või aiatööriista vahendusel; ka kuivanud taimede ümbruses säilitab mürk oma toime (mürgipuu vaik) mitu aastat.
Roniv mürgipuu (Toxicodendron radicans) on anakardiliste sugukonda mürgipuu perekonda kuuluv taimeliik.
Liaanimyrkkysumakki tai myrkkymuratti (Toxicodendron radicans) on sumakkikasveihin kuuluva kasvi, joka kasvaa Pohjois- ja Keski-Amerikassa sekä Itä-Aasiassa.[2] Se on varsin yleinen monilla Yhdysvaltain esikaupunkialueilla. Myrkkymuratti aiheuttaa kosketettaessa useimmille ihmisille allergisen reaktion, joka voi pahimmillaan olla hengenvaarallinen.lähde? Suomenkielisestä nimestään huolimatta se ei ole sukua eurooppalaiselle muratille (Hedera helix).
Liaanimyrkkysumakki tai myrkkymuratti (Toxicodendron radicans) on sumakkikasveihin kuuluva kasvi, joka kasvaa Pohjois- ja Keski-Amerikassa sekä Itä-Aasiassa. Se on varsin yleinen monilla Yhdysvaltain esikaupunkialueilla. Myrkkymuratti aiheuttaa kosketettaessa useimmille ihmisille allergisen reaktion, joka voi pahimmillaan olla hengenvaarallinen.lähde? Suomenkielisestä nimestään huolimatta se ei ole sukua eurooppalaiselle muratille (Hedera helix).
Toxicodendron radicans
Le sumac grimpant, herbe à puce, bois de chien, sumac vénéneux ou poison ivy (Toxicodendron radicans, anciennement Rhus radicans) est une liane de la famille des Anacardiaceae, comme les anacardiers et les pistachiers. C'est une plante sauvage originaire d'Amérique du Nord, où elle est commune dans une grande partie des États-Unis et du Canada. Il est aussi possible de la voir en Amérique du Sud et en Asie tempérée.
Cette espèce se multiplie par ses graines. Toutefois, les individus sont souvent sans fleurs et sans fruits. Lorsqu'elle a lieu, sa floraison est estivale[1].
Les oiseaux mangent ses fruits. Ses feuilles sont souvent broutées par le bétail, qui ne réagit pas à la substance toxique contenue dans l'herbe à puce[1].
Lorsqu'on la touche, elle provoque une réaction allergique extrêmement irritante et pouvant se surinfecter, une dermatite de contact. Cette dermatite apparaît généralement 24 à 48 heures après le contact mais peut se manifester 8 heures à 2 semaines plus tard. Le symptôme disparaît dans les cas courants après 2 à 5 jours. Il est fréquemment indiqué que le premier contact ne provoque pas d'effet autre que de sensibiliser l'individu chez lequel un contact ultérieur provoquera la réaction allergique.
L'agent irritant étant huileux (urushiol), très tenace et non volatil, le contact peut être indirect (vêtement, outil, animal, etc.). Les feux de forêt, le brûlage direct, la tonte et le débroussaillage mécaniques peuvent libérer l’huile en suspension dans l'air. Les feuilles mortes de la plante, même depuis quelques années (5 ans) peuvent provoquer une réaction allergique chez les plus sensibles.
Il faut noter qu'après un premier contact avec l'urushiol du sumac grimpant (sensibilisation), il est possible de développer une dermatite de contact avec, par exemple, une étiquette de vêtement d'origine indienne marquée avec de la résine de Semecarpus anacardium[2].
Laver à l'eau froide — si possible immédiatement — les parties du corps ayant été en contact avec le poison. L'eau froide dilue la sève et referme les pores de la peau empêchant ainsi le poison d'y pénétrer. Il est préférable de ne pas utiliser de savon qui répand la sève toxique et enlève l'huile protectrice de la peau. Cela n'annulera pas complètement l'effet, mais cela peut le diminuer[3].
Par la suite, la calamine et les pansements humides soulagent les démangeaisons, alors qu'une crème à base de cortisone assèche les bulles. Utiliser un antihistaminique comme la diphénhydramine peut aussi soulager les démangeaisons. Le Buro (topique à base d'acétate d'aluminium), vendu dans les pharmacies, va soulager l'inflammation de la peau. Après le traitement par Buro-Sol, appliquer une crème d'hydro-cortisone sur la peau sèche.
Toxicodendron radicans
Le sumac grimpant, herbe à puce, bois de chien, sumac vénéneux ou poison ivy (Toxicodendron radicans, anciennement Rhus radicans) est une liane de la famille des Anacardiaceae, comme les anacardiers et les pistachiers. C'est une plante sauvage originaire d'Amérique du Nord, où elle est commune dans une grande partie des États-Unis et du Canada. Il est aussi possible de la voir en Amérique du Sud et en Asie tempérée.
Tom nó féithleog adhmadach atá dúchasach do Mheiriceá Thuaidh, planda an-athraitheach. Na duilleoga le 3 dhuilleoigín, mín is snasta nó giobach, fiaclach nó maothánach. Na bláthanna bán. Na plandaí a fhoirmíonn toim ingearacha, le duilleoga barrmhaola maothánacha, cosúil le duilleoga darach. Tugtar dair nimhe orthu sin, agus glacann cuid de na saineolaithe leo mar speiceas difriúil. Táirgeann siad uile roisín a chuimsíonn an ceimiceán úraiseanól, atá nimhiúil don tadhall agus a chuireann tús le deirmitíteas dian. Tá sé do-ghalaithe agus is féidir é a iompar ar éadaí, ithir, fiú i ndeatach. Mar sin, is féidir leis a dhrochiarmhairtí a oibriú i bhfad ón bplanda féin.
Otrovni bršljan (lat. Toxicodendron radicans), biljna vrsta iz porodice rujevki, nije u rodu sa bršljanom (Rhus) nego pripada rodu Toxicodendron. Biljka je raširena po Aziji i istočnim predjelima Sjeverne Amerike.
Ovo ime ostalo mu je zato što je nekada pripisivan rodu Rhus, sinonim mu je Rhus radicans. Lišće, stabljike i korijenje otrovnog bršljana sadrži otrovnu ulje (urushiol) koje u dodiru s kožom izaziva upalnu alergijsku reakciju [1], pojavu crvenog osipa koji svrbi, malih neravnina, plikova ili otoka.
Na Zajedničkom poslužitelju postoje datoteke vezane uz: Otrovni bršljan Wikivrste imaju podatke o: Toxicodendron radicansJelatang[1] atau latang[2] (Laportea) adalah genus tumbuhan yang berasal dari suku Urticaceae.[3][4] Daun atau bagian lain dari tumbuhan ini dapat menimbulkan rasa gatal pada kulit apabila tersentuh.[1][5] Terna ini dapat hidup tahunan ataupun perenial. Seperti banyak tanaman dari suku Urticaceae, tumbuhan ini memiliki rambut yang menyengat dan gatal.[6]
Tumbuhan dari genus ini terdapat setidaknya 22[6] spesies, termasuk:
Sebelumnya masuk ke genus ini:
Jelatang atau latang (Laportea) adalah genus tumbuhan yang berasal dari suku Urticaceae. Daun atau bagian lain dari tumbuhan ini dapat menimbulkan rasa gatal pada kulit apabila tersentuh. Terna ini dapat hidup tahunan ataupun perenial. Seperti banyak tanaman dari suku Urticaceae, tumbuhan ini memiliki rambut yang menyengat dan gatal.
Tumbuhan dari genus ini terdapat setidaknya 22 spesies, termasuk:
Laportea aestuans (L.) Chew — Jelatang Hindia barat Laportea bulbifera (Siebold & Zucc.) Wedd. Laportea canadensis (L.) Wedd. — Jelatang Kanada Laportea cuneata (A.Rich.) Chew. — Jelatang rumput Laportea cuspidata (Wedd.) Friis Laportea grossa (Wedd.) Chew Laportea interrupta (L.) Chew. — Jelatang Hawaii Laportea peduncularis (Wedd.) Chew Laportea pterostigma Wedd. — Jelatang beracun Laportea urentissima Gagnep.Sebelumnya masuk ke genus ini:
Laportea stimulans Wee-Lek Chew Chew, 1965 — Jelatang gajahL'edera velenosa, detta anche edera del Canada o sommacco velenoso (Toxicodendron radicans, (L.) Kuntze, 1891), è una pianta della famiglia delle Anacardiaceae[1]. Nonostante il nome, non ha nulla a che vedere con l'edera comune (Hedera helix).
Causa dermatite allergica da contatto, con effetti spesso di una certa gravità[2]. Nelle sue foglie si trova il ramnosio, un monosaccaride aldeico levogiro, noto anche come isodulcite o monomelitosio.
L'edera velenosa, detta anche edera del Canada o sommacco velenoso (Toxicodendron radicans, (L.) Kuntze, 1891), è una pianta della famiglia delle Anacardiaceae. Nonostante il nome, non ha nulla a che vedere con l'edera comune (Hedera helix).
Causa dermatite allergica da contatto, con effetti spesso di una certa gravità. Nelle sue foglie si trova il ramnosio, un monosaccaride aldeico levogiro, noto anche come isodulcite o monomelitosio.
Jelatang (Toxicodendron radicans - syn. Rhus toxicodendron, Rhus radicans[1]) adalah sejenis tumbuhan yang daunnya berbulu (miang) yang dapat menyebabkan gatal pada kulit jika bersentuhan. Tumbuhan ini memiliki beberapa jenis. Ada yang berbatang, tingginya sekitar 10 cm sampai 1 m. Ada juga yang merambat. Ada yang berdaun kecil dan ada juga yang berdaun lebar.
Di daerah Kedurang, Bengkulu Selatan, Bengkulu, tanaman ini dibezakan berdasarkan bentuk dan kesan gatal yang ditimbulkannya. Untuk yang daun berukuran kecil, selebar kira-kira 5 cm, dinamakan "Jelatang Ayam". "Jelatang Kambing", daunnya lebih lebar dan dengan tahap kegatalan yang lebih. "Jelatang Kerbau" pula, daunnya paling lebar dan tebal. Lebarnya dapat mencapai 30 cm. Jelatang jenis ini, dapat menyebabkan gatal yang berlanjutan hingga seminggu kemudian. Semua jenis jelatang biasa tumbuh di daerah yang kelembabannya tinggi.


Jelatang (Toxicodendron radicans - syn. Rhus toxicodendron, Rhus radicans) adalah sejenis tumbuhan yang daunnya berbulu (miang) yang dapat menyebabkan gatal pada kulit jika bersentuhan. Tumbuhan ini memiliki beberapa jenis. Ada yang berbatang, tingginya sekitar 10 cm sampai 1 m. Ada juga yang merambat. Ada yang berdaun kecil dan ada juga yang berdaun lebar.
Di daerah Kedurang, Bengkulu Selatan, Bengkulu, tanaman ini dibezakan berdasarkan bentuk dan kesan gatal yang ditimbulkannya. Untuk yang daun berukuran kecil, selebar kira-kira 5 cm, dinamakan "Jelatang Ayam". "Jelatang Kambing", daunnya lebih lebar dan dengan tahap kegatalan yang lebih. "Jelatang Kerbau" pula, daunnya paling lebar dan tebal. Lebarnya dapat mencapai 30 cm. Jelatang jenis ini, dapat menyebabkan gatal yang berlanjutan hingga seminggu kemudian. Semua jenis jelatang biasa tumbuh di daerah yang kelembabannya tinggi.
De gifsumak (Rhus radicans, synoniemen: Toxicodendron radicans en Rhus toxicodendron; Engels: poison ivy) is een plant uit de pruikenboomfamilie (Anacardiaceae). Het is een 0,3-1 m hoge struik. De plant is berucht om het sap, dat sterk sensibiliserend is en bij veel mensen een ernstige allergische huiduitslag kan veroorzaken.
Het aantal chromosomen van de gifsumak is 2n = 30. De plant heeft koordachtige stengels. Hij vermeerdert zich vegetatief, niet alleen door wortelstokken, maar ook met wortels en stengels die gevormd worden op de knopen van liggende stengels. De stengels zijn rechtopstaand of meer kruipend, afhankelijk van de hoeveelheid licht, grondsoort en vocht. Ze kunnen kruidachtig of houtachtig zijn, de kleur groen of roodachtig. Alle variaties kunnen op één plant voorkomen.
De bladeren zijn oneven geveerd en hebben drie, 5 - 12 cm lange deelblaadjes. Het topblaadje heeft een duidelijk langere steel dan de twee andere. Dit is een onmiskenbaar kenmerk van gifsumak. De blaadjes zijn ovaal tot eirond, variërend van 5-15 cm lang en de breedte is twee derde van de lengte. Het blaadje is veernervig. De bladstelen zijn halfcirkelvormig. De bovenkant van het blaadje is glad en glanzend, de onderkant donzig. De randen van de blaadjes zijn glad, gelobd of gekarteld. Alle variaties kunnen op één plant voorkomen.
De gesteelde, 3 mm lange bloemen zijn groen-wit en staan in een pluim. De pluim staat in een bladoksel van een nieuw lot. De bloemen hebben vijf kroonbladen en vijf meeldraden.
De vrucht is een 3 - 6 mm grote, ronde, droge, vaalwitte tot groenige steenvrucht en bevat een hard benig zaadje.
De stengel, bladeren en bladstelen hebben tussen de cellen openingen zitten waaruit de actieve stof urushiol komt. Die stof oxideert aan de lucht bij vochtige omstandigheden en maakt een zwarte plakkerige stof op het oppervlakte van de plant. De oxidatie vermindert de giftigheid niet. De inktachtige stof op de plant gaat niet meer uit linnen of katoen en is oplosbaar in ether.
Oorspronkelijk is de plant afkomstig uit Zuid-Canada, Noord-Amerika, Mexico, Bermuda, het westelijk deel van de Bahama's, Japan, Koerilen, Taiwan en West- en Centraal-China. De plant is in de rest van de wereld geïntroduceerd en is daar soms verwilderd.
In Nederland komt de gifsumak voor in Friesland langs de Vangdijk, het fietspad tussen de Morra en de Fûgelhoeke (Vogelhoek), ten noordoosten van Hemelum. Stammetjes van de gifsumak zijn daar in 1919 geplant als bescherming tegen afslag van de dijk aan de kant van de Fûgelhoeke. In de loop der tijd werd een aantal kinderen in Hemelum ziek van de plant en omdat men niet wist waar het van kwam werd er maar een verbodsbord geplaatst. Begin jaren 1960 werd duidelijk dat het om de gifsumak ging en werd de bevolking hiervan op de hoogte gesteld.[1] De plant klimt inmiddels tot boven in de wilgen die daar ook gezet zijn als bescherming tegen het open water van de Morra. De beheerder van het gebied, It Fryske Gea, heeft er in 2009 nieuwe borden bij geplaatst met een waarschuwing om vooral van de plant af te blijven.
De gifsumak (Rhus radicans, synoniemen: Toxicodendron radicans en Rhus toxicodendron; Engels: poison ivy) is een plant uit de pruikenboomfamilie (Anacardiaceae). Het is een 0,3-1 m hoge struik. De plant is berucht om het sap, dat sterk sensibiliserend is en bij veel mensen een ernstige allergische huiduitslag kan veroorzaken.
Het aantal chromosomen van de gifsumak is 2n = 30. De plant heeft koordachtige stengels. Hij vermeerdert zich vegetatief, niet alleen door wortelstokken, maar ook met wortels en stengels die gevormd worden op de knopen van liggende stengels. De stengels zijn rechtopstaand of meer kruipend, afhankelijk van de hoeveelheid licht, grondsoort en vocht. Ze kunnen kruidachtig of houtachtig zijn, de kleur groen of roodachtig. Alle variaties kunnen op één plant voorkomen.
De bladeren zijn oneven geveerd en hebben drie, 5 - 12 cm lange deelblaadjes. Het topblaadje heeft een duidelijk langere steel dan de twee andere. Dit is een onmiskenbaar kenmerk van gifsumak. De blaadjes zijn ovaal tot eirond, variërend van 5-15 cm lang en de breedte is twee derde van de lengte. Het blaadje is veernervig. De bladstelen zijn halfcirkelvormig. De bovenkant van het blaadje is glad en glanzend, de onderkant donzig. De randen van de blaadjes zijn glad, gelobd of gekarteld. Alle variaties kunnen op één plant voorkomen.
De gesteelde, 3 mm lange bloemen zijn groen-wit en staan in een pluim. De pluim staat in een bladoksel van een nieuw lot. De bloemen hebben vijf kroonbladen en vijf meeldraden.
De vrucht is een 3 - 6 mm grote, ronde, droge, vaalwitte tot groenige steenvrucht en bevat een hard benig zaadje.
De stengel, bladeren en bladstelen hebben tussen de cellen openingen zitten waaruit de actieve stof urushiol komt. Die stof oxideert aan de lucht bij vochtige omstandigheden en maakt een zwarte plakkerige stof op het oppervlakte van de plant. De oxidatie vermindert de giftigheid niet. De inktachtige stof op de plant gaat niet meer uit linnen of katoen en is oplosbaar in ether.
Giftsumak (Toxicodendron radicans) er en plante i familien Anacardiaceae.
Planten er en løvfellende, forvedet klatreplante som dekker skogbunnen og kryper opp langs trestammer i løvskoger. Den klatrer ved hjelp av festerøtter. Bladene er trekoblete. Blomsterstanden er et 5 cm langt aks. Frukten er en avlang steinfrukt som er gråhvit når den er moden.
Til tross for det engelske navnet «poison ivy», er planten ikke nært beslektet med eføy (Hedera helix). Planten produserer urushiol, en hudirritant som hos de fleste mennesker forårsaker et kraftig og sterkt kløende utslett, også kjent som urushiol-indusert kontaktdermatitt (kontakteksem). Urushiol er ikke regnet som en gift, men et allergen, da det får kroppens immunforsvar til å svare med en allergisk reaksjon. Selv en lett berøring av hud mot denne planten kan gi alvorlige, brannsårliknende utslett.
Giftsumak er viktig for dyrelivet. Mange fugler og småpattedyr bruker plantene som skjulested eller bygger reir her. Bomullshalekaniner eter kvistene om vinteren, og bærene er viktig føde for nordkrattvaktel, villkalkun, hakkespetter, stær, hvitstrupespurv, myrteparula og andre fugler. Hvithalehjort beiter på bladene om våren og sommeren.
Arten er ganske variabel og deles i flere underarter. Den er utbredt i østlige deler av Canada og USA, i fjellene i Mexico og Guatemala og på Bahamas og Bermuda. Subsp. hispidum vokser i Kina, Japan og på de russiske øyene Kurilene og Sakhalin.
Denne planten brukes i det homeopatiske preparatet Rhus Toxicodendron. Det hevdes at den hjelper mot blant annet leddsmerter, stive muskler, RLS og hudproblemer.
Giftsumak (Toxicodendron radicans) er en plante i familien Anacardiaceae.
Planten er en løvfellende, forvedet klatreplante som dekker skogbunnen og kryper opp langs trestammer i løvskoger. Den klatrer ved hjelp av festerøtter. Bladene er trekoblete. Blomsterstanden er et 5 cm langt aks. Frukten er en avlang steinfrukt som er gråhvit når den er moden.
Til tross for det engelske navnet «poison ivy», er planten ikke nært beslektet med eføy (Hedera helix). Planten produserer urushiol, en hudirritant som hos de fleste mennesker forårsaker et kraftig og sterkt kløende utslett, også kjent som urushiol-indusert kontaktdermatitt (kontakteksem). Urushiol er ikke regnet som en gift, men et allergen, da det får kroppens immunforsvar til å svare med en allergisk reaksjon. Selv en lett berøring av hud mot denne planten kan gi alvorlige, brannsårliknende utslett.
Giftsumak er viktig for dyrelivet. Mange fugler og småpattedyr bruker plantene som skjulested eller bygger reir her. Bomullshalekaniner eter kvistene om vinteren, og bærene er viktig føde for nordkrattvaktel, villkalkun, hakkespetter, stær, hvitstrupespurv, myrteparula og andre fugler. Hvithalehjort beiter på bladene om våren og sommeren.
Arten er ganske variabel og deles i flere underarter. Den er utbredt i østlige deler av Canada og USA, i fjellene i Mexico og Guatemala og på Bahamas og Bermuda. Subsp. hispidum vokser i Kina, Japan og på de russiske øyene Kurilene og Sakhalin.
Denne planten brukes i det homeopatiske preparatet Rhus Toxicodendron. Det hevdes at den hjelper mot blant annet leddsmerter, stive muskler, RLS og hudproblemer.
Klättersumak (Toxicodendron radicans) är en växt i familjen sumakväxter. Den kan liksom giftsumak (Toxicodendron diversilobum), orsaka svår allergisk kontaktdermatit, kallat poison oak-dermatit. Klättersumak (engelska: Poison Ivy) är vanlig framförallt i USA:s centrala och östra delar.
Klättersumak (Toxicodendron radicans) är en växt i familjen sumakväxter. Den kan liksom giftsumak (Toxicodendron diversilobum), orsaka svår allergisk kontaktdermatit, kallat poison oak-dermatit. Klättersumak (engelska: Poison Ivy) är vanlig framförallt i USA:s centrala och östra delar.
Toxicodendron radicans là một loài thực vật có hoa trong họ Đào lộn hột. Loài này được (L.) Kuntze miêu tả khoa học đầu tiên năm 1891.[1]
T. radicans mọc trên khắp Bắc Mỹ, bao gồm các tỉnh ven biển của Canada, Quebec, Ontario, Manitoba, và tất cả các tiểu bang phía đông của dãy núi Rocky, cũng như ở các vùng núi của Mexico lên tới khoảng 1.500 m ( 4,900 ft). Caquistle hoặc caxuistle là thuật ngữ tiếng Nahuatl cho loài này. Nó thường được tìm thấy trong các khu vực rừng, đặc biệt là dọc theo các khu vực cạnh, nơi dòng cây phá vỡ và cho phép ánh nắng mặt trời để lọc qua. Loài này cũng phát triển trong các khu vực đá tiếp xúc, các cánh đồng mở và các khu vực bị xáo trộn.
Loài cây này có thể phát triển như một loại cây trồng trong rừng, mặc dù nó chỉ có khả năng chịu bóng râm. Loài cây này rất phổ biến ở các khu vực ngoại ô và ngoại thành của New England, Trung Đại Tây Dương và Đông Nam Hoa Kỳ. Các loài T. diversilobum tương tự (cây sồi độc Tây) và T. rydbergii (ivy độc Tây) được tìm thấy ở miền Tây Bắc Mỹ, và T. orientale ở Đài Loan, Nhật Bản, Triều Tiên và Sakhalin.
T. radicans hiếm khi phát triển ở độ cao trên 1.500 m (4.900 ft), mặc dù giới hạn độ cao thay đổi ở các vị trí khác nhau. Cây có thể mọc lên như một cây bụi cao tới 1,2 m (3,9 ft), cao 10–25 cm (3,9–9,8 in), hoặc như một cây leo leo trên nhiều loại cây khác nhau. Những cây nho già hơn trên những cây hỗ trợ đáng kể gửi các nhánh bên có thể bị nhầm lẫn với cành cây ngay từ cái nhìn đầu tiên.
Toxicodendron radicans là một loài thực vật có hoa trong họ Đào lộn hột. Loài này được (L.) Kuntze miêu tả khoa học đầu tiên năm 1891.
Toxicodendron radicans (L.) Kuntze, 1891
Токсикоде́ндрон укореня́ющийся (лат. Toxicodéndron rádicans) — листопадная лиана; вид рода Токсикодендрон (Toxicodendron) семейства Анакардиевые (Anacardiaceae). Известен также как ядовитый плющ[2]
Токсикодендрон укореняющийся — лиана, высоко взбирающаяся по опорам с помощью воздушных корней или стелющаяся по земле. Молодые побеги слабо опушены или голые.
Листья тройчатосложные, листочки яйцевидные или ромбические, до 12 см длиной, на верхушке приострённые. С обеих сторон светло-зелёные, сверху блестящие, снизу по жилкам слегка опушённые, цельнокрайние, крупнозубчатые или лопастные, на черешочках 1—3 см длиной. Общий черешок листа 5—10 см длиной. Осенью листья становятся карминовыми и оранжевыми.
Цветёт в июне — июле. Цветёт и плодоносит со второго года.
Соцветия — пазушные метёлки 3—6 см длиной. Цветки зеленовато-белые.
Плодоносит в октябре, плоды сохраняются до весны. Плоды — костянки, 5-6 мм в диаметре, сплюснуто-шаровидные, шиповато-волосистые, буро-зелёные, односемянные. Семена с неглубокими продольными бороздками.
Произрастает на сухих почвах.
Общее распространение: Северная Америка от Новой Шотландии до Флориды и на запад до Миннесоты и Арканзаса.
Декоративное, ядовитое
Токсикоде́ндрон укореня́ющийся (лат. Toxicodéndron rádicans) — листопадная лиана; вид рода Токсикодендрон (Toxicodendron) семейства Анакардиевые (Anacardiaceae). Известен также как ядовитый плющ
毒漆藤(学名:Toxicodendron radicans或Rhus toxicodendron英文:Poison Sumac),又名三葉毒藤,是一种分布在北美、亞洲及澳大利亚的有毒植物。大多數人觸碰到時會產生過敏反應。