mk
имиња во трошки

Adenoviruslar ( yun. aden – vəzi+viruslar ) – insanda yuxarı tənəffüs yollarının kəskin iltihabına, konyunktivit, enterokolit, viruslu pnevmoniya və s. xəstəliklərə səbəb olan virusların böyük bir qrupu.[1] 50-yə yaxın tipi, o cümlədən insanda 32 tipi məlumdur. Zülal örtükdən və DNT-dən ( dezoksiribonuklein turşusu ) ibarətdir. Ölçüləri 70-90 mmk-dur Adenoviruslar xarici qişası olmayan ,təqribən 70-90 nm diametrli sadə quruluşlu viruslardır.252 kapsomerdən ibarətdir. Onların 240-ı hekson formada olur, onlar virionun səthində tillər əmələ gətirir.[2]
Adenoviruslar ( yun. aden – vəzi+viruslar ) – insanda yuxarı tənəffüs yollarının kəskin iltihabına, konyunktivit, enterokolit, viruslu pnevmoniya və s. xəstəliklərə səbəb olan virusların böyük bir qrupu. 50-yə yaxın tipi, o cümlədən insanda 32 tipi məlumdur. Zülal örtükdən və DNT-dən ( dezoksiribonuklein turşusu ) ibarətdir. Ölçüləri 70-90 mmk-dur Adenoviruslar xarici qişası olmayan ,təqribən 70-90 nm diametrli sadə quruluşlu viruslardır.252 kapsomerdən ibarətdir. Onların 240-ı hekson formada olur, onlar virionun səthində tillər əmələ gətirir.
Els adenovirus (Adenoviridae) són un tipus de virus de mida mitjana (entre 60 i 90 nm), que es caracteritzen per tenir el material genètic en una doble cadena d'ADN no circular. Tenen un pes molecular petit i no tenen coberta externa. Són virus que afecten vertebrats i es transmeten per via digestiva, per contacte directe i per respiració. Poden provocar infeccions a les vies respiratòries, conjuntivitis, cistitis hemorràgica i gastroenteritis.
El seu criptograma és D/2: 20-30/12-17: S/S: V/I,O,R.
El nom d'adenovirus prové de la paraula grega "adeno", que signifíca glàndula, ja que es van descobrir a partir de cultius de cèl·lules extretes de diferents glàndules.[1]
Són virus que afecten animals vertebrats. Dins de la família Adenoviridae trobem 3 gèneres:
El tercer gènere encara no està ben definit però inclouria certs tipus d'adenovirus rics en A+T.[1]
Hi ha més de 100 adenovirus descrits, dels quals 49 són d'humans. En concret, els virus que afecten a humans estan dividits en 6 subgrups de la A fins a la F.
Cada un d'aquests grups té característiques pròpies. Per exemple, el grup A està caracteritzat per tenir potencial oncogènic associat a proteïnes adenovirals reguladores del cicle cel·lular.
Altres subgrups d'adenovirus es caracteritzen per tenir la capacitat d'hemaglutinació una propietat relacionada amb les proteïnes de la càpsida viral, concretament de la fibra.
Els adenovirus tenen una càpsida característica, formada de diferents proteïnes que formen una estructura icosaèdrica de 20 cares triangulars i 12 vèrtexs. El 13% del pes molecular de l'adenovirus correspon a l'ADN, i el 87% restant a proteïnes (valors aproximats, poden variar en funció del gènere i del subgrup).
En cada vèrtex de l'icosaedre que forma la seva càpsida hi ha unes estructures proteiques, anomenades fibres proteiques, que s'encarreguen de reconèixer l'hoste per tal de facilitar i iniciar el procés d'endocitosi. Dins de l'icosaedre hi ha la doble cadena d'ADN i algunes proteïnes, que serviran per dur a terme el procés de replicació, un cop el virus s'hagi introduït dins de la cèl·lula hoste.
[1] L'ADN dels adenovirus és de doble cadena, lineal i no segmentat. Conté de 30 a 36 kpb, en funció del serotip. El contingut de G+C de l'ADN del virus varia de 33,7 a 63,8%.[2]
El procés de replicació es produeix al nucli de la cèl·lula hoste, utilitzant els sistemes propis d'aquesta. El procés d'endocitosi s'inicia quan la fibra proteica del virus s'uneix a un receptor específic de la cèl·lula hoste. Aquest receptor s'anomena CAR (Coxsackie-Adenovirus Receptor).
Un cop endocitat, el virus es troba dins d'una vesícula a l'interior de la cèl·lula hoste. Aquesta vesícula es trencarà per acció de diferents proteïnes del virus i el virió passarà al citoplasma. Arribarà a la membrana nuclear de la cèl·lula i el genoma viral s'introduirà a dins del nucli. En el nucli s'ancorarà als centres actius de transcripció i replicació de l'ADN de l'hoste, de manera que es començaran a transcriure gens virals.
Se sintetitzen ARNm virals, que un cop al citoplasma utilitzaran les estructures cel·lulars per produir proteïnes víriques. Un cop totes les proteïnes pròpies del virus estiguin sintetitzades s'uniran per formar nous virions que sortiran de la cèl·lula induint la lisis cel·lular.
Els adenovirus són molt comuns, i gairebé podríem afirmar que el 100% de la població adulta ha estat en contacte amb ells alguna vegada i estan immunitzades en major o menor mesura. Per tant, les infeccions amb repercussió clínica són poc freqüents o bé s’observen en individus nounats o molt joves. Els diferents tipus d’adenovirus que existeixen mostren diferent tropisme: la majoria causen infeccions al tracte respiratori, i alguns serotipus s’associen a infeccions gastrointestinals (com Ad40 i Ad41). [3]
Els adenovirus són molt contagiosos en éssers humans (sobretot en zones de risc com guarderies, hospitals, escoles o centres militars). Es podrien transmetre per la tos i secrecions nasals, via oro-fecal o contacte directe (mans, per exemple nens que comparteixen joguines). També és probable la transmissió venèria.
No és una zoonosi, són molt específics i sovint el reservori és el mateix home (especialment els nens).
És important saber que es poden aïllar adenovirus de teixits limfoides (com les amígdales), ja que persisteixen en tals teixits durant un llarg període.
Segons la forma de presentació de la malaltia es classifiquen en:
Actualment s'especula que segons el lloc d'infecció la clínica de la malaltia pot ser una o una altra, ja que l'especificitat dels diversos serotipus d'adenovirus fa que es puguin agrupar segons la via infectiva:
Les infeccions per adenovirus ocórren majoritàriament al voltant de la primavera, inicis d'estiu o bé a finals d'hivern. És a dir, quan hi ha canvis ambientals i, per tant, quan hi ha més probabilitat de patir estats d'immunodeficiència (quan es produeixen la majoria d'infeccions per altres virus del tipus Rhinovirus o Orthomyxovirus).[5][6]
Com en la majoria d'infeccions virals, la prevenció es basa a seguir els següents hàbits:
- Rentar-se les mans amb aigua i sabó sovint.
- Tapar-se la boca i el nas quan s'estossega.
- Evitar l'escola, la feina en el cas d'estar malalt.
- Evitar al màxim el contacte proper amb persones malaltes.[7]
Existeix una vacuna com a mètode de prevenció contra els adenovirus aprovada per la població d'entre 17 i 50 anys.
Aquesta vacuna actua contra l'adenovirus Tipus 4 i el Tipus 7 concretament. Conté cadenes seleccionades i viables d'adenovirus humans preparades en cultius de fibroblasts diploides d'humà. Aquestes cadenes virals no han sigut atenuades.[8]
No s'ha de confondre amb l'estratègia d'utilitzar adonevirus com a vector per desenvolupar vacunes per altres patogens.
Des del 1971 al 1999 va ser utilitzada pels militars dels Estats Units, però els únics productors van parar la producció. El 2011 l'organització U.S. Food and Drug Administration va aprovar una nova vacuna contra l'adenovirus produïda per Teva Pharmaceuticals, que era igual que la utilitzada durant els anys 1971-1999. Durant l'octubre del 2001 els serveis militars van començar a administrar la nova vacuna durant l'entrenament bàsic i durant el primer any d'administració, la vacuna va prevenir 15,000 casos de malalties respiratòries febrils.
L'administració de la vacuna és oral amb una sola dosis, la qual és important empassar-se sencera i no s'ha de mastegar per evitar que el virus s'alliberi a la zona de les vies respiratòries altes.
La vacuna oral passa de manera intacta a través de l'estòmac fins a l'intestí, a on s'alliberen les cadenes víriques. Aquests adenovirus, amb potència molt baixa, es repliquen en el tracte intestinal i indueixen immunitat a persones amb pocs o sense anticossos neutralitzants.[8]
Una vacuna, com qualsevol altre medicament, pot causar reaccions adverses tot i que el risc que la vacuna causi problemes molt seriosos o la mort de l'individu és extremadament baix.
S'han descrit diferents problemes lleus al cap de 2 setmanes de la vacunació:
- Mal de cap
- Infecció a les vies altes del tracte respiratori (1 persona de cada 3).
- Dolor a les articulacions (1 de cada 6 persones).
- Dolor abdominal, nàusees (1 de cada 7)
També s'han descrit problemes més seriosos al cap de 6 mesos de la vacunació, però en molt pocs casos (1 de cada 100) i hi ha el dubte de si va ser realment a causa de la vacuna:
- Sang a l'orina.
- Pneumònia
- Inflamació de l'estómac o els intestins.[9]
Els adenovirus són els causants de moltes malalties respiratòries del tracte superior però també poden causar conjuntivitis, gastroenteritis, cistitis entre d'altres. Quant a les malalties respiratòries provocades per adenovirus, solen començar en tos i poden anar des d'un simple refredat comú a quadres més greus com pneumònia o bronquitis.
[10] En els nens, els adenovirus sovint causen infeccions del tracte superior que causen febre i mocs. Els adenovirus de tipus 1, 2, 3, 5 i 6 són els majors responsables d'aquestes infeccions. Ocasionalment també poden causar malalties de les vies respiratòries baixes, com ara una pneumònia.
Els adenovirus també causen malalties més greus, com ara la febre faringoconjuntival, aquesta malaltia és causada pels tipus 3 i 7. Els símptomes de la malaltia apareixen sobtadament i desapareixen en menys d'una setmana, entre aquest s'inclouen: conjuntivitis, febre, faringitis, mucositats i inflamació dels nòduls limfàtics del coll.
Aquests virus també poden causar diarrea en nens petits, causant febre i femtes líquides. Aquest problema el causen els adenovirus dels tipus 40 i 41. Els símptomes poden romandre durant dues setmanes.
El 51% de les cistitis hemorràgiques en nens americans i japonesos són causades per una infecció per adenovirus. Els nens que tenen cistitis hemorràgica traurà sang per l'orina aproximadament durant tres dies. Aquests, a més, tindran la necessitat d'anar a orinar freqüentment
En els adults, la majoria d'infeccions per adenovirus provoquen la malaltia respiratòria aguda (ERA), que és provocada pels tipus 4 i 7 d’adenovirus. Els virus provoquen sempre febre, mal de cap, secrecions nasals i tos. També poden ocasionar debilitat, calfreds, mal de cap i la inflamació dels ganglis limfàtics del coll. Aquests símptomes solen durar entre 3 i 5 dies.
Els adenovirus també provoquen la queratoconjuntivitis epidèmica (EKC), que és causada pels tipus 8, 19 i 37. Aquest virus provoca una inflamació dels teixits que recobreixen la parpella i cobreix part del globus ocular. La transmissió d’aquest virus es pot donar per la utilització de lents de contacte contaminades o a partir de l'eixugada de mans o la cara amb una tovallola que contingui els virus.
En els cànids,[11] una malaltia important causada per l’adenovirus caní CAV-1 és l'hepatitis canina infecciosa. El virus es dirigeix a les parts del parènquima (part funcional) dels òrgans, especialment en el fetge, els ronyons, els ulls i les cèl·lules endotelials (cèl·lules que recobreixen la superfície interior dels vasos sanguinis). El virus CAV-1 es replicarà en les cèl·lules de Kupffer (macròfags) del fetge i causarà dany als hepatòcits adjacents. El virus s’eliminarà per la femta i la saliva i podrà infectar altres gossos susceptibles.
Els símptomes dependran sobretot de l'estat immunològic de l'hoste. Un gos amb un estat immunològic correcte, amb 10-14 dies pot eliminar el virus encara que aquest romandrà localitzat en els ronyons i continuarà sent expulsat per l'orina durant 6-9 mesos. Si el gos no presenta un estat immunològic suficient per passar la malaltia sense gaires problemes, els símptomes poden ser diversos. La malaltia pot evolucionar a una etapa hiperaguda que causarà la mort de l'individu, aguda o que la infecció no sigui complicada. En tot cas els símptomes principals seran: febre, anorèxia, letargia, vòmits, diarrea i inflamacions ( en vasos, ganglis, cervell, ull...).
No hi ha raça, gènere, o associacions genètiques per adquirir el virus CAV-1.
[12] El CAV-2 (Adenovirus caní tipus 2 ) es tracta d'un virus que pot causar malalties respiratòries en gossos i és un dels agents infecciosos comunament associats amb la traqueobronquitis infecciosa canina, que també es coneix com "tos de les gosseres". La traqueobronquitis infecciosa canina es transmet generalment a través de la tos. La infecció se sol resoldre sense tractament encara que en algun cas pot conduir a una pneumònia.
En els bòvids, l'adenovirus boví (BAVs)[13] pot causar infeccions tant en les vies respiratòries com en les digestives.
Les infeccions per adenovirus boví es troben probablement en el bestiar arreu del món. El bestiar sovint es trobarà infectat sense mostrar cap signe de malaltia encara que poden aparèixer quan l'animal entra en una situació d'estrès (provoca una baixada de defenses). No obstant això, és més sovint que els animals seroconverteixin (desenvolupament d'anticossos contra el virus causa de l'exposició) sense desenvolupar signes de malaltia.
Curiosament, la infecció per adenovirus boví no s'associa sovint amb canvis bruscs en el tracte gastrointestinal o respiratori. La infecció per adenovirus boví pot estar associada amb una varietat de condicions de malaltia incloent la pneumònia, queratoconjuntivitis, enteritis, síndrome de vedell feble i l'avortament.
Actualment no existeix una vacuna disponible per als adenovirus bovins. Els vedells que se sap que estan infectats amb adenovirus han de ser aïllats, ja que poden transmetre la infecció a través de la femta o secrecions respiratòries.
Quant als èquids, la infecció de l'adenovirus equí (tipus 1 i tipus 2)[14] està molt estesa, però la majoria de les infeccions no donen lloc a signes clínics. No obstant això, en el cas dels poltres àrabs, l’adenovirus pot provocar pneumònia acabant amb la mort de l'animal. Les infeccions per adenovirus són la causa més freqüent de mort en els poltres àrabs amb immunodeficiència combinada (es caracteritza per l'absència de B funcional i limfòcits T).
En cavalls adults, les infeccions per adenovirus no semblen ser un problema important, però algunes vegades poden estar associats amb malalties del tracte respiratori superior i secreció ocular.
En els suids, l'adenovirus porcí causa diarrea i malalties gastrointestinals en garrins i també està sovint implicat en malalties respiratòries multifactorials.
Finalment, en les aus[15] les infeccions per adenovirus es troben en les aus de cria al mercat, i, probablement en totes les espècies d'aus. Les infeccions actuaran a nivell respiratori i gastrointestinal provocant malalties com per exemple enteritis hemorràgica. Moltes infeccions són subclíniques i semblen ser de poca importància econòmica o el benestar, encara que a vegades hi ha brots significatius de malaltia associats a adenovirus. Aquestes malalties no són d'importància per a la salut pública.
[16] Els adenovirus poden causar encefalitis viral, és una infecció poc comuna que pot provocar aquests virus. Normalment serà causada per una alteració dels sistemes de defensa de l’hoste, no pas per la virulència del virus. Hi ha 40 serotipus d'adenovirus que poden causar encefalitis viral. El tipus 7 és el que provoca més casos d'encefalitis viral i s’acompanya d'un quadre de pneumònia greu. Aproximadament la meitat de les infeccions són subclíniques. Els adenovirus només causen el 5% de les encefalitis que es detecten. La mortalitat causada pels adenovirus és al voltant del 15-20%.
L'encefalitis viral provoca un quadre febril, cefalàlgia (mal de cap), alteració de l’estat de consciència, desorientació i trastorns en la conducta i el llenguatge.
Quan hi ha una encefalitis causada per adenovirus, forma part d’un complex multisistèmic afavorit per la virèmia, que inclou: pneumònia, hepatitis, coagulopatia i insuficiència cardíaca. Per tant, la mortalitat del virus no és degut només a l'encefalitis.
El virus pot entrar al Sistema nerviós central a través de les neurones de l’epiteli olfactori, o a través d'una mossegada. A través de les neurones, viatgen pels axons per arribar al SNC.
No existeix cap tractament antiviral específic per les infeccions d'adenovirus. Davant d'una infecció, el tractament està enfocat en gran mesura als símptomes que es presenten.
La majoria de les infeccions per l'adenovirus amb pacients immunocompetents són autolimitades per la resposta immune i experimenten una recuperació completa sense cap tractament específic.[17]
Per exemple, davant una conjuntivitis s'administraran gotes oculars o si el pacient presenta febre, s'administraran medicaments com el paracetamol o ibuprofèn.
En termes generals, és molt important el repòs absolut i aïllament per prevenir l'extensió de la infecció, beure molta aigua i líquids per prevenir la deshidratació.
Actualment, en infeccions molt agudes o en pacients immunodeprimits s'administren Cidofovir i Ribavirina per tractar la infecció. La Ribavirina s'utilitza per tractar la infecció sobretot en pacients que pateixen cistitis hemorràgica o que se sotmeten a un trasplantament de medul·la òssia.[18] Ara bé, l'eficàcia de la Ribavirina és desconegut, ja que no ha estat completament provat en assaigs clínics. També s'utilitza el Cidofovir per tractar la infecció que és un inhibidor de la DNA-polimerasa vírica i és eficaç en la inhibició de la replicació de l'adenovirus en un cultiu. El Cidofovir s'utilitza en casos concrets i greus, ja que no és recomanable perquè produeix danys sobre els ronyons i a més és molt costòs.[19]
Actualment, molts estudis han demostrat l'eficàcia d'utilitzar els adenovirus per la teràpia gènica, és a dir, inserir un gen funcional determinat a un pacient que té aquest gen defectuós.
La particularitat que tenen els adenovirus per la teràpia gènica és que poden afectar a les cèl·lules que es repliquen i les que no; i que aquests vectors no s'integren al genoma de la cèl·lula hoste sinó que es mantenen en diferents còpies en forma de plàsmide. Aquest fet sembla un avantatge encara que obliga a repetir les injeccions, ja que l'expressió es produeix de forma temporal.
Per tant, els adenovirus es fan servir com un vector per administrar la teràpia gènica. Aquesta teràpia és especialment important en la fibrosi quística.[20]
Els adenovirus (Adenoviridae) són un tipus de virus de mida mitjana (entre 60 i 90 nm), que es caracteritzen per tenir el material genètic en una doble cadena d'ADN no circular. Tenen un pes molecular petit i no tenen coberta externa. Són virus que afecten vertebrats i es transmeten per via digestiva, per contacte directe i per respiració. Poden provocar infeccions a les vies respiratòries, conjuntivitis, cistitis hemorràgica i gastroenteritis.
El seu criptograma és D/2: 20-30/12-17: S/S: V/I,O,R.
El nom d'adenovirus prové de la paraula grega "adeno", que signifíca glàndula, ja que es van descobrir a partir de cultius de cèl·lules extretes de diferents glàndules.
Adenoviridae er en virusfamilie der tilhører gruppen af dobbeltstrenget DNA-virus (gruppe I, dsDNA).
Der kendes 34 typer, der inficerer mennesker. De foretrækker slimhinder og kan opholde sig i årevis i lymfevæv. Visse typer kan medføre tumorer hos nyfødte hamstere.
De forårsager:
Adenoviridae er en virusfamilie der tilhører gruppen af dobbeltstrenget DNA-virus (gruppe I, dsDNA).
Der kendes 34 typer, der inficerer mennesker. De foretrækker slimhinder og kan opholde sig i årevis i lymfevæv. Visse typer kan medføre tumorer hos nyfødte hamstere.
De forårsager:
Akut respiratorisk sygdom Febril catarrhalia Pharyngitis ConjunctivitisDie Familie Adenoviridae (von altgriechisch ἀδήν ‚Drüse‘) oder Adenoviren (Einzahl: Adenovirus) umfasst unbehüllte Viren mit einer doppelsträngigen, linearen DNA (Desoxyribonukleinsäure) als Genom. Ihr Kapsid hat eine ikosaedrische Symmetrie und besitzt einen besonderen, die Virusfamilie charakterisierenden Aufbau aus Penton- und Hexon-Kapsomeren. An den Pentonen sind typische, antennenartige Fiberproteine verankert, die den Virionen der Familie ihr „satellitenartiges“ Erscheinungsbild geben. Die Familie beinhaltet derzeit 47 human- und tierpathogene Virusspezies mit zahlreichen Subtypen bei Säugetieren, Vögeln, Reptilien und Fischen. Beim Menschen verursachen die humanen Adenoviren überwiegend Erkrankungen der Atemwege.
Die ersten Adenoviren wurden 1953 von einer Arbeitsgruppe um Wallace P. Rowe und Robert J. Huebner aus Tonsillen und anderem adenoidem Drüsengewebe von Kindern isoliert und in einer Zellkultur vermehrt.[2][3] Diese unter anderem bei Erkältungskrankheiten vorgefundenen Viren wurden auch als Adenoidal-Pharyngeal-Conjunctival-Viren (APC-Viren) und Adenoid Degeneration Agents (A-D-Agents, im Deutschen AD-Agens) bezeichnet, da sie in adenoidem Gewebe nekrotische Veränderungen verursachen.[4]
In der Geschichte der Molekularbiologie spielen die Adenoviridae eine bedeutende Rolle, da bei ihnen 1977 ein grundlegender Prozess der Genexpression entdeckt wurde, das so genannte Spleißen. In der Gentechnik und der virologischen Forschung sind Adenoviren für das Einschleusen von DNA als viraler Vektor in Zellen und Organismen von gewisser Bedeutung.
Die unbehüllten Kapside der Adenoviridae sind zwischen 70 und 90 nm im Durchmesser groß und bestehen aus 252 Kapsomeren. Von diesen Kapsomeren existieren zwei unterschiedliche Typen: 12 der sogenannten Pentone und 240 der Hexone. Die Hexone (8–10 nm) bestehen aus einem Trimer des Hexonproteins (Virusprotein II, Molekülmasse 120 kDa) und sind bei Mitgliedern der Gattung Mastadenovirus durch weitere hexonassoziierte Proteine an ihren Kontaktstellen stabilisiert (VP IX, X, XI). An der Innenseite der Hexone befinden sich zwei weitere Proteine (VP VI und VIII), die gleichzeitig mit Proteinen des innersten Nukleoproteinkomplexes interagieren. Das VP VI befindet sich in ringförmiger Anordnung nur an den fünf Hexonen, die jeweils um ein Penton gelagert sind.
Die Pentone befinden sich an den Ecken der ikosaedrischen Symmetrie (an den Achsenpunkten der fünfstrahligen Symmetrieachse) und bestehen aus einem Pentamer des Pentonbasisproteins (VP III, 80 kDa) und dem pentonbasisassoziierten Protein (VP IIIa, 66 kDa). An den Pentonen setzen die – je nach Spezies zwischen 9 und 77,5 nm langen – Fibern (spikes) an, die aus Trimeren des glykosylierten Fiberproteins (VP IV, 62 kDa) zusammengesetzt sind. Innerhalb der Gattung Aviadenovirus bestehen die Fibern aus zwei unterschiedlichen Fiberproteinen.
Das Fiberprotein vermittelt die Bindung an die Oberfläche der Wirtszelle und induziert die gruppenspezifischen Antikörper. Einen Nachteil von unbehüllten Viren gegenüber behüllten können die Adenoviren daher aufgrund der Fiberstruktur umgehen: Eine Anpassung an einen neuen Wirt oder eine neue Zielzelle (damit einem neuen Rezeptor) können unbehüllte Viren gewöhnlich nur durch Mutationen ihrer äußersten Kapsidproteine realisieren; diese Mutationen können jedoch zu einer Instabilität des Kapsids oder dem vollständigen Verlust seiner Verpackungsfähigkeit führen. Die Adenoviren haben hingegen die Möglichkeit, neue Varianten allein durch Mutationen der Fiberstrukturen zu entwickeln und das komplexe Kapsid unverändert beizubehalten.
Das Innere (Core) der Adenoviren ist von einem Nukleoproteinkomplex angefüllt, der aus dem doppelsträngigen, linearen DNA-Genom besteht, an das die basischen Proteine VP VII und X (bei der Gattung Mastadenovirus zusätzlich VP V) angelagert sind. Zusätzlich befindet sich an beiden 5’-Enden der dsDNA ein kovalent gebundenes Protein, das sogenannte Terminale Protein (TP).
Das Genom ist zwischen 26 und 45 kBp lang und enthält an beiden Enden repetitive Sequenzen, die so genannten ITRs (Inverted terminal repeats). Innerhalb der Familie ist der zentrale Anteil des Genoms, der überwiegend für die Strukturproteine des Kapsids codiert, sehr konserviert. Die Gattungen unterscheiden sich jedoch wesentlich in der DNA-Sequenz und deren Genprodukte an den Enden des Genoms.
Die Systematik nach ICTV (Stand November 2018) beinhaltet u. a. folgende Spezies:
Schimpansen-Adenoviren: Aus Schimpansen isolierte Adenoviren werden aufgrund ihrer großen Ähnlichkeit mit bestimmten Humanen Adenoviren (HAdVs) in „menschliche“ Adenovirus-Arten klassifiziert. So gehören die Simian-Adenoviren SAdV-22 bis SAdV-25 zur Spezies Human-Mastadenovirus E und SAdV-21 zur Spezies Human-Mastadenovirus B.[11]
Der Phage PRD1 (Familie Tectiviridae) zeigt in der Struktur des Kapsids und der Schwanzfibern auffällige Ähnlichkeiten mit Adenoviren. Auch die Anordnung einiger Gene auf dem Genom dieses Phagen (DNA-Polymerase, Terminales Protein) und das Vorhandensein zweier ITRs (Inverted terminal repeats) zeigt Analogien, was insgesamt auf einen stammesgeschichtlichen Zusammenhang mit den Adenoviren hindeutet.[12] Beide Familien wurden daher vom ICTV im März 2020 in dieselbe Klasse Tectiliviricetes gestellt.[1]
In Pflanzen und Pilzen findet sich, teils im Cytoplasma oder innerhalb der Mitochondrien, ein lineares Plasmid (z. B. das „Killer-Plasmid“ der Hefe), das eine ähnliche Anordnung der Gene für die ITRs, die Polymerase und das Terminale Protein zeigt.
Die Schwanzfibern vieler Mitglieder der Adenoviridae und das Coxsackievirus B nutzen den gleichen Rezeptor CAR (Coxsackie-Adenovirus-Rezeptor) zur Erkennung von Zielzellen. Darüber hinaus haben die adenoviralen Schwanzfibern strukturelle Ähnlichkeiten mit einem Anheftungsprotein innerhalb der Reoviridae.
Humane Adenoviren (vor allem Typ 5 aus der Spezies C) sind ein im Labor weit verbreiteter gentherapeutischer Vektor.
Die als Vektor verwendeten Viren sind replikationsgehemmt. Ihnen fehlt eine Genregion, die für die Vermehrung notwendig ist.[20]
Neben humanen Adenoviren werden auch aus Schimpansen-Adenoviren (ChAd oder AdC) abgeleitete nicht-replizierende Vektoren getestet. Vorteile gegenüber humanen Adenoviren ist bei ChAd die vernachlässigbare Seroprävalenz unter Menschen.[24] Zudem vermittelt eine bestehende Immunität gegenüber humanen Adenoviren des Types 5 keine gegenüber ChAd. Im Mittelpunkt steht hierbei ChAdOx1, das vom Jenner Institute (in Oxford) entwickelt wurde. ChAdOx1 wird als Impfstoff gegen verschiedene Krankheiten klinisch geprüft bzw. ist bereits zugelassen:
Neben ChAdOx1 wird auch die Plattform ChAd-SARS-CoV-2-S als potentieller Impfstoff gegen SARS-CoV-2 entwickelt, es liegen bereits erste tierexperimentelle Daten zur Wirksamkeit vor.[29]
Humane Adenoviren verursachen eine Vielzahl von unterschiedlichen Erkrankungen. Die unterschiedlichen Spezies A–G der Adenoviren sind nicht eindeutig einem Krankheitsbild zuzuordnen. Die Erkrankungen, die durch humane Adenoviren ausgelöst werden, können von leichten bis schweren Atemwegsinfektionen, über disseminierte (verteilte) Infektionen bei immunsupprimierten Kindern, als auch Durchfälle sein. Vor allem ist das humane Adenovirus (Typ 19) bekannt dafür Keratokonjunctivitiden (Augenentzündung mit Beteiligung der Cornea) auszulösen.[30] Nach einer US-Studie soll das Adenovirus 36 menschliches Fettgewebe dazu veranlassen, sich in besonders große Fettzellen zu verwandeln, wodurch eine Dickleibigkeit hervorgerufen werden kann.[31][32]
Die Familie Adenoviridae (von altgriechisch ἀδήν ‚Drüse‘) oder Adenoviren (Einzahl: Adenovirus) umfasst unbehüllte Viren mit einer doppelsträngigen, linearen DNA (Desoxyribonukleinsäure) als Genom. Ihr Kapsid hat eine ikosaedrische Symmetrie und besitzt einen besonderen, die Virusfamilie charakterisierenden Aufbau aus Penton- und Hexon-Kapsomeren. An den Pentonen sind typische, antennenartige Fiberproteine verankert, die den Virionen der Familie ihr „satellitenartiges“ Erscheinungsbild geben. Die Familie beinhaltet derzeit 47 human- und tierpathogene Virusspezies mit zahlreichen Subtypen bei Säugetieren, Vögeln, Reptilien und Fischen. Beim Menschen verursachen die humanen Adenoviren überwiegend Erkrankungen der Atemwege.
Die ersten Adenoviren wurden 1953 von einer Arbeitsgruppe um Wallace P. Rowe und Robert J. Huebner aus Tonsillen und anderem adenoidem Drüsengewebe von Kindern isoliert und in einer Zellkultur vermehrt. Diese unter anderem bei Erkältungskrankheiten vorgefundenen Viren wurden auch als Adenoidal-Pharyngeal-Conjunctival-Viren (APC-Viren) und Adenoid Degeneration Agents (A-D-Agents, im Deutschen AD-Agens) bezeichnet, da sie in adenoidem Gewebe nekrotische Veränderungen verursachen.
In der Geschichte der Molekularbiologie spielen die Adenoviridae eine bedeutende Rolle, da bei ihnen 1977 ein grundlegender Prozess der Genexpression entdeckt wurde, das so genannte Spleißen. In der Gentechnik und der virologischen Forschung sind Adenoviren für das Einschleusen von DNA als viraler Vektor in Zellen und Organismen von gewisser Bedeutung.
Adenoviruslar (yun. aden – bez va viruspar) – tarkibida DNK gruppasi 191bo‘lgan, odam va hayvonlarda adenovirus kasalliklarini qo‘zg‘atuvchi viruslar. Ular nafas yo‘llaridagi bez (adenoid) to‘qimalarida yashab, o‘tkir katar, kon’-yunktivit, enterokolit, atipik pnev-moniya va boshqa kasalliklarni qo‘zg‘atadi. A.odamning adenoidlaridan va mur-tak bezlaridan, shuningdek me’da-icha-klaridan ajratib olingan. Kattaligi 70–90 mmk. Ularning odamda kasallik qo‘zg‘atuvchi 30 dan ortiq turi ma’lum.[1]
Adenoviruslar (yun. aden – bez va viruspar) – tarkibida DNK gruppasi 191bo‘lgan, odam va hayvonlarda adenovirus kasalliklarini qo‘zg‘atuvchi viruslar. Ular nafas yo‘llaridagi bez (adenoid) to‘qimalarida yashab, o‘tkir katar, kon’-yunktivit, enterokolit, atipik pnev-moniya va boshqa kasalliklarni qo‘zg‘atadi. A.odamning adenoidlaridan va mur-tak bezlaridan, shuningdek me’da-icha-klaridan ajratib olingan. Kattaligi 70–90 mmk. Ularning odamda kasallik qo‘zg‘atuvchi 30 dan ortiq turi ma’lum.
Οι Αδενοϊοί (Adenoviridae) είναι μεσαίου μεγέθους, χωρίς φάκελο, εικοσαεδρικοί ιοί, οι οποίοι αποτελούνται από ένα πυρηνοκαψίδιο και το γονιδίωμά τους είναι γραμμικό δίκλωνο DNA (ομάδα Ι κατά Baltimore). Έχουν περιγραφεί 57 ορότυποι στον άνθρωπο και είναι υπεύθυνοι για το 5-10% των λοιμώξεων του ανώτερου αναπνευστικού συστήματος στα παιδιά, ενώ προσβάλλουν και ενήλικες. Ταξινομούνται στα επτά υπογένη, A-G.
Οι αδενοϊοί αποτελούν τους μεγαλύτερους άνευ φακέλου ιούς, με διάμετρο 90-100 nm). Λόγω του μεγάλου μεγέθους τους, είναι σε θέση να μεταφερθούν μέσω του ενδοσώματος (δηλ., σύντηξη περιβλήματος δεν είναι απαραίτητη). Το ιοσωμάτιο έχει επίσης μια μοναδική «ακίδα» ή ίνα που συνδέεται σε ακμή του καψιδίου (βλ. εικόνα παρακάτω) που βοηθά στην προσκόλληση στο κύτταρο ξενιστή μέσω του υποδοχέα αδενοϊού-coxsackie στην επιφάνεια του κυττάρου ξενιστή.
Το 2010, οι επιστήμονες ανακοίνωσαν ότι είχαν βρει τη δομή του ανθρώπινου αδενοϊού σε ατομικό επίπεδο, δημιουργώντας το μεγαλύτερο υψηλής ανάλυσης μοντέλο που έχει φτιαχτεί. Ο ιός αποτελείται από περίπου 1 εκατομμύριο αμινοξέα και ζυγίζει περίπου 150 MDa.
Το γονιδίωμα του αδενοϊού είναι γραμμικό, μη τμηματικό δικλωνικό (ds) DNA που είναι μεταξύ 26 και 45 Kbp. Αυτό επιτρέπει στον ιό να μεταφέρει θεωρητικά 22 προς 40 γονίδια. Αν και αυτά είναι σημαντικά περισσότερα από ό,τι άλλων ιών στην ίδια κατά Baltimore ομάδα, εξακολουθεί να είναι ένας πολύ απλός ιός και εξαρτάται σε μεγάλο βαθμό στο κύτταρο ξενιστή για την επιβίωση και αντιγραφή. Ένα ενδιαφέρον χαρακτηριστικό αυτού του ιικού γονιδιώματος είναι ότι έχει μία τερματική 55 kDa πρωτεΐνη που σχετίζεται με κάθε ένα από τα 5' άκρα του γραμμικού dsDNA. Αυτές χρησιμοποιούνται ως εκκινητές στην αντιγραφή του ιού και διασφαλίζουν ότι τα άκρα του γραμμικού γονιδιώματος του ιού έχουν αντιγραφεί επαρκώς.
Αδενοϊοί διαθέτουν γραμμικό dsDNA για γονιδίωμα και είναι σε θέση να αντιγράφονται στον πυρήνα των κυττάρων των θηλαστικών όπου χρησιμοποιούν τους μηχανισμούς αντιγραφής του ξενιστή.
Η είσοδος των αδενοϊών στο κύτταρο ξενιστή περιλαμβάνει δύο είδη αλληλεπιδράσεων μεταξύ του ιού και του κυττάρου-ξενιστή. Μεγαλύτερο μέρος της δράσης λαμβάνει χώρα στις κορυφές. Την είσοδο στο κύτταρο ξενιστή ξεκινά με την σύνδεση του τομέα «πόμολο» της ακιδόμορφης πρωτεΐνης με τον υποδοχέα κυττάρου. Οι δύο καθορισμένοι σήμερα υποδοχείς είναι ο CD46 για το υπογένος Β του ανθρώπινου αδενοϊού και για τους υπόλοιπους ορότυπους ο υποδοχέας των ιών Κοξάκι και των αδενοϊών (CAR). Υπάρχουν κάποιες αναφορές που υποδηλώνουν ότι το μείζον σύμπλεγμα ιστοσυμβατότητας και τα σιαλικά οξέα μπορεί να είναι και αυτά υποδοχείς. Μετά ακολουθεί μία δευτερεύουσα αλληλεπίδραση, όπου ένα εξειδικευμένο μοτίβο στην βάση της πρωτεΐνης αλληλεπιδρά με ένα μόριο ιντεγκρίνης. Είναι η αλληλεπίδραση συν-υποδοχέα η οποία διεγείρει εσωτερικοποίηση του αδενοϊού. Αυτός ο συν-υποδοχέας είναι η ιντεγκρίνη αν. Σύνδεση με την αν ιντεγκρίνη έχει ως αποτελέσματα την ενδοκυττάρωση του σωματιδίου του ιού μέσω ενός ενδοσώματος καλυμμένου με κλαθρίνη. Η ενδοκυττάρια σηματοδότηση επάγει τον πολυμερισμό της ακτίνης με αποτέλεσμα την είσοδο του λοιμογόνου παράγοντα στο κύτταρο ξενιστή μέσα σε ένα ενδόσωμα.[1]
Μόλις ο ιός έχει μπει επιτυχώς στο κύτταρο ξενιστή, το ενδόσωμα γίνεται πιο όξινο, κατάσταση η οποία μεταβάλλει την τοπολογία του ιού προκαλώντας το διαχωρισμό των συστατικών του καψιδίου. Αυτές οι μεταβολές, καθώς και η τοξική φύση μέρους του καψιδίου, οδηγούν στην απελευθέρωση του ιοσωματίου στο κυτταρόπλασμα. Με τη βοήθεια των κυτταρικών μικροσωληνίσκων, ο ιός μεταφέρεται στο πυρηνικό σύμπλεγμα πόρου, όπου το σωματίδιο αδενοϊού αποσυναρμολογεί. Το ιικό DNA στη συνέχεια απελευθερώνεται και μπορεί να εισέλθει στο πυρήνα μέσω του πόρου.[2]
Ο κύκλος ζωής αδενοϊού διαχωρίζεται από τη διαδικασία αντιγραφής του DNA σε δύο φάσεις: μια πρώιμη και μια όψιμη φάση. Σε αμφότερες τις φάσεις, ένα πρωτεύον μεταγράφημα που ματίζεται εναλλακτικά και μπορεί να παράγει μονοσιστρονικά mRNAs συμβατά με το ριβόσωμα του ξενιστή, επιτρέποντας την μετάφρασή τους.
Τα πρώιμα γονίδια είναι υπεύθυνα για την έκφραση κυρίως μη-δομικών, ρυθμιστικών πρωτεϊνών. Ο στόχος αυτών των πρωτεϊνών είναι τριπλός: να μεταβάλλουν την έκφραση των πρωτεϊνών ξενιστή που είναι απαραίτητες για τη σύνθεση DNA, να ενεργοποιήσουν άλλα γονίδια ιών (όπως η ιική DNA πολυμεράση) και να αποφευχθεί ο πρόωρος θάνατος του μολυσμένου κυττάρου μέσω της ανοσολογικής άμυνας (σταμάτημα της απόπτωσης, παρεμπόδιση της δραστηριότητας της ιντερφερόνης και μπλοκάρισμα του Μείζονος Συμπλέγματος Ιστοσυμβατός τάξης Ι).
Μερικοί αδενοϊοί υπό εξειδικευμένες συνθήκες μπορεί να μετατρέψουν κύτταρα χρησιμοποιώντας πρώιμα προϊόντα των γονιδίων τους. Η Ε1Α (που δεσμεύει την πρωτεΐνη του ρετινοβλαστωματος) έχει βρεθεί ότι μπορεί να κάνει αθάνατα πρωτογενή κύτταρα in vitro επιτρέποντας στην Ε1Β (δεσμεύει την p53) να βοηθήσει και σταθερά να μετασχηματίσει τα κύτταρα. Παρ 'όλα αυτά, εξαρτώνται η μία από την άλλη για να κάνουν επιτυχημένα ένα κύτταρο ογκογόνο.
Η αντιγραφή του DNA διαχωρίζει στις πρώιμες και όψιμες φάσεις. Μόλις τα πρώιμα γονίδια έχουν απελευθερωθεί επαρκείς πρωτεΐνες του ιού, τα μηχανισμούς αντιγραφής και τα υποστρώματα αντιγραφής, η αντιγραφή του γονιδιώματος του αδενοϊού μπορεί να συμβεί. Μία τερματική πρωτεΐνη που είναι ομοιοπολικά συνδεδεμένη με το 5' άκρο του γονιδιώματος του αδενοϊού δρα ως εκκινητής για την αντιγραφή. Η ιική DNA πολυμεράση κατόπιν χρησιμοποιεί ένα μηχανισμό μετατόπισης κλώνου, σε αντίθεση με τα συμβατικά θραύσματα του Οκαζάκι που χρησιμοποιούνται στην αντιγραφή του DNA θηλαστικού, να αναπαράγουν το γονιδίωμα.
Η όψιμη φάση του κύκλου του αδενοϊού εστιάζεται στην παραγωγή επαρκών ποσοτήτων δομική πρωτεΐνη να συσκευάσουν όλο το γενετικό υλικό που παράγεται από την αντιγραφή του DNA. Μόλις τα ιικά συστατικά έχουν επιτυχώς αναπαραχθεί, ο ιός συναρμολογείται σε κελύφη πρωτεΐνης και απελευθερώνονται από το κύτταρο, ως με αποτέλεσμα την κυτταρική λύση.
Οι αδενοϊοί είναι ασυνήθιστα σταθεροί σε χημικούς ή φυσικούς παράγοντες και αντίξοες συνθήκες ρΗ, επιτρέποντας την παρατεταμένη επιβίωση έξω από το σώμα και το νερό. Οι αδενοϊοί μεταδίδονται κυρίως μέσω σταγονιδίων, αλλά μπορεί και μέσω της κοπρανοστοματικής οδού. Με τα δάκτυλα διασπείρεται στους οφθαλμούς.
Οι αδενοϊοί μπορούν να προκαλέσουν εμπύρετες λοιμώξεις του ανώτερου αναπνευστικού, εμπύρετη φαρυγγοεπιπεφυκίτιδα, οξεία αναπνευστική νόσος, πνευμονία, επιδημική κερατοεπιπεφυκίτιδα, κοκκυτοειδές σύνδρομο, οξεία αιμοραγική κυστίτιδα, γαστρεντερίτιδα, ηπατίτιδα, σοβαρά συμπτώματα σε ασθενείς με AIDS και ανοσοκατασταλμένους ασθενείς και μηνιγγίτιδα.
Οι αδενοϊοί είναι από οι πιο κοινοί φορείς που χρησιμοποιούνται για την εισαγωγή τμημάτων DNA σε άλλα κύτταρα. Οι αδενοϊοί έχουν ένα πολύ αποτελεσματικό μηχανισμό εισόδου στο πυρήνα του κυττάρου, μπορούν να παραχθούν σε μεγάλες ποσότητες και να «μολύνουν» μεγάλο αριθμό κυττάρων, έχουν χαμηλή παθογονικότητα στον άνθρωπο και μπορούν να μεταφέρουν μεγάλα τμήματα γονιδίων (ακόμη και μεγαλύτερα από 30 kb), χαρακτηριστικά που τους καθιστούν πολύ χρήσιμους.[3][4] Ένα από τα κύρια μειονεκτήματα που παρουσιάζει η χρήση τους είναι το γεγονός ότι οι πρωτεΐνες των αδενοϊών αναγνωρίζονται από το ανοσοποιητικό σύστημα του ξενιστή, αν και οι αδενοϊοί διαθέτους μηχανισμούς μέσω των οποίων διαφεύγουν από την άμυνα του ξενιστή.[5]
Οι αδενοϊοί, και οι συγκεκριμένα οι conditionally replicating adenoviruses (CRAds), έχουν βρεθεί ότι πέρα από το να μεταφέρουν γονίδια σε περιπτώσεις γενετικής θεραπείας, έχουν την ικανότητα να σκοτώνουν επιλεκτικά καρκινικά κύτταρα μέσω της κυτταρικής λύσης. Αφού λύσουν ένα καρκινικό κύτταρο, οι νέοι αδενοϊοί μπορούν να μολύνουν άλλα καρκινικά κύτταρα. Επίσης, μπορούν να μεταφέρουν θεραπευτικό γονίδιο στα καρκινικά κύτταρα.[6]
Οι Αδενοϊοί (Adenoviridae) είναι μεσαίου μεγέθους, χωρίς φάκελο, εικοσαεδρικοί ιοί, οι οποίοι αποτελούνται από ένα πυρηνοκαψίδιο και το γονιδίωμά τους είναι γραμμικό δίκλωνο DNA (ομάδα Ι κατά Baltimore). Έχουν περιγραφεί 57 ορότυποι στον άνθρωπο και είναι υπεύθυνοι για το 5-10% των λοιμώξεων του ανώτερου αναπνευστικού συστήματος στα παιδιά, ενώ προσβάλλουν και ενήλικες. Ταξινομούνται στα επτά υπογένη, A-G.
Аденовирусҳо (лот. Adenoviridae, аз юнонӣ aden – ғадуд ва вирусҳо) — як гурӯҳи вирусҳо, ки ангезандаи бемориҳои гуногун (назлаи шадиди роҳҳои нафас, конъюнктивит, илтиҳоби шуш, илтиҳоби рӯдаҳо ва ғайра) мебошанд. Аденовирусҳо аз ҳуҷайраи аденоидҳо ва бодомакҳои одам, ки он ҷо дар ҳолати нофаъол қарор доранд, ҷудо карда шудаанд. Аденовирусҳои маймунҳо, гов, муш ва парандаҳо низ маълуманд. Аденовирусҳо аз ҷилди сафедавӣ ва ДНК, ки дар маркази вирион воқеанд, таркиб ёфтаанд. Аденовирусҳо липид надоранд. Андозаи Аденовирусҳо 70 – 90 ммк аст.
Аденовирусҳо (лот. Adenoviridae, аз юнонӣ aden – ғадуд ва вирусҳо) — як гурӯҳи вирусҳо, ки ангезандаи бемориҳои гуногун (назлаи шадиди роҳҳои нафас, конъюнктивит, илтиҳоби шуш, илтиҳоби рӯдаҳо ва ғайра) мебошанд. Аденовирусҳо аз ҳуҷайраи аденоидҳо ва бодомакҳои одам, ки он ҷо дар ҳолати нофаъол қарор доранд, ҷудо карда шудаанд. Аденовирусҳои маймунҳо, гов, муш ва парандаҳо низ маълуманд. Аденовирусҳо аз ҷилди сафедавӣ ва ДНК, ки дар маркази вирион воқеанд, таркиб ёфтаанд. Аденовирусҳо липид надоранд. Андозаи Аденовирусҳо 70 – 90 ммк аст.
Adenoviridae waa nuuc fayrus oo ka mid ah bahda DNA-fayrus.
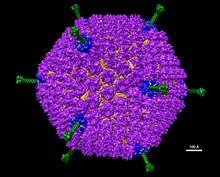
Adenoviruses (members of the family Adenoviridae) are medium-sized (90–100 nm), nonenveloped (without an outer lipid bilayer) viruses with an icosahedral nucleocapsid containing a double-stranded DNA genome.[2] Their name derives from their initial isolation from human adenoids in 1953.[3]
They have a broad range of vertebrate hosts; in humans, more than 50 distinct adenoviral serotypes have been found to cause a wide range of illnesses, from mild respiratory infections in young children (known as the common cold) to life-threatening multi-organ disease in people with a weakened immune system.[2]
This family contains the following genera:[4]
In humans, currently there are 88 human adenoviruses (HAdVs) in seven species (Human adenovirus A to G):[5]
Different types/serotypes are associated with different conditions:[12]
All these types are called Human mastadenovirus A–G by the ICTV, because all are members of the genus Mastadenovirus.

Adenoviruses are medium-sized (90–100 nm).[2] The virions are composed of one linear piece of double-stranded DNA inside an icosahedral capsid. 240 hexon proteins make up the bulk of the capsid, while twelve penton bases cap the icosahedron's corners. The penton bases are associated with protruding fibers that aid in attachment to the host cell via the receptor on its surface.[14]
In 2010, the structure of the human adenovirus was solved at the atomic level, making it the largest high-resolution model ever. The virus is composed of around 1 million amino acid residues and weighs around 150 MDa.[15][16]
The adenovirus genome is linear, non-segmented double-stranded (ds) DNA that is between 26 and 48 Kbp.[2] This allows the virus to theoretically carry 22 to 40 genes. Although this is significantly larger than other viruses in its Baltimore group, it is still a very simple virus and is heavily reliant on the host cell for survival and replication. An interesting feature of this viral genome is that it has a terminal 55 kDa protein associated with each of the 5' ends of the linear dsDNA. These are used as primers in viral replication and ensure that the ends of the virus' linear genome are adequately replicated.
Adenoviruses possess a linear dsDNA genome and are able to replicate in the nucleus of vertebrate cells using the host's replication machinery.[2] Entry of adenoviruses into the host cell involves two sets of interactions between the virus and the host cell.[2] Most of the action occurs at the vertices. Entry into the host cell is initiated by the knob domain of the fiber protein binding to the cell receptor.[2] The two currently established receptors are: CD46 for the group B human adenovirus serotypes and the coxsackievirus/adenovirus receptor (CAR) for all other serotypes.[2] There are some reports suggesting MHC molecules and sialic acid residues functioning in this capacity as well. This is followed by a secondary interaction, where a motif in the penton base protein (see capsomere) interacts with an integrin molecule. It is the co-receptor interaction that stimulates entry of the adenovirus. This co-receptor molecule is αV integrin. Binding to αv integrin results in endocytosis of the virus particle via clathrin-coated pits. Attachment to αV integrin stimulates cell signaling and thus induces actin polymerization, which facilitates clathrin-mediated endocytosis, and results in virion's entry into the host cell within an endosome.[17]
Once the virus has successfully gained entry into the host cell, the endosome acidifies, which alters virus topology by causing capsid components to disband. The capsid is destabilized and protein VI, which is one of the capsid constituents (see Adenovirus genome) is released from it.[18] These changes, as well as the toxic nature of the pentons, destroy the endosome, resulting in the movement of the virion into the cytoplasm.[2] With the help of cellular microtubules, the virus is transported to the nuclear pore complex, whereby the adenovirus particle disassembles. Viral DNA is subsequently released, which can enter the nucleus via the nuclear pore.[19] After this the DNA associates with histone molecules already present in the nucleus, which allows it to interact with the host cell transcription machinery. Then, viral gene expression can occur, without integrating the viral genome into host cell chromosomes,[20] and new virus particles can be generated.
The adenovirus life cycle is separated by the DNA replication process into two phases: an early and a late phase.[2] In both phases, a primary transcript that is alternatively spliced to generate monocistronic mRNAs compatible with the host's ribosome is generated, allowing for the products to be translated.
The early genes are responsible for expressing mainly non-structural, regulatory proteins.[2] The goal of these proteins is threefold: to alter the expression of host proteins that are necessary for DNA synthesis; to activate other virus genes (such as the virus-encoded DNA polymerase); and to avoid premature death of the infected cell by the host-immune defenses (blockage of apoptosis, blockage of interferon activity, and blockage of MHC class I translocation and expression).
Some adenoviruses under specialized conditions can transform cells using their early gene products. E1A (binds Retinoblastoma tumor suppressor protein) has been found to immortalize primary cells in vitro allowing E1B (binds p53 tumor suppressor) to assist and stably transform the cells. Nevertheless, they are reliant upon each other to successfully transform the host cell and form tumors. E1A is mostly intrinsically disordered protein and contains CR3 domain which is critical for transcriptional activation.[21]
DNA replication separates the early and late phases. Once the early genes have liberated adequate virus proteins, replication machinery, and replication substrates, replication of the adenovirus genome can occur. A terminal protein that is covalently bound to the 5' end of the adenovirus genome acts as a primer for replication. The viral DNA polymerase then uses a strand displacement mechanism, as opposed to the conventional Okazaki fragments used in mammalian DNA replication, to replicate the genome.
The late phase of the adenovirus lifecycle is focused on producing sufficient quantities of structural protein to pack all the genetic material produced by DNA replication.[2] Once the viral components have successfully been replicated, the virus is assembled into its protein shells and released from the cell as a result of virally induced cell lysis.[2]
Adenovirus is capable of multiplicity reactivation (MR)[22] (Yamamoto and Shimojo, 1971). MR is the process by which two, or more, virus genomes containing lethal damage interact within the infected cell to form a viable virus genome. Such MR was demonstrated for adenovirus 12 after virions were irradiated with UV light and allowed to undergo multiple infection of host cells.[22] In a review, numerous examples of MR in different viruses were described, and it was suggested that MR is a common form of sexual interaction that provides the survival advantage of recombinational repair of genome damages.[23]
Adenoviruses are unusually stable to chemical or physical agents and adverse pH conditions, allowing for prolonged survival outside of the body and water. Adenoviruses are spread primarily via respiratory droplets, however they can also be spread by fecal routes and via aerosols (airborne transmission).[24] Research into the molecular mechanisms underlying adenoviral transmission provide empirical evidence in support of the hypothesis that coxsackievirus/adenovirus receptors (CARs) are needed to transport adenoviruses into certain naive/progenitor cell types.[25]
Humans infected with adenoviruses display a wide range of responses, from no symptoms at all to the severe infections typical of Adenovirus serotype 14.
Bat adenovirus TJM (Bt-AdV-TJM) is a novel species of the Mastadenovirus genus isolated from Myotis and Scotophilus kuhlii in China.[26] It is most closely related to the tree shrew and canine AdVs.[27]
Two types of canine adenoviruses are well known, type 1 and 2. Type 1 (CAdV-1) causes infectious canine hepatitis, a potentially fatal disease involving vasculitis and hepatitis. Type 1 infection can also cause respiratory and eye infections. CAdV-1 also affects foxes (Vulpes vulpes and Vulpes lagopus) and may cause hepatitis and encephalitis. Canine adenovirus 2 (CAdV-2) is one of the potential causes of kennel cough. Core vaccines for dogs include attenuated live CAdV-2, which produces immunity to CAdV-1 and CAdV-2. CAdV-1 was initially used in a vaccine for dogs, but corneal edema was a common complication.[28]
Squirrel adenovirus (SqAdV) is reported to cause enteritis in red squirrels in Europe, while gray squirrels seem to be resistant. SqAdV is most closely related to the adenovirus of guinea pigs (GpAdV).
Adenovirus in reptiles is poorly understood, but research is currently in progress.
Adenoviruses are also known to cause respiratory infections in horses, cattle, pigs, sheep, and goats. Equine adenovirus 1 can also cause fatal disease in immunocompromised Arabian foals, involving pneumonia and destruction of pancreatic and salivary gland tissue.[28] Tupaia adenovirus (TAV) (tree shrew adenovirus 1) has been isolated from tree shrews.
Otarine adenovirus 1 has been isolated from sea lions (Zalophus californianus).[29]
The fowl adenoviruses are associated with many disease conditions in domestic fowl like inclusion body hepatitis, hydropericardium syndrome,[30] Egg drop syndrome, Quail bronchitis, Gizzard erosions and many respiratory conditions. They have also been isolated from wild black kites (Milvus migrans).[31]
Titi monkey adenovirus was isolated from a colony of monkeys.[32]
Currently there is a vaccine for adenovirus type 4 and 7 for US military personnel only. US military personnel are the recipients of this vaccine because they may be at a higher risk of infection. The vaccine contains a live virus, which may be shed in stool and lead to transmission. The vaccine is not approved for use outside of the military, as it has not been tested in studied in the general population or on people with weakened immune systems.[33]
In the past, US military recruits were vaccinated against two serotypes of adenovirus, with a corresponding decrease in illnesses caused by those serotypes. That vaccine is no longer manufactured. The U.S. Army Medical Research and Materiel Command announced on 31 October 2011 that a new adenovirus vaccine, which replaces the older version that has been out of production for over a decade, was shipped to basic training sites on 18 October 2011. More information is available here.[34]
Prevention of adenovirus, as well as other respiratory illnesses, involves frequent hand washing for more than 20 seconds, avoiding touching the eyes, face, and nose with unwashed hands, and avoiding close contact with people with symptomatic adenovirus infection. Those with symptomatic adenovirus infection are additionally advised to cough or sneeze into the arm or elbow instead of the hand, to avoid sharing cups and eating utensils, and to refrain from kissing others. Chlorination of swimming pools can prevent outbreaks of conjunctivitis caused by adenovirus.[33]
Diagnosis is from symptoms and history. Tests are only necessary in very serious cases. Tests include blood tests, eyes, nose or throat swabs, stool sample tests, and chest x-rays.[35] In the laboratory, adenovirus can be identified with antigen detection, polymerase chain reaction (PCR), virus isolation and serology. Even if adenovirus is found to be present, it may not be the cause of any symptoms. Some immunocompromised individuals can shed the virus for weeks and show no symptoms.[36]
Most infections with adenovirus result in infections of the upper respiratory tract. Adenovirus infections often present as conjunctivitis, tonsillitis (which may look exactly like strep throat and cannot be distinguished from strep except by throat culture), an ear infection, or croup.[37] Adenoviruses types 40 and 41 can also cause gastroenteritis.[38] A combination of conjunctivitis and tonsillitis is particularly common with adenovirus infections.
Some children (especially the youngest) can develop adenovirus bronchiolitis or pneumonia, both of which can be severe. In babies, adenoviruses can also cause coughing fits that look almost exactly like whooping cough. Adenoviruses can also cause viral meningitis or encephalitis. Rarely, adenovirus can cause hemorrhagic cystitis (inflammation of the urinary bladder—a form of urinary tract infection—with blood in the urine).
Most people recover from adenovirus infections by themselves, but people with immunodeficiency sometimes die of adenovirus infections, and—rarely—even previously healthy people can die of these infections.[39] This may be because sometimes adenoviral infection can lead to cardiac disorders. For example, in one study, some cardiac samples of patients with dilated cardiomyopathy were positive for presence of adenovirus type 8.[40]
Adenoviruses are often transmitted by expectoration (e.g. aerosols), but they can also be transmitted by contact with an infected person, or by virus particles left on objects such as towels and faucet handles. Some people with adenovirus gastroenteritis may shed the virus in their stools for months after getting over the symptoms. The virus can be passed through water in swimming pools that are not sufficiently chlorinated.
As with many other illnesses, good handwashing practice is one way to inhibit the person-to-person transmission of adenoviruses. Heat and bleach will kill adenoviruses on objects.
There are no proven antiviral drugs to treat adenoviral infections, so treatment is largely directed at the symptoms (such as acetaminophen for fever). The antiviral drug cidofovir has helped certain of those patients who had severe cases of illness; the number helped and to what degree, and the particular complications or symptoms it helped with, and when and where this happened, were not given in the source.[41] A doctor may give antibiotic eyedrops for conjunctivitis, while awaiting results of bacterial cultures, and to help prevent secondary bacterial infections. Currently, there is no adenovirus vaccine available to the general public, but a vaccine is available for the United States military for Types 4 and 7.
Adenoviruses have long been a popular viral vector for gene therapy due to their ability to affect both replicating and non-replicating cells, accommodate large transgenes, and code for proteins without integrating genetic material into the host cell genome.[20] More specifically, they are used as a vehicle to administer targeted therapy,[42] in the form of recombinant DNA or protein. This therapy has been found especially useful in treating monogenic disease (e.g. cystic fibrosis, X-linked SCID, alpha1-antitrypsin deficiency) and cancer.[20] In China, oncolytic adenovirus is an approved cancer treatment.[43] Specific modifications on fiber proteins are used to target Adenovirus to certain cell types;[44] a major effort is made to limit hepatotoxicity and prevent multiple organ failure. Adenovirus dodecahedron can qualify as a potent delivery platform for foreign antigens to human myeloid dendritic cells (MDC), and that it is efficiently presented by MDC to M1-specific CD8+ T lymphocytes.[45]
A safety issue with adenoviruses is that they can cause an immune response with a related inflammatory response as occurred in the death Jesse Gelsinger in 1999. To address this risk, the genome of the viral genes have been modified to remove some viral genes such. One such modification is the gutless vector that removes almost all the viral genome.[46]: 58
Adenovirus has been used for delivery of CRISPR/Cas9 gene editing systems, but high immune reactivity to viral infection has posed challenges in use for patients.
Modified (recombinant) adenovirus vectors, including replication incompetent types, can deliver DNA coding for specific antigens.[47]
Adenovirus have been used to produce viral vector COVID-19 vaccines. "In four candidate COVID-19 vaccines... Ad5... serves as the 'vector' to transport the surface protein gene of SARS-CoV-2".[48] The goal is to genetically express the spike glycoprotein of severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2). A replication-deficient chimpanzee adenovirus vaccine vector (ChAdOx1) is used by the Oxford–AstraZeneca COVID-19 vaccine that has been approved for use.[49][50] The Janssen COVID-19 vaccine uses modified recombinant adenovirus type-26 (Ad26).[51] Recombinant adenovirus type-5 (Ad5) are being used by Ad5-nCoV,[52] ImmunityBio and UQ-CSL V451. The Gam-COVID-Vac (aka Sputnik-V) product is innovative because an Ad26 based vaccine is used on the first day and an Ad5 vaccine is used on day 21.[51] Another one is ChAd-SARS-CoV-2-S; the vaccine reportedly prevented mice that were genetically modified to have human ACE2 (hACE2) receptors, presumably receptors that allow virus-entry into the cells, from being infected with SARS-CoV-2.[53][54]
Possible issues with using Adenovirus as vaccine vectors include: the human body develops immunity to the vector itself, making subsequent booster shots difficult or impossible.[55] In some cases, people have pre-existing immunity to Adenoviruses, making vector delivery ineffective.[56]
The use of Ad5 vaccines for COVID-19 worried researchers who had experience with two failed trials of an Ad5 vaccine, Phambili and STEP, due to the increased risk for uncircumcised male patients of contracting HIV-1 via unprotected anal sex.[57] At the time, it was concluded that heightened risk of HIV reception may be observed for any Ad5-based vector vaccine.[58] In October 2020, these researchers wrote in The Lancet: "On the basis of these findings, we are concerned that use of an Ad5 vector for immunisation against SARS-CoV-2 could similarly increase the risk of HIV-1 acquisition among men who receive the vaccine."[59][60] Vaccines using other technologies would not be affected, but Sputnik V, Convidecia and ImmunityBio's hAd5 would.[61] Two studies found that Ad5-specific CD4 T cells are more susceptible to HIV infection than CD4 T cells specific to certain other vectors, such as Cytomegalovirus[62] and Canarypox.[63]
By comparison, a Science article reported that China had approved CanSino's Ebola vaccine based on an Ad5 vector. It was tested in Sierra Leone, which had high HIV prevalence, making it more likely for such problems to be detected. CanSino's CEO said "we haven't seen anything with the Ebola vaccine" and speculated that HIV susceptibility might be limited to Ad5 vaccines which produced HIV proteins. In research reported in The Lancet in May, the company's researchers acknowledged the possibility, called it "controversial" and said they would watch for it in the company's COVID-19 vaccine candidate's trials.[48][52] It is not known to what extent LGBT discrimination in Sierra Leone could have contributed to masking a possible causal link in the Ebola vaccine trial; while the Step trial enrolled mainly homosexual and bisexual men, the Phambili trial enrolled mainly heterosexual men and women and still found an apparent connection.
 Adenovirus D26 structural model at atomic resolution
Adenovirus D26 structural model at atomic resolution Adenoviruses (members of the family Adenoviridae) are medium-sized (90–100 nm), nonenveloped (without an outer lipid bilayer) viruses with an icosahedral nucleocapsid containing a double-stranded DNA genome. Their name derives from their initial isolation from human adenoids in 1953.
They have a broad range of vertebrate hosts; in humans, more than 50 distinct adenoviral serotypes have been found to cause a wide range of illnesses, from mild respiratory infections in young children (known as the common cold) to life-threatening multi-organ disease in people with a weakened immune system.
Los adenovirus (Adenoviridae) son una familia muy contagiosa de virus que infecta tanto a humanos como a otros animales. Son virus no encapsulados de ADN bicatenario que pueden provocar enfermedades o malestares como infecciones en las vías respiratorias, conjuntivitis, cistitis hemorrágica y gastroenteritis. Los adenovirus también se utilizan como vectores portadores de secuencias de ADN para la terapia génica.[1]
Los adenovirus se aislaron por primera vez en 1953 en un cultivo de células adenoides humanas.[2] Desde entonces se han aislado más de 100 serotipos, de los cuales aproximadamente 51 son capaces de infectar al ser humano.[1]
Los adenovirus son los virus sin envoltura más grandes y tienen el tamaño máximo factible para ser transportados a través del endosoma (por lo que no precisan la fusión de la envoltura con la membrana celular).
Poseen un genoma ADN bicatenario lineal con una proteína terminal, por lo que son clasificados en el Grupo I bajo el esquema de la Clasificación de Baltimore. Son de tamaño medio (70-90 nm), sin envoltura y con forma deltaicosaédrica. Su cápside consta de 240 capsómeros con forma hexagonal (hexonas) y pentagonal (pentonas). Las 12 pentonas se localizan en cada uno de los vértices y se componen de una base pentona y una fibra que contiene proteínas de adherencia vírica y puede actuar como hemaglutinina. Tanto la pentona como la fibra son inmunógeno y contienen antígenos específicos de tipo.
Dentro de la cápside contiene el ADN vírico y al menos dos proteínas principales. En el virión del adenovirus existen 11 polipeptidos.
El genoma de los Adenovirus es ADN bicatenario lineal no segmentado con alrededor de 30–38 kbp. Esto les permitiría portar unos 30 a 40 genes. Aunque es un genoma significativamente más largo que los de otros virus en el Grupo I de Baltimore, es todavía muy simple y el virus depende fuertemente de la célula huésped para su replicación. Una interesante característica del genoma viral es que tiene una proteína terminal de 55 KDa asociada con cada una de las terminaciones 5' del ADN lineal, que son usadas como iniciadores en la replicación viral y aseguran que los extremos del genoma lineal del virus se replican adecuadamente.
La replicación de los adenovirus se estudia en los cultivos de HeLa. Un cultivo vírico dura aproximadamente de 32 a 36 horas produciendo 10,000 viriones.[1] La entrada del adenovirus en la célula huésped implica dos tipos de interacciones. La entrada es iniciada por las fibras pentonas al unirse al receptor de la célula. Los dos receptores actualmente conocidos son el receptor CD46 para los serotipos de adenovirus humano del grupo B y para los demás serotipos el receptor coxsackie adenovirus (CAR), un miembro de la superfamilia de las inmunoglobulinas. Cada célula blanco tiene aproximadamente 100,000 receptores para estas fibras.[1] Algunos virus pueden usar la molécula del complejo mayor de histocompatibilidad como receptor.[1]
A continuación, se produce la interacción secundaria, en la cual un punto especializado en la proteína de la base pentona interactúa con una molécula de integrina. La unión a la integrina αv estimula la señalización celular e induce la polimerización de actina dando lugar a la introducción del virión en la célula huésped a través de una vesícula recubierta de clatrina (endosoma).[3]
Una vez que el virus ha logrado entrar en la célula huésped, acidifica el endosoma, lo que causa que los compuestos de la cápside se disocien. Estos cambios, así como la naturaleza tóxica de la pentona, resultan en la liberación del virión en el citoplasma. Con la ayuda de los microtúbulos celulares, el virus es transportado al complejo de poros nucleares en donde la partícula de adenovirus se desmonta. A continuación, el ADN viral es liberado y entra en el núcleo a través del poro nuclear.[4] Después de esto, el ADN se asocia con las moléculas de histona, se expresan los genes virales y se generan nuevas partículas virales.
El ciclo biológico del adenovirus comprende dos fases, inicial y final, separadas por la replicación del ADN. En ambas fases tiene lugar una trancripción primaria, generando mARNs monocistrónico compatibles con los ribosomas del huésped, lo que permite que los productos sea traducidos. La transcripción del gen inicial E1, el procesamiento de la molécula transcrita primaria y traducción de la proteína del transactivador E1A precoz son necesarios para la transcripción de las proteínas precoces.[1] Los genes de la fase inicial son responsables de expresar principalmente las proteínas reguladoras no-estructurales. El objetivo de estas proteínas es triple: alterar la expresión de las proteínas del huésped que son necesarias para la síntesis del ADN, activar los otros genes del virus (tales como la ADN polimerasa codificada por el virus), y evitar la muerte prematura de la célula infectada por las defensas inmunitarias del huésped (bloqueo de la apoptosis, bloqueo de la actividad del interferón y bloqueo de la translocación y expresión MHC de clase I).
La proteína E1A también constituye un oncogén, y junto con la proteína E1B estimula el crecimiento celular al unirse a p105RB —producto del gen de retinoblastoma— y p53. Se ha visto que en células de ratón estimulan el crecimiento de la célula.[1]
La replicación del ADN tiene lugar en el núcleo y está mediada por una polimerasa de origen vírico. La proteína terminal (55 kDa) que se une covalentemente al extremo 5' del genoma del adenovirus actúa como iniciador para la replicación. A continuación, la ADN polimerasa viral utiliza un mecanismo de desplazamiento de cadena para replicar el genoma, en contraste a los fragmentos Okazaki comúnmente utilizados en la replicación del ADN de los mamíferos. Como en el caso de los papovavirus, algunos ARNm de los adenovirus comparten un mismo promotor y secuencias iniciales, pero son elaborados por Splicing (corte y empalme) de distintos intrones.[1]
La última fase del ciclo biológico del adenovirus se centra en la producción de cantidades suficientes de proteínas estructurales para empaquetar el material genético producido por la replicación del ADN. Una vez que los componentes virales han sido replicados, las partículas de virus son ensambladas y se liberan de la célula como consecuencia de la lisis celular inducida viralmente.
Basándose en resultados de estudios de homología del ADN y de patrones de aglutinación, los 47 serotipos que afectan al ser humano se han clasificado en 6 subgrupos (A a F).[1] Los adenovirus pueden causar desde enfermedad respiratoria (mayormente especies HAdV-B y C) y conjuntivitis (HAdV-B y D) a gastroenteritis (HAdV-F serotipos 40 y 41). La forma más común es una enfermedad respiratoria; sin embargo, también pueden causar otras enfermedades como gastroenteritis, conjuntivitis, cistitis, y sarpullidos, dependiendo del serotipo de adenovirus que cause la infección. La familia contiene los siguientes géneros:
Los adenovirus son capaces de producir infecciones líticas, latentes y transformadoras (en los hámster, pero no en el humano).
El virus infecta de forma lítica las células mucoepiteliales del tracto respiratorio, tracto gastrointestinal y conjuntiva o córnea. Persiste en el tejido linfoide (amígdalas, placas de Peyer). Las proteínas de la fibra vírica determinan la especificidad de la célula diana y la actividad tóxica de la pentona puede dar lugar a la inhibición del transporte celular del ARNm y de la síntesis proteica.
Los anticuerpos son importantes en la resolución de la enfermedad. Los síntomas de la enfermedad respiratoria causados por la infección de adenovirus abarcan del síndrome de resfriado común a una neumonía, tos perruna y bronquitis. Los pacientes con el sistema inmunitario comprometidos son especialmente susceptibles a complicaciones graves de la infección por adenovirus. La enfermedad respiratoria aguda (ERA), primero reconocida entre reclutas militares durante la Segunda Guerra Mundial, puede ser causada por infección por adenovirus en condiciones de estrés y hacinamiento. Los adenovirus son inusualmente estables a los agentes químicos o físicos y a condiciones adversas de pH, permitiéndoles sobrevivir largo tiempo fuera del cuerpo y del agua. Se dispersan primariamente vía aerosoles respiratorios (gotitas de saliva), sin embargo también pueden propagarse por la vía fecal-oral.
El virus es resistente a la inactivación. Tiene distribución mundial sin incidencia estacional. Es más frecuente la afectación en niños menores de 14 años y en instituciones cerradas y se transmiten por contacto directo y aguas contaminadas.
Existen grupos de investigación que intentan modificar los adenovirus para que puedan ser utilizados en terapia génica. La terapia génica consiste en adicionar un gen funcional a un paciente cuyo gen está ausente o defectuoso. Para ello, necesita vectores génicos y uno de los más utilizados en los ensayos clínicos es el adenovirus.
Los adenovirus pueden infectar a células en división o quiescentes, por lo que podría integrar el gen en diversas zonas del organismo (tienen afinidad por las células pulmonares). El problema principal es la alta inmunogenicidad, y que su expresión sólo se realiza a corto plazo. Por otro lado, estos vectores no se integran en el genoma del huésped sino que se mantienen en varias copias en forma de plásmido, por lo que la expresión es temporal, lo cual acarrea otro problema: obliga a tener que repetir las inyecciones y se acaba activando el sistema inmune...
|mes= (ayuda) http://es.wikipedia.org/w/index.php?title=Adenoviridae&action=edit§ion=10
Los adenovirus (Adenoviridae) son una familia muy contagiosa de virus que infecta tanto a humanos como a otros animales. Son virus no encapsulados de ADN bicatenario que pueden provocar enfermedades o malestares como infecciones en las vías respiratorias, conjuntivitis, cistitis hemorrágica y gastroenteritis. Los adenovirus también se utilizan como vectores portadores de secuencias de ADN para la terapia génica.
Adenoviirused kuuluvad viiruste rühma Adenoviridae. Nad nakatavad nii inimesi kui ka loomi (imetajaid ja linde). Adenoviirus isoleeriti esimesena inimese mandlitest, millest ka nende nimi.
Adenoviirused võivad inimestel tekitada mitmeid sümptomeid alates hingamisteede ärritusest kuni oksendamiseni (muuhulgas külmetused,silmapõletikud ja kõhulahtisus). Nad on ka ebatavaliselt leplikud keskkonna suhtes, suutes ellu jääda ka kehast väljaspool. Adenoviirused levivad peamiselt piisknakkusena.
Adenoviirused on keskmise suurusega viirused. Neil on kaksikheeliksiga DNA-genoom.
Adenoviiruseid kasutatakse geeniteraapias (geniditsiin[1], Glybera[2]).
Adenoviirused kuuluvad viiruste rühma Adenoviridae. Nad nakatavad nii inimesi kui ka loomi (imetajaid ja linde). Adenoviirus isoleeriti esimesena inimese mandlitest, millest ka nende nimi.
Adenoviirused võivad inimestel tekitada mitmeid sümptomeid alates hingamisteede ärritusest kuni oksendamiseni (muuhulgas külmetused,silmapõletikud ja kõhulahtisus). Nad on ka ebatavaliselt leplikud keskkonna suhtes, suutes ellu jääda ka kehast väljaspool. Adenoviirused levivad peamiselt piisknakkusena.
Adenoviirused on keskmise suurusega viirused. Neil on kaksikheeliksiga DNA-genoom.
Adenoviiruseid kasutatakse geeniteraapias (geniditsiin, Glybera).
Adenobirus Adenoviridae familian sailkatzen diren birusak dira. Izena latinetik dator (adeno = guruin), birus hauek hasieran gizakiaren guruin adenoideoetatik (amigdaletatik) bakartu baitziren. Animaliak (besteak beste, gizakia) infektatzen dituzte. 1953an isolatu ziren lehenengoz,[1] eta egun 100 serotipo inguru ezagutzen dira (horietako 43 dira giza patogenoak). Gizakiarengan gaixotasun anitzak eragiten dituzte: konjuntibitisa, arnas traktuko infekzioak, gastroenteritisa eta zistitisa, batez ere. Adenobirusek erresistentzia handia diete ingurugiroaren baldintza gogorrei, eta birioia gai da gorputzetik kanpo bizirik irauteko. Horrek fomiteen bidezko kutsapena errazten du. Material genetikoari dagokionez, adenobirusek harizpi bikoitzeko DNA dute, ikosaedroa den kapside batez babestua. Kapsidea 250 kapsomeroz osatuta dago, eta ez du kanpoko bilgarririk (horregatik esaten da birus biluziak direla).
Adenobirusak, infekzioak eragiteaz gainera, zelula normalak tumore ere bihurtzen ditu. 35.000 base dituen kate bikoitzeko DNA nukleoa du, eta bere pisu molekularra 20 milioikoa da. Adenobirusak kutsatuta dagoen zelularen nukleoaren barruan garatzen dira; bertan, erreplikatu eta antolamendu kristalinoa hartzen dute. Hartu duen zelularen nukleoan bere DNAren nukleoa eta proteina birikoak askatzen ditu, eta bertan, entzimek RNA mezulari birikoa sintetizatzen laguntzen dute, nahiz eta DNA birikoa kopiatzen duena birusak kodifikatutako DNA polimerasa bat izan. Horren ondorioz, birusaren osagai guztiak sintetizatu egiten dira, eta, muntatu ondoren, zelula horretatik beste bat kutsatzera abiatzen dira. Horrela sintetizatutako proteina biriko batek zelularen RNAren sintesia aldatzen du, eta, ondorioz, zelula hori minbiziduna bihurtzen du, eta tumoreak sortzen ditu. Birusa nukleoaren bildukia haustean askatzen da, eta ondoren zelula osoa barreiatzen da.
Medikuntzan egin diren ikerketen bidez, adenobirusek giza zeluletan sartzeko duten ahalmena kontrolatzen saiatu dira: adenobirus ez aktibodun sudurreko aerosolak sortu dira; akats genetikoak konpentsatzeko, giza zeluletara geneak eramateko bektoreak ere asmatu dituzte. Horrela sartu dute CFTR genea, horren gabeziak eragiten baitu fibrosi kistikoa. Gainera, adenobirusak txertoen bektore moduan ere erabiltzen dira. Baina hanturek eta gaixoak sortutako antigorputzek teknologia berri honen eraginkortasuna mugatzen dute, nahiz eta adenobirusarekin batera interferon batzuk hartuta eragozpen horiek arintzea lortzen den.
Adenobirus Adenoviridae familian sailkatzen diren birusak dira. Izena latinetik dator (adeno = guruin), birus hauek hasieran gizakiaren guruin adenoideoetatik (amigdaletatik) bakartu baitziren. Animaliak (besteak beste, gizakia) infektatzen dituzte. 1953an isolatu ziren lehenengoz, eta egun 100 serotipo inguru ezagutzen dira (horietako 43 dira giza patogenoak). Gizakiarengan gaixotasun anitzak eragiten dituzte: konjuntibitisa, arnas traktuko infekzioak, gastroenteritisa eta zistitisa, batez ere. Adenobirusek erresistentzia handia diete ingurugiroaren baldintza gogorrei, eta birioia gai da gorputzetik kanpo bizirik irauteko. Horrek fomiteen bidezko kutsapena errazten du. Material genetikoari dagokionez, adenobirusek harizpi bikoitzeko DNA dute, ikosaedroa den kapside batez babestua. Kapsidea 250 kapsomeroz osatuta dago, eta ez du kanpoko bilgarririk (horregatik esaten da birus biluziak direla).
Adenobirusak, infekzioak eragiteaz gainera, zelula normalak tumore ere bihurtzen ditu. 35.000 base dituen kate bikoitzeko DNA nukleoa du, eta bere pisu molekularra 20 milioikoa da. Adenobirusak kutsatuta dagoen zelularen nukleoaren barruan garatzen dira; bertan, erreplikatu eta antolamendu kristalinoa hartzen dute. Hartu duen zelularen nukleoan bere DNAren nukleoa eta proteina birikoak askatzen ditu, eta bertan, entzimek RNA mezulari birikoa sintetizatzen laguntzen dute, nahiz eta DNA birikoa kopiatzen duena birusak kodifikatutako DNA polimerasa bat izan. Horren ondorioz, birusaren osagai guztiak sintetizatu egiten dira, eta, muntatu ondoren, zelula horretatik beste bat kutsatzera abiatzen dira. Horrela sintetizatutako proteina biriko batek zelularen RNAren sintesia aldatzen du, eta, ondorioz, zelula hori minbiziduna bihurtzen du, eta tumoreak sortzen ditu. Birusa nukleoaren bildukia haustean askatzen da, eta ondoren zelula osoa barreiatzen da.
Medikuntzan egin diren ikerketen bidez, adenobirusek giza zeluletan sartzeko duten ahalmena kontrolatzen saiatu dira: adenobirus ez aktibodun sudurreko aerosolak sortu dira; akats genetikoak konpentsatzeko, giza zeluletara geneak eramateko bektoreak ere asmatu dituzte. Horrela sartu dute CFTR genea, horren gabeziak eragiten baitu fibrosi kistikoa. Gainera, adenobirusak txertoen bektore moduan ere erabiltzen dira. Baina hanturek eta gaixoak sortutako antigorputzek teknologia berri honen eraginkortasuna mugatzen dute, nahiz eta adenobirusarekin batera interferon batzuk hartuta eragozpen horiek arintzea lortzen den.
Adenovirukset ovat Adenoviridae-heimoon kuuluvia viruksia, jotka elävät sekä ihmisessä että eläimissä. Ne ovat saaneet nimensä kitarisojen eli adenoidien mukaan, joista virus on ensimmäisenä eristetty. Adenovirus on vaipaton DNA-virus,[1] joka on halkaisijaltaan noin 82 nanometriä. Viruksen DNA replikoidaan sen infektoiman solun tumassa, ja proteiinisynteesi tapahtuu solulimassa. Syntetisoidut proteiinit kuljetetaan tumaan, jossa virus kootaan. Adenovirus kestää happamia ja emäksisiä olosuhteita, joten se säilyy ehjänä ruuansulatuskanavassa, jätevedessä ja uima-altaissa.
Ihmisen adenovirus-perheeseen kuuluu yli 50 erilaista serotyyppiä, jotka voivat aiheuttaa infektioita useissa eri elimissä, kuten keuhkoissa, hengitysteissä, silmissä, virtsarakossa, suolistossa ja maksassa.[2] Adenovirukset voivat aiheuttaa infektioita myös sydämessä.
Adenovirukset aiheuttavat muun muassa lasten nielutulehduksia, flunssaa, silmä-[1] ja hengitysteiden tulehduksia[1]. Noin 5 prosenttia alle nelivuotiaiden lasten hengitystieinfektioista on adenoviruksen aiheuttamia.
Adenovirus aiheuttaa oireina oksentelua, kuumetta, löysää ulostetta ja flunssaa. Elimistön nestetasapaino on kovilla varsinkin pienillä vauvoilla. Adenovirus on melko lailla rotaviruksen kaltainen tauti. Ripulointi saattaa kestää useita viikkoja.
Suomessa varmistettiin 994 adenovirusinfektiota vuonna 2017.[3]
Adenovirukset ovat Adenoviridae-heimoon kuuluvia viruksia, jotka elävät sekä ihmisessä että eläimissä. Ne ovat saaneet nimensä kitarisojen eli adenoidien mukaan, joista virus on ensimmäisenä eristetty. Adenovirus on vaipaton DNA-virus, joka on halkaisijaltaan noin 82 nanometriä. Viruksen DNA replikoidaan sen infektoiman solun tumassa, ja proteiinisynteesi tapahtuu solulimassa. Syntetisoidut proteiinit kuljetetaan tumaan, jossa virus kootaan. Adenovirus kestää happamia ja emäksisiä olosuhteita, joten se säilyy ehjänä ruuansulatuskanavassa, jätevedessä ja uima-altaissa.
Ihmisen adenovirus-perheeseen kuuluu yli 50 erilaista serotyyppiä, jotka voivat aiheuttaa infektioita useissa eri elimissä, kuten keuhkoissa, hengitysteissä, silmissä, virtsarakossa, suolistossa ja maksassa. Adenovirukset voivat aiheuttaa infektioita myös sydämessä.
Adenovirukset aiheuttavat muun muassa lasten nielutulehduksia, flunssaa, silmä- ja hengitysteiden tulehduksia. Noin 5 prosenttia alle nelivuotiaiden lasten hengitystieinfektioista on adenoviruksen aiheuttamia.
Adenovirus aiheuttaa oireina oksentelua, kuumetta, löysää ulostetta ja flunssaa. Elimistön nestetasapaino on kovilla varsinkin pienillä vauvoilla. Adenovirus on melko lailla rotaviruksen kaltainen tauti. Ripulointi saattaa kestää useita viikkoja.
Suomessa varmistettiin 994 adenovirusinfektiota vuonna 2017.
Les Adenoviridae, ou adénovirus, sont une famille de virus qui regroupe une centaine de variétés, dont une quarantaine environ peut infecter l'humain. C'est en 1953 que ceux-ci ont été mis en évidence par Wallace P. Rowe (en) à partir de fragments d'amygdale[2] (qui lui donne son nom, du grec adến : glande[3], et non de « ADN »).
Les adénovirus sont des virus possédant de l'ADN double brin linéaire (30 000 à 38 000 paires de bases, pb), les deux brins d'ADN possèdent à leurs extrémités des séquences répétées inversées qui permettent aux molécules monocaténaires (simple brin) de se circulariser (la protéine p55 permet la circularisation). Les adénovirus sont des particules d'un diamètre de 60 à 90 nm, sans enveloppe, à capside icosaédrique formée de 252 capsomères (240 hexons (en) et 12 pentons). Les capsomères situés aux sommets de l'icosaèdre sont des pentons prolongés par une fibre de longueur variable et terminée par l'antigène Y, responsable de la propriété d'hémagglutination.
L’hexon est constitué de trois chaînes de polypeptides II. Les polypeptides VI, VIII et IX forment les liaisons entre les capsomères. La base du penton est constituée de cinq polypeptides III et la fibre de trois polypeptides IV.
Les polypeptides VII sont des analogues d’histones, ils se complexent avec l'ADN. Les polypeptides V entourent le complexe ADN-VII et le relient à la capside.
52 sérotypes ont été identifiés, classés en 7 sous-groupes, appelés de A à G[4].
Le cycle viral complet dure de 30 à 36 heures et se termine par la libération d'environ 10 000 particules virales après lyse de la cellule infectée. Ce rendement, très impressionnant, varie cependant d'un sérotype à un autre et du type cellulaire infecté. Le cycle se divise en trois étapes, une phase précoce correspondant à l'attachement et à l'entrée du virus, suivi d'une phase de réplication de l'ADN viral et de production des protéines virales et d'une phase tardive d'assemblage et de libération des virions.
Le cycle viral débute par l'attachement de la particule virale à la cellule hôte et à son internalisation dans cette dernière.
La phase précoce peut être décrite par les différentes étapes suivantes :
L'entrée de l'adénovirus a beaucoup été étudiée pour les sérotypes 2 et 5 (appartenant à la famille C des adénovirus humains). Cette entrée est séquentielle et repose sur l'interaction avec des protéines cellulaires. Pour les adénovirus de sérotype 2 et 5, la fibre de la particule virale est responsable de l'attachement à la cellule hôte via le récepteur CAR (Coxsackie and Adenovirus Receptor (en)) ). Ce récepteur est commun aux virus Coxsackie B3 de la famille des Picornaviridae et aux adénovirus de la famille A, C, E et éventuellement D. CAR est une glycoprotéine transmembranaire de 46 kilodaltons appartenant à la superfamille des immunoglobulines. Cette protéine est exprimée sur un large spectre de type cellulaire expliquant le large tropisme des adénovirus[5]. La protéine CAR est impliquée dans l'adhésion intercellulaire au niveau basolatéral des jonctions serrées des épithéliums[6].
Tous les sérotypes, à l'exception de ceux du sous-groupe B, ont la capacité de se lier à CAR, mais tous n'utilisent pas préférentiellement ce récepteur. Par exemple, l'adénovirus 37, appartenant au sous-groupe D, peut se lier à CAR mais utilise le récepteur CD46 pour infecter les cellules[7]
Même si l'expression de CAR participe au tropisme de l'Adénovirus in vitro [8], il n'y a cependant pas de corrélation directe entre le tropisme du virus pour des tissus exprimant fortement CAR in vivo chez la souris[9]. Ceci sous-entend la présence de récepteurs alternatifs qui seraient préférentiellement utilisés in vivo.
L'attachement de la tête de la fibre au récepteur CAR conduit à un changement de conformation permettant d'exposer le motif RGD (en) (Arginine - Glycine - Acide aspartique) porté sur une boucle à la surface de chaque monomère de la base de penton. Ce motif va ensuite interagir avec les intégrines cellulaires AlphaV Béta1, AlphaV Béta3, AlphaV Béta5, Alpha5 Béta1 et Alpha3 Béta1.
L'exposition des cinq motifs RGD portés par la base de penton (molécule pentamérique) permet l'association simultanée de plusieurs molécules d'intégrines. ce recrutement va initier l'entrée par endocytose dans la cellule.
Le virus entre dans la cellule par la voie des vésicules à clathrine, puis passe dans les endosomes. Le mécanisme par lequel le virus s'extrait de l'endosome n'est pas encore clairement élucidé, mais des études suggèrent l'implication de la protéine virale VI dans cet échappement[10]. Néanmoins, à la suite de l'acidification des endosomes précoces, les protéines IIIa et VIII se dissocient.
Les gènes précoces sont divisés en 4 groupes : E1 (A et B), E2 (A et B), E3 et E4.
E1A code des protéines transactivatrices (en) de la transcription qui agissent au niveau des promoteurs viraux et promoteurs de gènes cellulaires endogènes ainsi que pour des protéines d’autorégulation. Il active l’entrée en phase S. Une protéine de E1A active également le gène qui code la protéine p53 qui induit les mécanismes d’apoptose (p53 est un facteur de transcription qui va activer l'expression du gène de Bax).
Cette région code 7 protéines (minimum) toxiques pour la cellule qui vont induire l’apoptose indépendante de p53. La protéine E4orf6 bloque l’accumulation de p53. E4orf4 se lie à une protéine phosphatase p2a, entraînant la déphosphorylation d’activateurs de E1A et autres facteurs de transcription, aboutissant à la diminution de l’expression de E4 (autorégulation).
Son expression dépend d’activateurs synthétisés lors de l’expression de E1A et E4. La région E3 permet à la cellule infectée d’échapper au système immunitaire, elle contrecarre les défenses innées. E3 code une protéine qui s’associe aux molécules CMH de classe I. Cette protéine empêche que ces molécules soient exprimées à la surface de la cellules. E3 code aussi plusieurs protéines qui interfèrent avec l’inflammation (Tumor Necrosis Factor ou facteur de nécrose tumorale). Ces protéines de E3 viennent empêcher la fixation du TNF sur son récepteur. Une protéine de la région E3 produite très tardivement jouerait un rôle dans la destruction de la cellule.
E1B a une fonction anti-apoptotique. E1B s’exprime quasi simultanément avec E3 et code la protéine p55k qui se lie a p53 et l’inactive, et pour la protéine p19k, un équivalent fonctionnel de Bcl-2 (la protéine Bcl2 empêche l’homodimérisation de Bax, et l’homodimérisation de Bax permet l’activation de la caspase qui active à son tour l’endocaspase qui digère l’ADN). E1B bloque également l’apoptose induite par les produits d’E4 (nécessité d’un délai : le virus doit avoir du temps pour synthétiser ses particules virales). E1B19k serait inhibée tardivement par la protéine d’E3 qui joue un rôle dans la destruction de la cellule, la protéine p19k étant inhibée, Bax est actif et induit l'apoptose.
Son expression, comme celle de E3, dépend d’activateurs produits par E1A et E4. Cette région E2 est impliquée dans la réplication de l’ADN viral. E2A code une DNA binding protein (DBP) p72 qui recouvre l’ADN monocaténaire néo-synthétisé et le protège de l'activité des nucléases cellulaires. E2B code une protéine terminale p55 liée de façon covalente aux extrémités 5’ de l’ADN bicaténaire et sert d’amorce à la réplication.
Un des brins va être copié de façon continue de 5’vers 3’. L’autre brin est déplacé et recouvert par une protéine : la DBP (DNA Binding Protein) p72. Plusieurs fourches de réplication peuvent se suivre. On obtient des brins bicaténaires et monocaténaires. Ces derniers vont se circulariser grâce à des séquences répétées inversées a et a'.
Les gènes tardifs sont regroupés sous un seul opéron et se décomposent en 3 familles : L1, L2 et L3. La transcription s’effectue à partir de ce promoteur unique. Le regroupement de plusieurs gènes sous la régulation d’un seul promoteur permet une expression simultanée des protéines tardives. Les ARNm tardifs vont être traduits en protéines du core, de la capside et protéines des fibres.
L’assemblage se fait dans le noyau, donc les protéines de structure doivent migrer dans le noyau. Les produits des régions d'E3 et d'E4 induisent l'apoptose, la cellule est lysée et les virions libérés.
Ils sont capables d'infecter des cellules à division lente et se multiplient dans l'œil, l'appareil respiratoire et l'appareil digestif. Le pouvoir pathogène des adénovirus s'exerce principalement sur l'appareil respiratoire. La transmission peut être :
Ils sont excrétés par les selles de façon prolongée. Ils sont responsables de pharyngites et de pneumonies, mais aussi de conjonctivites. Certains sérotypes (40, 41), lorsqu'ils sont déglutis, peuvent causer des gastro-entérites (1 à 9 % des gastroentérites chez les enfants). Exceptionnellement, ils peuvent provoquer une encéphalite primaire (et non post ou para-infectieuse), sévère chez l'enfant et l'immunodéprimé.
Les adénovirus peuvent aussi provoquer des dermatoses érythémateuses (Acrodermatite papuleuse infantile de Gianotti-Crosti). Les corps apoptotiques contenant des particules virales sont transmis aux cellules adjacentes par endocytose. On estime que 50 % des infections à adénovirus sont asymptomatiques.
Les anticorps apparaissent dès l'enfance, cependant, la multitude des types (plus de 42 chez l'humain) fait que l'on peut avoir des gastroentérites à répétition. À l'âge de 4 ans, 85 % des enfants ont développé une immunité contre l'adénovirus de type entérique[11].
Le mastadénovirus humain C, responsable d'infections respiratoires bénignes, a été identifié chez un humain daté d'environ 31 000 ans. L'analyse génétique de ces souches anciennes suggère une présence du virus prédatant l'apparition de l'homme moderne[12].
Selon ICTV (20 juillet 2021)[13] :
Les Adenoviridae, ou adénovirus, sont une famille de virus qui regroupe une centaine de variétés, dont une quarantaine environ peut infecter l'humain. C'est en 1953 que ceux-ci ont été mis en évidence par Wallace P. Rowe (en) à partir de fragments d'amygdale (qui lui donne son nom, du grec adến : glande, et non de « ADN »).
Os adenovirus son grupos de virus que conteñen ADN, foron por vez primeira illados en células adenoides humanas do que lles vén o nome. Están clasificados no Grupo I da clasificación de Baltimore, son de tamaño medio (60-90 nm), hai 49 [Cómpre referencia] tipos inmunoloxicamente distintos que poden causar enfermidades nos seres humanos.
Adenovirusi su virusi koji mogu inficirati sisavce (domaće govedo, konja i svinju, ali i ovcu i kozu) ili neke vrste ptica i riba. Do sada je poznato 47 humanih i životinjskih patogenih adenovirusa s velikim brojem podtipova.
Porodica Adenoviridae (gr. αδένας, što znači žlijezda) obuhvaća tzv. viruse bez ovojnice čija kapsida ima ikosaedričnu simetriju.
Prve adenoviruse je 1953. godine izolirao i u staničnim kulturama umnožavao istraživački tim na čelu s W. P. Rowe. Tipični adenovirus je prosječnog promjera oko 100 nm. Njegov genom se sastoji od linearne dvonize DNK dužine oko 36 kb.
Adenovirusi imaju širok spektar stanica domaćina. Oni mogu inficirati stanice u diobi, stanice koje miruju ili pak već izdiferencirane stanice (npr. neurone). Općenito, kod čovjeka adenovirusi napadaju stanice epitela dišnih putova. Tamo prouzrokuju oko 15% svih oboljenja koje općenito nazivamo prehladama. Iako pretežno izazivaju oboljenja koja nisu opasna ipak mogu biti i uzročnici teških oboljenja kao što je bronhitis. U vrlo rijetkim slučajevima infekcije adenovirusima mogu izazvati smrt.
U molekularnoj biologiji adenovirusi imaju vrlo značajnu ulogu, posebno od 1977. godine kada su otkriveni osnovni principi tzv. genekspresije. Adenovirusi se s tim u vezi koriste kao gentehnički vektori za unošenje strane DNK u jednu stanicu ili jednostanični organizam.
Porodica adenovirusa pripada DNK-virusima. Poznato je ukupno 12 virusa ovoga tipa. Kada adenovirus napadne stanicu on tamo donosi svoj linearnu dvonizu (dupli helix) DNK. Virus će se u stanici razmnožavati, ali sadržaji njegove DNK neće ući u sastav čovječjeg genoma.
Da bi virus koji kod čovjeka izaziva oboljenje tipa prehlade mogao biti upotrijebljen kao terapeutsko sredstvo u medicini, on mora gen-tehničkim metodama biti nešto izmijenjen. U te svrhe "željeni virus" treba da zadrži sposobnost prodiranja u stanicu i da donese svoju DNK. S druge strane , pacijent ne smije trpjeti zbog infekcije adenovirusom. Znači, njegovo razmnožavanje mora biti obuzdano. To se postiže gen-tehničkom metodom pri kojoj E-1 region virusa biva izrezan (izdvojen) iz njegove cjelokupne dužine. Region E-1 je naime gen koji je neophodan za razmnožavanje virusa. Umjesto regiona E-1 ubaci se strana DNK. Na taj način ovaj virus postaje idealan za prenošenje gena, ali više nije u stanju da se razmnožava. Ovo se postiže jednim "trikom": Gen-tehnički promijenjen adenovirus (zajedno sa stranom DNK) biće kloniran na plazmid. Taj plazmid biti će dodat određenoj staničnoj kulturi čije stanice su također prethodno gen-tehnički promijenjene i u svom genomu sadrže region E-1 virusa. Ove nazovimo ih "stanice" pomoćnici zajedno sa plazmidima omogućavaju razmnožavanje virusa u staničnim kulturama. Sada nastaje mnoštvo virusa koji sadrže stranu DNK, te oni mogu biti korišteni kao prenosnici genetskih informacija. Na ovaj način možemo doći do vektora koji može poslužiti u medicini za genetičku terapiju. Taj vektor sadrži željeni gen. Adenovirus kao vektor taj gen može dalje prenositi, a da kod čovjeka ne izazove štetne infekcije kroz njegovo razmnožavanje.
Prednost ovog sistema je u dobrim mogućnostima uzgoja virusa i u činjenici da se on ne može samostalno razmnožavati, te tako izazvati neželjene infekcije. Ovaj sistem je manje povoljan kada je riječ o kapacitetu preuzimanja strane DNK. Naime, moguće je preuzeti dio jedne DNK dužine 7-10 kb. Adenovirusi se koriste za genetsku terapiju ljudskih stanica.
Adenovirusi su virusi koji mogu inficirati sisavce (domaće govedo, konja i svinju, ali i ovcu i kozu) ili neke vrste ptica i riba. Do sada je poznato 47 humanih i životinjskih patogenih adenovirusa s velikim brojem podtipova.
Porodica Adenoviridae (gr. αδένας, što znači žlijezda) obuhvaća tzv. viruse bez ovojnice čija kapsida ima ikosaedričnu simetriju.
Prve adenoviruse je 1953. godine izolirao i u staničnim kulturama umnožavao istraživački tim na čelu s W. P. Rowe. Tipični adenovirus je prosječnog promjera oko 100 nm. Njegov genom se sastoji od linearne dvonize DNK dužine oko 36 kb.
Adenovirusi imaju širok spektar stanica domaćina. Oni mogu inficirati stanice u diobi, stanice koje miruju ili pak već izdiferencirane stanice (npr. neurone). Općenito, kod čovjeka adenovirusi napadaju stanice epitela dišnih putova. Tamo prouzrokuju oko 15% svih oboljenja koje općenito nazivamo prehladama. Iako pretežno izazivaju oboljenja koja nisu opasna ipak mogu biti i uzročnici teških oboljenja kao što je bronhitis. U vrlo rijetkim slučajevima infekcije adenovirusima mogu izazvati smrt.
Adenoviridae adalah keluarga virus yang memiliki inang vertebrata.[1] Bentuk virus ini ikosahedral dengan diameter virion 70-100 nm dan genom 36-38kb. Adenoviridae memiliki dua genus yaitu Mastadenovirus dan Aviadenovirus.[2]
Jenis virus ini pertama kali ditemukan oleh Rowe pada tahun 1953.[1] Adenoviridae banyak menginfeksi manusia dan menjadi laten pada jaringan limfoid, namun juga memiliki kemampuan onkogenesis pada hewan coba rodensia.[1] Adenoviridae kebanyakan menyerang anak-anak dan orang militer dengan menginfeksi saluran pernapasan, infeksi pada mata, radang kantung kemih yang menyebabkan hematuria, serta encephalitis.[1]
Pengobatan biasanya jarang dilakukan untuk umum, vaksin oral atenuasi hanya diberikan pada militer.[2] Antiviral yang biasa diberikan untuk mengobati adalah cidofovir ribavirin, namun hasilnya tidak terlalu menjanjikan.[2] Pemberian vaksin hidup dapat menyebabkan penyebaran infeksi.[2]
Adenoviridae adalah keluarga virus yang memiliki inang vertebrata. Bentuk virus ini ikosahedral dengan diameter virion 70-100 nm dan genom 36-38kb. Adenoviridae memiliki dua genus yaitu Mastadenovirus dan Aviadenovirus.
Jenis virus ini pertama kali ditemukan oleh Rowe pada tahun 1953. Adenoviridae banyak menginfeksi manusia dan menjadi laten pada jaringan limfoid, namun juga memiliki kemampuan onkogenesis pada hewan coba rodensia. Adenoviridae kebanyakan menyerang anak-anak dan orang militer dengan menginfeksi saluran pernapasan, infeksi pada mata, radang kantung kemih yang menyebabkan hematuria, serta encephalitis.
Pengobatan biasanya jarang dilakukan untuk umum, vaksin oral atenuasi hanya diberikan pada militer. Antiviral yang biasa diberikan untuk mengobati adalah cidofovir ribavirin, namun hasilnya tidak terlalu menjanjikan. Pemberian vaksin hidup dapat menyebabkan penyebaran infeksi.
Adenoviridae è una famiglia di virus, unica rappresentante dell'ordine Rowavirales, appartenente alla classe Tectiliviricetes.[1] Gli adenovirus hanno dimensioni medie, con un genoma costituito da DNA lineare a doppio filamento, e presentano simmetria icosaedrica e sono privi di rivestimento lipidico.
Le particelle degli adenovirus hanno un capside icosaedrico dal diametro di 60-90 nm e sono prive di involucro lipidico. Sono i più grandi virus privi di involucro. Il capside è formato da 252 capsomeri di cui 240 esameri e 12 pentameri collocati ai vertici; all'apice di ciascun vertice si trova una fibra che facilita l'attacco alle cellule bersaglio risultando tossica, così come lo è la sua base. La fibra è formata anche da proteine virali d'attacco (VAP). Le grandi dimensioni degli adenovirus ne rendono ugualmente possibile l'entrata all'interno delle cellule bersaglio attraverso i pori, senza dover ricorrere alla fusione degli involucri. Ogni adenovirus è costituito da una molecola di DNA lineare a doppio filamento (dsDNA) costituita da 30-36 Kb paia di basi e codificante per 30-40 geni, un numero maggiore rispetto a virus del medesimo gruppo. Una proteina si lega covalentemente con l'estremità 5' e forma un genoma pseudocircolare mediante legame non covalente con l'estremità 3'. Il genoma codifica, tra gli altri polipeptidi, per 9 proteine strutturali che formano il virione (L1, L2, L3, L4, L5...) e 2 proteine associate al DNA.
L'adenovirus attacca le cellule mediante le fibre virali che legano il recettore coxsackie-adenovirus, una proteina della famiglia delle immunoglobuline oppure MHC I, entrambe poste sulla membrana plasmatica della cellula bersaglio. A questo punto la base del pentone si lega all'integrina αv che promuove l'endocitosi mediata da clatrina, del virus nella cellula. Nel citoplasma l'adenovirus lisa l'endosoma in cui è contenuto, si porta presso il nucleo e libera il DNA al suo interno. Il DNA di adenovirus viene trascritto su entrambi i sensi e spesso a partire dagli stessi promotori, le singole proteine vengono ottenute per splicing alternativo. La prima proteina precocissima codificata è E1A, ottenuto per splicing da E1; questa proteina è un transattivatore della trascrizione delle altre proteine precoci e un inibitore di Rb, il che lo rende oncogeno dato che promuove la proliferazione cellulare. E1B è un'altra proteina precocissima oncogena che inibisce p53. La replicazione del DNA avviene nel nucleo da parte di una DNA-polimerasi DNA-dipendente codificata dal genoma del virus che utilizza come primer la proteina terminale ad esso attaccata replicando entrambi i filamenti. Alla fine della replicazione del DNA inizia l'espressione dei geni tardivi che codificano per il capside. I loro mRNA sono tradotti dai ribosomi nel citoplasma, poi trasportate di nuovo al nucleo per essere assemblate con il DNA (che vi penetra attraverso l'apertura ad uno dei vertici) in modo da formare nuovi virioni. La replicazione di adenovirus è nel complesso particolarmente inefficiente per questo sono di normale riscontro decine o centinaia di virioni difettosi nelle cellule infettate. Nelle cellule permissive la replicazione del DNA virale e la traduzione delle sue proteine determina lisi della cellula, mentre nelle cellule non permissive si stabilisce un'infezione latente.[2][3].
Si conoscono almeno 100 sierotipi di adenovirus, 57 di questi possono potenzialmente infettare l'uomo e sono suddivisi in sette specie (Human Adenovirus + lettera dalla A alla G). Sulla base dei caratteri antigenici gli adenovirus umani sono distinti in 57 sierotipi diversi che, a loro volta, sono raggruppati in 7 diversi sottogeneri o sottogruppi, indicati con le lettere da A a G, a seconda della presenza o meno di altri caratteri.
Gli adenovirus più diffusi sono anche i primi ad essere stati scoperti (sierotipi 1-7). Alcuni tipi, in particolare il 12, 18 e 31 (gruppo A), hanno una notevole capacità di tumorigenesi in animali da esperimento.
Adenovirus bovini
Infetta gli uccelli (es.: adenovirus degli uccelli di tipo 1)
Infetta i mammiferi (es.: adenovirus umano di tipo 2 o 5)
(es.: adenovirus 1 degli anfibi e adenovirus 3 del tacchino)
Gli adenovirus sono insolitamente resistenti a cambiamenti chimici o fisici dell'ambiente nel quale si trovano, il che ne rende possibile la sopravvivenza anche per lunghi periodi al di fuori dei fluidi corporei: sono tuttavia eliminabili mediante il calore e l'uso di candeggina.
Il contagio avviene principalmente attraverso la saliva: la maggior parte delle specie infetta i vertebrati, tuttavia un genere parassita i funghi[4]. Generalmente questi virus determinano patologie non particolarmente gravi, tuttavia in rari casi è stata riportata la morte della persona colpita[4][5]
Gli adenovirus sono in grado di instaurare infezioni litiche (nelle cellule mucoepiteliali), latenti (nelle cellule linfoidi) e trasformanti (nelle cellule dei roditori, ma non in quelle umane). I virus infettano inizialmente le cellule epiteliali dell'orofaringe, degli organi respiratori e enterici, della congiuntiva (tramite contatto con le dita). Il tropismo tissutale dipende dalle proteine della fibra virale (VAP: proteine virali di attacco). La proteina della base del pentone (componente del capside virale) può inibire il trasporto degli mRNA cellulari dal nucleo al citoplasma inibendo la sintesi proteica della cellula infettata. Il marcatore istologico dell'infezione da adenovirus è rappresentato da dense inclusioni centrali intranucleari costituite da DNA e proteine virali; tali inclusioni ricordano quelle osservate nelle cellule infettate da citomegalovirus, tuttavia a differenza di quest'ultimo adenovirus non provoca citomegalia (ingrossamento cellulare). La viremia può verificarsi dopo replicazione in loco del virus e conseguente diffusione agli organi interni. Tale disseminazione è più frequente nei pazienti immunocompromessi. Il virus tende a instaurare infezioni latenti nelle cellule linfoidi e in altri tessuti come tonsille, adenoidi e placche di Peyer, e può essere riattivato nei pazienti immunocompromessi o infettate da altri agenti. Gli adenovirus possiedono numerosi meccanismi per eludere la risposta immunitaria dell'ospite all'infezione. Essi sono in grado di codificare per piccoli RNA non codificanti (indicati come RNA VA, associati al virus) i quali impediscono l'attivazione dell'inibizione della sintesi delle proteine virali da parte della PKR indotta dall'interferoni di tipo I (IFN-1). Le proteine virali E3 e E1A inoltre possono inibire l'apoptosi innescata dalla cellula ospite in risposta alle alterazioni indotte dal virus, oppure dall'azione del linfociti T e dalle citochine pro infiammatorie (TNF alfa). Alcuni ceppi di adenovirus possono inibire l'attività citotossica del linfociti T CD8 indirettamente, bloccando l'espressione delle MHC di classe I da parte delle cellule infettate.
Tra le possibili patologie causate da adenovirus vi sono congiuntiviti, gastroenteriti, cistiti e polmoniti.
Adenoviridae è una famiglia di virus, unica rappresentante dell'ordine Rowavirales, appartenente alla classe Tectiliviricetes. Gli adenovirus hanno dimensioni medie, con un genoma costituito da DNA lineare a doppio filamento, e presentano simmetria icosaedrica e sono privi di rivestimento lipidico.
Adenovira sunt vira magnitudinis mediae (90–100 nm), formae icosaedri, et nulli involucri, cum nucleocapside genomaque DNA linealis catenam duplex habenti.
Adenovirus adalah sejenis virus bersaiz sederhana (90–100 nm), tidak bersampul (tanpa dua lapisan lipid luar) ikosahedral viruses composed of a nucleocapsid dan bergenom bebenang ganda dua DNA linear . Terdapat 55 serotip yang dikenalpasti di dalam manusia, yang bertanggungjawab bagi 5–10% jangkitan pernafasan atasan pada kanak-kanak, dan juga jangkitan pada dewasa.
Virus ini adalah dari famili Adenoviridae yang menjangkit pelbagai spesis vertebra, termasuklah manusia. Adenovirus mula-mula diasingkan pada tahun 1953 daripada adenoid manusia. Mereka diklasifikasikan sebagai kumpulan I dibawah skima Pengkelasan Baltimore.
Famili mengandungi genera berikut:
Adenovirus adalah sejenis virus bersaiz sederhana (90–100 nm), tidak bersampul (tanpa dua lapisan lipid luar) ikosahedral viruses composed of a nucleocapsid dan bergenom bebenang ganda dua DNA linear . Terdapat 55 serotip yang dikenalpasti di dalam manusia, yang bertanggungjawab bagi 5–10% jangkitan pernafasan atasan pada kanak-kanak, dan juga jangkitan pada dewasa.
Virus ini adalah dari famili Adenoviridae yang menjangkit pelbagai spesis vertebra, termasuklah manusia. Adenovirus mula-mula diasingkan pada tahun 1953 daripada adenoid manusia. Mereka diklasifikasikan sebagai kumpulan I dibawah skima Pengkelasan Baltimore.
Adenovirussen (Adenoviridae) zijn een familie van virussen met de vorm van een regelmatig twintigvlak (icosahedron).
Op de hoekpunten bevinden zich speldvormige uitsteeksels. Deze 'spelden' spelen een rol in het maken van een verbinding met de gastheercel.
Adenovirussen veroorzaken bij mensen doorgaans milde ziekteverschijnselen, waaronder luchtweginfecties en conjunctivitis (bindvliesontsteking ). Het virus werd in 1953 ontdekt in operatief verwijderde neusamandelen van kinderen.[1] Onderzoek heeft aangetoond dat besmetting met een adenovirus zwaarlijvigheid bij dieren (onder andere kippen en muizen) kan veroorzaken. Of dat voor de mens ook geldt, is nog niet duidelijk.
Adenovirussen (Adenoviridae) zijn een familie van virussen met de vorm van een regelmatig twintigvlak (icosahedron).
Op de hoekpunten bevinden zich speldvormige uitsteeksels. Deze 'spelden' spelen een rol in het maken van een verbinding met de gastheercel.
Adenovirussen veroorzaken bij mensen doorgaans milde ziekteverschijnselen, waaronder luchtweginfecties en conjunctivitis (bindvliesontsteking ). Het virus werd in 1953 ontdekt in operatief verwijderde neusamandelen van kinderen. Onderzoek heeft aangetoond dat besmetting met een adenovirus zwaarlijvigheid bij dieren (onder andere kippen en muizen) kan veroorzaken. Of dat voor de mens ook geldt, is nog niet duidelijk.
Adenovirusa (medlem av familien Adenoviridae) er ei gruppe mellomstore (90—100 nm), membranlause (utan eit ytre bilipid lag) virus med ein ikosahedral nukleokapsid fylt med dobbelstrenga DNA-genom. Namnet kjem av at dei første gong blei isolert frå svelgmandelen (adenoide vegetasjonar) hjå menneske i 1953.[1][2]
Ryggbeinsdyr er ein utbreidd vert for desse virusa. Hjå menneske har ein funne heile 57 distinkte serotypar av adenovirus som kan valda ulike sjukdommar, frå milde luftvegsinfeksjonar hjå små barn til livstrugande multiorgansjukdommar hjå folk med svekka immunsystem.
Adenovirusa (medlem av familien Adenoviridae) er ei gruppe mellomstore (90—100 nm), membranlause (utan eit ytre bilipid lag) virus med ein ikosahedral nukleokapsid fylt med dobbelstrenga DNA-genom. Namnet kjem av at dei første gong blei isolert frå svelgmandelen (adenoide vegetasjonar) hjå menneske i 1953.
Ryggbeinsdyr er ein utbreidd vert for desse virusa. Hjå menneske har ein funne heile 57 distinkte serotypar av adenovirus som kan valda ulike sjukdommar, frå milde luftvegsinfeksjonar hjå små barn til livstrugande multiorgansjukdommar hjå folk med svekka immunsystem.
Adenovirusene er en gruppe virus som trives på slimhinnene. Denne typen virus hører til i en gruppe som ofte forårsaker forkjølelser.[1]
Adenovirusene er en gruppe virus som trives på slimhinnene. Denne typen virus hører til i en gruppe som ofte forårsaker forkjølelser.
Adenoviridae é uma família de vírus de genoma de DNA dupla hélice linear. Não segmentado, não possuem envelope celular bilipídico e são extremamente resistentes. A transmissão pode ser fecal-oral ou respiratória. Há mais de 40 sorotipos, e a infecção por um deles não dá imunidade contra os outros serotipos. São classificados de A a F e de acordo com o vetor (humano, bovino, porcino, ovino...). [1]
Os Mastadenovirus são muito comuns em humanos, estão espalhados no mundo todo e seus serotipos mais importantes são[2]:
Comuns no mundo todo, frequentemente causam infecções nas crianças, e em menor grau em adultos jovens, principalmente os parentes das crianças, os pediatras e enfermeiros. São também frequentes nos recrutas militares, acampamentos e escolas. A infecção é por contaminação com alimentos ou água contaminada com fezes ou mais raramente secreções no ar e causam:
Adenoviridae é uma família de vírus de genoma de DNA dupla hélice linear. Não segmentado, não possuem envelope celular bilipídico e são extremamente resistentes. A transmissão pode ser fecal-oral ou respiratória. Há mais de 40 sorotipos, e a infecção por um deles não dá imunidade contra os outros serotipos. São classificados de A a F e de acordo com o vetor (humano, bovino, porcino, ovino...).
Adenoviride (în latină Adenoviridae) este o familie de virusuri cu potențial patogenic la diferite specii. S-au izolat, ca serotipuri patogene, 51 la om, 9 la bovine, 4 la porcine, 2 la canine, 2 la murinc, 8 aviare, etc.
În această familie sunt încadrate virusuri cu genom ADN dublu catenar, cu o masă moleculară de 20-25x10 6 D. Capsida icosaedrică este alcătuită din 252 capsomere, din care 240 sunt hexamere și 12 sunt pentamere. Din fiecare pentonă pornește câte o prelungire asemănătoare cu un ac cu gămălie. Aceste prelungiri sunt diferite de la o specie virală la alta. Ele conțin un antigen specific cu rol în fixarea virusului pe celula gazdă și tot ele posedă și activitate hemaglutinantă. Pentonele conțin în structura lor o toxină responsabilă de efectul citopatic precoce, care apare atunci când în culturile de celule primare sunt inoculate doze mari de virus. Particulele virale au un diametru de 70-90 nm fără prelungiri.
Maturarea virionilor se produce în nucleul celulei gazdă.
Adenovirusurile sunt rezistente la tratamentul cu eter și la pH-ul acid. Prin reacția de seroneutralizare au fost identificate mai multe serotipuri patogene pentru fiecare specie (51 la om, 9 bovine, 4 porcine, 2 canine, 2 murinc, 8 aviare etc).
Adenovirus bovin tip 3 a fost izolat în culturi de celule renale primare de vițel, imunoelectronomicroscopic, captare făcută cu ser specific anti-adenovirus tip 3 preparat pe iepure (mărirea 100.000 x., bara reprezintă 100 nm).
În culturile celulare virusurile sunt recunoscute prin efectul citopatic produs, manifestat prin rotunjiri și reducerea dimensiunilor celulei, condensări citoplasmatice și apariția de incluzii intranucleare abnormale.
Adenovirusurile au tropism pentru mucoase și produc sindroame enterice și/sau pulmonare. La câine produce hepatită contagioasă. La păsări provoacă hepatită cu incluzii.
Adenovirusul uman 36 (Human adenovirus 36, HAdV-36, AD-36) a fost suspectat de legături cu obezitatea aviară în anul 2006 de câtre Dr. Nikhil Dhurandhar[1][2] și colaboratorii, care au gasit o corelație pozitivă între cantitatea de grăsime din organism și prezența de anticorpi AD-36 în sânge[3].
Cercetări ulterioare au demonstrat experimental o creștere statistic-significantă a creșterii în greutate la găini și șoareci după infestarea cu tulpini similare de virusuri[1].
Deocamdată, AD-36 este singurul adenovirus uman care ar putea fi implicat în obezitatea umană, în afară de găini, șoareci, șobolani și maimuțe[4].
Se presupune că procesul patologic ar fi următorul: infecția cu AD-36 duce la creșterea numărului celulelor adipoase din organism prin inducerea diferențierii celulare pe deoparte și amplificarea numerică prin diviziune a pre-adipocitelor (3T3-L1) și a celulelor mamă (stem cells) derivate din țesutul adipos uman, pe de alta[5].
Rezultatele cercetărilor grupului Dr. Nikhil Dhurandhar (Pennington Biomedical Research Centre, Louisiana) și ale lui Richard Atkinson (University of Wisconsin), publicate la 18 martie 2006 în câteva websites au trezit un interes deosebit și au declanșat o serie de alte cercetări. Testele de laborator efectuate la 2000 de australieni au relevat că peste 20% dintre participanți sunt pozitivi la Ad-36 Ab.
La 26 ianuarie 2009 portaluri internetice de știri acuzau virusul AD-36 ca o cauză potențială a tendinței populației britanice la obezitate (vezi mai jos: Legături externe)
|coauthors= (ajutor) |coauthors= (ajutor) |coauthors= (ajutor) Adenoviride (în latină Adenoviridae) este o familie de virusuri cu potențial patogenic la diferite specii. S-au izolat, ca serotipuri patogene, 51 la om, 9 la bovine, 4 la porcine, 2 la canine, 2 la murinc, 8 aviare, etc.
Adenoviridae je čeľaď vírusov. Vírus z tejto čeľade sa po slovensky volá adenovírus.
Sú to vírusy, ktorých genetickú informáciu kóduje DNA. Nemajú obal v podobe fosfolipidovej dvojvrstvy. Ako všetky ostatné druhy vírusov nie sú schopné samostatného množenia; na svoju replikáciu potrebujú živú bunku. Vyvolávajú napríklad niektoré choroby dýchacích ciest, konjunktivitídy či gastroenteritídy.
Adenoviridae je čeľaď vírusov. Vírus z tejto čeľade sa po slovensky volá adenovírus.
Sú to vírusy, ktorých genetickú informáciu kóduje DNA. Nemajú obal v podobe fosfolipidovej dvojvrstvy. Ako všetky ostatné druhy vírusov nie sú schopné samostatného množenia; na svoju replikáciu potrebujú živú bunku. Vyvolávajú napríklad niektoré choroby dýchacích ciest, konjunktivitídy či gastroenteritídy.
Aviadenovirus
Atadenovirus
Mastadenovirus
Siadenovirus
Adenovirusi (znanstveno ime Adenoviridae) so družina virusov. Genom adenovirusov je linearna molekula dvojnovijačne DNK. Virusne prepisovalne enote delijo na zgodnje (zapis za E1, E2, E3 in E4), zadrževalno zgodnje (zapis za IX in Iva) in pozne gene, glede na časovno ekspresijo v primerjavi z začetkom podvojevanja virusne DNK. Produkti zgodnjih genov so večinoma vpleteni pri prepisovanju adenovirusnega gena, podvajanju virusne DNK, zaviranju gostiteljskega imunskega odziva in inhibiciji celične apoptoze. »Pozni« proteini so strukturni, ki predstavljajo virusne sestavine, in regulacijski, ki prekinejo sintezo »zgodnjih« proteinov. Prvi gen, ki je izražen po virusni infekciji, je E1A in je najbolj pomemben prepisovalni aktivator za ostale gene.
Tako kot pri retrovirusih lahko adenovirusi vstopijo v celico šele, ko se ligandi na površini golih ikozaedričnih virusov pritrdijo na specifični receptor. Pri adenovirusih gre za proteinsko palčko, ki prepoznava antigene PHK II epitelijskih celic, sluznic dihal in prebavil. Po uspešni pritrditvi virusi vstopajo v celice z endocitozo. Pri tem se napravi endosom (mešiček), ki se odščipne in sprosti v citoplazmo. Znotraj celice se endosom zlije z lizosomom v endolizosom. Zaradi znižanja pH v endolizosomu se spremeni prostorska zgradba nekaterih virusnih proteinov. S tem se omogoči prehod kapside v citoplazmo.
Dvojnovijačna DNA se pomnožuje in prepisuje v jedru. Prepisovanje omogoči celična od DNA odvisna polimerazna DNA. Policistronske mRNA se cepijo v monocistronske mRNA. Virusi se navadno sprostijo, ko se celica razkroji.
Adenovirusi (znanstveno ime Adenoviridae) so družina virusov. Genom adenovirusov je linearna molekula dvojnovijačne DNK. Virusne prepisovalne enote delijo na zgodnje (zapis za E1, E2, E3 in E4), zadrževalno zgodnje (zapis za IX in Iva) in pozne gene, glede na časovno ekspresijo v primerjavi z začetkom podvojevanja virusne DNK. Produkti zgodnjih genov so večinoma vpleteni pri prepisovanju adenovirusnega gena, podvajanju virusne DNK, zaviranju gostiteljskega imunskega odziva in inhibiciji celične apoptoze. »Pozni« proteini so strukturni, ki predstavljajo virusne sestavine, in regulacijski, ki prekinejo sintezo »zgodnjih« proteinov. Prvi gen, ki je izražen po virusni infekciji, je E1A in je najbolj pomemben prepisovalni aktivator za ostale gene.
Adenovirus tillhör virussläktet Adenoviridae. Adenovirus är ett medelstort virus (60-90 nm) med dubbelsträngat DNA och saknar hölje samt har en ikosahedral form. Det finns 52 olika serotyper. Viruset står för 10% av akuta luftvägsinfektionerna hos barn och är en vanlig orsak till diarre. Barn drabbas oftare än vuxna och fall inträffar främst i slutet av vintern, under våren och i början av sommaren.
Den delas upp i 6 kategorier beroende på vilket organ som det infekterar.
Organ som infekteras,
Hos fåglar orsakar adenovirus ett flertal sjukdomar, bland annat Inklusionskroppshepatit (Inclusion body hepatitis, IBH) som orsakar kraftiga leverskador främst hos unga tamhönskycklingar. Diagnosen ställs genom mikroskopisk vävnadsundersökning (histologi), då viruset under ett visst skede orsakar för sjukdomen typiska vävnadsförändringar i levern (intranukleära inklusionskroppar). Dödligheten i flocken är oftast relativt låg men internationellt finns fall där dödligheten nått upp till 30%.
Adenovirus kan även orsaka muskelmagsskador hos kycklingar, vilket i Sverige diagnosticerades första gången 2016 (Statens veterinärmedicinska anstalt, SVA, Uppsala). Viruset ligger även bakom exempelvis Egg drop syndrome (EDS) hos värphöns, Hemorrhagic enteritis hos kalkon, Quail bronchitis hos vaktel och Marble spleen disease hos fasan
Umeå universitet http://www.info.umu.se/plussidan/Plusprojektsida.aspx?id=48
Diseases of Poultry - 13th Edition. David E. Swayne et al.
Statens veterinärmedicinska anstalt (SVA), Uppsala (ej publicerat)

Adenovirus tillhör virussläktet Adenoviridae. Adenovirus är ett medelstort virus (60-90 nm) med dubbelsträngat DNA och saknar hölje samt har en ikosahedral form. Det finns 52 olika serotyper. Viruset står för 10% av akuta luftvägsinfektionerna hos barn och är en vanlig orsak till diarre. Barn drabbas oftare än vuxna och fall inträffar främst i slutet av vintern, under våren och i början av sommaren.
Den delas upp i 6 kategorier beroende på vilket organ som det infekterar.
Organ som infekteras,
ögon njure luftvägar tarm hjärta lymfatiska systemetHos fåglar orsakar adenovirus ett flertal sjukdomar, bland annat Inklusionskroppshepatit (Inclusion body hepatitis, IBH) som orsakar kraftiga leverskador främst hos unga tamhönskycklingar. Diagnosen ställs genom mikroskopisk vävnadsundersökning (histologi), då viruset under ett visst skede orsakar för sjukdomen typiska vävnadsförändringar i levern (intranukleära inklusionskroppar). Dödligheten i flocken är oftast relativt låg men internationellt finns fall där dödligheten nått upp till 30%.
Adenovirus kan även orsaka muskelmagsskador hos kycklingar, vilket i Sverige diagnosticerades första gången 2016 (Statens veterinärmedicinska anstalt, SVA, Uppsala). Viruset ligger även bakom exempelvis Egg drop syndrome (EDS) hos värphöns, Hemorrhagic enteritis hos kalkon, Quail bronchitis hos vaktel och Marble spleen disease hos fasan
Аденовіруси мають форму ікосаедрів діаметром 60 — 80 ммк, які містять приблизно 200 — 250 капсомерів. Частинки не мають зовнішньої оболонки. Віруси складаються з нуклеїнової кислоти та білків, ліпідів не містять. Розмножуються тільки в культурах тканин того виду тварин, у якого вони породжують захворювання. Мають виражений тропізм до клітин епітелію.
Віріони мають форму ікосаедра діаметром 70-90 нм, що складається з 252 капсомерів з діаметром 7-9 нм. З них 240 капсомерів утворюють 20 різносторонніх трикутників, кожен має 6 сусідніх капсомерів і тому називається гексоном. Гексон побудований з 3-6 молекул білка II, складаю чого близько 50 % від всіх білків віріона. Групи з дев'яти гексонів зв'язані з двома додатковими мінорними білками (VII і IX). На дванадцяти вершинах ікосаедра знаходяться булавоподібні виступи довжиною від 8 до 30 нм з головкою на кінці величиною 4 нм. Вони відходять від вершин дванадцяти капсомерів, що мають 5 сусідніх. Ці капсомери разом з виступами називають пентонами, капсомери — основою пентонів, нитки — фібрами. Всередині капсида знаходиться серцевина з діаметром 66 нм, що представляє правильно організовану структуру з 12 петель. Вершини петель збігаються з вершинами капсида і на зрізі віріона серцевина утворює фігуру подібну квітці. Петлі утворені дезоксирибонуклеопротеїдом, що складається з ДНК і асоційованого з ним білка VII. Другий внутрішній білок V знаходиться на зовнішній поверхні петель. У серцевині також локалізовані білки VI, X.
Тип нуклеїнової кислоти: лінійна dsDNA, кожен ланцюг на 5’-кінці ковалентно зв'язаний з білком ТР (англ. terminal protein), містить інвертовані кінцеві повтори у обох ланцюгах. Розмір — 26-45 kbp. Вміст G+C пар 33.7-63.8 %. Процеси транскрипції, реплікації і збірки віріонів проходить в ядрі. Транскрипція відбувається за участю клітинної РНК-полімерази ІІ (ген VA транскрибується РНК-полімеразою ІІІ; кодує білки, що пригнічують синтез інтерферону та посилюють транскрипцію пізніх генів.) Синтезовані мРНК кепуються та поліаденілюються
Цикл вірусу:
Вірусний геном кодує більше 40 поліпептидів. Третина з них є структурними:
Основними не структурними білками є DNApol (120 kDa) та DBP(59 kDa).
Вуглеводи: Білки фібрил та деякі не структурні білки — глікозильовані. Ліпідів не виявлено.
Серотипи аденовірусів розрізняють за нейтралізацією. Поверхневі антигени, як правило, типоспецифічні. Гексони беруть участь у нейтралізації, фібрили у нейтралізації та інгібіції гемаглютиніну. Розчинні антигени, асоційовані з вірусними інфекціями, являють собою надлишкові капсидні білки, що не було використано. Як було показано у реакціях з моноклональними антитілами, гексони та інші антигени можуть нести численні епітопи, які можуть бути родо-, видо-, і навіть серотипоспецифічні. Родоспецифічні антигени розташовані на базальній поверхні гексону, в той час як серотипоспецифічні антигени розміщені на вузлових його ділянках.
Аденовіруси добре зберігаються при низьких температурах, а при 22°С — протягом двох тижнів. При 56 °C гинуть через 10 хвилин. Стійкі до етеру.
Можуть уражати риб, рептилій, птахів, ссавців, людей. Деякі аденовіруси людини (переважно виду Human adenovirus C) спричинюють продуктивні інфекції в клітинах деяких тварин (гризуни, жуйні). Деякі віруси спричинюють пухлини у різних видів. У 1962 pоці американський імунолог та вірусолог Д. Трентин з співавторами описали перший випадок індукції злоякісної пухлини у тварин патогенним вірусом людини — ним виявився аденовірус-12, що спричиняє пухлини в гризунів. Пізніше онкогенність аденовірусів у тварин багаторазово підтверджували інші дослідники, але його онкогенність для людей до сьогодні не довели.
У ссавців аденовірусні інфекції звичайні, але маніфестація інфекції пов'язана з певними факторами (конкурентні інфекції). Собачий аденовірус спричинює хвороби у собак, епізоотії у лисиці, ведмедів, вовків, койотів та скунсів.
Первина репродукція аденовірусів проходить в епітеліальних клітинах слизової оболонки дихальних шляхів і кишечника, в кон'юнктиві ока і лімфоїдній тканині. За типом ураження чутливих клітин розрізняють три види інфекційного процесу:
Аденовірусів людей відносять до роду Mastadenovirus. Добре розмножуються в культурах клітин людини. Збирання аденовірусу відбувається в ядрах клітин, де виникають характерні кристали, потім віріони з'являються у цитоплазмі. Цитопатичний ефект спостерігають через 24 — 96 годин, в залежності від серотипа вірусу. Аденовіруси мають два антигена — групоспецифічний розчинний антиген, який виявляють реакцією зв'язування комплементу та типоспецифічний антиген, який виявляють у реакціях нейтралізації та гальмування гемаглютинації. За антигенними та серологічними властивостями розрізняють серотипи, кожен з яких позначають цифрами 1, 2, 3, 4 тощо.
Пряма або непряма передача вірусу відбувається через слиз ротоглотки, фекалії, очі чи сечу, в залежності від серотипу. Джерело та резервуар віруса — хвора людина. Інфекція передається повітряно-крапельним механізмом передачі. Захворювання частіше за все мають спорадичний характер, але можуть спостерігатися спалахи.
Детальніші відомості з цієї теми Ви можете знайти в статті Аденовірусна інфекція.
Аденовіруси уражають слизові оболонки верхніх дихальних шляхів, спричинюють різні клінічні форми:
Деякі форми спричинює переважно один певний серотип. Захворювання продовжується 4 — 7 діб, закінчується одужанням та формуванням типоспецифічного імунітету. Кров людей, що одужали, містить віруснейтралізуючі та комплементзв'язуючі антитіла.
Детальніші відомості з цієї теми Ви можете знайти в статті Аденовірусна інфекція.
Діагностику здійснюють за допомогою виділення вірусів та серологічних реакцій. Для виділення роблять змив з слизових оболонок верхніх дихальних шляхів, кон'юнктиви або фекалій. Досліджуваним матеріалом заражають культури клітин. Спостереження проводять протягом 2 тижнів. Наявність вірусу та його приналежність до аденовірусів визначають досліджуючи цитопатичну дію. Типування проводять в реакції нейтралізації з типоспецифічними сироватками. Для серологічного діагнозу двічі беруть кров хворого в перші дні захворювання та в період одужання. З крові отримують сироватку та визначають наявність антитіл за допомогою реакцій нейтралізації, зв'язування комплементу та гальмування гемаглютинації. На сьогодні застосовують також полімеразну ланцюгову реакцію (ПЛР), яка дає можливість виявити ДНК вірусу в крові, мазку-відбитку з кон'юнктиви, мазку з ротової порожнини тощо.
Adenoviruses (thành viên của họ Adenoviridae) có kích thước trung bình (90-100 nm), nonenveloped (không có một lớp kép lipid bên ngoài) virus với một nucleocapsid icosahedral chứa một bộ gen DNA đôi sợi. Tên của chúng xuất phát từ sự cô lập ban đầu của họ từ những adenoids của con người vào năm 1953.[1]
ở người, hơn 50 loại huyết thanh adenovirus khác nhau đã được tìm thấy gây ra một loạt các bệnh tật, tnhiễm trùng đường hô hấp nhẹ ở trẻ nhỏ (được gọi là cảm lạnh thông thường) bệnh đa cơ quan đe dọa tính mạng ở những người có hệ miễn dịch suy yếu..
Trong quá khứ, các tân binh quân đội Hoa Kỳ đã được chủng ngừa hai loại huyết thanh của adenovirus, với sự sụt giảm tương ứng về bệnh tật do những kiểu huyết thanh đó gây ra. Vắc-xin đó không còn được sản xuất nữa. Quân đội Hoa Kỳ nghiên cứu y tế và Materiel lệnh công bố vào ngày 31 tháng 10 năm 2011 rằng một vắc-xin adenovirus mới, thay thế phiên bản cũ đã hết sản xuất trong hơn một thập kỷ, đã được chuyển đến các trang đào tạo cơ bản vào ngày 18 tháng 10 năm 2011. Thông tin thêm có sẵn. Thông tin thêm ở đây.
Vệ sinh tốt, bao gồm rửa tay, vẫn là cách tốt nhất để tránh lấy adenovirus từ người bị nhiễm bệnh.
Adenoviruses (thành viên của họ Adenoviridae) có kích thước trung bình (90-100 nm), nonenveloped (không có một lớp kép lipid bên ngoài) virus với một nucleocapsid icosahedral chứa một bộ gen DNA đôi sợi. Tên của chúng xuất phát từ sự cô lập ban đầu của họ từ những adenoids của con người vào năm 1953.
ở người, hơn 50 loại huyết thanh adenovirus khác nhau đã được tìm thấy gây ra một loạt các bệnh tật, tnhiễm trùng đường hô hấp nhẹ ở trẻ nhỏ (được gọi là cảm lạnh thông thường) bệnh đa cơ quan đe dọa tính mạng ở những người có hệ miễn dịch suy yếu..
Аде́новирусы[2] (лат. Adenoviridae) — семейство ДНК-содержащих вирусов позвоночных, лишённых липопротеиновой оболочки. Аденовирусы имеют диаметр 70—90 нм, содержат единичную двухцепочечную молекулу ДНК длиной 34-36 т.п.н.,[3] молекулярной массой 20—29⋅106 Да. Наиболее известны аденовирусы, вызывающие острые респираторные заболевания. Их название происходит из их первоначального выделения из аденоидов.[4] На материале аденовирусов впервые было открыто явление альтернативного сплайсинга.[5]
В патологии человека наибольшее значение имеют серотипы 3, 4, 7, 8, 14 и 21. Они относительно устойчивы во внешней среде, инактивируются лишь при прогревании до 56°С и обработке растворами хлорамина и фенола. Аденовирусы хорошо размножаются на культуре ткани человека и животных.
По данным Международного комитета по таксономии вирусов (ICTV), на март 2017 года в семейство включают 5 родов[6]:
Аденовирусная инфекция у человека вызывается аденовирусами. Большая часть серотипов аденовирусов приводят к инфекции верхних дыхательных путей. Также зачастую аденовирусы бывают причиной конъюнктивита, тонзиллита, отита. Также аденовирусы 40 и 41 серотипа могут вызывать гастроэнтерит.[7]
Не существует специфической антивирусной терапии для лечения аденовирусной инфекции, и лечение в основном направлено на устранение симптомов.
Аденовирусы используются в качестве вирусного вектора для генной терапии благодаря их способности размножаться в реплицирующихся и нереплицирующихся клетках[8].
В Китае аденовирусы используются в лечении онкологических заболеваний[9].
Аде́новирусы (лат. Adenoviridae) — семейство ДНК-содержащих вирусов позвоночных, лишённых липопротеиновой оболочки. Аденовирусы имеют диаметр 70—90 нм, содержат единичную двухцепочечную молекулу ДНК длиной 34-36 т.п.н., молекулярной массой 20—29⋅106 Да. Наиболее известны аденовирусы, вызывающие острые респираторные заболевания. Их название происходит из их первоначального выделения из аденоидов. На материале аденовирусов впервые было открыто явление альтернативного сплайсинга.
В патологии человека наибольшее значение имеют серотипы 3, 4, 7, 8, 14 и 21. Они относительно устойчивы во внешней среде, инактивируются лишь при прогревании до 56°С и обработке растворами хлорамина и фенола. Аденовирусы хорошо размножаются на культуре ткани человека и животных.
腺病毒科(Adenoviridae)是一種中型大小的病毒,約90-100nm大,是一種無外套膜的二十面體雙股DNA病毒,有核衣殼。
腺病毒有四屬:
腺病毒主要感染多種脊椎動物,當中包括人類。腺病毒於1953年最早從人類的腺樣組織分離出來,故名為腺病毒。其對淋巴腺有親和力,可以在淋巴腺中潛伏很久。
腺病毒的遺傳物質為線型雙股DNA,全長約30000-42000bp,G/C比例範圍很大,約在48-61%之間,具有末端重複序列、反向末端重複等特色,末端重複序列在3'端,長度約50-200nt,5'端具有與基因組相連的蛋白質。
腺病毒為無外套膜二十面體的病毒,其蛋白質外鞘在電子顯微鏡觀察下,呈現有棱有角的型態,平均直經約在90nm左右。
感染腺病毒一般會造成呼吸系統的不適,依感染不同血清型的腺病毒,可能會引起消化道不舒服、結膜炎、膀胱炎、起疹子等。
細胞培養:腺病毒培養於A549細胞株
40.41型腺病毒培養於HEK293細胞株
腺病毒科(Adenoviridae)是一種中型大小的病毒,約90-100nm大,是一種無外套膜的二十面體雙股DNA病毒,有核衣殼。
腺病毒有四屬:
人類的腺病毒(HAd)約有57種血清型,佔兒童5%到10%及大多數成年人的上呼吸道感染的成因; 豬腺病毒(PAV)有5種血清型; 羊腺病毒(OAV)有6種血清型; 牛腺病毒(BAV)分為兩個族群腺病毒主要感染多種脊椎動物,當中包括人類。腺病毒於1953年最早從人類的腺樣組織分離出來,故名為腺病毒。其對淋巴腺有親和力,可以在淋巴腺中潛伏很久。
アデノウイルスは、二重鎖直鎖状DNAウイルスで、カプシドは直径約80nmの正20面体の球形粒子をしており、エンベロープは持たない。アデノウイルスは感染性胃腸炎、ライノウイルス等とともに、「風邪症候群」を起こす主要病原ウイルスの一つと考えられている。
アデノウイルスのゲノムは、単一の二重鎖直鎖状DNAからなる。DNA両側の5'末端にTPタンパク質が共有結合しており、これがDNA複製の際にプライマーとして機能する点が特徴的である。標準的には長さ26-46 kbpで23-46のタンパク質コード遺伝子を含んでおり、[1]基本的な構造や機能は全てのアデノウイルスに共通している。ここではヒトアデノウイルスEを例として説明する。
ヒトアデノウイルスEには転写単位が17個あり、それぞれが1から8個のタンパク質遺伝子を含んでいる[2]。またそれぞれの転写単位から選択的スプライシングによって複数の異なったmRNAが生じる場合もある。
E1A, E1B, E2A, E2B, E3, E4の6つの転写単位はウイルスの増殖サイクルの初期に順次転写される。ここに存在する遺伝子から翻訳されたタンパク質は、主にウイルスゲノムの複製や転写の制御と、宿主の感染応答の抑制に関与する[3]。
転写単位L1-L5は増殖サイクルの後期になって転写され、主にウイルスのカプシド形成に関わる。これらは単一のプロモーター領域で制御されており[4]、ひとつの転写開始点から転写を開始し、下流にある5つの転写終結点のいずれかでランダムに転写終結して5種類のmRNA前駆体を生じ、さらに選択的スプライシングによって様々なタンパク質をコードするmRNAになる。
以下の表にヒトアデノウイルスEのタンパク質コード遺伝子38を示す。[5][6]
名前 RefSeq ID 転写単位 開始位置 終了位置 鎖 アミノ酸数 control protein E1A YP_068018.1 E1A 576 1441 + 257 control protein E1B 19K YP_068019.1 E1B 1600 2115 + 171 control protein E1B 55K YP_068020.1 E1B 1905 3356 + 483 capsid protein IX YP_068021.1 IX 3441 3869 + 142 encapsidation protein IVa2 YP_068022.1 IVa2 3930 5554 - 448 DNA polymerase YP_068023.1 E2B 5033 13773 - 1193 protein 13.6K YP_001661328.1 L1 7814 9476 + 139 terminal protein precursor pTP YP_068024.1 E2B 8404 13773 - 642 encapsidation protein 52K YP_068025.1 L1 10765 11937 + 390 capsid protein precursor pIIIa YP_068026.1 L1 11961 13736 + 591 penton base (capsid protein III) YP_068027.1 L2 13815 15422 + 535 core protein precursor pVII YP_068028.1 L2 15426 16007 + 193 core protein V YP_068029.1 L2 16055 17080 + 341 core protein precursor pX YP_068030.1 L2 17103 17336 + 77 capsid protein precursor pVI YP_068031.1 L3 17413 18141 + 242 hexon (capsid protein II) YP_068032.1 L3 18248 21058 + 936 protease YP_068033.1 L3 21082 21702 + 206 single-stranded DNA-binding protein YP_068034.1 E2A-L 21774 23312 - 512 hexon assembly protein 100K YP_068035.1 L4 23341 25716 + 791 protein 33K YP_068036.1 L4 25439 26252 + 214 encapsidation protein 22K YP_068037.1 L4 25439 25978 + 179 capsid protein precursor pVIII YP_068038.1 L4 26321 27004 + 227 control protein E3 12.5K YP_068039.1 E3 27005 27325 + 106 membrane glycoprotein E3 CR1-alpha YP_068040.1 E3 27279 27911 + 210 membrane glycoprotein E3 gp19K YP_068041.1 E3 27893 28417 + 174 membrane glycoprotein E3 CR1-beta YP_068042.1 E3 28449 29111 + 220 membrane glycoprotein E3 CR1-delta YP_068043.1 E3 29440 30264 + 274 membrane protein E3 RID-alpha YP_068044.1 E3 30273 30548 + 91 membrane protein E3 RID-beta YP_068045.1 E3 30554 30994 + 146 control protein E3 14.7K YP_068046.1 E3 30987 31388 + 133 protein U YP_068047.1 U 31481 31632 - 50 fiber (capsid protein IV) YP_068048.1 L5 31649 32926 + 425 control protein E4orf6/7 YP_068049.1 E4 33022 34169 - 141 control protein E4 34K YP_068050.1 E4 33270 34169 - 299 control protein E4orf4 YP_068051.1 E4 34072 34440 - 122 control protein E4orf3 YP_068052.1 E4 34449 34802 - 117 control protein E4orf2 YP_068053.1 E4 34799 35188 - 129 control protein E4orf1 YP_068054.1 E4 35236 35610 - 124それぞれの機能の概略は以下の通りである:[4]
B種以外のアデノウイルスは免疫グロブリンスーパーファミリーに属するCARタンパク質をレセプターとして宿主細胞内に取り込まれる。そしてE1Aの転写をきっかけとして各種の初期遺伝子が活性化され、ウイルスのDNAポリメラーゼやDNA結合タンパク質、感染細胞のアポトーシスを抑制する物質が合成される。さらにE1AはウイルスのDNA複製に都合のよいS期に誘導する。その後、ウイルスDNAの複製が始まると後期遺伝子が発現され、カプシドなどが合成され成熟したウイルスとなる。
人に感染するアデノウイルスは2016年現在、51型までの血清型と52型以降の全塩基配列による遺伝子型が知られており、A〜Gの7種に分類されている。種によって、どのような病気を起こすのか、ある程度判明している。多くのアデノウイルスは、潜伏期は5〜7日で、感染経路は便、飛沫、直接接触による。感染した場合、アデノウイルスは扁桃腺やリンパ節の中で増殖する(アデノとは扁桃腺やリンパ節を意味する言葉)。
主として3・7型による。
特に7型は重症の肺炎を起こす。乳幼児がかかることが多く、髄膜炎、脳炎[12]、心筋炎などを併発することもある。だらだらと長引く発熱、咳、呼吸障害など重症になることがあり、時に致命的なことがある[13]。
主として3・4型による。
1日の間に39〜40度の高熱と、37〜38度前後の微熱の間を、上がったり下がったりが4〜5日ほど続き、扁桃腺が腫れ、のどの痛みを伴う。その間、頭痛、腹痛や下痢を伴い、耳介前部および頸部のリンパ節が腫れることがある。両目または片目が真っ赤に充血し、目やにが出る。夏にプールを介して流行することがあるため、プール熱とも呼ばれることもあるが、プールに入らなくても飛沫や糞便を通して感染する。うがい、手洗い、プールの塩素消毒などで、ある程度予防できる。症状がインフルエンザに似ているため、「夏のインフルエンザ」と呼ばれることもある。
学校保健安全法上の学校感染症の一つであり、主要症状がなくなった後、2日間登校禁止となる。
主として8、19、37型によるとされてきたが、近年の日本においては53、54および56型によるEKCが多発するようになった。これらはいずれもD種アデノウイルスである。B種の3、7型やE種の4型による場合もあるが、D種より軽症である。
目が充血し、目やにが出るが、咽頭結膜熱のように高い熱はなく、のどの赤みも強くはない。結膜炎経過後に点状表層角膜炎を作ることが多く、幼小児では偽膜性結膜炎になることがある。角膜混濁が発症することがあり、数か月以上も症状が残ることがあるので眼科での治療が必要である。
流行性角結膜炎は学校保健安全法上の学校感染症の一つで、伝染の恐れがなくなるまで登校禁止となる。
主として11型による。
排尿時痛があり、真っ赤な血尿が出る。排尿時の痛みと肉眼的血尿が特徴で、これらの膀胱炎症状は2 〜 3日で良くなり、尿検査での潜血も10日程度で改善する。
主として1・2・3・4・6・7型による。
眼の痛み、羞明、涙目、目やにを訴え、結膜に小さなぶつぶつができる。
「腸管アデノウイルス胃腸炎」と呼ばれる。主として31・40・41型による。潜伏期間は、3〜10日[14]。集団感染は食品中では増殖しないため、人から人への感染様式で広がる[15]。
乳幼児期に多く、37℃程度の発熱、腹痛、嘔吐、下痢を伴い[14]、下痢は1週間以上長引く事もある。治療は対症療法。
ヒトだけで無く家畜(ウシ)に於いても胃腸炎症状を発症させ、出血性の腸炎症状を起こすことがあると報告されている[16]。
消毒剤への抵抗性が強く、塩素消毒が有効であるとされている。皮膚や環境表面から除去することは困難なため、患者に接触する場合は、手袋、マスク、眼鏡等により感染を防御する。
ウイルスの増殖に必要なE1領域を欠失させ代わりに外来の遺伝子を組み込んだアデノウイルスは、遺伝子を組み込むベクターとして用いられる[18]。レトロウイルスの場合は細胞の染色体に組み込まれるが、アデノウイルスの場合は染色体に組み込まれない。ただ、欠点としては免疫系に認識され炎症反応がおき、遺伝子を導入した細胞が排除されてしまうことである。
アデノウイルスは、二重鎖直鎖状DNAウイルスで、カプシドは直径約80nmの正20面体の球形粒子をしており、エンベロープは持たない。アデノウイルスは感染性胃腸炎、ライノウイルス等とともに、「風邪症候群」を起こす主要病原ウイルスの一つと考えられている。
아데노바이러스(학명: Adenoviridae)는 90~100nm의 중형 크기의 바이러스이며, 외피는 없다. 모양은 정이십면체로 되어 있으며, 이중나선 형태의 DNA를 가지고 있다. 아데노바이러스는 어린이가 걸린 상부 호흡기 질환 중 5~10%의 원인이며, 어른들도 감염되기도 한다.
아데노바이러스과에 속하는 바이러스들은 인간을 포함한 여러 척추동물들에게 감염될 수 있다. 아데노바이러스가 처음 분리된 곳이 사람의 인두 편도(adenoid)였으므로, 여기에서 "아데노바이러스(adenovirus)"라는 이름이 붙여졌다.[1]
아데노바이러스과는 다음의 속을 포함한다.
아데노바이러스 감염의 가장 흔한 증상은 상부 호흡기 질환이다. 아데노바이러스 감염은 종종 결막염, 편도염, 중이염, 후두염, 위장염 등을 동반하기도 한다. 특히 어린이의 경우 세기관지염이나 폐렴에 걸릴수 있으며, 상당히 악화될 수 있다. 아기들의 경우 백일해에 걸린것처럼 기침을 하기도 한다. 그 밖에도 아데노바이러스는 드물게 뇌염이나 방광염을 유발시킬 수 있다.
대부분의 사람들은 감염되어도 스스로 치유되지만, 면역결핍증을 가진 사람들은 감염에 의해 사망하기도 하며, 매우 드물지만 건강한 사람도 감염에 의해 사망에 이를 수 있다.[2]
아데노바이러스는 종종 기침할 때 나오는 물질에 의해 전염되지만 감염자와의 직접 접촉이나 수건이나 수도꼭지 등의 물체에 남겨진 바이러스 입자에 의해 전염되기도 한다. 다른 여러 질병들과 마찬가지로, 손을 잘 씻는 것이 아데노바이러스의 전파를 막을 수 있다. 열을 가하거나 표백제를 처리해도 아데노바이러스를 죽일 수 있다.
과거에 미군에서 두 가지 종류의 아데노바이러스에 대한 백신 접종을 받았지만.[3], 이 종류에 대한 감염이 줄어들어 현재는 더이상 백신이 생산되지 않는다. 따라서 현재는 손씻기 등 좋은 위생상태를 유지하는 것이 가장 좋은 예방법이다. 미군의 아데노바이러스 백신 접종은 Ad4형과 Ad7형을 타겟으로 한 백신을 사용하였는데, 1995년 생산 중단 이후 해당 감염이 호발하는 겨울철에만 사용하는 등 재고 긴축을 실시하다가 1999년 재고 고갈로 아데노바이러스 백신 접종이 중단되었다. 그러나 아데노바이러스 백신 접종 중단 이후 해당 질병의 창궐과 몇 개의 사망례가 보고되자 아데노바이러스 백신 접종 재개의 필요성이 주목을 받았고, 2011년 말에 미군 전 훈련 시설에 아데노바이러스 백신이 배치되어 접종 재개 되었다.
아데노바이러스 감염에 대한 항바이러스제는 최근 에볼라 치료용 실험약물로 연구가 되고 있는 brincidofovir가 바이러스 복제를 억제하는 것으로 알려져 있기는 하지만, 보통 열이 나면 해열제를 먹는 것처럼 치료는 대개 증상을 완화시키는 것이다. 결막염에 걸린 경우 의사는 항생제가 포함된 안약을 줄 수도 있는데, 이것은 결막염이 세균에 의한 것인지, 아니면 아데노바이러스와 같은 바이러스에 의한 것인지 확인하려 하는 것이다.(항생제는 세균을 죽일 수는 있지만 바이러스는 죽일 수 없다.)
아데노바이러스는 코로나19 백신을 제조하는데 바이러스 벡터(viral vector)로 사용된바있다. 벡터백신을 제조한 제조회사로는 영국 아스트라제네카와 미국의 얀센제약이 있다.
아데노바이러스(학명: Adenoviridae)는 90~100nm의 중형 크기의 바이러스이며, 외피는 없다. 모양은 정이십면체로 되어 있으며, 이중나선 형태의 DNA를 가지고 있다. 아데노바이러스는 어린이가 걸린 상부 호흡기 질환 중 5~10%의 원인이며, 어른들도 감염되기도 한다.
아데노바이러스과에 속하는 바이러스들은 인간을 포함한 여러 척추동물들에게 감염될 수 있다. 아데노바이러스가 처음 분리된 곳이 사람의 인두 편도(adenoid)였으므로, 여기에서 "아데노바이러스(adenovirus)"라는 이름이 붙여졌다.