fr
noms dans le fil d’Ariane


La ranita de San Antonio (Hyla arborea) ye una xaronca pequeña del xéneru Hyla d'unos 4,5 a 5 cm de llargor. La so piel tien de tar siempres húmeda y aliméntase d'inseutos. Ye'l representante por escelencia de los hílidos n'Europa, distribuyéndose per Europa central y meridional, y peles zones averáes d'Asia y África. Como que la intensidá del so cantar depende del mugor ambiental, considerase un higrómetru biolóxicu.
Son anfibios de pequeñu tamañu, de non más de 5 cm. Presenta un cuerpu ovaláu, cabeza ancha y güeyos grandes, saltones d'iris doráu. Fácilmente reconocibles pol intensu color verde brillante, anque, dependiendo de la so redolada, son capaces de camudar el so color del verde hasta'l pardu, l'azul y hasta mariellu. Dacuando puede atopase con llurdios. Tienen unes llinies que van del marrón al negru dibuxaes a lo llargo de les bandes de forma irregular y estendíes en llurdios más marrones. Les sos estremidaes espodaes y los deos provistos de ventoses, afeches a los sos vezos trepadores, déxen-yos xubir fácilmente pola vexetación y caltenese sobre les fueyes más polenques, siendo unu de los calteres que les dixebren de les xaronques típiques, de fuertes zanques traseres afeches al saltu. El machu presenta un gran sacu vocal qu'enche sol quexal al realizar la so llamada y desenvuelve mientres el periodu nupcial pequeñes rugosidaes nel primer deu de les estremidaes anteriores que lu van ayudar a suxetase a la fema mientres el amplexo.
Vive en territorios con agua permanente, onde abonda la vexetación a los marxes de llamargues, llagunes o ríos de corrientes lentes. Frecuenta preferiblemente árboles, carbes y otres vexetaciones trupes que-y dexen amazcarase y qu'amás tean próximes al agua. Ye d'actividá principalmente nocherniega y crepuscular. Presente nes zones mediterranees europees. Llargamente distribuida per Europa, dend'Ucraína y Bielorrusia, hasta los Balcanes, Creta, Italia, Benelux y Francia. La especie que vive na península ibérica ye Hyla molleri, igualmente denominada ranita de San Antonio.[2]
El periodu reproductor d'esta xaronquina empieza cola primavera, utilizando llamargues o riberes fluviales d'agües duces y con abonda vexetación.
Los machos atraen a les femes col so fuerte cantar, enchiendo'l sacu vocal que llega a adquirir un tamañu mayor que'l de la cabeza.
Como nel restu d'especies de xaronques, l'apareyamientu tien llugar una vegada el machu consiguiera atraer a una fema cola so llamada y mientres la nueche. La fema deposita paquetes con alredor de 1000 güevos, que son fecundaos esternamente pol machu, realizando'l denomináu amplexo axilar.
Hyla arborea Cuyarapa y la so metamorfosis,
La ranita de San Antonio (Hyla arborea) ye una xaronca pequeña del xéneru Hyla d'unos 4,5 a 5 cm de llargor. La so piel tien de tar siempres húmeda y aliméntase d'inseutos. Ye'l representante por escelencia de los hílidos n'Europa, distribuyéndose per Europa central y meridional, y peles zones averáes d'Asia y África. Como que la intensidá del so cantar depende del mugor ambiental, considerase un higrómetru biolóxicu.
Adi ağacqurbağası (lat. Hyla arborea) - ağacqurbağası cinsinə aid heyvan növü.
Adi ağac qurbağasına Mərkəzi və Qərbi Avropanın böyük hissəsində (İspaniyanın cənubu və Fransanın cənub hissələri istisna olmaqla) rast gəlinir.
Adi ağacqurbağası (lat. Hyla arborea) - ağacqurbağası cinsinə aid heyvan növü.
Ar glazig (Hyla arborea) a zo un divelfenneg bihan besk hag a vev en Europa.
La reineta arbòria o granoteta de Sant Antoni (Hyla arborea) és una espècie d'amfibi[1] que es troba a Europa des d'Ucraïna i Bielorússia fins a la península Ibèrica.[2]
Aquesta granoteta fa entre 4 o 5 cm de longitud sense considerar les potes[2], verd brillant amb una marca fosca al costat dels ulls que va des de les potes anteriors fins a les potes posteriors. Depenent del seu entorn són capaces de canviar el seu verd a blau, a groc i a vegades fins i tot les trobem amb punts negres. S'alimenta de petits insectes.[2] Té una gran facilitat a l'hora d'enfilar-se gràcies a unes ventoses col·locades a les puntes dels seus dits.
El període de reproducció comença a la primavera utilitzant basses[2] on hi abundi la vegetació.[cal citació] Els mascles atrauen a les femelles per la nit[2] inflant el seu sac vocal que arriba a ser més gran que el seu propi cap[cal citació] fent un soroll similar als dels ànecs.[2] La femella posarà al voltant de 1000 ous i el mascle els fecundarà externament.
La reineta arbòria o granoteta de Sant Antoni (Hyla arborea) és una espècie d'amfibi que es troba a Europa des d'Ucraïna i Bielorússia fins a la península Ibèrica.
Aquesta granoteta fa entre 4 o 5 cm de longitud sense considerar les potes, verd brillant amb una marca fosca al costat dels ulls que va des de les potes anteriors fins a les potes posteriors. Depenent del seu entorn són capaces de canviar el seu verd a blau, a groc i a vegades fins i tot les trobem amb punts negres. S'alimenta de petits insectes. Té una gran facilitat a l'hora d'enfilar-se gràcies a unes ventoses col·locades a les puntes dels seus dits.
Rosnička zelená (též rosnička stromová; Hyla arborea) je malá žába a jediný zástupce čeledi rosničkovitých (Hylidae) v Česku. Mimo Česka obývá téměř celé území Evropy: Ukrajinu, Bělorusko, Balkán, Krétu, Itálii, Benelux, Slovensko, Polsko, větší část Německa, většinu Francie a Nizozemska, severozápadní část Pyrenejského poloostrova. Chybí na Britských ostrovech, na většině území Skandinávie a Dánska, Alp a malé části severního Nizozemska a Německa. V Česku žije především v nížinách, maximálně do 750 m n. m.
K životu vyhledává vlhké listnaté lesy, kde vystupuje i do vyšších pater stromů.
Dorůstá délky 3–5 cm a výšky 3–4 cm, což ji činí jednou z nejmenších žab v Česku. Historicky proslula jako jakýsi barometr, jelikož reaguje na změnu tlaku, který kolísá obvykle před deštěm, a začne skřehotat. Charakteristické skřehotání však vydává i v období rozmnožování nebo těsně před ním. Zbarvení rosniček zelených je poněkud proměnlivé, jelikož kožní pigmenty reagují na teplotu a vlhkost, a tak se její zbarvení mění od světle zelené na tmavě zelenou, nažloutlou, šedou nebo dokonce až na nahnědlou. Zadní končetiny má znatelně silnější než přední, což umožňuje rychlé skákání. Na obou končetinách má přilnavé terčky určené pro šplhání a na poměrně kulaté hlavě a na bocích nápadný vodorovný černý proužek, který se táhne od nozder přes oko a ušní bubínek až k předním končetinám. Obě pohlaví jsou si na první pohled velice podobná, ale bezpečnou odlišností je samcův hnědožlutý vak na hrdle. Pulci jsou černohnědí, zlatavě tečkovaní, později zelenaví. Mají značně vysoký kožní lem, začínající už na hlavě a nápadně lesklé břicho.
Na rozdíl od mnoha druhů žab, které mají tak podobné skřehotání, že je nejde podle něj ani rozlišit, má rosnička zelená velice charakteristický skřek. Samec skřehotá pomocí hnědožlutého vaku na hrdle, který se skřehotáním nafukuje. Skřehotání rosničky zelené je nejvýraznější v období rozmnožování, ale hojně skřehotá i mimo toto období. Na svou drobnou velikost je jejich skřek až neuvěřitelně hlasitý a jde slyšet i na vzdálenost několika kilometrů, což z rosničky zelené činí nejhlasitější žábu Evropy. Charakteristické skřehotání, podle kterého se snadno určuje i jejich výskyt, je silně rytmické „kre-kre-kre-kre-kre...“ a podobá se „volání“ chřástala nejmenšího (Porzana pusilla) a chřástala malého (Porzana parva). Aktivní začíná být rosnička zelená zhruba od dubna a skřehotat začíná od pozdního odpoledne nebo za soumraku, občas skřehotá i přes noc.
Rosnička zelená se živí širokou škálou obvykle živočišné potravy. Pulci požírají vodní bezobratlé jako např. plankton, možný je i kanibalismus. Dospělci se živí převážně většími bezobratlými než pulci, obvykle pak hmyzem a pavouky, které nacházejí na listech stromů a které často loví pomocí rychlého skoku, na který kořist nestačí většinou nijak zareagovat.
Rosnička zelená dosahuje pohlavní dospělosti zhruba ve věku jednoho roku, pářit se začínají spolu s příchodem dubna a celého srpna, kdy své partnerky samci lákají výrazným skřehotáním a vrtivými pohyby. Páření začíná ihned po přilákání samice a jelikož bývá samec menší, lehá si na záda samice. Samice vajíčka kladou obvykle dvakrát do roka.
Samice vajíčka klade většinou během května, nejdříve, ale to je velice výjimečné, na konci března. Vajíčka jsou spojena v chumáče, které jsou velké zhruba jako vlašské ořechy a nakladeny v mělkých místech porostlých vodními rostlinami. V jednom chomáči je obvykle 10 až 50 vajíček. Vrchol každého vajíčka, které dosahuje zhruba 1,5–2 mm, je hnědý, dolní část pak žlutavě bílá. Po nakladení se vajíčka seřadí do skupinových řad, přičemž se část snůšky dostane do řady spodní.
Doba, po kterou se vajíčka vyvíjejí, závisí na převažujících vodních teplotách. Nicméně vajíčka umístěná v druhé, spodní řadě se vyvíjejí podstatně pomaleji než vajíčka umístěná těsně pod hladinou, kde jsou vystavena přímému slunečnímu svitu.
Rosnička zelená je v České republice vyhodnocena jako silně ohrožený druh a je zákonem přísně chráněná. Nejvíce ji ohrožuje rušení vodních nádrží, ve kterých se množí, a regulace toků spojená s likvidací přilehlých zarostlých mokřin a tůni, obecně tedy ničení přirozeného biotopu. Mezi hlavní hrozby patří i rybníkářství, tj. intenzivní hnojení rybníků, kvůli kterému dochází k takovému nahromadění organických látek, že zabíjí mladé pulce, čímž hynou celé vzácné populace.
Pro záchranu tohoto druhu bývají rosničky zelené přemísťovány do vhodnějšího prostředí, nebo bývají tvořeny umělé nádrže s přirozenou pobřežní vegetací.
V tomto článku byl použit překlad textu z článku European tree frog na anglické Wikipedii.
Rosnička zelená (též rosnička stromová; Hyla arborea) je malá žába a jediný zástupce čeledi rosničkovitých (Hylidae) v Česku. Mimo Česka obývá téměř celé území Evropy: Ukrajinu, Bělorusko, Balkán, Krétu, Itálii, Benelux, Slovensko, Polsko, větší část Německa, většinu Francie a Nizozemska, severozápadní část Pyrenejského poloostrova. Chybí na Britských ostrovech, na většině území Skandinávie a Dánska, Alp a malé části severního Nizozemska a Německa. V Česku žije především v nížinách, maximálně do 750 m n. m.
K životu vyhledává vlhké listnaté lesy, kde vystupuje i do vyšších pater stromů.
Er der problemer med lyden? Se da eventuelt Hjælp:Ogg Vorbis eller "Media help" (engelsk)
Løvfrøen (Hyla arborea) er en lille springpadde der findes i Europa, Asien og en del af Afrika.[3] Den lever det meste af sit liv klatrende rundt på grene og blade af buske og træer. I Danmark yngler den i små solbeskinnede vandhuller i Østjylland, på Als, Lolland, Sydbornholm og Sønderjylland.
Løvfrø er fredet ligesom alle andre danske padder.[4]
Løvfrøen kendes på at den er lille, klart grøn og klatrer i træer. En voksen Løvfrø bliver kun 4–5 cm lang. Den har små sugeskiver på fødderne.
Stemmen er en kraftig, skrattende lyd. I yngletiden lyder løvfrøernes kvækken fra vandhullerne efter solnedgang som et vedholdende, larmende kor. De kan også kvække i sensommeren, når de sidder i buske.
Løvfrøen (Hyla arborea) er en lille springpadde der findes i Europa, Asien og en del af Afrika. Den lever det meste af sit liv klatrende rundt på grene og blade af buske og træer. I Danmark yngler den i små solbeskinnede vandhuller i Østjylland, på Als, Lolland, Sydbornholm og Sønderjylland.
Løvfrø er fredet ligesom alle andre danske padder.
Der Europäische Laubfrosch (Hyla arborea) ist ein Froschlurch, der zur Familie der Laubfrösche im weiteren Sinne (Hylidae) und zur Gattung der Laubfrösche (Hyla) gehört. Er ist der einzige mitteleuropäische Vertreter einer nahezu weltweit (allerdings schwerpunktmäßig neuweltlich) verbreiteten Tierfamilie, die mit gut 700 Arten zu den formenreichsten innerhalb der Amphibien zählt. Für das Jahr 2008 wurde der Europäische Laubfrosch von der Deutschen Gesellschaft für Herpetologie und Terrarienkunde (DGHT) zum Lurch des Jahres gewählt.[1]
Die Kopf-Rumpf-Länge des Europäischen Laubfrosches beträgt 3 bis 4,5 Zentimeter, bei Weibchen auch bis 5 Zentimeter. Das Körpergewicht beim Männchen kann von 3,5 bis 7 Gramm variieren, beim weiblichen Frosch je nach Jahreszeit zwischen 6 und 9 Gramm. Der Kopf ist breiter als lang; die Kopfseiten fallen steil ab, die Schnauze ist entsprechend stumpfwinklig. Die stark hervortretenden Augen besitzen waagerecht-elliptische Pupillen, die bisweilen dunkel gesprenkelte Iris leuchtet goldgelb. In der Dunkelheit weiten sich die Pupillen derart, dass sie nahezu den gesamten sichtbaren Augapfel ausfüllen. Das Trommelfell ist deutlich erkennbar und etwa halb so groß wie das Auge. Ohrdrüsenwülste (Parotiden), wie beispielsweise bei der Erdkröte, fehlen. Die vorderen Gliedmaßen sind recht kurz und weisen je vier Finger mit Haftscheiben (s. u.) an den Enden auf, die Hinterfüße haben je fünf Zehen. Die Kehle der Männchen ist gelb bis gelbbraun gefärbt und faltig, jene der Weibchen weißlich bis hellgrau und leicht gekörnelt. Männchen besitzen eine große, gelb- oder bräunliche, kehlständige Schallblase.
Die Hautoberfläche ist glatt und kann – insbesondere beim Sonnenbaden – auffällig glänzen. Die Oberseite ist normalerweise leuchtend grün gefärbt. Der Bauch sowie die Innenflächen der Extremitäten sind vorwiegend weiß bis hellgrau und gekörnelt. Beiderseits an den Flanken zieht sich vom Nasenloch über das Trommelfell ein dunkler Streifen bis in die Leistenregion. Dort wölbt er sich nach oben und formt eine sogenannte Hüftschlinge. Speziell im Bereich dieser Hüftschlinge verläuft der Flankenstreifen bei jedem Individuum etwas anders. Die Hüftschlinge heißt auch Leistenspange, denn der schwarze Seitenstreifen endet in der Leistenregion und bildet keine Schlinge.[2] Die hellgrüne Hautfarbe entsteht durch Absorption langwelligen Lichts durch dunkle Hautpigmente, z. B. von Melanophoren (Melanocyten). Kurzwelliges Licht dagegen wird von gelben Hautpigmenten (Xanthophoren) als blaues Interferenzlicht reflektiert, das unter Mitwirkung von Lipophoren als kräftiges Grün in Erscheinung tritt. Das gelegentliche Auftreten blau gefärbter Laubfrösche beruht nachweislich auf einem Mangel an gelben Hautpigmenten und stellt damit eine Pigmentstörung in der Haut dar. Berichte über albinotische Exemplare von Hyla arborea sind äußerst selten und beziehen sich meist auf Kaulquappen oder auch auf frisch umgewandelte Juvenile. Ein solches, vollkommen gelb gefärbtes Jungtier wurde im Sommer 2007 in Holtum (Geest) im Landkreis Verden dokumentiert.[3]
Laubfrösche können in rascher Abfolge ein recht verschiedenfarbiges Aussehen annehmen. Die Variationsbreite reicht von hellgrau über gelblich bis dunkelgrün. Oft liest man in diesem Zusammenhang, dass der Frosch seine Hautfarbe der Farbe des Untergrundes anpasst, auf dem er sich gerade befindet. Dem widerspricht ein Experiment des Physiologen Biedermann, bei dem hellgrün gefärbte Hyliden nach operativer Entfernung der Augen keine dunkle Farbe angenommen haben. Vielmehr haben Tastreize, die von der Unterlage ausgehen, eine wesentliche Bedeutung auf die Hautfarbe des Tieres. Bringt man hellgrüne Laubfrösche in ein Behältnis, dessen Boden und Wände mit Filz oder mit Drahtgaze überzogen sind, werden die Tiere rasch dunkel. Auf glatten Strukturen, wie zum Beispiel Glas, bleiben sie dagegen hellgrün. Diese Reaktionen sind unabhängig von Farbe und Helligkeit. In der Natur bleibt ein Laubfrosch auf einem glatten Blatt grün, auf rauer Baumrinde wird er aber mitunter braun oder grau. Eine gewisse Rolle bei der Ausfärbung kommt der Umgebungstemperatur zu. So gilt grundsätzlich, dass mit höherer Außentemperatur die Haut umso heller erscheint.
Die Haut von Hyla arborea ist außerordentlich reich an Drüsen. Generell unterscheidet man bei adulten Amphibien zwischen zwei Arten von Hautdrüsen: Schleim- und Giftdrüsen. Ihre Anzahl variiert nach Art und Körperregion. Dabei spielt auch die Lebensweise sowie der momentane Aufenthaltsort (Wasser, Land) des Tieres eine Rolle. Schleimdrüsen liegen normalerweise über die gesamte Hautoberfläche in verschiedener Dichte verteilt. Die Sekretion erfolgt durch Kontraktion der an der Drüse ansetzenden Muskulatur und unterliegt einer nervösen Regulation. Je dichter die Schleimdrüsen beieinanderliegen, umso größer ist einerseits die Hautbefeuchtung und damit der Schutz vor Austrocknung. Andererseits steigt aber durch die Sekretion die innere, physiologische Austrocknung. Bei längerem Aufenthalt im Wasser dient der Schleim als Schutzschicht gegen das Eindringen von Flüssigkeit. Bei Hyla arborea, der sich als Gebüsch- und Baumbewohner in seiner Lebensweise von anderen Lurchen sehr unterscheidet, finden sich in Aufbau und Funktion der Drüsen anatomische Besonderheiten. Sie sind als Schutz gegen Austrocknung verschließbar. Jede Schleimdrüsenzelle verfügt über einen eigenen, speziellen Schließapparat, der die Sekretionsabläufe regulieren kann.
Bei Laubfröschen mit 4,5 cm Körperlänge ist das Gehirn 9–10 mm lang, gemessen vom Vorderrand der Lobi olfactorii bis zum Hinterende der Nerven der Vagus-Gruppe. Die größte Breite ist im Bereich der Lobi optici und beträgt zirka 4 mm. Damit ist das Gehirn fast ebenso groß wie bei einem Teichfrosch mit 6,8 cm Körperlänge.[4]
Der obere Teil besteht aus den drei Bogengängen mit je einer Ampulle, daran schließen der Utriculus und der große Sacculus an, der drei verhältnismäßig kleine, mit Sinneszellen ausgestattete Ausbuchtungen aufweist: Papilla amphibiorum, Papilla basilaris und Lagena. Die beiden Papillen perzipieren Schall. Die Papilla amphibiorum ist bei männlichen Laubfröschen im Mittel mit 70,5 Sinneszellen ausgestattet, bei weiblichen mit 77,8 Sinneszellen. Sie reagiert auf Schallwellen bis zirka 1000 Hz. Die Papilla basilaris enthält bei männlichen Laubfröschen zirka 11,2, bei weiblichen 16,3 Sinneszellen und reagiert auf Schallwellen über 1000 Hz. Der Hörbereich erstreckt sich bei 20 °C von 100 Hz bis 6500 Hz. Am niedrigsten ist die Hörschwelle bei zirka 3000 Hz, ab 4000 Hz steigt die Schwelle steil an. Fällt die Temperatur unter 20 °C, nimmt die Hörempfindlichkeit ab, steigt sie darüber bis 28 °C an, ergibt sich keine Verbesserung.[5][6]
Laubfrösche verfügen über ein hervorragendes Haft- und Klettervermögen. Zwar sind auch andere Amphibienarten in der Lage, an glatten Flächen, selbst an Glasscheiben, ein Stück emporzuklettern – sie heften sich dabei mittels Adhäsionskräften der feuchten Bauchhaut sowie der Gliedmaßen-Unterseiten an der jeweiligen Oberfläche an. Laubfrösche besitzen als Anpassung an die kletternde Lebensweise jedoch zusätzlich an den Finger- und Zehenspitzen rundliche Haftballen, die mit bloßem Auge gut zu sehen sind. Beim Klettern an glatten Oberflächen wird das flexible Endglied der Finger auf die Unterlage gepresst und durch leichtes, rückwärts gerichtetes Ziehen fixiert. Gleichzeitig erfolgt ein Ausstoß von Gewebsflüssigkeit, die bei der weiteren Fortbewegung des Frosches als winzige, klebrige Fußspur auf der Unterlage zurückbleibt. Unter dem Rasterelektronenmikroskop (REM) erweisen sich die Oberflächen der Haftscheiben als komplexer Zusammenschluss zahlreicher kleiner Untereinheiten, die vom optischen Eindruck an ein bienenwabenartiges Muster erinnern. Bei höherer Vergrößerung ist zu erkennen, dass sich diese Feinstrukturen aus kleinen, pentagonalen, teilweise hexagonalen Säulen aufbauen. Vermutlich aus Gründen der Stabilität zeigen sie eine unregelmäßige, versetzte Anordnung. Das komplexe Zusammenspiel dieser Substrukturen ermöglicht es den Laubfröschen, selbst an spiegelglatten Flächen mühelos emporzuklettern.
1960 waren u. a. Mertens und Wermuth[7] der Auffassung, dass es in Europa nur eine Laubfroschart, Hyla arborea, mit sechs Unterarten gebe: H. a. arborea, H. a. kretensis, H. a. meridionalis, H. a. molleri, H. a. sarda und H. a. schelkownikowi. Hyla intermedia galt als Synonym von H. arborea. Weitere Unterarten waren H. a. savignyi im Mittleren Osten und H. a. japonica in Japan. Die wenig differenzierte Einteilung gründete sich auf morphologische Merkmale, die bei den Laubfröschen geringe Unterschiede aufweisen.
Diese systematische Gliederung erfuhr in der Folge durchgreifende Veränderungen. Sie ergaben sich durch den Vergleich der Anzeigerufe, die spezifische Artmerkmale darstellen, und in der jüngsten Zeit durch Analysen der mitochondrialen DNS (mtDNA) und der Kern-DNS (nDNA).[8][9]
Aufgrund der Unterschiede bei den Anzeigerufen erhielten der Mittelmeer-Laubfrosch, H. meridionalis,[10] der Mittelöstliche Laubfrosch, H. savignyi,[11] und der Tyrrhenische Laubfrosch, H. sarda,[12] den Status von eigenständigen Arten. Bei den Unterarten H. a. kretensis, H. a. molleri und H. a. schelkownikowi wie auch bei H. intermedia ergaben sich dagegen keine gesicherten Unterschiede im Vergleich zum Anzeigeruf von H. arborea.[13]
Analysen der mitochondrialen DNS (mtDNA) und der Kern-DNS (nDNA) bestätigten den Artstatus von H. meridionalis und H. savignyi. Gleichzeitig enthüllten diese Untersuchungen bislang übersehene, noch unbenannte Arten wie H. felixarabica aus Süd-Arabien.[14] Die Laubfrösche in Süditalien und auf Sizilien gelten mittlerweile als eigene Art, H. intermedia. Eine nah verwandte, noch unbenannte Art wurde in der Süd-Schweiz nachgewiesen. Auch H. molleri erhielt Artstatus; ihre Verbreitung umfasst einen großen Teil der Iberischen Halbinsel. Außerdem wurde H. orientalis, die über ein großes Areal in Teilen der Ukraine, von Bulgarien, Russland, Nord-Armenien und einen kleinen Teil des Irans sowie im europäischen Teil der Türkei und in fast ganz Anatolien verbreitet ist, von H. arborea abgegrenzt.[15]
Die Anzeigerufe der Laubfrösche in der westlichen Türkei[16][17] und in Nord-Armenien, die jetzt H. orientalis zugeordnet werden, weisen nahezu identische Merkmale auf wie die von H. arborea in Südwest-Deutschland[18]. Dasselbe gilt auch für H. molleri und H. arborea, ferner für H. intermedia und H. arborea. Dass zwei Arten identische Anzeigerufe haben, ist nicht ungewöhnlich, solange sie nicht sympatrisch vorkommen und so eine Möglichkeit der Verwechslung bei der Partnerfindung nicht vorliegt[19][20].
Die Anzeigerufe der Männchen werden mit „äpp ... äpp ... äpp...äpp“ umschrieben und bestehen aus gleichförmigen Impulsgruppen, die durch Intervalle deutlich voneinander abgesetzt sind (siehe Abbildung). Eine Serie solcher Impulsgruppen bildet einen Ruf. Die meisten Rufe sind aus 15 bis 30 Impulsgruppen aufgebaut, lange Rufe mit bis zu hundert oder sogar mehr Impulsgruppen geben die Laubfrösche während der Hauptlaichzeit ab. Die Impulsgruppen beginnen stets mit einem sehr leisen Impuls, zumeist bauen neun Impulse eine Gruppe auf, Abweichungen sind gering. Der Frequenzumfang reicht von 400 bis 6000 Hertz und weist zwei dominante Bereiche bei 400 bis 1200 und von 1600 bis 2400 Hertz auf.[21] In 50 Zentimetern Entfernung von einem rufenden Männchen wurden Lautstärken bis zu 87 dB gemessen.
Die untere Rufschwelle liegt bei 8 °C Lufttemperatur, die obere bei 20 bis 22 °C. Die beiden Rufmerkmale Dauer der Impulsgruppen und Intervall sind mit der Lufttemperatur korreliert, sie nehmen bei steigender Temperatur ab. Bei 8 °C Lufttemperatur dauern die Impulsgruppen im Mittel 100 Millisekunden, bei 20 °C 65,7 Millisekunden. Die Intervalle messen bei 8 °C im Mittel 180 Millisekunden, bei 20 °C nur noch 82 Millisekunden. Bei dem Temperaturanstieg von 12 °C von der unteren zur oberen Rufschwelle verkürzen sich die Impulsgruppen demnach etwa um ein Drittel, die Intervalle um mehr als die Hälfte. Die Anzahl der Impulse pro Gruppe ändert sich nicht.[21] Die Veränderungen der Rufe unter dem Einfluss der Temperatur sind beim Hören mühelos feststellbar.[22]
Rufende Männchen sitzen meist am Ufer im flachen Wasser, sodass die Hinterbeine vom Wasser bedeckt sind. Andere Männchen haben Rufplätze auf Pflanzen oder Ästen gewählt oder sie liegen im Wasser und halten sich mit den Vorderbeinen an Pflanzen fest. Selten treiben sie frei auf der Wasseroberfläche. An Regentagen sitzen rufende Männchen auch ein bis zwei Meter vom Ufer entfernt auf dem nassen Untergrund. Häufig vollführen zwei Männchen über Minuten Wechselrufen. Dabei setzen die beiden Männchen ihre Impulsgruppen exakt in die Intervalle des Partners. Meist üben unmittelbar benachbarte Männchen Wechselrufen aus, bei geringer Rufaktivität können sie auch zehn Meter oder mehr voneinander entfernt sein.[21]
Ein weiterer kennzeichnender Ruftyp ist der Revierruf. Haben Laubfrosch-Männchen am Abend ihre Rufplätze gewählt, zeigen sie gegenüber anderen anwandernden Männchen territoriales Verhalten. Sobald diese zu rufen beginnen und weniger als 30 Zentimeter vom Platzhalter entfernt sind, gibt dieser Revierrufe ab, die knurrend klingen. Unter dem Einfluss der Revierrufe nehmen die Laubfrösche, meist sind es die Ankömmlinge, einen größeren Abstand ein. Nach bisherigen Ergebnissen bestimmen die Männchen anhand der Lautstärke der Rufe den Abstand voneinander.[21]
In Südwestdeutschland im Bereich des Neckartals beginnt die Rufaktivität der männlichen Laubfrösche in den ersten Maitagen und endet etwa Mitte Juli. Der Tagesgang der Rufaktivität wird von der Lufttemperatur und der Helligkeit bestimmt.[23]
Die Männchen beginnen zu rufen, wenn am Abend die Helligkeit auf mindestens 260 Lux zurückgegangen ist. Das ist Anfang Mai gegen 19:45 Uhr der Fall. Chorrufen, bei dem erstmals zehn Männchen gleichzeitig rufen, setzt bei weniger als 60 Lux ein. Das entspricht einer fortgeschrittenen Abenddämmerung. Mit zunehmender Tageslänge verlagert sich der Beginn des Rufens kontinuierlich auf einen späteren Zeitpunkt und liegt Mitte Juni bei 21 Uhr. Nimmt danach die Tageslänge wieder ab, folgen die Laubfrösche nicht, sondern beenden etwa Mitte Juli das Rufen der aktuellen Saison. Im Verlauf der mehr als zwei Monate dauernden Rufperiode verschiebt sich der Beginn des Rufens somit um mehr als eine Stunde.[23]
Im Frühjahr liegt die Lufttemperatur am Abend noch wenig über der unteren Rufschwelle von 8 Grad und fällt verhältnismäßig schnell unter diese ab. An solchen Tagen ist die Rufphase der Männchen kurz. Ist an sehr kühlen Tagen die Lufttemperatur am Abend zur Zeit des üblichen Rufbeginns bereits unter die untere Rufschwelle abgesunken, rufen die Laubfrösche nicht. Mit fortschreitender Tageserwärmung in der folgenden Zeit und dem jetzt langsamen Absinken der Lufttemperatur bis unter die untere Rufschwelle dauern die täglichen Rufphasen bis zu zwei Stunden. Im Sommer, wenn die Lufttemperatur nicht mehr unter die untere Rufschwelle absinkt, beenden die Laubfrösche das Rufen gegen 24 Uhr und wandern wieder ab. Während der Hauptfortpflanzungszeit rufen vereinzelt Männchen die ganze Nacht.[21]
Die Laubfroschweibchen sind überwiegend stumm oder nur zu unbedeutenden Lautäußerungen fähig (leises Quietschen).
Im Spätsommer und im Herbst – bis zum Beginn der Winterruhe etwa Mitte/Ende Oktober – sind sogenannte Herbstrufe zu hören. Diese werden, anders als die Balzrufe, an sonnigen Tagen („Altweibersommer“!) aus Hecken und Gebüschen heraus geäußert und klingen eher „krächzend“ oder „knarzend“. Bei entsprechender Bestandsdichte können sich auch kurzzeitige Konzerte mehrerer Männchen ergeben. Der Sinn dieser Lautäußerungen ist unbekannt.
Die nächtlichen Rufe im Frühling sind hingegen in ihrer Funktion klar zu deuten: Es sollen Weibchen angelockt werden, die aus den Winterquartieren zum Laichgewässer wandern. Nähert sich ein Weibchen einem balzenden Männchen (wobei die stimmgewaltigsten Exemplare von den Weibchen wohl bevorzugt werden), unterbricht dieses sein Gequake und versucht sogleich, den Rücken des Weibchens zu ersteigen und dieses in der Achselgegend zu umklammern (Amplexus). Dort verbleibt es, bis es Stunden oder manchmal auch erst Tage später zum Ablaichvorgang kommt. Dabei besamt das Männchen den gerade aus der Kloake des Weibchens austretenden Laich.
Rufende Männchen haben eine kennzeichnende Haltung. Die Vorderbeine sind gestreckt, sodass der Körper aufgerichtet ist. Der Körper und die einzelne kehlständige Schallblase sind aufgebläht, da die Männchen zum Rufen viel Luft in die Lungen und die Schallblase aufgenommen haben. Beim Rufen wird Luft im Rhythmus der Impulsgruppen zwischen Lungen und Schallblase bewegt, dabei bildet der Luftstrom aus den Lungen in die Schallblase den Schall. Während der Rufperiode ist bei den Männchen die Haut der Kehle gelb gefärbt, während sie bei den Weibchen weiß ist.[21]
Für die Stimmbildung ist der Kehlkopf mit den Stimmbändern wichtig. Er schließt direkt an die Mundhöhle an, auf ihn folgen unmittelbar die Lungen, da keine Luftröhre vorhanden ist. Der Kehlkopf besteht aus einem Knorpelring und zwei beweglichen Knorpelplatten, die den Eingang verschließen. Im rückwärtigen Teil ist ein Paar Stimmbänder in Form von straffen Ligamenten ausgebildet. Vier Paar Muskeln am Kehlkopf öffnen oder schließen seinen Eingang oder spannen und entspannen die Stimmbänder. Bei den Männchen ist der Kehlkopf größer als bei den Weibchen. Bei einem 48 mm großen Männchen hat der Kehlkopf eine Länge von 9,5 Millimeter, bei einem ebenso großen Weibchen von 3,1 Millimeter. Am Kehlkopf der Weibchen sind Stimmbänder zwar vorhanden, es sind jedoch Wülste aus weichem Gewebe.[24]
Die Feinstruktur der vier Kehlkopfmuskeln der Männchen ist identisch. Alle Merkmale weisen sie als schnelle Muskeln aus: Die Muskelfasern und Myofibrillen sind dünn, der Gehalt an Lipoiden und Glykogen ist hoch, und die Anzahl der motorischen Endplatten und der Mitochondrien ist groß. Bei den Weibchen sind die Kehlkopfmuskeln dagegen schwach ausgebildet. Sie haben auch übereinstimmende Feinstruktur, doch fehlen ihnen die Merkmale schneller Muskeln.[25][26]
Die unterschiedliche Struktur spiegelt sich in der Leistung wider, für die die Fusionsfrequenz ein Maß ist. Bei elektrischer Reizung eines Muskels ist die Fusionsfrequenz erreicht, wenn der Muskel in eine Dauerkontraktion (Tetanus) übergeht. Je höher die Fusionsfrequenz ist, desto schneller arbeitet der Muskel. Die Fusionsfrequenz nimmt bei steigender Temperatur zu. Bei den männlichen Laubfröschen haben alle vier Kehlkopfmuskeln identische Fusionsfrequenzen. Bei 10 Grad Celsius beträgt sie im Mittel 73 Hertz (= Reize pro Sekunde) und erhöht sich auf 206 Hertz bei 22 Grad. Bei den Weibchen sind die Fusionsfrequenzen der vier Kehlkopfmuskeln ebenfalls gleich, sie sind jedoch merklich niedriger als bei den Männchen. Bei 10 Grad beträgt sie im Mittel 31, bei 22 Grad 96 Hertz.[27]
Im unteren Temperaturbereich von 5 bis 8 °Celsius liegt die Schlagfrequenz des Herzens zwischen 10 und 20 Schlägen pro Minute und nimmt bei steigender Temperatur stark zu. Bei 10 °Celsius beträgt die Schlagfrequenz im Mittel 22 Schläge pro Minute und erhöht sich auf im Mittel 69 Schläge pro Minute bei 21 °Celsius. Der Anstieg in diesem Temperaturbereich folgt einer Gleichung ersten Grades. Die weitere Erhöhung der Temperatur führt zunächst zu einer Verlangsamung, danach zu plötzlichen, starken Änderungen der Schlagfrequenz und schließlich zur Wärmelähmung des Herzens.
Am offenen Herzen wurde das Elektrokardiogramm (EKG) registriert. Unter Verwendung der beim Elektrokardiogramm des Menschen üblichen Bezeichnungen sind beim Elektrokardiogramm des Laubfrosches und anderer Froschlurche die Zacken P, R, S und T ausgebildet, während die Q-Zacke fehlt. Beim Anstieg der Temperatur verkürzen sich alle Anteile des Elektrokardiogramms, die Zacken erheblich weniger als die zeitlichen Anteile zwischen ihnen.[28]
Die Eiablage findet überwiegend im April und Mai statt, früheste Beobachtungen von Laich stammen von Ende März, späteste von Juni.[29] Die oft etwas unförmigen Laichballen, die im Wasser etwa bis zu Walnussgröße aufquellen können, werden an seichten Stellen an die Gewässervegetation wie etwa untergetauchte Halme geheftet. Die Eizahl je Ballen beträgt zwischen 30 und 80, selten auch bis zu 100. Dafür kann ein Weibchen aber mehrere Dutzend davon in einer Nacht absetzen, so dass innerhalb eines Frühjahrs insgesamt zwischen 150 und 1100 je Weibchen abgelegt werden können. Die Eier sind oberseits gelblich bis hellbraun, unterseits cremeweiß gefärbt. Der Eidurchmesser beträgt 1,5 bis 2 Millimeter, die umgebenden Gallerthüllen messen drei bis vier Millimeter.
Nach der Eiablage richten sich die Eier im Laichballen so aus, dass der gelblich-bräunlich pigmentierte animale Pol nach oben und der weißliche, unpigmentierte vegetative Pol nach unten zeigt. Die Entwicklungsdauer der Gelege variiert nach den vorherrschenden Umgebungs- und Wassertemperaturen. In Laichballen, die zum Boden des Gewässers absinken, entwickeln sich die Embryonen deutlich langsamer als in Gelegen, die unter der Wasseroberfläche direkt dem Sonnenlicht ausgesetzt sind.
Geschlüpfte Larven sind zunächst etwa drei bis fünf Millimeter lang und von hellgelber Färbung, die mit zunehmendem Alter in ein goldüberlaufenes Olivgrün wechselt. Für die Larvalentwicklung bis zur Metamorphose benötigen sie je nach Wassertemperatur und Ernährungszustand zwischen 50 und 80 Tagen. Kurz vor der Umwandlung sind die Kaulquappen zwischen 35 und 50 Millimetern groß. Sie besitzen einen lang auslaufenden, kräftigen Ruderschwanz mit auffällig breiten Flossensäumen. Der obere Saum reicht bis zwischen die Augen – ein wichtiges Bestimmungsmerkmal für Feldherpetologen. Die Augen liegen in der Draufsicht in weitem Abstand zueinander an den Kopfseiten. Laubfroschkaulquappen sind hervorragende Schwimmer, die sich blitzschnell feindlichen Zugriffen entziehen können. Ihre Hautoberfläche schimmert im Sonnenlicht gold-grünlich. Die Atemöffnung ihrer inneren Kiemen (Spiraculum) befindet sich an der linken Körperflanke. Die Oberlippe trägt zwei Zahnreihen, die Unterlippe drei.
Die Haftscheiben werden schon im letzten Stadium der Larvalphase voll funktionsfähig ausgebildet. Der Übergang zum Landleben erfolgt in Mitteleuropa überwiegend in den Monaten Juli und August. Bei günstigen Witterungsverhältnissen können bereits Mitte Juni die ersten frisch metamorphosierten Jungtiere an Land angetroffen werden. Sind die Sommermonate überwiegend kühl und verregnet, kann es auch vorkommen, dass die Laubfroschlarven ihre Entwicklung im Oktober noch nicht vollzogen haben. Solche Exemplare haben dann kaum eine Überlebenschance, da die Überwinterung der Larven bei dieser Amphibienart in der Regel nicht erfolgreich ist, auch, weil die Tiere gegenüber niedrigen Temperaturen besonders empfindlich reagieren.
Während der Keimentwicklung im Ei, aber auch noch im Anheftstadium nach dem Schlupf ernähren sich die Larven durch den im Körper deponierten Dottervorrat. Sobald die Kaulquappen frei schwimmen, beginnen sie mit der aktiven Nahrungssuche. Im Allgemeinen fressen sie unselektiv organisches Material, das ihnen vor die Raspelzähnchen und Hornkiefer kommt. Überwiegend sind dies mikroskopisch kleine Algen (Grünalgen, Diatomeen) sowie Einzeller und Detritus aus ihrer direkten Umgebung. Dabei werden Pflanzen, Steine und andere Oberflächen nach solchen Nahrungspartikeln abgeweidet. Ältere Larven knabbern auch an Tierkadavern, wie zum Beispiel toten Fischen und Lurchen sowie ertrunkenen Mollusken und Landinsekten. Beim Auffinden solcher Nahrungsquellen werden die Kaulquappen offensichtlich durch Geruchs- bzw. Geschmacksstoffe geleitet. Wie viele Amphibienarten stellt auch der Laubfrosch nach der Metamorphose seine Ernährung völlig um.
Heranwachsende wie adulte Laubfrösche begeben sich normalerweise mit Einbruch der Dämmerung auf Nahrungssuche. Beutetiere finden sich überwiegend am Boden oder in dessen Nähe – es werden aber auch Flug- und Laufinsekten auf den erhöhten Tagessitzwarten nicht verschmäht. Der entscheidende optische Fangreiz entsteht durch die Bewegung des Opfers; regungslose Kleinorganismen werden nicht wahrgenommen. Bei der Überwältigung der Nahrungstiere spielt die klebrige Zunge eine wichtige Rolle. Diese ist am vorderen Mundboden verwachsen und komprimiert. Ist das Opfer in Reichweite, schnellt die Zunge hervor und befördert es ins Maul. Oft bewegt der Frosch dabei gleichzeitig seinen Körper in Richtung Beute oder springt diese regelrecht an. Überhaupt nutzt der Lurch sein reichhaltiges Repertoire an Bewegungsfähigkeit. Rasches, teilweise weites Hüpfen kommt ebenso wie behändes Rennen sowohl in der Horizontalen als auch in der Vertikalen zum Einsatz. Klettern und Hangeln – auch kopfüber – sind für Hyla arborea normale Bewegungsabläufe. Mangels Zähnen wird das Nahrungstier im Ganzen hinuntergeschluckt; bei größeren Brocken unterstützt das Einziehen der Augäpfel die Arbeit der Schlundmuskulatur.
Die nächtliche Aktivitätsdauer wird stark von den jeweiligen Umgebungsfaktoren wie Temperatur und Feuchte bestimmt. Gefressen werden Insekten nahezu aller vorhandenen Arten, daneben Spinnen und, in Ausnahmefällen, auch kleine Nacktschnecken. Genaue Nahrungsuntersuchungen liegen von U. Tester (1990) und H.-J. Clausnitzer (1986) vor. Demnach besteht der Hauptanteil der Nahrung aus Käfern (Coleoptera, 34,2 %) und Zweiflüglern (Diptera) wie beispielsweise Fliegen und Mücken (47,2 %); Spinnen (Araneae, 4,3 %), Ameisen (Formicidae, 1,6 %), Schmetterlinge (Lepidoptera, 1,1 %) und Zikaden (Cicadina, 1,1 %) machten bei diesen Untersuchungen nur geringe Anteile aus.
Durch die Abgrenzung des Östlichen Laubfrosches als eigenständige Art, Hyla orientalis, erfuhr das Areal von H. arborea eine beträchtliche Reduktion. Es umfasst West- und Mitteleuropa, Südschweden, erstreckt sich im Osten bis in das zentrale Polen, schließt den westlichen Teil der Ukraine ein, ferner den westlichen Balkan, Griechenland und Kreta. Auf den Britischen Inseln und in den baltischen Republiken fehlt die Art.
Deutschland
Die Nominatform des Europäischen Laubfrosches kommt (bzw. kam) in allen Bundesländern vor und besiedelt bevorzugt flache bis wellig geformte Bereiche der Tiefebene und des Hügellandes (planar-colline Höhenstufe). Für die wärmeliebende Amphibienart stellt diese Höhenstufe offensichtlich eine klimatisch bedingte Limitierung dar. Auch in den eher sommerkühlen Landschaften nahe der Nordsee (Ostfriesland, Emsland, Unterelbe) bestehen wohl natürliche Vorkommenslücken. In den meisten westlichen Bundesländern ist die Verbreitung aber vor allem aufgrund starker Bestandsrückgänge diskontinuierlich und verinselt, in den östlichen Bundesländern dagegen teilweise noch deutlich stetiger. Nennenswerte aktuelle Verbreitungsschwerpunkte des Laubfrosches befinden sich unter anderem in Teilen Mecklenburg-Vorpommerns, in der Mittelelbe-Niederung Sachsen-Anhalts und Niedersachsens sowie im Bereich des Leipziger Tieflandbeckens. Nach gezielten Artenschutzmaßnahmen durch Gewässerneuanlagen und Biotoppflege konnten sich in einigen Regionen, beispielsweise im westfälischen Münsterland, vormals stark reduzierte Bestände in letzter Zeit wieder etwas erholen. In Hessen werden vierzig Standorte verzeichnet, mit den Schwerpunkten Kreis Darmstadt-Dieburg, wo Experten 1200 Männchen gezählt haben, Bingenheimer Ried in der Wetterau[30] und im Werra-Meißner-Kreis.[31]
Schweiz und Österreich
In der Schweiz war die Art einst weit verbreitet, vor allem in tieferen Lagen. Der Rückgang dieser Art verlief hier noch rascher als in Deutschland. Die Laubfrösche in Tessin gehören zur erst 2018 abgetrennten Art Hyla perrini und wurden früher als Italienischer Laubfrosch eingestuft.[32]
In Österreich sind die aktuellen Bestände schwer einschätzbar; ein wichtiges Verbreitungszentrum ist die Gegend um den Neusiedler See.
Je nach saisonaler Aktivität beanspruchen Laubfrösche sehr unterschiedliche aquatische und terrestrische Teillebensräume. Für einen erfolgreichen und nachhaltig gesicherten Lebenszyklus sind die folgenden Biotoptypen und Strukturen relevant:
Als Sitzwarten werden von erwachsenen und heranwachsenden Tieren neben Sträuchern und sogar Baumkronen vor allem verschiedene krautige Pflanzenarten gewählt. In der Literatur werden oft Brombeergebüsche erwähnt; nach eigenen Beobachtungen werden außerdem die großen Blätter von Kletten (Arctium spec.) besonders gern zum Sonnenbaden genutzt. Offen ist bei dem Beispiel allerdings, ob diese Strukturen von den Fröschen gezielt bevorzugt werden oder man sie auf den großen Blattoberflächen nur einfacher entdeckt.
Begleitarten von Laubfröschen im Laichhabitat sind je nach Naturraum und Region (hier bezogen auf Deutschland) mehr oder weniger regelmäßig: Grasfrosch, Moorfrosch, Knoblauchkröte, Erdkröte, Wechselkröte, Kreuzkröte, Teichfrosch, Kammmolch, Teichmolch sowie die – allerdings seltenen – Rotbauch- und Gelbbauchunken. In etwas höheren Lagen teilen sich Laubfrösche manchmal mit dem Bergmolch das Laichgewässer. Das syntope Vorkommen in einem Habitat ist dabei nicht etwa Ausdruck einer symbiotischen Wechselbeziehung, sondern resultiert aus gemeinsamen Ansprüchen an Lebensraumqualitäten (beispielsweise: stark besonnte, krautige Flachgewässer ohne Fische; s. u.). Die verschiedenen Amphibienarten koexistieren im Laichgewässer mehr oder weniger friedlich, können aber auch als Konkurrenten um Ressourcen und als gegenseitige Fressfeinde in Erscheinung treten. So erbeuten größere Froschlurche bei Gelegenheit kleinere Exemplare der eigenen oder anderer Arten und Molche gelten als Laich- und Larven-Räuber. Auch Kaulquappen der Knoblauchkröte wird gelegentlich nachgesagt, dass sie die kleineren Laubfroschlarven dezimierten.
Als wechselwarmes (poikilothermes) Tier benötigt der Laubfrosch grundsätzlich frostfreie, terrestrische Überwinterungsplätze wie Erdhöhlen, große Laubhaufen, Bodenlückensysteme im Wurzelbereich von Laubbäumen sowie Stein- und Bodenspalten. (Böden unter Nadelbäumen sind aufgrund ihres hohen Gehalts an sauren Huminstoffen für die Überwinterung eher ungeeignet.) Gelegentlich werden auch Wühlmausbauten und Maulwurfsgänge als Quartier genutzt. Das Aufsuchen der Winterquartiere ist von den jeweils herrschenden Witterungsverhältnissen abhängig. In Mitteleuropa begibt sich der Laubfrosch in der Regel im Laufe des Monats Oktober zur Winterruhe – in der Oberrheinebene geschieht dies etwa zeitgleich mit der Gelbbauchunke.
Laubfroschlarven erreichen nur in Gewässern mit relativ geringem Feinddruck und einem ausreichenden Wasserpflanzenangebot in nennenswerter Zahl die Metamorphose. Insbesondere Fische, auch sogenannte „Friedfische“ wie beispielsweise Karpfen, reduzieren Laich und Larven der Lurchbestände erheblich, sodass solche Gewässer in der Regel keine Reproduktionsgewässer in einer Metapopulation des Laubfroschs sind.
Auch räuberische Wasser- und Schwimmkäfer sowie deren Larven (z. B. Dytiscidae, darunter der „Gelbrandkäfer“), größere Wasserwanzen (z. B. Skorpionswanzen (Nepidae), Rückenschwimmer, Ruderwanzen) und die Larven von Großlibellen (Anisoptera) sind Fressfeinde (Prädatoren) von Laubfroschlarven. Die Larven der Blaugrünen Mosaikjungfer (Aeshna cyanea) schwimmen die Kaulquappen von unten her an, ergreifen sie mit ihrer Fangmaske an der Schwanzwurzel und fressen sie bis auf den spiraligen Darmtrakt auf.
Auch zahlreiche Vogelarten wie Graureiher, Weißstorch, Purpurreiher, Nachtreiher, Rallenreiher sowie verschiedene Rabenvögel sind als Prädatoren bekannt. Hin und wieder wurden Überreste von Laubfröschen in Gewöllen von Eulen nachgewiesen.
(Zu Amphibien als Fressfeinde siehe Absatz Vergesellschaftung.)
Laubfrösche beherbergen als Larven wie auch als erwachsene Tiere eine Vielzahl von Parasiten. So finden sich in Darm und Leber der Kaulquappen die Amöben Entamoeba ranarum und Entamoeba histolytica sowie das Wimpertierchen Opalina ranarum. Die pathogenen Wirkungsweisen von E. histolytica (Erreger der Amöbenruhr) sind im Gegensatz zum Menschen im Amphibienorganismus nahezu unschädlich. Die Infektion der Kaulquappen erfolgt über die Nahrungsaufnahme.
Äußere Organe wie Haut und Kiemen von Amphibienlarven werden unter anderem durch die Wimpertierchen Charchesium polypinum sowie Trichodina pediculus besiedelt. Eine hohe Befalldichte von Ch. polypinum kann zum Tode führen. Trichodina lebt auf der Haut von Kaulquappen und wandert gelegentlich auch in die Harnblase ihres Wirts ein. Beim gemeinsamen Auftreten von Fischen und Amphibienlarven ist hin und wieder die Karpfenlaus (Argulus foliaceus) als Hautparasit an Laubfroschlarven zu beobachten.
Nahezu alle Amphibien sind von parasitierenden Trematoden (Saugwürmer) befallen, deren adulte Stadien vielfach in Atmungs- und Exkretionsorganen sowie im Verdauungskanal leben (Endoparasiten). Saugwürmer besitzen hakenkranzförmige Bauchsaugnäpfe zur Anheftung, verursachen aber in ihrem natürlichen Wirt nur geringe Schäden. Zur ernsten Bedrohung werden sie entweder bei Massenbefall oder, wenn sie bei Tierarten auftreten, die normalerweise nicht als Wirt fungieren. Einer der häufigsten Amphibienparasiten unter den Trematoden ist Polystomum integerrimum, der auch in der Harnblase von Laubfröschen zu finden ist. Dieser Saugwurm hat seinen Lebenszyklus exakt mit dem Biorhythmus seines Wirts synchronisiert. So setzen die Parasiten ihre Fortpflanzungsstadien ebenfalls in dem Zeitraum ab, in dem auch die Wirtstiere die Eiablage vollziehen. Damit gelangen Parasitenlarven (Mirazidien) und Kaulquappen gemeinsam in dasselbe Gewässer. Die Mirazidien heften sich an die Kiemen der Kaulquappen und ernähren sich dort von Schleimpartikeln. Im Verlauf der Metamorphose, wenn die Kaulquappe zum Frosch wird und ihre Kiemen verliert, wandern die Trematodenlarven über den Nahrungskanal in das Urogenitalsystem ein und erreichen die Harnblase. Nach drei Jahren werden die Parasiten dort geschlechtsreif und der Zyklus kann erneut beginnen.
Im Bereich des Darms ist Acantocephalus ranae ein typischer Vertreter, der auch bei Laubfröschen häufiger auftreten kann. Für die Verbreitung und Vermehrung dieses Parasiten sind Zwischenwirte wie Wasserasseln, Flohkrebse und Ostrakoden ("Muschelkrebse") erforderlich. Kommt es zu einem Massenbefall, durchbrechen die Parasiten die Darmwand des Wirts und dringen vielfach in die Leibeshöhle ein. Acantocephalus ranae tritt bevorzugt bei gesundheitlich geschwächten Laubfröschen auf.
Mit der Trockenlegung von Niedermooren und Gewässern sowie der Begradigung der meisten Bäche und Flüsse begann bereits Anfang bis Mitte des 20. Jahrhunderts der flächenhafte Verlust an geeigneten Lebensräumen. Habitatfragmentierung durch immer mehr bauliche Maßnahmen (Straßen-, Siedlungsbau) sowie die intensivierte Landwirtschaft mit Begleiterscheinungen wie Flächenentwässerung, Tümpelverfüllung, Heckenrodung, riesigen Ackerschlägen, Pestizideinsatz etc. verstärkten den Bestandsrückgang des Laubfrosches in Mitteleuropa nach dem Zweiten Weltkrieg noch deutlich – bis heute dauert dieser Abwärtstrend in vielen Regionen an. Das Aussetzen von Fischen in Kleingewässern kann ebenfalls negative Folgen für den Amphibienbestand haben. Neben dem eigentlichen Lebensraumverlust sind Laubfrösche zusätzlich dadurch gefährdet, dass sie häufig zwischen den saisonalen Teillebensräumen wechseln. So fallen die Frösche bei ihren Wanderungen auch noch dem Straßenverkehr zum Opfer. Insbesondere Jungtierwanderungen erleiden dabei erhebliche Verluste.
Die Verinselung ehemals vernetzter Lebensräume ist für den relativ kurzlebigen Laubfrosch besonders fatal. Zum Verständnis dieses Zusammenhangs wird in der Tierökologie das sogenannte „Metapopulations-Modell“ angewandt. Die nebenstehende Grafik soll dies veranschaulichen: Die großen blauen Kreise stellen Optimalbiotope dar, die als Refugien und Ausbreitungszentren von individuenreichen „Überschusspopulationen“ fungieren. Durch Abwanderungen von dort werden suboptimale Nebenkolonien („N“) in deren Umfeld stabilisiert, so dass sich dort trotz individuell hoher Sterblichkeit kleinere Bestände halten können. Zusätzlich dienen „Trittsteinbiotope“ („TB“), die als Dauerlebensraum weniger geeignet sind, als biotopvernetzende temporäre Aufenthaltsorte für Individuen, die in der ansonsten intensiv bewirtschafteten Gegend umherwandern. Über Nebenkolonien und Trittsteinbiotope bestehen so zumindest mittelbar auch populationsökologische Wechselbeziehungen zwischen den Optimalbiotopen. Voraussetzung für das Funktionieren dieses Modells ist u. a. die „biologische Durchdringbarkeit“ der Landschaft: Amphibien„freundliche“ Linienstrukturen (Hecken etc.) spielen dabei eine wesentliche Rolle. Die Grafik verdeutlicht auch, dass der Wegfall bereits einzelner Neben- oder Trittsteinbiotope das Verbundnetz empfindlich beeinträchtigen oder unterbrechen kann. Wird sogar ein Optimalbiotop destabilisiert oder zerstört, ist davon das gesamte direkt verknüpfte Umfeld betroffen. Das Aussterberisiko erhöht sich auch hier wegen ausbleibender Zuwanderungen erheblich, obwohl es dort selbst keine qualitativen Veränderungen gegeben hat.
Als Sympathieträger in der Bevölkerung und im Naturschutz gleichermaßen erfüllt der Laubfrosch wichtige Kriterien einer „Leitart“, die stellvertretend für ganze Lebensgemeinschaften mit ähnlichen Ansprüchen gefördert wird. Vordringlich für den Schutz ist der Erhalt der bestehenden Fortpflanzungsgewässer. Laubfrösche können aber auch durch Neuanlage von Kleingewässern in der Feldflur sowie in Kies- und Tongruben unterstützt werden. Optimale Gewässer weisen süd- bis südwestexponierte Lagen auf, sollten also mindestens ab dem Spätnachmittag einer mehrstündigen Sonneneinstrahlung ausgesetzt sein. Dies begünstigt sowohl die Entwicklung der Larven als auch die wärmebedürftigen erwachsenen Tiere. Im nördlichen Randbereich des Laichplatzes empfiehlt sich eine Anpflanzung von Gebüschen wie Schlehe, Hasel oder Brombeeren. Sie dienen als Verstecke und zugleich als Schutz gegen kühle Nordwinde. Eine Bepflanzung mit Nadelgehölzen ist nicht ratsam, da diese in der Regel nicht naturraumtypisch ist und von den Fröschen gemieden wird.
Verallgemeinernd lässt sich sagen, dass mehrere nah beieinanderliegende kleinere Laichgewässer der Bestandsförderung dienlicher sind als ein einzelnes großes, womöglich ziemlich tiefes Gewässer. Um gute Laichbedingungen für kopfstarke Subpopulationen zu ermöglichen, sollten diese Gewässer aber doch jeweils eine Mindestgröße von 100 m² aufweisen und über ausgedehnte Flach- und Wechselwasserzonen verfügen. Hierbei bewährt sich die Anlage von Gewässern unterschiedlicher Wassertiefe (Differenzen zwischen 20 und 50 cm Wassertiefe), da hiermit sowohl eine Gewährleistung der Laichplatzeignung in Trockenperioden (schwankender Grundwasserstand) als auch die regelmäßige Fischfreiheit (Austrocknen/Durchfrieren) gesichert werden kann. Da sich die Tiere immer nur zeitweise in den Teillebensräumen aufhalten, ist für einen effektiven Laubfroschschutz ein lokal abgestimmtes Biotopmanagement erforderlich. Damit sind folgende landschaftspflegerische Maßnahmen verbunden:
Beispielsweise neigen ungenutzte Nasswiesen häufig zur Verschilfung, vor allem bei nährstoffreichen Bodenverhältnissen. Um einen zumindest teilweise offenen Grünlandcharakter zu erhalten oder wiederherzustellen, wird zunächst ein zweimaliger Schnitt des hohen Aufwuchses pro Jahr durchgeführt. Zum Schutz juveniler, frisch metamorphosierter Laubfrösche sollte der erste Mahdtermin allerdings nicht vor Juli vorgenommen werden. Der zweite Schnitt erfolgt im Oktober. Nach deutlicher Reduzierung der Dynamik des Schilf- und Hochstaudenwachstums kann in Folge auf die jährliche Mahd verzichtet werden. Ein Zyklus mit Intervallen von zwei bis drei Jahren ist dann meist ausreichend. Wo Landschilfbestände erhalten bleiben sollen, sind keine weiteren Pflegemaßnahmen erforderlich. Dies ist beispielsweise dort der Fall, wo Schilfgürtel als Pufferzone zwischen landwirtschaftlichen Nutzflächen und gefährdeten bzw. geschützten Gewässern fungieren.
Die als Beispiele genannten Pflegemaßnahmen sind aufwändig und je nach Flächengröße des zu schützenden Lebensraum auch maschinen- und kostenintensiv. Für gefährdete Vorkommen kann eine fortlaufende Betreuung und Dokumentation (Monitoring) des „Ist-Zustandes“ ein hilfreiches Mittel sein, das Erlöschen einer Population abzuwenden. Hier sind der behördliche und der ehrenamtliche Naturschutz (Verbände, Gruppen) gleichermaßen gefordert.
Leben Laubfrösche im Bereich von gesetzlich streng geschützten Flächen (Naturschutzgebiet, Naturdenkmal, Nationalpark-Kernzone, Biosphärenreservats-Kernzone, FFH-Gebiet), sind darüber hinaus detaillierte „Pflege- und Entwicklungspläne“ zu erarbeiten. Auf ausreichenden Schutz von Pufferzonen ist in diesen Bereichen besonders zu achten.
Ferner ist es von Bedeutung, dass im unmittelbaren Bereich von Laubfroschhabitaten keine chemischen Mittel (Dünger, Pestizide) zum Einsatz kommen. Befinden sich solche Flächen in Privateigentum, so ist die Bereitschaft der jeweiligen Nutzer am ehesten dadurch zu erreichen, dass finanzielle Entschädigungen für die Duldung von Pflegemaßnahmen angeboten werden (staatliche Extensivierungsprogramme, Landschaftspflegerichtlinie), Vertragsnaturschutz vereinbart wird oder ein Flächenankauf durch die öffentliche Hand bzw. Naturschutzverbände erfolgt.
Regional gibt es über die Schutzbemühungen vorhandener Vorkommen hinaus auch Versuche zur Wiederansiedlung von Laubfröschen in ehemaligen Verbreitungsgebieten. Voraussetzung für das Gelingen derartiger, nicht unproblematischer Maßnahmen ist aber immer das Bereitstellen geeigneter Habitatstrukturen (aquatisch wie terrestrisch) in entsprechender Dimension und guter räumlicher Vernetzung.
Gesetzlicher Schutzstatus (Auswahl)[33]
Rote Liste-Einstufungen (Auswahl)[34][35]
Bisherige wissenschaftliche Synonyme sind:
Im deutschsprachigen Raum wird der Laubfrosch unter anderem auch als „Heckenfrosch“, „Grünrock“ oder (inzwischen selten) als „Wetterfrosch“ bezeichnet.
Mit dem Europäischen Laubfrosch eng verwandt sind die folgenden Arten der Paläarktis:
Der in Italien (einschließlich Sizilien) und in der Schweiz (Tessin) vorkommende Italienische Laubfrosch (Hyla intermedia) wird erst seit kurzem als eigene Art geführt und ähnelt dem Europäischen Laubfrosch sehr. Auch der Portugiesische Laubfrosch (Hyla molleri) galt bisher als Unterrat bzw. Varietät von Hyla arborea, wird seit 2008 aufgrund von molekulargenetischen Untersuchungen von einigen Autoren aber als eigene Art postuliert.[8] Bei dem in Südfrankreich, Nordwestitalien, Spanien, Portugal und Nordwestafrika lebenden Mittelmeer-Laubfrosch (Hyla meridionalis) endet der dunkle Flankenstreifen direkt hinter dem Oberarmansatz. Der auf Korsika, Sardinien, Elba, Capraia und einigen weiteren Mittelmeerinseln vorkommende Tyrrhenische Laubfrosch (Hyla sarda) hat einen Seitenstreifen, der bis zur Rumpfmitte verläuft und sich danach in einzelne Streifen und Flecken auflöst. Zudem befinden sich auf Rücken und Gliedmaßen dunkelgrüne Flecken und die Haut ist weniger glatt. Seine Schnauze ist leicht verkürzt, wodurch der Kopf breiter wirkt.
Der Europäische Laubfrosch (Hyla arborea) ist ein Froschlurch, der zur Familie der Laubfrösche im weiteren Sinne (Hylidae) und zur Gattung der Laubfrösche (Hyla) gehört. Er ist der einzige mitteleuropäische Vertreter einer nahezu weltweit (allerdings schwerpunktmäßig neuweltlich) verbreiteten Tierfamilie, die mit gut 700 Arten zu den formenreichsten innerhalb der Amphibien zählt. Für das Jahr 2008 wurde der Europäische Laubfrosch von der Deutschen Gesellschaft für Herpetologie und Terrarienkunde (DGHT) zum Lurch des Jahres gewählt.
Den Europäeschen Heckefräsch (Hyla arborea), meeschtens einfach Heckefräsch genannt, ass e Fräsch aus der Famill vun den Heckefräschen am breede Sënn (Hylidae).
D'Heckefräschen heesche sou well se sech meeschtens op de Blieder an an den Äscht vun Hecken an aneren Traisch ronderëm hiert Gewässer ophalen.
De Kierper, ouni d'Patten, ass 3 bis 4,5 cm laang, bei de Weibercher bis zu 5 cm. D'Ae stinn däitlech aus dem Kapp eraus, d'Pupillen hunn eng horizontal-elliptesch Form. D'Iris ass goldgiel. Am Däischteren dilatéiere sech d'Pupille sou wäit, datt se de siichtbaren Deel vum A bal ganz fëllen. D'Trommelfell ass däitlech ze gesinn. Déi viischt Bee sinn opfälleg kuerz an d'Patten hu jee véier Fangeren. Déi hënnescht Patten hu jee fënnef Zéiwen. D'Fangeren an d'Zéiwen hunn Haftscheiwen. De viischten Deel vum Männche sengem Hals ass giel bis gielbrong gefierft an d'Haut huet, do wou d'Schallblos ass, opfälleg Falen; beim Weibchen ass déi Haut wäiss bis hellgro, ouni Falen, gesäit awer liicht käreg aus. Dës Kennzeechen erlaben et déi zwee Geschlechter liicht z'ënnerscheeden.
D'Haut um Réck vum Heckefräsch ass glat a meeschtens gréng gefierft. Um Bauch ass d'Haut wäiss bis hellgro a liicht käreg. Op béid Säite vum Kierper zitt sech eng däischter Sträif vun den Nueslächer iwwer d'Trommelfell bis op déi hënnescht Hëft.
D'Heckefräsche kënne relativ séier hir Kierperfaarf änneren, vun hell- bis däischtergréng a vun hellgro bis gielgréng, jee nodeem wou se sech ophalen.
Den Europäeschen Heckefräsch ass mat e puer Ënneraarten iwwer ganz Mëttel- a Südeuropa vu Portugal a Spuenien am Westen a Südschweden am Norden, bis a Griicheland an och d'Tierkei verbreet. Am Oste geet d'Verbreedungsgebitt bis a Russland, do ongeféier bis zum Floss Don. An der Schwäiz war d'Aart fréier heefeg ze fannen, ass awer haut do ausgestuerwen. Am Süde vu Portugal, Spuenien a Frankräich sinn d'Heckefräschen duerch eng aner Aart, de Mëttelmier-Heckefräsch (Hyla meridionalis) vertrueden. An Italien lieft eng separat, no verwandt Aart, den Italieeneschen Heckefräsch (Hyla intermedia).
D'Heckefräsche klotere flénk an der Vegetatioun erëm. Dat ass méiglech well se un den Extremitéite vun hire Fangeren an Zéiwen opfälleg Haftballen hunn. Beim Kloteren op glater Uewerfläch presse se hir Haftscheiwen op d'Ënnerlag a fixéiere se andeems se se liicht no hannen zéien. Dobäi scheeden d'Ballen eng Hautflëssegkeet aus, déi d'Festhalen erliichtert an duerno als Foussspur op der Ënnerlag ze gesinn ass. Mat Liichtegkeet kënnen d'Heckefräschen sou och op spigelglate Flächen eropklammen.
Soubal am Fréijoer d'Temperaturen nuets op wéinstens 12-14 °C klammen, fänken d'Männercher un ze ruffen. Hir Concerten dauere meeschtens vu Sonnenënnergank bis Mëtternuecht. Véier- bis sechsmol an der Sekonn widderhuele se hire charakteristesche Ruff - geck... geck... geck - dee bis op eng Distanz vun e puer Kilometer ze héieren ass. Hir Schallblos wierkt dobäi wéi e Resonanzverstäerker. Mat hirem Ruffe lackelen d'Männercher d'Weibercher un, déi aus hire Wanterquartéiere bei d'Läichgewässer zéien. Sou bal e Weibchen engem Männche méi no kënnt, klëmmt deen op säi Réck a gräift et hanner de viischte Patten. Am Moment wou d'Weibchen d'Eeër ausstéisst - bis dohi kënnen e puer Stonnen oder och Deeg vergoen -, stéisst de Männche seng Somflësseggkeet aus an d'Eezelle gi befrucht.
D'Eeër gi meeschtens vun Abrëll bis Mee ofgeluecht, dat a Form vu Kludderen, wouvu jiddwereng am Waasser bis zur Déckt vun enger Noss opquëllt. Eng Eeërkludder besteet meeschtens aus 30 bis 80, seele bis zu 100 Eeër. D'Eeër ginn, op Plaze wou d'Waasser net déif ass, un d'Planze gepecht. E Weibche ka bis zu e puer Dosen Eekludderen an enger Nuecht ofleeën, wat zesummen an engem Fréijoer tëscht 150 a 1100 Eeër ausmécht. Jiddwer Ee, mat engem Duerchmiesser vun 1,5 bis 2 mm, sëtzt an enger Enveloppe aus enger gellisaartegem Substanz.
Wann s'aus dem Ee erauskomme sinn d'Kauzekäpp ca. 3–5 mm laang. Fir hir Entwécklung bis zur Metamorphos brauche se jee no Temperatur vum Waasser an Ernierungszoustand 50 bis 80 Deeg a sinn dann tëscht 35 a 50 mm grouss. Si hunn a staarke Rudderschwanz mat opfälleg breede Flosseborden. Deen ieweschte Bord zitt sech no vir bis tëscht d'Aen - wat wichteg bei der Bestëmmung am Verglach mat de Kauzekäpp vun anere Fräschenaarten ass. A Mëtteleuropa verloossen déi jonk Heckefräschen d'Waasser meeschtens vu Juli bis August.
Am Ufank vum 20. Joerhonnert war den Heckefräsch verspreet iwwer ganz Lëtzebuerg ze fannen.[1] An den 1960er an 1970er Jore gouf d'Aart an 9 Rasterquadrate vu jee 4 km Säitelängt, dovu 6 am Guttland an 3 am Éislek nogewisen.[2]
No 1980 ass de Bestand vum Heckefräsch drastesch zréckgaangen. Mëtt der 1990er Jore gouf d'Aart nëmme méi op dräi Plazen, dovun zwou am Kanton Réiden an eng aner am Kanton Réimech fonnt.[3]
No 1994 huet den Naturschutzsyndikat SICONA am Guttland eng ganz Rëtsch nei Dëmpele geschaf a gläichzäiteg anerer fir d'Erhale vum Heckefräsch optimiséiert. D'Resultat dovu war, datt am Joer 2000 den Heckefräsch op 16 Plazen am Land konnt nogewise ginn.
Duerch natierlech Verännerungen, virun allem d'Zouwuesse vun den 'neien' Dëmpele mat Christusstaf, hu sech awer d'Liewensbedingunge fir den Heckefräsch nees verschlechtert, an 2009 gouf et nëmme méi eng eenzeg kleng Populatioun am Land.
Zanter 2011 goufen du vum SICONA-Westen, an Zesummenaarbecht mat der Naturverwaltung nei Initiative lancéiert fir den Heckefräsch z'erhalen: nei Weiere goufen ugeluecht, anerer fir den Heckefräsch optimiséiert an et goufen Heckefräsche gezillt an ausgesat (2012: 1100 an 2013 500 Déieren).[4]
Den Europäeschen Heckefräsch (Hyla arborea), meeschtens einfach Heckefräsch genannt, ass e Fräsch aus der Famill vun den Heckefräschen am breede Sënn (Hylidae).
D'Heckefräschen heesche sou well se sech meeschtens op de Blieder an an den Äscht vun Hecken an aneren Traisch ronderëm hiert Gewässer ophalen.
De Hasselpogg is en Pogg, de in Middeleuropa leevt.
De Hasselpoggen sünd so 3 bet 4,5 Zentimeter groot, dat Seken warrt woll ok bet 5 Zentimeter groot. Dat Seken bringt mit 6 bet 9 Gramm ok mehr op’e Waag as dat Heken mit 3,5 bet 7 Gramm. An’e Tehn hebbt de Poggen lütte Schieven, mit de se good an’n Ünnergrund anbackt un ok kleddern köönt. Dat geiht över Adhäsion. De Huut is glatt un op’n Rügg mehrsttiets gröön. De Buuk is mehr gries.
De Hasselpogg leevt in Europa vun Portugal bet Grekenland, vun Süüdsweden bet na’n Donstroom in Russland ran.
De Hasselpogg is en Pogg, de in Middeleuropa leevt.
Hyla arborea ye una especie d'anuro arbolicola y a especie més común d'a suya familia en Europa.
Vive en terrenos con augua permanent como basas, lacunas u partz lentas d'os ríos, on en as marguins abunda a vechetación. Hyla arborea ocupa preferiblement puestos on bi haiga árbols, maticals y atras vechetacions densas que li permitan de camuflar-se y estar a man de l'augua.
Present en as zonas mediterranias europeas. Amplament distribuita por Europa, dende Ucraína y Belarrusia, dica os Balcans, Creta, Italia, Benelux, Alemanya, asinas como gran part de Francia y Peninsula Iberica. En Aragon se troba en as sierras de Moncayo, de Cucalón, d'Albarrazín, o Galacho de Chuslibol y Sierra d'Alcubierre.
Ο Ευρωπαϊκός δεντροβάτραχος, Hyla arborea (Linnaeus, 1758) είναι ένα είδος μικρού βατράχου της οικογένειας Hylidae, που απαντάται στην Ευρώπη. Βάσει πρόσφατων γενετικών μελετών ένας αριθμός taxa, που προηγουμένως αποτελούσαν υποείδη του H. arborea, πλέον αναγνωρίζονται ως είδη[1][2][3].
Οι Ευρωπαϊκοί δεντροβάτραχοι είναι μικροί, με τα αρσενικά να κυμαίνονται μεταξύ 32-43mm και τα θηλυκά μεταξύ 40-50mm σε ολικό μήκος. Συνήθως είναι πράσινοι, αλλά μπορεί να έχουν και γκρι χρώμα, ανάλογα με τη θερμοκρασία, την υγρασία ή τη διάθεσή τους. Τα θηλυκά έχουν λευκό λαιμό, ενώ τα αρσενικά έχουν χρυσό-καφέ λαιμό, με διπλωμένους του φωνητικούς σάκους τους[4].
Απαντάται στην βορειοδυτική, κεντρική και νοτιοδυτική Ευρώπη[3]. Στην Ελλάδα απαντάται στην ηπειρωτική Ελλάδα, εκτός από το ανατολικό τμήμα της Θράκης, όπου αντικαθίσταται από τον Ασιατικό δεντροβάτραχο. Επίσης, εντοπίζεται στην Πελοπόννησο και σε αρκετά νησιά: Εύβοια, Κρήτη, Κέρκυρα, Λευκάδα, Κεφαλλονιά, Ζάκυνθος, Θάσος, Άνδρος, πιθανόν σε περισσότερα νησιά[5]. Οι πληθυσμοί στα ανατολικά νησιά του Αιγαίου (Σάμος, Χίος, Λέσβος, Ρόδος, Κως) θεωρείται ότι ανήκουν στον Ασιατικό δεντροβάτραχο[2].
Ο Ευρωπαϊκός δεντροβάτραχος, Hyla arborea (Linnaeus, 1758) είναι ένα είδος μικρού βατράχου της οικογένειας Hylidae, που απαντάται στην Ευρώπη. Βάσει πρόσφατων γενετικών μελετών ένας αριθμός taxa, που προηγουμένως αποτελούσαν υποείδη του H. arborea, πλέον αναγνωρίζονται ως είδη.
Квакша звычайная (Hyla arborea, драўнянка) — невялікае земнаводнае сямейства квакшаў.
Даўжыня цела дасягае 35—45 мм, вядомая максымальная даўжыня — 52 мм; маса 4—9 г. Зьверху квакша афарбавана ў ярка-зялёны колер, зьнізу — у жаўтавата-белы. Верхняя і ніжняя часткі цела падзелены тонкай чорнай палосай, якая пашыраецца ззаду і ўтварае пятлю ўгару у вобласьці пахвіны. Зьверху цёмная палоса мае белы беражок. Афарбоўка квакшаў прыкметна мяняецца ў залежнасьці ад тэмпэратуры і вільготнасьці навакольнага асяродзьдзя (напр., пры паніжэньні тэмпэратуры і павьшэньні вільготнасьці афарбоўка цямнейшая).
Цела зграбнае, канечнасьці адносна тонкія і доўгія. Кончыкі пальцаў квакшы расшыраны ў дыскі, якія зьяўляюцца прыстасаваньнем да лажання па дрэвах (па вэртыкальных паверхнях). Дыскі на кончыках пальцаў дапамагаюць ёй прыклейвацца да лістоў, галін, ствалоў дзякуючы таму, што яны багатыя на лімфатычныя і сьлізістыя залозы. Самцы маюць слаба разьвітыя шлюбныя мазалі.
Квакша звычайная (Hyla arborea, драўнянка) — невялікае земнаводнае сямейства квакшаў.
The European tree frog (Hyla arborea) is a small tree frog. As traditionally defined, it was found throughout much of Europe, Asia and northern Africa,[3] but based on molecular genetic and other data several populations formerly included in it are now recognized as separate species (for example, H. intermedia of Italy and nearby, H. molleri of the Iberian Peninsula, H. meridionalis of parts of southwestern Europe and northern Africa, and H. orientalis of parts of Eastern Europe, Turkey and the Black Sea and Caspian Sea regions), limiting the true European tree frog to Europe from France to Poland and Greece.[4][5][6]
European tree frogs are small; males range from 32–43 mm (1.3–1.7 in) in length, and females range from 40–50 mm (1.6–2.0 in) in length. They are slender, with long legs.[4] Their dorsal skin is smooth, while their ventral skin is granular. Their dorsal skin can be green, gray, or tan depending on the temperature, humidity, or their mood. Their ventral skin is a whitish color, and the dorsal and ventral skin is separated by a dark brown lateral stripe from the eyes to the groin. Females have white throats, while males have golden brown throats[7] with large (folded) vocal sacs. The head of H. arborea is rounded, the lip drops strongly, the pupil has the shape of a horizontal ellipse, and the tympanum is clearly recognizable. The discs on the frog's toes, which it uses to climb trees and hedges, is a characteristic feature of H. arborea . Like other frogs, their hind legs are much larger and stronger than the fore legs, enabling the frogs to jump rapidly.[5]
Members of the H. arborea species complex are the only representatives of the widespread tree frog family (Hylidae) indigenous to mainland Europe.[5] and are found across most of Europe (except Ireland),[5][6][8][9] northwest Africa, and temperate Asia to Japan.[7] This species complex is native to these countries:
Albania; Armenia; Austria; Azerbaijan; Belarus; Belgium; Bosnia and Herzegovina; Bulgaria; Croatia; Cyprus; the Czech Republic; Denmark; France; Georgia; Germany; Greece; Hungary; Israel (found in the Ayalon Valley); Italy; Liechtenstein; Lithuania; Luxembourg; Macedonia, the Republic of; Moldova; Montenegro; the Netherlands; Poland; Portugal; Romania; the Russian Federation; Serbia; Slovakia; Slovenia; Sweden; Switzerland; Turkey; Ukraine.[10][1]
It has also been introduced to the United Kingdom,[10] (although at least one British population, now thought to be extinct, may have been native[11]), and it has been reintroduced to Latvia.[1]
European tree frogs can be found in marshlands, damp meadows, reed beds, parks, gardens,[7] vineyards, orchards, stream banks, lakeshores,[10] or humid or dry forests.[4] They tend to avoid dark or thick forests,[10] and they are able to tolerate some periods of dryness; therefore, sometimes they are found in dry habitats.[4]
European tree frogs reproduce in stagnant bodies of water, such as lakes, ponds, swamps, reservoirs, and sometimes puddles,[1] from late March to June.[7] They croak in the breeding season, even when migrating to their mating pools or ponds.[5] Males will often change breeding ponds, even within the same breeding season.[13] After a spring rain, the males will call females from low vegetation or shallow ponds.[4] About 800 to 1000 eggs are laid in clumps the size of a walnut.[4][7] Individual eggs are about 1.5 mm in diameter. After 10–14 days, the eggs hatch. Then, after three months, tadpoles metamorphose into frogs.[7] Metamorphosis usually peaks from late July to early August.[13] They are able to live for up to 15 years.[7]
According to the IUCN Red List of Endangered Species, H. arborea is “listed as Least Concern in view of its wide distribution, presumed large population, and because it is unlikely to be declining fast enough to qualify for listing in a more threatened category.”[1] However, according to the IUCN, the population trend of H. arborea is decreasing.[1] Some of the main threats to European tree frogs include habitat fragmentation and destruction, pollution of wetlands, predation from fish, capture for the pet trade,[10][1] and climate change. Besides these main threats, other possible reasons for the decline in their populations include increased UVB radiation and local and far-ranging pesticides, fertilizers, and pollutants.[10] Trout have been observed preying on European tree frogs, and in Europe, trout introduced into a pond result in a significant decline in their population. While H. arborea is sensitive to habitat fragmentation, habitat restoration (beginning in the 1980s) has been successful to increase populations. Besides habitat restoration, other attempts to increase population have included building of new breeding ponds, creation of “habitat corridors to connect breeding sites”, and reintroductions. This has been successful in Sweden, Latvia, and Denmark.[12] Habitat protection has been shown to be the most important approach to conserving European tree frog populations.[10]
Formerly included in the European tree frog, the form molleri is now recognized as its own species, the Iberian tree frog
Hyla arborea tadpole and metamorph
European tree frogs in Witte Veen
The European tree frog (Hyla arborea) is a small tree frog. As traditionally defined, it was found throughout much of Europe, Asia and northern Africa, but based on molecular genetic and other data several populations formerly included in it are now recognized as separate species (for example, H. intermedia of Italy and nearby, H. molleri of the Iberian Peninsula, H. meridionalis of parts of southwestern Europe and northern Africa, and H. orientalis of parts of Eastern Europe, Turkey and the Black Sea and Caspian Sea regions), limiting the true European tree frog to Europe from France to Poland and Greece.
La Eŭropa arborano (Hyla arborea iama Rana arborea) estas malgranda arborano de familio de Hiledoj kaj genro Hyla troviĝanta en Eŭropo, Azio kaj parto de Afriko.[1] Baze sur molekula genetiko kaj alia informaro, nombraj taksonoj iam traktitaj kiel subspecio de H. arborea[2] estas nune ĝenerale agnoskitaj kiel plena specio.[3][4]
La Eŭropa arborano estas malgranda; maskloj gamas el 32-43 mm longe, kaj inoj gamas el 40-50 mm longe. Ili estas sveltaj, kun longaj kruroj.[2] Ties dorsa haŭto estas milda, dum ties ventra haŭto estas granula. Ties dorsa haŭto povas esti verda, griza aŭ bruneca depende al la temperaturo, humideco aŭ eĉ bonfarto. Ties ventra haŭto estas blankeca, kaj la dorsa kaj ventra haŭtoj estas separataj de malhelbruna flanka strio el la okuloj al la ingveno. Inoj havas blankaj gorĝojn, dum maskloj havas flavbrunajn gorĝojn[5] kun grandaj (falditaj) voĉosakoj. La kapo de la H. arborea estas rondoforma, la palpebro forte falas, la pupilo havas la formon de horizontala elipso, kaj la timpana membrano estas klare rekonebla. La diskoj de la fingroj, kiujn ĝi uzas por grimpi al arboj kaj arbustoj, estas karaktera trajto de H. arborea. Kiel ĉe aliaj ranoj, ties malantaŭaj kruroj estas multe pli grandaj kaj fortaj ol la antaŭaj, kio permesas al tiu ranoj salti rapide.[3]
Hyla arborea var. molleri Bedriaga, 1890
Hyla arborea, ranido kaj metamorfozo
Eŭropa arborano en Witte Veen
Membroj de la specikomplekso de H. arborea estas la nuraj reprezentantoj de la disvastigata arborana familio de Hiledoj indiĝena de kontinenta Eŭropo.[3] kaj ili troviĝas ĉe plej de Eŭropo (escepte Irlando),[3][4][6][7] nordokcidenta Afriko, kaj moderklimata Azio ĝis Japanio.[5] Tiu specikomplekso estas indiĝena de la jenaj landoj:
Albanio; Armenio; Aŭstrio; Azerbajĝano; Belarusio; Belgio; Bosnio kaj Hercegovino; Bulgario; Kroatio; Kipro; Ĉeĥio; Danio; Francio; Kartvelio; Germanio; Grekio; Hungario; Israelo (ĉe Ajalon Valo); Italio; Liĥtenstejno; Litovio; Luksemburgio; Macedonio; Moldavio; Montenegro; Nederlando; Pollando; Portugalio; Rumanio; Rusia Federacio; Serbio; Slovakio; Slovenio; Svedio; Svisio; Turkio; Ukrainio.[8][9]
Ĝi estis ankaŭ enmetita en Unuiĝinta Reĝlando,[8] kaj reenmetita en Latvio.[9]
Eŭropaj arboranoj povas troviĝi en marĉoj, neprofundaj herbejoj, kareksejoj, parkoj, ĝardenoj,[5] vitejoj, fruktoĝardenoj, rojobordoj, lagobordoj,[8] aŭ humidaj aŭ sekaj arbaroj.[2] Ili tendencas eviti malhelajn aŭ densajn arbarojn,[8] kaj ili kapablas tolerati kelkajn periodojn de sekeco; tiele, foje ili troviĝas ankaŭ en sekaj habitatoj.[2]
La Eŭropa arborano (Hyla arborea iama Rana arborea) estas malgranda arborano de familio de Hiledoj kaj genro Hyla troviĝanta en Eŭropo, Azio kaj parto de Afriko. Baze sur molekula genetiko kaj alia informaro, nombraj taksonoj iam traktitaj kiel subspecio de H. arborea estas nune ĝenerale agnoskitaj kiel plena specio.
La ranita de San Antonio (Hyla arborea) es una pequeña rana arborícola del género Hyla de unos 4,5 a 5 cm de longitud. Su piel debe estar siempre húmeda y se alimenta de insectos. Es el representante por excelencia de los hílidos en Europa, distribuyéndose por Europa central y meridional, y por las zonas colindantes de Asia y África. Dado que la intensidad de su canto depende de la humedad ambiental, se la considera un higrómetro biológico.
Son anfibios de pequeño tamaño, de no más de 5 cm. Presenta un cuerpo ovalado,cabeza ancha y ojos grandes, prominentes de iris dorado. Fácilmente reconocibles por el intenso color verde brillante, aunque, dependiendo de su entorno, son capaces de cambiar su color del verde hasta el pardo, el azul y hasta amarillo. A veces se puede encontrar con manchas. Poseen unas líneas que van del marrón al negro dibujadas a lo largo de los costados de forma irregular y extendidas en manchas más marrones. Sus extremidades esbeltas y los dedos provistos de ventosas, adaptadas a sus hábitos trepadores, les permiten subir fácilmente por la vegetación y mantenerse sobre las hojas más lustrosas, siendo uno de los caracteres que las separan de las ranas típicas, de fuertes ancas traseras adaptadas al salto. El macho presenta un gran saco vocal que infla bajo la mandíbula al realizar su llamada y desarrolla durante el periodo nupcial pequeñas rugosidades en el primer dedo de las extremidades anteriores que le ayudarán a sujetarse a la hembra durante el amplexo.
Vive en territorios con agua permanente, donde abunda la vegetación a los márgenes de charcas, lagunas o ríos de corrientes lentas. Frecuenta preferiblemente árboles, matorrales y otras vegetaciones densas que le permitan camuflarse y que además estén próximas al agua. Es de actividad principalmente nocturna y crepuscular. Presente en las zonas mediterráneas europeas. Ampliamente distribuida por Europa, desde Ucrania y Bielorrusia, hasta los Balcanes, Creta, Italia, Benelux y Francia. Compartiendo territorio, dentro de la península ibérica, habita una especie muy similar, cuyo nombre es Hyla molleri, igualmente denominada ranita de San Antonio.[2]
El periodo reproductor de esta ranita comienza con la primavera, utilizando charcas o riberas fluviales de aguas dulces y con abundante vegetación.
Los machos atraen a las hembras con su potente canto, hinchando el saco vocal que llega a adquirir un tamaño mayor que el de la cabeza.
Como en el resto de especies de ranas, el apareamiento tiene lugar una vez el macho haya conseguido atraer a una hembra con su llamada y durante la noche. La hembra deposita paquetes con alrededor de mil huevos, los cuales son fecundados externamente por el macho, realizando el denominado amplexo axilar.
|coautores= (ayuda)
|coautores= (ayuda)
|coautores= (ayuda)
La ranita de San Antonio (Hyla arborea) es una pequeña rana arborícola del género Hyla de unos 4,5 a 5 cm de longitud. Su piel debe estar siempre húmeda y se alimenta de insectos. Es el representante por excelencia de los hílidos en Europa, distribuyéndose por Europa central y meridional, y por las zonas colindantes de Asia y África. Dado que la intensidad de su canto depende de la humedad ambiental, se la considera un higrómetro biológico.
Harilik lehekonn (Hyla arborea, varem Rana arborea) on lehekonlaste sugukonda kuuluv kahepaiksete liik.[1]
Lehekonna levila hõlmab osa Aasiast ja enamikku Euroopat (välja arvatud selle põhjaosa; samuti pole lehekonna Baleaaridel, Prantsusmaa ja Pürenee poolsaare lõunapiirkondades). Leedus on väike lehekonna asurkond, Lätis on lehekonn taasasustatuna.[1]
Lehekonn on eeskätt ööloom.[1]
Harilik lehekonn (Hyla arborea, varem Rana arborea) on lehekonlaste sugukonda kuuluv kahepaiksete liik.
Lehekonna levila hõlmab osa Aasiast ja enamikku Euroopat (välja arvatud selle põhjaosa; samuti pole lehekonna Baleaaridel, Prantsusmaa ja Pürenee poolsaare lõunapiirkondades). Leedus on väike lehekonna asurkond, Lätis on lehekonn taasasustatuna.
Lehekonn on eeskätt ööloom.
Zuhaitz-igel arrunta edo Hyla arborea Euskal Herrian aurki daitekeen igeletako bat da. Igel honen kolorazio ohikoena berdea bada ere, tonalitatea oso aldakorra izan daiteke, eta marroixka izatera hel daiteke. Gainera, indibiduo batek, zein substraturen gainean dagoen edota dituen sentipenen arabera kolorearen intentsitatea alda dezake. Sudurzulo bakoitzetik lerro beltz bat luzatzen da animaliaren alde biak eta baita hankak ere zeharkatzen dituena. Lerro ilun hau inguratzen zuri edo krema koloreko beste lerrotxo bat beha daiteke. Bizkarrean ez dute orbanik aurkezten eta alde bentrala zuria dute.
Gorputza obalatua izan ohi da eta burua nahiko zabala. Bertan kokatzen diren tinpanoak nahiko txikiak dira, igeletan topatzen diren tinpanoekin erkatuz. Alde dortsala leuna den bitartean, behe-aldea bikortsua dute. Arrek, ahots-zaku handia dute, eta kantu egiten dutenean nabarmenki puzten da; kantatzen ez dagoenean, tolestura batzuk sumatzen dira hau kokatzen den ingurunean.
Hanka luzeak ditu anuru honek eta behatzarteko mintzik gabekoa da (agertu daitezke, baina kasu hauetan ez dira ezta atzamarren luzera erdira ere ailegatzen). Hatz bakoitzaren muturrean disko-formako kopadura bat ageri du, eta honek baimentzen dio zuhaitzen hosto, adar eta beste hainbat gainazali atxikitzea.
Igel espezie honek Europa du bizileku, eta Norvegia, Estonia, Letonia, Ingalaterra eta [[Irlanda] kenduta, beste herrialde guztietan, gehiago edo gutxiago, topa dezakegula esan genezake.
Euskal Herrian, bi populazio ezberdindu ditugu: bata gune mediterraniarrean kokatzen da (uren banaketa-lerrotik hasi eta Ebroraino, Nafarroaren hegoaldea kenduta), eta bestea kostaldean, banaketa lerro estu bat osatuz.
Putzu, urmael eta zingiren moduko inguruneak ditu gogoko igel honek, landare anitzez inguraturik daudenak batez ere. Itsas mailatik eta kota altuetara bitartean topa daiteke anfibio hau, eta altuera handienean aurkitu den populazioa 1950 m-tara bizi da. [Zuhaitz]]en adar eta hostoetan ematen du denbora gehiena, baina hala ere, zenbait momentutan, uretan edota lurrean ere ikus daiteke.
Emeek erruten dituzten arrautzek, 800tik 1.000ra izan daitezkeenak, kolore horixka eta 1,5 mm-ko diametroa dute. Errun eta 12-15 egunera, 5-8 mm-tako larbak jaiotzen dira. Garapena aurrera doalarik, zapaburuek, kolore gris edota berdea hartu eta metamorfosia pairatzen hasten dira. 3 hilabeteren buruan, animalia gazteak uretatik ateratzen hasten dira, eta baita talde handitan irten ere. 3-4 urte eta 5 cm inguruko tamaina dutelarik lortzen dute heldutasun sexuala. 5 urteko bizi luzetasuna du animaliatxo honek naturan.
Udaberri edo negu bukaeran, ugaltzeko garaia heltzen zaie anuru hauei, eta arrak emeei aurrea hartuz putzuetara jotzen dute. Hor direlarik, emeak erakartzen dituzte «kraar-kraar-kraar» soinua behin eta berriro errepikatuz; kantu hau, ugalketa garaitik kanpo ere burutu dezakete hezetasun altuko egunetan, euria egin eta gero batez ere. Emeak ar bat aukeratu ondoren, arra, emearen bizkarraldera igo eta bikoteak, anplexus axial deritzon jarrera hartzen du. Anplexusa, bi ordutan luza daiteke eta gauez zein egunez burutu dezakete.
Espezie hau, gautar eta ilunabartarra da batez ere, baina deshidratazioa nolabait jasateko moldatua dagoen larruazala duenez, egunez eguzkitan ere aurkitu daiteke. Zuhaitzetan egon ohi da, eta gutxitan arriskatzen da lurrean edota uretan egotera, bere etsaien menpe. Bero altuko egunetan ordea, putzu, harripe eta leku freskoetan gordetzen da.
Udazkenetik udaberrira, lokatz, goroldio eta arrakalen artean hibernatzen du.
Mingaina erabiliz edota harrapakinen gainean salto eginez ehizatzen du. Harrapakinen artean, tximeleta, kilker, euli eta beste hainbat intsektu aurkitzen dira. Indibiduo batzuen urdailean, hemipteroak, opilioiak eta inurriak ere topatu dira.
Anfibioak izan ohi dituzten etsai natural berberak ditu Hyla arboreak, besteak beste hegazti harrapariak, ugaztun “anfibiozaleak”, narrastiak… Gainera, intsektu urtarrek, anfibio honen zein beste askoren zapaburuei erasotzen diete.
Bestetik, gero eta zailago bihurtzen ari da espezie honetako indibiduo bat naturan aurkitzea, eta honen arrazoien artean, ekintza antropikoa nabarmendu beharko genuke. Gizakiak, putzuen eta zingiren inguruko landaredia murriztu, zapaburuak kaltetzen dituzten intsektizidak erabili eta hezeguneetan, hauek kutsatzen dituzten gune industrialak kokatzen baititu. Beraz, espezie honen “etsai naturalen” artean gizakia sartzea legezkoa litzake.
Zuhaitz-igel arrunta edo Hyla arborea Euskal Herrian aurki daitekeen igeletako bat da. Igel honen kolorazio ohikoena berdea bada ere, tonalitatea oso aldakorra izan daiteke, eta marroixka izatera hel daiteke. Gainera, indibiduo batek, zein substraturen gainean dagoen edota dituen sentipenen arabera kolorearen intentsitatea alda dezake. Sudurzulo bakoitzetik lerro beltz bat luzatzen da animaliaren alde biak eta baita hankak ere zeharkatzen dituena. Lerro ilun hau inguratzen zuri edo krema koloreko beste lerrotxo bat beha daiteke. Bizkarrean ez dute orbanik aurkezten eta alde bentrala zuria dute.
Gorputza obalatua izan ohi da eta burua nahiko zabala. Bertan kokatzen diren tinpanoak nahiko txikiak dira, igeletan topatzen diren tinpanoekin erkatuz. Alde dortsala leuna den bitartean, behe-aldea bikortsua dute. Arrek, ahots-zaku handia dute, eta kantu egiten dutenean nabarmenki puzten da; kantatzen ez dagoenean, tolestura batzuk sumatzen dira hau kokatzen den ingurunean.
Hanka luzeak ditu anuru honek eta behatzarteko mintzik gabekoa da (agertu daitezke, baina kasu hauetan ez dira ezta atzamarren luzera erdira ere ailegatzen). Hatz bakoitzaren muturrean disko-formako kopadura bat ageri du, eta honek baimentzen dio zuhaitzen hosto, adar eta beste hainbat gainazali atxikitzea.
Euroopanlehtisammakko (Hyla arborea), aiemmin käytetty myös nimeä lehtisammakko[3], on lehtisammakoiden heimoon kuuluva palearktinen sammakkolaji, joka elää Manner-Euroopassa Pyreneiden niemimaalta Kaukasiaan ulottuvalla vyöhykkeellä.[1][4][5] Sen kanta on pienentynyt huomattavasti Länsi- ja Keski-Euroopassa ilmaston lämpenemisen sekä luonnollisten elinympäristöjen häviämisen ja saastumisen takia.[4]
Euroopanlehtisammakon käyttäytymisen perusteella on kautta aikojen ennustettu säätä, sillä se kurnuttaa ennen sadetta ja kiipeilee puissa ja pensaissa kauniilla ilmalla.[5]
Euroopanlehtisammakko kasvaa 4–5 cm:n pituiseksi.[5][6] Sen sormet ja varpaat päättyvät pyöreään tarttumalevyyn ja varpaiden välissä on uimaräpylät.[4][5] Täysikasvuisen yksilön takaraajat ulottuvat eteenpäin taivutettuina silmien etupuolelle.[4]
Selkäpuolen iho on sileä ja omenanvihreä, mutta voi alustan, lämpötilan ja sammakon mielentilan mukaan muuttua herkästi harmaaksi, ruskeaksi tai lähes mustaksi.[4][5][6] Vatsassa iho on nystyisempää ja väriltään valkoista tai kellertävää.[4] Selkä- ja vatsapuolen erottaa toisistaan ohut, katkeamaton juova, joka on valkoreunainen ja väriltään musta tai ruskea. Juova alkaa sieraimesta ja päättyy nivusten kohdalla hakaseen; joskus hakanen kuitenkin puuttuu ja juova ulottuu nivusten sisäpinnalle asti.[4][5]
Sammakon kieli on kiinnittynyt suuontelon etuosaan ja kitalaessa on vannasluut. Kylkijuovan kohdalla sijaitsevat tärykalvot ovat selvästi pienemmät kuin silmät, joissa on vaakasoikeat pupillit. Toisin kuin eräillä muilla sammakkolajeilla, euroopanlehtisammakolla ei ole silmien alapuolella tummaa täplää.[4] Koiraan kurkunpäähän liittyy erittäin laajenemiskykyinen äänirakko, jossa iho on tummempaa ja löysempää kuin muualla.[4][5] Äänirakosta lähtevä äänekäs ja konemainen kurnutus (ke-ke-ke tai ep-ep-ep) voi kantaa jopa kilometrien päähän.[5][6]
Vihreä suojaväri.
Euroopanlehti-sammakko on yleinen Keski-, Etelä- ja Itä-Euroopassa. Levinneisyysalue ulottuu pohjoisessa Tanskaan, Etelä-Ruotsiin ja Liettuaan ja kaakossa Ukrainaan ja Krimin niemimaalle.[1] Levinneisyysalueen itäosissa laji on edelleen elinvoimainen, mutta Länsi-Euroopassa sen kanta on pienentynyt huomattavasti. Syiksi tähän arvellaan torjunta-aineiden ja saasteiden leviämistä ympäristöön, ilmaston lämpenemistä ja UVB-säteilyn lisääntymistä, kutupaikkojen vähentymistä, populaatioiden eristäytymistä toisistaan sekä sammakoiden kiinniottamista lemmikkieläimiksi.[4]
Euroopanlehtisammakon lähisukulaisia ovat Euroopassa välimerenlehtisammakko (Hyla meridionalis) ja Aasiassa muun muassa Hyla savignyi ja Hyla japonica.[1][6] Monet niistä luettiin aikaisemmin sen alalajeiksi.[1] Nykyisen luokituksen mukaiset euroopanlehtisammakon alalajit on lueteltu alla olevassa taulukossa.[4]
Euroopanlehtisammakon alalajeja Alalaji Levinneisyys H. arborea arborea Eurooppa. Levinneisyysalueen pohjoisraja kulkee linjallaEuroopanlehtisammakko elää leveälehtisissä puissa ja pensaissa, joskus hyvinkin kaukana vedestä.[5] Tavallisimpia elinympäristöjä ovat valoisat sekametsät ja pensaikot, puutarhat, viinitarhat, hedelmätarhat, puistot ja järvien ja purojen rannat – Etelä-Euroopassa myös saaristometsät ja tulvatasankojen tiheiköt. Kosteilla ja metsäisillä vuoriseuduilla sammakkoa tavataan aina puurajalle asti. Sen sijaan pimeitä ja tiheitä metsiä se karttaa.[4]
Päiväsaikaan euroopanlehtisammakko pysyttelee enimmäkseen paikoillaan puiden, pensaiden ja ruohokasvien lehdillä ja varsilla. Aktiivisimmillaan se on illalla ja yöllä, jolloin se laskeutuu maahan juomaan vettä ja etsimään ravintoa. Syksyllä ennen horrokseen vaipumista sammakko on aktiivinen päivälläkin. Se horrostaa syys–joulukuusta helmi–toukokuuhun jonkin multa- tai kivikasan alla tai puunkolossa.[4]
Kevään tullen euroopanlehtisammakko hakeutuu kutemaan vesistöihin ja kosteille niityille.[4][5] Tyypillisiä kutupaikkoja ovat seisovat vedet, kuten järvet, lammet ja suot, mutta myös pelkät ojat ja lätäköt kelpaavat. Kuteminen tapahtuu yleensä huhti–toukokuussa, joskus kuitenkin jo maaliskuussa tai vasta kesä–heinäkuussa. Kutulammikoissa on pääsääntöisesti enemmän koiraita kuin naaraita.[4] Naaraat saapuvat lammikoihin koiraiden jälkeen ja poistuvat heti parittelun jälkeen, kun taas koiraat saattavat jäädä veteen kesäkuuhun saakka.[4][6] Naaras laskee kutupaikkaan 200–2 000 munaa pieninä, pähkinän kokoisina rykelminä, jotka koostuvat 3–100 munasta.[4][5] Rykelmät vajoavat veden pohjaan ja tarttuvat vesikasveihin.[6] Toukkien muodonvaihdos tapahtuu maantieteellisestä sijainnista riippuen kesä- ja syyskuun välisenä aikana. Toukka voi myös talvehtia ja kasvaa aikuiseksi vasta seuraavana kesänä. Noustuaan maalle nuoret sammakot jäävät kiipeilemään kaislikoihin ja pensaikoihin ve tuntumaan.[4]
Pääosa euroopanlehtisammakon ravinnosta muodostuu nopeista lentävistä hyönteisistä, joita se nappaa suuhunsa jopa lennosta.[4][6]. Se saalistaa yleensä maasta käsin, mutta kutuaikana myös vesikasvien lehdiltä.[4]
Euroopanlehtisammakko (Hyla arborea), aiemmin käytetty myös nimeä lehtisammakko, on lehtisammakoiden heimoon kuuluva palearktinen sammakkolaji, joka elää Manner-Euroopassa Pyreneiden niemimaalta Kaukasiaan ulottuvalla vyöhykkeellä. Sen kanta on pienentynyt huomattavasti Länsi- ja Keski-Euroopassa ilmaston lämpenemisen sekä luonnollisten elinympäristöjen häviämisen ja saastumisen takia.
Euroopanlehtisammakon käyttäytymisen perusteella on kautta aikojen ennustettu säätä, sillä se kurnuttaa ennen sadetta ja kiipeilee puissa ja pensaissa kauniilla ilmalla.
Hyla arborea
Hyla arborea, la rainette verte, est une espèce d'amphibiens de la famille des Hylidae[1].
Sans analyse génétique, cette rainette ne se différencie de sa proche parente, la Rainette méridionale, que par son chant plus rapide[2] ou par la bande latérale sombre qui se prolonge sur ses flancs, alors que cette ligne se limite au contour de l'œil chez l'espèce méridionale.
Les noms latins suivants ont pu être autrefois donnés à cette espèce[1] :
Les périodes glaciaires et interglaciaires ont modifié son aire de répartition, avec des mouvements de population contraints par les grandes chaînes montagneuses [3]. Elle semble surtout s'être alors réfugiée dans les péninsules européennes (Hewitt, 99, taberlet 98 cités par Fubey et al.[3]) ou dans des refuges qui restent à préciser. Lors de la recolonisation vers le nord à la faveur du réchauffement qui a suivi la fin de la dernière glaciation, des groupes génétiques distincts se sont maintenus, avec quelques cas de spéciations (Hewitt 2001 cité par Fubey et al.[3]). Ainsi trouve-t-on en Suisse des sous-espèces différentes au nord et au sud des Alpes (Tessin), comme c'est d'ailleurs le cas pour le triton lobé (Triturus vulgaris) avec sa sous-espèce meridionalis, ou encore avec certains reptiles (sous-espèce muralis au nord et maculiventris au Sud pour le Lézard des murailles), ou pour la couleuvre (Natrix maura dans le bassin du Rhône et Natrix tessellata au sud des Alpes (Hofer et al, 2001 cités par Fubey et al.[3]). Ce sont maintenant les activités humaines [3] (drainage des zones humides, pollution par les insecticides et nitrates, fragmentation écopaysagère, pollution lumineuse) qui affectent l'aire de répartition des populations (souvent relictuelles) de rainettes.
La rainette verte (Hyla arborea) n'est présente qu'au nord de la Suisse bien qu'elle soit ailleurs présente bien plus au sud (de l'Espagne à la Turquie), alors qu'on trouve au sud la Rainette intermédiaire (Hyla intermedia) dans le Tessin et en Italie (Gasc et al. 1997, Grossenbacher, 1988 cités par Fubey et al.[3]). Cette répartition est localement faussée par des introductions par l'homme (rainette verte introduite, dans le Canton de Genève, semble-t-il sans succès[3]). Seule l'étude de l'ADN permet d'identifier les espèces avec certitude (gène mitochondrial codant le cytochrome b) (Bradley et Baker, 2001 cités par Fubey et al.[3]).
Cette espèce est aujourd'hui encore répandue dans certaines zones, mais en régression ou disparue dans une grande partie de son aire naturelle ou potentielle de répartition. Sa distribution contemporaine va de la péninsule Ibérique et de la France vers l'est à l'ouest de la Russie et la région du Caucase, et au sud vers les Balkans et la Turquie. Elle est globalement absente de la Scandinavie (à l'exception du sud et l'est du Danemark et de l'extrême sud de la Suède). Elle a été introduite au Royaume-Uni mais elle y est maintenant considérée comme éteinte. C'est une espèce de plaine qui a été enregistrée à une altitude maximale (en Bulgarie) de 2 300 m.
Elle est ainsi présente (ou l'a été) en Albanie, en Arménie, en Autriche, en Azerbaïdjan, en Biélorussie, en Belgique, en Bosnie-Herzégovine, en Bulgarie, en Croatie, en République tchèque, au Danemark, en France, en Géorgie, en Allemagne, en Grèce, en Hongrie, en Italie, au Liechtenstein, en Lituanie, au Luxembourg, en Macédoine, en Moldavie, au Monténégro, aux Pays-Bas, en Pologne, en Roumanie, en Russie, en Serbie, en Slovaquie, en Slovénie, en Espagne, en Suède, en Suisse, en Turquie, en Ukraine et en Lettonie (où elle a été réintroduite).
Elle vit dans les forêts de feuillus, les forêts mixtes, les parcs et jardins, les vergers, les rives des lacs et cours d'eau. Elle évite les forêts trop sombres et denses[4].
On la classe communément parmi les grenouilles même si scientifiquement on sépare les grenouilles (ranidés) des rainettes (hylidés) notamment parce que les rainettes sont équipées de pelotes adhésives au bout des doigts leur permettant un mode de vie arboricole (en Europe, les rainettes sont les seuls amphibiens européens à avoir ce mode de vie de grimpeur).
Elle ne dépasse pas 5 cm de long, a la peau lisse, vert souvent très vif, a le ventre gris-blanc et présente une bande brune de l'œil aux flancs.
Les rainettes vertes se rencontrent dans les milieux marécageux et boisés mais toujours à proximité de l'eau. On peut en apercevoir le soir près des points d'eau dans un jardin (gamelle pour chien, mares, etc.) et la journée sur des branches de plantes exposées au soleil, très souvent à proximité d'un point d'eau. Elles ont une activité nocturne intense, tandis qu'elles passent la journée, lorsque celle-ci est bien ensoleillée, immobiles plusieurs heures afin de prendre le soleil.
Leur régime est composé en particulier d'insectes volants.
La maturité sexuelle est atteinte à deux ans[5], et la reproduction a lieu au printemps, de mars à juin.
Les femelles pondent de 800 à 1000 œufs en masses non flottantes.
Les têtards présentent une crête dorsale marquée et des mouvements vifs et rapides semblables à ceux d'alevins.
Le taux de survie d'une année sur l'autre ne varie pas de manière significative selon le sexe[5]. La survie de la jeune génération semble fortement liée à la pluviométrie (les pluies favorisent la survie des têtards)[5].
C'est une espèce au chant sonore, dont les mâles forment des chœurs nocturnes sonores caractéristiques constitués d'une sorte de "waka-waka" répétitif. Les individus femelles ont un chant plus ample, plus grave et avec une fréquence plus élevée[6]. Le chant semble avoir une grande importance au sein d'une population pour la reproduction[7].
Cette espèce est menacée d'extinction[8]. La plupart des amphibiens sont en régression sur la totalité de leur aire de répartition, pour des raisons probablement multifactorielles[9],[10], qui peuvent concerner les parties aquatique et/ou terrestre de leur cycle de vie.
Cette espèce a des besoins précis pour maintenir sa diversité génétique[11] et son développement[12], notamment en termes d'habitat naturel[13]. Elle a par exemple du mal à se déplacer dans les milieux asséchés ou traités par des insecticides, sachant que les milieux qu'elle fréquente, des mares peu profondes notamment, peuvent évoluer rapidement (sécheresse, drainage, pollution, atterrissement naturel…). Elle forme des métapopulations parfois éloignées les unes des autres et peut effectuer de petites migrations[14].
La rainette verte est l'une des espèces en forte régression dans les zones urbanisées et dans les régions d'agriculture intensive[15]. La pollution de l'eau, par les insecticides notamment, ainsi que l'introduction de poissons dans les petites mares sont des facteurs de disparition de l'espèce dans les territoires concernés[16]. Elle est par exemple considérée comme menacée de disparition en Suisse[17], voire éteinte en Belgique[18].
Selon une étude danoise récente basée sur des analyses génétiques (marqueurs microsatellite[19],[20]).[Quoi ?]
La fragmentation des habitats est également un facteur important de régression ou disparition de cette espèce. Il est source de "goulot d'étranglement génétique"[21].
Une autre étude récente montre que parmi les facteurs de régression, l'urbanisation de la périphérie d'un étang antérieurement occupé par des rainettes a un impact très négatif sur la probabilité de présence de l'espèce. Le nombre d'heures d'ensoleillement de l'étang est corrélé à l'importance des chants de mâles (supposés importants pour la territorialité et le succès de reproduction)[22]. Une conductivité élevée de l'eau (signe de minéralisation ou salinisation) a été associée à une plus faible probabilité de présence de l'espèce[22] (hors littoral dunaire).
Enfin, curieusement, sur le territoire de cette étude plus une zone humide est proche de route à deux voies, plus les mâles chantent (réaction au bruit des véhicules ?)[22].
Hyla arborea
Hyla arborea, la rainette verte, est une espèce d'amphibiens de la famille des Hylidae.
Sans analyse génétique, cette rainette ne se différencie de sa proche parente, la Rainette méridionale, que par son chant plus rapide ou par la bande latérale sombre qui se prolonge sur ses flancs, alors que cette ligne se limite au contour de l'œil chez l'espèce méridionale.
A Hyla arborea é unha pequena ra do xénero Hyla, da familia dos hílidos (Hylidae), duns 4,5 a 5 cm de lonxitude, cor verde, hábitos arborícolas e que se alimenta de insectos.
Pode verse en días húmidos e nubrados, porén, atinxe os niveis máximos de actividade durante a noite.
Historicamente as relas foron utilizadas como barómetros biolóxicos, debido ao feito de comezaren os machos a croar ao sentiren a proximidade da chuvia.
Esta ra é o representante por excelencia dos hílidos en Europa, distribuíndose pola Europa central e meridional (agás a península Ibérica), estendéndose polo leste até o Cáucaso e Asia occidental.
É un anfibio de pequeno tamaño, de non máis de 5 cm de lonxitude. Presenta un corpo ovalado, algo repoludo, coa cabeza ancha e os ollos grandes e prominentes, de iris dourado.
Facilmente recoñecíbel pola intensa cor verde brillante, aínda que, dependendo da subespecie, temperatura ou humidade relativa ou o seu contorno, a súa cor pode variar entre as tonalidades verde escura a verde intensa, pasando pola cincenta, parda e amarela, ás veces con manchas. Ao longo dos flancos presentan unhas liñas irregulares de cor que vai da parda á negra.
As súas extremidades son esveltas, e nas puntas dos dedos teñen ventosas, adaptadas aos seus hábitos gabeadores, que lles permiten agatuñar facilmente pola vexetación e manterse sobre as follas máis lustrosas, sendo este un dos caracteres que as separan das ras típicas, de fortes ancas traseiras adaptadas ao salto.
O macho presenta un gran saco vocal que infla debaixo da mandíbula ao realizar a súa chamada e desenvolve durante o período nupcial pequenas rugosidades no primeiro dedo das extremidades anteriores que lle axudarán a suxeitarse á femia durante o amplexo.
Vive en territorios con auga permanente, onde abunda a vexetación, nas marxes de pozas, lagoas ou ríos de correntes lentas. Frecuenta preferibelmente árbores, matogueiras e outras vexetacións densas que lle permitan agocharse, e que ademais estean próximas á auga.
É de actividade principalmente crepuscular e nocturna.
Presente nas zonas mediterráneas europeas, está amplamente distribuída por Europa, desde Ucraína e Belarús, até os Balcáns, Creta, Italia, Benelux e Francia.
Na península Ibérica substitúea a especie Hyla molleri, que anteriormente era considerada unha subespecie dentro de H. arborea.[2][3][4][5][6][7]
O período reprodutor desta ra comeza coa primavera, utilizando pozas ou ribeiras fluviais de augas doces e con abundante vexetación.
Os machos atraen as femias co seu potente canto, inchando o saco vocal que chega a adquirir un tamaño maior có da cabeza.
Coma no resto de especies de ras, o apareamento ten lugar unha vez que o macho consegue atraer unha femia coa súa chamada, e durante a noite. A femia deposita paquetes con ao redor de 1.000 ovos, que son fecundados externamente polo macho durante o denominado amplexo axilar.
A Hyla arborea é unha pequena ra do xénero Hyla, da familia dos hílidos (Hylidae), duns 4,5 a 5 cm de lonxitude, cor verde, hábitos arborícolas e que se alimenta de insectos.
Pode verse en días húmidos e nubrados, porén, atinxe os niveis máximos de actividade durante a noite.
Historicamente as relas foron utilizadas como barómetros biolóxicos, debido ao feito de comezaren os machos a croar ao sentiren a proximidade da chuvia.
Esta ra é o representante por excelencia dos hílidos en Europa, distribuíndose pola Europa central e meridional (agás a península Ibérica), estendéndose polo leste até o Cáucaso e Asia occidental.
Obične gatalinke (kreketuša; Hyla arborea) su vrsta iz porodice gatalinki i nalazimo u gotovo cijeloj Europi, osim Engleske, Irske i skandinavskih zemalja. Ove žabe u pravilu ne žive u šumama već preferiraju osunčane rubove šuma, grmlja i šikare, močvarna zemljišta, livade i vode stajaćice bogate vegetacijom i bez prisustva ribe. Gatalinka je ugrožena u zapadnoj Europi i gotovo iskorijenjena u Belgiji. To je jedina vrsta iz porodice gatalinki koja živi u središnjoj Europi. Obična gatalinka zimuje u većim grupama u zemlji, ispod korijena, u šupljinama drveća. U proljeće se pojavljuje u travnju-svibnju.
Gatalinka pripada najmanjim žabama Europe s tjelesnom dužinom do 3 cm. Jednobojna je, s gornje strane obično svijetlo-zelene boje, dok s donje strane boja znatno varira i može biti sivo-zelena ili mrka. Ženka nakon parenja odlaže jaja u vodu, a mlade gatalinke, nakon preobrazbe napuštaju vodena staništa u srpnju ili kolovozu. Pretežno je aktivna noću. Za vrijeme dugih ljetnih suša, pred kišu se javlja poznatim kreketanjem zbog čega su u prošlosti često korištene kao barometri. Hrani se kukcima.
Obična gatalinka može se naći posvuda na tlu Hrvatske i na popisu je zaštićenih vrsta u Republici Hrvatskoj.
Obične gatalinke (kreketuša; Hyla arborea) su vrsta iz porodice gatalinki i nalazimo u gotovo cijeloj Europi, osim Engleske, Irske i skandinavskih zemalja. Ove žabe u pravilu ne žive u šumama već preferiraju osunčane rubove šuma, grmlja i šikare, močvarna zemljišta, livade i vode stajaćice bogate vegetacijom i bez prisustva ribe. Gatalinka je ugrožena u zapadnoj Europi i gotovo iskorijenjena u Belgiji. To je jedina vrsta iz porodice gatalinki koja živi u središnjoj Europi. Obična gatalinka zimuje u većim grupama u zemlji, ispod korijena, u šupljinama drveća. U proljeće se pojavljuje u travnju-svibnju.
Gatalinka pripada najmanjim žabama Europe s tjelesnom dužinom do 3 cm. Jednobojna je, s gornje strane obično svijetlo-zelene boje, dok s donje strane boja znatno varira i može biti sivo-zelena ili mrka. Ženka nakon parenja odlaže jaja u vodu, a mlade gatalinke, nakon preobrazbe napuštaju vodena staništa u srpnju ili kolovozu. Pretežno je aktivna noću. Za vrijeme dugih ljetnih suša, pred kišu se javlja poznatim kreketanjem zbog čega su u prošlosti često korištene kao barometri. Hrani se kukcima.
Obična gatalinka može se naći posvuda na tlu Hrvatske i na popisu je zaštićenih vrsta u Republici Hrvatskoj.




La raganella europea (Hyla arborea Linnaeus, 1758) è un anfibio dell'ordine degli Anuri, diffuso in Europa e Asia.
Di aspetto simile alle rane, ma dotata di un solo sacco vocale bruno sotto la gola e di ventose sulle dita delle zampe. Questo permette all'animale di arrampicarsi su alberi, arbusti, foglie e muri.
Presenta una striatura nera o marrone chiara che parte dalla narice, prosegue dopo l'occhio e continua fino all'inserzione dell'arto inferiore. Questo carattere la differenzia dalla Hyla meridionalis, anch'essa presente in Europa, in cui la striatura nera si interrompe bruscamente dopo il timpano. La lunghezza del corpo varia in media dai 3 ai 5 cm, ma può toccare i 6,5.Ha il dorso verde e il ventre biancastro
[1] La raganella, se eccitata o se il tempo cambia, varia di colore, passando addirittura a una colorazione chiazzata[2]
Le raganelle sono insettivore, si nutrono di artropodi e altri invertebrati terricoli. Sono prevalentemente arboricole, ma si trovano anche in mezzo alle erbe palustri, nei campi in prossimità di fossi e risaie. Raggiungono la maturità sessuale a 1 anno. All'inizio della stagione degli amori i maschi fanno i loro richiami e si riuniscono in coro entrando in competizione. Sono legate all'acqua per la riproduzione. Possono deporre dalle 200 alle 2000 uova. Dall'uovo dopo 3 settimane dalla deposizione esce il girino che compie il proprio ciclo vitale in tempi variabili tra 1,5 e 3 mesi. Alla fine della metamorfosi il girino avrà sviluppato zampe atte a saltare, polmoni per respirare fuori dall'acqua, avrà perso la coda e avrà cambiato regime alimentare passando da detritivoro a carnivoro. Le raganelle vanno in letargo d'inverno. Hanno un'aspettativa di vita di 3-5 anni.[1]
La specie, nota anche come raganella europea, è ampiamente distribuita in quasi tutta l'Europa: dalla Spagna alla Francia, dalla Germania al Benelux, dai Balcani all'Ucraina. Presente anche a Creta oltre che in Italia. È invece assente nell'arcipelago britannico, in Scandinavia e in Danimarca.
[1] In Asia, arriva fino al Mar Caspio.[2] Vive in zone umide dalla campagna aperta.
La specie è diffusa, in Italia, solamente nel Friuli settentrionale.[3]
Nonostante non sia in pericolo di estinzione, la raganella è una specie da preservare per tutto il patrimonio faunistico italiano ed europeo, essendo una delle poche eccezioni di specie viventi in zone con clima temperato di una famiglia prettamente tropicale. La rarefazione in alcune zone è dovuto alla degradazione degli habitat, anche se è ancora molto numerosa su tutto il suo areale.
La raganella europea (Hyla arborea Linnaeus, 1758) è un anfibio dell'ordine degli Anuri, diffuso in Europa e Asia.
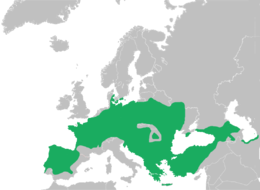
Paprastoji medvarlė, europinė medvarlė, medvarlė (lot. Hyla arborea, angl. European tree frog, vok. Europäischer Laubfrosch) – medvarlinių (Hylidae) šeimos varliagyvis. Kūnas 3-4,5 (5) cm, svoris 3,5-7 g. Gyvena netoli vandens krūmuose ir medžiuose tarp lapų. Aktyvi prieblandoje. Minta vabzdžiais bei kitais bestuburiais.[1]
Lietuvoje labai reta rūšis, nes Lietuva yra šiaurinėje jos paplitimo dalyje, tad daugiau natūraliai paplitusi pietinėje šalies dalyje, kur žinomos kelios nerštavietės. Gyvena Nemuno baseino upelių slėniuose. Aptinkamos pamiškėse, krūmuotose pievose, sodybose. Neršia nedidelėse kūdrose.
Saugoma Berno konvencijos – II kategorija. Rūšis įrašyta į Lietuvos raudonąją knygą.
Paprastųjų medvarlių gyvenamas biotopas prie Elbės
Paprastosios medvarlės ant varnalėšos lapo
Paprastoji medvarlė, europinė medvarlė, medvarlė (lot. Hyla arborea, angl. European tree frog, vok. Europäischer Laubfrosch) – medvarlinių (Hylidae) šeimos varliagyvis. Kūnas 3-4,5 (5) cm, svoris 3,5-7 g. Gyvena netoli vandens krūmuose ir medžiuose tarp lapų. Aktyvi prieblandoje. Minta vabzdžiais bei kitais bestuburiais.
Lietuvoje labai reta rūšis, nes Lietuva yra šiaurinėje jos paplitimo dalyje, tad daugiau natūraliai paplitusi pietinėje šalies dalyje, kur žinomos kelios nerštavietės. Gyvena Nemuno baseino upelių slėniuose. Aptinkamos pamiškėse, krūmuotose pievose, sodybose. Neršia nedidelėse kūdrose.
Saugoma Berno konvencijos – II kategorija. Rūšis įrašyta į Lietuvos raudonąją knygą.
Eiropas kokvarde, parastā kokvarde jeb vienkārši kokvarde (Hyla arborea) ir neliela auguma kokvaržu dzimtas (Hylidae) suga, kas sastopama Eiropā un Āzijas rietumos.[2] Nesenā pagātnē kokvardei tika sistematizētas daudzas pasugas, kuras, līdz ar ģenētisko pētījumu jaunākajiem atklājumiem, 2005. gadā veicot ģints sistemātikas revīziju, izdalītas kā jaunas sugas.[3]
Kokvarde izplatīta lielākajā daļā Eiropas, sakot ar Atlantijas okeāna krastu rietumos, Portugāli rietumdienvidos, pāri Rietumeiropai, Centrāleiropai un Austrumeiropai, virzienā uz dienvidaustrumiem pāri Kaukāzam sasniedzot Kaspijas jūru. Ziemeļu robeža stiepjas caur Zviedrijas dienvidiem, Lietuvas dienvidiem, Baltkrievijas rietumdienvidiem, ziemeļaustrumos sasniedzot Krievijas un Ukrainas pierobežas teritorijas.[2] Dienvidu robeža Vidusjūru sasniedz tikai Balkānu pussalā un Turcijā. Kokvarde ir introducēta Lielbritānijā[4] un reintroducēta Latvijā.[5]
Dzīvo labi apgaismotos platlapju un jauktos mežos, krūmājos, dārzos, parkos, ezeru un upju krastos. Var būt sastopama arī apdzīvotās vietās. Izvairās no tumšiem un bieziem mežiem. Pļavās lielākoties mēdz uzturēties vairošanās laikā. Dzīves lielāko daļu pavada lapotnē. Vairojas stāvošas ūdenstilpēs — ezeros, dīķos. Ziemo meža zemsedzē, alās, dobumos, starp akmeņiem.[6]
Pastāv uzskats, ka Latvijā kokvarde ir bijusi reti sastopama suga jau kopš 1777. gada. Tomēr ticamas ziņas par sugas novērošanu ir arī no 19. gadsimta un 20. gadsimta pirmās puses. Populācijas skaita samazināšanos sekmēja intensīva lauksaimniecības zemju ierīkošana un bebru pilnīga iznīcināšana 19. gadsimtā, kuri ar savu darbību nodrošināja kokvaržu nārstam un dzīvei piemērotu vidi — seklus un lekna augāja ieskautus dīķus.[5] Latvijas kokvaržu populācijas saskaldīšana vairākās izolētās, nelielās grupās noveda pie tā, ka tās nespēja pretoties nelabvēlīgajiem vides faktoriem un suga uz kādu laiku valsts teritorijā bija izzudusi.
Kopš 1987. gada Rīgas Zooloģiskā dārza Ekoloģijas laboratorija veic kokvardes reintrodukciju Latvijā. Kopš 1990. gada mākslīgi izveidotā kokvardes populācija Liepājas rajonā ir nostabilizējusies un sākusi dabīgā ceļā paplašināt savu izplatības teritoriju. Reintrodukcijas vietā nodibināts liegums.[5] Parastā kokvarde ir iekļauta Latvijas un Baltijas Sarkanajās grāmatās, kā arī Eiropas apdraudēto abinieku un rāpuļu sarakstā.[7]
Kokvarde ir neliela auguma varde ar slaidām, spēcīgām pakaļkājām un koši zaļu muguru, kas atkarībā no temperatūras un mitruma daudzuma vai pat vardes pašsajūtas var būt arī pelēcīga vai zeltaina.[4] Tās ķermeņa garums ir apmēram 3,5 — 5 cm,[5] Vēderpuse gaiša, bez plankumiem. Uz muguras āda ir gluda, bet uz vēdera grubuļota.[4] Gaišo pavēderi un zaļo muguru nodala tumši brūna sānu josla ar gaišu augšējo maliņu. Tumšā josla sākas pie nāss un beidzas pie pakaļkājas paslēpenes. Pirkstu galos ir piesūcekņi, ar kuru palīdzību dzīvnieks spēj pārvietoties pa zariem un lapām. Galva noapaļota, acu zīlītes horizontālas elipses. Tēviņš nedaudz mazāks, ar tumšu kaklu. Iekšējais rezonators labi attīstīts, dzied visu nārsta periodu. Dziesma mazliet atgādina pīļu pēkšķēšanu vai tarkšķēšanu.[7] Kopkvarde spēj veikt negaidītus, tālus lēcienus.
Kokvarde pārtiek galvenokārt no lidojošiem kukaiņiem, bet ēd arī kāpurus, skudras un vaboles. Tā ir aktīva krēslā un tumsā, arī nārsta dziedāšana sākas pievakarē. Pa dienu parasti slēpjas lapotnē vai zemsedzē. Ziemošanas periods sākas septembra beigās — oktobrī; ziemo zemsedzē, alās, dobumos.[7]
Eiropas kokvardes vairojas staignās ūdenstilpnēs, dīķos, kuru krasti aizauguši ar krūmiem un kārkliem. Latvijā vispiemērotākie biotopi nārstošanai ir bebraines. Mātītes iznērš aptuveni 800—1000 olas, kuri parasti sakārtoti apaļos, gļotainos kamolos. Šīs “pikas” ir valrieksta lielumā un izvietotas ūdenstilpes dibenā. Vienas olas vidējais izmērs ir aptuveni 1,5 mm diametrā. Kurkuļi izšķiļas pēc 10—14 dienām. Tie ir gaiši, sasniedz 5 cm garumu. Metamorfoze notiek pēc 2 — 3 mēnešiem, un jaunās vardītes ūdenstilpi parasti atstāj jūlija beigās — augustā. To izmērs ir 0,9 — 1,8 cm. Dzimumgatavība iestājas dzīves otrajā vai trešajā gadā. Indivīds spēj dzīvot līdz 15 gadiem. [8]
Eiropas kokvarde, parastā kokvarde jeb vienkārši kokvarde (Hyla arborea) ir neliela auguma kokvaržu dzimtas (Hylidae) suga, kas sastopama Eiropā un Āzijas rietumos. Nesenā pagātnē kokvardei tika sistematizētas daudzas pasugas, kuras, līdz ar ģenētisko pētījumu jaunākajiem atklājumiem, 2005. gadā veicot ģints sistemātikas revīziju, izdalītas kā jaunas sugas.
De boomkikker of Europese boomkikker (Hyla arborea) is een kikker uit de familie boomkikkers (Hylidae).
De boomkikker komt voor in een groot deel van Europa en is de enige soort uit de familie boomkikkers die voorkomt in België en Nederland. De kikker leeft op open zonbeschenen plekken in relatief dicht begroeide en vrij vochtige biotopen in de buurt van water. Het is een boombewonende soort die zich ophoudt tussen het gebladerte. Het voedsel bestaat uit verschillende ongewervelden zoals insecten en de kikker heeft diverse vijanden zoals vogels en zoogdieren. De boomkikker wordt in een deel van zijn verspreidingsgebied bedreigd door uiteenlopende menselijke activiteiten.
De lichaamslengte is ongeveer 4 tot 5 centimeter, de boomkikker is van alle West-Europese kikkers te onderscheiden door de egale lichtgroene kleur op de rug en de relatief gladde huid zonder wratten zoals padden of langwerpige klierlijsten op de rug zoals veel echte kikkers. De boomkikker is tevens de enige soort in de Benelux waarvan de vingers en tenen hechtschijven dragen.[2]
De boomkikker komt voor in het grootste deel van centraal Europa. De kikker ontbreekt in Scandinavië, op een uiterst zuidelijk puntje van Zweden na. Ook in zuidwestelijk Frankrijk en het grootste deel van Spanje komt de soort niet voor. Hier leeft wel de Mediterrane boomkikker. De populaties op de eilanden Corsica, Elba, Sardinië en Capri in de Middellandse Zee worden tegenwoordig tot een aparte soort gerekend: de Sardijnse boomkikker (Hyla sarda).
De boomkikker komt in de volgende landen voor: Albanië, Armenië, Azerbeidzjan, Wit-Rusland, België, Bosnië en Herzegovina, Bulgarije, Denemarken, Duitsland, Frankrijk, Georgië, Griekenland, Groot-Brittannië, Hongarije, Kroatië, Israël, Italië, Letland, Liechtenstein, Litouwen, Luxemburg, Moldavië, Montenegro, Nederland, Oekraïne, Oostenrijk, Polen, Portugal, Roemenië, Rusland, Servië, Slowakije, Slovenië, Spanje, Tsjechië, Zweden, Zwitserland en Turkije. Mogelijk zijn er populaties in het noorden van Iran, maar dit is niet geheel zeker.
In Letland was de soort uitgestorven, maar komt deze weer voor na herintroductie van exemplaren uit Wit-Rusland en exemplaren die zijn opgekweekt in de dierentuin van Riga.[1]
De boomkikker is geïntroduceerd in Groot-Brittannië en kwam hier van nature niet voor.[3] Een populatie in New Forest is waarschijnlijk uitgestorven doordat alle exemplaren zijn weggevangen door verzamelaars.[4]
In België zijn de populaties meer versnipperd, de boomkikker ontbreekt bijvoorbeeld in het noordwesten. Recente waarnemingen van de boomkikker komen vooral uit de omgeving van Limburg. Rond het jaar 2000 lag het aantal roepende mannetjes op een honderdtal, maar door soortgerichte maatregelen is dit in 2013 weer aangegroeid tot een duizendtal.[5]
In Nederland is deze soort zeldzaam. Versnipperde populaties komen voor in het zuiden en oosten in de provincies Limburg, Noord-Brabant, Zeeuws-Vlaanderen; de Achterhoek in Gelderland heeft de grootste populatie van het land, doorlopend in de populatie in Oost-Twente in Overijssel. In Drenthe waren enkele kleinere populaties in 2007 nog aanwezig. Deze zijn echter tot op een na vrijwel uitgestorven. De Reestdalpopulatie overleeft door strenge bescherming, intensief beheer en herintroductie. In sommige natuurgebieden zijn de kikkers uitgezet, zoals rond Valkenswaard, de Amsterdamse Waterleidingduinen (AWD), Zuid-Hollands Duingebied en Utrecht. Soms worden boomkikkers vanuit Zuid-Europa (die niet genetisch hetzelfde zijn als de Nederlandse) meegenomen naar Nederland en kunnen een kleine populatie vormen. Dit is het geval met de populaties rond Eindhoven en de uit Kroatië afkomstige populaties in Schouwen.[6]
De natuurlijke biotoop bestaat uit jonge en natuurlijke poelen in laaglandriviersystemen. De boomkikker is echter niet kieskeurig en heeft in kleinschalig agrarisch landschap, met veel hagen en veedrinkpoelen, een vervangende biotoop gevonden. Favoriet zijn wateren met aangrenzende struik-achtige begroeiing, maar ook in tuinen, parken, houtwallen, weilanden en bosranden kan de kikker worden aangetroffen. Er is een voorkeur voor bepaalde planten zoals aardbei, gele lis, hondsroos, hop, ridderzuring, rode bes en wilde kamperfoelie.[7]
De eitjes worden afgezet in de kleinste poeltjes, zoals met water gevulde wiel- en rupsbandsporen op bouwterreinen. Er zijn wel enkele voorwaarden; zo mag het water niet stromen en moet het water in een open plek liggen die goed door de zon wordt beschenen.[3] Grootbladerige struiken en bomen zijn gewenst, maar de poelen mogen niet geheel door bomen worden omgeven; het water moet door de zon worden beschenen. De larven kunnen zich niet ontwikkelen bij een watertemperatuur lager dan 15 °C.[8] Ook dient het water visvrij te zijn, omdat anders de eitjes en larven worden opgegeten. Waterplanten die een voorkeur hebben zijn riet en lisdodde.[9]
De boomkikker is een typische bewoner van laaglanden en heuvellanden. De soort komt bij uitzondering ook voor op grote hoogte, zoals in Bulgarije, waar hij is aangetroffen op een hoogte van 2300 meter boven zeeniveau.[1]
De boomkikker wordt ongeveer 3 tot 4 centimeter lang, de vrouwtjes worden gemiddeld iets groter dan de mannetjes tot 4,5 cm[10] en bereiken in uitzonderlijke gevallen 5 cm.[11] De huid is glad aan de bovenzijde maar korrelig op de buik, de trommelvliezen aan weerszijden van de kop zijn duidelijk zichtbaar door de bruine kleur, de iris is geel tot oranje van kleur en heeft een enigszins elliptische horizontale pupil. De gepaarde gifklieren achter de ogen worden parotoïden genoemd en zijn niet sterk vergroot. De kikker heeft zogenaamde vomerine tanden; tandachtige structuren in het verhemelte van de bek.[3]
De boomkikker draagt hechtschijven aan de uiteinden van de vingers en de tenen. Dit zijn kleine schijfvormige structuren die qua vorm doen denken aan zuignappen maar een wezenlijk andere werking hebben. Net als andere kikkers hebben de hechtschijven een fijne structuur met zeer kleine kanaaltjes, waarin bij het neerzetten van de hechtschijf vocht wordt gedreven waardoor de kikker blijft plakken, zie ook onder kikkers. Bij het klimmen speelt ook de buikzijde een rol, door het slijmlaagje van de huid blijft de kikker beter plakken.
Een typisch kenmerk van de boomkikker is de heldere, groene kleur en het ontbreken van vlekken of strepen op de rug. De kleur is meestal lichtgroen, maar kan ook groengrijs tot geelbruin of bruin zijn, afhankelijk van de temperatuur en de gemoedstoestand van de kikker. Het veranderen van kleur heeft niets met het aanpassen aan de ondergrond te maken. Indien gestrest (bijvoorbeeld bij hantering) wordt de kleur donkerder tot donkergroen of -bruin. Ook kunnen vlekken ontstaan op de rug.
Heel soms komen blauwe exemplaren voor. Deze zijn echter niet van kleur veranderd maar hebben een tekort aan een gele kleurstof in de huid. Omdat het gele pigment samen met blauw pigment de groene kleur veroorzaakt, kleurt de kikker blauw bij een tekort aan de gele kleurstof.[9] Dit komt soms ook voor bij andere soorten zoals de bastaardkikker (Rana esculenta).
De buikzijde is wit tot grijs van kleur, de overgang tussen buik en rug wordt gemarkeerd door een donkerbruine streep onderaan de flanken die begint aan het neusgat vooraan de kop en doorloopt door het oog en trommelvlies en via de achterpoten reikt tot de lies, onder de rechter achterpoot. Deze streep is wit- tot geel-omrand aan de bovenzijde en heeft een voor deze soort kenmerkende uitstulping bij de lies die wat naar voren gekromd is. De poten zijn van boven groen en van onderen geelachtig tot roze van kleur, vooral de tenen. Ook hier is de boven- en onderzijde gescheiden door een duidelijk donkere lijn.
Mannetjes zijn van de vrouwtjes te onderscheiden aan hun kwaakblaas; alleen de mannetjes kwaken. De keel van de mannetjes is ook te herkennen als er niet gekwaakt wordt omdat de huid hier een donkere, geelbruine tot grijze kleur heeft, evenals een geplooid oppervlak. De keel van de vrouwtjes is glad en lichter van kleur.[3] Mannetjes blijven daarnaast wat kleiner al is dit in het veld moeilijk te zien.
De kikkervisjes zijn van andere soorten te onderscheiden aan de bovenste staartzoom die doorloopt tot boven de ogen. De larven kleuren gedurende hun ontwikkeling olijfgroen waaraan ze makkelijk te herkennen zijn. Bijna volgroeide exemplaren kleuren ten slotte grasgroen, net als de ouderdieren. Het mondveld van de larve heeft drie ononderbroken onderste tandenrijen en twee bovenste tandenrijen, waarvan de onderste rij kort is onderbroken in vergelijking met bijvoorbeeld de Mediterrane boomkikker. De larven zijn als ze uit hun ei kruipen zo'n 3 tot 5 millimeter lang en worden uiteindelijk 50 mm, na de metamorfose zijn de juvenielen ongeveer 12 tot 21 mm.[8] Zie voor een beschrijving van de ontwikkeling van de kikkervisjes het kopje voortplanting.
Sardijnse boomkikker (Hyla sarda) van Corsica, Elba, Sardinië en Capri. De liesstreep gaat naar achteren toe over in een vlekkerige streep, soms komen rugvlekken voor. Daarnaast is de huid korreliger van structuur.
De meeste andere Hyla- soorten leven buiten Europa in Noord- en Zuid-Amerika en Azië. Van de meeste Europese kikkers is de soort makkelijk te onderscheiden. Het onderscheid met andere boomkikkers die in Europa leven is niet zo eenvoudig maar deze soorten hebben meestal een beperkt verspreidingsgebied. Omdat de verspreiding van verschillende soorten kikkers in Europa goed is onderzocht, is in het veld meestal geen verwarring mogelijk. De verschillende Europese soorten zijn:
Ook met andere boomkikkers buiten Europa is de boomkikker vaak te onderscheiden aan de gekromde vlek op de lies. Geslachten met soorten die ook een groene kleur hebben en een gladde huid zijn bijvoorbeeld Phyllomedusa uit Noord-Amerika en Litoria uit Australië. Zie voor afbeeldingen van gelijkende soorten ook onder afbeeldingen.
De boomkikker dankt zijn naam aan de overwegend klimmende levenswijze, de kikker wordt meestal gevonden in lage struiken in de directe nabijheid van water, maar kan ook in bomen worden aangetroffen tot een hoogte van tien meter. Met name de mannetjes bevinden zich in de paartijd 's nachts vaak in het water of op de bodem terwijl de vrouwtjes zich meestal in de bomen bevinden.
De boomkikker houdt zich meestal op in planten in de buurt van het water en wordt maximaal enkele honderden meters van het voortplantingsbiotoop aangetroffen. Van een uit Nederland afkomstig exemplaar is echter bekend dat hij een afstand van 12,6 kilometer kan afleggen binnen één jaar.[8]
Net als alle amfibieën is de kikker koudbloedig, meer specifiek ectotherm, en zit het grootste deel van de dag doodstil op een tak of blad om zo veel mogelijk energie te sparen. 's Nachts, als er gefoerageerd wordt op zoek naar voedsel, is de kikker actief. De nachtelijke levenswijze van de meeste kikkers en padden dient voornamelijk om uitdroging te voorkomen; bij de boomkikker is dit echter niet het geval. Boomkikkers zonnen veel en verstoppen zich niet, maar vertrouwen op de camouflage. Alleen op hete dagen wordt de schaduw opgezocht. Tijdens het nemen van een zonnebad slaapt de kikker en worden de ogen gesloten. Het lichaam is door de gesloten ogen, die geel tot oranje van kleur zijn, ook minder goed zichtbaar voor vijanden. De poten worden zo dicht mogelijk tegen het lichaam gehouden om waterverlies door verdamping te beperken.
Tussen augustus en oktober daalt de temperatuur in het grootste deel van het verspreidingsgebied sterk. In de winter is het te koud om actief te zijn en zoekt de boomkikker een schuilplaats op om de winterslaap in door te brengen. Het winterkwartier bestaat uit holle bomen, holtes tussen boomwortels, in de strooisellaag en in houtstapels.[11] Waarschijnlijk kan de kikker niet onder water overwinteren, zoals andere Europese kikkers wel kunnen. Boomkikkers die rond de Middellandse Zee leven slaan de winterslaap regelmatig over.
De boomkikker plant zich voort van april tot juli. De mannetjes begeven zich gedurende deze tijd meer op de bodem en in het water terwijl ze op een vrouwtje wachten. Ze kwaken hierbij luidruchtig, het geluid draagt ver en zou omschreven kunnen worden als een krék-krék-krék-krék-achtig geluid. Het kan tot op een kilometer afstand gehoord worden. De mannetjes kwaken niet door elkaar heen, maar stemmen het geluid op elkaar af zodat ze beter te horen zijn. Ze zitten altijd minstens 30 tot 40 centimeter uit elkaar, als twee mannetjes elkaar te dicht naderen wordt een ratelend geluid geproduceerd om de naderende soortgenoot op afstand te houden.[9]
De kwaakblaas kan zeer ver worden uitgerekt en is dan bijna zo groot als de kikker zelf en quasi-doorzichtig.[9] De boomkikker heeft alleen een kwaakblaas onder de keel, en geen wangblazen zoals veel groene kikkers (Peleophylax). Ook buiten de paartijd laten de kikkers van zich horen, dit wordt soms gestimuleerd door overvliegende vliegtuigen, regenval en ook het nabootsen van de roep kan de kikkers van zich laten doen horen.
Sommige mannetjes zijn zogenaamde satelliet-mannetjes; ze kwaken niet, maar proberen een door een kwakend mannetje gelokt vrouwelijk exemplaar te bespringen. Een satelliet-mannetje hoeft hierdoor geen energie te steken in het zoeken naar een vrouwtje of het maken van geluiden.[8]
Kwakende mannetjes zitten meestal in of dicht bij het water. Zodra een vrouwtje geïnteresseerd is, kan direct de paring en afzet van de eieren plaatsvinden. Wanneer zich in of langs het water bevinden de boomkikkers bijvoorbeeld voor monitoringsdoeleinden geteld worden, lijkt het alsof er veel meer mannetjes dan vrouwtjes zijn. Dit komt doordat de mannetjes zich gedurende langere tijd in het water begeven, ongeveer een maand, terwijl de vrouwtjes slechts één keer het water betreden voor de ei-afzet en daarna hun landbiotoop opzoeken.[12] Om de populaties van de kikker in kaart te brengen wordt vooral gezocht naar larven, eiklompjes en pas gemetamorfoseerde dieren[13] Jongere boomkikkers blijven dicht bij de bodem, waardoor ze beter te zien zijn dan de volwassen exemplaren.[8]
Als een vrouwtje geïnteresseerd is, vindt de paring plaats. Hierbij klemt het mannetje zich met de voorpoten vast onder de oksels van het vrouwtje, wat een amplexus axillaris wordt genoemd. Pas nadat het vrouwtje de eitjes heeft afgezet en het mannetje deze heeft bevrucht laat de man weer los.
Het vrouwtje produceert zo'n 200 tot 1400 eitjes, die in kleine klompjes worden afgezet in het water. Ze produceert maximaal 50 klompjes per nacht die ongeveer zo groot zijn als een walnoot en ongeveer 3 tot 50 eitjes bevatten,[3] zelden meer tot 100.[8] De eitjes zijn lichtbruin aan de bovenzijde en witgeel aan de onderzijde; de vrucht ontwikkelt zich snel en de embryonale ontwikkeling kan al na drie dagen worden voltooid, waarna de larven uit de eieren kruipen.
De ontwikkeling van de kikkervisjes is sterk afhankelijk van de watertemperatuur, beneden 15 graden kunnen ze zich niet ontwikkelen, bij een temperatuur van 17 graden vindt de metamorfose plaats na 11 weken, bij een temperatuur van 20 graden na ongeveer 7 weken.
Het mannetje is vaak na de eerste overwintering al volwassen, bij vrouwtjes duurt dit meestal twee jaar. De boomkikker kan in gevangenschap 15 jaar oud worden, maar in de natuur wordt een dergelijke leeftijd door natuurlijk verval en predatie nooit bereikt.
Het voedsel bestaat uit allerlei insecten, meestal tweevleugeligen of andere vliegende insecten zoals kevers en wantsen, die met de lange tong worden gevangen of worden besprongen. Vooral vliegende insecten worden gegrepen, waarschijnlijk vanwege het lenige lichaam van de boomkikker, het vermogen om zich vast te hechten na een sprong en de stevige achterpoten waarmee een relatief grote sprong kan worden gemaakt. Meestal steekt de boomkikker zijn tong naar de prooi uit en maakt hij tegelijkertijd een happende beweging met zijn bek, terwijl hij zich daarbij voorwaarts beweegt.
Uit een onderzoek naar de voedselgewoonten van exemplaren uit de omgeving van Bazel (Zwitserland) bleek dat de mannetjes in de paartijd, als ze zich meer op de bodem bevinden, voornamelijk leven van kevers, spinnen en vliesvleugeligen. Buiten de paartijd bleken volwassen exemplaren vooral te jagen op oorwormen, wantsen en vliegen en muggen. De juveniele exemplaren bleken vooral vliesvleugeligen, vliegen en muggen en wantsen te eten.[8] Uit onderzoek naar de maaginhoud van larven uit een populatie in noordelijk Italië bleek dat vrijwel alle exemplaren (99%) algen in de maag hadden, 53% had delen van planten opgenomen en in 21% van de gevallen bleek de maag detritus te bevatten.[8]
Vijanden van de boomkikker zijn vooral vogels. Voorbeelden van Nederlandse vogels die graag boomkikkers eten zijn de blauwe reiger, bosuil, grote trap, grauwe klauwier, kerkuil, kleine zilverreiger, kokmeeuw, roodpootvalk en de wespendief.[8] Ook verschillende slangen eten boomkikkers en ook andere - grotere - kikkers lusten graag een boomkikker als ze de kans krijgen. In het water kan de kikker worden belaagd door verschillende roofvissen zoals de snoek. Bij hantering produceert de kikker meer slijm zodat de huid glibberig wordt, daarnaast worden piepende geluiden gemaakt.
De larven van de boomkikker worden vooral gegeten door waterinsecten zoals de larven van libellen, larven en volwassen geelgerande watertorren en bootsmannetjes. Ook grotere kikkervisjes van andere soorten eten boomkikkerlarven, zoals de larven van de knoflookpad.[8] Daarnaast zijn grote vissen zoals karpers een gevaar voor de larven. Enkele exotische vissen die zich in Europa hebben verspreid eten grote hoeveelheden larven, zoals de zonnebaars.[6]
Larve van de blauwe glazenmaker, een libel
De boomkikker werd in vroeger tijden vaak als barometer gehouden omdat de kikker zou reageren op verschillen in vochtigheid en luchtdruk. Zo zou de kikker gaan kwaken bij naderende regen, maar ook omhoog en omlaag klimmen bij atmosferische drukveranderingen. Dit is echter achterhaald, de kleur hangt weliswaar voor een deel af van de omgevingstemperatuur maar ook de gemoedstoestand van de kikker is van invloed. Daarnaast kwaakt de kikker ook wel overdag bij zonnig weer.
Met de naar verhouding brede kop, grote ogen en geprononceerde 'grijphanden' doet de kikker aandoenlijk aan. Het is een populaire soort die wordt beschouwd als erg decoratief en wereldwijd wordt verspreid door de handel in exotische dieren.
De boomkikker is in zijn areaal geen bedreigde diersoort. Door de International Union for Conservation of Nature and Natural Resources (IUCN) wordt de kikker als niet bedreigd (Least Concern) beschouwd. Internationaal wordt de soort beschermd door de Conventie van Bern en de Vogel- en Habitatrichtlijn.
In België is de kikker plaatselijk algemeen, in Nederland echter is de soort zeldzaam. Enkele decennia geleden bleek het aantal exemplaren met 80% gedaald en de soort verdween in delen van het verspreidingsgebied. In Groningen is de soort waarschijnlijk al in de 19e eeuw uitgestorven.[12] Van de zes provincies waar de kikker voorkomt heeft Drenthe het kleinste verspreidingsgebied, de boomkikker komt hier maar op één plaats voor. In Noord-Brabant is de soort op drie plaatsen te vinden: Molenschotse Heide, Leemkuilen en De Brand.[12] In veel leefgebieden zijn populaties opnieuw geïntroduceerd, in de Achterhoek en Twente zijn maatregelen genomen om de populaties gezonder te maken door houtwallen en poelen te herstellen. Een populatie in de Dautenvijvers van Diepenbeek veroorzaakte in 2008 opschudding bij omwonenden omdat Natuurpunt bij verkoop van aanpalende gronden een voorkooprecht kan uitoefenen. Diepenbeek heeft immers de boomkikker geadopteerd als diersoort in de specifieke biotoop van de Wijers.
De boomkikker wordt vooral bedreigd door verzuring, verdroging, verstoring, verandering, versnippering, aantasting of vernietiging van de natuurlijke habitat. Ook het verlanden van vennen en watervervuiling (vermesting, pesticiden) en een te hoge visstand doen de kikker of de larven in aantal en verspreidingsgebied achteruitgaan. In sommige gebieden worden populaties bedreigd door het wegvangen van kikkers voor de handel in exotische dieren. Omdat de kikker zich vrijwel niet over de bodem verplaatst, is het aantal verkeersslachtoffers in vergelijking met andere amfibieën laag.
Een andere bedreiging is het door de mens onderhouden van het leefgebied zoals het maaien van het gras; waar de meeste kikkers zich tegen de bodem drukken en zo de messen ontwijken of weg springen voordat de maaier in de buurt is, vertrouwen boomkikkers op hun camouflage. Ze blijven stilzitten en worden zo vaak aan stukjes gehakt of met het maaisel verpakt en afgevoerd als compost.[7]
De boomkikker is door zijn exotische uiterlijk populair bij natuurbeschermingsorganisaties en wordt als icoon gebruikt voor diersoorten die bijna uitgestorven waren in Nederland, maar waar het tegenwoordig beter mee gaat. Natuurorganisaties en provincies werken regelmatig samen om exemplaren te (her)introduceren in gebieden. Het blijkt echter dat het uitzetten van exemplaren weinig effect heeft zolang de oorzaak van het verdwijnen van het amfibie nog niet is aangepakt. Daarnaast dient rekening gehouden te worden dat zowel de voortplantingshabitat als de landhabitat aangepakt moeten worden. Het zomaar uitzetten van exemplaren om de soort in stand te houden heeft daarnaast niet de voorkeur van Reptielen Amfibieën Vissen Onderzoek Nederland omdat het niet zo is dat we een vat kikkers opentrekken en het goed komt.[14]
De kikker wordt in Nederland beschermd door de Flora- en faunawet en staat op de rode lijst en heeft als beschermingsstatus 'bedreigd'. Bijna de helft van de leefgebieden van de boomkikker is eigendom van particulieren, nog geen kwart van het verspreidingsgebied is in bezit van staatsbosbeheer.
De stichting Reptielen, Amfibieën en Vissen Onderzoek Nederland (RAVON) heeft in 2001 in opdracht van het Ministerie van Landbouw, Natuur en Voedselkwaliteit het soortbeschermingsplan boomkikker (2001 - 2005) opgesteld. Op alle locaties waar de boomkikker voorkomt worden nu de bestaande populaties beschermd, vervolgens worden ze uitgebreid en aangesterkt door natuurbeheer, en ten slotte worden deze populaties verbonden zodat genetische uitwisseling mogelijk is.
De boomkikker wordt ook wel gewone boomkikker genoemd omdat het in Nederland en België de enige vertegenwoordiger is van de familie van de boomkikkers (Hylidae). De soort wordt ook wel Europese boomkikker genoemd maar deze naam is enigszins misleidend omdat dit niet de enige boomkikkersoort is die in Europa voorkomt.
De Nederlandse naam boomkikker is terug te voeren op de levenswijze van het dier, en de naam wordt al lang gebruikt. Vroeger werd de soort wel aangeduid met boomkikvors of boomkikvorsch. De Nederlandse naam is analoog aan het Engelse Tree Frog en het Duitse Laubfrosch. In het aan het Nederlands gerelateerde Plattdüütsch wordt de kikker hasselpogg genoemd.
De boomkikker kreeg in 1758 de wetenschappelijke naam Rana arborea van Carl Linnaeus. In 1817 plaatste Georges Cuvier de soort in het geslacht Hyla. De wetenschappelijke naam Hyla arborea verwijst naar de levenswijze; Hyla betekent 'kwaken' en arborea betekent 'in bomen levend'.[15] De boomkikker werd lange tijd verdeeld in drie verschillende ondersoorten, die tegenwoordig niet meer worden onderscheiden. Deze voormalige ondersoorten zijn:
Er zijn meerdere synoniemen:[2]
Referenties
De boomkikker of Europese boomkikker (Hyla arborea) is een kikker uit de familie boomkikkers (Hylidae).
De boomkikker komt voor in een groot deel van Europa en is de enige soort uit de familie boomkikkers die voorkomt in België en Nederland. De kikker leeft op open zonbeschenen plekken in relatief dicht begroeide en vrij vochtige biotopen in de buurt van water. Het is een boombewonende soort die zich ophoudt tussen het gebladerte. Het voedsel bestaat uit verschillende ongewervelden zoals insecten en de kikker heeft diverse vijanden zoals vogels en zoogdieren. De boomkikker wordt in een deel van zijn verspreidingsgebied bedreigd door uiteenlopende menselijke activiteiten.
De lichaamslengte is ongeveer 4 tot 5 centimeter, de boomkikker is van alle West-Europese kikkers te onderscheiden door de egale lichtgroene kleur op de rug en de relatief gladde huid zonder wratten zoals padden of langwerpige klierlijsten op de rug zoals veel echte kikkers. De boomkikker is tevens de enige soort in de Benelux waarvan de vingers en tenen hechtschijven dragen.
Rzekotka drzewna (Hyla arborea) – gatunek płaza z rodziny rzekotkowatych.
Osiąga około 5 cm długości. Cechuje się zwykle zielonym, szarym, brązowym lub żółtawym ubarwieniem, które potrafi zmieniać w zależności od otoczenia. Boki ciała rzekotki zdobi charakterystyczna ciemna pręga, odgrywająca obok rechotu rolę w doborze płciowym. Oczy są duże, wyłupiaste, kończyny tylne długie, opuszki palców wieńczą przylgi ułatwiające wspinaczkę po drzewach.
Płaz zamieszkuje większą część Europy, od Portugalii aż do krańców kontynentu i zachodniej Azji (Azerbejdżan), na północy sięga Danii. Preferuje niziny, ale istnieją doniesienia o spotkaniu go na wysokości 2300 m. Zajmuje różnorodne środowiska roślinne, zarówno lasy, tereny krzewiaste, jak i porośnięte niższą roślinnością. Rozmnaża się w różnorodnych zbiornikach wód stojących, w tym sztucznych. Żywi się drobnymi bezkręgowcami, głównie owadami (zwłaszcza chrząszcze) i pająkami. Menu zmienia się w zależności od miesiąca i roku. Zdarzają się w nim też jaja innych płazów.
W Europie Środkowej rozród zaczyna się w maju. Po ampleksusie samica składa żółtawe, otoczone galaretowatą osłonką jaja (skrzek), do 10 kłębów po 10–50 sztuk. Wylęgają się z nich żółtooliwkowe, pływające wolno kijanki, mierzące do 5 cm długości. Przeobrażają się po 90 dniach na przełomie lipca i sierpnia lub też dopiero w następnym roku. Zwierzę bywa hodowane w terrariach. W Europie Zachodniej jego liczebność obniża się, co ma związek ze zmianami w środowisku spowodowanymi działalnością ludzką. W związku z tym rzekotka figuruje w wielu czerwonych listach i księgach, IUCN przyznaje jej status LC. Prowadzi się działania zmierzające do ochrony gatunku, chronią go również liczne prawodawstwa.
Rzekotka drzewna jest głównym członkiem Hyla arborea complex, grupy gatunków zamieszkujących Europę i Azję[2]. Używa się też terminu Hyla arborea group. Należy tu 16 gatunków[3], w tym wszystkie gatunki azjatyckie w liczbie 10. Europę, północ Afryki i Bliski Wschód zamieszkuje 5 gatunków[4]. Można wśród nich wymienić między innymi Hyla sarda, Hyla intermedia i rzekotkę śródziemnomorską[5].
Gatunki te zaliczają się do rodzaju Hyla, obejmującego jeszcze 3 inne grupy gatunków (cinerea, versicolor i eximia), co daje w sumie 31 gatunków zamieszkujących Holarktykę. Rodzaj należy z kolei do podrodziny Hylinae liczącej około 590 gatunków. Zalicza się ona do rodziny rzekotkowatych (Hylidae), jednej z największych rodzin płazów, obejmującej około 870 gatunków[3].
Pierwszy człon polskiej nazwy wziął się od rechotania samców. Drugi człon jej nazwy odwołuje się do zdolności wspinania się po drzewach[6].
Postulowano wyodrębnienie populacji zamieszkującej tereny od północnych stoków Alp do Sycylii z podgatunku nominatywnego H. arborea arborea do nowego gatunku Hyla italica, kierując się zróżnicowaniem loci genów kodujących białko[7], obecnie jednak takiego gatunku się nie wyróżnia[8], pojawiła się natomiast Hyla intermedia[9].
Do rodzaju włączano kiedyś Hyla arborea sarda, rzekotkę wyróżniającą się ziarnistą skórą zdobioną jasnymi i ciemnymi plamami, żyjącą na kilku wyspach Morza Śródziemnego[10]. Jednakże obecnie uważa się ją za oddzielny gatunek[11]. Podgatunek H. arborea kretenis bywa uważany za synonim H. arborea[3]. Podobnie Hyla intermedia bywała niekiedy utożsamiana z rzekotką drzewną. Pogląd ten wyznawała jeszcze Frost w 2004[4].
Kladogram z pacy Smith et al. z 2005[4], opierający się na analizie Bayesa dwóch genów mtDNA i dwóch jądrowych, uproszczony:
Hyla ebraccata, Hyla microcephala
Hyla melanomma, Hyla sumichrasti
Plectrohyla chrysopleura, Plectrohyla guatemalensis
Hyla miotympanum, Hyla miliaria
Hyla dendrophasma, Ptychohyla hypomycter
Hyla bromeliacia, Duellmanohyla soralia, Ptychohyla salvadorensis
Anotheca spinosa, Triprion petasatus
Pternohyla fodiens, Smilisca cyanosticta, Smilisca phaeota
Hyla annectans, Hyla chinensis
Hyla arborea, Hyla savignyi
Hyla andersoni, Hyla femoralis, Hyla versicolor, Hyla avicoca, Hyla gratiosa
Hyla japonica, Hyla arenicolor, Hyla wrightorum, Hyla euphorbiacae, Hyla plicata
Stöck i współpracownicy zaproponowali w 2008 następujący kladogram powstały na bazie badań mtDNA[3] (uproszczono):
Hyla arborea
Hyla orientalis, Hyla gumilevskii, Hyla molleri
Drzewo z tej samej pracy, z wykorzystaniem genu RAG1[3], uproszczono:
Hyla savignyi (nowy takson)
Hyla arborea (Grecja, Chorwacja)
Hyla arborea (Niemcy, Francja, Szwajcaria)
Hyla orientalis, Hyla gumilevskii
Wynik badania zespołu Stöcka z 2011[12]
Hyla arborea
Wedle Smith i współpracowników (2005) oraz wcześniejszych prac Caroll (1988) czy Homana (1998) ostatni przodek europejskich rzekotkowatych, wśród których Smith et al. wyróżniają 5 gatunków, żył co najmniej 10 milionów lat temu, dokładniej w zakresie 10–23 miliony lat temu, co oznacza miocen dolny. Naukowcy przedstawili analizę Bayesa badań dwóch genów DNA mitochondrialnego (12S, ND1) oraz dwóch genów jądrowych (POMC, c-myc). Najmniej od rzekotki drzewnej różniła się Hyla savignyi (szacowany cały rozdział linii wynosi mniej, niż 10 milionów lat temu), w następnej dopiero kolejności rzekotka śródziemnomorska (około 20 milionów lat temu). Jeszcze wcześniej oddzieliła się linia prowadząca do Hyla annectans i Hyla chinensis, było to mniej niż 25 milionów lat temu[4].
Badania genetyczne opublikowane przez Stöcka i współpracowników w 2008 wykazały stopień pokrewieństwa pomiędzy gatunkami. Z badań mitochondrialnego DNA wynika, że najbliżsi krewni rzekotki drzewnej zaliczają się do kladu tworzonego przez Hyla intermedia (stanowiąca grupę siostrzaną kladu złożonego z pozostałych wymienionych) Hyla sarda, Hyla orientalis, Hyla gumilevskii, Hyla molleri. Inny rezultat dało badanie z użyciem genu RAG1 (politomia wielu gatunków). Naukowcy sądzą, że rozdzielenie się rzekotki drzewnej,Hyla orientalis, Hyla molleri, Hyla intermedia i Hyla sarda nastąpiło pod koniec kryzysu messyńskiego, po zatopieniu licznych regionów, co spowodowało rozdzielenie populacji. Wydarzyło się to około 5,3 miliona lat temu[3]. W kolejnym badaniu z 2011 w oparciu o sekwencje DNA mitochondrialnego i jądrowego, zespół tego samego autora pisze o podziałach sprzed 5,4–7,1 miliona lat. Czas podziału na podstawie badań cytochromu b oszacował on na 7,1 miliona lat temu (wczesny messyn), podczas gdy badanie intronów fibrynogenu alfa wskazuje na 5,4 miliona lat (późny messyn)[12].
Dawniej upatrywano przyczyn rozdzielenia się rzekotek drzewnej i śródziemnomorskiej w zlodowaceniu[13]. Badania te wykazują istnienie kladu złożonego z rzekotek drzewnych zamieszkujących Grecję, w tym Kretę, i Chorwację. Autorzy wyjaśniają to starym polimorfizmem genetycznym sięgającym wstecz plejstocenu, gdy rzekotki ostały się na Bałkanach. Uważają też, że jedna z linii prezentująca jeden z wariantów mtDNA rozprzestrzeniła się później[3]. Dufresnesa i współpracownicy jako refugia wymieniają południowe Bałkany i wybrzeże Adriatyku, trzecia linia po ostatnim maksimum glacjalnym rozprzestrzeniła się na Nizinie Pannońskiej. Populacje zamieszkujące północną i zachodnią część Europy są młodsze[14].
Chromosomy rzekotki, o czym świadczą porównania z plataną, są konserwatywne. Występuje ich 12 par. Dawniejsze chromosomy odpowiadające parom 4, 7 i 8 platany w linii rzekotek uległy podziałowi. Odwrotnie natomiast fragmenty 4A i 7A połączyły się u rzekotek w pojedynczy chromosom[15].
Częstość rekombinacji zależy od płci (cheterochiazmia) i od fragmentu chromosomu. O ile u samic tempo rekombinacji jest w miarę stałe, u samców ulegają jej zwłaszcza końcowe fragmenty chromosomów. Pomiędzy parami chromosomów w trakcie podziału mejotycznego najczęściej tworzą się zaledwie 2 chiazmy – po obu końcach chromosomów. Zmniejszona częstość rekombinacji u samców spełnia zasadę Haldane'a-Huxleya[15].
Płeć determinowana jest genetycznie. Hemizygotyczne są samce, co potwierdzono poprzez badania nieulegającego rekombinacji locus WHA 5-22A[5]. Chromosom płciowy przypomina chromosom 1 platany szponiastej. Brelsford et al w 2013 znaleźli 13 wspólnych markerów[16]. System determinacji płci u rzekotki drzewnej liczy sobie przynajmniej 5 milionów lat[15]. Występują chromosomy X i Y, bardzo podobne do siebie[12]. Świadczy to o tym, że w tym czasie musiały zachodzić rekombinacje, które zapobiegły degeneracji chromosomu Y[15], spowodowanej brakiem rekombinacji obserwowanym u ssaków[17]. Rzekotka drzewna odziedziczyła je po przodku wspólnym z Hyla intermedia. Badania zespołu Stöck dowodzą, że to właśnie zachodzące co jakiś czas rekombinacje, a nie epizody odwrócenia systemu determinacji płci utrzymały chromosom Y. W rezultacie chromosomy płci, które ewidentnie jawią się badaczom jako nowe (w momencie podziału linii rzekotki drzewnej, Hyla intermedia i Hyla molleri nie były one jeszcze zróżnicowane) noszą na sobie bardzo stare geny[12]. Za gen determinujący płeć uchodzi choćby Dmrt1[15]. Rekombinacja chromosomu Y zatrzymała się jeszcze przed powstaniem współczesnego gatunku. Wskazano kilka różnych niepodlegających rekombinacji haplotypów tego chromosomu[12]. Mimo licznych krzyżówek laboratoryjnych rekombinacji nie udawało się zaobserwować u samców. Zespołowi Dufresnesa udało się zaobserwować w ograniczonym zakresie i to głównie u płazów z południowych Bałkanów bądź wybrzeża Adriatyku. Populacje zamieszkujące refugium na Bałkanach cechują się częstszą rekombinacją chromosomów płciowych, niż rzekotki żyjące na północ i na zachód – w tych populacjach, młodszych od bałkańskich, nie występuje ona w ogóle. Populacja pannońskie wykazują w tym względzie cechy pośrednie[14].
Rzekotka drzewna dorasta do 5 cm długości[18][6], choć nieraz podaje się 3–4[19], do 5,2[10] czy 4–6 cm[20].W Portugalii średnia odległość pysk – kloaka wyniosła 37,7 mm, mieszcząc się w zakresie od 35 do 40 mm[21]. W Szwajcarii przystępujące do rozrodu osobniki mierzą 34,9 mm u samców oraz 36,4 mm u samic. Wedle badań greckich średnia odległość od pyska do kloaki wynosi 39,5 mm u samców (mieszcząc się w zakresie 32,2–45,8 mm) oraz 43,7 mm u samic (zakres 32,6–47,9 mm). Wyniki niemieckie, bazujące na pomiarach wykonywanych w okolicach Monachium, wskazują na większe rozmiary płazów, średnie wynoszą odpowiednio 43,2 oraz 44,5 mm. Korelacji długości ciała z szerokością geograficzną nie zauważa się[22].
Masa ciała wykazuje różnice w zależności od płci. Lżejsze samce ważą przeciętnie 8–9 g, cięższe od nich samice osiągają natomiast średnio 11 g, mogą jednak ważyć nawet 15 g[10]. W Portugalii masa przystępujących do godów zwierząt wyniosła średnio 4,41 g, wahając się od 3,6 do 5,6 g[21]. Czyni to rzekotkę niewielkim płazem[18], jednym z najmniejszych lądowych przedstawicieli tej gromady żyjących w Europie Zachodniej[20]. Rozmiarami przewyższa ją choćby jej krewna rzekotka śródziemnomorska[21]. Podczas trwającego dwa lata badania zawsze na przekroju paliczka w drugim roku znajdywano jeden spoczynkowy słój więcej, niż w poprzednim. Wskazuje to na roczny cykl wzrostu paliczków i potwierdza, że badanie kośćca stanowi najlepszą metodę oceny wieku płaza, podczas gdy poleganie na rozmiarach ciała nie jest wiarygodne. Dowiedziono w ten sposób, że rozmiary ciała korelują z wiekiem u osobników obu płci, jednak z wiekiem tempo wzrostu spada. Samce dwuletnie są mniejsze od liczących sobie przynajmniej trzy lata, trzyletnie zaś od co najmniej czteroletnich. Jednak te liczące 4, 5 lub 6 lat nie różnią się już znacząco. W przypadku samic już te trzyletnie nie wykazują znaczących statystycznie różnic ze starszymi. Z drugiej strony zaobserwowano, że jednoroczne samce z jednego roku mogą przewyższać wielkością dwuletnie samce z innego roku. Średni wiek i rozmiary samic są większe, niż u samców. Zależność pomiędzy wiekiem a rozmiarami ciała w przypadku rzekotki drzewnej przypomina te spotykane u innych bezogonowych[23].
Budowę ciała tego zwierzęcia określa się jako kształtną, wydłużoną. Skóra różni się w dotyku w zależności od regionu ciała. Podczas gdy na grzbiecie sprawia wrażenie gładkiej, delikatnej, lśniącej, na brzuchu i bokach ciała jest już chropowata[18]. Sprawia wrażenie błyszczącej, nie licząc osobników niedługo po opuszczeniu kryjówek zimowych[10]. Płaz wykazuje zmienność ubarwienia. Jego kolor zależy od pory roku, podłoża i wilgotności. Na grzbiecie przyjmuje zazwyczaj barwę zieloną, rzadziej spotyka się osobniki od ubarwionych jasnożółto do bardzo ciemnych[18]: brązowe, oliwkowozielone, ochrowe, czarniawe, a nawet niebieskie[10]. Zaobserwowano, że osobnik barwy intensywnie zielonej może w krótkim czasie stać się żółtawy, szary czy brązowawy[6]. Donosi się też o rzekotkach niemal czarnych czy niebieskich[19]. Po bokach ciała biegnie ciemna smuga rozpoczynająca się w okolicy nozdrzy, kończąca w biodrach[6], przebiegająca przez oko i błonę bębenkową wytwarzająca ponad udami ciemną, dużą zatokę[19] zwaną zatoką biodrową, dobrze widoczną w spoczynku[10]. Odgrywa ona rolę w doborze płciowym[24]. Stanowi ona cechę odróżniającą H. arborea od blisko spokrewnionego gatunku rzekotki śródziemnomorskiej. Brzuszna strona ciała przyjmuje kolor żółtawy[10], białawy czy białawoszary z zaznaczonym delikatnym groszkowaniem[19]. Ubarwienie ma charakter maskujący, siedząca na liściach czy gałązkach roślin rzekotka staje się prawie niewidoczna[6].
Wyróżniają się osobniki młode. W sierpniu i wrześniu, gdy usadawiają się wysoko na roślinności, barwi je opalizująca jasna zieleń, często współistniejąca ze złotawym połyskiem[10].
Rzekotka drzewna potrafi dostosować swe ubarwienie do koloru podłoża, zwłaszcza do jasności, w mniejszym stopniu innych parametrów jego barwy. Zdolnością tą i tak przewyższa swą krewną rzekotkę zieloną (choć w przeciwieństwie do niej nie osiąga barwy oliwkowożółtej)[25]. Najczęściej przyjmuje barwę zieloną, pozwalającą na ukrycie się wśród roślinności, jednakże nawet większość obserwowanych osobników może przyjmować inną barwę. Spotyka się np. osobniki czarne. Niekiedy w tym samym miejscu znaleźć można rzekotki drzewne kilku wariantów ubarwienia[26]. Zmiany ubarwienia warunkowane są strukturalnymi modyfikacjami chromatoforów. Płaz rozjaśnia swą szarą skórę poprzez agregację melanosomów. Podczas ciemnienia skóry odnotowano rozpraszanie się melanosomów melanoforów, otaczających irydofory, a częściowo także ksantofory. Te ostatnie również modyfikują swój kształt: z soczewkowatego na płytkowaty. Również one mogą migrować w głębsze warstwy skóry, a nawet ustawiać się poniżej irydoforów. Skóra przybiera wtedy barwę szarą. Zmiana koloru z zieleni na szarość nie odbywa się bezpośrednio, ale poprzez ciemną zieleń, oliwkową zieleń i w końcu ciemną szarość. W zależności od zmiany barwy irydofory zmieniają kształt z kubkowatego na stożkowaty czy cylindryczny dzięki mniej regularnemu rozłożeniu płytek, gdy staje się ona ciemniejsza, w skórze szarej przypominają zaś piłki z koncentrycznym, warstwowym rozkładem płytek[27]. Odnotowano, że zmiany irydoforów i ksantoforów przebiegają równolegle, melanoforów zaś niezależnie od nich[25]. Istnienie osobników niebieskich warunkuje nieobecność barwnika żółtego[10].
W porze godowej samiec demonstruje różnorodnie ubarwiony[24] nieparzysty worek rezonansowy. Kiedy nie jest rozdęty, widać na prawie całym podgardlu żółtobrązowy obszar, nieobecny u samicy[10]. Narząd ten zawdzięcza swe kolory karotenoidom. Barwniki te stanowią dla organizmu drogocenne substancje, dostarczane wraz z pożywieniem. Biorą udział choćby w obronie przed patogenami. Możliwość użycia ich jako sygnału płciowego stanowi więc oznakę dobrej kondycji samca[24].
U H. arborea arborea obserwowano skórne gruczoły surowicze produkujące jad merokrynowo, poprzez egzocytozę, podczas gdy w przypadku tego typu płazich gruczołach obserwowano wydzielanie holokrynowe. Pojawiają się one u kijanki na etapie kończyn tylnych, później drobne krople jadu skupiają się w większe, różnorodne. U osobników młodocianych pojedyncze porcje jadu trafiają do wąskiego światła gruczołu leżącego pod wstawkami, u dorosłych znaleziono tylko duże struktury złożone z mniejszych ziaren, tworzące powtarzający się wzór. Jad wyprodukowany został z udziałem siateczki śródplazmatycznej szorstkiej i aparatu Golgiego[28].
Od rzekotki śródziemnomorskiej rzekotkę drzewną odróżnia się po ciemnym pasie biegnącym aż do bioder, u H. meridionalis kończącym się u nasady ramienia (u osobników młodych mogą przechodzić na boki tułowia). Dodatkowo rzekotki śródziemnomorskie są nieco większe i często cechują się jaśniejszą zielenią grzbietu. Samce mają też podłużny fałd na worku rezonansowym, niespotykany u rzekotki drzewnej, na skutek którego rechot staje się głębszy i wolniejszy. Zapobiega to też krzyżowaniu się obu gatunków[29].
Hyla arborea ma duże, wyłupiaste oczy o złotawych tęczówkach[18]. Bezogonowe, posiadając dwa rodzaje pręcików, dysponują wzrokiem silnie wyczulonym na niewielką ilość światła. Wykorzystują go głównie podczas polowania[24].
Płuca tworzą połączone w siatkowatą strukturę fałdy od pierwszego do trzeciego rzędu. Wyściela je w większości pojedynczy rodzaj pneumocytów, a z wyjątkiem trzeciego także przez rozmieszczony w postaci nieregularnych kępek nabłonek urzęsiony. W cytoplazmie pneumocytów stwierdza się trzy rodzaje ciałek: lamelarne, gęste (z których tworzą się w przyszłości lamelarne) i wielopęcherzykowate (włączone w lamelarne). Nie występują w nim komórki kubkowe, w przeciwieństwie do kopulastych ciałek neuroepitelialnych rozlokowanych na jego obrzeżach. Pneumocyty wydzielają ciałka blaszkowate do przestrzeni wypełnionej przez powietrze, tubularne struktury mielinowe stanowią jednak rzadkość. Bariera pomiędzy krwią i powietrzem ma 0,6 μm grubości, tworzą ją nabłonek płuc, śródbłonek naczynia krwionośnego i przestrzeń śródmiąższowa[30].
Długie[19], niewiele dłuższe od ciała, sprawiające wrażenie delikatnych[10] kończyny dolne kończą się długimi palcami zaopatrzonymi buławkowatego kształtu przylgami[18], podobnie jak łapy przednie[19]. Mają one za zadanie umożliwić zwierzęciu przebywanie na gładkich liściach[18]. Za skoki odpowiada mięsień brzuchaty łydki[31].
Występuje dymorfizm płciowy. Podgardle samca jest ciemniejsze niż u samicy. Dysponuje on też wspomnianym już workiem rezonansowym dużej wielkości, umiejscowionym na podgardlu. Wydawany przez niego dźwięk określa się jako doniosły, wysoki, ciągły turkot. Wydaje się on donioślejszy niż odgłosy innych występujących w Polsce bezogonowych[18]. Prócz niego w okresie godowym osobnik płci męskiej rozwija również modzele na kciukach[10].
Na przełomie marca i kwietnia[10] lub też w kwietniu Hyla arborea wybudza się z letargu zimowego, by na początku maja przystąpić do rozrodu. W środowisku wodnym przebywa krótko. Wiedzie lądowy tryb życia[18]. Spotyka się ją od maja do września[6]. Zimę zwierzę to spędza zagrzebane w ziemi w sąsiedztwie zbiornika wodnego czy w wilgotnym zagłębieniu. Rzadziej zimuje w suchej glebie. Sen zimowy rozpoczyna z końcem września lub początkiem października[10].
Aktywność przypada na zmierzch i na noc[19]. Z drugiej strony podnosi się, że potrzebuje ona dużo słońca, co ma związek z tropikalnym pochodzeniem rzekotkowatych[10].
Rzekotka drzewna większą część swego życia spędza na roślinach. Wspina się zręcznie dzięki takim adaptacjom jak przylgi czepne na palcach czy płaski kształt ciała. Przylgi sprawiają, że lądująca Hyla potrafi utrzymać się w danym miejscu docelowym, jeśli przyczepi się doń tylko jedną przylgą. Dzięki spłaszczeniu ciała zaś bezogonowy potrafi przylgnąć brzuszną stroną ciała do powierzchni, na którą się wspina. W efekcie bardzo sprawnie idzie jej wspinaczka. Potrafi nawet poruszać się po pionowych powierzchniach[10]. Siedlisko rzekotki utrudnia badanie jej. W związku z tym specjaliści używają HDF (Harmonic Direction Finder), urządzenia służącego do lokalizacji noszącego je obiektu za pomocą mikrofali[32].
Budowa kończyn dolnych umożliwia zwierzęciu skoki[10].
Zamierając w bezruchu, przyjmuje okrągły kształt, z kończynami przyciśniętymi do tułowia. Zapewnia sobie kamuflaż, dostosowując barwę skóry do otoczenia[10].
Wydłużony[33][34] okres rozrodczy w Europie Środkowej zaczyna się na początku maja[18] (spotyka się też z informacjami, że jest to połowa kwietnia[19]), na przykład w południowych Niemczech chodzi o koniec kwietnia lub początek maja, koniec rozrodu następuje zaś na początku lipca[34], w Rumunii zaczyna się on w marcu, trwając do maja[33]. Rozród następuje więc później, niż u większości bezogonowych. W jednym z badań samice obserwowano w miejscu godów od 10 maja do 22–23 czerwca. Poszczególne osobniki wybierają z reguły z roku na rok ten sam zbiornik, zwykle wysychający w porze letniej w terminie zależnym od ilości opadów[23]. Migracje zdarzają się tylko, jeśli nowy staw oddalony jest od poprzedniego na mniej niż 320 m. W miejscu rozrodu samce przewyższają liczebnie samice, w 1990 i 1999 obliczono stosunek ich liczebności odpowiednio na 1,52:1 i 2,15:1[23].
Jedynie podczas okresu godowego płaz ten nie spędza czasu na roślinach. Za dnia płazy te przebywają na brzegu, zwłaszcza w czasie sprzyjającej pogody, wieczór zaś i noc spędzają w wodzie[10].
Samce rechoczą donośnie w pobliżu zbiorników wodnych w maju i w czerwcu, w pierwszej połowie nocy[35], chociaż istnieją informacje o rechocie trwającym do późnej nocy. Istnieją też jesienne nawoływania rzekotki na przełomie sierpnia i września[10].
Gdy zapadnie zmierzch, samce rozpoczynają swój chóralny rechot[10]. Usadawiają się wtedy zwykle nieco nad poziomem wody[24] lub na jej powierzchni. Częściej wybierają taflę wody, niż okoliczną roślinność[21]. Ustalają rewiry o średnicy 3 m – tyle dzieli sąsiadujące bezogonowe. Gdy na obszar ten wkroczy rywal, jest przeganiany[10] Rechocząc, samce prezentują boczne części swych worków rezonansowych[24]. Ich odgłosy opisuje się jako "repp-repp-repp"[6] albo "ep-ep-ep...". Rechot wielu osobników zlewa się z sobą, a przez to wzmacnia, przywabiając samice do zbiornika wodnego[10]. Chór liczy sobie przeciętnie 11,1 płaza z odchyleniem standardowym 5,3[9]. Seria odgłosów liczy sobie ich od 12 do 30, średnio 20,99 lub 19,94 u samców przystępujących do rozrodu i 22,14 lub 19,95 u nieprzystępujących. Pojedynczy odgłos trwa średnio 63 lub 65,38 u tych pierwszych i 64,01 lub 65,67 u tych drugich[34], ogólnie średnio 65,0 ms, a przerwa 138,1 ms. Ma on wedle Castellano częstotliwość 5,1 Hz[9]. Friedl naliczył w ciągu minuty średnio 162,35 lub 149,91 odgłosu (zależnie od roku, zakresy 106,07–196,72 i 89,07–217,57) u samców spółkujących i 160,18 lub 146,33 (94,49–209,92 lub 103,83–196,66) u niespółkujących[34]. Przeciętnie ilość pulsów w jednym odgłosie wynosi 8,2[9], mieszcząc się w zakresie 6–11. U samców rozradzających się średnia wyniosła 7,83 lub 7,84 (zakres 7,02–8,59 lub 7,50–8,35), u niewybranych przez samicę 7,97 lub 7,85 (7,63–8,49 lub 7,11–8,53), pojedynczy puls trwał odpowiednio 8,10 lub 8,51 ms (7,47–8,33 lub 7,83–9,39 ms) oraz 8,09 ms lub 8,55 (7,46–8,64 lub 7,88–10,39 ms)[34], z częstotliwością 128 Hz. Częstotliwość podstawowa wynosi średnio 953,1 Hz[9] (zakres 900–1200 Hz[34]), a dominująca 2121,5 Hz[9], dokładniej 2068,1 lub 2165,6 Hz (1965,3–2190,5 lub 2027,2–2429,2 Hz) u samców, którym udał się przystąpić do kopulacji, i 2153,3 lub 2146,3 Hz (1959,3–2325,9 lub 1976,4–2422,7 Hz) u pozostałych[34]. Średnio samce rzekotki drzewnej osiągały 88,85 dB. Zakres rozciągał się od 77,80 do 94,48 dB. W porównaniu z większą, co oznacza również obecność większego gardła, rzekotką śródziemnomorską (91,64 dB, zakres 81,47-97,67 dB) samce rzekotki drzewnej rechoczą mniej intensywnie[21].
Zarówno właściwości spektralne rechotu, jak i związane z czasem modyfikuje temperatura. Wielkość ciała wpływa natomiast głównie na właściwości spektralne wydawanych dźwięków, odpowiada za 11% zmienności w obrębie populacji i aż 73% różnic międzygatunkowych w obrębie tego samego kladu[9]. Być może niektóre wzorce rechotu podlegają dziedziczeniu. Jedno z badań pokazało, że samce o przeciętnej liczbie pulsów mają większą szansę na przystąpienie do rozrodu, niż osobniki o zbyt dużej lub zbyt małej ich ilości (dobór stabilizujący), wydaje się jednak, że rechot nie stanowi istotnego czynnika w doborze naturalnym rzekotek drzewnych (większość różnic pomiędzy obserwowanymi cechami rechotu nie wykazuje istotności statystycznej). Nie zaobserwowano też istotnych różnic między kumkaniem samców, które przeżyły następny rok, i takimi, którym się to nie udało[34]. Wydając z siebie 8000 dźwięków na minutę, samiec zużywa na ten cel średnio 1,076 ml tlenu/h, choć zaobserwowano trzykrotne różnice przy tej samej częstości rechotania. 69% tej energii pochodzi z utleniania węglowodanów, których znaczenie wzrasta wraz z większą częstością wydawanych dźwięków. Część energii dostarczają lipidy[35]. Udało się eksperymentalnie pobudzić samca do rechotania przez drażnienie prądem elektrycznym jądra przedwzrokowego przedniego. Jednakże amplituda dźwięków wzrastała szybciej, niż u naturalnie rechoczących osobników. Pobudzenie tego jądra spowodowało wydawanie dźwięków również u samic. Stan gotowości do wydawania dźwięków osiągnięto zaś za pomocą drażnienia prócz uprzednio wymienionego także jąder przedwzrokowego tylnego, wielkokomórkowego i podwzgórza[36]. Przeciętnie samiec kumka w chórze przez 7,5 nocy. Zależy to od minimalnej temperatury dziennej i w czasie rozpoczęcia śpiewu, a także opadów. Zmienne te odpowiadają za 37,8% rozkładu uczestnictwa samców w chórze[37].
Późniejszymi porami roku samce rechoczą również na lądzie[10]. Ponadto nie kumka on cały czas, ale część czasu poświęca żerowaniu[38].
To samica dokonuje wyboru[10]. Szukając partnera, kieruje się wydawanym przez niego głosem[19]. Preferuje też samce o kolorowym worku rezonansowym i stanowiącej przedłużenie jego wzoru dużej czarnej wstędze na boku ciała, dobrze odróżniającej się od grzbietu i brzucha, schowanej częściowo pod kończynami za dnia, gdyż rzucałaby się w oczy drapieżnikom. Samica wybiera osobniki o najciemniejszych barwach (danych tych nie tłumaczy fototaksja ujemna, gdyż nocne bezogonowe wykazują raczej fototaksję dodatnią). Poleganie na kilku zmysłach, a nie jednym, usprawnia znalezienie odpowiedniego samca, pozwala też na lepsze odróżnienie od siebie osobników różnych gatunków, zwłaszcza wśród składającego się z wielu osobników różnych gatunków chóru[24].
Głos i ruchliwość wskazują na dobrą kondycję i atrakcyjność samca[31]. W przeciwieństwie do samic inwestujących energię w składane jaja samce wielu gatunków przeznaczają ją głównie na ekstrawaganckie pokazy. Taki sposób rozrodu nazywa się lek[38]. Mięśnie związane z wydawaniem dźwięków znajdują się pod większym wpływem testosteronu[31]. Wysoki poziom tego steroidu wiąże się z bardziej atrakcyjnymi dźwiękami. Co więcej, wedle badań zespołu Julli Desprat z 2017 podwyższony sztucznie poziom testosteronu zmniejsza latencję orientacji w przypadku zdobyczy i przyśpiesza atakowanie ofiary (nie wpływa natomiast na odsetek ataków na zdobycz uwieńczonych sukcesem) – samce, którym podano testosteron, uważniej wypatrywały zdobyczy, a po dostrzeżeniu jej ich układ nerwowy szybciej przetwarzał informację, umożliwiając szybszy atak[38] (receptory androgenowe znaleziono już wcześniej w mózgu płazów[39]). Tracąc mniej czasu na zdobywaniu pokarmu, samiec może dłużej nawoływać samice[38].
Wedle Friedla w dwóch kolejnych latach 1990 i 1991 42,1% i 41,1% z oznaczonych przez niego 38 i 56 samców przystąpiło do spółkowania[34].
Zachodzi ampleksus, podczas którego samiec przytrzymuje partnerkę uchwytem pachwinowym[19] w okolicy bioder[10]. Pozycje typowe dla rozrodu osobnik każdej płci przyjmuje także po pobudzeniu elektrycznym jądra przedniego przedwzrokowego[36]. Wczesne złożenie jaj oznacza też wcześniejsze przeobrażenie i większe rozmiary młodych płazów. Późne przystąpienie do składania skrzeku w połączeniu z szybszym wyschnięciem zbiornika wodnego oznacza zwiększoną śmiertelność larw[23].
Samica składa żółtawe, otoczone galaretowatą osłonką jaja (skrzek) w postaci kłębów. Wedle starszych źródeł jeden zawiera od 800 do 1000[18] lub około 1000 jaj[10], wedle nowszych jedynie około 25[6] lub 10–50[19]. Pojedynczy pakiet osiąga rozmiary orzecha włoskiego, a samica tworzy ich do 10, co oznacza niewielką płodność gatunku[6].
Z jaj wylęgają się larwy zwane kijankami. Osiągają one długość do 5 cm (tyle samo osiąga dorosły płaz). Zabarwione są żółto-oliwkowo[18], zielono[40] lub ciemno-szaro ze złotymi cętkami. Wyróżnia je wysoka, zaczynająca się już na głowie, błona płetwowa[10]. Fałd płetwowy wysokością dwukrotnie przewyższa sam tułów[40]. Są aktywne, pływają wolno, co naraża je, podobnie jak kijanki ropuchy szarej, na zagrożenie ze strony larw ważek. Lepiej jednak od B. bufo sobie z nim radzą, preferując inne siedliska i będąc bardziej nieuchwytne[41]. Żywią się roślinami wodnymi i glonami. W Izraelu nie stwierdzono preferencji co do głębokości, na której żyją, ani też różnic w szybkości wzrostu kijanek z dna zbiornika i żyjących przy powierzchni[42]. Badania prowadzone w Narwiańskim Parku Narodowym i Suwalskim Parku Krajobrazowym wykazały, że często współwystępują i dobrze znoszą obecność larw kumaka nizinnego, w mniejszym zaś stopniu zależność ta zachodzi dla traszki zwyczajnej, grzebieniastej i ropuchy paskówki[43]. Okazuje się, że ich rozwój może zależeć od obecności drapieżników. We Francji opisano wyższe ogony u kijanek eksponowanych na działanie drapieżników w porównaniu z larwami, które ich nie zaznały. Drapieżnictwo spowalnia również tempo rozwoju larw. Masa kijanek nie zależy od zagrażającego drapieżnictwa w łagodnych warunkach, w przeciwieństwie do trudnych[44]. Przeobrażają się po upływie 90 dni, jednak mogą też zimować i podlegać metamorfozie dopiero w następnym sezonie[18]. Metamorfoza przypada zwykle na koniec lipca i sierpień[19]. Młode rzekotki drzewne osiągają 16 mm długości[10].
Osobniki obu płci osiągają dojrzałość w drugim roku życia. Wtedy też, po dwukrotnym w ciągu swego życia przezimowaniu, przystępują pierwszy raz do rozrodu. Zaobserwowano jednak rozmnażającego się rocznego samca. Nie odnotowano natomiast zwierząt dojrzewających później, od trzeciego roku życia[23]. Z innej strony badania greckie wykazały późniejsze o rok przystępowanie do rozrodu samic względem Niemiec i Szwajcarii. Nie towarzyszyła im różnica w długości ciała. Wnioski te opierają się jednak na niewielkiej grupie samic. Jednakże podobne wyniki zaobserwowano u żab z rodzaju Rana, jak Rana perezi, Rana sylvatica czy żaba trawna[22].
Wedle badań greckich najliczniejsze grupy wiekowe samców obejmują osobniki trzyletnie i czteroletnie. Przeciętny wiek samca wynosił w nich 3,74 roku, odnotowano osobniki dwu- i sześcioletnie, w przypadku samic 4,7 roku, badane samice miały od 3 do 6 lat[22].
Nie stwierdza się różnicy w przeżywalności dorosłych samic i samców. W jednym z badań uzyskano co prawda różne współczynniki przeżywalności (odpowiednio 20% i 37%), różnica ta nie wykazuje jednak istotności statystycznej. Współczynniki te zależą od zmieniających się warunków środowiska i nie są takie same w kolejnych latach. Tester, badając je przez 4 lata, otrzymał dla samców przeżywalność od 15% do 44%, przy czym najmniejsza wartość wiązała się z surową zimą. Najstarsze zbadane osobniki liczą sobie sześć lat[23], choć mówi się o rzekotkach dożywających nawet 15 lat[19]. Choć średni wiek samicy jest większy, niż samca, maksymalna długość życia nie wykazuje różnic ze względu na płeć. Za najważniejszy czynnik wpływający na strukturę wiekową populacji uchodzą opady deszczu, toteż zmienia się ona znacznie w kolejnych latach. W jednym z badań wykazano, że osobniki dwuletnie stanowiły w tej samej populacji w 1990 9,7%, natomiast rok później już 69,5%. Uważa się, że za takie duże różnice wśród bezogonowych odpowiada zmienna przeżywalność w okresie larwalnym[23].
Zwierzę cechuje się szerokim zasięgiem występowania[2], jednym z najszerszych wśród gatunków Palearktyki[45]. Płaza spotyka się w Europie Środkowej i Południowej, w północno-zachodniej Afryce (IUCN nie podaje jej obecności na tym kontynencie[2]) i w Azji Mniejszej. Północna granica jego zasięgu przebiega na południu Szwecji[18] oraz w południowej i wschodniej Danii. Na zachodzie rozproszone populacje żyją na Półwyspie Iberyjskim. Dalej bezogonowy bytuje od Francji do zachodniej Federacji Rosyjskiej[2]. Na wschodzie sięga on Krymu i Kaukazu[18], niektóre źródła wymieniają tu też Ural[19], inne jej tam nie umieszczają. Na południu obejmuje swym zasięgiem występowania Bałkany i Turcję, nie licząc jej wschodniej i południowo-wschodniej części. IUCN dostrzega jednak konieczność dalszych badań rozmieszczenia płaza w południowej Turcji[2].
Płaza introdukowano w Wielkiej Brytanii, w New Forest[2]. Niegdyś, po ustąpieniu ostatniego zlodowacenia, kanał La Manche uniemożliwił mu skolonizowanie wysp[10]. Wydaje się jednak, że wyginął w tym kraju[2]. Natomiast egzystuje na Łotwie, również na skutek reintrodukcji[2].
Zasięg występowania rzekotki drzewnej obejmuje następujące państwa: Albania, Armenia, Austria, Azerbejdżan, Białoruś, Belgia, Bośnia i Hercegowina, Bułgaria, Chorwacja, Czarnogóra, Czechy, Dania, Rosja, Francja, Grecja, Gruzja, Hiszpania, Holandia, Liechtenstein, Litwa, Luksemburg, Łotwa (reintrodukowano), Macedonia, Mołdawia, Niemcy, Polska, Portugalia, Rumunia, Serbia, Słowacja, Słowenia, Szwajcaria (na początku XX wieku jednorodnie rozmieszczona w całym kraju, wiek później kilka nie kontaktujących się ze sobą metapopulacji[20]), Szwecja, Turcja, Ukraina, Węgry, Włochy[2]. Starsze publikacje znajdują rzekotkę także w Izraelu[42].
Obecność płaza w Iranie jest niepewna[2]. Skamieniałości tego gatunku (prawa kość biodrowa) znaleziono w Libanie[46].
W Polsce rzekotka występuje pospolicie w całym kraju[18].
W latach 1987–1992 podjęto próbę reintrodukcji zwierzęcia na Łotwę, do Parku Narodowego Gaua. Użyto osobników z Białorusi i trzymanych w niewoli w ogrodzie zoologicznym w Rydze[2].
Gatunek ten uznawano niegdyś za jedynego członka rodziny rzekotkowatych występującego w Europie[18]. Jednakże wiadomo obecnie, że na terenie Francji żyją prócz niej również rzekotka śródziemnomorska i Hyla sarda[47], tę pierwszą spotyka się też w Hiszpanii[48], w tym na obszarach niezamieszkanych przez rzekotkę drzewną[10]. Obecnie w regionie europejskim wraz z Bliskim Wschodem i Afryką Północną notuje się 5 gatunków[4].
Jest to zwierzę nizinne[2]. Choć wedle niektórych dociera w górach tylko do wysokości 1500 m[19], w Europie odnotowano jego obecność na maksymalnej wysokości 2300 m nad poziomem morza w Bułgarii, ale informacja ta wedle IUCN wymaga jeszcze potwierdzenia[2]. W polskich górach spotyka się ją rzadko, płaz sięga do piętra regla dolnego[18].
Obszar występowania gatunku pokrywa się dość dokładnie z europejskim biomem lasów liściastych[10].
Rzekotka drzewna zasiedla drzewa, krzewy, rzadziej rośliny łąkowe o szerokich liściach[18], a także roślinność zielną[20] i niską roślinność przybrzeżną[2]. Wspina się zręcznie po drzewach i innych roślinach, robiąc użytek z przylg na palcach. Potrafi wspinać się nawet po gładkiej, pionowej powierzchni. Przebywa na liściach i gałązkach, maskując się dzięki swemu ubarwieniu[6]. Dochodzi w ten sposób do wysokości 10 m[19].
Rzekotka drzewna preferuje doliny rzeczne porośnięte lasem: łęgiem, niskim grądem czy lasem mieszanym. Lubi obszary obfitujące w kałuże, stawy, trzcinowiska, oczka wodne[10]. Jej siedliska stanowią widne lasy liściaste i mieszane[2], skraje lasów[6], zwłaszcza nasłonecznione[49], busz i tereny porośnięte krzewami[2], zarośla[6], łąki[2], zwłaszcza wilgotne i zadrzewione[6], pastwiska[19], brzegi jezior, ale także sady, parki, ogrody, winnice[2], żywopłoty, brzegi pól z dobrze rozwiniętą niską roślinnością, zwłaszcza porosłe jeżynami[49]. Spotykano ją nawet w dużych miastach. Unika natomiast ciemnych i gęstych lasów[2]. W Polsce występuje pospolicie głównie na terenach zasobnych w drzewa liściaste i gęste krzewy[18]. Potrafi przetrwać okresy suche, spotyka się ją więc także na terenach suchych[2]. Wedle innych źródeł nie oddala się ona jednak od zbiornika wodnego na odległość większą, niż kilkaset m[6]. Potrafi rozprzestrzeniać się z prędkością do 12,6 km rocznie[50] (wedle innych danych 10–12 km), rzadko jednak przebywa więcej niż 4 km. Prawdopodobieństwo zajęcia nowych obszarów zależy od ilości stawów w okolicy. Jednakże rzekotki wybierają zbiorniki już zasiedlone przez przedstawicieli swego gatunku, nawet jeśli leżą dalej od niezamieszkałych[49].
Claire Vos i Anton Stumpel w 1996 wykazali, że prawdopodobieństwo zajęcia przez rzekotkę stawu wiąże się z trzema czynnikami: obecnością innych stawów w odległości 750 m, obecnością krzaków oraz obecnością wysokiej roślinności zielnej[51], choć w 2005 takich związków nie wykrył Buskirk[52]. Poszczególne osobniki przywiązane są do "własnego" zbiornika[53].
Rozmnażanie ma miejsce w zbiornikach wód stojących, jak jeziora, stawy, bagna, także w sztucznych, a nawet w rowach i kałużach[2]. Może to być też staw, starorzecze, zatoka, jeśli jest spokojna, rozlewisko w dolinie rzecznej, dół po wydobyciu żwiru, oczko wodne. Zbiornik zarasta zwykle roślinność wodna. Ważna jest czystość wody oraz brak ryb i traszek[10]. Buskirk nie znalazł ani jednego stawu, w którym H. arborea koegzystowała by z rybami[52]. Rzekotki przystępują jednak do rozrodu w zbiornikach zamieszkanych przez żaby wodne, jeziorkowe i trawne, traszki grzebieniaste, zwyczajne i górskie[34]. W Skanii pojawiają się jednak informacje o zagrożeniu ze strony żaby wodnej[54]. Dla tego płaza najodpowiedniejsze wydają się zbiorniki o powierzchni od 1000 do 2000 m²[49]. Unika on wód kwaśnych[55]. Badania wykonane w Szwajcarii przez Pelleta i współpracowników (2003) wykazały następujące negatywne czynniki wpływające na zasiedlenie stawu przez rechoczące samce: urbanizacja przyległych terenów, niski opór elektryczny wody, nieznaczny czas nasłonecznienia wody. Chodzi tutaj o ogrzewanie wody przez promienie słoneczne, co oznacza wyższą temperaturę rozwoju larw, a więc i szybsze ich dojrzewanie, co przekłada się na większy sukces rozrodczy. Wysoka zdolność wody do przewodzenia wynikała w tym przypadku z jonów chlorkowych. Na podłożach wapiennych wynika z kationów wapnia i anionów wodorowęglanowych i węglanowych, wśród nawożonych pól z azotanów. Zaproponowano zdolność wody do przewodzenia prądu jako miarę eutrofizacji zbiornika, związanej z rozrostem glonów powodującym nad ranem powstanie warunków beztlenowych, niekorzystnych dla rozwoju kijanek. Rolę czynnika pozytywnego odgrywa w tym badaniu odległość dróg[56].
Wysokość nad poziomem morza, którą osiąga rzekotka, różni się na północnej i na południowej stronie Alp. Na północy dochodzi do 600 m, na południu zaś do 800 m[10].
Płaz żywi się głównie owadami, na które sprawnie poluje[18]. Jego strategia polega na usadowieniu się na gałęzi czy w zaroślach i nieruchomym oczekiwaniu na pojawienie się zdobyczy, aż ta wpadnie w zasadzkę. Wtedy rzekotka może rzucić się na ofiarę. Atak taki wymaga sprawnej koordynacji bodźców dopływających z wpatrzonych w zdobycz oczu, obliczenia trajektorii precyzyjnego skoku i wysunięcia języka, by pochwycić nim ofiarę. Liczy się w nim szybkość, zwłaszcza w gęstej roślinności, wśród której ofiara za chwilę może przestać być w zasięgu drapieżnika[38]. Badania żołądków 585 dorosłych osobników z Rumunii pozwoliły dokładniej przyjrzeć się zdobyczom rzekotki. Większość z nich stanowiły dorosłe pająki i chrząszcze. Spośród tych ostatnich zidentyfikowano przedstawicieli 11 rodzin, z których największy udział miały biegaczowate, kusakowate, sprężykowate i stonkowate. Larwy chrząszczy znajdywano najczęściej w marcu (niecałe 22%) i na początku maja (24,4%). Imagines tego rzędu w marcu natrafiono w 53,7% bezogonowych, w kwietniu już w 60,1%, w maju na początku w niecałych 47,2%, później w prawie 42%, najczęściej jednak w czerwcu: w niecałych 72%. W sierpniu było to 12,5%, we wrześniu 40%. Pająki na początku maja są zjadane przez ponad ¾ osobników i w każdym miesiącu od marca aż do sierpnia znajdywano je w ponad połowie żołądków, we wrześniu jedynie w 0,2. Równonogów nie znaleziono w drugiej połowie maja i w czerwcu. Pluskwiaki różnoskrzydłe najczęściej pojawiały się we wczesnym maju (20,5%), by w następnym miesiącu w ogóle nie zostać znalezione. Pluskwiaki równoskrzydłe do maja stanowiły rzadkość, w pierwszej połowie tego miesiąca pojawiały się już w ponad 16% żołądków i do końca badania (wrzesień) nie spadały poniżej połowy przebadanych płazów. Larwy motyli w kwietniu i na początku następnego miesiąca dostrzeżono w ponad 40% (odpowiednio 45,5% i 43,3%). Larwy chruścików ukazały się jedynie w czerwcu, w drugiej połowie miesiąca w większej ilości (35,1%), i we wrześniu, tym razem obecne u prawie ⅔ płazów (65%). Imago krótkorogich były obecne od 2,4% przewodów pokarmowych w marcu do 30% we wrześniu, prawie 22,5% osiągając w kwietniu. Dojrzałe długorogie od kwietnia do sierpnia znajdywano w granicach 20–30% płazów. W marcu nie wymieniono ich w ogóle, we wrześniu osiągnęły wartość 15%. Błonkoskrzydłe były najchętniej spożywane w czerwcu (35,5% osobników). Nieznaczny odsetek stanowiły: ślimaki, zaleszczotki, roztocze, wije, skoczogonki, ważki, prostoskrzydłe, skorki, wielbłądki, sieciarki, wojsiłki, larwy muchówek. Zwraca uwagę prawie wyłączna obecność bezkręgowców lądowych, organizmy wodne znaleziono jedynie w marcu. Zaliczają się doń ślimaki, równonogi, larwy długorogich. W żołądkach znaleziono również szczątki roślin (najczęstsze we wrześniu − 35%, podczas gdy w czerwcu tylko 9,7%), kawałki złuszczonej skóry (tylko u zwierząt bytujących w środowisku wodnym), a także jaja płazów nie należących do rodzaju Hyla. Dokładniej zostały one złożone przez żabę moczarową i doszukano się ich u 4,9% osobników jedynie na początku okresu rozrodczego. Wtedy też odnotowano najwięcej płazów z pustym żołądkiem (w marcu − 14,6%, podczas gdy pod koniec czasu godów − w końcu maja − było to 2,3%, a po okresie reprodukcji − w czerwcu − 3%), co może być efektem godów lub skromnej dostępności pokarmu. Ich ilość ocenia się jednak jako niewielką. W związku z wydłużonym okresem rozrodczym płazy w jego trakcie nie zaprzestają zdobywania pożywienia. Rzekotki najmniej zróżnicowanym pokarmem żywiły się w sierpniu. Ich dieta z tego miesiąca najbardziej przypomina czerwcową, menu tych płazów z marca zaś jest najbliższe majowemu, a dopiero później kwietniowemu. Najbardziej od wszystkich innych różni się to wrześniowe. Poza tym w kolejnych sezonach obserwuje się znaczne różnice w diecie[33].
Bezogonowy musi zgromadzić zapasy energii pozwalające mu przetrwać zimę, ale także przystąpić po niej do rozrodu[33]. Sen zimowy rozpoczyna w czasie spadania wykorzystywanych przez niego jako schronienie liści z drzew. Rzadko spędza zimę na lądzie, częściej zagrzebuje się wtedy w szlamie na dnie zbiorników wodnych. Wiele osobników razem spędza zimę[18].
Zwierzę oprócz maskującego ubarwienia nie posiada żadnej ochrony przed drapieżnikami[18].
Badania przeprowadzone w Turcji ujawniły pasożytowanie na rzekotkach drzewnych następujących robaków[57]:
Zwierzę występuje sympatrycznie z innym gatunkiem − rzekotką śródziemnomorską. Odnotowano obecność bezpłodnych hybryd[2].
W przeszłości uważano rzekotkę drzewną za pomocną w tworzeniu prognoz pogody. Trzymano ją z tego względu w specjalnych, wysokich terrariach[18]. Cały czas hoduje się ją jako zwierzę domowe[2].
W przeszłości przyznawano rzekotce drzewnej umiejętność przepowiadania pogody. Zaobserwowano bowiem płazy zajmujące miejsca wysoko na roślinach podczas ładnej, słonecznej pogody i spędzające czas nisko w czasie pogody ludziom mniej sprzyjającej: deszczowej czy pochmurnej. Za przyczynę tego zjawiska uchodzi zachowanie się owadów zależne od chwilowych warunków pogodowych. Jednakże niegdyś umieszczano rzekotkę w słoju, w którym znajdowała się drabinka, i od pozycji zwierzęcia na tejże próbowano przewidywać pogodę[10].
Występowała pospolicie[18], jednak obecnie tylko w odpowiednim środowisku na części swego zasięgu występowania. W Europie Zachodniej populacje są pofragmentowane[2], a Hyla arborea stanowi rzadkość[6]. Liczebność płaza obniża się jednak nie tylko tam. Spadek liczebności notuje się też w leżącej na wschodzie zasięgu występowania płaza Turcji, co pozostaje w zgodzie z ogólnym trendem populacyjnym[2]. Natomiast w Holandii po osiągnięciu minimum w 1985 populacja powoli zwiększa swą liczebność[49]. W 2009 na Pojezierzu Starogardzkim te skaczące stwierdzono w co drugim stawie[58]. W Polsce występuje na terenie całego kraju, jednak pospolicie tylko na obszarze nizinnym[18]. Trudno jest ją jednakże zaobserwować[10].
Rzekotka drzewna wykazuje dużą wrażliwość na zmiany w środowisku. Wpływają nań fragmentacja lasów, zagajników i łąk, jak również osuszanie i zanieczyszczenie mokradeł[2]. Osuszanie i inwestycje związane z budową dróg wpłynęły niekorzystnie na używane przez rzekotki płytkie, ciepłe, nieeutroficzne stawy pozbawione ryb. Wprowadzanie zmian w roślinności wokół stawów utrudnia płazom migrację pomiędzy zbiornikami wodnymi[53]. Zaznacza się też wpływ drapieżnych ryb[2], eutrofizacji i zanieczyszczenia wód. W zachodniej Szwajcarii negatywną rolę odgrywają też przekształcanie pastwisk i łąk w rejony podmiejskie, plantacje intensywnego rolnictwa i budowa dróg[20]. W kraju tym rzekotkę uznaje się za poważnie zagrożoną, a zasięg występowania płaza w tym kraju jest rozczłonkowany[56]. Lokalne spadki liczebności mogą mieć związek z odłowem i traktowaniem płaza jako zwierzęcia domowego[2]. Prawdopodobieństwo wymarcia lokalnej populacji zależy od wielkości stawu i dostępności okolicznych środowisk leśnych, prawdopodobieństwo zasiedlenia zaś od ilości stawów w okolicy[49].
Badania przeprowadzone w Danii wykazały odchylenia od prawa Hardy'ego-Weinberga, za przyczynę których uchodzi chów wsobny, wpływający negatywnie na stan zdrowia populacji. Fragmentacja środowiska przyczynia się bowiem do spadku różnorodności genetycznej, redukując rozmiary i pogarszając kondycję populacji. Subpopulacje tracą przez nią łączność ze sobą. Zwiększa się rola dryfu genetycznego, jak również możliwość chowu wsobnego, który zmniejsza różnorodność genetyczną, ocenianą przez porównywanie z przewidywaniami czynionymi dzięki wspomnianemu prawu. Rzeczona różnorodność wykazuje korelację z kondycją populacji − jest ona niewielka w populacjach małych, o niedużym stopniu heterozygotyczności, które posiadają też często niewielkie zdolności adaptacyjne. Tymczasem badane populacje przeszły niegdyś przez wąskie gardło. W badaniach tych oceniono 12 loci mikrosatelitarnego DNA i wśród większości loci polimorficznych w niektórych stawach znaleziono też monomorficzne. Wykryto również niedobór heterozygot będący prawdopodobnie efektem nielosowego krzyżowania się, alleli null czy efektu Washlunda. Żadne z loci nie wykazało jednak odchyleń w każdym z ocenianych stawów. Chów wsobny w populacjach, których status oceniano wcześniej korzystnie, osiągał mniejszy poziom[53]. W Holandii natomiast, gdzie populacja przeszła efekt szyjki od butelki w 1985, po przebadaniu 8 polimorficznych (od 2 do 10 alleli) loci mikrosatelitarnych wykryto zaledwie jeden locus monomorficzny w jednej z populacji[49].
Opisywany spadek heterozygotyczności ma niekorzystny wpływ na rzekotki. Chociażby stan larw pozytywnie koreluje z ich heterozygotycznością (w tym masa ciała i długość)[59]. Luquet potwierdził mniejszą masę ciała i gorszy rozwój kijanek z izolowanych populacji, w trudnych warunkach cechowała je również wyższa umieralność. Larwy izolowanych populacji wykazywały również większą zależność rozwoju od zagrażających im drapieżników[44].
Na obniżenie populacji rzekotki drzewnej wpłynęły pestycydy i inne ksenobiotyki. Zagrożenie dla rozwoju larw stanowią estrogeny, wprowadzane do środowiska przez człowieka, w tym EE2 (17α-etynyloestradiol) używane jako środek antykoncepcyjny. Zaburza on determinację płci rzekotki drzewnej. W badaniach pod kierunkiem Ghali znacznie mniej osobników poddanych działaniu E2 przeszło metamorfozę. Obecność hotmonu wpływała także na długość i masę ciała młodocianych rzekotek. O ile w krytycznym okresie po przeobrażeniu prawie połowa osobników umiera, wcześniejszy kontakt z estrogenem zwiększał jeszcze tę liczbę do 62%. Kolejnych kilkanaście tygodni przeżyło tylko 13% (w grupie kontrolnej 28%). Etiopatogeneza nie została dokładnie poznana. Estrogeny, poza tym że wywołują feminizację samców płazów i uszkadzają im jądra[45], prowadzą do odwrócenia płci na żeńską i powstawania osobników hermafrodytycznych[60], mogą powodować rozwój guzów, uszkadzając DNA[45].
Populacje zamieszkujące Jutlandię znajdują się w lepszej kondycji, niż te z wyspy Lolland, na której znacząco spadła ilość odpowiednich dla rzekotki stawów[53]. W Szwajcarii kolejne lokalne wyginięcia przeplatają się z rekolonizacjami[20].
W 1996 gatunkowi przyznano status niższego ryzyka. W 2004 zmieniono go na bliski zagrożenia (NT). Dwa lata później sklasyfikowano go jednak jako najmniejszej troski (LC)[2]. Na niektórych obszarach (np. województwo opolskie) w ogóle nie umieszcza się go w żadnej z kategorii czerwonej listy związanych z zagrożeniem[61]. Wymienia go załącznik II konwencji berneńskiej oraz aneks IV dyrektywy siedliskowej Unii Europejskiej. Figuruje również w wielu krajowych czerwonych księgach czy listach. Chroni go ustawodawstwo wielu krajów[2], między innymi Polski, gdzie podlega ścisłej ochronie gatunkowej[62]. Na przykład w Szwajcarii, gdzie uznaje się go za wysoce zagrożony, odpowiednie prawodawstwo wprowadzono już w 1968[20].
Zamieszkuje liczne obszary chronione[2].
W części zasięgu występowania podejmuje się działania mające na celu zmniejszenie śmiertelności tych bezogonowych na drogach. Służą mu również prowadzone w Europie Środkowej programy tworzenia stawów[2]. Podobne działania podjęła Holandia, zwracając również uwagę na siedliska wokół zbiornika[49]. Szwecja podjęła specjalny program odnowy gatunku. Dzięki niemu liczba osobników, wynosząca w 1980 r. 2000 rzekotek, zwiększyła się przez następne 28 lat do 50000[2].
W 2016 opublikowano badanie wykonane metodą PVA (Population Viability Analysis), dotychczas rzadko stosowaną do oceny zagrożonych populacji płazów, wykorzystując izolowaną populację ze stawu w Hanowerze, liczącą około 70 zwierząt. Zwrócono uwagę na negatywny związek między fragmentacją środowiska a stanem genetycznym populacji. W zbadanych 8 loci mikrosatelitarnych stwierdzono od 4 do 7 alleli, średnio 4,9. W WHA1-60 stwierdzono znaczny niedobór heterozygot, gdy inne spełniały prawo Hardy'ego-Weinberga. Analiza wykazała wysokie prawdopodobieństwo wyginięcia w ciągu następnego półwiecza. Jako kluczowy czynnik podano przeżywalność osobników młodocianych. Takim niewielkim populacjom zagraża także chów wsobny. Po wyginięciu staw mógłby zostać ponownie zasiedlony przez inną populację rzekotki drzewnej. Populację mogłaby natomiast uratować imigracja z metapopulacji. Zasugerowano działania ochronne, zwłaszcza zwiększające przeżywalność na wczesnych etapach życia oraz stworzenie korytarzy umożliwiających migracje. W planowaniu należy brać pod uwagę oddziaływania metapopulacyjne[63].
Rzekotka drzewna zostaje często flagowym gatunkiem różnych programów ochronnych[2].
Rzekotka drzewna (Hyla arborea) – gatunek płaza z rodziny rzekotkowatych.
Osiąga około 5 cm długości. Cechuje się zwykle zielonym, szarym, brązowym lub żółtawym ubarwieniem, które potrafi zmieniać w zależności od otoczenia. Boki ciała rzekotki zdobi charakterystyczna ciemna pręga, odgrywająca obok rechotu rolę w doborze płciowym. Oczy są duże, wyłupiaste, kończyny tylne długie, opuszki palców wieńczą przylgi ułatwiające wspinaczkę po drzewach.
Płaz zamieszkuje większą część Europy, od Portugalii aż do krańców kontynentu i zachodniej Azji (Azerbejdżan), na północy sięga Danii. Preferuje niziny, ale istnieją doniesienia o spotkaniu go na wysokości 2300 m. Zajmuje różnorodne środowiska roślinne, zarówno lasy, tereny krzewiaste, jak i porośnięte niższą roślinnością. Rozmnaża się w różnorodnych zbiornikach wód stojących, w tym sztucznych. Żywi się drobnymi bezkręgowcami, głównie owadami (zwłaszcza chrząszcze) i pająkami. Menu zmienia się w zależności od miesiąca i roku. Zdarzają się w nim też jaja innych płazów.
W Europie Środkowej rozród zaczyna się w maju. Po ampleksusie samica składa żółtawe, otoczone galaretowatą osłonką jaja (skrzek), do 10 kłębów po 10–50 sztuk. Wylęgają się z nich żółtooliwkowe, pływające wolno kijanki, mierzące do 5 cm długości. Przeobrażają się po 90 dniach na przełomie lipca i sierpnia lub też dopiero w następnym roku. Zwierzę bywa hodowane w terrariach. W Europie Zachodniej jego liczebność obniża się, co ma związek ze zmianami w środowisku spowodowanymi działalnością ludzką. W związku z tym rzekotka figuruje w wielu czerwonych listach i księgach, IUCN przyznaje jej status LC. Prowadzi się działania zmierzające do ochrony gatunku, chronią go również liczne prawodawstwa.
A rã-arborícola-europeia (Hyla arborea), também conhecida como rela (em Portugal), é uma pequena rã pertencente à família Hylidae. Podem ser vistas em dias húmidos e nublados, porém, atingem os níveis máximos de actividade durante a noite.
Historicamente, as relas foram utilizadas como barómetros devido ao facto de começarem a coaxar ao sentirem a aproximação de chuva. Dependendo da subespécie, temperatura, humidade ou disposição da rã, a sua cor pode variar entre as tonalidades verde-tropa a verde intenso, passando pelo cinzento, castanho e amarelo. Vive no máximo 10 anos.
A sua cabeça é arredondada, o lábio superior é descaído, a sua pupila tem a forma de uma elipse horizontal e o tímpano é facilmente identificável. Os machos podem ser distinguidos das fêmeas pela sua cor castanho-amarelado e grandes sacos vocais na zona da garganta. O seu amplexo (acasalamento) é axilar. Tanto machos como fêmeas adultas atingem tamanhos entre 30–40 mm, podendo mais raramente atingir os 45–50 mm. O dorso suave, brilhante e normalmente de um verde-folha, está separado do ventre acinzentado a branco-amarelado por uma risca escura, que se estende desde os nostrilos, sob o olho e tímpano, até à virilha. Ambas as suas pernas anteriores e posteriores comprida, com 4 e 5 dedos, respectivamente. Nas patas posteriores apresentam membranas interdigitais relativamente bem desenvolvidas.[1]
Distribuída por toda a Europa desde a Ucrânia e Bielorrússia, até aos Balcãs, Creta, Itália, Benelux, Alemanha, a maior parte da França e as zonas temperadas do noroeste da Península Ibérica (Portugal e Espanha). Está ausente das ilhas Britânicas, da maior parte da Escandinávia e Dinamarca, dos Alpes e de pequenas áreas do norte dos Países Baixos e Alemanha.
Vive nas orlas dos charcos, lagoas e ribeiras com vegetação emergente alta e densa (juncos, canas ou silvas) que utiliza como refúgio. Também pode ser observada em prados húmidos e terrenos encharcados, com vegetação herbácea e arbustiva abundantes.
A sua alimentação consiste essencialmente em invertebrados diversos, nomeadamente aranhas, formigas, moscas, centopeias, percevejos e pequenos escaravelhos.
O período reprodutivo inicia-se na Primavera, quando os machos cantam durante a noite nas orlas dos charcos e ribeiras onde se reproduzem e são as primeiros a chegar a esses locais. Cada fêmea pode depositar cerca de 200 a 1400 ovos.
A rã-arborícola-europeia (Hyla arborea), também conhecida como rela (em Portugal), é uma pequena rã pertencente à família Hylidae. Podem ser vistas em dias húmidos e nublados, porém, atingem os níveis máximos de actividade durante a noite.
Historicamente, as relas foram utilizadas como barómetros devido ao facto de começarem a coaxar ao sentirem a aproximação de chuva. Dependendo da subespécie, temperatura, humidade ou disposição da rã, a sua cor pode variar entre as tonalidades verde-tropa a verde intenso, passando pelo cinzento, castanho e amarelo. Vive no máximo 10 anos.
Brotăcelul (Hyla arborea), cunoscut și sub numele de răcănel, brotac, broatec este o broască arboricolă din familia hilide (Hylidae) răspândită în aproape întreagă Europa, spre est ajunge până în Urali, Caucaz, Asia Mică. Se găsește și în nord-vestul Africii. Este singura broască arboricolă din Europa. Brotăcelul este o specie cu mai multe subspecii geografice. În România[1][2][3][4] și Republica Moldova[5] trăiește subspecia Hyla arborea arborea. În România este o broască comună și se întâlnește pretutindeni unde există apă și arbori, tufișuri sau stuf, de la șes până la altitudine de 1000 m în munții Carpați. În timpul verii trăiește pe arbori, tufișuri sau stuf. Datorită discurilor sale adezive de pe degete se cațără cu ușurință pe arbori și tufișuri și execută uriașe salturi prin aer. Când este vreme frumoasă șade pe fața frunzelor, iar când este vreme ploioasă se prinde pe dosul frunzelor. Este acvatic numai în perioada scurtă de reproducere. Brotăcelul poate fi crescut în acvariu. În captivitate poate trăi până la vârsta de 22 ani.
Are o lungimea de 3,5-4,5 cm. Masculul are aceeași mărime ca femela. Corpul este zvelt, oval, capul scurt și rotunjit, pupila ochiului orizontală, timpanul foarte distinct. Limba circulară, liberă și crestată posterior. Pielea este netedă și lucioasă dorsal și granulată pe partea internă a coapselor și pe gușa femelelor. Toate degetele posedă discuri adezive care secretă un lichid lipicios ce îi permite o bună aderare pe suprafețele pe care se deplasează, permițând brotăcelului să se cațăre chiar pe un geam vertical. Membrele posterioare au membrane interdigitale reduse, cele anterioare nu au aceste membrane.
Coloritul pe partea dorsală variabil, de obicei verde intens ca iarba, uneori galben-verde, cafeniu sau cu pete cafenii pe un fond galben-roz. Abdomenul este alb. Degetele galben deschis sau roz. Îi este caracteristică o dungă laterală neagră sau cafenie, mărginită deasupra cu alb sau galben, care se întinde de la nări, trece prin dreptul ochilor, timpan și ajunge de-a lungul flancurilor, până la baza membrelor posterioare, unde formează o prelungire orientată postero-anterior. Această dungă separă partea verde a corpului de partea albă. Cromatoforii din dermă prin mișcările lor amiboidale pot să schimbe într-un timp scurt culoarea brotăcelului, punând-o în armonie cu substratul (homocromism), pe vegetație el are o culoare verde intens, făcându-l nevăzut în frunzișul arborilor, iar pe sol devine verzui-brun-pământiu. Datorită coloritului de protecție, el nu se ferește când este descoperit și nu încearcă să fugă.
Diferența între mascul și femelă se face după gușă. La mascul pielea gușii este închisă la culoare și încrețită, iar la femelă este netedă și albă. Masculul nu are calozități nupțiale, însă posedă un sac vocal mare sub bărbie, de culoare brună închisă sau brună gălbuie, care amplifică orăcăitul său bine cunoscut după ce asfințește soarele, mai ales în perioada de reproducere; în stare de repaus sacul vocal formează cute; când aceasta se dilată depășește cu mult mărimea capului.
Brotăcelul duce o viață crepuscular-nocturnă, dar are și o activitate diurnă, stând uneori pe frunze la soare și vânând insecte. Iarna hibernează în crapaturile din clădiri, sub frunze și mușchi, la poalele copacilor, în scorburi, vizuini sau sub pietre. Hrana brotăcelului constă din diferite insecte și larvele lor (coleoptere, diptere), predominând formele zburătoare, pe care le prinde printr-un salt, cu ajutorul limbii sale protractile și lipicioase. Consumă și arahnide (păianjeni) și acarieni. Are ca dușmani păsările răpitoare și șerpii.
Reproducerea brotăcelului are loc în aprilie-iunie în apă, unde el este un foarte bun înotător. În această perioadă masculii intră în apă; femelele îi urmează mai târziu și pentru o perioadă scurtă, când are loc fecundarea și depunerea pontei. Amplexul (îmbrățișarea copulatorie pe care o face masculul cățărat pe spatele femelei cu picioarele dinainte) este axilar. Brotăceii sunt lipsiți de organe de acuplație și fecundația la ei este externă. Ponta este depusă noaptea, în decurs de câteva ore, și constă din grămezi mici de ouă. Larvele, care înoată tot atât de rapid ca peștii, se metamorfozează în iulie-august. După perioada de reproducere, brotăceii se îndepărtează de apă, urcându-se pe stuf, apoi trec în pădure, pe arbori și arbuști.
Brotăcelul (Hyla arborea), cunoscut și sub numele de răcănel, brotac, broatec este o broască arboricolă din familia hilide (Hylidae) răspândită în aproape întreagă Europa, spre est ajunge până în Urali, Caucaz, Asia Mică. Se găsește și în nord-vestul Africii. Este singura broască arboricolă din Europa. Brotăcelul este o specie cu mai multe subspecii geografice. În România și Republica Moldova trăiește subspecia Hyla arborea arborea. În România este o broască comună și se întâlnește pretutindeni unde există apă și arbori, tufișuri sau stuf, de la șes până la altitudine de 1000 m în munții Carpați. În timpul verii trăiește pe arbori, tufișuri sau stuf. Datorită discurilor sale adezive de pe degete se cațără cu ușurință pe arbori și tufișuri și execută uriașe salturi prin aer. Când este vreme frumoasă șade pe fața frunzelor, iar când este vreme ploioasă se prinde pe dosul frunzelor. Este acvatic numai în perioada scurtă de reproducere. Brotăcelul poate fi crescut în acvariu. În captivitate poate trăi până la vârsta de 22 ani.
Are o lungimea de 3,5-4,5 cm. Masculul are aceeași mărime ca femela. Corpul este zvelt, oval, capul scurt și rotunjit, pupila ochiului orizontală, timpanul foarte distinct. Limba circulară, liberă și crestată posterior. Pielea este netedă și lucioasă dorsal și granulată pe partea internă a coapselor și pe gușa femelelor. Toate degetele posedă discuri adezive care secretă un lichid lipicios ce îi permite o bună aderare pe suprafețele pe care se deplasează, permițând brotăcelului să se cațăre chiar pe un geam vertical. Membrele posterioare au membrane interdigitale reduse, cele anterioare nu au aceste membrane.
Coloritul pe partea dorsală variabil, de obicei verde intens ca iarba, uneori galben-verde, cafeniu sau cu pete cafenii pe un fond galben-roz. Abdomenul este alb. Degetele galben deschis sau roz. Îi este caracteristică o dungă laterală neagră sau cafenie, mărginită deasupra cu alb sau galben, care se întinde de la nări, trece prin dreptul ochilor, timpan și ajunge de-a lungul flancurilor, până la baza membrelor posterioare, unde formează o prelungire orientată postero-anterior. Această dungă separă partea verde a corpului de partea albă. Cromatoforii din dermă prin mișcările lor amiboidale pot să schimbe într-un timp scurt culoarea brotăcelului, punând-o în armonie cu substratul (homocromism), pe vegetație el are o culoare verde intens, făcându-l nevăzut în frunzișul arborilor, iar pe sol devine verzui-brun-pământiu. Datorită coloritului de protecție, el nu se ferește când este descoperit și nu încearcă să fugă.
Diferența între mascul și femelă se face după gușă. La mascul pielea gușii este închisă la culoare și încrețită, iar la femelă este netedă și albă. Masculul nu are calozități nupțiale, însă posedă un sac vocal mare sub bărbie, de culoare brună închisă sau brună gălbuie, care amplifică orăcăitul său bine cunoscut după ce asfințește soarele, mai ales în perioada de reproducere; în stare de repaus sacul vocal formează cute; când aceasta se dilată depășește cu mult mărimea capului.
Brotăcelul duce o viață crepuscular-nocturnă, dar are și o activitate diurnă, stând uneori pe frunze la soare și vânând insecte. Iarna hibernează în crapaturile din clădiri, sub frunze și mușchi, la poalele copacilor, în scorburi, vizuini sau sub pietre. Hrana brotăcelului constă din diferite insecte și larvele lor (coleoptere, diptere), predominând formele zburătoare, pe care le prinde printr-un salt, cu ajutorul limbii sale protractile și lipicioase. Consumă și arahnide (păianjeni) și acarieni. Are ca dușmani păsările răpitoare și șerpii.
Reproducerea brotăcelului are loc în aprilie-iunie în apă, unde el este un foarte bun înotător. În această perioadă masculii intră în apă; femelele îi urmează mai târziu și pentru o perioadă scurtă, când are loc fecundarea și depunerea pontei. Amplexul (îmbrățișarea copulatorie pe care o face masculul cățărat pe spatele femelei cu picioarele dinainte) este axilar. Brotăceii sunt lipsiți de organe de acuplație și fecundația la ei este externă. Ponta este depusă noaptea, în decurs de câteva ore, și constă din grămezi mici de ouă. Larvele, care înoată tot atât de rapid ca peștii, se metamorfozează în iulie-august. După perioada de reproducere, brotăceii se îndepărtează de apă, urcându-se pe stuf, apoi trec în pădure, pe arbori și arbuști.
Rosnička zelená (Hyla arborea) je žaba z čeľade rosničkovité (Hylidae)
Obýva takmer celé územie Európy: Ukrajinu, Bielorusko, Balkán, Krétu, Taliansko, Benelux, Slovensko, Poľsko, Česko, väčšiu časť Nemecka, väčšinu Francúzska a Holandsko, severozápadnú časť Pyrenejského polostrova. Chýba na Britských ostrovoch, na väčšine územia Škandinávie a Dánska, Álp a malej časti severného Holandska a Nemecka.
Vyhľadáva vlhké listnaté lesy, kde vystupuje aj do vyšších poschodí stromov.
Dorastá do dĺžky 5 cm a výšky 3 – 4 cm. Historicky je známa ako akýsi barometer, pretože reaguje na zmenu tlaku, ktorý kolíše obvykle pred dažďom. Sfarbenie rosničiek zelených je trochu premenlivé, pretože kožné pigmenty reagujú na teplotu a vlhkosť, a tak sa jej sfarbenie mení od svetlozelenej na tmavozelenú, žltkastú, šedú alebo dokonca až na hnedú. Zadné končatiny má viditeľne silnejšie ako predné, čo umožňuje rýchle skákanie. Na oboch končatinách má priľnavé chodidlá určené na šplhanie a na pomerne guľatej hlave a na bokoch nápadný vodorovný čierny prúžok, ktorý sa tiahne od nozdier cez oko a ušný bubienok až k predným končatinám. Obe pohlavia sú si na prvý pohľad veľmi podobné, ale bezpečnou odlišnosťou je samcov hnedožltý vak na hrdle.
Rosnička zelená sa živí širokou škálou obvykle živočíšnej potravy. Dospelí sa živia prevažne väčšími bezstavovcami, väčšinou potom hmyzom a pavúkmi, ktoré sa nachádzajú na listoch stromov a ktoré často lovia pomocou rýchleho skoku, na ktorý korisť nestačí väčšinou nijak zareagovať.
Rosnička zelená dosahuje pohlavnú dospelosť zhruba vo veku jedného roka. Pária sa od apríla do augusta. Párenie začína ihneď po prilákaní samice a pretože býva samec menší, ľahne si na chrbát samice. Samice vajíčka kladú obvykle dvakrát do roka.
Samice vajíčka kladú väčšinou v priebehu mája, najskôr, ale to je veľmi výnimočné, na konci marca. Vajíčka sú spojené do chumáčov, ktoré sú veľké približne ako vlašské orechy. V jednom chumáči je zvyčajne 10 až 50 vajíčok. Vrchol každého vajíčka, ktoré dosahuje 1,5 – 2 mm, je hnedý, dolná časť potom žlto-biela. Po nakladení sa vajíčka zoradia do skupinových radov.
Rosnička zelená (Hyla arborea) je žaba z čeľade rosničkovité (Hylidae)
Zelena rega (znanstveno ime Hyla arborea) je vrsta brezrepih dvoživk iz družine pravih reg (Hylidae).
Živi skoraj po celi Evropi (sever Pirenejskega polotoka, Francija, Belgija, Nizozemska, Danska, južna Švedska, Nemčija, Avstrija, Balkan, Apeninski polotok in severozahod Evrope do Urala in Kavkaza). Zeleno rego ogroža predvsem izsuševanje in zastrupljanje mokrišč.
Zelena rega je velika od 4 do 5 cm in ima gladko kožo. Telo je običajno živo zeleno, vendar lahko barvo telesa prilagaja barvi okolice, zato je lahko celo sive ali rjave barve s temnejšimi pikami. Na konicah prstov ima povečane zaobljene blazinice z oprijemalnimi ploščicami. Samec je manjši od samice in ima rumeno grlo, samica je veliko večja, njeno grlo pa je belo.
Paglavci imajo oči ob strani trupa. Hrbtni del repnega grebena je visok in se začne že na sprednjem delu telesa. Telo je običajno rumenkasto, z zlato obarvanim trebuhom.
Odrasle osebke najdemo na gozdnih obronkih, na travnikih z višjo vegetacijo ali v mejicah. Paglavce najpogosteje najdemo v velikih mlakah z obilico rastlinja, včasih pa tudi v manjših lužah ali kanalih. Izogibajo se vodam, v katerih so ribe.
Parijo se med aprilom in junijem. Kot večina dvoživk je tudi zelena rega v času razmnoževanja vezana na vodo. Pred parjenjem se samci oglašajo in jih lahko slišimo nekaj kilometrov daleč. Mrest vsebuje okoli 900 jajčec. Mrestov premer je okoli 2–3 cm in je pritrjen na vodno rastlinje. V 10 dneh se razvijejo paglavci.
Zelena rega (znanstveno ime Hyla arborea) je vrsta brezrepih dvoživk iz družine pravih reg (Hylidae).
Živi skoraj po celi Evropi (sever Pirenejskega polotoka, Francija, Belgija, Nizozemska, Danska, južna Švedska, Nemčija, Avstrija, Balkan, Apeninski polotok in severozahod Evrope do Urala in Kavkaza). Zeleno rego ogroža predvsem izsuševanje in zastrupljanje mokrišč.
Lövgroda eller vanlig lövgroda (Hyla arborea) är en art i familjen lövgrodor (Hylidae).
Den finns i större delen av södra och centrala Europa med nordgräns i höjd med södra Jylland, södra Skåne och sydligaste Litauen. Den saknas i större delen av Ryssland.[2] Östgränsen går från västra Vitryssland, större delen av Ukraina, Turkiet, Georgien och Azerbajdzjan.[1] Den är enda företrädaren för familjen i Nordeuropa. I Sverige finns den endast i södra Skåne, och där endast sällsynt. Den dog ut i östra Skåne på 1940-talet. I Sydskåne har den gått framåt på senare år, och togs 2005 bort från svenska rödlistan. Under den senaste inverteringen år 2000–2004 iakttogs arten på 793 lokaler, och antalet spelande hanar bedömdes till mellan 16 000 och 31 000.[3]
I övriga Norden finns den endast i fem områden i Danmark; på Bornholm, på Fyn, på Als och i Sydostjylland.[4]
Den är gräsgrön på ovansidan, med ett svart, ofta gulkantat streck på sidorna, på undersidan vitaktig. Hannen har brun strupe, som kan blåsas upp till en stor boll. Kroppslängden kan uppgå till 5 cm.[5]
Lövgrodor lever i träd och buskar. Äldre lövgrodor kan ofta klättra högt upp i lövverket, medan de yngre håller sig nära marken. Den hoppar med stor skicklighet från blad till blad och fångar insekter (även larver).[6] Den undviker alltför tät och mörk skog.[1]
Leken och yngelutvecklingen sker i stillastående vatten som sjöar, dammar och sankmarker, ibland även i mindre vattensamlingar som diken och pölar.[1] Under parningstiden, som i Danmark och Skåne infaller under april till juni, kväker hannarna flitigt, särskilt nattetid. Också senare under sommaren kan man höra dess klingande läte, som kan höras på minst en kilometers håll.[7]
Lövgrodan blir könsmogen vid omkring 3 års ålder, och kan normalt bli upp till 9 år gammal. I fångenskap har som mest 22 år uppnåtts.[8]
Lövgroda eller vanlig lövgroda (Hyla arborea) är en art i familjen lövgrodor (Hylidae).
У цього виду дуже багато назв. Окрім зазначених вище «райка деревна» та «райка звичайна», також є такі: квакша звичайна, ракхавка, деревна жабка, деревна кракавка.
Зустрічаються на більшій частині Центральної та Західної Європи (відсутні в південній Іспанії та південній Франції), на північ межа доходить до Англії (тут інтродукована), північно-західної частини Нідерландів, Норвегії. На сході межа йде приблизно південною Литвою, Білоруссю, прикордонними зі східною Україною областями Росії (Бєлгородська область). В Україні поширена майже по всій території, але найчисленнішою є на Поліссі та в Лісостепу, а також у лісистих районах Криму. В степовій зоні зустрічається по заплавах та плавнях річок, а також у степових байрачних лісах.
На Закарпатті у підхожих для свого оселення місцях чисельність райок доволі висока й навесні на 100 м берегової лінії нерестових водойм нараховується до 20 особин. У басейні річки Південний Буг щільність становить близько 21 ос./га, в південно-східній частині ареалу (Дніпровсько-Орельський заповідник у Дніпропетровській області) — 10-25 ос./100 м². По закінченні сезону розмноження райки й надалі тримаються приблизно таких самих біотопів (долини річок, околиці стоячих водойм тощо), і їхня щільність тут може складати 30-60 ос./га.
У кількісному співвідношенні у цей період на місцях нересту переважають самці, оскільки самиці, як вже зазначалося, полишають водойми відразу ж після парування. Смертність протягом року може досягати 34 % при максимальній тривалості життя в природі до 12 років, хоча в Швейцарії смертність в середньому становить 75 % серед молоді й 70 % серед дорослих, що дозволяє говорити про повну заміну популяції протягом 5 років. Для райок Молдови та Північної Італії вказують смертність 95-99 % молодих особин, малу тривалість життя дорослих (максимум 4-5 років) та оновлення чисельності дорослих на 95 % щороку.
Тварини невеликих розмірів, довжина тіла статевозрілих особин звичайно до 50-60 мм. Пальці задніх кінцівок з'єднані перетинками. Шкіра на спині гладка, на черевному боці грубозерниста. У забарвленні спини найчастіше переважають однотонні яскраво-зелені кольори, хоча трапляються (залежно від субстрату та температури повітря) світло-сірі, коричнюваті або сіро-голубуваті особини. Черевний бік білого або жовтуватого кольору.
Забарвлення верхнього (спинного) та нижнього (черевного) боків тіла розділене двома контрастними темними смугами з жовто-білими краями, кожна з яких тягнеться по обох боках тіла від очей до пахвинної області, утворюючи тут петлю. Темні смуги є також і на морді, де вони сполучають ніздрі та верхньопередні краї очей. Статевий диморфізм виявлений слабо: самці мають непарний горловий резонатор та шлюбні мозолі на першому пальці передніх кінцівок.
Матеріали з морфологічної мінливості райок України обмежені працею М.Щербака (1966), у якій вказано на своєрідність райок Криму та їхню більшу схожість з райками Кавказу, ніж з жителями лісостепової України або Молдови. Ще одне порівняння мінливості розмірів тіла райок з різних ділянок їхнього ареалу (без диференціації за статтю) знову підтвердило, що найбільші за розмірами тварини (довжина тіла в середньому 43 і 39 мм) живуть у Криму та на Закарпатті відповідно. Тварини з інших регіонів України (лісостеп), істотно дрібніші, довжина їхнього тіла становить близько 30 мм.
Матеріали з хромосомного набору обмежуються відомостями щодо каріотипу цих тварин з ділянок ареалу поза межами України (2n = 24, NF = 48). Рівень гетерозиготності цих амфібій у різних пунктах України (окол. Києва, Крим, дельта Дунаю) становить 0,06, 0,038 і 0,048 відповідно. При цьому, якщо міжпопуляційна генетична дистанція між материковими вибірками менше 0,009, то між кримськими та київськими, кримськими та дунайськими вона 0,058 і 0,065 відповідно.
Далі на захід ареалу (Італія, Швейцарія, Німеччина, країни Балканського п-ва) існує дві різко відмінні за 9 генами групи. Одна поширена від Сицилії до півночі Італії включно, друга — в ряді Балканських країн (до південної частини цього півострова). Середня генетична дистанція Нея становить 0,47,що дозволяє оцінити час їх дивергенції у 2-3 млн років. Обидва види — H. intermedia (див. вище) і H. arborea — морфологічно дуже схожі й відрізняються лише розмірами барабанної перетинки, яка в перших більша (Lt. c./L. tym. 4,38 і 4,56 відповідно).
Поява після зимової сплячки залежить від географічної широти місцевості, специфіки весняного періоду і звичайно відбувається у другій половині березня — початку квітня. Перші появи райок на місцях нересту припадають на встановлення температури води 4-6°С, масове заселення нерестилищ на 9-10°С, а початок відкладання ікри — на досягнення водою температури 13 °C.
Сезон розмноження розтягнутий, і співаючих самців райок відзначають з березня-квітня до середини-кінця червня. При виборі місць для розмноження райки найчастіше віддають перевагу більш або менш відкритим ділянкам (зазвичай неподалік від деревних насаджень) зі стоячими водоймами й розвиненою водяною рослинністю. Дослідження гідрохімічних показників нерестових водойм райок показало, що вони характеризуються рН 7,4-9,4, загальною твердістю 1,2-6,5мекв./л, лужністю 0,8-4,9мекв./л. Місця нересту від місць зимівлі (Німеччина) можуть бути розташовані на відстані від 100 м до 13,1 км.
З факторів, що визначають вибір місць розмноження райок (північна Італія), найістотніше значення мають такі як розвиток на поверхні водойм рослинності, вік водойми, прибережні місця оселення, ступінь антропогенного впливу та площа водної поверхні. Ці параметри середовища разом з тим не впливають на щільність тварин.
Першими на місця нересту прибувають самці. Як і деякі інші види безхвостих земноводних, самиці полишають водойми відразу ж після відкладання ікри, самці ж залишаються тут ще на деякий час. Співвідношення самиць та самців за даними для західних популяцій (Швейцарія) становить 1 : 1,5.
Самців райок за поведінкою можна умовно розділити на три групи: представники однієї видають шлюбні крики у воді, другої — на чагарниках, деревах і т. ін., третя група — це мовчазні («сателітні») самці. Характер постійності таких груп потребує підтвердження спеціальними дослідженнями із застосуванням мічення.
Парування та відкладання ікри відбувається зазвичай при температурі води близько 13 °C, ікра відкладається на дно або на підводні рослини кількома невеликими грудками (до 200 яєць), усього у кладці може бути 1500—2000 ікринок. Не виключено, що цим амфібіям в долині Південного Бугу притаманна порційність відкладання ікри. При цьому самиці райок за перший раз відкладають близько 70 % всієї кількості яєць кладки, за другий — близько 20 %, і за третій — близько 10 %. Розміри тіла дворічних самиць тут у середньому становлять 40 мм, а кількість відкладених ікринок близько 450, трирічних — 47 мм і 820, чотирирічних — 52,6 мм і 1123, п'ятирічних — 56,8 мм і 1383 відповідно.
У західних ділянках ареалу (Італія) виявлена наявність двох піків у відкладанні ікри, розділених перервою 5-10 днів. Разом з тим надалі залишається нез'ясованим питання — чи можуть окремі самиці у цьому регіоні нереститися двічі на рік або ж міграція самиць має два піки активності в одному сезоні.
Перебуваючи на місцях нересту, самці райок можуть «регулювати» температуру свого тіла. Так, при падінні температури повітря більше ніж на 1-2°С, самці переміщуються у воду. Температура води 8 °C і повітря 6 °C є критичними для відкладання ікри. Вилуплення личинок при температурі води 17-19°С відбувається приблизно через 8-14 діб, а весь період водного розвитку завершується протягом 45-90 днів. Підвищення температури води на 5-6°С скорочує період личинкового розвитку приблизно на 10 днів.
Розміри щойно вилуплених з ікри личинок 5-10 мм (довжина тіла з хвостом), зяберний отвір розташований на лівому боці й скерований назад і догори, анальний отвір розташований на правому боці. Хвостовий плавець високий, його кінець загострений. Є вказівки на те, що пізні строки личинкового розвитку в окремих випадках можуть приводити до зимівлі на личинковій стадії, що відзначено для Карпат.
Відразу ж після проходження метаморфозу молоді особини деякий час залишаються поблизу водойм, потім мігрують до місць зимівлі. Розміри тіла ювенільних райок при цьому складають усього 15-20 мм. Статевої зрілості райки досягають на 2-4-у році життя при довжині тіла самців 35 мм і самиць 37 мм.
Результати багаторічного мічення цих тварин у дещо західніших ділянках ареалу (Швейцарія) показали, що тут більшість самиць досягає статевої зрілості приблизно у тому ж віці (два роки) при середній довжині тіла 36,7 мм. У Північній Італії та Молдові статеваї зрілість самців настає на другому році життя, самиць — на третьому.
Абсолютна плодючість залежить від розмірів самиці й коливається від 692 до 1872 яєць, відносна (кількість ікринок на 1 г маси самиці) — від 88 до 126.
На відміну від усіх інших видів земноводних України райки добре лазять по вертикальних (у тому числі по гладких) поверхнях і охоче населяють нижній та середній яруси деревних насаджень, піднімаючись на висоту близько 2 м. Їм властива присмерково-нічна активність: вдень вони звичайно тримаються на стовбурах, гіллі, листі дерев, на високій траві, а увечері та вночі спускаються на землю для поповнення запасів води.
Райки характеризуються виразною прив'язаністю до своїх місць перебування. Так, у Нідерландах з помічених мігруючих тварин понад 82 % не долали відстані 850 м (хоча найбільша зареєстрована дистанція переміщень після зимівлі становила 12,6 км). Сезон активності триває до вересня-жовтня, після чого райки йдуть на зимівлю, яка відбувається на суші у порожнинах ґрунту, норах, купах каміння, є згадка про зимівлю в дуплах дерев. У працях минулих років стверджувалося про зимівлю більшості тварин у водоймах.
Дослідження особливостей живлення райок у Карпатах показало, що вони живляться головним чином комахами, серед яких жуки-попики (Chrysomelidae) та двокрильці становлять 81 % і 70,5 % раціону відповідно. У цілому можна відзначити, що основа раціону представлена наземними комахами, при цьому частка летючих форм складає істотну частину, досягаючи майже 20-50 %. Райки звичайно живляться на суші, при цьому можуть полювати й на високих стеблах.
Порівняння живлення райок з іншими видами безхвостих амфібій, що живуть у тих самих або в сусідніх біотопах (землянка (Pelobates fuscus) та зелені жаби (Pelophilax esculentus complex)), дозволило з'ясувати, що коефіцієнт перекривання (0 — при повному неперекриванні, 1— при повному перекриванні) ніш райки та зелених жаб становить 0,7899, тоді як райок та землянок — лише 0,4008.
Цьоголітків райок виявляли у складі живлення гребінчастих тритонів, дорослих — в озерних жаб, болотяних черепах, водяного і звичайного вужів та багатьох птахів: воронових, фазана, крижня, сірої чаплі тощо.
Попри те, що райка в межах свого ареалу нерідко трапляється у населених пунктах, усе ж такі антропогенні фактори, як зникнення лісонасаджень, забруднення водойм і т. ін. призводять до зменшення чисельності популяцій. Інші причини зникнення виду можуть бути пов'язані з будівництвом гідроспоруд, як, наприклад, на Південному Бузі в Миколаївській області, в результаті чого прогнозується затоплення заплавних ділянок та нижнього ярусу каньйону річки. Багаторічні дослідження популяцій цього виду в західних ділянках ареалу (Німеччина) дозволили дійти висновку про те, що відсутність в наш час райок у деяких місцях пов'язана з двома основними причинами: зникненням нерестових водойм та забрудненням середовища.
Вид занесено до Додатку II «Конвенції з охорони дикої флори і фауни та природного середовища існування в Європі» (категорія «види, що підлягають особливій охороні») та до «Червоної книги хребетних Міжнародного союзу охорони природи (МСОП)» (категорія «відносно благополучні види»).
Hyla arborea là một loài ếch trong họ Nhái bén. Loài này sinh sống ở châu Âu. Có năm phân loài. H. arborea là những thành viên duy nhất của họ Nhái bén phổ biến rộng rãi, bản địa châu Âu đại lục. H. arborea được tìm thấy ở châu Âu (trừ Anh, Ireland, Bồ Đào Nha và Tây Ban Nha), phía tây bắc châu Phi, và ôn đới châu Á, Nhật Bản. Nó là loài bản địa các nước sau:
Albania; Armenia, Áo, Azerbaijan, Belarus, Bỉ, Bosnia và Herzegovina; Bulgaria; Croatia, Cộng hòa Séc, Đan Mạch, Pháp, Georgia, Đức, Hy Lạp, Hungary; Israel (tìm thấy ở thung lũng Ayalon); Italia; Liechtenstein, Lithuania Luxumbuourg, Makedonia, Cộng hòa Nam Tư cũ, Moldova, Montenegro, Hà Lan, Ba Lan, Romania, Liên bang Nga, Serbia, Slovakia, Slovenia, Thụy Điển, Thụy Sĩ, Thổ Nhĩ Kỳ, Ukraina. Nó cũng đã được nhập nội vào Vương quốc Anh, và nó đã được nhập nội là vào Latvia. H. arborea có thể được tìm thấy trong vùng đầm lầy, đồng cỏ ẩm ướt, lau sậy, công viên, vườn hoa, vườn nho, vườn cây ăn trái, ven bờ sông, bờ ao hồ, hoặc rừng ẩm ướt hoặc khô. Chúng có xu hướng tránh tối hoặc rừng dày, và chúng có thể chịu đựng được một số giai đoạn khô, do đó, đôi khi chúng được tìm thấy trong môi trường sống khô ráo.
Hyla arborea là một loài ếch trong họ Nhái bén. Loài này sinh sống ở châu Âu. Có năm phân loài. H. arborea là những thành viên duy nhất của họ Nhái bén phổ biến rộng rãi, bản địa châu Âu đại lục. H. arborea được tìm thấy ở châu Âu (trừ Anh, Ireland, Bồ Đào Nha và Tây Ban Nha), phía tây bắc châu Phi, và ôn đới châu Á, Nhật Bản. Nó là loài bản địa các nước sau:
Albania; Armenia, Áo, Azerbaijan, Belarus, Bỉ, Bosnia và Herzegovina; Bulgaria; Croatia, Cộng hòa Séc, Đan Mạch, Pháp, Georgia, Đức, Hy Lạp, Hungary; Israel (tìm thấy ở thung lũng Ayalon); Italia; Liechtenstein, Lithuania Luxumbuourg, Makedonia, Cộng hòa Nam Tư cũ, Moldova, Montenegro, Hà Lan, Ba Lan, Romania, Liên bang Nga, Serbia, Slovakia, Slovenia, Thụy Điển, Thụy Sĩ, Thổ Nhĩ Kỳ, Ukraina. Nó cũng đã được nhập nội vào Vương quốc Anh, và nó đã được nhập nội là vào Latvia. H. arborea có thể được tìm thấy trong vùng đầm lầy, đồng cỏ ẩm ướt, lau sậy, công viên, vườn hoa, vườn nho, vườn cây ăn trái, ven bờ sông, bờ ao hồ, hoặc rừng ẩm ướt hoặc khô. Chúng có xu hướng tránh tối hoặc rừng dày, và chúng có thể chịu đựng được một số giai đoạn khô, do đó, đôi khi chúng được tìm thấy trong môi trường sống khô ráo.
Обыкновенная квакша[1][2], или древесница[2] (лат. Hyla arborea) — лягушка из рода квакш до 5 см длиной.
Квакши[3] — небольшие лягушки с максимальной длиной тела 53 мм (в Европе до 60 мм). Окраска очень изменчива, может меняться буквально на глазах, в зависимости от цвета субстрата и физиологического состояния. Сверху от травянисто-зеленого до темно-серого, синеватого или бурого цвета. По бокам головы и туловища проходит темная с белой каемкой сверху полоса, которая около паховой области образует петлю. Снизу белого или желтоватого цвета. У самцов горло темное.
Встречаются на большей части Центральной и Западной Европы (за исключением южной Испании и южной Франции), на севере границы доходят до Великобритании (здесь интродуцирована), северно-западной части Нидерландов, Норвегии. На востоке граница проходит по северо-западной Латвии,[4] Белоруссии, пограничными с восточной Украиной областями России (Белгородская область). На Украине распространена почти по всей территории, но наибольшая численность на Полесье и в лесостепях. Распространены в лесных районах Крыма. В степной зоне встречается на берегах рек.
Весной квакши пробуждаются в конце марта — начале апреля, в Молдавии в первой декаде апреля, в Карпатах и Крыму в апреле-мае, на Кавказе в начале марта, при температуре воздуха 8—12° С. Иногда им приходится преодолевать до 750 м, чтобы попасть в водоем. Самцы, приходящие первыми, концентрируются по краю водоема.
Для размножения используют различные хорошо прогреваемые водоемы со стоячей водой и растительностью. Это могут быть мелкие водоемы на просеках или опушках леса, лужи, болотца, мелиоративные канавы, мелководная прибрежная часть озер. В реках и других проточных водоемах квакши икру не откладывают. Интенсивные ночные концерты, устраиваемые самцами, могут продолжаться до конца мая.
Нерест происходит при температуре воды 13°С. Самка откладывает около 690—1870 икринок несколькими порциями в виде небольших комочков (в Молдавии 15—21 комочков по 21—56 икринок). Кладки лежат на дне водоема или прикреплены к растениям. Период икрометания растянут и длится с начала апреля до конца июля, на Кавказе с конца марта до мая. Диаметр икринки с оболочкой 3—4,5 мм, яйцеклетки 1,0—1,6 мм. Эмбриональное развитие длится около 8—14 суток. Размер личинок после выклева 8—9 мм. Личиночное развитие продолжается 45—90 суток. Перед метаморфозом головастики достигают длины 46—49 мм. В Карпатах отмечены случаи зимовки личинок. Сеголетки длиной 10—17 мм и более выходят на сушу в дневное время в июле — начале сентября. В отличие от взрослых они весьма активны днем и держатся в основном на траве у водоемов.
歐洲樹蛙(學名:Hyla arborea)是歐洲大陸特有的一種樹蟾。
歐洲樹蛙的體型細小,一般長3-4厘米,最長也只有4.5厘米。綠色的背及白黃色的腹部之間有一道黑間分隔,黑間由鼻孔向兩側伸延,到臀部形成一個黑點。牠們的後肢比前肢大及強壯,可幫助跳躍。牠們的趾上有圓盤,用來攀樹或樹籬。牠們的頭圓,嘴唇向下,瞳孔呈橫橢圓形,耳膜清晰可見。牠們可以將皮膚的顏色由鮮綠色轉變為橄欖綠色、灰色、褐色及黃色,視乎不同的亞種、溫度、濕度及情緒而定。雄蛙有很大及呈褐黃色的聲囊。
歐洲樹蛙並非生活在樹林中,而是活躍於森林邊緣、石南樹叢、潮濕沙丘、叢林、草原及有湖的公園內。牠們的棲息地經常受到人類活動的騷擾。牠們在西歐正處於瀕危,在比利時已接近滅絕。
歐洲樹蛙傳統上被視為天然的氣壓錶,從叫聲能夠測度是否會下雨。在繁殖季節時,當牠們遷往繁殖池時也會嘎嘎叫。牠們交配時的抱對方式是腋抱式的。