fi
nimet breadcrumb-navigoinnissa


Haemophilus influenzae, anteriorment anomenat bacil de Pfeiffer o Bacillus influenzae, és un cocbacil gram-negatiu no mòbil descrit el 1892 per Richard Pfeiffer durant una pandèmia de grip. És generalment aerobi però pot créixer com anaerobi facultatiu. H. influenzae va ser considerat erròniament com la causa de la grip comuna fins a 1933, quan l'etiologia viral de la grip va arribar a ser aparent. No obstant això, H. influenzae és responsable d'un ampli rang de malalties com meningitis, epiglotitis, pneumònia, sèpsia i altres de menor gravetat.[1]
A causa del seu petit genoma, H. influenzae va ser el primer organisme de vida lliure el genoma complet del qual va ser seqüenciat, per Craig Venter. El seu genoma consisteix d'1.830.140 parells de bases i conté 1.740 gens.[2]
En 1930 es van definir dues categories principals de H. influenzae: ceps amb càpsula i sense ella. La patogènia de les infeccions de H. influenzae no es comprèn totalment, encara que la presència del tipus B encapsulat (HiB) és el principal factor de virulència. La seva càpsula li permet resistir la fagocitosi i la lisi als hostes no immunitzats. Els ceps no encapsulats són menys invasius, encara que són capaços d'induir una resposta inflamatòria que causa nombrosos símptomes. Exemples d'infecció per ceps capsulats són meningitis, pneumònia i epiglotitis. La vacunació amb la vacuna Hib conjugada és efectiva en la prevenció de la infecció i diverses vacunes estan ara disponibles per a ús rutinari.

La majoria de soques de H. influenzae són patògens oportunistes, això és, usualment viuen en el seu hoste sense causar malalties, però poden causar problemes quan altres factors (com una malaltia viral que redueixi la resposta immune) creen una oportunitat infecciosa. Es coneixen sis tipus de H. influenzae encapsulades: a, b, c, d, i i f,[3] així com soques no encapsulades, responsables de malalties emergents.[4]
Les malalties causades naturalment per H. influenzae semblen afectar solament als éssers humans. En els nens, H. influenzae tipus B (HIB) causa bacterièmia i meningitis bacteriana aguda. Ocasionalment causa cel·lulitis, osteomielitis, epiglotitis i infeccions associades. A causa de l'ús rutinari de la vacuna HIB conjugada als Estats Units des de 1990, la incidència de la malaltia HIB invasiva s'ha reduït a 1,3/100.000 nens. No obstant això, HIB continua sent la causa principal de les infeccions del tracte respiratori inferior en nens dels països en vies de desenvolupament que no realitzen vacunacions. Les soques de H. influenzae sense càpsula (no del tipus B) causen infeccions de l'oïda (otitis mitjana), oculars (conjuntivitis) i sinusitis en nens i s'associen amb la pneumònia. La meningitis, especialment en infants, nens majors de 7 anys i en els ancians, és la manifestació clínica més seriosa de les invasions tissulars causades per Haemophilus influenzae.[5] Certes soques de tipus no-b apareixen amb mutacions que causen malalties invasives en individus vacunats en contra del tipus b (les soques encapsulades).[4]
El diagnòstic clínic de H. influenzae típicament es realitza per cultius o per la tècnica d'aglutinació en làtex. El diagnòstic es considera confirmat quan l'organisme és aïllat a un lloc estèril del cos. Cal esmentar que H. influenzae cultivat a partir d'esput o des de la cavitat nasofaríngea no és vàlid a causa que generalment aquestes zones estan colonitzades per l'agent. Altres llocs com el líquid cefaloraquidi i la sang sí que són vàlids i confirmatius.
Els cultius bacterians de H. influenzae es realitzen en plaques d'agar, de preferència agar xocolata, amb addició de X (hemina) i V (NAD), a 37 °C en un incubador enriquit amb CO₂.[6] El creixement en agar sang és només un fenomen satèl·lit al voltant d'altres bacteris. Les colònies de H. influenzae apareixen com a colònies convexes, llises, pàl·lides, grises o transparents. L'observació amb tinció de gram i microscòpics d'un espècimen de H. influenzae mostrarà cocbacils gram-negatius, sense acord específic. L'organisme cultivat pot caracteritzar-se encara més mitjançant proves de catalasa i oxidasa, les quals han de ser positives. Es requereixen proves serològiques per a distingir el polisacàrid capsular i diferenciar entre ceps b de H. influenzae i els ceps no encapsulats. Encara que molt específics, el cultiu bacterià de H. influenzae té poca sensibilitat. L'ús d'antibiòtics abans d'obtenir la mostra redueix en gran mesura la taxa d'aïllament ja que s'eliminen els bacteris abans que la identificació sigui possible.[7] Més enllà d'això, H. influenzaeés un bacteri meticulós al moment del cultiu, i qualsevol modificació dels procediments del cultiu pot reduir les taxes d'aïllament.
H. influenzae creix a la zona hemolítica de Staphylococcus aureus en plaques d'agar sang donat que l'hemòlisi de les cèl·lules de S. aureus allibera nutrients vitals per al seu creixement. H. influenzae no creix fora de la zona hemolítica de S. aureus a causa de la falta de nutrients en aquestes zones.
La prova d'aglutinació de partícules de làtex (LAT per les seves sigles en anglès, Latex particle agglutination test) és un mètode més sensible per a la detecció de H. influenzae.[8] Donat que el mètode es basa en antígens en lloc de bacteris viables en un cultiu, els resultats no es veuen afectats per l'ús previ d'antibiòtics. També té el benefici addicional de ser molt més ràpid que els mètodes de cultiu. No obstant això, no es pot detectar la sensibilitat a antibiòtics amb LAT, per la qual cosa és necessari fer un cultiu paral·lelament.
La reacció en cadena de la polimerasa (PCR) ha demostrat ser més sensible que les proves de LAT o el cultiu, sent molt específiques.[9] No obstant això, la PCR encara no s'ha convertit en una prova rutinària a la pràctica clínica. La immunoelectroforesi a contracorrent ha demostrat ser un mètode d'investigació de diagnòstic eficaç, però ha estat reemplaçat en gran part per la PCR.
Haemophilus influenzae produeixbeta-lactamases, i també és capaç de modificar les seves proteïnes d'unió a la penicil·lina, de manera que és resistent a la família d'antibiòtics de les penicil·lines. En casos severs, la cefotaxima i la ceftriaxona per via intravenosa són els antibiòtics d'elecció, i, per als casos menys greus, es prefereix una associació d'ampicil·lina i sulbactam, cefalosporines de segona i tercera generació, o fluoroquinolones, encara que s'han observat Haemophilus influenzae resistent a les fluoroquinolones.[10]
Els macròlids (com per exemple la claritromicina) es poden utilitzar en pacients amb antecedents d'al lèrgia als antibiòtics beta-lactàmics, encara que també s'han aïllat ceps resistents als macròlids.[11]
Existeixen vacunes eficaces per Haemophilus influenzae des de principis de 1990, per la qual cosa es pot prevenir. Malauradament, la vacuna contra l'Hib costa al voltant de set vegades el cost total de les vacunes contra el xarampió, la poliomielitis, la tuberculosi, la diftèria, el tètanus i la tos ferina. En conseqüència, mentre que el 92% de la població dels països desenvolupats han estat vacunats contra el Hib a partir del 2003, la cobertura de vacunació va ser del 42% en els països en desenvolupament, i només el 8% per als països menys avançats.[12]
H. influenzae va ser el primer organisme de vida lliure de tenir el seu genoma sencer seqüenciat, obra de Craig Venter i el seu equip. Es va elegir aquest microorganisme perquè un dels líders del projecte, el premi Nobel Hamilton Smith, hi havia estat treballant-hi durant dècades i va proporcionar biblioteques d'ADN d'alta qualitat. El genoma consta d'1.830.140 parells de bases d'ADN en un únic cromosoma circular que conté 1.740 gens que codifiquen proteïnes, 58 gens d'ARN de trasnferència (ARNt), i 18 altres gens ARN. El mètode utilitzat és la seqüenciació del genoma complet en escopetada (Shotgun sequencing), que va ser acabat i publicat a Science el 1995 i el va dur a terme a l'Institut de Recerca Genòmica dels Estats Units.[2]
Haemophilus influenzae, anteriorment anomenat bacil de Pfeiffer o Bacillus influenzae, és un cocbacil gram-negatiu no mòbil descrit el 1892 per Richard Pfeiffer durant una pandèmia de grip. És generalment aerobi però pot créixer com anaerobi facultatiu. H. influenzae va ser considerat erròniament com la causa de la grip comuna fins a 1933, quan l'etiologia viral de la grip va arribar a ser aparent. No obstant això, H. influenzae és responsable d'un ampli rang de malalties com meningitis, epiglotitis, pneumònia, sèpsia i altres de menor gravetat.
A causa del seu petit genoma, H. influenzae va ser el primer organisme de vida lliure el genoma complet del qual va ser seqüenciat, per Craig Venter. El seu genoma consisteix d'1.830.140 parells de bases i conté 1.740 gens.
Haemophilus influenzae je gramnegativní fakultativně anaerobní nepohyblivý opouzdřený kokobacil.
Mezi hlavní faktor virulence patří pouzdro, které zvyšuje invazivitu H.influenzae. Lipopolysacharid (LPS) je zodpovědný za rozvoj zánětu. Pomocí pilů a adhezinů je schopný adherovat na sliznice. IgA proteáza štěpí IgA slizniční protilátky.
Původně byl považován za původce chřipky (od toho jeho název). Přenáší se kapénkovou infekcí. Způsobuje meningitidy (zejména u dětí), epiglotitidy, otitidy a pneumonie.
Roste pouze na čokoládovém agaru po přidání růstových faktorů (hemin a NAD).
Je citlivý na aminopeniciliny, cefalosporiny III. generace, popřípadě v kombinaci s inhibitory beta-laktamáz. Očkování probíhá jako součást hexavakcíny, která obsahuje polysacharid b pouzdra.
Haemophilus influenzae je gramnegativní fakultativně anaerobní nepohyblivý opouzdřený kokobacil.
Haemophilus influenzae, er en Gram-negativ bakterie, formet som en kokkoid stav. Bakterien blev først beskrevet i 1892 af Richard Pfeiffer under en influenzapandemi. Den er medlem af Pasteurellaceae familien, den vokser generelt aerob, men kan vokse anaerob.
Man troede indtil 1933 at H. influenzae var årsag til influenza, men det år fandt man den virus der er den egentlige årsag. H. influenzae giver mange forskellige sygdomme bl.a. meningitis (hjernehindebetændelse) og epiglottitis (strubelågsbetændelse).
H. influenzae var den første fritlevende organisme der fik sekventeret hele sit genom.
I 1930 blev to store kategorier af H. influenzae defineret: den non-kapsulate og den kapsulate form. Der kendes seks typer af kapsulerede H. influenzae: a, b, c, d, e, og f.
Patogenesen af H. influenzae infektioner er ikke fuldt forstået, selvom tilstedeværelse af kapselen type b(Hib) vides at gøre bakterien særligt virulent. Kapslen tillader bakterien at være svær for kroppens makrofager at fagocytose, desuden er komplement-medieret lyse hæmmet. Non-kapsulate former er næsten altid mindre invasive, de kan dog producere et inflammatorisk respons i mennesker, hvilket kan give symptomer.
De fleste former af H. influenzae er opportunistisk patogene, det vil sige at de ofte lever i deres vært, uden at give sygdom, men kan give problemer fx når værtens immunforsvar er svækket, eller man samtidig har en virusinfektion.
Hos nyfødte og små børn giver H. influenzae type b (Hib) bakteriæmi, pneumoni, strubelågsbetændelse og akut bakteriel meningitis samt andre infektioner. Efter indførelsen af vaccinationen er tilfældene af sygdom med Hib dog faldet drastisk. De non-kapsulate former af H. influenzae kan give øreinfektioner(mellemørebetændelse), øjeninfektioner og sinuitis hos børn, og er associeret med pneumoni.
Bakterien kan dyrkes, men bakterien har brug for tilstedeværelse af NAD og hæmin i det medie, hvor den dyrkes. Derfor skal den dyrkes på chokoladeagar, eller omkring en Staphylococcus aureus på en blodagar, hvorved den har tilgang til de rette næringsstoffer.
Prøvematerialet tages ved fx svælgpodning, ekspektorat, cerebrospinalvæske eller blodprøve.
Polymerase Chain Reaction (PCR) er ofte en bedre metode til at påvise bakterien end dyrkning, da PCR er langt mere specifikt. Metoden er dog noget dyrere end at dyrke den, hvilket er årsag til at det diagnostisk ikke bruges så ofte.
Haemophilus influenzae producerer beta-lactamaser og kan samtidig modificere dens penicillin-bindende proteiner. Dette gør bakterien resistent overfor penicillin, derfor bruges ampicillin til behandling.
Til forebyggelse af infektioner med H. influenzae type b findes der en vaccine. Børn vaccineres mod denne type når de er 3, 5 og 12 måneder gamle. Vaccinen består af renset kapselpolysakkarid bundet til tetanustoksoid. Vaccinen virker således ikke i forhold til den non-kapsulate form(da det er kapslen man vaccinerer imod)
Haemophilus influenzae, er en Gram-negativ bakterie, formet som en kokkoid stav. Bakterien blev først beskrevet i 1892 af Richard Pfeiffer under en influenzapandemi. Den er medlem af Pasteurellaceae familien, den vokser generelt aerob, men kan vokse anaerob.
Man troede indtil 1933 at H. influenzae var årsag til influenza, men det år fandt man den virus der er den egentlige årsag. H. influenzae giver mange forskellige sygdomme bl.a. meningitis (hjernehindebetændelse) og epiglottitis (strubelågsbetændelse).
H. influenzae var den første fritlevende organisme der fik sekventeret hele sit genom.
Die invasive Haemophilus-influenzae-b-Infektion ist eine der schwersten bakteriellen Infektionen in den ersten fünf Lebensjahren. Der Erreger kommt nur beim Menschen vor und findet sich vor allem auf den Schleimhäuten der oberen Atemwege.
Erreger ist Haemophilus influenzae vom Typ b (Hib), ein gramnegatives Bakterium, das von Mensch zu Mensch über Tröpfcheninfektion verbreitet wird. Die Inkubationszeit beträgt zwei bis fünf Tage. Danach können fieberhafte Infektionen des Nasenrachenraums mit Mittelohr-, Nasennebenhöhlen- und Lungenentzündung auftreten. Gefürchtete Komplikationen sind Hirnhautentzündungen oder Entzündungen des Kehldeckels, die mit Erstickungsanfällen einhergehen. Bleibende Schäden und Todesfälle sind möglich.
Solange Keime aus dem Nasenrachenraum isoliert werden können, besteht Ansteckungsgefahr. Sehr selten erfolgt eine erneute Infektion bei Kindern unter zwei Jahren. Ein erhöhtes Infektions- und Komplikationsrisiko besteht bei eingeschränkter Funktion oder nach entfernter Milz.
Bekapselte oder unbekapselte Haemophilus influenzae besiedeln natürlicherweise die Schleimhäute, insbesondere die der oberen Atemwege. Sie können aber dort z. B. infolge eines viralen Infektes zu eitrigen Infektionen führen.
Übertragen werden die Bakterien über Tröpfcheninfektion oder direkten Kontakt, die Inkubationszeit liegt zwischen zwei und fünf Tagen. Sowohl Kranke als auch gesunde Keimträger können ansteckend sein.[1] Die Krankheit beginnt als fieberhafte Infektion des Nasenrachenraums und kann dann Mittelohr- und Nasennebenhöhlenentzündung, akute Bronchitis und Lungenentzündung hervorrufen, überwiegend durch unbekapselte Stämme.[2] Bei einer Mittelohrentzündung kann Haemophilus influenzae auch Biofilme ausbilden, die eine Therapie erschweren.[3]
Bekapselte Stämme wie Haemophilus influenzae Typ b aber auch Stämme des Biotyps I und II können gelegentlich die Schleimhautbarriere (Mukosabarriere) überwinden.[2] Das Kapselpolysaccharid vermittelt hierbei die Virulenz, auch das Lipopolysaccharid unterstützt eine invasive Infektion.[3] Hierbei gelangen die Bakterien zwischen den Epithelzellen in die Submukosa und können sich vom Nasen-Rachenraum über den Blutweg in andere Organe ausbreiten – mit entsprechendem Krankheitsbild (Sepsis, Arthritis, Osteomyelitis, Phlegmone, Perikarditis).[2][1]
Die schwerwiegendste bzw. bedrohlichste Komplikation ist eine eitrige Hirnhautentzündung (Meningitis). Sie kann auch von einer Ohrinfektion ausgehen.[3] Klinisch ist sie nicht von einer Meningokokken-Meningitis unterscheidbar.[1] Die ersten Symptome sind Reizbarkeit, Schläfrigkeit oder Erbrechen. Nach 12 bis 24 Stunden steigt der Hirndruck mit weiteren Symptomen (Krämpfe, Bewusstlosigkeit, Atemstillstand, Hypothermie, Schock mit Verbrauchskoagulopathie).[2] Unbehandelt sterben 20 bis 60 Prozent der Erkrankten, die eine Meningitis entwickeln.[4] Auch bei rechtzeitiger Behandlung mit Antibiotika beträgt die Todesrate noch mehr als fünf Prozent.[4] Nach überstandener Hirnhautentzündung kommt es oftmals zu Defektheilungen mit dauerhaften Schäden des Nervensystems wie Hörschäden (auch Taubheit), Sehstörungen (auch Blindheit) oder geistigen Störungen (20–40 %).[4] Etwa fünf Prozent der Kinder sind nach einer Hib-Hirnhautentzündung körperlich und geistig schwerstbehindert.
Weitere Komplikationen einer Infektion können sehr plötzlich einsetzende Kehldeckelentzündungen (akute Epiglottitis) bzw. eine akute Kehlkopfverengung (Larynxstenose) mit Erstickungsgefahr, Brustfell- oder Gelenkentzündung, Blutvergiftung und Knochenhautentzündung sein. Das Vollbild entwickelt sich innerhalb 2 bis 24 Stunden.[2] Sie geht mit einem hohen Fieber einher und kann innerhalb kürzester Zeit in ein fulminantes Stadium gelangen.[1] Falls man keine lebensrettende Intubation durchführen kann, versterben die meisten bereits auf dem Weg zum Arzt bzw. zur Klinik.[2]
Bei Erwachsenen kommt es zu Sekundärinfektionen mit H. influenzae, zum Beispiel nach einer akuten Bronchitis oder einer virusbedingten Lungenentzündung. Bei Rauchern ist die Epithelbarriere der Bronchialschleimhaut aufgrund des Nikotins bereits vorgeschädigt, was eine Invasion auch durch unbekapselte, körpereigene Stämme begünstigt.[1] Dies führt zu einer chronischen Bronchitis (Raucherhusten).
Bevor Impfstoffe in Ländern der Dritten Welt zugänglich waren, starben im Jahre 2000 weltweit noch geschätzt 371.000 Kinder unter 5 Jahren an dieser impfpräventablen Infektion, über 8 Millionen Kinder erkrankten.[5][4] Heute wie damals sind insbesondere Kinder zwischen dem 6. Lebensmonat und dem 4. Lebensjahr betroffen.[1][6] Eine Hib-Infektion hinterlässt eine Immunität gegen Hib.[3]
Einer diagnostizierten Infektion wird mit der Gabe von Ampicillin begegnet; die Therapie sollte so früh wie möglich beginnen.[1] Eine mögliche Resistenz gegenüber diesem Antibiotikum wird plasmidkodiert übermittelt und wird zunehmend beobachtet. Daher werden alternativ Cephalosporine der 3. Generation (10–15 % intravenös)[7] oder Chinolone bzw. auch Makrolide (z. B. Clarithromycin) empfohlen.[1]
Falls Kinder infolge der Infektion an einer akuten Mittelohrentzündung erkranken, werden leichte Fälle antibiotisch nicht behandelt, andernfalls mittels Amoxicillin.[7] Die parallele Gabe von Clavulansäure kann der β-Laktamase von Hib entgegenwirken.
Im Falle einer durch Haemophilus influenzae verursachten Meningitis (Hirnhautentzündung) erhalten enge Kontaktpersonen des Patienten eine Chemoprophylaxe mit Rifampicin, Schwangere mit 500 mg Ceftriaxon.[8]
Bei Wohngemeinschaften oder Familien mit ungeimpften Kindern unter 4 Jahren bzw. mit Immunsupprimierten kann zur Prophylaxe Rifampicin gegeben werden (tägliche Einzeldosis von 20 mg/kg Körpergewicht über vier Tage).[9] Während Kleinkinder unter einem Monat durch den Nestschutz geschützt sind, können Erwachsene alternativ auch ein Einzeldosis an 500 mg Ciprofloxacin erhalten.
Wenn der Erreger Haemophilus influenzae direkt via Blut- oder Liquortest nachgewiesen wird, ist dies in Deutschland meldepflichtig gemäß Absatz 1 Nr. 18 des Infektionsschutzgesetzes (IfSG). Die Leitung einer Gemeinschaftseinrichtung (z. B. in einem Kindergarten) muss das Gesundheitsamt beim Auftreten einer Hib-Hirnhautentzündung (Meningitis) oder eines Verdachtsfalles gemäß IfSG informieren.[10] Bis zum Ende der Kontagiosität darf diese Einrichtung nicht besucht werden. Schließlich ist auch ein Auftreten oder der Verdacht einer Hib-Meningitis in einer Wohngemeinschaft gemäß IfSG Absatz 3 zu melden.[10]
In der Schweiz ist ein laboranalytischer Befund von invasiver Haemo-philus-influenzae-Erkrankung für Ärzte, Spitäler usw. meldepflichtig und zwar nach dem Epidemiengesetz (EpG) in Verbindung mit der Epidemienverordnung und der Verordnung des EDI über die Meldung von Beobachtungen übertragbarer Krankheiten des Menschen.
In Österreich sind sowohl eine Haemophilus influenzae-Meningitis als auch alle invasiven influenzae-Erkrankungen als invasiven bakteriellen Erkrankungen (Meningitiden und Sepsis) meldepflichtig.[11][12] Dies bezieht sich nach Abs. 1 Nummer 2 Epidemiegesetz 1950 auf Erkrankungs- und Todesfälle.
Nach der Einführung der allgemeinen Impfung von Kindern Anfang der 1990er Jahre wurde weltweit ein dramatischer Rückgang der Fallzahlen von Infektionen durch Haemophilus influenzae Typ b beobachtet. So fiel die Inzidenz in den USA bei unter Fünfjährigen von über 80 auf 0,5 pro 100.000.[3] In der Folge wurden Wiederanstiege unter geimpften Kindern und Heranwachsenden in Großbritannien und den Niederlanden verzeichnet.[13] 2018 wurden 851 Fälle invasiver Infektionen durch Haemophilus influenzae in Deutschland gemeldet, davon 40 bei Kindern im Alter bis 5 Jahren und 646 bei Erwachsenen über 59 Jahre.[14] Von den gemeldeten Fällen konnten wiederum 36 eindeutig dem Kapseltyp b zugeordnet werden. Wichtig ist, die Kinder so früh wie möglich entsprechend den offiziellen Empfehlungen zu impfen, denn Säuglinge sind die am meisten gefährdete Gruppe.[15]
Meist werden Kombinationsimpfstoffe eingesetzt, die als einen Anteil die Hib-Komponente beinhalten. Über Impfreaktionen wie leichte Temperaturerhöhung oder Rötung und Schwellung an der Einstichstelle wird gelegentlich berichtet.[16] Im Allgemeinen treten diese Reaktionen nach der zweiten und dritten Impfung etwas häufiger auf. Die Impfung richtet sich gegen Serotyp b, gegen andere Serotypen oder unbekapselte Stämme zeigt er keine Wirkung.[7]
Geimpft werden sollten ferner unbedingt alle Patienten ohne Milz (z. B. nach einer Splenektomie) oder mit bestimmten Erkrankungen, die die Funktion der Milz beeinträchtigen (funktionelle Asplenie).[17]
Die invasive Haemophilus-influenzae-b-Infektion ist eine der schwersten bakteriellen Infektionen in den ersten fünf Lebensjahren. Der Erreger kommt nur beim Menschen vor und findet sich vor allem auf den Schleimhäuten der oberen Atemwege.
Erreger ist Haemophilus influenzae vom Typ b (Hib), ein gramnegatives Bakterium, das von Mensch zu Mensch über Tröpfcheninfektion verbreitet wird. Die Inkubationszeit beträgt zwei bis fünf Tage. Danach können fieberhafte Infektionen des Nasenrachenraums mit Mittelohr-, Nasennebenhöhlen- und Lungenentzündung auftreten. Gefürchtete Komplikationen sind Hirnhautentzündungen oder Entzündungen des Kehldeckels, die mit Erstickungsanfällen einhergehen. Bleibende Schäden und Todesfälle sind möglich.
Solange Keime aus dem Nasenrachenraum isoliert werden können, besteht Ansteckungsgefahr. Sehr selten erfolgt eine erneute Infektion bei Kindern unter zwei Jahren. Ein erhöhtes Infektions- und Komplikationsrisiko besteht bei eingeschränkter Funktion oder nach entfernter Milz.
Haemophilus influenzae (formerly called Pfeiffer's bacillus or Bacillus influenzae) is a Gram-negative, non-motile, coccobacillary, facultatively anaerobic, capnophilic pathogenic bacterium of the family Pasteurellaceae. The bacteria are mesophilic and grow best at temperatures between 35 and 37°C.[1]
H. influenzae was first explained in 1893[2] [3] by Richard Pfeiffer during an influenza pandemic[4] when he incorrectly described Haemophilus influenzae as the causative microbe, which is why the bacteria retain the name "influenza".[5][6] H. influenzae is responsible for a wide range of localized and invasive infections, typically in infants and children,[7] including pneumonia, meningitis, or bloodstream infections.[8] Treatment consists of antibiotics, however H. influenzae is often resistant to the penicillin family but amoxicillin/clavulanic acid can be used in mild cases.[9] The recommended form of prevention of the type b form of H. influenzae is a series of the Hib vaccine and boosters, which are most often given under the age of 5, and sometimes in conjunction with other vaccines in the form of the DTaP-IPV/Hib vaccine.[10]
This species was the first free-living microorganism to have its entire genome sequenced.[11][12]
In 1930, two major categories of H. influenzae were defined: the unencapsulated strains and the encapsulated strains. Encapsulated strains were classified on the basis of their distinct capsular antigens. The six generally recognized types of encapsulated H. influenzae are: a, b, c, d, e, and f.[13] H. Influenzae type b, also known as Hib, is the most common form, recognizable by its polyribosyl ribitol phosphate (PRP) capsule, and found mostly in children.[14] Types a, e, and f have been isolated infrequently, while types d and c are rarely isolated. Unencapsulated strains are more genetically diverse than the encapsulated group.[15] Unencapsulated strains are termed nontypable (NTHi) because they lack capsular serotypes; however, they can be classified by multilocus sequence typing. NTHi strains are considered to be part of the normal human flora in the upper and lower respiratory tract, genitals, and conjunctivae (mucous membranes of the eye).[14]
H. Influenzae is a small Gram-negative bacterium, approximately 0.3 micrometer to 1 micrometer.[16] Like other Gram-negative bacteria, H. influenzae has a thin peptidoglycan layer surrounded by an outer membrane containing lipopolysaccharide.[17] Some types of H. influenzae contain a polysaccharide capsule around the outer membrane to aid in protection and colonization.[18] The bacteria are pleomorphic, meaning the shape of the bacterium is variable, however it is typically coccobacillus or rod-shaped.[19] H. Influenzae contains pili, which are specialized to adhere to the human nasopharynx. The H. Influenzae pili, unlike those of E. coli, resist unwinding, allowing for stronger adhesion to resist expulsion when coughing or sneezing.[20] A minority of non-typeable, or unencapsulated, H. influenzae employ a variety of attachment techniques, such as pili, adhesins, or Hia and Hap proteins.[21] Though the bacteria possess pili, they are not used for traditional movement or motility, and the bacterium is still considered to be non-motile.[22]
The cell wall of H. influenzae bacterium contains various proteins, referred to as autotransporters, for adherence and colony formation. H. influenzae prefers to bind to mucus linings or non-ciliated epithelial cells, which is facilitated by Hap autotransporters in the cell wall binding with unknown receptors within the epithelium.[23] The Hap autotransporters also facilitate the formation of microcolonies of the bacteria. These microcolonies are likely responsible for the formation of various biofilms within the body, such as those which are responsible for middle ear or lung infections.[23]
Penicillin binding proteins (PBPs) contain penicillin binding domains are involved in peptidoglycan metabolism, which makes up the cell wall, to give bacterial cells rigidity.[24] Beta-lactams are used in antibiotics that bind to PBPs, in order to target peptidoglycan synthesis.[25] Some isolates of H. Influenzae have contained modified PBPs that resist beta-lactam action by producing beta-lactamases. This resistance is likely due to a N526K mutation, or R517H substitution in conjunction with another unknown mutation. The R517H substitution alone did not have a lower affinity for penicillin, and therefore cannot cause resistance alone.[24] Beta-lactamase emergence in the 1970s caused the therapy for severe cases of H. influenzae to be changed from ampicillin to cephalosporins, however further resistance to cephalosporins has occurred due to changes in the transpeptidase domain of penicillin binding protein 3 (PBP3).[26]


Clinical features may include initial symptoms of an upper respiratory tract infection mimicking a viral infection, usually associated with low-grade fevers. This may progress to the lower respiratory tract within a few days, with features often resembling those of wheezy bronchitis. Sputum may be difficult to expectorate and is often grey or creamy in color. The cough may persist for weeks without appropriate treatment. Many cases are diagnosed after presenting chest infections that do not respond to penicillins or first-generation cephalosporins. A chest X-ray can identify alveolar consolidation.[27]
Clinical diagnosis of invasive H. influenzae infection is typically confirmed by bacterial culture or latex particle agglutination tests or polymerase chain reaction tests on clinical samples obtained from a sterile body site. In this respect, H. influenzae cultured from the nasopharyngeal cavity or throat would not indicate H. influenzae disease, because these sites are colonized in disease-free individuals.[28] However, H. influenzae isolated from cerebrospinal fluid or blood or joint fluid would indicate H. influenzae infection.
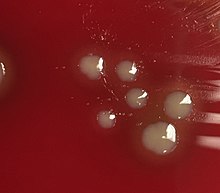
Bacterial culture of H. influenzae is performed on agar plates, the preferable one being chocolate agar, with added X (hemin) and V (nicotinamide adenine dinucleotide) factors at 37 °C in a CO2-enriched incubator.[29] The ideal CO2 concentration for the culture is ~5%.[30] Blood agar growth is only achieved as a satellite phenomenon around other bacteria. Colonies of H. influenzae appear as convex, smooth, pale, grey, or transparent colonies.[30]
Gram stained and microscopic observation of a specimen of H. influenzae will show Gram-negative coccobacillus. The cultured organism can be further characterized using catalase and oxidase tests, both of which should be positive. Further serological testing is necessary to distinguish the capsular polysaccharide and differentiate between H. influenzae b and nonencapsulated species.
Although highly specific, bacterial culture of H. influenzae lacks sensitivity. Use of antibiotics prior to sample collection greatly reduces the isolation rate by killing the bacteria before identification is possible.[31] Recent work has shown that H.influenzae uses a highly specialized spectrum of nutrients where lactate is a preferred carbon source.[32]
H. influenzae will grow in the hemolytic zone of Staphylococcus aureus on blood agar plates; the hemolysis of cells by S. aureus releases factor V which is needed for its growth. H. influenzae will not grow outside the hemolytic zone of S. aureus due to the lack of nutrients such as factor V in these areas.[33]
The latex particle agglutination test (LAT) is a more sensitive method to detect H. influenzae than is culture.[34] Because the method relies on antigen rather than viable bacteria, the results are not disrupted by prior antibiotic use. It also has the added benefit of being much quicker than culture methods. However, antibiotic sensitivity testing is not possible with LAT alone, so a parallel culture is necessary.[35]
Polymerase chain reaction (PCR) assays have been proven to be more sensitive than either LAT or culture tests, and are highly specific.[36] These PCR tests can be used for capsular typing of encapsulated H. influenzae strains.[37]
H. influenzae is generally found within and upon the human body, but can also live on various dry, hard surfaces for up to 12 days.[38][39] Most strains of H. influenzae are opportunistic pathogens; that is, they usually live in their host without causing disease, but cause problems only when other factors (such as a viral infection, reduced immune function or chronically inflamed tissues, e.g. from allergies) create an opportunity. They infect the host by sticking to the host cell using trimeric autotransporter adhesins.[40]
The pathogenesis of H. influenzae infections is not completely understood, although the presence of the polyribosyl ribitol phosphate (PRP) capsule in encapsulated type b (Hib), a serotype causing conditions such as epiglottitis, is known to be a major factor in virulence.[41] Their capsule allows them to resist phagocytosis and complement-mediated lysis in the nonimmune host. The unencapsulated strains are almost always less invasive; however, they can produce an inflammatory response in humans, which can lead to many symptoms. Vaccination with Hib conjugate vaccine is effective in preventing Hib infection but does not prevent infection with NTHi strains.[42]
Haemophilus influenzae can cause respiratory tract infections including pneumonia, otitis media, epiglottitis (swelling in the throat), eye infections and bloodstream infection, meningitis. It can also cause cellulitis (skin infection) and infectious arthritis (inflammation of the joint).[43]
Naturally acquired disease caused by H. influenzae seems to occur in humans only. In healthy children under the age of 5, H. influenzae type b was responsible for more than 80% of aggressive infections, before the introduction of the [Hib] vaccine.[44] In infants and young children, H. influenzae type b (Hib) causes bacteremia, pneumonia, epiglottitis and acute bacterial meningitis.[45] On occasion, it causes cellulitis, osteomyelitis, and infectious arthritis. It is one cause of neonatal infection.[46]
Due to routine use of the Hib vaccine in the U.S. since 1990, the incidence of invasive Hib disease has decreased to 1.3/100,000 in children.[45] However, Hib remains a major cause of lower respiratory tract infections in infants and children in developing countries where the vaccine is not widely used. Unencapsulated H. influenzae strains are unaffected by the Hib vaccine and cause ear infections (otitis media), eye infections (conjunctivitis), and sinusitis in children, and are associated with pneumonia.[45]
Many microbes colonize within a host organism. Colonization occurs when a microorganism continues to multiply within the host, without interaction, causing no visible signs of illness or infection. Haemophilus influenzae colonizes differently in adults than it does young children. Because this bacterium colonizes more rapidly in young children, they are capable of carrying more than one strain of the same bacterium. Once in the adult stage of life, a human is likely to only be carrying one strain as this bacterium does not colonize as aggressively in adults. Nearly all infants will undergo colonization of this bacteria within their first year of life.[21]
Some strains of Haemophilus influenzae produce beta-lactamases, and are also able to modify its penicillin-binding proteins, so the bacteria have gained resistance to the penicillin family of antibiotics. In severe cases, cefotaxime and ceftriaxone delivered directly into the bloodstream are the elected antibiotics, and, for the less severe cases, an association of ampicillin and sulbactam, cephalosporins of the second and third generation, or fluoroquinolones are preferred. (Fluoroquinolone-resistant Haemophilus influenzae have been observed.)[47]
Macrolides and fluoroquinolones have activity against non-typeable H. influenzae and could be used in patients with a history of allergy to beta-lactam antibiotics.[48] However, macrolide resistance has also been observed.[49]
The serious complications of HiB are brain damage, hearing loss, and even death. This is commonly associated with HiB but however the HiB non-typable doesn't often cause serious conditions but it has more risks to a chronic infection because it has the ability to change its surface antigens. Chronic infections are usually not as serious than acute infections.[50]
There are a few other possible diseases and conditions that can arise from the Haemophilus influenzae depending on the areas that they exist in within the human body. This bacterium can exist in the nasal passages (especially the nasopharynx), the ear canal, and the lungs. The bacterium's presence in these areas can lead to some conditions such as otitis media (which is the inflammation of the middle ear), chronic obstructive pulmonary disorder, which causes decreased air flow to the lungs, epiglotitis (which is the swelling of the epiglottis) and asthma which can become severe.[51]
H. influenzae uses the Embden–Meyerhof–Parnas (EMP) pathway for glycolysis and the pentose phosphate pathway, which is anabolic rather than catabolic. The citric acid cycle is incomplete and lacks several enzymes that are found in a fully functioning cycle. This partially functional cycle is not unique to the H. influenzae. The enzymes missing from the TCA cycle are citrate synthase, aconitate hydratase, and isocitrate dehydrogenase.[52] Haemophilus influenzae has been found in both aerobic, and anaerobic environments, as well as environments with different pH's.[51]
Effective vaccines for Haemophilus influenzae serotype b have been available since the early 1990s, and are recommended for children under age 5 and asplenic patients. The World Health Organization recommends a pentavalent vaccine, combining vaccines against diphtheria, tetanus, pertussis, hepatitis B and Hib. There is not yet sufficient evidence on how effective this pentavalent vaccine is in relation to the individual vaccines.[53]
Hib vaccines cost about seven times the total cost of vaccines against measles, polio, tuberculosis, diphtheria, tetanus, and pertussis. Consequently, whereas 92% of the populations of developed countries were vaccinated against Hib as of 2003, vaccination coverage was 42% for developing countries, and only 8% for least-developed countries.[54]
The Hib vaccines do not provide cross-protection to any other Haemophilus influenzae serotypes like Hia, Hic, Hid, Hie or Hif.[55]
An oral vaccination has been developed for non-typeable Haemophilus influenzae (NTHi) for patients with chronic bronchitis but it has not shown to be effective in reducing the number and severity of COPD exacerbations.[56] However, there is no effective vaccine for the other types of capsulated Haemophilus inflenzae or Haemophilus inflenzae nontypeable.
H. influenzae was the first free-living organism to have its entire genome sequenced. Completed by Craig Venter and his team at The Institute for Genomic Research, now part of the J. Craig Venter Institute. Haemophilus was chosen because one of the project leaders, Nobel laureate Hamilton Smith, had been working on it for decades and was able to provide high-quality DNA libraries. The sequencing method used was whole-genome shotgun, which was completed and published in Science in 1995.[11]
The genome of strain Rd KW20 consists of 1,830,138 base pairs of DNA in a single circular chromosome that contains 1604 protein-coding genes, 117 pseudogenes, 57 tRNA genes, and 23 other RNA genes.[11] About 90% of the genes have homologs in E. coli, another gamma-proteobacterium. In fact, the similarity between genes of the two species ranges from 18% to 98% protein sequence identity, with the majority sharing 40-80% of their amino acids (with an average of 59%).[57]
Conjugative plasmids (DNA molecules that are capable of horizontal transfer between different species of bacteria) can frequently be found in H. influenzae. It is common that the F+ plasmid of a competent Escherichia coli bacterium conjugates into the H. influenzae bacterium, which then allows the plasmid to transfer among H. influenzae strands via conjugation.[58]
Unencapsulated H. influenzae is often observed in the airways of patients with chronic obstructive pulmonary disease (COPD). Neutrophils are also observed in large numbers in sputum from patients with COPD. The neutrophils phagocytize H. influenzae, thereby activating an oxidative respiratory burst.[59] However instead of killing the bacteria the neutrophils are themselves killed (though such an oxidative burst likely causes DNA damage in the H. influenzae cells). Dearth of killing the bacteria appears to explain the persistence of infection in COPD.[59]
H. influenzae mutants defective in the rec1 gene (a homolog of recA) are very sensitive to killing by the oxidizing agent hydrogen peroxide.[60] This finding suggests that rec1 expression is important for H. influenzae survival under conditions of oxidative stress. Since it is a homolog of recA, rec1 likely plays a key role in recombinational repair of DNA damage. Thus H. influenzae may protect its genome against the reactive oxygen species produced by the host's phagocytic cells through recombinational repair of oxidative DNA damages.[61] Recombinational repair of a damaged site of a chromosome requires, in addition to rec1, a second homologous undamaged DNA molecule. Individual H. influenzae cells are capable of taking up homologous DNA from other cells by the process of transformation. Transformation in H. influenzae involves at least 15 gene products,[11] and is likely an adaptation for repairing DNA damage in the resident chromosome.[62]
Vaccines that target unencapsulated H. influenzae serotypes are in development.[63]
Haemophilus influenzae (formerly called Pfeiffer's bacillus or Bacillus influenzae) is a Gram-negative, non-motile, coccobacillary, facultatively anaerobic, capnophilic pathogenic bacterium of the family Pasteurellaceae. The bacteria are mesophilic and grow best at temperatures between 35 and 37°C.
H. influenzae was first explained in 1893 by Richard Pfeiffer during an influenza pandemic when he incorrectly described Haemophilus influenzae as the causative microbe, which is why the bacteria retain the name "influenza". H. influenzae is responsible for a wide range of localized and invasive infections, typically in infants and children, including pneumonia, meningitis, or bloodstream infections. Treatment consists of antibiotics, however H. influenzae is often resistant to the penicillin family but amoxicillin/clavulanic acid can be used in mild cases. The recommended form of prevention of the type b form of H. influenzae is a series of the Hib vaccine and boosters, which are most often given under the age of 5, and sometimes in conjunction with other vaccines in the form of the DTaP-IPV/Hib vaccine.
This species was the first free-living microorganism to have its entire genome sequenced.
Haemophilus influenzae, anteriormente llamado bacilo de Pfeiffer o Bacillus influenzae, son cocobacilos Gram-negativo no móviles descritos en 1892 por Richard Pfeiffer durante una pandemia de gripe. Es generalmente aerobio pero puede crecer como anaerobio facultativo. H. influenzae fue considerado erróneamente como la causa de la gripe común hasta 1933, cuando la etiología viral de la gripe llegó a ser conocida. Sin embargo, H. influenzae es responsable de un amplio rango de enfermedades como meningitis, epiglotitis, neumonía, sepsis y otras de menor gravedad.[1]
Debido a su pequeño genoma, H. influenzae fue el primer organismo de vida libre cuyo genoma completo fue secuenciado, por Craig Venter. Su genoma consta de 1.830.140 pares de bases y contiene 1.740 genes.[2]
En 1930 se definieron dos categorías principales de H. influenzae: cepas con cápsula y sin ella. La patogénesis de las infecciones de H. influenzae no se comprende totalmente, aunque la presencia del tipo B encapsulado (HiB) es el principal factor de virulencia. Su cápsula le permite resistir la fagocitosis y la lisis en los huéspedes no inmunizados. Las cepas no encapsuladas son menos invasivas, aunque son capaces de inducir una respuesta inflamatoria que causa trastornos. Como ejemplos de infección por cepas capsuladas se puede mencionar a la meningitis, neumonía y epiglotitis. La vacunación con la vacuna Hib conjugada es efectiva en la prevención de la infección y varias vacunas se usan rutinariamente.
La mayoría de las cepas de H. influenzae son patógenos oportunistas, esto es, viven en su huésped sin causar enfermedades, pero pueden causar problemas cuando otros factores (tal como una enfermedad viral que reduce la respuesta inmune) crean una oportunidad infecciosa. Se conocen seis tipos de H. influenzae capsuladas: a, b, c, d, e y f,[3] así como cepas no capsuladas, responsables de enfermedades emergentes.[4]
Las enfermedades causadas naturalmente por H. influenzae parecen afectar solo a los seres humanos. En los niños, H. influenzae tipo B (HIB) causa bacteriemia y meningitis bacteriana aguda. Ocasionalmente causa celulitis, osteomielitis, epiglotitis e infecciones asociadas. Aparece de forma infrecuente o en un número muy bajo en el tracto respiratorio superior, constituye una causa frecuente de enfermedad en niños no vacunados (epiglotitis, laringitis, celulitis). Debido al uso rutinario de la vacuna HIB conjugada en EE. UU. desde 1990, la incidencia de la enfermedad HIB invasiva se ha reducido a 1,3 por 100 000 niños. Sin embargo, HIB continúa siendo la causa principal de las infecciones del tracto respiratorio inferior en niños de los países en vías de desarrollo que no realizan vacunaciones. Las cepas de H. influenzae sin cápsula (no del tipo B) causan infecciones del oído (otitis media) y oculares (conjuntivitis) y sinusitis en niños y se asocian con la neumonía. La meningitis, especialmente en infantes, niños mayores de 7 años y en los ancianos, es la manifestación clínica más seria de las invasiones tisulares causadas por Haemophilus influenzae.[5] Ciertas cepas de tipo no-b aparecen con mutaciones que causan enfermedades invasivas en individuos vacunados en contra del tipo b (las cepas capsuladas).[4]
El diagnóstico clínico del H.influenzae típicamente es realizado por cultivos o por la técnica de aglutinación en látex. El diagnóstico es considerado como confirmativo cuando el organismo es aislado en un sitio estéril del cuerpo. Cabe mencionar que el H. Influenzae cultivado a partir del esputo o desde la cavidad nasofaríngea no es válido debido a que generalmente esas zonas están colonizadas por el agente. Otros sitios como el LCR y la sangre sí son válidos y confirmativos.
Los cultivos bacterianos de H. influenzae se realizan en placas de agar, de preferencia agar chocolate, con adición de X (Hematina) y V (NAD), a 37 ° C en un incubador con CO2-enriquecido.[6] El crecimiento de agar sangre es solo un fenómeno satélite alrededor de otras bacterias. Las colonias de H. influenzae aparecen como colonias convexas, lisas, pálidas, grises o transparentes. La observación con tinción de Gram y microscópicos de un espécimen de H. influenzae mostrará cocobacilos Gram-negativos, sin acuerdo específico. El organismo cultivo puede caracterizarse aún más mediante pruebas de catalasa y oxidasa, las cuales deben ser positivas. En las pruebas serológicas es necesario distinguir el polisacárido capsular y diferenciar entre la cepa b de H. influenzae y las cepas no encapsuladas. Aunque muy específicos, los cultivos bacterianos de H. influenzae carecen de la sensibilidad. El uso de antibióticos antes de la toma de la muestra reduce en gran medida la tasa de aislamiento al matar las bacterias antes de que la identificación sea posible.[7] Más allá de esto, H. influenzae es una bacteria muy sensible al protocolo de cultivo, y cualquier modificación de este puede reducir las tasas de aislamiento. La H. influenzae crece en la zona hemolítica de Staphylococcus aureus en placas de agar sangre pues la hemólisis de las células de S. aureus libera nutrientes vitales para su crecimiento.
La prueba de aglutinación en partículas de látex (LAT por las siglas en inglés de latex particle agglutination test) es un método más sensible para la detección de la H. infuenzae.[8] Debido a que el método se basa en antígenos en lugar de bacterias viables en un cultivo, los resultados no son afectados por el uso previo de antibióticos. También tiene el beneficio adicional de ser mucho más rápido que los métodos de cultivo. Sin embargo, no se puede detectar la sensibilidad a antibióticos con LAT, por lo que es necesario un cultivo en paralelo.
La reacción en cadena de la polimerasa (PCR) ha demostrado ser más sensible que cualquiera de las pruebas de LAT o el cultivo.[9] Sin embargo, PCR no es aún un método común en la práctica clínica. La inmunoelectroforesis, en cambio, ha demostrado ser un método de investigación de diagnóstico eficaz.
Una nueva forma de combatir al H. influenzae, al neumococo, y otros patógenos respiratorios y urinarios, es usar una cefalosporina de tercera generación denominada Ceftriaxona.[10] Actualmente esta molécula está avalada por la Semergen y otras sociedades médicas como la mejor opción ante la amoxicilina con clavulánico.[cita requerida]
La resistencia a antibióticos ha incrementado entre las cepas de H. influenzae, mayormente en términos de resistencia a la ampicilina mediada por β-lactamasa, lo que representa una seria preocupación clínica a nivel mundial. Por lo general, aquellas cepas resistentes a la ampicilina son también resistentes al cloranfenicol.[5]
H. influenzae y S. pneumoniae se pueden encontrar en el sistema respiratorio superior de los seres humanos.
Un estudio de competición en un laboratorio reveló que, en una placa de Petri, S. pneumoniae siempre superaba a H. influenzae atacándolo con peróxido de hidrógeno. Este erosiona las moléculas superficiales que H. influenzae necesita para sobrevivir.[11]
Cuando ambas bacterias se colocan juntas en la cavidad nasal, en el plazo de dos semanas solo Hemophilus influenzae sobrevive. Cuando ambas se colocan por separado en la cavidad nasal, ambas sobreviven. Al examinar el tejido fino respiratorio superior de los ratones expuestos a ambas especies de bacterias, se encontró un número extraordinariamente grande de células inmunes neutrófilas. En los ratones expuestos a solamente una de las bacterias, estas células no estaban presentes.
Las pruebas de laboratorio demostraron que los neutrófilos expuestos a H. influenzae muertos atacaban más agresivamente a S. pneumoniae que los neutrófilos no expuestos. La exposición a H. influenzae muertos no tenía ningún efecto en H. influenzae vivos.
Dos escenarios pueden ser responsables de esta respuesta:
Se desconoce porqué H. influenzae no es afectado por la respuesta inmune.[12]
|número-autores= (ayuda) |número-autores= (ayuda) Haemophilus influenzae, anteriormente llamado bacilo de Pfeiffer o Bacillus influenzae, son cocobacilos Gram-negativo no móviles descritos en 1892 por Richard Pfeiffer durante una pandemia de gripe. Es generalmente aerobio pero puede crecer como anaerobio facultativo. H. influenzae fue considerado erróneamente como la causa de la gripe común hasta 1933, cuando la etiología viral de la gripe llegó a ser conocida. Sin embargo, H. influenzae es responsable de un amplio rango de enfermedades como meningitis, epiglotitis, neumonía, sepsis y otras de menor gravedad.
Debido a su pequeño genoma, H. influenzae fue el primer organismo de vida libre cuyo genoma completo fue secuenciado, por Craig Venter. Su genoma consta de 1.830.140 pares de bases y contiene 1.740 genes.
Haemophilus influenzae Haemophilus generoko bakterioa da. Lehendabizikoz 1892an Richard Pfeifferrek deskribatua, hasieran gripe pandemikoaren iturburua zela pentsatu zuten.[1] Gero, 1933an, gripearen eragilea birus bat zela topatu zuten ikerlariek. Hala ere, Haemophilus influenzae beste gaitz batzuen atzean dago: meningitis, epiglotitis, pneumonia, otitis eta sinusitis, besteak beste, eragin ditzake.
Bakterio honen genoma osoa 1995ean sekuentziatu zen. 1740 genek osatzen dute genoma hori [2]
Haemophilus influenzae bazilo Gram negatiboa da, oso pleomorfikoa (itxuraz aldatzen du). Anaerobio fakultatiboa, ez da mugikorra. Oxidasa (+). Andui batzuek (birulentzia handienetakoak) kapsula dute, baina beste batzuek ez.
Haemophilus influenzae da transformazio genetikoa egin dezakeen bakterio urrietako bat [3]
Haemophilus generoko bakterio guztien antzera, H. influenzae odola behar du egoki hazteko (hortik datorkio izena). Izan ere, beste bakterioen aldean hemofiloek ezin dute hainbat molekula sintetizatu: heminak eta porfirinak, besteak beste, bakterioen zitokromoek behar dituztenak. Molekula hauek odolaren globulu gorrietan ugariak direnez, Haemophilus laborategian hazteko hazkuntza-inguruari odola gehitzen zaio beti (odol-agarra eta txokolate-agarra izanik mikrobio hauekin gehien erabiltzen diren hazkuntza-inguruak).
Haemophilus influenzae ohiko bakterioa da giza organismoan: gizabanako askok daramate bakterioa, saprofito moduan, inongo gaitzik jasan gabe (batez ere ahoan eta nasofaringean).
Gizakia da bakterio honen gordeleku bakarra [4].
Aipatu den bezala, bakterio honen andui batzuek zelula hormaren gaineko kapsula dute. Kapsula honek mikrobioaren birulentzia areagotzen du, makrofagoen eta beste zelulen fagozitosia ekiditen duelako. Andui kapsuladunek gaitz larriak eragiten dituzte: haurren meningitisa, esaterako, eta baita pneumonia eta epiglotitisa ere. Kapsularik gabeko anduiek birulentzia gutxiago dute, eta hain larriak ez diren gaitzak sortzen dituzte (otitisa, sinusitisa...).
1990. urtean mota honetako meningitisaren aurkako txertoa lortu zen, H. influenzaek haurrengan sortzen duen infekzioaren ondorio larriak prebenitzen dituena. Hego Euskal Herrian txerto hori umeen txertaketa-egutegian ezarrita dago.
Haemophilus influenzaek erresistentzia garatu du penizilinarekiko. Mikrobioa sentikorra da, aldiz, zefalosporinekiko (zeftriaxona), kloranfenikolarekiko eta amoxizilinarekiko, hauek izanik erabilitako antibiotikoak mikrobioak sortutako gaitzak tratatzeko.
Haemophilus influenzae Haemophilus generoko bakterioa da. Lehendabizikoz 1892an Richard Pfeifferrek deskribatua, hasieran gripe pandemikoaren iturburua zela pentsatu zuten. Gero, 1933an, gripearen eragilea birus bat zela topatu zuten ikerlariek. Hala ere, Haemophilus influenzae beste gaitz batzuen atzean dago: meningitis, epiglotitis, pneumonia, otitis eta sinusitis, besteak beste, eragin ditzake.
Bakterio honen genoma osoa 1995ean sekuentziatu zen. 1740 genek osatzen dute genoma hori
Haemophilus influenzae (suomeksi toisinaan hemofilus) on gramnegatiivinen kokkobasilli. Bakteerin kuvaili ensimmäisen kerran saksalainen bakteriologi Richard Pfeiffer vuonna 1892 influenssapandemian aikaan. H. influenzae on yleensä aerobinen, mutta voi tietyissä oloissa toimia fakultatiivisena anaerobina.
H. influenzae:n genomin pienestä koosta johtuen se oli viruksia lukuun ottamatta ensimmäinen eliö, jonka koko genomi sekvensoitiin. Genomi koostuu 1 830 140 emäsparista ja sisältää 1740 geeniä. Projekti suoritettiin yhdysvaltalaisessa The Institute for Genomic Research -tutkimuslaitoksessa ja julkaistiin vuonna 1995 arvovaltaisessa Science-lehdessä.[1]
Suurin osa H. influenzae -kannoista on opportunistisia patogeeneja, mikä tarkoittaa, että ne eivät aiheuta isäntäeliössään tautia, ellei isännän immuunijärjestelmä häiriinny esimerkiksi virusinfektion tai lääkityksen seurauksena. Yleisesti tunnetaan kuusi H. influenzae:n serotyyppiä: a, b, c, d, e, ja f. H. influenzae tyyppi b (Hib) aiheutti aiemmin suuren osan hemofilusinfektioista, mutta tilanne muuttui, kun Hib-rokote otettiin käyttöön.[2] Suomessa Hib-rokote tuli yleiseen rokotusohjelmaan 1980-luvun lopulla.[3]
H. influenzae:n aiheuttamiin sairauksiin kuuluvat muun muassa aivokalvontulehdus, kurkunkansitulehdus (epiglottiitti), niveltulehdus (artriitti), välikorvatulehdus (otiitti), poskiontelotulehdus (sinuiitti), keuhkokuume ja sidekalvontulehdus.[2]
Haemophilus influenzae (suomeksi toisinaan hemofilus) on gramnegatiivinen kokkobasilli. Bakteerin kuvaili ensimmäisen kerran saksalainen bakteriologi Richard Pfeiffer vuonna 1892 influenssapandemian aikaan. H. influenzae on yleensä aerobinen, mutta voi tietyissä oloissa toimia fakultatiivisena anaerobina.
H. influenzae:n genomin pienestä koosta johtuen se oli viruksia lukuun ottamatta ensimmäinen eliö, jonka koko genomi sekvensoitiin. Genomi koostuu 1 830 140 emäsparista ja sisältää 1740 geeniä. Projekti suoritettiin yhdysvaltalaisessa The Institute for Genomic Research -tutkimuslaitoksessa ja julkaistiin vuonna 1995 arvovaltaisessa Science-lehdessä.
Suurin osa H. influenzae -kannoista on opportunistisia patogeeneja, mikä tarkoittaa, että ne eivät aiheuta isäntäeliössään tautia, ellei isännän immuunijärjestelmä häiriinny esimerkiksi virusinfektion tai lääkityksen seurauksena. Yleisesti tunnetaan kuusi H. influenzae:n serotyyppiä: a, b, c, d, e, ja f. H. influenzae tyyppi b (Hib) aiheutti aiemmin suuren osan hemofilusinfektioista, mutta tilanne muuttui, kun Hib-rokote otettiin käyttöön. Suomessa Hib-rokote tuli yleiseen rokotusohjelmaan 1980-luvun lopulla.
H. influenzae:n aiheuttamiin sairauksiin kuuluvat muun muassa aivokalvontulehdus, kurkunkansitulehdus (epiglottiitti), niveltulehdus (artriitti), välikorvatulehdus (otiitti), poskiontelotulehdus (sinuiitti), keuhkokuume ja sidekalvontulehdus.
Haemophilus influenzae, autrefois appelé bacille de Pfeiffer, est une bactérie de la famille des Pasteurellacae et de la classe des Gammaproteobacteria. Les cellules sont des coccobacilles ou de petits bâtonnets immobiles à Gram négatif.
Richard Pfeiffer (de) (1858-1945) a été le premier à les décrire en 1892 lors de la pandémie de grippe (influenza) de 1889-1892[1]. On a longtemps cru qu'il s'agissait de l'agent infectieux responsable de la grippe, jusqu'à ce que Richard Shope mette en évidence en 1931 l'étiologie virale de cette maladie, en isolant un virus à partir de filtrats de broyats de poumons de porcs à l'occasion d'une grippe porcine proche de la grippe humaine[2].
Son génome est le premier à être entièrement séquencé, en 1995 (1 830 140 paires de base et 1 740 gènes).
C'est une bactérie isolée à partir du microbiote des voies respiratoires supérieures humaines.
En dehors du tractus respiratoire, H. influenzae peut se voir dans certaines ostéites et arthrites et infections génitales comme des vaginites.
Autres espèces au pouvoir pathogène voisin :
Petit bacille à Gram négatif, les souches virulentes de sérotype b sont fréquemment encapsulées mais la capsule est difficilement visible en dehors des prélèvements pathologiques purulents.
Haemophilus influenzae exige deux facteurs de croissance : les facteurs X (hémine ou hématine) et V (NAD+).
Sur un milieu ordinaire où l'on dépose un disque contenant ces facteurs X+V, les colonies ne poussent qu'autour du disque.
Le facteur X peut être apporté par un milieu enrichi en hémoglobine (gélose au sang cuit ou chocolat). Le facteur V peut être apporté par l'ajout d'extrait de levure, un supplément polyvitaminé ou par coculture avec des colonies de Staphylococcus aureus. Le chauffage du sang à 75 °C lors de la préparation de la gélose au sang cuit libère le facteur V et inactive les inhibiteurs de ce dernier pouvant-être présent dans certains sang animaux comme celui du mouton.
Le camp-test consiste à ensemencer une suspension d'Haemophilus sur un milieu gélosé au sang frais (facteur X) et puis à ajouter une strie de S. aureus (facteur V). Ceci induit un satellitisme typique, Haemophilus influenzae poussant autour de la strie de staphylocoques.
Haemophilus influenzae est sensible à l'amoxicilline dans 80 % des cas[3], cependant elle peut présenter une résistance aux β-lactamines en sécrétant une β-lactamase pouvant être traitée par de l'amoxicilline associée à un inhibiteur des pénicillinases tel que l'acide clavulanique. Il est également sensible aux céphalosporines de 3e génération et aux fluoroquinolones.
Des vaccins contre Haemophilus influenzae b sont disponibles depuis le début des années 1990. La couverture vaccinale des pays développés est de 92 %, alors qu'elle n'est que de 42 % dans les pays en voie de développement et 8 % dans les pays les plus pauvres[4]. Les vaccins protégeant d’haemophilus influenzae sont les suivants :
Le tableau vaccinal pour Haemophilus influenzae est le suivant :
Trois vaccinations sont recommandées en France[5]. Aux États-Unis, depuis la vaccination les progrès ont été spectaculaires pour les enfants (2008, 2009), mais semblent sans effets chez les adultes (avec un nombre de cas en augmentation dans l'Ohio par exemple[6].
Les recherches sur Haemophilus influenzae ont permis d'isoler une série d'enzymes de restriction nommées Hind, dont la troisième découverte, HindIII, est l'une des enzymes de restriction les plus utilisées en biologie moléculaire. Son site de restriction à bouts cohésifs est palindromique :
5'---A AGCTT---3'
3'---TTCGA A---5'
Haemophilus influenzae, autrefois appelé bacille de Pfeiffer, est une bactérie de la famille des Pasteurellacae et de la classe des Gammaproteobacteria. Les cellules sont des coccobacilles ou de petits bâtonnets immobiles à Gram négatif.
Richard Pfeiffer (de) (1858-1945) a été le premier à les décrire en 1892 lors de la pandémie de grippe (influenza) de 1889-1892. On a longtemps cru qu'il s'agissait de l'agent infectieux responsable de la grippe, jusqu'à ce que Richard Shope mette en évidence en 1931 l'étiologie virale de cette maladie, en isolant un virus à partir de filtrats de broyats de poumons de porcs à l'occasion d'une grippe porcine proche de la grippe humaine.
Son génome est le premier à être entièrement séquencé, en 1995 (1 830 140 paires de base et 1 740 gènes).
Haemophilus influenzae, antes chamada bacilo de Pfeiffer, é unha especie de bacterias gramnegativa, con forma de cocobacilo. É unha especie xeralmente de vida aerobia, pero pode crecer tamén como anaerobio facultativo.[1]
Foi descrita en 1892 por Richard Pfeiffer durante unha pandemia de gripe ou influenza. H. influenzae foi erradamente considerada o axente causante da gripe ata 1933, cando se fixo evidente a etioloxía viral desa doenza, pero á bacteria xa lle quedou o nome taxonómico de H. influenzae. Aínda que non produce a gripe, H. influenzae é responsable de diversas enfermidades infecciosas humanas.
H. influenzae foi o primeiro organismo de vida libre do que se secuenciou o seu xenoma completo, que foi publicado en 1995.
En 1930, definíronse dúas categorías principais de H. influenzae: as cepas non encapsuladas e as cepas encapsuladas. As cepas encapsuladas clasificáronse baseándose nos sues antíxenos capsulares. Hai seis tipos xeralmente recoñecidos de H. influenzae encapsulada, designados con letras minúsculas: a, b, c, d, e, f.[2]
A diversidade xenética entre as cepas non encapsuladas é maior que nas encapsuladas. As cepas non encapsuladas denomínanse non tipificables (NTHi) porque carecen dos serotipos capsulares; porén, poden ser clasificadas por tipificación de secuencia multilocus. A patoxénese das infeccións por H. influenzae non se comprende totalmente, aínda que a presenza de cápsula no tipo b encapsulado (Hib), un serotipo que causa epiglotite, sábese que é un factor principal de virulencia. As súas cápsulas permítenlles resistir a fagocitose e a lise mediada polo sistema do complemento no hóspede non inmune. As cepas non encapsuladas son case sempre menos invasivas, pero poden producir unha resposta inflamatoria en humanos, a cal pode causar moitos síntomas. A vacinación coa vacina Hib conxugada é efectiva para a prevención das infeccións por Haemophilus influenzae b (Hib), pero non impide a infección polas cepas non tipificables (NTHi).[3]
A maioría das cepas de H. influenzae son patóxenas oportunistas, que xeralmente viven no seu hóspede sen causarlle enfermidades, e causan problemas só cando se crea unha oportunidade por factores como unha infección vírica, redución da función inmunitaria ou inflamación crónica dos tecidos, por exemplo nas alerxias. Infectan ao seu hóspede ao adherirse á célula hóspede utilizando adhesinas autotransportadoras triméricas (TAA).
As enfermidades adquiridas de forma natural causadas por H. influenzae só se dan nos humanos. Nos nenos a H. influenzae tipo b (Hib) causa bacteremia, pneumonía, e un tipo de meninxite bacteriana aguda. En ocasións causa celulite, osteomielite, epiglotite, e artrite infecciosa. De feito, H. influenzae é o principal axente etiolóxico asociado coa epiglotite.
A vacina Hib conxugada é moi efectiva. Por exemplo, en EEUU, debido ao uso rutineiro da vacina Hib conxugada desde 1990, a incidencia da enfermidade invasiva por Hib diminuíu ata 1,3/100.000 en nenos. Porén, a Hib continúa a ser unha causa importante de infeccións do tracto respiratorio inferior en nenos nos países en desenvolvemento económico nos que a vacina non se usa xeneralizadamente. Esta vacina non afecta ás cepas de H. influenzae non encapsuladas e estas poden causar infeccións de oído (otite media), infeccións oculares (conxuntivite), e sinusite en nenos, e están asociadas á pneumonía.
O diagnóstico clínico de H. influenzae realízase normalmente por medio de cultivos bacterianos ou por aglutinacións de partículas de látex. A diagnose considérase confirmada cando o organismo é illado dunha parte normalmente estéril do corpo. Neste sentido, a H. influenzae cultivada a partir de mostras da cavidade nasofarínxea ou de esputos non sería indicativo dunha enfermidade por H. influenzae, porque eses lugares son colonizados polo organismo tamén en persoas sas.[5] Polo contrario, o H. influenzae illado do líquido cefalorraquídeo ou do sangue indicaría unha infección por H. influenzae.
Os cultivos bacterianos de H. influenzae realízanse en placa de ágar, xeralmente en ágar chocolate que conteña ademais os factores X (hemina) e V (nicotinamida adenina dinucleótido) a 37 °C nun incubador enriquecido en CO2.[6] O crecemento en ágar sangue só se consegue como un fenómeno satélite arredor doutra bacteria. As colonias de H. influenzae teñen un especto convexo, liso, pálido, cincento ou transparente.
A tinguidura de Gram e a observación microscópica dun espécime de H. influenzae mostrará que é gramnegativa, bacilar ou cocobacilar, e sen ningunha disposición característica (como cadeas, grupos etc.). O organismo cultivado pode ser caracterizado utilizando as probas da catalase e oxidase, que dan ambas as dúas positivo. Cómpren probas serolóxicas para distinguir o polisacárido capsular e diferenciar entre H. influenzae b e as cepas non encapsuladas.
Aínda que o cultivo de H. influenzae é moi específico, carece de sensibilidade. O uso de antibióticos antes de tomar as mostras reduce enormemente o éxito do illamento porque mata á bacteria antes de que a identificación sexa posible.[7] Ademais, H. influenzae é unha bacteria moi delicada no seu cultivo, e calquera modificación dos procedementos de cultivo pode reducir moito as taxas de illamento. Os laboratorios de mala calidade que hai ás veces nos países en desenvolvemento económico obteñen unhas baixas taxas de illamento de H. influenzae.
H. influenzae crece na zona hemolítica de Staphylococcus aureus se cultivamos ambas os microorganismos en placa de ágar. A hemólise de células sanguíneas causada por S. aureus libera o factor V que cómpre para o crecemento de H. influenzae, que non se encontra fóra de dita zona hemolítica. O ágar Fildes é mellor para o illamento. No medio Levinthal as cepas capsuladas mostran unha iridescencia distintiva.
A proba de aglutinación de partículas de látex (LAT) é un método máis sensible que os cultivos para detectar H. influenzae.[8] A mostra mestúrase con partículas de látex cubertas con anticorpos, e se o antíxeno da bacteria está presente únese aos anticorpos e isto fai que as partículas de látex se aglutinen.[9] Como o método depende da detección de antíxenos máis que de bacterias viables, os resultados non son empecidos polo uso previo de antibióticos. Ten tamén o beneficio engadido de ser moito máis rápido que os métodos de cultivo. Porén, as probas de sensibilidade a antibióticos non son posibles usando só a proba de aglutinación de partículas de látex, polo que é necesario facer paralelamente un cultivo.
Os ensaios utilizando a técnica da reacción en cadea da polimerase (PCR) son máis sensibles que os cultivos ou a aglutinación de partículas de látex, e son moi específicos.[8] Porén, os ensaios de PCR non se aplican aínda de forma rutineira nos laboratorios clínicos. A inmunoelectroforese contracorrente é tamén outro efectivo método de diagnóstico de investigación, pero foi substituído en grande medida pola PCR.
Tanto H. influenzae coma Streptococcus pneumoniae poden encontrarse no sistema respiratorio superior humano. Nun estudo in vitro de competición entre estas especies, S. pneumoniae sempre domina a H. influenzae ao atacala con peróxido de hidróxeno e quitarlle as moléculas de superficie que H. influenzae necesita para sobrevivir.[10]
In vivo, cando ambas as especies se sitúan xuntas na cavidade nasal, en dúas semanas, só H. influenzae sobrevive. Cando se sitúan separadamente na cavidade nasal, ambas as dúas poden sobrevivir. Cando se examinou o tecido respiratorio superior de ratos expostos a ambas as especies bacterianas, encontrouse un enorme número de neutrófilos (células inmunitarias). Nos ratos expostos a unha soa das bacterias estes neutrófilos non se atopan.
As probas de laboratorio mostran que os neutrófilos expostos a H. influenzae mortas eran máis agresivos ao atacar a S. pneumoniae que os non expostos. A exposición dos neutrófilos a H. influenzae mortas non tiña efecto sobre as H. influenzae vivas.
Hai dúas explicacións posibles para esta resposta:
Non está claro por que H. influenzae non é afectada pola acción do sistema inmunitario.[11]
Haemophilus influenzae produce beta-lactamases, e pode modificar as súas proteínas de unión á penicilina, polo que adquire resistencia aos antibióticos da familia da penicilina. En casos graves, os antibióticos de elección son a cefotaxime e ceftriaxona administrados directamente no torrente sanguíneo, e, nos casos menos graves, é preferible unha asociación de ampicilina e sulbactam, cefalosporinas de segunda xeración, ou fluoroquinolonas. (tamén se observaron cepas de H. influenzae resistentes á fluoroquinolona).[12]
Outros antibióticos que poden usarse son os macrólidos (como a claritromicina), mais tamén se observou resistencia aos macrólidos.[13]
Disponse de vacinas efectivas contra a H. influenzae tipo b desde principios da década de 1990, e recoméndase para nenos de menos de 5 anos e pacientes asplénicos (co bazo extirpado). A Organización Mundial da Saúde recomenda unha vacina pentavalente, combinando as vacinas contra a difteria, tétano, pertusis, hepatite B e Hib. Aínda non hai suficientes evidencias da efectividade que ten a vacina pentavalente en relación coas vacinas administradas por separado.[14]
As vacinas contra Hib costan aproximadamente sete veces máis que as vacinas contra o sarampelo, polio, tuberculose, difteria, tétano e pertusis. En consecuencia, mentres que o 92% das poboacións dos países desenvolvidos estaba vacinado contra a Hib en 2003, a cobertura da vacinación era de só o 42% nos países en desenvolvemento económico, e de só o 8% nos países máis subdesenvolvidos.[15]
H. influenzae foi o primeiro organismo de vida libre do que se secuenciou o xenoma completo. A secuenciación foi completada por Craig Venter e o seu equipo, e escolleron a Haemophilus porque un dos líderes do proxecto, o premio Nobel Hamilton Smith, traballara con ela durante décadas e podía proporcionar librarías de ADN de gran calidade. O seu xenoma consta de 1 830 140 pares de bases de ADN nun único cromosoma circular que contén 1.740 xenes que codifican proteínas, 2 xenes de ARNts, e 18 xenes doutros ARN. O método de secuenciación utilizado foi a escopeta de xenoma completo.[16]
A presenza de H. influenzae non encapsulada obsérvase a miúdo nas vías aéreas de pacientes con enfermidade pulmonar obstrutiva crónica (COPD). Os neutrófilos tamén aparecen en grandes cantidades nos esputos dos pacientes de COPD. Os neutrófilos fagocitan a H. influenzae, e dese modo activan unha explosión respiratoria oxidativa.[17] Porén, en vez de mataren á bacteria son os propios neutrófilos os que morren (aínda que esa explosión oxidativa probablemente causa tamén danos no ADN de H. influenzae). A imposibilidade de matar a H. influenzae pode explicar a persistencia de infección na COPD.[17]
Os mutantes de H. influenzae defectivos no xene rec1 (un homólogo de recA) son moi sensibles a morrer por axentes oxidantes como o peróxido de hidróxeno.[18] Estes descubrimentos suxiren que a expresión de rec1 é importante para a supervivencia de H. influenzae en condicións de estrés oxidativo. Como é un homólogo de recA, o rec1 probablemente xoga un papel fundamental na reparación recombinacional dos danos no ADN. Así, H. influenzae pode protexer o seu xenoma contra as especies reactivas do oxíxeno producidas polas células fagocíticas do hóspede ao reparar recombinacionalmente os danos oxidativos no ADN.[19] A reparación recombinacional do sitio danado dun cromosoma require, ademais de rec1, unha segunda molécula de ADN non danada homóloga. Todas as células de H. influenzae poden captar ADN homólogo procedente doutras células polo proceso de transformación. A transformación en H. influenzae implica polo menos a intervención de 15 produtos xénicos,[20] e é probablemente unha adaptación para a reparación de danos no ADN nos cromosomas dunha célula.
Haemophilus influenzae, antes chamada bacilo de Pfeiffer, é unha especie de bacterias gramnegativa, con forma de cocobacilo. É unha especie xeralmente de vida aerobia, pero pode crecer tamén como anaerobio facultativo.
Foi descrita en 1892 por Richard Pfeiffer durante unha pandemia de gripe ou influenza. H. influenzae foi erradamente considerada o axente causante da gripe ata 1933, cando se fixo evidente a etioloxía viral desa doenza, pero á bacteria xa lle quedou o nome taxonómico de H. influenzae. Aínda que non produce a gripe, H. influenzae é responsable de diversas enfermidades infecciosas humanas.
H. influenzae foi o primeiro organismo de vida libre do que se secuenciou o seu xenoma completo, que foi publicado en 1995.
H. influenzae è un coccobacillo pleomorfo Gram negativo della famiglia delle Pasteurellaceae. Il suo diametro è di 0.2-2.0 micron, è asporigeno, immobile, aerobio-anaerobio facoltativo, caratterizzato da parassitismo obbligato (deve colonizzare un organismo vivente, non è un batterio ambientale). H. influenzae di tipo b è il batterio più importante nella patologia umana.
H. influenzae cresce in agar cioccolato, soprattutto in presenza di alcuni fattori di crescita, denominati X (ematina) e V (NAD). Presenta una capsula polisaccaridica che caratterizza i 7 sierotipi (a, b, c, d, e, e', f). Si distinguono 8 biotipi (I-VIII) sulla base di 3 reazioni biochimiche:
Tra questi deve essere ricordato H. influenzae biogruppo aegyptucus, particolarmente virulento e agente eziologico di congiuntivite purulenta e febbre purpurea brasiliana.
La capsula polisaccaridica di H. influenzae (tipo b) inibisce la fagocitosi mediata dal sistema del complemento. È composta da ribosio, fosfato e ribitolo. Notevole importanza assumuno gli anticorpi anti-capsula (anti-poliribitolfosfato, PRP) che si sviluppano nel soggetto esposto al batterio e al vaccino, poiché sono in grado di garantire protezione duratura. Altri fattori di virulenza sono i pili e le adesine che promuovono l'attacco alle cellule epiteliali. Il LPS sostiene il quadro infiammatorio, mentre i glicopeptidi sono in grado di bloccare l'attività delle ciglia delle cellule bronchiali e di indurre necrosi estesa. Un altro importante fattore di virulenza sono le proteasi, in grado di dissolvere la matrice extracellulare e promuovere l'invasione tissutale e sistemica.
I ceppi acapsulati colonizzano normalmente il tratto respiratorio superiore. La colonizzazione può esitare nella penetrazione del microrganismo nella sottomucosa nasofaringea; tuttavia, raramente può verificarsi l'entrata nel torrente circolatorio e la distribuzione in altri siti. I quadri più comuni (dovuti a colonizzazione patologica o da diffusione) sono otite media, sinusite, bronchite e polmonite. I ceppi capsulati, in assenza di anticorpi opsonizzanti (soggetti non vaccinati o non precedentemente esposti), possono facilmente colonizzare il torrente ematico e promuovere batteriemia con disseminazione alle meningi (meningite), ai tessuti molli (celluliti) e all'epiglottide (epiglottiti).
Sebbene il 35-85% degli adulti presenta H. influenzae nel tratto respiratorio superiore (nasofaringe, orofaringe), solo lo 0,4% ha Hib (H. influenzae di tipo b). Il 60-90% dei bambini presenta H. influenzae, ma solo il 5% ha Hib, percentuale che aumenta nei bambini ricoverati nei centri pediatrici.
La diffusione avviene da persona a persona: i bambini possono contrarre l'infezione da altri bambini o da adulti portatori. Se Hib rimane a livello della mucosa nasale o delle alte vie respiratorie, la malattia non si verifica. Se invece penetra a livello del polmone o nel sangue, si ha malattia.
I campioni biologici elettivi sono distinti in base al quadro patologico:
L'esame microscopico mette in evidenza coccobacilli gram negativi e leucociti polimorfonucleati. L'esame colturale si svolge seminando il campione su agar cioccolato in atmosfera contenente 5% di anidride carbonica. Possono essere svolti test della dipendenza da fattori X e V (vedi sopra). L'identificazione biochimica può avvenire mediante il riconoscimento di reazioni metaboliche particolari (laborioso) o mediante test immunoenzimatici. La sierotipizzazione è utile solo a fini epidemiologici. Può essere anche osservato il fenomeno di satellitismo; Hib cresce su agar sangue come colonie satellite intorno a Staphylococcus aureus, che rende disponibili i fattori presenti nel sangue che, senza riscaldamento (si tenga presente che agar cioccolato è agar sangue cotto) non sarebbero disponibili. La ricerca dell'antigene capsulare in campioni di liquor o urina può essere fatta mediante agglutinazione su particelle di latex.
Infezioni gravi vanno trattate con antibiotici beta-lattamasi resistenti, come cefalosporine con buona penetrazione nel liquido cefalorachidiano o cloramfenicolo (quest'ultimo deve essere dosato sotto costante monitoraggio, dati i notevoli effetti avversi). Le altre infezioni possono essere trattate con ampicillina o cefalosporine. Anche altri antibiotici, tra cui lo xibornolo, un antibiotico somministrabile per os o per inalazione tramite formulazioni spray, si sono dimostrati efficaci nei confronti del germe.
Il vaccino è composto da antigene purificato (PRP capsulare purificato e proteine carrier). La vaccinazione avviene a 2, 4, 6 e 12-15 mesi. Per i portatori a rischio di Hib, può essere utile una chemioprofilassi con rifampicina.
H. influenzae è un coccobacillo pleomorfo Gram negativo della famiglia delle Pasteurellaceae. Il suo diametro è di 0.2-2.0 micron, è asporigeno, immobile, aerobio-anaerobio facoltativo, caratterizzato da parassitismo obbligato (deve colonizzare un organismo vivente, non è un batterio ambientale). H. influenzae di tipo b è il batterio più importante nella patologia umana.
Pfeifera nūjiņa, arī hemofilā nūjiņa vai influences baktērija (Haemophilus influenzae) ir gramnegatīva baktērija. Fakultatīvi anaeroba, bet labāk aug aerobos apstākļos. Ir patogēnas tikai cilvēkam, kam var izraisīt pneimoniju, otītu (vidusauss iekaisums), sinusītus, laringotraheītu, bronhītu u.c. Haemophilus influenzae biovar aegyptius izraisa strutainu konjunktivītu[1].
Šo baktēriju pirmo reizi aprakstīja vācu bakteriologs Rihards Pfeifers (1858—1945), kļūdaini uzskatot to par gripas jeb influences ierosinātāju.
Haemophilus influenzae (Rd celms) bija pirmais brīvi dzīvojošais organisms, kuram 1995. gadā tika veikta pilna genoma sekvenēšana[2].
Pfeifera nūjiņa, arī hemofilā nūjiņa vai influences baktērija (Haemophilus influenzae) ir gramnegatīva baktērija. Fakultatīvi anaeroba, bet labāk aug aerobos apstākļos. Ir patogēnas tikai cilvēkam, kam var izraisīt pneimoniju, otītu (vidusauss iekaisums), sinusītus, laringotraheītu, bronhītu u.c. Haemophilus influenzae biovar aegyptius izraisa strutainu konjunktivītu.
Šo baktēriju pirmo reizi aprakstīja vācu bakteriologs Rihards Pfeifers (1858—1945), kļūdaini uzskatot to par gripas jeb influences ierosinātāju.
Haemophilus influenzae (Rd celms) bija pirmais brīvi dzīvojošais organisms, kuram 1995. gadā tika veikta pilna genoma sekvenēšana.
Haemophilus influenzae type b, afgekort Hib, is een bacterie. De bacterie wordt door hoesten en niezen van de ene op de andere persoon overgebracht. Ongeveer 5 procent van de gevallen van meningitis (= hersenvliesontsteking) bij zuigelingen en peuters in Nederland wordt veroorzaakt door de Hib-bacterie. Van de 100 kinderen die Hib-meningitis krijgen, overlijden gemiddeld 2 kinderen en bijna 10 kinderen houden er een ernstige handicap (doofheid, epilepsie, geestelijke achterstand) aan over. Daarnaast kan de Hib-bacterie nog andere ernstige verschijnselen veroorzaken, zoals epiglottitis (=zwelling van het strotklepje, waardoor kinderen kunnen stikken), middenoorontsteking (otitis media), sinusitis en ontsteking van de gewrichten.
Vaccinatie met Hib-vaccin biedt volledige bescherming tegen Hib-ziekten. Maar zoals hierboven al staat vermeld wordt hersenvliesontsteking maar in 5 procent van de gevallen veroorzaakt door de Hib- bacterie. Kinderen die tegen Hib-ziekten zijn ingeënt kunnen dus wel nog hersenvliesontsteking krijgen die door een andere bacterie of virus wordt veroorzaakt. De vaccinatie is opgenomen in het Nederlandse Rijksvaccinatieprogramma.
Het vaccin is een geconjugeerd vaccin. B-cellen met een immunoglobuline tegen het polysacharide van het vaccin zullen het conjugaat opnemen. De proteïne-component van het vaccin zal gepresenteerd worden op het oppervlak van de B-cel met behulp van klasse II MHC moleculen, de T-helper-cel zal hier op binden en hierdoor zal de B-cel geactiveerd worden zodat de B-cel antilichamen gaat aanmaken tegen het bacterieel polysacharide.
Om Haemophilus influenzae te kweken op een voedingsbodem dienen de X én de V factor aanwezig te zijn (bijvoorbeeld chocoladeplaat of bloedplaat met voedster)[1]. Met 'voedster' wordt hier bijvoorbeeld een Staphylococcus aureus bedoeld die op de bloedagarplaat wordt meegeënt en zodoende de X en de V factor levert voor de groei van de Haemophilus influenzae.
Bronnen, noten en/of referentiesBLNAR – (β-lactamase negative, ampicilin resistant) - nazwa opornych szczepów bakterii należących do gatunku Haemophilus influenzae. Nie można wykluczyć, że ten sam mechanizm jest obecny u niektórych bakterii Haemophilus parainfluenzae (wykryte u pacjentów przebywających w rejonach Południowej Afryki)[1] oraz Haemophilus haemolyticus[2].
Oporność jest związana z modyfikacją białek (PBP) będących miejscem wiązania beta-laktamów (zwłaszcza mutacja genu ftsl kodująca białko PBP 3A/3B polegająca na substytucji 1-3 aminokwasów w pobliżu centrum aktywnego enzymu)[3][4][5]. Kolejne mutacje u szczepów BLNAR mogą dotyczyć pompy ArcAB[6]. Innym mechanizmem oporności na beta-laktamy jest wytwarzanie przez bakterie enzymu rozkładającego antybiotyk; szczepy BLNAR nie wytwarzają jednak takiego enzymu, co zostało podkreślone w nazwie (beta-laktamazo ujemne, ampicylinooporne).
Na tempo rozprzestrzeniania się tej mutacji wpływa prawdopodobnie zdolność do horyzontalnego transferu mutacji genu ftsI[2][7].
Mutacje w obrębie genu ftsI obejmują (pozycja, pierwotny aminokwas, aminokwas po mutacji)[2]:
Markowitz w 1980 roku opisał szczep Haemophilus influenzae oporny na ampicylinę, które nie wytwarzał beta-laktamazy; mechanizm oporności był dla niego niejasny[8]. Był to pierwszy tego typu przypadek na świecie[9]. w 1981 stanowiły one 2% szczepów H. influenzae, natomiast 5 lat później już 4%[10]. W 1985 w Quebecu na 200 szczepów zidentyfikowano tylko 4 BLNAR[11]. W 1988 Needham podejrzewał w tym rzadkim ówcześnie mechanizmie oporności mutacje w obrębie PBP 4 i 5[12].
Na początku lat 90 szczepy BLNAR nie wydawały się istotnym zagrożeniem - zależnie od rejonu występowały one u 0,4-2,8% badanych bakterii Haemophilus influenzae (dla porównania - w USA ponad 20% szczepów wytwarzało beta-laktamazę)[13][14]. Uważano, że produkcja enzymu rozkładającego beta-laktamy utrudni spopularyzowanie innego mechanizmu oporności na tą samą klasę antybiotyków[13]. Ponadto niektóre szczepy mogły zostać błędnie sklasyfikowane jako BLNAR ze względu na niejasne kryteria dotyczące MIC ampicyliny[13]. Dopiero później ustalono minimalne stężenie ampicyliny na 2 mikrogramy na mililitr[15].
Analiza Haemophilus influenzae z 30 amerykańskich laboratoriów mikrobiologicznych z okresu listopad 1994 - kwiecień 1995 wykazała m.in że 2,5% szczepów należy do grupy BLNAR[16]. 1,1% bakterii posiadało oba mechanizmy oporności - wytwarzało enzym i miało zmodyfikowane białka PBP) - szczepy te nazwano BLPACR (β-lactamase positive, ampicilin-clavulanate resistan)[16].
W badaniu zakończonym w 1995 roku nie zidentyfikowano żadnego szczepu BLNAR w São Paulo[17].
W 1999 opisano szczepy BLNAR u japońskich dzieci chorujących na zakażenie dróg oddechowych[18]. W innej japońskiej publikacji z tego samego roku oceniono częstość oporności polegającej na wytwarzaniu beta-laktamazy i modyfikacji PBP za porównywalną (14 i 14,5%)[19]. Wśród szczepów Haemophilus influenzae będących czynnikiem etiologicznym zapalenia ucha środkowego 25% należało do BLNAR, a 15,5% wytwarzało beta-laktamazę (2000, Japonia)[20].
W Hiszpanii w 1999 oceniono częstość występowania BLNAR na 9,3%; szacunki z wcześniejszych lat mówiły o około 5%[21]. BLPACR stanowiło 0,1% wszystkich szczepów[21]. W tym okresie zakażenia w Europie Wschodniej były rzadkie (0,2-0,3%)[9].
W 2000 Japończycy potwierdzili istnienie szczepów BLPACR; równocześnie ocenili częstość występowania BLNAR na 9%[22]. Inne badanie wykazało ogromne różnice w wykrywaniu szczepów BLNAR - zakres sięgał 5-44% - zależnie od użytej metody; postulowano ujednolicenie kryteriów rozpoznawania BLNAR[23].
W 2001 wykazano bezpieczeństwo i skuteczność meropenemu; zarówno in vitro jak i na myszach[24].
W 2002 opisano w Holandii 9 przypadków BLNAR z 2 szpitali; autorzy sugerowali zakażenie wewnątrzszpitalne[25].
Japończycy badacze w 2002 roku zauważyli tendencje spadkową wśród szczepów wytwarzających beta-laktamazę (mniej niż 10% ogółu), natomiast częstość BLNAR wciąż rosła[26]. Udział BLNAR wśród bakterii Haemophilus influenzae zwiększył się w ciągu dwóch lat prawie czterokrotnie[6]. W 2005 ogłoszono, że wśród chorych leczonych ambulatoryjnie na infekcje dróg oddechowych odsetek BLNAR wśród H. influenzae wynosił 35%[27]. Tego typu oporność wiąże się z trudnością w doborze empirycznego antybiotyku przy infekcji dróg oddechowych, makrolidy skuteczne względem BLNAR nie działają na pneumokoki (Japońskie szczepy są oporne na ten antybiotyk)[28].
Według Zakładu Epidemiologii i Mikrobiologii Klinicznej Narodowego Instytutu Zdrowia Publicznego w Warszawie w latach 2002-2004 12,8% szczepów miało oporność typu BLNAR, natomiast 9% wytwarzało beta-laktamazę[29].
Kanadyjczycy w 2002 roku zakończyli badanie nadzoru mikrobiologicznego PROTEKT - szczepów BLNAR okazało się bardzo mało (<0,1%)[30].
Do 2004 w Moskwie zidentyfikowano pięć przypadków BLNAR[31].
W 2004/2005 procentowa liczba szczepów BLNAR pozostawała w Europie taka sama jak w latach 2002/2003 (zaś udział bakterii wytwarzających beta-laktamazę zmalał)[32].
W 2006 roku 30% bakterii Haemophilus influenzae w Korei Południowej okazało się mieć oporność typu BLNAR[33].
Pierwsze ogólnokrajowe japońskie badanie oporności bakterii na antybiotyki przeprowadzone w okresie styczeń-sierpień 2006 wykazało odsetek 29,1% BLNAR i 4,8% BLPAR[34].
Przegląd porównujący oporność w 1997 i 2006 wykazał niezbicie większy udział szczepów BLNAR w 2006; dotyczy to zwłaszcza najmłodszej grupy wiekowej (<3 lata)[35].
Szczepy BLNAR mają 2-3 razy wyższe MIC dla wszystkich antybiotyków beta-laktamowych[33].
Opisano przypadek rocznego chłopca z ZOMR u którego skuteczne okazały się duże dawki ceftriaxonu[36]. Aktywność względem bakterii zachowuje piperacylina (z tazobaktamem lub bez niego)[37], lewofloksacyna[38][39], tozofluksacyna[40] (fluorochinolony), cefditoren (cefalosporyna III generacji)[27]; z makrolidów najlepsza okazała się azytromycyna[27]. Jednak lekiem z wyboru podczas podejrzenia infekcji BLNAR jest ceftraxon; lek ten jest skuteczny także względem pneumokoków[41][42].
In vitro skuteczne okazało się połączenie meropenemu z cefotaksymem, ryfampicyną lub ampicyliną[43].
Trudne w leczeniu zapalenie opon mózgowych wywoływane przez szczepy BLNAR spowodowały pojawienie się w Japonii głosów o konieczności rutynowego szczepienia niemowląt przeciwko Haemophilus influenzae[44][45].
BLNAR – (β-lactamase negative, ampicilin resistant) - nazwa opornych szczepów bakterii należących do gatunku Haemophilus influenzae. Nie można wykluczyć, że ten sam mechanizm jest obecny u niektórych bakterii Haemophilus parainfluenzae (wykryte u pacjentów przebywających w rejonach Południowej Afryki) oraz Haemophilus haemolyticus.
Haemophilus influenzae – Gram-ujemna bakteria (pałeczka) przenoszona drogą kropelkową, wywołująca głównie zakażenia układu oddechowego i zapalenie opon mózgowo-rdzeniowych.
Bakteria ta została po raz pierwszy opisana w 1892 roku przez Richarda Pfeiffera podczas epidemii grypy (od jego nazwiska powstała dawna nazwa tej bakterii, pałeczka Pfeiffera[1]). Nazwy łacińska (Haemophilus influenzae) i polska (pałeczka grypy) mają znaczenie czysto historyczne, ponieważ wiadomo już od 1933 roku, że grypa ma etiologię wirusową[potrzebny przypis].
H. influenzae był pierwszym mikroorganizmem, którego cały genom udało się zsekwencjonować [potrzebny przypis]. Na genom tej bakterii składają się 1 830 140 par zasad DNA w pojedynczym kolistym chromosomie, który zawiera 1740 kodujących białka genów, 58 genów tRNA i 18 innych genów kodujących RNA[potrzebny przypis]. Przeprowadzone w The Institute for Genomic Research przedsięwzięcie sekwencjonowania genomu H. influenzae zostało ukończone i opublikowane w czasopiśmie naukowym Science w 1995 roku[potrzebny przypis].
Haemophilus influenzae jest nieruchomą, Gram-ujemną pałeczką nietworzącą przetrwalników. Należy do bakterii względnie beztlenowych. Rośnie najlepiej na ogrzanych płytkach agaru czekoladowego (ogrzewanie erytrocytów powoduje uwalnianie czynnika X (hemina) i V (NAD+), które są niezbędne do wzrostu bakterii)[2].
Podczas pandemii w końcu XIX wieku bakterię izolowano ze zwłok osób zmarłych na grypę (influenza)[potrzebny przypis]. Sądząc, iż to właśnie ona odpowiada za tę chorobę, nazwano ją Haemophilus influenzae. Dopiero w roku 1933 zidentyfikowano właściwy czynnik etiologiczny: wirus grypy[potrzebny przypis].
Ze względu na obecność różnych przeciwciał wobec polisacharydowej otoczki wyróżnia się 6 podtypów Haemophilus influenzae: a, b, c, d, e, f. W celu szybkiej identyfikacji danego podtypu stosuje się metodę bezpośredniej immunofluorescencji.
Głównymi czynnikami chorobotwórczymi Haemophilus influenzae są:
Haemophilus influenzae przenosi się drogą kropelkową, przedostając się do dróg oddechowych, a następnie do krwi. Niekiedy może się szerzyć poprzez ciągłość na opony mózgowo-rdzeniowe. Przenosi się wyłącznie z człowieka na człowieka (ludzie zwykle są skolonizowani szczepami bezotoczkowymi).
Może wywoływać wiele chorób:
W leczeniu stosuje się antybiotyki, na przykład cefalosporyny III generacji, amoksycylinę, chloramfenikol.
W celu profilaktyki można stosować szczepionkę zawierającą oczyszczony polirybofosforan, skojarzoną z immunogennymi białkami lub polipeptydami.
W chemioprofilaktyce stosuje się ryfampicynę.
Haemophilus influenzae – Gram-ujemna bakteria (pałeczka) przenoszona drogą kropelkową, wywołująca głównie zakażenia układu oddechowego i zapalenie opon mózgowo-rdzeniowych.
Bakteria ta została po raz pierwszy opisana w 1892 roku przez Richarda Pfeiffera podczas epidemii grypy (od jego nazwiska powstała dawna nazwa tej bakterii, pałeczka Pfeiffera). Nazwy łacińska (Haemophilus influenzae) i polska (pałeczka grypy) mają znaczenie czysto historyczne, ponieważ wiadomo już od 1933 roku, że grypa ma etiologię wirusową[potrzebny przypis].
H. influenzae był pierwszym mikroorganizmem, którego cały genom udało się zsekwencjonować [potrzebny przypis]. Na genom tej bakterii składają się 1 830 140 par zasad DNA w pojedynczym kolistym chromosomie, który zawiera 1740 kodujących białka genów, 58 genów tRNA i 18 innych genów kodujących RNA[potrzebny przypis]. Przeprowadzone w The Institute for Genomic Research przedsięwzięcie sekwencjonowania genomu H. influenzae zostało ukończone i opublikowane w czasopiśmie naukowym Science w 1995 roku[potrzebny przypis].
A Haemophilus influenzae, inicialmente designada de bacilo de Pfeiffer, é uma bactéria cocobacilar Gram negativo, aeróbia facultativa da família Pasteurellaceae. H. influenzae foi descrita pela primeira vez em 1892 por Richard Pfeiffer durante uma pandemia de influenza. Foi confundida como a causa da gripe comum, atualmente definida como causada pelo vírus influenza, até 1933. A utilização de vacinas diminuiu drasticamente o número de pessoas infectadas.[1]
Os tipos de H. influenzae vão de A a F, predominando o tipo B, abreviado como HiB, o mais virulento deste grupo. Este procarionte simples foi o primeiro organismo de vida livre a ter seu genoma completamente sequenciado, com aproximadamente 1.740 genes.
É uma bactéria oportunista que só causa doenças espontaneamente em humanos, geralmente crianças pequenas ou imunodeprimidos. Pode provocar meningites, infecções no ouvido médio (Otite média) e respiratórias (faringite, bronquite ou pneumonia). Raramente pode causar também infecções generalizadas (sépsis), epiglotite, osteomielite e artrite séptica.[2]
O espectro de manifestações clínicas presentes nas infecções por H. Influenzae varia dependendo da tipagem do germe. Quanto à classificação existem duas variantes principais: encapsulados e não encapsulados. Os do primeiro grupo são subclassificados e distribuídos em grupos nomeados de A a F, de acordo a seus antígenos capsulares. Os não encapsulados são genericamente chamados de "não tipáveis". Os germes dos grupos encapsulados costumam causar quadros mais severos, principalmente aqueles do grupo B, associado a infecções de sistema nervoso central, epiglotite e sepse. É este o grupo coberto pela vacina contra H. influenzae presente no calendário de imunizações do Brasil. As infecções pelos germes do grupo "não-tipáveis" costuma correr com sintomas brandos sistêmicos ou de vias respiratórias, causando otites e faringites.
Em 2000, apesar de já existir vacina, foi responsável pela morte de 386 mil crianças menores de 5 anos. Sua vacina é geralmente conjugada com a DTP (difteria, tétano e pertussis) em três doses ou com a vacina de pólio e está no calendário de vacinação em mais de 100 países.[3]
A Haemophilus influenzae, inicialmente designada de bacilo de Pfeiffer, é uma bactéria cocobacilar Gram negativo, aeróbia facultativa da família Pasteurellaceae. H. influenzae foi descrita pela primeira vez em 1892 por Richard Pfeiffer durante uma pandemia de influenza. Foi confundida como a causa da gripe comum, atualmente definida como causada pelo vírus influenza, até 1933. A utilização de vacinas diminuiu drasticamente o número de pessoas infectadas.
Os tipos de H. influenzae vão de A a F, predominando o tipo B, abreviado como HiB, o mais virulento deste grupo. Este procarionte simples foi o primeiro organismo de vida livre a ter seu genoma completamente sequenciado, com aproximadamente 1.740 genes.
Haemophilus influenzae (denumită în trecut Bacillus influenzae) este o bacterie Gram-negativă patogenă, cocobacilară, facultativ anaerobă din familia Pasteurellaceae. H. influenzae a fost descrisă pentru prima dată în 1892 de către Richard Pfeiffer în timpul unei epidemii de gripă.[1]
Haemophilus influenzae (denumită în trecut Bacillus influenzae) este o bacterie Gram-negativă patogenă, cocobacilară, facultativ anaerobă din familia Pasteurellaceae. H. influenzae a fost descrisă pentru prima dată în 1892 de către Richard Pfeiffer în timpul unei epidemii de gripă.
Haemophilus influenzae (tudi Pfeifferjev bacil) je vrsta hemofilusov[1], gramnegativnih pleomorfnih (polimorfnih) bacilov, to pomeni, da se njihova oblika prilagaja okolju, lahko postanejo bacili, kokobacili ali tudi vibriji. Je fakultativno anaerobna oportunistična bakterija, ki jo je prvi opisal Richard Pfeiffer leta 1892 med pandemijo gripe oziroma influence.[2] Sprva so zmotno predvidevali, da povzroča gripo, in sicer vse do leta 1933, ko so odkrili virus gripe. Haemophilus influenzae, pri 80% populacije, naseljuje nosno-žrelni predel (nasopharynx) in je del normalne mikrobne flore. Haemophilus influenzae (tipa B) povzroča različne lokalizirane in invazivne okužbe,[3] zlasti vnetja dihal, paranazalnih sinusov, srednjega ušesa, veznic, možganskih ovojnic, seroznih mren in sklepov, lahko pa tudi sepso. H. influenzae raste le na krvnem agarju in čokoladnem agarju, na katerega je cepljen tudi Staphylococcus aureus[1], s tem dodamo rastni faktor V (koencim ali NAD+) in X (hematin), pri tem se tudi pojavi ti. satelitni efekt.
'Haemophilus influenzae je bil prvi organizem iz narave, ki so mu določili zaporedje celotnega genoma.[3]
Ločimo neinkapsulirane in inkapsulirane seve. Poznanih je šest tipov inkapsuliranih sevov H. influenzae, ki jih označujemo s črkami a do f.[4] Najbolj poznana sta tipa a in b:
Bakterija Haemophilus influenzae je zelo razširjena med splošnim prebivalstvom, po izračunih svetovne zdravstvene organizacije – WHO jo nosijo 4je od 5ih ljudi. Podatki za Slovenijo, iz Nacionalnega inštituta za javno zdravje, kažejo da se letno s patogenim sevom (tipa B) bakterije okuži približno 3.700[5] prebivalcev Slovenije. V naši regiji so najbolj ogroženi otroci od 5-14 let in odrasli nad 50im letom starosti, medtem ko na evropskem povprečju so daleč najbolj ogroženi dojenčki. Po podatkih, evropskega centra za preprečevanje in nadzor nad boleznimi, Haemophilus influenzae raje okuži moške, kot pa ženske[6].
Haemophilus i. se prenaša aerosolno ali pa s kontaktom. Bakterija se nahaja samo v človeku in se ne prenaša preko živali (ni zoonozna). Po navadi se nahaja na sluznicah nosu in grla in je oportunist. Okužbe z Haemophilusom tipa B so najpogostejše v zimskem in spomladanskem obdobju od novembra in do maja, poleti se pa okužbe znatno zmanjšajo. Okužbe se pogoste predvsem v zaprtih prostorih, kot so vrtci, šole in dom.
Sevi brez kapsule so večinoma neinvazivni, a so eni najpogostejših povzročiteljev okužb dihal pri človeku, predvsem akutnega poslabšanja kroničnega obstruktivnega bronhitisa, pljučnice, akutnega vnetja srednjega ušesa in sinuzitisa.[7]
Med sevi s kapsulo (inkapsuliranimi sevi) je bil Haemophilus influenzae tipa b (Hib) pred uvedbo obveznega cepljenja otrok proti temu povzročitelju najpogostejši povzročitelj hemofilusnih invazivnih okužb pri otrocih.[7] Pri necepljenih otrocih lahko povzroči vnetje možganskih ovojnic (meningitis), vnetje poklopca (epiglotitis), okužbo krvi (bakteriemijo), vnetje sklepov (septični artritis), kosti (osteomielitis), pljuč (pljučnico) in osrčnika (perikarditis).[8] Inkapsulirani sevi Hi, ki niso tip b, so redko povzročitelji invazivnih okužb,[7] čeprav so v zadnjem času pogostejše invazivne okužbe tudi s tipom a.[1]
Haemophilus influenzae (tudi Pfeifferjev bacil) je vrsta hemofilusov, gramnegativnih pleomorfnih (polimorfnih) bacilov, to pomeni, da se njihova oblika prilagaja okolju, lahko postanejo bacili, kokobacili ali tudi vibriji. Je fakultativno anaerobna oportunistična bakterija, ki jo je prvi opisal Richard Pfeiffer leta 1892 med pandemijo gripe oziroma influence. Sprva so zmotno predvidevali, da povzroča gripo, in sicer vse do leta 1933, ko so odkrili virus gripe. Haemophilus influenzae, pri 80% populacije, naseljuje nosno-žrelni predel (nasopharynx) in je del normalne mikrobne flore. Haemophilus influenzae (tipa B) povzroča različne lokalizirane in invazivne okužbe, zlasti vnetja dihal, paranazalnih sinusov, srednjega ušesa, veznic, možganskih ovojnic, seroznih mren in sklepov, lahko pa tudi sepso. H. influenzae raste le na krvnem agarju in čokoladnem agarju, na katerega je cepljen tudi Staphylococcus aureus, s tem dodamo rastni faktor V (koencim ali NAD+) in X (hematin), pri tem se tudi pojavi ti. satelitni efekt.
'Haemophilus influenzae je bil prvi organizem iz narave, ki so mu določili zaporedje celotnega genoma.
Ločimo neinkapsulirane in inkapsulirane seve. Poznanih je šest tipov inkapsuliranih sevov H. influenzae, ki jih označujemo s črkami a do f. Najbolj poznana sta tipa a in b:
Haemophilus influenzae tipa a, ki zlasti v zadnjem času povzroča invazivne bolezni, in Haemophilus influenzae tipa b ki je bil pred uvedbo cepiva Hib najpogostejši povzročitelj gnojnega meningitisa pri otrocih.Haemophilus influenzae är en bakterie som kan orsaka hjärnhinneinflammation, luftvägsinfektion med mera. Bakterien är efter pneumokocker den vanligaste orsaken till mellanöroninfektion hos barn. Bakterien är en gramnegativ kockobacill, inte sporbildande och beskrevs första gången 1892 av den tyske läkaren Richard Pfeiffer. Han hade först funnit den i sputum hos patienter vilka insjuknat i ryska snuvan, senare återfanns den även i sputum och lungprover från avlidna som fallit offer för spanska sjukan. Trots sitt namn, så orsakar bakterien inte influensa.
Det första genomet att någonsin bli kartlagt var H. influenzae eftersom den har ett så pass litet genom. 1995 publicerade Hamilton O. Smith och Craig Venter sitt resultat av 1 830 137 baspar (bp) fördelat på 1 750 gener. Som jämförelse fastställdes under våren 2000 sekvensen av det mänskliga genomet till 3 miljarder bp.[1]
H. influenzae är en liten bakterie (1 µm X 0.3 µm), som ingår i släktet Haemophilus som hör till familjen Pasteurellaceae, en bakteriefamilj bestående av gramnegativa bakterier. Bakterierna i familjen är fakultativt anaeroba[2] men den kan även växa aerobt.
År 1930, definierades två huvudkategorier av H. influenzae, de kapslade stammarna och de okapslade stammarna. De kapslade stammarna har därefter delats in i ytterligare kategorier (a-f) utifrån den biokemiska skillnaden i kapseln. De stammar som inte har någon kapsel kallas inte typbara (NTHi) eftersom de saknar kapsulära serotyper.[3]
Den mest sjukdomsframkallande stammen av H. influenzae är typ b (Hib), med en STI polyribosylribitolfosfat (PRP) kapsel. Den står för mer än 95 % av de fall med invasiva sjukdom[4], som orsakas av H. influenzae. Det är framför allt barn som drabbas av dessa, men även nära hälften av de invasiva H. influenzae-fallen som drabbar vuxna.
H. influenzae kan orsaka olika infektioner i de övre luftvägarna, framförallt mellanöreinflammation och bihåleinflammation. Hos barn där H. influenzae påvisas i blodet kan den leda till hjärnhinneinflammation (meningit), struplocksinflammation (epiglottit) och ledinfektion. Bakterien kan även ge upphov till luftrörskatarr och ganska ovanligt lunginflammation.
Influensa är en virussjukdom i luftvägarna och skall inte förväxlas med H. influenzae-infektion. Influensainfektion innebär däremot en ökad risk för sekundär bakterieinfektion, exempelvis med H. influenzae. På grund av att H influenzae ofta kunde påvisas i lungorna hos personer som avlidit i samband med influensa och då man i början av 1900-talet kunde odla fram bakterierna från lungprov och därefter undersöka vilka bakterier man funnit. Slutsatsen drogs därefter att bakterien orsakade influensa och därigenom fick sedan bakterien sitt artepitet[5].
Numera finns det ett effektivt vaccin mot Hib. Polysackarider från den kapsel som kallas b används sedan 1993 som vaccinering och skyddar mot de allvarligaste formerna av infektioner. Detta vaccin erbjuds av landets barnavårdscentraler till alla barn upp till ett halvår. Sedan vaccinationen infördes har sjukdomar orsakade av Hib minskat kraftigt.
Enligt smittskyddsförordningen[6] är invasiv infektion av H. influenzae anmälningspliktig.
Haemophilus influenzae är en bakterie som kan orsaka hjärnhinneinflammation, luftvägsinfektion med mera. Bakterien är efter pneumokocker den vanligaste orsaken till mellanöroninfektion hos barn. Bakterien är en gramnegativ kockobacill, inte sporbildande och beskrevs första gången 1892 av den tyske läkaren Richard Pfeiffer. Han hade först funnit den i sputum hos patienter vilka insjuknat i ryska snuvan, senare återfanns den även i sputum och lungprover från avlidna som fallit offer för spanska sjukan. Trots sitt namn, så orsakar bakterien inte influensa.
Det första genomet att någonsin bli kartlagt var H. influenzae eftersom den har ett så pass litet genom. 1995 publicerade Hamilton O. Smith och Craig Venter sitt resultat av 1 830 137 baspar (bp) fördelat på 1 750 gener. Som jämförelse fastställdes under våren 2000 sekvensen av det mänskliga genomet till 3 miljarder bp.
Haemophilus influenzae (eski isimleri; Pfeiffer basili ya da Bacillus influenzae), Gram-negatif, kokobasil, Pasteurellaceae ailesine ait fakültatif anaerobik bir bakteridir. H. influenzae ilk olarak bir grip salgını sırasında Richard Pfeiffer tarafından 1892 yılında tarif edilmiştir.[1] Bakteri gripin viral etyolojisinin ortaya çıktığı 1933 yılına kadar yanlışlıkla grip nedeni olarak kabul edilmiştir ve hala yanlışlıkla halk arasında grip bakterisi olarak bilinmektedir. H. influenzae lokalize ve invazif enfeksiyonların geniş bir aralığından sorumludur. Tüm genom dizilimi ortaya çıkarılmış ilk serbest yaşayan organizmadır. Genom dizilimi projesi 1995 yılında tamamlanmış ve yayınlanmıştır.
Haemophilus influenzae (eski isimleri; Pfeiffer basili ya da Bacillus influenzae), Gram-negatif, kokobasil, Pasteurellaceae ailesine ait fakültatif anaerobik bir bakteridir. H. influenzae ilk olarak bir grip salgını sırasında Richard Pfeiffer tarafından 1892 yılında tarif edilmiştir. Bakteri gripin viral etyolojisinin ortaya çıktığı 1933 yılına kadar yanlışlıkla grip nedeni olarak kabul edilmiştir ve hala yanlışlıkla halk arasında grip bakterisi olarak bilinmektedir. H. influenzae lokalize ve invazif enfeksiyonların geniş bir aralığından sorumludur. Tüm genom dizilimi ortaya çıkarılmış ilk serbest yaşayan organizmadır. Genom dizilimi projesi 1995 yılında tamamlanmış ve yayınlanmıştır.
H. influenzae вперше була описана у 1892 році Річардом Пфайффером під час пандемії грипу. Гемофільна паличка була знайдена ним у виділеннях з носа людей, хворих на грип. Гемофільна паличка помилково вважалася збудником грипу до 1933 року, коли вірусна етіологія грипу стала очевидною. H. influenzae відповідальна за широке коло локальних та генералізованих інфекцій.
Дрібна (0,3—0,5 × 0,2—0,3 мкм) нерухома кокобацила, розташовується поодиноко, попарно та скупченнями, утворює капсулу. Джгутиків не має, слабо фарбується аніліновими барвниками.
Хемоорганогетеротроф, факультативний анаероб. Утворює дрібні непрозорі пласкі колонії на середовищах, що містять прогріту кров (кров'яний агар лише з кінською або кролячою кров'ю, шоколадний агар, Колумбійський агар або середовище Левенталя, збагачене гемоглобіном). Не росте на простих живільних середовищах, які не містять кров. Для життєдіяльності мікроорганізму необхідні фактори росту X й V, залежність від яких є систематизуючою ознакою[1]. Метаболізує глюкозу з утворенням кислоти. Утворює колонії S- та R- типів. Гладенькі колонії S-типу утворюються H. influenzae типу b, що утворюють капсулу.
Для гемофільных бактерій є характерним т.зв. феномен сателіта, який проявляєтся в їх здатності рости на кров'яному агарі навколо колоній стафілококків або інших бактерій, що продукують нікотинамідаденіндинуклеотид (НАД) або спричинюють гемоліз. Власне гемофільним паличкам здатність викликати гемолиз не властива. Дрібні райдужні колонії гемофільних бактерій можуть бути виявлені на кров'яному агарі лише в зоні гемолізу, яка утворена іншими мікроорганізмами (наприклад, стафілококами).
Геном H. influenzae був повністю секвенований у 1995 році і опублікований в журналі Science. Мікроорганізм був обраний тому, що нобелевський лауреат Хамілтон Отанел Сміт тривалий час працював з ним та міг надати високоякісні бібліотеки клонованої ДНК[2]. Геном являє собою кільцеву дволанцюгову молекулу ДНК розміром 1830138 п.н. та містить 1789 генів, з яких 1657 кодують білки, частка Г+Ц пар складає 38%[3].
H. influenzae поділяють на 6 серотипів — a, b, c, d, e та f[4]. Штами серотипу b спричиняють найбільш важкі інфекції.
Спочатку H. influenzae був ідентифікований як збудник грипу, але після з'ясування вірусної етіології грипу (1933 р.) було виявлено, що цей мікроорганізм є одним зі збудників пневмонії[5], менінгіту[6], епіглотиту[7], до захворювання найбільш схильні діти віком до 3 років[8], а також дорослі зі скомпрометованою імунною системою[9]. Інфекція H. influenzae асоційована з перикардитом, целюлітом, остеомієлітом та септичним артритом[10]. H. influenzae уражає лише людей[11]. Капсула є фактором патогенності та захищає мікроорганізм від впливу імунної системи людини.
Haemophilus influenzae, là vi trùng thuộc loại cầu trực khuẩn Gram âm được bác sĩ Richard Pfeiffer tìm ra năm 1892 trong một trận dịch cúm. Từ đó, Haemophilus influenzae bị "đổ oan" là nguyên nhân của bệnh cúm cho đến năm 1933 khi khoa học tìm ra virus bệnh cúm. Tuy nhiên, Haemophilus influenzae vẫn là một vi trùng đáng ngại cho sức khỏe loài người.
Hệ gen của H. influenzae khá nhỏ và được khám phá hoàn tất năm 1995, gồm 1.830.140 cặp ADN với 1740 gen (do toán nghiên cứu của bác sĩ Robert Fleischmann).
Từ năm 1930, khoa học tìm ra hai dạng H. influenzae: loại không có vỏ và loại có vỏ. Loại có vỏ (loại H. influenzae B) lây nhanh và có khả năng gây bệnh ở người. Khi xâm nhập vào cơ thể người chưa có miễn nhiễm, lớp vỏ giúp H. influenzae tránh không bị tiêu diệt bởi các bạch huyết cầu và hệ thống complement.
Loại không vỏ tuy kém sức xâm nhập nhưng có thể làm bệnh khá trầm trọng như viêm nắp phế quản.
Haemophilus influenzae, là vi trùng thuộc loại cầu trực khuẩn Gram âm được bác sĩ Richard Pfeiffer tìm ra năm 1892 trong một trận dịch cúm. Từ đó, Haemophilus influenzae bị "đổ oan" là nguyên nhân của bệnh cúm cho đến năm 1933 khi khoa học tìm ra virus bệnh cúm. Tuy nhiên, Haemophilus influenzae vẫn là một vi trùng đáng ngại cho sức khỏe loài người.
Hệ gen của H. influenzae khá nhỏ và được khám phá hoàn tất năm 1995, gồm 1.830.140 cặp ADN với 1740 gen (do toán nghiên cứu của bác sĩ Robert Fleischmann).
Haemophilus influenzae (Lehmann and Neumann 1896) Winslow et al. 1917
Гемофильная палочка, палочка Пфайффера, палочка инфлюэнцы (лат. Haemophilus influenzae) — вид грамотрицательных неподвижных бактерий семейства Pasteurellaceae. Первоначально описана в 1892 году немецким бактериологом Рихардом Пфайффером ( нем. Richard Pfeiffer, 1858—1945) как возбудитель инфлюэнцы (гриппа). Первый свободноживущий организм, чей геном был полностью отсеквенирован. Возбудитель так называемой гемофильной инфекции у человека.
Мелкая (0,3—0,5 × 0,2—0,3 мкм) неподвижная коккобацилла, располагается одиночно, попарно и скоплениями, образует капсулу. Жгутиков не имеет, слабо прокрашивается анилиновыми красителями.
Хемоорганогетеротроф, факультативный анаэроб. Образует маленькие, непрозрачные плоские колонии на средах, содержащих прогретую кровь (кровяной агар только с лошадиной или кроличьей кровью, шоколадный агар, Колумбийский агар и среда Левенталя обогащённые гемоглобином), не растёт на простых питательных средах, не содержащих кровь. Для жизнедеятельности необходимы факторы роста X и V, зависимость от которых является систематическим признаком[1]. Сбраживает глюкозу с образованием кислоты. Образует колонии S- и R- типа. Гладкие колонии S- типа образуются H. influenzae типа b, образующих капсулу.
Для гемофильных бактерий характерен так называемый феномен кормушки или сателлита, который проявляется в их способности расти на кровяном агаре вокруг колоний стафилококков или других бактерий, продуцирующих НАД или вызывающих гемолиз. Для самих гемофильных палочек, способность вызывать гемолиз не характерна. Мелкие радужные колонии гемофильных бактерий могут быть обнаружены на кровяном агаре только в зоне гемолиза, образуемой другими микроорганизмами, например стафилококками.
Геном H. influenzae штамма Rd был первым геномом свободноживущего организма, который был полностью секвенирован в 1995 году и опубликован в журнале Science. Микроб был выбран потому что нобелевский лауреат Хамилтон Отанел Смит долгое время работал с этим микроорганизмом и мог предоставить высококачественные библиотеки клонированной ДНК[2]. Геном представлен кольцевой двуцепочечной молекулой ДНК размером 1830138 п.н. и содержит 1789 гена, из которых 1657 кодируют белки, процент % Г+Ц пар составляет 38 %[3].
H. influenzae разделяют на 6 серотипов — a, b, c, d, e и f[4]. Штаммы серотипа b вызывают наиболее тяжело протекающие инфекции.
Первоначально H. influenzae идентифицировали как возбудителя гриппа, после установления вирусной природы гриппа (1933 г.) обнаружилось, что микроб является одним из возбудителей пневмонии[5], менингита[6], эпиглоттита[7], заболеваниям подвержены дети в возрасте до 3 лет[8], а также взрослые с ослабленным иммунитетом[9]. Ассоциирован с перикардитом, целлюлитом, остеомиелитом и септическим артритом[10]. H. influenzae поражает только людей[11]. Капсула является фактором патогенности и защищает микроорганизм от действия иммунной системы человека.
Гемофильная палочка, палочка Пфайффера, палочка инфлюэнцы (лат. Haemophilus influenzae) — вид грамотрицательных неподвижных бактерий семейства Pasteurellaceae. Первоначально описана в 1892 году немецким бактериологом Рихардом Пфайффером ( нем. Richard Pfeiffer, 1858—1945) как возбудитель инфлюэнцы (гриппа). Первый свободноживущий организм, чей геном был полностью отсеквенирован. Возбудитель так называемой гемофильной инфекции у человека.
流感嗜血桿菌(學名:Haemophilus influenzae),簡稱嗜血桿菌,前稱費佛氏桿菌(或譯拜菲爾氏菌)或流感桿菌,是一種沒有運動力的革蘭氏陰性桿菌。牠是於1892年由費佛(英语:Richard Friedrich Johannes Pfeiffe)博士在流行性感冒的瘟疫中發現。牠一般都是好氧生物,但可以成長為兼性厭氧生物。[1]流感嗜血桿菌最初被誤認為是流行性感冒的病因,但直至1933年,當發現流行性感冒的病毒性病原後,才消除了這種誤解。不過,流感嗜血桿菌仍是會導致其他不同種類的病症。
於1930年,流感嗜血桿菌分類為兩類,即莢膜菌株及沒有莢膜的菌株。現今,流感嗜血桿菌通常依莢膜的種類分為六種血清型(即a,b,c,d,e和f)。而沒有莢膜的菌株,其基因多樣性比有莢膜的菌株還要高。沒有莢膜的菌株稱為NTHi(nontypable),因為它們沒有莢膜的血清型。
雖然已知莢膜類的乙型流感嗜血桿菌(或是b型流感嗜血桿菌,簡稱HiB)是毒性的主因之一,但感染流感嗜血桿菌的病因卻仍未完全清楚。牠們的莢膜能幫助牠們抵抗在沒有免疫的寄主體內的吞噬作用及不觸發補體介導的裂解。沒有莢膜的菌株則較少侵略性,但牠們能誘發炎症而產生其他病症,如會厭炎。接種HiB結合型疫苗是一種有效的預防方法,其中某幾種疫苗已經廣為使用。
大部份流感嗜血桿菌都是機會性感染細菌,即牠們會在寄主體內生存而不引起任何疾病,但當某一些因素(如病毒感染或免疫力下降)出現後則會引發病症。流感嗜血桿菌一般有六種菌株,稱為a型、b型(又稱乙型)、c型、d型、e型及f型。
由流感嗜血桿菌自然產生的疾病只會在人類出現。在嬰兒及孩童中,乙型流感嗜血桿菌會引致菌血病症(英语:Bacteremia)及急性細菌性腦膜炎。偶而地牠會引致蜂窩組織炎、骨髓炎(英语:Osteomyelitis)及關節感染。自從1990年開始,美國使用HiB結合型疫苗後,HiB病症的患病率減少至每十萬名兒童有1.3名兒童感染。但是,HiB仍然是發展中國家引致嬰兒及兒童下呼吸道疾病的主因。沒有莢膜的流感嗜血桿菌會引致兒童的耳朵感染(如中耳炎)、眼睛感染(結膜炎)及鼻竇炎,並且聯帶肺炎。
流感嗜血桿菌與肺炎鏈球菌都能在人類的上呼吸系統中發現。一項有關牠們之間的競爭研究指出,在培養基內,肺炎鏈球菌能以過氧化氫攻擊流感嗜血桿菌及能排除在表面流感嗜血桿菌生存所需的分子。
當兩種細菌一同在鼻腔內時,兩星期之內,只有流感嗜血桿菌能夠生存。當兩種細菌分別地放在鼻腔內時,兩者皆能生存。使實驗鼠的上呼吸組織暴露於兩種細菌時,發現有格外大量的中性粒細胞。當實驗鼠只是暴露於其中一種細菌時,則不會出現這些細胞。
實驗显示,接触过流感嗜血桿菌死菌的中性粒細胞对肺炎鏈球菌會強烈攻擊,而未接触过流感嗜血桿菌死菌的中性粒細胞的這種攻擊则較不會這麼強烈。接触流感嗜血桿菌死菌,却不會對流感嗜血桿菌活菌有所影響。這種現象有兩種可能性:
至於為何流感嗜血桿菌會不受免疫系統的影響則不得而知。[2]
因其細少的基因體,流感嗜血桿菌是第一種被全部测序的独立生存(非病毒)生物。選擇它的原因是項目領導人之一諾貝爾獎獲得者漢彌爾頓·史密斯已經研究它幾十年並且可以提供高質量的基因庫。牠的基因體包含了1,830,140的DNA鹼基對及1740個蛋白質編碼基因,兩個转运RNA,和其他18個RNA。流感嗜血桿菌的基因排序計劃由基因組研究所(英语:J. Craig Venter Institute)策劃,使用霰彈槍定序法於1995年完成及刊登於《科學》雜誌上。[3]
流感嗜血桿菌(學名:Haemophilus influenzae),簡稱嗜血桿菌,前稱費佛氏桿菌(或譯拜菲爾氏菌)或流感桿菌,是一種沒有運動力的革蘭氏陰性桿菌。牠是於1892年由費佛(英语:Richard Friedrich Johannes Pfeiffe)博士在流行性感冒的瘟疫中發現。牠一般都是好氧生物,但可以成長為兼性厭氧生物。流感嗜血桿菌最初被誤認為是流行性感冒的病因,但直至1933年,當發現流行性感冒的病毒性病原後,才消除了這種誤解。不過,流感嗜血桿菌仍是會導致其他不同種類的病症。

インフルエンザ菌(インフルエンザきん、Haemophilus influenzae)とは、パスツレラ科ヘモフィルス属のグラム陰性短桿菌で、主に呼吸器や中耳に感染する細菌の1種である。b型菌のことをHib(ヒブ)と呼ぶ。歴史的な理由によりインフルエンザという名称が付けられてはいるが、インフルエンザの病原体ではない。
1800年代のインフルエンザの大流行の際に、原因菌として分離された細菌である。そのためインフルエンザ菌という名称が付いているが、その後否定されたため名称だけが残ることとなった(インフルエンザの真の病原体は、RNAウイルスのインフルエンザウイルスである)。ただし、インフルエンザに引き続いて二次的感染を起こすことがある。1995年にH. influenzae Rd.株の全ゲノム配列が解析され[1]、その後データが改定されることにより、本菌のゲノムは1,830,138塩基の環状染色体からなり、染色体上には1,657のタンパク質配列がコードされている事が明らかとなった。なお、インフルエンザ菌は、初めて全ゲノム配列が明らかとなった生物である。
ヘモフィルス属のグラム陰性桿菌である。フィラメント状や球菌状の形態も呈する多形性という性質がある。発育因子としてX因子(ヘミン)とV因子(NAD)の両方を必要とする。ヘミン(hemin)を要求することは属名 (Haemophilus) の由来ともなっている。通常はブレインハートインフュージョン等の培地にヘミンとNAD、または羊脱線維血液を加えて培養する。
生物型ではI - VII型までの8つに分類され、このうちII型とIII型は莢膜を持たない。莢膜の血清型はa - fの6型に分けられる。血清型bの莢膜の構成成分である莢膜多糖体抗原 (phosphoribosylribotol phosphate) は病原因子として重要である。
非莢膜株は血清型分類できないという意味でnon-typable(NT)株とも呼ばれる。これに学名Haemophilus influenzaeの頭文字を略した"Hi"をつけて、b型菌を Hib、非莢膜株をNTHiなどと略すこともある。
非莢膜株と莢膜株とで大きく異なる病原性を持つ。
非莢膜株は健康なヒト、特に乳幼児の上気道(咽頭、鼻腔)にも常在している。感染症としては中耳炎、副鼻腔炎、気管支炎、肺炎などの気道感染症が多い。小児では気道感染症の3大起炎菌のひとつ(他は肺炎球菌、モラクセラ・カタラーリス)とされている。
莢膜株も上気道に保菌されていることがあるが、気道感染症を起こすことは少なく、直接血流中に侵入して感染症を起こすものと考えられている。莢膜株の感染症ではほとんどの場合b型が起炎菌で、敗血症、髄膜炎、結膜炎、急性喉頭蓋炎、関節炎などを起こす。b型以外の莢膜株が人に感染症を起こすことは稀であるが、Hibワクチン(ヒブワクチン)の普及によりb型以外による感染症が目立つようになってきている。
感染病巣からの培養による菌の分離、同定が基本である。血清型b型は迅速診断法として共同凝集反応、酵素抗体法、PCR法などが用いられる。ラテックス凝集法はb型菌の迅速診断法として広く行われており、髄液(髄膜炎の場合)、尿(敗血症の場合)などを対象とする。
一般にはペニシリン系抗生物質のアンピシリンなどが有効である。ただし、後述のとおり耐性菌の出現が問題となっている。
βラクタマーゼ産生菌(BLPAR)やβラクタマーゼ非産生アンピシリン耐性(BLNAR)インフルエンザ菌が報告された。BLNARの存在が報告されたのは1980年であり、それほどBLNARの発生はそれほど古い話ではない[2]。しかし、2004年の北里大学の報告によると、検出されたインフルエンザ菌のうち21.3%(2002年)がBLNARであり[3]、また2007年の長崎大学による報告では、19.5%(1995-1997年)がBLNARであり[4]、近年の高い出現率が問題になっている。耐性機構としては、ペニシリン結合タンパク質であるPBP-3(ftsI)が重要な役割を果たしており、ftsIの変異と薬剤耐性の関係は遺伝子工学的アプローチにより部分的であるが明らかになっている[5]。BLNARのftsIによる変異については、現在、Ubukataらによると3グループ(グループI、II、III[6])、さらに、Ubukataらの報告を発展する形で、Dabernetらにより6グループ(I、IIa、IIb 、IIc、IId、III[7])に分類されている。Ubukataらの報告によると、グループI、IIは比較的弱いセフェム系への耐性を、IIIは高度耐性を有するものとされている。これについては、グループI、IIとIIIの間でのミスセンス変異数の違いに起因するという考察がある[8]。 その場合はβラクタマーゼ阻害薬配合ペニシリン系抗生物質、第2、第3世代セフェム系、ニューキノロン系が一般的に用いられる。実際に、ニューキノロン系抗菌薬のレボフロキサシンにはBLNAR グループI、II、III全てMICが非常に低い値を示している[9]。
なお、インフルエンザ菌b型「Hib」の感染症、特に髄膜炎の場合には第3世代セファロスポリンであるセフトリアキソン、セフォタキシムが第一選択とされる。
b型菌の莢膜多糖体抗原を輸送蛋白に結合させたワクチンは、b型菌(Hib)による重症感染症(Hib感染症)の予防に極めて有効である。世界100カ国以上でこのHibワクチンは導入されており、導入された国では Hib による髄膜炎、喉頭蓋炎がほとんど消失している。
2007年1月26日、Hib莢膜多糖体蛋白結合ワクチン(販売名アクトヒブ®;[10])が厚生労働省により承認され、問題となっている乳幼児のインフルエンザ菌感染[11]への予防の切り札となることが期待されている。日本では2008年12月より任意接種可能となり、2013年4月より予防接種法による定期接種の対象となった。その結果、小児のHib髄膜炎発症は激減している[12]。
接種年齢は、2ヶ月齢以上になれば受けられる。望ましい接種スケジュールは、初回免疫として生後2ヶ月から7ヶ月になるまでに接種を開始し、4 - 8週間間隔で3回、追加免疫として3回目接種から1年後に1回の合計4回接種する。合計4回接種を受けた人のほぼ100%に抗体(免疫)が出来るため最適な予防接種プランとされている。生後7ヶ月から1歳未満の場合は、4 - 8週間間隔で2回、追加免疫として2回目接種から1年後に1回の合計3回接種となる。1歳以上の場合は追加免疫はなく1回接種のみで抗体獲得となる。
Hibワクチン接種後、次のワクチンを接種する場合には、6日間以上の間隔をあける必要がある。但し、このワクチンは他のワクチンと同時接種が可能である。諸外国では三種混合と同時接種スケジュールが組まれ、定期予防接種に認定されている[13]。
インフルエンザ菌(インフルエンザきん、Haemophilus influenzae)とは、パスツレラ科ヘモフィルス属のグラム陰性短桿菌で、主に呼吸器や中耳に感染する細菌の1種である。b型菌のことをHib(ヒブ)と呼ぶ。歴史的な理由によりインフルエンザという名称が付けられてはいるが、インフルエンザの病原体ではない。
헤모필루스 인플루엔자(Haemophilus influenzae, 이전에는 Pfeiffer's bacillus 또는 Bacillus influenzae라고 불림)는 파스퇴렐라과에 속한 그람 음성, 구간균, 통성 혐기성, 호이산화탄소성의 병원성 세균이다. 헤모필루스 인플루엔자는 1892년의 인플루엔자 범유행 동안 리처드 프리드리히 요하네스 파이퍼(Richard Friedrich Johannes Pfeiffer)에 의해 처음 기술되었다.[1] 그는 이 세균을 인플루엔자의 원인 미생물로 잘못 생각하여, 그 이름에 '인플루엔자'를 포함시켰다.[2][3]
일부에서는 이 세균이 인플루엔자[4]의 원인이 되어 세균성 인플루엔자를 일으킨다고 주장했다. 헤모필루스 인플루엔자는 광범위한 국소 및 침습적 감염을 유발하지만 인플루엔자는 바이러스에 의해 발생한다.
이 종은 전체 게놈이 분석된 최초의 자유 생활 생명체이다.[5]
1930년에 헤모필루스 인플루엔자의 두 가지 주요 카테고리인 '협막에 싸여 있지 않은 균주'와 '협막에 싸여 있는 균주'가 정의되었다. 협막에 싸여 있는 균주는 고유한 협막 항원을 기준으로 분류되었다. 협막이 있는 헤모필루스 인플루엔자의 일반적으로 인정되는 6가지 유형은 a, b, c, d, e, f이다.[6] 협막이 없는 균주 간의 유전적 다양성은 협막이 있는 그룹보다 크다. 협막이 없는 균주는 협막 혈청형이 없기 때문에 nontypable(분류 불가능, NTHi)이라고 한다. 그러나 이들은 다좌위 서열 구분법에 의해 분류될 수 있다. 헤모필루스 인플루엔자 감염의 발병기전은 완전히 이해되지 않았지만, 후두개염 등을 유발하는 혈청형인 B형 헤모필루스 인플루엔자(Hib)에 존재하는 폴리리보실 리비톨 포스페이트(PRP) 협막이 독성의 주요 요인으로 알려져 있다.[7] Hib의 협막은 숙주의 식작용과 보체 매개 용해에 저항할 수 있도록 한다. 협막이 없는 균주는 보통 덜 침습적이지만, 인간에게 염증 반응을 일으켜 많은 증상을 유발할 수 있다. B형 헤모필루스 인플루엔자 백신을 통한 예방접종은 Hib 감염을 예방하는 데 효과적이지만 NTHi 균주에 의한 감염을 예방하지는 못한다.[8]
대부분의 헤모필루스 인플루엔자 균주는 기회감염 병원체이다. 즉, 일반적으로 질병을 일으키지 않고 숙주에 살지만 다른 요인(바이러스 감염, 면역 기능 저하, 알레르기로 인한 만성 염증 등)이 기회를 만들 때만 문제를 일으킨다. 균주들은 삼량체 자가수송체 부착소를 사용하여 숙주 세포에 달라붙어 숙주를 감염시킨다.[9]
헤모필루스 인플루엔자에 의해 자연적으로 걸리는 질병은 인간에게만 발생하는 것으로 보인다. 영유아에서 B형 헤모필루스 인플루엔자(Hib)는 균혈증, 폐렴, 후두개염, 급성 세균성 수막염을 유발한다.[10] 경우에 따라 연조직염, 골수염, 감염성 관절염을 유발한다. 신생아 감염의 원인 중 하나이다.[11]
1990년 이후 미국에서는 Hib 백신이 일상적으로 사용되면서 침습성 Hib 질병의 발병률은 소아에서 1.3/100,000까지 감소했다.[10] 그러나 Hib는 백신이 널리 사용되지 않는 개발도상국의 영유아에서 하기도 감염의 주요 원인으로 남아 있다. 협막이 없는 헤모필루스 인플루엔자 균주는 Hib 백신의 영향을 받지 않으며 소아에서 중이염, 눈 감염(결막염), 부비동염 같은 질병을 유발하며 폐렴과도 관련이 있다.[10]
임상적 특징에는 바이러스 감염과 비슷한 상기도 감염의 초기 증상이 있을 수 있으며, 일반적으로 발열과 관련이 있으며 종종 미미한 수준이다. 종종 천명성 기관지염의 특징과 유사한 특징을 보이면서 며칠 안에 하기도로 진행될 수 있다. 객담은 뱉어내기 어려울 수 있으며 회색 또는 크림색인 경우가 많다. 기침은 적절한 치료를 하지 않으면 몇 주 동안 지속될 수 있다. 많은 경우 페니실린이나 1세대 세팔로스포린에 반응하지 않는 가슴의 감염이 발생한 후 진단된다. 단순 가슴 방사선 사진으로 폐포의 경화를 식별할 수 있다.[12]
임상적인 진단은 일반적으로 미생물 배양이나 라텍스 응집 검사에 의해 수행된다. 진단은 미생물이 일반적으로 무균이어야 하는 신체 부위에서 동정될 때 확인됐다고 간주한다. 따라서 코인두안이나 가래에서 배양된 헤모필루스 인플루엔자는 헤모필루스 인플루엔자로 인한 질병이 있다는 뜻이 아니다. 왜냐하면 질병이 없는 사람에서도 이런 부위에는 헤모필루스 인플루엔자가 집락화되어 있기 때문이다.[13] 그러나 뇌척수액이나 혈액에서 헤모필루스 인플루엔자가 동정된 경우 감염된 것으로 진단한다.
헤모필루스 인플루엔자의 배양은 37°C 온도의 이산화탄소가 풍부한 배양기에서, X인자(헤민)와 V인자(니코틴아마이드 아데닌 다이뉴클레오타이드, NAD)가 추가된 초콜릿 한천배지에서 주로 이루어진다.[14] 혈액 한천배지에서 헤모필루스 인플루엔자는 다른 세균(황색포도상구균, 폐렴구균과 같이 용혈성이 있는 세균들)의 주변에서만 위성처럼 성장한다. 헤모필루스 인플루엔자의 집락은 볼록하고, 매끄럽고, 창백하고, 회색이거나 투명한 색으로 나타난다.
그람 염색 후 현미경으로 헤모필루스 인플루엔자를 관찰하면 그람 음성의 구간균으로 나타난다. 배양된 미생물은 카탈레이스와 산화 효소 검사를 사용하여 추가로 특정될 수 있으며 둘 다 양성이 나와야 한다. 협막 다당류를 구별하고 Hib와 협막이 없는 종을 구별하기 위해서는 추가적인 혈청학적 검사가 필요하다.
헤모필루스 인플루엔자의 세균 배양은 특이도가 높지만 민감도가 낮다. 검체 채취 전 항생제를 사용하면 분리하기 전에 세균이 사멸해 분리율이 크게 낮아질 수 있다.[15] 또한 헤모필루스 인플루엔자는 배양하기 까다로운 세균이며, 따라서 배양 단계를 임의로 바꾸면 분리율이 크게 줄어들 수 있다. 연구에 따르면 헤모필루스 인플루엔자는 젖산을 탄소 공급원으로 선호하는, 고도로 특정화된 스펙트럼 내에서 영양소를 사용한다.[16]
헤모필루스 인플루엔자는 혈액 한천배지에서 황색포도상구균이 용혈시킨 영역에서 성장한다. 황색포도상구균에 의해 적혈구가 용혈되면 헤모필루스 인플루엔자의 성장에 필요한 V인자가 방출된다. 반면 황색포도상구균이 용혈시킨 영역 밖에는 V인자와 같은 성장에 필요한 영양소가 부족하기 때문에 헤모필루스 인플루엔자 균이 자라지 않는다.
라텍스 응집 검사(LAT)는 헤모필루스 인플루엔자를 검출하는 배양보다 더 민감한 방법이다.[17] 이 방법은 살아 있는 박테리아가 아닌 항원에 의존적이기 때문에 이전에 항생제를 사용했어도 인해 결과를 내는 데에 문제가 없다. 또한 배양보다 훨씬 빠르다는 추가적인 이점이 있다. 그러나 LAT 단독으로는 항생제 감수성 검사가 불가능하므로 배양을 병행해야 한다.
중합효소 연쇄 반응(PCR) 분석은 LAT나 배양 검사보다 더 민감하고 매우 특이적인 것으로 입증되었다.[17] 그러나 PCR 분석은 아직 임상 환경에서 일상적이지 않다. 대조 면역전기영동(countercurrent immunoelectrophoresis)은 효과적인 연구, 진단 방법으로 나타났지만 PCR로 대부분 대체되었다.
헤모필루스 인플루엔자와 폐렴구균(Streptococcus pneumoniae) 모두 인간의 상기도에서 발견될 수 있다. 두 균의 경쟁에 대한 in vitro 연구에서 폐렴구균은 항상 헤모필루스 인플루엔자를 과산화수소로 공격하고 생존에 필요한 표면 분자를 제거하여 헤모필루스 인플루엔자를 압도했다.[18]
두 박테리아를 함께 비강에 넣으면 2주 이내에 헤모필루스 인플루엔자만 살아남았다. 둘 중 하나가 비강에 따로따로 배치되면 각각 살아남았다. 두 박테리아 종에 모두 노출된 마우스의 상기도 조직을 조사한 결과, 엄청나게 많은 수의 호중구가 발견되었다. 한 종에만 노출된 마우스에서는 호중구가 존재하지 않았다.
실험실 테스트는 죽은 헤모필루스 인플루엔자에 노출된 호중구가 노출되지 않은 호중구보다 폐렴구균을 공격하는 데 더 공격적이란 것을 보여주었다. 그러나 죽은 헤모필루스 인플루엔자에 노출시켜도 살아있는 헤모필루스 인플루엔자에는 영향을 미치지 않았다.
이 결과에는 두 가지 예상 가능한 시나리오가 있다.
헤모필루스 인플루엔자가 면역 반응에 영향을 받지 않는 이유는 불분명하다.[19]
헤모필루스 인플루엔자는 폐렴, 중이염, 후두개염(목구멍의 부종), 눈 감염과 혈류 감염, 수막염을 비롯한 호흡기 감염의 원인이 될 수 있다. 또한 연조직염(피부 감염), 감염성 관절염을 유발할 수 있다.[20]
헤모필루스 인플루엔자는 베타-락타메이스를 생산하고 페니실린 결합 단백질을 변형할 수도 있으므로 페니실린 계열의 항생제에 내성을 갖는다. 심한 경우에는 혈류로 직접 전달되는 세포탁심과 세프트리악손이 항생제로 선택되며, 덜 심한 경우에는 암피실린과 설박탐의 결합, 2세대 및 3세대 세팔로스포린, 플루오로퀴놀론이 선호된다. 플루오로퀴놀론 내성 헤모필루스 인플루엔자가 발견되기도 했다.[21]
마크롤라이드와 플루오로퀴놀론은 협막이 없는 헤모필루스 인플루엔자에 대한 활성을 가지며 베타-락탐 항생제에 알레르기 병력이 있는 환자에서 사용할 수 있다.[22] 그러나 마크롤라이드 내성도 보고된 바 있다.[23]
Hib의 심각한 합병증에는 뇌 손상, 청력 상실이 있으며 심지어 사망에 이를 수도 있다. 일반적으로 심각한 합병증은 Hib와 관련이 있다. 대개 Hi non-typable은 심각한 상태를 유발하지 않지만 이들은 표면 항원을 변경할 수 있는 능력이 있기 때문에 만성 감염의 위험이 더 크다. 만성 감염은 일반적으로 급성 감염만큼 심각하지는 않다.[24]
B형 헤모필루스 인플루엔자 백신은 1990년대 초부터 사용할 수 있었으며 5세 미만의 어린이나 무비증 환자에게 권장된다. 세계보건기구(WHO)는 디프테리아, 파상풍, 백일해, B형 간염, Hib에 대한 백신을 결합한 5가 백신을 권장한다. 이 5가 백신이 개별 백신과 관련하여 얼마나 효과적인지에 대한 충분한 증거는 아직 없다.[25]
Hib 백신은 홍역, 소아마비, 결핵, 디프테리아, 파상풍, 백일해 백신의 총 비용의 약 7배 정도 비용이 든다. 결과적으로 2003년 기준으로 선진국 인구의 92%가 Hib 예방접종을 받은 개발도상국의 백신 접종률은 42%, 최빈개도국의 경우 8%에 불과했다.[26]
Hib 백신은 Hia, Hic, Hid, Hie, Hif와 같은 다른 헤모필루스 인플루엔자의 혈청형에 대해 교차 보호를 일으키지는 못한다.[27]
만성 기관지염 환자를 위한 비정형(non-typable) 헤모필루스 인플루엔자(NTHi)에 대한 경구 백신이 개발되었지만 COPD 악화의 수와 중증도를 줄이는 데 효과적인 것으로 보이지 않았다.[28] 그 외 다른 종류의 헤모필루스 인플루엔자에 대한 효과적인 백신은 없다.
헤모필루스 인플루엔자는 전체 게놈이 분석된 최초의 자유 생활 생명체였다. 현재 J. 크레이그 벤터 연구소의 일부가 된 연구소 중 하나인 Institute for Genomic Research의 크레이그 벤터와 그의 팀이 완성했다. 헤모필루스 인플루엔자를 선택한 이유는 프로젝트 리더 중 한 명인 노벨상 수상자 해밀턴 O. 스미스가 수십 년 동안 이 작업을 해왔고, 따라서 고품질 DNA 데이터(library)를 제공할 수 있었기 때문이다. 균주 Rd KW20의 게놈은 1604개의 단백질 암호화 유전자, 117개의 유사유전자, 57개의 tRNA 유전자, 23개의 기타 RNA 유전자를 포함하는 단일 원형 염색체에 1,830,138개의 염기쌍 DNA로 구성되어 있었다.[29] 사용된 염기서열분석법은 1995년 사이언스에 완성되어 게재된 총유전체 샷건 시퀀싱이었다.[30]
협막이 없는 헤모필루스 인플루엔자는 만성 폐쇄성 폐질환(COPD) 환자의 기도에서 종종 발견된다. 호중구는 COPD 환자의 가래에서도 많이 관찰된다. 호중구는 헤모필루스 인플루엔자를 포식하여 산화적 호흡폭발을 활성화한다.[31] 그러나 이런 산화적 호흡폭발로 인해 헤모필루스 인플루엔자 세포의 DNA 손상을 일으킬 수 있음에도, 호흡폭발로 인해 세균 대신 호중구 자체가 죽어 버린다. 세균이 죽지 않는 현상은 COPD에서 감염의 지속성이 일어나는 이유를 설명하는 것으로 보인다.[31]
rec1 유전자(recA의 상동)에 결함이 있는 돌연변이 헤모필루스 인플루엔자는 산화제인 과산화수소에 의한 사멸에 매우 민감하다.[32] 이 발견은 rec1 발현이 산화 스트레스를 받는 상황에서 헤모필루스 인플루엔자 생존에 중요하다는 것을 시사한다. recA 의 상동체이기 때문에 rec1 은 DNA 재조합 시의 손상 복구에 중요한 역할을 할 것으로 예상된다. 따라서 헤모필루스 인플루엔자는 산화로 인한 DNA 손상을 복구하여 숙주의 포식세포에 의해 생성된 활성산소종으로부터 게놈을 보호할 수 있다.[33] 염색체의 손상된 부위의 재조합 시 복구는 rec1에 더하여 손상되지 않은 두 번째 상동 DNA 분자를 필요로 한다. 개별 헤모필루스 인플루엔자 세포는 형질전환 과정을 통해 다른 세포로부터 상동 DNA를 흡수할 수 있다. 헤모필루스 인플루엔자의 형질전환에는 적어도 15개의 유전자가 만드는 산물이 관여한다.[30]
협막이 없는 헤모필루스 인플루엔자 혈청형을 표적으로 하는 백신이 개발 중이다.[34]
헤모필루스 인플루엔자(Haemophilus influenzae, 이전에는 Pfeiffer's bacillus 또는 Bacillus influenzae라고 불림)는 파스퇴렐라과에 속한 그람 음성, 구간균, 통성 혐기성, 호이산화탄소성의 병원성 세균이다. 헤모필루스 인플루엔자는 1892년의 인플루엔자 범유행 동안 리처드 프리드리히 요하네스 파이퍼(Richard Friedrich Johannes Pfeiffer)에 의해 처음 기술되었다. 그는 이 세균을 인플루엔자의 원인 미생물로 잘못 생각하여, 그 이름에 '인플루엔자'를 포함시켰다.
일부에서는 이 세균이 인플루엔자의 원인이 되어 세균성 인플루엔자를 일으킨다고 주장했다. 헤모필루스 인플루엔자는 광범위한 국소 및 침습적 감염을 유발하지만 인플루엔자는 바이러스에 의해 발생한다.
이 종은 전체 게놈이 분석된 최초의 자유 생활 생명체이다.