pms
nòm ant ël fil


Development - Life Cycle: metamorphosis
Other Physical Features: ectothermic ; bilateral symmetry
Key Reproductive Features: gonochoric/gonochoristic/dioecious (sexes separate)
Ağacadırmananlar (lat. Dendrobatidae) - quyruqsuzlar dəstəsinə aid suda-quruda yaşayanlar fəsiləsi. Dünyanın ən zəhərli canlısıdır. Bir qram zəhəri eyni anda 30.000 min siçan və 150 insanı öldürməyə bəs edər.
Ağacadırmananlar (lat. Dendrobatidae) - quyruqsuzlar dəstəsinə aid suda-quruda yaşayanlar fəsiləsi. Dünyanın ən zəhərli canlısıdır. Bir qram zəhəri eyni anda 30.000 min siçan və 150 insanı öldürməyə bəs edər.
Els dendrobàtids o granotes de punta de fletxa (Dendrobatidae) són una família de granotes. Moltes d'elles es caracteritzen pel verí que produeixen, i que les fa perilloses. Dins del gènere Phyllobates es troba l'espècie més verinosa de totes, P. terribilis.
Els dendrobàtids o granotes de punta de fletxa (Dendrobatidae) són una família de granotes. Moltes d'elles es caracteritzen pel verí que produeixen, i que les fa perilloses. Dins del gènere Phyllobates es troba l'espècie més verinosa de totes, P. terribilis.
Pralesničkovití (Dendrobatidae) je čeleď malých pestrých jedovatých žab žijících ve středo a jihoamerických pralesích. Obecně se jim říká pralesničky nebo šípové žáby. Místní Indiáni je lovili, jedem natírali šípy a zabíjeli pomocí nich zvířata.[zdroj?]
Žijí v tropických pralesích Střední a Jižní Ameriky. Většina druhů pobývá na zemi, případně v pralesním podrostu několik metrů nad zemí, některé druhy v korunách stromů. Dosahují délky 1 až 6 cm, jsou štíhlé a pestře zbarvené, což upozorňuje na jejich jedovatost. Zbarvení a vzorování se liší u různých druhů, nemusí být stejné i v rámci jednoho druhu. Na špičkách prstů předních nohou mají malé polštářky sloužící jako přísavky.[1] Pralesničky jsou jedovaté, některé druhy více, některé měně. Mezi nejjedovatější patří žlutě zbarvená pralesnička strašná (Phyllobates terribils) a pralesnička dvoubarvá (Phyllobates bicolor). Uvádí se, že jed z jedné žáby aplikovaný injekčně může usmrtit až tisíc myší. Amazonští indiáni, například Janomamové jejich jedem natírají šípy k lovu.[2], z toho pochází starší označení celé skupiny - šípové žáby. Jed pralesničky barvířské používali někteří amazonští Indiáni, zejména Tupinambové, k přebarvování peří papoušků. Pokud se ranky po vytrhaných perech potřou silně zředěným jedem, naroste ptákovi oranžové nebo žluté peří namísto zeleného. Tato technika se označuje jako tapiragé.[zdroj?]
Pralesničkovití (Dendrobatidae) je čeleď malých pestrých jedovatých žab žijících ve středo a jihoamerických pralesích. Obecně se jim říká pralesničky nebo šípové žáby. Místní Indiáni je lovili, jedem natírali šípy a zabíjeli pomocí nich zvířata.[zdroj?]
Giftfrø og farvefrø er fællesbetegnelser for springpadder i familien Dendrobatidae. Deres naturlige levesteder er Mellemamerika og Sydamerika. Den grønne og sorte giftfrø Dendrobates auratus er blevet indført til nogle af øerne i Hawaii.
Frøerne er små, dagaktive og ofte med kraftige farver. Mange af arterne har forskellige former for gift i huden. Der er indianere i Sydamerika, der bruger giften fra frøen til at fremstille pilegift. Den art med den kraftigste gift er den gule giftfrø Phyllobates terribilis.
Giften i frøen menes at skyldes dens føde: myrer, mider og biller. Gift fra de leddyr den spiser bliver gemt i kirtler i huden. Frøer der fanges i naturen og derefter holdes i fangenskab og fodres med bananfluer og fårekyllinger mister gradvist deres gift.
De bruger den kraftige farve til at afskrække dens fjender, på den måde fortæller den "Jeg er farlig! Spis mig ikke!"
StubGiftfrø og farvefrø er fællesbetegnelser for springpadder i familien Dendrobatidae. Deres naturlige levesteder er Mellemamerika og Sydamerika. Den grønne og sorte giftfrø Dendrobates auratus er blevet indført til nogle af øerne i Hawaii.
Die Baumsteigerfrösche (Dendrobatidae), auch Pfeilgiftfrösche oder Farbfrösche genannt, sind eine Familie der Froschlurche (Anura). Die oft sehr kleinen (etwa 12 bis 50 mm) und farbenfrohen Frösche werden derzeit in ein Dutzend Gattungen und rund 170 Arten untergliedert. Mit dem Färberfrosch, Dendrobates tinctorius (Cuvier, 1797), wurde eine Art erstmals bereits im 18. Jahrhundert von einem Europäer beschrieben. Die deutschsprachige Bezeichnung „Pfeilgiftfrösche“ für die ganze Familie ist irreführend, da im Wesentlichen nur drei Arten der Gattung Phyllobates von indigenen Völkern für das Pfeilgift verwendet werden. Nicht alle Stoffe, die von den Baumsteigerfröschen durch ihre Hautdrüsen ausgeschieden werden, sind tödliche Nervengifte.
Die Baumsteigerfrösche bewohnen den mittel- und südamerikanischen Regenwald; einige Arten sind auch noch im Hochland von Ecuador anzutreffen. Die meisten Arten finden sich östlich der Anden im Amazonasbecken und der Mata Atlântica. Die nördliche Verbreitungsgrenze ist Nicaragua.[1] Es besteht außerdem noch eine allochthone Population von Dendrobates auratus auf Hawaii. Diese Frösche wurden dort Anfang des 20. Jahrhunderts ausgesetzt.[2]
Die Tiere leben bei Tagestemperaturen von 25 bis 28 °C und Nachttemperaturen von 22 bis 25 °C sowie einer relativen Luftfeuchtigkeit von 70 bis 100 %.[3] Sie bewohnen je nach Art alle Zonen des neotropischen Regenwaldes von der Laubschicht des Bodens bis in die Baumkrone.
Zwischen der ersten und zweiten, sowie zwischen der zweiten und dritten Zehe sind keine Schwimmhäute ausgebildet. Gaumenbeine fehlen. Die gleichen Merkmalszustände finden sich bei Allobates, einer Gattung der Aromobatidae. Aufgrund umfangreicher Analysen mikrobiologischer und phänotypischer Daten[1] ist davon auszugehen, dass es sich hierbei um Konvergenzen handelt.
Die Laichablage erfolgt bei kleineren Arten überwiegend auf Blättern von Pflanzen und Bäumen. Größere Arten (Dendrobates tinctorius und D. auratus) sind auch Höhlenlaicher. Je nach Art umfasst ein Gelege zwischen zwei und 35 Eiern. Dem Laichen geht ein teils stundenlanges Balzritual voraus. Dem durch seine Rufe lockenden Männchen nähert sich das Weibchen und streicht ihm mit den Vorderbeinen über den Rücken. Beide suchen sich dann einen geeigneten Platz zum Ablaichen. Die Abgabe des Laichs erfolgt beispielsweise an Bromelienblättern über deren Blattachseln beziehungsweise in der Blattachsel selbst. Die Besamung der Eier durch das Männchen geschieht äußerlich unmittelbar nach deren Abgabe. Die Gelege werden meistens vom Männchen bewacht. Manche Arten bewässern ihre Gelege regelmäßig, indem sie den Inhalt ihrer Blase auf die Eier entleeren.
Pfeilgiftfrösche sind tagaktiv; denn ihre grellen Farben bieten ihnen am Tag Schutz. Damit ihre Kaulquappen nicht den Fressfeinden in Flüssen und Teichen ausgeliefert sind, werden die nach 10 bis 16 Tagen Embryonalentwicklung schlüpfenden Kaulquappen auf dem Rücken des Männchens in kleinste Wasseransammlungen auf Pflanzen (Phytotelmata), etwa mit Wasser gefüllte Blattachseln, überführt. Bei manchen Arten (beispielsweise Ranitomeya imitator) erfolgt dieser Transport einzeln, bei anderen, beispielsweise dem Dreistreifen-Baumsteiger (Epipedobates tricolor), kann er das gesamte Gelege gleichzeitig umfassen. Später bringen sie ihre Nachkommen in gleicher Weise auf den Erdboden.[4] Die Weibchen einiger Arten füttern die Kaulquappen mit unbefruchteten Nähreiern bis zur Metamorphose (vgl. Oophaga), bei anderen ernähren sich die Larven von Algen oder Insekten, die in die Blattachseln fallen. Die Entwicklung von der Kaulquappe zum Jungfrosch dauert zwischen sechs und 14 Wochen.
Baumsteigerfrösche sondern über ihre Haut basische Alkaloide ab, von denen etwa 200 Varianten bekannt sind (beispielsweise Pumiliotoxin bei Dendrobates, Batrachotoxin bei Phyllobates). Batrachotoxin wirkt auf das Nervensystem. Es verhindert die Inaktivierung der Natriumkanäle und ist damit ein sogenanntes Krampfgift. Es treten Muskel- und damit auch Atemlähmungen auf, die in schweren Fällen beim Menschen zum Tod nach etwa 20 Minuten führen können. Das Gift dringt durch kleine Verletzungen oder Hautporen in den Blutkreislauf ein. Ein Gegengift ist Tetrodotoxin. Die Pfeilgiftfrösche, die Batrachotoxin über ihre Haut abgeben, gehören neben einigen Würfelquallen und der Krustenanemone zu den giftigsten Tieren der Welt. Gemäß LD-50 ist schon eine Giftmenge von 2 µg/kg für das Opfer tödlich.
Die Frösche nehmen ihr Gift durch Verspeisen von giftigen Beutetieren auf und sequestrieren es in ihrem Körper. Dabei wurden in den letzten 30 Jahren bis zu 232 verschiedene Alkaloide aus bis zu 21 verschiedenen Strukturklassen identifiziert.[5] Die hochtoxischen Pumiliotoxine und Allopumiliotoxine werden durch den Konsum von Milben erworben, wohingegen weitere Stoffe durch die Aufnahme von Ameisen und Käfern in den Körper der Frösche gelangen. Dabei können die Giftstoffe durch den Frosch-Organismus sowohl verändert (Metabolisierung) werden oder auch unverändert bleiben. Die Giftigkeit von in Gefangenschaft gehaltenen Tieren nimmt mit der Zeit ab, wenn keine geeigneten Futtertiere zur Verfügung stehen. In Gefangenschaft geborene Nachzuchten besitzen in den meisten Fällen kein Hautgift mehr.
Ihren deutschen Namen haben Pfeilgiftfrösche der Tatsache zu verdanken, dass das Hautsekret von drei Arten der Gattung Blattsteiger (Phyllobates terribilis, Phyllobates bicolor und Phyllobates aurotaenia) von bestimmten Indianerstämmen in Westkolumbien als Pfeilgift bei der Jagd mit dem Blasrohr verwendet wird. Das Sekret wird auf die Spitzen der Pfeile aufgetragen. Es enthält hohe Konzentrationen von Batrachotoxin.
Mit ihrer auffälligen Körperfärbung signalisieren Pfeilgiftfrösche ihre Ungenießbarkeit. In der Biologie wird dieser Mechanismus als Aposematismus bezeichnet. Fressfeinde müssen allerdings in der Regel diese Ungenießbarkeit erst erlernen. Meist ist eine einzige Erfahrung für einen Fressfeind ausreichend, um eine lebenslange Aversion und damit Meidung dieser Tierart zu entwickeln. Auch wenn der erste Frosch dieser Art, mit dem das Jungtier eines Räubers Bekanntschaft macht, dabei häufig verletzt oder gar gefressen wird, bleiben alle anderen Individuen dieser Population von diesem Jäger fortan verschont.
Nur rund ein Drittel der Arten in der Familie der Baumsteigerfrösche produziert Hautgifte. Einige Arten, die keine Alkaloide absondern können, gleichen in ihrer Färbung und Zeichnung den ungenießbaren Arten und täuschen durch diese Anpassung mögliche Fressfeinde (Batessche Mimikry). Aber auch giftige Arten passen sich in der Färbung einander an (Müllersche Mimikry).[6] Eines der ersten Beispiele, die innerhalb der Amphibien erforscht wurden, ist die Art Ranitomeya imitator, die in verschiedenen Teilen ihres Verbreitungsgebietes die Farben und Zeichnungen der dort beheimateten Baumsteiger-Frösche Ranitomeya variabilis (früher Dendrobates variabilis genannt), Ranitomeya summersi (früher Dendrobates fantasticus) und Ranitomeya ventrimaculatus (früher Dendrobates ventrimaculatus) nachahmt.[7] Es wurde gezeigt, dass diese Farbvarianten tatsächlich der Art Ranitomeya imitator angehören, obwohl sie den Arten in bestimmten Teilen ihres Verbreitungsgebiets äußerlich stärker ähneln als den anderen Populationen ihrer eigenen Art. Die Mechanismen der Variabilität innerhalb der gleichen Art und die Evolution der Signalfarben sind Gegenstand neuerer Forschungsarbeiten zu den Baumsteiger-Fröschen. Es kommen dafür die Koevolution der Frösche und ihrer Fressfeinde, aber auch Konkurrenz innerhalb der gleichen Art und die Auswahl der Männchen durch die Weibchen in Frage.[8]
Lange Zeit wurden alle auffällig gefärbten Baumsteiger-Frösche als nahe verwandt angesehen und in den Gattungen Dendrobates und Phyllobates zusammengefasst. Ebenso wurden ungiftige Arten dieser Familie mit Tarnfarben in die Gattung Colostethus gestellt, die bald über 100 Arten umfasste. Es stellte sich jedoch heraus, dass die Möglichkeit zur Produktion von Hautgiften und aposematische Färbungen durch konvergente Entwicklung innerhalb der Familie mehrmals entstanden und nicht in jedem Fall auf enge Verwandtschaft zurückzuführen sind.[9] Aufgrund molekulargenetischer Untersuchungen wurden die Verwandtschaftsbeziehungen innerhalb der Baumsteiger-Frösche in den vergangenen beiden Jahrzehnten neu gefasst.
Die Gattungen Dendrobates, Epipedobates, Phyllobates sowie Minyobates werden auf Anhang II des Washingtoner Artenschutz-Übereinkommens (CITES) geführt. Der Handel mit diesen Tieren ist streng reglementiert. Neben den Wildfängen der farbenprächtigen kleinen Frösche für den Zoohandel in Nordamerika und Europa stellt die zunehmende Abholzung des Regenwaldes in den Lebensräumen der Baumsteigerfrösche die größte Bedrohung dar. Oft ist eine Population bereits ausgestorben, bevor ihr Artstatus geklärt werden kann.[10]
Der Chytridpilz (Batrachochytrium dendrobatidis) ist ein Töpfchenpilz, der die Haut von Amphibien befällt und bei ihnen die Chytridiomykose auslöst, eine Krankheit, die besonders in den kühleren Regionen der Anden für die befallenen Frösche tödlich verlaufen kann. Viele Arten der Baumsteigerfrösche (Dendrobatidae) sind daher durch diese ursprünglich aus Afrika stammende Pilzkrankheit stärker gefährdet. Darauf verweist auch der Artname des Pilzes B. dendrobatidis
Die Systematik der Baumsteigerfrösche ist in den letzten Jahren grundlegend überarbeitet worden.[1] Verschiedene früher ebenfalls unter den Dendrobatidae geführte Taxa wurden einer neu etablierten Familie Aromobatidae zugeordnet. Die auf diese Weise arrangierten Familien Aromobatidae und Dendrobatidae sind Schwestergruppen. Die ehemalige Gruppierung der Baumsteigerfrösche, die die Aromobatidae mit einschloss, ist somit monophyletisch. Sie wurde bei der taxonomischen Umstellung in den Rang einer Überfamilie namens Dendrobatoidea gehoben. Die deutsche Bezeichnung Baumsteigerfrösche wurde jedoch auf Familienniveau dahin gehend angepasst, dass sie die Aromobatidae nicht mehr einschließt.
Dendrobatoidea Aromobatidae>>>
Silverstoneia
Epipedobates
Colostethus
Ameerega
Hyloxalus
Phyllobates
Minyobates
Ranitomeya
Adelphobates
Oophaga
Dendrobates
Die Baumsteigerfrösche wurden gegenwärtig in drei Unterfamilien gegliedert, von denen eine bei der Revision neu errichtet wurde.[1]
Während die Colostethinae aus einem basalen Zweig der Baumsteigerfrösche hervorgehen, besteht zwischen den Hyloxalinae und den Dendrobatinae ein Schwestergruppenverhältnis. Auch auf der Ebene der Gattungen wurden zahlreiche taxonomische Umstellungen vorgenommen. Zwei Gattungen wurden dabei neu etabliert. Außerdem wurden aufgrund phylogenetischer Untersuchungen viele zusätzliche Arten aus „Sammelarten“ (Artenkomplex) mit großem Verbreitungsgebiet und verschiedenen Farbmorphen ausgegliedert.[11] Derzeit zeichnet sich die folgende Klassifikation mit drei Unterfamilien und elf Gattungen ab.
Stand: 4. April 2019
Unterfamilie Colostethinae Cope, 1867 (5 Gattungen, 68 Arten)
Unterfamilie Dendrobatinae Cope, 1865 (8 Gattungen, 61 Arten)
Unterfamilie Hyloxalinae Grant, Frost, Caldwell, Gagliardo, Haddad, Kok, Means, Noonan, Schargel & Wheeler, 2006 (3 Gattungen, 70 Arten)
Zu den Dendrobatidae incertae sedis wird außerdem Colostethus poecilonotus Rivero, 1991 gestellt, dessen Position innerhalb der Familie ungeklärt ist. Colostethus poecilonotus wurde genauer gesagt als Dendrobatoidea incertae sedis eingeordnet, könnte also auch ein Vertreter der Aromobatidae sein.[1]
Die Baumsteigerfrösche (Dendrobatidae), auch Pfeilgiftfrösche oder Farbfrösche genannt, sind eine Familie der Froschlurche (Anura). Die oft sehr kleinen (etwa 12 bis 50 mm) und farbenfrohen Frösche werden derzeit in ein Dutzend Gattungen und rund 170 Arten untergliedert. Mit dem Färberfrosch, Dendrobates tinctorius (Cuvier, 1797), wurde eine Art erstmals bereits im 18. Jahrhundert von einem Europäer beschrieben. Die deutschsprachige Bezeichnung „Pfeilgiftfrösche“ für die ganze Familie ist irreführend, da im Wesentlichen nur drei Arten der Gattung Phyllobates von indigenen Völkern für das Pfeilgift verwendet werden. Nicht alle Stoffe, die von den Baumsteigerfröschen durch ihre Hautdrüsen ausgeschieden werden, sind tödliche Nervengifte.

Do Boomstieger-Poagen (Dendrobatidae), uk Pielgift-Poagen of Faaw-Poagen naamd, sunt een Amphibien-Familie, ju tou do Poagen-Oardige (Anura) heert. Jo lieuwje in Middel- un Suud-Amerikoa. Dät sunt oafter aiske litje (sowät 12 bit 50 mm) un bunte Poagen un wäide hoast in sowät een Duts Sleeke un uum do 170 Oarde iendeeld. Mäd ju Faawer-Poage (Dendrobates tinctorius), wuude een Oard eerstmoals al in't 18. Jierhunnerd fon aan Europäer beskrieuwen. Dät oafter ju heele Familie as "Pielgiftpoagen" beteekend wäd, lät wät mis, uumdät gewöönelk bloot tjo Oarde fon dän Sleek Phyllobates fon ienheemske Foulke (Indioanere) foar dät Pielgift bruukt wuuden sunt. Nit aal do Stoffe, do fon do Boomstiegerpoagen truch hiere Häid-Käddele uutskädded wäide, sunt doodelke Näärwengifte.
Twiske ju eerste un twäide, juust so as twiske ju twäide un trääde Toone sunt neen Swimhäide uutbielded. Die Muulebeen-Bunke failt. Do sälge Määrkmoale fiende sik bie dän Sleek Allobates, man die heert tou do Aromobatidae. Apgruunde fon joopgungende mikrobiologiske un phänotypiske Unnersäikengen is deerfon uuttougungen, dät düsse Uureenstämmenge nit ap genetisken Touhoopehong, man ap Konvergenz touräächgungt.
Boomstieger-Poagen reeke uur hiere Häid basiske Alkaloide ou, wierfon sowät 200 Varianten bekoand sunt (biespilswiese Pumiliotoxin bie Dendrobates, Batrachotoxin bie Phyllobates. Batrachotoxin wierket ap dät Näärwensystem, Dät ferhinnert ju Inaktivierenge fon do Natriumkanoale un is deermäd een sonaamd Kroampgift. Deer trät Muskel- un deermäd uk Omme-Loamegaid ap, ju in sweere Faale bie Moanskene toun Dood ätter sowät 20 Minuten fiere kon. Dät Gift tringt truch litje Seeregaiden of Häid-Pooren in dän Bloud-Kringloop ien. Een Juungift is Tetrodotoxin. Do Pielgift-Poagen, do Batrachotoxin uur hiere Häid oureeke, heere ieuwenske wäkke Doobel-Kwallen un ju Krusten-Anemoone tou do gifterchste Dierte fon ju Waareld. Ätter LD-50 is al een Gift-Masse fon 0,002 mg/kg foar dät Offer doodelk.
Do Poagen nieme dät Gift truch Apfreeten fon gifterge Büüte-Dierte ap un sequestrierje dät in hieren Lieuw. Deerwie wuuden in do lääste 30 Jiere bit tou 232 ferskeedene Alkaloide uut bit tou 21 ferskeedene Struktuur-Klassen fääststoald. Do hoochtoxiske Pumiliotoxine un Allopumiliotoxine kriege do Poagen truch dän Konsum fon Mieten (düütsk:Milben), wilst uur Stoffe truch ju Apnoame fon Miegelken (düütsk:Ameisen) un Ruste (düütsk:Käfer) in dän Lieuw fon do Poagen kuume. Deerbie konnen do Giftstoffe so blieuwe, as jo sunt, man toumäts wäide do uk in dän Poagen-Organismus uumebaud (Metabolisierenge).
Ju Giftegaid fon Poagen in Fangenskup nimt uurloang ou, wan neen oainde Fodder-Dierte moor tou Ferföigenge stounde. Wan een Poage in Fangenskup ättertuchted wuuden is, häd ju in do maaste Faale neen Häidgift moor.
Boomstiegerpoagen rakt dät in dän Tropisken Rienwoold fon Middel- un Suud-Amerikoa, wäkke Oarde lieuwje uk in't Hoochlound fon Ecuador. Man do maaste Boomstiegerpoagen rakt dät aastelk fon do Anden in't Amazonas-Bäkken un in ju Mata Atlântica. In't Noude kuume Boomstieger-Poagen bit Nicaragua foar. Aaltouhoope sunt jo in Bolivien, Costa Rica, Brasilien, Kolumbien, Ecuador, Venezuela, Suriname, Frantsöösk Guayana, Peru, Panama, Guyana un Nicaragua tou fienden.
Buppedät rakt dät een allochthone Populatjsoon fon Dendrobates auratus ap Hawaii. Do Dierte wuuden junner tou Begin fon't 20. Jierhunnerd uutsät (Neobiota).
Ju Poageglidderske wäd bie litje Oarde maasttieds ap Bleede fon Plonten un Boome oulaid. Grattere Oarde, biespilswiese ju Faawer-Poage (Dendrobates tinctorius) un die Gould-Boomstieger (Dendrobates auratus) lääse hiere Glidderske uk in Höölen ou. Aal ätter ju Oard uumfoated ju oulaide Glidderske two bit 35 Oaiere. Eer ju Glidderske oulaid wäd, tuddelje do Dierte uurenloang uumetou. Dät Montje lokket truch sien Roupe dät Wiefken bietou un strikt him mäd do Faanderbeene uur dän Rääch. Bee säike sik ätters een goadelke Steede, uum ju Glidderske outoulääsen. Dät Oureeken fon ju Glidderske skjucht biespilswiese ap Bromelien-Bleede uur dän Blääd-Tjoachter of in dän Blääd-Tjoachter binne. Ju Befruchtenge fon do Oaiere truch dät Montje skjucht buute un fluks ätter dät Oulääsen. Ju Glidderske wäd maasttieds fon do Montjene bewoaked. Wäkke Oarde miege räägelmäitich ap hiere Glidderske, uum ju fuchtich tou hoolden.
Boomstieger-Poagen sunt deeges aktiv, uumdät hiere ljoachte Klöäre him deeges Skuul reeke. Uumdät hiere litje Poagenstäite (Kwabben) nit do Freetfäinde in Äien un Poule uutlääwerd sunt, wäide do jo ätter 10 bit 16 Deege Embryonoal-Äntwikkelenge slippede litje Dierte ap dän Rääch fon dät Montje in litje Woater-Ounsammelengen ap Plonten (Phytotelmata) broacht, biespilswiese mäd Woater apfälde Blääd-Tjoachtere. Bie wäkke Oarde, biespilswiese Ranitomeya imitator, wäide do litje oankeld transportierd, bie uurswäkke, biespilswiese dän Träistriepel-Boomstieger (Epipedobates tricolor) wäide do aal touhoope wächbroacht. Leeter brange jo hiere litje ap ju sälge Wiese ap dän Äidboudem. Do Wiefkene fon wäkke Oarde fodderje do Poagenstäite of Kwabben mäd uunbefruchtede Neer-Oaiere bit tou ju Metamorphose tou (fergliekje Oophaga), bie wäkke Oarde freete do Poagenstäite uk Algen of Insekten, do in do Blääd-Tjoachtere faale. Ju Äntwikkelenge fon dän Poagenstäit tou een junge Poage duurt twiske säks un fjautien Wieke.
Hier skäl een Lieste mäd do Oarde fon Boomstieger-Poagen stounde, aal oardend ätter Unnerfamilien un Sleeke. Dät stuure deerbie is, dät älk Jier deer mäd reekend wäide mout, dät näie Oarde fuunen wäide, of dät al bekoande Oarde nieper unnersoacht un näi ienoardend wäide. Düsse Lieste is nu ätter't bääste Wieten un Gewieten ap dän Stound fon 2018, man dät kon weese, dät ju touken Jier al nit moor aktuell is:
Unnerfamilie Colostethinae
Unnerfamilie Hyloxalinae
Unnerfamilie Dendrobatinae
Tou do Dendrobatidae incertae sedis wäide buppedät do Oarde "Colostethus" poecilonotus un "Colostethus" ramirezi stoald, wierbie ju Positsjoon binne ju Familie uunkloor is. "Colostethus" poecilonotus wuude nieper as Dendrobatoidea incertae sedis ienoardend, dät kuude also uk aan Fertreeder fon do Aromobatidae weese. "Colostethus" ruthveni skient uk nit tou dän Sleek tou heeren, wier hie uurspröängelk ienoardend wuuden is, fuulmoor heert hie wäil ainewaiens in ju Unnerfamilie fon do Dendrobatinae.
Do Boomstieger-Poagen (Dendrobatidae), uk Pielgift-Poagen of Faaw-Poagen naamd, sunt een Amphibien-Familie, ju tou do Poagen-Oardige (Anura) heert. Jo lieuwje in Middel- un Suud-Amerikoa. Dät sunt oafter aiske litje (sowät 12 bit 50 mm) un bunte Poagen un wäide hoast in sowät een Duts Sleeke un uum do 170 Oarde iendeeld. Mäd ju Faawer-Poage (Dendrobates tinctorius), wuude een Oard eerstmoals al in't 18. Jierhunnerd fon aan Europäer beskrieuwen. Dät oafter ju heele Familie as "Pielgiftpoagen" beteekend wäd, lät wät mis, uumdät gewöönelk bloot tjo Oarde fon dän Sleek Phyllobates fon ienheemske Foulke (Indioanere) foar dät Pielgift bruukt wuuden sunt. Nit aal do Stoffe, do fon do Boomstiegerpoagen truch hiere Häid-Käddele uutskädded wäide, sunt doodelke Näärwengifte.
Eiturpílafroskar halda til í mið- og suðuramerikansku skógunum. Hesir litføgru froskarnir eru sera eitrandi. Teir verða ofta róptir eiturfroskar, tí upprunafólk smurdu froskaeitur á oddin á blásipílum. Síðan vórðu pílarnir skotnir gjøgnum long blásirør eftir apum og øðrum djórum. Kláru litirnir á eiturpílafroskunum virka sum ávaring til ránsdjór. Eiturpílafroskar eta øll sløg av flogkykti. Flestu eiturpílafroskar eru smáir á vøkstri, minni enn 1,5 sentimetrar, tó at onkrir verða upp í 6 sentimetur. Vaksnu froskarnir verpa í vátlendi. Tá ið eggini eru klakt, ber froskurin ungarnar á bakinum í ein hyl. Eiturpílafroskar hava kalt blóð, og tað merkir, at teir kunnu liva bæði í vatni og á landi.
Kodhok awisa ya iku jeneng umum saka seklompok kodhok ing kulawarga Dendrobatidae kang minangka kodhok asli Amérika Tengah lan Kidul.[1]
Ora kaya kodhok umum liyané, spésies kang aktif ing wayah awan, lan kerep nuduhake awakee kanthi warna kang cerah.[2] Sanajan kabèh dendrobatids rada beracun ing alam alasan, tingkat toksisitas warna-warna saka siji spésies lan liyané, lan saka siji populasiliyané. Akèh spésies kang kritis lan terancam cures.[3]Amfibi iki kerep diarani kodhok panah déning pribumi indian akibat panggunaan sekresi beracun kanggo ngracuni pucuk panahe.[4]
Akèh-akèhé kodhok jinis iki duwé ukuran awak kang gedhéné 1,2 cm kanggo kodhok diwasa, sanajan ana kodhok kang ukurané nganti 6 cm.[5] Bobot awake rata-rata 2 gram. Kodhok iki saliyané wernane padhang uga nuduhake pola aposematik kanggo nuduhake pemangsa potensial. Werna padhange gegayutan karo kodhok iki lan tingkat toksisitas alkaloid.[6] Kodhok spésies Dendrobates duwé tingkat alkaloid, déné spésies Colostethus wernane samar-samar lan ora beracun.[7]
|title= ora ana utawa kosong (pitulung) |title= ora ana utawa kosong (pitulung) Kodhok awisa ya iku jeneng umum saka seklompok kodhok ing kulawarga Dendrobatidae kang minangka kodhok asli Amérika Tengah lan Kidul.
மத்திய மற்றும் தென் அமெரிக்காவில் வாழக்கூடிய, அதிக பட்சம் 2.5 அங்குலமே நீளமுள்ள, ஒரு வகையான தவளைகள் நச்சு அம்புத் தவளைகள் ( Poison dart frog) இத் தவளைகள் கண்கவரும் பிரகாசமான நிறங்களில் காணப்படும்.[1]. தாக்கும் ஒரு வகையான கொழகொழப்பான, கொடிய விஷத்தினை தன் முதுகுப்பகுதியில் சுரக்குமாம். இது எதிரிகளை எச்சரிக்கை விடுத்துத் தாக்க பயன்படும் ஒரு கருவி. தவளை சுரக்கிர விஷம் கிட்டத்தட்ட 10 மனிதர்களைக் கொல்லக்கூடியதாம். மழைக்காடுகளில் மட்டுமே காணப்படும் இந்த தவளைகள் நச்சு அம்பு தவளைகள் என அழைக்கப்படுகின்றன. மத்திய மற்றும் தென் அமெரிக்கப் பகுதிகளில் 220 இனங்கள் கண்டறியப்பட்டுள்ளன. இவற்றின் மேல் தோலில் அம்புகளை தடவி வேட்டையாட உபயோகித்தனர். இத் தவளைகள் கண்கவரும் பிரகாசமான நிறங்களில் காணப்படும். இந்த நிறம் ஒரு எச்சரிக்கை அடையாலம். மேல் தோலில் உள்ள விஷம் 20,000 எலிகளையும், 10 மனிதர்களையும் கொள்ள கூடியது. நச்சு, இது உண்ணும் கரையான்கள்,எறும்பு, பூச்சிகளில் இருந்து பெறுகிறது.[2].
மத்திய மற்றும் தென் அமெரிக்காவில் வாழக்கூடிய, அதிக பட்சம் 2.5 அங்குலமே நீளமுள்ள, ஒரு வகையான தவளைகள் நச்சு அம்புத் தவளைகள் ( Poison dart frog) இத் தவளைகள் கண்கவரும் பிரகாசமான நிறங்களில் காணப்படும்.. தாக்கும் ஒரு வகையான கொழகொழப்பான, கொடிய விஷத்தினை தன் முதுகுப்பகுதியில் சுரக்குமாம். இது எதிரிகளை எச்சரிக்கை விடுத்துத் தாக்க பயன்படும் ஒரு கருவி. தவளை சுரக்கிர விஷம் கிட்டத்தட்ட 10 மனிதர்களைக் கொல்லக்கூடியதாம். மழைக்காடுகளில் மட்டுமே காணப்படும் இந்த தவளைகள் நச்சு அம்பு தவளைகள் என அழைக்கப்படுகின்றன. மத்திய மற்றும் தென் அமெரிக்கப் பகுதிகளில் 220 இனங்கள் கண்டறியப்பட்டுள்ளன. இவற்றின் மேல் தோலில் அம்புகளை தடவி வேட்டையாட உபயோகித்தனர். இத் தவளைகள் கண்கவரும் பிரகாசமான நிறங்களில் காணப்படும். இந்த நிறம் ஒரு எச்சரிக்கை அடையாலம். மேல் தோலில் உள்ள விஷம் 20,000 எலிகளையும், 10 மனிதர்களையும் கொள்ள கூடியது. நச்சு, இது உண்ணும் கரையான்கள்,எறும்பு, பூச்சிகளில் இருந்து பெறுகிறது..
မြားဆိပ်ဖား (အင်္ဂလိပ်: Poison dart frog; အခြားအမည် dart-poison frog၊ poison frog; ယခင်အမည် poison arrow frog) ကို ဗဟိုအမေရိကနှင့် တောင်အမေရိကတွင် တွေ့ရပြီး အရောင်တောက်ပ၍ ၄ စင်တီမီတာခန့် ရှည်သည်။ တောက်ပသောအရောင်သည် အဆိပ်ရှိကြောင်းကို ပြသည်။ ဖား၏ အရည်ပြားမှရသောအဆိပ်ကို ဒေသခံလူများက သုတ်လိမ်းပြီး အသုံးပြုကြသည်။ အဖိုသည် ဥများကို ကျောတွင် သယ်ဆောင်ထားသည်။ ဖားလောင်းသည် ဖွံ့ဖြိုးသည်အထိ ဖခင်ကို တွယ်ကပ်နေသည်။
မြားဆိပ်ဖား (အင်္ဂလိပ်: Poison dart frog; အခြားအမည် dart-poison frog၊ poison frog; ယခင်အမည် poison arrow frog) ကို ဗဟိုအမေရိကနှင့် တောင်အမေရိကတွင် တွေ့ရပြီး အရောင်တောက်ပ၍ ၄ စင်တီမီတာခန့် ရှည်သည်။ တောက်ပသောအရောင်သည် အဆိပ်ရှိကြောင်းကို ပြသည်။ ဖား၏ အရည်ပြားမှရသောအဆိပ်ကို ဒေသခံလူများက သုတ်လိမ်းပြီး အသုံးပြုကြသည်။ အဖိုသည် ဥများကို ကျောတွင် သယ်ဆောင်ထားသည်။ ဖားလောင်းသည် ဖွံ့ဖြိုးသည်အထိ ဖခင်ကို တွယ်ကပ်နေသည်။
Poison dart frog (also known as dart-poison frog, poison frog or formerly known as poison arrow frog) is the common name of a group of frogs in the family Dendrobatidae which are native to tropical Central and South America.[2] These species are diurnal and often have brightly colored bodies. This bright coloration is correlated with the toxicity of the species, making them aposematic. Some species of the family Dendrobatidae exhibit extremely bright coloration along with high toxicity, while others have cryptic coloration with minimal to no amount of observed toxicity.[3] The species that have great toxicity derive this feature from their diet of ants, mites and termites.[3][4] However, other species that exhibit cryptic coloration, and low to no amounts of toxicity, eat a much larger variety of prey.[4] Many species of this family are threatened due to human infrastructure encroaching on their habitats.
These amphibians are often called "dart frogs" due to the Native Americans' use of their toxic secretions to poison the tips of blowdarts. However, out of over 170 species, only four have been documented as being used for this purpose (curare plants are more commonly used for Native American darts) all of which come from the genus Phyllobates, which is characterized by the relatively large size and high levels of toxicity of its members.[5][6]

Most species of poison dart frogs are small, sometimes less than 1.5 cm (0.59 in) in adult length, although a few grow up to 6 cm (2.4 in) in length. They weigh 1 oz. on average.[7] Most poison dart frogs are brightly colored, displaying aposematic patterns to warn potential predators. Their bright coloration is associated with their toxicity and levels of alkaloids. For example, frogs of the genus Dendrobates have high levels of alkaloids, whereas Colostethus species are cryptically colored and are not toxic.[4]
Poison dart frogs are an example of an aposematic organism. Their bright coloration advertises unpalatability to potential predators. Aposematism is currently thought to have originated at least four times within the poison dart family according to phylogenetic trees, and dendrobatid frogs have since undergone dramatic divergences – both interspecific and intraspecific – in their aposematic coloration. This is surprising given the frequency-dependent nature of this type of defense mechanism.[3][8]
Adult frogs lay their eggs in moist places, including on leaves, in plants, among exposed roots, and elsewhere. Once the eggs hatch, the adult piggybacks the tadpoles, one at a time, to suitable water: either a pool, or the water gathered in the throat of bromeliads or other plants. The tadpoles remain there until they metamorphose, in some species fed by unfertilized eggs laid at regular intervals by the mother.[9]
Poison dart frogs are endemic to humid, tropical environments of Central and South America.[5] These frogs are generally found in tropical rainforests, including in Bolivia, Costa Rica, Brazil, Colombia, Ecuador, Venezuela, Suriname, French Guiana, Peru, Panama, Guyana, Nicaragua, and Hawaii (introduced).[5][10]
Natural habitats include moist, lowland forests (subtropical and tropical), high-altitude shrubland (subtropical and tropical), moist montanes and rivers (subtropical and tropical), freshwater marshes, intermittent freshwater marshes, lakes and swamps. Other species can be found in seasonally wet or flooded lowland grassland, arable land, pastureland, rural gardens, plantations, moist savanna and heavily degraded former forest. Premontane forests and rocky areas have also been known to hold frogs. Dendrobatids tend to live on or close to the ground, but also in trees as much as 10 m (33 ft) from the ground.[11]

Many species of poison dart frogs are dedicated parents. Many poison dart frogs in the genera Oophaga and Ranitomeya carry their newly hatched tadpoles into the canopy; the tadpoles stick to the mucus on the backs of their parents. Once in the upper reaches of the rainforest trees, the parents deposit their young in the pools of water that accumulate in epiphytic plants, such as bromeliads. The tadpoles feed on invertebrates in their nursery, and their mother will even supplement their diet by depositing eggs into the water. Other poison frogs lay their eggs on the forest floor, hidden beneath the leaf litter. Poison frogs fertilize their eggs externally; the female lays a cluster of eggs and a male fertilizes them afterward, in the same manner as most fish. Poison frogs can often be observed clutching each other, similar to the manner most frogs copulate. However, these demonstrations are actually territorial wrestling matches. Both males and females frequently engage in disputes over territory. A male will fight for the most prominent roosts from which to broadcast his mating call; females fight over desirable nests, and even invade the nests of other females to devour competitor's eggs.[12]
The operational sex ratio in the poison dart frog family is mostly female biased. This leads to a few characteristic behaviors and traits found in organisms with an uneven sex ratio. In general, females have a choice of mate. In turn, males show brighter coloration, are territorial, and are aggressive toward other males. Females select mates based on coloration (mainly dorsal), calling perch location, and territory.[13]
Dart frogs are the focus of major phylogenetic studies, and undergo taxonomic changes frequently.[1] The family Dendrobatidae currently contains 16 genera, with about 200 species.[14][15]
Genus name and authority Common name Species Adelphobates (Grant, et al., 2006)Some poison dart frogs species include a number of conspecific color morphs that emerged as recently as 6,000 years ago.[13] Therefore, species such as Dendrobates tinctorius, Oophaga pumilio, and Oophaga granulifera can include color pattern morphs that can be interbred (colors are under polygenic control, while the actual patterns are probably controlled by a single locus).[16] Differing coloration has historically misidentified single species as separate, and there is still controversy among taxonomists over classification.[17]
Variation in predation regimens may have influenced the evolution of polymorphism in Oophaga granulifera,[18] while sexual selection appears to have contributed to differentiation among the Bocas del Toro populations of Oophaga pumilio.[19][20][21]
The chemical defense mechanisms of the Dendrobates family are the result of exogenous means.[22] Essentially this means that their ability to defend has come through the consumption of a particular diet. In fact, captive raised species exhibited non-detectable levels of toxins whereas the wild-caught species did as a result of their calcium and vitamin-rich Drosophila and cricket diet. The secretion of these chemicals is released by the granular glands of the frog.[22] The discharge happens as a result of acetylcholine being released into the body which triggers the sympathetic or parasympathetic system depending on the species.[22] The chemicals secreted by the Dendrobatid family of frogs are unique alkaloids that consist of greatly different and unique chemical structures and toxicity.[22] It has been suggested that initially the granular glands were solely responsible for the production and synthesis of the diverse toxins in different species of Dendrobates, then through evolution the glands were adapted to also be responsible for storage, and then finally even the secretion of them upon triggering.[22]
Many poison dart frogs secrete lipophilic alkaloid toxins such as allopumiliotoxin 267A, batrachotoxin, epibatidine, histrionicotoxin, and pumiliotoxin 251D through their skin. Alkaloids in the skin glands of poison dart frogs serve as a chemical defense against predation, and they are therefore able to be active alongside potential predators during the day. About 28 structural classes of alkaloids are known in poison dart frogs.[5][23] The most toxic of poison dart frog species is Phyllobates terribilis. It is argued that dart frogs do not synthesize their poisons, but sequester the chemicals from arthropod prey items, such as ants, centipedes and mites – the diet-toxicity hypothesis.[24][25] Because of this, captive-bred animals do not possess significant levels of toxins as they are reared on diets that do not contain the alkaloids sequestered by wild populations. In fact, new studies suggest that the maternal frogs of some species lay unfertilized eggs, which are laced with trace amounts of alkaloids, to feed the tadpoles.[26] This behavior shows that the poisons are introduced from a very young age. Nonetheless, the captive-bred frogs retain the ability to accumulate alkaloids when they are once again provided an alkaloidal diet.[27] Despite the toxins used by some poison dart frogs, some predators have developed the ability to withstand them. One is the snake Erythrolamprus epinephalus, which has developed immunity to the poison.[28]
Chemicals extracted from the skin of Epipedobates tricolor may have medicinal value. Scientists use this poison to make a painkiller.[29] One such chemical is a painkiller 200 times as potent as morphine, called epibatidine; however, the therapeutic dose is very close to the fatal dose.[30] A derivative ABT-594 developed by Abbott Laboratories, called Tebanicline got as far as Phase II trials in humans,[31] but was dropped from further development due to dangerous gastrointestinal side effects.[32] Secretions from dendrobatids are also showing promise as muscle relaxants, heart stimulants and appetite suppressants.[33] The most poisonous of these frogs, the golden poison frog (Phyllobates terribilis), has enough toxin on average to kill ten to twenty men or about twenty thousand mice.[34] Most other dendrobatids, while colorful and toxic enough to discourage predation, pose far less risk to humans or other large animals.
Conspicuous coloration in these frogs is further associated with diet specialization, body mass, aerobic capacity, and chemical defense.[8] Conspicuousness and toxicity may be inversely related, as polymorphic poison dart frogs that are less conspicuous are more toxic than the brightest and most conspicuous species.[35] Energetic costs of producing toxins and bright color pigments lead to potential trade-offs between toxicity and bright coloration,[36] and prey with strong secondary defenses have less to gain from costly signaling. Therefore, prey populations that are more toxic are predicted to manifest less bright signals, opposing the classical view that increased conspicuousness always evolves with increased toxicity.[37]
Skin toxicity evolved alongside bright coloration,[38] perhaps preceding it.[3] Toxicity may have relied on a shift in diet to alkaloid-rich arthropods,[24] which likely occurred at least four times among the dendrobatids.[24] Either aposematism and aerobic capacity preceded greater resource gathering, making it easier for frogs to go out and gather the ants and mites required for diet specialization, contrary to classical aposematic theory, which assumes that toxicity from diet arises before signaling. Alternatively, diet specialization preceded higher aerobic capacity, and aposematism evolved to allow dendrobatids to gather resources without predation.[8] Prey mobility could also explain the initial development of aposematic signaling. If prey have characteristics that make them more exposed to predators, such as when some dendrobatids shifted from nocturnal to diurnal behavior, then they have more reason to develop aposematism.[3] After the switch, the frogs had greater ecological opportunities, causing dietary specialization to arise. Thus, aposematism is not merely a signaling system, but a way for organisms to gain greater access to resources and increase their reproductive success.[39]
Dietary conservatism (long-term neophobia) in predators could facilitate the evolution of warning coloration, if predators avoid novel morphs for a long enough period of time.[40] Another possibility is genetic drift, the so-called gradual-change hypothesis, which could strengthen weak pre-existing aposematism.[41]
Sexual selection may have played a role in the diversification of skin color and pattern in poison frogs.[42][43][44][45] With female preferences in play, male coloration could evolve rapidly. Sexual selection is influenced by many things. The parental investment may shed some light on the evolution of coloration in relation to female choice. In Oophaga pumilio, the female provides care for the offspring for several weeks whereas the males provides care for a few days, implying a strong female preference. Sexual selection increases phenotypic variation drastically. In populations of O. pumilio that participated in sexual selection, the phenotypic polymorphism was evident.[46] The lack of sexual dimorphism in some dendrobatid populations however suggests that sexual selection is not a valid explanation.[47]
Functional trade-offs are seen in poison frog defense mechanisms relating to toxin resistance. Poison dart frogs containing epibatidine have undergone a 3 amino acid mutation on receptors of the body, allowing the frog to be resistant to its own poison. Epibatidine-producing frogs have evolved poison resistance of body receptors independently three times. This target-site insensitivity to the potent toxin epibatidine on nicotinic acetylcholine receptors provides a toxin resistance while reducing the affinity of acetylcholine binding.[48]
All species of poison dart frogs are Neotropical in origin. Wild-caught specimens can maintain toxicity for some time (this can be obtained through a form of bioaccumulation), so appropriate care should be taken when handling them.[49] While scientific study on the lifespan of poison dart frogs is scant, retagging frequencies indicate it can range from one to three years in the wild.[50] However, these frogs typically live for much longer than that in captivity, having been reported to live as long as 25 years. These claims also seem to be questionable, since many of the larger species take a year or more to mature, and Phyllobates species can take more than two years. In captivity, most species thrive where the humidity is kept constant at 80 to 100% and where the temperature is around 72 °F (22 °C) to 80 °F (27 °C) during the day and no lower than 60 °F (16 °C) to 65 °F (18 °C) at night. Some species tolerate lower temperatures better than others.
Many species of poison dart frogs have recently experienced habitat loss, chytrid diseases, and collection for the pet trade.[51][52][53] Some are listed as threatened or endangered as a result.[54] Zoos have tried to counteract this disease by treating captive frogs with an antifungal agent that is used to cure athlete's foot in humans.[55]
The poison dart frog is known for its aggressive and predatory behavior. As tadpoles, the individuals of the genus Dendrobates are said to exhibit some unique cannibalistic tendencies, along with many other forms of predatory behavior.[56] Dendrobates tadpoles that either consumed three or more conspecific tadpoles and/or relatively large larvae of a specific species of mosquito by the name of Trichoprosopon digitatum common in their environment led them to having a much higher growth rate and typically lived much longer lives.[56] Reasons for this behavior could be that predation and aggression was selected for and favored for a few reasons. One reason is to eliminate predators, and the second reason is that it serves as a source of food in habitats that were low in resources. This predation could have evolved over time and led to cannibalism as another form of predatory behavior that had benefitted individuals survival fitness.[56] However one observation has been noted in the general characteristic of Dendrobates tadpoles including D. arboreus, D. granuliferus, D. lehmanni, D. occultator, D. pumilio, D. speciosus, and many other Dendrobates species is that they have reduced mouth parts as young tadpoles which limits their consumption typically to unfertilized eggs only.[56] Thus, it can be assumed that the cannibalistic tendencies of Dendrobates is limited to their lifetime as a tadpole and does not cross over into their adult life.
The Dendrobatidae are a family of species very well known for their territorial and aggressive behavior not only as tadpoles, but as adults too. These aggression behaviors were not only limited to males, as many female Dendrobatidae also are known to defend their own native territory very aggressively.[57] These areas that were being defended aggressively by Dendrobatidae were typically found to be regions that served as male calling sites.[57] In fact, the males were seen wrestling with intruders of their territory in order to defend their calling sites as well as their vegetation.[57] The different ways in which Dendrobatidae defended their own territories included physical combat and aggression. While vocalization and various behavioral displays served as a way of exhibiting one's strength or fitness, territorial disputes and fights led to physical combat and aggression at times too.[57] Physical violence and aggression is particularly common at times of calling. If it was seen that an intruder was making calls in the territory of a Dendrobatidae frog then the resident frog would attempt to eliminate the competition to claim the territory and the females in it to himself.[57] The resident frog would initially try to make its presence known by the means of vocalization and various behavioral displays as a way to exert dominance.[57] If this did not scare away the intruder, then the resident frog would move towards the intruder and strike them.[57] This encounter would immediately escalate into a full on fight where both are striking each other and grasping each other's limbs.[57] Similarly, the females also often would get into fights and display aggressive behaviors in disputes over territory or a mating conflict. It was also observed that females who were going after the same male, after hearing their call, would chase each other down and wrestle to fight for the male.[58] After a female courts with a male, they are also very likely to exhibit aggressive behavior towards any females that approach that male.[58] Both the males and females bought their own respective sexes for each other in a fairly similar fashion.[58]
Observations of the Dendrobatidae family suggest that males of the species would typically make their mating call in morning between the times of 6:30 am to 11:30 am.[57] The calling would typically come from a place of elevation from various pieces of nature. The males would usually be on average one meter above the ground on limbs, trunks, and stems, or logs of trees so that their voice traveled further as well as the fact that it would help themselves be seen.[57] The calls were signaled towards the stream as the females typically were in that area.[57] Each male typically had their own region in which they only made calls from, and typically an individual would repeat their calls from the same spot during a mating season.[57] After the call is received, the female makes its way to the male, and fertilization occurred in a few instances.[57] This observed fertilization was not accomplished through amplexus.[57] Initiation and interaction during courtship typically were the result of active females rather than males.[58] The females stroked, climbed on, and jumped on the other in tactile courtship, and were by far the more active sex.[58] The duration of courtship in poison frogs is long and females could even reject males even after an entire day of active following which was found to occur in a few instances.[59] In the majority of cases, the males in fact chose the oviposition site and led the way and females usually followed the male to the site.[57] In some Dendrobatidae species, such as strawberry poison frog, visual cues under high light intensity were also used to identify individuals from the same population.[59] Different species use different cues to identify individuals from their same population during the time of mating and courtship.
The diet of the Dendrobatidae is unique and vital in giving this family of frogs characteristics that are distinct from the rest. The diet of Dendrobatidae is what gives them the alkaloids that are found in their skin.[22] This unique skin color and pigmentation and ability to transform color is an distinct feature that finds its basis in its diet. The diet is also what allows this family of frogs to have a defense mechanism such as poison, which is why it's commonly referred to as the poison dart frog.[22] Both skin alkaloids and venoms and toxins are substances that can be from endogenous sources.[22] Endogenous sources essentially means that the individual themselves is producing or synthesizing those substances on their own, or they can be obtained through exogenous sources like consumption.[22] Researchers have studied these characteristics and have formed the diet-toxicity hypothesis which just implies that they believe that the diet of these Dendrobatidae is what gives them their toxicity and skin alkaloids.[22] The data from numerous studies has led to the conclusions that there are direct correlations present between the frog's diet and its skin alkaloids that act as evidence to prove the diet-toxicity hypothesis.[22] The diet that is responsible for these characteristics consists primarily of small and leaf-litter arthropods found in its general habitat, typically ants.[22] Their diet, however, is typically separated into two distinct categories.[60] The first is the primary portion of Dendrobatidae's diet which include prey that are slow-moving, large in number, and small in size.[60] This typically consists of ants, while also including mites, small beetles, and minor litter-dwelling taxa.[60] The second category of prey are much rarer finds and are much larger in body size, and they tend to have high palatability and mobility.[60] These typically consist of the orthopteroids, lepidopteran larvae, and spiders.[60] The natural diet of an individual dendrobatid depends on its species, prey abundance in its location, as well as many other factors. The available species present in the individual's enivornment can influence its diet vastly. Frogs of one species can specialize in preying on one particular prey, whereas another can focus on a different type of prey. The preference is one that depends on various factors that are calculated and decided upon as the most beneficial for one's own fitness.
Typically in many species the larger portion of parental investment falls on the shoulders of the female sex, whereas the male sex has a much smaller portion.[58] However, it has been studied that in the family of Dendrobatidae, many of the species exhibit sex role reversal in which the females are competing for a limited number of males and the males are the choosers and their parental investment is much larger than the females.[58] This theory also says that the female will typically produce eggs at an exceedingly fast rate that the males cannot possibly take full care of them which then leads to some of the males becoming unreceptive.[58] Dendrobatidae also exhibit the parental quality hypothesis. This is where the females mating with the males try to ensure that their male mates with as few individuals as possible so that their number of offspring is limited, and thus each individual offspring receives a larger portion of care, attention, and resources.[58] However, this creates an interesting dynamic of balance as there is a limited number of males available, and with many females competing for a limited number of males for courtship this makes it difficult ot limit the number of individuals a male mates with. Whereas in many species, the competition is flipped in that the competition is prominent among the males, among the Dendrobatidae it is the opposite as the females seem to have a great deal of competition among themselves for males. Females will even take the drastic measures and resort to the destroying of other female's eggs in order to make sure that the male they mated with is receptive and that it scares the male from mating with other females.[58]
Poison dart frogs suffer from parasites ranging from helminths to protozoans.[61]
Poison dart frogs suffer from chytridiomycosis, which is a deadly disease that is caused by the fungus Batrachochytrium dendrobatidis (Bd). This infection has been found in frogs from Colostethus and Dendrobates.[62][63]
{{cite journal}}: CS1 maint: multiple names: authors list (link) Poison dart frog (also known as dart-poison frog, poison frog or formerly known as poison arrow frog) is the common name of a group of frogs in the family Dendrobatidae which are native to tropical Central and South America. These species are diurnal and often have brightly colored bodies. This bright coloration is correlated with the toxicity of the species, making them aposematic. Some species of the family Dendrobatidae exhibit extremely bright coloration along with high toxicity, while others have cryptic coloration with minimal to no amount of observed toxicity. The species that have great toxicity derive this feature from their diet of ants, mites and termites. However, other species that exhibit cryptic coloration, and low to no amounts of toxicity, eat a much larger variety of prey. Many species of this family are threatened due to human infrastructure encroaching on their habitats.
These amphibians are often called "dart frogs" due to the Native Americans' use of their toxic secretions to poison the tips of blowdarts. However, out of over 170 species, only four have been documented as being used for this purpose (curare plants are more commonly used for Native American darts) all of which come from the genus Phyllobates, which is characterized by the relatively large size and high levels of toxicity of its members.
Dendrobatedoj estas familio de ranoj vivantaj en centra kaj suda Amerikoj. Multaj specioj havas intense koloran haŭton. Kvankam ĉiuj sovaĝe vivandaj dentrobatetoj estas iuspece venenaj, la nivelo de veneneco tre varias inter diversaj specioj, kaj ankaŭ samspecie inter diversaj populacioj. Multaj specioj estas minacataj. Ofte la grupiĝo de ranoj nomatas "venensagaj ranoj", ĉar la veneno de ilia haŭto uzatas en kanpafado.
Konataj specioj estas Dendrobates azureus ("dendrobato lazura"), trovebla en suda Surinamo kaj norda ĝis centra Brazilo kaj la ora venenrano (Phyllobates terribilis) de la venena genro de Filobatoj.
Los dendrobátidos (Dendrobatidae) son una familia de anfibios anuros conocidos como ranas venenosas de dardo o ranas punta de flecha, endémicas de Centroamérica y América del Sur, que incluye 203 especies y está estrechamente relacionada con la familia Aromobatidae, con la que forma la superfamilia Dendrobatoidea.
La familia Dentrobatidae incluye, distribuidos en tres subfamilias, los siguientes géneros:[1][2][3][4]
Estas ranas se caracterizan popularmente por su piel brillante y coloreada, poseen una coloración aposemática. El rango de colores va del naranja luminoso y negro azulado al amarillo y el rojo. Sin embargo, los miembros del género Colostethus son generalmente castaños y poco llamativos. Las ranas van de un tamaño de 1 a 6 cm de longitud, dependiendo de la edad y la especie de rana.
Tienen una distribución neotropical que va de Nicaragua a Bolivia, incluyendo la mayor parte del norte de Sudamérica y algunas islas caribeñas. Habitan ecosistemas muy diversos: bosques de nubes, selvas tropicales de tierras bajas, bosques andinos xerofíticos, etc.[5] Su rango altitudinal va de los 300 a los 2000 m.[6] Dendrobates auratus ha sido introducida en las islas Hawái.[7] La diversidad de especies es mayor en Panamá y Costa Rica, el Chocó colombiano, los Andes colombianos y el piedemonte andino oriental de Ecuador y Perú.[8]
Estas ranas son de hábitos diurnos,[5] y tienen una dieta basada en pequeños artrópodos (hormigas, ácaros, termitas, ortópteros, escarabajos, etc.), que varía mucho entre especies, mientras que algunas son especialistas, otras muchas son generalistas.[9][10] Muestran un comportamiento, especialmente en lo reproductivo, complejo; son especies territoriales y la mayoría suelen exhibir un cuidado parental grande hacia sus huevos y renacuajos.[11][12]
Estas ranas recibieron su nombre común de los numerosos tipos de alcaloides venenosos encontrados en la piel de muchas especies. Un buen número de los miembros de esta familia poseen en su piel estas defensas químicas. Las pumiliotoxinas son una familia de aproximadamente 80 alcaloides, liposolubles, que lo obtienen de la dieta, principalmente de artrópodos, es decir, que estas toxinas no son sintetizadas por las propias ranas (Saporito et al. 2004, Smith y Jones 2004). La rana dardo más venenosa es la rana dorada (Phyllobates terribilis), la toxina que poseen es la batraciotoxina, la cual penetra en su cuerpo al ingerir un tipo de escarabajos de la familia Melyridae, que son los que la sintetizan, la rana al ingerir este tipo de coleópteros acumulan la toxina en su cuerpo ya que esta no les hace daño.[cita requerida]
Se ha comprobado que los niveles de toxicidad varían dentro de una misma población según como de llamativo es su patrón de coloración. Tradicionalmente y como parecería lógico se ha considerado que los fenotipos con un patrón más llamativo y visible van junto a mayor toxicidad,[13] como se ha demostrado para Oophaga pumilio,[14] pero en contra de esta lógica por ejemplo en O. granulifera se vio que ocurría justo lo contrario, los fenotipos con patrones más apagados tenían mayores niveles de toxicidad.[15] Aunque no está claro, los mecanismos que están detrás de esto podrían ser la disponibilidad de presas, o la dieta entre distintas zonas.[15]
Tradicionalmente se ha considerado que el aposematismo en Dendrobatidae tenía un único origen evolutivo, ya que los compuestos bioquímicos tóxicos como rasgo son difíciles de elaborar y poco probables de que se den en la evolución, siguiendo así un criterio de máxima parsimonia.[10] Pero los últimos estudios filogenéticos que incluyen caracteres moleculares parecen demostrar que el aposematismo en Dendrobatidae tiene múltiples orígenes,[10][16] en un proceso de convergencia evolutiva que se desarrolló de manera independiente.
El número de veces que este proceso se ha dado es objeto de divergencias entre diferentes estudios, entre tres y cinco para algunos,[10] y en estudios más recientes seis para la coloración de advertencia y cuatro para la toxicidad, habiendo menos orígenes para la toxicidad dado que existen clados de mímicos batesianos de especies tóxicas.[17] La especialización en la dieta también se ha desarrollado en varias ocasiones, entre dos y tres, y parece que de manera muy estrecha a la del aposematismo, aunque hay casos de especies aposemáticas que no presentan una dieta especializada aparente. Estos procesos evolutivos son, a excepción de uno de ellos, bastante recientes.[10][17]
Hay, además, algunos otros rasgos que parecen haber surgido junto al aposematismo y su especialización alimenticia. El primero serían una cabeza y lengua más estrechas para poder alimentarse de especies muy pequeñas como los ácaros. El segundo un aprente metabolismo más rápido, justo lo contrario que otras especies de ranas simpátricas terrestres; aunque se tienen datos de pocas especies.[18] Estos rasgos no son independientes y probablemente se refuercen los unos a los otros, aunque si parece claro que el primero en surgir y comenzar con todo este fenómeno es la toxicidad,.[10] Que rasgos surgen tras la toxicidad no está claro, aunque existen algunas hipótesis al respecto. La primera sería que la coloración aposemática surgiría, aumentaría la capacidad de conseguir recursos del individuo y esto acabaría llevando a tasas metabólicas más altas y a una especialización de la dieta. La segunda sería que la especialización de la dieta iría tras la toxicidad permitiendo que esta aumentara, y facilitando posteriormente la aparición de coloraciones de advertencia. Pero es importante reforzar la idea de que después este conjunto de rasgos han coevolucionado.[10][17] También es importante señalar que si se dieran condiciones en las que la efectividad del aposematismo se redujera la especialización alimenticia podría revertir a una dieta generalista.[17]
Se tiende a considerar que la coloración aposemática está controlada y direccionada por la selección por depredación ya que son ellos, los predadores, los que se encargan de mantener el fenotipo con la señal más efectiva. Pero en el caso de Oophaga pumilio se ha visto que entra en juego la selección sexual, las hembras eligen a los machos con una coloración más brillante, generando un leve dimorfismo sexual.[19] La coloración aposemática también influye en este caso en el comportamiento territorial entre machos.[20]
La selección por depredación funciona como una fuerza estabilizadora de la evolución, manteniendo la señal de advertencia establecida,[21] pero esto parece ser solo así cuando la frecuencia de la señal es alta, es decir cuando el número de individuos que poseen la señal es alto. Si es baja se abre una puerta a que la señal evolucione o surja una nueva.[22] Además, el patrón no influye en la depredación, si no que tiene que ver más con la coloración.[23] En general las señales de advertencia en este clado parecen estar dirigidas a sus depredadores a corta distancia como son serpientes y arañas,[17] aunque para Oophaga pumilio se vio que las señales de advertencia eran honestas para aves, ligeramente para crustáceos y no existía una correlación entre toxicidad y coloración para serpientes,[14] lo que se explica ya que en este caso son las aves el principal depredador.[23]
Los dendrobátidos (Dendrobatidae) son una familia de anfibios anuros conocidos como ranas venenosas de dardo o ranas punta de flecha, endémicas de Centroamérica y América del Sur, que incluye 203 especies y está estrechamente relacionada con la familia Aromobatidae, con la que forma la superfamilia Dendrobatoidea.
Nuolimyrkkysammakot (Dendrobatidae) on sammakkoeläinten heimo, jonka lajit elävät Keski- ja Etelä-Amerikan sademetsissä. Tällä hetkellämilloin? lajeja tiedetään olevan yli kaksisataa.
Nuolimyrkkysammakot ovat pienikokoisia (1,5–6 cm) ja kirkasvärisiä. Ne ovat todennäköisesti maailman myrkyllisimpiä eläimiä. Eräiden lajien myrkyissä on batrakotoksiini-hermomyrkkyä, joka on eräs luonnon myrkyllisimmistä aineista. Phyllobates terribilis eli kultanuoli kantaa yli 3 800 mikrogrammaa myrkkyä, mikä riittäisi tappamaan yli 1 500 ihmistä. Kolmen lajin myrkkyä tiedetään käytetyn puhallusputkimetsästyksessä. Muun muassa intiaanit käyttivät myrkkyä eläinten metsästämiseen. Nuolimyrkkysammakkojen koskeminen tai syöminen voi olla kohtalokasta.
Nuolimyrkkysammakot ovat sammakkoeläimille poikkeuksellisesti aktiivisia päiväsaikaan. Kirkkaat värit varoittavat petoeläimiä sammakoiden ihon myrkyllisyydestä.
Nuolimyrkkysammakot (Dendrobatidae) on sammakkoeläinten heimo, jonka lajit elävät Keski- ja Etelä-Amerikan sademetsissä. Tällä hetkellämilloin? lajeja tiedetään olevan yli kaksisataa.
Nuolimyrkkysammakot ovat pienikokoisia (1,5–6 cm) ja kirkasvärisiä. Ne ovat todennäköisesti maailman myrkyllisimpiä eläimiä. Eräiden lajien myrkyissä on batrakotoksiini-hermomyrkkyä, joka on eräs luonnon myrkyllisimmistä aineista. Phyllobates terribilis eli kultanuoli kantaa yli 3 800 mikrogrammaa myrkkyä, mikä riittäisi tappamaan yli 1 500 ihmistä. Kolmen lajin myrkkyä tiedetään käytetyn puhallusputkimetsästyksessä. Muun muassa intiaanit käyttivät myrkkyä eläinten metsästämiseen. Nuolimyrkkysammakkojen koskeminen tai syöminen voi olla kohtalokasta.
Nuolimyrkkysammakot ovat sammakkoeläimille poikkeuksellisesti aktiivisia päiväsaikaan. Kirkkaat värit varoittavat petoeläimiä sammakoiden ihon myrkyllisyydestä.
Les Dendrobatidae, communément appelés dendrobates, sont une famille d'amphibiens[1] qui sont originaires de l'Amérique centrale et du Sud. Ces espèces de grenouilles de petite taille sont diurnes et ont souvent des corps de couleur vive. Tous les dendrobates sauvages sont toxiques, bien que leur toxicité varie considérablement d'une espèce à l'autre et d'une population à une autre. Ces amphibiens sont appelés « poison-dart frogs » en anglais (grenouilles à flèches empoisonnées) en raison de l'utilisation faite par les Amérindiens de leurs sécrétions toxiques pour empoisonner les extrémités de leurs flèches de sarbacane. Cependant, seulement quatre espèces provenant du genre Phyllobates, hautement toxique, ont été documentées comme étant utilisées à cet effet [2],[3]. Elles font l'objet d'un commerce notamment en France en tant que nouveaux animaux de compagnie. De nombreuses espèces sont menacées.
La plupart des espèces de Dendrobatidae sont de petite taille à l'âge adulte, allant de moins de 15 mm de long pour moins d'1 gramme à 6 cm de long pour environ 28 g[4]. La plupart des Dendrobatidae affichent des motifs aposématiques aux couleurs vives avertissant les prédateurs potentiels de leur dangerosité. Leur coloration vive est associée à leur toxicité et les niveaux d'alcaloïdes contenus dans leur peau. Les grenouilles du genre Dendrobates ont des niveaux élevés d'alcaloïdes, alors que les espèces du genre Colostethus sont cryptiques et ne sont pas toxiques[5].
Les Dendrobatidae sont un exemple d'organisme aposématique. Leur coloration vive annonce leur inappétence pour les prédateurs potentiels. On pense que l'aposématisme est apparu au moins quatre fois au sein de la famille des Dendrobatidae selon les arbres phylogénétiques, et ces grenouilles ont depuis subi des divergences spectaculaires - à la fois interspécifiques et intraspécifiques - dans leur coloration. Ceci est surprenant étant donné que ce type de mécanisme de défense dépend de la fréquence à laquelle ces animaux sont présents[6],[7].
Certaines espèces de Dendrobatidae présentent un certain nombre de colorations différentes au sein d'une même espèce, et ce polymorphisme semblent être apparu récemment, il y a 6 000 ans[8]. Par conséquent, les espèces telles que Dendrobates tinctorius, Oophaga pumilio et O. granulifera peuvent avoir un motif de couleur qui peut varier suivant les croisements (les couleurs sont sous contrôle polygénique, tandis que les motifs sont probablement contrôlés par un seul locus)[9]. Les différences de coloration ont historiquement conduit à identifier les individus d'une même espèce comme appartenant à deux espèces différentes, et cela explique le grand nombre de controverses parmi les taxonomistes pour la classification de ces espèces[10].
Les variations dans les régimes de prédation peuvent avoir influencé l'évolution du polymorphisme chez O. granulifera[11], tandis que la sélection sexuelle semble avoir contribué à la différenciation entre les populations de Oophaga pumilio à Bocas del Toro[12],[13],[14].
Les espèces de la famille des Dendrobatidae présentent un spectre de comportements reproductifs marqués par un rituel nuptial et des soins parentaux contrastant avec la majorité des anoures[15].
Les Dendrobatidae se reproduisent plusieurs fois dans l'année, la période de reproduction commence typiquement au début de la saison des pluies.
Les mâles sont particulièrement territoriaux lors de cette période et se disputent en luttant les emplacements à partir desquels ils émettent leur cri ainsi que les sites de ponte. Des luttes entre femelles sont également présentes chez certaines espèces et conditionnent l'accès aux mâles et aux sites de ponte[16]. Les femelles inspectent les mâles et choisissent alors leur partenaires en fonction de son apparence et de l'emplacement choisi pour l'appeler[8]. Chez la majorité des espèces, le mâle amène ensuite la femelle au site de ponte. Certains Dendrobatidae forment alors un amplexus céphalique caractéristique, le mâle s'accrochant au dos de la femelle en la maintenant par la tête, tandis que d'autres ne forment pas d'amplexus[17]. Les œufs sont pondus hors de l'eau dans des endroits humides, comme sur les feuilles, dans les plantes, sur des racines exposées, les œufs sont fertilisés par fécondation extérieure.
Une fois éclos, les têtards sont déplacés individuellement ou en groupe sur le dos d'un parent pour être acheminés jusqu'à un milieu aquatique où ils se développeront. En fonction des espèces, la dépôt des têtards a lieu au niveau du sol dans un plan d'eau stagnante ou un ruisseau, ou bien dans les phytotelmes de plantes terrestres ou épiphytes tels que les réserves d'eau des broméliacées [18]. Chez la majorité des espèces les soins parentaux persistent sous diverses formes telles que le déplacement des têtards lorsque la réserve d'eau s'assèche ou le nourrissage des têtards par la femelle avec des œufs infertiles, jusqu'à la métamorphose des têtards [19].
La métamorphose survient entre 50 et 80 jours après la ponte et les jeunes atteignent la maturité sexuelle au cours de leur première année[réf. nécessaire].
Les Dendrobatidae adultes sont carnivores et se nourrissent de petits arthropodes qu'ils chassent activement durant la journée. Des spécialisations alimentaires sont apparues à plusieurs reprises dans la famille des Dendrobatidae et sont fortement corrélées à la toxicité et à l'aposématisme des espèces spécialistes. Celles-ci sont en effet capable de séquestrer les alcaloïdes présents dans leur alimentation, principalement composée de fourmis et d'acariens oribates et développent ainsi une toxicité les protégeant des prédateurs [22],[23].
Les têtards sont principalement carnivores à forte tendance cannibales. Ils se nourrissent d'arthropodes aquatiques et de têtards de la même espèce ou d'autres amphibiens[24]. Différentes recherches montrent que cette prédation permet également aux têtards d'éliminer les autres têtards et larves d'insectes prédatrices lorsque ces derniers sont encore trop petits pour les attaquer et les manger. Chez certaines espèces, l'alimentation est complétée par des œufs infertiles pondus par la femelle, voir majoritairement comprise de ces œufs chez les Dendrobatidae les plus spécialisés[19].
Les Dendrobatidae sont endémiques des environnements tropicaux humides d'Amérique Centrale et du Sud[2]. Ces grenouilles sont généralement rencontrées dans les forêts tropicales, notamment en Bolivie, au Costa Rica, au Brésil, en Colombie, en Équateur, au Venezuela, au Suriname, en Guyane française, au Pérou, au Panama, au Guyana, au Nicaragua, et à Hawaii (où ils sont introduits)[2],[25].
Leurs habitats naturels comprennent les forêts subtropicales et tropicales humides de plaine, les terres arbustives subtropicales ou tropicales de haute altitude, les montagnes, rivières, marais d'eau douce, lacs et marécages sous un climat subtropicale ou tropicale. Certaines espèces peuvent être rencontrées dans des prairies saisonnièrement humides ou des plaines inondées, les terres arables, les pâturages, les jardins, les plantations, la savane humide et les anciennes forêts fortement dégradées. Les Dendrobatidae ont tendance à vivre sur ou près du sol, mais aussi dans les arbres jusqu'à 10 m au-dessus du sol[26].
Les Dendrobatidae forment avec leur famille sœur Aromobatidae la superfamille des Dendrobatoidae. La famille des Dendrobatidae contient selon Amphibian Species of the World (04 avril 2020)[27] 17 genres, avec 199 espèces[28],[29], elle est cependant l'objet de diverses études phylogénétiques et la taxonomie des espèces lui appartenant évolue fréquemment[30] .
Beaucoup de grenouilles de la famille des Dendrobatidae sécrètent des toxines alcaloïdes lipophiles à travers leur peau. Les alcaloïdes contenus dans les glandes de la peau des grenouilles servent comme moyen de défense chimique contre les prédateurs, et ils sont donc en mesure d'être actifs face aux prédateurs potentiels pendant la journée. Environ 28 classes structurelles d'alcaloïdes sont connues chez ces grenouilles[2],[32]. Parmi ces espèces la plus toxique est Phyllobates terribilis. Certains scientifiques pensent que les Dendrobatidae ne synthétisent pas leurs poisons, mais séquestrent les produits chimiques de certains arthropodes qu'ils consomment, comme les fourmis, mille-pattes et acariens[33],[34]. Pour cette raison, les animaux élevés en captivité ne présentent pas les niveaux significatifs de toxines de ceux vivant dans le milieu naturel, car leurs régimes sont différents. En fait, de nouvelles études suggèrent que les femelles de certaines espèces pondent des œufs non fécondés, qui présentent des traces d'alcaloïdes, pour nourrir les têtards[35]. Ce comportement montre que les poisons sont introduits à partir d'un très jeune âge. Néanmoins, les grenouilles élevées en captivité conservent la capacité d'accumuler des alcaloïdes quand on leur fourni une alimentation en contenant[36]. Malgré les toxines utilisées par certaines Dendrobatidae, des prédateurs ont développé la capacité de leur résister. Par exemple le serpent Liophis epinephelus a développé une immunité au poison[37].
Les molécules chimiques extraites de la peau d'Epipedobates tricolor ont une valeur médicinale. Les scientifiques utilisent ce poison comme analgésique[38]. Parmi les molécules extraites on trouve en effet un analgésique 200 fois plus puissant que la morphine, l'épibatidine. Cependant, la dose thérapeutique est très proche de la dose mortelle[39]. Un dérivé, ABT-594, développé par les Laboratoires Abbott, appelée Tebanicline est entré en deuxième phase de test chez l'Homme[40], mais son développement a été stoppé en raison des effets secondaires gastro-intestinaux trop importants[41]. Les sécrétions des Dendrobatidae peuvent également être intéressantes comme relaxants musculaires, stimulants cardiaques et anorexigènes[42]. La plus toxique de ces grenouilles, Phyllobates terribilis, dispose d'assez de toxines en moyenne pour tuer dix à vingt hommes ou environ dix mille souris[43]. La plupart des autres Dendrobatidae, même si elles sont colorées et suffisamment toxiques pour décourager les prédateurs, comportent beaucoup moins de dangers pour les humains ou d'autres animaux de grande taille.
Une première étude menée par Summers et Clough (2000) sur l'évolution de la coloration de la peau et de la toxicité dans la famille des Dendrobatidae a indiqué que l'évolution de la toxicité de la peau était significativement corrélée avec l'évolution de la coloration vive[44]. Par ailleurs, une étude réalisée par Santos et Cannatella (2011) a confirmé cela en expliquant qu'il y avait une corrélation remarquable entre la coloration et la spécialisation de l'alimentation, la masse corporelle, la capacité aérobie, et la défense chimique chez les Dendrobatidae[7]. Santos et Cannatella (2011) proposent deux scénarios évolutifs qui expliquent ces corrélations. Une possibilité est que l'aposématisme et la capacité aérobie ont précédé une plus grande collecte de ressources, les grenouilles consommant plus de fourmis et d'acariens et spécialisant leur alimentation. Ceci est contraire à la théorie aposématique classique, qui considère que la toxicité de l'alimentation est apparue avant la coloration vive. La deuxième hypothèse suggère que la spécialisation de l'alimentation a précédé la capacité aérobie supérieure et que l'aposématisme a évolué afin de permettre aux Dendrobatidae de partir à la recherche de nourriture sans risquer la prédation.
D'autres données indiquent que la coloration et la toxicité peuvent être inversement proportionnelles. Une étude récemment publiée par Wang et Shaffer (2011) soutient cette idée. Cette étude a révélé que chez les grenouilles Dendrobatidae polymorphes, les animaux aux coloris les moins visibles sont plus toxiques que les espèces les plus brillantes et les plus visibles[45]. Les dépenses énergétiques pour produire les toxines et les pigments de couleurs vives conduisent à des compromis possibles entre la toxicité et coloration vive[46]. Les proies avec de fortes défenses secondaires (comme les grenouilles toxiques dans l'étude Wang et Shaffer 2011) ont moins à gagner avec une peau colorée coûteuse en énergie. Par conséquent, les populations de grenouilles très toxiques manifestent des signaux extérieurs de dangerosité moins évidents[47]. Cette théorie conteste le principe que l'augmentation de la coloration de la peau évolue toujours avec une toxicité accrue.
La mobilité des proies pourrait également expliquer le développement initial de la signalisation aposématique. Si les proies ont des caractéristiques qui les rendent plus exposées aux prédateurs, telles que la taille ou l'habitat, ils ont de bonnes raisons de développer de l'aposématisme. Un exemple de cela est le passage du comportement nocturne au comportement diurne chez certaines Dendrobatidae[6]. Après le passage à un comportement diurne, les grenouilles avaient de plus grandes possibilités en termes de biologie, et en conséquence la spécialisation alimentaire est apparue[48]. Ainsi, l'aposématisme est non seulement un système de signalisation, mais un moyen pour les organismes d'avoir un meilleur accès aux ressources et à accroître leur succès comme reproducteurs.
Marples et al., cependant, a montré que les habitudes alimentaires (néophobie à long terme) des prédateurs pourraient faciliter l'évolution de la coloration d'avertissement si les prédateurs évitent les nouvelles formes pour une période de temps suffisamment longue[49].
De nombreuses études ont suggéré que la sélection sexuelle joue un rôle dans la diversification de la couleur et des motifs de la peau des Dendrobatidae[50],[51],[52],[53]. Comme les préférences des femelles jouent alors un rôle important, la coloration des mâles devrait évoluer plus rapidement. La sélection sexuelle est influencée par beaucoup de choses. L'investissement parental peut expliquer à un certain point l'évolution de la coloration par rapport au choix de la femelle. Par exemple, chez Oophaga pumilio les deux sexes ne sont pas impliqués de la même manière dans le soin aux jeunes. La femelle pond les œufs et s'occupe de la progéniture pendant plusieurs semaines tandis que les mâles déposent le sperme (ce qui demande moins d'énergie) et ne s'occupent des jeunes que pendant quelques jours. Cette différence entre sexes indique qu'il y aura une forte incidence du choix des femelles. La sélection sexuelle fait fortement augmenter la variation phénotypique chez les espèces. Tazzyman et Iwasa (2010) ont constaté qu'il y avait des populations de O. pumilio qui utilisaient la sélection sexuelle, et d'autres non. Dans les premières populations, le polymorphisme phénotypique était évident[54].
L'absence de fort dimorphisme sexuel dans certaines populations de Dendrobatidae suggère que la sélection sexuelle n'est pas une hypothèse valable de l'aposématisme de ces grenouilles[55]. Ce pourrait être parce que la mesure de protection principale des populations de grenouilles aposématiques est leur capacité à avertir les prédateurs de leur toxicité. Rûdh et al. (2011) ont prédit que la préférence des femelles pour les mâles plus vifs augmenterait la vivacité de la coloration chez les deux sexes et accroîtrait ainsi leurs aptitudes à avertir les agresseurs. S'il y avait un dimorphisme sexuel entre les mâles et les femelles au sein d'une population aposématique il y aurait une différence au niveau de la prédation des mâles et des femelles qui provoquerait un déséquilibre dans le sex-ratio, ce qui aurait une incidence sur les stratégies d'accouplement et, finalement modifierait le comportement d'accouplement de l'espèce.
De nombreuses espèces de Dendrobatidae ont connu récemment une disparition de leur habitat (en raison de l'exploitation forestière et l'agriculture), et sont touchées par des maladies telle que la chytridiomycose. Certaines espèces sont donc répertoriées comme menacées ou en danger[56]. Les zoos ont essayé d'enrayer cette maladie en traitant les grenouilles en captivité avec un agent antifongique qui est normalement utilisé pour soigner les pieds des athlètes[57].
Toutes les espèces de grenouilles venimeuses sont d'origine néotropicale. Les spécimens capturés dans la nature peuvent maintenir la toxicité pendant un certain temps, de sorte qu'il faut prendre de grandes précautions lors de la manipulation de ces animaux[58]. En captivité, la plupart des espèces vivent correctement lorsque l'humidité est maintenue constante vers 80 à 100% et lorsque la température est d'environ 22 °C à 27 °C pendant la journée et pas inférieure à 16 °C à 18 °C pendant la nuit. Certaines espèces tolèrent des températures plus basses mieux que d'autres.
Les Dendrobatidae, communément appelés dendrobates, sont une famille d'amphibiens qui sont originaires de l'Amérique centrale et du Sud. Ces espèces de grenouilles de petite taille sont diurnes et ont souvent des corps de couleur vive. Tous les dendrobates sauvages sont toxiques, bien que leur toxicité varie considérablement d'une espèce à l'autre et d'une population à une autre. Ces amphibiens sont appelés « poison-dart frogs » en anglais (grenouilles à flèches empoisonnées) en raison de l'utilisation faite par les Amérindiens de leurs sécrétions toxiques pour empoisonner les extrémités de leurs flèches de sarbacane. Cependant, seulement quatre espèces provenant du genre Phyllobates, hautement toxique, ont été documentées comme étant utilisées à cet effet ,. Elles font l'objet d'un commerce notamment en France en tant que nouveaux animaux de compagnie. De nombreuses espèces sont menacées.
Frog caol atá dúchasach do Mheiriceá Láir is Theas. Gealdaite go minic. Áitríonn sé coillearnach. Beireann sé uibheacha ar an talamh, agus iompraíonn na froig fhásta na torbáin go dtí an t-uisce. An craiceann an-nimhiúil. Cuimlíonn na bundúchasaigh a reanna saighde le craiceann froig bheo chun iad a nimhiú le haghaidh seilge. Tá roinnt buaf i Meiriceá Theas freisin a dtugtar buafa saigheadnimhe orthu.
Katak beracun dengan warna seperti biru safir, adalah nama umum dari sekelompok katak dalam keluarga Dendrobatidae yang merupakan katak asli Amerika Tengah dan Selatan.[1]
Tidak seperti kebanyakan katak lainnya, spesies yang aktif di siang hari, dan sering menunjukkan tubuh berwarna cerah.[2] Walaupun semua dendrobatids setidaknya agak beracun di alam liar, tingkat toksisitas bervariasi dari satu spesies ke berikutnya, dan dari satu populasi yang lain. Banyak spesies yang kritis dan terancam punah.[3]Amfibi ini sering disebut katak panah oleh pribumi indian akibat penggunaan sekresi beracun mereka untuk meracuni ujung panahnya.[4]
Sebagian besar katak berjenis ini mempunyai ukuran tubuh sebesar 1,2 cm untuk katak dewasa, meskipun terdapat katak yang berukuran hingga 6 cm.[5] Ukuran rata-rata berat mereka sekitar 2 gram. Katak ini selain berwarna cerah juga menampilkan pola aposematik untuk memperingatkan pemangsa potensial. warna terang mereka berhubungan dengan mereka dan tingkat toksisitas alkaloid.[6] Katak seperti yang spesies Dendrobates memiliki tingkat alkaloid, sedangkan spesies Colostethus yang samar-samar berwarna dan tidak beracun.[7]
|title= (bantuan)Pemeliharaan CS1: Banyak nama: authors list (link) |title= (bantuan) Katak beracun dengan warna seperti biru safir, adalah nama umum dari sekelompok katak dalam keluarga Dendrobatidae yang merupakan katak asli Amerika Tengah dan Selatan.
Dendrobatidae Cope, 1865 è una famiglia di anfibi dell'ordine degli Anuri.[1]
I membri di questa famiglia sono particolarmente noti per la loro particolare capacità di produrre potenti tossine a livello cutaneo, tanto da essere anche conosciute come le rane da veleno per le frecce.
Diffuse nel Centro e Sud America, alcune di queste sono a serio rischio di estinzione a causa della distruzione dell'habitat.
Comprende 202 specie raggruppate in 16 generi e 3 sottofamiglie:[1]
Dendrobatidae Cope, 1865 è una famiglia di anfibi dell'ordine degli Anuri.
I membri di questa famiglia sono particolarmente noti per la loro particolare capacità di produrre potenti tossine a livello cutaneo, tanto da essere anche conosciute come le rane da veleno per le frecce.
Diffuse nel Centro e Sud America, alcune di queste sono a serio rischio di estinzione a causa della distruzione dell'habitat.
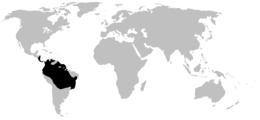
Medlaipinės (lot. Dendrobatidae, angl. Poison dart frogs, vok. Baumsteigerfrösche) – beuodegių varliagyvių (Anura) šeima. Varlės nedidelės, dieninės, dažnai ryškių spalvų, randamos Centrinėje ir Pietų Amerikoje. Kai kurių rūšių (pvz., mėlynoji medlaipė (Dendrobates azureus) odoje aptinkama nuodingų alkaloidų. Nuodingiausia medlaipinė varlė yra siaubingoji lapalaipė (Phyllobates terribilis).
Suaugusių medlaipinių varlių dydis yra 1-6 cm, priklausomai nuo amžiaus ir rūšies. Dėmėtoji medlaipė (Dendrobates tinctorius) yra viena iš didesnių varlių, pasiekianti 6 cm ilgį. Mažesnės varlės, tokios kaip Dendrobates imitator, neužauga didesnės nei 2,5 cm.
Gyvena drėgnuose tropiniuose miškuose upių ir upelių pakrantėse. Kai kurios rūšys didesnę gyvenimo dalį praleidžia medžiuose. Yra ir tokių rūšių, kurios aptinkamos atvirose sausose vietose, kur po žemaūgiais augalais yra susidarę nedideli drėgno dirvožemio ploteliai.
Medlaipinės varlės yra aktyvios dieną. Patinai stambesni už pateles. Poravimosi metu patinai patelę apima ne per juosmenį, bet už galvos ir savo pirštais prispaudžia už pasmakrės. Šitokioje būsenoje patinams patogiau apvaisinti ikrelius. Mažosios medlaipės (Dendrobates pumilio) patinas iš pradžių išleidžia spermą, o tik po to patelė į tą pačia vietą išneršia kiaušinėlius. Stambesni patinai agresyviai gina savo teritoriją. Jie savo skleidžiamais garsais privilioja patelės ir dėl jų grumiasi su kitais patinais.
Ikrus deda į paklotę, po akmenimis, ant prie pat žemės palinkusių augalų lapų ar bromelijinių augalų skrotelėse. Dėtis nedidelė – nuo 1-2 iki 30-40 kiaušinėlių. Jie vystosi visus metus. Dėtį vienas iš tėvų arba nuolat saugo, arba kaskart aplanko ir tokių apsilankymų metu kiaušinėlius sudrėkina vandeniu. Be to, užpakalinėmis kojomis kiaušinėlius apvarto ir sumaišo.
Išsiritę buožgalviai prisitvirtina ant tėvų nugaros odos dėmių, išskiriančių specifinį sekretą. Buožgalvių pilvelio viršus lygus ar šiek tiek banguotas, dėl to jie gerai išsilaiko ant tėvų nugaros. Čia jie gali išbūti nuo kelių valandų iki savaitės ar daugiau.
Daugelis rūšių savo buožgalvius atneša prie nedidelių upelių. Kai kurios juos išleidžia į bromelijinių augalų skrotelėse po lietaus susitelkusį vandenį. Spalvingoji medlaipė (Dendrobates auratus) neretai savo buožgalvius išleidžia į vandenį, susikaupusį medžių drevėse. Tokiame neturtingame maisto medžiagomis vandenyje buožgalviai linkę į kanibalizmą, ir dėl to tik vienas teišgyvena iki pilnos brandos. Mažosios medlaipės, kurios buožgalviai vystosi lapų skrotelėse susitelkusiame vandenyje, reguliariai aplanko savo jauniklius ir į vandenį išneršia neapvaisintus kiaušinėlius, kuriais buožgalviai maitinasi.
Šeimoje yra 9 gentys ir virš 150 rūšių.
Medlaipinės (lot. Dendrobatidae, angl. Poison dart frogs, vok. Baumsteigerfrösche) – beuodegių varliagyvių (Anura) šeima. Varlės nedidelės, dieninės, dažnai ryškių spalvų, randamos Centrinėje ir Pietų Amerikoje. Kai kurių rūšių (pvz., mėlynoji medlaipė (Dendrobates azureus) odoje aptinkama nuodingų alkaloidų. Nuodingiausia medlaipinė varlė yra siaubingoji lapalaipė (Phyllobates terribilis).
Suaugusių medlaipinių varlių dydis yra 1-6 cm, priklausomai nuo amžiaus ir rūšies. Dėmėtoji medlaipė (Dendrobates tinctorius) yra viena iš didesnių varlių, pasiekianti 6 cm ilgį. Mažesnės varlės, tokios kaip Dendrobates imitator, neužauga didesnės nei 2,5 cm.
Gyvena drėgnuose tropiniuose miškuose upių ir upelių pakrantėse. Kai kurios rūšys didesnę gyvenimo dalį praleidžia medžiuose. Yra ir tokių rūšių, kurios aptinkamos atvirose sausose vietose, kur po žemaūgiais augalais yra susidarę nedideli drėgno dirvožemio ploteliai.
Medlaipinės varlės yra aktyvios dieną. Patinai stambesni už pateles. Poravimosi metu patinai patelę apima ne per juosmenį, bet už galvos ir savo pirštais prispaudžia už pasmakrės. Šitokioje būsenoje patinams patogiau apvaisinti ikrelius. Mažosios medlaipės (Dendrobates pumilio) patinas iš pradžių išleidžia spermą, o tik po to patelė į tą pačia vietą išneršia kiaušinėlius. Stambesni patinai agresyviai gina savo teritoriją. Jie savo skleidžiamais garsais privilioja patelės ir dėl jų grumiasi su kitais patinais.
Raibvaržu dzimta (Dendrobatidae) ir bezastaino abinieku dzimta, kas sastopama Dienvidamerikā un Centrālamerikā. Tai pieder vairāk nekā 175 sugu, no kurām lielākā daļa ir spilgti krāsotas.
Daļa raibvaržu caur ādu izdala indi (batrahotoksīnu), kas atbaida plēsējus. Vairākas indiāņu ciltis ar šo indi piesūcināja medībām, retāk savstarpējām cilšu sadursmēm paredzētu bultu uzgaļus. Šādi sašauts putns vai zīdītājs uz vietas tika paralizēts.
Lielākā vardīšu daļa ir nelielas, 1,5 līdz 6 cm garumā, reti 7 – 8 cm. Daudzas sugas ir koši krāsainas un raibas, sarkanas, zaļas, zeltainas, zilas, dzeltenas, melnas ar spilgtiem rakstiem, plankumiem un svītrām.
Dzīvo visos Dienvidamerikas tropiskajos reģionos, no Nikaragvas un Kostarikas līdz pat Brazīlijas dienvidiem.
Raibvardes var izdzīvot vienīgi mitrā vidē. Mitinās mitros lietus mežos, dažas sugas var būt sastopamas sezonāli applūstošās zālainēs, ganībās, augļu dārzos, mitrās savannās. Parasti dzīvo uz zemes vai tuvu tai, lai arī var būt sastopamas kokos 10 m augstumā.
Pārtiek no maziem kukaiņiem, skudrām, zirnekļiem un lēcastēm.
Vienīgais dabiskais ienaidnieks ir čūska Liophis reginae, kas ir imūna pret vardes indi.
Vardes inde ir viena no bīstamākajām dzīvnieku indēm. Norijot vardi, plēsējs iet bojā, bet, nolaizot vardi, iestājas paralīze. Viena no bīstamākajām ir Kolumbijas rietumos dzīvojošā Phyllobates terribilis. Divi mikrogrami šīs indes var izrādīties nāvējoša cilvēkam, bet katrai vardei ir apmēram 200 mikrogrami bīstamās vielas.
Daudzu sugu raibvardes ir gādīgi vecāki. Kad no olām izšķiļas kurkuļi, tie uzrāpjas mātītei uz muguras un viņa tos ienes ūdenī — sīkā lietusūdens baseinā, kas atrodas bromēliju dzimtas augu ūdeņainās iedobēs. Katrā tādā baseiniņā tiek ievietots tikai viens kurkulis. Šāds ceļojums var ilgt pat vairākas stundas, taču kurkuļi ir ļoti cieši piestiprinājušies pie muguras ar mitrām siekalām. Regulāri, pēc noteikta starplaika mātīte baro kurkuļus ar neapaugļotām oliņām. Attīstījusies varde izrāpjas no ārēji ananasiem līdzīgā kausveidīgā padziļinājumā un nokāpj zemē, kur sāk pieaugušas vardes dzīvi.
Zināmas tikai četras raibvaržu sugas, ar kuru indi indiāņi mērcēja bultu, šautriņu un šķēpu uzgaļus (Amazones pamatiedzīvotāji daudz plašāk pielietoja kurāri). Dažkārt vardi uzmauca uz asa mieta un turēja virs uguns, līdz no ādas dziedzeriem izdalījās inde. To savāca mazā traukā un pēc fermentācijas piesūcināja bultas.
Lielāko apdraudējumu rada raibvaržu dabiskās vides — lietus mežu — iznīcināšana.
Dzimtai pieder trīs apakšdzimtas, 13 ģintis un aptuveni 180 sugas. Daļa sugu veido dažādu krāsu variāciju pasugas.
Raibvaržu dzimta (Dendrobatidae) ir bezastaino abinieku dzimta, kas sastopama Dienvidamerikā un Centrālamerikā. Tai pieder vairāk nekā 175 sugu, no kurām lielākā daļa ir spilgti krāsotas.
Daļa raibvaržu caur ādu izdala indi (batrahotoksīnu), kas atbaida plēsējus. Vairākas indiāņu ciltis ar šo indi piesūcināja medībām, retāk savstarpējām cilšu sadursmēm paredzētu bultu uzgaļus. Šādi sašauts putns vai zīdītājs uz vietas tika paralizēts.
Pijlgifkikkers (Dendrobatidae) zijn een familie van kikkers (Anura). Pijlgifkikkers zijn door hun felle kleuren en de bijzondere vorm van broedzorg een van de bekendste groepen van kikkers.
Pijlgifkikkers zijn kleine, gedrongen diertjes die zich kenmerken door de vaak zeer felle kleuren. Er zijn ongeveer 185 verschillende soorten die voorkomen in delen van Midden- en Zuid-Amerika. De meeste soorten zijn overdag actief en zijn niet schuw, in tegenstelling tot de meeste andere kikkers die zich overdag schuilhouden en juist erg alert zijn.
De groep werd vroeger wel tot de echte padden gerekend, maar dit is achterhaald. Pijlgifkikkers leven in vochtige en warme, tropische gebieden. De meeste soorten zijn bodembewoners, sommige soorten zijn juist in bomen te vinden. Het voedsel bestaat uit insecten en andere kleine ongewervelden. Veel soorten zijn erg giftig en hebben hierdoor weinig vijanden.
Bekende soorten zijn de aardbeikikker (Oophaga pumilo), de bijengifkikker (Dendrobates leucomelas) en ten slotte de zeer giftige soort Phyllobates terribilis. Een aantal soorten wordt wel als exotisch huisdier in een paludarium gehouden.
Pijlgifkikkers worden ook wel gifkikkers[1] of boompadden[2] genoemd. Ze danken hun Nederlandstalige naam aan hun giftige huid. Van een aantal soorten is bekend dat ze extreem giftig zijn voor gewervelde dieren. Ook in andere talen wordt de groep als zodanig aangeduid, zoals het Engelse 'poison dart frogs' en het Italiaanse 'rane da veleno per le frecce' en het Noorse 'pilgiftfrosker'. In het Duits worden de kikkers ook wel 'baumsteigerfrösche' genoemd, wat vrij vertaald boomklimkikkers betekent.
De wetenschappelijke naam Dendrobatidae betekent letterlijk 'boomwandelaars', afgeleid van het Oudgriekse δένδρον, dendron, dat 'boom' betekent en βάτης, batēs voor 'wandelaar'.
Pijlgifkikkers komen voor in noordelijk Zuid- en zuidelijk Midden-Amerika.[3] De meeste soorten komen voor in de noordwestelijke delen van Zuid-Amerika.[4]
Pijlgifkikkers leven in de landen Bolivia, Brazilië, Colombia, Costa Rica, Ecuador, Frans-Guyana, Guyana, Nicaragua, Panama, Peru, Suriname en Venezuela.[3] Het verspreidingsgebied kent twee 'gaten' waar de kikkers niet voorkomen. Dit zijn de berggebieden rond de Julianatop in Suriname en de Roraima in Venezuela.[3]
Wat betreft hoogteverspreiding komen de verschillende soorten voor van laaglanden nabij zeeniveau tot echte berggebieden tot 2000 meter boven zeeniveau.[5]
De habitat bestaat uit vochtige, tropische bossen met weinig temperatuurfluctuaties en een hoge relatieve luchtvochtigheid. Met name de luchtvochtigheid is belangrijk, pijlgifkikkers kunnen binnen korte tijd uitdrogen.
De meeste soorten leven op de bodem, dergelijke soorten kruipen door de schaduwrijke strooisellaag van het bos. Vaak groeien op de bodem planten als varens en mossen. Water wordt onttrokken uit dauw en plasjes water op de bosbodem. Van de boombewonende soorten leeft het grootste deel op een hoogte tot ongeveer twee meter en zelden hoger. Slechts enkele soorten zijn aan te merken als bewoners van hoge bomen, en brengen het grootste deel van hun leven op grote hoogte door.[6]
Andere soorten leven bij beken en stroompjes en kruipen over stenen langs oevers. Ze springen bij gevaar in het water en vluchten ver weg van een beek zodra het hard gaat regenen. Dit gedrag dient waarschijnlijk om te voorkomen dat de dieren worden weggespoeld. Tijdens of na een grote regenbui stijgt het waterpeil aanzienlijk waarbij de stroomsnelheid sterk toeneemt en de territoria worden overspoeld. Als het waterpeil weer zakt keren de kikkers terug en nemen een nieuw territorium aan.
Pijlgifkikkers leven altijd in dichtbegroeide gebieden zoals bossen. Voorbeelden van typen bossen die geschikt zijn als habitat zijn bergbossen, nevelwouden, bamboebossen en kustbossen.[5] Van een aantal soorten is bekend dat ze zich kunnen handhaven in door de mens aangepaste streken. Een voorbeeld is de soort Ameerega silverstonei, die veel wordt aangetroffen in theeplantages.[6]
De kop is typisch kikkerachtig; de kop is peervormig maar duidelijk afgeplat. De trommelvliezen of tympana zijn zoals bij alle kikkers niet in een holte geplaatst maar aan het kopoppervlak gepositioneerd. De trommelvliezen zijn achter de ogen gelegen, ze zijn altijd veel kleiner dan het oog. Pijlgifkikkers kunnen niet best horen; wel kunnen ze trillingen waarnemen. De ogen zijn aan de zijkanten van de kop gelegen. Met de ogen kunnen ze alleen beweeglijke objecten waarnemen, omdat hun zenuwstelsel niet is ingericht op het herkennen van lichtpatronen, maar alleen lichtverschuivingen, dus beweging. Pijlgifkikkers hebben geen gifklieren achter de ogen die bij andere kikkers wel voorkomen, deze klieren worden de parotoïden genoemd.
De mannetjes hebben een kwaakblaas aan de keel die gebruikt wordt om een vrouwtje te lokken. De kwaakblaas is duidelijk zichtbaar en bij veel soorten zijn de kwaakgeluiden duidelijk hoorbaar.
Pijlgifkikkers worden niet erg groot, gemiddeld worden ze ongeveer 2 tot 4 centimeter lang. De kleinste soorten bereiken een lichaamslengte van iets meer dan een centimeter, zoals de tot 13 millimeter lange Andinobates claudiae. Grotere soorten zoals uit het geslacht Aromobates kunnen tot 6 centimeter lang worden.[7] Opmerkelijk is dat de mannetjes altijd ongeveer even groot zijn als de vrouwtjes. Bij vrijwel alle andere kikkers zijn de vrouwtjes beduidend groter dan de mannetjes. Mannetjes hebben vaak hetzelfde kleurpatroon als vrouwtjes zodat dit ook geen duidelijk geslachtsonderscheid geeft. Van een aantal soorten kunnen de mannetjes worden onderscheiden aan de sterker verbrede tenen in vergelijking met die van vrouwtjes.
De huid is meestal glad, sommige soorten hebben duidelijke wratachtige huidklieren maar bij geen enkele soort is de huid sterk wratachtig van structuur zoals bij veel padden het geval is. Bij enkele soorten komt een fijn gekorrelde (ook wel: gegranuleerde) klierstructuur voor.
Pijlgifkikkers staan vooral bekend om hun grote variatie aan felle lichaamskleuren. Sommige soorten hebben een onopvallende zoals de soorten uit het geslacht Aromobates, maar de meeste pijlgifkikkers hebben een uitzonderlijke bonte kleurentekening. De kleuren kunnen variëren van geel, oranje, groen en rood, zelfs blauwe kleuren komen voor. Bij sommige soorten zijn de kikkers geheel uniform gekleurd, andere soorten hebben fel gekleurde strepen of vlekken op een donkere tot zwarte achtergrond. Pijlgifkikkers kennen soms vele variaties binnen een enkele soort.
Enkele voorbeelden van kleurschakeringen die bij de pijlgifkikkers voorkomen zijn:
Van de soort Ranitomeya imitator is bekend dat er verschillende kleurenvariaties bestaan die lijken op andere soorten pijlgifkikkers. Omdat het verspreidingsgebied van Ranitomeya imitator erg groot is, overlapt het areaal met dat van andere soorten die er verschillend uitzien. De pijlgifkikker bootst deze verschillende soorten na, wat mimicry wordt genoemd. In delen waar soorten voorkomen die een zwarte kleur met gele strepen hebben, heeft Ranitomeya imitator eenzelfde tekening. Als er soorten voorkomen die een zwarte kleur met gele dwarsbanden hebben, dan wordt deze tekening nagebootst.
Veel soorten hebben kleine pootjes die bovendien vrij dun zijn, pijlgifkikkers kunnen toch vrij grote sprongen maken als ze bijvoorbeeld moeten vluchten. De poten zijn relatief krachtig en de kikkers kunnen ook goed klimmen. Op de toppen van de vingers en de tenen zijn verdikkingen aanwezig die bestaan uit kliercellen. De uiteinden van de vingers en tenen hebben hierdoor een enigszins spatelachtige vorm.
De poten van pijlgifkikkers dragen nooit zwemvliezen zoals bij andere families voorkomt. De poten van de mannetjes ontwikkelen bij veel kikkers verdikte structuren aan de binnenzijde, de zogenaamde copulatieborstels. Deze dienen om een vrouwtje beter vast te kunnen houden tijdens de amplexus. Bij de pijlgifkikkers ontbreken dergelijke structuren echter.
Pijlgifkikkers kunnen door hun felle kleuren en kleine lichaam slechts met enkele andere groepen van kikkers worden verward. Een van deze groepen zijn de soorten uit het geslacht Mantella en de familie Mantellidae. Dit zijn eveneens kleine, felgekleurde kikkers die echter niet direct verwant zijn. Net als pijlgifkikkers vergaren zij gif (alkaloïden) uit mieren. Mantella's komen echter alleen voor op het Afrikaanse eiland Madagaskar. De grote gelijkenis met de pijlgifkikkers wordt als een vorm van convergente evolutie beschouwd, zowel (eerst) van de gifdragende mieren als daarna van de kikkers.[5][8]
Ook sommige boomkikkers (Hylidae) en rietkikkers (Hyperoliidae) hebben felle kleuren, zoals Afrixalus paradorsalis. Deze soorten zijn echter gemakkelijk te onderscheiden aan de op zuignapjes gelijkende hechtschijfjes die bij de pijlgifkikkers altijd ontbreken.
Pijlgifkikkers eten in de natuur verschillende insecten en andere zeer kleine geleedpotigen zoals kevertjes, mijten, mieren en termieten. Met name de mieren die op het menu staan bevatten gifstoffen die door de kikkers worden gebruikt om vijanden te vergiftigen. Ook bepaalde giftige kevers uit de familie Melyridae worden waarschijnlijk gegeten. De pijlgifkikkers zijn bestand tegen het gif in de gegeten prooidieren en zijn in staat het gif op te slaan in het lichaam en meer specifiek in de klieren van de huid. Oorspronkelijk komt het gif uit planten die door de mieren en kevers werden gegeten. Planten maken het gif aan om zich te verdedigen tegen insecten. Plantenetende insecten nemen het gif dan op en worden later door de pijlgifkikkers gegeten die het vergif als het ware recyclen.
In gevangenschap opgegroeide pijlgifkikkers zijn niet giftig. Er wordt aangenomen dat wildvangdieren die in gevangenschap worden gebracht na enige tijd hun giftigheid verliezen, omdat het gif niet meer uit het dieet wordt aangevuld.
Dit principe van 'geleend' gif komt ook voor bij andere kikkers zoals de gelijkende soorten uit het geslacht Mantella en bij veel Zuid-Amerikaanse hoornkikkers (Ceratophrys), maar ook bij geheel andere dieren, zoals kreeften en inktvissen.
Een aantal soorten pijlgifkikkers heeft bromelia-achtige planten nodig waar water in blijft staan. Hierdoor hebben ze een eigen waterreservoir (phytotelma), dat insecten aantrekt welke vervolgens door de larven worden gegeten. Ook zorgt het watertje voor een voldoende vochtige omgeving en biedt een goede schuilplaats tegen vijanden. Ten slotte worden vaak de eitjes afgezet in dergelijke poeltjes, zodat de planten een belangrijke schakel vormen in de voortplantingscyclus van de pijlgifkikkers.
De mannetjes lokken de vrouwtjes door geluiden te produceren met de kwaakblaas. Het lokgeluid bestaat vaak uit korte, hoge piepjes; sommige soorten houden het uren vol. Het geluid wordt gemaakt door de kwaakblaas te vullen met lucht, waarna de lucht vele malen per seconde weer naar buiten wordt geperst. De geluiden en ritmes verschillen per soort. Van veel soorten is bekend dat de mannetjes gevechten uitvoeren om een territorium te verdedigen tegen concurrenten. Ook is dit gedrag van vrouwtjes onderling bekend en zelfs een mannetje en een vrouwtje of de jongen onderling kunnen in een dergelijk gevecht worden aangetroffen. Een gevecht ontstaat als een kikker het territorium van een soortgenoot betreedt. Van een aantal soorten is bekend dat de kikker zich eerst opricht op alle vier de poten en een afweergeluid maakt. Vervolgens wordt de indringer besprongen en als dat niet helpt gaan de dieren op de achterpoten staan en volgt een soort worsteling. Als een koppeltje elkaar gevonden heeft, voert het mannetje een soort dansje uit waarbij hij het vrouwtje regelmatig aanraakt. Vervolgens zet het vrouwtje haar eitjes af waarna het mannetje deze bevrucht.
De paring van de pijlgifkikkers wijkt af van die van de meeste kikkers. Pijlgifkikkers kennen een bijzondere paargreep of amplexus, het mannetje pakt het vrouwtje bij de kop tijdens de eiafzet en niet bij haar lichaam of onder de oksels van de voor- of achterpoten zoals alle andere kikkers. Sommige soorten kennen in het geheel geen paargreep wat al helemaal uitzonderlijk is voor kikkers. Dergelijke soorten zijn tijdens de paring met de cloaca's aan elkaar gehecht, en de kikkers zitten hierbij met de koppen van elkaar af. Een voorbeeld van een dergelijke soort is Oophaga granulifera.[9]
Pijlgifkikkers zijn altijd eierleggend en de embryo's ontwikkelen zich altijd in het water. Veel soorten zetten de eitjes af in kleine tijdelijke watertjes op het land, dergelijke kleine poeltjes worden wel phytotelmata genoemd. Een phytotelma is een kleine, met water gevulde natuurlijke holte zoals een met water gevulde bladoksel of een holte in een boom waarin zich regenwater verzamelt. Een dergelijk waterreservoirtje komt veel voor bij planten uit de bromeliafamilie.
Veel soorten pijlgifkikkers kennen een vorm van broedzorg. Het beschermen van de eieren of larven komt wel bij meer groepen kikkers voor, zoals de in de Benelux voorkomende vroedmeesterpad. Bij de pijlgifkikkers is de broedzorg echter hoog ontwikkeld. Soms worden de eieren bewaakt door het mannetje tot ze bijna uitkomen. Van een aantal soorten is bekend dat het vrouwtje niet alle eieren in een enkel poeltje afzet, maar de eieren individueel deponeert in meerdere watertjes. Het vrouwtje loopt vervolgens met enige regelmaat alle poeltjes na en zet hierbij zogenaamde voedseleitjes af.[10] Dit zijn onbevruchte eitjes die geen levensvatbaar embryo bevatten maar alleen dienen om de larven te voeden. Bij deze speciale vorm van ouderzorg zijn de larven voor hun voeding vooral afhankelijk van het moederdier. De mate waarin de larve van deze eitjes afhankelijk is verschilt ook weer van soort tot soort. Het moederdier wordt bij sommige soorten zelfs gegidst door de vader naar de verscheidene poeltjes waarin zich larven bevinden. Het vrouwtje wordt hierbij door de larven gestimuleerd tot de afzet van voedseleitjes.[6]
De larven hebben nog kieuwen als ze uit het ei kruipen, deze verliezen ze meestal na een paar weken. De kikkervisjes hebben nog geen poten maar al wel een staart. Kikkervisjes hebben vaak verhoornde kaakdelen die voorzien zijn van kleine tandjes. Bij larven van de pijlgifkikkers echter zijn deze monddelen gereduceerd of ontbreken zelfs volledig.[10] Na enige tijd ontwikkelen zich longen en worden de kieuwen gereduceerd. In dit stadium komt het bij een aantal soorten voor dat de mannetjes de kikkervisjes op de rug nemen en deze verplaatsen van het phytotelma naar grotere waterreservoirs zoals beekjes of rivieren.
De kikkervisjes zuigen zich met een soort zuigschijf aan de buik vast op de rug van het mannetje. De kikkervisjes zijn daarnaast omgeven door een slijmerige substantie die ze bijeen houdt. Van de soort Hyloxalus subpunctatus is bekend dat de kikkervisjes zich in rijen op de rug van het mannetje positioneren wat duidt op een hoge specialisatie.
Onder normale omstandigheden ontwikkelt een kikkervisje zich na twee tot drie maanden een kleine kikker, het dier is dan echter een subadult. Pas enige tijd later is de kikker volwassen en dus geslachtsrijp.
Sommige pijlgifkikkers hebben geen giftige huidafscheidingen, zoals de soorten uit het geslacht Colostethus. De meeste pijlgifkikkers zijn echter zeer giftig en kunnen leiden tot een snelle dood als ze door een vijand worden opgegeten. De vooraanstaande bioloog Doris Mable Cochran omschreef de pijlgifkikkers eens als 'de Borgia's onder de amfibieën'.[1]
Phyllobates terribilis is van alle pijlgifkikkers de giftigste soort. In de huid van deze kikker is 20 keer meer gif aanwezig in vergelijking met andere soorten pijlgifkikkers. In de huidextracten van alle kikkers en padden tezamen zijn bijna 500 verschillende verbindingen gevonden. De verbindingen van pijlgifkikkers bestaat uit vetminnende behorend tot de alkaloïden. Belangrijke vergiften zijn inmiddels geanalyseerd en benoemd als pumiliotoxinen, zoals homobatrachoxine en batrachotoxine. Met name deze laatste stof is een van de giftigste verbindingen. Van de aardbeikikker is aangetoond dat het dier in staat is een bepaald vergif (pumiliotoxine 251D) zelf in een krachtiger variant om te zetten.
Omdat de concentratie gif hoog is, en er soms verschillende soorten gif worden aangetroffen in dezelfde kikker, moet een klein aantal soorten met grote zorgvuldigheid worden gehanteerd. Het gif kan ook door de huid (dermaal) worden opgenomen of worden overgebracht op andere dieren. Door natuuronderzoekers is wel beschreven dat kleine dieren die ze hanteerden na eerder een pijlgifkikker in handen te hebben gehad daardoor stierven.
Sommige indianenstammen vangen de kikkers en roosteren deze boven een vuurtje. De gifdruppeltjes die uit de huid komen worden opgevangen en op de pijlpunt aangebracht.[11] Het gif wordt ook wel verkregen door de pijlpunt over de rug van de kikker te wrijven. De vergiftigde pijlpunt wordt in een blaaspijp afgeschoten op dieren. Met name de soorten Phyllobates terribilis, Phyllobates aurotaenia en Phyllobates bicolor worden door indianen gebruikt voor het vervaardigen van de giftige pijlpunten.[7]
De felle kleuren van het lichaam van veel pijlgifkikkers dienen als schrikkleur, en meer specifiek is dit een vorm van aposematische kleuring. Als een vijand eenmaal een kikker heeft proberen op te eten en daarna heeft moeten uitspuwen vanwege de giftigheid wordt het dier -evenals gelijkende dieren- voortaan met rust gelaten.
Pijlgifkikkers zijn populair als exotisch huisdier en worden wel in gevangenschap gehouden in een paludarium. Pijlgifkikkers zijn overdag actief, in tegenstelling tot vrijwel alle andere kikkers. Ze kunnen het best in koppels gehouden worden, sommige soorten kunnen het beter in groep doen. De gouden regel is geen soorten combineren.
Pijlgifkikkers prefereren een dichtbegroeide omgeving, in een kaal leefgebied kunnen ze niet genoeg schuilplaatsen vinden. Tropische planten of imitaties daarvan zijn belangrijk, veel soorten ontwikkelen zich als larve in bepaalde planten zoals bromelia's. Alle soorten hebben een permanent vochtige omgeving nodig zodat de dieren niet uitdrogen. Men kan het terrarium vochtig houden door regelmatig te nevelen met een plantenspuit. De ruimte dient zo afgedicht te zijn dat er wel frisse lucht wordt toegevoerd maar er geen tocht kan ontstaan. De ideale temperatuur ligt rond de 25 graden Celsius. Voor de afzet van de eieren kunnen enkele kleine poeltjes worden gemaakt door bijvoorbeeld met water gevulde fotorolletjes in de bak te plaatsen. Een bladlaag is ook zeer belangrijk, dit maakt de dieren minder schuw omdat ze zich dan steeds kunnen verstoppen.
Als voedsel kunnen springstaartjes (Collembola), fruitvliegjes (Dropsophilia), erwtluis, voorraadkevers, ovenvisjes en jonge wasmotlarven worden aangeboden. Deze laatsten kunnen beter slechts af en toe worden gevoerd omdat ze namelijk veel vet bevatten.
Het voedsel wordt bepoederd met suppletiepreparaten die vitaminen en mineralen bevatten. Gekweekte voedseldieren voorzien wel in proteïnen en bouwstoffen, maar bevatten vaak onvoldoende vitaminen en mineralen. Indien men dit nalaat kan nakweek bijvoorbeeld de beruchte aandoening 'luciferpoten' (of Spindly Leg Syndrome = SLS) krijgen; onderontwikkelde voorpoten als gevolg van vitaminen- of calciumgebrek. Deze aandoening is niet te behandelen.
Bovendien is de verhouding calcium/fosfor vaak niet ideaal bij veel voedseldieren die in gevangenschap worden aangeboden. In de zomer is het aangeraden om ook 'weideplankton' te voederen, dit zijn insecten die men vangt in de natuur. Het vangstgebied mag echter geen chemische producten bevatten zoals kunstmatige meststoffen, onkruidverdelgers en roetdeeltjes, zoals men aantreft bij autowegen.
De gevangen diertjes mogen niet te groot zijn. Sommige grotere gevangen geleedpotigen zoals een volwassen sabelsprinkhaan, eet eerder de gifkikker op dan andersom. Afhankelijk van de soort zijn er nog andere problemen die men tegenkomt als men pijlgifkikkers wil houden; de dieren zijn vaak prijzig. Bij veel soorten zijn de dieren buitengewoon territoriaal; vooral bij een teveel aan mannetjes gaan de dieren elkaar bevechten wat tot stress en uitputting leidt en de dieren uiteindelijk kunnen sterven. Ook met de zeer luidruchtige mannetjes in de paartijd zal men rekening moeten houden, een terrarium in een aan de slaapkamer aangrenzende ruimte is dan niet aan te raden aangezien de mannetjes zeer luidruchtig zijn. Bij andere soorten zijn het dan weer de vrouwtjes die vechten.
Pijlgifkikkers, en met name exemplaren die uit het wild komen, kunnen vele ziekten hebben, zoals parasieten die zich bij wildvangdieren explosief kunnen vermenigvuldigen. De omstandigheden zijn namelijk niet alleen voor de kikker optimaal in het terrarium. Voorbeelden zijn flagellaten, nematoden, wormen, mijten, teken en luizen. Een enkel exemplaar kan in een terrarium binnen zeer korte tijd een hele groep besmetten.
Bovendien zijn nakweekdieren, die in gevangenschap zijn geboren, minder bevattelijk voor stress, wat voor in gevangenschap gehouden amfibieën doodsoorzaak nummer één is.
De wetenschappelijke naam van de familie pijlgifkikkers is Dendrobatidae. De groep werd voor het eerst wetenschappelijk beschreven door Edward Drinker Cope in 1865.
Pijlgifkikkers behoren tot de Neobatrachia, hoewel deze indeling niet algemeen wordt erkend.[4] Deze een groep van kikkers wordt gezien als hoger ontwikkeld dan de soorten uit de onderorde Archaeobatrachia. De kikkers zijn vermoedelijk een natuurlijke groep, dit wordt wel monofyletisch genoemd. Van alle geslachten wordt Aromobates als de meest basale groep gezien. Er zijn nog geen fossielen gevonden die aan de pijlgifkikkers worden toegekend.[4]
Pijlgifkikkers worden soms tot de kikkerachtige groep Ranoidea gerekend en sommige biologen rekenen ze tot de echte kikkers (Ranidae). Dit is echter niet onomstreden. Andere biologen plaatsen de kikkers juist in de padachtige groep Bufonoidea.[10]
De indeling in verschillende subgroepen zoals geslachten en later onderfamilies is sinds de benoeming van de familie aan verandering onderhevig geweest. Tot 1987 waren er drie geslachten; Colostethus, Dendrobates en Phyllobates. In dat jaar werden twee nieuwe geslachten benoemd door Charles William Myers; Minyobates en Epipedobates.[6] Een jaar later werden door Helmut en Elke Zimmermann de geslachten Phobobates en Allobates beschreven. In 1991 werd voor het eerst een nachtactieve pijlgifkikker ontdekt die hierdoor tot een apart geslacht werd gerekend; Aromobates. Deze groep werd beschreven door de biologen Myers, Paolillo-O. en Daly.
In 2006 werden de verschillende geslachten opnieuw verdeeld in verschillende onderfamilies en waren er 11 geslachten.[7] Later werden er echter meer geslachten toegekend, zoals Excidobates in 2008. Het geslacht Andinobates is pas in 2011 voor het eerst wetenschappelijk beschreven en wordt hierdoor in veel literatuur nog niet gebruikt. Tegenwoordig (augustus 2013) ligt het aantal geslachten op dertien.[3]
Een bijkomend verschijnsel bij indeling van de pijlgifkikkers is dat er waarschijnlijk nog enkele tientallen niet zijn ontdekt, waardoor de indeling in de toekomst ongetwijfeld weer aangepast zal moeten worden op basis van deze nog te verkrijgen inzichten.
Onderstaand is een tabel van de verschillende onderfamilies en geslachten weergegeven.
Onderfamilie Colostethinae Cope, 1867 (68 soorten) Naam Verspreiding Beschrijving Voorbeeldsoort Afbeelding voorbeeldsoort Ameerega Colostethus
Colostethus Epipedobates
Epipedobates Silverstoneia
Silverstoneia Onderfamilie Dendrobatinae Cope, 1865 (56 soorten) Naam Verspreiding Beschrijving Voorbeeldsoort Afbeelding voorbeeldsoort Adelphobates
Onderfamilie Dendrobatinae Cope, 1865 (56 soorten) Naam Verspreiding Beschrijving Voorbeeldsoort Afbeelding voorbeeldsoort Adelphobates Andinobates
Andinobates Dendrobates
Dendrobates Excidobates
Excidobates Minyobates
Minyobates Phyllobates
Phyllobates Ranitomeya
Ranitomeya Onderfamilie Hyloxalinae Grand et al, 2006 (59 soorten) Naam Verspreiding Beschrijving Voorbeeldsoort Afbeelding voorbeeldsoort Hyloxalus
Onderfamilie Hyloxalinae Grand et al, 2006 (59 soorten) Naam Verspreiding Beschrijving Voorbeeldsoort Afbeelding voorbeeldsoort Hyloxalus
Referenties
Bronnen
Pijlgifkikkers (Dendrobatidae) zijn een familie van kikkers (Anura). Pijlgifkikkers zijn door hun felle kleuren en de bijzondere vorm van broedzorg een van de bekendste groepen van kikkers.
Pijlgifkikkers zijn kleine, gedrongen diertjes die zich kenmerken door de vaak zeer felle kleuren. Er zijn ongeveer 185 verschillende soorten die voorkomen in delen van Midden- en Zuid-Amerika. De meeste soorten zijn overdag actief en zijn niet schuw, in tegenstelling tot de meeste andere kikkers die zich overdag schuilhouden en juist erg alert zijn.
De groep werd vroeger wel tot de echte padden gerekend, maar dit is achterhaald. Pijlgifkikkers leven in vochtige en warme, tropische gebieden. De meeste soorten zijn bodembewoners, sommige soorten zijn juist in bomen te vinden. Het voedsel bestaat uit insecten en andere kleine ongewervelden. Veel soorten zijn erg giftig en hebben hierdoor weinig vijanden.
Bekende soorten zijn de aardbeikikker (Oophaga pumilo), de bijengifkikker (Dendrobates leucomelas) en ten slotte de zeer giftige soort Phyllobates terribilis. Een aantal soorten wordt wel als exotisch huisdier in een paludarium gehouden.
Pilgiftfrosker (Dendrobatidae) er en gruppe ekstremt giftige[2] frosker (amfibier) som holder til i tropiske skoger i Mellom- og Sør-Amerika, fra Nicaragua og Costa Rica i nord til Brasil og Bolivia i sør, gjerne nær vann som dammer og bekker.
Navnet pilgiftfrosk stammer fra embera-folket, et lokalt stammefolk fra Colombias regnskoger som benyttet giften fra pilgiftfrosker til å forgifte pilspissene med når de jakter vilt med sitt tradisjonelle blåserør. Nye piler ble forberedt for jakt ved å dyppe tuppen i en giftblanding, der hovedingrediensen var gift fra pilgiftfrosker. Giftblandingen, som er mørk å se til, tørker så inn på pilspissene. Giften er så kraftig at kun et rift fra ei pil kan være nok til å drepe dyret det jaktes på.
Pilgiftfroskens farger er kraftige og kan variere i ulike mønstre i fargene gul, kopper, rød, grønn, blå og svart. De sterke fargene er til for å advare potensielle rovdyr om at de bærer en svært sterk gift. En pilgiftfrosks størrelse varierer fra 1 til 6 centimeter, etter alder og art.
Størrelsen varierer fra 1 til 7 cm (avhengig av arten) og er generelt små, oftest bare 1–2 cm. De har en naturlig levetid på 15–20 år i fangenskap.
De giftigst pilgiftfroskene tilhører slekten Phyllobates, og så langt man vet er gul (gyllen) giftfrosk (Phyllobates terribilis) den giftigste av alle, ja kanskje også av alle dyr som lever på kloden vår i dag.[1] Det hevdes at giften (batrachotoxin, en svært potent nevrotoksin) fra en slik frosk er nok til å ta livet av ti voksne menn. Faktisk er 0,00001 gram av denne giften nok til å drepe et menneske.[2] Giften sitter i små kjertler under hudoverflaten. Når frosken blir stresset «svetter» giften til hudoverflaten. Andre arter med pilgiftfrosker er mindre giftige, og bare en håndfull av dem er giftige nok til å utgjøre en fare for mennesker.
Hva som forårsaker giften, er fortsatt ukjent, men forskere har en teori om at det kan være dietten.[2] Biller, maur og termitter som spiser giftige planter, kan være en årsak til dette. Frosker i fangenskap utvikler ikke giften, trolig grunnet mangel på føde som den ville pilgiftfrosken får. Giften er forsket på til medisin, og forskere har funnet ut at det kan brukes som smertestillende. Dessverre har giften gitt mennesker kraftige bivirkninger som gjør legemiddelet usikkert.
Det er også kjent at pitohuier, noen spurvefugler i pirolfamilien, har samme type gift i hud og fjær som pilgiftfroskene. Fuglene er endemiske for Papua-Australia og eter mest frukt, og man tror at giften akkumuleres via næringsopptaket, trolig fra en type børstebiller.[3]
Pilgiftfroskene lever i små grupper på opptil åtte dyr. Når hunnen har gytt eggene sine befrukter hannen dem. Når eggene er klekket, bærer noen med seg rumpetrollene på ryggen til vann. På grunn av mindre fuktighet der pilgiftfroskene lever, er mange arter truet.
Pilgiftfrosken yngler nær dammer og bekker. Parringsritualet går ut på at hannen finner en yngleplass, før de begynner med parringsrop. Hanner er svært territoriale og bryter for å forsvare det. Hunner kan også begynne å bryte om det er kamp om hannen og redet. Eggene legges på en fuktig plass, gjerne blant løv, planter og røtter. Pilgiftfrosken yngler likt som fisker. Hunnen legger eggene først før hannen går og befrukter eggene like etterpå. Når eggene har klekket er det hannen som får størst instinkt og bærer rumpetrollene ned til dammer eller bekker. Begge partnerne viser uvanlige foreldreinstinkter og det er ikke unikt, men hannen utmerker seg mest blant denne typen frosk.
Pilgiftfrosken kan skilles mellom kjønnene ved å se på den fremste tåen på frembeina. I tillegg har hannen sterkere fargedrakt og er mer aggressive enn hunnene. Hunnene har fordel av at hun velger partner til parringen.
Disse froskene mangler naturlige trusler og har kun en fiende. Slangen Leimadophis epinephelus, som er resistent mot giften deres.
Pilgiftfrosker (Dendrobatidae) er en gruppe ekstremt giftige frosker (amfibier) som holder til i tropiske skoger i Mellom- og Sør-Amerika, fra Nicaragua og Costa Rica i nord til Brasil og Bolivia i sør, gjerne nær vann som dammer og bekker.
Drzewołazowate (Dendrobatidae) − rodzina płazów z rzędu bezogonowych zamieszkujących Amerykę Południową i Środkową.W przeciwieństwie do większości przedstawicieli Anura prowadzą dzienny tryb życia, a ich skóra przybiera jaskrawe barwy. Choć wszystkie dzikie drzewołazowate wytwarzają toksyny, poziom toksyczności różni się u poszczególnych gatunków, a nawet w przypadku poszczególnych populacji. Wiele gatunków uznaje się za krytycznie zagrożone. Znane są z tego, że wydzielane przez nie trujące związki służą Indianom do zatruwania strzałek do dmuchawek[2], jednakże na ponad 175 gatunków tylko w trzech udokumentowano takie wykorzystanie tych płazów – znaczniej częściej używana jest w tym celu roślinna kurara (dodatkowo żaden z nich nie zalicza się do rodzaju Dendrobates, zwracającego uwagę kolorem i skomplikowanymi wzorami na skórze)[3][4].
Większość drzewołazowatych osiąga niewielkie rozmiary, czasem dorosłe są mniejsze niż 1,5 cm długości. Kilka gatunków osiąga 6 cm. Ważą około 2 g. Większość cechuje jaskrawe ubarwienie ostrzegawcze, odstraszające potencjalnych drapieżników. Wiąże się ono z toksycznością i poziomem alkaloidów. Te ostatnie osiągają wysokie wartości u gatunków z rodzaju Dendrobates, podczas gdy zakamuflowani przedstawiciele Colostethus są nietoksyczni[5]. W przeciwieństwie do większości bezogonowych wiodą głównie dzienny tryb życia[6]. Przyszłe na świat i wzrastające w niewoli, nie produkują toksyn, które zawiera skóra płazów żyjących w naturalnym środowisku[7].
Osobniki dorosłe składają jaja w wilgotnych miejscach: między innymi na liściach, w roślinach, pośród wystających z gleby korzeni. Gdy wyklują się kijanki, są przenoszone na grzbiecie do najbliższego zbiornika wodnego, zwykle kałuży, ale także do tych tworzonych przez rośliny m.in. z rodziny bromeliowatych. Larwy pozostają tam do czasu przeobrażenia[6].
Drzewołazowate to endemity wilgotnych, tropikalmych środowisk Ameryki Środkowej i Południowej[3]. Zamieszkują wilgotne lasy deszczowe Boliwii, Kostaryki, Brazylii, Kolumbii, Ekwadoru, Wenezueli, Surinamu, Gujany Francuskiej, Peru, Panamy, Nikaragui, żyją też na Hawajach, nie stanowiąc ich natywnej fauny[3][8].
Siedlisko tych płazów obejmuje zwrotnikowe i podzwrotnikowe wilgotne nizinne lasy deszczowe, zwrotnikowe i podzwrotnikowe zarośla na dużej wysokości, zwrotnikowe i podzwrotnikowe wilgotne tereny górskie, rzeki, mokradła słodkowodne, w tym te istniejące tylko okresowo, bagna i jeziora. Niektóre gatunki zamieszkują też sezonowo wilgotne lub zalewowe tereny trawiaste, pola uprawne, pastwiska, ogrody, plantacje, wilgotne tereny sawannowe, a także silnie zdegradowane lasy. Płazy te spotykano też w lasach u podnóża gór i na terenach skalistych. Drzewołazowate mają tendencję do bytowania na poziomie lub w pobliżu gruntu, ale także na drzewach nawet do wysokości 10 m[9].
U drzewołazowatych występuje zapłodnienie zewnętrzne: samica składa klaster jaj, a następnie samiec zapładnia je, podobnie jak w przypadku większości ryb. Jednakże drzewołazy często obserwowano stykające się ze sobą w sposób właściwy dla kopulacji innych płazów bezogonowych. Zachowanie to wiąże się jednak z współzawodnictwem o terytorium, częstym u osobników obojga płci. Samce walczą o najbardziej rzucające się w oczy grzędy, by wydawać z nich odgłosy godowe. Samice z kolei konkurują o pożądane gniazda, a nawet atakują gniazda rywalek, pożerając ich jaja. Wiele gatunków drzewołazowatych to oddani rodzice. Drzewołaz karłowaty zanosi swe nowo wyklute kijanki w korony drzew. Larwy przylegają do śluzu na plecach rodziców. Pozostawiają oni swe młode w zbiornikach wodnych tworzonych przez epifity, jak bromeliowate. Kijanki żywią się bezkręgowcami. Matka uzupełnia ich dietę, składając do wody jaja. Inne drzewołazowate składają jaja na poziomie dna lasu, ukryte wśród ściółki[10].
Drzewołazowate podlegają badaniom filogenetycznym na dużą skalę. Ich systematyka często ulega zmianom[11]. Rewizje taksonomiczne rodziny Dendrobatidae miały miejsce w 2006 i 2017 roku. Rodzina zawiera 16 rodzajów obejmujących około 190 gatunków[12][13].
Wyróżnia się następujące podrodziny i rodzaje[1]:
Niektóre gatunki drzewołazowatych wykształciły wewnątrzgatunkowy polimorfizm ubarwienia, który pojawił się 6 tys. lat temu[19]. Wobec tego taki gatunek, jak drzewołaz malarski, może wykazywać formy różniące się wzorami, które można ze sobą krzyżować (kolory dziedziczą się poligenowo, podczas gdy same wzory pozostają prawdopodobnie pod kontrolą pojedynczego locus)[20]. Zróżnicowane ubarwienie było w przeszłości przyczyną brania pojedynczego gatunku za kilka odrębnych, a wśród taksonomów cały czas panują kontrowersje[21].
Wiele spośród drzewołazów wydziela przez skórę toksyczne lipofilowe alkaloidy. Związki z gruczołów skórnych tych płazów służą do obrony przed drapieżnikami. Alkaloidy te pod względem budowy chemicznej podzielono na około 28 klas[3][22]. Najbardziej toksyczny z drzewołazów to liściołaz żółty Phyllobates terribilis. Podnosi się, że drzewołazowate nie syntetyzują samodzielnie tych toksyn, lecz czerpią odpowiednie związki chemiczne z stawonogów, którymi się żywią (jak mrówkowate, stonogi czy roztocze)[23]. W związku z powyższym trzymane w niewoli osobniki nie zawierają znacznych ilości toksyn. Poza tym istnieją drapieżniki, które wykształciły oporność na te toksyny, przykład stanowi wąż Liophis epinephelus)[24].
Substancje chemiczne wyekstrahowane ze skóry Epipedobates tricolor mogą zostać wykorzystane w medycynie[25]. Jeden z nich, epibatydyna, ma właściwości przeciwbólowe 200 razy silniejsze od morfiny, jednakże wywiera też nieakceptowalne efekty uboczne związane z układem pokarmowym człowieka[26]. Wydzieliny drzewołazów mogą się okazać także źródłem miorelaksantów, stymulantów serca i środków hamujących apetyt[27]. Najbardziej trujący przedstawiciel rodziny, liściołaz żółty, posiada wystarczająco dużo toksyny dla zabicia dwudziestu ludzi lub około dziesięciu tysięcy myszy[28].
Wszystkie Dendrobatidae pochodzą z krainy neotropikalnej. Złapane dzikie osobniki przez pewien czas mogą zachowywać toksyczność, dlatego w obejściu z nimi należy zachować odpowiednie środki ostrożności[29]. O ile niewiele jest badań naukowych traktujących o długości życia tych płazów, dzięki oznaczaniu osobników szacuje się ją pomiędzy 1 a 3 latami na wolności[30].
Jak wiele rodzin swej gromady, drzewołazowate także dotknął ogólnoświatowy spadek liczebności populacji płazów. Utrata siedlisk spowodowana rolnictwem i wyrębem lasów oraz wprowadzenie nowych drapieżników do ekosystemu należą do częstszych jej przyczyn, najbardziej jednak w ostatnich 25 latach dotknęła je Chytridiomycosis skóry[31]. Ogrody zoologiczne podjęły starania w celu przeciwdziałania tej chorobie poprzez kurację złapanych bezogonowych lekami przeciwgrzybiczymi używanymi w terapii grzybicy stóp u człowieka[32].
Drzewołazowate (Dendrobatidae) − rodzina płazów z rzędu bezogonowych zamieszkujących Amerykę Południową i Środkową.W przeciwieństwie do większości przedstawicieli Anura prowadzą dzienny tryb życia, a ich skóra przybiera jaskrawe barwy. Choć wszystkie dzikie drzewołazowate wytwarzają toksyny, poziom toksyczności różni się u poszczególnych gatunków, a nawet w przypadku poszczególnych populacji. Wiele gatunków uznaje się za krytycznie zagrożone. Znane są z tego, że wydzielane przez nie trujące związki służą Indianom do zatruwania strzałek do dmuchawek, jednakże na ponad 175 gatunków tylko w trzech udokumentowano takie wykorzystanie tych płazów – znaczniej częściej używana jest w tym celu roślinna kurara (dodatkowo żaden z nich nie zalicza się do rodzaju Dendrobates, zwracającego uwagę kolorem i skomplikowanymi wzorami na skórze).
Dendrobatidae é uma família de anfíbios pertencentes à ordem anura, subordem Neobatrachia.
Os membros deste grupo têm a particularidade de produzirem toxinas potentes que se encontram na sua pele. A espécie com a toxina mais venenosa é a Phyllobates terribilis, que se iguala com o veneno da vespa do mar.
Mais de 100 toxinas foram já identificadas nas secreções cutâneas de membros deste grupo, especialmente no género Dendrobates e Phyllobates. Os membros deste último género produzem uma neurotoxina potente denominada batracotoxina. Apenas 40 microgramas desta substância podem ser fatais.
Algumas tribos indígenas da América do Sul utilizam estas toxinas, colocando na ponta das setas utilizadas em caçadas, daí o nome em inglês poison dart frogs.
Algumas das espécies adquirem a capacidade de produção de toxinas em parte devido a factores alimentares, nomeadamente devido à ingestão de formigas. Estas formigas, por sua vez, alimentam-se de espécies de plantas com propriedade tóxicas.
Vivem de 5 a 12 anos.
São caracterizados por terem a pele colorida e terem um pequeno tamanho. A cor da pele varia desde o laranja e preto ao azul e amarelo.
Encontram-se originalmente nas América Central e América do Sul, e uma espécie, (Dendrobates auratus) foi introduzida na ilha de Oahu, no Havaí para controlar a população de pernilongos.[1]
Esta família é alvo constante de estudos filogenéticos e sofre mudanças taxonómicas de maneira frequente.[2] A família Dendrobatidae foi revista taxonomicamente em 2006 e contém 12 géneros, com cerca de 170 espécies.[3][4]
Dendrobatidae é uma família de anfíbios pertencentes à ordem anura, subordem Neobatrachia.
Os membros deste grupo têm a particularidade de produzirem toxinas potentes que se encontram na sua pele. A espécie com a toxina mais venenosa é a Phyllobates terribilis, que se iguala com o veneno da vespa do mar.
Mais de 100 toxinas foram já identificadas nas secreções cutâneas de membros deste grupo, especialmente no género Dendrobates e Phyllobates. Os membros deste último género produzem uma neurotoxina potente denominada batracotoxina. Apenas 40 microgramas desta substância podem ser fatais.
Algumas tribos indígenas da América do Sul utilizam estas toxinas, colocando na ponta das setas utilizadas em caçadas, daí o nome em inglês poison dart frogs.
Algumas das espécies adquirem a capacidade de produção de toxinas em parte devido a factores alimentares, nomeadamente devido à ingestão de formigas. Estas formigas, por sua vez, alimentam-se de espécies de plantas com propriedade tóxicas.
Vivem de 5 a 12 anos.
Pilgiftsgrodor, giftgrodor eller ibland dendrobatider[1] är en grupp groddjur som tillhör familjen Dendrobatidae. Långt ifrån alla pilgiftsgrodor är giftiga och ännu färre används för produktion av pilgift. Den giftigaste av alla kända arter är gyllene kokoigiftgroda (Phyllobates terribilis).
Pilgiftsgrodorna är inhemska i Centralamerika och Sydamerika. Utbredningsområdet sträcker sig från södra Nicaragua till Bolivia.[2]
Guldgrodan (Dendrobates auratus) har introducerats till några av Hawaiis öar.[3]
Pilgiftsgrodor karakteriseras vanligen av deras skarpt färgade skinn och blygsamma storlek. De skarpa färgerna är ett sätt att signalera dess giftighet. Skinnfärgen kan variera från ljusorange och svart till blå eller gul, men medlemmarna av det artrikaste släktet, Colostethus, är generellt sett bruna. Fullvuxna pilgiftsgrodor varierar i storlek från 1,5 centimeter till 6 centimeter,[1] beroende på ålder och art.
Arterna är aktiva på dagen och lever i tropiska skogar. Vissa pilgiftsgrodor är anpassade för ett liv intill vattendrag och andra vistas främst på träd eller buskar. Honor lägger äggen i en grop på land och de nykläckta grodynglen flyttas till vattnet.[2]
Mer än 100 gifter har identifierats i skinnsekret på pilgiftsgrodor, särskilt grodor i släktena Dendrobates och Phyllobates. De senare har det extremt farliga neurotoxinet batrachotoxin, av vilket det räcker med 40 mikrogram för att dosen ska vara dödlig. Den gyllene kokoigiftgrodan är så giftig att det kan räcka med att nudda grodans rygg med tungspetsen för att överföra en dödlig dos gift.
Vissa indianstammar i Sydamerika, som Noanamá Chocó och Emberá Chocó i västra Colombia doppar spetsen på sina blåsrörspilar i giftet som kan hittas på tre arter av Phyllobates. Det är från detta familjen har fått sitt namn trots att ingen av alla de övriga medlemmarna i familjen pilgiftsgrodor används på så sätt; de flesta är inte ens giftiga. När ett vilt djur skjuts med en förgiftad pil dör det inom minuter av neurotoxinet. Giftpilar gjorda med giftet batrachotoxin är tillräckligt potenta för att döda apor och fåglar mycket snabbt eftersom giftet paralyserar nervsystemet nästan omedelbart.
Det finns väl underbyggda teorier som säger att giftet i grodorna kommer från deras diet av myror[2], skalbaggar och andra insekter. Dessa gifter överförs från insekten till grodan och utsöndras sedan på dess skinn. Grodor som fångas vilt och ges en diet av till exempel fruktflugor eller syrsor förlorar efterhand sin giftighet, och pilgiftsgrodor uppfödda i fångenskap är inte giftiga.[1]
Enligt Amphibian Species of the World delas familjen i tre underfamiljer[4]:
Pilgiftsgrodor, giftgrodor eller ibland dendrobatider är en grupp groddjur som tillhör familjen Dendrobatidae. Långt ifrån alla pilgiftsgrodor är giftiga och ännu färre används för produktion av pilgift. Den giftigaste av alla kända arter är gyllene kokoigiftgroda (Phyllobates terribilis).
Zehirli ok Kurbağası (Dendrobatidae), Anura (kurbağalar) takımının Orta ve Güney Amerika’da yaşayan bir familyası. 175 kadar keşfedilmiş türü bulunmaktadır. Dünyanın en zehirli hayvanlarıdır. Bir insan onlara dokunduğunda felç olabilir. Kendisini takip eden mavi halkalı ahtapotun zehri siyanürden 10.000 kat daha güçlü olmasına karşın, Zehirli ok kurbağasını yakalayamamıştır. Bu kurbağayı yutan bir insan 1 dakikadan az bir zamanda yaşamını yitirir. Batrakotoksin (Batrachotoxin) denilen zehri bilinen en etkili zehirden bile 250 kat güçlüdür. Boyu yalnızca 2,5 cm olmasına rağmen, bir insan ona dokunduğu anda vücuduna 400 farklı alkali zehir yayılmaya başlar. Zehir kana karışırsa 1 dakika içerisinde öldürebilir. Derisindeki zehir 30.000 fare ya da 150 insanı öldürebilecek güçtedir. Bilimciler bu zehri bir sinek ve karınca türünü yemesi nedeniyle derisindeki keselerde ürettiğini keşfetmişlerdir.
Zehirli ok Kurbağası (Dendrobatidae), Anura (kurbağalar) takımının Orta ve Güney Amerika’da yaşayan bir familyası. 175 kadar keşfedilmiş türü bulunmaktadır. Dünyanın en zehirli hayvanlarıdır. Bir insan onlara dokunduğunda felç olabilir. Kendisini takip eden mavi halkalı ahtapotun zehri siyanürden 10.000 kat daha güçlü olmasına karşın, Zehirli ok kurbağasını yakalayamamıştır. Bu kurbağayı yutan bir insan 1 dakikadan az bir zamanda yaşamını yitirir. Batrakotoksin (Batrachotoxin) denilen zehri bilinen en etkili zehirden bile 250 kat güçlüdür. Boyu yalnızca 2,5 cm olmasına rağmen, bir insan ona dokunduğu anda vücuduna 400 farklı alkali zehir yayılmaya başlar. Zehir kana karışırsa 1 dakika içerisinde öldürebilir. Derisindeki zehir 30.000 fare ya da 150 insanı öldürebilecek güçtedir. Bilimciler bu zehri bir sinek ve karınca türünü yemesi nedeniyle derisindeki keselerde ürettiğini keşfetmişlerdir.
Дереволазові (Dendrobatidae) — родина безхвостих земноводних. Шкірні залози деяких видів з роду листолазів (Phyllobates) виділяють батрахотоксин — сильну отруту.
Систематика станом на 2006 рік, включає 12 родів, понад 170 видів.[2][3] У 2011 році виокремлений ще один рід Andinobates[4]:
Назва роду і автор Англійська назва Кількість видів Adelphobates (Grant, et al., 2006)Дереволазові (Dendrobatidae) — родина безхвостих земноводних. Шкірні залози деяких видів з роду листолазів (Phyllobates) виділяють батрахотоксин — сильну отруту.
Ếch phi tiêu độc (danh pháp khoa học: Dendrobatidae) là tên gọi chung của một nhóm các loài ếch trong họ Dendrobatidae có nguồn gốc ở Trung và Nam Mỹ. Không giống như hầu hết các loài ếch, các loài này hoạt động ban ngày và thường có thân màu rực rỡ. Mặc dù tất cả các loài trong họ Dendrobatidae hoang dã ít nhất phần nào có độc, mức độ độc tính thay đổi đáng kể từ loài này sang loài khác và từ nhóm này sang nhóm khác. Nhiều loài đang cực kỳ nguy cấp. Những động vật lưỡng cư này thường được gọi là "ếch phi tiêu" do dân bản xứ da đỏ sử dụng các chất tiết độc của da các loài ếch này để tẩm độc đầu mũi phi tiêu thổi[1]. Trên thực tế, trong số 179 loài, chỉ có ba loài đã được ghi nhận như đang được sử dụng cho mục đích này (chất nhựa cura ở các cây độc như Strychnos toxifera, Chondrodendron tomentosum thường được sử dụng nhiều hơn), và loài được sử dụng để tẩm độc mũi tên không thuộc về chi Dendrobates, là chi với các đặc trưng như màu sắc rực rỡ và các hoa văn phức tạp khác nhau trong các loài thuộc chi này[2][3].
Họ Dendrobatidae này được phân chia thành các phân họ và chi như sau:
Ếch phi tiêu độc (danh pháp khoa học: Dendrobatidae) là tên gọi chung của một nhóm các loài ếch trong họ Dendrobatidae có nguồn gốc ở Trung và Nam Mỹ. Không giống như hầu hết các loài ếch, các loài này hoạt động ban ngày và thường có thân màu rực rỡ. Mặc dù tất cả các loài trong họ Dendrobatidae hoang dã ít nhất phần nào có độc, mức độ độc tính thay đổi đáng kể từ loài này sang loài khác và từ nhóm này sang nhóm khác. Nhiều loài đang cực kỳ nguy cấp. Những động vật lưỡng cư này thường được gọi là "ếch phi tiêu" do dân bản xứ da đỏ sử dụng các chất tiết độc của da các loài ếch này để tẩm độc đầu mũi phi tiêu thổi. Trên thực tế, trong số 179 loài, chỉ có ba loài đã được ghi nhận như đang được sử dụng cho mục đích này (chất nhựa cura ở các cây độc như Strychnos toxifera, Chondrodendron tomentosum thường được sử dụng nhiều hơn), và loài được sử dụng để tẩm độc mũi tên không thuộc về chi Dendrobates, là chi với các đặc trưng như màu sắc rực rỡ và các hoa văn phức tạp khác nhau trong các loài thuộc chi này.
Издревле индейцы Центральной Америки смазывают ядом древолазов наконечники охотничьих и боевых стрел (в том числе духовых). Яд этих амфибий гораздо сильнее кураре, и даже легкая царапина отравленным наконечником может привести к смерти. Охотники собирают яд с помощью огня, держа лягушку над костром. Когда она начинает выделять яд, его наносят на кончики стрел.
Из батрахотоксина, входящего в состав яда древолазов, ученые смогли выделить производное вещество — эпибатидин, обладающий болеутоляющими свойствами в 200 раз сильнее морфина и не вызывающий привыкания. Однако, терапевтическая доза данного препарата очень близка к смертельной дозе[19].
Также, благодаря яркой окраске, дневной активности, тихим и приятным трелям, издаваемым древолазами, они стали очень популярны среди террариумистов.
Являются эндемиками Центральной и Южной Америки. Обитают в дождевых лесах Боливии, Коста-Рики, Бразилии, Колумбии, Эквадора, Венесуэлы, Суринама, Французской Гвианы, Перу, Панамы, Гайаны и Никарагуа[20]. Существует также инвазивная популяция красящих древолазов на Гавайях[21].
На октябрь 2018 года семейство включает 3 подсемейства, 16 родов и 197 видов[20][1]:
Colostethinae Cope, 1867
Dendrobatinae Cope, 1865
Hyloxalinae Grant et al., 2006
|month= (справка) |coauthors= (справка) Издревле индейцы Центральной Америки смазывают ядом древолазов наконечники охотничьих и боевых стрел (в том числе духовых). Яд этих амфибий гораздо сильнее кураре, и даже легкая царапина отравленным наконечником может привести к смерти. Охотники собирают яд с помощью огня, держа лягушку над костром. Когда она начинает выделять яд, его наносят на кончики стрел.
Из батрахотоксина, входящего в состав яда древолазов, ученые смогли выделить производное вещество — эпибатидин, обладающий болеутоляющими свойствами в 200 раз сильнее морфина и не вызывающий привыкания. Однако, терапевтическая доза данного препарата очень близка к смертельной дозе.
Также, благодаря яркой окраске, дневной активности, тихим и приятным трелям, издаваемым древолазами, они стали очень популярны среди террариумистов.

箭毒蛙,即箭毒蛙科(Dendrobatidae),又名樹棘蛙科或叢蛙科,是細小及白天活動的青蛙。牠們是中美洲及南美洲的原住民,而當地部族將牠們身上的毒素塗在箭上,故得此名。此科下有超過175個物種,但只有55种具有毒性,且只有3種的毒素被当地居民用以狩猎。毒素的來源是捕食當地的某種螞蟻和蝨子轉化而來,所以人工馴養會變得沒有毒性,購買觀賞蛙時應該避免野生捕獲的劇毒個體。此科下身體最多色彩的是箭毒蛙屬,而毒素最劇烈的是葉毒蛙屬的金色箭毒蛙。
大部份箭毒蛙都有耀眼的皮膚顏色,是對掠食者的一種警號。牠們非常細小,約長1-6厘米,不同物種、年齡及性別均有所不同。牠們大部份都生活在潮濕的熱帶環境(熱帶雨林)。
雖然缺乏科學研究,但箭毒蛙的壽命估計野生的是3-15年,而飼養的可達20年。飼養的箭毒蛙一般都是沒有毒的。大部份物種在約1.5-2.5歲就會達至性成熟。
箭毒蛙可一年繁殖3、4次,一次能產下6至10顆卵,由於箭毒蛙親代照護的行為,會將卵背在背上移動至靠近水源的棲地安置,因此大大提升了孵化的機率。
要確定箭毒蛙的性別,可以透過其行為來觀察。成熟的雄蛙在吃飽或大雨後會為交配而叫喊。幼蛙的性別可以從背部來觀察。雄性的背部一般都是向下斜而不起折,雌性的背部較圓但有較大的折。另外可以從牠們的腳趾來確定性別。一些雌性箭毒蛙屬的腳趾較窄,而雄性的較闊。一些物種的成熟雄性在頸上會有一灰帶,這正是發出交配叫喊的部位。
所有箭毒蛙都是源自熱帶的。大部份飼養的物種在濕度80-100%、日間溫度22-27℃及晚間溫度不低於16-18℃會發展得很繁盛。當中一些物種能抵受較低的溫度。
一些箭毒蛙物種有大量的亞種形態。不同形態有不同顏色及生活在不同的地方。例如花箭毒蛙就最少有12個形態。過往曾將不同的形態看作為不同的物種,但現時仍未有清晰箭毒蛙的分類。例如天藍叢蛙可能是花箭毒蛙的一個形態,而非一個獨立的物種。
箭毒蛙各種的保育狀況不一,像LC無危的草莓箭毒蛙,EN瀕危的金色箭毒蛙和三色箭毒蛙9,CR極危的紅帶箭毒蛙。(根據IUCN紅色名錄)
箭毒蛙,即箭毒蛙科(Dendrobatidae),又名樹棘蛙科或叢蛙科,是細小及白天活動的青蛙。牠們是中美洲及南美洲的原住民,而當地部族將牠們身上的毒素塗在箭上,故得此名。此科下有超過175個物種,但只有55种具有毒性,且只有3種的毒素被当地居民用以狩猎。毒素的來源是捕食當地的某種螞蟻和蝨子轉化而來,所以人工馴養會變得沒有毒性,購買觀賞蛙時應該避免野生捕獲的劇毒個體。此科下身體最多色彩的是箭毒蛙屬,而毒素最劇烈的是葉毒蛙屬的金色箭毒蛙。


ヤドクガエル科(矢毒蛙科、Dendrobatidae)は、両生綱無尾目に属する科の1つ。
北アメリカ大陸南部、南アメリカ大陸、ハワイ(オアフ島)
ヤドクガエル属の場合最大種アイゾメヤドクガエルでも6cm程と主に小型種で形成される。体色は属によっては鮮やかで後述の毒を保有することによる警戒色とされる。弱毒種でも体色の派手な種が存在するが、これは強毒種に偽装したベイツ型擬態とされる。
毒はアルカロイド系の神経毒で、20μgで人間の大人を死に至らしめるという、生物が持つ毒ではパリトキシンに次いで危険とされるバトラコトキシンのほか、ヒストリオニコトキシン、プミリオトキシン等を持つ種がある。
特にバトラコトキシンを備えるフキヤガエル属の3種は最も危険とされ、モウドクフキヤガエル Phyllobates terribilis(皮膚に絶えず毒素を分泌しており、触ることも危険)、ココエフキヤガエル(ココイヤドクガエル) Phyllobates aurotaenia、アシグロフキヤガエル(ヒイロフキヤガエル) Phyllobates bicolorはこの順に毒が強く、命に関わることもある。ただしこれ以外の種ではそこまで強毒を持つ種は少なく、無毒種もいる。
これらの毒は生息地を同じくするアリやダニ等から摂取して貯蓄[1]もしくは体内で変成される。そのためコオロギやショウジョウバエ等を餌に長期飼育された個体や飼育下繁殖個体では毒を持たないとされる。
また、同じヤドクガエル科でも、種類によって繁殖形態が多様化しているのも特徴である。ふつうのカエルのように水たまり、沼、川などに産卵するものもいるが、樹洞や着生植物の葉の間などのわずかな水場に産卵するものもいる。このような狭い水環境では幼生(オタマジャクシ)の食べる餌にも事欠いてしまうが、幼生が餌を摂らずにカエルまで成長するもの、メスが産む無精卵を食べて成長するもの、親が卵や幼生を背負って適した水場まで移動するものなど、幼生を成長させるための様々な適応が見られる。
9属200種以上が知られている。
かつて先住民がフキヤガエル属の内、数種からの毒を抽出し吹き矢に塗って矢毒とし狩猟等に用いたことが名前の由来となっている。
有毒種のため、ペットとしては敬遠されていた。しかし種によっては飼育も易しく、カエルの中でも飼育下での繁殖例も多い。そのため毒を持たない繁殖個体が流通し、派手な体色からペットとしてのヤドクガエルの人気が高まっている。飼育方法は観葉植物や苔を植え込んだテラリウムを維持するといったもので、生物を飼育するより、生物が生息する環境を飼育するといった感に近いものがある。縄張り意識が強い種もいるため、カエルの大きさや数にもよるが、体長6cm以下のカエルのペアに対して60cm規格水槽など、大型のケージが必要とされる。
長期飼育された個体や飼育下繁殖個体は毒を持たないとされるが万が一の可能性もあるためなるべく素手では持たないようにし、万が一素手で触ってしまった場合はすぐに手を洗うようにする。また、カエルにとっても人間の体温は高温過ぎるため、素手での接触は禁忌である。
原産地は北米南部から中南米にかけてであるがハワイ・オアフ島にも害虫駆除の目的で移植され、帰化生物として繁殖している。
독개구리과(Dendrobatidae)는 라틴 아메리카에 서식하는 개구리의 한 부류이다. 경계색을 띠고 있다. 중남미의 부족들이 독개구리과의 몇몇 종의 피부에서 나오는 독을 독침을 만들 때 쓰기 때문에 ‘독개구리과’라는 이름이 붙었다.
콜롬비아 지방의 원주민들이 Phyllobates aurotaenia, Phyllobates bicolor, Phyllobates terribilis 등을 독침을 만드는 데에 쓴다. 뉴로톡신이 들은 독침을 맞은 야생 동물은 독침을 더 쏘지 않아도 몇 분 안에 죽고, 바트라코톡신의 경우 거의 순식간에 신경을 마비시키기 때문에 움직이는 새나 원숭이를 그 자리에서 바로 떨어뜨릴 수 있다. 끝에 이 개구리의 등을 갖다 대기만 해도 구강 점막을 통해 치사량만큼의 독이 흡수된다.
2014년 현재, 개구리목의 계통 분류는 다음과 같다.[1][2][3]
신와아목 청개구리상과/